Биологическая химия с упражнениями и задачами : учебник / под ред. чл.-корр. РАМН С.Е. Северина. - 2011. - 624 с.: ил.
|
|
|
|
МОДУЛЬ 10 ОБМЕН НУКЛЕОТИДОВ
Темы_
10.1. Биосинтез и катаболизм пуриновых рибонуклеотидов. Заболевания, связанные с нарушением их метаболизма
10.2. Биосинтез и катаболизм пиримидиновых рибонуклеотидов. Оротацидурия
10.3. Биосинтез дезоксирибонуклеотидов. Иммунодефициты
10.4. Механизмы действия противовирусных и противоопухолевых препаратов на ферменты синтеза рибо- и дезоксирибонуклеотидов
Цели изучения Уметь:
1. Использовать знания о путях синтеза и распада нуклеотидов для понимания патогенеза заболеваний, связанных с нарушением их метаболизма.
2. Объяснять действие противовирусных и противоопухолевых препаратов - ингибиторов ферментов синтеза рибо- и дезоксирибонуклеотидов.
Знать:
1. Функции нуклеотидов и их производных в обмене веществ у эукариотов.
2. Биосинтез и катаболизм пуриновых нуклеотидов. Нарушения, приводящие к развитию подагры и синдрома Леша-Нихена.
3. Биосинтез пиримидиновых рибонуклеотидов. Причины возникновения оротацидурии.
4. Образование дезоксирибонуклеотидов. Иммунодефициты, вызванные ингибированием синтеза дезоксирибонуклеотидов.
5. Ингибиторы синтеза рибо- и дезоксирибонуклеотидов как противовирусные и противоопухолевые препараты.
Нуклеотиды и их производные выполняют многообразные функции в организме, участвуя в:
• синтезе нуклеиновых кислот и нуклеотидных коферментов;
• реакциях запасания и использования энергии (АТФ, ГТФ, УТФ и т.д.);
• образовании активных форм углеводов (УДФ-глюкозы, ГДФ-маннозы), азотистых оснований (ЦДФ-холина), сульфата (ФАФС) и метионина (SАМ);
• трансдукции сигналов в клетку, являясь вторичными вестниками действия гормонов, факторов роста, нейромедиаторов и других регуляторных молекул (цАМФ, цГМФ).
ТЕМА 10.1. БИОСИНТЕЗ И КАТАБОЛИЗМ ПУРИНОВЫХ РИБОНУКЛЕОТИДОВ. ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ С НАРУШЕНИЕМ ИХ МЕТАБОЛИЗМА
1. Реакции образования пуриновых нуклеотидов начинаются с синтеза 5-фосфорибозил-1-дифосфата (ФРДФ), являющегося общим донором фосфорибозы в синтезе пуриновых и пиримидиновых нуклеотидов. ФРДФ образуется из рибозо-5-фосфата и АТФ в реакции, катализируемой ФРДФ-синтетазой:
 2. Основным путем образования пуриновых нуклеотидов является синтез из простых предшественников (de novo).
2. Основным путем образования пуриновых нуклеотидов является синтез из простых предшественников (de novo).
В этом метаболическом пути свободное азотистое основание не образуется, а пуриновое кольцо формируется на остатке рибозо-5-фосфата при участии глицина, амидного азота Глн, а-NН2-группы Асп, СО2 и одноуглеродных производных: метенил- и формил-Н4-фолата (рис. 10.1).
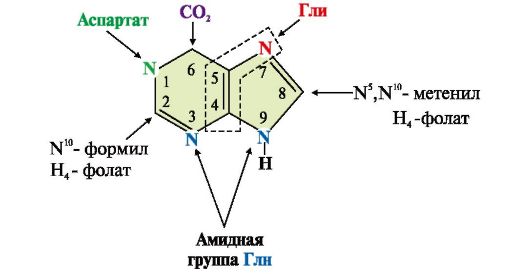 Рис. 10.1 Происхождение атомов С и N в пуриновом основании
Рис. 10.1 Происхождение атомов С и N в пуриновом основании
Синтез первого пуринового нуклеотида - инозин-5'-монофосфата (ИМФ)
включает 10 стадий и идет с затратой шести молекул АТФ. Все реакции протекают в цитозоле большинства клеток организма. Двумя последовательными реакциями ИМФ может превращаться в АМФ или ГМФ соответственно
(рис. 10.2).
Регуляторной и скорость-лимитирующей стадией процесса является перенос амидной группы Глн на ФРДФ с образованием 5-фосфорибозил-1- амина, которую катализирует ФРДФ-амидофосфорибозилтрансфераза.
Ткани, не способные к синтезу пуринов: эритроциты, полиморфноядерные лейкоциты и частично мозг - обеспечиваются нуклеотидами за счет их синтеза в печени.
3. Синтез нуклеозиддифосфатов (НДФ) и нуклеозидтрифосфатов (НТФ) происходит при участии АТФ и ферментов нуклеозидмонофосфат- или нуклеозиддифосфаткиназ (НМФ- и НДФ-киназы соответственно) (рис. 10.3).
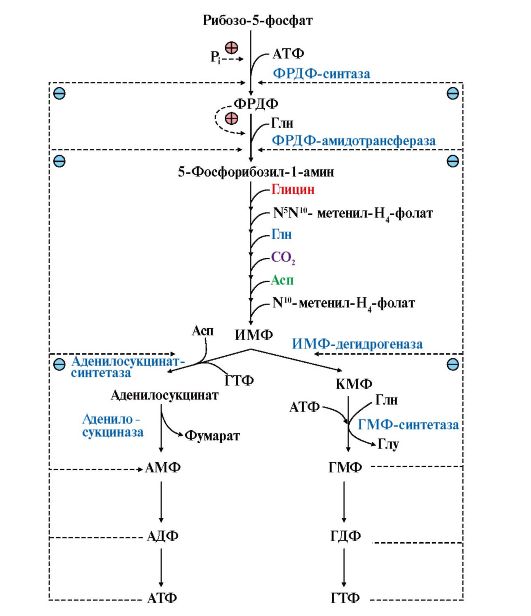 Рис. 10.2. Синтез пуриновых нуклеотидов и его регуляция.
Рис. 10.2. Синтез пуриновых нуклеотидов и его регуляция.
Перенос амидной группы Глн на ФРДФ и образование 5-фосфорибозил-1-амина катализирует ФРДФ-амидофосфорибозилтрансфераза. Затем с аминогруппой 5-фосфорибозил-1-амина последовательно взаимодействуют остаток Гли, N5N10- метенил-Н4-фолат, еще одна амидная группа Глн, диоксид углерода, аминогруппа Асп и формильный радикал N10-формил-Н4-фолата. Синтезируется первый пуриновый нуклеотид - инозин-5'-монофосфат (ИМФ). На этом этапе метаболический путь раздваивается и ИМФ становится общим предшественником АМФ и ГМФ, каждый из которых получается в двух последовательных реакциях. В процессе синтеза АМФ из ИМФ используется энергия молекулы ГТФ, а при синтезе ГМФ - энергия АТФ. ФРДФ-амидофосфорибозилтрансфераза, аденилосукцинатсинтетаза и ИМФ-дегидрогеназа - аллостерические ферменты, и их активность регулируется по механизму отрицательной обратной связи
 Рис. 10.3. Синтез пуриннуклеозидди- и -трифосфатов
Рис. 10.3. Синтез пуриннуклеозидди- и -трифосфатов
4. Регуляция процесса. АМФ, ГМФ, ИМФ, ди- и трифосфаты адениловых и гуаниловых нуклеотидов ингибируют ключевые реакции своего синтеза аллостерически по механизму отрицательной обратной связи.
Первые два фермента - ФРДФ-синтетаза и ФРДФ-амидофосфорибозилтрансфераза определяют скорость синтеза пуриновых нуклеотидов по основному пути, и их ингибирование происходит лишь при одновременном повышении концентрации АМФ и ГМФ. Активность аденилосукцинатсинтетазы и ИМФ-дегидрогеназы, находящихся на разветвлении метаболического пути, снижается при увеличении количества конечного продукта, образующегося в каждой из ветвей. АМФ ингибирует превращение ИМФ в аденилосукцинат, а ГМФ - превращение ИМФ в ксантозин-5'-монофосфат (КМФ). Превращение ИМФ в аденилосукцинат в ходе синтеза АМФ требует ГТФ, а превращение КМФ в ГМФ - АТФ. Перекрестная регуляция путей использования ИМФ служит для того, чтобы снизить синтез одного пуринового нуклеотида при дефиците другого и обеспечить сбалансированное содержание адениловых и гуаниловых нуклеотидов.
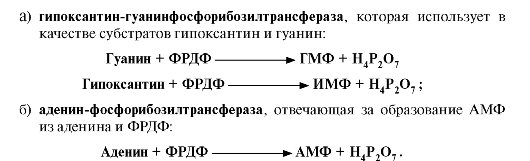
5. Запасные пути синтеза. Пуриновые нуклеотиды синтезируются «запасными» путями из азотистых оснований и нуклеозидов. Эти пути имеют вспомогательное значение, давая от 10 до 20% общего количества нуклеотидов. При этом используются азотистые основания и нуклеозиды, образующиеся в процессе катаболизма нуклеиновых кислот («путь спасения»). Эти реакции
катализируют ферменты:
 Еще один «запасной» путь включает фосфорилирование пуриновых нуклеозидов с помощью АТФ. Так, аденозинкиназа катализирует фосфорилирование аденозина до АМФ или дезоксиаденозина до дАМФ:
Еще один «запасной» путь включает фосфорилирование пуриновых нуклеозидов с помощью АТФ. Так, аденозинкиназа катализирует фосфорилирование аденозина до АМФ или дезоксиаденозина до дАМФ:
 6. Катаболизм пуриновых нуклеотидов. Гиперурикемия, подагра. Мононуклеотиды теряют фосфатный остаток гидролитически под действием фосфатаз или нуклеотидаз с образованием нуклеозидов. Дальнейшие превращения в мочевую кислоту сопровождаются гидролитическим дезаминированием с участием аденозиндезаминазы или гуаназы и отщеплением рибозы, которое ускоряется пуриннуклеозидфосфорилазой (рис. 10.4).
6. Катаболизм пуриновых нуклеотидов. Гиперурикемия, подагра. Мононуклеотиды теряют фосфатный остаток гидролитически под действием фосфатаз или нуклеотидаз с образованием нуклеозидов. Дальнейшие превращения в мочевую кислоту сопровождаются гидролитическим дезаминированием с участием аденозиндезаминазы или гуаназы и отщеплением рибозы, которое ускоряется пуриннуклеозидфосфорилазой (рис. 10.4).
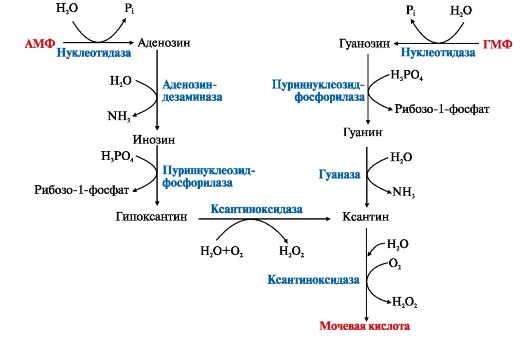 Рис. 10.4. Катаболизм пуриновых нуклеотидов. Образование мочевой кислоты.
Рис. 10.4. Катаболизм пуриновых нуклеотидов. Образование мочевой кислоты.
Мононуклеотиды под действием фосфатаз или нуклеотидаз теряют фосфатный остаток и превращаются в нуклеозиды. Аденозин дезаминируется, отщепляет рибозу и образует гипоксантин. Гуанозин в результате сходных реакций превращается в ксантин. Под действием ксантиноксидазы гипоксантин и ксантин окисляются в мочевую кислоту
Последние стадии процесса катализирует фермент ксантиноксидаза, участвующая в превращении азотистых оснований в конечный продукт. Она окисляет гипоксантин в ксантин и ксантин в мочевую кислоту с участием молекулярного кислорода. Образование мочевой кислоты происходит главным образом в печени и кишечнике. У человека мочевая кислота является конечным продуктом обмена пуринов и выводится из организма с мочой и немного через кишечник.
В норме содержание мочевой кислоты в сыворотке крови составляет 0,15-0,47 ммоль/л, или 3-7 мг/дл, а в суточной моче - 400-600 мг/дл.
Частым нарушением катаболизма пуринов является гиперурикемия, которая возникает, когда в плазме крови концентрация мочевой кислоты превышает норму.
На фоне гиперурикемии развивается подагра - заболевание, при котором мочевая кислота и ураты из-за плохой растворимости начинают кристаллизоваться и откладываться в суставных хрящах, связках и мягких тканях с образованием подагрических узлов или тофусов, вызывая воспаление суставов и почечнокаменную болезнь. Подагрой страдает от 0,3 до 1,7% населения земного шара. У мужчин сывороточный фонд уратов в 2 раза выше, чем у женщин, поэтому они болеют подагрой в 20 раз чаще, чем женщины.
Заболевание генетически детерминировано и вызвано:
• дефектами ФРДФ-синтетазы, связанными с гиперактивацией фермента, либо его устойчивостью к ингибированию конечными продуктами синтеза;
• частичной потерей активности гипоксантин-гуанинфосфорибозилтрансферазы, которая обеспечивает повторное использование пуринов.
При полной потере активности гипоксантин-гуанинфосфорибозилтрансферазы развивается тяжелая форма гиперурикемии - синдром Леша-Нихена, при котором наблюдаются неврологические и психические отклонения. В первые месяцы жизни детей неврологические расстройства еще не наблюдаются, но на пеленках обнаруживаются розовые и оранжевые пятна, вызванные повреждением мочевыводящих путей кристаллами мочевой кислоты. Болезнь наследуется как рецессивный признак, сцепленный с Х-хромосомой, и встречается только у мальчиков.
Лечат подагру диетой, ограничивающей потребление мясных продуктов, и аллопуринолом - структурным аналогом гипоксантина. Ксантиноксидаза окисляет препарат в оксипуринол, который прочно связывается с активным центром фермента и останавливает катаболизм пуринов на стадии гипоксантина, который в 10 раз лучше растворим в жидкостях организма, чем мочевая кислота.
ТЕМА. 10.2. БИОСИНТЕЗ И КАТАБОЛИЗМ ПИРИМИДИНОВЫХ РИБОНУКЛЕОТИДОВ. ОРОТАЦИДУРИЯ
1. УМФ является общим предшественником всех остальных пиримидиновых нуклеотидов: ЦМФ и ТМФ. Синтез УМФ de novo включает шесть последовательных стадий (рис. 10.5) и протекает главным образом в цитозоле клеток при участии трех ферментов, два из которых полифункциональны:
• первый полифункциональный фермент - КАД-фермент содержит домены, проявляющие активности карбамоилфосфатсинтетазы II (КФСН), аспартаттранскарбамоилазы (ATK), дигидрооротазы и катализирующие три первые реакции этого метаболического пути;
• митохондриальная NAD-зависимая дигидрооротатдегидрогеназа которая окисляет дигидрооротат в оротат;
• превращение азотистого основания - оротата в нуклеотид и его последующее декарбоксилирование до УМФ катализирует второй полифункциональный фермент - УМФ-синтаза, обладающая оротатфосфорибозилтрансферазной и ОМФ-декарбоксилазной активностями.
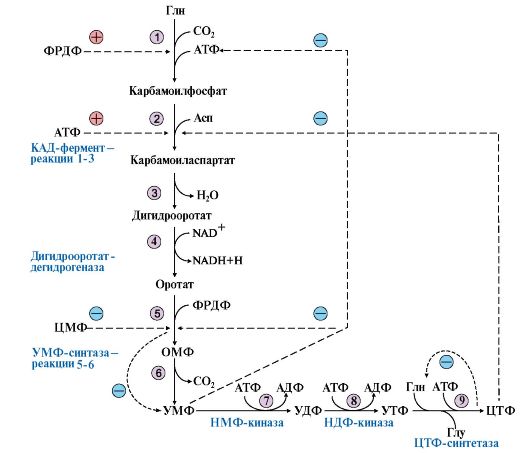 Рис. 10.5. Синтез пиримидиновых нуклеотидов и его регуляция:
Рис. 10.5. Синтез пиримидиновых нуклеотидов и его регуляция:
1-3 - КАД-фермент (1-карбамоилфосфатсинтетаза, КФС11); 2 - аспартаттранскарбамоилаза (АТК); 3 -дигидрооротаза; 4 - дигидрооротатдегидрогеназа; 5, 6 - УМФ-синтаза (5-оротатфосфорибозилтрансфераза; 6 - ОМФ-декарбоксилаза); 7 - НМФ-киназа; 8 - НДФ-киназа; 9 - ЦТФ-синтетаза.
Аллостерически регулируются по механизму отрицательной обратной связи карбамоилфосфатсинтетазная и аспататтранскарбамоилазная активности КАД-фермента конечными продуктами метаболического пути - УМФ и ЦТФ, тогда как ФРДФ активизирует КФС11, а АТФ - АТК
Пиримидиновое кольцо «собирается» из простых предшественников - глутамина, аспартата и СО2 - и после окисления превращается в азотистое основание - оротат. Превращение оротата в нуклеотид - оротидин-5'- монофосфат (ОМФ) - осуществляется с использованием ФРДФ. УМФ образуется при декарбоксилировании ОМФ.
Превращение УМФ в полифосфорные производные за счет переноса γ-фосфатного остатка АТФ на УМФ с образованием УДФ и УТФ катализируют НМФ- и НДФ-киназы.
Синтез ЦТФ из УТФ осуществляет ЦТФ-синтетаза, используя амидную группу Глн и энергию АТФ для аминирования пиримидинового кольца.
2. Регуляция процесса. Активность ферментов синтеза пиримидиновых нуклеотидов регулируется аллостерически по механизму отрицательной обратной связи конечными продуктами УМФ и ЦТФ:
• в составе КАД-фермента: УМФ ингибирует, а ФРДФ активирует КФС II, тогда как активность аспартаттранскарбамоилазы ингибирует ЦТФ, но активирует АТФ;
• УМФ и ЦМФ снижают активность второго полифункционального фермента - УМФ-синтазы;
• накопление ЦТФ снижает активность ЦТФ-синтетазы.
Синтез пуриновых и пиримидиновых нуклеотидов строго координируется: ФРДФ активирует оба синтеза, а накопление пуриновых и пиримидиновых нуклеотидов ингибирует образование ФРДФ по механизму отрицательной обратной связи.
 4. Оротацидурия - редкое
наследственное заболевание, при котором в результате мутации в гене
второго полифункционального фермента нарушается превращение оротата в
УМФ. С мочой выделяется до 1,5 г оротата (в 1000 раз больше, чем в
норме). Клинически заболевание проявляется в виде мегалобластной анемии,
нарушений работы ЖКТ, сердца, интеллектуального развития и двигательной
способности. Высокие концентрации оротата в крови и тканях нетоксичны
для организма, а указанные симптомы возникают в результате неспособности
организма из-за «пиримидинового голода» обеспечить нормальную
скорость синтеза нуклеиновых кислот и увеличения числа клеток. Наиболее
характерным следствием оротацидурии является мегалобластная анемия, вызванная
снижением скорости деления клеток эритроцитарного ряда. Для лечения
этой болезни используют уридин или цитидин в дозах от 0,5 до 1 г/сут,
которые с помощью уридинцитидинкиназы превращаются в УМФ или ЦМФ в обход
нарушенной реакции. Полифосфорные производные полученных нуклеотидов -
УТФ и ЦТФ - ингибируют регуляторные ферменты синтеза пиримидиновых
нуклеотидов de novo и снижают синтез и выведение оротата с мочой.
4. Оротацидурия - редкое
наследственное заболевание, при котором в результате мутации в гене
второго полифункционального фермента нарушается превращение оротата в
УМФ. С мочой выделяется до 1,5 г оротата (в 1000 раз больше, чем в
норме). Клинически заболевание проявляется в виде мегалобластной анемии,
нарушений работы ЖКТ, сердца, интеллектуального развития и двигательной
способности. Высокие концентрации оротата в крови и тканях нетоксичны
для организма, а указанные симптомы возникают в результате неспособности
организма из-за «пиримидинового голода» обеспечить нормальную
скорость синтеза нуклеиновых кислот и увеличения числа клеток. Наиболее
характерным следствием оротацидурии является мегалобластная анемия, вызванная
снижением скорости деления клеток эритроцитарного ряда. Для лечения
этой болезни используют уридин или цитидин в дозах от 0,5 до 1 г/сут,
которые с помощью уридинцитидинкиназы превращаются в УМФ или ЦМФ в обход
нарушенной реакции. Полифосфорные производные полученных нуклеотидов -
УТФ и ЦТФ - ингибируют регуляторные ферменты синтеза пиримидиновых
нуклеотидов de novo и снижают синтез и выведение оротата с мочой.
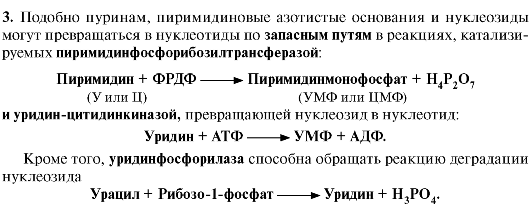
5. Катаболизм пиримидиновых нуклеотидов. От пиримидиновых нуклеотидов отщепляются остатки фосфорной кислоты и рибозы в реакциях, аналогичных катаболизму пуриновых нуклеотидов. Образующиеся пиримидиновые основания способны разрушаться ферментными системами организма с образованием ряда продуктов (рис. 10.6).
 Рис. 10.6. Катаболизм пиримидиновых оснований
Рис. 10.6. Катаболизм пиримидиновых оснований
В отличие от конечных продуктов пуринового обмена продукты катаболизма пиримидинов хорошо растворимы в воде. Причем β-аланин имеет физиологическое значение, содержится во многих тканях и в плазме крови в свободном виде или включается в состав мышечных пептидов: карнозина и ансерина. Бактериальные клетки используют β-аланин для синтеза пантотеновой кислоты, которая входит в состав HS-КоА.
β-Аминоизобутират, образующийся при распаде тимина, частично экскретируется с мочой, а частично трансаминируется, превращаясь в метилмалонил полуальдегид, а затем в сукцинил-КоА.
ТЕМА 10.3. БИОСИНТЕЗ ДЕЗОКСИРИБОНУКЛЕОТИДОВ.
ИММУНОДЕФИЦИТЫ
Клетки, как правило, содержат в 5-10 раз больше РНК, чем ДНК. Быстрорастущие клетки для репликации генома нуждаются в дезоксирибонуклеозидтрифосфатах (дНТФ), которые образуются путем прямого восстановления гидроксильной группы рибозы в дезоксирибозу в составе пуриновых и пиримидиновых НДФ и последующего фосфорилирования дНДФ с использованием АТФ.
1. Восстановление всех рибонуклеотидов катализирует рибонуклеотидредуктазный комплекс, который включает рибонуклеотидредуктазу (РНРазу), белковый кофактор тиоредоксин и систему его регенерации: фермент тиоредоксинредуктазу и NADPH (рис. 10.7). Непосредственным восстановителем НДФ является тиоредоксин, сульфгидрильные группы которого в ходе этой реакции окисляются.
2. РНРаза - аллостерический фермент и его активность зависят от количественного содержания отдельных дезоксирибонуклеотидов в клетке. дАТФ является ингибитором восстановления всех рибонуклеотидов, а дГТФ подавляет восстановление пиримидиновых НДФ.
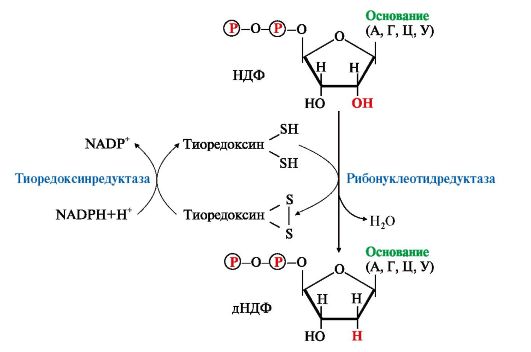 Рис. 10.7. Восстановление рибонуклеозиддифосфатов в дезоксипроизводные.
Рис. 10.7. Восстановление рибонуклеозиддифосфатов в дезоксипроизводные.
Восстановителем НДФ является тиоредоксин, сульфгидрильные группы которого окисляются в ходе этой реакции. Окисленный тиоредоксин восстанавливается тиоредоксинредуктазой с участием NADPH
3. Синтез дТМФ из дУМФ катализирует тимидилатсинтаза с участием N5N10- метилен Н4-фолата, за счет которого:
• включается одноуглеродный радикал в молекулу дУMФ и
• восстанавливается метиленовая группа в метильную. Тимидилатсинтаза не только переносит метиленовую группу
N5N10-метилен-Н4-фолата в 5-положение пиримидинового основания дУМФ, но в процессе восстановления ее в метильный радикал забирает два атома водорода от Н4-фолата, поэтому восполнение запасов N5N10-метилен- Н4-фолата нуждается в работе еще двух ферментов: дигидрофолатредуктазы и сериноксиметилтрансферазы (рис. 10.8).
Интенсивность синтеза дТМФ зависит от скорости восстановления продукта реакции дигидрофолата в Н4-фолат с помощью дигирофолатредуктазы.
Образование дУМФ осуществляется двумя путями: дефосфорилированием дУДФ или дефосфорилированием дЦДФ и последующим гидролитическим дезаминированием дЦМФ с помощью дЦMФ-дезаминазы. В организме человека преобладает последний путь.
4. Количество ферментов РНРазы и тимидилатсинтазы регулируется на
генетическом уровне по механизму индукции и зависит от скорости синтеза ДНК. Их количество увеличивается и высокая скорость реакций, катализируемых РНРазой и тимидилатсинтазой, наблюдаются только тогда, когда клетки активно синтезируют ДНК и готовятся к делению.
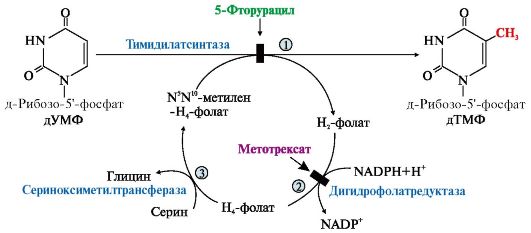 Рис. 10.8. Синтез дТМФ
Рис. 10.8. Синтез дТМФ
На схеме показаны препараты, часто использующиеся в лечении онкологических заболеваний и останавливающие синтез дТМФ на стадиях превращения дУМФ в дТМФ и восстановления Н2-фолата в Н4-фолат
5. Небольшое количество дезоксирибонуклеотидов может образовываться по «запасному» пути в реакциях, катализируемых тимидинкиназой и дезоксицитидинкиназой:
 Дезоксицитидинкиназа фосфорилирует также дезоксигуанозин и дезоксиаденозин.
Дезоксицитидинкиназа фосфорилирует также дезоксигуанозин и дезоксиаденозин.
6. Иммунодефициты - состояния, связанные с нарушением функций иммунной системы. Они возникают при ингибировании работы РНРазы, вызванном недостаточностью ферментов катаболизма аденозина и гуанозина. Недостаточность аденозиндезаминазы и пуриннуклеозидфосфорилазы снижает скорость превращения пуриновых нуклеозидов в азотистые основания и мочевую кислоту. В клетках накапливаются избыточные количества рибо- и дезоксирибонуклеотидов, вызывая в быстро делящихся клетках повышение концентрации дАТФ и дГТФ, которые тормозят восстановление всех остальных НДФ в дезоксипроизводные. Это останавливает синтез ДНК и деление клеток.
• Низкая активность аденозиндезаминазы нарушает пролиферацию и созревание Т- и В-лимфоцитов и сопровождается возникновением тяжелых форм клеточного и гуморального иммунодефицита. Накопление дАТФ ингибирует РНРазу и лишает клетки субстратов для синтеза ДНК. Дети с этой патологией, как правило, погибают от частых инфекций.
• Наследственная недостаточность пуриннуклеозидфосфорилазы останавливает созревание Т-лимфоцитов в связи с накоплением в клеткахпредшественниках дГТФ, блокирующего РНРазу и синтез пиримидиновых дНТФ, но не столь сильно, как дАТФ. У пациентов оказывается сниженным клеточный иммунитет. Больные страдают частыми и хроническими инфекционными заболеваниями.
ТЕМА 10.4. МЕХАНИЗМЫ ДЕЙСТВИЯ ПРОТИВОВИРУСНЫХ И ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ НА ФЕРМЕНТЫ СИНТЕЗА РИБО- И ДЕЗОКСИРИБОНУКЛЕОТИДОВ
Аналоги пуринов и пиримидинов, их нуклеозиды и нуклеотиды широко используются в клинической медицине и научных исследованиях (табл. 10.1). Изменения в структуре гетероциклического кольца или углеводной компоненты приводят к образованию соединений, токсический эффект которых обусловлен:
• ингибированием определенных ферментов, участвующих в синтезе нуклеотидов или нуклеиновых кислот;
• включением синтетических аналогов нуклеотидов в РНК или ДНК, где они нарушают комплементарное взаимодействие азотистых оснований или удлинение полинуклеотидных цепей.
Таблица 10.1. Некоторые противоопухолевые и противовирусные препараты
Соединения | Механизм действия | Область применения |
5-Фторурацил | Превращается в рибо- и дезоксирибонуклеотиды, которые ингибируют тимидилатсинтазу и рост цепей РНК | Лечение солидных опухолей желудка, ЖКТ, молочной железы, легких и др. |
Метотрексат | Структурный аналог фолиевой кислоты, ингибирует дигидрофолатредуктазу, нарушает синтез пуриновых нуклеотидов и превращение дУМФ в дТМФ | Химиотерапия опухолей |
Ацикловир (ацикло- гуанозин) | Превращается в соответствующий НТФ и останавливает синтез вирусной ДНК | Лечение герпесных инфекций |
Азидотимидин (АЗТ) | Фосфорилируется с образованием АЗТ-трифосфата и блокирует репликацию вируса иммунодефицита | Лечение СПИДа |
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
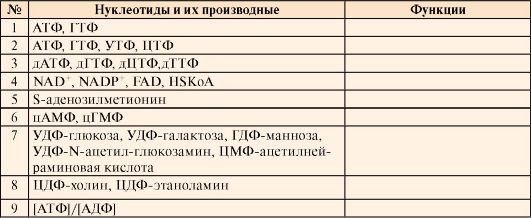
1. Систематизируйте знания о функциях нуклеотидов. Для этого перенесите в тетрадь и заполните табл. 10.2. В ходе этой работы используйте сведения из учебника о значении нуклеотидов в трансдукции сигналов, синтезе нуклеиновых кислот и белков, регуляции дыхания, а также в образовании углеводов, сложных липидов и аминокислот.
Таблица 10.2. Функции нуклеотидов и их производных
 2. Напишите
две начальные регуляторные реакции синтеза пуриновых нуклеотидов с
образованием 5-фосфорибозил-1-амина. Укажите ферменты, их активаторы и
ингибиторы.
2. Напишите
две начальные регуляторные реакции синтеза пуриновых нуклеотидов с
образованием 5-фосфорибозил-1-амина. Укажите ферменты, их активаторы и
ингибиторы.
3. Напишите строение аденина и тимина и укажите происхождение атомов С и N в этих азотистых основаниях. Отметьте, какие атомы азотистых оснований будут участвовать в связывании с рибозой или дезоксирибозой.
4. Напишите схему реакций, в ходе которых ИМФ превращается в ГМФ и АМФ. Укажите регуляторные ферменты, их активаторы и ингибиторы.
5. Синдром Леша-Нихена - наследственное заболевание, связанное с полным отсутствием активности фермента гипоксантин-гуанинфосфорибозилтрансферазы. Напишите схемы реакций, которые не осуществляются в организме больных, страдающих указанной патологией. Укажите, как используются субстраты этого фермента в данном случае.
6. а) Напишите схему метаболического процесса, в котором участвуют фер-
менты: аденозиндезаминаза, пуриннуклеозидфосфорилаза и ксантиноксидаза.
б) Установите соответствие. Ферменты:
A. Аденозиндезаминаза
Б. Пуриннуклеозидфосфорилаза
B. Ксантиноксидаза Г. Гуаназа
Д. Гипоксантингуанинфосфорибозилтрансфераза Характеристика:
1. Катализирует фосфоролитическое расщепление нуклеозидов
2. Относится к классу оксидоредуктаз
3. Катализирует превращение аденозина в инозин
в) Укажите, какие патологии связаны с недостаточностью аденозиндезаминазы и пуриннуклеозидфосфорилазы в Т- и В-лимфоцитах.
7. Напишите схему синтеза пиримидиновых нуклеотидов до образования УМФ. Укажите ферменты, катализирующие отдельные стадии процесса. Отметьте регуляторные ферменты, их активаторы и ингибиторы. Опишите заболевание, которое связано с недостаточностью фермента УМФ-синтазы.
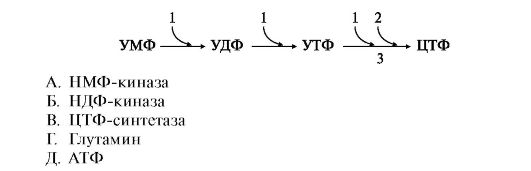
8. Дополните схему превращения УМФ в ЦТФ недостающими компонентами, подобрав к цифрам буквы:
 9. Напишите
схему синтеза УМФ по запасному пути с участием уридинцитидинкиназы.
Назовите наследственное заболевание, при котором с помощью этой реакции у
больных устраняется «пиримидиновый голод».
9. Напишите
схему синтеза УМФ по запасному пути с участием уридинцитидинкиназы.
Назовите наследственное заболевание, при котором с помощью этой реакции у
больных устраняется «пиримидиновый голод».
10. На схеме превращения ЦДФ в дЦДФ изобразите сопряженный процесс, в ходе которого восстанавливается окисленный тиоредоксин. Укажите ферменты и кофермент, участвующие в этих реакциях. Перечислите метаболиты, ингибирующие скорость этой реакции по аллостерическому механизму.
11. Перенесите в тетрадь табл. 10.3 и, используя информацию рис. 10.7 и 10.8, заполните ее.
Таблица 10.3. Пути синтеза дезоксирибонуклеотидов
? п/п | Компоненты реакций | Биосинтез дАДФ, дГТФ, дУДФ, дЦДФ | Биоситез дТМФ |
1. | Субстраты | ||
2 | Ферменты | ||
3. | Доноры Н в реакциях восстановления Донор СН3-группы |
12. Составьте схему реакций превращения в активный ингибитор
тимидилатсинтазы - д5-F-УMФ, имея в виду, что компонент УМФсинтазы - оротатфосфорибозилтрансфераза может превращать аналоги пиримидинов в нуклеотиды. Укажите механизм, по которому это соединение снижает активность тимидилатсинтазы.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
 3. Установите соответствие.
3. Установите соответствие.
Ферменты:
A. Ксантиноксидаза Б. Гуаназа
B. Пуриннуклеозидфосфорилаза Г. Аденозиндезаминаза
Д. Нуклеотидаза
Реакции:
1. Образование аденозина из АМФ
2. Введение гидроксильной группы в С8-положение пуринового кольца
3. Превращение нуклеозида в азотистое основание
4. Выберите правильные ответы. Ксантиноксидаза:
A. Содержит в рабочей части фермента производное витамина РР
Б. Катализирует реакции, в которых одним из продуктов является Н2О2
B. Обладает абсолютной специфичностью к субстрату
Г. Использует в качестве субстрата - гипоксантин, который растворим хуже, чем мочевая кислота
Д. Катализирует две последовательные необратимые реакции образования мочевой кислоты
5. Выполните «цепное» задание:
а) одним из субстратов синтеза УМФ является:
A. Аспарагин Б. Глутамин
B. Аланин Г. Аргинин
б) выбранная аминокислота вступает в реакцию образования:
A. 5-Фосфорибозил-1-дифосфата Б. Инозин-5-монофосфата
B. Карбамоилфосфата Г. Рибозо-5-фосфата
в) это вещество последовательно подвергается:
A. Конденсации с аспарагиновой кислотой, дегидратации, дегидрированию
Б. Дегидрированию, конденсации с аспарагиновой кислотой, дегидратации
B. Дегидратации, конденсации с аспарагиновой кислотой, дегидриро-
ванию
Г. Конденсации с аспарагиновой кислотой, дегидрированию, дегидратации
г) в результате образуется свободное пиримидиновое основание:
A. Урацил Б. Цитозин
B. Тимин Г. Оротат
д) при повышении концентрации в организме этого основания развивается:
A. Подагра
Б. Синдром Леша-Нихена
B. Оротацидурия Г. Гиперурикемия
е) при лечении этого заболевания используют:
A. АТФ
Б. Оротат
B. Урацил Г. Уридин Д. Тимин
6. Выберите правильные ответы.
Для карбамоилфосфатсинтетазы II в составе КАД-фермента характерно, что:
A. Фермент локализован в цитозоле клеток
Б. Субстратами КФС II являются СО2, NH3 и две молекулы АТФ
B. Продукт реакции - карбамоилфосфат является макроэргическим соединением
Г. Фермент катализирует обратимую реакцию Д. Относится к классу трансфераз
7. Выберите правильный ответ.
Компонент РНР-азного комплекса, участвующий в восстановлении гидроксильной группы в С2 -положении рибозы:
A. NADH Б. NADPH
B. Тиоредоксин
Г. Тиоредоксинредуктаза Д. FADH2
8. Выберите правильные ответы.
В превращении дУМФ в дТМФ участвуют ферменты:
A. Тимидилатсинтаза
Б. Дигидрофолатредуктаза
B. Фосфатаза
Г. дЦМФ-дезаминаза
Д. Сериноксиметилтрансфераза
9. Выберите правильный ответ.
В активно делящихся клетках тимидин активно превращается в дТМФ при участии:
A. Пиримидинфосфорибозилтрансферазы
Б. ФРДФ
B. АТФ
Г. Тимидилатсинтазы Д. Тимидинкиназы
10. Установите соответствие. Ингибируемые реакции:
A. Образование дТМФ из дУМФ Б. Образование дАДФ из АДФ
B. Восстановление тиоредоксина
Г. Образование Н4-фолата из Н2-фолата Д. Репликация вирусной ДНК Противоопухолевые препараты:
1. Ацикловир
2. 5-F-урацил
3. Метотрексат
11. Выберите правильные ответы.
Аналоги фолиевой кислоты - мощные ингибиторы пролиферации, так как они:
A. Являются конкурентными ингибиторами дигидрофолатредуктазы Б. Нарушают синтез пуринового кольца
B. Уменьшают скорость превращения дУМФ в дТМФ Г. Снижают образование АМФ и ГМФ из ИМФ
Д. Нарушают превращение УТФ в ЦТФ
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. 1-Г, 2-Б, 3-А
2. 1-А, 2-Б, 3-Г
3. 1-Д, 2-А, 3-В
4. Б, Д
5. а) Б, б) В, в) А, г) Г, д) В, е) Г, Д
6. А, В
7. В
8. А, Б, Д
9. Д
10. 1-Д, 2-А, 3-Г
11. А, Б, В
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Синтез пуриновых нуклеотидов из простых предшественников (de novo)
2. Запасные пути образования пуриновых нуклеотидов
3. Катаболизм пуринов
4. Гиперурикемия
5. Подагра
6. Синдром Леша-Нихена
7. Синтез пиримидиновых нуклеотидов de novo
8. Оротацидурия
9. Рибонуклеотидредуктазный комплекс
10. Тимидилатсинтазный комплекс
11. Иммунодефициты как результат недостаточности ферментов катаболизма пуриннуклеозидов
12. Ингибиторы синтеза дезоксирибонуклеотидов
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. Через 1 час после внутривенного введения животным аспартата, содержащего изотоп 15N, радиоактивная метка была обнаружена в РНК и ДНК разных органов и тканей. Как объяснить результаты этого эксперимента? Для ответа:
а) напишите формулы азотистых оснований, в составе которых окажется
метка, и отметьте в них радиоактивный атом;
б) для пиримидиновых нуклеотидов правильность вашего выбора докажите схемой соответствующего метаболического пути.
2. Антибиотик азасерин - структурный аналог глутамина, являющийся мощным ингибитором синтеза пуриновых нуклеотидов, нашел применение в экспериментальных работах. Зная происхождение атомов гетероциклического кольца пурина, определите, какие этапы синтеза пуриновых нуклеотидов будут ингибированы при введении азасерина.
3. У новорожденного на первой неделе жизни обнаружили двустороннюю пневмонию. Внимательно обследовав маленького пациента, врачи выяснили, что он страдает врожденным иммунодефицитом. У больного была снижена скорость дезаминирования адениловых и дезоксиадениловых нуклеотидов. Малышу повезло: врачи вовремя приняли необходимые меры и ввели ему генную конструкцию, содержавшую необходимый ген. Однако большинство детей с подобной генетической патологией погибают в раннем возрасте. Объясните причину высокой смертности детей с такой патологией. Для этого:
а) напишите схемы реакций, скорость которых снижена у данного пациента, и участвующие в них ферменты;
б) укажите вещество, накапливающееся при снижении скорости дезаминирования адениловых нуклеотидов, и фермент, активность которого ингибирует это вещество. Представьте схему реакции, катализируемую этим ферментом;
в) объясните, пролиферация и созревание каких клеток снижается при ингибировании этой реакции и почему.
4. В клинику обратился мужчина с жалобой на острую боль в суставе большого пальца левой ноги, возникшую два дня назад. При осмотре отмечалась отечность плюснефалангового сустава, покраснение и местное повышение температуры. В ходе сбора анамнеза выяснилось, что пациент употребляет много мясной пищи. Биохимический анализ крови показал: содержание мочевой кислоты - 0,51 ммоль/л (норма - 0,17-0,42 ммоль/л). Каков наиболее вероятный диагноз в данном случае и каковы причины возникновения этого заболевания? Для ответа на вопрос:
а) приведите схему синтеза мочевой кислоты;
б) объясните механизм развития указанных симптомов;
в) укажите, какие лечебно-профилактические мероприятия необходимо провести в данном случае;
г) объясните, почему вещество, используемое для лечения указанной патологии, облегчает состояние больного.
5. Молодая мама обнаружила на пеленках своего сына розовые и оранжевые разводы; этот факт удивил женщину, и она решила обратиться в детскую поликлинику. После проведения анализов вердикт педиатров был неутешителен: у малыша обнаружилась тяжелая форма гиперурикемии - синдром Леша-Нихена. Объясните, чем было вызвано данное заболевание. Для ответа на вопрос:
а) представьте схему метаболического пути, при нарушении которого наблюдается синдром Леша-Нихена;
б) напишите реакцию, дефект которой явился причиной данного заболевания; укажите фермент, который ее катализирует;
в) объясните причину появления розовых и оранжевых разводов на пеленках.
6. В процессе лечения подагры аллопуринолом у больного обнаружили накопление оротовой кислоты в тканях и крови. Содержание оротовой кислоты в моче значительно превосходило норму (600 мг/сут). Врач поставил диагноз - оротацидурия. Почему развилась эта патология? Для ответа:
а) укажите, при нарушении какого метаболического пути для лечения используют аллопуринол;
б) вспомните, дефектом какого фермента обмена нуклеотидов вызвана наследственная оротацидурия;
в) объясните, почему в процессе лечения аллопуринолом у больного развилась оротацидурия.
7. У ребенка по результатам анализов на фоне мегалобластной анемии содержание оротовой кислоты в моче составляет более 1 г/сут (в норме синтезируется 600 мг/сут) и отмечено резкое снижение активности фермента УМФ-синтазы. Какое заболевание мы можем диагностировать? Для ответа на вопрос:
а) приведите реакции, которые катализирует бифункциональный фермент УМФ-синтаза;
б) укажите возможные последствия данного заболевания;
в) объясните, почему для лечения этой болезни используют уридин;
г) напишите схему реакции, в которую вовлекается уридин, и опишите механизм действия полученного продукта на метаболизм пиримидинов.