Биологическая химия с упражнениями и задачами : учебник / под ред. чл.-корр. РАМН С.Е. Северина. - 2011. - 624 с.: ил.
|
|
|
|
МОДУЛЬ 2 ЭНЗИМОЛОГИЯ
Структура модуля | Тема |
Модульная единица 1 | 2.1. Свойства ферментов как белковых катализаторов 2.2. Активный центр: специфичность действия ферментов 2.3. Механизм действия ферментов 2.4. Кофакторы и коферменты 2.5. Классификация и номенклатура ферментов 2.6. Основы кинетики ферментативного катализа |
Модульная единица 2 | 2.7. Ингибиторы активности ферментов 2.8. Регуляция активности ферментов 2.9. Применение ферментов в медицине 2.10. Энзимопатии |
Модульная единица 1 ФЕРМЕНТЫ КАК БЕЛКОВЫЕ КАТАЛИЗАТОРЫ
Цели изучения Уметь:
1. Объяснять свойства ферментов и особенности ферментативного катализа их белковой природой.
2. Оценивать роль витаминов в питании человека как субстратов для синтеза коферментов.
3. Определять принадлежность ферментов к определенному классу и подклассу в соответствии с их номенклатурой.
4. Рассчитывать активность ферментов и оценивать сродство фермента к субстрату.
Знать:
1. Особенности строения ферментов как белковых катализаторов.
2. Виды специфичности ферментов.
3. Основы классификации ферментов, классы ферментов, примеры катализируемых ферментами реакций.
4. Строение коферментов и кофакторов и их роль в ферментативном катализе, роль витаминов в этом процессе.
5. Основы ферментативной кинетики.
6. Единицы активности ферментов и способы их определения.
ТЕМА 2.1. СВОЙСТВА ФЕРМЕНТОВ КАК БЕЛКОВЫХ
КАТАЛИЗАТОРОВ
1. Ферменты - это белковые катализаторы, ускоряющие химические реакции в живых клетках. Они обладают всеми свойствами, характерными для белков, и определенными особенностями строения, обусловливающими их каталитические свойства. Ферменты, кроме того, подчиняются общим законам катализа и обладают свойствами, характерными для небиологических катализаторов: ускоряют энергетически возможные реакции, сохраняют энергию химической системы постоянной, не расходуются в процессе реакции.
2. Для ферментов характерны:
• специфичность. Биологическая функция фермента, как и любого белка, обусловлена наличием в его структуре активного центра, с которым взаимодействует определенный лиганд. Лиганд, взаимодействующий с активным центром фермента, называется субстратом.
• каталитическая эффективность. Большинство катализируемых ферментами реакций высокоэффективны, они протекают в 108-1014 раз быстрее, чем некатализируемые реакции. Каждая молекула фермента способна за секунду трансформировать от 100 до 1000 молекул субстрата в продукт.
• конформационная лабильность. Каталитическая эффективность фермента, как и любой белковой молекулы, зависит от его конформации и, в частности, от конформации активного центра. В клетках имеются вещества, которые могут вызывать незначительные изменения конформации молекулы фермента за счет разрыва одних и образования других слабых связей; это может вызывать как повышение, так и снижение активности фермента.
3. Активность ферментов может регулироваться. Действие ферментов в клетке, как правило, строго упорядочено: продукт одной ферментативной реакции является субстратом другой; таким образом образуются метаболические пути. Среди множества ферментов практически каждого метаболического пути имеются ключевые, или регуляторные, ферменты, активность которых может изменяться в зависимости от потребности клетки в конечном продукте метаболического пути.
4. Оптимальные условия протекания ферментативных реакций: температура 37-38 °С; нормальное атмосферное давление, рН 6,9-7,7, характерное для большинства тканей. В отличие от этого для эффективного химического катализа часто требуются высокие температура и давление, а также экстремальные значения рН.
ТЕМА 2.2. АКТИВНЫЙ ЦЕНТР: СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ ФЕРМЕНТОВ
1. Активный центр ферментов - это определенный участок белковой молекулы, способный комплементарно связываться с субстратом и обеспечивающий его каталитическое превращение. Структура активного центра сформирована радикалами аминокислот, так же как и в случае активного центра любого белка. В активном центре фермента имеются аминокислотные остатки, функциональные группы которых обеспечивают комплементарное связывание субстрата (участок связывания), и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата (каталитический участок) (рис. 2.1).
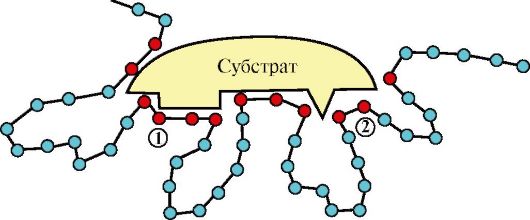 Рис. 2.1. Схема строения активного центра фермента.
Рис. 2.1. Схема строения активного центра фермента.
Красным цветом отмечены аминокислоты, образующие активный центр фермента: 1 - участок связывания; 2 - каталитический участок
2. Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость ферментов. Различают субстратную и каталитическую специфичности фермента, которые определяются строением активного центра.
3. Под субстратной специфичностью понимается способность каждого фермента взаимодействовать лишь с одним или несколькими определенными субстратами.
Различают:
- абсолютную субстратную специфичность, если активный центр фермента комплементарен только одному субстрату;
- групповую субстратную специфичность, если фермент катализирует однотипную реакцию с небольшим количеством (группой) структурно похожих субстратов;
- стереоспецифичность, если фермент проявляет абсолютную специфичность только к одному из существующих стереоизомеров субстрата.
4. Каталитическая специфичность, или специфичность пути превращения субстрата, обеспечивает преобразование одного и того же субстрата под действием разных ферментов. Это обеспечивается строением каталитических участков активных центров соответствующих ферментов. Например, молекула
глюкозо-6-фосфата в клетках печени человека является субстратом четырех различных ферментов: фосфоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы. Однако за счет особенностей строения каталитических участков этих ферментов происходят различные превращения глюкозо-6-фосфата с образованием четырех различных продуктов (рис. 2.2).
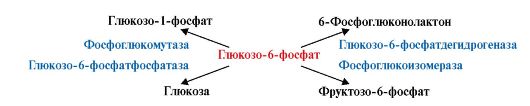 Рис. 2.2. Каталитические пути превращения глюкозо-6-фосфата.
Рис. 2.2. Каталитические пути превращения глюкозо-6-фосфата.
Специфичность пути превращения субстрата обеспечивает возможность преобразования одного и того же субстрата под действием разных ферментов. Молекула глюко- зо-6-фосфата является субстратом разных ферментов, что приводит к образованию разных продуктов
ТЕМА 2.3. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
1. В ходе катализа субстрат, связанный с активным центром фермента в фермент-субстратный (ES) комплекс, претерпевает химическое превращение в продукт, который затем высвобождается. Схематично процесс катализа можно представить следующим образом:
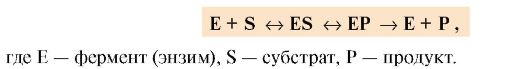 Процесс
ферментативного катализа условно можно разделить на этапы (рис. 2.3).
На этапе I происходит сближение и ориентация субстрата в области
активного центра фермента. На этапе II в результате индуцированного соответствия [изменение
конформации субстрата (S) и активного центра фермен- та] образуется
фермент-субстратный комплекс (ES). На этапе III происходит
дестабилизация связей в субстрате и образование нестабильного комплекса
фермент-продукт (ЕР). На этапе IV происходит распад комплекса (ЕР) с
высвобождением продуктов реакции из активного центра и освобождением
фермента.
Процесс
ферментативного катализа условно можно разделить на этапы (рис. 2.3).
На этапе I происходит сближение и ориентация субстрата в области
активного центра фермента. На этапе II в результате индуцированного соответствия [изменение
конформации субстрата (S) и активного центра фермен- та] образуется
фермент-субстратный комплекс (ES). На этапе III происходит
дестабилизация связей в субстрате и образование нестабильного комплекса
фермент-продукт (ЕР). На этапе IV происходит распад комплекса (ЕР) с
высвобождением продуктов реакции из активного центра и освобождением
фермента.
2. Для понимания энергетики химической реакции необходимо учитывать изменение энергии субстратов и продуктов реакции, а также роль ферментов в этом процессе. Известно, для того чтобы прошла реакция, субстраты должны получить такое количество дополнительной энергии (называемой энергией активации Еа), которое необходимо для вступления молекул субстрата в реакцию (рис. 2.4). В случае ферментативной реакции происходит снижение энергии активации, что обеспечивает более эффективное протекание реакции.
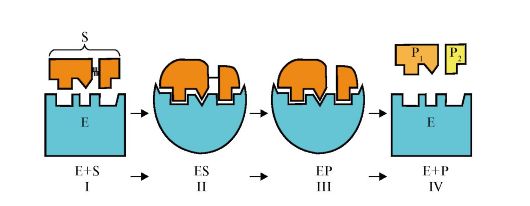 Рис. 2.3. Этапы ферментативного катализа:
Рис. 2.3. Этапы ферментативного катализа:
I - этап сближения и ориентации субстрата в активном центре фермента; II - образование фермент-субстратного комплекса (Ев); III - образование нестабильного комплекса фермент-продукт (ЕР); IV - высвобождение продуктов реакции из активного центра фермента
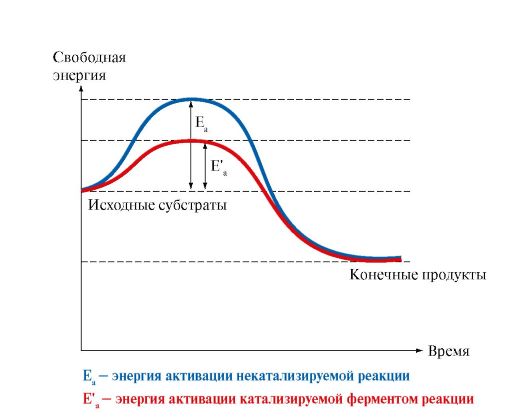 Рис. 2.4. Изменение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами.
Рис. 2.4. Изменение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами.
Фермент понижает энергию активации Еа, т.е. снижает высоту энергетического барьера; в результате возрастает доля реакционно-способных молекул и повышается скорость реакции
ТЕМА 2.4. КОФАКТОРЫ И КОФЕРМЕНТЫ
Большинство ферментов для проявления каталитической активности нуждается в присутствии некоторых веществ небелковой природы - кофакторов. Различают две группы кофакторов: ионы металлов и коферменты.
1. Ионы металла участвуют в функционировании фермента различными способами.
• Изменяют конформацию молекулы субстрата, что обеспечивает комплементарное взаимодействие с активным центром. Например, в качестве субстрата выступает комплекс Mg2+-АТФ.
• Обеспечивают нативную конформацию активного центра фермента. Ионы
Mg2+, Mn2+, Zn2+, Co2+, Mo2+ участвуют в стабилизации активного центра ферментов и способствуют присоединению кофермента.
• Стабилизируют конформацию белковой молекулы фермента. Например, для стабилизации четвертичной структуры фермента алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка.
• Непосредственно участвуют в ферментативном катализе. Ионы Zn2+, Fe2+, Мп2+, Cu2+ принимают участие в электрофильном катализе. Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон. Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях:
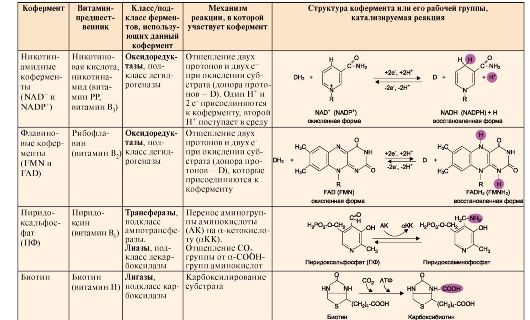
 2. Коферменты являются
органическими веществами, чаще всего производными витаминов, которые
непосредственно участвуют в ферментативном катализе, так как находятся в
активном центре ферментов. Фермент, содержащий кофермент и обладающий
ферментативной активностью, называют холоферментом. Белковую часть такого фермента называют апоферментом, который в отсутствие кофермента не обладает каталитической активностью.
2. Коферменты являются
органическими веществами, чаще всего производными витаминов, которые
непосредственно участвуют в ферментативном катализе, так как находятся в
активном центре ферментов. Фермент, содержащий кофермент и обладающий
ферментативной активностью, называют холоферментом. Белковую часть такого фермента называют апоферментом, который в отсутствие кофермента не обладает каталитической активностью.
 Кофермент
может связываться с белковой частью фермента только в момент реакции
или быть связанным с апоферментом прочными ковалентными связями. В
последнем случае он называется простетической группой. Примеры
наиболее распространенных коферментов - производных витаминов, а также
их участие в ферментативных процессах - приведены в табл. 2.1.
Кофермент
может связываться с белковой частью фермента только в момент реакции
или быть связанным с апоферментом прочными ковалентными связями. В
последнем случае он называется простетической группой. Примеры
наиболее распространенных коферментов - производных витаминов, а также
их участие в ферментативных процессах - приведены в табл. 2.1.
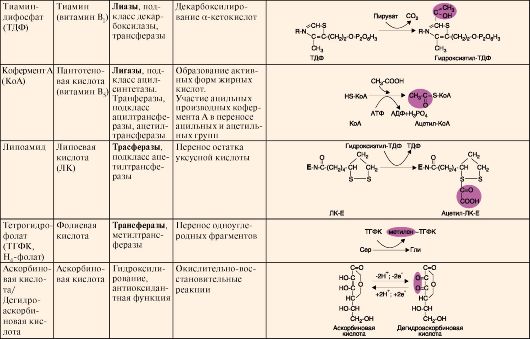
Таблица 2.1. Структура и функция основных коферментов
 Окончание табл. 2.1.
Окончание табл. 2.1.
 ТЕМА 2.5. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА
ТЕМА 2.5. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА
ФЕРМЕНТОВ
1. В названии большинства ферментов содержится суффикс «аза», присоединенный к названию субстрата реакции (например: уреаза, сахараза, липаза, нуклеаза) или к названию химического превращения определенного субстрата (например: лактатдегидрогеназа, аденилатциклаза, фосфоглюкомутаза, пируваткарбоксилаза). Однако в употреблении сохранился ряд тривиальных, исторически закрепленных названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения (например трипсин, пепсин, ренин, тромбин и др.).
2. Для того чтобы систематизировать имеющиеся в природе ферменты, Международный союз биохимии и молекулярной биологии (IUBMB) в 1961 г. разработал номенклатуру, согласно которой все ферменты делятся на шесть основных классов в зависимости от типа катализируемой химической реакции. Каждый класс состоит из многочисленных подклассов и подподклассов, в зависимости от преобразуемой химической группы субстрата, донора и акцептора преобразуемых группировок, наличия дополнительных молекул и т.д. Каждый из шести классов имеет свой порядковый номер, строго закрепленный за ним: 1-й класс - оксидоредуктазы; 2-й класс - трансферазы; 3-й класс - гидролазы; 4-й класс - лиазы; 5-й класс - изомеразы; 6-й класс - лигазы.
Эта классификация необходима для точного определения фермента: для каждого фермента имеется кодовое число. Например, фермент маладегидрогеназа имеет систематическое название L-малат: NAD-оксидоредуктаза и кодовое число - 1.1.1.38. Первая цифра означает номер класса ферментов (в данном случае цифра 1 свидетельствует, что фермент относится к классу оксидоредуктаз); вторая цифра указывает на тип катализируемой реакции (в данном примере окислению подвергается гидроксильная группа); третья цифра означает наличие кофермента (в данном случае - кофермент NAD+), последняя цифра - это порядковый номер фермента в данной подгруппе.
3. Характеристика основных классов ферментов с примерами катализируемых ими реакций.
1. Оксидоредуктазы катализируют различные окислительно-восстановительные реакции. Класс делится на подклассы:
а) дегидрогеназы катализируют реакции дегидрирования (отщепления водорода с переносом электронов от дегидрируемого субстрата на другой акцептор). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN. К этому подклассу относятся ферменты малатдегидрогеназа (рис. 2.5), изоцитратдегидрогеназа, сукцинатдегидрогеназа, α-кетобутиратдегидрогеназа и др.;
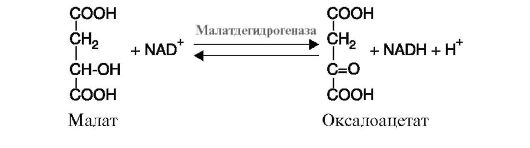 Рис. 2.5. Реакция дегидрирования малата
Рис. 2.5. Реакция дегидрирования малата
б) оксидазы - катализируют реакции окисления с участием молекулярного кислорода (рис. 2.6);
 Рис. 2.6. Реакция, катализируемая ферментом цитохромоксидазой
Рис. 2.6. Реакция, катализируемая ферментом цитохромоксидазой
в) оксигеназы (гидроксилазы) катализируют реакции окисления путем включения атома кислорода в гидроксильную группу молекулы субстрата. Реакция протекает с участием молекулярного кислорода, один атом которого присоединяется к субстрату, а второй участвует в образовании молекулы воды (рис. 2.7).
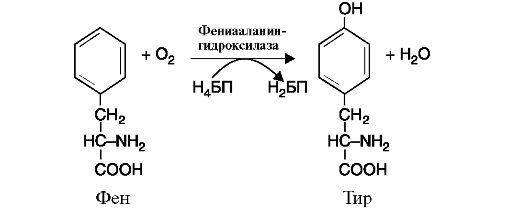 Рис. 2.7. Реакция гидроксилирования фенилаланина.
Рис. 2.7. Реакция гидроксилирования фенилаланина.
Коферменты реакции: тетрагидробиоптерин (Н4БП) и дигидробиоптерин (Н2БП)
2. Трансферазы - катализируют реакции переноса функциональных групп. В зависимости от переносимой группы подразделяются на подклассы: аминотрансферазы (рис. 2.8), ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, киназы (фосфотрансферазы) (рис. 2.9).
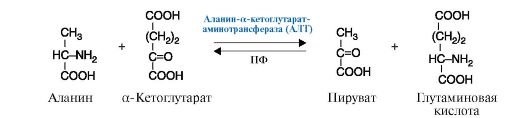 Рис.
2.8. Реакция, катализируемая ферментом АЛТ
(Аланин-а-кетоглутаратаминотрансфераза), относящимся к классу
трансфераз, подклассу аминотрансфераз.
Рис.
2.8. Реакция, катализируемая ферментом АЛТ
(Аланин-а-кетоглутаратаминотрансфераза), относящимся к классу
трансфераз, подклассу аминотрансфераз.
ПФ - кофермент пиридоксальфосфат
 Рис. 2.9. Реакция, катализируемая ферментом протеинкиназа, относящимся к классу трансфераз, подклассу фосфотрансфераз.
Рис. 2.9. Реакция, катализируемая ферментом протеинкиназа, относящимся к классу трансфераз, подклассу фосфотрансфераз.
АТФ является донором остатка фосфорной кислоты
3. Гидролазы катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Разделяются на подклассы в зависимости от субстрата. Названия образуются в зависимости от молекулы субстрата или конкретной гидролизуемой химической связи: протеазы, амилазы, гликозидазы, нуклеазы, эстеразы, фосфатазы и др. Пример схемы реакции гидролиза молекулы белка приведен на рис. 2.10.
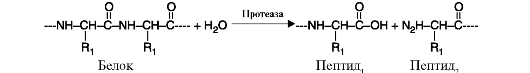 Рис. 2.10. Реакция гидролиза молекулы белка
Рис. 2.10. Реакция гидролиза молекулы белка
4. Лиазы - к лиазам относятся ферменты, отщепляющие от субстратов негидролитическим путем определенные группы, такие, как СО2, Н2О, NH2 SH2 и др., или присоединяющие (например, молекулу воды) по двойной связи. Реакция декарбоксилирования (отщепления молекулы CO2) приведена на рис. 2.11, а реакция присоединения молекулы воды (гидратазная реакция) - на рис. 2.12.
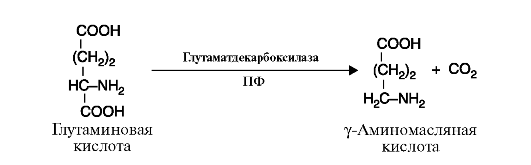 Рис. 2.11. Реакция декарбоксилирования (отщепления молекулы CO2)
Рис. 2.11. Реакция декарбоксилирования (отщепления молекулы CO2)
ПФ-кофермент пиридоксальфосфат
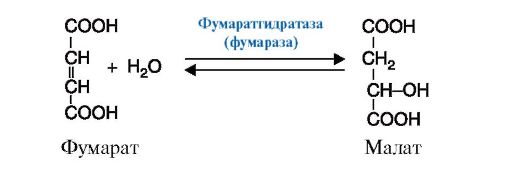 Рис. 2.12. Реакция присоединения молекулы воды к фумарату
Рис. 2.12. Реакция присоединения молекулы воды к фумарату
5. Изомеразы катализируют различные внутримолекулярные превращения (рис. 2.13).
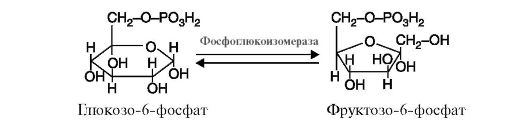 Рис. 2.13. Реакция, катализируемая ферментом фосфоглюкоизомераза
Рис. 2.13. Реакция, катализируемая ферментом фосфоглюкоизомераза
6. Лигазы (синтетазы) катализируют реакции усложнения молекулы за счет присоединения друг к другу двух молекул с образованием ковалентной связи; при этом используется энергия АТФ или других макроэргических соединений (рис. 2.14).
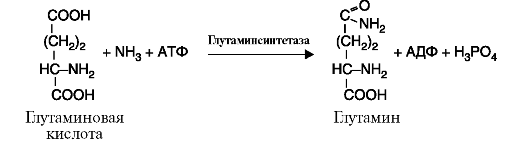 Рис. 2.14. Реакция, катализируемая ферментом глутаминсинтетазой
Рис. 2.14. Реакция, катализируемая ферментом глутаминсинтетазой
ТЕМА 2.6. ОСНОВЫ КИНЕТИКИ ФЕРМЕНТАТИВНОГО
КАТАЛИЗА
1. Кинетика ферментативных реакций - это раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ и факторов окружающей среды.
Для измерения каталитической активности ферментов используют такие показатели, как скорость реакции или активность фермента. Скорость ферментативной реакции определяется уменьшением количества молекул субстрата или увеличением количества молекул продукта за единицу времени. Скорость ферментативной реакции является мерой каталитической активности фермента и обозначается как активность фермента.
На практике пользуются условными величинами, характеризующими активность фермента: 1 международная единица активности (МЕ) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 минуту при оптимальных условиях (температура 37°С, оптимальное значение рН раствора) проведения ферментативной
реакции. Эти единицы активности используют в медицинской и фармацевтической практике для оценки активности ферментов:
 Для
оценки количества молекул фермента среди других белков данной ткани
определяют удельную активность (Уд.Ак.) фермента, численно равную
количеству превращенного субстрата (в мкмолях) за единицу времени одним
миллиграммом (мг) белка (фермента, выделенного из ткани):
Для
оценки количества молекул фермента среди других белков данной ткани
определяют удельную активность (Уд.Ак.) фермента, численно равную
количеству превращенного субстрата (в мкмолях) за единицу времени одним
миллиграммом (мг) белка (фермента, выделенного из ткани):
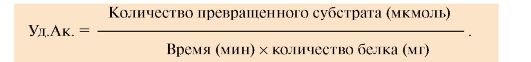 По удельной активности судят о степени очистки фермента: чем меньше посторонних белков, тем выше удельная активность.
По удельной активности судят о степени очистки фермента: чем меньше посторонних белков, тем выше удельная активность.
2. Кинетику ферментативных реакций исследуют в оптимальных условиях проведения энзиматической реакции. Оптимальные условия индивидуальны для каждого фермента и определяются в первую очередь температурой, при которой проводится реакция, и значением рН раствора.
• Повышение температуры до определенных пределов оказывает влияние на скорость ферментативной реакции подобно тому, как влияет температура на любую химическую реакцию: с увеличением температуры повышается скорость ферментативной реакции. Однако скорость ферментативной химической реакции имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, что связано с термической денатурацией белковой молекулы (рис. 2.15). Для большинства ферментов человека оптимальной температурой является 37-38 °С.
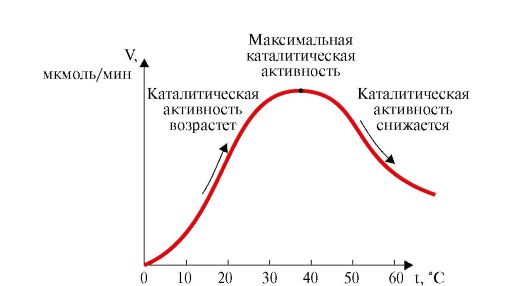 Рис. 2.15. Зависимость скорости ферментативной реакции (V) от температуры
Рис. 2.15. Зависимость скорости ферментативной реакции (V) от температуры
• Активность ферментов зависит от рН раствора, при котором протекает ферментативная реакция. Влияние рН на активность ферментов обусловлено изменением ионизации функциональных групп аминокислотных остатков данного белка и субстрата, обеспечивающих оптимальное образование фермент-субстратного комплекса. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность (рис. 2.16).
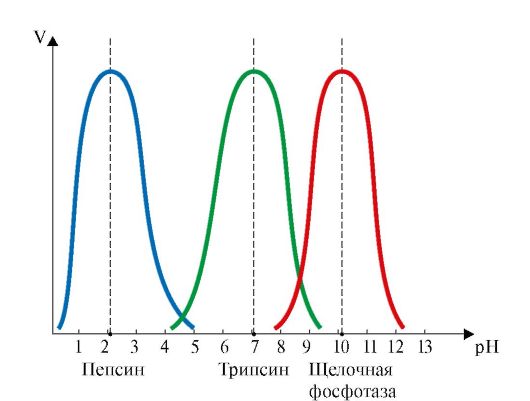 Рис. 2.16. Зависимость скорости ферментативной реакции (V) от рН среды
Рис. 2.16. Зависимость скорости ферментативной реакции (V) от рН среды
3. Кинетические характеристики ферментативной реакции зависят от концентрации реагирующих веществ. Если концентрацию фермента оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывается гиперболой (рис. 2.17). При увеличении количества субстрата начальная скорость реакции возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратных комплексов, наблюдается наибольшая скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению количества образующегося продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax
Величина Vmax дает характеристику каталитической активности фермента и определяет максимальную возможность образования продукта при данной концентрации фермента и в условиях избытка субстрата; Vmax - величина, постоянная для данной концентрации фермента.
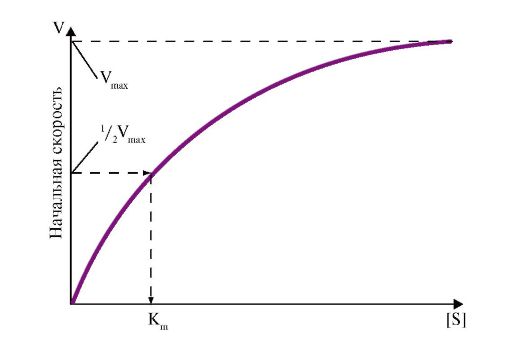 Рис. 2.17. Зависимость скорости реакции (V) от концентрации субстрата S:
Рис. 2.17. Зависимость скорости реакции (V) от концентрации субстрата S:
Vmax - максимальная скорость реакции при данной концентрации фермента в оптимальных условиях проведения реакции; Km - константа Михаэлиса
4. Основной кинетической характеристикой эффективности фермента является константа Михаэлиса - Km. Константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости. Km характеризует сродство данного фермента к данному субстрату и является величиной постоянной. Чем меньше Km, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции, и наоборот, чем больше Km, тем меньше сродство фермента к субстрату и меньше начальная скорость реакции.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Перенесите в тетрадь табл. 2.2. Для заполнения таблицы используйте учебник и дополнительную литературу. Сделайте вывод о необходимости разнообразного питания для здоровья человека.
2. Перенесите в тетрадь табл. 2.3 и заполните ее. Пользуясь учебником, выпишите по одной реакции с участием каждого кофермента.
3. Перенесите в тетрадь график активности ферментов (рис. 2.18). Дайте определение и укажите Vmax этих реакций. Укажите К в первом и вовтором
max m
случае. Какой биохимический смысл имеет константа К
Таблица 2.2. Характеристика основных водорастворимых витаминов являющихся предшественниками коферментов
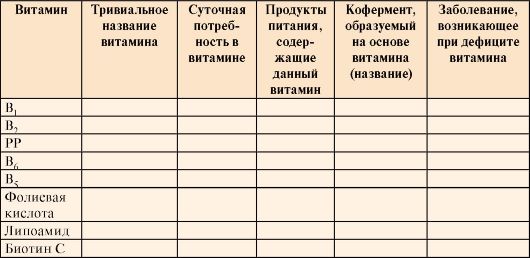 Таблица 2.3. Основные коферменты
Таблица 2.3. Основные коферменты

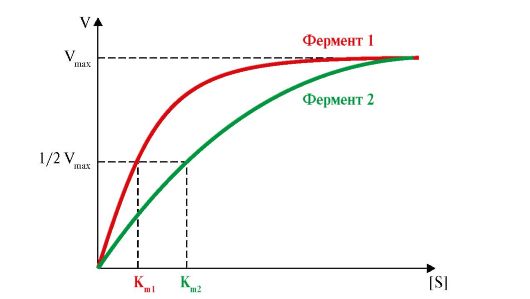 Рис. 2.18. Зависимость скорости ферментативных реакций от концентрации субстрата
Рис. 2.18. Зависимость скорости ферментативных реакций от концентрации субстрата
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильные ответы. Ферменты:
A. Являются белками
Б. Снижают скорость ферментативных реакций
B. Обладают специфичностью действия Г. Являются простыми белками Д. Способны к регуляции
2. Выберите правильные ответы. Константа Михаэлиса (Кm):
A. Является характеристикой субстратной специфичности фермента Б. Численно равна концентрации субстрата, при которой наблюдается половина Vmax
B. Характеризует сродство фермента к субстрату
Г. Характеризует насыщенность активного центра фермента субстратом Д. Является кинетической характеристикой фермента
3. Выберите правильные ответы. Кофермент ПФ функционирует с ферментами классов:
A. Оксидоредуктаз Б. Трансфераз
B. Гидролаз Г. Лиаз Д. Изомераз
4. Установите соответствие. Тип реакции, в которой участвует кофермент:
А. Карбоксилирование Б. Окисление-восстановление
В. Трансаминирование Г. Ацилирование Д. Ацетилирование
Кофермент:
1. Биотин
2. Пиридоксальфосфат
3. NAD+
5. Установите соответствие. Фермент катализирует:
A. Только необратимые реакции
Б. Однотипные реакции с небольшим числом (группой) структурно сходных субстратов
B. Превращение только одного из существующих стереоизомеров субстрата
Г. Реакции в присутствии коферментов Д. Превращение только одного субстрата Субстратная специфичность:
1. Абсолютная
2. Групповая
3. Стереоспецифичность
6. Выполните «цепное» задание:
а) окислительно-восстановительные реакции катализируют ферменты клас-
са:
A. Трансферазы
Б. Оксидоредуктазы
B. Лигазы
б) ферменты, относящиеся к подклассу этого класса, осуществляют реакции
отщепления атомов водорода от субстрата:
A. Оксидазы
Б. Гидроксилазы
B. Дегидрогеназы
в) коферментом для этих ферментов является:
A. Биотин
Б. Кофермент А
B. NAD+
г) кофермент построен на основе витамина:
A. Никотиновая кислота Б. Биотин
B. Витамин В2
д) недостаток этого витамина приводит к заболеванию:
A. Цинга
Б. Пеллагра
B. Макроцитарная анемия
7. Установите соответствие. Класс ферментов:
A. Оксидоредуктаза Б. Гидролаза
B. Лигаза Г. Лиаза
Д. Трансфераза
Фермент:
1. Сукцинатдегидрогеназа
2. Пируваткарбоксилаза.
3. ДНКаза.
8. Дополните предложения недостающими словами:
Фермент, содержащий кофермент и обладающий ферментативной активностью, называют ............. Белковую часть такого фермента называют ............., который в отсутствие.............не обладает каталитической
активностью. Кофермент, связанный с апоферментом прочными ковалентными связями, называется..............
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. А, В, Д
2. Б, В, Д
3. Б, Г
4. 1-А; 2-В; 3-Б
5. 1-Д; 2-Б; 3-В
6. а) Б; б) В; в) В; г) А; д) Б
7. 1-А; 2-В; 3-Б
8. Холоферментом, апоферментом, кофермента, простетической группой
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Энзимология
2. Ферментативный катализ
3. Фермент-субстратный комплекс
4. Кинетика ферментативного катализа
5. Субстрат
6. Активный центр фермента
7. Максимальная скорость реакции - Vmax
8. Константа Михаэлиса - Km
9. Единицы активности ферментов
10. Классы ферментов
11. Специфичность ферментов
12. Кофакторы ферментов
13. Удельная активность фермента
14. Апофермент
15. Холофермент
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. В настоящее время в биохимических лабораториях для определения активности ферментов в биологических жидкостях человека используют автоматические биохимические анализаторы. Помогите лаборанту разобраться в реактивах, которые необходимо использовать для определения активности лактатдегидрогеназы (ЛДГ), а также подсчитайте активность ЛДГ у двух пациентов. Для этого:
а) напишите реакцию, которую катализирует ЛДГ;
б) укажите субстрат, кофермент, витамин-предшественник, источник фермента;
в) перечислите условия проведения реакции (температура, время);
г) объясните, по какому параметру можно оценить скорость ферментативной реакции;
е) рассчитайте активность ЛДГ в крови у пациентов в единицах МЕ/л. Сделайте вывод: у кого из пациентов активность выше.
Таблица 2.4. Данные для определения активности ЛДГ
Параметры | Пациент 1 | Пациент 2 |
Исходное количество субстрата, взятое в реакцию, мкмоль | 40 | 40 |
Объем сыворотки крови пациента, мл | 5 | 5 |
Время инкубации, мин | 10 | 10 |
Количество субстрата, оставшееся после проведения реакции, мкмоль | 31 | 4 |
2. Человек относится к гомойотермным (температура поддерживается на постоянном уровне) живым организмам. В медицине в некоторых случаях для лечения используют экстремальные температуры. В частности, гипотермические условия используются при продолжительных операциях, особенно на головном мозге и сердце) гипертермические условия используются с целью коагуляции тканей. Объясните правомерность данных подходов с точки зрения энзимолога. Для ответа:
а) укажите, какая температура оптимальна для большинства ферментов человека;
б) нарисуйте график зависимости скорости ферментативных реакций от температуры;
в) объясните необходимость проведения длительных оперативных вмешательств в гипотермических условиях;
г) опишите, на чем основан метод термической коагуляции тканей;
д) укажите последствия воздействия критических температур на человека.
3. Больная 35 лет обратилась в клинику с жалобами на воспалительные процессы слизистой оболочки ротовой полости, мышечную усталость, конъюнктивит. Больная в течение длительного времени питалась однообразно, исключая из своего рациона такие продукты, как печень, рожь, молоко, дрожжи. Врач диагностировал гиповитаминоз В2. Объясните причины наблюдаемых симптомов. Для этого:
а) назовите коферменты, образующиеся из витамина В2;
б) укажите, в каких реакциях участвуют данные коферменты;
в) напишите рабочие части формулы окисленной и восстановленной форм коферментов;
г) приведите примеры реакций с участием этих коферментов (используйте материалы учебника).
4. Фермент кислая фосфатаза осуществляет гидролиз сложных эфиров фосфорной кислоты. Этот фермент образуется в клетках печени, селезенки, простаты; его содержат эритроциты, тромбоциты, макрофаги и остеокласты. Этот фермент содержится также в акросоме сперматозоидов и при оплодотворении расщепляет фосфолипиды плазмолеммы ооцита. Наибольшая ферментативная активность кислой фосфатазы проявляется при кислых значениях pH (4,7-6,0). Нарисуйте график зависимости скорости реакции от рН и объясните причину изменения активности кислой фосфатазы при изменении рН. Представьте схему реакции. Определите класс фермента и его специфичность.
5. При исследовании скорости реакции превращения дипептида под действием пептидазы тонкого кишечника были получены следующие результаты: максимальная активность фермента составляет 40 мкмоль/мин«мг, Кm 0,01. При какой концентрации субстрата скорость реакции равна 10 мкмоль/мин«мг? Используя данные задачи:
а) напишите схему реакции, определите класс фермента и связь, которую он разрушает в субстрате;
б) нарисуйте график зависимости скорости реакции от концентрации субстрата и ответьте на вопрос задачи;
в) дайте определение Кш, укажите зависимость между величиной Кш и сродством фермента к субстрату.
6. Студент определял удельную активность фермента лизоцима, выделенного из белка куриного яйца. Лизоцим гидролизует гликопротеины клеточной стенки бактерий. Студент инкубировал реакционную смесь, содержащую субстрат, фермент, буфер, обеспечивающий оптимальное значение рН 5,2 и обнаружил, что под действием 1 мг лизоцима за 15 минут образовалось всего 12 мкмоль продукта. Сделав расчет и выясняя причину
низкого значения удельной активности фермента, он вспомнил, что не включил термостат и поэтому инкубировал пробы при комнатной температуре, а t опт фермента 37°С. Повторив опыт при оптимальных условиях он установил, что за 15 минут по действием 1 мг лизоцима образовалось 45 мкмоль продукта. Рассчитайте удельную активность фермента в обоих случаях и объясните механизм влияния температуры на скорость ферментативной реакции.
7. Активность многих ферментов в клетке регулируется другими ферментами - протеинкиназой и фосфопротеинфосфатазой. Укажите особенности протекания этих реакций; напишите реакции, катализируемые данными ферментами, укажите, к какому классу ферментов они относятся. Отметьте субстратную специфичность.
Модульная единица 2 РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ. МЕДИЦИНСКИЕ АСПЕКТЫ ЭНЗИМОЛОГИИ
Цели изучения Уметь:
1. Интерпретировать результаты влияния ингибиторов - лекарств, ядов - на ферментативные реакции организма.
2. Объяснять значение регуляции активности ферментов для влияния на скорость метаболического пути.
3. Объяснять основы применения ферментов как лекарств.
4. Применять знания о свойствах ферментов и ферментном составе органов в норме и при различных нарушениях метаболизма.
5. Интерпретировать результаты определения активности ферментов в диагностике заболеваний.
Знать:
1. Классификацию ингибиторов ферментов по механизму их действия.
2. Примеры лекарственных препаратов - ингибиторов ферментов.
3. Основные механизмы регуляции активности ферментов в организме.
4. Принципы регуляции метаболических путей и роль ферментов в регуляции метаболизма.
5. Основы использования ферментов для диагностики и лечения заболеваний.
ТЕМА 2.7. ИНГИБИТОРЫ АКТИВНОСТИ ФЕРМЕНТОВ
1. Под термином «ингибирование активности ферментов» понимают специфическое снижение каталитической активности, вызванное определенными химическими веществами - ингибиторами.
Ингибиторы представляют большой интерес для выяснения механизмов ферментативного катализа, помогают установить роль отдельных ферментативных реакций в метаболических путях организма. В основе действия многих лекарственных препаратов и ядов лежит принцип ингибирования ферментативной активности.
2. Ингибиторы способны связываться с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определенных условиях легко отделяются от фермента:
Е + I ↔ EI .
Необратимое ингибирование наблюдается в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента:
Е + I → E-I .
3. По механизму действия обратимые ингибиторы подразделяются на конкурентные и неконкурентные.
Конкурентное ингибирование вызывает обратимое снижение скорости ферментативной реакции в результате связывания ингибитора с активным центром фермента, которое препятствует образованию ферментсубстратного комплекса. Такой тип ингибирования наблюдается, когда ингибитор является структурным аналогом субстрата; в результате возникает конкуренция молекул субстрата и ингибитора за связывание с активным центром фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется (рис. 2.19).
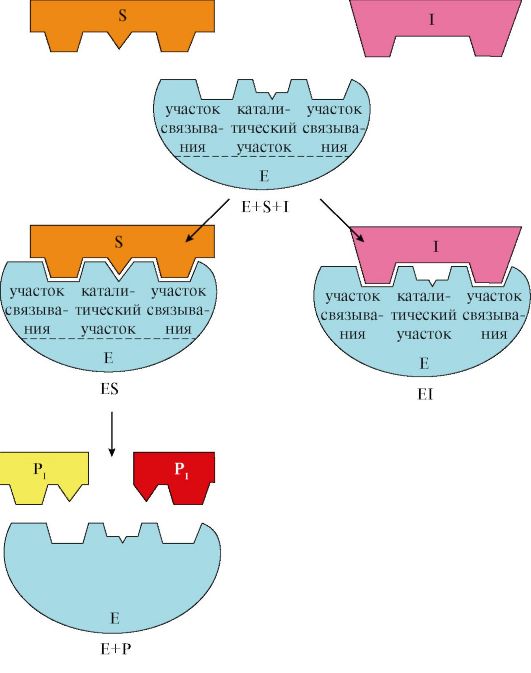 Рис. 2.19. Схема конкурентного ингибирования активности фермента
Рис. 2.19. Схема конкурентного ингибирования активности фермента
Для конкурентного типа ингибирования справедливы следующие уравнения:
E + S ↔ES →E + P ; E + I ↔ EI.
Отличительной особенностью конкурентного ингибирования является возможность его ослабления при повышении концентрации субстрата, так как обратимый ингибитор не изменяет структуры фермента. Поэтому при высоких концентрациях субстрата скорость реакции не отличается от таковой в отсутствие ингибитора, т.е. конкурентный ингибитор не изменяет Vmax, но повышает Km.
Классическим примером конкурентного ингибирования является ингибирование сукцинатдегидрогеназной реакции малоновой кислотой (рис. 2.20). Малонат является структурным аналогом сукцината (наличие двух карбоксильных групп) и может также взаимодействовать с активным центром сукцинатдегидрогеназы. Однако перенос двух атомов водорода на простетическую группу FAD от малоновой кислоты невозможен и, следовательно, скорость реакции снижается.
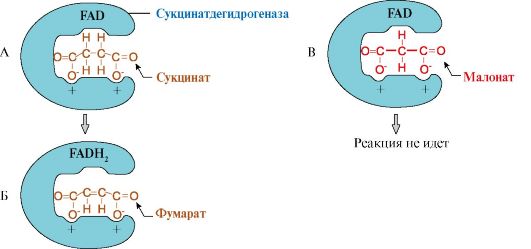 Рис. 2.20. Пример конкурентного ингибирования сукцинатдегидрогеназы малоновой кислотой:
Рис. 2.20. Пример конкурентного ингибирования сукцинатдегидрогеназы малоновой кислотой:
А - сукцинат связывается с активным центром фермента сукцинатдегидрогеназы за счет ионных связей; Б - в ходе ферментативной реакции происходит отщепление двух атомов водорода от сукцината с присоединением их к коферменту FAD. В результате образуется фумарат, который удаляется из активного центра сукцинатдегидрогеназы; В - малонат является структурным аналогом сукцината, он также связывается с активным центром сукцинатдегидрогеназы, но химическая реакция не идет
4. Многие лекарственные препараты оказывают свое терапевтическое действие по механизму конкурентного ингибирования. Например, реакция гидролиза ацетилхолина на холин и уксусную кислоту катализируется ферментом ацетилхолинэстеразой (АХЭ) (рис. 2.21) и может быть ингибирована в присутствии конкурентных ингибиторов этого фермента (например, прозерин, эндрофоний и др.) (рис. 2.22). При добавлении таких ингибиторов активность ацетилхолинэстеразы уменьшается, концентрация ацетилхолина (субстрата) увеличивается, что сопровождается усилением проведения нервного импульса. Конкурентные ингибиторы ацетилхолин-эстеразы используются при лечении мышечных дистрофий, а также для лечения двигательных нарушений после травм, параличей, полиомиелита.
 Рис. 2.21. Реакция гидролиза ацетилхолина под действием АХЭ
Рис. 2.21. Реакция гидролиза ацетилхолина под действием АХЭ
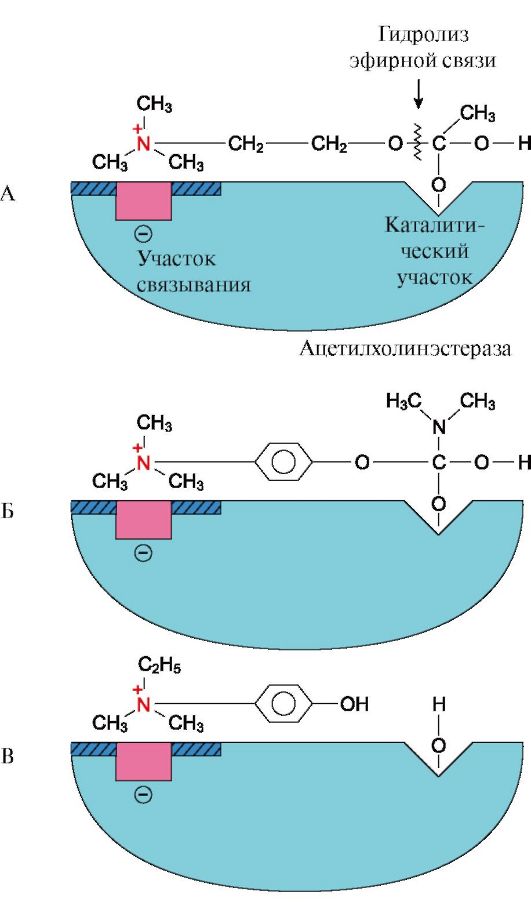 Рис. 2.22. Связывание в активном центре АХЭ конкурентных ингибиторов
Рис. 2.22. Связывание в активном центре АХЭ конкурентных ингибиторов
А - присоединение субстрата (ацетилхолина) в активном центре фермента.
Стрелкой указано место гидролиза ацетилхолина; Б - присоединение конкурентного ингибитора прозерина в активный центр фермента. Реакция не идет; В - присоединение конкурентного ингибитора эндрофония в активный центр фермента. Присоединение ингибиторов к активному центру АХЭ препятствует присоединению ацетилхолина
Другой пример лекарственных препаратов, механизм действия которых основан на конкурентном ингибировании фермента, - использование при заболеваниях поджелудочной железы (острые панкреатиты, некрозы) пептидных ингибиторов протеолитического фермента трипсина, таких как апротинин, трасилол, контрикал. Эти лекарственные препараты ингибируют трипсин, который высвобождается в окружающие ткани и кровь, и тем самым предотвращают нежелательные аутолитические явления при заболеваниях поджелудочной железы.
5. В некоторых случаях конкурентные ингибиторы, взаимодействуя с активным центром фермента, могут использоваться ими в качестве псевдосубстратов (антиметаболитов), что приводит к синтезу продукта с неправильной структурой. Полученные вещества не имеют «нужную» структуры и поэтому лишены функциональной активности. К таким лекарственным веществам относятся сульфаниламидные препараты.
6. Неконкурентным обратимым называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата; присоединение неконкурентного ингибитора к ферменту изменяет конформацию активного центра и уменьшает скорость ферментативной реакции, т.е. снижает ферментативную активность. Примером неконкурентного ингибитора может быть действие ионов тяжелых металлов, которые взаимодействуют с функциональными группами молекулы фермента, препятствуя катализу.
7. Необратимые ингибиторы снижают ферментативную активность в результате образования ковалентных связей с молекулой фермента. Чаще всего модификации подвергается активный центр фермента. В результате фермент не может выполнять каталитическую функцию.
Использование необратимых ингибиторов представляет больший интерес для выяснения механизма действия ферментов. Важную информацию о структуре активного центре фермента дают соединения, блокирующие определенные группы активного центра. Такие ингибиторы называют специфическими. К специфическим ингибиторам причисляют диизопропилфторфосфат (ДФФ). ДФФ образует ковалентную связь с ОН-группой серина, содержащемся в активном центре фермента и принимающем непосредственное участие в катализе, поэтому ДФФ относят к специфическим необратимым ингибиторам «сериновых» ферментов (рис. 2.23). ДФФ используют с целью изучения структуры активного центра ферментов в энзимологии.
В отличие от специфических ингибиторов неспецифические ингибиторы образуют ковалентные связи с определенными группами фермента, расположенными не только в активном центре, но и в любом участке молекулы фермента. Например, ацетат йода (рис. 2.24) взаимодействует с любыми SH-группами белка. Такое взаимодействие изменяет конформацию молекулы фермента, а соответственно, и конформацию активного центра и снижает каталитическую активность.
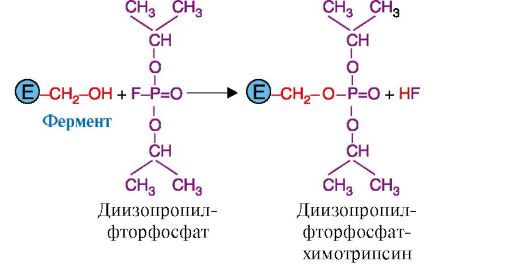 Рис. 2.23. Специфическое ингибирование активности химотрипсина с помощью ДФФ
Рис. 2.23. Специфическое ингибирование активности химотрипсина с помощью ДФФ
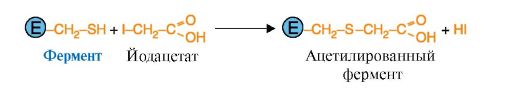 Рис. 2.24. Неспецифическое ингибирование активности фермента ацетатом йода.
Рис. 2.24. Неспецифическое ингибирование активности фермента ацетатом йода.
Неспецифическое ингибирование происходит вследствие ковалентной модификации SH-групп цистеина молекулами ацетата йода
8. Примером лекарственного препарата, действие которого связано с необратимым ингибированием ферментов, является широко используемый аспирин. Действие этого противовоспалительного нестероидного препарата основано на ингибировании фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты. В результате ацетильный остаток аспирина присоединяется к свободной концевой ОН-группе серина одной из субъединиц циклооксигеназы (рис. 2.25). Тем самым блокируется образование простагландинов (см. модуль 8), которые обладают широким спектром биологических функций и в том числе являются медиаторами воспаления. Поэтому аспирин относят к противовоспалительным средствам. Ингибированные молекулы фермента разрушаются, синтез простагландинов восстанавливается только после синтеза новых молекул фермента.
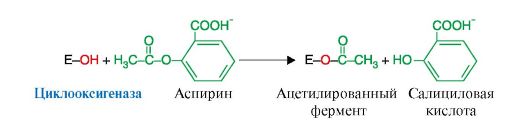 Рис. 2.25. Механизм инактивации циклооксигеназы с помощью необратимого ингибитора - аспирина
Рис. 2.25. Механизм инактивации циклооксигеназы с помощью необратимого ингибитора - аспирина
ТЕМА 2.8. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
1. Все химические реакции в клетке протекают при участии ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути (последовательного превращения одних веществ в другие), достаточно регулировать количество молекул фермента или их активность. Обычно в метаболических путях имеются ключевые ферменты, за счет которых происходит регуляция скорости всего пути. Эти ферменты (один или несколько в метаболическом пути) называются регуляторными ферментами. Регуляция скорости ферментативных реакций осуществляется на трех независимых уровнях: изменением количества молекул фермента, доступностью молекул субстрата и кофермента, изменением каталитической активности молекулы фермента (табл. 2.6).
Таблица 2.5. Способы регуляции скорости ферментативных реакций
Способ регуляции | Характеристика |
Изменение количества молекул фермента | Количество молекул фермента в клетке определяется соотношением двух процессов: синтеза и распада. Наиболее изучен механизм регуляции синтеза фермента на уровне транскрипции (синтеза мРНК), который регулируется определенными метаболитами, гормонами и рядом биологически активных молекул |
Доступность молекул субстрата и кофермента | Важный параметр, контролирующий протекание ферментативной реакции, - наличие субстрата и кофермента. Чем больше концентрация исходного субстрата, тем выше скорость реакции |
Изменение каталитической активности молекулы фермента | Основными способами регуляции активности ферментов являются: - аллостерическая регуляция; - регуляция с помощью белок-белковых взаимодействий; - регуляция путем фосфорилирования-дефосфорилирова- ния молекулы фермента; - регуляция частичным (ограниченным) протеолизом |
Рассмотрим способы регуляции скорости ферментативных реакций за счет изменения каталитической активности молекулы фермента.
2. Аллостерическая регуляция. Аллостерическими ферментами называют ферменты, активность которых может регулироваться с помощью веществэффекторов. Участвующие в аллостерической регуляции эффекторы - это клеточные метаболиты, которые часто являются участниками именно того пути, регуляцию которого они осуществляют.
Эффектор, который вызывает снижение (ингибирование) активности фермента, называется ингибитором. Эффектор, который вызывает повышение (активацию) активности ферментов, называют активатором.
Аллостерические ферменты имеют определенные особенности строения:
- обычно являются олигомерными белками, состоящими из нескольких протомеров;
- имеют аллостерический центр, пространственно удаленный от каталитического активного центра;
- эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах.
Аллостерические центры, так же как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие - к ингибиторам.
Протомер, на котором находится аллостерический центр, называется регуляторным протомером в отличие от каталитического протомера, содержащего активный центр, в котором проходит химическая реакция.
Аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или повышает каталитическую активность фермента. Если к аллостерическому центру присоединяется ингибитор, то в результате кооперативных конформационных изменений происходит изменение конформации активного центра, что вызывает снижение сродства фермента к субстрату и, соответственно, снижение скорости ферментативной реакции. И наоборот, если к аллостерическому центру присоединяется активатор, то сродство фермента к субстрату увеличивается, что вызывает повышение скорости реакции. Последовательность событий при действии аллостерических эффекторов представлена на рис. 2.26.
Регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента.
Аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
Аллостерические ферменты играют важную роль в различных метаболических путях, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состава клетки. Скорость метаболических процессов зависит от концентрации веществ, как использующихся, так и образующихся в данной цепи реакций. Исходные вещества могут быть активаторами аллостерических ферментов метаболического пути. В то же время при накапливании конечного продукта какого-либо метаболического пути он может действовать как аллостерический ингибитор фермента. Такой способ регуляции распространен в организме и носит название «отрицательная обратная связь»:
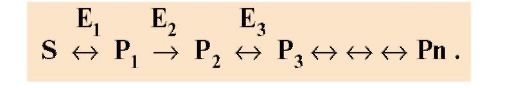
 Рис. 2.26. Схема строения и функционирования аллостерического фермента:
Рис. 2.26. Схема строения и функционирования аллостерического фермента:
А - действие отрицательного эффектора (ингибитора). Ингибитор (I) присоединяется к аллостерическому центру, что вызывает кооперативные конформационные изменения в молекуле фермента, в том числе и в активном центре фермента. Сродство фермента к субстрату снижается, в результате снижается и скорость ферментативной реакции; Б - действие положительного эффектора (активатора). Активатор (А) присоединяется к аллостерическому центру, что вызывает кооперативные конформационные изменения. Сродство фермента к субстрату повышается, и скорость ферментативной реакции увеличивается. Продемонстрировано обратимое действие как ингибитора, так и активатора на активность фермента
Рассмотрим аллостерическую регуляцию процесса катаболизма глюкозы, который заканчивается образованием молекулы АТФ (рис. 2.27). В том случае, если молекулы АТФ в клетке не расходуются, она является ингибитором аллостерических ферментов данного метаболического пути: фосфофруктокиназы и пируваткиназы. В то же время промежуточный метаболит катаболизма глюкозы - фруктозо-1,6-бисфосфат является аллостерическим активатором фермента пируваткиназы. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяет
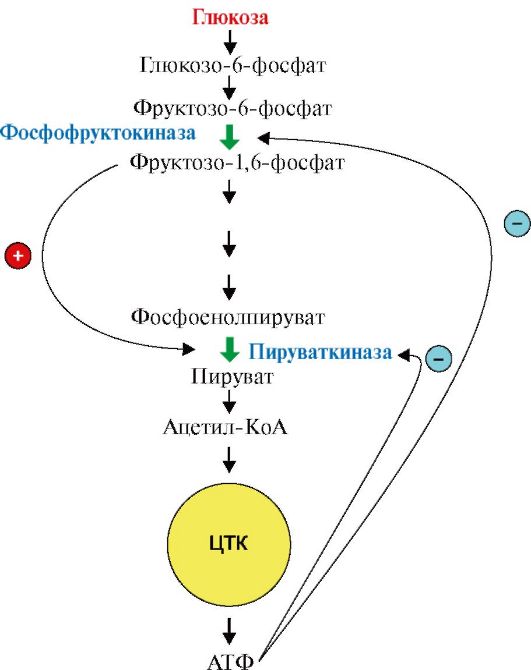 Рис. 2.27. Аллостерическая регуляция процесса катаболизма глюкозы.
Рис. 2.27. Аллостерическая регуляция процесса катаболизма глюкозы.
Молекула АТФ является аллостерическим ингибитором ферментов метаболического пути - фосфофруктокиназы и пируваткиназы. Молекула фруктозо-1,6-бисфосфата является аллостерическим активатором фермента пируваткиназы
осуществлять регуляцию скорости метаболического пути. Аллостерические ферменты катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-лимитирующие реакции (самые медленные) или реакции в месте разветвления метаболического пути.
3. Регуляция с помощью белок-белковых взаимодействий. Некоторые ферменты изменяют свою активность в результате белок-белковых взаимодействий. Можно выделить по крайней мере два механизма изменения активности фермента таким способом: активация ферментов в результате присоединения белков-активаторов (активация фермента аденилатциклазы с помощью α-субъединицы G-белка, см. модуль 4) и изменение каталитической активности в результате ассоциации и диссоциации протомеров.
В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно рассмотреть регуляцию фермента протеинкиназы А.
Протеинкиназа А (цАМФ-зависимая) состоит из четырех субъединиц двух типов: двух регуляторных (R) и двух каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3',5'-АМФ (цАМФ) (по два на каждую субъединицу). Присоединение четырех молекул цАМФ к двум регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса; при этом высвобождаются две активные каталитические субъединицы (рис. 2.28). Активная протеинкиназа А катализирует перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (т.е. вызывает фосфорилирование белков).
 Рис. 2.28. Регуляция активности протеинкиназы А (ПКА) с помощью белок-белковых взаимодействий.
Рис. 2.28. Регуляция активности протеинкиназы А (ПКА) с помощью белок-белковых взаимодействий.
Активация ПКА осуществляется с помощью четырех молекул цАМФ, которые присоединяются к двум регуляторным субъединицам, что приводит к изменению конформации регуляторных протомеров и диссоциации тетрамерного комплекса. При этом высвобождаются две активные каталитические субъединицы, способные вызывать фосфорилирование белков
Отщепление молекул цАМФ от регуляторных субъединиц приводит к ассоциации регуляторных и каталитических субъединиц протенкиназы А с образованием неактивного комплекса.
4. Регуляция каталитической активности ферментов путем фосфорилирова- ния-дефосфорилирования. В биологических системах часто встречается механизм регуляции активности ферментов с помощью их ковалентной модификации. Быстрым и широко распространенным способом химической модификации ферментов является их фосфорилирование-дефосфорилирование.
Фосфорилирова-нию подвергаются ОН-группы фермента, которое осуществляется ферментами протеинкиназами (фосфорилирование) и фосфопротеинфосфатазами (дефосфорилирование). Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными (рис. 2.29). Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро варьировать активность ключевых ферментов метаболических путей в зависимости от условий внешней среды.
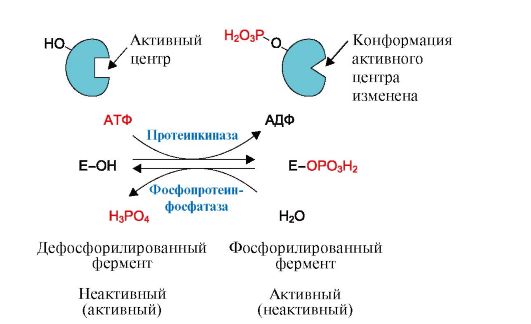 Рис. 2.29. Схема регуляции активности ферментов фосфорилированием-дефосфорилированием.
Рис. 2.29. Схема регуляции активности ферментов фосфорилированием-дефосфорилированием.
Фосфорилирование ферментов происходит с помощью фермента протеинкиназы. Донором остатка фосфорной кислоты является молекула АТФ. Фосфорилирование фермента изменяет его конформацию и конформацию активного центра, что изменяет сродство фермента к субстрату. При этом некоторые ферменты при фосфорилировании активируются, другие - ингибируются. Обратный процесс - дефосфорилирование - вызывают ферменты фосфопротеинфосфатазы, отщепляющие остаток фосфорной кислоты от фермента и возвращающие фермент в исходное состояние
5. Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом. Некоторые ферменты, которые функционируют вне клеток (в желудочно-кишечном тракте или плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определенных пептидных связей, который приводит к отщеплению части молекулы. В оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента (рис. 2.30). Частичный протеолиз представляет собой пример регуляции, когда активность фермента изменяется
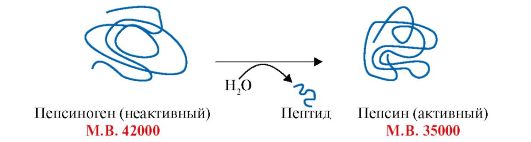 Рис. 2.30. Активация пепсина с помощью частичного протеолиза.
Рис. 2.30. Активация пепсина с помощью частичного протеолиза.
В результате гидролиза одной или нескольких пептидных связей пепсиногена (неактивной молекулы) отщепляется часть молекулы и формируется активный центр фермента пепсина
необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы. Частичный протеолиз лежит в основе активации пищеварительных протеолитических ферментов (пепсин, трипсин, химотрипсин, эластаза), пептидных гормонов (инсулин), белков свертывающей системы крови и ряда других белков.
ТЕМА 2.9. ПРИМЕНЕНИЕ ФЕРМЕНТОВ В МЕДИЦИНЕ
1. Широкое применение в медицинской практике ферменты находят в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. Ферменты также используются в качестве специфических реактивов
для определения ряда метаболитов. Например, фермент глюкозооксидазу применяют для количественного определения глюкозы в моче и крови; фермент уреазу используют для оценки содержания в биологических жидкостях мочевины; с помощью различных дегидрогеназ выявляют наличие соответствующих субстратов, например пирувата, лактата, этилового спирта и т.д.
2. Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека.
• Принципы энзимодиагностики основаны на следующих закономерностях:
- в норме в сыворотке крови содержатся ферменты, выполняющие специализированные функции, например, участвующие в свертывающей системе крови. Клеточные ферменты практически не проникают из неповрежденных клеток в кровь. В минимальных количествах некоторые ферменты клеток могут определяться в крови;
- при повреждении мембран клеток (воспаление, некроз) в крови или других биологических жидкостях (например, в моче) увеличивается количество внутриклеточных ферментов поврежденных клеток, активность которых можно зарегистрировать специальными биохимическими тестами;
- для энзимодиагностики используют ферменты, имеющие преимущественную или абсолютную локализацию в определенных органах (органоспецифичность);
- количество высвобождаемого фермента должно быть пропорционально степени повреждения ткани и достаточно для определения его активности;
- активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, отличается от нормальных значений и стабильна в течение достаточно длительного времени (сутки);
- появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например некрозе.
• Ферменты, катализирующие одну и ту же химическую реакцию, но с разной первичной структурой белка, называют изоферментами. Они отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента. Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты или их субъединицы. На различиях в физико-химических свойствах и основаны методы определения изоферментов. Изоферменты часто являются органоспецифичными, так как в каждой ткани содержится преимущественно один тип изоферментов. Следовательно, при повреждении органа в крови появляется соответствующая форма изофермента. Обнаружение определенных изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
Например, фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты) (рис. 2.31). Лактатдегидрогеназа - олигомерный белок с мол. массой 134 000, состоящий из четырех субъединиц двух типов - М (от англ. muscle - мышца) и Н (от англ. heart - сердце). Комбинация этих субъединиц лежит в основе формирования пяти изоформ лактатдегидрогеназы (рис. 2.32, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются другие варианты этого фермента. Изоформы ЛДГ различаются друг от друга электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ (рис. 2.32, Б). Для диагностики заболеваний сердца печени и мышц необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. 2.32, В представлены электрофореграммы
 Рис. 2.31. Реакция, катализируемая лактатдегидрогеназой (ЛДГ)
Рис. 2.31. Реакция, катализируемая лактатдегидрогеназой (ЛДГ)
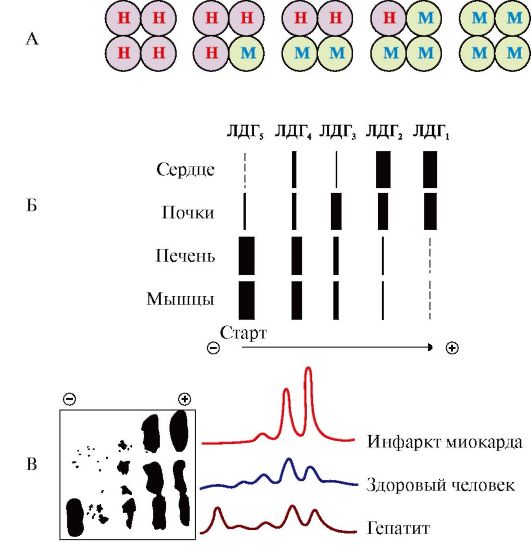 Рис. 2.32. Изоформы лактатдегидрогеназы:
Рис. 2.32. Изоформы лактатдегидрогеназы:
А - строение различных изоформ ЛДГ; Б - распределения на электрофореграмме и относительные количества изоформ ЛДГ в различных органах; В - содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы - слева и фотометрическое сканирование - справа)
плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифических изоформ ЛДГ широко используется в качестве диагностического теста.
Другим примером может служить креатинкиназа. Креатинкиназа (КК) которая катализирует реакцию образования креатинфосфата (рис. 2.33). Молекула КК представляет собой димер, состоящий из субъединиц двух типов М (от англ. muscle - мышца) и В (от англ. brain - мозг). Эти субъединицы образуют три изофермента: ВВ, МВ, ММ. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и МВ - в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2.34). Определение активности КК в плазме крови имеет значение при диагностике инфаркта миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
 Рис. 2.33. Реакция, катализируемая ферментом креатинкиназа (КК)
Рис. 2.33. Реакция, катализируемая ферментом креатинкиназа (КК)
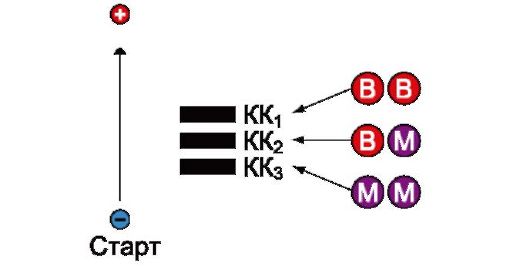 Рис. 2.34. Структура и электрофоретическая подвижность различных изоформ креатинкиназы
Рис. 2.34. Структура и электрофоретическая подвижность различных изоформ креатинкиназы
• Энзимодиагностика используется для установления диагноза при заболеваниях различных органов. Набор анализов зависит от возможностей конкретной биохимической лаборатории и постоянно совершенствуется. Наиболее распространены следующие энзимодиагностические тесты:
- при заболеваниях сердца (инфаркт миокарда) - лактадегидрогеназа, креатинкиназа, аспартатаминотрансфераза, аланинаминотрансфераза. Одним из первых белков при инфаркте миокарда в крови появляется белок - тропонин;
- при заболеваниях печени - аланинаминотрансфераза, аспартатаминотрансфераза, ацетилхолинэстераза, гамма-глутамилтранспептидаза. При заболеваниях поджелудочной железы - панкреатическая амилаза, липаза;
- при заболеваниях простаты - кислая фосфатаза.
3. Применение ферментов в качестве лекарственных препаратов активно развивают в следующих направлениях:
• заместительная терапия - использование ферментов в случае их недостаточности;
• элементы комплексной терапии - применение ферментов в сочетании с другой терапией.
Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков. Например, пепсин используют при гастритах со сниженной секреторной функцией. Дефицит панкреатических ферментов также в значительной степени может быть компенсирован приемом внутрь препаратов, содержащих основные ферменты поджелудочной железы (фестал, энзистал, мезимфорте и др.).
В качестве дополнительных терапевтических средств ферменты используются при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты рибонуклеаза и дезоксирибонуклеаза используются в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов, герпетических кератитах.
Ферментные препараты стали широко применяться при тромбозах и тромбоэмболиях для разрушения тромба. С этой целью используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы.
Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания спаек и рубцов после ожогов и операций.
Фермент аспарагиназа (разрушает аминокислоту Асн в крови) используется при онкологических заболеваниях крови, ограничивая поступление аминокислоты Асн в опухолевые клетки. Лейкозные клетки не способны к самостоятельному синтезу этой аминокислоты, поэтому снижение ее содержания в крови нарушает рост этих клеток.
ТЕМА 2.10. ЭНЗИМОПАТИИ
В основе многих заболеваний лежит нарушение функционирования ферментов в клетке - так называемые энзимопатии. Различают энзимопатии первичные (наследственные) и вторичные (приобретенные). Приобретенные энзимопатии, как и вообще протеинопатии, по-видимому, наблюдаются при всех заболеваниях.
При первичных энзимопатиях дефектные ферменты наследуются в основном, по рецессивно-аутосомному типу. При этом нарушается метаболический путь, содержащий дефектный фермент (рис. 2.35). Развитие заболевания в этом случае может происходить по одному из «сценариев»:
• нарушается образование конечных продуктов, что вызывает недостаток определенных веществ (например, при альбинизме не вырабатывается пигмент в клетках кожи);
• накапливаются субстраты-предшественники, оказывающие токсическое действие на организм (например, при алкаптонурии накапливается промежуточный метаболит - гомогентезиновая кислота, которая откладывается в суставах, вызывая в них воспалительные процессы).
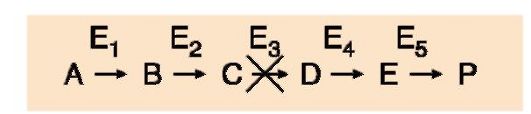 Рис. 2.35. Метаболический путь с энзимопатией фермента Е3
Рис. 2.35. Метаболический путь с энзимопатией фермента Е3
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
Решите задачи
1. В клетках жировой ткани переключение метаболических процессов с анаболических на катаболические происходит в зависимости от ритма питания. Важное значение в регуляции этого переключения играют гормоны, регулирующие активность ключевых ферментов путем фосфорилирования- дефосфорилирования. Дополните схему регуляции активности ключевого фермента распада жира (рис. 2.36), если известно, что этот фермент (ТАГ-липаза) активен в фосфорилированной форме, а неактивен в дефосфорилированной форме. Для ответа на вопрос:
а) перепишите схему в тетрадь и укажите названия ферментов, вызывающих фосфорилирование и дефосфорилирование белков (впишите их название в прямоугольники);
б) назовите класс этих ферментов;
в) запишите дополнительные субстраты и продукты, участвующие в этих реакциях (впишите их названия в квадраты);
г) сделайте вывод о роли гормонов в регуляции метаболизма клетки.
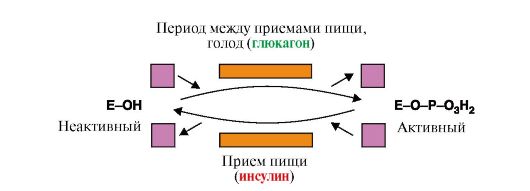 Рис. 2.36. Регуляции активности ТАГ-липазы
Рис. 2.36. Регуляции активности ТАГ-липазы
2. Аспарагиназа, катализирующая реакцию катаболизма аспарагина, нашла применение для лечения лейкозов. Предпосылкой антилейкемического действия аспарагиназы послужил факт выявления в лейкозных клетках дефектного фермента синтеза аспарагина - аспарагинсинтетазы. Обоснуйте лечебное действие аспарагиназы. Для ответа:
а) напишите реакции, катализируемые ферментами аспарагинсинтетазой (раздел 7) и аспарагиназой;
б) укажите классы, к которым относятся эти ферменты;
в) сделайте вывод о концентрации Асн в опухолевых клетках при использовании аспарагиназы;
г) объясните, почему применение аспарагиназы снижает скорость роста опухолевой ткани.
3. Перенесите в тетрадь и заполните табл. 2.7 по применению ферментов в медицине с использованием материала данного пособия, учебника.
Таблица 2.6. Применение ферментов в медицине
Применение | Название фермента | Примеры использования |
Для диагностики | ||
Для терапии | ||
В качестве аналитических реактивов |
4. Перенесите в тетрадь и заполните табл. 2.8 по лекарственным препаратам - ингибиторам ферментов, используя текущий раздел, учебник, дополнительную литературу.
Таблица 2.7. Лекарственные препараты - ингибиторы ферментов
Лекарственный препарат | Ферментмишень | Механизм действия | Заболевание |
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильный ответ.
Конкурентные ингибиторы:
A. Образуют ковалентные связи с активным центром фермента Б. Взаимодействуют с аллостерическим центром
B. Взаимодействуют с активным центром фермента, образуя слабые связи
Г. Уменьшают Кш Д. Уменьшают Vmax
2. Выберите правильный ответ. Необратимые ингибиторы:
A. Являются структурными аналогами субстрата Б. Образуют с ферментом ковалентные связи
B. Образуют с ферментом слабые связи
Г. Взаимодействуют с регуляторным центром
Д. Снижают свое действие при увеличении концентрации субстрата
3. Выберите правильные ответы. Аллостерические ферменты, как правило:
А. Являются белками с третичной структурой
Б. Состоят из нескольких протомеров В. Ингибируются необратимо
Г. Имеют активные и аллостерические центры, расположенные на разных протомерах
Д. Регулируются метаболитами данного процесса
4. Выберите правильные ответы.
При регуляции ферментов с помощью частичного протеолиза происходит:
A. Укорочение пептидной цепи белка
Б. Изменение вторичной и третичной структуры фермента
B. Необратимая активация
Г. Необратимое ингибирование
Д. Формирование активного центра
5. Выберите правильный ответ.
Регуляция активности ферментов с помощью белок-белковых взаимодействий сопровождается:
A. Необратимым ингибированием
Б. Присоединением или отщеплением регуляторных белковых субъединиц
B. Присоединением эффекторной молекулы к аллостерическому центру Г. Фосфорилированием фермента
Д. Дефосфорилированием фермента
6. Выберите правильные ответы. Энзимодиагностика основана на:
A. Выходе ферментов в кровь при повреждении тканей Б. Органоспецифичности
B. Высокой стабильности ферментов
Г. Преобладании определенных изоферментов в разных тканях Д. Низкой активности или полном отсутствии активности диагностически значимых ферментов в крови в норме
7. Установите соответствие.
Используется для диагностики заболеваний:
A. Печени
Б. Предстательной железы
B. Поджелудочной железы Г. Почек
Д. Сердца Фермент:
1. Креатинкиназа
2. Амилаза
3. Кислая фосфатаза
8. Выполните «цепное» задание:
а) одним из ферментов, определяемым при энзимодиагностике инфаркта миокарда, является:
A. Кислая фосфатаза Б. Лактатдегидрогеназа
B. Амилаза
б) этот фермент относится к классу ферментов:
A. Гидролаза Б. Лигаза
B. Оксидоредуктаза
в) одним из коферментов этого класса ферментов является:
A. Пиридоксальфосфат Б. Биотин
B. NAD+
г) витамином - предшественником этого кофермента является:
A. Никотиновая кислота Б. Пиридоксин
B. Биотин
9. Выполните «цепное» задание:
а) после отравления органическими фторфосфатами у человека наблюдается:
A. Расширение зрачка
Б. Повышенное сокращение гладких мышц
B. Расслабление гладких мышц
б) причина этого эффекта связана с:
A. Нарушением функционирования Na+, Е+-АТФазы Б. Увеличением количества ацетилхолина
B. Уменьшением количества ацетилхолина
в) это связано с тем, что фторфосфаты:
A. Являются конкурентным ингибитором ацетилхолинэстеразы (АХЭ)
Б. Образуют ковалентные связи с АХЭ
B. Нарушают синтез ацетилхолина
г) такой способ ингибирования называется:
A. Необратимым Б. Обратимым
B. Конкурентным
д) аналогичный способ ингибирования наблюдается при использовании:
A. Трасилола Б. Аспирина
B. Прозерина
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. В
2. Б
3. Б, Г, Д
4. А, Б, В, Д
5. Б
6. А, Б, Г, Д
7. 1-Д, 2-В, 3-Б
8. а) Б, б) В, в) В, г) А
9. а) Б, б) Б, в) Б, г) А, д) Б
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Метаболический путь
2. Ингибирование ферментов
3. Активация ферментов
4. Обратимое ингибирование
5. Необратимое ингибирование
6. Конкурентное ингибирование
7. Аллостерическая регуляция
8. Аллостерические эффекторы
9. Ключевые ферменты
10. Регуляция с помощью форсфорилирования - дефосфорилирования
11. Регуляция с помощью белок - белковых взаимодействий
12. Частичный протеолиз
13. Изоферменты
14. Энзимопатия
15. Энзимодиагностика
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. В клетках человека метаболический путь синтеза пуриновых нуклеотидов, необходимых для синтеза нуклеиновых кислот, начинается с молекулы рибозо-5-фосфата. В процессе синтеза на определенном этапе этот процесс разветвляется и заканчивается образованием двух пуриновых нуклеотидов - АМФ и ГМФ (рис. 2.37). Для образования эквимолярных соотношений этих нуклеотидов в клетке действует многоступенчатая регуляция нескольких ключевых ферментов по механизму отрицательной обратной связи. Так, при избытке образования АМФ замедляется образование аденилосукцината, а при избытке ГМФ - ксантозинмонофосфата. В то же время если оба эти нуклеотида не расходуются, замедляется образование фосфорибозилдифосфата. Предположите, какие ферменты метаболического пути синтеза пуриновых нуклеотидов являются регуляторными. Для ответа:
а) дайте определения: «метаболический путь» и «ключевые ферменты метаболического пути»;
б) предположите, какие из ферментов, представленных на рис. 2.37, являются регуляторными;
в) укажите механизм регуляции этих ферментов, их локализацию в метаболическом пути и особенности строения;
г) назовите, какие соединения и для каких ферментов являются эффекторами;
д) обоснуйте понятие регуляции «по механизму отрицательной обратной связи».
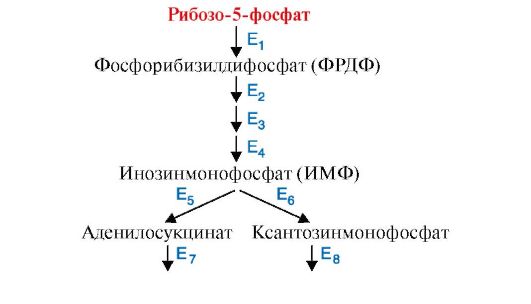
Рис. 2.37. Схема образования в клетке пуриновых нуклеотидов
2. В 1935 г. немецкий врач Г. Домагк обнаружил противомикробное действие протонзила (красный стрептоцид), синтезированного в качестве красителя. Вскоре было установлено, что действующим началом красного стрептоцида является образующийся при его метаболизме сульфаниламид (стрептоцид), который явился родоначальником большой группы сульфаниламидных препаратов (рис. 2.38).
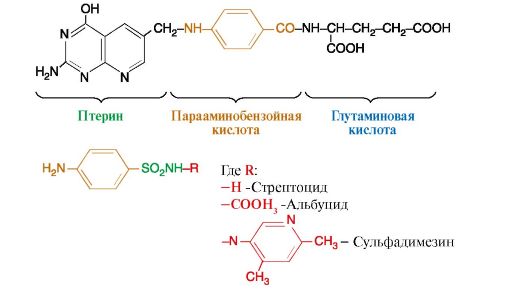 Рис. 2.38. Структура фолиевой кислоты и общая формула сульфаниламидов
Рис. 2.38. Структура фолиевой кислоты и общая формула сульфаниламидов
Бактериостатическое действие сульфаниламидов заключается в том, что они замещают парааминобензойную кислоту (ПАБК) в активном центре фермента дигидроптеоратсинтазы в процессе синтеза бактериями фолиевой кислоты, которая необходима для образования нуклеиновых кислот; что в результате нарушается рост и развитие микроорганизмов. В организме человека фолиевая кислота не синтезируется, а поступает с пищей в качестве витамина.
Объясните механизм антибактериального действия сульфаниламидов, для этого ответьте на вопросы:
а) как называется такой тип ингибирования (сравните структуры сульфаниламидов и ПАБК)? Как такие ингибиторы влияют на Кт и Vmax
реакции?
в) почему при лечении обычно сразу назначают ударную дозу сульфаниламидов?
г) будут ли сульфаниламиды влиять на образование нуклеиновых кислот в клетках человека? Ответ поясните.
3. К психиатру обратились 2 пациента страдающих депрессивными расстройствами. Известно, что причиной возникновения депрессий у человека в ряде случаев является нехватка нейромедиаторов в синаптической щели. Также в мозге находятся ферменты группы моноаминооксидаз (МАО), которые разрушают медиаторы, выброшенные в синаптическую щель. Первому пациенту был назначен пирлиндол, который является структурным аналогом медиатора серотонина. Второму - ниаламид, который способен ковалентно связываться с активным центром МАО. Объясните механизмы действия этих препаратов и укажите, у какого пациента, скорее всего, более быстро проявится эффект от применения лекарства. Для ответа:
а) охарактеризуйте влияние этих препаратов на МАО, укажите разницу в
механизмах взаимодействия с этим ферментом;
б) приведите схему ингибирования МАО пирлиндолом и ниаламидом;
в) основываясь на механизме ингибирования этих препаратов, объясните
какой из них будет иметь более длительное влияние на организм и почему.
4. В последнее время участились случаи использования метанола для изготовления технических жидкостей, используемых в средствах по уходу за автотранспортом, в том числе в составе стеклоомывающих средств. Главная опасность метилового спирта, или метанола, - использование его в качестве суррогатного алкоголя, что приводит к летальному исходу. Так, по данным Научно-практического токсикологического центра Росздрава, доля больных, отравившихся метанолом, составляет от 0,1 до 0,5% всех госпитализированных. Объясните причину токсического действия метанола и способ оказания медицинской помощи, если известно, что метанол ингибирует активность фермента ацетальдегиддегидрогеназы, участвующего в катаболизме этанола, что вызывает накопление ацетальдегида. Для ответа на вопрос:
а) напишите реакции окисления этанола, учитывая, что окисление проис-
ходит в два этапа с образованием промежуточного соединения - ацетальдегида; конечным продуктом является уксусная кислота; коферментом обеих реакций является NAD+;
б) напишите структурную формулу метанола и укажите механизм ингибирования активности фермента;
в) предложите способ лечения в случаях отравления метанолом.
5. В старину итальянские дамы закапывали сок красавки в глаза, при этом зрачки расширялись и глаза приобретали особый блеск. Сейчас известно, что подобный эффект вызван алкалоидом атропином, содержащимся во многих растениях: красавке, белене, дурмане. Объясните механизм действия атропина. Для этого:
а) назовите рецепторы, ингибитором которых является атропин (см. модуль 1), укажите типы рецепторов и последовательность событий при попадании в глаза атропина;
б) ответьте, где в медицине используют атропин и лекарственные препараты с аналогичным действием;
в) укажите какие меры можно предпринять в случае передозировки атропина? Обоснуйте возможные пути повышения концентрации ацетилхолина и объясните необходимость этого действия.
6. Применение больших доз кофеина вызывает у людей симптомы, сходные с действием адреналина: увеличение частоты сердечных сокращений; расширение бронхов, возбуждение, изменение метаболизма в тканях, депонирующих энергоносители. Объясните механизм действия кофеина, имея в виду, что он является конкурентным ингибитором фермента фосфодиэстеразы (ФДЭ), ответственного за распад цАМФ:
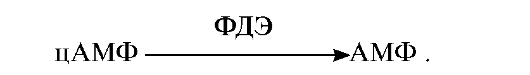 Для ответа на этот вопрос:
Для ответа на этот вопрос:
а) ответьте, концентрация какого вещества повысится в клетке при действии кофеина;
б) объясните механизм регулирующего действия цАМФ в клетке; изобразите схематически структуру фермента, который активируется вследствие увеличения концентрации цАМФ в клетке;
в) назовите, какие процессы в клетке будут активироваться в результате применения кофеина? Напишите схему этих реакций;
г) запомните, что аналогичный механизм действия наблюдается у препаратов, улучшающих реологические свойства крови (например, трентал), а также у препаратов, которые используются для расслабления бронхов и снятия бронхоспазма (например, теофиллина).
7. Больной Л. поступил в больницу с подозрением на инфаркт миокарда. По словам больного, за 5 часов до приезда врача врача у него возникла одышка. Врач предположил инфаркт миокарда и госпитализировал больного. В больнице для подтверждения диагноза в течение нескольких дней делали биохимический анализ крови. Результаты анализов представлены в табл. 2.9. Подтверждают ли полученные данные диагноз врача? Для ответа:
а) перенесите табл. 2.9 в тетрадь и подсчитайте кратность увеличения активности ферментов у больного, учитывая, что нормальные значения активностей ферментов следующие МЕ/л, для КК <190, для АСТ <47, для ЛДГ <250;
б) постройте графики динамики изменения активности исследуемых ферментов (по оси абсцисс - время, по оси ординат - кратность увеличения);
в) сделайте вывод о значимости данных результатов в постановке диагноза.
Таблица 2.8. Результаты анализа ферментов креатинкиназы (КК), аспартатаминотрансферазы (АСТ) и лактатдегидрогеназы (ЛДГ) у больного с инфарктом миокарда
Фермент | Активность, МЕ/л | Кратность | Активность, МЕ/л | Кратность |
12 часов после окклюзии сосуда | 72 часа после окклюзии сосуда | |||
КК | 380 | 285 | ||
АСТ | 75 | 190 | ||
ЛДГ | 500 | 1750 | ||
24 часа после окклюзии сосуда | 96 часов после окклюзии сосуда | |||
КК | 570 | 200 | ||
АСТ | 200 | 140 | ||
ЛДГ | 1000 | 1500 | ||
48 часов после окклюзии сосуда | 120 часов после окклюзии сосуда | |||
КК | 380 | 190 | ||
АСТ | 330 | 70 | ||
ЛДГ | 2000 | 1250 | ||