Биологическая химия с упражнениями и задачами : учебник / под ред. чл.-корр. РАМН С.Е. Северина. - 2011. - 624 с.: ил.
|
|
|
|
МОДУЛЬ 9 ОБМЕН АМИНОКИСЛОТ
Структура модуля | Темы |
Модульная единица 1 | 9.1. Роль белков в питании. Азотистый баланс 9.2. Переваривание белков в желудке и кишечнике, всасывание аминокислот 9.3. Трансаминирование и дезаминирование аминокислот |
Модульная единица 2 | 9.4. Обмен аммиака: источники, превращение в тканях 9.5. Орнитиновый цикл и его биологическая роль 9.6. Гипераммониемия и ее причины 9.7. Пути использования безазотистых остатков аминокислот 9.8. Биосинтез заменимых аминокислот |
Модульная единица 3 | 9.9. Обмен серина и глицина. Роль фолиевой кислоты 9.10. Обмен метионина. Реакции трансметилирования 9.11. Обмен фенилаланина, тирозина и гистидина в разных тканях 9.12. Заболевания, связанные с нарушением обмена фенилаланина и тирозина 9.13. Биогенные амины: синтез, инактивация, биологическая роль |
Модульная единица 1 РОЛЬ БЕЛКОВ В ПИТАНИИ. ПЕРЕВАРИВАНИЕ БЕЛКОВ И ВСАСЫВАНИЕ АМИНОКИСЛОТ. ПРОЦЕССЫ ТРАНСАМИНИРОВАНИЯ И ДЕЗАМИНИРОВАНИЯ
АМИНОКИСЛОТ
Цели изучения Уметь:
1. Использовать знания о составе белков пищи для понимания основ рационального питания.
2. Применять знания о переваривании белков в норме для объяснения патогенеза заболеваний, возникающих при нарушениях этого процесса.
3. Интерпретировать результаты анализа желудочного сока при заболеваниях желудочно-кишечного тракта.
4. Использовать данные определения активности аланин- и аспартатаминотрансфераз в сыворотке крови для диагностики заболеваний сердца и печени.
Знать:
1. Основы полноценного белкового питания, обеспечивающие поддержание азотистого баланса.
2. Этапы переваривания белков в желудочно-кишечном тракте, особенности синтеза и активации протеолитических пищеварительных ферментов.
3. Механизмы защиты секреторных клеток желудка и поджелудочной железы от самопереваривания.
4. Классификацию аминокислот по возможности их синтеза в организме.
5. Процесс трансаминирования и способы дезаминирования аминокислот, биологическое значение этих процессов.
ТЕМА 9.1. РОЛЬ БЕЛКОВ В ПИТАНИИ. АЗОТИСТЫЙ БАЛАНС
В организме человека содержится примерно 15 кг белков. Количество свободных аминокислот составляет около 35 г. Ежесуточно в организме распадается до аминокислот почти 400 г белков и столько же синтезируется.
1. Основным источником аминокислот для человека являются пищевые белки. Суточная норма потребления белков составляет в среднем около 100 г.
20 α-аминокислот, которые встречаются в белках организма, можно разделить на четыре группы:
• заменимые аминокислоты - Ала, Асп, Асн, Глу, Глн, Про, Гли, Сер - синтезируются в необходимых количествах в организме;
• незаменимые аминокислоты - Вал, Лей, Иле, Мет, Фен, Три, Лиз, Тре - не могут синтезироваться в организме и должны поступать с пищей;
• частично заменимые аминокислоты - Гис, Арг - синтезируются очень медленно, в количествах, не покрывающих потребности организма, особенно в детском возрасте;
• условно заменимые аминокислоты - Цис, Тир - синтезируются из незаменимых аминокислот Мет и Фен соответственно.
2. Полноценность белкового питания зависит от аминокислотного состава белков и определяется наличием незаменимых аминокислот. Отсутствие в пищевых белках незаменимых аминокислот (даже одной) нарушает их синтез в организме. Обновление белков в различных тканях происходит с разной скоростью. Так, белок соединительной ткани коллаген обновляется полностью за 300 дней, а белки системы свертывания крови - от нескольких минут до нескольких дней.
3. Большая часть свободных аминокислот используется для синтеза собственных белков организма. Кроме того, из аминокислот синтезируется большое количество биологически активных молекул:
• биогенные амины (медиаторы); некоторые аминокислоты сами являются нейромедиаторами - например, глицин и глутамат;
• гормоны белковой природы;
• гем, креатин, карнитин и другие азотсодержащие соединения.
Аминокислоты подвергаются реакции дезаминирования; образовавшиеся безазотистые остатки используются для синтеза глюкозы, кетоновых тел или окисляются до СО2 и Н2О.
Азот аминокислот выводится из организма почками в виде мочевины или аммонийных солей. Аминокислоты и белки содержат до 95% всего азота организма.
4. Азотистый баланс - разница между количеством азота, поступающего с пищей, и количеством азота, выделяемого почками в виде мочевины и азотистых солей. Он является показателем состояния белкового и аминокислотного обмена.
Азотистый баланс может быть:
• положительным - у детей, беременных женщин, при увеличении мышечной массы у спортсменов и больных, выздоравливающих после тяжелой болезни, что свидетельствует о преобладании синтеза белков и роста тканей над их распадом;
• отрицательным - при тяжелых заболеваниях, голодании, старении, что свидетельствует об усилении процессов распада белков;
• равным нулю (азотистое равновесие) - у здоровых взрослых людей при нормальном питании.
ТЕМА 9.2. ПЕРЕВАРИВАНИЕ БЕЛКОВ В ЖЕЛУДКЕ И КИШЕЧНИКЕ, ВСАСЫВАНИЕ АМИНОКИСЛОТ
1. При переваривании происходит гидролиз пищевых белков до свободных аминокислот. Процесс переваривания начинается в желудке и продолжается в тонком кишечнике под действием ферментов пептидгидролаз (пептидаз). Основные пептидазы синтезируются в клетках желудка, поджелудочной железы и кишечника (рис. 9.1). В желудке белки пищи денатурируются и гидролизуются с образованием олигопептидов. В кишечнике панкреатические пептидазы продолжают гидролиз олигопептидов до ди- и трипептидов и свободных аминокислот. Короткие пептиды расщепляются до свободных аминокислот в пристеночном слое или в клетках кишечного эпителия. Затем происходит их всасывание.
Все пептидазы, в зависимости от места расположения в пептиде гидролизуемой связи, делятся на эндопептидазы и экзопептидазы:
• эндопептидазы - расщепляют пептидные связи, удаленные от концов пептидной цепи (пепсин, трипсин, химотрипсин, эластаза);
• экзопептидазы - гидролизуют пептидные связи, образованные N- и С-концевыми аминокислотами (аминопептидаза, карбоксипептидазы А и В), а также расщепляют ди- и трипептиды.
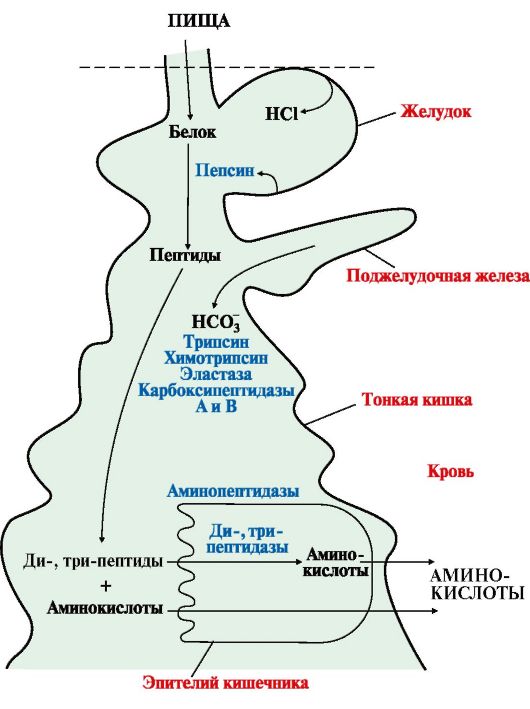 Рис. 9.1. Переваривание белков в желудочно-кишечном тракте
Рис. 9.1. Переваривание белков в желудочно-кишечном тракте
Ферменты, участвующие в переваривании белков, обладают относительной субстратной специфичностью и гидролизуют пептидные связи; при этом каждая пептидаза преимущественно расщепляет связи, образованные определенными аминокислотами (табл. 9.1).
2. Желудочные и панкреатические пептидазы вырабатываются в неактивной форме (проферменты), секретируются к месту действия, где активируются путем частичного протеолиза (отщепление пептида различной длины, чаще с N-конца молекулы профермента). Место синтеза проферментов (клетки слизистой оболочки желудка, поджелудочная железа) и место их активации (полость желудка, тонкого кишечника) пространственно разделены. Такой механизм образования активных ферментов необходим для защиты секреторных клеток желудка и поджелудочной железы от самопереваривания.
Таблица 9.1. Характеристика протеолитических ферментов желудочно-кишечного тракта
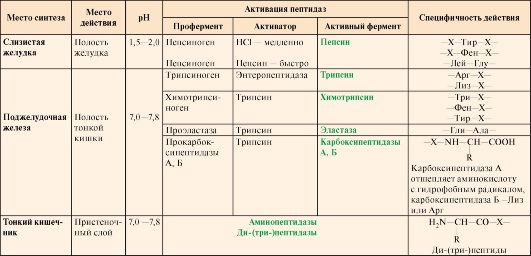 Примечание: X - любая аминокислота
Примечание: X - любая аминокислота
Преждевременная активация проферментов в секреторных клетках происходит при:
• язвенной болезни желудка - пепсиноген превращается в пепсин в клетках слизистой желудка;
• остром панкреатите - трипсиноген превращается в трипсин в клетках поджелудочной железы и активирует остальные панкреатические пептидазы.
3. Слизистая оболочка желудка вырабатывает следующие факторы, необходимые для переваривания белков:
• пепсиноген - синтезируется в главных клетках;
• соляную кислоту - вырабатывается обкладочными клетками. Гидролиз белков в желудке происходит под действием пепсина.
Профермент пепсиноген при поступлении пищи секретируется в полость желудка, где в два этапа происходит его активация:
• с помощью НС! - медленно;
• аутокаталитически - быстро, уже имеющимся пепсином. Соляная кислота желудочного сока выполняет следующие функции:
• .участвует в активации пепсиногена;
• создает оптимум рН для пепсина;
• оказывает бактерицидное действие;
• денатурирует белки пищи.
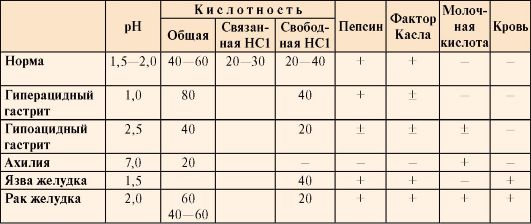
Значение рН желудочного сока в норме составляет 1,5-2,0. Определение кислотности желудочного сока используется для диагностики различных заболеваний желудка (табл. 9.2).
Таблица 9.2. Компоненты желудочного сока в норме и при патологических состояниях
•  Общая кислотность желудочного сока -
это совокупность всех кислотореагирующих веществ желудочного сока,
представляющая собой секрет желудка, собираемый в течение 1 часа
(предварительно отбирают секрет, ранее содержащийся в желудке).
Общая кислотность желудочного сока -
это совокупность всех кислотореагирующих веществ желудочного сока,
представляющая собой секрет желудка, собираемый в течение 1 часа
(предварительно отбирают секрет, ранее содержащийся в желудке).
• Связанная соляная кислота - это соляная кислота, связанная с белками и продуктами их переваривания.
• Свободная соляная кислота - это соляная кислота, не связанная с другими молекулами.
• Общая кислотность желудочного сока выражается в титрационных единицах (ТЕ) и измеряется количеством 0,1 М NaOH в миллилитрах, затраченным на титрование 100 мл желудочного сока в присутствии определенных индикаторов.
• Кислотность желудочного сока в норме составляет:
общая 40-60 ТЕ;
связанная HCl 20-30 ТЕ;
свободная HCl 20-40 ТЕ.
При диагностике заболеваний желудка помимо биохимических анализов обязательно проводят рентгенологические и эндоскопические исследования, иногда биопсию.
В слизистой оболочке желудка вырабатывается также внутренний фактор (фактор Касла), который представляет собой белок, способствующий всасыванию витамина В12 в тонкой кишке. Отсутствие этого витамина часто приводит к развитию анемии.
Молочная кислота в норме в желудочном соке отсутствует. Образуется при уменьшении содержания или отсутствии свободной соляной кислоты в результате усиленного размножения молочнокислых бактерий или при злокачественных опухолях желудка.
НС1 и пепсин способны разрушать клетки эпителия желудка. В норме это не происходит благодаря наличию защитных факторов слизистой оболочки, таких, как:
• образование на поверхности слизи, содержащей гетерополисахариды, которые не являются субстратами пептидгидролаз;
• секреция эпителиальными клетками ионов НСО3-, создающих в пристеночном слое менее агрессивную среду с рН 5,0-6,0, в которой пепсин неактивен. Кроме того, клетки поврежденного эпителия обладают способностью к быстрой регенерации.
Пепсин гидролизует пептидные связи, образованные аминогруппой или карбоксильной группой ароматических аминокислот (см. табл. 9.1):
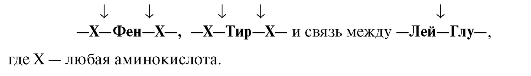 4. Переваривание белков в кишечнике происходит под действием:
4. Переваривание белков в кишечнике происходит под действием:
• ферментов поджелудочной железы-трипсина, химотрипсина, эластазы, карбоксипептидаз А и Б;
• ферментов эпителия тонкой кишки - аминопептидазы, дипептидаз, трипептидаз.
Активная форма трипсина образуется в кишечнике при участии фермента энтеропептидазы, выделяемого клетками кишечника. Энтеропептидаза отщепляет от N-конца трипсиногена гексапептид (рис. 9.2), что приводит к изменению конформации молекулы и формированию активного центра трипсина.
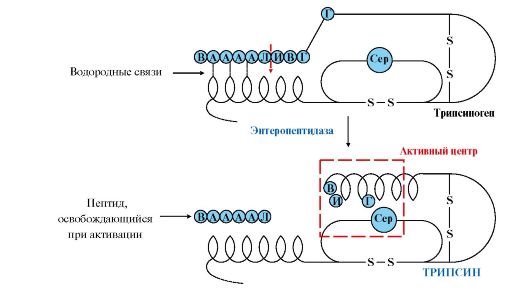 Рис. 9.2. Механизм активации трипсиногена.
Рис. 9.2. Механизм активации трипсиногена.
Пунктирная стрелка - место гидролиза. Буквами обозначены аминокислоты (А - асп, Г - глу, В - вал, Л - лиз, И - иле)
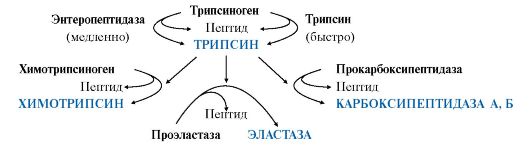
Остальные проферменты панкреатического сока (химотрипсиноген, прокарбоксипептидазы А и В, проэластаза) активируются трипсином. Активация панкреатических пептидаз в кишечнике происходит в виде каскада реакций.
 Ферменты эпителия тонкой кишки синтезируются в энтероцитах сразу в активной форме.
Ферменты эпителия тонкой кишки синтезируются в энтероцитах сразу в активной форме.
• Ферменты, участвующие в переваривании белков в кишечнике, обладают субстратной специфичностью к определенным аминокислотам в белке: Трипсин гидролизует преимущественно пептидные связи, образованные карбоксильными группами катионогенных аминокислот:
• 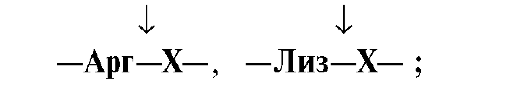 Химотрипсин - пептидные связи, образованные карбоксильными группами ароматических аминокислот:
Химотрипсин - пептидные связи, образованные карбоксильными группами ароматических аминокислот:
• 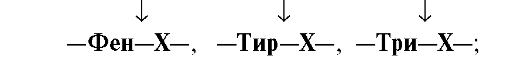 Эластаза - связь между -Гли-Ала-
Эластаза - связь между -Гли-Ала-
• Карбоксипептидазы отщепляют С-концевые аминокислоты:
карбоксипептидаза А - гидрофобные аминокислоты, карбоксипептидаза В - Лиз и Арг;
• Аминопептидаза - отщепляет N-концевые аминокислоты;
• Дипептидаза - гидролизует дипептиды;
• Трипептидаза - расщепляет трипептиды на отдельные аминокислоты.
5. Конечным результатом переваривания белков является образование свободных аминокислот, поступающих в клетки слизистой оболочки кишечника, путем вторично-активного транспорта за счет градиента концентрации натрия (симпорт). Всасывание L-аминокислот является активным, требующим затраты энергии процессом. Транспорт их осуществляется двумя путями:
• через воротную систему печени;
• по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток.
Аминокислоты конкурируют друг с другом за специфические участки связывания белков-переносчиков. Так, всасывание лейцина в больших количествах уменьшает всасывание изолейцина и валина. В крови максимальная концентрация аминокислот достигается через 30-50 минут после приема белковой пищи. Свободные аминокислоты, в отличие от белков пищи, лишены видовой специфичности и не обладают антигенными свойствами.
Скорость проникновения аминокислот через мембраны клеток различается, что указывает на существование транспортных систем, обеспечивающих перенос аминокислот через мембраны. Известно пять специфических транспортных систем для переноса определенной группы близких по строению аминокислот:
• нейтральных с короткой боковой цепью (аланин, серин, треонин);
• нейтральных с длинной или разветвленной боковой цепью (валин, лейцин, изолейцин);
• с катионными радикалами (лизин, аргинин);
• с анионными радикалами (глутаминовая и аспарагиновая кислоты);
• иминокислот (пролин, оксипролин).
Переносчики аминокислот первой и пятой групп, а также переносчик метионина относятся к числу Na+-зависимых. Независимые от Na+ переносчики специфичны для некоторых нейтральных аминокислот (фенилаланин, лейцин) и аминокислот с катионными радикалами (лизин).
Одной из основных транспортных систем для нейтральных аминокислот является γ-глутамильный цикл, который функционирует в почках, поджелудочной железе, печени и селезенке, в мозге и других тканях он содержится в очень небольших количествах (рис. 9.3).
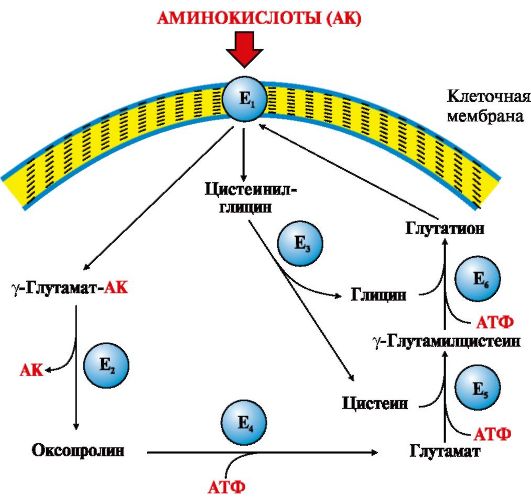 Рис. 9.3. γ-Глутамильный цикл:
Рис. 9.3. γ-Глутамильный цикл:
Е1 - γ-глутамилтранспептидаза (γ-ГТ); Е2 - γ-глутамилциклотрансфераза; Е3 - пептидаза; Е4 - оксопролиназа; Е5 - γ-глутамилцистеинсинтетаза; Е6 - глутатионсинтетаза.
Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием фермента γ-ГТ. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты
Ключевую роль в работе системы играет мембранный фермент γ-глутамилтранспептидаза (γ-ГТ). Этот гликопротеин катализирует перенос γ-глутамильной группы с глутатиона (γ-глутамилцистеинилглицин) или другого γ-глутамильного пептида на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Глутатион содержится во всех тканях животных. Для транспорта в клетку одной молекулы аминокислоты с участием γ-глутамильного цикла затрачивается три молекулы АТР.
γ-ГТ в больших количествах содержится в почках, поджелудочной железе, печени и других тканях. Активность фермента в сыворотке крови в норме составляет 30-50 МЕ/л (мкмоль/мин-мг) для мужчин и 25-35 МЕ/л для женщин. Определение активности γ-ГТ в сыворотке крови используется для диагностики заболеваний печени и сердца. γ-ГТ-тест используется также в качестве маркера рака поджелудочной железы, печени, предстательной железы и для обнаружения людей из группы раннего риска алкоголизма, для контроля за лечением хронического алкоголизма.
ТЕМА 9.3. ТРАНСАМИНИРОВАНИЕ И ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
1. Промежуточный обмен аминокислот чаще всего начинается с отщепления α-аминогруппы от аминокислоты. Это происходит с помощью двух типов реакций:
• трансаминирования;
• дезаминирования.
Трансаминирование - реакция переноса аминогруппы с аминокислоты (донора) на α-кетокислоту (акцептор), в результате чего образуются новая кетокислота и новая аминокислота. Реакция обратима.
 Реакция
трансаминирования происходит с участием ферментов аминотрансфераз
(трансаминаз), которые локализованы в цитозоле и митохондриях клеток
практически всех органов. Коферментом этих ферментов является
производное витамина В6 - пиридоксальфосфат. Трансаминированию подвергаются все аминокислоты, кроме лизина, треонина и пролина.
Реакция
трансаминирования происходит с участием ферментов аминотрансфераз
(трансаминаз), которые локализованы в цитозоле и митохондриях клеток
практически всех органов. Коферментом этих ферментов является
производное витамина В6 - пиридоксальфосфат. Трансаминированию подвергаются все аминокислоты, кроме лизина, треонина и пролина.
Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 различных аминотрансфераз. Наиболее распространенными являются:
• аспартатаминотрансфераза (АСТ), по обратной реакции - глутаматоксалоацетаттрансаминаза;
• аланинаминотрансфераза (АЛТ), по обратной реакции - глутаматпируваттрансаминаза.
Название каждой аминотрансферазы включает названия субстратов:
• донора аминогруппы (аминокислоты);
• акцептора аминогруппы (α-кетокислоты). Например, фермент, катализирующий реакцию
 называется
глутаматоксалоацетатаминотрансфераза. По субстратам обратной реакции
этот фермент называется аспартатаминотрансферазой (АСТ). Название
акцептора - α-кетоглутарата - из названия фермента обычно исключается,
так как эта кетокислота является основным акцептором аминогрупп в
организме.
называется
глутаматоксалоацетатаминотрансфераза. По субстратам обратной реакции
этот фермент называется аспартатаминотрансферазой (АСТ). Название
акцептора - α-кетоглутарата - из названия фермента обычно исключается,
так как эта кетокислота является основным акцептором аминогрупп в
организме.
Основными донорами аминогрупп в реакциях трансаминирования являются глутамат, аспартат и аланин.
Реакции трансаминирования играют большую роль в обмене аминокислот.
• Путем трансаминирования из соответствующих α-кетокислот синтезируются заменимые аминокислоты, если их в данный момент в ткани недостаточно. Таким образом происходит перераспределение аминного азота в тканях и органах.
• 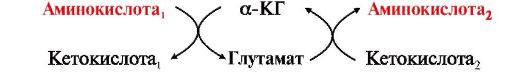 Трансаминирование - один из начальных этапов катаболизма аминокислот. Образующиеся
α-кетокислоты могут затем окисляться в цикле трикарбоновых кислот, а
некоторые - использоваться для синтеза глюкозы или кетоновых тел.
Трансаминирование - один из начальных этапов катаболизма аминокислот. Образующиеся
α-кетокислоты могут затем окисляться в цикле трикарбоновых кислот, а
некоторые - использоваться для синтеза глюкозы или кетоновых тел.
Трансаминирование происходит во многих тканях, но наиболее активно - в печени.
2. В клинике широко используется определение активности некоторых аминотрансфераз в сыворотке крови, особенно часто - АСТ и АЛТ. Эти ферменты являются органоспецифическими, наиболее активны в клетках печени и сердца. В норме их активность в крови мала - 5-40 ЕД/л.
Существуют изоферменты АСТ: цитозольная форма (ц-АСТ) и митохондриальная (м-АСТ). В печени, миокарде и большинстве других органов м-АСТ представляет 80% массы фермента, но в сыворотке - лишь менее 12% как у здоровых людей, так и у больных. Повышение активности м-АСТ в сыворотке крови имеет место при острых поражениях печени, инфаркте миокарда, сопровождающихся некрозом тканей и разрушением клеточных мембран, при этом повышение активности м-АСТ отражает тяжесть болезни, поражение органа и прогноз.
Определение активности АЛТ и АСТ применяется для диагностики заболеваний миокарда и печени, в том числе при отравлении хлорорганическими соединениями, используемыми на химических производствах (CCl4, хлороформ и др.). В этом случае активность ферментов в сыворотке крови увеличивается до 400 ед. и больше.
• Особенно важное значение для диагностики имеет увеличение активности АЛТ при безжелтушных формах вирусного гепатита.
• Для определения степени поражения печени и сердца определяют соотношение активностей АСТ-АЛТ в сыворотке крови - коэффициент де Ритиса, который в норме составляет 1,33+0,42.
• При гепатитах активность АЛТ увеличивается в 6-8 раз по сравнению с нормой, а АСТ - в 2-4 раза (рис. 9.4). Коэффициент де Ритиса уменьшается до -0,6. Однако при циррозе печени коэффициент де Ритиса приближается к 1,0 вследствие развивающегося некроза тканей и выхода в кровь митохондриальной фракции АСТ.
• При инфаркте миокарда активность АСТ увеличивается в 8-10 раз, а активность АЛТ - в 1,5-2 раза (рис. 9.5). Коэффициент де Ритиса значительно увеличивается. При стенокардии, пороках сердца, инфаркте
легкого активность аминотрансфераз в крови не увеличивается, что дает возможность дифференциальной диагностики заболеваний сердца.
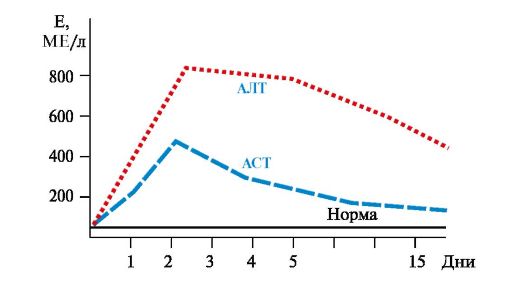 Рис. 9.4. Активность аминотрансфераз сыворотки крови при остром гепатите
Рис. 9.4. Активность аминотрансфераз сыворотки крови при остром гепатите
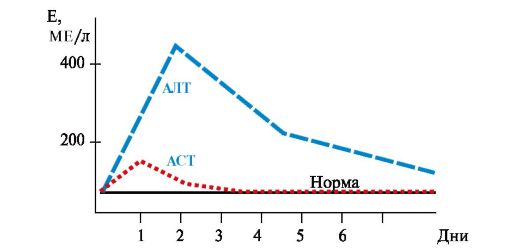 Рис. 9.5. Активность аминотрансфераз сыворотки крови при инфаркте миокарда
Рис. 9.5. Активность аминотрансфераз сыворотки крови при инфаркте миокарда
Особую важность имеет возможность дифференциальной диагностики тяжести заболеваний печени и сердца, а также анализ динамики течения заболевания.
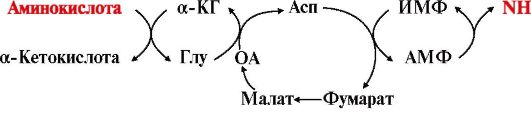
3. Катаболизм аминокислот начинается с реакции дезаминирования - удаления α-аминогруппы, которая выделяется в виде аммиака и образования безазотистого остатка (α-кетокислоты). При дезаминировании в отличие от трансаминирования общее количество аминокислот уменьшается.
Продукт дезаминирования аммиак - токсичное соединение, в клетках подвергается обезвреживанию.
Безазотистый остаток представляет собой α-кетокислоту, которая включается:
• в реакции окисления до СО2 и Н2О;
• в реакции трансаминирования для синтеза заменимых аминокислот;
• в анаплеротические реакции для восполнения убыли метаболитов ОПК или для синтеза других соединений;
• в глюконеогенез;
• в кетогенез.
Дезаминированию подвергаются все аминокислоты кроме лизина и пролина (табл. 9.3).
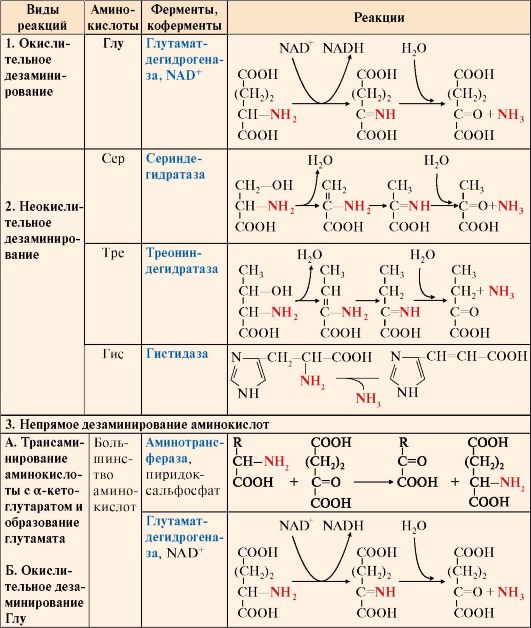
Существует несколько типов реакций дезаминирования:
• окислительное - характерно только для Глу;
• неокислительное - характерно для Сер, Тре и Гис;
• непрямое - для остальных аминокислот.
Прямому окислительному дезаминированию подвергается только глутамат. Окислительное дезаминирование глутамата происходит под действием фермента глутаматдегидрогеназы, коферментом которого является NAD+. Реакция идет в митохондриях многих тканей, наиболее активно - в печени. В реакцию неокислительного дезаминирования вступают:
• серин и треонин - с отщеплением воды;
• гистидин - внутримолекулярным способом.
Большинство аминокислот подвергается в клетке непрямому дезаминированию, которое включает две стадии:
А. Трансаминирование с α-кетоглутаратом и образование Глу в цитозоле клетки;
Б. Окислительное дезаминирование Глу в митохондриях.
Центральную роль в непрямом дезаминировании играют глутамат и α-кетоглутарат.
Другой тип дезаминирования аминокислот - непрямое неокислительное - происходит с участием цикла ИМФ-АМФ и характерен для мышечной ткани и мозга, в которых глутаматдегидрогеназа малоактивна:
 Аминогруппа
аминокислот с помощью двух последовательных реакций трансаминирования
переносится на ИМФ с образованием АМФ, который гидролитически
дезаминируется с выделением аммиака.
Аминогруппа
аминокислот с помощью двух последовательных реакций трансаминирования
переносится на ИМФ с образованием АМФ, который гидролитически
дезаминируется с выделением аммиака.
Таблица 9.3. Реакции дезаминирования аминокислот
 Катаболизм аминокислот и, соответственно, реакции дезаминирования ускоряются при:
Катаболизм аминокислот и, соответственно, реакции дезаминирования ускоряются при:
• голодании в результате ускорения распада белков тканей;
• поступлении с пищей больших количеств белка;
• сахарном диабете и других длительно протекающих тяжелых заболеваниях, также сопровождающихся распадом тканевых белков.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Заполните табл. 9.4, распределив аминокислоты по возможности их синтеза в организме.
Таблица 9.4. Классификация аминокислот по возможности синтеза в организме
 2. Перепишите
в тетрадь пептид, радикалы аминокислот напишите формулами. Укажите,
какие связи в данном пептиде будут расщепляться приведенными ниже
протеазами (Х - любой аминокислотный остаток):
2. Перепишите
в тетрадь пептид, радикалы аминокислот напишите формулами. Укажите,
какие связи в данном пептиде будут расщепляться приведенными ниже
протеазами (Х - любой аминокислотный остаток):
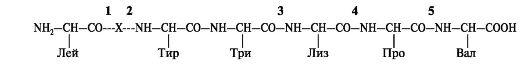 A. Пепсин Б. Трипсин
A. Пепсин Б. Трипсин
B. Химотрипсин
Г. Карбоксипептидаза Д. Аминопептидаза
3. Перенесите в тетрадь рис. 9.6, замените цифры на названия проферментов (цифры без индекса) и ферментов (цифры с индексом «а»):
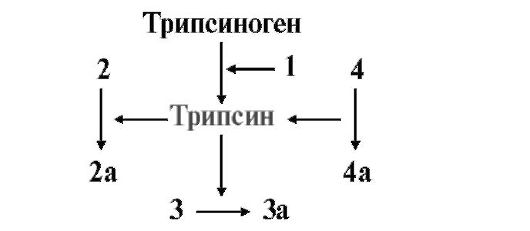 Рис. 9.6. Каскадный механизм активации пептидаз панкреатического сока
Рис. 9.6. Каскадный механизм активации пептидаз панкреатического сока
4. При острых панкреатитах, а также в результате механического повреждения (травмы) поджелудочной железы в ее клетках происходит активация проферментов. Объясните, в чем заключается опасность преждевременной активации этих ферментов. Для ответа на вопрос:
а) напишите, какие ферменты могут активироваться в этих случаях;
б) объясните, как может повлиять на клетки железы преждевременная активация;
в) назовите лекарственные препараты, применение которых уменьшит разрушительное действие панкреатических пептидаз, укажите механизм их действия (см. модуль 2).
5. В составе белков, которые человек получал с пищей, содержался избыток глутамата и мало аланина. Однако аланин присутствовал в организме в нормальных количествах. Объясните это, записав формулами реакции трансаминирования между следующими парами аминокислот и α-кетокислот:
а) Глу + Пируват -
б) Глу + Оксалоацетат -
в) Асп + α-Кетоглутарат - Укажите:
а) названия продуктов, образующихся в реакциях;
б) полное название ферментов по прямой и обратной реакциям; локализацию их в клетке;
в) название кофермента, участвующего в реакциях; напишите его формулу.
6. Напишите реакции дезаминирования Ала, Глу, Сер, Гис. Укажите ферменты и коферменты. Назовите типы дезаминирования этих аминокислот.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильный ответ.
Наибольшее содержание белка отмечено в:
A. Мясе Б. Рыбе
B. Молоке Г. Капусте
Д. Сое
2. Выберите правильные ответы. Соляная кислота в желудке:
A. Денатурирует белки
Б. Оказывает бактерицидное действие
B. Обеспечивает всасывание белков
Г. Создает оптимум рН для действия пепсина Д. Активирует липазу
3. Выберите правильные ответы.
Положительный азотистый баланс наблюдается:
A. При голодании
Б. В период роста ребенка
B. У взрослого человека при нормальном питании
Г. В период реабилитации после длительного заболевания Д. При старении
4. Установите соответствие. Аминокислота:
A. Гис
Б. Сер
B. Цис
Г. Мет
Д. Арг
Характеристика:
1. Заменимая
2. Условно заменимая
3. Незаменимая
5. Выберите правильные ответы.
Пищевая ценность белка зависит от:
A. Присутствия всех заменимых аминокислот Б. Порядка чередования аминокислот
B. Наличия всех незаменимых аминокислот
Г. Возможности расщепления в желудочно-кишечном тракте Д. Присутствия всех 20 аминокислот
6. Выполните «цепное» задание:
а) в расщеплении пептидной связи ( -Гли-Ала-) участвует:
A. Химотрипсин Б. Эластаза
B. Карбоксипептидаза А Г. Трипсин
б) активатором данного фермента является:
A. Пепсин Б. Трипсин
B. Энтеропептидаза Г. Химотрипсин
в) этот фермент используют для лечения:
A. Гнойных ран
Б. Нарушения переваривания белков в желудке
B. Некоторых злокачественных образований Г. Вирусного конъюнктивита
7. Установите соответствие.
Протеолитический фермент:
A. Дипептидаза Б. Трипсин
B. Химотрипсин Г. Эластаза
Д. Дипептидаза
Пептидная связь:
1. ...-Арг-Ала-...
2. ...-Тир-Про- ...
3. Глу-Мет
8. Выберите правильные ответы. Аминотрансферазы:
A. Локализованы в цитозоле и митохондриях клеток Б. Взаимодействуют с двумя субстратами
B. Используют АТФ как источник энергии Г. Катализируют необратимую реакцию
Д. Используют пиридоксальфосфат в качестве кофермента
9. Выберите правильные ответы.
Для непрямого дезаминирования необходимы витамины:
A. В1
Б. в6
B. РР Г. С
Д. Биотин
10. Установите соответствие. Состояние:
A. Почечнокаменная болезнь Б. Гепатит
B. Инфаркт миокарда Г. Пневмония
Д. Норма Коэффициент де Ритиса:
1. 6,0
2. 0,5
3. 1,3
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. Д
2. А, Б, Г
3. Б, Г
4. 1-Б, 2-В, 3-Г
5. В, Г
6. а) Б, б) Б, в) А
7. 1-Б, 2-В, 3-Д
8. А, Б, Д
9. Б, В
10. 1-В, 2-Б, 3-Д
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Азотистый баланс, азотистое равновесие
2. Полноценные белки пищи
3. Заменимые и незаменимые аминокислоты
4. Переваривание белков
5. Пептидгидролазы
6. Эндопептидазы и экзопептидазы
7. Проферменты
8. Показатели кислотности желудочного сока
9. Гастриты гипоацидные, гиперацидные и анацидные
10. Ахилия
11. Трансаминирование
12. Диагностическое значение аспартат- и аланин-аминотрансфераз
(АСТ и АЛТ)
13. Коэффициент де Ритиса
14. Дезаминирование окислительное и неокислительное
15. Непрямое дезаминирование аминокислот
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ОБМЕНА АМИНОКИСЛОТ, ИЗУЧАЕМЫЕ В ДАННОЙ МОДУЛЬНОЙ ЕДИНИЦЕ
• Кислотность желудочного сока в норме:
общая 40-60 ТЕ связанная 20-30 ТЕ свободная HCl 20-40 ТЕ
• Активность γ-ГТ в сыворотке крови здоровых людей:
у мужчин - 30-50 МЕ/л у женщин - 25-35 МЕ/л
• Активность АЛТ и АСТ в сыворотке крови здоровых людей: 5-40 МЕ/л
• Коэффициент де Ритиса: 1,33 ± 0,42
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. В африканских странах дети получают пищу преимущественно растительного происхождения, содержащую белки в недостаточных количествах. При этом часто наблюдается малокровие, мышечные дистрофии, отставание в росте и развитии, светлый цвет кожи. Объясните появление этих симптомов, для чего:
а) объясните, какие по составу белки необходимы для полноценного белкового питания;
б) дайте определение понятию «азотистый баланс» и укажите, какой азотистый баланс наблюдается при белковом голодании;
в) перечислите биологически активные вещества, которые синтезируются из аминокислот в организме;
г) назовите, какие пути обмена аминокислот усиливаются и тормозятся при белковом голодании.
2. У больного развился острый панкреатит, при этом стенки протока поджелудочной железы воспалились и отекли, просвет протока уменьшился, наблюдаются застойные явления. Таким больным необходима срочная медицинская помощь. Объясните, чем опасно затруднение оттока сока поджелудочной железы. Для этого:
а) назовите ферменты, которые синтезируются в поджелудочной железе;
б) укажите пути их активации, назовите активаторы проферментов;
в) объясните, к каким последствиям приведет их активация в ткани поджелудочной железы.
3. В желудочном соке больного обнаружен высокий уровень лактата. Укажите, какие заболевания возможны в этом случае. Для ответа:
а) назовите процесс, продуктом которого является лактат, перечислите здоровые и патологические ткани, в которых этот процесс происходит наиболее активно;
б) перечислите компоненты и рН желудочного сока в норме;
в) перечислите функции соляной кислоты желудочного сока;
г) предположите, какие компоненты желудочного сока нужно определить дополнительно, чтобы уточнить диагноз.
4. У больного язвенной болезнью желудка провели операцию с экстирпацией (удалением) большей части желудка. Но послеоперационное обследование показало, что процесс переваривания белков у пациента существенно не изменился. Объясните полученные результаты обследования. Для этого:
а) назовите пептидазу, которая синтезируется в желудке, назовите механизм ее активации, перечислите активаторы;
б) напишите формулу пептида и укажите, какая связь расщепляется в желудке здорового человека;
-Цис-Мет-Арг-Гли-Ала-Фен-Вал-Сер-
в) перечислите панкреатические пептидазы и ферменты энтероцитов, назовите, под действием каких ферментов при переваривании данного фрагмента белка появятся пептиды, С-концевыми аминокислотами которых являются Арг и Фен, укажите их проферменты;
г) назовите, к какой группе пептидаз относятся данные ферменты.
5. При безжелтушных формах гепатита высокочувствительным тестом является повышение в крови активности фермента γ-глутамилтранспептидазы (γ-ГТ), которая возрастает в 10-15 раз по сравнению с нормой (10-60 МЕ/л). Объясните диагностическое значение этого фермента, для ответа:
а) назовите основное свойство ферментов, определение активности которых в крови больных используется для диагностики заболеваний;
б) назовите систему, в работе которой участвует γ-ГТ, объясните ее роль в организме;
в) приведите примеры других ферментов, определение активности которых можно использовать для диагностики патологии печени.
6. Восточная кухня предполагает использование больших количеств глутамата в качестве приправы. Объясните, почему при вегетарианском питании с употреблением растительной пищи, содержащей мало белков, но много крахмала и при использовании глутамата общее количество аминокислот (Ала, Асп и т.д.) не снижается. Для этого:
а) назовите, к какой группе аминокислот по возможности синтеза в организме относятся Глу, Ала, Асп;
б) назовите, какая реакция может использоваться для перераспределения азота аминокислот в организме;
в) напишите реакции, с помощью которых можно получить Ала, Асп, назовите ферменты, катализирующие реакции, коферменты.
7. Здоровых крыс длительное время содержали на искусственной белковой диете, исключающей аминокислоты лейцин, валин и фенилаланин. Как изменится у этих животных азотистый баланс? Ответ поясните. Для этого:
а) дайте определение азотистого баланса;
б) назовите, к какой группе аминокислот по возможности синтеза в организме относятся Лей, Вал и Фен.
8. У пациента с подозрением на инфаркт миокарда определяли активность аланин- (АЛТ) и аспартатаминотрансферазы (АСТ) в крови. Активность какой из аминотрансфераз увеличится в большей степени при такой патологии и почему? Назовите другие ферменты, активность которых определяют в крови для подтверждения указанной патологии. При ответе на вопрос:
а) напишите реакции, которые катализируют АЛТ и АСТ;
б) объясните значение этих реакций в метаболизме аминокислот;
в) объясните принципы энзимодиагностики.
Модульная единица 2 ИСТОЧНИКИ АММИАКА В ОРГАНИЗМЕ, ПРИЧИНЫ ЕГО ТОКСИЧНОСТИ И СПОСОБЫ ОБЕЗВРЕЖИВАНИЯ. ГИПЕРАММОНИЕМИЯ. ИСПОЛЬЗОВАНИЕ БЕЗАЗОТИСТЫХ ОСТАТКОВ АМИНОКИСЛОТ
Цели изучения Уметь:
1. Объяснять причины токсичности аммиака и механизмы его обезвреживания в организме.
2. Использовать эти знания для понимания причин возникновения гипераммониемии разных типов и ее клинических проявлений.
3. Интерпретировать результаты определения концентрации мочевины в биологических жидкостях для диагностики заболеваний.
4. Объяснять роль аминокислот в обеспечении организма энергоносителями в условиях голодания.
Знать:
1. Источники аммиака и реакции его обезвреживания в организме.
2. Реакции процесса биосинтеза мочевины (орнитиновый цикл).
3. Причины и последствия нарушения синтеза и выведения мочевины.
4. Пути использования безазотистых остатков аминокислот для синтеза глюкозы и кетоновых тел.
ТЕМА 9.4. ОБМЕН АММИАКА: ИСТОЧНИКИ, ПРЕВРАЩЕНИЕ В ТКАНЯХ
1. Основным источником аммиака является катаболизм аминокислот в
тканях. Небольшая часть аммиака образуется в клетках при распаде азотсодержащих соединений (биогенных аминов, нуклеотидов и др.) (рис. 9.7), а также при гниении белков в кишечнике в результате деятельности микрофлоры, откуда он частично всасывается и поступает в воротную вену. Концентрация аммиака в крови воротной вены существенно выше, чем в общем кровотоке.
Катаболизм аминокислот и образование аммиака происходит во всех тканях организма. Однако концентрация аммиака в крови очень мала, так как он быстро связывается в клетках с образованием нетоксичных продуктов. Содержание аммиака в крови в норме составляет всего 0,4-0,7 мг/л (25-40 мкмоль/л).
Из организма аммиак выводится почками в виде конечных продуктов азотистого обмена:
• мочевины - синтезируется в печени;
• аммонийных солей - образуются в почках.
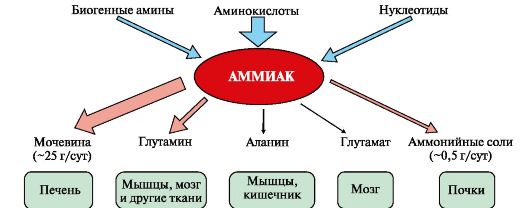 Рис. 9.7. Источники аммиака и пути его превращения в разных тканях
Рис. 9.7. Источники аммиака и пути его превращения в разных тканях
2. В разных тканях существует несколько способов связывания и выведения аммиака (рис. 9.8).
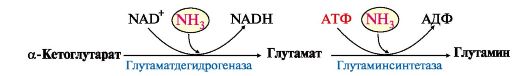
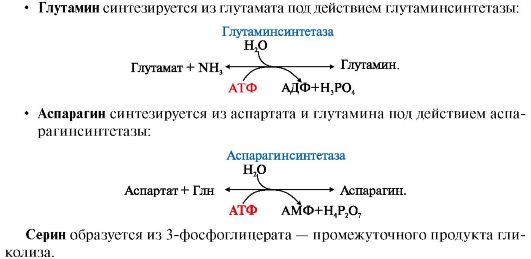
Основной реакцией обезвреживания аммиака почти во всех тканях является синтез глутамина под действием глутаминсинтетазы:
 Глутаминсинтетаза
обладает высоким сродством к аммиаку и благодаря этой реакции в крови и
тканях поддерживается низкая концентрация NH3.
Глутаминсинтетаза
обладает высоким сродством к аммиаку и благодаря этой реакции в крови и
тканях поддерживается низкая концентрация NH3.
Глутамин можно считать транспортной формой аммиака, он является нейтральной аминокислотой и способен легко проникать через клеточные мембраны путем облегченной диффузии (в отличие от глутамата, требующего механизмов активного транспорта). Глутамин поступает в кровь из многих органов, в наибольшем количестве - из мышц и мозга (см. рис. 9.8).
3. Из тканей глутамин транспортируется в почки и кишечник. В клетках кишечника под действием фермента глутаминазы происходит отщепление амидной группы в виде NH3 а образовавшийся глутамат с помощью АЛТ превращается в аланин.
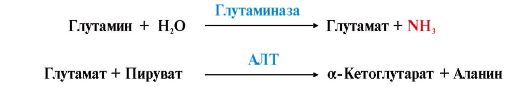 Таким
образом, в энтероцитах амидная группа глутамина превращается в аммиак, а
аминогруппа глутамина - включается в состав аланина.
Таким
образом, в энтероцитах амидная группа глутамина превращается в аммиак, а
аминогруппа глутамина - включается в состав аланина.
4. В почках глутамин также подвергается действию фермента глутаминазы и
расщепляется на глутамат, который реабсорбируется и возвращается в клетки тканей, и аммиак (см. рис. 9.8, В).
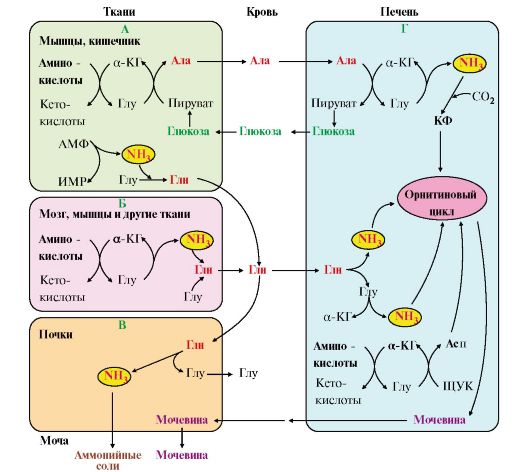 Рис. 9.8. Пути обмена азота аминокислот и аммиака:
Рис. 9.8. Пути обмена азота аминокислот и аммиака:
А - выведение азота из мышц и кишечника в составе аланина и глутамина; Б - выведение азота из мозга и мышц в виде глутамина; В - экскреция аммиака из почек в виде аммонийных солей; Г - включение азота аминокислот в мочевину в печени
Глутаминаза почек активируется при ацидозе; образовавшийся аммиак используется для нейтрализации кислых продуктов и образования аммонийных солей [в основном, NH4Cl, (NH4)2SO4], которые экскретируются с мочой (рис. 9.9). Экскреция солей аммония в норме составляет -0,5 г/сут, при
ацидозе выведение аммонийных солей может увеличиться до 10 г/сут. Этот путь выведения аммиака:
• поддерживает кислотно-щелочной баланс в норме;
• защищает организм от потери с мочой ионов Na+ и К+, которые также могут использоваться для выведения избытка анионов.
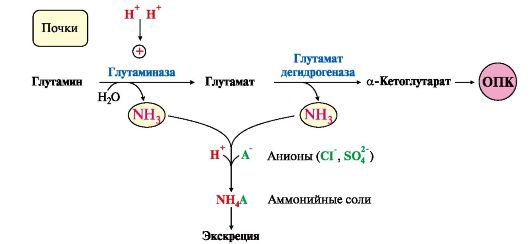 Рис. 9.9. Использование глутамина в почках для поддержания кислотно-щелочного баланса
Рис. 9.9. Использование глутамина в почках для поддержания кислотно-щелочного баланса
5. В мозге и некоторых других органах для обезвреживания аммиака используется реакция восстановительного аминирования α-кетоглутарата под действием глутаматдегидрогеназы, которая катализирует реакцию, обратную окислительному дезаминированию глутамата. Однако этот путь в тканях используется слабо. Хотя, если учитывать возможность последующего образования глутамина, он является выгодным для клеток, так как способствует обезвреживанию сразу двух молекул NH3:
 6. Из мышц, клеток кишечника и некоторых других тканей избыток азота выводится в кровь в виде аланина (см. рис. 9.8, А, Г). Образование аланина в этих органах можно представить следующей схемой:
6. Из мышц, клеток кишечника и некоторых других тканей избыток азота выводится в кровь в виде аланина (см. рис. 9.8, А, Г). Образование аланина в этих органах можно представить следующей схемой:
 Аминогруппы
разных аминокислот в ходе реакций трансаминирования переносятся на
пируват, источником которого служат глюкоза и безазотистые остатки
аминокислот. Особенно много аланина выделяют мышцы в силу их большой
массы, а также потому, что работающие мышцы часть энергии получают за
счет распада аминокислот. Аланин поступает в печень,
Аминогруппы
разных аминокислот в ходе реакций трансаминирования переносятся на
пируват, источником которого служат глюкоза и безазотистые остатки
аминокислот. Особенно много аланина выделяют мышцы в силу их большой
массы, а также потому, что работающие мышцы часть энергии получают за
счет распада аминокислот. Аланин поступает в печень,
где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается в процессе синтеза мочевины, а пируват включается в глюконеогенез или ОПК. Глюкоза из печени поступает в ткани и в процессе гликолиза окисляется до пирувата. Образование аланина в мышцах, его перенос в печень и перенос глюкозы в обратном направлении составляют глюкозоаланиновый цикл (см. рис. 9.8, А, Г).
7. В печени аммиак обезвреживается путем связывания с СО2 и образования карбамоилфосфата (см. рис. 9.8, Г). Реакцию катализирует карбамоилфосфатсинтетаза I, которая использует 2 моль АТФ. Фермент локализован в митохондриях гепатоцитов. Продукт реакции - карбамоилфосфат - включается затем в орнитиновый цикл Кребса-Гензелейта для синтеза мочевины.
ТЕМА 9.5. ОРНИТИНОВЫЙ ЦИКЛ И ЕГО БИОЛОГИЧЕСКАЯ РОЛЬ
1. Мочевина - конечный продукт азотистого обмена, в составе которого из организма выводится избыток аммиака. Экскреция мочевины в норме составляет -25 г/сут. Синтез мочевины происходит только в печени (рис. 9.10).
Содержание мочевины в сыворотке крови в норме составляет 2,5-8,4 мМ/л (15-50 мг/дл).
Катаболизм аминокислот и образование аммиака происходит во многих тканях. Азот из тканей транспортируется в печень в составе трех соединений: глутамина, аланина и аммиака.
Полный набор ферментов цикла синтеза мочевины есть только в гепатоцитах. Первые две реакции протекают в митохондриях, а последующие три - в цитозоле.
Молекула мочевины (карбамида, двойного амида угольной кислоты) содержит два атома азота:
• первая аминогруппа (ем. рис. 9.10) включается в цикл в виде аммиака, образующегося в митохондриях гепатоцитов при дезаминировании аминокислот или поступающего из крови. Реакцию катализирует митохондриальная карбамоилфосфатсинтетаза I (цитоплазматическая карбамоилфосфатсинтетаза II участвует в синтезе пиримидиновых нуклеотидов);
• вторая аминогруппа (см. рис. 9.10) вводится в молекулу мочевины из аспартата.
2. Аммиак, используемый карбамоилфосфатсинтетазой I, поставляется в печень, главным образом, из кишечника с кровью воротной вены. Роль других источников, в том числе окислительного дезаминирования глутамата и гидролиза глутамина в печени, существенно меньше.
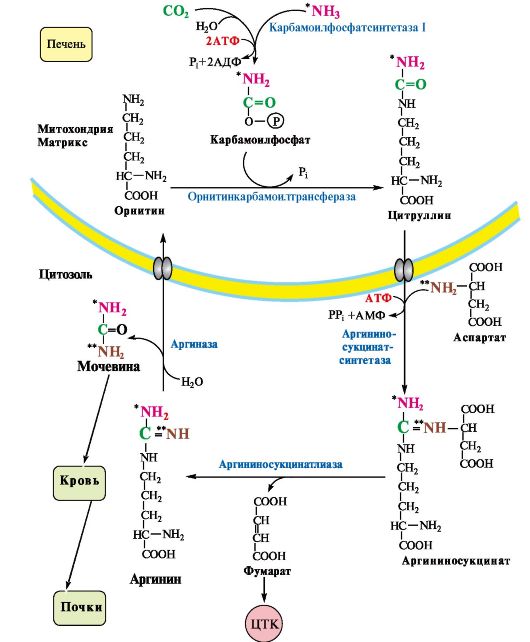 Рис. 9.10. Орнитиновый цикл Кребса-Гензелейта.
Рис. 9.10. Орнитиновый цикл Кребса-Гензелейта.
Ферменты орнитинового цикла локализованы в митохондриях и цитозоле гепатоцитов. В цикле происходит трансмембранный перенос цитруллина и орнитина. На схеме показаны пути включения двух атомов азота из разных аминокислот в молекулу мочевины:
- азот одной аминогруппы - в виде аммиака в матриксе митохондрии (*N);
- азот второй аминогруппы поставляется в составе аспартата в цитозоле (**N)
Аспартат, необходимый для синтеза аргининосукцината, образуется в печени:
• преимущественно с использованием аминогруппы аланина, который поступает из мышц и клеток кишечника (рис. 9.11);
• путем трансаминирования глутамата с оксалоацетатом. Образующийся в орнитиновом цикле фумарат включается в реакции
цитратного цикла и превращается в оксалоацетат, который путем трансаминирования снова образует аспартат (см. рис. 9.11). Таким образом, с орнитиновым циклом сопряжен цикл регенерации аспартата из фумарата. Пируват, образующийся в этом цикле, используется в ОПК или для глюконеогенеза.
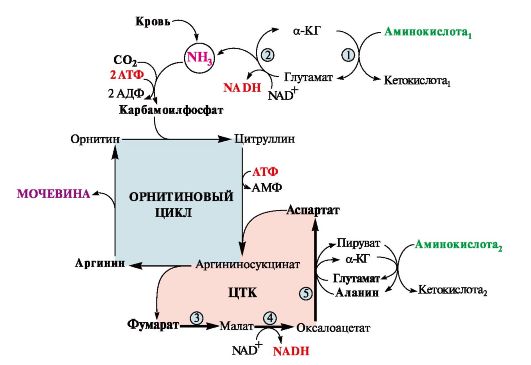 Рис. 9.11. Цикл регенерации аспартата.
Рис. 9.11. Цикл регенерации аспартата.
Ферменты, катализирующие реакции: 1 - аминотрансфераза; 2 - глутаматдегидрогеназа; 3 - фумараза; 4 - малатдегидрогеназа; 5 - аминотрансфераза
3. В орнитиновом цикле расходуется энергия четырех макроэргических связей трех молекул АТФ на синтез одной молекулы мочевины. Затраты энергии происходят также при трансмембранном переносе компонентов цикла (цитруллина, орнитина, мочевины) (см. рис. 9.10). В почках перенос мочевины из крови в мочу происходит за счет градиента ионов натрия, создаваемого К, Na-АТФазой, которая потребляет АТФ.
Процесс синтеза мочевины имеет возможность компенсации энергозатрат (см. рис. 9.11):
• при регенерации аспартата из фумарата на стадии дегидрирования малата образуется NADH, который может обеспечить синтез трех молекул АТФ;
• при окислительном дезаминировании глутамата в разных органах также образуется NADH, соответственно - еще три молекулы АТФ.
4. Орнитиновый цикл в печени выполняет две функции:
• превращение азота аминокислот в мочевину, которая экскретируется и помогает избежать накопления аммиака в организме;
• синтез аргинина и пополнение его фонда в организме.
Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Такой запас мощности необходим для предотвращения гипераммониемии при изменениях количества белка в пище.
5. Регуляторными реакциями являются синтез карбамоилфосфата, цитруллина и заключительная реакция, катализируемая аргиназой. Основным регуляторным фактором является содержание субстратов, прежде всего аммиака. Высокий уровень NH3 вызывает повышение уровня образования мочевины. Кроме того, скорость орнитинового цикла регулируется с помощью двух механизмов:
• аллостерическая активация карбамоилфосфатсинтетазы I N-ацетил- глутаматом (N-АГ);
• индукция синтеза ферментов карбамоилфосфатсинтетазы I, орнитинкарбамоилтрансферазы и аргиназы кортизолом.
N-ацетилглутамат является активатором карбамоилфосфатсинтетазы I. Образуется в матриксе митохондрий гепатоцитов из глутамата и ацетил-КоА специфической синтазой (рис. 9.12), которая активируется при повышении содержания аргинина в печени.
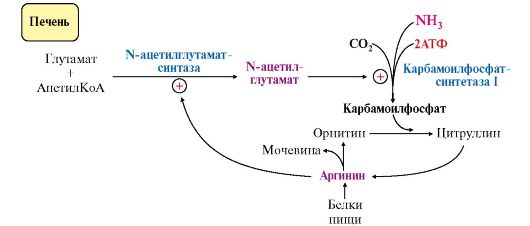 Рис. 9.12. Регуляция карбамоилфосфатсинтетазы I
Рис. 9.12. Регуляция карбамоилфосфатсинтетазы I
Индукция синтеза ферментов орнитинового цикла происходит в ответ на повышение скорости распада белков при голодании, длительной физической работе и при высокобелковой диете. В этих случаях углерод аминокислот превращается в глюкозу, а азот включается в молекулу мочевины. Индукция синтеза ферментов орнитинового цикла происходит параллельно с индукцией ферментов глюконеогенеза, АЛТ и глутаматдегидрогеназы. Заболевания, характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.), также сопровождаются активацией орнитинового цикла.
ТЕМА 9.6. ГИПЕРАММОНИЕМИЯ И ЕЕ ПРИЧИНЫ
1. Аммиак превращается в мочевину только в печени, поэтому при заболеваниях печени (гепатиты, цирроз и др.) или наследственных дефектах ферментов обезвреживания аммиака наблюдается повышение содержания аммиака в крови (гипераммониемия), которое оказывает токсическое действие на организм.
Гипераммониемия сопровождается следующими симптомами:
• тошнота, рвота;
• головокружение, судороги;
• потеря сознания, отек мозга (в тяжелых случаях).
Все перечисленные симптомы обусловлены действием аммиака на центральную нервную систему и прежде всего на головной мозг.
2. Механизмы токсического действия аммиака связаны с тем, что:
• аммиак вызывает снижение концентрации α-кетоглутарата, так как
сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата:
•  Это вызывает угнетение ЦТК (гипоэнергетическое состояние) и обмена аминокислот (трансаминирования); высокие концентрации аммиака вызывают синтез глутамина из глутамата в нервной ткани:
Это вызывает угнетение ЦТК (гипоэнергетическое состояние) и обмена аминокислот (трансаминирования); высокие концентрации аммиака вызывают синтез глутамина из глутамата в нервной ткани:
•  снижение концентрации глутамата подавляет обмен аминокислот и синтез нейромедиаторов, в частности, γ-аминомасляной кислоты (ГАМК),
снижение концентрации глутамата подавляет обмен аминокислот и синтез нейромедиаторов, в частности, γ-аминомасляной кислоты (ГАМК),
основного тормозного медиатора:
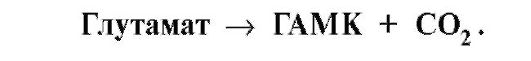 Это
нарушает проведение нервного импульса, вызывает судороги. Накопление
глутамина в нервных клетках повышает осмотическое давление и, в больших
концентрациях, может вызвать отек мозга;
Это
нарушает проведение нервного импульса, вызывает судороги. Накопление
глутамина в нервных клетках повышает осмотическое давление и, в больших
концентрациях, может вызвать отек мозга;
В крови и цитозоле аммиак превращается в ион NH4+:
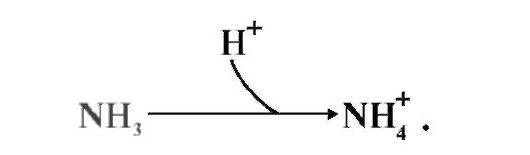 Накопление NH4+ нарушает трансмембранный перенос одновалентных катионов Na+ и К+, что также влияет на проведение нервных импульсов.
Накопление NH4+ нарушает трансмембранный перенос одновалентных катионов Na+ и К+, что также влияет на проведение нервных импульсов.
3. Известно пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла (табл. 9.5). Нарушение орнитинового цикла наблюдается при гепатите и некоторых других вирусных заболеваниях; так, например, вирус гриппа подавляет синтез карбамоилфосфатсинтетазы I.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации:
• аммиака;
• глутамина;
• аланина.
Диагностика различных типов гипераммониемии производится путем определения:
• содержания аммиака в крови;
• метаболитов орнитинового цикла в крови и моче;
• активности фермента в биоптатах печени.
Основным диагностическим признаком служит повышение концентрации аммиака в крови. Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложненных заболеваний.
Для снижения концентрации NH3 в крови и облегчения состояния больных рекомендуется:
• малобелковая диета;
• введение метаболитов орнитинового цикла (аргинина, цитруллина, глутамата), которые стимулируют выведение аммиака в обход нарушенных реакций (рис. 9.13), например, в составе фенилацетилглутамина и гиппуровой кислоты.
Таблица 9.5. Наследственные нарушения орнитинового цикла и их проявления
Заболевание | Дефект фермента | Тип наследования | Основные клинические проявления | Метаболиты | Лечение | |
Кровь | Моча | |||||
Гипераммониемия тип I | Карбамоилфосфат- синтетаза I | Аутосомнорецессивный | В течение 24-48 часов после рождения судороги, потеря сознания, кома | Глн ί АлаТ | Оротат | Гемодиализ, малобелковая диета |
Гипераммониемия тип II | Орнитин- карбамоил- трансфераза | Сцепленный с Х-хромосомой | Снижение толерантности к белкам, судорожные припадки | Глн ί АлаТ | Оротат | Малобелковая диета, фенилацетат, глутамат, цитруллин |
Цитруллинемия | Аргинино- сукцинат- синтетаза | Аутосомнорецессивный | Тяжелая гипераммониемия у новорожденных. У взрослых - после белковой нагрузки | Цитруллин Τ | Цитруллин Τ | Малобелковая диета, аргинин, глутамат |
Аргинино- сукцинат- урия | Аргинино- сукцинат- лиаза | Аутосомнорецессивный | Гипераммониемия, судороги | Аргинино- сукцинат Τ | Аргининосукцинат, Глн, Ала, Лиз | Малобелковая диета, аргинин |
Гипераргининемия | Аргиназа | Аутосомнорецессивный | Гипераргининемия | АргТ | Apr Лиз Орнитин | Малобелковая диета |
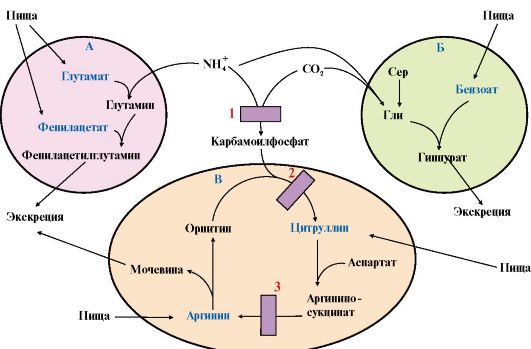 Рис.
9.13. Пути выведения аммиака при включении в диету глутамата,
фенилацетата (А), бензоата (Б) и цитруллина (В) [1, 2 и 3 - ферментные
блоки]:
Рис.
9.13. Пути выведения аммиака при включении в диету глутамата,
фенилацетата (А), бензоата (Б) и цитруллина (В) [1, 2 и 3 - ферментные
блоки]:
А - поступление с пищей больших доз глутамата и фенилацетата при дефекте карбамоилфосфатсинтетазы I вызывает синтез глутамина и образование фенилацетилглутамина, который выводится с мочой; Б - введение в рацион бензоата приводит к образованию из глицина гиппуровой кислоты, в составе которой экскретируется азот; В - при дефекте орнитинкарбамоилтрансферазы введение больших доз цитруллина стимулирует синтез мочевины из карбамоилфосфата и аспартата. При дефекте аргининосукцинатлиазы введение больших доз аргинина стимулирует регенерацию орнитина и выведение азота в составе цитруллина и аргининосукцината
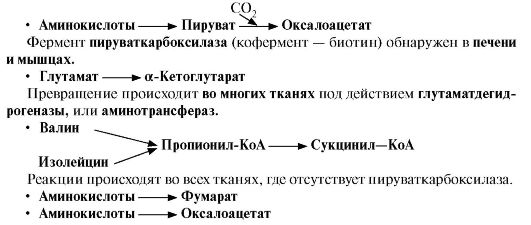
ТЕМА 9.7. ПУТИ ИСПОЛЬЗОВАНИЯ БЕЗАЗОТИСТЫХ ОСТАТКОВ АМИНОКИСЛОТ
1. Катаболизм всех аминокислот сводится к образованию шести соединений, являющихся метаболитами ОПК (рис. 9.14):
• пируват,
• ацетил-КоА,
• α-кетоглутарат,
• сукцинил-КоА,
• фумарат,
• оксалоацетат.
Аминокислоты, которые в ходе катаболизма превращаются в пируват или другие промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат), в итоге превращаются в оксалоацетат и используются в процессе глюконеогенеза. Эти аминокислоты образуют группу гликогенных аминокислот.
Образование глюкозы из аминокислот стимулирует гормон кортизол, который индуцирует в печени синтез ферментов глюконеогенеза, орнитинового цикла и АЛТ.
Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат или ацетил-КоА и могут быть источником кетоновых тел - кетогенные аминокислоты: Лиз, Лей.
Катаболизм ряда аминокислот приводит к образованию соединений, которые могут использоваться для синтеза глюкозы, и кетоновых тел, так как превращаются сразу в два продукта - один из метаболитов ОПК и ацетилКоА (Иле) или ацетоацетат (Три, Фен, Тир). Такие аминокислоты называют смешанными или глико-кетогенными (см. рис. 9.14).
2. Полное окисление безазотистых остатков аминокислот до углекислого газа и воды реального энергетического значения не имеет. Основной путь их использования - включение в глюконеогенез. Этот процесс усиливается при голодании и сахарном диабете.
Безазотистые остатки аминокислот используются для восполнения количества метаболитов ОПК, которое затрачивается на синтез биологически
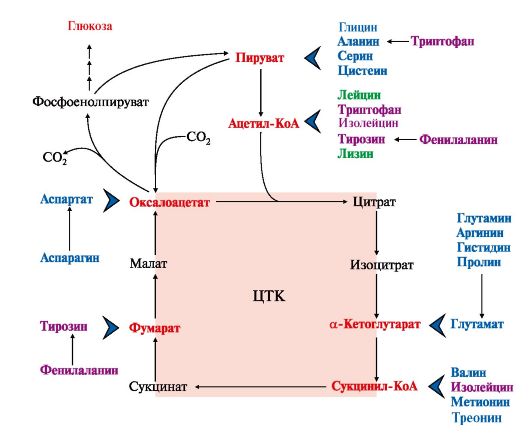 Рис. 9.14. Пути использования безазотистого остатка аминокислот
Рис. 9.14. Пути использования безазотистого остатка аминокислот
активных веществ. Такие реакции называют анаплеротическими. Можно выделить пять анаплеротических реакций:
 Последние две реакции происходят в печени.
Последние две реакции происходят в печени.
Первые две реакции являются основными анаплеротическими реакциями.
Тема 9.8. БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ
1. Углеродный скелет восьми заменимых аминокислот (Ала, Асп, Асн, Сер, Гли, Про, Глу, Глн) и цистеина может синтезироваться из глюкозы (рис. 9.15).
α-Аминогруппа вводится в соответствующие α-кетокислоты с помощью реакции трансаминирования. Универсальным донором α-аминогруппы является глутамат.
Непосредственно путем трансаминирования метаболитов ОПК с глутаматом синтезируются:
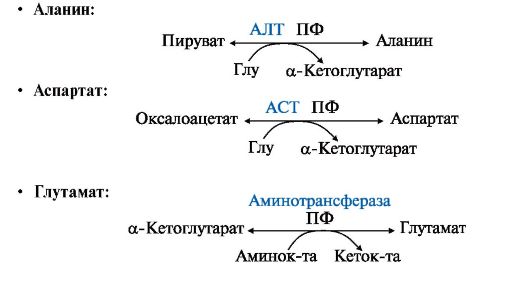
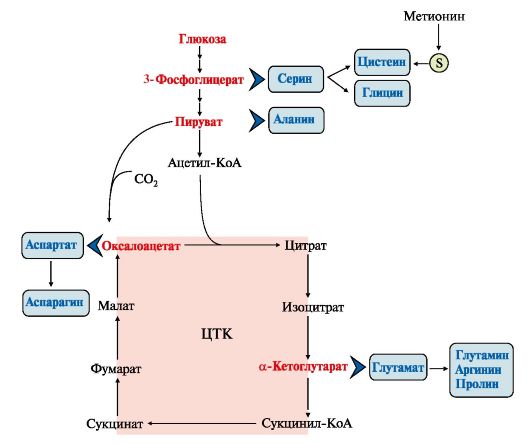 Рис. 9.15. Пути биосинтеза заменимых аминокислот
Рис. 9.15. Пути биосинтеза заменимых аминокислот
 2. Частично заменимые аминокислоты Арг и Гис синтезируются в небольших количествах, которые не отвечают потребностям организма, что особенно ощутимо в детском возрасте. Синтез аргинина происходит в реакциях орнитинового цикла. Гистидин синтезируется из АТФ и рибозы.
2. Частично заменимые аминокислоты Арг и Гис синтезируются в небольших количествах, которые не отвечают потребностям организма, что особенно ощутимо в детском возрасте. Синтез аргинина происходит в реакциях орнитинового цикла. Гистидин синтезируется из АТФ и рибозы.
Условно заменимые аминокислоты Тир и Цис образуются с использованием незаменимых аминокислот:
• фенилаланин превращается в тирозин под действием фенилаланингидроксилазы;
• для образования цистеина необходима сера, донором которой является метионин. В синтезе используются углеродный скелет и α-аминогруппа серина.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Перечислите основные источники аммиака в организме, укажите концентрацию аммиака в сыворотке крови в норме.
2. Запишите формулами основную реакцию обезвреживания аммиака в мышцах и головном мозге. Назовите фермент, укажите условия реакции.
3. Часть глутамина кровью транспортируется в почки, где под действием глутаминазы распадается на глутаминовую кислоту и аммиак. Объясните значение этой реакции для организма, для этого:
а) запишите реакцию, катализируемую глутаминазой, назовите ее активатор;
б) перечислите, в виде каких солей выводится аммиак почками;
в) укажите, какое количество солей аммония выводится почками в норме и как изменится их содержание в моче при ацидозе.
4. Напишите формулами реакцию обезвреживания аммиака, характерную только для печени. Укажите фермент, условия реакции. Какова дальнейшая судьба продукта реакции?
5. а) Перепишите в тетрадь схему глюкозоаланинового цикла (рис. 9.16), дополнив недостающие компоненты и назвав процессы, в которые вовлекаются указанные метаболиты;
б) укажите функцию глюкозоаланинового цикла;
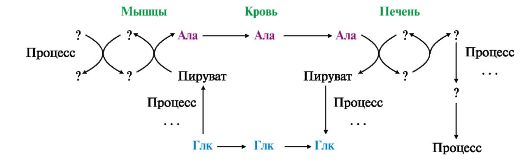 Рис. 9.16. Схема глюкозо-аланинового цикла
Рис. 9.16. Схема глюкозо-аланинового цикла
в) вспомнив тему «Обмен углеводов» (см. модуль 6), назовите еще один цикл, который функционирует между этими тканями и сопряжен с глюкозо-аланиновым шунтом.
6. Укажите, в чем заключается биологическая роль орнитинового цикла Кребса-Гезелейта. Для этого:
а) напишите схему процесса, укажите ферменты;
б) перечислите наиболее важные продукты процесса: 1 - . . , 2 - . . .
в) назовите источники атомов азота мочевины: 1 - . . , 2 - . . .
г) укажите, сколько АТФ требуется для синтеза 1 моль мочевины;
д) напишите формулами реакции, идущие с затратой АТФ, укажите ферменты.
7. Напишите схему регенерации аспартата. Укажите возможные источники азота аспартата: 1 - . . , 2 - . . .
8. а) Назовите причины первичной и вторичной гипераммониемии;
б) перечислите механизмы токсического действия высоких концентраций аммиака на организм;
в) объясните действие больших доз аргинина при аргининосукцинатурии (наследственный дефект аргининосукцинатлиазы), напишите реакции, которые происходят при поступлении аргинина.
9. Напишите схему использования безазотистого остатка:
а) Сер;
б) Лей;
в) Вал;
г) Фен.
10. Напишите анаплеротическую реакцию, в которой используется пируват, назовите фермент, кофермент. Укажите, какую роль играют анаплеротические реакции в организме.
11. Заполните табл. 9.6.
Таблица 9.6. Классификация аминокислот по использованию безазотистого остатка
Гликогенные аминокислоты | Гликокетогенные аминокислоты | Кетогенные аминокислоты |
12.Выберите правильные ответы.
а) Из метаболитов ОПК путем трансаминирования синтезируются аминокислоты:
A. Лизин Б. Лейцин
B. Аланин Г. Аспартат Д. Глутамат
б) Напишите формулами реакции синтеза выбранных аминокислот из соответствующих предшественников, назовите ферменты, коферменты.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильные ответы. Источником аммиака в организме являются:
A. Дезаминирование аминокислот Б. Катаболизм нуклеотидов
B. Инактивация биогенных аминов
Г. Процессы гниения белков в кишечнике Д. Распад мочевины
2. Выберите правильные ответы. Конечные продукты азотистого обмена:
A. Глутамин Б. Карнитин
B. Мочевина Г. Аланин
Д. Аммонийные соли
3. Установите соответствие. Фермент:
A. Карбамоилфосфатсинтетаза I Б. Глутаминаза
B. Глутаминсинтетаза
Г. Глутаматдегидрогеназа
Д. АЛТ (ГПТ)
Действие фермента:
1. Дезаминирует аланин в печени
2. Обезвреживает аммиак в печени
3. Расщепляет глутамин в почках 4. Выполните «цепное» задание:
а) при длительном голодании гормон кортизол стимулирует в тканях распад
белков. Образовавшиеся аминокислоты поступают в печень и включаются в процесс:
A. Дезаминирования Б. Гликолиза
B. Синтеза гликогена
Г. Синтеза аминокислот Д. Синтеза кетоновых тел
б) продуктом указанного процесса является:
A. Глюкоза Б. Аммиак
B. Цитрат Г. Лактат
Д. Ацетоацетат
в) это вещество в печени превращается в:
A. Глутамат
Б. Карбамоилфосфат
B. Аспартат Г. Аланин
Д. Ацетил-КоА
г) полученное соединение включается в:
A. Гликолиз
Б. Глюконеогенез
B. Орнитиновый цикл Г. Цитратный цикл
Д. Глюкозоаланиновый цикл
д) напишите схему выбранного процесса, укажите ферменты
е) в этом процессе синтезируется:
A. Глюкоза Б. Пируват
B. Мочевина Г. Глутамат Д. Ацил-КоА
ж) образовавшееся вещество:
A. Депонируется в тканях Б. Экскретируется почками
B. Выделяется с желчью в кишечник Г. В клетках окисляется до СО2 и Н2О
Д. Используется как энергетический субстрат
5. Выберите правильные ответы.
В митохондриях локализованы ферменты:
A. Карбамоилфосфатсинтетаза I Б. Аргиназа
B. Орнитинкарбамоилтрансфераза Г. Аргининосукцинатлиаза
Д. Аргининосукцинатсинтетаза
6. Выберите правильный ответ.
а) Реакцию с затратой АТФ катализирует:
A. Орнитинкарбамоилтрансфераза Б. Карбамоилфосфатсинтетаза I
B. Глутаматдегидрогеназа Г. Аргиназа
Д. Аргининосукцинатлиаза
б) напишите формулами реакцию, которую катализирует выбранный фермент.
7. Установите соответствие. Дефект фермента:
A. Орнитинкарбамоилтрансфераза Б. Аргининосукцинатлиаза
B. Карбамоилфосфатсинтетаза I Г. Аргиназа
Д. Аргининосукцинатсинтетаза Энзимопатия:
1. Гипераммониемия I
2. Цитруллинемия
3. Гипераргининемия
8. Выберите правильные ответы.
Нарушения орнитинового цикла повышают содержание в крови:
A. Аланина Б. Орнитина
B. Глутамата Г. Глутамина Д. Аммиака
9. Выберите правильные ответы.
Повышенние содержания мочевины в сыворотке крови может быть обнаружено при:
A. Усиленном распаде тканевых белков (раковая кахексия) Б. Значительном поступлении белков с пищей
B. Нарушении фильтрационной способности почек Г. Поражениях паренхимы печени (гепатит)
Д. Дефекте ферментов орнитинового цикла
10. Выберите правильные ответы.
При гиперкортицизме (повышенной секреции кортизола корой надпочечников) наблюдается:
A. Уменьшение синтеза экскретируемых белков печени Б. Индукция синтеза ферментов орнитинового цикла
B. Увеличение скорости синтеза глутаматдегидрогеназы Г. Усиление распада тканевых белков
Д. Репрессия синтеза ферментов орнитинового цикла
11. Установите соответствие. Безазотистый остаток:
A. Пируват
Б. α-Кетоглутарат
B. Сукцинил-КоА Г. Оксалоацетат Д. Фумарат
Аминокислота:
1. Глн
2. Сер
3. Асп
12. Установите соответствие. Метаболит ОПК:
A. α-Кетоглутарат Б. Сукцинил-КоА
B. Ацетил-КоА Г. Фумарат
Д. Изоцитрат
1. Образуется только из гликогенных аминокислот
2. Образуется только из кетогенных аминокислот
3. Не образуется из аминокислот
13. Установите соответствие. Предшественник:
A. Серин Б. Пируват
B. 3-Фосфоглицерат Г. Глутамат
Д. Аспартат
Аминокислота:
1. Ала
2. Про
3. Асн
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. А, Б, В, Г
2. В, Д
3. 1-Д, Г, 2-А, 3-Б
4. а) А, б) Б, в) Б, г) В, д) Схема - рис. 9.10, е) В, ж) Б
5. А, В
6. а) Б, б) рис. 9.6
7. 1-В, 2-Д, 3-Г
8. А, Г, Д
9. А, Б, В, Г, Д
10. А, Б, В, Г
11. 1-Б, 2-А, 3-Г
12. 1-А, 2-В, 3-Д
13. 1-Б, 2-Г, 3-Д
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Обезвреживание аммиака в тканях
2. Транспортные формы аммиака
3. Мочевина
4. Соли аммония
5. Гипераммониемия
6. Цитруллинемия
7. Аргининосукцинатурия
8. Гипераргининемия
9. Токсичность аммиака
10. Алкалоз
11. Гликогенные аминокислоты
12. Кетогенные аминокислоты
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ОБМЕНА АМИНОКИСЛОТ, ИЗУЧАЕМЫЕ В ДАННОЙ МОДУЛЬНОЙ ЕДИНИЦЕ
• Концентрация аммиака в сыворотке крови: 0,04-0,07 мг/дл (25-40 мкмоль/л)
• Концентрация мочевины в сыворотке крови: 15-50 мг/дл (2,5-8,4 ммоль/л)
• Суточное выведение мочевины: -25 г/сут
• Суточное выведение аммонийных солей: -0,5 г/сут
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
1. Объясните, почему при кетонемии резко увеличивается выведение солей аммония (до 10 г/сут вместо 0,5 г/сут в норме). Для этого:
а) вспомните пути обезвреживания аммиака в разных тканях (мозг, мышцы, печень);
б) назовите, в виде какой аминокислоты происходит перенос аммиака из мышц в почки; напишите реакцию ее синтеза, укажите фермент;
в) напишите реакцию, которая происходит в почках при ацидозе; назови-
те фермент, который ее катализирует;
г) объясните, какое значение имеет эта реакция для поддержания кислот-
но-щелочного баланса;
д) напишите формулы солей, в виде которых выводится аммиак при кетонемии.
2. У больного гриппом отмечается головокружение, тошнота, судорожные припадки. Содержание аммиака в крови составляет 1,0 мг/дл. Учитывая действие вируса гриппа на печень, объясните механизмы развития симптомов патологии. Для этого:
а) напишите, чему равна концентрация аммиака в сыворотке крови в норме;
б) в тетради напишите схему орнитинового цикла, отметьте место ферментного блока при гриппе;
в) перечислите вещества, которые будут накапливаться в крови больного (1 - 2 - 3 - ...);
г) перечислите механизмы токсического действия аммиака;
д) укажите, для каких клеток токсическое действие NH3 наиболее опасно.
3. Объясните, почему у больного с тяжелой формой вирусного гепатита (поражение до 80% клеток паренхимы печени) концентрация мочевины в сыворотке крови снижена и составила 1,4 ммоль/л, в моче - 16 г/сут. Для ответа:
а) назовите, в составе какого соединения выводится из организма 90% азота, укажите место его синтеза;
б) напишите схему процесса, конечным продуктом которого является это соединениие;
в) назовите вещества, концентрация которых может увеличиться в крови таких больных;
г) объясните, нужно ли ограничивать потребление белков пищи при этом
заболевании.
4. Больной аргининосукцинатурией в возрасте 22 лет вводили кетоаналоги валина, лейцина, изолейцина и фенилаланина на фоне малобелковой диеты в течение 2 недель, что вызвало снижение концентрации аммиака в плазме с 90 до 40 мкг/дл, а выведение аргининосукцината снизилось с 2 до 0,8 г в сутки. Объясните механизм лечебного действия кетоаналогов, написав соответствующие реакции и схемы.
5. Объясните, каковы причины повторяющейся рвоты, судорожных припадков с потерей сознания у 4-месячного ребенка, если в его крови обнаружена высокая концентрация цитруллина. Для этого:
а) напишите схему нарушенного процесса, на схеме покажите место ферментного блока;
б) напишите формулами реакцию, которая блокирована при данной патологии;
в) объясните механизмы развития перечисленных симптомов; укажите, как изменится суточное выделение мочевины при этой патологии;
г) предположите, как повлияет на состояние больного малобелковая диета.
6. На изолированных гепатоцитах исследовали синтез глюкозы из аминокислот. Для этого к культуре клеток добавляли различные аминокислоты и регистрировали скорость образования глюкозы. В контрольном опыте (без добавления аминокислот) скорость глюконеогенеза составляла 0,15 мкмоль глюкозы в минуту. При введении в инкубационную среду аланина, пролина и глутаминовой кислоты скорость увеличивалась до 0,17-0,18 мкмоль/мин, а при добавлении лизина или лейцина не изменялась. Объясните полученные результаты. Для этого:
а) напишите схему соответствующего процесса, используя в качестве субстрата аланин;
б) назовите, к какой группе относятся все перечисленные аминокислоты.
7. Вычислите, сколько моль аспарагиновой кислоты может образоваться из 6 моль глюкозы. Для ответа:
а) напишите схему распада глюкозы до пирувата;
б) напишите реакцию образования кетоаналога аспартата из пирувата, укажите фермент, кофермент;
в) напишите реакцию трансаминирования между глутаматом и этим кетоаналогом, укажите фермент, кофермент.
Модульная единица 3 ОСОБЕННОСТИ ОБМЕНА ОТДЕЛЬНЫХ АМИНОКИСЛОТ: СЕРИНА, ГЛИЦИНА, МЕТИОНИНА, ФЕНИЛАЛАНИНА, ТИРОЗИНА И ГИСТИДИНА. РОЛЬ ВИТАМИНОВ В12, В6 И ФОЛИЕВОЙ КИСЛОТЫ. ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ С НАРУШЕНИЕМ ОБМЕНА ФЕНИЛАЛАНИНА И ТИРОЗИНА.
СИНТЕЗ, БИОЛОГИЧЕСКАЯ РОЛЬ И ИНАКТИВАЦИЯ
БИОГЕННЫХ АМИНОВ
Цели изучения Уметь:
1. Использовать знания об обмене некоторых аминокислот (серина, глицина, метионина, фенилаланина, тирозина и гистидина) для понимания их специфических функций в организме здорового человека.
2. Объяснять причины возникновения наследственных заболеваний, связанных с нарушением обмена отдельных аминокислот (фенилкетонурия, алкаптонурия и др.).
3. Интерпретировать результаты определения креатинина в моче для оценки функционального состояния мышц и почек.
4. Объяснять значение биогенных аминов для нормального функционирования организма и молекулярные основы лечения заболеваний, связанных с изменением их содержания (болезнь Паркинсона и т.д.).
Знать:
1. Роль серина и глицина в образовании производных фолиевой кислоты, необходимых для синтеза пуриновых и пиримидиновых нуклеотидов, регенерации метионина.
2. Значение метионина как донора метильной группы для синтеза различных соединений, примеры реакций трансметилирования.
3. Особенности обмена фенилаланина, тирозина и гистидина в разных тканях.
4. Физиологические функции биогенных аминов, пути их образования и инактивации.
ТЕМА 9.9. ОБМЕН СЕРИНА И ГЛИЦИНА.
РОЛЬ ФОЛИЕВОЙ КИСЛОТЫ
Кроме путей обмена, характерных для большинства аминокислот, входящих в состав белков, почти для всех аминокислот существуют и специфические пути превращения. Рассмотрим обмен некоторых аминокислот, специфические пути превращения которых приводят к синтезу биологически важных продуктов и во многом определяют физиологическое состояние человека.
1. Серин - заменимая аминокислота, синтезируется из промежуточного
продукта гликолиза - 3-фосфоглицерата в последовательности реакций дегидрирования, трансаминирования и гидролиза под действием фосфатазы
(рис. 9.17).
В организме серин используется для синтеза:
• фосфолипидов (фосфатидилсерины, сфингомиелины);
• аминокислот (глицина, цистеина).
Основной путь катаболизма серина - его дезаминирование с образованием пирувата (см. тему 9.3).
2. Глицин образуется из серина под действием сериноксиметилтрансферазы. Коферментом этого фермента является тетрагидрофолиевая кислота (Н4-фолат),
которая присоединяет β-углеродный атом серина, образуя метилен - Н4-фолат
(рис. 9.18):
Глицин является предшественником:
• порфиринов (гема),
• пуриновых оснований,
• коферментов,
• глутатиона и др. Катаболизм глицина происходит
также с участием Н4-фолата, который связывает а-СН2-группу глицина (см. рис. 9.18).
3. Н4-фолат образуется в печени из фолиевой кислоты (фолата) с участием ферментов фолатредуктазы и дигидрофолатредуктазы (рис. 9.19). Коферментом этих редуктаз является NADPH.
Метиленовая группа -СН2- в молекуле метилен-Н4-фолата может превращаться в другие одноуглеродные группы:
 Н4-фолат способен передавать эти группы на другие соединения и играет роль промежуточного переносчика одноуглеродных групп.
Н4-фолат способен передавать эти группы на другие соединения и играет роль промежуточного переносчика одноуглеродных групп.
Одноуглеродные фрагменты используются для синтеза нуклеотидов и ряда соединений (см. рис. 9.18).
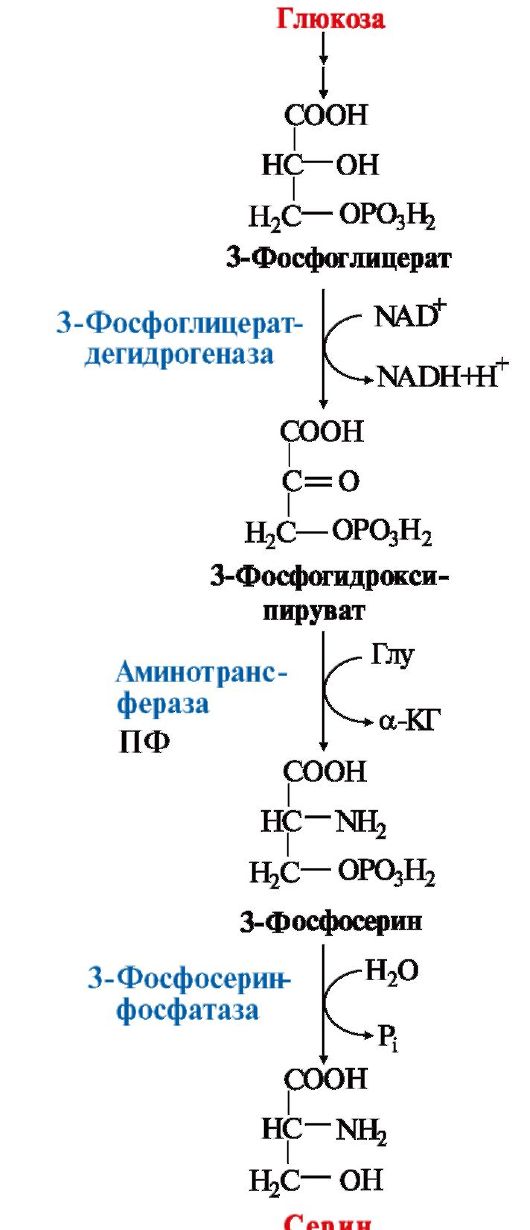 Рис. 9.17. Синтез серина из глюкозы
Рис. 9.17. Синтез серина из глюкозы
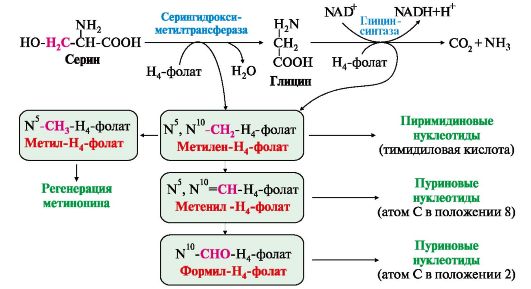 Рис. 9.18. Биологическая роль одноуглеродных групп
Рис. 9.18. Биологическая роль одноуглеродных групп
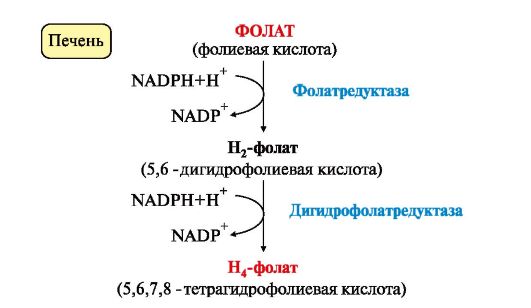 Рис. 9.19. Схема синтеза Н4-фолата в печени
Рис. 9.19. Схема синтеза Н4-фолата в печени
4. Фолиевая кислота является витамином для человека и большинства млекопитающих (витамин ВС или В9). Она широко распространена в пищевых продуктах и синтезируется бактериями кишечника. Гиповитаминоз у человека возникает достаточно редко. Причинами его могут послужить:
• неправильное питание - недостаточное потребление овощей, фруктов и мясных продуктов;
• нарушение всасывания фолиевой кислоты в кишечнике;
• гепатит, цирроз и другие поражения печени, вызывающие снижение активности фолатредуктазы.
Гиповитаминоз фолиевой кислоты приводит к нарушению синтеза нуклеиновых кислот в организме, что сказывается прежде всего на быстро делящихся клетках крови, и развитию мегалобластной анемии.
5. Многие патогенные микроорганизмы способны синтезировать фолиевую кислоту из парааминобензойной кислоты, которая является составной частью фолата. На этом основано бактериостатическое действие сульфаниламидных лекарственных препаратов, которые являются структурными аналогами n-аминобензойной кислоты:
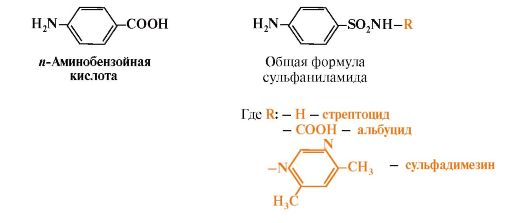 Препараты
являются конкурентными ингибиторами ферментов синтеза фолиевой кислоты у
бактерий или могут использоваться как псевдосубстраты, в результате
чего образуется соединение, не выполняющее функции фолиевой кислоты, Это
делает невозможным деление клеток, бактерии перестают размножаться и
погибают. Сульфаниламиды называют антивитаминами.
Препараты
являются конкурентными ингибиторами ферментов синтеза фолиевой кислоты у
бактерий или могут использоваться как псевдосубстраты, в результате
чего образуется соединение, не выполняющее функции фолиевой кислоты, Это
делает невозможным деление клеток, бактерии перестают размножаться и
погибают. Сульфаниламиды называют антивитаминами.
ТЕМА 9.10. ОБМЕН МЕТИОНИНА. РЕАКЦИИ ТРАНСМЕТИЛИРОВАНИЯ
1. Метионин - незаменимая аминокислота, необходимая для синтеза белков. Мет-тРНКмет участвует в инициации процесса трансляции каждого белка. Как и многие другие аминокислоты, метионин подвергается транс- и дезаминированию. Особая роль метионина заключается в том, что метильная группа этой аминокислоты используется для синтеза целого ряда соединений в реакциях трансметилирования. Основным донором метильной группы является S-аденозилметионин (SAM) - активная форма метионина, который присутствует во всех типах клеток и синтезируется из метионина и АТФ под действием фермента метионин-аденозилтрансферазы:
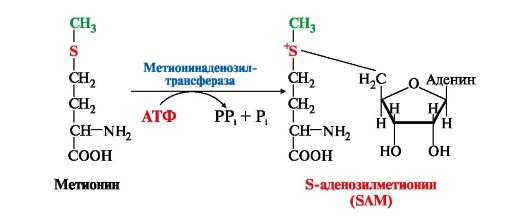 Структура -S+-CH3
в SAM является нестабильной, метильная группа легко отщепляется, что
определяет высокую способность ее к переносу на другие соединения в
реакциях трансметилирования (рис. 9.20).
Структура -S+-CH3
в SAM является нестабильной, метильная группа легко отщепляется, что
определяет высокую способность ее к переносу на другие соединения в
реакциях трансметилирования (рис. 9.20).
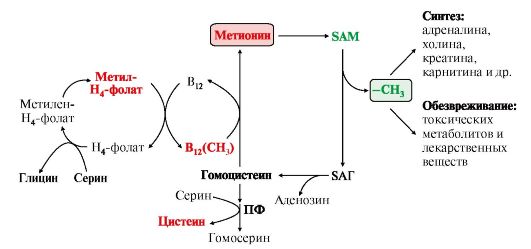 Рис. 9.20. Метаболизм метионина
Рис. 9.20. Метаболизм метионина
В реакциях трансметилирования SAM превращается в S-аденозилгомо- цистеин (SAr), который гидролитически расщепляется с образованием аденозина и гомоцистеина. Последний может снова превращаться в метионин с участием метил-Н4-фолата и витамина В12. Регенерация метионина тесно связана с обменом серина и глицина и взаимопревращениями производных Н4-фолата (см. рис. 9.20).
2. Метионин и серин необходимы для синтеза условно заменимой аминокислоты цистеина, причем в этом процессе метионин является донором атома серы. Цистеин образуется непосредственно из гомоцистеина в ходе двух реакций, которые происходят с участием пиридоксальфосфата (см. рис. 9.20). Генетический дефект этих ферментов приводит к нарушению использования гомоцистеина в организме и превращению его в гомоцистин.
Гомоцистин может накапливаться в крови и тканях, выделяться с мочой, вызывая гомоцистинурию. Заболевание сопровождается эктопией (смещением) хрусталика глаза, катарактой, остеопорозом, умственной отсталостью (-50% больных). Причиной заболевания могут служить как наследственные нарушения обмена гомоцистеина, так и гиповитаминоз фолиевой кислоты или витаминов В12 и
SАМ как донор метильной группы участвует в синтезе многих веществ (лецитина, адреналина, карнитина, ацетилхолина, креатина и др.), а также в инактивации нормальных метаболитов и обезвреживании токсических веществ в печени.
3. Синтез фосфатидилхолина (лецитина) наиболее активно протекает в печени, которая использует лецитин на построение мембран и формирование липопротеинов. Реакцию катализирует фосфатидилэтаноламинтрансметилаза.
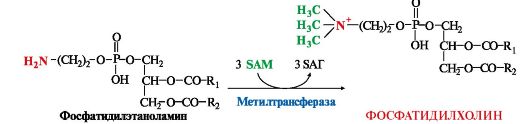 В
клетки других тканей фосфатидилхолин доставляется в составе ЛПНП.
Особую роль лецитин играет в метаболизме ЛПВП (см. модуль 8).
В
клетки других тканей фосфатидилхолин доставляется в составе ЛПНП.
Особую роль лецитин играет в метаболизме ЛПВП (см. модуль 8).
4. Синтез карнитина - переносчика ацильной группы в митохондрии - происходит путем метилирования γ-аминомасляной кислоты с участием SAM:
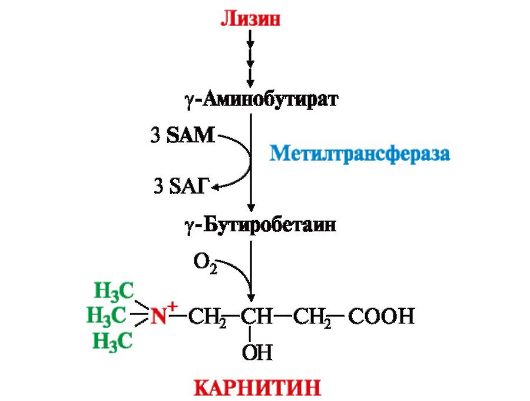 5. Синтез креатина происходит с использованием трех аминокислот: аргинина, глицина и метионина. Процесс
начинается в почках, в реакцию вступают аргинин и глицин. Образующийся
гуанидинацетат поступает затем в печень, где подвергается метилированию с
участием SAM и превращается в креатин. Из печени креатин
транспортируется в мышцы и головной мозг.
5. Синтез креатина происходит с использованием трех аминокислот: аргинина, глицина и метионина. Процесс
начинается в почках, в реакцию вступают аргинин и глицин. Образующийся
гуанидинацетат поступает затем в печень, где подвергается метилированию с
участием SAM и превращается в креатин. Из печени креатин
транспортируется в мышцы и головной мозг.
Креатин в клетках превращается в креатинфосфат - макроэргическое соединение, являющееся резервной формой энергии в мышечной и нервной тканях. Содержание креатинфосфата в покоящейся мышце в восемь раз выше, чем АТФ. Эту реакцию катализирует фермент креатинкиназа (рис. 9.21).
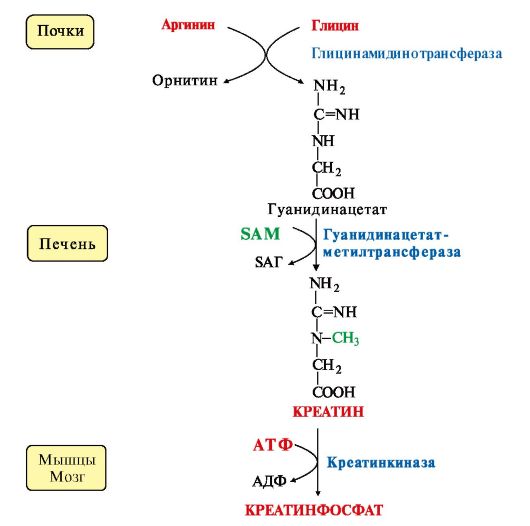 Рис. 9.21. Схема синтеза и использования креатина
Рис. 9.21. Схема синтеза и использования креатина
Креатинфосфат играет важную роль в обеспечении работающей мышцы энергией в начальный период физической работы. В работающей мышце концентрация АТФ некоторое время остается постоянной, а концентрация креатинфосфата быстро снижается. Часть образовавшегося креатина и креатинфосфата с постоянной скоростью превращается в креатинин, который выводится с мочой (норма - 1-2 г/сут, или 8,8-17,6 ммоль/л)
При уменьшении массы мышц вследствие длительного отрицательного азотистого баланса, при состояниях, ведущих к атрофии мышц, выделение креатинина снижается (голодание, острые инфекции, сахарный диабет, гипертиреоз и т.д.). Определение содержания в крови креатина и креатинина используется для диагностики заболеваний, а также как показатель эффективности работы мышц в спортивной медицине.
ТЕМА 9.11. ОБМЕН ФЕНИЛАЛАНИНА, ТИРОЗИНА И ГИСТИДИНА В РАЗНЫХ ТКАНЯХ
1. Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется ароматическое кольцо. Основная часть поступающего с пищей фенилаланина используется в синтезе тканевых белков, превращение остальной части начинается с его гидроксилирования, в результате чего образуется тирозин. Реакция эта катализируется специфической монооксигеназой - фенилаланингидроксилазой, коферментом которой является тетрагидробиоптерин (Н4-БП) (рис. 9.22).
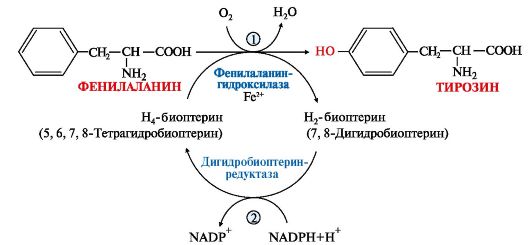 Рис. 9.22. Реакция гидроксилирования фенилаланина и регенерация тетрагидробиоптерина (Н4БП):
Рис. 9.22. Реакция гидроксилирования фенилаланина и регенерация тетрагидробиоптерина (Н4БП):
1. Реакцию катализирует фенилаланингидроксилаза (1), коферментом которой является Н4БП. Кофактором являются ионы Fe2+. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП).
2. Регенерация дигидробиоптерина (2) происходит при участии дигидробиоптеринредуктазы с использованием NADPH.
2. Тирозин - условно заменимая аминокислота. Синтезируется только из фенилаланина.
Катаболизм Фен и Тир происходит в печени. В результате ряда реакций образуется фумарат и ацетоацетат (рис. 9.23, А). Фумарат используется для синтеза глюкозы (глюконеогенез) или окисляется до СО2 и Н2О. Ацетоацетат - кетоновое тело, которое окисляется в тканях с выделением энергии. Таким образом, Фен и Тир относятся к смешанным (гликокетогенным) аминокислотам по использованию безазотистого остатка.
Превращение промежуточного продукта катаболизма Тир - гомогентизиновой кислоты - в фумарилацетоацетат сопровождается расщеплением ароматического кольца.
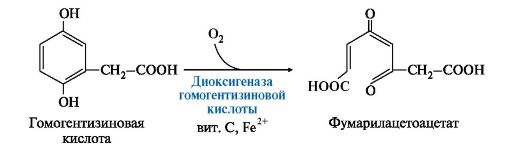 Процессы расщепления ароматических колец в биологических системах катализируются ферментами диоксигеназами. Для катализа диоксигеназам необходимы кофакторы - Fe2+ или гем (для некоторых - Сu+), а также - витамин С.
Процессы расщепления ароматических колец в биологических системах катализируются ферментами диоксигеназами. Для катализа диоксигеназам необходимы кофакторы - Fe2+ или гем (для некоторых - Сu+), а также - витамин С.
3. В мозговом веществе надпочечников и нервной ткани из тирозина синтезируются катехоламины (дофамин, норадреналин, адреналин) (рис. 9.23, В).
Тирозин под действием специфической монооксигеназы - тирозингидроксилазы превращается в ДОФА. Для протекания реакции необходимы Н4БП, О2 и Fe2+ (реакция аналогична гидроксилированию фенилаланина, см. рис. 9.22). Тирозингидроксилаза найдена только в надпочечниках и катехоламинэргических нейронах (преимущественно в их нервных окончаниях). Этот фермент является регуляторным и определяет скорость синтеза катехоламинов. Одна из функций последних - регуляция деятельности сердечнососудистой системы.
Активность тирозингидроксилазы значительно изменяется в результате:
• аллостерической регуляции по принципу ретроингибирования норадреналином;
• фосфорилирования с участием цАМР - зависимой протеинкиназы, при этом снижается Км для кофермента Н4БП и сродство фермента к норадреналину, в результате чего происходит активация тирозингидроксилазы;
• индукции синтеза фермента кортизолом.
Катехоламины выполняют очень важные функции в организме. Дофамин является медиатором среднего отдела мозга. Норадреналин - тормозный медиатор синаптической нервной системы и разных отделов головного мозга, но может выполнять функцию возбуждающего медиатора в гипоталамусе. Адреналин - гормон интенсивной физической работы, который синтезируется при стрессе и регулирует основной обмен, а также усиливает сокращение сердечной мышцы.
В щитовидной железе тирозин используется для синтеза гормонов иодтиронинов (тироксина и трииодтиронина) (рис. 9.23, Г). Подробно их функции и синтез рассматриваются в модуле 11.
В меланоцитах - пигментных клетках кожи, сетчатки глаз тирозин является предшественником пигментов меланинов (см. рис. 9.23, Б).
4. Частично заменимая аминокислота гистидин синтезируется из глутамата в сложном процессе, поскольку образование гетероциклического радикала в клетках человека и млекопитающих сопряжено с большими трудностями.
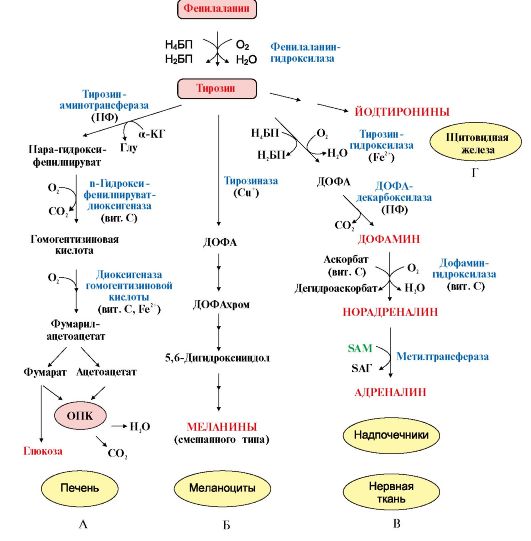 Рис. 9.23. Пути превращения фенилаланина и тирозина в разных тканях:
Рис. 9.23. Пути превращения фенилаланина и тирозина в разных тканях:
А - катаболизм фенилаланина и тирозина в печени; Б - синтез меланинов в меланоцитах; В - синтез катехоламинов в надпочечниках и нервной ткани; Г - синтез иодтиронинов в щитовидной железе
Обмен гистидина включает синтез гистамина в соединительной ткани, а также путь катаболизма, который происходит в печени и, частично, в коже человека.
В печени и коже дезаминирование гистидина катализирует фермент гистидаза. Образующийся уроканат только в печени способен превращаться через ряд стадий в глутамат. Наследственный дефект гистидазы вызывает
накопление гистидина в организме и развитие гистидинемии, которая проявляется задержкой в умственном и физическом развитии детей. Ферменты гистидаза и уроканиназа (рис. 9.24) являются гепатоспецифическими, поэтому их определение используется в клинике для диагностики поражений печени.
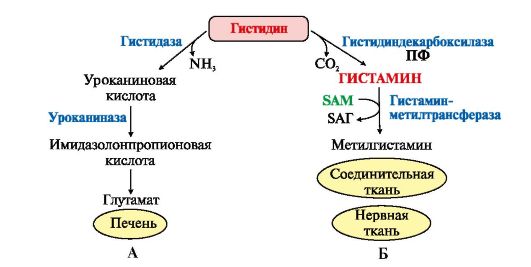 Рис. 9.24. Схема обмена гистидина в разных тканях:
Рис. 9.24. Схема обмена гистидина в разных тканях:
А - катаболизм гистидина в печени; Б - синтез и инактивация гистамина
7. Гистамин синтезируется путем декарбоксилирования гистидина в тучных клетках соединительной ткани, образует комплекс с белками и сохраняется в секреторных гранулах. Выделяется в кровь при повреждении ткани (удар, ожог, воздействие эндо- и экзогенных веществ). Гистамин выполняет следующие функции:
• стимулирует секрецию желудочного сока, слюны (пищеварительный гормон);
• обеспечивает воспалительную реакцию - расширение сосудов, покраснение кожи, отечность ткани;
• обеспечивает аллергическую реакцию;
• повышает проницаемость капилляров, вызывает отеки, снижает артериальное давление (но увеличивает внутричерепное давление, вызывает головную боль);
• сокращает гладкую мускулатуру легких, вызывает удушье;
• выполняет роль нейромедиатора.
ТЕМА 9.12. ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ С НАРУШЕНИЕМ ОБМЕНА ФЕНИЛАЛАНИНА И ТИРОЗИНА
Метаболизм фенилаланина, тирозина и гистидина в разных тканях приводит к образованию различных биологически активных соединений. Дефекты ферментов обмена этих аминокислот проявляются как наследственные заболевания (энзимопатии).
1. В печени фенилаланин метаболизируется двумя путями. Большая часть не использованного для синтеза белков Фен (до 80%) превращается в тирозин
под действием фермента фенилаланингидроксилазы при участии кофермента тетрагидробиоптерина. Небольшое его количество включается в альтернативный путь:
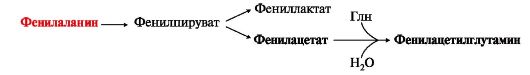 Конъюгат
фенилацетата с глутамином выводится с мочой. При нормальной активности
фенилаланингидроксилазы этот путь не имеет большого значения. Он
становится главным при нарушении превращения фенилаланина в тирозин.
Дефект фенилаланингидроксилазы приводит к заболеванию фенилкетонурии (ФКУ). Известны две формы заболевания:
Конъюгат
фенилацетата с глутамином выводится с мочой. При нормальной активности
фенилаланингидроксилазы этот путь не имеет большого значения. Он
становится главным при нарушении превращения фенилаланина в тирозин.
Дефект фенилаланингидроксилазы приводит к заболеванию фенилкетонурии (ФКУ). Известны две формы заболевания:
• классическая - наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы. Наиболее тяжелое проявление - нарушение умственного и физического развития, судорожный синдром;
• вариантная (биоптеринзависимая гиперфенилаланинемия) - следствие мутаций в генах, контролирующих метаболизм тетрагидробиоптерина (см. рис. 9.22). Клинические проявления - близкие, но не совпадающие с классической ФКУ.
Тяжелые проявления ФКУ связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата, фениллактата. Большие концентрации Фен ограничивают транспорт Тир и Три через гематоэнцефалический барьер и тормозят синтез нейромедиаторов.
Тетрагидробиоптерин (Н4БП) необходим для реакций гидроксилирования не только Фен, но также Тир и Три, поэтому при недостатке этого кофермента нарушается метаболизм всех трех аминокислот, в том числе синтез нейромедиаторов - катехоламинов и серотонина. Заболевание характеризуется тяжелыми неврологическими нарушениями и ранней смертью (злокачественная ФКУ).
2. Нарушение катаболизма Тир в печени на стадии расщепления гомогентизиновой кислоты приводит к алкаптонурии («черная моча»). Для этого заболевания характерно выделение с мочой гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует черные пигменты - алкаптоны. Алкаптоны способны откладываться в хрящевой ткани и суставах, что вызывает артриты и охроноз (черные пятна). Болезнь врожденная, связана с дефектом фермента диоксигеназы гомогентизиновой кислоты.
3. Наследственный дефект тирозиназы - фермента, катализирующего в меланоцитах превращение тирозина в ДОФА, вызывает нарушение синтеза темных пигментов меланинов, которое приводит к альбинизму. Основным клиническим проявлением альбинизма (от лат. albus - белый) являются отсутствие пигментации кожи и волос. У больных часто снижается острота
зрения и появляется светобоязнь. Длительная инсоляция таких больных приводит к ожогам и раку кожи.
4. Недостаточность дофамина в черной субстанции мозга приводит к болезни Паркинсона. Это одна из самых распространенных неврологических болезней (частота встречаемости 1:200 среди людей старше 60 лет). Характеризуется снижением активности тирозингидроксилазы или ДОФА-декарбоксилазы. Заболевание сопровождается тремя основными симптомами: акинезия (скованность движений), ригидность (напряжение мышц), тремор конечностей (непроизвольное дрожание). Дофамин не проникает через гематоэнцефалический барьер, поэтому для лечения паркинсонизма используются следующие подходы:
• заместительная терапия препаратами - предшественниками дофамина (производными ДОФА) - леводопа, мадопар, наком и др.;
• подавление инактивации дофамина ингибиторами МАО - депренил, ниаламид, пиразидол и др.
5. Депрессивные состояния часто связаны со снижением в нервных клетках содержания дофамина и норадреналина. Гиперсекреция дофамина в височной доле мозга наблюдается при шизофрении.
ТЕМА 9.13. БИОГЕННЫЕ АМИНЫ: СИНТЕЗ, ИНАКТИВАЦИЯ, БИОЛОГИЧЕСКАЯ РОЛЬ
1. Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению α-карбоксильной группы. Продуктами реакции являются СО2 и биогенные амины (табл. 9.7). Образование биогенных аминов происходит с участием ферментов декарбоксилаз в присутствии кофермента пиридоксальфосфата.
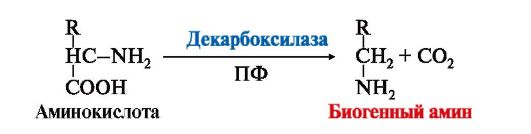 Биогенные
амины являются биологически активными веществами, выполняют функцию
нейромедиаторов (серотонин, дофамин, ГАМК), гормонов (адреналин),
регуляторных факторов местного действия (гистамин).
Биогенные
амины являются биологически активными веществами, выполняют функцию
нейромедиаторов (серотонин, дофамин, ГАМК), гормонов (адреналин),
регуляторных факторов местного действия (гистамин).
2. В нервных клетках декарбоксилирование глутамата приводит к образованию γ-аминомасляной кислоты (ГАМК), которая является основным тормозным медиатором. Инактивации ГАМК происходит либо путем трансаминирования и превращения в сукцинат, являющийся метаболитом ЦТК, либо окислительным путем под действием моноаминооксидазы (МАО)
(рис. 9.25).
 Рис. 9.25. Схема синтеза и инактивации ГАМК
Рис. 9.25. Схема синтеза и инактивации ГАМК
ГАМК в виде препаратов гаммалон или аминалон применяют при нарушениях мозгового кровообращения, умственной отсталости, эндогенных депрессиях и травмах головного мозга.
3. В нервной ткани из серина синтезируется ацетилхолин, который также относится к биогенным аминам:
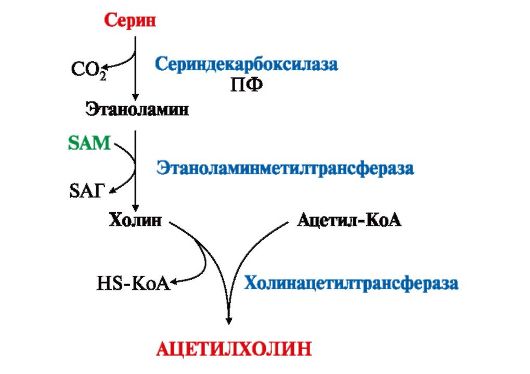 Нарушение образования ацетилхолина в синапсах может вызвать миастению - мышечную слабость.
Нарушение образования ацетилхолина в синапсах может вызвать миастению - мышечную слабость.
4. Серотонин - нейромедиатор проводящих путей, образуется в гипоталамусе, надпочечниках из аминокислоты триптофана:
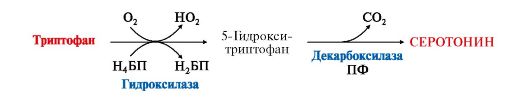 Серотонин представляет
собой биологически активное вещество широкого спектра действия. Он
стимулирует сокращение гладкой мускулатуры, перистальтику кишечника,
оказывает сосудосуживающий эффект, регулирует артериальное давление,
температуру тела, дыхание, обладает антидепрессантным действием («гормон
удовольствия»), принимает участие в аллергической реакции, поскольку в
небольших количествах синтезируется в тучных клетках.
Серотонин представляет
собой биологически активное вещество широкого спектра действия. Он
стимулирует сокращение гладкой мускулатуры, перистальтику кишечника,
оказывает сосудосуживающий эффект, регулирует артериальное давление,
температуру тела, дыхание, обладает антидепрессантным действием («гормон
удовольствия»), принимает участие в аллергической реакции, поскольку в
небольших количествах синтезируется в тучных клетках.
5. К биогенным аминам относятся и катехоламины (дофамин, норадреналин и адренамин) (см. рис. 9.23, В).
Таблица 9.7. Биологическая роль и предшественники некоторых биогенных аминов
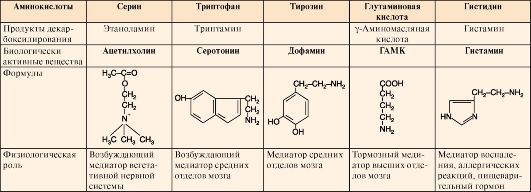 6. Инактивация биогенных аминов происходит двумя путями:
6. Инактивация биогенных аминов происходит двумя путями:
• метилирование с участием SAM под действием метилтрансфераз - характерно для гистамина, адреналина, норадреналина:
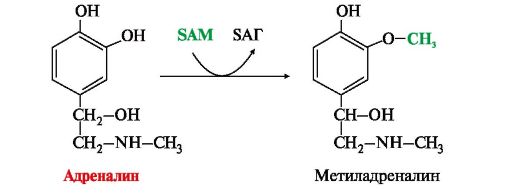 окисление ферментами моноаминооксидазами (МАО) с коферментом FAD - характерно для дофамина, норадреналина, серотонина, ГАМК.
окисление ферментами моноаминооксидазами (МАО) с коферментом FAD - характерно для дофамина, норадреналина, серотонина, ГАМК.
При окислении биогенных аминов происходит дезаминирование и образование альдегида, а затем кислоты, которые выводятся почками:
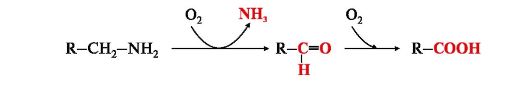 ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Проявлением гиповитаминоза фолиевой кислоты является мегалобластная анемия. Объясните, почему появляются симптомы анемии. Для этого:
а) напишите, какие производные образуются из метилен-Н4-фолата;
б) перечислите соединения, для синтеза которых они необходимы;
в) назовите ткани, на которых прежде всего скажется дефицит витамина ВС;
г) перечислите возможные причины гиповитаминоза.
2. Объясните механизм антибактериального действия сульфаниламидных лекарственных препаратов. Для этого:
а) напишите формулу фолиевой кислоты, укажите компоненты, из которых она состоит;
б) напишите формулу одного из сульфаниламидных препаратов, назовите аналогом какого соединения он является;
в) выберите правильные ответы.
Антибактериальная активность сульфаниламидных препаратов основана на том, что они являются:
A. Конкурентными ингибиторами ферментов синтеза фолата Б. Аллостерическими ингибиторами
B. Псевдосубстратами
Г. Корепрессорами синтеза ферментов образования фолата Д. Индукторами синтеза белков
г) укажите, как повлияет на антибактериальное действие сульфаниламидов добавление я-аминобензойной кислоты.
3. Объясните, в чем заключается биологическая функция метионина. Для этого:
а) напишите реакцию активации метионина;
б) перечислите процессы, в которых участвует -СН3-группа метионина;
в) перечислите аминокислоты и витамины, которые необходимы для регенерации метионина;
г) напишите реакции синтеза адреналина и креатина, в которых используется активная форма метионина. Укажите ферменты и их локализацию в организме.
4. Перечислите пути использования фенилаланина и тирозина в различных тканях:
а) напишите формулами реакции катаболизма фенилаланина в печени, укажите ферменты и коферменты;
б) обратите внимание на то, что реакция превращения фенилаланина в тирозин является основным путем его метаболизма;
в) на схеме процесса покажите места ферментных блоков, вызывающих его наследственные нарушения; назовите эти заболевания.
5. а) Напишите формулами реакции синтеза катехоламинов, укажите фер-
менты и коферменты. Запишите название тканей, в которых происходит этот процесс;
б) отметьте реакцию, в которой участвует метионин; назовите, в виде какого соединения он включается в реакцию;
в) выделите регуляторную реакцию синтеза катехоламинов, назовите фермент, кофермент; перечислите механизмы регуляции и эффекторы этого фермента.
6. Напишите формулами реакцию образования гистамина, укажите фермент, кофермент. В каких клетках она происходит? Назовите способ инактивации гистамина, напишите реакцию.
7. а) Напишите формулами реакцию образования ГАМК, укажите
аминокислоту-предшественник, фермент, кофермент;
б) напишите реакцию инактивации ГАМК окислительным путем, укажите фермент, кофермент;
в) объясните, почему ГАМК в виде препаратов аминалон или гаммалон используется в клинике при лечении заболеваний, связанных с резким возбуждением коры головного мозга.
8. а) Назовите, недостаточность какого нейромедиатора приводит к болезни
Паркинсона; напишите реакции его синтеза и инактивации, укажите ферменты и коферменты;
б) назовите лекарственные препараты и витамины, которые можно рекомендовать при болезни Паркинсона; объясните механизмы их действия;
в) объясните, почему состояние больных улучшается при приеме ингибиторов МАО.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильные ответы.
В синтезе серина из 3-фосфоглицерата участвуют следующие ферменты:
A. Фосфорилаза Б. Дегидрогеназа
B. Аминотрансфереза Г. Метилтрансфераза Д. Фосфатаза
2. Выберите правильный ответ.
В метаболизме серина и глицина участвует витамин:
A. Биотин
Б. Фолиевая кислота
B. Тиамин
Г. Пиридоксин Д. Рибофлавин
3. Установите соответствие. Процесс, реакции:
A. Реакции декарбоксилирования Б. Синтезе пуриновых нуклеотидов
B. Реакции трансаминирования Г. Регенерации метионина
Д. Синтезе тимидиловой кислоты Производные Н4-фолата участвуют в:
1. Метил-Н4-фолат
2. Метилен-Н4-фолат
3. Метенил-Н4-фолат
4. Выберите правильные ответы. Метионин в организме человека является:
A. Источником метильной группы в реакциях синтеза веществ Б. Инициатором процесса трансляции
B. Донором СН3-группы при обезвреживании соединений Г. Источником серы для синтеза цистеина
Д. Предшественником гомоцистеина
5. Выберите правильные ответы.
Для регенерации метионина необходимы витамины:
A. В1
Б. в2
B. в12
Г. Пантотеновая кислота Д. Фолиевая кислота
6. Установите соответствие. Место синтеза:
A. Печень Б. Почки
B. Надпочечники
Г. Кожа
Д. Щитовидная железа Активное вещество:
1. Меланины
2. Иодтиронины
3. Адреналин
7. Выберите правильный ответ.
Для синтеза тирозина необходим кофермент:
A. Пиридоксальфосфат Б. Н4-фолат
B. FADH2 Г. NADH
Д. Н4БП
8. Установите соответствие. Фермент:
A. Фенилаланинтрансаминаза Б. Фенилаланингидроксилаза
B. Тирозингидроксилаза Г. Дофамингидроксилаза Д. ДОФА-декарбоксилаза
Реакция:
1. Синтез тирозина
2. Образование ДОФА
3. Синтез дофамина
9. Установите соответствие. Биогенный амин:
A. Ацетилхолин
Б. ГАМК
B. Серотонин Г. Дофамин
Д. Норадреналин Аминокислота-предшественник:
1. Глутамат
2. Серин
3. Триптофан
10. Выполните «цепное» задание:
а) незаменимой аминокислотой является:
A. Глу Б. Асп
B. Мет
Г. Сер
б) активная форма этой аминокислоты образуется при взаимодействии с:
A. Ацетил-КоА
Б. УТФ
B. HS-КоА
Г. АТФ
в) образованный продукт участвует в реакции:
A. Трансаминирования Б. Декарбоксилирования
B. Трансметилирования Г. Трансацилирования
г) эта реакция является последней в синтезе:
A. Адреналина Б. Дофамина
B. Аргинина
Г. Гомогентизиновой кислоты
д) полученное вещество синтезируется в:
A. Мозге
Б. Корковом слое надпочечников
B. Печени
Г. Поджелудочной железе
Д. Мозговом слое надпочечников
е) напишите формулами заключительную реакцию, которая происходит только в названном органе.
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. Б, В, Д
2. Б
3. 1-Г, 2-Д, 3-Б
4. А, Б, В, Г, Д
5. В, Д
6. 1-Г, 2-Д, 3-В
7. Д
8. 1-Б, 2-В, 3-Д
9. 1-Б, 2-А, 3-В
10. а) В, б) Г, в) В, г) А, д) Д, е) см. рис. 9.23
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Фолиевая кислота (витамин Вс)
2. Одноуглеродные производные фолиевой кислоты
3. Мегалобластная анемия
4. Сульфаниламидные препараты
5. Активная форма метионина
6. Трансметилирование
7. Регенерация метионина
8. Биогенные амины
9. Катехоламины
10. Фенилкетонурия
11. Алкаптонурия
12. Альбинизм
13. Болезнь Паркинсона
14. Гистидинемия
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ОБМЕНА АМИНОКИСЛОТ, ИЗУЧАЕМЫЕ В ДАННОЙ МОДУЛЬНОЙ ЕДИНИЦЕ
• Содержание креатинина в моче здоровых людей: 8,8-17,6 ммоль/л
• Суточное выделение креатинина: 1-2 г (эта величина прямо пропорциональна массе мышц)
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. Больной, страдающий туберкулезом, проходил длительное лечение антибиотиками. В результате у него появились симптомы дисбактериоза и анемии (диарея, рвота, слабость, головокружение). Обследование показало снижение общего количества эритроцитов в крови пациента, увеличение их объема наряду с уменьшением содержания в них гемоглобина. Объясните причины указанных нарушений. Для этого:
а) укажите роль микрофлоры кишечника в обеспечении организма человека витамином, недостаточность которого приводит к нарушению метаболизма эритроцитов;
б) назовите заболевание, которое является первым проявлением недостаточности этого витамина;
в) напишите схему реакции превращения витамина в кофермент и представьте схему образования производных этого кофермента;
г) перечислите функции указанных соединений.
2. При обследовании пациента оказалось, что концентрация креатинина в моче составляет 30 ммоль/л (при норме 8,8-17,6 ммоль/л). Назовите, какую патологию можно предположить у этого больного, для ответа:
а) перечислите аминокислоты - предшественники креатинина;
б) напишите схему образования креатинина и укажите органы, которые участвуют в этом процессе;
в) укажите, при каких патологиях повышается содержание креатинина в моче.
3. Творог содержит все незаменимые аминокислоты. Известно, что при жировом перерождении печени больным рекомендуют употреблять в пищу много творога. Объясните, почему такая диета может улучшить состояние больного. Для этого:
а) назовите частицы, участвующие в транспорте триацилглицеролов из печени; перечислите компоненты, входящие в их состав;
б) напишите реакцию синтеза холина и укажите, какая из незаменимых аминокислот необходима для этого;
в) напишите формулу фосфолипида, в состав которого входит холин.
4. Развитие сердечно-сосудистых заболеваний иногда сопровождается повышением в крови уровня гомоцистина. При этом повышается уровень тромбообразования, формируются атеросклеротические бляшки. Гомоцистин оказывает также токсическое действие на нервную систему, гомоцистинурия отмечается при деменции и болезни Альцгеймера. Табакокурение, злоупотребление кофе повышают уровень гомоцистина в крови. Уровень его понижается при комплексной витаминотерапии витаминами ВС, В12,B6 Объясните механизм лечебного действия витаминов при гомоцистинурии. Для этого:
а) назовите аминокислоту, в процессе превращения которой в клетках образуется гомоцистеин и гомоцистин;
б) изобразите схему ресинтеза этой аминокислоты;
в) на схеме отметьте реакции, в которых участвуют перечисленные витамины;
г) перечислите биологические функции названной аминокислоты, напишите реакцию ее активации, укажите фермент;
д) приведите примеры использования активированной аминокислоты для синтеза биологически активных соединений.
5. У новорожденного ребенка в роддоме обнаружили на мокрых пеленках темные пятна. При обследовании в моче обнаружено большое количество гомогентизиновой кислоты. Объясните возможную причину наблюдаемого нарушения. Для ответа:
а) назовите соединения, накапливающиеся в моче больного, укажите, при каком заболевании наблюдается такой симптом;
б) напишите схему метаболического пути, в котором это соединение является промежуточным метаболитом; укажите ферменты и кофакторы;
в) назовите фермент, отсутствие которого является причиной заболевания;
г) используя материалы учебника (модуль 3), укажите тип мутации в гене этого фермента.
6. У ребенка 1,5 месяца содержание фенилаланина в крови составляет 34 мг/дл (норма 1,4-1,9 мг/дл), содержание фенилпирувата в моче - 150 мг/сут (норма 8-10 мг/сут). Предположите, какой патологии соответствуют результаты анализа крови и мочи. Для ответа:
а) назовите причину данного заболевания;
б) напишите реакцию, которая блокирована при данном заболевании;
в) напишите схему альтернативного пути метаболизма субстрата.
7. Пожилой пациент страдает болезнью, ранее известной как «дрожательный паралич». Основными ее симптомами являются напряжение мышц, скованность движения, непроизвольное дрожание рук и головы. Предположите, каким заболеванием страдает данный пациент. Для ответа:
а) назовите причину заболевания;
б) напишите реакции, скорость которых снижена в этом случае;
в) перечислите подходы к лечению этой патологии в медицинской практике; назовите соответствующие препараты, применяемые при лечении, и механизм их действия.
8. Для лечения депрессий легкой и средней тяжести, сопровождающихся тревожными состояниями, для улучшения настроения и повышения психической и физической активности используют препараты Деприм, Негрустин, содержащие сухой экстракт зверобоя продырявленного (Hypericum perforatum). Установлено, что основные действующие вещества препаратов - гиперицин, флавоноиды - повышают количество серотонина в клетках мозга, ингибируя МАО. Объясните механизм терапевтического действия Деприма. Для этого:
а) укажите место синтеза и функции серотонина в организме;
б) напишите схему синтеза и инактивации серотонина, назовите ферменты и коферменты;
в) назовите вещества, содержание которых может повышаться в нервной системе при приеме ингибитора МАО; назовите аминокислоты - их предшественники.