Онкология: учебник для вузов / Вельшер Л.З., Матякин Е.Г., Дудицкая Т.К., Поляков Б.И. - 2009. - 512 с.
|
|
|
|
ГЛАВА 6. ОБЩИЕ ПРИНЦИПЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Своевременная и квалифицированная диагностика злокачественных опухолей определяет во многом успех излечения. По словам нашего замечательного соотечественника онколога-хирурга Б.Е. Петерсона (1977): «Успехи в противораковой борьбе зависят в основном от работы первичных поликлинических лечебных учреждений. Важно, чтобы на самом первом этапе обращения больного в поликлинику, были предприняты все меры для исключения или подтверждения злокачественной опухоли». Этот замечательный ученый высказывал еще мысль о том, что подозрение на опухоль при ее отсутствии менее опасно человеку, чем ошибочное лечение другого процесса при наличии опухоли. Одной из характерных особенностей течения большинства злокачественных опухолей является отсутствие (или крайняя скудость) симптоматики на ранних стадиях. В то же время лечебные мероприятия наиболее эффективны именно в начальном периоде заболевания, когда размеры опухоли минимальны и нет распространения на другие органы, поэтому проблема выявления пациентов с ранними стадиями патологического процесса - одна из основных в онкологии. Темпы роста зависят от гисто- логического строения и индивидуальных особенностей опухоли и организма. Это доказывает необходимость выявить опухоли на прединвазивных стадиях развития, что возможно только при диспансерном наблюдении больных с предопухолевыми заболеваниями.
Катастрофически
обстоит дело со своевременной диагностикой опухолевой патологии в
России. Опухоли распознаются преиму- щественно в далеко зашедшей
стадии. Доля больных с опухолевым процессом I-II стадии, выявленных в
скрытым течением болезни, но чаще связано с неинформированностью населения, низким культурным и социальным статусом. Анализ клинической ситуации в России показывает, что в половине случаев врачебных ошибок врач «первичного контакта» не владел приемами общего клинического обследования и не смог вовремя диагностировать опухоль.
Но, кроме того, следует отметить, что, несмотря на адекватные и вовремя предпринятые усилия врачей по диагностике и лечению злокачественных опухолей, существует некоторое количество больных (процент известен для каждого вида и локализации опухоли), у которых очень скоро наступает диссеминация опухоли. В таких случаях неуспех в лечении определяют как биологические свойства самой опухоли, ее изначальная агрессивность, так и особенности организма. Как правило, это свойственно низкодифференцированным, инфильтративно растущим опухолям, которые характеризуются наиболее агрессивным течением и требуют соответствующих лечебных подходов.
Подозрение на опухолевую патологию возникает и у больного, и у врача при появлении опухолевидных образований на коже, в полости рта или припухлости на поверхности различных отделов человеческого тела. Хотя такие явные изменения не всегда сопровождают наличие опухолевой болезни, эти случаи так называемых визуальных локализаций не представляют собой диагностических трудностей. Несвоевременная диагностика таких опухолей при своевременном обращении больного к врачу определяет недостаточную квалифика- цию последнего. Следует учесть, что среди опухолей головы и шеи к визуальным относят и те, которые невидимы невооруженным глазом, но хорошо определяются при непрямой фаринго- и ларингоскопии.
Трудно переоценить роль ультразвукового исследования, эхотомографии в визуализации опухолей многих локализаций, в том числе опухолей головы и шеи. В последнее время быстро развивается распознавание заболеваний ранних стадий щитовидной и молочной желез с помощью ультразвуковых методик. Ультразвуковое исследование, ставшее рутинным в настоящее время в онкологии, особенно значимо на поликлиническом этапе обследования. С его помощью выявляется первичная опухоль и можно достаточно подробно оха- рактеризовать ее (распространенность, генерализация, соотношение с соседними анатомическими структурами). Исследование может быть проведено как через кожу, так и с применением специальных
внутриполостных датчиков (эндовагинального, трансректального, интраоперационного). Исследование с использованием эффекта Допплера позволяет оценить просвет сосудов, скорость кровотока в магистральных сосудах и в новообразованных.
Интраоперационное исследование позволяет получить наиболее достоверную информацию о состоянии оперируемого органа и опухоли в нем, так как исключены физические помехи от окружающих тканей, датчик располагается непосредственно на исследуемой области, при этом выявляются непальпируемые образования, достоверно оценивается истинная распространенность опухоли.
Намного сложнее распознать опухолевое заболевание за жалобами не столь явными. Опухоли могут сопровождаться появлением и развитием самых разнообразных симптомов. Рак может также при- водить к появлению общих симптомов в виде температуры, повышенной утомляемости, похудания. Это может быть вызвано опухолевой интоксикацией за счет веществ, изменяющих обменные процессы в организме и снижающих иммунный статус пациента.
Признаки и симптомы зависят от морфологического строения, размеров опухоли, ее месторасположения и от того, насколько вовлечены в процесс окружающие органы или структуры. По мере роста опухоль сдавливает близлежащие органы, кровеносные сосуды и нервы, что спровоцирует появление некоторых признаков и симптомов, свидетельствующих о поражении органа. В случае распространения (метастазирования) рака симптомы могут возникнуть в различных частях организма. Если опухоль располагается в особо важной области, например в некоторых частях головного мозга, то даже рак малого размера может давать раннюю симптоматику. Онкологам известны типичные проявления большинства часто встречающихся опухолей. Нередко опухоль замечается самим пациентом, пальпируется через кожу или определяется на поверхности в виде язвы, утолщения, изменившегося родимого пятна и т.д. Кровотечения и другие выделения (слизистые, гнойные) могут появиться из естественных отверстий на фоне раннего или запущенного рака. Кровь в мокроте бывает признаком рака легкого, в кале - признаком рака толстой или прямой кишки. Кровотечение из влагалища может явиться признаком рака шейки матки или самой матки. Кровь в моче может свидетельствовать о возможном раке мочевого пузыря или почки. Выделение крови из соска может быть признаком доброкачественной или злокачественной опухоли молочной железы. Известно, что
нередко опухоли проявляются общесоматическими симптомами (артериальное давление повышается при апудомах, некоторых обра- зованиях щитовидной железы). Наиболее типична общая симптоматика для опухолей центральной нервной системы.
Однако иногда опухоль возникает в таких местах, когда симптомы могут не появляться до тех пор, пока она не достигнет больших размеров. Рак поджелудочной железы невозможно определить с помощью наружного осмотра. Некоторые опухоли этой локализации не дают симптомов до той поры, пока они не вовлекают в процесс нервы. Тогда развиваются боли в спине. Другие опухоли растут около желчного протока, приводя к изменению цвета кожи (желтухе). К сожалению, многие виды рака внутренних локализаций проявляются, когда он уже бывает распространенным (предстательная железа, почка, толстый кишечник и др.).
Опухоль может проявляться некоторыми общими, не специфическими признаками и симптомами. Из них наиболее частыми являются беспричинное похудание, повышенная температура, утомляемость, боль и изменения цвета и других признаков на коже. Повышение температуры часто наблюдается при распространенном процессе. Почти у всех онкологических больных лихорадка отмечается на каком-либо этапе болезни, особенно если лечение оказывает влияние на иммунную систему и повышает восприимчивость к инфекциям. Повышение температуры редко бывает ранним признаком опухоли, например это достаточно ранний признак при болезни Ходжкина (лимфогранулематозе).
Повышенная
утомляемость, слабость чаще является признаком прогрессирования
заболевания, однако может возникнуть и на раннем этапе, особенно если
рак вызывает хроническую потерю крови, что встречается при раке толстой
кишки, желудка, опухолях матки. Необъяснимое похудание на 4-
Боль чаще всего - симптом распространенного процесса. Некоторые виды рака внутренних органов могут вызывать видимые кожные признаки в виде потемнения кожи (гиперпигментации), пожелтения (желтухи), покраснения (эритемы), зуда или избыточного роста волос, избыточной кератинизации (см. «Паранеоплазии»).
Иногда опухолевые клетки выделяют вещества в кровоток, которые вызывают симптомы, обычно не характерные для опухоли. Например, некоторые опухоли поджелудочной железы вырабатывают вещества,
приводящие к образованию тромбов в сосудах нижних конечностей. Некоторые виды рака вырабатывают гормоноподобные вещества.
В онкологической практике предлагается каждый случай затрудненной диагностики рассмотреть с точки зрения возможного скрыто протекающего онкологического заболевания. Полноценно визуализируются с помощью ультразвукового исследования почки, печень, органы малого таза. Этот метод стал рутинным и высокоэффективным при обследовании всех зон регионарного метастазирования при любой локализации опухоли (шея, подмышечные области, забрюшинное пространство), так как он выявляет метастазы в субклини- ческой стадии. Эхография позволяет получить максимум информации о патологических состояниях в брюшной полости и способствует активному выявлению опухолей яичников в группах риска, дифференциальной диагностике, определению распространенности заболевания, мониторингу эффективности проводимого лечения. Более специфичные симптомы, которыми проявляются опухолевые пора- жения конкретного органа, следует выяснять при сборе анамнеза.
Опухоли наружных локализаций проявляются чаще в виде раны или язвы: рак кожи, рак полости рта, рак полового члена или вла- галища. Опухоли внутренних органов вызывают нарушение их функции, требующие обследования. Нарушение пищеварения или затрудненное глотание, изменения характера стула или функции мочевого пузыря требуют использования лучевых методов обследования. Длительный непрекращающийся кашель может быть призна- ком рака легкого. Охриплость - возможный признак рака гортани или щитовидной железы.
Необходимо при подозрении на опухолевую патологию обследовать все зоны, сопряженные с жалобами, подвергнуть морфологическому исследованию все сомнительные участки доступных обзору слизистых и кожи, визуализировать их, используя возможности УЗИ, рентгенологических методов, а также учесть возможную иррадиацию болевых ощущений или парестезий. Так, боли по ходу тройничного нерва могут быть вызваны патологией в верхнечелюстной пазухе или в нижней челюсти. Головные боли могут быть связаны со сдавлением опухолью сонных артерий. Четко локализованные односторонние головные боли, нарушения подвижности языка, охриплость и другие неврологические нарушения могут быть связаны с новообразованием в глубоких зонах лица, в челюстях, щитовидной железе или в толще слюнных желез и т.д.
Обследование онкологического больного проводится по традиционному плану. При сборе анамнеза требуется выяснить нет ли хронических заболеваний, обратить внимание на изменение симптомов, возможность воздействия канцерогенных факторов в быту или на производстве, наследственную предрасположенность к опухолям и т.д. Врач должен выделить возможные симптомы опухоли и акцентировать внимание на их давности, динамике, степени проявления в момент обследования. По предъявляемым жалобам можно ори- ентироваться, какой орган или систему органов требуется обследовать в первую очередь. Тщательный сбор анамнестических данных позволяет, как правило, заподозрить опухоль и ориентироваться в направленности и последовательности назначаемого обследования. Для опухоли характерно постоянное нарастание жалоб, изредка с временным улучшением самочувствия, как правило, на фоне приема противовоспалительных средств и антибиотиков.
Врач обязан обследовать больного при малейшем подозрении на опухоль. Наблюдение пациента не допустимо, следует подтвердить или отвергнуть онкологический диагноз, объективизировать свои представления о заболевании. Обследование в неспециализированном учреждении преимущественно должно иметь только цель обнаружения опухоли, с тем, чтобы не затягивать обращение к специалисту. Детальное обследование, определяющее морфологический диагноз, распространенность процесса, возможности лечения, следует проводить в специализированной онкологической клинике.
Клиническая картина злокачественного образования зависит от органа, в котором возникла опухоль, от локализации в нем, формы роста, морфологической характеристики и распространенности опухолевого процесса. Размер и консистенция опухоли зависят от исходной ткани, скорости роста, наличия очагов некроза, кист, отложений извести, что связывается обычно с нарушением кровоснабжения опухоли или проведением лучевой и химиотерапии.
При наружных локализациях опухолей ведущими являются приемы физикального обследования: осмотр и пальпация. Необходимо тщательно осмотреть кожные покровы и видимые слизистые, обследовать доступные пальпации лимфатические узлы. Оцениваются величина и расположение очага, подозрительного в отношении опухоли, относительно жизненно важных анатомических структур. В области головы и шеи это сосудисто-нервный пучок, основание черепа и позвоночник, а также соседствующие с очагом поражения
органы головы и шеи. Далее следует обследовать зоны регионарного метастазирования и зоны возможного гематогенного распространения. Наиболее часто при локализации опухолей в области головы и шеи отмечается поражение отдаленными метастазами легких, поэтому рентгенологическое обследование легких является обязательным при направлении на консультацию к онкологу. Чрезвычайно важным является выполнение условия полного клинического осмотра любого онкологического больного. В практике наших онкологических учреждений, как правило, полный осмотр осуществляется специа- листами соответствующего профиля.
При опухолевой патологии внутренних органов жалобы носят общий характер: изменение самочувствия, снижение общего тонуса в виде вялости, утомляемости, может появиться отвращение к какому-либо виду пищи, снижение аппетита. Врачу нередко приходится сталкиваться с множественной патологией. Симптомы одной болезни могут быть изменены другим патологическим процессом или предшествующим лечением. Классический синдром дискомфорта («синдром малых признаков»), описанный А.И. Савицким, следует вспомнить при разговоре с каждым пациентом, затрудняющимся изложить свои жалобы. Известен факт, когда онкологический больной скрывает проявления своей болезни. Сокрытие симптомов от самого себя - свидетельство того, что больной сам подозревает у себя развитие серьезной патологии.
Вначале проводится методичная пальпация пораженного органа и периферических лимфатических узлов, позволяющая охарактеризовать их количество, плотность, соотношение с соседними органа- ми, например с магистральными сосудами шеи, основанием черепа, позвоночником, распространение в грудную полость или прорастание кожи. При физикальном обследовании больных с локализацией процесса во внутренних органах часто уже полный внимательный и квалифицированный осмотр устанавливает правильный клинический диагноз.
Полный осмотр совершенно необходим и потому, что видимое проявление болезни в онкологической практике может быть симптомом поражения весьма отделенного органа, симптомом не онкологического заболевания или нескольких болезней. В отношении опухолевой патологии особенно должно настораживать появление патологических выделений из естественных отверстий: носа, мочеполовых путей, соска молочной железы и т.д., периодическое появление примеси крови
в них. Таким же знаковым признаком являются симптомы нарушения проходимости полых органов. Не нужно забывать о частом наличии у онкологического больного проявлений паранеопластических синдромов (кожных, неврологических, эндокринных и т.д.).
С точки зрения структуры опухоли делятся на доброкачественные и злокачественные, последние, в свою очередь, различают по степени злокачественности. Доброкачественные опухоли характеризует наличие капсулы, экспансивный рост. Распространение в направлении здоровых тканей сопровождается сдавлением или раздвиганием последних. Для доброкачественных опухолей характерно наличие в клетках большинства признаков специфичных для данного органа, медленный рост и, следовательно, при морфологическом исследова- нии обнаруживается мало клеток, находящихся в стадии митоза. Эти опухоли не дают метастазов.
При злокачественных опухолях типично отсутствие капсулы, характерно проникновение клеток в ткани за видимые границы опухоли (инфильтрирующий рост), опухолевая ткань формирует недиф- ференцированные анаплазированные конгломераты, утратившие признаки исходного органа. При морфологическом исследовании отмечается интенсивное размножение (много митозов). Клинически отмечается быстрый рост и появление вторичных опухолей - метастазов.
Выделяют еще опухоли с так называемым деструирующим ростом, которые имеют некоторые черты злокачественных опухолей. К таким опухолям относятся, например, базалиома и десмоид. Они не имеют капсулы, склонны к рецидивам после удаления, но не дают метастазов.
В прогнозе далеко не все определяется принадлежностью опухоли к доброкачественному или злокачественному варианту. Некоторые злокачественные опухоли развиваются десятилетиями (некоторые варианты рака щитовидной железы, карциноиды), в то же время доброкачественные опухоли, как правило, большого размера, расположенные вблизи жизненно важных органов, могут быть неоперабельными.
От истинных опухолей следует отличать некоторые объемные образования, часто симулирующие опухоль, но не имеющие к опухолям отношения. Это кисты, представляющие собой полости в ткани органа, имеющие капсулу и наполненные различным жидкостным содержимым.
Опухолеподобные поражения в силу частой необходимости дифференциальной диагностики обычно находят свое отражение в классификациях органных опухолей. Сюда относят также пороки развития, дисгормональные гиперпластические процессы, очаги избыточной регенерации. Кисты следует отличать от кистом. В назва- нии отражена опухолевая природа последних. Так, в виде слившихся между собой множественных кист развиваются серозные и муцинозные опухоли. Дифференцировать их в начальных стадиях развития возможно только при гистологическом исследовании. Гамартома - опухолевидное локальное разрастание тканей, характерных для данного органа. Эти образования занимают промежуточное положение между пороками развития и доброкачественными опухолями. К ним относят гемангиомы, лимфангиомы, аденомы печени и др.
При изучении
данных, полученных после инструментального обследования, и
сопоставлении их с клиническими проявлениями следует исходить из
возможных вариантов роста опухоли. В зависимости от варианта роста
опухоли как наружной, так и внутренней локализации появляется
соответствующая симптоматика. На самых ранних этапах развития
злокачественная опухоль представляет собой ограниченное количество
клеток, проросших базальную мембрану, но не распространяющихся за
пределы ткани, из которой она возникла. Такой рак применительно к
внутренним органам называют ранним, размеры его невелики - 1,0-
6.1. ФОРМЫ РОСТА ОПУХОЛИ. СПОСОБЫ ИНСТРУМЕНТАЛЬНОГО ОБСЛЕДОВАНИЯ
Более объемные экзофитные опухоли выявляются пальпаторно при наружных локализациях или в виде дефекта наполнения полого органа при его контрастировании (пищевод, желудок, кишечник, мочевой пузырь). Природное контрастирование - воздушный столб в просвете органа (гортань, трахея, носоглотка) - также используется в приемах рентгенологической диагностики. При опухоли просвет
органа меняет свою конфигурацию. Плотность разных анатомических образований имеет разную ультразвуковую, магнитно-резонансную и рентгенологическую контрастность, что также используют в диагностике (структуры и желудочки мозга, печень и просвет желчного пузыря, опухоли в толще мягких тканей, просвет сосудов и т.д.).
Кроме опухолей, сопровождающихся увеличением объема тканей в определенном месте, новообразовательные процессы могут сопро- вождаться уменьшением объема тканей, что обычно сопровождается изъязвлением, наличием незаживающих ран. Опухоль как бы пронизывает весь орган, границы ее размыты, определяются крайне нечетко (эндофитные опухоли). Чаще можно отметить признаки экзо- и эндофитной опухоли в одном образовании. И, наконец, как вариант эндофитного роста могут быть опухоли, не изменяющие в значитель- ной степени поверхность кожи или форму стенок полых органов, а лишь инфильтрирующие их. Это уменьшает эластичность тканей, смещаемость или подвижность их и нарушает функцию органов, особенно если орган имеет двигательные свойства за счет подлежащей мышечной ткани (гортань, стенка желудка и др.).
По мере дальнейшего роста любого из указанных вариантов опухоли отмечается ее распространение в глубоко лежащие слои и в окружающие ткани. Одновременно или позже появляются метастазы в регионарных лимфатических узлах (лимфогенное распространение) и отдаленных органах (гематогенная диссеминация). После общего осмотра складывается решение, какие органы и системы органов, какими способами, в каком порядке необходимо обследовать. В первую очередь применяют наиболее информативные методы, тогда надобность в остальных отпадает сама собой.
Все виды инструментального обследования сводятся к визуальной оценке распространенности опухолевого процесса и соотношения его с жизненно важными структурами. Любой метод обследования может быть охарактеризован в применении к данному конкретному виду опухоли по нескольким критериям. Вероятность положительного результата какого-либо диагностического метода при наличии болезни называется чувствительностью метода, а вероятность отрицательного результата в отсутствие болезни - специфичностью. Диагностический метод безупречен, если и чувствительность, и спе- цифичность его равны 100%, но такой результат возможен только при использовании методики, определяющей конкретный вид опухоли. Существует также характеристика методик обследования по эффек-
тивности, информативности и др., когда с помощью этих методов оценивается онкологический или другой диагноз. Обследование с помощью инструментальных методов должно быть четко систематизировано и методически оправдано.
С этой точки зрения оцениваются все существующие в конкретном учреждении методы обследования. Термография - метод интроскопии, фиксирующий инфракрасное излучение, испускаемое обследуемым объектом. Этот метод демонстрирует интенсивность обменных процессов в той или иной области человеческого тела. В ряде случаев с его помощью удается дифференцировать доброкачественные и злокачественные опухоли, определить распространенность опухолевого процесса, распознать рецидив и метастазы при динамическом наблюдении за больными. Термография применяется при обследовании больных с опухолями больших слюнных и щитовидной желез, ЛОР-органов, при лимфопролиферативных заболеваниях. Метод термографии в настоящее время практически не используется, так как другие варианты инструментального обсле- дования дают больше информации. Соответствующую информацию получают, используя сначала ультразвуковые и рентгенологические методы исследования, а также эндоскопию.
Ультразвуковое исследование основано на физическом эффекте отражения ультразвукового излучения от границы между различными по плотности тканями, при этом воспринимаемая разница в акустической сопротивляемости в современных приборах крайне мала (около 1%), а чувствительность метода велика (рис. 6.1). Использование эффекта Допплера вносит неоценимый вклад в современную всестороннюю диагностику злокачественных опухолей. В основе этого эффекта лежит закономерность, заключающаяся в том, что частота отраженного звука увеличивается при приближении предмета (форменные элементы крови) и уменьшается при его удалении. Это позволяет проследить естественное движение некоторых жидкостей (крови, мочи) внутри организма. Исследование этим способом позволяет оценить уровень кровоснабжения опухоли, соотношение опухоли с магистральными кровеносными сосудами, выявить их смещение, деформацию и даже прорастание, наличие тромбов и т.д. (рис. 6.2). В ряде случаев этот способ обследования позволяет избежать такого инвазивного способа обследования, как селективная артериальная ангиография, применение которой порой сопряжено с опасными осложнениями.
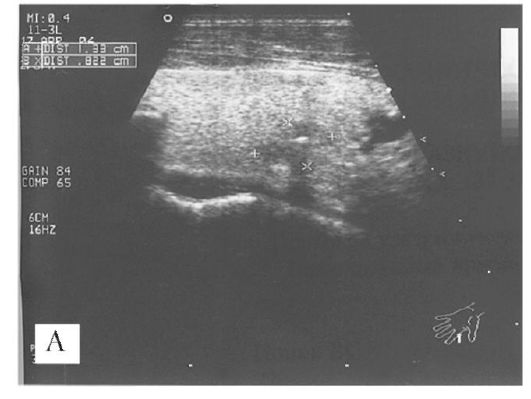
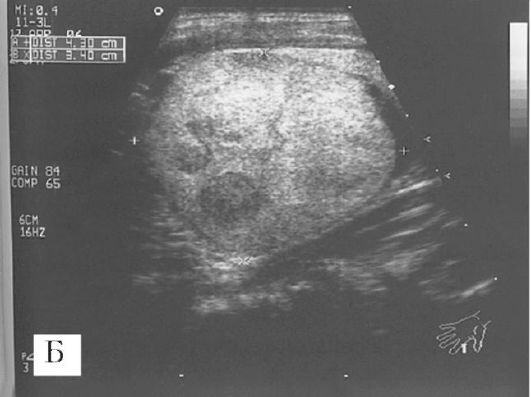
Рис. 6.1. А - УЗИ при раке щитовидной железы. Микрокальцинат с распространением измененного участка (ультразвукового изображения опухоли) за пределы кальцинировавшейся капсулы. Границы опухоли нечеткие. Б - аденома щитовидной железы: объемное образование занимает почти всю долю железы, четко отграничено от оставшихся здоровых участков доли
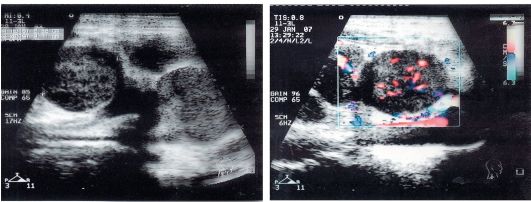
Рис. 6.2. УЗИ с эффектом Допплера. Метастазы рака носоглотки в лимфатические узлы шеи. Прослеживается уровень кровоснабжения в метаста- тическом узле
Эндоскопические методы исследования показали свою эффективность в диагностике ранних форм рака полых органов - желудка, пищевода, легкого. Невозможно переоценить значение эндоскопического метода для морфологического подтверждения диагноза. При эндоскопии полых органов для оценки состояния его слизистой оболочки прибегают к хромоэндоскопии. Для окрашивания поверхности слизистой используют р-р Люголя (шейка матки), индигокармин или
раствор метиленового синего (слизистая желудка, толстой кишки). Эти методы позволяют точнее визуализировать границы участков измененного эпителия.
Кроме диагностики новообразований органов желудочно-кишечного тракта, верхних дыхательных путей, трахеобронхиального дерева, мочевыделительной системы (цистоскопия), женских половых органов, разработаны и широко применяются в клинической онкологии торакоскопия, лапароскопия. Они позволяют осмотреть органы грудной и брюшной полостей, оценить состояние плевры и брюшины, а при наличии их опухолевого поражения взять биопсийный материал для цитологического и гистологического исследований.
При необходимости назначают интраскопические инвазивные методики: медиастиноскопию, супрареноскопию и ретроперито- неоскопию, которые выполняют под наркозом. Медиастиноскопия позволяет оценить состояние клетчаточного пространства и лимфатических узлов переднего и центрального средостения, передней и боковых поверхностей трахеи, крупных бронхов, сосудов средостения и при наличии опухолевой патологии произвести биопсию. Супрареноскопию и ретроперитонеоскопию предпринимают с целью ревизии надпочечников и прилежащей забрюшинной жировой клетчатки с лимфатическими узлами при их вовлечении в опухолевый процесс с целью биопсии и морфологического подтверждения диагноза. С помощью эндоскопических методов осуществляют динамическое наблюдение за излеченными больными.
Современные способы обследования существенно расширили возможности своевременного распознавания опухолей. Лучевая диаг- ностика решает множество задач как при первичном обследовании, так и в процессе лечения и наблюдения за больными. Выявляются характер новообразования и метастазов первичного процесса и рецидивов. Пункция и биопсия под контролем лучевых методов позволяют обеспечить прицельный забор материала практически из любого участка тела.
Рентгенологическое обследование является одним из основных в диагностике опухолевых образований внутренних органов (легкого) и всех полых органов (пищевода, желудка, кишечника, почки, мочевого пузыря). Стали рутинными такие приемы рентгенологического исследования, как обзорная рентгенография и рентгенотомография, которые основаны на различии поглощения рентгеновского излучения разными тканями человеческого тела.
Инвазивные методы исследования следует назначать по строгим показаниям. Так, при подозрении на богато кровоснабжаемую опухоль, прорастание магистральных сосудов шеи, когда ставится вопрос о сосудистой пластике, может быть назначена селективная ангиография сосудов различных отделов тела человека. Целесообразность назначения инвазивных методов исследования должна выражаться в четкой формулировке предположительного диагноза, чтобы при исследовании велись прицельные поиски объективных проявлений данной болезни.
Серьезным этапом в проведении детального обследования внутренних органов стала компьютерная томография (КТ). По
сути, это вариант рентгенологического обследования, при котором с помощью компьютера можно по плоскостным срезам воспроизводить структуру органа в нужном направлении и всесторонне изучать распространенность опухоли, детально оценить состояние костных структур. Возможна многоплоскостная реконструкция изображения. Особенно эффективна техника компьютерной реконструкции образований из тканей определенной плотности, например опухолей, и исключение (компьютерная прозрачность) нормальных тканей. Эта техника позволяет продемонстрировать соотношение опухоли и наиболее ответственных анатомических структур (рис. 6.3).
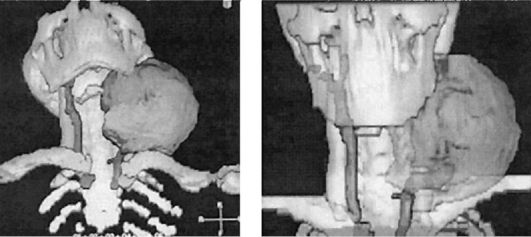
Рис. 6.3. На реконструированном компьютерном изображении можно проследить соотношение внеорганной опухоли шеи и магистральных сосудов шеи. Большая протяженность обеих ветвей общей сонной артерии расположена в толще опухоли
Новый этап визуализации внутренних органов связан с внедрением в практику магнитно-резонансной томографии (МРТ). Отличием метода является высокое естественное контрастирование мягких тканей, визуализация всей интересующей области: малый таз, средостение, область глубоких зон лица и головного мозга и т.д. Работа приборов магнитно-резонансных томографов основана на следующем явлении. В магнитном поле непарные ядра атомов, в частности водорода, создают радиочастотное излучение. Ядра водорода слабо полимеризованы и входят в состав многих сложных биологических соединений в мягких тканях. Будучи помещенными в сильное магнитное поле, они ориентируются по направлению внешнего магнитного поля. Этот факт ориентации, или прецессии, регистрируется прибором, отражая различные физические свойства тканей, через которые пропускается радиочастотный импульс. Для этого исследо- вания ни воздух, ни костные структуры не являются препятствием. Магнитно-резонансная томография прекрасно зарекомендовала себя для изучения мягкотканных структур организма.
Велика роль лучевых методов в осуществлении лечения и проведении контроля в процессе наблюдения. Особенно большую роль в процессе лучевой терапии играет компьютерная томография. Топометрия является важнейшим моментом для планирования различных видов лечения. Особенно значима в этом отношении трехмерная компьютерная реконструкция зоны поражения. С ее помощью осуществляется визуализация опухоли, определение ее объема и соотношения с окружающими органами и тканями, что позволяет планировать лучевую терапию и определить границы полей облучения.
Некоторые лечебные приемы также не осуществимы без лучевых методов (эмболизация обильно кровоснабжаемых опухолей, проведение катетера в артерию для внутриартериальной химиотерапии и др.). Лучевые методы позволяют также точнее планировать объем и тактику предстоящего хирургического вмешательства.
6.2. КЛАССИФИКАЦИИ ОПУХОЛЕЙ. КЛАССИФИКАЦИЯ TNM
Уточненная диагностика опухолевого процесса подразумевает получение исчерпывающих представлений о первичной опухоли и ее метастазах, если они есть. Первичная опухоль в зависимости от
морфологического строения характеризуется при формулировании диагноза описательно: морфологический вид и локализация. Например, невринома шеи окологлоточной области. Для хирурга важно учесть соседство с окружающими органами и тканями даже при доброкачественном характере новообразования. Результаты, получаемые при обследовании, следует трактовать исходя из возможных вариантов роста опухолей. В случае локализации процесса во внутренних органах вопрос о возможности радикальной операции или об ее объеме нельзя решать лишь на основании пальпаторных и визуальных данных. В формулировке диагноза после проведенного обследования учитываются все полученные данные, процесс подлежит определенной систематизации, классификации.
Каждая опухоль обладает автономностью и индивидуальными особенностями, включая гистогенез, биологическую активность и клинические проявления. Для характеристики опухолей имеются различные классификации, в которых определение места конкретной опухоли позволяет максимально точно судить об ее наиболее типичных свойствах.
Сначала классифицируют опухоли по месту развития первичного процесса (по органам). Развиваются характерные клинические признаки и типичная симптоматика. Затем опухоль характеризуют по гистогенетической принадлежности: из эпителиальных клеток развивается рак, из клеток мезенхимальных тканей - саркома, из клеток гемопоэтической и иммунной системы - системные опухолевые заболевания. Наконец, опухоли могут иметь множественное гистогенетическое происхождение.
Но особенности развития опухоли у данного человека и некоторые индивидуальные черты конкретной опухолевой массы описать в классификационных характеристиках невозможно. Об этом можно судить лишь в процессе наблюдения и оценивать по ответам на тот или иной вариант лечения и/или по динамике возникновения и развития или по отсутствию рецидива и метастазов.
В онкологической практике очень важно придерживаться единой классификации, чтобы получаемые научные данные и рекомендации, разработанные для лечения различных новообразований, были понятными и применимыми одинаково в разных странах. В середине ХХ века утверждена отечественная классификация по стадиям. Поскольку она достаточно часто упоминается в научных изданиях приведем принципы ее построения. Для I стадии характерны огра-
ничение процесса поверхностными тканями органа, малые размеры первичного очага и отсутствие метастазов, как регионарных, так и отдаленных. При II стадии опухоль большего, чем при первой стадии, размера прорастает в подлежащие ткани и дает единичные метастазы в регионарные лимфатические узлы. При III стадии опухоль значительных размеров, ограниченно смещаема в связи с прорастанием подлежащих тканей, дает метастазы в регионарные лимфатические узлы. Для IV стадии заболевания, независимо от размеров опухоли, характерны отдаленные, гематогенные метастазы.
Международная
классификация ТNМ является основной в современной клинической
практике. Она была разработана Р. Denoix (Франция) в период с 1943 по
1952 гг. В нашей стране эта классификация введена с 70-х гг. ХХ в. Она
наиболее точно кодирует распространенность опухоли. Кроме того, ее
применение необходимо для получения сравнимых результатов диагностики и
лечения, получаемых исследователями и практикующими врачами в разных
клиниках. В разработке международной классификации онкологических
заболеваний участвовали ведущие онкологические учреждения разных стран.
С течением времени в классификацию вносят определенные изменения и
добавления. Последняя классификация онкологических заболеваний МКБ-О (по
разделу «Онкология») издана в
Желательно верифицировать и вариант строения опухоли, так как часто способ лечения зависит от получения этих предварительных данных, например медуллярный рак щитовидной железы лечат иначе, чем папиллярный вариант рака. Мелкоклеточный рак легкого требует обязательного использования полихимиотерапии в отличие от немелкоклеточного рака, для которого обычно используется комбинация облучения и операции. По окончании очередного этапа лечения, например при выписке из стационара, к формулировке диагноза добавляется фраза: «Состояние после (первого этапа или радикального курса) лучевого или хирургического лечения, полихимиотерапии и др.» В соответствии в современными классификациями следует указывать распространенность опухоли по TNM, без такого указания диагноз злокачественного новообразования является неполным.
Развивающиеся множественные опухоли разного строения в любом органе оцениваются отдельно. В случае развития нескольких
опухолей одной структуры стадию опухоли оценивают по наибольшему опухолевому узлу. По мере получения результатов углубленного исследования стадия процесса может меняться, но после проведе- ния радикального или паллиативного лечения стадию менять нельзя. Кроме того, в диагнозе следует указать осложнения, которые наступили после хирургического вмешательства. К последствиям операции относят осложнения, развившиеся в течение 4 нед после нее.
Повторные оперативные вмешательства, выполненные после «пробных» торакотомий и лапаротомий, сделанных в неспециализированных лечебных учреждениях, свидетельствуют о частом завы- шении стадии заболевания. Важно совместное изучение инструментальной семиотики новообразования исследующим специалистом и особенно хирургом, что позволяет последнему детализировать представление об опухоли и предстоящей операции. Срочное цитологическое или гистологическое исследование позволяет определить более четко границы опухоли, характер измененных лимфоузлов и других тканей. Речь идет не только об опухолях желудка, толстой кишки, легкого, почки, забрюшинных внеорганных опухолях, но и об опухолях слизистой оболочки полости рта, гортани, внеорганных опухолях шеи и др.
Злокачественные первичные опухоли в зависимости от морфологического строения обычно характеризует символ «Т» по Международной классификации ВОЗ (TNM). Если градация по такой символике не предусмотрена, то также пользуются описательным принципом (например, эстезионейробластома полости носа и носоглотки с распространением на придаточные пазухи и основание черепа). Также надо определить интраорганное распространение опухоли и переход ее на соседние органы и структуры. Переход опухоли на соседние органы диктует выполнение комбинированного оперативного вмешательства. Нужно помнить также о возможности внутриорганного метастазирования, характерного, например, для первичного рака печени и легкого, а также для рака щитовидной железы. Отмечены случаи мультифокального роста опухоли на слизистой оболочке полости рта. Вариант имплантационного метастазирования: «целующиеся» опухоли голосовых складок при раке гортани. При наличии нескольких опухолевых узлов в пределах одного органа символ Т определяют по наибольшему опухолевому узлу. Множественный характер опухолей (m) указывают в скобках при обозначении символа Т, также возможно указание количества
опухолей [Т3(m) или Т3(5)]. Если опухоли развиваются одновременно в двух органах (молочные железы, почки, слюнные железы), то символ Т классифицируется раздельно в обоих органах. В некоторых случаях, когда до операции невозможно распознать степень инвазии опухоли (матка, желудок, кишечник и др.) послеоперационная оценка категории рТ имеет большое значение для определения необходимости дополнительного лечения и прогноза заболевания. Окончательная оценка распространенности процесса, прорастание в соседние органы и ткани, наличие отдаленных метастазов, как пра- вило, осуществляется в ходе хирургического вмешательства.
Состояние регионарных лимфатических узлов обозначено символом «N» по классификации TNM. Знание путей лимфооттока от пораженного органа позволяет подробно изучить зоны регионарного метастазирования до операции и определить наличие метастазов или их отсутствие в регионарных лимфатических узлах. При метастазах наружных локализаций следует оценить символ «N» в соответствии с уровнем поражения - N123 Дополнительную информацию о состоянии регионарных лимфатических узлов дают УЗИ и радиоизотопное исследование. Пункция или биопсия лимфатического узла позволяет морфологически подтвердить метастатический характер поражения.
Важным этапом диагностики является оценка возможного гематогенного и имплантационного (отсевы по брюшине, плевре) распространения опухоли (символ М). В последней версии классификации TNM введен индекс Х, который применяют в случаях, когда размер первичного очага, поражение регионарных лимфатических узлов и наличие отдаленных метастазов определить по тем или иным причинам невозможно, кроме того, изменена градация пораженных лимфатических узлов. Для символа Т некоторых локализаций имеется 2 подраздела: а - без поражения жизненно важных органов, что определяет резектабельность опухоли, b - прорастание опухоли в жизненно важные органы и ткани (крупные сосуды, паренхиматозные органы). Мультифокальные опухоли обозначаются знаком m. Дополнительно введена гистологическая градация (G - степень дифференцировки клеток). Наличие или отсутствие остаточной опухоли (опухолевой ткани) после лечения обозначается символом R. Это отражает эффективность лечения, влияет на планирование дальнейшего лечения и является важным фактором прогноза. К необязательным категориям относят: L - инвазия лимфатических
сосудов, V - инвазия вен, C - клиническая достоверность (отражает достоверность классификации с учетом использованных диагностических методов).
Все местно распространенные опухоли головы и шеи с символом Т4 поделены на Т4a (возможна операция) и Т4Ь (нерезектабельная опухоль). Кроме того, есть градация Т4с - при наличии отдаленных метастазов. Для обозначения поражения регионарных лимфоузлов верхней части шеи используется индекс U, нижней части шеи - индекс L.
Если пути лимфогенного метастазирования достаточно хорошо известны, то пути гематогенного метастазирования опухолей намного менее закономерны. Известно, что при раке молочной железы метастазы чаще всего локализуются в костях, печени, легких, головном мозге. Опухоли органов желудочно-кишечного тракта чаще метастазируют в печень, забрюшинные лимфоузлы, яичники у женщин. Рак легкого метастазирует в печень, кости, головной мозг. Несмотря на отсутствие симптоматики, свидетельствующей о поражении какого-либо из этих органов, обычно все группы лимфатических узлов внутренних локализаций и внутренние органы, для которых характерно метастатическое поражение, обследуют до начала лечения. Для диагностики метастазов в отдаленные лимфоузлы и органы используют те же методы, что и для диагностики первичных опухолей этих локализаций. При исключении отдаленных метастазов обозначают символ М0. При подтверждении метастазов - М1.
В ряде случаев прибегают к таким специфическим способам обследования, как радиоизотопное исследование и лимфосцинти- графия. Радионуклеиды или меченые ими биологические субстраты, имеют свойство накапливаться в разных органах и тканях. После введения такого радиофармпрепарата анализу подвергается его пространственное и временное распределение с помощью гамма-камеры или «радиощупа». Все методы позволяют получать количественную, функциональную или биохимическую информацию. За счет этого выявляются интересующие объекты. Например, в результате реакции с моноклональными антителами, меченными 99Тс (иммуносцинтиграфия), выявляются рак яичников, молочной железы и др.
Некоторые сложные биохимические вещества, меченные изотопом, включаются в тот или иной обменный процесс, позволяя визу- ально оценить функциональное состояние органа (динамическая нефросцинтиграфия).
6.3. СПОСОБЫ МОРФОЛОГИЧЕСКОЙ ВЕРИФИКАЦИИ ОПУХОЛЕЙ
Для морфологического исследования используются различные методы забора материала. Соскобы и мазки-отпечатки с поверхностных изъязвленных опухолей являются очень распространенным способом диагностики в практике обследования больных с опухолями головы и шеи. При поверхностно расположенных узловых образованиях выполняется их пункция. При малых размерах подозрительных в отношении опухолевого роста образований возможно выполнение пункции под контролем УЗИ. Тканевую принадлежность опухоли установить тем легче, чем доброкачественнее опухоль, так как в структуре доброкачественной опухоли сохраняется много черт исходной ткани. Отрицательные результаты цитологического исследования не редкость в практике отделений опухолей головы и шеи. Это бывает связано либо с солидным характером опухолей и трудностями фрагментации клеток (саркомы, невриномы), либо с затруднением трактовки полученного материала, так как в виду множественности закладок жаберных дуг бывает сложно установить тканевую принадлежность опухолевых клеток. В неясных случаях прибегают к проведению иммуногистохимических, электронно-микроскопических исследований, иногда выявляющих дополнительные морфологические признаки, позволяющие сопоставить опухоль с исходной тканью.
В настоящее время при обнаружении опухоли внутренних органов возможно осуществить морфологическое исследование практи- чески в любой части тела. Во многих случаях доступ осуществляется с помощью эндоскопической техники. Медиастиноскопия - метод визуального инструментального исследования переднего средостения. Можно проникнуть в плевральную полость и выполнить биопсию плевры и легочной ткани (медиастиноплевроскопия) при соче- танном поражении легких и лимфатических узлов средостения. Во время медиастиноскопии возможно удаление паратрахеальных кист, кистоподобных образований и небольших опухолей вилочковой железы. Ретроперитонеоскопия позволяет осуществить забор материала из этой области. В тех случаях, когда непосредственный визуальный доступ невозможен или сопряжен с большим риском (при патологии сосудов), пункция или трепанобиопсия осуществляются под контролем УЗИ или КТ. Таким образом, становятся доступными для обследования опухоли щитовидной железы, средостения, пери-
ферических отделов легких, печени, почек, поджелудочной железы, внеорганные забрюшинные опухоли и др. Если пункцию выполнить невозможно, используют эндоскопические методы исследования: фаринго- и ларингоскопию, эзофагогастродуоденоскопию, торакоскопию, бронхоскопию, колоноскопию и др., в ходе которых под визуальным контролем обычно забирают участок ткани (биоптат или браш-биоптат - соскоб специальной щеточкой, смывы с поверхности образования и т.д.) для морфологического исследования. Эти способы обычно дают достаточно материала для морфологической верификации диагноза. Наиболее информативный материал получают из участков опухоли на границе со здоровой тканью.
Открытая биопсия опухоли выполняется, как правило, после неудачных попыток верифицировать диагноз вышеуказанными методами или из-за необходимости получить больше ткани для выполнения некоторых специфических исследований, например для определения рецепторов гормонов при опухолях молочной железы, иммуногистохимического исследования при гематосаркомах. Биопсия инцизионная предполагает получение участка ткани непо- средственно из патологического очага, выполняется под местной анестезией (из опухоли молочной железы, мягких тканей) или под наркозом (из костных опухолей). Биопсия эксцизионная выполняется как хирургическое вмешательство с удалением опухоли в пределах здоровых тканей. Трепанобиопсия в основном используется для исследования новообразований молочной железы, костей, мягкотканных опухолей. При невозможности верифицировать злокачественность опухоли на диагностическом этапе планируют срочное гистологическое исследование во время операции.
При подозрении на метастазы внутренних локализаций во внутрибрюшных, забрюшинных, внутригрудных лимфоузлах символ «N» первоначально характеризуется градацией «х», что обозначает невозможность оценить их состояние. Хотя на современном этапе развития диагностических методов появилась возможность до операции достаточно подробно охарактеризовать состояние лимфатических узлов. При глубоком расположении очага положение иглы контролируют с помощью УЗИ или рентгенологически.
Гистологическая верификация может быть получена при использовании специальной иглы или трепана, при этом изымается столбик измененной ткани, пригодный для гистологического исследования. Особенно важным в плане адекватной диагностики распространен-
ности опухолей бывает исследование сомнительных по клиническим данным образований в зонах регионарного метастазирования. В большинстве же случаев сопоставление клинических проявлений опухоли с ее симптомами вне основного очага не требует верификации всех обнаруженных метастазов. Производят морфологическое исследование наиболее доступных вторичных опухолей, что само по себе делает ясным представление об истинной распространенности заболевания. Верификация диагноза осуществляется путем чрезкожной пункции метастаза или забора материала при лапароили торакоскопии.
Основная задача морфологической диагностики - установить тканевую принадлежность опухоли (гистогенез), при этом тщательно оценивается степень атипии самой клетки и нарушение тканевых структур. В большинстве случаев диагноз устанавливается по традиционно приготовленным препаратам, изучаемым при световой микроскопии.
6.4. МЕТОДИКА ЗАБОРА МАТЕРИАЛА ДЛЯ ЦИТОЛОГИЧЕСКОГО ОБСЛЕДОВАНИЯ
Для цитологического исследования используют клеточный материал, взятый из опухоли. Для этого используют отпечатки с поверхности изъязвленной опухоли, пункцию опухолей, жидкостное содержимое опухолей и кистозных полостей. Исследуются любые естественные выделения: моча, мокрота, пунктат и жидкостное содержимое верхнечелюстных или лобных пазух. Жидкости подвергают центрифугированию, осадок исследуется. В ряде случаев цитологическому исследованию подвергается мазок с биоптата или с операционного препарата, когда требуется срочное морфологическое заключение.
Учитывая, что от контакта с водой и слюной клетки опухоли разрушаются, следует избегать контакта исследуемого материала с ними. Для забора материала используют только стерильный сухой инструмент: скальпель, игла, шприц, предметное стекло. Обилие элементов крови в пунктате затрудняет его изучение.
Техника забора материала с язвы состоит в следующем. Поверхность изъязвленных опухолей освобождают от струпов, при обильном кровоснабжении в исследуемой области пережимают приводящие сосуды и производят отпечаток с поверхности опухолевой
язвы. Можно скальпелем царапающими движениями аккуратно снять поверхностные слои с поверхности язвы и распределить их тонким слоем по предметному стеклу. С опухолей, выявляемых при эндоскопическом исследовании, материал для цитологического исследования забирают специальной щеточкой-скарификатором (браш-биоптат). Биопсийный материал при эндоскопии берут специальными цапками, затем с поверхности биопсированного кусочка ткани производится цитологический мазок.
Пункция опухолей, расположенных под неизъязвленной кожей или слизистой оболочкой, может быть произведена в нескольких направлениях (обычно в трех) с учетом того, что самые агрессивные и жизнеспособные клетки располагаются ближе к поверхности опухоли. При обильном кровоснабжении опухоли можно пережать магистральный сосуд к данному региону или «обескровить» данный участок путем прижатия опухоли к подлежащей кости.
Методика аспирационной биопсии при всей своей простоте требует определенного навыка. Аспирационная биопсия - манипуляция хирургическая. От техники забора материала, обработки и окраски препарата зависит результативность изучения цитологического мазка врачом-цитологом и нередко достоверность результатов. У взрослых пункция выполняется, как правило, без дополнительной анестезии. У детей исследование поверхностных образований проводят с обезболиванием, а пункцию опухолей грудной клетки, малого таза, забрюшинного пространства - с применением масочного наркоза и использованием релаксантов.
Аспирационная биопсия позволяет получить цитологический материал более чем в 90% случаев и решить вопрос о наличии опухолевого процесса. Опухоли малого размера пунктируют под контролем УЗИ. Диагностическое значение имеют только положительные результаты пункции, а отрицательные данные часто не исключают наличие опухоли. В таких случаях, решая вопрос о дальнейших шагах для исключения опухоли, руководствуются клиническими данными. Повторять пункционное обследование больше трех раз обычно нецелесообразно. При отсутствии убедительных данных о морфологической природе опухоли планируют биопсию.
Диагностические операции являются частым диагностическим приемом в онкологии. К ним прибегают, когда исчерпаны все другие возможности уточнить диагноз. Она необходима также, когда требуется более подробное, чем при цитологическом исследовании, изу-
чение структуры опухолей, исследование некоторых биохимических свойств ее - рецепторы, иммуногистохимия и др.
Выполнение пункции не дает гарантии повреждения соседних органов или крупных сосудов с последующими осложнениями. В труднодоступных областях (опухоль печени под куполом диафрагмы) исследование крайне затруднено.
«Сторожевой», или сигнальный, лимфатический узел также относительно новое понятие в онкологии. Считается, что лимфатический отток из любого участка тела осуществляется в преимущественном направлении и, следовательно, должен существовать некий «сторожевой» лимфатический узел, через который проходит основной поток лимфы. В этих лимфатических узлах возникают первые метастазы злокачественных опухолей соответствующих органов и тканей. При выявлении метастаза в сторожевом лимфатическом узле более вероятно поражение других лимфатических узлов. Если сторожевой лимфатический узел интактен, то другие лимфоузлы с большой долей вероятности также интактны.
Распознавание локализации одного или нескольких лимфатических узлов, через которые осуществляется преимущественный отток лимфы из определенного органа или участка тела, активно разрабатывается в настоящее время в клинической онкологии. Для большинства локализаций опухолей по клиническим наблюдениям установлены пути преимущественного первичного лимфооттока. Для органов головы и шеи это также достаточно ясно. Например, при локализации рака в передних отделах полости рта и языка первые метастазы развиваются в лимфатических узлах подбородочного и подчелюстных треугольников. Для рака задних отделов полости рта, нёбных миндалин регионарным лимфатическим узлом первого порядка является подчелюстной лимфоузел гомолатеральной сто- роны, рак гортани и гортаноглотки в первую очередь метастазирует в лимфоузел у места впадения лицевой вены во внутреннюю яремную. При раке носоглотки первые метастазы реализуются в верхней группе яремной цепочки лимфатических узлов. Эти данные позволили разработать некоторые варианты фасциально-футлярного иссечения клетчатки шеи в зависимости от локализации первичной опухоли. Выявление микрометастаза в сторожевом лимфатическом узле свидетельствует о реализации метастатического процесса и необходимости активных лечебных мероприятий для эрадикации метастазов.
Потребность проследить конкретный вариант лимфооттока возникла в связи с частым развитием субклинических метастазов при таких видах опухолей, при которых не ясно, где возможно развитие метастазов в первую очередь. Например, при развитии опухоли кожи (меланомы, рака) в средних отделах туловища метастазы равным образом могут появиться как в подмышечных областях, так и в подвздошных. Первоначально такое исследование проводилось при раке молочной железы и меланоме кожи. Для поиска «сторожевых» лимфатических узлов был предложен метод непрямой контрастной лимфоангиографии с радиоактив- ным модифицированным технецием (99mТс). Лимфатические узлы 1-го порядка, накопившие радиофармпрепарат, выявляются при исследовании в гамма-камере, или во время операции мобильным «радиощупом». В настоящее время предпринимаются активные поиски выявления сигнальных лимфатических узлов при разных опухолях. Следует сказать, что обнаружение сигнальных лимфатических узлов для органов головы и шеи имеет объективные трудности в связи с близким расположением первичного очага и лимфоузлов первого порядка. Доказательство отсутствия изменений в них позволит избежать дополнительных этапов специфи- ческого противоопухолевого лечения, как правило, включающего достаточно обширное хирургическое вмешательство.
«Радикальность» - термин, часто употребляемый в онкологии. Под этим термином понимается полнота удаления первичной злокачественной опухоли или зон ее регионарного, т.е. лимфогенного метастазирования. Представление о радикальности в онкологии всегда условно, так как даже с помощью самых новейших методов не всегда есть возможность диагностировать скрыто развивающийся очаг заболевания, или его диссеминацию. Можно говорить только о клинических данных, определяющих радикальность проводимого лечения. Степень радикальности оценивают непосредственно после окончания запланированного консилиумом первичного лечения: операции или курсов полихимиотерапии или лучевой терапии. После операции для внутренних локализаций одновременно уточняют и распространенность опухоли (стадию), и радикальность выполненного хирургического вмешательства. Обнаружение признаков опухоли по краю резекции свидетельствует о не радикальной операции. Часто это исследование выполняется в ходе хирургического вмешательства. Биологическая радикальность оценивается в
процессе наблюдения за больным, через 5-10 лет, при этом оценка стадии заболевания изменяться не может.
Следует различать термины «рецидив опухоли» и «остаточная опухоль». Рецидив - развитие такой же опухоли в том же органе на том же месте после радикальной операции или после полной ремиссии, если проводились консервативные варианты лечения.
Остаточная опухоль - элементы злокачественной опухоли, определяемые макроскопически (в операционной ране) или микроскопически (по краю резекции в операционном препарате). Условные сроки проявления остаточной опухоли или рецидива различны для разных опухолей. В среднем считается, что возникновение роста опухоли в зоне операции до 1 года - результат нерадикальной операции, а после этого срока - истинный рецидив. В отношении химиолучевого лечения о радикальном лечении можно говорить, если достигнута полная ремиссия (исчезновение опухоли и всех ее проявлений) на условный срок не менее чем 4 недели.
Общее состояние больного является определяющим в подборе планируемых диагностических мероприятий. Пациенту в тяжелом состоянии не имеет смысла проводить обследование в полном объеме, так как лечение онкологической патологии всегда достаточно агрессивно и тяжесть состояния, обусловленная распространенностью процесса, не позволит провести лечение с удовлетворяющим результатом. В особо тяжелых случаях консилиум обсуждает вопрос о симптоматической терапии без обследования.
6.5. СОВРЕМЕННЫЕ МЕТОДЫ ДИАГНОСТИКИ РАКА
Внедрение в повседневную практику современных морфологических методов верификации опухолей позволило значительно улучшить качество диагностики и, соответственно, лечения злокачественных новообразований. Биохимические исследования, широко осуществляемые в современной онкологии, являются вспомогательными в выборе возможного лечения больных. Различные современные способы биохимического изучения опухолей и специ- фические тесты жидкостных сред организма основаны на протеомике. Протеомика - наука о белках человеческого организма.
Все опухоли имеют обычно моноклональную природу, т.е. являются потомками одной мутантной клетки. Маркерные мутации присутствуют во всех опухолевых клетках. Это позволяет обнаружить
достаточное количество молекул мутантной ДНК при анализе как самой опухоли, так и лимфатических узлов, крови, костного мозга, содержащих опухолевые клетки. Мутантные молекулы ДНК опухолевого происхождения могут быть выявлены даже в плазме крови онкологических больных, что упрощает раннюю диагностику заболевания. В различных направлениях биотерапии широко используется генная технология, при которой как в опухолевые, так и в клетки иммунной системы внедряются новые гены, изменяя их качества в нужном направлении.
С
На уровне молекулярной биологии в настоящее время производится цитологическое исследование, включающее метод ДНК- проточной цитометрии, при этом определяется злокачественность опухоли по числу клеток с диплоидным или анеуплоидным набором хромосом. Анеуплоидный набор хромосом свидетельствует о высокой злокачественности процесса, диплоидный - о более высокой степени дифференцировки опухолей. Количественная оценка и соот- ношение таких клеток в опухоли позволяет судить о степени злокачественности процесса.
Онкофетальные и онкоплацентарные антигены - РЭА, АФП, в-ХГЧ, ТБГ - особенно известны современным онкологам. АФП - α-глобулин, имеющий структурное сходство с альбумином. В I триместре беременности он является физиологическим продуктом желточного мешка, а с 13-й нед вырабатывается печенью плода. Содержание АФП (β-фетопротеина) может выступать как маркер при первичном раке печени и герминогенных опухолях яичников (дисгерминомы, хорионэпителиомы, тератомы) и яичка, а также при метастазах в печень, раке желудка, кишечника, желчного пузыря, поджелудочной железы и др.
Хорионический гонадотропин человека (в-ХГЧ) секретируется нормальной тканью плаценты и хориона, пролиферирующими клетками трофобласта (при пузырном заносе), резко повышен при хорионкарциноме. Их повышенное содержание косвенным образом свидетельствует о возврате какой-либо ткани к эмбриональному продуцированию специфических белков. По характеру аномальных белков можно предположить локализацию опухоли. Одним из первых изучен РЭА
(раково-эмбриональный антиген). Уровень его содержания определяют в сыворотке крови. РЭА - гликопротеин, у плода он синтезируется в клетках слизистой желудка и кишечника. После рождения продукция данного антигена резко снижается. Содержание его повышено при низкой степени дифференцировки эпителиальных опухолей легкого, желудка, молочной железы, колоректального рака и др.
Второй метод диагностики онкологических заболеваний - выявление онкомаркеров иммунохимическими методами. Анализ многих иммунохимических маркеров выполняется с помощью стандартных диагностических наборов. Биохимические онкомаркеры - большая группа факторов, обнаруживаемых в злокачественных и ассоциированных со злокачественным ростом клетках. Они включают:
• эмбриональные антигены;
• ростовые и дифференцировочные антигены;
• ферменты и изоферменты;
• другие факторы.
Однако чувствительность иммунохимических методов в тысячи раз меньше, чем при применении молекулярно-генетических мето- дов. Диагностическое значение они имеют уже при сформировавшихся опухолях. Лишь в последние годы благодаря качественному повышению уровня иммунотехнологий намечается некоторая тенденция к повышению эффективности этого метода диагностики и индивидуализации подходов к каждой в отдельности локализации опухолевого процесса.
В настоящее время к специфичным диагностическим тестам относят опухолевые маркеры (ОМ). Это вещества, концентрация которых в биологических жидкостях (крови, моче, содержимом кист, асцитической жидкости и др.) указывает на развитие опухолевого процесса, дает информацию о степени распространенности процесса и реакции на лечение. Как опухолевый маркер могут выступать различные соединения либо белки, либо более простые вещества, как правило, указывающие на определенные биохимические процессы в организме. Число выявляемых маркеров и их диагностическая значимость постоянно растут. В большинстве случаев это сложные белки с углеводным либо липидным компонентом, синтезируемые опухолевыми клетками или окружающими опухоль нормальными клетками в повышенных концентрациях. В настоящее время таких веществ известно много, но в реальной практике применяется не более 20-25 из них.
Карбогидратные антигены, обозначаемые СА, ассоциированные с опухолями различной природы, многочисленны. Их значимость особенно велика при нарастании концентрации в сыворотке крови параллельно с опухолевой массой, что позволяет диагностировать рецидив и метастазы раньше, чем они могут быть обнаружены при физикальном обследовании. Так, СА-19-9, СА-50 и РЭА особенно значимы при диагностике первичного и метастатического рака пече- ни, СА-125 - при раке яичников. Изменения гена-супрессора опухолевого роста Р53 отмечены при многих злокачественных опухолях человека, более чем у половины больных гепатоцеллюлярным раком, раком желудка и молочной железы и др. Этот ген подавляет клеточную пролиферацию, индуцирует апоптоз.
Антиген плоскоклеточного рака SCC (squamous cell carcinoma antigen) - маркер плоскоклеточного рака, принадлежит к семейству ингибиторов сывороточных протеаз (химотрипсин, катепсины). В норме экспрессируется в плоском эпителии, преимущественно в плоском эпидермисе (в шиповатом и зернистом слоях). Основные источники в организме - кожа, многослойный плоский эпителий бронхов, пищевода, шейки матки, анального канала. Повышен при раке шейки матки, раке головы и шеи, раке пищевода, легкого, вуль- вы, влагалища, а также при некоторых заболеваниях (псориаз, экзема, красный плоский лишай, туберкулез, хроническая печеночная и хроническая почечная недостаточность).
Тиреоглобулин (ТГ) - специфический йодсодержащий протеин щитовидной железы, являющийся предшественником тиреоидных гормонов. ТГ синтезируется в фолликулярных клетках (А-клетки) щитовидной железы и накапливается в фолликулах. В норме в сыворотке крови его выявляют лишь в незначительных количествах, его секреция находится под контролем тиреотропного гормона гипофиза. Повышается при фолликулярном и папиллярном раке щито- видной железы, особенно его высокодифференцированные формы, а также при тиреотоксикозе, токсической аденоме, тиреоидите. Показательно исследование этого белка при метастазах в легкие и печень при невыявленном первичном очаге. Наиболее специфичными являются кальцитонин при медуллярном раке щитовидной железы, PSA при раке предстательной железы. Моноклональные иммуноглобулины исследуют при определенных опухолях кроветворных и лимфоидных органов.
Циркулирующие опухолевые маркеры - природные протеины, которые секретируются опухолевыми клетками. В настоящее время в клинике наиболее широко применяется определение у больных раком яичника опухолеассоциированного маркера СА-125. При исследовании СА-125 следует отметить физиологические колебания: прогрессивный рост уровня белка в фолликулярную - лютеиновую фазу менструального цикла с резким повышением во время самой менструации, а затем резким падением к ее окончанию. Описаны слу- чаи повышения концентрации маркера в крови до 100-300 ЕД/мл. Такие концентрации наблюдаются редко, но их следует учитывать.
Повышение уровня СА-125 в сыворотке крови характерно и для больных острым гепатитом, панкреатитом, туберкулезом, при перитонитах и асцитических выпотах различной этиологии, но не выше 100 ЕД/мл, а также при некоторых онкологических заболеваниях: рак молочной железы, матки, предстательной железы, легких, желудка.
После каждого курса полихимиотерапии целесообразно проведение исследования уровня СА-125. При уменьшении концентрации маркера в крови химиотерапия является эффективной. При неиз- менности содержания маркера или росте показателей можно думать либо о неправильно поставленном диагнозе, либо о резистентности опухоли.
При положительной динамике показателя и нормализации его в течение первых 3 месяцев в процессе лечения выживаемость значительно выше, чем при более медленной динамике концентрации СА-125. Этот маркер используется для диагностики рецидивов.
Основные методы определения уровня ОМ в сыворотке крови - радиоиммунологический, иммуноферментный и хемилюми- несцентный (с помощью специфических антител к этим белкам). Онкомаркеры находят все более широкое применение для динамического наблюдения за онкологическими больными с целью раннего выявления субклинических рецидивов и метастазов.
При низкой степени дифференцировки клеток определение исходной ткани опухоли на основании стандартно приготовленных препаратов затруднено. В таких случаях могут помочь исследование биохимических маркеров, изучение ультраструктуры клеток с помощью электронной микроскопии и иммуногистохимии. Дифференциальная диагностика опухолей человека с помощью иммуногистохимии (иммуноцитохимии) основывается на фунда-
ментальных особенностях опухолевых клеток, которые сохраняются несмотря на опухолевое перерождение. Собственно иммуногистохимия - один из методов окраски биологических объектов, изучаемых под микроскопом. Сохраняется активность функционирующих генов в условиях злокачественной трансформации клетки. Этим объясняется сходство фенотипа опухолевых клеток и их нормальных аналогов. Эпителиальные, мышечные, сосудистые и другие опухоли имеют соответствующие наборы иммуногистохимических признаков, а также характерную ультраструктуру. Иммуногистохимия сочетает в себе гистохимические и иммунологические методы исследования.
Способ получения «гибридомных антител» разработан в 70-е гг. ХХ в., что позволило получать моноклональные антитела (МА). С этих пор в онкологической клинической практике используются (МА) как для диагностики, так и для лечения. Этот способ обследования позволяет изучить рецепторы опухолевых клеток, гормональный и ферментный состав клеточной цитоплазмы и таким образом оценить функциональные возможности клетки, состояние системы апоптоза. Особенно широко иммуногистохимические реакции при- меняют в онкогематологии. Иммуноцитохимический метод основан на оценке реакции клеток с различными маркерами.
Значительное число белков, выявляемых в опухолях с помощью иммуногистохимических реакций, кодируется отдельными функци- ональными генами, экспрессия которых подчиняется определенным правилам. В настоящее время разработан способ получения моноклональных антител от иммунизированных животных. Отбираются клетки, способные к размножению и продуцирующие антитела, представляющие интерес для конкретного исследования, при этом визуализируется положение того или иного белка (антигена) в изу- чаемом объекте при помощи вступившего с ним в реакцию антитела, т.е. иммунологические реакции перенесены на предметное стекло. Иммуногистохимия изучает ткани при сохранении их структуры и антигенной активности. Могут быть использованы ткани, фиксированные в формалине и залитые парафином. Здесь в первую очередь используется широкий ряд моноклональных антител, выявляющих хорошо охарактеризованные клеточные антигены. Таким образом, анализируется прижизненное местонахождение антигенов.
Сейчас уже имеется несколько сотен различных антител, выявляющих экспрессию тех или иных белков, связанных с определен- ными типами клеток, специфической функцией, пролифератив-
ной активностью, апоптозом, внеклеточным матриксом и т.д. Так, определение онкогенов, генов-супрессоров, генов апоптоза дает достаточную информацию о происхождении и степени злокачественности опухоли.
Эти тесты особенно значимы при поиске первичного опухолевого очага, при оценке радикальности операции, потому что если оставлен какой-то объем опухолевой ткани, то тест будет положительным. Часто используют эти пробы для определения необходимости поиска рецидивной опухоли. Онкомаркеры неспецифичны, их содержание может повышаться при ряде неопухолевых процессов. В настоящее время их исследование значимо только в контексте других методов исследования.
6.6. ПОЗИТРОННАЯ ЭМИССИОННАЯ ТОМОГРАФИЯ (ПЭТ)
Этот способ обследования основан на применении радиофармпрепарата, меченного позитронно излучающими радионуклидами. ПЭТ - более сложный вариант радионуклидных исследований, активно изучается и имеет большие перспективы для применения в онкологии. Основное назначение этого метода в настоящее время - дифференциальная диагностика доброкачественных и злокачественных новообразований, выявление скрытой первичной опухоли, выявление метастазов в лимфатических узлах и отдаленных от первичного очага органах. При введении такого препарата прослеживается распределение его во всех отделах тела человека. Это, учитывая специфичность участия введенного соединения в обменных процессах, может ассоциироваться со скоплением клеток определенного строения, чаще опухолевых, или с определенными, преимущественно осуществляющимися в данном скоплении клеток биохимическими процессами. Таким образом, используют для исследования меченые аминокислоты, пептиды, гормоны, противоопухолевые препараты и др. В настоящее время имеется более двухсот соединений позитронно излучающих нуклидов с различными биологическими агентами, участвующими в обмене клеток изучаемых объектов. Наиболее широкое применение в онкологии в настоящее время получили исследования клеточной энергетики с помощью 18F-фтордиок- сиглюкозой (18F-ФДГ). Основой для этого исследования является давно установленный факт, что для опухолевой клетки характер-
ны более высокие показатели аэробного и анаэробного гликолиза. Определение интенсивности обмена глюкозы лежит в основе распознавания опухолевой и неопухолевой ткани и позволяет оценить уровень дифференцировки опухолей. ПЭТ с 18F-ФДГ является самым информативным радионуклидным методом диагностики опухолей. Этот метод в настоящее время чаще всего используют при обследовании больных раком легкого, толстой кишки, меланомой, злокачественными лимфомами, опухолями органов головы и шеи, раком молочной железы.
На стадии разработки находятся несколько физических методов воздействия на опухоль, в том числе с диагностической целью. Флюоресцентный способ получил свое применение в лечении, но изучаются его возможности и в диагностике. Флюоресценция - метод выявления раковых клеток, основанный на избирательном накоплении в раковых клетках фотосенсибилизатора. При освещении кожи или слизистой оболочки светом лазера раковые клетки начинают светиться. Это слабое свечение можно увидеть через специальную камеру и определить границы распространения опухоли. По отно- сительной силе свечения можно определить количество фотосенсибилизатора в клетках. Этот способ позволяет выявлять как предраковые процессы, так и раковые опухоли задолго до клинически проявляющихся стадий. Метод находится в стадии разработки.
В настоящее время применяют и флюоресцентную диагностику. Используется не только фотосенсибилизатор, но и регистрируется собственное свечение тканей при возбуждении лазерным излучением, или в ультрафиолетовом спектре. В организме имеются собственные флуорохромы (триптофан, коллаген, эластин и др.). Интенсивность свечения определяется количеством соответствующих веществ в покровном эпителии. Обычно свечение нормальных тканей и патологического очага различаются.
С