Иммунология : практикум : учеб. пособие / [Ковальчук Л. В. и др.] - 2010. - 176 с. : ил.
|
|
|
|
ГЛАВА 6 ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ В ИММУНОЛОГИИ
6.1. ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ
Полимеразная цепная реакция (ПЦР) - экспериментальный метод молекулярной биологии, который представляет собой специфическую амплификацию нуклеиновых кислот, индуцируемую синтетическими олигонуклеотидными праймерами in vitro.
Идея разработки метода ПЦР принадлежит американскому исследователю Kary Mullis, который в 1983 г. создал метод, позволивший амплифицировать ДНК в ходе циклических удвоений с помощью фермента ДНК-полимеразы в искусственных условиях. Через несколько лет после опубликования этой идеи, в 1993 г., К. Mullis получил за нее Нобелевскую премию.
В начале использования метода после каждого цикла нагревания- охлаждения приходилось добавлять в реакционную смесь ДНК-полимеразу, так как она быстро инактивировалась при высокой температуре. Процедура была очень неэффективной, требовала много времени и фермента. В 1986 г. ее существенно модифицировали за счет использования ДНК-полимеразы из термофильных бактерий. Эти ферменты способны выдерживать множество циклов реакции, что позволяет автоматизировать проведение ПЦР. Одна из наиболее часто использовавшихся термостабильных ДНК-полимераз была выделена из бактерий Thermus aquaticus и названа Taq-ДНК-полимеразой.
Суть метода. Метод основан на многократном избирательном копировании определенного участка ДНК при помощи фермента Taq- ДНК-полимеразы. Полимеразная цепная реакция позволяет получить амплификаты длиной до нескольких тысяч пар нуклеотидов. Для увеличения длины ПЦР-продукта до 20-40 тыс. пар нуклеотидов применяют смесь различных полимераз, но все равно это значительно меньше длины хромосомной ДНК эукаротической клетки.
Реакция проводится в программируемом термостате (амплификаторе) - приборе, который может проводить достаточно быстро
охлаждение и нагревание пробирок (обычно с точностью не менее 0,1 °С). Амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта» и последующего хранения. Для ПЦР в режиме реального времени выпускают приборы, оборудованные флуоресцентным детектором. Существуют также приборы с автоматической крышкой и отделением для микропланшет, что позволяет встраивать их в автоматизированные системы.
Обычно при проведении ПЦР выполняется 20-45 циклов, каждый из которых состоит из трех стадий: денатурации, отжига праймеров, элонгации (рис. 6.1 и 6.2). На рис. 6.1 представлена динамика изменения температуры в пробирке при проведении цикла ПЦР.
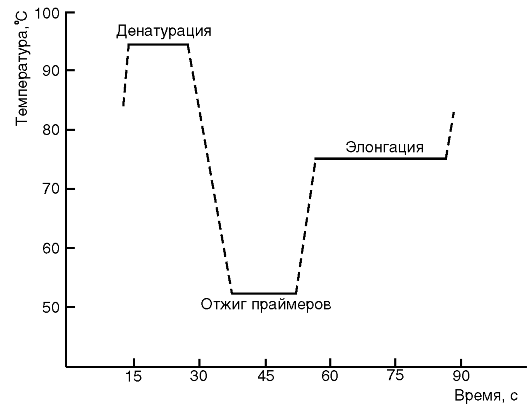 Рис. 6.1. График изменения температуры в пробирке в течение одного цикла полимеразной цепной реакции
Рис. 6.1. График изменения температуры в пробирке в течение одного цикла полимеразной цепной реакции
Денатурация ДНК-матрицы проводится с помощью нагревания реакционной смеси до 94-96 °С на 5-90 с, чтобы цепи ДНК разошлись. Следует отметить, что перед первым циклом осуществляют предварительный прогрев реакционной смеси в течение 2-5 мин для полной денатурации исходной матрицы, что позволяет снизить количество неспецифичных продуктов реакции.
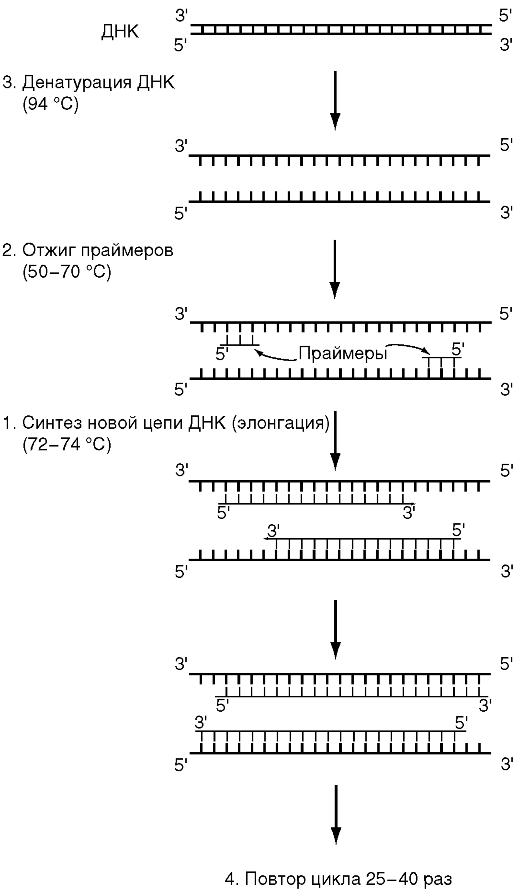 Рис. 6.2. Схема первого цикла полимеразной цепной реакции
Рис. 6.2. Схема первого цикла полимеразной цепной реакции
Стадия отжига праймеров. При плавном снижении температуры праймеры комплементарно связываются с матрицей. Температура отжига зависит от состава праймеров и обычно она на 4-5° ниже расчетной температуры плавления. Длительность стадии - 5-60 с.
Во время следующей стадии - элонгации - происходит синтез дочерней цепи ДНК на матрице материнской. Температура элонгации зависит от полимеразы. Часто используемые ДНК-полимеразы Taq и Pfu наиболее активны при 72 °С. Время элонгации, в основном зависящее от длины ПЦР-продукта, обычно составляет 1 мин на каждую тысячу пар оснований.
После проведения ПЦР проба инкубируется при температуре 72 °С в течение 10 мин. Количество специфического продукта реакции (ограниченного праймерами) при 100% эффективности теоретически возрастает в геометрической прогрессии по формуле Р = 2n, где Р - количество специфического продукта, а η - число циклов реакции. Практически эффективность ПЦР меньше 100%, поэтому в действительности P = (1 + E)n, где P - количество продукта; Е - средняя эффективность цикла; а n - число циклов реакции.
При большем, чем указано, количестве циклов реакции происходит накопление неспецифических продуктов последней. Рост требуемого продукта в геометрической прогрессии ограничен числом реагентов, присутствием ингибиторов и побочных продуктов реакции. На последних циклах рост замедляется, это называют «эффектом плато» (рис. 6.3). Кинетика ПЦР имеет экспоненциальный характер только на начальном этапе, после чего начинается выход на плато в силу истощений в реакции компонентов (dNTP, праймеров) и нарастающего температурного повреждения Таq-ДНК-полимеразы, конкуренции за фермент амплификонов.
Компоненты полимеразной цепной реакции. Компоненты, используемые в ПЦР, следующие: Taq-ДНК-полимераза, дезоксирибонуклеотидтрифосфаты, буферный раствор, «прямой» и «обратный» праймеры, а также ДНК-матрица.
Фермент Taq-ДНК-полимераза. При оптимальных условиях в реакционной смеси ПЦР (50-100 мкл) фермент содержится в количестве 0,5-2 единиц на пробу. Taq-ДНК-полимераза синтезирует цепь ДНК до 1000 пар оснований в минуту. Увеличивая время полимеризации и подбирая новые разновидности ДНК-полимеразы, обладающие и экзонуклеазной (редактирующей) активностью, вырезающей ошибочные (некомплементарные) нуклеотиды, удалось получить очень
длинные амплифицированные ДНК - до 42 тыс. пар оснований (Лонг-ПЦР). Избыток Таq-ДНК-полимеразы увеличивает образование неспецифических продуктов ПЦР.
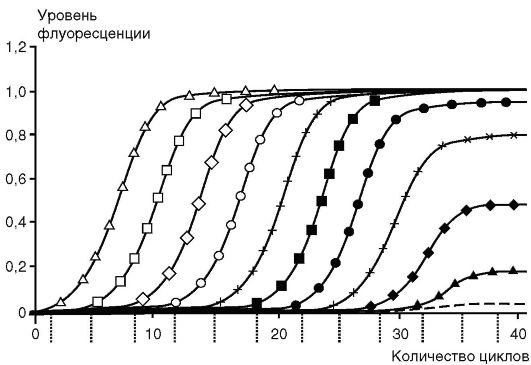 Рис. 6.3. Динамика накопления продукта при полимеразной цепной реакции
Рис. 6.3. Динамика накопления продукта при полимеразной цепной реакции
dNTP. Дезоксирибонуклеотидтрифосфаты (dNTP), используемые в ПЦР, следующие: dATP, dGTP, gTTP, dCTP. dNTP содержатся в реакционной смеси в эквивалентных концентрациях от 200 до 500 мкм, так как избыток какого-либо из них увеличивает ложное спаривание нуклеотидов в ПЦР.
Праймеры. Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами, каждый из последних комплементарен одной из цепей двухцепочечной матрицы, обрамляет начало и конец амплифицируемого участка (рис. 6.4).
Поскольку праймеры каждый раз встраиваются в амплифицируемые фрагменты ДНК-матрицы (амплификоны), то они должны в реакционной смеси ПЦР присутствовать в избытке, и концентрация их составляет 0,5-1 мкМ. Специфичность получаемого продукта
ПЦР в значительной степени определяется так называемой температурой отжига праймеров, при которой они взаимодействуют с комплементарными участками ДНК-матрицы, образуя двухцепочечные структуры.
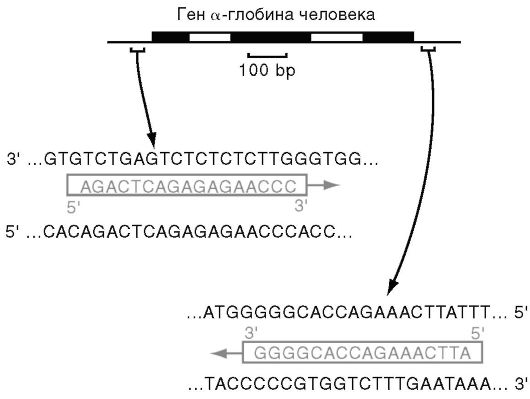 Рис. 6.4. Пример «прямого» и «обратного» праймеров
Рис. 6.4. Пример «прямого» и «обратного» праймеров
Буферная система. 10-кратный буфер для ПЦР чаще всего имеет состав: 0,5 М KCl; 0,2 М Трис-HCl, pH 8,4; 25 мМ MgCl2; 1 мг/мл бычьего сывороточного альбумина (БСА) - пример стандартной прописи буферной системы.
Tris Cl. Высокое значение рН нужно из-за того, что при повышении температуры рН Tris-буфера падает и при 72 °С составляет ~7,5.
KCl. Средние концентрации KCl стимулируют на 40-60% активность Taq-ДНК-полимеразы (но 0,2 M полностью ингибирует полимеразную активность).
MgCl2. Диапазон рабочих концентраций: 0,5-5 мМ. Увеличение концентрации Mg2+ оказывает очень резкое влияние на специфичность и эффективность ПЦР: увеличивается выход, но более высокими темпами уменьшается специфичность. Оптимум зависит от последовательностей матрицы и праймеров.
Таким образом, слишком низкая концентрация Mg2+ - низкий выход, слишком высокая - неспецифическая амплификация.
На молекулярном уровне: Mg2+ образует комплексы с dNTP's. Именно эти комплексы являются субстратом для Taq-ДНК- полимеразы. C Mg2+ стехиометрически связываются dNTP's, PPi, EDTA, PO4. Повышение концентрации Mg2+ вызывает повышение температуры плавления ДНК.
В полимеразной цепной реакции используется вода высокой очистки (MQ). В зависимости от конструкции прибора (если «крышка» амплификатора не нагревается) в реакцию бывает необходимым на ПЦР-смесь наслаивать стерильное минеральное масло для предотвращения испарения пробы.
ДНК-матрица. Общее количество ДНК, вносимой в пробирку для ПЦР, не должно превышать 1 мкг, ибо большой избыток неспецифической ДНК снижает специфичность и чувствительность ПЦРамплификации ДНК-матрицы. Подготовка пробы материала (выделение ДНК или РНК) должна проводиться в условиях, исключающих перекрестное загрязнение исследуемых проб выделяемыми нуклеиновыми кислотами.
Чтобы ПЦР прошла успешно, должна произойти гибридизация праймеров с нужной последовательностью-мишенью. Если эта последовательность слегка различается у разных индивидуумов или у микроорганизмов из разных изолятов (т.е. имеет место полиморфизм), может произойти ее неполное спаривание с амплимером и нарушение нормальной амплификации, что приведет к получению ложноотрицательного результата. Следует отметить: у человека большая часть геномных последовательностей консервативна и не различается у разных индивидуумов, а потому обычно в таких случаях для работы подходят одинаковые наборы «консервативных» праймеров.
Контаминация. Для исключения ложноположительного результата необходимо обязательное использование чистых перчаток, одноразовых пробирок и наконечников к автоматическим пипеткам, проведение предварительной ультрафиолетовой обработки помещения и рабочих поверхностей столов и приборов. Подчеркнем: ДНКматрицы генов клеток, вирусов и бактерий пригодны для ПЦР в течение десятков лет даже после замораживания, высушивания, температурной или химической денатурации белков и др.
Чувствительность ПЦР порой достигает математически возможного предела (детекции 1 копии ДНК-матрицы), поэтому существует высокая степень опасности получения ложноположительного результата в силу переноса через предметы и реагенты как самой ДНКматрицы (реже), так и амплификонов (очень часто), получаемых в больших количествах во многих пробирках в течение ежедневной работы.
Причинами ложноположительных результатов являются следующие 3 вида контаминаций.
1. Контаминация от пробы к пробе (в процессе обработки клинических образцов или при раскапывании реакционной смеси), приводящая к появлению спорадических ложноположительных результатов.
2. Контаминация рекомбинантными плазмидами, содержащими клонированные последовательности детектируемого гена.
3. Контаминация продуктами амплификации (амплификонами). Она - наиболее частая причина ложноположительных результатов, поскольку в процессе ПЦР-генодиагностики амплификоны накапливаются в больших количествах и очень легко переносятся с аэрозолями и через приборы. Поэтому детекция продуктов ПЦР должна проводиться в изолированной комнате сотрудником, не производящим обработку клинических образцов и не готовящим реактивы для ПЦР. Приготовление основных растворов также должно производиться в отдельной чистой комнате. Все растворы следует хранить и использовать небольшими порциями.
Необходимо постоянно осуществлять собственные виды лабораторного контроля и периодически применять зашифрованные отрицательные и положительные контрольные образцы для оценки специфичности и чувствительности ПЦР-генодиагностических исследований. Неуклонно выполняя эти требования и выполняя в каждой ПЦР отрицательный контроль разных типов (на процедуру обратной транскрипции, буферный раствор, праймеры), можно практически исключить ложноположительные результаты ПЦР.
Очень важен для правильной интерпретации результатов выбор способов контроля. Положительный и отрицательный контроль должен быть хорошо охарактеризован. Часто используют ДНК из клеточных линий, заведомо содержащих или не содержащих последовательность-мишень. В каждом анализе нужны как минимум три вида контроля:
1) положительный контроль (образец заведомо содержит последовательность-мишень);
2) отрицательный контроль (образец заведомо не содержит последовательность-мишень);
3) бланк-контроль (реакционная смесь, в которой присутствуют все компоненты за исключением ДНК; бланк-контроль является индикатором загрязнений).
Один тип положительного контроля должен содержать максимальное число последовательностей-мишеней, другой - небольшое их число. Это позволяет определить чувствительность и эффективность ПЦР.
Детекция. Для анализа ПЦР-амплифицированной ДНК существуют разные методы: гель-электрофорез, дот-блот-гибридизацию и блот-гибридизацию по Саузерну. С их помощью можно анализировать большинство ПЦР-продуктов, но абсолютно точные результаты получают только при секвенировании. Следует отметить: в дальнейших главах будет описана модификация ПЦР - полимеразная цепная реакция в режиме реального времени, в которой детекция возрастания количества ПЦР-продуктов осуществляется непосредственно в пробирке при прохождении реакции (см. ниже).
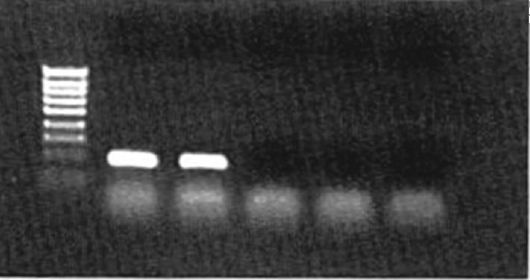 Рис. 6.5. Фотография электрофоретического геля с ПЦР-продуктами
Рис. 6.5. Фотография электрофоретического геля с ПЦР-продуктами
Присутствие специфического ПЦР-продукта (амплификона) в подавляющем большинстве случаев детектируют электрофоретическим разделением ПЦР-амплификационной смеси на окрашенных бромистым этидием агарозном или полиакриламидном гелях. Для такого выявления необходимо не менее 20 нг ДНК. Специфичность полосы амплифицированной ДНК подтверждается ее положением (размерами) по отношению к маркерным фрагментам и ДНКстандарту. Дополнительные доказательства специфичности амплификона получают путем расщепления специфическими рестриктазными
ферментами или путем гибридизации со специфическим радиоактивным или флуоресцентным олигонуклеотидным зондом.
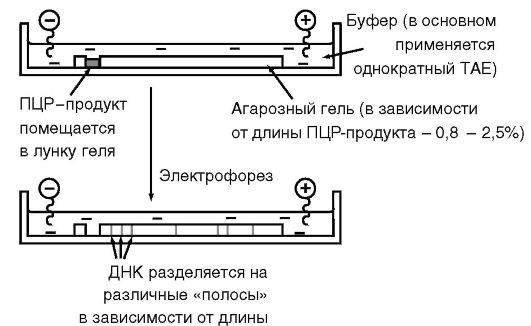 Рис. 6.6. Устройство горизонтальной электрофоретической камеры
Рис. 6.6. Устройство горизонтальной электрофоретической камеры
Электрофорез в агарозном геле позволяет легко, без применения радиоизотопов, обнаружить амплифицированную ДНК и определить ее размер (рис. 6.5 и 6.6). Остановимся на некоторых ее особенностях применительно к анализу ПЦР-амплифицированной ДНК:
а) 10-20 мкл амплифицированной ДНК разделяют в 2% агарозном геле вместе со стандартными фрагментами размером 50-1000 пар нуклеотидов;
б) электрофорез проводят при высоком напряжении (10-15 В/см), поскольку образующиеся при ПЦР небольшие фрагменты сложно детектировать после электрофореза в течение ночи при небольшом напряжении вследствие их интенсивной диффузии.
Разрешение можно повысить, используя полиакриламидные или агарозные гели с высокой концентрацией агарозы (3-4%). Впрочем, если анализ нужно провести быстро и с небольшими затратами, вполне приемлемы 2% агарозные гели. Обычно при амплификации ДНК, выделенной из фиксированных тканей, выход ПЦР-продуктов ниже, и они менее специфичны, чем в случае амплификации высокоочищенной ДНК.
Метод гибридизации ПЦР-амплифицированной ДНК (по Саузер- ну) позволяет идентифицировать полосы в геле, наблюдаемые после электрофореза амплифицированной ДНК. Для гибридизации используются как изотопно, так и неизотопно меченые зонды.
Дот-блот-гибридизация дает простой ответ по типу «да-нет» и особенно полезна в тех случаях, когда проводится анализ большого числа образцов.
Прямое секвенирование амплифицированной ДНК - также высоконадежный метод доказательства ее специфичности, но применяется в основном для определения точечных мутаций генов. В последние годы для детекции и одновременно количественной оценки амплифицированной ДНК все больше начинают применять гибридизационно-ферментный метод на микропланшетах. Но существуют и другие варианты: используются олигонуклеотидный зонд, его метят дигоксигенином или флуоресцеином с последующим проявлением моноклональными антителами к дигоксигенину или флуоресцеину; меченные ферментами моноклональные антитела к двухцепочечной ДНК; зонд, меченный рутением (электрохемилюминесцентный метод). Весьма перспективна для количественных детекций амплификонов на гель-электрофореграммах миниатюрная видеокамера, передающая на экран монитора интенсивность флуоресценции полос ДНК-амплификонов, что позволяет одновременно получить соотношение полос ДНК-стандарта и ДНК-амплификонов исследуемого гена.
Результат ПЦР можно квалифицировать как положительный или отрицательный в зависимости от того, обнаружена в образце интересующая вас последовательность-мишень или нет. Однако нарушение нормального хода амплификации, недостаточная чувствительность метода и непредвиденный полиморфизм последовательности-мишени в области связывания праймеров или гибридизационного зонда порой обусловливают ложноотрицательный результат. При загрязнении образцов и случайной гомологии между зондом, праймерами и последовательностью, сходной с мишенью, получаются ложноположительные результаты.
Модификации. В последние годы широко используется такой простой прием, как «горячий старт ПЦР», который заключается в предварительном прогревании пробирок с ПЦР-амплификационной смесью при температуре 95 °С в течение 3-5 мин. Такой прием предупреждает амплификацию неспецифических ДНК-фрагментов
вследствие низкотемпературного, неспецифического спаривания праймеров.
При использовании РНК в качестве матриц для ПЦР предварительно на этой РНК-матрице посредством фермента РНК-зависимой ДНК-полимеразы (обратная транскриптаза, ревертаза) синтезируют комплементарную ДНК (кДНК), затем использующуюся в качестве матрицы в ПЦР. ПЦР с обратной транскриптазой (ОТ-ПЦР) широко применяется для детекции РНК вирусов, определения экспрессии вирусных, бактериальных и клеточных генов по их РНК.
Существуют различные модификации ПЦР, использующиеся в зависимости от конкретных целей проведения реакции или от характера последующего молекулярного анализа амплификатов. Так, для трудноамплифицируемых участков ДНК (содержащих различные повторяющиеся последовательности или необычные структурные элементы), а также в тех случаях, когда матричная ДНК присутствует в следовых количествах, ПЦР проводят в два этапа, используя в качестве матричной ДНК на втором этапе амплификации продукты ПЦР, синтезированные на первом этапе. Часто в этих случаях для повышения специфичности посадки праймеров применяют систему так называемых вмонтированных праймеров, т. е. при доамплификации в качестве праймеров выбирают последовательности, локализованные внутри амплифицированного на первом этапе участка ДНК.
В ряде случаев удобно проводить мультиплексную ПЦР, т.е. одновременную амплификацию нескольких участков матричной ДНК. Можно получать меченые продукты ПЦР, добавляя в реакционную смесь меченые dNTP. Особого внимания заслуживает возможность проведения ПЦР с молекулами кДНК. На основе этой реакции разработаны методы анализа экспрессии генов и получения больших количеств кДНК. Реакция амплификации осуществима не только в растворах, но и непосредственно на хромосомных препаратах, при этом в случае использования меченых нуклеотидов продукты амплификации гибридизуются и выявляют комплементарные им участки ДНК на хромосомах. До настоящего времени доступными амплификации были участки ДНК, не превышающие по длине 5 тыс. пар оснований. В последнее время благодаря внесению ряда кардинальных усовершенствований (особый подбор праймеров, использование сразу двух различных ДНК-полимераз, специального температурного режима полимеразных циклов) возможно про-
ведение амплификации фрагментов ДНК, достигающих 35 тыс. пар оснований.
Полимеразная цепная реакция в режиме реального времени
В последние годы появилась такая модификация ПЦР, как ПЦР в режиме реального времени (ПЦР-РВ). Ей предшествовал вариант с флуоресцентной детекцией ПЦР-продукта в конечной точке: в реакционную смесь добавляли специфический флуоресцентный зонд и далее через 30-40 циклов определяли уровень флуоресценции.
В реакционную смесь при ПЦР-РВ также добавляется или специфический флуоресцентный зонд (TaqMan и др.), или интеркалирующий краситель (SYBR GreenI и др.), но в данном случае амплификатор позволяет детектировать флуоресценцию каждый цикл и наблюдать рост количества ПЦР-продукта в каждой пробирке, и далее по имеющейся калибровке определять точное исходное количество образца в пробе (рис. 6.7).
Прогресс в этой области позволяет использовать несколько независимых зондов в реакции, проводить одновременную детекцию нескольких ПЦР-продуктов и создавать ПЦР-системы мультиплексного формата.
Альтернативные ПЦР-методы амплификации нуклеиновых кислот
1. Лигазная цепная реакция (ЛЦР). Принцип аналогичен таковому при выполнении ПЦР, но вместо ДНК-полимеразы и dNTP используется термостабильная лигаза и 4 специфических олигонуклеотида, добавляемых в реакционную смесь в избытке. Каждые 2 олигонуклеотида комплементарны к детектируемому специфическому фрагменту цепи ДНК-матрицы и непосредственно примыкают друг к другу, одновременно они комплементарны и второй паре олигонуклеотидов. После денатурации ДНК-матрицы при 95 °С олигонуклеотиды связываются специфическими фрагментами цепей ДНК-матрицы и лигируются при 50 °С. Далее эти две стадии цикла повторяются много раз, в результате чего происходит экспоненциальное возрастание соединенных ковалентной связью олигонуклеотидов. Для быстрого количественного обнаружения лигированных олигонуклеотидов применяют 2 метки: биотин на одном конце, а флуоресцеин - на другом конце лигированных
олигонуклеотидов, поэтому они связываются антифлуоресцеиновыми антителами на поверхности мембраны или микропланшета. Антибиотиновые антитела, конъюгированные со щелочной фосфатазой, также количественно взаимодействуют с образовавшимся фиксированным комплексом и после добавления субстрата дают окрашенный продукт.
2. Каталитическая амплификационная система, или циклическая зондовая технология (ЦЗТ), - противоположность ЛЦР, поскольку принцип состоит не в сшивании двух олигонуклеотидных зондов, а напротив, в расщеплении рибонуклеотидной комплементарной вставки при помощи фермента РНК-азы Н и получении из одного длинного ДНК-РНК-ДНК-зонда двух коротких ДНКовых олигонуклеотидов, которые затем детектируются одним универсальным дезоксинуклеотидным зондом, конъюгированным с маркерным ферментом. Достоинства метода заключаются в изотермальности реакции, исключении возможности перекрестной контаминации, быстроте проведения (менее 1 ч) и в полной автоматизации.
Преимущества РЦР перед другими методами
Для выявления нуклеиновой кислоты-мишени методом гибридизации in situ с применением радиоактивно меченного зонда необходимо, чтобы мишень присутствовала в анализируемом препарате в количестве нескольких тысяч копий. Нередко число аномальных последовательностей в препарате диагностически значимо, но меньше необходимого числа копий мишени, и гибридизация может дать ложноотрицательный результат. Для выявления уникальной нуклеотидной последовательности методом ПЦР достаточно 10 копий матрицы. К преимуществам полимеразной реакции нужно отнести следующее.
1. Метод прямой и позволяет достичь предельно возможной чувствительности (от нескольких копий до одного возбудителя в пробе).
2. Специфичность метода приближается к 100%.
3. Для ПЦР-анализа пригоден любой материал, в том числе и гистологические препараты.
4. Метод позволяет определять число копий возбудителя в пробе и тем самым наблюдать динамику.
5. Исследуемый материал может быть дезинфицирован химической или термической обработкой в момент его забора, и, следова-
тельно, исключается возможность инфицирования персонала в процессе проведения ПЦР.
6. Метод прост в исполнении, возможна его полная автоматизация.
7. Результаты получают через несколько часов, т.е. в течение одного рабочего дня.
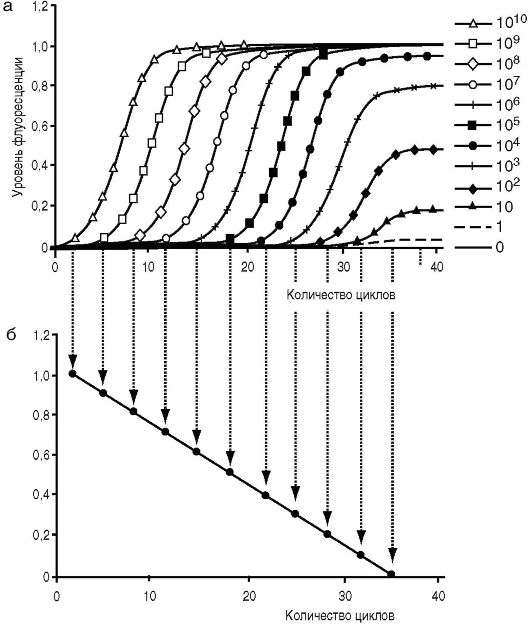 Рис. 6.7. Сопоставление
результатов ПЦР-РВ с калибровочной прямой: наблюдается рост количества
ПЦР-продукта в каждой пробирке (а), определяется по имеющейся калибровке
точное исходное количество образца в пробе (б)
Рис. 6.7. Сопоставление
результатов ПЦР-РВ с калибровочной прямой: наблюдается рост количества
ПЦР-продукта в каждой пробирке (а), определяется по имеющейся калибровке
точное исходное количество образца в пробе (б)
Области применения
Метод ПЦР применяется для выявления в клинических образцах вирусов, микобактерий, простейших и бактерий, для обнаружения врожденных и приобретенных генетических нарушений, а также для идентификации личности. Сфера применения ПЦР в диагностике будет постепенно расширяться, поскольку в клинической практике все чаще имеют дело с очень небольшими по размеру биоптатами, получаемыми, например, при эндоскопических исследованиях; или это тонкоигольные аспираты и т.д. В подобных случаях обычный гистологический анализ затруднен. Перечислим, для чего может служить ПЦР.
В иммунологических исследованиях ПЦР чаще всего используется:
• для определения полиморфизма генов, белковые продукты которых участвуют в иммунологических реакциях;
• для определения экспрессии цитокинов, рецепторов цитокинов и других эффекторных молекул;
• для ДНК типирования HLA аллелей и др.
ДНК, выделенную из лимфоцитов, анализируют следующими вариантами ПЦР.
1. ПЦР-праймер со специфической последовательностью (PCRSSP).
2. ПЦР-олигонуклеотидные пробы со специфической последовательностью (PCR-SSOP).
3. ПЦР-рестрикционный анализ продуктов амплификации (PCRRFLP).
4. ПЦР-метод обратной гибридизации амплифицированного фрагмента с олигонуклеотидными зондами, фиксированными на мембране или другой твердой подложке (пластине).
6.2. ИССЛЕДОВАНИЕ ЭКСПРЕССИИ ГЕНОВ МЕТОДОМ МИКРОЧИПОВ
Биологические микрочипы - один из новейших инструментов биологии и медицины.
Прообразом современных микрочипов стал саузерн-блоттинг, изготовленный в 1975 г. Эдом Саузерном. Он использовал меченую нуклеиновую кислоту для определения специфической последова-
тельности среди фрагментов ДНК, зафиксированных на твердой подложке.
Точнее всего биочипы описывает английское название «DNAmicroarrays», что означает «организованное размещение молекул ДНК на специальном носителе-платформе». В качестве платформы используют пластинку из стекла, иногда и другие материалы, например кремний, различные гели. На платформу наносятся биологические макромолекулы (ДНК, белки, ферменты), способные избирательно связывать вещества, содержащиеся в анализируемом растворе.
В зависимости от того, какие макромолекулы используются и каковы цели исследования, выделяют различные виды биочипов: ДНК-микрочипы и белковые микрочипы. Опишем методику с применением ДНК-микрочипов.
Размещенные на платформе макромолекулы занимают очень небольшой участок - размером с покровное стекло (рис. 6.8, см. также цв. вклейку). Микроскопический размер биочипа позволяет размещать на небольшой площади огромное количество разных молекул ДНК и считывать с этой площади информацию с помощью специального лазерного устройства.
Рис. 6.8. Стекла, используемые для приготовления микрочипов
 В
поверхностных матричных биочипах ДНК иммобилизуется на поверхности
мембран или пластинок из стекла, пластика, полупроводника или металла. В
гелевых биочипах ДНК иммобилизуется в слое полиакриламидного геля
толщиной 10-20 мкм, нанесенного на специально обработанную поверхность
стекла. Иммобилизуемая ДНК наносится на поверхность или через игольчатые
растры механического робота, или с помощью технологии струйного
принтера (рис. 6.9, см. также цв. вклейку). Контроль качества нанесения
осуществляется с помощью специализированной оптики и компьютерного
анализа изображения. Затем на биочипе гибридизуют молекулы ДНК, меченные
с помощью флюоресцентной или радиоактивной
В
поверхностных матричных биочипах ДНК иммобилизуется на поверхности
мембран или пластинок из стекла, пластика, полупроводника или металла. В
гелевых биочипах ДНК иммобилизуется в слое полиакриламидного геля
толщиной 10-20 мкм, нанесенного на специально обработанную поверхность
стекла. Иммобилизуемая ДНК наносится на поверхность или через игольчатые
растры механического робота, или с помощью технологии струйного
принтера (рис. 6.9, см. также цв. вклейку). Контроль качества нанесения
осуществляется с помощью специализированной оптики и компьютерного
анализа изображения. Затем на биочипе гибридизуют молекулы ДНК, меченные
с помощью флюоресцентной или радиоактивной
метки (рис. 6.10, см. также цв. вклейку). Интенсивность флюоресценции в ячейках измеряют с помощью сканера, передающего сигнал на прибор с зарядовой связью (рис. 6.9, см. также цв. вклейку). Данные о гибридизации получают также с помощью масс-спектрометрии, атомной силовой микроскопии и др. В основе принципа работы всех типов биочипов с иммобилизованной ДНК лежит точное соответствие между комплементарными ДНК (по правилу Уотсона-Крика): А-Т, G-С. Если соответствие между нуклеотидами иммобилизованной и гибридизуемой ДНК полностью отвечает условиям комплементарности, то образующиеся дуплексы будут термодинамически наиболее устойчивы и станут давать более сильный сигнал флюоресценции. Выявление и сопоставление наиболее ярко светящихся ячеек проводит прибор - анализатор биочипов.
 Рис. 6.9. Оборудование
для приготовления микрочипов: механический робот для нанесения через
игольчатые растры проб на поверхность стекол (а); сканер для детекции
интенсивности флюоресценции в ячейках (б); данные со сканера передаются
на персональный компьютер для дальнейшей обработки
Рис. 6.9. Оборудование
для приготовления микрочипов: механический робот для нанесения через
игольчатые растры проб на поверхность стекол (а); сканер для детекции
интенсивности флюоресценции в ячейках (б); данные со сканера передаются
на персональный компьютер для дальнейшей обработки
Гибридизуемая ДНК обычно заранее вырабатывается в достаточных количествах с помощью ПЦР. При использовании более современных технологий ПЦР осуществляется непосредственно на чипе. Анализ на 1 микрочипе занимает 6-10 ч и позволяет провести диагностику индивидуально.
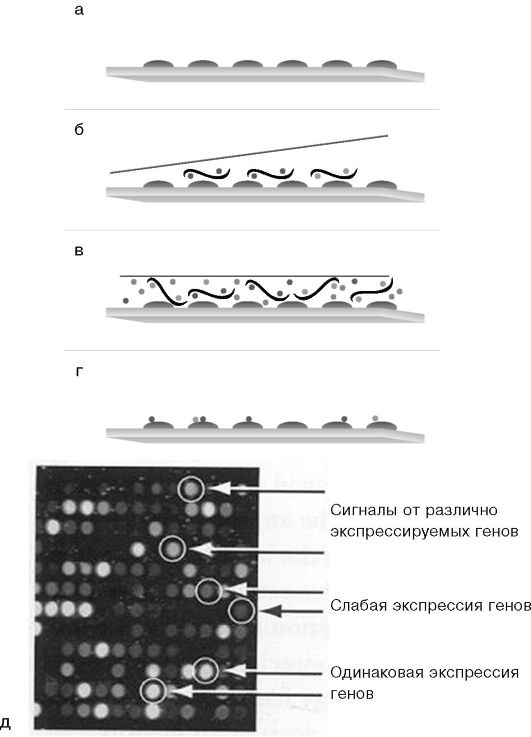 Рис. 6.10. Схема
гибридизации меченой пробы с микрочипом: а - исходная поверхность
микрочипа; б - добавление меченой пробы; в - гибридизация микрочипа с
пробой в течение 16 ч; г - отмывка микрочипа от несвязавшейся пробы; д -
детекция результатов
Рис. 6.10. Схема
гибридизации меченой пробы с микрочипом: а - исходная поверхность
микрочипа; б - добавление меченой пробы; в - гибридизация микрочипа с
пробой в течение 16 ч; г - отмывка микрочипа от несвязавшейся пробы; д -
детекция результатов
С помощью микрочипов возможны:
• одновременный анализ работы десятков тысяч генов, сравнение их экспрессии;
• быстрое определение наличия вирусных и бактериальных возбудителей;
• диагностика лейкозов и других вирусных заболеваний;
• диагностика различных видов раковых опухолей;
• скрининг действия новых лекарств на различные гены (такие исследования помогают создавать новые лекарственные препараты, выяснять, на какие гены и каким образом эти препараты действуют).
Еше биочипы - незаменимый инструмент для биологических исследований: в процессе одного эксперимента нередко выясняется влияние различных факторов на работу десятков тысяч генов.
6.3. ПОЛУЧЕНИЕ МЫШЕЙ С НОКАУТОМ
(KNOCK-OUT) И НОКИНОМ (KNOCKIN) ГЕНОВ -
МЕТОД НАПРАВЛЕННОГО МУТАГЕНЕЗА
Метод нокаута/нокина генов (т.е. удаления или добавления определенного гена или генов в геном организма) - это метод получения клеток или целых организмов (мышей), в которых целенаправленно разрушен определенный ген или встроен дополнительный ген. Для осуществления подобного необходимо иметь:
1) клонированный заданный ген;
2) два «методических» гена для селекции искомых клеток с удачно инактивированным геном и соответствующую селективную среду культивирования;
3) особую уникальную линию перевивных стволовых эмбриональных мышиных клеток - ES (embryonic stem cell line), сохраняющих способность дифференцироваться в надлежащих условиях во все типы клеток организма мыши, включая гаметы;
4) здоровых мышей и трудолюбие примерно на год упорной работы.
Эванс, Кауфман и соавт. опубликовали в «Nature» работу о выведении перевиваемой (трансформированной) линии эмбриональных стволовых клеток - ES (embryonic stem cells). Независимо от них аналогичную работу выполнил G. Martin и опубликовал ее в том же
1981 г. в PNAS. Эти перевивные линии клеток авторы получили из эмбрионов мышей на самых ранних стадиях развития - стадиях бластулы, выводя их в культуру на подслой фидерных клеток - эмбриональных фибробластов в присутствии факторов, подавляющих дифференцировку (например, LIF - leukemia inhibitory factor).
Позже разные авторы вывели несколько линий и сублиний ES (D3, CCE, AB-1, E14TG2a, J1, R1, HM-1 и др.). Данные клетки используют для создания мутантных мышей - с отсутствием определенного гена (генетический нокаут) или с введением лишнего гена (генетический нокин) в исследовательских целях. Массовый характер работы по генетическому нокауту приняли с 1991 г. Работы по выведению эмбриональных стволовых клеток человека имеют место, но в настоящее время такие работы «не принимают» в ответственном научном сообществе по двум причинам:
1) всегда подозревается трансформированность перевиваемых in vitro клеток, т.е. возможность их опухолевого перерождения, что для подавляющего большинства биологов и медиков является абсолютным запретом на применение эмбриональных стволовых клеток у людей;
2) в настоящее время нет благоразумных аргументов для оправдания работ по созданию запланированных кем бы то ни было людей-мутантов, аналогичных мышам с генетическим нокаутом или нокином.
Методики удаления/встраивания генов основаны на природном феномене гомологичной рекомбинации. При половом размножении живых организмов природа «предусмотрела» мейоз и кроссинговер в мейозе, при котором происходят физическое сближение гомологичных генов в гомологичных хромосомах и обмен участками ДНК между гомологичными генами. Оказывается, если в клетку ввести отдельный ген, то он тоже в состоянии найти в хромосомах гомологичный себе ген (одноименный) и вступить с ним в гомологичную рекомбинацию, т.е. произвести обмен участками ДНК. Для направленного мутагенеза (или нокаута) заданного гена в клетку вводят не интактный гомологичный ген, а умышленно поврежденный. Дальше все происходит по природным механизмам: поврежденный, но гомологичный экзоген находит одноименный интактный клеточный ген, вступает с ним в гомологичную рекомбинацию, и в результате в хромосоме на месте прежнего интактного гена появляется поврежденный «подлог». Цель достигнута.
Учитывая выдающиеся возможности этой методики, опишем ее подробнее. В качестве «методических» генов используют обычно два - ген резистентности к неомицину neor и ген вирусной тимидинкиназы из вируса простого герпеса HSV-tk. Если в некой клетке есть ген neor, то такая клетка способна жить в присутствии препарата - аналога неомицина G418. Клетки, не имеющие гена neor, погибают в присутствии G418. Если в клетке есть вирусный ген HSV-tk, то такая клетка погибнет при добавлении в среду культивирования противовирусного препарата ганцикловира. Клеткам, не имеющим гена HSV-tk, ганцикловир не страшен.
Сначала в ДНК препарата заданного гена (т.е. in vitro), примерно в середину последовательности, встраивают ген neor. Сбоку на некотором расстоянии помещают ген HSV-tk. Это и есть экзогенетическая конструкция, необходимая и достаточная для попытки направленного мутагенеза в какой-либо клетке. Для «создания» целой мыши без заданного гена используют клетки линии ES. В них трансфицируют описанную выше генетическую конструкцию, клетки помещают в селективную культуральную среду, содержащую G418 и ганцикловир.
Возможны 3 варианта внутриклеточной «судьбы» экзогенетической конструкции:
1) она не встраивается в хромосомы и бесследно теряется при делении клетки; такие клетки, просто ES, погибают в селективной среде от отравления препаратом G418;
2) экзогенетическая конструкция встраивается на случайные места в геноме; она, как правило, сохраняет свою целостность, несет и ген neor, и ген HSV-tk; такие клетки тоже погибают в селективной среде, но под действием ганцикловира;
3) экзогенетическая конструкция находит гомологичный клеточный ген и вступает с ним в гомологичную рекомбинацию: эти клетки и есть искомые; «хвост» с геном HSV-tk (он вне гомологичной области) выщепляется и теряется при делении клетки; ген neor, поскольку он расположен в середине гомологичной последовательности ДНК, как раз оказывается встроенным в хромосому; в результате искомые клетки несут ген neor, но не несут ген HSV-tk и поэтому способны жить и делиться в селективной среде, содержащей и G418, и ганцикловир; такие клетки и выделяют из массы остальных.
В описанном варианте направленный мутагенез, или нокаут гена, произошел на одной из гомологичных хромосом. Его можно выполнить и на обеих гомологичных хромосомах, для чего нужны еще два других «методических» гена для селекции. Но мышей с нокаутом гена можно получить и в случае нокаута одного из гомологичных генов в клетках ES следующим образом. От «свежезабеременевшей» мыши выделяют эмбрионы на стадии бластулы или морулы (или проводят оплодотворение in vitro). В эти ранние эмбрионы инъецируют одномутированные клетки ES и имплантируют их в матку подготовленной псевдобеременной самке. Из такой сконструированной бластулы развиваются здоровые (по мышиным меркам) эмбрионы, рождаются мышата-мозаики, часть клеток которых во всех тканях, включая половые клетки, происходит из одномутированных клеток ES. Поскольку половые клетки гаплоидны, то часть из них несет в «чистом виде» нокаутированный ген.
Подобных мышат используют для инбредного размножения, и в потомстве второго поколения какая-то часть мышат обязательно получается гомозиготной по нокаутированному (испорченному) гену. Это и есть конечная цель работы. Чтобы удостовериться в правильности полученного результата, выполняют контрольную ПЦР на ген neor.
Таких мышей размножают инбридингом и получают необходимое и достаточное для запланированной работы число особей с заданным генетическим нокаутом (т.е. с отсутствием функционально дееспособного гена).
Генетический нокаут возможен только в отношении генов, отсутствие которых позволяет организму развиться, родиться и начать жить. Если какой-то ген абсолютно необходим для реализации онтогенеза организма, то нокаут по данному гену осуществим в перевиваемых in vitro клетках, и в какой-то мере на моделях in vitro исследуемы последствия отсутствия гена для жизнедеятельности клетки.
Вышеперечисленным потенциал метода не исчерпывается. Можно получить библиотеку экзогенов, в которых «методический» ген (а именно его внедрение и нарушает генетический код, т.е. является мутирующим фактором) повреждает разные участки исследуемого гена. Одним из генов библиотеки производят нокаут. Затем в отдельные «нокаутированные» клетки трансфицируют интактный ген (если происходит реставрация экспрессии соответствующего белка, то она доказывает «от противного»: исходно сделанный нокаут был истин-
ным), а также (по одному) разные гены из библиотеки поврежденных генов. Анализируют, не произойдет ли реставрация экспрессии продукта в случае ретрансфекции каких-то генов из поврежденных. Таким образом, удается установить функциональную нагрузку различных участков одного гена.
Существенные усовершенствования в методы генетического нокаута внесли работы B. Sauer (1993), N.J. Kilby и соавт. (1993), H. Gu и K. Rajewsky (1993) и других исследователей, первыми использовавших сайтспецифичную рекомбиназу Cre (Causes recombination), выделенную Sauer из бактериофага Р1. Если в геном мыши ввести ранее описанным методом «слева» и «справа» от интересующего гена сайты, специфичные для Cre, то вырезание гена (точнее, его инверсию и как следствие потерю функции) можно осуществить не в клетках ES, а в любой момент онтогенеза, т.е. у мышей в любом возрасте. Последовательность нуклеотидов, узнаваемая Cre, носит название LoxP (locus of X-over P1) и состоит из 34 пар оснований, включающих 13 пар инвертированных повторов по краям: ATAACTTGGTATAGCATACAT-TATACGAAGTTAT.
Систему «LoxP-Cre» используют и в модели трансгенных мышей. Таким образом, существуют способы тканеспецифичного выключения заданного гена в заданный момент онтогенеза. Это весьма трудоемкие работы, но их познавательная ценность сегодня кажется огромной.
Трансгенная мышь есть мышь, в чей геном введен посторонний ген (экзоген). Чтобы «сделать» трансгенную мышь, необходимо иметь в качестве препарата чистую ДНК, строго воспроизводящую последовательность нуклеотидов заданного экзогена (как минимум). Обычно к ДНК экзогена с определенным смыслом пристраивают еще регуляторные последовательности ДНК-промоторы и энхансеры. Получают вектор экспрессии в виде кольцевой ДНК (фактически - искусственный вирус).
«Готовят» мышь-самку: ей вводят фолликулостимулирующий гормон и хорионический гонадотропин для индукции суперовуляции. Такую самку спаривают с самцом, после чего у самки быстро извлекают оплодотворенные яйцеклетки. Микроманипулятором в мужской пронуклеус инъецируют ДНК экзогена в дозе несколько сот копий, и такие яйцеклетки имплантируют в матку или яйцеводы другой подготовленной псевдобеременной самки. И ждут от нее потомства. Опыт показывает, что примерно 25% новорожденных мышат несут
экзоген (теперь уже трансген) в своем геноме. Экзогены ковалентно встраиваются (интегрируются) в одно или в несколько десятков мест собственного генома мыши (кстати, как ретровирусы типа ВИЧ). Если в собственном геноме нет генов, гомологичных экзогену, то встраивание экзогена происходит в случайные места генома.
Встраивание осуществляется очень быстро после ввода экзогенной ДНК в пронуклеус - до первой репликации ДНК зиготы, так как большинство мышей, получивших экзоген (75%), имеют его в каждой клетке своего тела, включая гаметы. Интересно, но факт: встраивание чужеродной ДНК в геном в большинстве случаев допускает нормальное развитие и рождение организма, разумеется, если трансген не кодирует синтез токсичного для организма белка. В первом поколении мышей трансген находится в гетерозиготном состоянии. Таких мышей спаривают, и во втором поколении отбирают гомозигот по трансгену. Вот они уже и есть полноценные трансгенные мыши.
Дополнение трансгена тканеспецифичными и/или индуцибельными промоторами позволяет манипулировать экспрессией трансгена по усмотрению экспериментатора (не во всех клетках; а только, например, в Т-лимфоцитах или только в β-клетках островков Лангерганса, не постоянно, а только после введения в организм индуктора). Таким образом, можно изучать как будут проходить развитие и жизнедеятельность организма при излишней экспрессии определенного гена (overexpression).
6.4. ПРИМЕНЕНИЕ РЕГУЛЯТОРНЫХ МИКРО-РНК В ИММУНОЛОГИЧЕСКИХ ИССЛЕДОВАНИЯХ
Клетки животных содержат множество некодирующих РНК, таких, как транспортная РНК и рибосомальная РНК, а также регуляторные РНК, влияющие на экспрессию других генов. Один из классов малых некодирующих РНК - микроРНК (miRNA) - охарактеризован как наиболее многочисленный и филогенетически обширный. На генах микроРНК синтезируются миниатюрные транскрипты длиной приблизительно в 22 нуклеотида, функционирующие как негативные регуляторы других РНК. Первая молекула miRNA - lin-4 - открыта только в 1993 г. и охарактеризована V. Ambros и соавт. при скрининге генов нематоды Caenorhabditis elegans. Последующее изучение функций этого класса молекул показало их участие во многих физиологических процессах: пролиферации, дифференцировки, клеточной
гибели и т.д. (табл. 6.1). Нарушение функций микроРНК может привести к различным заболеваниям, в том числе раковым.
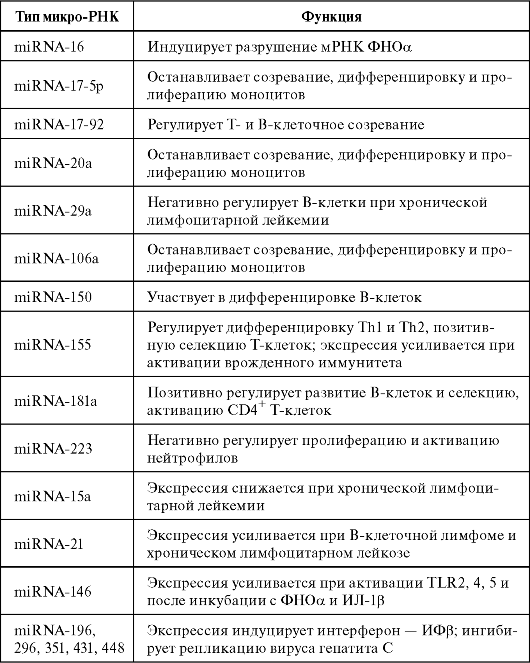
Таблица 6.1. Функции и мишени miRNA, участвующих в иммунном ответе (модифицирована по Lindsay M.A., 2008)
 В
настоящее время известно более 700 различных молекул miRNA, и они
регулируют более 30% генов человека. Микро-РНК - пожалуй, самый большой
класс регуляторов белков.
В
настоящее время известно более 700 различных молекул miRNA, и они
регулируют более 30% генов человека. Микро-РНК - пожалуй, самый большой
класс регуляторов белков.
Молекулярный механизм формирования зрелой молекулы miRNA следующий. Первоначально РНК-полимеразой II транскрибируется длинный олигонуклеотид, называемый первичной микро-РНК (primiRNA). Молекула pri-miRNA кепирована и полиаденилированна, как и другие транскрипты РНК-полимеразы II. Участки, кодирующие miRNA, могут располагаться как в интронах белоккодирущих генов, так и в экзонах и интронах генов, которые белок не кодируют. Pri-miRNA имеет длину около 60-80 оснований и содержит в своей структуре одну или несколько петель. Такая структура распознается ферментом РНКазой III, называемой Drosha, и ее кофактором DGCR8. Молекула pri-miRNA разрезается этим ферментом до молекулы предшественника микроРНК - pre-miRNA. Pre-miRNA на своем 3' конце содержат два основания, которые распознаются белком экспортином-5. Данный белок, связываясь с pre-miRNA, транспортирует ее через ядерную мембрану в цитоплазму, где находится другая РНКаза III - Dricer, разрезающая pre-miRNA и оставляющая от нее участок в 20-23 нуклеотида. Таким образом, формируется зрелая miRNA, встраивающаяся в белковый комплекс RISC (RNA-induced silecing complex). Только в составе такого комплекса miRNA способна оказывать свое действие на мРНК, заключающееся в разрушении мРНК-мишени или в торможении ее трансляции. Негативная регуляция мРНК реализуется за счет комплементарности между miRNA и мРНК-мишенью. Когда связь miRNA с участком 3' UTR (3'-нетранслируемый регион) мРНК-мишени несовершенна вследствие неполной комплементарности, происходит репрессия трансляции. Когда же комплементарность сохранена полностью, мРНК-мишень разрушается комплексом RISC.
В последние годы особый интерес вызывает возможность регулирования врожденного и адаптивного иммунного ответа с помощью семейства miRNA.
На сегодняшний день хорошо охарактеризована небольшая группа молекул miRNA, участвующих в регуляции генных механизмов врожденного иммунитета. Мы приводим данные о наиболее изученных miRNA, играющих важную роль в регуляции генов врожденного иммунитета.
MiRNA-146
Семейство miRNA представлено двумя молекулами: miRNA-146а и miRNA-146b. Они локализованы на хромосомах 5 и 10 соответственно. Молекулы отличаются лишь по двум нуклеотидным основаниям в 3' регионе. Важность этих miRNA для врожденного иммунитета впервые показал K.D. Таganov и соавт. (2006). Уровень miRNA в клетках линии THP-1 человека повышается в ответ на стимуляцию липополисахаридом (ЛПС) - лигандом TLR4. Такой же эффект наблюдается в ответ на активацию паттернами бактерий и некоторых грибов TLR2, 4 или 5, а также после действия провоспалительных цитокинов (ФНОα и ИЛ-1β). Экспрессия miRNA-146 не повышается в ответ на активацию TLR3, рецепторов 7 и 9. Увеличения уровня miRNA-146а не происходит при стимуляции ИЛ-1β эпителиальных клеток легких и бронхов. В промоутерном регионе miRNA-146а выявлены несколько потенциальных транскрипционных факторов, которые могут быть вовлечены в регуляцию экспрессии этой молекулы: IRF3, IRF7 (interferon regulatory factor) и CCAAT enhancer-binding protein-b (C/EBPb). Однако непосредственный регулятор экспрессии микроРНК-146 до сих пор не известен. При изучении мишеней для miRNA-146 показано: молекула может блокировать мРНК генов адаптерных белков IRAK1 (IL-1 receptor associated kinase 1) и TRAF6 (TNF receptor-associated factor 6). IRAK1 и TRAF6 - адаптерные белки, участвующие в передаче сигнала с TLR и рецептора ИЛ-1. Отрицательная регуляция данных молекул с помощью miRNA-146 приводит к тому, что сигнал с TLR не проводится в клетку и провоспалительные медиаторы не секретируются. Это может иметь чрезвычайно важное значение при разработке новых TLR-опосредованных подходов в регуляции врожденного иммунитета через адаптерные молекулы.
MiRNA-155
MiRNA-155 образуется из первичного транскрипта, который считывается со второго экзона белокнекодирующего гена, называемого «BIC». Ранние исследования miRNA-155 показали усиленную экспрессию этой молекулы у человека при В-клеточной лимфоме. Трансгенная экспрессия miRNA-155 в В-клетках мышей приводит к малигнизации, что дало основание для предположения о роли miRNA-155 в дифференцировке и пролиферации В-лимфоцитов. Ведущая роль miRNA-155 в регуляции Т- и В-клеточного ответа
выявлена в исследованиях на мышах, дефицитных по miRNA-155. У них не развивается оптимальный иммунный и протективный ответ на патогены после иммунизации. В последние годы показано значение miRNA-155 в реакциях врожденного иммунитета. Экспрессии miRNA-155 возрастает после стимуляции ЛПС и липопротеином (лиганд TLR2) в моноцитах, макрофагах и в спленоцитах мышей, которых иммунизировали Salmonella enteritidis, содержащей ЛПС. В отличие от таковой miRNA-146а экспрессия miRNA-155 увеличивается и после активации врожденного иммунного ответа вирусными и бактериальными нуклеотидами, имеющими в своей структуре лиганды для TLR3 - poly (I:C) и для TLR9 - CpG. Экспрессия miRNA-155 может возрастать в ответ на стимуляцию ИФβ и ИФγ. Количество miRNA-155 варьирует после стимуляции ФНОа и зависит от сроков инкубации с цитокином. В подобных случаях miRNA-155 оказывает как позитивное, так и негативное действие на экспрессию своих мишеней (NF-κΒ, IKKb, IKKe, а также FADD домен - Fasassociated death domain и Ripk 1 - receptor iteracting serine - threonine kinase 1). В отличие от miRNA-146, miRNA-155 позитивно регулирует экспрессию провоспалительных цитокинов в процессе врожденного иммунного ответа. Такой эффект продемонстрирован на эмбриональных клетках человека (HEK-293), в которых miRNA-155 увеличивает продукцию ФНОа путем снижения связанной с 3' UTR посттрансляционной ингибицией. Усиленная экспрессия miRNA-155 наблюдается в В-клетках мышей, трансгенных по miRNA-155. При очень высоких уровнях miRNA-155 мыши высокочувствительны к септическому шоку. Трансфекция miRNA-155 в гемопоэтические стволовые клетки и трансплантация их летально облученным мышам приводят к появлению у них признаков миелоидной неоплазии. Эти данные позволили авторам предположить, что связь между воспалением и канцерогенезом вызвана хронически высоким уровнем miRNA-155.
MiRNA-223 - регулятор пролиферации и активации нейтрофилов
Многими исследованиями показано: экспрессия miRNA-223 связана с миелоидными клетками в костном мозгу; она повышается при дифференцировке миелоидных предшественников в гранулоциты. Интересны наблюдения за мышами с нокаутом гена miRNA-223, которые оставались здоровыми и у них обнаруживалось повышенное число предшественников гранулоцитов в костном мозгу и зрелых
нейтрофилов в циркуляции. Считается, что miRNA-223 вовлечена в негативную регуляцию созревания, но не дифференцировки гранулоцитов. Действие miRNA-223, вероятно, опосредовано через отрицательное влияние другого миелоидного фактора (подобного ELF-1). Этот транскрипционный фактор участвует в пролиферации клеток миелоидного ряда. Функциональные исследования циркулирующих нейтрофилов нокаутных животных показали: miRNA-223 не вовлечена в выход клеток из сосудистого русла, миграцию или фагоцитоз ими Escherichia coli. Однако уменьшение количества miRNA- 223 приводит к усилению кислородного взрыва и цитотоксического ответа на действие грибов Candida albicans. У животных, нокаутных по miRNA-223, спонтанно развиваются воспалительные процессы в легких и наблюдается повышенное разрушение тканей после воздействия эндотоксинов. Обнаруживается быстрое и селективное увеличение экспрессии miRNA-223 в эпителии легких и бронхов после аэрозольного воздействия токсином. Большое количество факторов может регулировать экспрессию miRNA-223 в процессе дифференцировки и созревания гранулоцитов.
Таким образом, накапливается все больше фактов, свидетельствующих о том, что микроРНК представляет собой новый большой класс регуляторных молекул, участвующих во многих физиологических процессах организма. Важную роль микроРНК играют в развитии врожденного иммунного ответа. В основном эти молекулы блокируют или активируют адаптерные молекулы, которые необходимы для проведения сигнала с рецепторов врожденного иммунитета или для регуляции факторов транскрипции, участвующих в дифференцировке и созревании различных клеток врожденного иммунитета. Важно, что данные молекулы реализуют свое действие на посттранскрипционном уровне, благодаря чему изучение микроРНК представляет интерес, ибо, вероятно, оно будет способствовать более глубокому пониманию механизмов регуляции врожденного иммунитета. Следует отметить перспективность такого направления исследований, так как с каждым годом возрастает количество данных о возможностях miRNA регулировать врожденный иммунитет. Несомненно: miRNA вскоре станут основой для создания перспективных лекарственных средств, дающих эффект строго направленной коррекции нарушений врожденного иммунитета. Становится очевидной и необходимость разработки новых подходов к синтезу miRNA, изучению механизмов
их действия, поиску молекул-мишеней и новых методов тестирования, основанных в первую очередь на принципе ПЦР (см. табл. 6.1).
В настоящее время известно несколько методов для определения экспрессии генов микроРНК в биологических образцах.
Первым методом анализа является Northern blot. Он хорошо изучен и описан, однако довольно трудоемок, а кроме того, существует много ограничений использования образцов. Для определения зрелой микроРНК в пробе общую РНК наносят на 12% денатурирующий полиакриламидный гель. В качестве маркера используют низкомолекулярный олигонуклеотид. После электрофореза пробы помещают на мембрану и проводят гибридизацию с олигонуклеотидными пробами (меченными 32Р изотопом или другой меткой), комплементарными зрелой форме изучаемой микроРНК. Далее мембраны отмывают от несвязавшихся олигонуклеотидных последовательностей и осуществляют детекцию с помощью радиочувствительной пленки (если метка 32Р).
В последнее время для обнаружения молекул микроРНК в биологическом образце используют метод микрочипов (см. выше). Он позволяет исследовать образец на наличие одновременно большого количества молекул микроРНК. Недостаток такого подхода - необходимость содержания в образце больших количеств исследуемой РНК, что не всегда возможно.
Из клеточной культуры, в которой нужно определить микроРНК, выделяют общую РНК. Выделенный материал инкубируют с малыми последовательностями РНК, меченными флуоресцентными метками (Cy5, Cy3 и др). Далее меченый образец наносится на микрочип, содержащий ДНК-последовательности известных (по крайней мере 200) молекул микроРНК. После инкубации в течение 14 ч происходит гибридизация и затем планшет отмывается. Результат считывается при помощи флуоресцентного сканера (методически процесс описан выше). По свечению в лунках планшета определяют, какой из 200 образцов микроРНК экспрессируется в пробе.
Новый метод для определения уровня экспрессии генов микроРНК - количественная обратная транскрипция с ПЦР (ОТ-ПЦР) (см. выше). Этот метод имеет высокую специфичность и чувствительность.
Чтобы исследовать микроРНК с помощью ПЦР, необходимо модифицировать последнюю, ибо праймеры в обычной системе для ПЦР имеют тот же размер, что и исследуемая микроРНК. Разработан
новый методический подход, основанный на модификации ПЦР, названный miR-Q. Первым шагом в данной методике является встраивание последовательности искомой микроРНК в кДНК с известной последовательностью. Это осуществляется при реакции обратной транскрипции. После проводят ПЦР и детекцию полученного амплификата2.
Вопросы и задания
1. Какие молекулярно-генетические методы используются для решения иммунологических задач?
2. Дайте определение термина «полимеразная цепная реакция» и опишите суть метода.
3. Какие существуют модификации ПЦР, применяемые в иммунологии? Почему они используются?
4. Нарисуйте схему последовательности этапов ПЦР.
5. Опишите трудности, возникающие при постановке ПЦР.
6. Перечислите преимущества ПЦР перед другими методическими подходами.
7. Что такое микрочипы?
8. Какие виды микрочипов вы знаете?
9. Какие иммунологические цели достижимы при использовании микрочипов?
10. Опишите метод получения мышей с нокаутом (knock-out) и нокином (knock-in) генов.
11. Как получить трансгенную мышь?
12. Что такое регуляторные микроРНК?
13. Каким образом регуляторные микроРНК могут быть применены в иммунологических исследованиях?
14. Назовите основные методы для определения микроРНК.
15. Что такое гибридомы?
16. Дайте определение моноклональных антител.
17. Опишите этапы получения гибридом.
18. Проиллюстрируйте принципы метаболической селекции клеток.
2 В подготовке материалов главы 6 приняла участие студентка VI курса МБФ РГМУ Е.А. Акимова.