Иммунология : практикум : учеб. пособие / [Ковальчук Л. В. и др.] - 2010. - 176 с. : ил.
|
|
|
|
ГЛАВА 4 ИММУНОАНАЛИЗЫ
Термин «иммуноанализ» в международной литературе применяют не к любым методам исследований, используемым в иммунологии, а только к тем, в которых ключевыми взаимодействующими субстанциями являются исходно растворимые «антиген» (или лиганд) и «антитело». В более чем 99% современных тест-систем иммуноанализов один из компонентов (либо антиген, либо антитело) сорбирован на твердой фазе, но сорбированы они из исходно растворимого состояния.
Область применения иммуноанализов широка, но чаще их используют с диагностическими целями практически во всех отраслях медицины, а также в ветеринарии и биологии. Нередко иммуноанализы находят совершенно необычное применение. Например, итальянские виноделы для осветления вина марки «мерло» используют пшеничную муку. Полученный винный продукт может содержать пшеничный глютен, опасный для больных целиакией. Иммуноанализы позволяют выявить присутствие глютена и забраковать такое вино.
В 20-30 гг. ХХ века (после работ Ф. Обермейера, Е.П. Пика, К. Ландштейнера и других ученых, получавших антитела к искусственно синтезированным антигенам) к антителам стали относиться как к высокоспецифическим реагентам, избирательно связывающим то или иное вещество, способное быть антигеном при иммунизации животных.
Чтобы лучше понять суть методов иммуноанализов, полезно осознать их отличие от иных исследований, применяемых в современной иммунологии. В фундаментальных исследованиях по иммунологии используют фактически все известные в биологических науках методы. Самые современные - методы молекулярной биологии и молекулярной генетики. В прикладной клинической иммунологии методическая база не столь широка. По сути иммунологическими называют такие методы, в которых так или иначе визуализируются реакции «антиген-антитело».
Антитела - растворимые молекулы белков. Антигены бывают разные (корпускулярные, растворимые, нерастворимые), но далеко не все видны невооруженным глазом (как, например, эритроциты в реакциях
гемолиза или агглютинации). Связывание двух растворимых молекул часто приводит к образованию также растворимого иммунного комплекса, следовательно, невидимого глазом. Поэтому с технической стороны разные тест-системы иммуноанализа различаются между собой средствами визуализации факта связывания антитела с антигеном. С 1948 г. и до конца 1960-х гг. методы визуализации комплексов антиген-антитело представляли собой преципитацию в геле (методы Оухтерлони, Манчини, варианты иммуноэлектрофореза в геле), т.е. выпадение этих комплексов в осадок, а также гемолиз или гемагглютинацию с использованием хорошо видимых эритроцитов, на поверхность которых сорбировали либо антиген, либо (реже) антитела.
4.1. МЕТОДЫ ОПРЕДЕЛЕНИЯ ПРЕЦИПИТАТОВ АНТИТЕЛ С АНТИГЕНАМИ В ГЕЛЕ
Встречная иммунодиффузия по Оухтерлони и Элеку
В 1948 г. Орьян Оухтерлони (Orjan Ouchterlony) и независимо от него Стефан Элек (Stephen Elek) опубликовали разработанную ими методику двойной, или встречной, иммунодиффузии, т.е. диффузии антител и антигенов навстречу друг другу в геле. Эти исследователи обнаружили и использовали физико-химические свойства агарового геля, поры которого имеют размеры, достаточные, чтобы пропустить (дать возможность диффундировать) молекулы свободных антител и многих растворимых антигенов, но задерживающие более крупные по размеру комплексы антител с антигенами. В результате в месте встречи антител с антигенами выпадает осадок; в геле он виден невооруженным глазом как полоса преципитации. Оухтерлони и Элек подобрали концентрацию агар-агара - 1,25-1,5%.
Порядок постановки реакции следующий.
1. Агар растворяют в физиологическом растворе при 56 °С (температура расплавления агара).
2. В виде золя агар выливают на плоское стекло. При охлаждении до комнатной температуры агар застывает в гель.
3. В застывшем геле пробивают трубочкой-пробойником правильные круглые отверстия (лунки) небольшого диаметра (~2-3 мм).
4. В эти лунки вносят образцы антисыворотки и растворы антигенов.
5. Оставляют на диффузию в течение 16-24 ч, по истечении которых можно наблюдать полосы преципитации, если в исследуемых образцах присутствовали комплементарные друг другу лиганды.
Метод Оухтерлони и Элека иллюстрирует рис. 4.1. (см. также цв. вклейку).
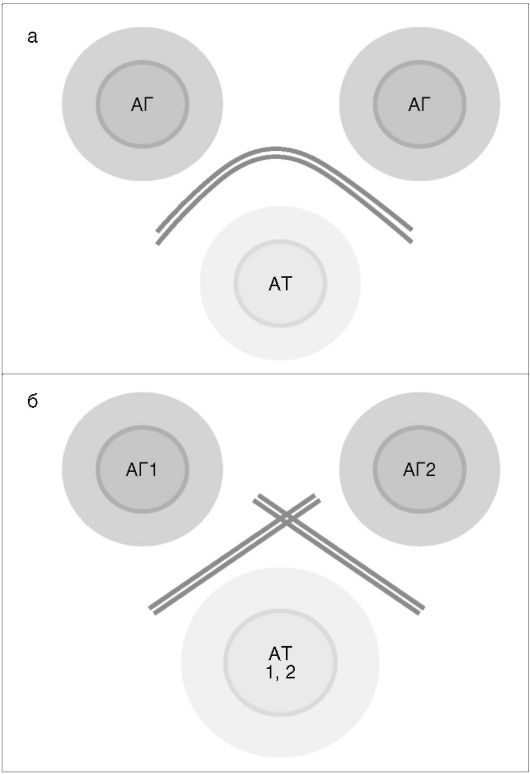 Рис. 4.1. Метод
Оухтерлони и Элека: а - линии преципитации, при диффузии двух
одинаковых антигенов (АГ) навстречу антителам (АТ), плавно сливающиеся
друг с другом; б - линии преципитации, при диффузии двух разных
антигенов навстречу антителам, не сливающиеся, а пересекающиеся между
собой, «не замечающие» друг друга
Рис. 4.1. Метод
Оухтерлони и Элека: а - линии преципитации, при диффузии двух
одинаковых антигенов (АГ) навстречу антителам (АТ), плавно сливающиеся
друг с другом; б - линии преципитации, при диффузии двух разных
антигенов навстречу антителам, не сливающиеся, а пересекающиеся между
собой, «не замечающие» друг друга
Радиальная иммунодиффузия по Манчини
В 1965 г. Джульетта Манчини и соавт., а независимо от них - Д.Л. Фэй и Э.М. МакКелви разработали методику радиальной иммунодиффузии (РИД) в том же агаровом геле для количественного определения содержания в крови (в сыворотке) иммуноглобулинов классов А, G и М.
Для этого потребовалось получить моноспецифические антисыворотки лабораторных животных против очищенных иммуноглобулинов классов М, А и G человека. Моноклональных антител в те годы еще не было.
Манчини, Фэй и МакКелви воспользовались тем физикохимическим свойством агар-агара, что температура его плавления недалека от физиологических температур теплокровных животных, и белки (по крайней мере иммуноглобулины) не претерпевают калечащую денатурацию при температуре плавления агара. Это позволило авторам ввести в состав золя агара, т.е. в жидкую фазу, антисыворотки против иммуноглобулинов разных изотипов, тщательно перемешать раствор перед заливанием на стеклянную пластину. Таким образом, в слое агарового геля оказываются заплавленными антииммуноглобулиновые антиизотипические антитела. В таком геле пробивают круглые луночки, в которые вносят так называемые стандарты (или калибраторы, т.е. растворы иммуноглобулинов с известной концентрацией для построения калибровочной кривой) и пробы испытуемых сывороток и оставляют на свободную диффузию на 16-24 ч.
По истечении этого времени вокруг луночек образуются видимые невооруженным глазом кольца преципитатов. Опыт показал: диаметр колец преципитатов тем больше, чем выше концентрация данного изотипа иммуноглобулинов в исследуемой биопробе. Калибраторы - препараты иммуноглобулинов заданного изотипа с известной весовой концентрацией (мг/мл) - позволяют построить калибровочную кривую и с ее помощью определить концентрации иммуноглобулинов в испытуемых пробах сывороток. Последнее возможно только на прямом отрезке кривой. Для спрямления калибровочной кривой прибегают к несложным математическим действиям, например откладывают на осях координат не диаметр колец преципитации, а квадрат этой величины, и/или не концентрацию изотипа иммуноглобулинов, а логарифм концентрации по основанию 2 или 10. Какой подход окажется приемлемым, подбирают опытным путем в каждой лаборатории.
Хотя метод РИД разработан полвека назад, его нередко используют в лабораториях клинической иммунологии до настоящего времени в силу простоты исполнения, относительно невысокой стоимости реагентов и независимости от приборов.
Метод РИД применим только для названных изотипов иммуноглобулинов (М, А и G), ибо их физиологические концентрации в сыворотках крови попадают в пределы чувствительности метода (мг/мл).
Изотипы IgD и IgE присутствуют в нормальных сыворотках в таких низких концентрациях, которые метод РИД не «видит». Концентрации IgE определяют с помощью высокочувствительных вариантов иммуноферментного анализа - ИФА (см. ниже):
1) общий IgE - ловушечным ИФА, в котором первым слоем на твердой фазе сорбированы моноклональные антиизотипические анти-ε-антитела;
2) для определения антигенспецифичных IgE антигены сорбируют на пористой твердой фазе, где площадь сорбции существенно превосходит дно планшета при одном и том же реакционном объеме; чувствительность определения соответственно существенно выше.
IgD в норме присутствует в сыворотках в следовых количествах, и задача его измерения встает крайне редко (вероятно, только в случаях IgD-продуцирующих плазмоцитом).
В табл. 4.1 и 4.2 приведены нормальные концентрации иммуноглобулинов разных изотипов у людей разного возраста (по данным более современного нефелометрического определения с использованием антиизотипических моноклональных антител и прибора нефелометра).
Таблица 4.1. Концентрации иммуноглобулинов классов М, А и G в сыворотке крови человека в норме
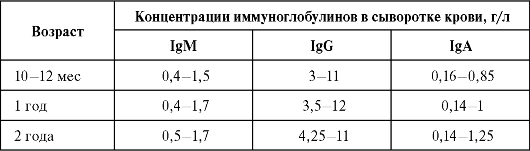 Окончание табл. 4.1
Окончание табл. 4.1
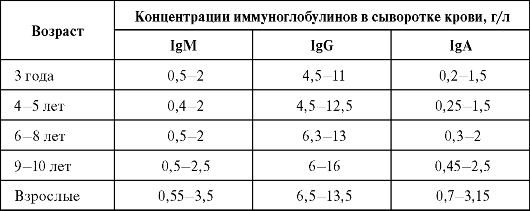 Таблица 4.2. Концентрация изотипов IgG (1, 2, 3, 4), IgA (1, 2) и IgE в сыворотке крови взрослого человека в норме
Таблица 4.2. Концентрация изотипов IgG (1, 2, 3, 4), IgA (1, 2) и IgE в сыворотке крови взрослого человека в норме
 Поскольку
IgE в норме в крови присутствует в низкой концентрации, то для снижения
вероятности ошибок при записывании нулей по международной
договоренности значения IgE выражают в так называемых международных
единицах - МЕ/мл или кМЕ/л (IU/ml, kIU/l). 1 МЕ равна 2,43 нг IgE.
Поскольку
IgE в норме в крови присутствует в низкой концентрации, то для снижения
вероятности ошибок при записывании нулей по международной
договоренности значения IgE выражают в так называемых международных
единицах - МЕ/мл или кМЕ/л (IU/ml, kIU/l). 1 МЕ равна 2,43 нг IgE.
Лабораторная работа 4-1
Определение уровня IgМ, IgA и IgG в сыворотке человека методом радиальной иммунодиффузии
1. Готовят 1,25-1,5% раствор агар-агара (или синтетической агарозы) в 0,1 М веронал-мединаловом буфере с рН 8,6 (на 1 л воды берут 0,8 г веронала и 4,5 г мединала). Навеску агара (агарозы) заливают буфером и нагревают на водяной бане при 56 °С до полного растворения полимера.
2. В раствор агара добавляют рассчитанное количество (расчет производят, исходя из данных, приведенных в листовке-вкладыше к коммерческим реагентам) антиизотипической антисыворотки,
быстро и тщательно перемешивают. Каждый вариант антиизотипической антисыворотки добавляют в отдельную пробирку с раствором агара (агарозы).
3. Раствор смеси агара (агарозы) с антиизотипической сывороткой быстро выливают на подготовленные обезжиренные стеклянные пластины и кладут их на горизонтальный предметный столик для ровного затвердевания агара/агарозы в гель. Гель прозрачен и бесцветен. На стандартное предметное стекло для микроскопических препаратов (площадью 1875 мм2) требуется примерно 3,2 мл смеси раствора агара с антисывороткой.
4. В геле, подложив под стекло с гелем трафарет, специальной трубочкой-пробойником диаметром 2-3 мм делают два (или больше, что зависит от размеров стекол и количества испытуемых биопроб) ряда лунок. Расстояния между центрами лунок - порядка 1,5 см.
5. Заранее рассчитывают и подготавливают растворы калибровочных иммуноглобулинов (иногда называемые стандартами) в трех известных концентрациях.
6. В три лунки (диаметром 2 мм) заливают автоматической пипеткой (дозатором) по 5 мкл калибровочных растворов иммуноглобулинов, в остальные лунки - также по 5 мкл - заливают испытуемые сыворотки.
7. Стекла помещают во влажную, плотно закрываемую посуду и выдерживают в холодильнике при +4 °С 24-48 ч. За это время происходит спонтанная диффузия белков из лунок в гель и образование преципитатов между иммуноглобулинами, содержащимися в испытуемых сыворотках, и антиглобулиновыми антиизотипическими антителами, содержащимися в агаровом геле. Поскольку диффузия свободно идет во всех направлениях, преципитаты имеют форму правильных колец. Преципитаты видны невооруженным глазом, и диаметры колец измеряют в миллиметрах.
8. Для снижения фона образования неспецифических преципитатов пластины можно отмывать раствором с высокой ионной силой - 5% NaCl: в течение 48-72 ч промывочный раствор меняют несколько раз.
9. Если задачи работы требуют долгосрочного хранения препаратов, то гель на стеклах с преципитатами фиксируют и красят анилиновыми красителями, прокрашивающими белки, например кумасси-голубым (на 1 г сухого красителя - 50 мл ледяной уксусной кислоты и 150 мл воды).
Окрашенные препараты с кольцами преципитатов промывают и высушивают.
Внешний вид стекол с результатами РИД и калибровочная кривая показаны на рис. 4.2 (см. также цв. вклейку).
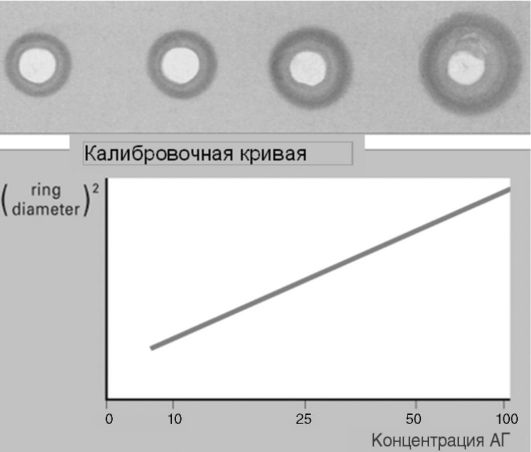 Рис. 4.2. Внешний вид стекол с результатами РИД и калибровочная кривая
Рис. 4.2. Внешний вид стекол с результатами РИД и калибровочная кривая
Иммуноэлектрофорез
В те же 40-е гг. XX в. биохимики научились проводить электрофоретическое разделение белков в гелевых средах. В 1953 г. П. Грабар и К. Уиллиамс (P. Grabar, C.S. Williams) предложили методику иммуноэлектрофореза, которая фактически представляет собой комбинацию электрофоретического разделения белковых смесей и метода Оухтерлони и Элека. В геле с одного края пластины пробивают ряд из несколько лунок, в которые вносят исследуемые на содержание тех или иных интересующих белков растворы или сыворотки пациентов. К пластине с гелем прикладывают электрическое поле и проводят электрофорез. По завершении электрофореза в геле в центре пластины вырезают канавку, параллельную направлению движения белков в электрическом поле. В эту канавку вносят антисыворотку или смесь антител против искомых белков и оставляют на 16-24 ч
для диффузии, после чего регистрируют образующиеся полосы преципитации. Число полос преципитации показывает, к какому количеству компонентов, находящихся в биопробе, в антисыворотке есть комплементарные антитела. Если при электрофорезе использовать калибраторы, т.е. известные белки в достаточных концентрациях, то сравнение полос преципитации материала из биопроб с полосами преципитации с калибровочными белками может стать доказательством наличия в испытуемом материале конкретного белка(ов).
Существует множество модификаций метода иммуноэлектрофореза. На рис. 4.3 проиллюстрировн наиболее простой и употребляемый вариант.
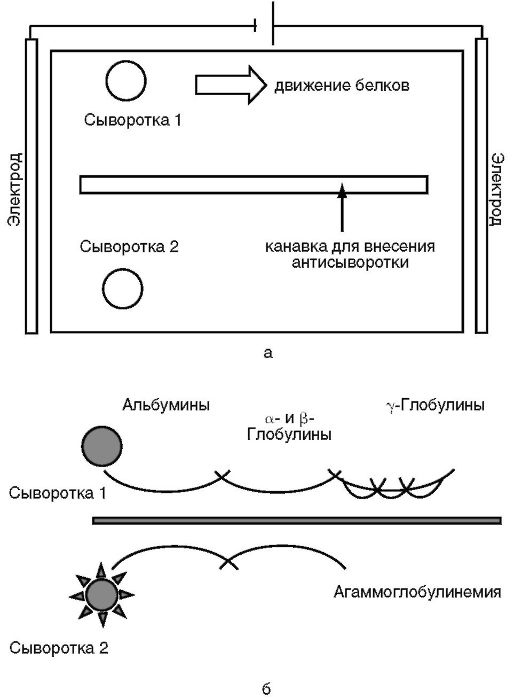 Рис. 4.3. Схема иммуноэлектрофореза по Грабару и Уиллиамсу: а - схема установки; б - результаты электрофореза
Рис. 4.3. Схема иммуноэлектрофореза по Грабару и Уиллиамсу: а - схема установки; б - результаты электрофореза
В стартовые лунки для электрофореза внесены сыворотки крови двух пациентов - 1 и 2, в канавку в центре пластины по завершении электрофореза проб сывороток внесена смесь антисывороток против основных фракций сывороточных белков - альбуминов, α-, β- и γ-глобулинов. После диффузии сыворотки-1 видны дуги преципитации со всеми основными фракциями сывороточных белков, в том числе с иммуноглобулинами. В сыворотке пациента 2 гамма-глобулины отсутствуют. На основании данных электрофореза пациенту 2 поставлен диагноз агаммаглобулинемии.
«Ракетный» иммуноэлектрофорез
Если к гелю на стеклах, полностью подготовленных для выполнения метода радиальной иммунодиффузии, приложить электрическое поле, то движение компонентов сывороток, в том числе иммуноглобулинов, из лунок в толщу геля будет происходить не в режиме спонтанной диффузии, а в принудительном режиме по силовым линиям электрического поля, что существенно ускоряет процесс. В результате преципитаты станут видны уже примерно через 1 ч, но будут иметь форму не колец, а вытянутых пиков, напоминающих летательные аппараты - ракеты. Такую модификацию метода иммунодиффузии называют «ракетным» иммуноэлектрофорезом. Внешний вид результатов «ракетного» иммуноэлектрофореза показан на рис. 4.4.
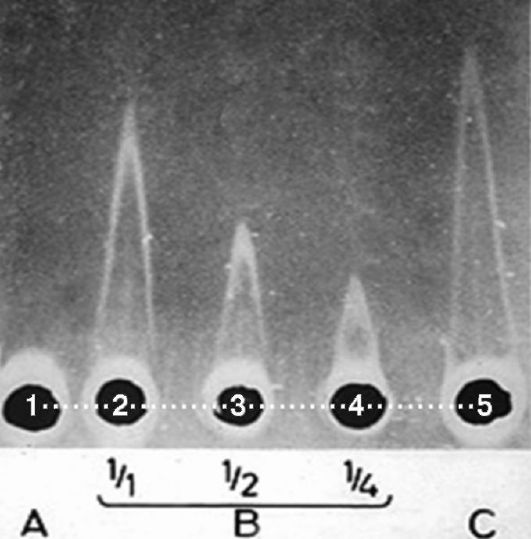 Рис. 4.4. «Ракетный»
иммуноэлектрофорез: 1 - пациент с агаммаглобулинемией; 2, 3, 4 -
калибровочные растворы иммуноглобулинов; 5 - пациент с
гипергаммаглобулинемией (возможна миеломная болезнь)
Рис. 4.4. «Ракетный»
иммуноэлектрофорез: 1 - пациент с агаммаглобулинемией; 2, 3, 4 -
калибровочные растворы иммуноглобулинов; 5 - пациент с
гипергаммаглобулинемией (возможна миеломная болезнь)
В настоящее время во многих лабораториях изотипы иммуноглобулинов определяют нефелометрическим методом. Специфическими реагентами служат моноклональные антиизотипические антитела. Количество иммунных комплексов оценивают на приборе нефелометре. Калибровку и расчет результатов осуществляют с помощью программного обеспечения.
4.2. ИММУНОФЕРМЕНТНЫЙ И РАДИОИММУННЫЙ
АНАЛИЗЫ
В основе самых распространенных на сегодня методов иммуноанализов, базирующихся на количественном определении растворимых веществ, лежит взаимодействие антигена с антителом (т.е. иммунологическое распознавание), которое детектируется (визуализуется) с помощью специальной метки, заранее конъюгированной либо с антителом, либо с антигеном. В качестве меток используют вещества, которые при определенных условиях тот или иной прибор может «увидеть» (зарегистрировать) и измерить количество метки. Физико-химическая чувствительность таких анализов обычно составляет нанограммы на миллиметр, но, применяя конкретные тест-системы, нередко выявляют пико- и фемтомоли определяемого вещества.
Варианты меток и материалов для твердой фазы
Метки
1. Радионуклид используется при радиоиммунном анализе (РИА).
2. Ферменты, катализирующие превращение бесцветного субстрата в цветной или флюоресцирующий продукт. В данном случае исследование называют иммуноферментным анализом (ИФА), его разновидность - анализ иммуноферментно-флюоресцентный.
3. Флюоресцирующие, люминесцирующие вещества и др.
В случае РИА результат измеряют на счетчиках радиоактивности в зависимости от того, какие частицы/кванты излучает конкретная метка-радионуклид. Результаты РИА нельзя зарегистрировать без соответствующих приборов. В случае ИФА при образовании цветного продукта результат реакции определяют с помощью спектрофотометра, измеряющего оптическую плотность. Без прибора, на
глаз, реакцию можно оценить приблизительно как положительную или отрицательную.
При использовании в качестве метки фермента, катализирующего образование флюоресцирующего продукта, результат реакции определяют на флюориметре, измеряющем излучение в определенном диапазоне длин волн. Без прибора в данном случае не обойтись.
Впервые методы РИА были разработаны в 1958 г. С. Берсоном и Р. Ялоу. Последняя удостоена в 1977 г. Нобелевской премии за РИА, позволившего впервые в мире определять нанограммовые концентрации пептидных гормонов в крови человека.
Менее чем через год после описания РИА в качестве метки стали использовать ферменты с бесцветными субстратами, но окрашенными продуктами. Метод назвали ИФА. По чувствительности и специфичности РИА и ИФА одинаковы, так как их показатели определяются в большей мере аффинностью взаимодействия антитела и антигена, а не типом метки. Однако ИФА применяют много чаще, чем РИА, ибо реагенты для ИФА существенно дольше остаются стабильными, а следовательно, технологию ИФА проще стандартизировать. В РИА используют непрерывно излучающие радионуклиды, и величина их удельной радиоактивности непрерывно же изменяется. Для мечения белков применяют радионуклиды йода (131I или 125I; γ-излучение), у которых период полураспада весьма короток, и реагенты необходимо обновлять примерно раз в месяц.
Сначала иммуноанализы разрабатывали в так называемых гомогенных вариантах (без разделения компонентов в растворе). Но вскоре в технологии иммуноанализов начали использовать твердую фазу, на которой методом спонтанной сорбции из раствора фиксируется антиген или антитело. Анализы стали называть твердофазными, или иммуносорбентными (англ. ELISA - Enzyme linked immunosorbent assay). Технологически твердофазные анализы несравнимо удобнее гомогенных тестов. В настоящее время твердофазные варианты ИФА применяют в 99,9% тест-систем.
В качестве «твердой фазы» используют следующие материалы:
1) пластмассу (полистирол, поливинилхлорид и др.) в виде стандартно штампованных микроплашек с 96 или 60 лунками (или шарики, колпачки и прочее - для постановки единичных проб);
2) пористые материалы типа нитроцеллюлозы в виде наполнителей в объеме или в виде плоских листов или полосок стрипов
(англ. strip); стрипы используют в методиках типа иммуноблота и иммунохроматографии; в пористых материалах существенно больше площадь, на которой сорбирован один из участников взаимодействия; другие реагенты диффундируют по порам.
Принцип иммуносорбентных анализов заключается в том, что на материале твердой фазы в соответствии с физико-химическими свойствами сорбируется антиген или антитело.
Белки хорошо сорбируются на подобранных для ИФА/РИА пластмассовых материалах. Если заданный антиген в силу своей химической природы (липид, углевод, липоили гликопроизводные белков) плохо сорбируется на выбранной твердой фазе, то подбирают вещество-«подложку», которое с одной стороны хорошо свяжется с твердой фазой, с другой стороны - с антигеном. Однако потребность в «подложке» возникает крайне редко.
Все остальные реагенты тест-систем используют в виде растворов. Их добавляют к твердой фазе поочередно, инкубируют, после чего несвязавшиеся реагенты легко удаляют промывкой твердой фазы. В этом главное технологическое преимущество твердофазного иммуноанализа. Результат реакции «остается» на твердой фазе и регистрируется количественно.
Существует много вариантов конструкций тест-систем для иммуноанализов. Мы разберем несколько базисных и более подробно объясним значения терминов.
Прямые иммуноанализы
Прямыми называют анализы, в которых метку присоединяют непосредственно либо к заданному антигену, либо к антителу, специфичному против искомого антигена.
Прямой вариант используют в гомогенных системах и некоторых гетерогенных: в конкурентном, ингибиторном, сэндвич-ИФА и иммуноферменто-метрическом анализе (рис. 4.5).
Ингибиторный иммуноферментный анализ
В ингибиторном ИФА (рис. 4.6) на твердой фазе иммобилизуют антиген. Растворимые антитела как реагент конъюгированы с ферментом. Определяемый антиген в испытуемой пробе конкурирует с иммобилизованным на твердой фазе антигеном за растворимые антитела. В итоге ферментативная активность, измеряемая на твердой фазе, обратно пропорциональна концентрации определяемого вещества в пробе.
Результаты ИФА показаны на рис. 4.7 (см. также цв. вклейку).
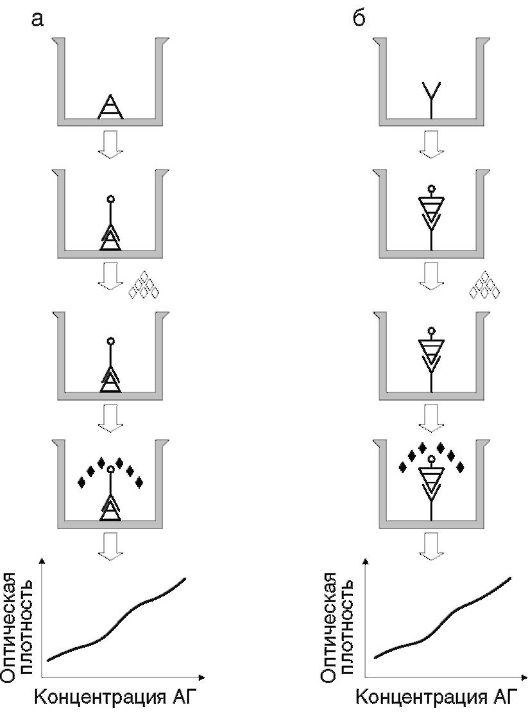 Рис. 4.5. Схема постановки прямого метода ИФА: а - для выявления антител; б - для выявления антигена; АГ - антигены; АТ - антитела.
Рис. 4.5. Схема постановки прямого метода ИФА: а - для выявления антител; б - для выявления антигена; АГ - антигены; АТ - антитела.
«Сэндвич»-ИФА
«Сэндвич»-ИФА (рис. 4.8) разработан для антигенов, на которых есть не менее двух неперекрывающихся эпитопов. Против обоих эпитопов получают в качестве реагентов специфичные антитела. Антитела к одному из эпитопов сорбируют на твердой фазе. Испытуемую пробу добавляют к твердой фазе, инкубируют, отмывают. После отмывки вносят конъюгат антител ко второму эпитопу с ферментом. Ферментативная активность, остающаяся на твердой фазе, прямо пропорциональна содержанию антигена в пробе.
«Сэндвич»-ИФА не требует препаратов очищенных антигенов, что выгодно отличает его от конкурентных и ингибиторных методик, поскольку чистые антигены всегда труднодоступны и дороги. Чувствительность «сэндвич»-ИФА потенциально выше, чем конку-
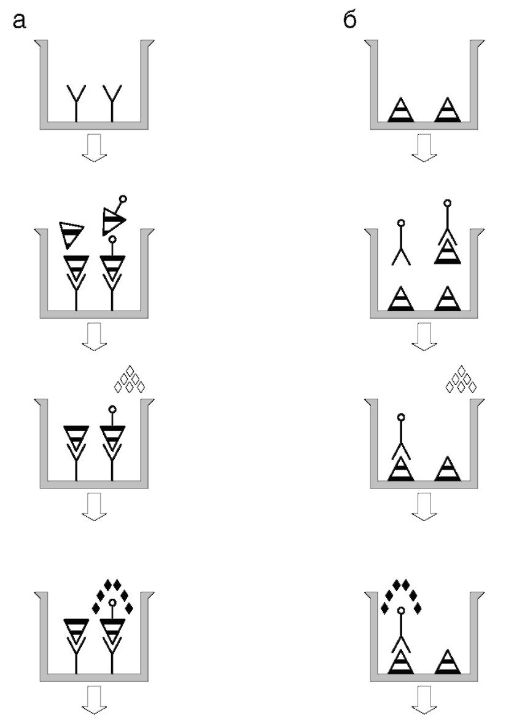 Рис. 4.6. Принцип конкурентного (а) и ингибиторного (б) ИФА
Рис. 4.6. Принцип конкурентного (а) и ингибиторного (б) ИФА
 Рис. 4.7. Планшет с результатами ИФА
Рис. 4.7. Планшет с результатами ИФА
рентных и ингибиторных. Аналогичная технология применима и с использованием одного антитела (и на твердой фазе, и в составе конъюгата с ферментом) в случаях наличия на заданном антигене повторяющихся эпитопов. В современных модификациях ту же технологию называют ловушечным ИФА (capture IA) - антитела на твердой фазе «ловят» свой антиген из смеси веществ в биопробе.
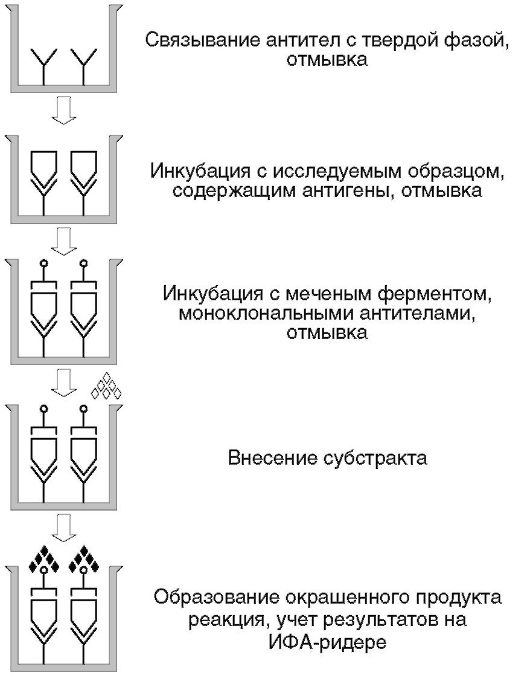 Рис. 4.8. Принцип «сэндвич»-ИФА
Рис. 4.8. Принцип «сэндвич»-ИФА
Иммунометрический анализ
При иммунометрическом анализе (рис. 4.9) в пробирку с испытуемой пробой, предположительно содержащей определяемый антиген, вносят заведомый избыток меченых антител. Затем к этой смеси добавляют также заведомый избыток иммобилизованного на мелкодисперсной твердой фазе антигена. После инкубации центрифугированием отделяют растворимую фракцию (супернатант) и в ней измеряют ферментативную активность (если метка - фермент).
Ферментативная активность супернатанта прямо пропорциональна содержанию антигена в испытуемой биопробе. Благодаря использованию избытка реагентов этот метод более чувствителен, чем конкурентный ИФА, и его аналитические возможности приближаются к предельным.
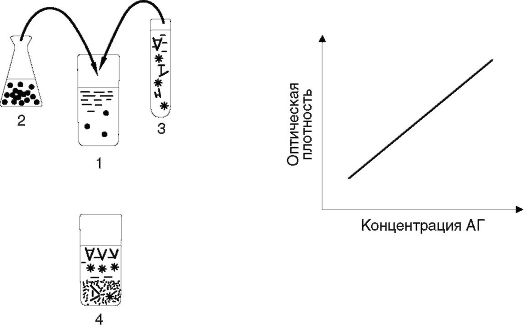 Рис. 4.9. Принцип
иммунометрических анализов: 1 - пробирка с биопробой (сывороткой крови
или др.); 2 - в пробирку с биопробой вносят заведомый избыток чистого
антигена, сорбированного на мелкодисперсном твердофазном носителе; 3 -
затем в ту же пробирку вносят заведомый избыток меченых антител; 4 -
материал инкубируют (чтобы реагенты успели связаться), центрифугируют и в
супернатанте измеряют количество метки. Величина сигнала в супернатанте
прямо пропорциональна содержанию искомого вещества (антигена) в
испытуемой пробе. OD - optical density - величина оптической плотности,
измеренная спектрофотометром; АГ - концентрация искомого антигена в
биопробах
Рис. 4.9. Принцип
иммунометрических анализов: 1 - пробирка с биопробой (сывороткой крови
или др.); 2 - в пробирку с биопробой вносят заведомый избыток чистого
антигена, сорбированного на мелкодисперсном твердофазном носителе; 3 -
затем в ту же пробирку вносят заведомый избыток меченых антител; 4 -
материал инкубируют (чтобы реагенты успели связаться), центрифугируют и в
супернатанте измеряют количество метки. Величина сигнала в супернатанте
прямо пропорциональна содержанию искомого вещества (антигена) в
испытуемой пробе. OD - optical density - величина оптической плотности,
измеренная спектрофотометром; АГ - концентрация искомого антигена в
биопробах
Непрямые иммуноанализы
Непрямые методики (рис. 4.10) применяют чаще, чем прямые.
Непрямым иммуноанализом называют анализ, в котором метку присоединяют не к целевому антигену и не к антителу против целевого антигена, а к так называемым вторым антителам - антивидовым антииммуноглобулиновым антителам, т.е. антителам к иммуноглобулинам того вида животных или человека, с биологическим материалом которого работают.
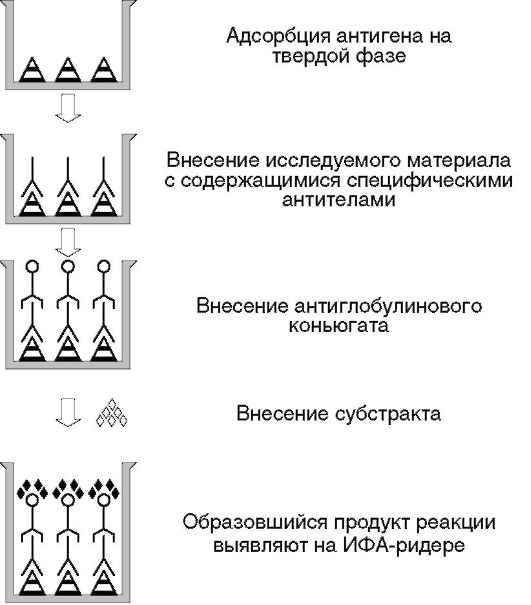 Рис. 4.10. Принцип непрямых иммуноанализов
Рис. 4.10. Принцип непрямых иммуноанализов
Таким образом, один и тот же препарат конъюгата антиглобулиновых антител с ферментом используют в качестве проявляющего стандартного реагента в разных тест-системах для определения различных конкретных антигенов или антител.
Вместо антивидовых антиглобулиновых антител для конъюгации с ферментом может быть использован, например, протеин А стафилококка, который по своей природе с высокой аффинностью связывается с иммуноглобулинами класса G некоторых видов млекопитающих, включая человека. Все описанные схемы постановки прямого варианта ИФА (конкурентный, ингибиторный, «сэндвич», иммунометрический) применяют и в непрямом варианте.
Непрямые варианты ИФА не требуют очистки искомых антигенов или антител. Чистым должен быть только препарат антивидовых антииммуноглобулиновых антител.
В качестве ферментов-меток в ИФА используются следующие ферменты и субстраты для них.
1. Пероксидаза из корней хрена, субстраты:
• орто-фенилендиамин (продукт желто-коричневый, растворимый, поглощает при 492 нм);
• 3,3'-диаминобензидин (продукт коричневый, нерастворимый);
• 3-амино-9-этилкарбазол (продукт красный; нерастворимый);
• 5-аминосалициловая кислота (продукт коричневый, растворимый, поглощает при 405 нм);
• 2,2'-азино-бис(3-этилбензтиазолин)-6-сульфоновая кислота (продукт зеленый, растворимый, поглощает при 405 нм);
• 4-хлоро-1-нафтол(продуктголубой,нерастворим);3,3'-диметокси- бензидин (продукт желто-оранжевый, растворимый, поглощает при 405 нм);
• 3,3',5,5'-тетраметилбензидин (продукт голубой, растворимый, поглощает при 450 нм);
• ABTS - 2,2'-азино-ди(3-этилбензтиазолин)-6-сульфоновая кислота.
2. β-Галактозидаза (субстраты - дериваты β-галактозида, например 4-метилумбелиферил-β-D-галактозин).
3. Щелочная фосфатаза (субстраты: 5-бромо-4-хлоро-3-индолил фосфат в комбинации с голубым тетразолиевым, продукт голубой, нерастворимый; р-нитрофенил фосфат, продукт желтый, растворимый, поглощает при 405 нм).
4. Уреаза (субстрат - мочевина в комбинации с бромкрезолом пурпурным, продукт образуется очень быстро, пурпурного цвета, растворимый, поглощает при 590 нм).
Нерастворимые продукты ферментативных реакций используют в методах иммуногистохимии и иммуноблота, растворимые - в иммуноферментных анализах, в которых результат регистрируют количественно спектрофотометрически.
Встречаются оригинальные разработки с использованием других (кроме вышеперечисленных) ферментов-меток.
Если по тем или иным биохимическим причинам заданный антиген или интересующее антитело не удается конъюгировать с меткой без существенных потерь в аффинности их связывания, то в конструкцию тест-системы пробуют вводить дополнительные компоненты. Например, нередко используют так называемое «авидинбиотиновое» взаимодействие. Авидин - белок, выделяемый из «белка» куриных яиц, биотин - витамин Н (он же кофермент R). Авидин по своей природе с высокой аффинностью (Kd ~ 10-15 M) связывает биотин. Биотин легко конъюгируется с флюоресцеином. Кроме того, и против авидина, и против биотина получены высокоаффинные моноклональные антитела (существуют коммерческие
препараты). Соответственно все эти дополнительные компоненты используют при необходимости в конструкциях тест-систем, предназначенных для детекции того или иного заданного вещества. Сходным по аффинности сродством к биотину обладает также белок стрептавидин, выделяемый из грибов Streptomyces avidinii.
В конкретных вариантах тест-систем используют разные буферные растворы, соответствующие свойствам конкретных антигенов, ферментов и их субстратов. Для примера мы опишем последовательность действий и используемые реагенты при выполнении непрямого твердофазного иммуноанализа, его простой и часто встречающийся вариант, подходящий, в частности, для определения специфических противовирусных антител как маркера наличия в организме той или иной вирусной инфекции (специфическую лабораторную диагностику вирусных инфекций применяют для выявления инфицированности ВИЧ, вирусами гепатитов, герпеса, цитомегаловирусами и др.).
Лабораторная работа 4-2
Твердофазный непрямой иммуноферментный анализ
1. На твердую фазу стандартных 96-луночных планшетов сорбируют заданные антигены. В большинстве тест-систем используют в качестве антигенов либо рекомбинантные белки, либо синтетические пептиды, реже - компоненты лизата натуральных вирусов. Антигены растворяют до конечной концентрации 1-10 мкг/мл или опытным путем подбирают более подходящие концентрации, чаще всего в 0,05 М карбонат-бикарбонатном буфере при рН 9,6.
Для приготовления 1 л буферного раствора берут 0,015 М (1,59 г) Na2CO3 и 0,035 M, 94 г NaHCO3 и растворяют в воде.
Раствор АГ вносят в лунки планшетов в объеме 50-100 мкл.
Существуют другие варианты посадочных буферов, например фосфатно-солевой буфер, рН 7,2 (PBS).
Для приготовления 1 л раствора PBS берут 0,0025 М дигидрофосфата натрия (0,345 г NaH2PO4 × H2O, MW 137,99); 0,0075 М гидрофосфата натрия (2,68 г Na2HPO4 × 12 H2O, MW 358,14) и 0,145 М хлористого натрия (8,474 г NaCl, MW 58,44).
Время, отводимое на сорбцию, подбирают опытным путем. Как правило, достаточно 12-16 ч при комнатной температуре или при +4 °С.
2. Лунки планшета тщательно промывают фосфатно-солевым буфером или водой с детергентом (0,1% Tween-20) 5-10 раз. В современных лабораториях процедуры отмывки осуществляют в аппаратах типа «вошер» (англ. to wash - мыть).
3. В некоторых случаях на следующем этапе в лунки вносят 1% раствор бычьего сывороточного альбумина (БСА) или иного консервативного белка, например казеина, для так называемой «забивки» не покрытых антигеном площадей на дне лунок. Инкубируют 30-60 мин, после чего отмывают.
4. В лунки вносят исследуемые образцы биопроб в тех или иных разведениях. Для каждого разведения используют 2-3 лунки («параллели»). В качестве разводящей жидкости применяют PBS. В некоторых случаях в него добавляют 1% БСА. Инкубируют 1 ч и дольше. Время либо подбирают опытным путем, либо следуют инструкции к коммерческой тест-системе.
5. Отмывают (как описано выше).
6. Вносят конъюгат антииммуноглобулиновых антител с ферментом в заранее подобранном рабочем разведении или по инструкции к тест-системе. Инкубируют 1 ч.
7. Отмывают (как описано выше).
8. Вносят в лунки раствор субстрата того фермента, который входит в состав антииммуноглобулинового конъюгата. Если фермент - пероксидаза хрена, то субстратами могут быть ортофенилендиамин и перекись водорода. Эти субстраты растворяют в 0,1 М цитрат-фосфатном буфере, рН 5: цитрат χ H2O 0,0347 M (7,3 г/л, MW 210,14); гидрофосфат натрия 0,0667 M (Na2HPO4 × 12 H2O 23,87 г/л, MW 358,14).
На один планшет требуется 10 мл раствора. C небольшим запасом к 12 мл субстратного буфера добавляют 8 мг ортофенилендиамина и 5 мкл 30% перекиси водорода, быстро растворяют и раскапывают по лункам.
9. Через 15-30 мин в лунках, где произошла реакция «антиген- антитело», появится желто-коричневая окраска. Другие лунки останутся бесцветными. Для остановки ферментативной реакции в лунки вносят по 50 мкл 1 М раствора серной кислоты (55,5 мл 96 серной кислоты на 900 мл воды; строго добавлять кислоту в воду, а не наоборот!!!).
10. Интенсивность ферментативной реакции измеряют в единицах величины оптической плотности на спектрофотометрах, приспособленных для планшетов («мультисканах»). Для ортофенилендиамина
длина волны проходящего света должна быть 492 нм (для тетраметилбензидина - 450нм). В связи с этим в мультискане устанавливают соответствующий светофильтр.
11. Современные спектрофотометры оснащены программным обеспечением, в котором предусмотрен автоматический расчет средних значений между параллелями и сравнение опытных показателей с показателями в контрольных лунках. Если такого обеспечения нет, то результаты анализируют «вручную».
Оптическую плотность (OD - optical density) в контрольных лунках принимают за некий «фон». Эти показатели умножают на 2; такую величину условно принимают за «линию раздела» - границу (cut off) между положительными и отрицательными значениями OD: значения ниже «cut off» считают отрицательными, значения выше «cut off» - положительными, значения, близкие к «cut off», - неопределенными, или «серой зоной».
Метод иммуноблота
Метод иммуноблоттинга (первоначальное название Western blot, WB1) был разработан главным образом в целях обнаружения в сыворотках пациентов антител, реагирующих с отдельными белками возбудителей инфекционных заболеваний, чаще всего вирусов.
Метод представляет собой следующее.
1. В культурах клеток in vitro (в настоящее время, как правило, в промышленных масштабах) выращивают препаративные количества реплицирующихся вирусов.
2. Клетки разрушают (ультразвуком или иначе), вирусную массу выделяют из культуральной смеси методами ультрацентрифугирования.
3. Вирусные частицы диссоциируют на отдельные белки детергентами и подвергают электрофорезу в геле. В результате каждый вирусный белок в соответствии со своей молекулярной массой и электрическим зарядом занимает определенную позицию в геле. Без применения красок и специальных проявляющих реагентов фракционированные электрофорезом белки в геле не видимы глазу.
1 Впервые блестящая методическая идея «блоттинга» (переноса на «промокашку»; blot по-английски - пятно на промокашке) пришла в голову и была реализована применительно к электрофоретическому анализу ДНК биохимиком E.M. Southern в 1975 г. Из уважения к автору коллеги-биохимики воспользовались лингвистической особенностью фамилии Southern (южный) и тот же метод, примененный к РНК, назвали Northern blot (северный), а к белкам - Western blot (западный).
4. В целях существенной экономии дорогостоящих реагентов в дальнейшем фракционированные белки из геля «промокают», перенося таким образом на плоский пористый материал - нитроцеллюлозу. В производственных масштабах перенос продуктов электрофоретического разделения в геле на нитроцеллюлозу осуществляют также электрофорезом.
5. Лист нитроцеллюлозы с перенесенными на нее электрофоретически разделенными белками вируса нарезают на тонкие полоскистрипы (strip), соответствующие по формату специальным выпускаемым промышленностью пластмассовым «корытцам», в которых стрипы обрабатывают испытуемыми сыворотками и проявляющими реагентами.
6. Стрип заливают испытуемой неразведенной и разведенной 1:10 (или подбирают иные разведения) сывороткой, инкубируют 1 ч или более, тщательно промывают фосфатным солевым буфером с детергентом (0,1% Tween-20), заливают раствором конъюгата антииммуноглобулиновых антител с ферментом (например, пероксидазой хрена), инкубируют 1 ч, тщательно промывают, вносят раствор субстрата (например, ортофенилендиамина с перекисью водорода), после чего наблюдают, не проявятся ли окрашенные полосы в зонах расположения фракционированных вирусных белков.
В случае, если у человека в крови нет противовирусных антител, стрип остается неокрашенным (имеет место лишь неспецифический легкий фон по всей площади стрипа). Это отрицательный результат. Если окрашенными оказываются все полосы вирусных белков, результат квалифицируют как положительный. Если окрашиваются не все, а 1-2 полосы, результат рассматривают как неопределенный.
Ложноотрицательные результаты в иммуноблоте крайне маловероятны. Поэтому по международным соглашениям сертифицированные для клинической диагностики промышленно выпускаемые иммуноблоттинговые тест-системы приняты в качестве подтверждающих по отношению к планшетным и прочим скрининговым иммуноанализам. На рис. 4.11. представлена схема «сэндвича», приготовленного для блоттинга.
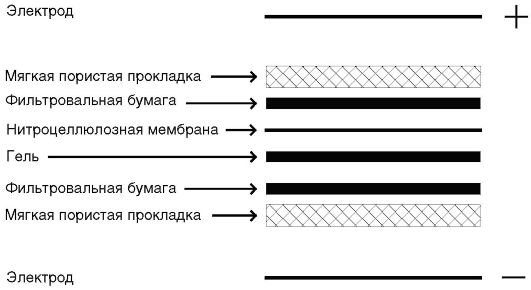 Рис. 4.11. Схема «сэндвича», приготовленного для блоттинга
Рис. 4.11. Схема «сэндвича», приготовленного для блоттинга
4.3. ЧУВСТВИТЕЛЬНОСТЬ, СПЕЦИФИЧНОСТЬ, ДИАГНОСТИЧЕСКАЯ ЭФФЕКТИВНОСТЬ ТЕСТ-СИСТЕМ ИММУНОАНАЛИЗОВ
Чувствительность иммуноанализов
Термин «чувствительность» применительно к иммуноанализам имеет два разных смысла.
1. Чувствительность в физико-химическом понимании - это определяемая данным анализом минимальная концентрация искомого вещества в пробе. Как правило, для большинства ИФА-тест-систем такая чувствительность составляет нанограммы в миллилитре.
2. Второе понимание термина «чувствительность» - популяционное и относится к диагностическим тест-системам, предназначенным для выявления тех или иных маркеров заболеваний, чаще всего инфекционных.
При разработке любой тест-системы пользуются биологическим материалом, скажем, пробами крови людей, заведомо больных данным заболеванием (эти пробы называют истинно позитивными), и людей, заведомо не больных данным заболеванием (эти пробы называют истинно отрицательными).
Параметры рассчитывают по приведенным ниже формулам, где N - число тех или иных результатов конкретных анализов на биологическом материале от пациентов с достоверно известными диагнозами.
 Чувствительность
иммуноанализа в данном случае - это параметр, всегда привязанный к
конкретной тест-системе, а не только к принципу метода. Чувствительность
зависит от аффинности и авидности взаимодействия используемых (или
искомых) антител с искомым (или используемым) антигеном, от других
реагентов, включенных в систему, от времени и температуры инкубаций.
Чувствительность
иммуноанализа в данном случае - это параметр, всегда привязанный к
конкретной тест-системе, а не только к принципу метода. Чувствительность
зависит от аффинности и авидности взаимодействия используемых (или
искомых) антител с искомым (или используемым) антигеном, от других
реагентов, включенных в систему, от времени и температуры инкубаций.
Поскольку связывание антител с антигенами не подчиняется линейным зависимостям, то в целях попадания в «зоны эквивалентности» практически во всех вариантах иммуноанализов принято так называемое титрование сывороток или растворов антигенов, т.е. сыворотки (или растворы антигенов) разводят известным образом (двукратные, пятикратные, десятикратные или иные разведения) и каждое из разведений пускают в иммуноанализ. Для того чтобы установить нижнюю границу достоверных признаков связывания антител с антигеном (cut-off - граница отличия отрицательных результатов от положительных), в каждой постановке иммуноанализов обязательно применение заведомо отрицательных и заведомо положительных контрольных сывороток. Если целью анализа является определение не титров сывороток, а численных концентраций искомых антител или антигенов, то прибегают к калибровке. Для этого тест-система должна располагать калибровочными растворами (от 3 до 10 точек), содержащими известные нарастающие концентрации искомого вещества, а система регистрации результатов тоже должна быть «оцифрована», например в единицах оптической плотности, измеряемых спектрофотометрически, или в единицах флюоресцентного излучения, измеряемого флюориметрами, или в единицах числа импульсов в минуту, измеряемых счетчиками радиоактивности (в случае радиоиммуноанализов). В диапазонах прямолинейности калибровочной кривой возможно определение искомых концентраций в испытуемых биопробах.
Учитывая сказанное, мы приведем лишь порядок концентраций, выявляемых с помощью различных технологий иммуноанализов. При этом конкретные тест-системы в пределах одной технологии могут по чувствительности отличаться друг от друга также на порядки.
Методы преципитации, агглютинации и иммунодиффузии работоспособны при концентрациях искомых веществ порядка миллиграммов на миллилитр. Как правило, калибровочные растворы имеют диапазон концентраций от 1 до 0,1 мг/мл.
Твердофазные радиоиммуноанализы и иммуноферментные анализы работают в большинстве тест-систем в нанограммовых диапазонах концентраций (нанограммы на миллилитр). Однако ловушечные конструкции тест-систем, а также иммунометрические тест-системы могут иметь существенно более высокую чувствительность, например 10-12-15 г/мл.
Специфичность иммуноанализов
Специфичность диагностической тест-системы - параметр, характеризующий ее распознавательные возможности в отношении именно данного заболевания, которое она «не путает» с другими.
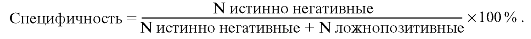 Диагностическая эффективность тест-систем
Диагностическая эффективность тест-систем
Диагностическая эффективность - это параметр, характеризующий возможности данной тест-системы одновременно правильно определять позитивные пробы как позитивные, а негативные пробы - как негативные.
 Положительная и отрицательная предсказательная значимость тестсистем.
Положительная и отрицательная предсказательная значимость тестсистем.
Есть еще и такие характеристики диагностических тест-систем, как положительная предсказательная значимость (ППЗ) и отрицательная предсказательная значимость (ОПЗ). Чтобы пользоваться данными характеристиками (и это отличает их от приведенных выше
чувствительности и специфичности), необходимо знание реальной распространенности данного инфекционного заболевания в обследуемых популяциях населения.
ППЗ рассчитывают как частоту встречаемости инфицированных людей среди всех индивидуумов, определенных данной тест-системой как позитивные:
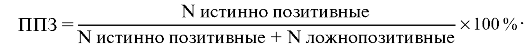 ОПЗ
тест-системы рассчитывают как частоту неинфицированных людей среди всех
индивидуумов, определенных данной тест-системой как отрицательные:
ОПЗ
тест-системы рассчитывают как частоту неинфицированных людей среди всех
индивидуумов, определенных данной тест-системой как отрицательные:
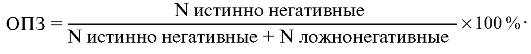 4.4. ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВА КЛЕТОК, СЕКРЕТИРУЮЩИХ ТОТ ИЛИ ИНОЙ ПРОДУКТ, - МЕТОД ELISPOT
4.4. ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВА КЛЕТОК, СЕКРЕТИРУЮЩИХ ТОТ ИЛИ ИНОЙ ПРОДУКТ, - МЕТОД ELISPOT
Метод ELISPOT (Enzyme-linked immunospot, spot - пятно) был разработан в 1983 г. двумя группами авторов (Sedgwick J.D., Holt P.G., Czerkinsky C.C. et al.) для подсчета числа антителообразующих клеток. ELISPOT пришел на смену знаменитому методу локального гемолиза в агаре Н. Йерне.
Идея метода ELISPOT состоит в использовании культуры клеток in vitro при проведении ловушечного твердофазного иммуноанализа на пористой поверхности (рис. 4.12, см. также цв. вклейку). В настоящее время промышленность выпускает планшеты для культивирования (чаще всего 96-луночные, той же стандартной формы, что и планшеты для ИФА), дно которых покрыто нитроцеллюлозной мембраной. На нитроцеллюлозе сорбируют интересующий антиген, после чего в лунки помещают лимфоциты в полноценной культуральной среде и культивируют их в оптимальных для живых клеток условиях (СО2-инкубатор, оптимальная плотность посадки клеток, все необходимые метаболические добавки и т.д.). Через несколько часов или
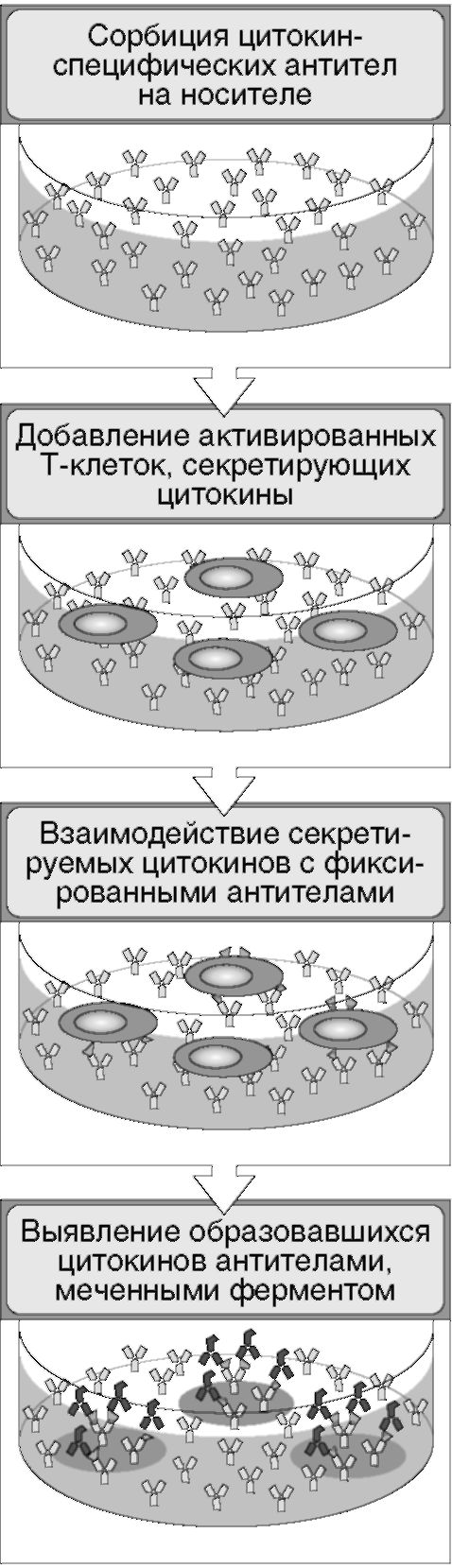 Рис. 4.12. Общий принцип метода ELISPOT для определения количества клеток, секретирующих цитокины
Рис. 4.12. Общий принцип метода ELISPOT для определения количества клеток, секретирующих цитокины
1, 2, 3 сут (условия подбирают опытным путем) клетки тщательно вымывают из лунок в проточной системе физраствором или водой с детергентом (например, 0,1% Tween-20 или др.).
Если какие-то клетки секретировали антитела против антигена, сорбированного на дне, то на этом дне фиксируются иммунные комплексы «антиген-антитело». Затем добавляют антииммуноглобулиновый конъюгат с ферментом, инкубируют, промывают, добавляют бесцветный субстрат. Фермент, остающийся после промывок только в точках, в которых лежали во время культивирования антителообразующие клетки (пористая поверхность не позволяет клеткам «кататься» по дну лунок), катализирует образование цветного продукта. В результате на дне лунок образуются окрашенные пятна в тех точках, над которыми лежали антителообразующие клетки (АОК). Первоначально пятна пытались подсчитывать визуально. Получали нечеткие субъективные результаты. Вскоре разработали несложное приборное оборудование, состоящее из миниатюрной видеокамеры, которая фиксирует изображение каждой лунки планшета и в цифровом виде отправляет эту информацию в компьютер. С помощью специально созданного программного обеспечения (самый дорогостоящий компонент метода) стали проводить анализ данных, сравнивая опытные лунки с контрольными и определяя количество искомых клеток на (например) 106 общего числа клеток в исследуемой суспензии.
Вскоре стало очевидно: метод ELISPOT весьма универсален и пригоден для под-
счета, скажем, клеток, продуцирующих тот или иной цитокин. В данном случае первым слоем на дно специальных планшетов для ELISPOT сорбируют моноклональные антитела против интересующего цитокина. Затем помещают в лунки культуру исследуемых клеток. Специфическим и творческим моментом в данном случае является добавление в культуру стимуляторов продукции заданного цитокина. Дальнейшие этапы выполнения метода те же, что при подсчете АОК.
Метод ELISPOT, несмотря на весьма высокие цены на реагенты и приборы, включен в международные протоколы обязательных исследований при разработках и клинических испытаниях вакцин. Мы приведем в качестве примера более подробный протокол методики с применением для повышения чувствительности авидин-биотиновой системы. Методика в целом включает два этапа:
1-й - стерильное культивирование живых и функционирующих
клеток;
2-й - иммуноанализ в тех же планшетах, но уже в нестерильных условиях.
Стерильные условия работы
1. Антицитокиновое антитело-1 сорбируют на пористой твердой фазе культурального планшета (это антитело - ловушка для секретируемого цитокина).
2. В планшет помещают исследуемые клетки (суспензию в различных концентрациях - от 105 до 2х106 в 1 мл).
3. К клеткам добавляют стимулятор в различных концентрациях.
4. Систему культивируют в оптимальных условиях в течение 2-24 ч или больше (подбирают оптимум).
Нестерильные условия работы
1. Лунки тщательно промывают сначала водой с целью удаления клеток, затем отмывочным буфером с детергентом (0,1% Tween-20), чтобы смыть все, что плохо связалось.
2. В лунки вносят конъюгат проявляющего антитела-2 с биотином, инкубируют 2 ч.
3. Промывают и вносят конъюгат «авидин-пероксидаза», инкубируют 1 ч.
4. Промывают и вносят субстратную смесь - АЕС [3-амино-9- этилкарбазол, растворенный исходно в N,N-диметилформамиде (100 мг АЕС на 10 мл DMF) и разбавленный до конечной концентрации в 0,1 М ацетатном буфере, рН 5 и плюс перекись водорода; рецепт
субстратной смеси: 333,3 мкл матричного раствора АЕС + 10 мл ацетатного буфера + 5 мкл 30% перекиси водорода].
5. Реакцию останавливают под визуальным контролем через 5-50 мин путем промывки плэйтов водой.
6. Плэйты сушат при комнатной температуре в темноте в течение 2 ч.
7. Регистрируют результат, т.е. подсчитывают пятна: либо «вручную», под соответствующим микроскопом (результаты получают в «двоичной системе» - «много» или «мало»), либо в специальном аппарате, считывающем картину дна лунок видеокамерой и соответствующей компьютерной программой анализа пятен (получают цифровой результат).
Результаты, получаемые в ELISPOT, отражены на рис. 4.13 (см. также цв. вклейку).
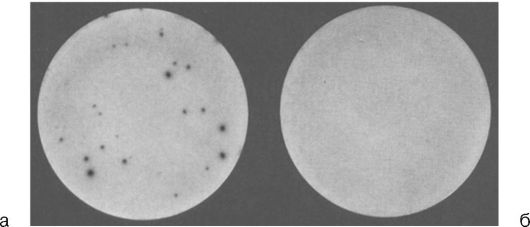 Рис. 4.13. Примеры
результатов ELISPOT: увеличенное изображение двух лунок: лунки с
положительным результатом (а), с четко различимыми «пятнами»,
подлежащими подсчету; лунки с отрицательным результатом (б)
Рис. 4.13. Примеры
результатов ELISPOT: увеличенное изображение двух лунок: лунки с
положительным результатом (а), с четко различимыми «пятнами»,
подлежащими подсчету; лунки с отрицательным результатом (б)
4.5. МЕТОДЫ ИССЛЕДОВАНИЯ ВНУТРИКЛЕТОЧНЫХ ЦИТОПЛАЗМАТИЧЕСКИХ И ЯДЕРНЫХ БЕЛКОВ - ФАКТОРОВ ТРАНСКРИПЦИИ, СИГНАЛЬНЫХ МОЛЕКУЛ И ДРУГИХ
Методы твердофазных иммуноанализов типа ELISA используют и для изучения молекулярных процессов проведения сигналов от мембранных рецепторов внутрь клетки. Эксперименты такого типа состоят из двух этапов.
Творческий поисковый этап - создание модели активации определенных живых клеток in vivo или в культуре in vitro.
Технический этап:
а) лизис клеток без денатурации макромолекул;
б) детекция искомых молекул передачи сигналов методом ловушечного ИФА.
В качестве «ловушки» на твердой фазе используют высокоспецифичные антитела к определенным эпитопам, характерным для активированного состояния молекул, например сайтам фосфорилирования конкретных белков, участвующих в проведении сигнала. В этой связи коммерческие тест-системы такого назначения получили название «phosphoELISA».
Внутриклеточные белки исследуют в целях анализа конкретных молекулярных путей проведения сигналов в клетке (англ. pathways - путь), определяя конкретные киназы, фосфатазы, адаптерные белки, факторы транскрипции и др.
Для исследования внутриклеточных цитоплазматических белков и их производных интересующие клетки тщательно отмывают от внеклеточных субстанций 2-3-кратным центрифугированием (800 g, 5-6 мин) в фосфатном солевом буферном растворе, после чего лизируют буфером следующего состава (одного из возможных): 50 mM Tris, pH 7,4; 250 mM NaCl; 5 mM EDTA (этилендиаминтетраацетат); 1% NP40 (Nonidet P40); 50 mM NaF; 1mM Na3VO4; 1 mM PMSF (ингибитор сериновых протеаз - трипсина и химотрипсина - фенилметан-сульфонил флюорид, матричный 0,3 М раствор в ДМСО, добавляют ex temporo); смесь ингибиторов протеаз (AEBSF, пепстатин А, Е-64, бестатин, лейпептин, апротинин или других, добавляют ex temporo).
Осадок отмытых фосфатным буфером клеток ресуспендируют в лизирующем буфере и оставляют на 15 мин в условиях мягкого перемешивания. Затем лизат центрифугируют при 14 000 об/мин в течение 10 мин, разливают по аликвотам, определяют в нем общую концентрацию белков (чаще всего - методом Bradford). Наиболее приемлемы для дальнейших анализов концентрации белков 200- 400 мкг/мл.
В дальнейшем выполняют обычный ловушечный вариант ELISA (см. выше). Весьма важен как можно более многосторонний контроль (как минимум заведомо положительный контроль, заведомо отрицательный контроль, а также лизат одноименных, но неактивированных клеток, лизат клеток, обработанных «посторонним» биохимически родственным активатору веществом и др.).
Определение факторов транскрипции во внутриядерном содержимом
Процедура получения фракции ядер интересующих клеток может быть следующей.
1. 5х106-2х107 клеток помещают в коническую пробирку объемом 15 мл, дважды отмывают в 10 мл фосфатно-солевого буфера (ФСБ) при 800 g 5-6 мин.
2. Супернатант удаляют и к осадку клеток добавляют гипотонический лизирующий буфер из расчета 0,5 мл буфера на 5х106 клеток. Ex temporo (не ранее, чем за 10 мин до добавления к клеткам) на 0,5 мл гипотонического буфера добавляют 5 мкл ингибиторов фосфатаз, 5 мкл ингибиторов протеаз, 5 мкл DTT (дитиотреитол), 0,5 мкл
PMSF.
3. Клетки аккуратно перемешивают в гипотоническом буфере, переносят в чистую пробирку объемом 1,5 мл и оставляют на льду в течение 10 мин.
4. Добавляют 25 мкл на 0,5 мл рабочего материала раствора детергента (0,1% SDS; 1% Triton X-100; 0,1% Tween 20) и перемешивают в течение 5 с.
5. Центрифугируют при 800 g 5-6 мин, 4 °С.
6. Супернатант отделяют (он содержит цитоплазматические белки и может представлять интерес для отдельного анализа), а осадок ядер ресуспендируют в 1 мл полного буфера для отмывки ядер (к буферу добавляют ex temporo 10 мкл ингибиторов фосфатаз, 10 мкл ингибиторов протеаз, 10 мкл раствора DTT, 1 мкл раствора PMSF).
7. Ядра дважды отмывают центрифугированием при 800 g 5-6 мин, 4 °С.
8. Осадок ядер по объему примерно равен 25 мкл. К этому осадку добавляют равный объем специальных экстрагирующих буферов и аккуратно перемешивают в течение 2 с.
9. Смесь инкубируют на льду в течение 30 мин, перемешивая каждые 10 мин.
10. Осветляют ядерный экстракт центрифугированием при 14 000 g 30 мин при 4 °С.
11. Супернатант содержит искомые вещества (факторы транскрипции). Его переносят в чистые охлажденные пробирки.
12. Определяют концентрацию белков по Bredford. Как правило, из 5х106 клеток удается получить 25-100 мкг ядерных белков.
13. Полученные образцы можно морозить при -80 °С в ожидании анализа, но только однократно.
Существуют технологии одновременного определения в одном биоматериале нескольких искомых факторов транскрипции (или цитокинов, или киназ и др.). Подобные методы в настоящее время осуществимы главным образом с применением высокотехнологичных коммерческих тест-систем. В качестве примера мы приведем описание процедур для тест-системы «Luminex 100» (Invitrogen. www.invitrogen.com). В данной технологии в качестве твердой фазы для ключевых реагентов используют микрошарики. Оценка результатов возможна только на уникальном приборе (большинство подобных тест-систем - так называемые закрытые, т.е. используют только свои приборы, свои реагенты, свои компьютерные программы).
Факторы транскрипции по своей природе реагируют, т.е. специфически связываются с определенными последовательностями нуклеотидов в двуспиральной ДНК.
Поэтому специфическими реагентами на факторы транскрипции являются строго определенные олигонуклеотиды ДНК, меченные биотином.
Второй олигонуклеотидный реагент конструируют из двух частей. Первая - последовательность нуклеотидов, комплементарная меченному биотином олигонуклеотиду. В виде двойной спирали они составляют сайт связывания искомого фактора транскрипции. Вторая часть этого олигонуклеотида - «ловушечная» последовательность, комплементарная последовательности нуклеотидов, фиксированной на твердой фазе (микрошариках).
Пробы раскапывают в лунки микропланшет, предназначенных для проведения ПЦР, чтобы использовать для инкубаций в качестве термостата термоциклер.
Минимальный набор анализируемых образцов включает:
• заведомо позитивный контроль;
• заведомо негативный контроль;
• пробу в виде постороннего белка;
• ядерный экстракт из нестимулированных клеток;
• ядерный экстракт из одноименных стимулированных клеток. Такой планшет инкубируют в течение 20 мин при 25 °С (можно в
ПЦР-термоциклере, который в данном случае используют как удобный динамичный термостат).
Затем в лунки с позитивным контрольным реагентом добавляют только буфер, тогда как в остальные лунки вносят буфер с нуклеазой, расщепляющей не связанную с белками ДНК. Инкубируют 20 мин при 37 °С. Только те ДНК-пробы, с которыми связались факторы транскрипции, не расщепляются нуклеазой, так как факторы транскрипции защищают последовательность нуклеотидов от атаки нуклеазы. Таким образом, количество биотиновой метки на молекулах ДНК прямо коррелирует с количеством того или иного фактора транскрипции в биопробе.
Стадия гибридизации с твердой фазой: в лунки вносят реагентные микрошарики и инкубируют 45 мин при комнатной температуре под светонепроницаемой крышкой, например, из алюминиевой фольги (рис. 4.14).
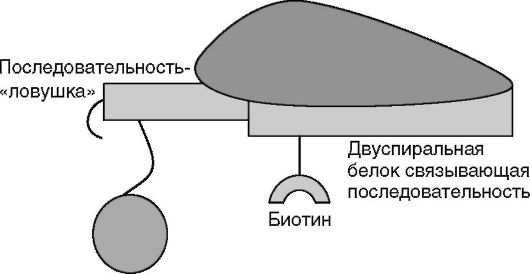 Рис. 4.14. Связывание с твердой фазой (шариками)
Рис. 4.14. Связывание с твердой фазой (шариками)
На следующей стадии (отмывке) применяют специальные планшеты из фильтрующего материала: содержимое лунок первоначальных планшет переносят в лунки планшет из фильтрующего материала и промывают трижды промывочным буфером с использованием вакуумной аспирации; растворимые компоненты вымываются, микрошарики остаются на дне лунок фильтровальных планшет.
Добавляют проявляющий реагент - конъюгат стрептавидина с люминофором, инкубируют 5 мин в темноте (рис. 4.15). Промывают и регистрируют люминесценцию на специальном приборе (например, Luminex 100).
Результаты считывают и обрабатывают специальной компьютерной программой (Luminex IS и др.).
В каждой биопробе за один цикл анализа, т.е. одновременно, можно количественно определить до 10 факторов транскрипции и более.
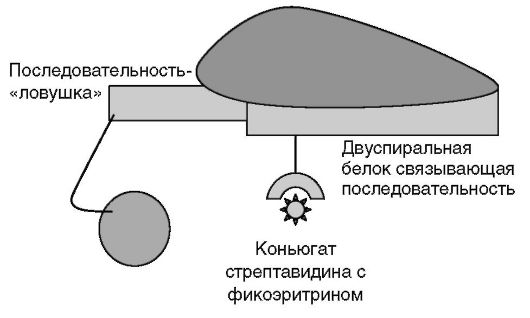 Рис. 4.15. Проявка
Рис. 4.15. Проявка
Вопросы и задания
1. Дайте определение термина «иммуноанализы».
2. Назовите варианты меток.
3. Назовите технологические варианты иммуноанализов.
4. Что такое «прямые» иммуноанализы?
5. Что такое «непрямые» иммуноанализы?
6. Какие вам известны варианты конструкций тест-систем?
7. Какие ферменты используют в иммуноферментных анализах?
8. Что такое иммунохроматография?
9. Что такое иммуноблот?
10. Дайте определение чувствительности и специфичности тестсистем.
11. Тест-системы с какими чувствительностью и специфичностью (высокой/низкой) следует применять в скрининговых (первичных) обследованиях?
12. Как зависит величина сигнала от концентрации определяемого вещества в биопробе в:
а) ловушечном;
б) конкурентном;
в) ингибиторном;
г) «сэндвич»;
д) иммунометрическом вариантах иммуноанализов.
13. Нарисуйте схему иммунометрической тест-системы.
14. Что означает вывод о «ложнопозитивном» результате иммуноанализа?
15. Что означает вывод о «ложнонегативном» результате иммуноанализа?
16. Какие варианты регистрирующих приборов применяют в иммуноанализах?
17. Какова в среднем чувствительность иммуноанализов (относительно концентраций определяемых веществ)?