Иммунология : практикум : учеб. пособие / [Ковальчук Л. В. и др.] - 2010. - 176 с. : ил.
|
|
|
|
ГЛАВА 2 МЕТОДЫ РАЗДЕЛЕНИЯ КЛЕТОК ПЕРИФЕРИЧЕСКОЙ КРОВИ
Для изучения функциональной активности лимфоцитов и других клеток крови необходимы эффективные способы их разделения (рис. 2.1). Идеальные методы разделения характеризуются незначительной степенью потерь клеток при высокой степени очистки, сохранением физиологической активности выделенных клеток. В основе методов выделения клеток лежат два главных принципа.
1. Разделение клеток по их физическим свойствам, например по размерам, плотности или заряду.
2. Разделение клеток по поверхностным антигенам.
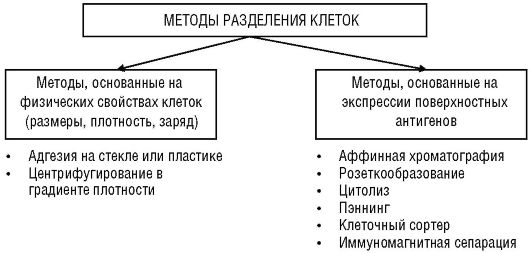 Рис. 2.1. Основные методы разделения клеток
Рис. 2.1. Основные методы разделения клеток
Среди разнообразных способов разделения клеток крови наибольшее распространение получили гравитационные, основанные на различной удельной плотности клеток крови, которые различаются между собой следующим образом: эритроциты > нейтрофилы и эозинофилы > лимфоциты и моноциты > тромбоциты.
2.1. ВЫДЕЛЕНИЕ ЛЕЙКОЦИТОВ
Принцип метода. Для осаждения эритроцитов из периферической крови применяют растворы декстрана, желатины и др. Гепаринизированную кровь смешивают с 6% раствором декстрана или 0,3% раствором желатины в соотношении 1:5. Смесь в пробирке отстаивают 30-40 мин под углом 45° в термостате при температуре 37 °С до осаждения эритроцитов. Плазму, обогащенную лейкоцитами, отбирают, примесь эритроцитов лизируют. Выделенные клетки отмывают центрифугированием в растворе Хенкса или культуральной среде 199 при 1000 об/мин в течение 5 мин.
2.2. ВЫДЕЛЕНИЕ МОНОНУКЛЕАРНЫХ КЛЕТОК
Мононуклеарные клетки выделяют (рис. 2.2, см. также цв. вклейку) из периферической крови человека по методу Boyum (1968), основанному на седиментации в одноступенчатом градиенте плотности фиколл-урографина. Фиколл в данной смеси выступает как агент, агрегирующий эритроциты, а изопак (или урографин) нужен для создания изотоничности и плотности 1,077 г/см3.
Принцип метода. Гепаринизированную кровь разводят в 3 раза культуральной средой и аккуратно наслаивают на градиент фиколлурографина. Кровь задерживается над фиколлом и не смешивается с ним. Постепенно эритроциты склеиваются фиколлом и опускаются на дно пробирки. Гранулоциты, имеющие плотность большую, чем седиментирующий раствор, оседают вместе с эритроцитами. Лимфоциты вместе с моноцитами остаются в интерфазе, их собирают, переносят в другую пробирку и отмывают центрифугированием.
Метод не дает выхода более 90% клеток.
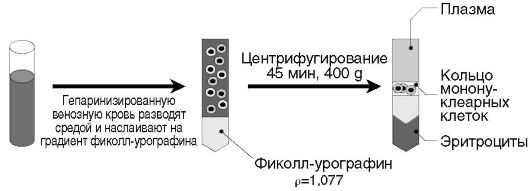 Рис. 2.2. Выделение мононуклеарных клеток в одноступенчатом градиенте плотности фиколл-урографина
Рис. 2.2. Выделение мононуклеарных клеток в одноступенчатом градиенте плотности фиколл-урографина
Лабораторная работа 2-1
1. 10 мл гепаринизированной крови человека (20-25 ЕД гепарина на 1 мл крови) разводят в 3 раза (1 часть крови и 2 части питательной среды 199).
2. Разведенную кровь наслаивают на раствор фиколл-урографина (плотность 1,077 г/см3) в соотношении 1:3 (1 часть фиколла и 3 части разведенной крови). Кровь остается над раствором фиколла и не смешивается с ним.
3. Проводят центрифугирование при комнатной температуре в течение 45 мин на центрифуге с горизонтальным ротором при 400 g.
Следует иметь в виду, что для определения необходимого числа оборотов в конкретных условиях центрифугирования или получения соответствующего центробежного ускорения одну из необходимых величин (ускорение или число оборотов) находят по формуле:
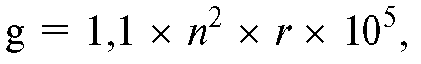 где g - центробежное ускорение; n - число оборотов в минуту; r - радиус от центра оси до границы разделяемых сред.
где g - центробежное ускорение; n - число оборотов в минуту; r - радиус от центра оси до границы разделяемых сред.
4. После центрифугирования собирают интерфазное кольцо, содержащее мононуклеарные клетки, в отдельную пробирку. Эритроциты склеиваются фиколлом и оседают на дно пробирки вместе с гранулоцитами (см. рис. 2.2).
5. Суспензию мононуклеарных клеток трижды отмывают средой 199, центрифугируя по 10 мин при 200 g.
6. Клетки ресуспендируют в 1 мл культуральной среды. Подсчет клеток осуществляют в камере Горяева. Жизнеспособность клеток определяют с помощью 0,1% раствора трипанового синего. Необходимо подсчитать процент выхода жизнеспособности клеток (более 90%). Для этого подсчитывают начальное количество клеток и количество выделенных клеток.
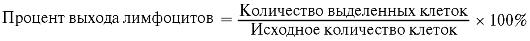 2.3. ВЫДЕЛЕНИЕ МОНОЦИТОВ
2.3. ВЫДЕЛЕНИЕ МОНОЦИТОВ
Лабораторные методы выделения моноцитов разнообразны, но основные методические приемы преимущественно связаны с фракционированием моноцитов по способности прилипать к стеклу или пластиковой поверхности или по способности при центрифугировании к локализации в определенных зонах ступенчатого градиента.
Выделение моноцитов по способности прилипать к стеклу или пластику
Принцип метода. Моноциты периферической крови человека получают выделением мононуклеарных клеток по методу Воуит с последующим их фракционированием на прилипающие (ПК) и неприлипающие клетки (НПК). Для получения моноцитов мононуклеарные клетки, выделенные в одноступенчатом градиенте фиколлурографина, разделяют на ПК и НПК, используя способность клеток моноцитарно-макрофагального ряда прилипать к стеклу и пластику. Для этого суспензию мононуклеаров в концентрации 2χ106 кл/мл культивируют в среде 199, содержащей 20% сыворотку эмбриона коровы (СЭК), при 37 °С в пластиковых чашках Петри. Через 40 мин собирают НПК, а ПК снимают со дна чашки охлажденным (4-6 °С) раствором Версена, который заливают по 1 мл в чашку сразу после удаления надосадочной жидкости. Через 1-2 мин собирают ПК, помещают в силиконированные центрифужные пробирки и центрифугируют при 200 g в течение 10 мин. Удаляют надосадочную жидкость и ПК ресуспендируют в среде 199 с 10% СЭК.
Метод Рекалде
Принцип метода. Данный метод выделения моноцитов основан на центрифугировании лейкоцитов в гипертоническом градиенте плотности фиколл-урографина (Recalde Н., 1984).
Лабораторная работа 2-2
Постановка метода Рекалде
1. Кровь осторожно перемешивают с 6% раствором декстрана Т-500 («Pharmacia», Швеция), приготовленном на физиологическом растворе из расчета: 1 объем декстрана на 5 объемов крови.
2. Кровь отстаивается в течение 30 мин (15 мин при 37 °С, затем 15 мин при комнатной температуре).
3. Осторожно собирают плазму, обогащенную лейкоцитами (лейкомасса). К полученной лейкомассе трехкратно добавляют раствор NaС1 по следующей схеме:
• 0 мин - добавляют 9% NaС1 из расчета 5 мкл на 1 мл лейкомассы, инкубация 10 мин при 37 °С;
• 11-я минута - добавляют 9% NaС1 из расчета 10 мкл на 1 мл лейкомассы, инкубация 10 мин при 37° С;
• 21-я минута - добавляют 9% ?С1 из расчета 10 мкл на 1 мл лейкомассы, инкубация 10 мин при 37 °С.
Общее время инкубации составляет 30 мин.
4. К лейкомассе добавляют равный объем раствора Хенкса, соответствующей осмомолярности, полученный путем добавления 25 мкл 9% раствора NaС1 на каждый миллилитр стандартного раствора Хенкса.
5. Немедленно проводят выделение моноцитов на гипертоническом градиенте плотности. Для этого в стандартный раствор фиколлурографина добавляют кристаллический NaС1 из расчета 2,8 мг на каждый миллилитр раствора фиколл-урографина (удельная плотность 1,078 г/см3). Конечная плотность раствора составляет 1,080 г/см3. В силиконированные пробирки на один объем гипертонического градиента осторожно наслаивают 3 объема подготовленной лейкомассы.
6. Пробирки центрифугируют в течение 25 мин при 400 g при комнатной температуре в центрифуге с горизонтальным ротором. После центрифугирования моноциты концентрируются в интерфазном кольце.
7. Моноциты из интерфазы переносят в силиконированные пробирки и дважды отмывают средой 199, содержащей 5% СЭК. Режим центрифугирования - 10 мин при 200 g.
8. Клетки ресуспендируют в питательной среде RPMI-1640, содержащей 1% L-глютамина, 40 мкг/мл гентамицина и 10% СЭК. Количество моноцитов определяют подсчетом в камере Горяева. Жизнеспособность клеток оценивают с помощью 0,1% раствора трипанового синего.
2.4. ВЫДЕЛЕНИЕ НЕЙТРОФИЛОВ
Для выделения нейтрофилов из периферической крови можно использовать несколько методов.
Выделение нейтрофилов в двойном градиенте плотности фиколл-урографина
Принцип метода. Для предотвращения активации нейтрофилов во время выделения рекомендуется проводить все манипуляции при 4 °C. Используют фиколл-урографин ρ = 1,077 г/см3 и ρ = 1,119 г/см3. Вначале создают двойной градиент фиколл-урографина: первым в пробирку вносят раствор фиколл-урографина, имеющий плотность ρ = 1,119 г/см3, затем на него аккуратно наслаивают раствор фиколла с плотностью ρ = 1,077 г/см3. Гепаринизированную кровь наслаивают на двойной градиент фиколл-урографина, центрифугируют 45 мин при 400 g. После центрифугирования получают кольца мононуклеарных клеток (верхнее) и нейтрофилов (нижнее), а в осадке находятся эритроциты. Полученное кольцо мононуклеарных клеток в зависимости от характера эксперимента удаляют или отбирают в чистую центрифужную пробирку и отмывают культуральной средой. Нейтрофильное кольцо отбирают и переносят в чистую пробирку, содержащую среду, свободную от ионов Ca2+ и Mg2+. Клетки дважды отмывают, центрифугируя 10 мин при 200 g. Присутствующие эритроциты можно лизировать. Для уменьшения примеси эритроцитов и повышения доли нейтрофилов нужно вначале проинкубировать гепаринизированую кровь с 6% раствором декстрана и затем полученную взвесь клеток наслоить на двойной градиент фиколл-урографина (получают два кольца клеток, см. выше) или на одинарный градиент плотности фиколл-урографина (ρ = 1,077 г/см3). В последнем случае нейтрофилы присутствуют в осадке вместе с эритроцитами, которые впоследствии лизируют. При использовании обоих вариантов метода содержание нейтрофилов в полученной клеточной суспензии составляет около 95% (рис. 2.3, см. также цв. вклейку).
Выделение нейтрофилов в градиенте плотности перколла
Перколл представляет собой взвесь коллоидных частиц двуокиси кремния, покрытых поливинилпирролидоном, что делает частицы нетоксичными. Обычно коммерческий препарат перколла разбавляют культуральной средой для сохранения изотоничности раствора.
Используют растворы перколла разной концентрации. Вначале на 63% раствор перколла наслаивают 72% раствор перколла, а затем - гепаринизированную кровь. После центрифугирования, кроме кольца мононуклеарных клеток, получают кольцо гранулоцитов и осадок эритроцитов. Кольцо, содержащее гранулоциты, переносят в другую пробирку, клетки отмывают и подсчитывают их число.
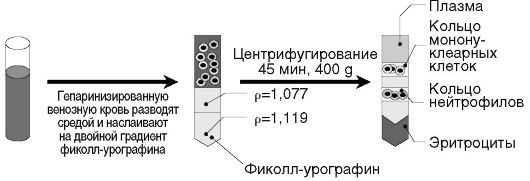 Рис. 2.3. Выделение нейтрофилов в двухступенчатом градиенте плотности фиколл-урографина
Рис. 2.3. Выделение нейтрофилов в двухступенчатом градиенте плотности фиколл-урографина
2.5. АНАЛИТИЧЕСКАЯ И ПРЕПАРАТИВНАЯ ЦИТОФЛУОРИМЕТРИЯ
Метод проточной цитофлуориметрии, предложенный в начале 1970-х годов, широко используется в медико-биологических и клинических исследованиях. Востребованность цитометрии объясняется быстротой, точностью и надежностью метода. Определение фенотипа каждой клетки в сочетании с анализом большого количества событий дает максимально полную информацию в кратчайшие сроки.
Принцип метода. Используются проточные цитометры разных фирм. При проведении исследования клетки, окрашенные тем или иным флуоресцентным красителем, вводят с потоком буферного раствора в вибрирующую проточную камеру с форсункой. В каждой капле жидкости, выходящей из форсунки, содержится одна клетка. Источник света (чаще всего лазер) освещает отдельные клетки в проходящей через световой пучок тонкой струе жидкости. Исходный световой луч рассеивается клеткой. Это рассеяние измеряется с помощью фотоэлектронного умножителя (ФЭУ). Рассеяние света под малыми углами (переднее рассеяние - forward scatter) может быть использовано для определения размеров клетки. На основе данного параме-
тра можно отличить жизнеспособные ядерные клетки от мертвых и эритроцитов. Рассеяние света под углом 90° (боковое рассеяние - side scatter) позволяет судить о соотношении размеров ядра и цитоплазмы и наличии гранул в клетке. Полученные характеристики позволяют разделить анализируемые лейкоциты на лимфоциты, моноциты, нейтрофилы. Одновременно можно проводить анализ поверхностных и внутриклеточных антигенов клеток с помощью моноклональных антител к ним, конъюгированных с различными флуоресцентными метками. Если анализируемая клетка содержит флуорохром, то он испускает излучение соответствующих параметров, при этом интенсивность флуоресценции коррелирует с плотностью антигена на клеточной поверхности, а уровень флуоресценции измеряется с помощью ФЭУ (рис. 2.4, см. также цв. вклейку).
В практике широко используются два флуоресцентных красителя - флуоресцеин-5-изотиоционат (ФИТЦ) и R-фикоэритрин (ФЭ). Они возбуждаются аргоновым лазером с длиной волны 488 нм и излучают флуоресценцию в разных диапазонах волн: ФИТЦ излучает свет в «зеленом» спектре, а ФЭ - в «оранжево-красном». Красители различаются как по специфичности их молекулярного связывания, так и по оптическим характеристикам, таким, как спектр поглощения, возбуждение флуоресценции и др. В настоящее время спектр используемых флуорохромов расширился (табл. 2.1).
Таблица 2.1. Основные используемые флуорохромы
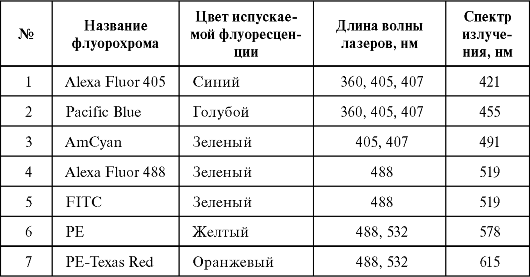 Окончание табл. 2.1
Окончание табл. 2.1
 Проточный цитометр включает три основных блока:
Проточный цитометр включает три основных блока:
1) оптический, где производится измерение;
2) блок обработки сигналов, где сигналы усиливаются и преобразуются в электрические;
3) блок сбора и обработки данных (см. рис. 2.4).
Оптические системы
Источником света обычно служит лазер. Он способен направить на клетку интенсивный световой сигнал и создать чувствительную систему детекции.
Световой сигнал проходит через соответствующие линзы и зеркала и попадает на ФЭУ. На этой стадии передачи сигнала используются
оптические фильтры для выделения света с определенной длиной волны, благодаря чему на каждый детектор попадает только избранный тип светового сигнала, например зеленое или красное излучение клеток при флуоресценции или рассеянный свет. Оптический блок предназначен для измерения рассеяния света и флуоресценции. Современные цитометры оборудованы несколькими фотоэлектронными умножителями, что позволяет одновременно регистрировать несколько типов флуоресценции.
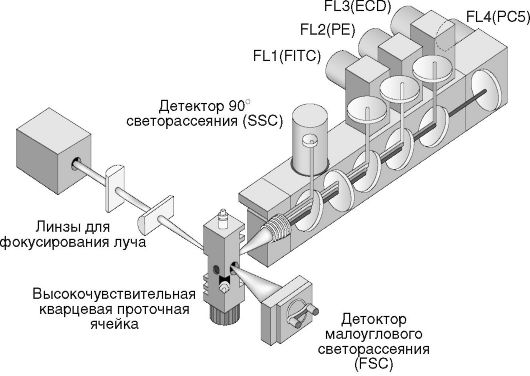 Рис. 2.4. Устройство проточного цитометра
Рис. 2.4. Устройство проточного цитометра
Система сбора и обработки данных
Сигналы, поступающие от детекторов, усиливаются, их амплитуды измеряются и анализируются в цифровой форме для каждой клетки отдельно. Ограничения, накладываемые на регистрируемый параметр, называются окнами («gate»). Окна выделяются автоматически или вручную (рис. 2.5, см. также цв. вклейку). Результаты анализа используются для построения распределений исследованных клеток по их характеристикам. Эти распределения называют гистограммами.
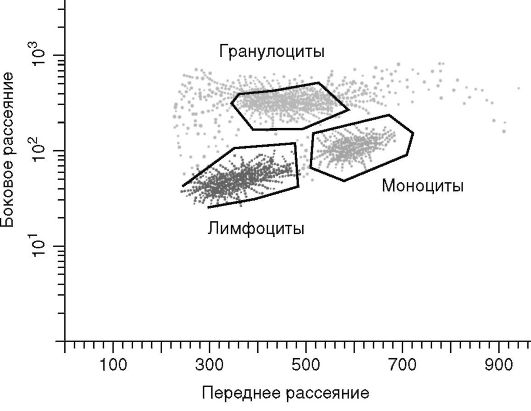 Рис. 2.5. Выделение окон лимфоцитов, моноцитов, нейтрофилов по светорассеянию
Рис. 2.5. Выделение окон лимфоцитов, моноцитов, нейтрофилов по светорассеянию
Применение метода проточной цитометрии
 Рис. 2.6. Проточный цитофлуориметр
Рис. 2.6. Проточный цитофлуориметр
Современные проточные цитометры обладают высокой чувствительностью, высоким уровнем автоматизации, просты в эксплуатации, имеют небольшие размеры (рис. 2.6, см. также цв. вклейку). Проточная цитометрия стала незаменимым методом диагностики различных иммунопатологических состояний в клинической практике: успешно используется в гематологических лабораториях, для оценки иммунного статуса, в онкологии. Метод позволяет:
• проводить иммунофенотипирование клеток: дифференцировать популяции лейкоцитов, определять субпопуляционный состав лимфоцитов;
• оценивать функциональную активность клеток;
• проводить анализ клеточного цикла и плоидности клеток;
• проводить анализ программируемой клеточной гибели (апоптоза);
• определять внутриклеточные и растворимые формы цитокинов;
• оценивать фагоцитарную активность клеток;
• проводить анализ биологических жидкостей (секреты, слюна и др.);
• проводить количественное и качественное исследование pH, концентрации свободных ионов кальция, уровня окислительных процессов;
• осуществлять мониторинг иммунодефицитных состояний, проводить онкогематологические исследования.
Количественное определение субпопуляций лимфоцитов с помощью проточной лазерной цитометрии с использованием моноклональных антител
Фенотипирование лимфоцитов широко применяется в клинической иммунологии. В основе метода лежит взаимодействие моноклональных антител, меченных флуоресцентной меткой, с поверхностными антигенами лимфоцитов и последующий анализ образцов на проточном цитометре. Возможно использование одного моноклонального антитела, меченного флуорохромом, или двух различающихся по специфичности моноклональных антител, меченных разными флуорохромами (рис. 2.7). Определяют процент клеток, несущих на своей поверхности искомый антиген, и среднюю интенсивность свечения, которая характеризует выраженность экспрессии исследуемого антигена. Для проведения исследования можно использовать как цельную кровь, так и предварительно выделенные
из периферической крови обследуемого лейкоциты или мононуклеарные клетки. Разработаны многоцветовые цитометры.
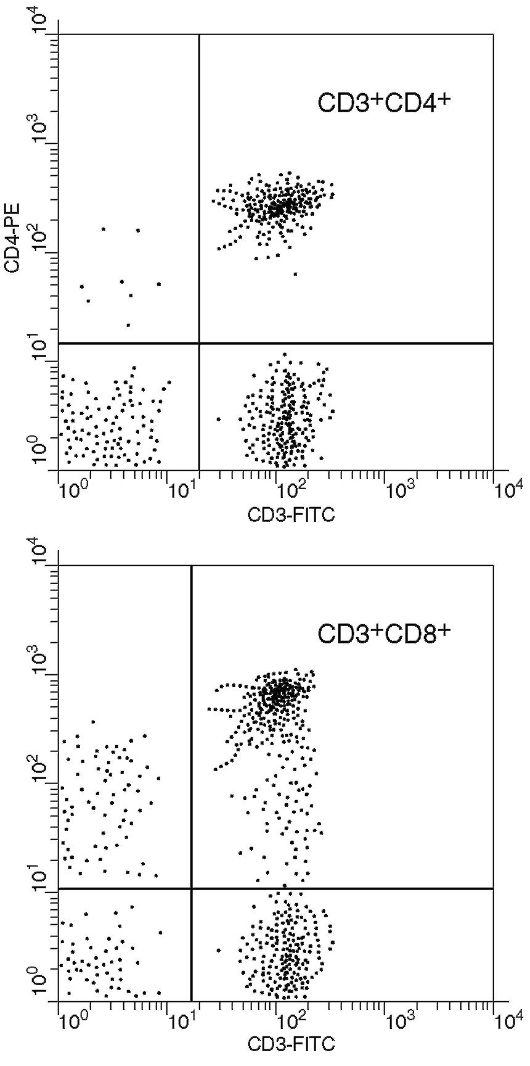 Рис. 2.7. Дот-анализ: двойное окрашивание по CD3 и CD4
Рис. 2.7. Дот-анализ: двойное окрашивание по CD3 и CD4
Лабораторная работа 2-3
1. Получают гепаринизированную периферическую венозную кровь (20-25 ЕД гепарина на 1 мл крови) в объеме 5 мл.
2. Лейкоциты выделяют из периферической крови. Для этого добавляют в пробирку 0,3% раствор желатины, перемешивают и инкубируют в термостате 30 мин при 37 °С для осаждения эритроцитов. Собирают лейкомассу. Клетки отмывают полной культуральной средой, центрифугируя при 1000 об/мин в течение 10 мин. Процедуру отмывки проводят дважды.
3. К клеточному осадку добавляют 50 мкл полной культуральной среды. Затем в каждую пробирку вносят по 50 мкл предварительно разведенного образца нужных моноклональных антител (монАТ), меченных флуорохромами. Одна пробирка (контроль) содержит только клетки и полную культуральную среду.В остальные пробирки добавляют монАТ - CD3, CD4, CD8, CD19 и другие в зависимости от цели эксперимента.
4. Пробирки инкубируют 30 мин при 4 °С.
5. Клетки отмывают от излишних монАТ в полной культуральной среде центрифугированием при 1000 об/мин в течение 5 мин.
6. Оставшиеся в пробе эритроциты лизируют, добавляя к клеточному осадку лизирующий раствор, состоящий из 0,8% раствора NH4Cl, 0,1% раствора NaHCO3, 0,0037% натриевой соли ЭДТА (рН = 7,2-7,4).
7. Проводят встряхивание проб на шейкере 1 мин.
8. Образцы центрифугируют 5 мин при 1000 об/мин. Надосадочную жидкость сливают, добавляют полную культуральную среду и повторяют центрифугирование в том же режиме.
9. Для фиксации меченых клеток в каждую пробу добавляют по 100 мкл 2% параформальдегида и инкубируют 30 мин при 4 °С.
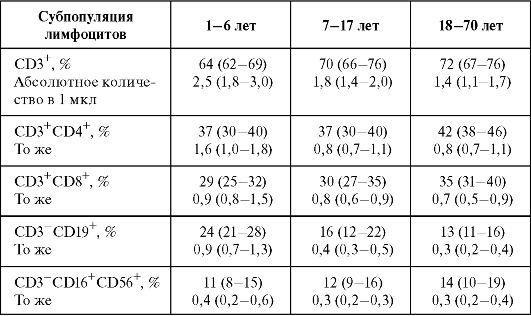
10. Анализ образцов проводят на проточном цитометре. Содержание основных субпопуляций лимфоцитов в периферической крови здоровых людей представлено в табл. 2.2.
Выделение клеток методом проточной цитометрии
На основе параметров, измеряемых с помощью проточной цитометрии, можно проводить сепарацию клеток. Проанализированные клетки перемещаются в каплю, которой придается положительный/ отрицательный заряд, или в нейтральную каплю (процесс контро-
лируется компьютерной программой). Капли с флуоресцирующими клетками заряжаются положительно, а с нефлуоресцирующими - отрицательно. Капля проходит между противоположно заряженными электродами и отклоняется вправо или влево в зависимости от своего заряда. Уровень чистоты клеточных фракций, разделенных с помощью клеточного сортера, доходит до 99%.
Таблица 2.2. Содержание основных субпопуляций лимфоцитов в периферической крови здоровых людей разного возраста
 2.6. ИММУНОМАГНИТНАЯ СЕПАРАЦИЯ КЛЕТОК
2.6. ИММУНОМАГНИТНАЯ СЕПАРАЦИЯ КЛЕТОК
Магнитная сепарация клеток становится стандартным и широко используемым методом, дающим надежные и воспроизводимые результаты, применяемым как для научных исследований, так и в клинической лабораторной практике.
Принцип метода. Магнитная сепарация клеток основана на использовании парамагнитных бус (микросфер), покрытых монАТ против поверхностного антигена, специфичного для интересующих клеток. Магнитные бусы имеют диаметр около 50 нм, невидимы при световой микроскопии, подвергаются биодеградации и не травмируют клетки. Поскольку размер микросфер чрезвычайно мал, то для удержания меченых клеток необходимо наличие высокоградиентного магнит-
ного поля. Для успешного разделения клеток чрезвычайно важно, чтобы микробусы после воздействия магнитного поля не проявляли остаточной намагниченности. Использование однородных по размеру и форме микробус обеспечивает: быстрое и эффективное связывание клеток; минимизацию неспецифического связывания; хорошо воспроизводимые результаты.
Метод позволяет осуществлять выделение интересующей популяции клеток из цельной крови, образцов клеток костного мозга или мононуклеарной суспензии, что обеспечивает быстрый и прямой доступ к максимальному числу целевых клеток. Частицы добавляют непосредственно к образцу биологической жидкости. После 10- 20-минутной инкубации пробирка с образцом помещается в магнитный сепаратор, где клетки интересующей популяции, связанные с магнитными частицами, улавливаются, а в супернатанте остаются не связавшиеся с микробусами клетки. При этом поддерживаются оптимальные условия жизнеспособности и функционирования клеток. Выделенные целевые клетки ресуспендируют в солевом буферном растворе и анализируют согласно протоколу исследования. При необходимости магнитные частицы впоследствии отделяются от исследуемых клеток (рис. 2.8, см. также цв. вклейку).
Метод магнитной сепарации предоставляет неограниченные возможности по выделению любой интересующей клеточной популяции. Иммуномагнитные микробусы позволяют осуществить либо положительную, либо отрицательную селекцию нужных клеток (как из клеточной суспензии, так и из цельной крови). При положительной селекции выделяемые клетки связываются с бусами, покрытыми монАТ, поверхностными маркерами данного типа клеток, а лишние клетки удаляются. При отрицательной селекции с магнитными микробусами, нагруженными монАТ, связываются клетки, которые нужно удалить. Выделяемая популяция клеток остается в клеточной суспензии. Оба типа селекции можно провести двумя способами.
1. Прямой метод - клетки инкубируют с микробусами, нагруженными моноклональными антителами к клеточным антигенам.
2. Непрямой метод - клетки на первом этапе инкубируют с первичными антителами к клеточным антигенам, которые бывают:
а) немечеными;
б) конъюгированы с биотином;
в) конъюгированы с флюорохромом.
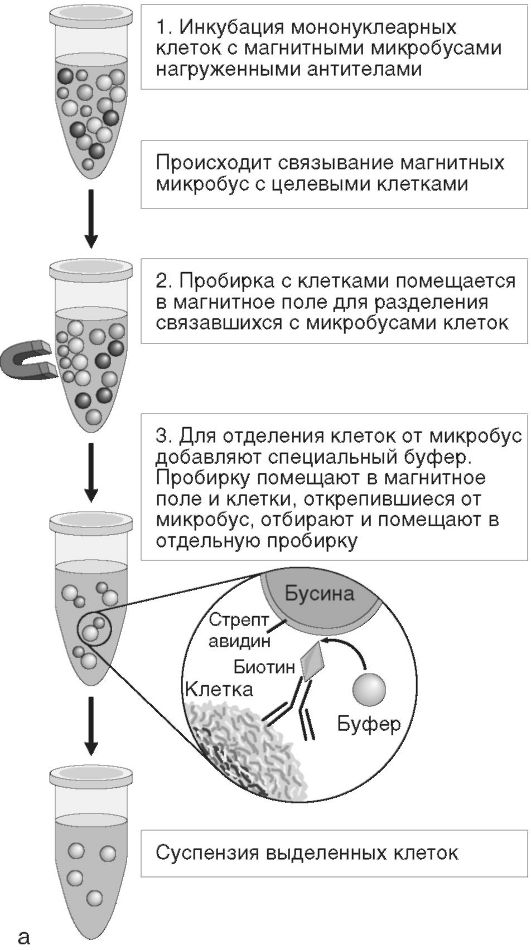
 Рис. 2.8. Иммуномагнитная сепарация: а - основные этапы; б - магнитные бусы; в - пример магнитного штатива
Рис. 2.8. Иммуномагнитная сепарация: а - основные этапы; б - магнитные бусы; в - пример магнитного штатива
• На втором этапе клетки инкубируют с вторичными антителами к иммуноглобулину (в случае использования неконъюгированных первичных антител), антителами к биотину или микробусами, конъюгированными со стрептавидином (в случае использования первичных антител, конъюгированных с биотином) или антителами к флюорохрому (в случае использования первичных антител, конъюгированных с флюорохромом). Существует несколько типов парамагнитных бус: частицы, конъюгированные с первичными антителами, - это готовые к использованию микробусы, связанные с моноклональными антителами, высокоспецифичными к определенным поверхностным маркерам клеток человека и мыши;
• частицы, конъюгированные с вторичными антителами, - это частицы, связанные с очищенными вторичными антителами, позволяющие использовать любые мышиные, крысиные или кроличьи первичные антитела для выделения целевой популяции клеток;
• неконъюгированные бусы - частицы для прямого ковалентного связывания специфических антител и лигандов.
Метод позволяет получить высокоочищенные фракции как меченых, так и немеченых клеток с гарантированным оптимальным выходом. При этом клетки по параметрам жизнеспособности готовы для последующих экспериментов. Очистка клеточной суспензии занимает сравнительно мало времени (30-40 мин). Полученные клетки можно исследовать с помощью микроскопии, метода проточной цитометрии, культивирования in vitro и использовать для других методов иммунного анализа.
Вопросы и задания
1. На каких свойствах основано разделение клеток периферической крови?
2. Приведите последовательность этапов получения мононуклеарных клеток.
3. Как можно выделить популяцию моноцитов из периферической крови человека?
4. Каким образом одновременно можно разделить мононуклеарные клетки, нейтрофилы, тромбоциты и эритроциты?
5. Представьте последовательность этапов выделения нейтрофилов из периферической крови и оценки их фагоцитарной активности.