Иммунология : практикум : учеб. пособие / [Ковальчук Л. В. и др.] - 2010. - 176 с. : ил.
|
|
|
|
ГЛАВА 1. ОБЪЕКТЫ ИССЛЕДОВАНИЯ В ИММУНОЛОГИИ
1.1. ИНБРЕДНЫЕ ЖИВОТНЫЕ
Для проведения фундаментальных исследований в иммунологии лучший объект - инбредные мыши. Инбредные животные - это животные, полученные путем инбридинга (in breed - выводить породу, разводить), т.е. последовательных близкородственных скрещиваний с целью получения гомозиготного и генетически идентичного потомства. Среди потомков для дальнейших скрещиваний сначала отбирают особей по признакам внешнего сходства, в последующих поколениях уже тестируют на совпадение групп крови и приживление кожных лоскутов. Через 20 поколений и более такой селекции получают мышей с весьма высокой степенью гомозиготности, обозначаемых как чистая линия, в пределах которой все животные генетически почти идентичны (например, как однояйцевые близнецы у человека).
Главная цель выведения чистых линий мышей и исследований на них - получение возможности многократного повторения экспериментов на генетически одинаковых организмах, т.е. обеспечение воспроизводимости результатов исследований в высоком смысле этого понятия, что полностью исключено при решении многих иммунологических задач с использованием беспородных животных. Подобные проблемы существуют при оценке результатов иммунных процессов у человека.
Мыши стали исключительными экспериментальным животными в иммунологии в силу ряда причин, главные из которых следующие:
1) короткий срок беременности (21 сут) и множественное потомство от каждой самки (5-8 детенышей в одни роды) позволяют весьма быстро вывести чистые линии, что важно по вышеназванным причинам;
2) себестоимость содержания мышей по сравнению с таковой других млекопитающих наименьшая;
3) структура и функция иммунной системы мыши и человека во многом сходны;
4) выведение чистых линий мышей показало, что, например, некоторые из них (несмотря на гомозиготность) весьма крепкие и здоровые, т.е. не всякий инбридинг приводит к вырождению.
Кроме того, путем целенаправленного отбора тех или иных свойств созданы многочисленные линии мышей с точно заданными характеристиками, и это позволяет выбирать особей, необходимых для достижения конкретных научных целей. Характеристики животных разных линий занесены в соответствующие документы; на них ориентируются питомники по разведению чистолинейных мышей, имеющиеся во всех странах, где успешно занимаются проблемами экспериментальной иммунологии. Из наиболее прославленных питомников хотим упомянуть Джексоновскую лабораторию (The Jackson Laboratory) в США. Ежегодно она поставляет в университеты, медицинские институты и научно-исследовательские лаборатории всего мира приблизительно 2 млн животных 2500 разных линий, стоков и животных-моделей. Около 97% этих животных можно приобрести только в Джексоновской лаборатории. В каждом питомнике разводимые и поддерживаемые линии мышей имеют паспорт, систематизированы в соответствующих базах данных и доступны для широкого применения. Известен гаплотип (Н-2) мышей разных линий, их окрас, поведенческие характеристики, особенности функционирования иммунной системы и прочие свойства, необходимые не только для иммунологических исследований, но и исследований в других областях биологии и медицины (онкология, фармакология, экология и т.д.).
Мы приводим характеристику некоторых наиболее известных линий мышей, которые экспериментаторы выбирают с теми или иными определенными целями (табл. 1.1).
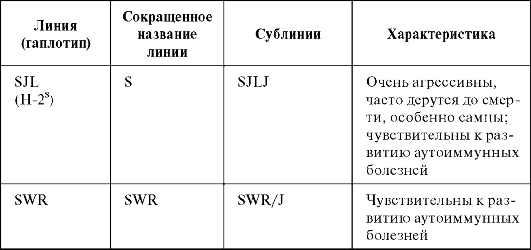
Таблица 1.1. Линии инбредных мышей, наиболее часто применяемые в исследованиях (Кондратьева И.А., Ярилин А.А., 2004)
 Продолжение табл. 1.1
Продолжение табл. 1.1
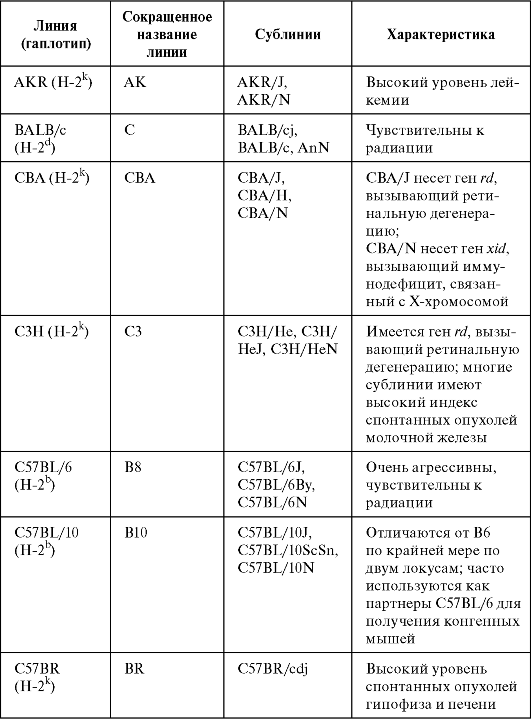 Продолжение табл. 1.1
Продолжение табл. 1.1
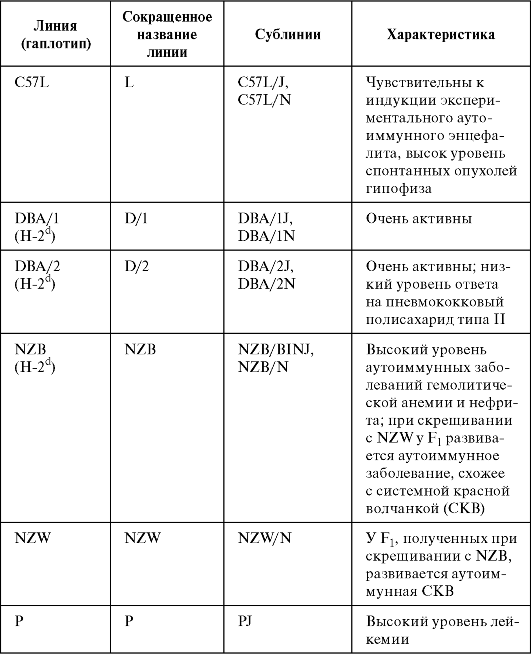 Окончание табл. 1.1
Окончание табл. 1.1
 СВА/J (рис. 1.1, см. также цв. вклейку) и гибриды первого поколения (CBA/J ×C57Bl.6)F1 - серо-бурые
здоровые выносливые мыши, которые хорошо переносят облучение в
кроветворных летальных дозах, и по этой причине их часто используют в
радиационных моделях.
СВА/J (рис. 1.1, см. также цв. вклейку) и гибриды первого поколения (CBA/J ×C57Bl.6)F1 - серо-бурые
здоровые выносливые мыши, которые хорошо переносят облучение в
кроветворных летальных дозах, и по этой причине их часто используют в
радиационных моделях.
 Рис. 1.1. Мышь линии СВА/J
Рис. 1.1. Мышь линии СВА/J
C57B1/6 (рис. 1.2, см. также цв. вклейку) - черного цвета мыши, подвижные, агрессивного поведения.
Balb/c (рис. 1.3) - белые мыши с хрупким здоровьем. Однако это самая востребованная линия для гибридомной биотехнологии, потому что линии миелом, на основе которых получают гибридомы, ведут свою «родословную» от перевивной линии лейкозных клеток МОРС- 21, происходящей от мышей Balb/c. Гибридомы хорошо растут в брюшной полости живых сингенных мышей в виде асцитных опухолей.
Кроме собственно чистых линий мышей, генетики научились выводить так называемых конгенных мышей. Так называют линии, отличающиеся друг от друга небольшой областью генома (иногда одним геном).
 Рис. 1.2. Мышь линии C57B1/6
Рис. 1.2. Мышь линии C57B1/6
 Рис. 1.3. Мышь линии Balb/c
Рис. 1.3. Мышь линии Balb/c
В основе выведения конгенных линий мышей лежит генетический прием возвратного скрещивания - получение потомства в ряду поколений от скрещивания гетерозиготы (потомков гомозиготных родителей, генетически отличающихся между собой) с одним из исходных гомозиготных родителей. Смысл подобного скрещивания - внедрить комплекс Н-2 донорской линии А в генотип основной линии В. На рисунке 1.4 представлены донорская маркирующая линия А и основная линия В. От скрещивания гомозиготных особей этих двух линий получают гибриды первого поколения F1, (a/b; генерация 1). При дальнейшем скрещивании гибридов F1 с особями основной линии В получают потомство, состоящее как из гомозигот (b/b), так и гетерозигот (а/b) по комплексу Н-2. В последующих скрещиваниях отбираются только гетерозиготные особи, имеющие признак «а» (Н-2а), который определяется по приживлению кожного трансплантата от маркирующей линии A и положительной серологической реакции клеток
крови с анти-А-сывороткой. По мере продолжения скрещиваний а-положительных особей с особями основной линии В доля генома линии А постоянно снижается, но при этом для дальнейшего размножения из потомства отбирают только тех особей, которые сохраняют признак «а» (H-2a). К двенадцатому поколению (генерация ? 12) практически весь геном отбираемых после гибридизации мышей представлен основной линией В, за исключением признака «а», по которому шел отбор. Дальнейшая задача состоит в переводе признака «а» в гомозиготное состояние. Для этой цели гетерозигот (а/b) скрещивают между собой и отбирают для дальнейшего размножения только тех особей из потомства, которые отторгают кожный трансплантат, взятый от особей линии В, и не дают реакции с анти-В-сывороткой. Подобный отбор выявляет особей с отсутствием признака «b» (H-2b) и гомозиготность по признаку «а» (H-2a). Таким образом, в результате применения данной схемы скрещивания в геном основной линии В внедряется комплекс Н-2 маркирующей линии А (рис. 1.4). С момента перевода комплекса H-2a в гомозиготное состояние констатируется получение новой конгенной (по отношению к основной) линии В (Klein J., 1975).
1.2. ЛИНИИ МЫШЕЙ С ГЕНЕТИЧЕСКИМИ ДЕФЕКТАМИ, ЗАТРАГИВАЮЩИМИ ИММУННУЮ
СИСТЕМУ
SCID (англ. severe combined immunodeficiency) - мыши, страдающие тяжелым иммунодефицитом в результате мутации в генах RAG, ответственных за перегруппировку генов иммуноглобулинов и Т-клеточного рецептора. Животные практически лишены Т- и В-лимфоцитов и могут жить в безмикробных условиях, но необязательно - в полностью стерильных. Эти мыши не отторгают ксеногенные ткани, в частности им можно вводить с расчетом на приживление самые разнообразные клетки человека.
В 1959 г. Расселом и соавт. описаны определенные частично инбредные мыши - спонтанные мутанты-самцы, которые вскоре после рождения покрывались чешуйчатой перхотью (рис. 1.5), заметно отставали в росте, страдали от тяжелой диареи и умирали в возрасте около 3 нед. При морфологическом исследовании у мышей наблюдали массивную лимфоаденопатию, спленомегалию, аномаль-
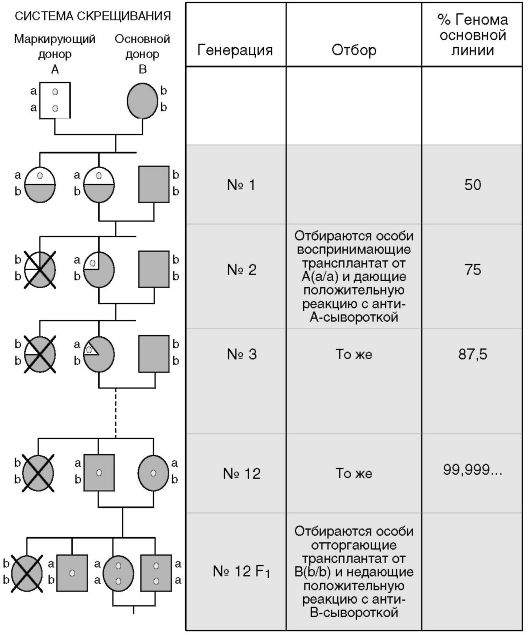 Рис. 1.4. Схема получения конгенных линий (Галактионов В.Г., 1986)
Рис. 1.4. Схема получения конгенных линий (Галактионов В.Г., 1986)
ную инфильтрацию лимфоцитами кожи, печени, легких, эндокринных желез. Мутантных самцов назвали «скуpфи» (англ. scurfy - покрытые перхотью). Только в 2001 г. M.E. Brunkow и соавт. показали: мутация scurfy затронула ген фактора транскрипции FoxP3 (вставка двух пар оснований в 8-й экзон этого гена), локализованного на Х-хромосоме. В том же 2001 г. несколько исследователей (C. Bennett,
R. Wildin) показали: у детей с синдромом IPEX поврежден тот же ген (Xp11.23-Xq13.3), что и у мышей scurfy - FoxP3. В 2003-2005 гг. Джейсон Фонтенот и Александр Руденский показали: экспрессия гена FoxP3 является существенным и определяющим моментом в дифференцировке в тимусе Т-регуляторных клеток (Treg), открытых Сакагучи в 1995-1996 гг. и ответственных за поддержание иммунологической толерантности к нормальным тканям своего организма и гомеостаза в иммунной системе, а также за контроль аутоиммунных и опухолевых заболеваний.
 Рис. 1.5. Мышь линии Scurfy («покрытые перхотью»)
Рис. 1.5. Мышь линии Scurfy («покрытые перхотью»)
Nude (лишенные волосяного покрова) - замеченные и отобранные в 1960 г. мыши со спонтанной мутацией, в результате которой у мышей-гомозигот по данной мутации (nu/nu) отсутствуют тимус и волосяной покров (рис. 1.6, см. также цв. вклейку). Мутантный ген поддерживают при размножении мышей в гетерозиготном состоянии; он перенесен мышам нескольких других линий, например Balb/c, CBA/Ca, C57Bl/10ScSn и пр.
 Рис. 1.6. Мышь линии Nude
Рис. 1.6. Мышь линии Nude
C57Bl/6-bg/bg (англ. beige - бежевый) - мыши-мутанты бежевого окраса из исходно черной линии. Характеризуются существенно сниженной активностью NK-клеток и фагоцитов с повреждением лизосомальных структур.
AKR - белые мыши (рис. 1.7, см. также цв. вклейку). У 90% особей обоего пола к возрасту 6-8 мес развиваются «спонтанные» тимомы и лейкоз.
 Рис. 1.7. Мышь линии AKR/J
Рис. 1.7. Мышь линии AKR/J
W/Wv - мыши с существенным дефицитом тучных клеток в слизистых оболочках.
1.3. ЛИНИИ МЫШЕЙ С АУТОИММУННОЙ
ПАТОЛОГИЕЙ
NZB (New Zeland Black) - новозеландские черные мыши с аутоиммунной гемолитической анемией. Сывороточные антиэритроцитарные антитела мышей связывают эритроциты, но не агглютинируют их.
(NZB χ NZW)F1 - гибриды первого поколения черных и белых новозеландских мышей. У них «спонтанно» развивается синдром, напоминающий красную волчанку человека с гломерулонефритом. В крови содержится много антител к ДНК.
MRL/Mp-lpr/lpr - мыши с СКВ и ревматоидным артритом, с синдромом повышенной лимфопролиферации, увеличенными лимфоузлами. В крови у них увеличено содержание антител против иммуноглобулинов и против ДНК. Мутация идентифицирована в гене Fas, т.е. у этих мышей имеется недостаточность процессов апоптоза лимфоцитов.
MRL/Mp- +/+0 - мыши с хроническим гломерулонефритом, антителами к ДНК, но без лимфоаденопатии.
C57B\/KS-db/db - склонные к быстрому ожирению мыши, у которых к возрасту 4 мес развиваются существенное повреждение выработки инсулина и тяжелый диабет.
NOD (non-obese diabetic mouse) - мыши с диабетом, но без ожирения. Модель с болезнью, наиболее близкой к диабету I типа у человека.
EAGM (experimental autoimmune myasthenia gravis) - мыши с аутоиммунной миастенией гравис.
EAE (experimental autoimmune encephalitis) - мыши с аутоиммунным энцефалитом.
EAT (experimental autoimmune thyroiditis) - мыши с аутоиммунным тиреоидитом.
1.4. БИОЛОГИЧЕСКИЕ МАТЕРИАЛЫ
ДЛЯ ИССЛЕДОВАНИЙ
Для исследования иммунной системы используются следующие биологические материалы.
1. Цельная периферическая кровь.
2. Сыворотка крови - жидкая фракция крови, освобожденная от фибриногена.
3. Плазма крови - жидкая фракция крови, содержащая фибриноген, следовательно, способная к образованию сгустков фибрина.
4. Клетки крови, отделенные от жидкой фракции.
5. Цереброспинальная жидкость.
6. Синовиальная жидкость.
7. Бронхоальвеолярный лаваж.
8. Выделения слизистых секретов половых органов (из канала шейки матки, влагалища, семенная жидкость).
9. Выделения из носа (смывы или адсорбция на пористые материалы).
10. Моча.
11. Супернатанты, полученные от культивируемых in vitro клеток
12. Гомогенаты тканей (биопсия или post mortem).
13. Цитоплазматические и ядерные компоненты клеток. Биологический материал разного происхождения отличается по
биохимическому составу, ионной силе, вязкости. Все эти параметры имеют существенное значение для реализации связывания
антител с антигенами, используемыми для тестирования. Поэтому каждая конкретная тест-система разработана строго для конкретного вида биоматериала и в 99% случаев - для сыворотки крови. Тест-системы для анализа компонентов сыворотки не могут быть использованы в опытах с другими биологическими жидкостям из-за высокой вероятности получения ложных результатов. Тест-системы, предназначенные для человека (за некоторыми исключениями), нельзя примененять на лабораторных животных и наоборот. Исключение составляют перекрестно-реагирующие агенты, например цитокин - трансформирующий фактор роста человека и свиньи.
Приведем несколько примеров технических приемов получения биоматериалов.
Сыворотка крови
Как правило, у человека или животных берут венозную кровь в чистую сухую пробирку. Оставляют при комнатной температуре на 20-30 мин для образования первичного сгустка фибрина. Затем пробирки центрифугируют на цитоцентрифугах при 1000-2000 об/мин в течение 10 мин. Супернатант и есть сыворотка крови. Если анализ выполняют не в тот же день и час, то сыворотку разливают по аликвотам в плотно закрываемые криопробирки (полипропиленовые) и замораживают. Для краткосрочного хранения можно заморозить до -18-20 °С, для более продолжительного хранения лучше использовать морозильные камеры с температурой -70-80 °С. Повторные оттаивания-замораживания нежелательны или недопустимы (в зависимости от конкретного вида анализа). Нежелательно или недопустимо также использовать в работе сыворотки с признаками гемолиза и липидемии.
Существуют приемы так называемого осветления мутного биоматериала, в частности центрифугирование при 14 000 об/мин в течение 10 мин. Однако следует иметь в виду: при этой процедуре возможна потеря искомого биопродукта. И все же данную процедуру принято применять для осветления проб мочи, цереброспинальной жидкости, бронхоальвеолярного лаважа, синовиальной жидкости.
Плазма крови
Для получения плазмы крови следует позаботиться о том, чтобы не образовался сгусток фибриногена. Добиваются этой цели двумя способами: либо работают как можно быстрее, свежевзятую кровь
безотлагательно центрифугируют при 2000 g в течение 10 мин с охлаждением, супернатант быстро разливают по аликвотам в охлажденные полипропиленовые пробирки и морозят; либо кровь берут в пробирки с антикоагулянтами (гепарином, цитратом натрия или этилендиаминтетраацетатом - ЭДТА). Но в последнем случае следует учитывать, что присутствие антикоагулянта в биоматериале не повлияет на результаты иммуноанализа. В большинстве случаев антикоагулянты влияют на взаимодействие антител с антигенами, большинство тест-систем рассчитано на работу с сывороткой крови, а не с плазмой.
Слизистые секреты, сорбированные на пористые губки
Губки, предназначенные для сорбции выделений (из канала шейки матки, со слизистой рта, зубодесневых карманов, полостей носа и т.п.), имеют стандартные размеры и массу. По окончании процедуры сорбции губки помещают в пробирки с экстрагирующим буфером и оставляют, как правило, на ночь в холодильнике при 4 °С, после чего центрифугируют при 13 000 об/мин в течение 10 мин и супернатант используют в качестве материала для иммуноанализа.
Состав экстрагирующего буфера: 50 мМ HEPES, pH 7,5; 150 мМ NaCl; 1 mM ЭДТА; 25 mM EGTA; 1 mM Na3VO4; 1 mM NaF; 0,1% Tween 20; 10% глицерол.
1.5. МЕТОДИЧЕСКИЕ ОСОБЕННОСТИ РАБОТЫ
С ИММУНОКОМПЕТЕНТНЫМИ КЛЕТКАМИ
Для выявления отдельных популяций клеток, оценки количественных закономерностей их появления и накопления, изучения маркеров и рецепторов различных популяций лимфоцитов необходимо овладеть методами работы с клетками иммунной системы.
Лабораторная работа 1-1
Выделение органов и тканей иммунной системы
Животное забивают, взвешивают (вес тела животного необходимо знать при вычислении селезеночного индекса), делают разрез по средней линии брюшка, кожу отпрепаровывают и оттягивают на иглах. Находят паховые и подмышечные лимфатические узлы.
Делают разрез мышц брюшины и извлекают брыжеечные лимфатические узлы. Из брюшной полости извлекают селезенку. Вскрывают грудную полость и за грудиной находят тимус. Вырезают бедренные и большие берцовые кости. Выделенные ткани и органы помещают в среду 199 и хранят при температуре тающего льда (0-2 °С). Приготовление клеточных суспензий идет при температуре тающего льда в чашках Петри или бюксах в стерильных условиях.
Получение клеточных суспензий из костного мозга
Для получения клеточной суспензии из костного мозга можно использовать бедренные, большие берцовые и плечевые кости. Кости очищают от прилегающих тканей при помощи пинцета и скальпеля, остатки тканей счищают марлей, срезают эпифизы и при помощи шприца с иглой соответствующего диаметра вымывают костный мозг 2-3 мл среды 199 (охлажденной до 0-2 °С) в центрифужную пробирку. Осторожно, избегая образования пены, клетки суспензируют, пропуская взвесь небольшими порциями через шприц. Полученную суспензию клеток дважды отмывают средой 199 при центрифугировании (250-500 об/мин 10 мин). Hадосадочную жидкость сливают (отбирают), клетки ресуспензируют в свежей среде 199. В полученной суспензии подсчитывают общее количество ядросодержащих клеток и определяют их жизнеспособность (см. ниже).
Получение клеточной суспензии из лимфатических узлов, тимуса и селезенки
Лимфатические узлы (подмышечные, паховые, брыжеечные и др.), тимус или селезенку очищают от жира и соединительной ткани. Очищенные лимфатические узлы, тимус или селезенку переносят в чашку Петри или бюкс с небольшим количеством среды 199 (0,5 мл) и фрагментируют ножницами (можно осторожно ворсить скальпелем, разрывать препаровальными иглами или раздавливать в гомогенизаторе) до получения однородной клеточной взвеси. К полученной взвеси добавляют еще 2,5 мл среды 199 и фильтруют ее через капроновую сетку в центрифужную пробирку. Дважды отмывают средой 199 при центрифугировании в течение 5 мин при 1000 об/мин. Супернатант удаляют, а к осадку добавляют свежей среды 199 и ресуспензируют пастеровской пипеткой, шприцем с иглой или автоматическим дозатором. В полученной клеточной суспензии подсчитывают
число ядросодержащих клеток в 1 мл и определяют их жизнеспособность (см. ниже).
Подсчет числа ядросодержащих клеток в суспензии
Взвесь клеток тщательно перемешивают шприцем с иглой или автоматическим дозатором. В лунке круглодонного планшета смешивают 20 мкл взвеси клеток и 180 мкл 5% раствора уксусной кислоты. Таким образом, первоначальная взвесь клеток разводится в 10 раз (эритроциты под влиянием уксусной кислоты лизируются, у ядросодержащих клеток разрушается оболочка, но ядра сохраняются). Полученную смесь опять тщательно перемешивают и затем заполняют ею камеру Горяева. Под микроскопом в сетке камеры Горяева подсчитывают число клеток в 100 больших квадратах (25 «окон»). Подсчет производят в 2 сетках камеры и выводят среднее число клеток.
Принцип подсчета числа клеток в 1 мл суспензии
Полученное число клеток соответствует объему в 100 больших квадратах, т.е. 0,4 мм3 (площадь квадрата 1/25 мм2, высота камеры 0,1 мм). Следовательно, если в камере насчитали 100 клеток, т.е. в 0,4 мм3 находится 100 клеток, то в 1000 мм3 - 250 000 клеток, а с учетом разведения клеток в 10 раз общее число ядросодержащих клеток в 1 мл составит 50х106. По упрощенной схеме подсчета полученное среднее число клеток делят на 4 и умножают на 105. Для определения общего числа ядросодержащих клеток в органе количество клеток в 1 мл умножают на количество среды, в которой был суспензирован орган или ткань.
Х = А / 4 × 105,
где Х - количество клеток в 1 мл клеточной суспензии; А - количество клеток в 25 квадратах.
Для определения общего числа ядросодержащих клеток в органе количество клеток в 1 мл умножают на количество среды, в которой были суспендированы орган или ткань.
Определение жизнеспособности клеток
Определение жизнеспособности клеток производится методом суправитальной окраски 0,1% раствором трипановой сини.
Hа предметное стекло наносят каплю взвеси клеток и 1 каплю 0,1% раствора трипановой сини. Через 30-60 с окрашенную каплю взвеси покрывают покровным стеклом. Избыток суспензии удаляют промакиванием фильтровальной бумагой и под микроскопом подсчитывают число живых (неокрашенных) и погибших (синих) клеток на 100 кариоцитов. Выводят процент гибели клеток.
Раствор трипановой сини готовят заранее. Порошок растворяют в бидистиллированной воде из расчета получения 0,2% раствора, который фильтруют. Это маточный раствор. Рабочий раствор приготовляют перед опытом: маточный раствор разбавляют 4,25% раствором хлористого натрия до нужной концентрации (1 капля гипотонического физиологического раствора + 3 капли трипановой сини).
Вопросы и задания
1. Дайте определение инбредных животных.
2. Опишите принцип получения конгенных линий мышей.
3. Какие биологические материалы используются для исследования иммунной системы?
4. Перечислите основные этапы получения клеток костного мозга у мышей.
5. Перечислите основные этапы выделения клеток из периферических органов мышей.
6. Как подсчитать количество клеток в 1 мл клеточной суспензии и определить жизнеспособность клеток?