Иммунология : практикум : учеб. пособие / [Ковальчук Л. В. и др.] - 2010. - 176 с. : ил.
|
|
|
|
ГЛАВА 3 МЕТОДЫ ИЗУЧЕНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ КЛЕТОК ИММУННОЙ СИСТЕМЫ IN VITRO И IN VIVO
3.1. ОЦЕНКА ПРОЛИФЕРАТИВНОЙ АКТИВНОСТИ ЛИМФОЦИТОВ
Лимфоциты - единственный тип клеток крови, для которых пролиферация в периферических тканях является физиологической нормой и обязательным этапом в развитии иммунного ответа. Поэтому количественная оценка пролиферативной активности лимфоцитов в спланированных экспериментальных условиях может служить мерой реактивности лимфоцитов на тот или иной внешний стимул. Если такой внешний стимул - специфический антиген, то уровень пролиферативного ответа лимфоцитов допустимо расценить как показатель иммуногенности препарата, содержащего антиген (способности вызывать на себя иммунный ответ), или численности клона(ов), реагирующих на данный антиген лимфоцитов.
Существуют вещества, которые называют митогенами за их способность вызывать деление клеток. Митогены обусловливают поликлональную или олигоклональную пролиферацию лимфоцитов. Первым случайно обнаруженным в процессе рутинных работ в банке крови по гемагглютинации эритроцитов митогеном лимфоцитов стал лектин фитогемагглютинин (ФГА) из обыкновенной фасоли Phaseolus vulgaris, способный агглютинировать эритроциты только определенного серологического типа. ФГА - сильный митоген, индуцирующий переход клеток из стадии G2 в митоз. Впервые ФГА выделен из фасоли П. Новеллом в 1960 г. С тех пор появился новый метод оценки пролиферативной активности лимфоцитов человека и экспериментальных животных, получивший название бласттрансформация. Оказалось, ФГА вызывает митотическое деление преимущественно Т-лимфоцитов. Также преимущественное митогенное действие в отношении Т-лимфоцитов оказывает лектин конканавалин А, выделенный из растений семейства бобовых
Canavalia ensiforme. В последнее время получили широкое распространение моноклональные антитела (монАТ) против CD3 или CD28 антигенов (как наиболее мощные поликлональные стимуляторы Т-лимфоцитов).
Митоген (pokeweed mitogen) из корня растения лаконоса Phytolacca americana стимулирует пролиферацию и В- и Т-лимфоцитов, а кроме того вызывает поликлональную продукцию иммуноглобулинов В-лимфоцитами. Пролиферацию преимущественно В-лимфоцитов вызывают препараты липополисахаридов (ЛПС) эндотоксинов из грамотрицательных бактерий.
Методы оценки пролиферативной активности лимфоцитов в культуре in vitro рассчитаны на выявление и измерение уникального для клеточного деления процесса - удвоения ДНК в S-фазе митоза.
Методов существует несколько.
1. Исторически первый метод - микроскопический (морфологический). Клетки, прошедшие S-фазу, но еще не прошедшие митоз, имеют двойное количество ДНК и остальных компонентов хромосом. Соответственно вся клетка больше по размеру, чем неделящиеся клетки, что хорошо видно на препаратах мазков или даже в живой культуре под световым микроскопом. Микроскопический метод детекции клеток в S-фазе называют «реакцией бласттрансформации» и в настоящее время используют по крайней мере для демонстрации бластных и других форм лимфоцитов. Помимо поликлональной активации Т- и В-лимфоцитов, достаточно широко используются методы, основанные на стимуляции антиген/аллерген- специфических клонов Т- и В-клеток. Естественно, что в последнем случае число трансформированных клеток может быть мало. Для их подсчета морфологический метод не пригоден.
В лабораторной генетике реакцию бласттрансформации лимфоцитов применяют с целью визуализации хромосом и анализа кариотипа человека. Для остановки клеточного цикла на стадии митоза используют колхицин.
2. Колорометрический метод. Он основан на использовании внутриклеточных прижизненных красителей, включаемых в цепи ДНК. Это, например, MTT - 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил тетразолиум бромид.
3. Микроцитофлуорометрический метод (FACS). Он основан на использовании флюоресцентных красителей, включаемых в цепи ДНК, с оценкой на проточном цитометре.
4. Радиоизотопный метод. Он основан на использовании меченых нуклеотидов, включаемых в состав только ДНК, в частности тимидина (3H-Td) - β-излучатель, уридина 14C-Td - γ-излучатель или 131I-дезоксиуридина - γ-излучатель.
«Золотым стандартом» для оценки пролиферации является последний метод - радиоизотопный, поскольку с его помощью подсчитывают не только клетки, находящиеся в данный момент в S-фазе, но и уже поделившиеся дочерние клетки, которые другие названные методы уже «не видят». Опишем кратко метод оценки пролиферации по включению 3Н-тимидина.
A. Создают экспериментальную систему стимуляции лимфоцитов in vitro: это может быть внесение антигена, митогена или других стимулирующих агентов (цитокины, антитела против поверхностных антигенов и др.). Время культивирования лимфоцитов зависит от стимулятора: для митогенов - обычно 72 ч, для антигена - до 6- 7 сут.
Б. За 4-24 ч до остановки эксперимента in vitro вводят меченый тимидин. Чаще всего используют метил-3Н-тимидин. Удельная радиоактивность препарата - около 1-2 Кю/мкмоль. Если удельная активность коммерческого препарата выше, то его разводят «холодным» (т.е. нерадиоактивным) тимидином до заданной величины, чтобы избежать «тимидинового самоубийства» живых клеток. Готовят матричный раствор тимидина в культуральной среде: как правило, его концентрация составляет 20 мкКю/мл. Если эксперимент проводят in vitro в лунках с объемом 200 мкл, то в каждую лунку вносят по 25 мкл матричного раствора 3Н-тимидина, что создает его рабочую концентрацию 0,5 мкКю на лунку. Количество клеток в лунке при этом, как правило, составляет 1-5×105.
B. По завершении культивирования в присутствии 3Н-тимидина клетки удаляют из лунок прибором харвестером на непроницаемые для клеток микропористые фильтры, геометрически соответствующие формату лунок культуральных плашек. Фильтры промывают от невключившегося в клеточную ДНК 3Н-тимидина, после чего сушат при 60-80 °С под инфракрасной лампой или феном.
Г. Каждый фильтр помещают в индивидуальный флакон с сцинтилляционной жидкостью и в специальном счетчике β-частиц просчитывают число импульсов в минуту (срт) и определяют индекс стимуляции. Его значение и является количественным показателем уровня пролиферации исследуемых клеток. Показатели эксперимен-
тальных лунок сравнивают с контрольными и рассчитывают статистическую достоверность различий.
3.2. ОЦЕНКА КЛЕТОЧНОЙ ЦИТОТОКСИЧНОСТИ
Классический феномен цитотоксичности - способность Т-лимфоцитов распознавать клеточные элементы, несущие признаки генетической чужеродности (в частности, клетки, модифицированные вирусом, опухолевые клетки, аллогенные и ксеногенные клетки), и уничтожать их. NK-клетки, в отличие от Т-лимфоцитов, распознают как чужеродные клетки организма, утратившие антигены главного комплекса гистосовместимости (молекулы МНС). Другие клетки (например, В-лимфоциты, моноцитарно-макрофагальные клетки, эозинофилы, нейтрофилы и т.п.) также способны к цитотоксичности, но эта функция связана с привлечением антител против клеткимишени - КМ (антителозависимая клеточная цитотоксичность), цитокинов (ФНОа) и иных агентов. В физиологических условиях, т.е. в норме, цитотоксичность клеток иммунной системы направлена на разрушение и элиминацию стареющих и поврежденных клеток, таким образом обеспечивая клиренс многоклеточного организма от отживших клеток и продуктов их распада.
Основные клетки, обладающие цитотоксичностью, - антигенспецифические цитотоксические лимфоциты (ЦТЛ), NK (естественные киллеры), а также клетки миелоидного ряда (макрофаги, нейтрофилы).
Цитотоксическая активность клеток-киллеров реализуется при непосредственном синаптическом контакте лимфоцита (клеткиэффектора - КЭ) с КМ. При этом в КМ индуцируется апоптоз.
В зрелом дифференцированном цитотоксическом лимфоците формируются гранулы, содержащие перфорин и гранзимы. После образования синапса между КЭ и КМ гранулы концентрируются в области контакта и затем освобождаются в направлении КМ. Перфорин при контакте с мембраной КМ полимеризуется и встраивается в мембрану, формируя в ней пору диаметром около 100 Ǻ. В эту пору проникают гранзимы - ферменты, инициирующие апоптоз КМ.
Индукция апоптоза в КМ также может происходить через CD95 молекулы (другое название Fas), содержащие домен смерти. Лигандом CD95 служит молекула FasL (CD178), экспрессируемая на ЦТЛ, NK-клетках. В некоторых случаях КЭ сами становятся «жертвой» Fas-опосредованного апоптоза. Экспрессируя Fas-молекулы,
они могут проконтактировать с клетками, несущими Fas-лиганд, например, при потытке преодолеть гематоэнцефалический барьер. Повышенная экспрессия Fas (CD95) молекул на активированных лимфоцитах демонстрирует их способность к апоптозу при несостоявшихся физиологических процессах пролиферации и дифференцировки после активации. Считается, что такой процесс может привести к феномену, обозначенному как иммунодефицит, вызванный активацией (Ковальчук Л.В., Чередеев А.Н.).
В системе in vitro степень разрушения КМ приближается к лизису. Методов оценки функциональной активности ЦТЛ существует несколько, однако «золотым стандартом» до сих пор считается «хромовый тест». Под «хромом» имеют в виду соль хромата натрия, содержащую радиоактивный изотоп хрома - Na251CrO4, которую используют для мечения КМ. Такую метку подобрали опытным путем как относительно удовлетворяющую следующим критериям: свободно проникать в живые клетки и не выходить оттуда, пока клетка жива. Метка не вступает в прочные соединения с внутриклеточными структурами и имеет возможность выйти во внеклеточную среду из погибающей КМ.
Выбор КМ - отдельная творческая задача, которую экспериментально решают в соответствии с целями конкретного исследования. Чаще всего в качестве КМ используют опухолевые или зараженные вирусом клетки. Когда КМ выбраны, дальнейшая схема эксперимента кратко представляет собой следующее.
Лабораторная работа 3-1
1. 1х106 КМ инкубируют в среде, содержащей изотоп Na251CrO4 (37×105 Bq или 100 мкКю, специфическая активность 5 мкКю/моль), при 37 °С в течение 1-1,5 ч, после чего тщательно отмывают от не вошедшего в клетки изотопа.
2. КМ подсчитывают и раскапывают в подобранной дозе в лунки культуральных круглодонных микропланшетов.
3. В те же лунки вносят КЭ. Соотношение КМ и КЭ обычно составляет от 1:10 до 1:500 в пользу КЭ.
4. Плашки подвергают мягкому центрифугированию - 150 g в течение 1 мин, после чего помещают в СО2-инкубатор при 37 °С на 4-6 ч.
5. По завершении культивирования плашки центрифугируют при 250 g в течение 5 мин для плотного осаждения клеток.
6. Супернатанты собирают в специальные пробирки, в которых радиоактивность подсчитывают в γ-счетчике.
7. В качестве контроля используют:
а) лунки с КМ, в которые не вносят КЭ, - это контроль спонтанного выхода метки;
б) лунки с КМ, в которые вместо КЭ вносят детергент Triton X-100 1% (v/v), - это контроль максимально возможного высвобождения метки из КМ.
Цитотоксичность в опытных лунках рассчитывают обычно по следующей формуле:
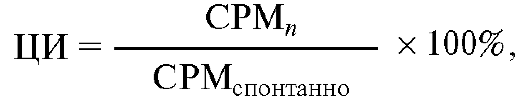 где CPM - это число импульсов в минуту соответственно в экспериментальных лунках (СРМn), в лунках со спонтанным высвобождением метки (СРМспонтанно) и в лунках с максимально возможным высвобождением метки (CPMmax).
где CPM - это число импульсов в минуту соответственно в экспериментальных лунках (СРМn), в лунках со спонтанным высвобождением метки (СРМспонтанно) и в лунках с максимально возможным высвобождением метки (CPMmax).
Оценка цитотоксической активности с использованием проточной цитометрии
Кроме описанного «хромового» теста, существуют методики оценки клеточной цитотоксичности с использованием проточного цитофлуориметра. В данном случае для мечения клеток используют два реагента. Сначала метят КМ флуорохромом, который проникает в клетки, не повреждая их, и флуоресцирует, возбужденный лазерным излучением. Затем к КМ добавляют КЭ, инкубируют их совместно, чтобы дать возможность реализоваться киллерной атаке, и добавляют к смеси второй реагент, превращающийся во флуорохром только в живых клетках под действием их ферментов-эстераз. В результате в итоговой картине КЭ станут светиться одним цветом «живого флуорохрома», живые КМ будут двухцветными, погибшие КМ - одноцветными по первому флуорохрому.
Известен метод оценки антителозависимой клеточной цитотоксичности с использованием в качестве КМ эритроцитов (например, барана), покрытых IgG- антителами к ним. КЭ, несущие Fc-рецепторы к IgG, разрушают (лизируют) КМ, и по уровню освобождаемого в культуральную среду гемоглобина судят об активности таких киллеров (NK, В-клетки, моноциты, макрофаги и др.).
Определение перфорина методом ELISPOT
Белок перфорин является необходимым компонентом лизиса, осуществляемого ЦТЛ и NK-клетками для уничтожения КМ. Метод ELISPOT (см. гл. 4) широко применяется для определения выработки цитокинов антигенспецифическими Т-клетками. Метод ELISPOT достаточно чувствителен для выявления перфорина после активации ЦТЛ соответствующими антигенными эпитопами, например вирусными (потенциально годен для использования любой эпитоп). При выполнении данного метода на дне лунки пластикового планшета фиксируются монАТ к перфорину. Недостаток метода - отсутствие возможности определить фенотип клеток, секретирующей перфорин, что частично компенсируется обогащением фракции ЦТЛ магнитной сепарацией. В экспериментах с использованием иммуномагнитной сепарации показано: основную популяцию клеток, образующих «пятна», составляют CD8+
Т-лимфоциты (80-90%).
Связывание с тетрамерными структурами MHC класса I
Конструирование тетрамерных комплексов MHC класса I обеспечило создание быстрого, специфичного и высокочувствительного метода выявления и подсчета антигенспецифических CD8+ Т-клеток с помощью проточной цитофлуориметрии. Тетрамер состоит из молекул MHC класса I, нагруженных специфическим антигенным пептидом, связанных с биотином, которые затем прикрепляются к стрептавидину, меченному флуорохромом - ФИТЦ, ФЭ и др. (рис. 3.1, см. также цв. вклейку). Тетрамеры MHC класса I связываются с CD8+ субпопуляцией Т-лимфоцитов. Созданы тетрамеры MHC класса II, связывающиеся с CD4+ Т-лимфоцитами. Тетрамерные структуры характеризуются сниженной способностью связывания с молекулой CD8. Однако сохраняют способность специфически связываться с TКР, обеспечивая точное узнавание антигенспецифических Т-клеток. Количество выявляемых данным методом антигенспецифических клеток составляет менее 1% от всех CD8+-клеток.
Отдельное использование тетрамерного связывания не дает информации о фенотипе клеток или функции ЦТЛ, поэтому целесообразно параллельно проводить определение внутриклеточного содержания цитокинов, хемокинов и цитотоксических эффекторных молекул (перфорина, гранзимов), фенотипа специфических CD8+ Т-лимфоцитов.
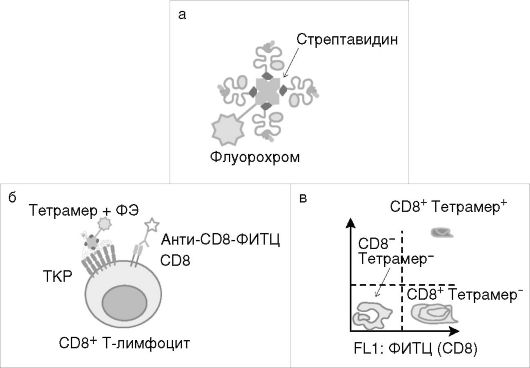 Рис. 3.1. Тетрамерные
структуры: а - строение тетрамерной структуры; б - связывание тетрамера
ЦТЛ; в - пример результатов, полученных при анализе тетрамерных
структур на проточном цитофлуориметре; ФИТЦ -
флуоресцеин-5-изотиоционат; ФЭ - фикоэритрин
Рис. 3.1. Тетрамерные
структуры: а - строение тетрамерной структуры; б - связывание тетрамера
ЦТЛ; в - пример результатов, полученных при анализе тетрамерных
структур на проточном цитофлуориметре; ФИТЦ -
флуоресцеин-5-изотиоционат; ФЭ - фикоэритрин
Использование методов цитофлуориметрического определения цитотоксической активности в комбинации с тетрамерным методом и иммунофенотипированием позволяет полно охарактеризовать популяции КЭ (ЦТЛ) и КМ. Данные методы - мощный инструмент для изучения кинетики киллерной активности ЦТЛ, они дают представление о фенотипе клеток и позволяют отслеживать физиологические изменения в КЭ и КМ
Определение каспаз методом проточной цитофлуорометрии
В результате запуска апоптоза, опосредованного перфорин/гран- зимовым и Fas/FasL механизмами, в КМ активируются каспазы. Данным методом определяют внутриклеточную активацию каспаз в КМ, используя белки, содержащие меченные флуорофором участки, подверженные расщеплению каспазами. Нерасщепленный флуорофор образует «молчащий» димер, после расщепления каспазами мономеры флуоресцируют.
Определение цитотоксической активности NK-клеток
NK составляют около 10-15% лимфоцитов периферической крови человека. NK - клетки врожденного иммунитета, в них не происходит перегруппировки генов I-клеточного рецептора (ТКР), кодирующих антигенраспознающие рецепторы. Функция NK - распознавание и уничтожение в организме клеток, пораженных вирусом, опухолевых клеток, лишенных МНС хозяина. NK проявляют функциональную активность без предварительной сенсибилизации и обладают так называемой естественной цитотоксичностью. Кроме того, NK способны уничтожать КМ, покрытые IgG антителами, вовлекая рецептор для IgG - FcγRIII (CD16). Такой тип цитотоксичности получил название антителозависимой клеточной цитотоксичности.
Функциональная активность NK оценивается по способности убивать КМ (например, клетки эритромиелоидной линии К562 человека, меченные радиоактивными изотопами 51Cr или 3Н-уридином).
Лабораторная работа 3-2
КМ К-562 метят изотопом 3Н-уридином (1 мкКи/мл) и инкубируют 1 ч при 37 °С. Затем клетки трижды отмывают культуральной средой, содержащей 10% СЭК. Отмытые КМ выдерживают в культуральной среде 2 ч при 37 °С и отмывают еще раз с целью удаления 3Н-уридина, не включившегося в РНК КМ. Готовят рабочую суспензию меченых КМ с таким расчетом, чтобы в 1 мл содержалось 1×106 КМ и 5 мкг панкреатической РНК-азы.
Цитотоксическую реакцию проводят в круглодонных 96-луночных микропланшетах. В каждую ячейку помещают по 100 мкл рабочей суспензии меченых КМ с РНК-азой и 100 мкл суспензии мононуклеарных клеток (рабочая концентрация - 1х107/мл). Используют различные соотношения КЭ:КМ - 100:1; 50:1; 25:1; 12,5:1. Клетки каждого разведения помещают как минимум в 3 лунки. В контрольных пробах меченые КМ инкубируют без мононуклеарных клеток.
Культуры инкубируют 14 ч при 37 °С и с 5% содержанием СО2. После инкубации содержимое лунок переносят на фильтры с помощью собирателя клеток - харвестра. Фильтры высушивают, помещают в сцинтилляционную жидкость, проводят учет реакции с помощью β-счетчика. Показатель функциональной активности естественных киллеров выражают в виде индекса цитотоксичности (ИЦ), который определяют по формуле:
 Оценка функциональной активности NK-клеток с использованием проточной цитометрии
Оценка функциональной активности NK-клеток с использованием проточной цитометрии
В качестве метки для КМ применяют флуоресцентный краситель 5-, 6-карбоксифлуоресцеин диацетатсукцинилмидиловый эфир (КФДЭ), который образует прочную ковалентную связь с внутриклеточными белками и в используемой концентрации не влияет на жизнеспособность клетки.
Первоначально нефлуоресцирующий КФДЭ проникает через клеточную мембрану. Карбоксифлуоресцеины связываются с внутриклеточными молекулами, формируя конъюгаты, обеспечивая стойкое флуоресцентное окрашивание клетки. Окрашенные таким образом КМ К-562 смешивают с КЭ и инкубируют в течение нескольких часов. После окончания культивирования клетки окрашивают пропидий йодидом для определения убитых в ходе реакции КМ. По количеству убитых К-562 определяют активность NK-клеток. Анализ проводят на проточном цитофлуориметре и определяют количество КМ, включивших КФДЭ (зеленое свечение), и количество убитых клеток, включивших пропидий йодид (красное свечение).
Антителозависимая клеточно-опосредованная цитотоксичность
In vivo случается чаще всего в патологических условиях и направлена на безъядерные клетки - эритроциты и тромбоциты, реже на ядросодержащие клетки крови, например нейтрофилы. Проявляются эти процессы в форме гемолитических анемий, тромбоцитопений, нейтропений. Этиология, как правило, либо инфекционная, либо лекарственная.
Комплементзависимая цитотоксичность
Микролимфоцитотоксический тест. Этот вариант иммунной цитотоксичности используют в качестве лабораторного теста в трансплантологии для оценки возможного наличия в крови реципиента антител к клеточным антигенам предполагаемого донора.
Тест проводят следующим образом.
1. У реципиента берут периферическую кровь, получают сыворотку и раскапывают, например, двукратные разведения этой сыворотки в лунки планшета.
2. У донора берут периферическую кровь, выделяют из нее лейкоциты или фракцию мононуклеаров (что лучше) и аликвоты клеток, например по 2×105 на лунку, раскапывают в лунки с разведениями сыворотки реципиента.
3. Планшеты инкубируют в СО2-инкубаторе при 37 °С в течение 45-60 мин.
4. Затем в лунки добавляют комплемент (заранее оттитрованную сыворотку кролика или морской свинки).
5. Продолжают инкубацию еще 30-45 мин.
6. Поврежденные клетки выявляют по включению суправитального красителя - трипанового синего, для чего из каждой лунки берут аликвоту клеток, добавляют к этой аликвоте 0,5% раствор трипанового синего и в камере Горяева подсчитывают число прокрашенных (поврежденных) и непрокрашенных (живых) клеток.
В случае если процент поврежденных клеток достоверно превышает таковой в контроле (т.е. в лунках, в которые не вносили сыворотку реципиента), то данный донор получает отвод.
После внедрения в клиническую практику трансплантологии этого теста трансплантологи значительно реже сталкиваются со случаями сверхострого отторжения трансплантатов.
В другом варианте микролимфоцитотоксический тест применяют для серологического типирования HLA специфичностей. Основные этапы теста указаны на рис. 3.2 (см. также цв. вклейку). В качестве КМ используют выделенные из крови пациента мононуклеарные клетки серотипирования HLA специфичностей класса I или очищенную фракцию В-клеток, например на колонке со стеклянной ватой, для тестирования специфичностей HLA класса II. Клетки инкубируют с панелью стандартных типирующих сывороток и после добавлениия комплемента определяют количество убитых и выживших клеток.
 Рис. 3.2. Микролимфоцитотоксический тест (серотипирование HLA класса I)
Рис. 3.2. Микролимфоцитотоксический тест (серотипирование HLA класса I)
3.3. ОЦЕНКА ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ
ФАГОЦИТОВ
Фагоцитарные клетки - основная группа клеток системы врожденного иммунитета. Они имеют миелоидное происхождение и обладают способностью к фагоцитозу. По морфологии и функции их разделяют на мононуклеарные клетки (моноциты/макрофаги) и нейтрофилы, что соответствует предложенному И.И. Мечниковым разделению на макро- и микрофаги. Роль фагоцитов в иммунном ответе крайне многообразна. Они выполняют ряд ключевых функций как во врожденном, так и в адаптивном иммунитете. Активация фагоцитов запускается через многие поверхностные рецепторы. Ведущая роль в активации фагоцитов отводится паттернраспознающим рецепторам врожденного иммунитета, таким, как Toll-подобные рецепторы, NOD-рецепторы, манозные рецепторы, рецепторы-«мусорщики», рецепторы комплемента и многие другие. Ответная реакция развивается быстро, не требует пролиферации и дифференцировки клеток.
Процесс активации обычно подразделяется на два этапа: прайминг и собственно активация. Суть прайминга заключается в том,
что предварительная обработка клеток небольшим количеством стимулятора (1-й сигнал), действие которого не вызывает прямую активацию, сопровождается увеличением ответа фагоцитов на второй сигнал. В результате активированные фагоциты выполняют следующие функции:
• выработка активных форм кислорода (АФК);
• генерация окиси азота;
• хемотаксис;
• фагоцитоз;
• синтез и секреция цитокинов и других биологически активных медиаторных молекул (метаболитов арахидоновой кислоты, компонентов комплемента, факторов свертывания крови, белков матрикса, ферментов, противомикробных пептидов, гормонов и др.);
• бактерицидная активность;
• процессинг и презентация антигена («профессиональными» антигенпредставляющими клетками: дендритными, мононуклеарными фагоцитами).
Лабораторная работа 3-3
Определение фагоцитарной активности нейтрофилов и макрофагов
1. Для получения нейтрофилов мышам вводят внутрибрюшинно 3-4 мл 2-3% раствора пептона и через 2 ч животных умерщвляют с помощью хлороформа. Их вскрывают в асептических условиях. Из брюшной полости с помощью шприца или пастеровской пипетки отсасывают жидкость, переносят ее в силиконизированные центрифужные пробирки.
2. После центрифугирования пробирок в течение 10 мин при 1000 об/мин осадок ресуспендируют в среде 199, подсчитывают число клеток в камере Горяева и доводят до концентрации 1-2х106/мл.
3. К клеткам добавляют равный объем бактерий (чаще всего Staphylococcus aureus, не содержащий белка А) или опсонизированного зимозана в соотношении 1:10 и инкубируют при 37 °С в течение 30 мин.
4. Бактерии предварительно должны быть опсонизированы мышиной сывороткой. Опсонизацию проводят в течение 10 мин при температуре 37 °С с последующим отмыванием.
5. После инкубации готовят мазок на предметном стекле, фиксируют его метанолом 20 мин и красят краской Романовского-Гимзы в течение 30-40 мин.
6. Учет результатов осуществляется микроскопически. В мазке при увеличении х90 с иммерсионной системой подсчитывают фагоцитарный индекс (процент фагоцитирующих нейтрофилов) и фагоцитарное число (количество поглощенных бактерии на 1 нейтрофил).
Для изучения фагоцитарной активности макрофагов на 3-4-е сутки после введения раствора пептона мышей умерщвляют (в соответствии с современными нормами биоэтики), вскрывают в асептических условиях и вводят внутрибрюшинно 5-8 мл среды 199, содержащей 10% сыворотки эмбриона коровы. После легкого массажа брюшной полости жидкость отсасывают. Полость можно промывать средой 199 несколько раз, объединяя в одну все полученные порции. Далее исследование ведется так же, как опыты с нейтрофилами (рис. 3.3, см. также цв. вклейку).
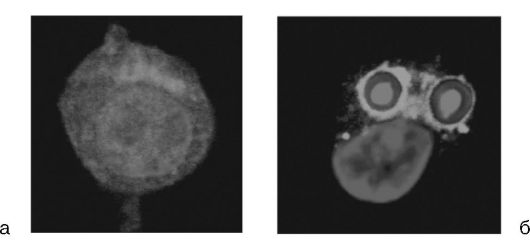 Рис. 3.3. Фагоцитоз
зимозана макрофагом (конфокальная микроскопия и лазерная сканирующая
конфокальная микроскопия): а - интактный макрофаг; б - макрофаг,
захвативший зимозан (красный)
Рис. 3.3. Фагоцитоз
зимозана макрофагом (конфокальная микроскопия и лазерная сканирующая
конфокальная микроскопия): а - интактный макрофаг; б - макрофаг,
захвативший зимозан (красный)
Лабораторная работа 3-4
Оценка фагоцитарной активности лейкоцитов человека
Последовательность выполнения операций:
• кровь из пальца (или из венозной крови до контакта с антикоагулянтом) в количестве 0,1 мл помещают на тщательно вымытое обезжиренное покровное стекло;
• покровное стекло выдерживают во влажной камере при 37 °С 45 мин, после чего образовавшийся сгусток осторожно удаляют пинцетом;
• покровное стекло с прикрепленными нейтрофилами промывают в растворе Хенкса;
• на покровное стекло наносят фагоцитируемую взвесь и снова выдерживают во влажной камере (клетками вверх) при 37 °С в течение 30 мин (в качестве объекта фагоцитоза могут быть использованы частицы латекса, опсонизированный зимозан, S. aureus). На покровное стекло осторожно наносят 0,2 мл суточной культуры лабораторного штамма S. aureus в концентрации 108 бактерий на 1 мл;
• после инкубации в течение 60 мин стекло промывают в растворе Хенкса для удаления непоглощенных частиц и высушивают;
• высушенный препарат фиксируют 5 мин в метаноле. Окрашивают гематоксилином Караччи (4 мин) с докраской эозином (30 с);
• после проведения через гистологическую батарею спирт-ксилол препарат заключают в канадский бальзам;
• учет фагоцитарной активности осуществляют, определяя процент нейтрофилов с фагоцитированным материалом (фагоцитарное число) и количество поглощенных частиц из расчета на один нейтрофил (фагоцитарный индекс). На каждом стекле для этой цели исследуют не менее 200 клеток.
Метод оценки хемотаксиса нейтрофилов с использованием камеры Бойдена
Наиболее широко применяется для оценки хемотаксической активности нейтрофилов метод с использованием камеры Бойдена.
Основная идея, заложенная в конструкцию камеры, заключается в разделении пористым фильтром в растворе двух реагирующих компонентов: лейкоцитов и факторов, обладающих хемотаксической активностью. В зависимости от исследуемых популяций клеток диаметр пор фильтров составляет от 3 до 8 мкм. Факторы с хемотаксической активностью помещаются в нижнюю камеру и довольно быстро создают концентрационный градиент, распространяющийся через толщу фильтра. Помещенные в верхнюю камеру лейкоциты начинают активную миграцию вдоль градиента и собираются на нижней поверхности фильтра, где можно подсчитать их количество.
Подсчет клеток на нижней поверхности фильтра проводится микроскопически; выявляется число клеток, видимых в одном поле при большом увеличении.
Более надежен радиометрический метод оценки миграционной активности лейкоцитов, когда используются лейкоциты, меченные изотопами 51Сг или 90Тс. После постановки реакции измеряют радиоактивность фильтров. Однако такой метод требует дополнительного оборудования.
Одна из модификаций метода основана на применении двойного фильтра. Суть ее в следующем. Ниже обычного фильтра помещают целлюлозонитратный фильтр. В результате миграции клетки, прошедшие через верхний пористый фильтр, падают на целлюлозонитратную мембрану. Трудности учета падающих с нижней поверхности фильтров клетки успешно преодолеваются путем использования одиночных поликарбонатных фильтров.
В качестве фильтров апробированы самые разнообразные материалы, включая целлюлозонитраты, целлюлозные эфиры и поликарбонаты. Впервые поликарбонаты использовались для изучения хемотаксиса клеток перитонеального экссудата у морских свинок, а затем были предложены для измерения хемотаксиса моноцитов крови человека. С тех пор фильтры из этого материала получили широкое распространение при постановке реакций по оценке хемотаксической активности моноцитов крови человека. Преимущество поликарбонатных фильтров состоит прежде всего в одинаковом размере пор. Кроме того, при использовании таких фильтров значительно облегчается подсчет клеточных элементов, поскольку у мигрирующих клеток не наблюдается изменений морфологических характеристик, что отнюдь не редкость при применении фильтров из других материалов.
Особенности постановки методов оценки хемотаксиса in vitro
Хотя метод довольно прост, необходимо остановиться на некоторых технических особенностях, способных существенным образом повлиять на миграционную активность и количество клеток, помещаемых в камеру.
Так как хемотаксис связан с высокой метаболической активностью клеток, необходимо соблюдать определенный температурный режим. Максимальный хемотаксис наблюдается при 37 °С. В интервале тем-
пературы от 33 до 43 °С значительных различий результатов миграции не наблюдается. Однако при экспериментальной гипотермии у свинок при температуре 29 °С отмечено снижение миграционной активности моноцитов.
Состав среды, используемой при постановке метода, не требует каких-либо специальных добавок за исключением небольшого количества белка, облегчающего миграцию клеток. Наиболее оптимальный рН среды - 7,0, хотя в некоторых случаях предпочтение отдается некоторому смещению рН в кислую сторону, что обычно характерно для воспалительной реакции in vivo. Как указывалось выше, моноциты, проходящие сквозь фильтры, могут попадать в раствор нижней камеры, и поэтому их не учитывают. Важное значение имеет время проведения реакции. При использовании поликарбонатных фильтров оптимальные сроки инкубации клеток при 37 °С - 90 мин.
Следует избегать добавления в систему нативных сывороток. Например, сыворотка человека порой содержит факторы как способствующие хемотаксу, так и его ингибирующие.
Важна также криоконсервация выделенных моноцитов. В отличие от всех других функций клеток хемотаксис у размороженных моноцитов снижен. Присутствие лимфоцитов в клеточной суспензии, загружаемой в камеру, обычно не влияет на хемотаксис моноцитов.
При соблюдении стандартных условий постановки реакции техническая вариабельность результатов составляет около 20%, что вполне допустимо. Воспроизводимость метода весьма высокая. Рекомендуется подсчитывать при микроскопии как минимум 10 случайных полей миграции на 2 идентичных фильтрах. Если перед помещением на фильтры камеры моноциты были хорошо суспендированы, разбросы подсчета клеток в отдельных полях зрения под микроскопом невелики и связаны обычно только с ошибками при самом подсчете.
В следующем разделе мы уделяем внимание ряду методических приемов оценки активности фагоцитарных клеток в генерации многочисленных медиаторных молекул (в первую очередь цитокинов и активных форм кислорода и азота). Все эти факторы врожденного иммунитета крайне важны для нормального функционирования иммунной системы, а особенно - для выявления патологических состояний, характеризующихся сниженной или повышенной выработкой подобных медиаторов.
Лабораторная работа 3-5
Получение супернатанта, содержащего цитокины и другие биологически активные молекулы из моноцитов периферической крови человека
1. Мононуклеарные клетки (МНК) выделяют из периферической крови путем центрифугирования в градиенте плотности фиколлверографина. Затем клетки ресуспендируют в среде RРМI 1640, содержащей 2-меркаптоэтанол (5×10-5 М), с конечной концентрацией 1 х106 клеток в 1 мл.
2. В каждую лунку 24-луночного планшета помещают 1 мл клеточной взвеси МНК и инкубируют в течение 60 мин при 37 °С для получения фракции прилипающих моноцитов. Надосадочную жидкость, содержащую лимфоциты, удаляют.
3. В опытные лунки с прилипшими моноцитами добавляют ЛПС (E. coli), растворенный в RРМI 1640 до конечной концентрации 10 мкг/мл, а в контрольные лунки - равный объем среды RРМI
1640.
4. Через 24 ч культивирования при 37 °С в атмосфере 5% СО2 проводят центрифугирование при 400 g в течение 8 мин при комнатной температуре; надосадочную жидкость, содержащую цитокины, собирают, стерилизуют фильтрованием (0,2 мкм) и хранят при -20 °С.
5. Супернатант, полученный таким способом, можно использовать для определения концентрации различных цитокинов (провоспалительных, противовоспалительных, колониестимулирующих факторов (КСФ) и др.), секретируемых МНК. Оценку цитокинов проводят методами биологического тестирования (см. гл. 7) или ИФА (см. гл. 4). Кроме того, можно определять содержание оксида азота, противомикробных пептидов и других биологически активных молекул.
Определение выработки активных форм кислорода и оксида азота
Исключительно важную роль как в процессах активации фагоцитов, так и в реализации их кислородзависимой бактерицидной функции играют активные формы кислорода (АФК) и оксида азота, образующиеся в процессе кислородного или дыхательного взрыва.
В основе дыхательного взрыва лежит усиление потребления глюкозы и ее расщепление с участием NADPH+ (по механизму гексозомонофосфатного шунта), сопровождающиеся накоплением NADPH. Взаимодействие NADPH с молекулой кислорода при участии NADPH-оксидазы приводит к генерации супероксид аниона (О2-), из которого с участием ионов водорода образуются потенциально токсичные для бактерий гидроксильные радикалы (ОН), перекись водорода (Н2О2) и синглетный кислород (1О2). Этот процесс начинается спонтанно, после образования фагосомы и перед ее слиянием с лизосомой. Наиболее выраженный бактерицидный эффект реализуется в фаголизосомах. Образование Н2О2 происходит спонтанно и при участии супероксиддисмутазы. Фермент миелопероксидаза обеспечивает образование гипохлорида из Н2О2 с участием ионов галогенов. Оксид азота (NO) образуется в результате расщепления аргинина до цитруллина и катализируется NO-синтазой (рис. 3.4).
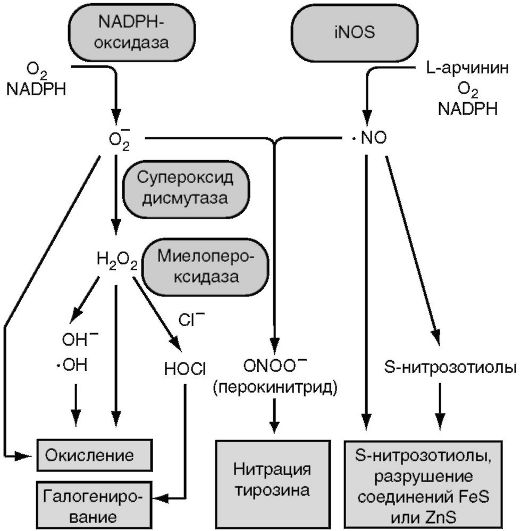 Рис. 3.4. Схема выработки бактерицидных субстанций фагоцитов (активных форм кислорода и оксида азота)
Рис. 3.4. Схема выработки бактерицидных субстанций фагоцитов (активных форм кислорода и оксида азота)
Продукцию АФК фагоцитарными клетками определяют методом хемилюминесценции (ХЛ). Как известно, ХЛ-сверхслабое свечение усиливается люминофорами: люминолом и люцигенином. Люминол позволяет идентифицировать образование перекиси водорода и гипохлорной кислоты, люцигенин - супероксидного радикала. При взаимодействии с АФК люминофоры переходят в возбужденное состояние и при возвращении в исходное испускают квант света, который регистрируется хемилюминометром. Имеются данные о корреляции между выработкой АФК и киллингом бактерий фагоцитами.
Описание метода люминолзависимой хемилюминесценции
В качестве объекта исследования можно использовать суспензию лейкоцитов, мононуклеарных клеток или макрофагов перитонеального экссудата экспериментальных животных. Оптимальное количество клеток для регистрации люминолзависимой ХЛ подобрано экспериментально и составляет 1 млн/мл макрофагов и мононуклеарных клеток крови и 2×105/мл лейкоцитов. Для регистрации хемилюминесценции в термостатируемую кювету хемилюминометра ХЛМ-3 помещают: 1 млн клеток; 2,8 мл раствора Хенкса; 2×10-5 М люминола («Serva», Германия). Через 3-5 мин регистрируют спонтанную ХЛ. Затем в кювету добавляют 1,43 мкг/мл опсонизированного сывороткой крови человека зимозана («Sigma», США) и регистрируют индуцированную ХЛ.
Затем оценивают интенсивность ХЛ в милливольтах (или в относительных единицах). Спонтанная ХЛ показывает уровень выработки АФК клетками в организме. Индуцированная различными стимуляторами ХЛ отражает потенциальную, резервную способность клеток отвечать на стимул. Снижение индуцированной ХЛ может служить одним из признаков нарушения бактерицидной функции фагоцитов. Это демонстрируют результаты кинетики ХЛ-ответа нейтрофилов у больных с генитальным герпесом (рис. 3.5).
Так, у больных с генитальным герпесом спонтанная выработка АФК выше, чем у здоровых доноров. Действие опсонизированного зимозана не стимулирует выработку АФК, она остается на уровне спонтанной выработки и значительно ниже показателей таковой у здоровых доноров, что свидетельствует о снижении противовирусного действия нейтрофилов при генитальном герпесе.
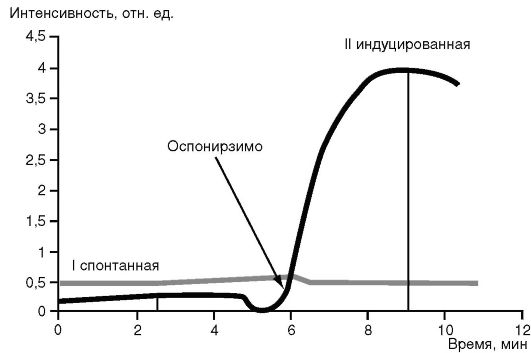 Рис. 3.5. Кинетика ХЛ-ответа нейтрофилов здоровых доноров (черная кривая) и больных с генитальным герпесом (зеленая кривая)
Рис. 3.5. Кинетика ХЛ-ответа нейтрофилов здоровых доноров (черная кривая) и больных с генитальным герпесом (зеленая кривая)
Определение содержания NO в супернатантах культуры фагоцитов in vitro
Оксид азота (NO) участвует во многих физиологических и патологических процессах на уровне как клеток, так и организма в целом, выполняя защитное, регуляторное и повреждающее действия.
Регуляторное действие NO проявляется в поддержании тонуса и проницаемости сосудов, в подавлении адгезии тромбоцитов, в модуляции клеточной адгезии, нейротрансмиссии и бронходилатации, а также некоторых функций почек и иммунной системы.
Повреждающее действие оксида азота реализуется через ингибирование ферментативных функций, индукцию процессов перекисного окисления липидов и повреждения ДНК клетки, повышение чувствительности клетки к воздействию радиации, алкилирующих агентов и токсических металлов, а также через истощение антиокислительных возможностей клетки. Непрямое цитотоксическое действие N0 осуществляется за счет модуляции цитокинового равновесия и опосредованной (через ИЛ-12) активации NK-клеток и цитотоксических лимфоцитов. Сам по себе NO не является мощным
цитотоксическим агентом, но может усиливать чувствительность клеток к действию других цитотоксических агентов. Наиболее выраженной антимикробной активностью обладают соединения, образовавшиеся при взаимодействии АФК и NО в случае их совместной генерации. В результате взаимодействия NO с АФК и с некоторыми другими соединениями образуются цитотоксические агенты, в том числе пероксинитрит (ONOO), S-нитрозотиолы (RSNO), нитрогендиоксид (МЭ2), динитрогентриоксид (N2O3), динитроген-тетраоксид (N2O4) и железодинитрозильные комплексы (DNIC). Однако NО может снижать эффективность окислительного взрыва за счет формирования железонитрильных комплексов, что уменьшает способность железа катализировать прооксидантные реакции.
Эффекты NO принято разделять на основные и опосредованные. Основные включают те реакции, в которых он непосредственно взаимодействует со специфическими биологическими молекулами, например с гуанилатциклазой, цитохромом Р450 и др. Опосредованные эффекты связаны не с самим NO, а с реактивными формами азота, образующимися при взаимодействии NO с кислородом или с супероксидным анионом-радикалом.
Основные эффекты NO имеют место при низких концентрациях NO (менее 1 мкM), тогда как побочные (включая образование радикалов) становятся возможными при более высоких концентрациях NO (более 1мкМ).
Оксид азота in vivo образуется с участием NO-синтазы (NOS), которая у млекопитающих существует в трех изоформах: nNOS - нейтральная (тип 1); iNOS - индуцибельная (тип 2); ecNO-синтаза - эндотелиальная (тип 3).
В макрофагальных клетках функционирует iNOS, экспрессию которой стимулируют некоторые цитокины и микробные продукты, часто действующие в синергизме. NOS типов 1 и 3 называют также cNOS - избирательная, которая присутствует в клетках и может быть активирована притоком кальция с последующим его связыванием с кальмодулином. В присутствии iNOS оксид азота вырабатывается в больших количествах и часто дает побочные эффекты, такие, как перекисное окисление липидов и гидроксилирование, образование нитрозаминов и нитротирозина.
Активированный на цитохроме р450 кислород включается в реакцию образования NW-OH-L-аргинина и является участником одного из наиболее важных этапов в зависимой от NOS-реакции -
окислении гуанидинового азота. Затем гидроксилированная форма L-аргинина при участии супероксидных анион-радикалов и гема превращается в L-цитруллин с одновременным образованием NO.
Для оценки продукции NO перитонеальными макрофагами животных или моноцитами периферической крови человека определяют содержание нитрит-аниона (NO2-) в супернатанте культивируемых клеток (см. Лабораторную работу 3-5) спектрофотометрическим методом с использованием реактива Грисса. Для этого 150 мкл культуральной среды переносят из лунки планшета в пробирку и добавляют последовательно 75 мкл 1,5% раствора сульфаниламида и 1N HCl и 75 мкл 0,15% раствора нафтилэтилендиамминдихлорида в дистиллированной воде (компоненты реактива Грисса). Затем доводят объем раствора до 1 мл. После инкубации в течение 10 мин анализируют оптическую плотность раствора на спектрофотометре (например, на СФ-46) при 540 нм, используя в качестве контроля полную среду культивирования с добавлением раствора Грисса. Продукцию NO выражают в микромолях при помощи калибровочного графика.
Оценка киллинга фагоцитов
Наиболее надежный метод оценки завершенности фагоцитоза - микробиологический, заключающийся в измерении числа бактерий, выживших в лейкоцитах после фагоцитоза.
Принцип метода. Для постановки метода готовят взвесь лейкоцитов и опсонизированных микроорганизмов в соответствующих соотношениях. Через определенные промежутки времени лейкоциты разрушают, делают посевы на питательный агар и через сутки подсчитывают число выросших колоний. Лейкоциты здоровых доноров убивают до 80% бактерий за 20-30 мин (Czuprynski, 1983).
Определение активности миелопероксидазы в лейкоцитах периферической крови
Миелопероксидаза - один из ключевых ферментов фагоцитов, определяющих бактерицидность этих клеток. Сущность метода заключается в добавлении к лизату клеток периферической крови субстрата фермента ортофенилендиамина и перекиси водорода. Развившаяся цветная реакция оценивается по изменению оптической плотности при 492 нм на фотометре.
Снижение уровня миелопероксидазы коррелирует с уменьшением бактерицидности нейтрофилов в отношении стафиллококков.
Особенно снижен уровень этого фермента при хроническом лимфогранулематозе.
Количественная оценка антителообразующих клеток (метод Йерне)
Метод идентификации отдельных антителообразующих (АОК), разработанный и предложенный в 1963 г. Нобелевским лауреатом Н. Йерне и А. Нордином, дает возможность анализировать популяции лимфоидных клеток с точным учетом абсолютного числа АОК. Несмотря на то что прошло более 45 лет со дня сообщения о новом методе, он до сих пор используется при иммунологических исследованиях. Появились новые, получающие все большее распространение способы оценки АОК, но метод Н. Йерне, или, как его еще называют, метод локального гемолиза, или бляшкообразования в агаре, благодаря своей информативности и доступности остается в практике экспериментальной иммунологии, в частности при изучении действия различных факторов (физических, фармацевтических, токсических и др.) на антителообразование у экспериментальных животных. Доступен метод и для иммунологического практикума.
Основной принцип метода локального гемолиза состоит в том, что определенное число клеток лимфоидных тканей (селезенка, лимфатические узлы) мышей, иммунизированных эритроцитами барана, смешивают in vitro с эритроцитами барана и расплавленным, но не влияющим на жизнеспособность клеток агаром. Смесь помещают на чашку Петри и после инкубации при 37 °С в присутствии комплемента визуально подсчитывают число зон гемолиза («бляшек») в агаровой пластинке. В центре каждой «бляшки» находится АОК, представляющая собой плазматическую или лимфобластную клетку. Зная взятое для посева на агар число лимфоидных клеток, можно высчитать количество АОК на фиксированное число кариоцитов (например, на 1 млн или 10 млн) или на целый орган (селезенка).
Прямой способ (принцип описан выше) выявляет АОК, продуцирующие IgM антитела, лизирующие эритроциты в присутствии комплемента.
С помощью непрямого способа (рис. 3.6, см. также цв. вклейку) представляется возможность выявить АОК, продуцирующие IgG антитела (АТ). Для этих целей суспензию клеток дополнительно обрабатывают кроличьей антисывороткой, содержащей АТ против IgG мышей, на пике выработки IgM-АТ. Антисыворотка, содержа-
щая IgM-АТ против IgG мышей, взаимодействует in vitro в агаре с IgG-АТ против эритроцитов барана с присоединением комплемента. Этот комплекс способен лизировать эритроциты. Таким образом, при непрямом методе выявляется сумма АОК, продуцирующих IgM и IgG антитела.
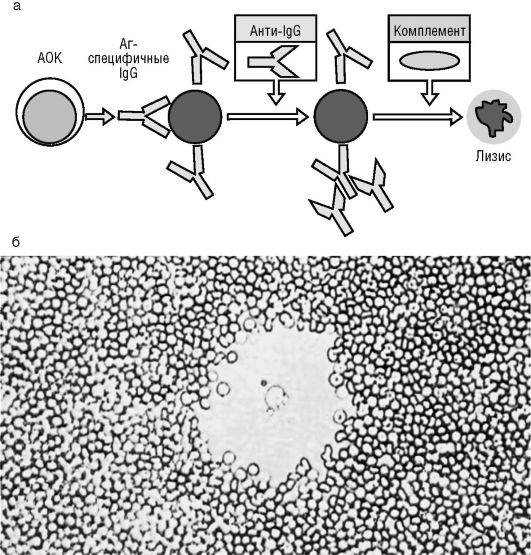 Рис. 3.6. Непрямой метод Йерне: а - схема постановки метода; б - зона гемолиза, в центре АОК
Рис. 3.6. Непрямой метод Йерне: а - схема постановки метода; б - зона гемолиза, в центре АОК
Использование эритроцитов барана, конъюгированных с растворимыми антигенами, дает возможность изучить динамику образования АОК к некорпускулярным антигенам. Метод локального гемолиза в модификации может быть применен для анализа АОК у разных видов животных, а также у человека.
Впервые метод Н. Йерне позволил выявить количественные закономерности динамики антителообразования при первичной и вторичной иммунизации животных. Перечислим указанные закономерности.
1. При первичной иммунизации мышей эритроцитами барана вначале возрастает число АОК, продуцирующих IgM-АТ (пик образования АОК в среднем у мышей - 4-5 сут), а затем, через 1-2 дня, увеличивается число АОК, продуцирующих IgG-АТ.
2. При вторичной иммунизации иммунный ответ осуществляется преимущественно за счет АОК, вырабатывающих IgG.
3. После иммунизации число АОК возрастает за несколько дней до 50-500 млн клеток. Накопление АОК в лимфоидной ткани предшествует выявлению циркулирующих в крови АТ.
4. В небольшом количестве (1 на 10 млн кариоцитов) АОК предсуществуют в лимфоидных тканях (фоновые АОК).
5. Нарастание числа АОК после иммунизации происходит постепенно, по кривой, близкой к экспоненциальной, т.е. в результате размножения изначально небольшого числа клеток-предшественников.
6. АОК после иммунизации выявляются в основном в селезенке, лимфатических узлах, в костном мозгу и отсутствуют в других тканях (печень, легкие, почки, мозг).
Постановка реакции выявления АОК (метод Н. Йерне)
Предварительная подготовка занятия (для группы из 10-12 человек)
1. Иммунизация мышей эритроцитами барана. Мышей (4 особи) иммунизируют внутривенно 0,5 мл 2% суспензии отмытых эритроцитов барана за 4-5 дней до опыта.
2. Приготовление агара (1,4% раствор). 7 г сухого агара Дифко помещают в колбу с 500 мл дистиллированной воды и расплавляют на водяной бане, постоянно помешивая. Жидкий агар разливают в лотки. После того как агар застынет, его разрезают на кубики 1x1 см, которые завертывают в марлю и промывают проточной водой в течение 5-7 дней.
3. Перед занятием (перед опытом) готовят 0,7% раствор агара. Для этого 10 мл предварительно расплавленного агара (1,4%) смешивают с 8 мл дистиллированной воды и добавляют 2 мл 10-кратного раствора Хэнкса и 2 капли 7,5% раствора бикарбоната натрия (рН 7,0-7,2). Получают 8-10 чашек агара.
4. Агар разливают по пробиркам по 2 мл и хранят в водяной бане при 45 °С (за час до опыта).
5. Чашки Петри помещают в сушильный шкаф (80-90 °С).
6. Готовят 10% взвесь эритроцитов барана (предварительно отмыв их 3 раза физиологическим раствором).
Непосредственная постановка реакции
1. Забивают мышей и фиксируют их на столике.
2. Выделяют селезенку.
3. Готовят суспензию клеток в 3 мл среды 199 и подсчитывают число ядросодержащих клеток в суспензии.
4. Готовят разведение клеток с концентрацией 50x106 и 10x106 в 1 мл.
5. Готовят смесь агара, эритроцитов барана и клеток селезенки. Для этого в пробирки с 2 мл агара, находящиеся в водяной бане при 45 °С, добавляют 0,1 мл 10% суспензии эритроцитов барана и 0,1 мл суспензии клеток (конечная концентрация клеток - 5x106 и 1x106).
6. Разливают смесь в чашки Петри. Смесь из пробирок выливают на теплые чашки Петри. Быстрыми круговыми движениями смесь равномерно распределяют по дну чашки. Чашки ставят на горизонтальный столик. Дают агару застыть.
7. Инкубируют чашки Петри в термостате при 37 °С в течение 60 мин.
8. Разведение комплемента: сухой комплемент морских свинок разводят средой 199 (на 1 ампулу 5 мл среды, получают 20% раствор).
9. В каждую чашку Петри аккуратно добавляют по 3 мл комплемента.
10. Инкубируют чашки Петри в течение 30 мин при 37 °С.
11. Оценивают реакцию.
12. Подсчитывают число бляшкообразующих клеток на чашку и пересчитывают на 1 млн клеток и на всю селезенку.
13. Микроскопия бляшек: находят бляшку с лизированным участком и бляшкообразующей клеткой в центре.
14. Для улучшения контрастирования бляшек производят окраску препаратов (состав красителя: 10 мл 2% раствора бензидина в ледяной уксусной кислоте, 10 мл 5% H2O2, 80 мл дистиллированной воды).
15. Для сохранения бляшек чашку Петри заливают 10% раствором формалина.
3.5. КУЛЬТУРА КЛЕТОК IN VIVO
Метод колониеобразования кроветворных клеток в селезенке облученных мышей
После атомной бомбежки авиацией США японских городов Хиросимы и Нагасаки 6 августа 1945 г. перед мировой медициной встали проблемы защиты человека от лучевой болезни. Начала интенсивно развиваться новая наука - радиобиология. Во всех странах, в том числе в СССР, исследователи вскоре выяснили основные патологические проявления, вызванные проникающим лучевым поражением экспериментальных животных, и начали интенсивный поиск методов предупреждения и лечения лучевой болезни. Экспериментальные исследования показали: наиболее радиочувствительны гемопоэтические стволовые клетки, лимфоциты и клетки других кроветворных ростков. Облучение в 850-1000 Рад (≈10 Gy в современных единицах измерения) определили как «кроветворные летальные дозы». После такого облучения регенерация кроветворной ткани невозможна, но в течение ближайших дней (максимум 2 нед) экспериментальные мыши способны выживать за счет функционирования зрелых гемопоэтических клеток. При облучении в дозах выше 10 Gy наступает так называемая кишечная смерть за 1-3 сут, при еще более высоких дозах радиации возможна «смерть под лучом».
Единственным более или менее надежным средством спасения экспериментальных животных при облучении в «кроветворной летальной дозе» оказалась трансплантация клеток костного мозга от сингенных доноров. С тех пор облученные в «кроветворной летальной дозе» и сохранившие жизнеспособность в течение определенного срока мыши обозначаются лабораторным термином «живые пробирки». Трансплантация внутривенно таким мышам сингенных или аллогенных донорских костно-мозговых, селезеночных либо других лимфоидных клеток дает возможность в течение достаточного количества дней исследовать не только процессы приживления или неприживления вводимых клеток, но и явления взаимодействия разных типов клеток между собой. Более точно «живые пробирки» стали определять как «культуру клеток in vivo». Именно использование культуры клеток in vivo (рис. 3.7, см. также цв. вклейку) позволило сделать целый ряд открытий, актуальных до настоящего времени (взаимодействие Т- и В- лимфоцитов, роль В-клеток в антителообразовании, способность гемопоэтических клеток-предшественников к колониеобразованию in vivo и др.). Благодаря полученным данным
позже появился термин «Т-лимфоциты хелперы» (англ. to help - помогать). Т-лимфоциты рассматривали как необходимые помощники В-лимфоцитов в антителопродукции.
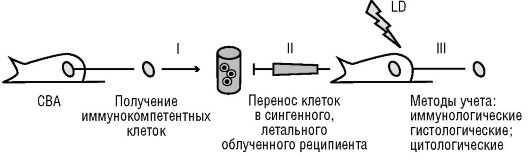 Рис. 3.7. Схема культуры клеток in vivo
Рис. 3.7. Схема культуры клеток in vivo
Следует отметить: подавление гемопоэза и иммунопоэза вызывается не только лучевым поражением, но и введением в высоких дозах химиопрепаратов со свойствами цитостатиков и иммунодепрессантов (метотрексат, 6-меркаптоэтанол, циклофосфамид и др.).
Сведения о закономерностях поведения гемопоэтических и иммунокомпетентных клеток в условиях экспериментальных моделей in vivo оказались актуальными для современной медицины. В последние годы все большее распространение получают методы клеточной биотехнологии в лечении многих заболеваний человека. Трансплантация гемопоэтических стволовых клеток нашла достаточно широкое применение не только в лечении лучевой болезни, но и целого ряда заболеваний, в первую очередь генетически опосредованных первичных иммунодефицитов, различных форм лейкозов.
В 1961 г. появилась публикация канадских ученых J.E. Till и E.A. McCulloch, в которой был представлен новый метод изучения кроветворных клеток-предшественников. Летально облученным (850-950 Рад) мышам-реципиентам трансплантировали внутривенно донорские клетки костного мозга. Через 7-10 сут на поверхности селезенки возникали видимые невооруженным глазом узелки-колонии (рис. 3.8), которые, как показал гистологический анализ, состояли из дифференцированных кроветворных клеток эритроидного, миелоидного или мегакариоцитарного ростков. Некоторые колонии отличались смешанным типом, но никогда не образовывались лимфоидные колонии. Авторы продемонстрировали прямую зависимость между числом трансплантированных донорских кроветворных клеток в
определенном диапазоне доз и числом сформировавшихся в селезенке реципиентов колоний.
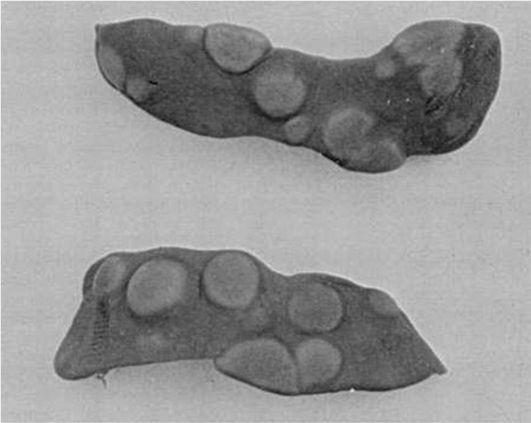 Рис. 3.8. Колониеобразующие единицы (КОЕс) в селезенке мышей
Рис. 3.8. Колониеобразующие единицы (КОЕс) в селезенке мышей
Метод Тилла и MакКуллоча получил распространение как количественный способ клонирования кроветворных клеток в селезенке летально облученных мышей. В течение ряда лет клетки, дающие начало колониям, считали стволовыми кроветворными клетками (СКК). Но позже авторы и вслед за ними другие исследователи осторожно обозначили эти клетки как колониеобразующие (КОЕс). Скорее всего КОЕс - мультипотентные клетки-предшественники, отстоящие на несколько этапов дифференцировки от СКК.
Метод Тилла и MакКуллоча использовали и до сих пор используют многие исследователи во многих лабораториях мира для изучения закономерностей приживления донорских кроветворных тканей в организме облученных реципиентов.
Р.В. Петров и Л.С. Сеславина, применяя данную экспериментальную систему, в 1967 г. обнаружили и в 1977 г. зарегистрировали как открытие явление взаимодействия между СКК и лимфоцитами. Суть открытия заключалась в том, что аллогенные лимфоциты инактивировали стволовые клетки. Не исключено, что инактивирующее или тормозящее действие лимфоцитов распространяется и на другие
несингенные активно пролиферирующие клетки (раковые, эпителиальные и др.), способные обеспечить за счет размножения самоподдерживающуюся популяцию. Данный феномен может являться одним из главных механизмов иммунологического надзора и элиминации соматических мутаций (Петров Р.В., 1987).
Вопросы и задания
1. Какими методами можно оценить фагоцитоз и его завершенность?
2. Перечислите типы клеточной цитотоксичности.
3. Как оценить функциональную активность NK?
4. Как оценить цитотоксические Т-клетки?
5. Опишите основные принципы иммуномагнитной сепарации.
6. Приведите принцип работы и устройство проточного цитофлуориметра.
7. Что отражает спонтанная и индуцированная хемилюминесценция?
8. Дайте определение и приведите основные этапы культуры клеток in vivo.
9. Какие основные иммунологические феномены были изучены с помощью культуры клеток in vivo?
10. Назовите методы, выявляющие АОК.
11. Каковы особенности метода Н. Йерне?
12. Опишите закономерности антителообразования.
13. Каковы постановка реакции и методы оценки?