Медицинская и клиническая генетика для стоматологов: учебник для вузов / Под ред. О.О. Янушевича., - 2009. - 400 с.
|
|
|
|
ГЛАВА 6. ПРОФИЛАКТИКА НАСЛЕДСТВЕННОЙ ПАТОЛОГИИ
Акуленко Лариса Вениаминовна Петрин Александр Николаевич
6.1. МЕДИКО-ГЕНЕТИЧЕСКОЕ КОНСУЛЬТИРОВАНИЕ
Основная цель медико-генетического консультирования состоит в профилактике наследственных и врожденных заболеваний. Врожденные и наследственные болезни занимают существенное место в структуре заболеваемости и смертности как детского, так и взрослого населения. Суммарная частота наследственных заболеваний в популяциях человека составляет 3,5-5,4%. Среди них врожденные пороки развития составляют 1,9-2,2%, мультифакториальные - 0,7-1,0%, моногенные - 0,4-1,5%, хромосомные - 0,5-0,7%.
Среди госпитализированных детей доля больных с наследственными дефектами составляет от 20 до 45-50%. Центральную роль по снижению груза наследственной патологии в семьях играет медикогенетическое консультирование.
В процессе медико-генетического консультирования больной или его родственники получают информацию об этиологии заболевания, методах лечения и предупреждения, а также риске возникновения данной патологии у других членов семьи, в том числе и у еще не родившихся детей.
Задачами медико-генетического консультирования являются:
1) диагностика наследственного заболевания;
2) определение характера наследования;
3) расчет повторного генетического риска;
4) определение способа профилактики;
5) объяснение значений риска, методов профилактики, лечения и реабилитации;
6) направление пациентов в специализированные медицинские учреждения для консультирования по проблемам лечения и реабилитации.
Методология проведения медико-генетической консультации включает несколько этапов:
• клинико-генеалогическое обследование пациента и его родственников;
• получение оценок генетического риска.
6.1.1. Методы обследования пациента и его родственников
Данный этап медико-генетического консультирования предполагает использование всего имеющегося диагностического арсенала для точной постановки диагноза. Большое значение имеют сбор и анализ клинико-генеалогической информации, данные о течении беременности и родов, информация об особенностях развития, наличии сопутствующих заболеваний и т.д. С помощью генеалогического метода могут быть установлены закономерности наследования заболевания или признака и сформулирована гипотеза о риске заболевания у родственников пробанда или консультирующегося. Важное значение для постановки диагноза имеет клинический осмотр пациента и его родственников. Наследственные заболевания характеризуются полисимптоматичностью поражения. Отдельные симптомы заболевания могут быть зарегистрированы при наружном осмотре головы, шеи, грудной клетки, конечностей при использовании методов лабораторного и инструментального исследования пациента. Для правильного описания симптомов заболевания и последующей постановки диагноза часто необходимы дополнительные консультации у разнообразных специалистов (невропатолога, дерматолога, окулиста, оториноларинголога, гинеколога, андролога, педиатра и др.). Такие консультации могут оказать решающую роль в постановке диагноза. В диагностической работе медико-генетические консультации широко используют компьютерные информационно-диагностические системы (POSSUM, LDDB, SINGEN и др). Конечной целью этих информационно-диагностических программ является диагностика наследственных и врожденных заболеваний на основе автоматического анализа разнообразных клинико-лабораторных признаков заболевания. Эти программы имеют некоторые ограничения и диагностике определенных групп наследственных заболеваний. Программа «POSSUM», например, содержит информацию более чем о 1000 наследственных заболеваний и синдромов,
имеющих различную генетическую этиологию (моногенные болезни, хромосомные болезни). В том числе среди дифференциальнодиагностических признаков имеются аномалии зубов и ротовой полости. Лабораторные методы диагностики широко используются для постановки диагноза наследственного заболевания. Основными методами лабораторной диагностики являются: биохимическая, цитогенетическая и молекулярно-генетическая диагностика.
Биохимические методы диагностики используются при подозрении на наличие наследственного биохимического дефекта. Разнообразие методов биохимической диагностики чрезвычайно широкое, позволяющее идентифицировать многие известные к настоящему моменту наследственные обменные нарушения. Метод биохимической диагностики используется также при осуществлении профилактических программ на популяционном уровне, скрининг новорожденных на выявление наследственных болезней обмена (фенилкетонурия, адреногенитальный синдром, гипотиреоз и др.). Биохимические методы диагностики играют важную роль и при формировании среди беременных групп с риском рождения детей с врожденной и наследственной патологией.
Цитогенетическая диагностика занимает одно из ведущих мест в алгоритме медико-генетического обследования пациента и членов его семьи. Современные методы клинической цитогенетики позволяют надежно диагностировать примерно 1000 разнообразных форм хромосомных заболеваний человека. В настоящее время цитогенетические методы все время совершенствуются, используются молекулярно-цитогенетические методы исследования хромосом.
Особое место в диагностике наследственных заболеваний принадлежит молекулярно-генетическим методам. С позиций медико-генетического консультирования методы ДНК-диагностики необычайно расширяют возможности генетического прогноза относительно некоторых заболеваний. ДНК-диагностика во многих случаях позволяет точно установить генотипы родителей и точно предсказать (и подтвердить) ожидаемые генотипы и фенотипы потомков. Наряду с другими методами диагностики (биохимическими, цитогенетическими) ДНК-диагностика предоставляет огромные возможности анализа патологических генотипов. Ее используют в практике медико-генетического консультирования в качестве подтверждающей диагностики, для диагностики скрытого носительства мутантного гена, успешно применяют для внутриутробной диагностики патоло-
гии плода (пренатальная ДНК-диагностика), в практике вспомогательных репродуктивных технологий (преимплантационная ДНКдиагностика).
Преимплантационная ДНК-диагностика позволяет выявить наличие генетических аномалий (мутаций) у раннего зародыша еще до момента его пересадки в полость матки. Пренатальная ДНКдиагностика позволяет определить генотип плода на ранних сроках беременности (8-11 нед). В том случае, когда диагноз тяжелого, не излечимого наследственного заболевания подтверждается, родители совместно с врачом-генетиком решают вопрос о целесообразности пролонгирования данной беременности. ДНК-диагностики позволяет перейти от вероятностного генетического прогноза к консультированию в терминах точного знания диагноза (в терминах абсолютных значений риска).
В настоящее время ДНК-диагностика заняла лидирующие диагностические позиции. Благодаря этому методу удалось получить молекулярно-генетические характеристики многих генов, детерминирующих наследственное заболевание или предопределяющих степень предрасположенности к заболеваниям с более сложной, чем моногенное наследование, генетикой. Анализ сведений, помещенных в каталог меделирующих признаков МакКюсика, показывает, что в настоящее время для многих форм патологии уже установлена локализация патологических генов в определенном хромосомном районе и молекулярные особенности этих генов охарактеризованы. Это означает, что данные заболевания принципиально могут быть диагностированные методами ДНК-диагностики в разные периоды онтогенеза (в доимплантационный период, в пре- и постнатальный период). Другая сторона этой проблемы состоит в том, что с проведением и использованием методов ДНК-диагностики возникает целый ряд проблем этического характера. Эти проблемы также следует учитывать при проведении медико-генетического консультирования. К ним относятся, в частности, проблемы досимптоматического, прогностического, предсказательного тестирования (тестирование клинически здоровых людей, принадлежащих к группе риска). Такое тестирование может дать точную оценку риска развития заболевания (вплоть до 100% вероятности развития заболевания в случае обнаружения патологической мутации). Вероятно, что такое тестирование вполне оправдано в случае заболеваний, для которых имеются методы профилактики и эффективные способы лечения,
существенно отодвигающие дебют и уменьшающие тяжесть проявления патологии. В том случае, когда заболевание не имеет адекватных способов профилактики и снижения тяжести страданий пациента, данные предсказательного тестирования могут принести вред пациенту и его семье, как в случае, например, хореи Гентигтона . Однако проблемы прогностического тестирования чрезвычайно многогранны, однозначного их решения практически никогда не существует. Для проведения такого тестирования требуется взвешенное решение врача-консультанта, человека, обратившегося за консультацией, его близких и друзей. В некоторых случаях целесообразна дополнительная психологическая консультация. После завершения диагностического этапа медико-генетического консультирования преступают к осуществлению второго этапа.
6.1.2. Получение оценок генетического риска
Генетический риск - вероятность появления наследственной патологии у обратившегося за консультацией или у его родственников. Расчеты генетического риска основаны на анализе закономерностей наследования того или иного заболевания или на основе эмпирических данных. В том случае когда генотипы консультрующихся точно не установлены, используются расчеты, направленные на получение вероятностных оценок риска. В них используются оценки вероятности образования определенного типа гамет у родителей.
• Априорная вероятность, вероятность наличия определенного генотипа на основании предполагаемого типа наследования заболевания.
• Условная вероятность - вероятность рождения пораженного исходя из заданной априорной вероятности с учетом дополнительной информации (значения пенетрантности, сроков манифестации, наличия пораженных в семье и др.).
• Совместная вероятность - оценивает вероятность совместного наступления события как произведение априорной и условной вероятности.
• Апостериорная вероятность - отношение совместной вероятности определенного генотипа к сумме совместных вероятностей возможных генотипов.
Дополнительной информацией для расчетов генетического риска являются данные о частотах генов заболеваний в популяциях, наличия и степень кровного родства (уровень инбридинга) и др.
Генетический риск до 5% считается низким, в пределах 6-20% - средний риск, более 20% - высокий. Расчеты генетического риска не являются самоцелью консультирования. Полученные значения риска служат основой для принятия решения относительно планирования деторождения. В принятии этого решения роль врачагенетика заключается в предоставлении всесторонней информации относительно величины риска, объяснение его значений, предоставление данных относительно тяжести течения заболевания, возможного лечения и его эффективности и т.д. Один из основополагающих принципов медико-генетического консультирования заключается в недопустимости директивности. Семья должна сама принять осознанное решение относительно репродуктивного поведения при риске возникновения наследственного заболевания. Важным элементом проведения медико-генетической консультации является возможность использования методов пренатальной диагностики для определения степени риска наследственной патологии у плода. Наличие пренатальной диагностики, информативность различных диагностических подходов могут сыграть решающую роль в принятии семьей решения в каждом конкретном случае.
6.2. МЕТОДЫ ПРЕНАТАЛЬНОЙ ДИАГНОСТИКИ НАСЛЕДСТВЕННЫХ БОЛЕЗНЕЙ
В настоящее время известно около 30 тыс. наследственных болезней, лечение которых практически неэффективно. Ликвидация этих болезней в населении возможна только за счет профилактических мероприятий, которые реализуются через медико-генетическое консультирование.
Пренатальная диагностика неразрывно связана с задачами медико-генетического консультирования. Ранее пренатальная генетическая консультация ограничивалась определением генетического риска, выраженного в процентах. Благодаря новым методам исследования стала возможной индивидуальная диагностика внутриутробных проявлений заболевания плода, в связи с чем многие женщины, раннее не планировавшие деторождение из-за высокого риска, могут решиться на этот шаг. Однако необходимо помнить, что эта форма профилактики доступна не при всех наследственных болезнях.
Пренатальная диагностика поднимает ряд биологических и этических проблем, потому что в отличие от прочих врачебных вмеша-
тельств здесь речь идет не о лечении болезни, а о ее предупреждении путем элиминации плода, что избавляет родителей от страданий.
На современном уровне развития пренатальной диагностики при использовании всех современных методов исследования можно было бы предотвратить примерно в 15-20% случаях рождение ребенка, пораженного тяжелыми наследственными заболеваниями.
Благодаря современным методам пренатальной диагностики в настоящее время можно распознавать различные изменения хромосом, дефекты закрытия невральной трубки (ДЗНТ), многие болезни обмена веществ. В большинстве же случаев приходится ограничиваться лишь оценкой степени генетического риска.
В настоящее время пренатальная диагностика располагает арсеналом диагностических методов, позволяющих получить информацию о внутриутробном состоянии плода, практически соизмеримую с данными, получаемыми о внеутробном пациенте.
Принципиально все методы пренатальной диагностики подразделяются на неинвазивные и инвазивные.
6.2.1. Неинвазивные методы пренатальной диагностики
К неинвазивным методам относят:
• ультразвуковое исследование с черно-белой или цветной допплерографией;
• иммунорадиологический и иммуноферментный анализ факторов материнской сыворотки.
Ультразвуковое исследование (УЗИ)
Пренатальный диагноз наследственных болезней, как правило, является не случайной находкой, а результатом целенаправленного исследования. Это в полной мере относится и к ультразвуковой диагностике. При подозрении на какое-либо заболевание плода надо выбрать соответствующие методы исследования.
Отбор случаев, требующих методов пренатальной диагностики, производится при генетическом консультировании. Аномалии плода, которые удается выявить при помощи ультразвуковой диагностики, чаще всего являются элементами синдромов, вызванных генами плейотропного действия (не считая тератогенных случаев). Эти аномалии наследуются в соответствии с хорошо изученными закономерностями. В подобных случаях существует повышенный риск повторения.
Ультразвуковые исследования в настоящее время занимают ведущее положение в комплексе методов пренатальной диагностики. Практически до 70% основной информации о внутриутробно развивающемся плоде можно получить при ультразвуковом исследовании (УЗИ).
Метод УЗИ является практически безопасным как для плода, так и для организма матери. В настоящее время ограничений к применению исследования нет.
Общепринятым считается 4-кратное ультразвуковое исследование при нормально протекающей беременности - в сроках:
• 10-11 нед;
• 19-20 нед;
• 25-26 нед;
• 37-38 нед.
Любое осложнение в течение беременности можно считать дополнительным показанием к рациональному УЗИ с учетом клинической ситуации.
Объем информации, который можно получить в различные сроки беременности о внутриутробно развивающемся плоде, можно себе представить, исходя из следующих данных:
• плодное яйцо в полости матки визуализируется с 2-3 нед;
• тельце эмбриона с 4-5 нед;
• сердцебиение эмбриона регистрируется с 4-5 нед;
• с 7 нед можно наблюдать отдельные движения плода;
• головка как отдельное анатомическое образование лоцируется с 8 нед;
• с 9 нед начинают визуализироваться конечности эмбриона (идентификация их становится возможной лишь к 12 нед);
• с 12 нед доступны визуализации структуры головного мозга, позвоночник, лицо, грудная клетка, живот, желудок, а также в некоторых случаях отчетливо кисти и стопы;
• с 14 нед идентифицируются сплетения головного мозга, сердце как анатомическое образование с наличием камер, мочевой пузырь.
Патология I триместра беременности подразделяется на бластопатии и эмбриопатии. К бластипатиям, доступным У3-диагностике, относят:
• пузырный занос;
• гипоплазию хориона;
• анэмбрионию;
• отслойку хориона.
Диагностика эмбриопатий зависит от срока беременности. На разных сроках беременности можно получить необходимую информацию, в частности:
• с 5 нед диагностируется замерший эмбрион (на основании отсутствия сердцебиения);
• 8-9 нед можно заподозрить дефекты развития головки, что служит показанием к динамическому исследованию в 11-12 нед;
• с 9-10 нед можно заподозрить аномалии развития конечностей, однако подтвердить диагноз можно лишь в 12 нед. В это же время можно диагностировать большинство грубых пороков развития эмбриона и прервать беременность путем артифициального аборта.
II триместр беременности является оптимальным для УЗ-пренатальной диагностики. До 27 нед определению доступно не менее 98% всех видов пороков развития плода. Остается добавить, что при высокой разрешающей способности сканера в 36 нед для диагностики доступна даже такая патология, как отслойка сетчатки глаза плода. Безусловно, что в настоящие время такой высокий уровень диагностики находится в стадии научного эксперимента.
Основную информацию по выявлению врожденных и наследственных заболеваний плода дает УЗИ во II триместре беременности, в сроках от 16 до 28 нед, когда сформированы и доступны подробному исследованию практически все органы и системы плода и включаются синдромологические особенности врожденного и/или наследственного заболевания. Диагностическая точность выявления так называемых ультразвуковых стигм, или маркеров, врожденных и наследственных заболеваний при соответствующей квалификации специалиста может достигать 70-80%.
Перечень генетических синдромов, которые могут быть выявлены при ультразвуковом исследовании, расширяется с каждым годом. Наиболее актуальной является диагностика генетически детерминированных врожденных заболеваний, не связанных с грубыми пороками развития или проявляющихся в виде мелких операбельных дефектов. К этой категории относятся некоторые хромосомные и обменные заболевания плода.
Одним из важных вопросов пренатальной диагностики является определение состояния плода при доношенной беременности перед родами. При этом оценка биофизического профиля плода, определе-
ние росто-весовых параметров, интерпретация состояния плаценты и пуповины, диагностика аномальных положений плода могут быть решающими при решении вопроса о сроке и методе родоразрешения беременной.
Важным разделом ультразвуковой диагностики является допплерометрическое исследование маточного и фетоплацентарного кровотока. В последние годы с использованием аппаратуры высокой разрешающей способности стало возможным исследовать кровоток в большинстве сосудов плода. Однако наибольшую практическую ценность имеют исследования маточных артерий, артерий пуповины и аорты плода. Сущность исследования кривых скоростей кровотока состоит в математическом анализе максимального систолического и конечного диастолического кровотока, продолжительности графической кривой между максимальными и минимальными значениями показателей кровотока, а также в определении формы кривой кровотока. Проведенные многочисленные исследования убедительно свидетельствуют, что допплерометрия позволяет на наиболее ранних этапах возникновения диагностировать гипоксическое состояние плода, гораздо раньше других методов исследования.
Новым направлением использования допплерометрии в перинатологии является допплерэхокардиография, которая занимает на сегодняшний день первое место в изучении внутрисердечной гемодинамики плода. К новейшим достижениям в изучении кровообращения плода относится цветная допплерография, носящая название «цветное допплеровское картирование». При использовании данного метода можно быстро и точно осуществлять поиск даже самых мелких сосудов плода и производить качественную регистрацию кривых скоростей кровотока. Наличие кровотока в новообразованиях головного мозга и туловища плода, кистозных или полостных образованиях пуповины и плаценты диагностируются, как правило, только при применении цветного допплеровского картирования. Значительно облегчается и оценка внутрисердечной гемодинамики плода, что имеет неоценимое значение в пренатальной диагностике врожденных пороков сердечно-сосудистой системы.
Фетальные маркеры
Весьма эффективным подходом к формированию группы высокого генетического риска является использование материнского сывороточного скрининга на альфа-фетопротеин (AFP или АФП),
хорионический гонадотропин (в или ХГЧ), неконьюгированный эстриол (мЕ3) и ассоциированный с беременностью белок А плазмы (PAPPA - pregnancy-associated plasma protein A).
Созданы коммерческие наборы, компьютерные программы и тестсистемы для массовых скрининговых популяционных исследований, как для выявления трисомии 18 (синдром Эдвардса), трисомии 21 (синдром Дауна), открытых дефектов невральной трубки плода (spina bifida), так и для своевременного обнаружения различной акушерской патологии.
Для каждого определенного срока беременности характерны определенные концентрации данных веществ в сыворотки крови беременной и их постоянные соотношения. Мониторинг беременной на предмет специфического изменения соотношения сывороточных маркеров может указать на хромосомное заболевание, пороки развития невральной трубки или внутренних органов плода либо на осложненное течение беременности.
Некоторые маркеры [например, креатинфосфокиназа (КФК)] могут использоваться при пренатальной диагностике ряда нервномышечных заболеваний - миопатия Дюшена и т.п. К сожалению, наиболее информативно содержание КФК в амниотической жидкости, а определение уровня этого фермента в сыворотке беременной малопоказательно.
Первоначально вышеперечисленные биохимические маркеры определяли в амниотической жидкости. Позднее, по крайней мере для АФП, ХГЧ, Е3 и некоторых других факторов, была продемонстрирована полная корреляция уровня их содержания в крови беременной и в ее амниотической жидкости.
В настоящее время разрабатываются такие методы пренатальной диагностики, как целомоцентез, смыв клеток цервикального канала беременной и выделение клеток плода из крови матери (клетки, прошедшие через плацентарный барьер, можно обнаружить циркулирующими в кровотоке беременной как в норме, так и при различной патологии).
6.2.2. Инвазивные методы пренатальной диагностики
К инвазивным диагностическим процедурам относятся:
• амниоцентез;
• кордоцентез;
• хорион биопсия;
• биопсия органов плода с последующим лабораторным исследованием полученного материала методами, соответствующими конкретным целям пренатального исследования;
• амниоскопия;
• фетоскопия.
Биопсия хориона
Биопсия хориона проводится в любые сроки беременности. Показаниями к биопсии хориона служат:
• в I триместре - сбалансированные хромосомные перестройки у родителей, обменные заболевания в семье, возраст женщины более 36 лет, рождение в анамнезе ребенка с хромосомной патологией;
• во II триместре - необходимость кариотипирования плода или морфологического исследования плаценты;
• в III триместре биопсия плаценты используется крайне редко, как правило, в случае, когда специалисты не владеют более информативными методами исследования.
Различают щипцовую и аспирационную биопсию хориона. Щипцовая биопсия хориона производится путем трансцервикального введения специальных биопсийных щипцов. Аспирационная биопсия хориона (АБХ) производится путем вакуумного отсасывания в шприц ворсин хориона. В настоящее время преимущественно используется АБХ в связи с большим объемом получаемого биологического материала и меньшим процентом осложнений.
Диагностическая ценность АБХ состоит прежде всего в исключительности применения в I триместре, а также в скорости проведения анализов на образцах культуры хориона.
Амниоцентез
Амниоцентез - пункция амниотической полости с целью аспирации амниотической жидкости. Амниоцентез (АЦ) производится трансабдоминальным или трансвагинальным путем (пунктируется передний свод влагалища). Применяется в целях:
• цитогенетической диагностики хромосомной патологии плода;
• диагностики эритробластоза, наследственных заболеваний обмена;
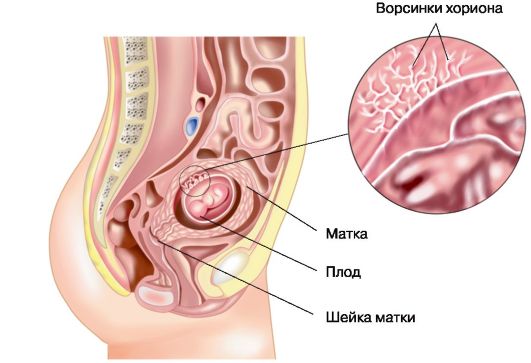 Рис. 6.1. Месторасположение хорионической ткани
Рис. 6.1. Месторасположение хорионической ткани
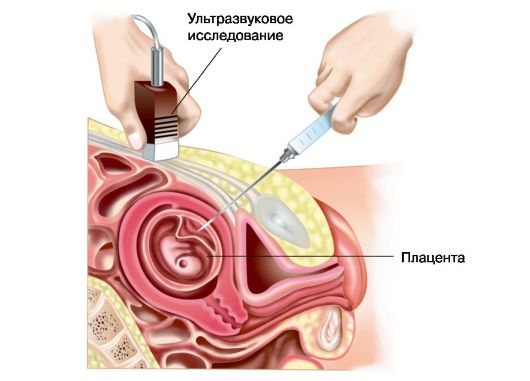 Рис. 6.2. Хориоцентез, трансабдоминальный доступ
Рис. 6.2. Хориоцентез, трансабдоминальный доступ
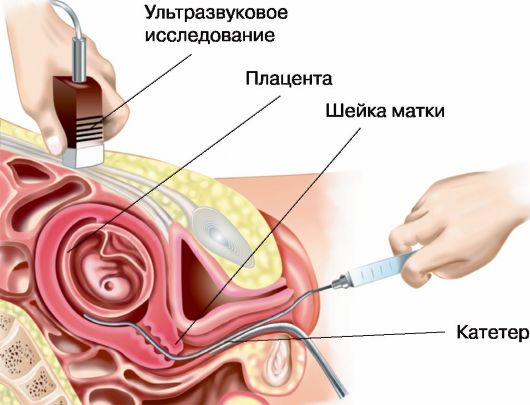 Рис. 6.3. Хориоцентез, трасцервикальный доступ
Рис. 6.3. Хориоцентез, трасцервикальный доступ
• проведения иммуноферментного анализа амниотической жидкости на АФП при подозрении на наличие открытых свищевых дефектов нервной трубки;
• оценки зрелости легочной ткани на основании анализа соотношения лецитин - сфингомиелинопределения уровня фосфатидилглицерида и других биохимических компонентов амниотической жидкости;
• диагностики степени выраженности гипоксического состояния плода на основании уровня кислотности.
Применяется амниоцентез начиная с 11-12 нед беременности, вплоть до родов. Риск осложнений при проведении амниоцентеза не превышает 0,5-1% и практически не зависит от срока беременности.
Диагностическая ценность амниоцентеза заключается в простоте выполнения манипуляции и широте спектра диагностических возможностей. Неудобство применения амниоцентеза для целей цитогенетической диагностики состоит в длительности и сложности культивирования клеток амниотической жидкости. Несмотря на это,
амниоцентез остается одной из самых распространенных диагностических процедур в большинстве пренатальных диагностических центров.
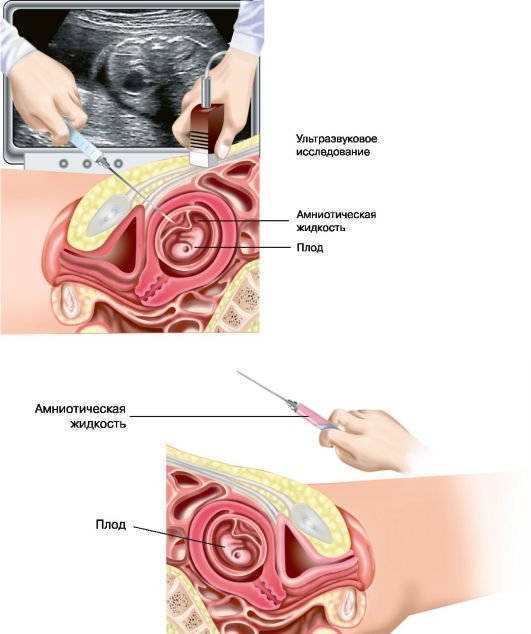 Рис. 6.4 а, б. Амниоцентез
Рис. 6.4 а, б. Амниоцентез
Кордоцентез
Кордоцентез - пункция вены пуповины с целью получения плодной крови в настоящее время является наиболее актуальным методом пренатальной диагностики, поскольку кровь плода является наиболее благодатным и информативным биологическим материалом.
В настоящее время кровь плода используется в:
• цитогенетической пренатальной диагностике хромосомной патологии;
• диагностике наследственных болезней обмена;
• диагностике гемоглобинопатий;
• исследованиях белкового спектра крови;
• диагностике коагулопатий;
• при оценке степени выраженности гипоксического состояния плода и его инфицированности;
• определения АВО-антигенов и Rh-фактора плода;
• диагностике и лечении резус-конфликтной беременности, для внутриутробного переливания крови при гемолитической болезни плода.
Наиболее часто кордоцентез применяется, начиная с 18 нед беременности, однако при наличии УЗ-сканеров с высокой разрешающей способностью кордоцентез можно выполнять с 12 нед.
Риск осложнений после кордоцентеза колеблется от 1,5 до 2,5%. Основным осложнением является продолжительное кровотечение из прокола вены пуповины, вследствие чего развивается внутриутробная анемия и гипоксия плода, что в ряде случаев может приводить к его гибели. В различные сроки беременности допускается аспирация от 0,5 до 5 мл крови плода.
По технике выполнения кордоцентеза различают две методики:
1) применение пункционных адаптеров;
2) метод так называемой свободной руки.
Пуповину как объект пункции подразделяют на три отдела: плацентарный, абдоминальный и свободную петлю (участок, удаленный от плацентарного и абдоминального отделов). Наиболее часто осуществляется пункция плацентарного отдела. Это связано с надежной устойчивостью данного отдела в амниотической полости. Однако при пункции пуповины, расположенной в непосредственной близости от поверхности плаценты, высока вероятность проникновения иглы в лакуны плаценты, заходящие в некоторых случаях глубоко в корень пуповины, и получения в связи с этим образца смешанной
крови (плодной с материнской). Такие образцы для анализа, естественно, непригодны.
Менее употребляемым методом является пункция пуповины в абдоминальном отделе, что связано как с высоким риском ранения плода при его двигательной активности, так и с более частым возникновением кровотечения при ранении артерии.
В этом отношении наиболее благоприятным представляется метод пункции «свободной петли» пуповины, исключающий получение образца смешанной крови и понижающий риск ранения плода и возникновения кровотечения. Однако осуществление данного метода является более сложным в связи с относительной неустойчивостью данного отдела пуповины в амниотической полости, что требует от оператора большого практического навыка. Оптимальным считается применение двух методик: пункции «свободной петли» пуповины методом «свободной руки» и пункции плацентарного отдела с применениям пункционных адаптеров.
Кардиоцентез
Альтернативным подходом к получению образца крови плода является кардиоцентез - пункция полостей сердца плода. Кардиоцентез осуществляется по принципу кордоцентеза. Производится пункция правого желудочка сердца через грудную клетку вблизи от грудины. Осуществлять кардиоцентез предпочтительно с применением пункционного адаптера для оптимального выбора траектории прохождения пункционной иглы.
В связи с высоким риском гибели плода при попадании иглы в проводящие нервные пучки, а также риском ранения смежных жизненно важных органов кардиоцентез применяется лишь в случаях наличия грубых пороков развития плода перед прерыванием беременности и абсолютном маловодии, когда визуализация пуповины невозможна.
Биопсия кожи и печени плода
Редко используемыми диагностическими процедурами, применяемыми при наличии высокого риска возникновения специфических наследственных заболеваний, являются биопсия кожи и печени плода. Указанные процедуры осуществляются по принципу кардиоцентеза, но требуют специальной подготовки беременной (медикаментозной премедикации), позволяющей максимально сни-
зить двигательную активность плода с целью уменьшения риска его травматизации.
Фетоскопия
Фетоскопия - метод, позволяющий осуществить непосредственный визуальный осмотр плода. Фетоскопию производят специальным эндоскопическим прибором в сроках от 16 до 22 нед беременности. Фетоскопия технически схожа с лапаро- и гистероскопией. Фетоскопический прибор так же, как и лапароскоп, состоит из проводящего троакара, оптической системы с каналом для введения биопсий ной иглы и осветительной системы.
Применяется два способа введения фетоскоскопа: трансабдоминальный и трансвагинапьный. Преимущественно используется трансабдоминальный доступ. Перед осуществлением фетоскопии обязательным является проведение прицельного ультразвукового исследования для определения положения плода в матке, расположения и состояния плаценты и миометрия.
Противопоказаниями для проведения фетоскопии являются: расположение плаценты по передней стенки матки, наличие множественной миомы матки с преимущественным расположением миоматозных узлов по передней стенке и выраженный варикоз миометрия передней стенки матки. Риск прерывания беременности при проведении фетоскопии колеблется от 3 до 8%.
Существенной отрицательной особенностью фетоскопии является наличие риска осложнений со стороны женщины в виде внутрибрюшного кровотечения и эмболии околоплодными водами. В связи с этим в настоящее время фетоскопия применяется в редких случаях. Чаще всего показаниями для ее проведения являются тяжелые, летальные поражения кожи (эритродермия Брока, буллезный эпидермолиз), печени, почек, требующие проведения уточняющей биопсии, а также некоторые специфические наследственные заболевания плода, когда необходима визуальная диагностика.
Амниоскопия
Амниоскопия - трансцервикальный осмотр плодного пузыря, применяемый, как правило, для качественной визуальной оценки околоплодных вод при доношенной беременности или при необходимости в более ранние сроки.
Амниоскоп состоит из металлического зеркального конуса длиной 20-25 см и диаметром узкой части от 12 до 20 мм, мандрена,
оптического окуляра и осветительной системы. Осмотр производят на гинекологическом кресле в асептических условиях. В цервикальный кана л вводится амниоскоп с мандреном, затем мандрен уда ляется, после чего подключается осветительная система и подводится осветительный окуляр. При неосложненном течении беременности в предлежащей части плодного пузыря определяется достаточное количество светлых, прозрачных и опалесцирующих плодных вод с наличием белой сыровидной смазки.
Обнаружение хлопьев мекония, зеленоватая окраска вод и оболочек могут указывать на гипоксическое состояние плода. Примесь коричневого мекония может свидетельствовать о наличии резус-конфликтной беременности, гемолитической болезни плода, а также об открытых дефектах желудочно-кишечного тракта.
Основным осложнением амниоскопии является разрыв плодного пузыря, излитие околоплодных вод. В настоящее время в связи с наличием отработанных критериев ультразвуковой диагностики вышеуказанных состояний амниоскопия применяется в основном как вспомогательный метод для уточнения диагноза.
6.3. МЕТОДЫ ВЫЯВЛЕНИЯ ХРОМОСОМНЫХ НАРУШЕНИЙ И МОНОГЕННЫХ ЗАБОЛЕВАНИЙ
Определение кариотипа клеток амниотической жидкости представляет собой дорогостоящий, трудоемкий метод. В настоящее время пренатальное исследование хромосом показано в тех случаях, когда имеется повышенный риск хромосомных аномалий (ХА), приводящих к тяжелому отставанию в соматическом или умственном развитии. Генетическая консультация может рекомендовать кариотипирование клеток амниотической жидкости, но право на решение сохраняется исключительно за супружеской парой.
Синдром Дауна
У 5% всех беременных существует более высокий, чем средний, риск наличия какой-нибудь ХА у плода. Эти женщины рожают 20% детей с ХА.
Пока занием для прената льного цитогенетического анализа является наличие в семье больного с синдромом Дауна. Если мать моложе 30 лет, риск повторения на основании ретроспективных данных
составляет 1-2%, т.е. он несколько превышает частоту трисомии 21 в популяции. Если у родителей имеются отклонения со стороны психики, необходимо провести амниоцентез.
У женщин старше 30 лет, родивших детей с синдромом Дауна, риск повторения одинаков со средним риском их возрастной группы. Если у одного из родителей обнаружена транслокация (центрическое слияние) или мозаицизм, тогда степень риска повторения определяется другими факторами.
Давно известно, что у женщин старшего возраста чаще рождаются дети с синдромом Дауна. На возрастной кривой матери имеются два пика, один из которых соответствует 27 годам, а второй - 40 годам жизни. Риск синдрома Дауна среди 35-летних женщин составляет 1:300, а среди 30-летних - 1:800, поэтому вполне понятно, что возрастную границу, являющуюся показанием для амниоцентеза, нельзя сдвинуть ниже 35 лет.
При генетическом консультировании более целесообразно пользоваться данными пренатальной диагностики и информировать родителей о риске выкидыша и мертворожденности. 40-летним и более старшим женщинам необходимо рекомендовать пренатальную диагностику обязательно, 35-39-летним - выборочно, а 30-34-лет- ним - лишь в редких случаях. Пренатальная диагностика в первую очередь предупреждает рождение ребенка с синдромом Дауна. Кроме того, в ходе исследования довольно часто выявляют и аутосомную, и гоносомную анеуплодии.
Необходимо также знать, что возможные мутагенные факторы (облучение, вирусная инфекция, медикаментозные средства, действующие в первой половине беременности) не приводят к значимым генетическим изменениям у плода, хотя в прошлом эта возможность и не отвергалась.
Привычный выкидыш
Относительно часто у супружеской пары первое зачатие заканчивается выкидышем. В подобных случаях риск выкидыша при второй беременности не более высок, чем в популяции в среднем.
Если и вторая беременность закончится выкидышем и удастся установить патологический кариотип плода, риск нового выкидыша уже более высок. В то же время наличие привычных выкидышей в анамнезе у матери, родившей здорового ребенка, не означает неблагоприятный прогноз для ее детей.
Если у плода ХА не обнаружены, то причину повторяющихся выкидышей необходимо искать у матери (недостаточность шейки матки, аномалии матки и т.д.). Если при гинекологическом обследовании причины со стороны матери исключены, то в 20% подобных случаев удается выявить ХА у одного из родителей. Хотя эти аберрации и не сопровождаются заметными изменениями фенотипа, они все же могут привести к бесплодию. В подобных случаях, если беременность удается довести до конца, имеется значительная вероятность рождения больного ребенка.
Болезни обмена веществ
Если определение повторного риска ХА основывается на эмпирических данных, то для установления риска моногенного заболевания существуют точные методы.
Преобладающее большинство врожденных болезней обмена веществ, открытых в начале этого столетия, передается по аутосомно-рецессивному типу: у практически здоровых родителей-гетерозигот около 25% потомков будут больными гомозиготами.
Причиной небольшой части болезней обмена веществ у мужчин являются рецессивные гены, сцепленные с Х-хромосомой, так что у женщин-гетерозигот больны будут около 50% сыновей.
Пока известно лишь небольшое число аутосомно-доминантных болезней обмена веществ, связанных с биохимическими нарушениями. В подобных случаях больной (гетерозигота) передает по наследству аномальный ген 50% потомков. В ежедневной практике генетического консультирования врач сталкивается с подобными ситуациями, когда показана пренатальная диагностика.
Если в связи с рождением больного ребенка у родителей выявится гетерозиготность, при следующей беременности рекомендуется воспользоваться пренатальной диагностикой (ретроспективная профилактика).
В тех случаях, когда гетерозиготность обнаружена при профилактических осмотрах населения, пренатальная диагностика показана уже при первой беременности (проспективная профилактика) .
К пренатальной диагностике следует прибегать в небольших популяциях, в которых в первую очередь из-за более частого кровного родства - частота определенных генов выше, чем в популяции в среднем.
Если функция одного гена (или пары генов) нарушена, закодированный им фермент образуется лишь частично или вообще не образуется. Это приводит к нарушению обменного процесса, направляемого данным ферментом, в результате чего в организме накапливаются продукты неправильного метаболизма и/или возникает дефицит в конечных продуктах нормального обмена веществ. Из этого следует, что пренатальная диагностика должна основываться на исследовании ферментов или отдельных продуктов обмена веществ.
Очевидно, что специфическая диагностика возможна лишь в случае специфического анализа ферментов. В настоящее время примерно при 200 болезнях обмена веществ точно известен фермент, ответственный за заболевание.
В принципе дефицит ферментов, обнаруживаемый в культурах фибробластов кожи, можно обнаружить и в культурах клеток амниотической жидкости. Однако разница в активности двух ферментов может быть весьма существенной. Она наблюдается также при исследовании культур фибробластов кожи матери, плода и клеточных культур.
Для достоверного пренатального диагноза необходимы культуры клеток амниотической жидкости и эпителиальных клеток кожи родителей. За исключением отдельных случаев культивированные клетки в замороженном состоянии (в жидком азоте) можно хранить в клеточном банке. Эти культуры имеют большое значение не только для сопоставления активности ферментов у больных гомозигот и родителей-гетерозигот с активностью клеточных культур амниотической жидкости, но и для сравнения при выявлении новых случаев.
Для традиционного культивирования клеток амниотической жидкости необходимо несколько миллионов клеток, что сопряжено с рядом проблем (фактор времени, сложность методики и т.д.). Большим прогрессом в пренатальной диагностике явилось введение микрохимических методов, благодаря которым для анализа достаточно уже 100-1000 культивированных клеток.
Сущность микрометода в следующем: если на 7-10-й день культивирования отмечается соответствующий рост клеточных клонов, питательный раствор сливают, а клетки лиофилизируют. Замораживание не оказывает влияния на активность большинства ферментов, материал можно хранить при температуре 20 °С. Активность фермента определяют с помощью методов спектрофотометрии, флюороили радиометрии.
Дефекты закрытия невральной трубки
Наиболее частую форму врожденной аномалии центральной нервной системы представляют анэнцефалия и/или spina bifida, которые принято обозначать общим названием dysraphia neuralis, или дефекты закрытия невральной трубки (ДЗНТ). Выделение этой аномалии объясняется не только ее распространенностью, но и возможностями пренатальной диагностики (распознавание с большой долей вероятности до 20 нед беременности). Биохимические аспекты патогенеза неизвестны, поэтому специфическая пренатальная диагностика ДЗНТ не представляется возможной.
В настоящее время существуют 2 метода исследования, облегчающие пренатальную диагностику: определение уровня α-фетопротеина (АФП) в амниотической жидкости и исследование клеток в ней, прямое ультразвуковое исследование . Эффективность каждого из методов зависит в первую очередь от технических условий. При соблюдении определенных условий лучший результат достигается одновременным применением обоих методов.
В наши дни как определение АФП, так и ультразвуковая диагностика являются неотъемлемыми методами исследования в пренатальных центрах, с их помощью удается предупредить повторение ДЗНТ почти во всех случаях (ретроспективная профилактика), а благодаря организации проспективных профилактических осмотров можно предупредить примерно 70-80% всех случаев ДЗНТ.
α-Фетопротеин известен не так давно. Иммунологически идентичный белок был обнаружен и при некоторых опухолевых заболеваниях, поэтому исследование АФП получило широкое распространение в первую очередь в онкологической практике.
Молекулярная масса АФП 61000-75000, в отношении электрофореза он соответствует альфа-глобулину. По своим физическим свойствам АФП очень схож с альбумином, оказывает нецитотоксическое иммуносупрессивное действие, угнетая некоторые функции Т-клеток. Вероятно, что иммунорегуляторная активность АФП оказывает защитное действие на плод, о чем свидетельствует следующий факт: введение беременным животным анти-АФП-сыворотки может вызвать выкидыш и аномалии развития. В последнее время некоторые авторы считают вероятной роль АФП в защите развивающегося мозга плода от материнских эстрогенов.
АФП можно обнаружить в амниотической жидкости уже на 6-й неделе беременности (его концентрация составляет 1,5 мкг/мл).
В последующем кривая концентрации АФП в амниотической жидкости схожа с кривой его уровня в сыворотке крови плода, однако количество его в сыворотке значительно меньше (примерно в 100 раз). Наиболее высокая концентрация АФП в амниотической жидкости отмечается на 12-14-й неделе беременности (в среднем около 30 мкг/ мл), затем она резко уменьшается и на 20-й неделе составляет лишь 10 мкг/мл.
Удалось установить также, что содержание АФП в амниотической жидкости не является специфическим признаком ДЗНТ. Содержание АФП может быть повышенным и при ряде других аномалий развития, а также при осложненной беременности. Пока не совсем выяснены вопросы, когда и почему увеличивается содержание АФП в амниотической жидкости, насколько чувствителен метод исследования и в какой степени этот признак характерен для ДЗНТ. Поскольку содержание АФП в сыворотке крови плода с ДЗНТ не повышено, наиболее вероятно, что излишки АФП просачиваются через пораженные участки, не покрытые кожей.
Хотя патогенез и неизвестен, остается фактом, что содержание АФП в амниотической жидкости при анэнцефалии повышено практически в 100% случаев, при манифестной форме spina bifida в 90%. Определение уровня АФП не позволяет исключить возможность ДЗНТ без кожного дефекта, хотя эта форма составляет 5-10% всех случаев.
С помощью данного теста можно диагностировать большое число патологических состояний. Проблема возникает при относительно доброкачественных заболеваниях, но особенно в тех случаях, когда плод здоров, а содержание АФП повышено.
Если у супружеской пары, обратившейся в генетическую консультацию, уже был ребенок с ДЗНТ, то степень повторного риска всегда более 1-2%. При повторной беременности может быть рекомендована пренатальная диагностика, в результате которой можно предотвратить рождение второго пораженного ребенка.
90% детей с ДЗНТ рождаются в семьях, где не было признаков, указывавших на генетическое предрасположение в семье. В настоящее время наиболее многообещающим кажется определение уровня АФП в сыворотке крови матери. После того как была установлена диагностическая ценность уровня АФП в амниотической жидкости, выяснилось, что при ДЗНТ уровень АФП повышен и в крови матери.
Уровень АФП в сыворотке крови матери может быть повышен не только при ДЗНТ, но и при ряде состояний, сопровождающихся высоким уровнем АФП. Если к этому добавить еще и не связанные с беременностью заболевания, которые могут сопровождаться повышением уровня АФП в сыворотке крови матери, становится очевидным, что надо быть хорошо знакомым со всеми этими состояниями, чтобы сделать правильный вывод. Повышення концентрация АФП у матери может наблюдаться в следующих ситуациях.
• Аномалии развития плода: врожденный нефроз, врожденные дефекты кожи, омфалоцеле (exomphalos), расщепление желудка (gastroschisis), аномалия отпочкования конечностей с олигоамнионом, обусловленная, возможно, просачиванием амниотической жидкости.
• Осложнения беременности: многоплодная беременность, замедленное развитие плода, угрожающий аборт, несостоявшийся выкидыш, внутриутробная гибель плода (в III триместре).
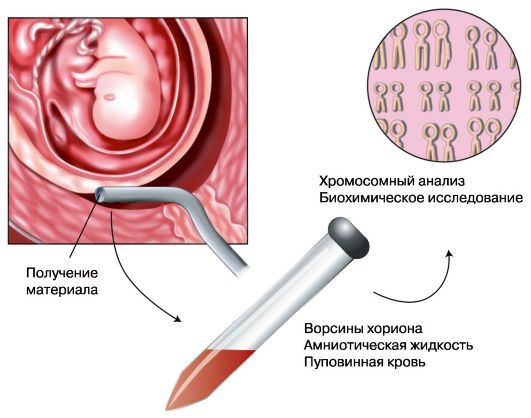 Рис. 6.5. Лабораторная диагностика наследственных болезней
Рис. 6.5. Лабораторная диагностика наследственных болезней
• Злокачественные заболевания матери: первичный рак печени, метастатические опухоли печени, тератокарциномы яичников, рак желудка и поджелудочной железы с метастазами в печень.
• Незлокачественные заболевания матери: острый хронический гепатит, неспецифический цирроз и жировое перерождение печени, врожденная тирозинемия, атаксия-телеангиэктазия. Если при повышенном уровне АФП в сыворотке крови матери возможно исключить аномалии развития плода, осложнения беременности и прочие заболевания матери, перечисленные выше, то в преобладающем большинстве случаев можно ожидать рождения здорового ребенка.