Клиническая фармакология: избранные лекции / С.В. Оковитый, В.В. Гайворонская, А.Н. Куликов, С.Н. Шуленин. - 2009. - 608 с.
|
|
|
|
ЛЕКЦИЯ 6 КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ СРЕДСТВ ЛЕЧЕНИЯ ПНЕВМОНИИ
Пневмония остается одним из самых распространенных заболеваний, на долю которого приходится до 10% всех госпитализаций.
Клинические классы пневмоний
• Амбулаторные (внебольничные, внегоспитальные, домашние).
• Госпитальные (нозокомиальные).
• На фоне иммунодефицита или нейтропении.
• Аспирационные пневмонии.
6.1. ФАРМАКОТЕРАПИЯ ВНЕБОЛЬНИЧНЫХ ПНЕВМОНИЙ
Под внебольничной пневмонией (ВП) понимают пневмонию, приобретенную вне стационара или развившуюся в течение первых 48 ч поле госпитализации в лечебное учреждение. Заболеваемость внебольничной пневмонией составляет 10-12%о и значительно увеличивается у больных преклонного возраста. Летальность колеблется от 1-3% в молодом и среднем возрасте до 15-20% в пожилом и старческом возрасте. Этиология и препараты выбора для лечения внебольничных пневмоний представлены в табл. 6.1.
Учитывая сложности микробиологической диагностики пневмоний, к которым относятся отсутствие мокроты, трудности определения внутриклеточных возбудителей, наличие исходной колонизации дыхательных путей, возможность приема антибактериального средства до момента выявления возбудителя, длительность получения микробиологических результатов возникает необходимость в осуществлении эмпирической антибактериальной терапии.
На сегодняшний день нет убедительных данных, которые позволили бы говорить об очевидном превосходстве одного класса ан- тибиотиков над другим. В этой связи особое значение приобретает выполнение следующих правил антимикробной химиотерапии ВП (Страчунский Л. С., 2005):
- следует применять наиболее активные препараты и с лучшей биодоступностью в группе (например, амоксициллин, амоксициллин/
Таблица 6.1. Этиология и препараты выбора для лечения внебольничных пневмоний
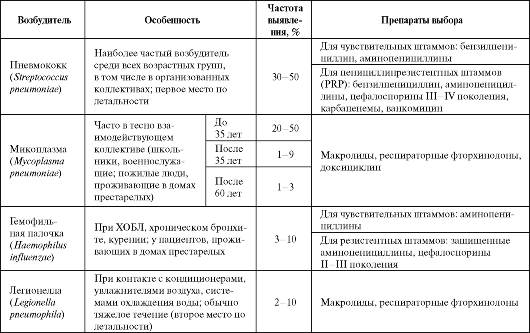
Окончание таблицы 6.1
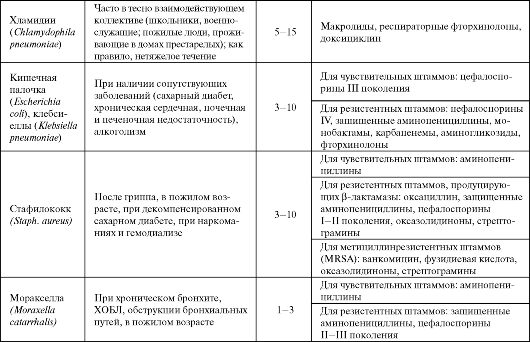
клавуланат; кларитромицин, азитромицин; левофлоксацин, моксифлоксацин);
- применять антибиотики необходимо в высоких дозах (например, амоксициллин по 3 г/сут);
- при тяжелой ВП - комбинация β-лактама и макролида или монотерапия «респираторным» фторхинолоном.
Подобный подход к выбору антибиотика при лечении ВП закреплен, в частности, в согласительных рекомендациях Российского респираторного общества, Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) и Альянса клинических химиотерапевтов и микробиологов (табл. 6.2).
Таблица 6.2. Эмпирическое лечение внебольничных пневмоний у амбулаторных больных (Чучалин А. Г. и др., 2003, в модификации Синопальникова А. И., 2005)
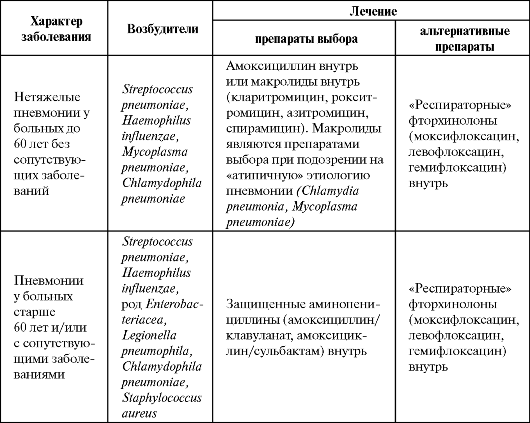
Доксициклин применяется только при подозрении на пневмонию, вызванную Mycoplasma pneumoniae или Chlamydophila pneumoniae. При ВП, вызванных пневмококком, использование данного антибиотика
нерационально, учитывая достаточно высокий уровень резистентности возбудителя к препарату (в РФ более 30%).
Во всех случаях следует отдавать предпочтение пероральному приему антибиотиков, а к назначению парентеральных лекарственных форм прибегают только при невозможности приема препарата пациентом внутрь. Через 3-5 суток оценивают эффективность проводимой антибактериальной терапии, и в случае ее адекватности лечение продолжают до 7-10 дней (при атипичной пневмонии - 14 сут). При этом рентгенологическая картина не может быть полноценным критерием для продления длительности терапии.
Показания к госпитализации при ВП определяются исходя из критериев тяжести состояния пациента в соответствии с классом риска исхода заболевания (табл. 6.3) или по шкале CRB-65.
Критерии оценки риска неблагоприятного исхода ВП (PORT, Fine M. J. et al., 1999)
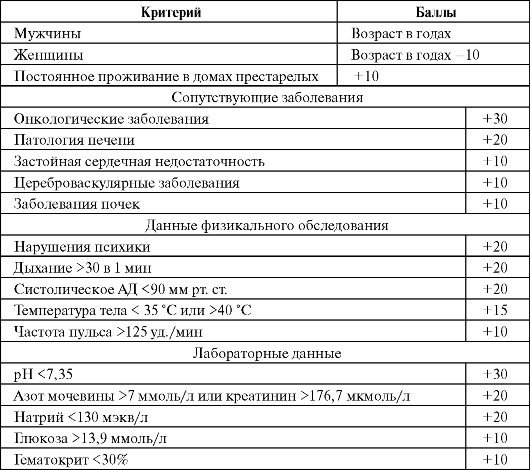
Окончание

Таблица 6.3. Классы риска исхода ВП (Fine M. J. et al., 1997)
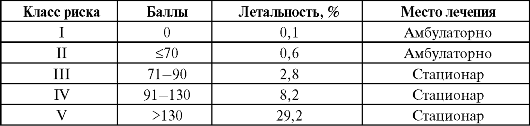
Кроме того, показаниями к госпитализации больных с внебольничной пневмонией могут быть:
1. Пожилой возраст (старше 65 лет).
2. Невозможность адекватного ухода и выполнения всех врачебных предписаний в амбулаторных условиях.
3. Предпочтение пациента или членов его семьи.
4. Наличие хотя бы одного критерия тяжелого состояния (см. выше).
5. Сопутствующие заболевания (см. выше) и состояния:
- алкоголизм;
- иммунодефицит;
- лейкопения;
- гиперлейкоцитоз;
- аспирация;
- септический шок;
- деструкция легочной ткани.
6. Неудовлетворительные или особые социальные условия. Следует учитывать, что при решении вопроса о госпитализации
больного, помимо медицинского аспекта (степень тяжести пневмонии, обострение/декомпенсация сопутствующих заболеваний и др.) следует учитывать и ряд социальных факторов, например, невозможность или сложность ухода за больным (в домашних условиях, при на- хождении в организованных коллективах и т. п.).
В настоящее время при лечении ВП у госпитализированных пациентов доказана целесообразность возможно более раннего парентерального назначения антибиотиков (в первые 4-8 ч от момента
госпитализации). Изначальное пероральное применение антибактериальных препаратов допускается только при наличии пневмонии легкой степени тяжести (табл. 6.4).
Таблица 6.4. Эмпирическое лечение внебольничных пневмоний у госпитализированных больных (Чучалин А. Г. и др., 2003, в модификации А. И. Синопальникова, 2005)
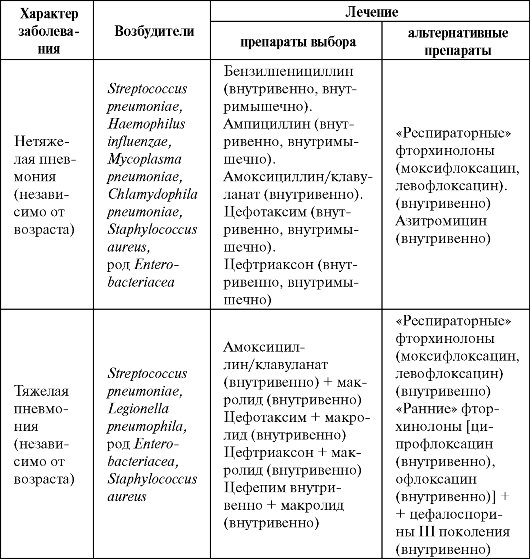
Если при тяжелой пневмонии у госпитализированных больных с ВП есть подозрение на то, что заболевание вызвано Pseudomonas aeruginosa, препаратами выбора являются цефтазидим, цефепим, це- фоперазон/сульбактам, тикарциллин/клавуланат, пиперациллин/та-
зобактам, карбапенемы (меропенем, имипенем). Эти препараты можно применять в монотерапии или комбинации с аминогликозидами поколения.
При наличии деструкции легочной ткани, зачастую вызываемой золотистым стафилококком и клебсиеллами с присоединением анаэробов, возможно добавление метронидазола или клиндамицина.
При подозрении на аспирацию следует назначать амоксициллин/ клавуланат, цефоперазон/сульбактам, тикарциллин/клавуланат, пи- перациллин/тазобактам, карбапенемы.
Через 3-4 суток антибактериальной терапии (иногда дольше) при достижении клинического эффекта (1 - уменьшение выраженности интоксикации; 2 - уменьшение кашля, объема экспекторируемой мокроты, одышки; 3 - нормальная температура тела при двух ее последовательных измерениях с 8-часовым интервалом; 4 - нормальное количество лейкоцитов в периферической крови; 5 - отсутствие нарушений гастроинтестинальной абсорбции) может быть рассмотрен вопрос о переводе больного на пероральный прием антибиотика («ступенчатая терапия»). Ступенчатая терапия (первоначальное назначение препарата парентерально, с последующим переходом на энтеральный путь введения) дает следующие преимущества:
- повышение приверженности больного к лечению;
- уменьшение стоимости антибактериальной терапии;
- снижение риска постинъекционых и нозокомиальных инфекций;
- сокращение сроков пребывания больного в стационаре;
- улучшение качества жизни;
- облегчение условий работы медицинского персонала. Общая длительность лечения антибактериальной терапии у госпи- тализированных больных ВП составляет, как правило, 7-10 суток, а у больных с тяжелыми ВП - 10 суток. Если клинические и/или эпидемиологические данные свидетельствуют в пользу микоплазменной или хламидийной инфекции, продолжительность лечения должна составлять 14 суток. При ВП, вызванной Staphylococcus aureus или бактериями рода Enterobacteriacea, длительность антибиотикотерапии составляет 14-21 суток, а при легионеллезной этиологии - 21 суток.
Иногда сроки антибактериальной терапии приходится определять индивидуально, например, при затяжном течении заболевания или осложненной пневмонии (деструкция, абсцедирование, эмпиема).
Возможные причины затяжного (прогрессирующего) течения пневмоний на фоне антибактериальной терапии:
• Неадекватная антибактериальная терапия.
• Локальная обструкция дыхательных путей (рак, аденома, мукоидная закупорка).
• Кистозный фиброз.
• Бронхоэктазии.
• Нарушения иммунитета.
• Формирование абсцесса легкого.
• Рецидивирующая аспирация (ахалазия, рак пищевода).
• Активизация туберкулезной инфекции.
Для принятия решения о завершении антибактериальной терапии пневмонии используют следующие критерии:
• Нормальная температура тела в течение не менее 2-3 суток.
• Отсутствие интоксикации.
• Стабильность гемодинамики и отсутствие дыхательной недостаточности.
• Отсутствие гнойной мокроты.
• Отсутствие отрицательной рентгенологической динамики.
• Количество лейкоцитов в периферической крови менее 10 × 109/л, нейтрофилов <80%, юных форм <6%.
Сохранение отдельных клинических, лабораторных и/или рентгенологических признаков заболевания не является показанием к продолжению антибактериальной терапии или ее модификации. Как правило, эти признаки разрешаются самостоятельно или под влиянием симптоматической терапии.
Клинические и лабораторные признаки, не являющиеся показанием к продолжению антибактериальной терапии или замене антибиотика (Чучалин А. Г. и др., 2004)
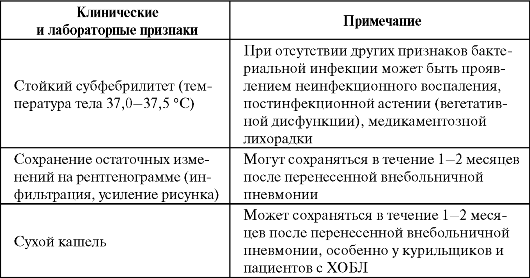
Окончание таблицы
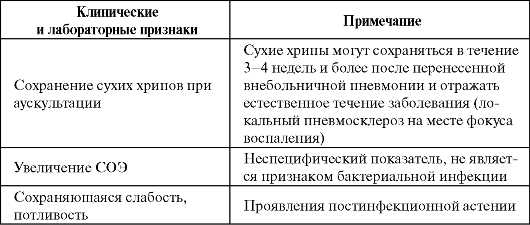
Большое значение для эффективности проводимой антибактериальной терапии имеет резистентность микроорганизмов к использу- емым антибиотикам. Согласно результатам многоцентрового российского исследования ПеГАС-I, β-лактамные антибиотики сохраняют высокую активность in vitro в отношении исследованной популяции Streptococcus pneumoniae: нечувствительность (частота умеренно резистентных и резистентных штаммов) к амоксициллину и амоксицил- лину/клавуланату составляет 0,5%, к цефотаксиму и цефепиму - 2%, к бензилпенициллину - 9%. Устойчивость к макролидам (эритромицину, азитромицину, кларитромицину и др.) колеблется от 2 до 6%. Не выявлено резистентности к «респираторному» фторхинолону ле- вофлоксацину. Самый высокий процент нечувствительных штаммов (27 и 33% соответственно) отмечен к тетрациклину и ко-тримоксазолу. Некоторые обобщенные сведения по резистентности возбудителей пневмоний приведены в табл. 6.5 и 6.6.
Таблица 6.5. Резистентность возбудителей пневмоний

Окончание табл. 6.5
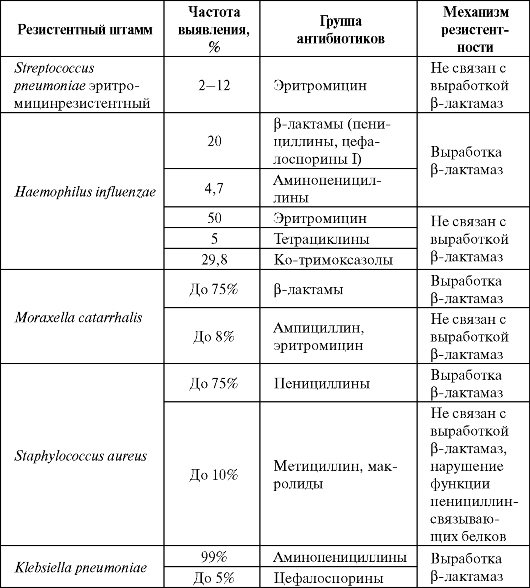
Таблица 6.6. Уровни резистентности Streptococcus pneumoniae к бензилпенициллину и препараты выбора
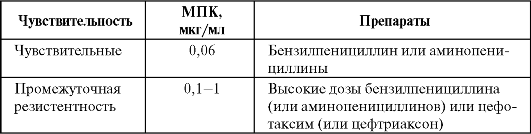
Окончание табл. 6.6
Примечание: МПК - минимальная подавляющая концентрация.
6.2. ФАРМАКОТЕРАПИЯ ГОСПИТАЛЬНЫХ ПНЕВМОНИЙ
Госпитальная (нозокомиальная, внутрибольничная) пневмония (ГП) - бронхолегочная инфекция, развившаяся через 48 ч после госпитализации при условии, что в течение первых двух суток не имелось ни клинических, ни рентгенологических признаков пневмонии.
Клинические классы госпитальных пневмоний
Госпитальная пневмония, развившаяся в отделении общего профиля:
• Ранняя - до 5 дней госпитализации.
• Поздняя - после 5 дней госпитализации.
Госпитальная пневмония, развившаяся в отделении интенсивной терапии и реанимации, ассоциированная с ИВЛ (вентилятор-ассоциированная пневмония, ВАП):
• Ранняя ВАП: ≤ 4 суток после ИВЛ.
• Поздняя ВАП: >4 суток после ИВЛ
С учетом особенностей профиля лечебного отделения и факторов риска ГП могут быть разделены следующим образом:
1. Пневмонии, развившиеся у пациентов в отделении общего профиля без факторов риска или ранние ВАП, развившиеся в ОРИТ.
Возбудители: Streptococcus pneumoniae, род Enterobacteriacea, Haemophilus influenzae, реже Pseudomonas aeruginosa, Staphylococcus aureus (преимущественно метициллинчувствительный, MSSA).
2. Пневмонии, развившиеся у пациентов в отделении общего профиля при наличии факторов риска или поздние ВАП, развившиеся в отделении интенсивной терапии и реанимации ОРИТ.
Возбудители: род Enterobacteriacea, Pseudomonas aeruginosa, Acinetobacter sp., реже Staphylococcus aureus (преимущественно метициллинрезистентный, MRSA).
Госпитальные пневмонии отличаются от внебольничных в первую очередь тем, что вызываются грамотрицательными микроорганизма-
ми (Pseudomonas aeruginosa и Haemophilus influenzae, род Enterobacteriacea), а также Staphylococcus aureus (табл. 6.7). Почти в 50% случаев выявляется сразу несколько микроорганизмов.
Таблица 6.7. Этиология госпитальных пневмоний
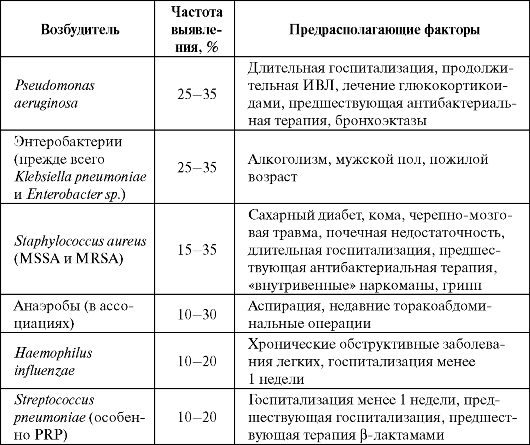
Примечание: PRP - пенициллинрезистентный Streptococcus pneumoniae; MSSA - метициллин чувствительный Staphylococcus aureus; MRSA - метициллинрезистентный Staphylococcus aureus.
Госпитальные пневмонии протекают тяжелее по сравнению с внебольничными и чаще дают летальные исходы. Летальность при ГП достигает 30%, а при инфицировании синегнойной палочкой - до 70%.
Факторами риска развития госпитальной пневмонии являются:
- пожилой возраст;
- хроническая обструктивная болезнь легких;
- тяжелые сопутствующие заболевания;
- нарушения сознания;
- аспирация;
- эндотрахеальная интубация.
Кроме того, частота развития госпитальных пневмоний может увеличиваться при назначении седативных и снотворных средств (повышение риска аспирации), применении глюкокортикоидов (формирование иммуносупрессии), использовании Н2-гистаминоблокаторов и антацидов (возрастание микробной колонизации желудка).
Рекомендации по эмпирической терапии госпитальных пневмоний представлены в табл. 6.8.
Таблица 6.8. Эмпирическое лечение госпитальных пневмоний
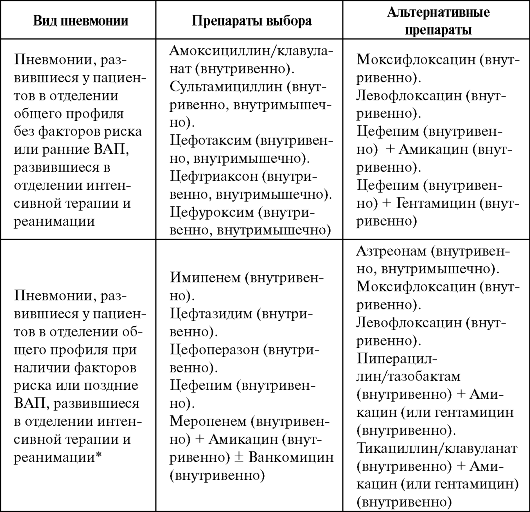
Примечание: * - высокий риск инфицирования полирезистентными возбудителями.
Следует учитывать, что рекомендации по эмпирической терапии ГП являются в значительной степени условными, а проведение такого лечения должно основываться на локальных данных об этиологической структуре госпитальных инфекций и частоте распространения в лечебных отделениях стационара антибиотикорезистентных штаммов.
Лечение ГП следует начинать с внутривенного введения антибиотиков, однако при наличии хорошего ответа некоторые пациенты могут быть переведены на их пероральный прием (в первую очередь это касается линезолида и фторхинолонов, пероральные формы которых биоэквивалентны растворам для внутривенного введения).
Одним из факторов, оптимизирующих антибактериальную терапию ГП, является назначение антибиотиков с учетом их фармакоки- нетических/фармакодинамических особенностей (в частности, зави- симости бактерицидного эффекта препаратов от концентрации или времени экспозиции) (табл. 6.9).
Таблица 6.9. Распределение антибиотиков по фармакодинамическим параметрам (Craig W., 1998)
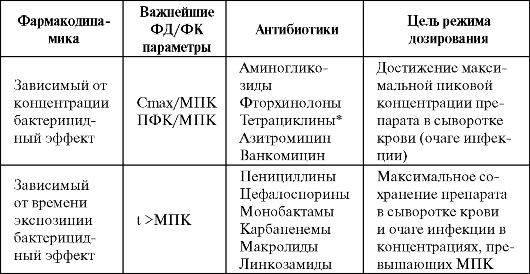
Примечание: * - бактериостатическое действие; ФК - фармакокиненический; ФД - фармакодинамический.
Так, для β-лактамов характерно времязависимое бактерицидное действие, т. е. наибольшая гибель микроорганизмов наблюдается в том случае, если в очаге инфекции как можно дольше поддержи-
вается концентрация антибиотика, превышающая МПК90 в 4 раза. Следовательно, при использовании препаратов данной группы у больных с ГП (особенно находящихся в ОРИТ) более предпочтительна их длительная внутривенная инфузия. Исключение могут составлять карбапенемы, для которых возможен интермиттирующий режим дозирования в силу присутствия у них постантибиотического эффекта и нестабильности в растворах при комнатной температуре в течение суток.
В противоположность β-лактамам, аминогликозиды и фторхинолоны обладают зависимым от концентрации бактерицидным эффектом, а следовательно, максимальная эрадикация микроорганизмов наблюдается при концентрациях препаратов, превышающих МПК в 10 раз (для фторхинолонов) или в 10-12 раз (для аминоглкозидов). Таким образом, оптимальным режимом при терапии аминогликозидами является введение всей суточной дозы однократно внутривенно в виде короткой инфузии, что наряду с хорошей биодоступностью создает концентрации антибиотика, максимально превышающие МПК, в очаге инфекции. Если больной получает комбинированную терапию с аминогликозидами, то при наличии хорошего ответа их можно отменить через 5-7 дней.
Фторхинолоны также могут вводиться один раз в сутки, однако, учитывая их способность в очень высоких концентрациях вызывать нежелательные реакции со стороны нервной системы, можно разделять суточную дозу препаратов на два введения.
При адекватно подобранной антибиотикотерапии состояние больных ГП обычно улучшается через 48-72 ч после начала лечения, поэтому изменять схему антимикробной терапии следует не ранее этого срока, за исключением тех случаев, когда прогрессирует ухудшение состояния или это диктуется результатами бактериологического исследования.
Традиционная длительность лечения ГП составляет 14-21 день, однако если исчезновение клинических признаков заболевания происходит ранее этого срока, то длительность терапии может быть сокращена до 7 дней (кроме случаев инфекции, вызванной синегнойной палочкой). Более длительная антибактериальная терапия на фоне разрешившейся инфекции (14 дней и более) может приводить к колонизации новыми микроорганизмами (прежде всего синегнойной палочкой и энтеробактериями) и рецидиву пневмонии.
В том случае, если эмпирическая антибактериальная терапия подобрана адекватно, клинические признаки инфекции исчезают.
6.3. АСПИРАЦИОННЫЕ ПНЕВМОНИИ
Под аспирационной пневмонией (АП) понимают поражения легких, возникающие вследствие аспирации (микроаспирации) содер- жимого носоглотки, полости рта или желудка с последующим развитием за этим инфекционного процесса. Развитие АП наиболее часто следует ожидать при состояниях, связанных с нарушением сознания (алкогольное опьянение, поражения центральной нервной системы, наркоз), заболеваниях периферических нервов, ряде механических факторов, способствующих аспирации (назогастральное зондирова- ние), травмах лица и шеи, опухолях пищевода, трахеи и т. д.
Аспирационные пневмонии могут быть госпитальными и негоспитальными. В этиологии негоспитальной АП решающая роль принадлежит неклостридиальным облигатным анаэробам, колонизирующим ротоглотку (Bacteroides sp., Peptostreptococcus sp., Fusobacterium sp.), нередко в сочетании с аэробными грамотрицательными бактериями, аэробными грамположительными кокками и микроаэрофильными стрептококками (Streptococcus milleri). При госпитальной АП особое значение приобретает грамотрицательная кишечная микрофлора в сочетании с анаэробами.
Факторы риска аспирационной пневмонии
1. Нарушения сознания различного генеза:
• Острая или хроническая алкогольная интоксикация.
• Передозировка лекарственных средств.
• Инсульт.
• Травмы ЦНС.
• Общая анестезия, включая седацию при проведении эзофагогастроскопии.
2. Наличие патогенных микроорганизмов в носоглотке.
3. Заболевания полости рта:
• Пародонтоз.
• Гингивит.
4. Травмы лица и шеи.
5. Опухоли пищевода, трахеи.
6. Дисфагия вследствие:
• Опухолей пищевода.
• Ахалазии пищевода.
• Трахеобронхиальных свищей.
7. Гастроэзофагеальный рефлюкс (гастроэзофагеальная рефлюксная болезнь).
8. Заболевания центральной и периферической нервной системы:
• Инсульт.
• Миастения.
• Амиотрофический латеральный склероз.
• Болезнь Паркинсона.
• Рассеянный склероз.
9. Механические и ятрогенные факторы, повреждающие верхние отделы дыхательных путей и ЖКТ:
• Эндотрахеальные трубки.
• Назогастральные зонды (в том числе для зондового питания).
• Трахеостома.
10. Рвота различного генеза.
11. Бронхиальная обструкция опухолью или инородным телом. Использование антибиотиков для профилактики АП, особенно
у тяжелых стационарных больных, не оправдано ввиду клинической неэффективности и риска селекции резистентной микрофлоры.
Развившаяся аспирационная пневмония требует незамедлительной антибактериальной терапии. При этом в основном руководствуются эмпирическим выбором препаратов, который представлен в табл. 6.10.
Таблица 6.10. Эмпирическая терапия аспирационных пневмоний (Гайдуль К. В. и др., 2005)
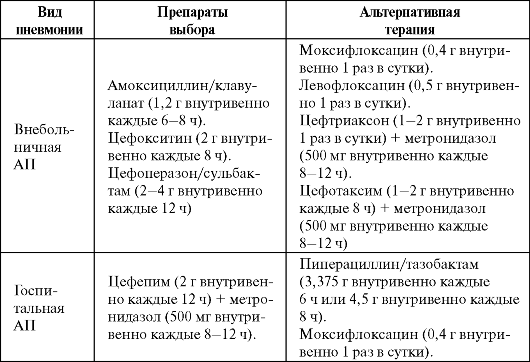
Окончание табл. 6.10

При этом следует отметить, что рутинное включение в медикаментозные схемы лечения АП глюкокортикоидов чаще всего не приводит к желаемому результату, поэтому не показано.
Быстрый ответ на антимикробную терапию - положительная динамика общесоматического статуса и признаки разрешения внутрилегочного инфильтрата через 1-2 дня лечения - больше свидетельствует об остром химическом пневмоните. В этих случаях следует рассмотреть вопрос о прекращении дальнейшего приема антибиотиков.
При адекватно подобранной эмпирической терапии АП стабилизация клинической картины наблюдается через 2-3 дня после начала лечения. Именно в первые 48-72 ч необходимо решить, эффективна ли эмпирическая терапия, продолжить лечение или сменить антибиотик.
«Затяжное» течение с длительным фебрильным периодом и прогрессирование легочной инфильтрации свидетельствуют о развитии осложнений, например, абсцедировании или неадекватности антибактериальной терапии вследствие резистентности возбудителя (например, суперинфекция резистентными штаммами Pseudomonas aeruginosa).
При хорошем ответе на лечение на 7-е сутки отпадает необходимость продолжения антибиотикотерапии. При тяжелом течении заболевания, особенно госпитальной АП, когда процесс вызван резистентными возбудителями, такими как Pseudomonas aeruginosa и Acinetobacter sp., рекомендуется продлить прием антибиотиков до 2-3 недель.
Осложнения в виде абсцессов легких, бронхоплевральных свищей и эмпиемы плевры требуют комплексного подхода к терапии и длительному (от 4 до 8 недель) приему антибактериальных препаратов.
6.4. ПНЕВМОНИЯ НА ФОНЕ НЕЙТРОПЕНИИ
Пневмония на фоне нейтропении чаще всего является госпитальной. К факторам риска развития такой патологии относят:
- лечение цитостатиками;
- применение иммунодепрессантов;
- тяжелые дефекты иммунитета (ВИЧ-инфекция, гипогаммаглобулинемия).
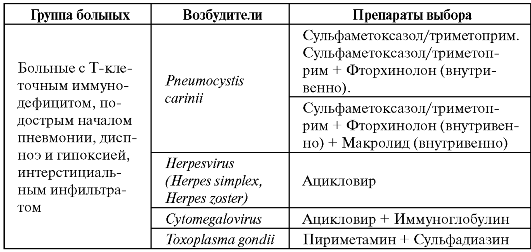
Этиологические факторы пневмоний на фоне нейтропении и препараты выбора представлены в табл. 6.11.
Таблица 6.11. Этиология и препараты выбора для лечения пневмонии на фоне нейтропении
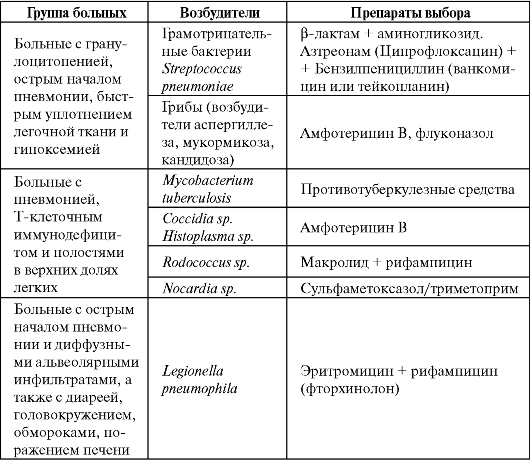
Окончание табл. 6.11
6.5. КРАТКАЯ ХАРАКТЕРИСТИКА АНТИБАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ, ИСПОЛЬЗУЕМЫХ В ТЕРАПИИ ПНЕВМОНИЙ
Для терапии пневмоний в настоящее время наиболее широкое применение нашли антибактериальные препараты следующих групп:
I. Антибиотики:
• β-лактамы.
• Макролиды, азалиды и кетолиды.
• Стрептограмины.
• Линкозамиды.
• Аминогликозиды.
• Тетрациклины.
• Гликопептиды.
• Оксазолидиноны.
II. Синтетические противомикробные средства:
• Фторхинолоны.
• Нитроимидазолы.
К антибактериальным препаратам, используемым для лечения пневмоний, предъявляются следующие требования:
• Высокая активность в отношении возбудителей бронхолегочной патологии.
• Способность хорошо проникать в бронхолегочную ткань.
• Высокая безопасность.
Для препаратов, используемых для лечения внебольничных пневмоний, дополнительными требованиями являются удобство применения в амбулаторных условиях и высокая биодоступность при приеме внутрь.
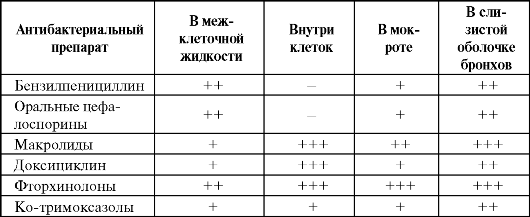
Особенности распределения различных антибактериальных препаратов в бронхолегочной ткани представлены в табл. 6.12.
Таблица 6.12. Распределение некоторых антибактериальных препаратов в бронхолегочной ткани
β-лактамы
Механизм действия β-лактамов связан с нарушением синтеза микробной стенки. Они блокируют активность ферментов транспептидаз и карбоксипептидаз (называемых пенициллинсвязывающими белками, ПСБ), в результате чего ингибируется реакция транспептидации пептидогликана, что приводит к нарушению образования бактериальной стенки и гибели бактерий.
Различия в чувствительности микроорганизмов к β-лактамам обусловлены особенностями строения бактериальной стенки, огра- ничивающей проникновение антибиотиков и выработкой ферментов, разрушающих пенициллины (β-лактамаз).
Биосинтетические пенициллины
• Бензилпенициллин (натриевая, калиевая, новокаиновая, этилендиаминовая соли).
• Бициллины (1 и 5).
• Феноксиметилпенициллин (Оспен).
• Бензилпенициллин бензатин (Экстенциллин).
Из биосинтетических пенициллинов для лечения пневмонии используется бензилпенициллин, обладающий относительно узким спектром действия (табл. 6.15). Фармакокинетика препарата
характеризуется коротким периодом полувыведения (средняя терапевтическая концентрация в крови сохраняется 3-4 ч), что обусловливает необходимость введения бензилпенициллина не реже 6 раз в сутки.
Полусинтетические пенициллины
I поколение:
Пенициллиназоустойчивые (изоксазолилпенициллины):
• Метициллин
• Оксациллин (Бристопен).
• Диклоксациллин (Динапен).
• Клоксациллин (Тегопен).
• Нафциллин (Унипен).
Пенициллиназонеустойчивые (аминопенициллины):
• Ампициллин (Пентрексил).
• Амоксициллин (Амоксиллат).
• Бакампициллин (Пенбак).
• Пенамециллин (Марипен). Комбинированные:
• Аугментин (амоксициллин + клавулановая кислота).
• Сультамициллин (Уназин) (ампициллин + сульбактам).
II поколение (карбоксипенициллины):
• Карбенициллин (Геопен).
• Тикарциллин (Тикар).
• Кариндациллин.
• Карфециллин (Карфексил).
• Флумициллин. Комбинированные:
• Тиментин (тикарциллин + клавулановая кислота).
III поколение (уреидопенициллины):
• Азлоциллин (Секропен).
• Пиперациллин (Пипрацил).
• Мезлоциллин (Байпен).
• Апалциллин. Комбинированные:
• Тазоцин (пиперацилин + тазобактам).
IV поколение (амидинопенициллины):
• Мециллинам.
• Пивамдиноциллин.
• Ацидоциллин.
• Амидиноциллин.
• Бакамдиноциллин.
Аминопенициллины - это полусинтетические пенициллины I поколения с широким спектром действия и высокой чувствительнос- тью к пенициллиназам. Спектр действия аминопенициллинов представлен в табл. 6.13. Амоксициллин по сравнению с ампициллином обладает гораздо большей биодоступностью при пероральном приеме, что позволяет создавать более высокие концентрации препарата в тканях (в том числе легочной). Кроме того, амоксициллин имеет больший период полувыведения, что дает возможность назначать его 3 раза в сутки, а не 4, как ампициллин. Это делает назначение амоксициллина более предпочтительным по сравнению с ампициллином.
В случае выявления ампициллинрезистентных штаммов микроорганизмов используются защищенные аминопенициллины, пред- ставляющие собой комбинацию одного из аминопенициллинов с ингибитором β-лактамаз (клавулановой кислотой или сульбактамом). Введение в комбинацию ингибитора β-лактамаз, не обладающего значимой собственной антибактериальной активностью, позволяет расширить спектр действия антибиотика и повысить его активность.
Изоксазолилпенициллины в нашей стране представлены, в первую очередь, оксациллином. Спектр действия препарата узкий, с преобладающим действием на грамположительную микрофлору (см. табл. 6.13). Оксациллин резистентен к действию β-лактамаз и является средством выбора при стафилококковых (MSSA) пневмониях.
Карбоксипенициллины и уреидопенициллины по спектру действия сходны с аминопенициллинами, но обладают более низкой активностью в отношении грамположительных кокков, хотя превосходят их по влиянию на грамотрицательные палочки, в том числе Pseudomonas aeruginosa. Это позволяло рассматривать их как антипсевдомонадные препараты. По активности в отношении Pseudomonas aeruginosa препараты данных групп располагаются в следующем порядке снижения активности: азлоциллин = пиперациллин >тикарциллин >карбенициллин. При этом предпочтительнее является использование защищенных карбокси- и уреидопенициллинов, так как резистентность к монопрепаратам высокая.
Амидинопенициллины имеют узкий спектр действия (преимущественно на грамотрицательные палочки), не разрушаются β-лактамазами. Используются в основном при инфекциях мочевыводящих путей.
Распределение цефалоспоринов по поколениям определяется спектром их антимикробной активности (см. табл. 6.13). Препараты I поко-
Таблица 6.13. Спектр антибактериальной активности β-лактамных антибиотиков
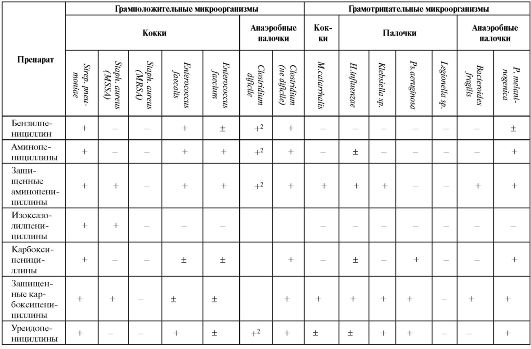
Окончание табл. 6.13
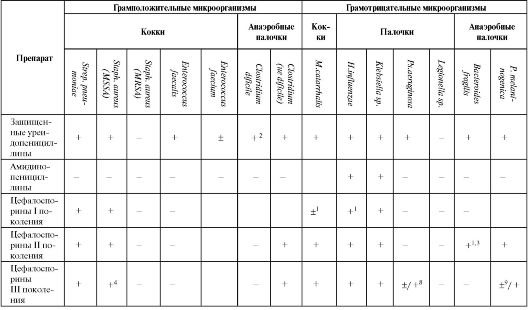
Окончание таблицы 6.13
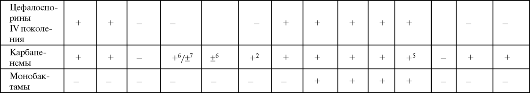
Примечание: 1 - кроме оральных цефалоспоринов; 2 - подавляют при смешанных интраабдоминальных инфекциях и инфекциях малого таза; 3 - кроме цефуроксима; 4 - кроме цефтибутена и цефиксима; 5 - кроме эртапенема; 6 - имипенем; 7 - меропенем, эртапенем; 8 - цефепим, цефтазидим; 9 - цефтриаксон.
Цефалоспорины
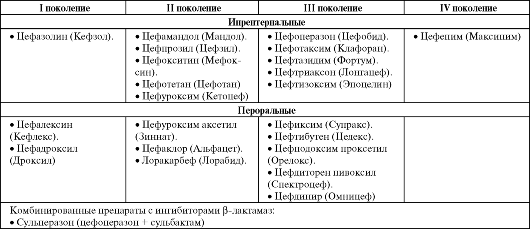
ления активны в отношении грамположительных палочек и кокков, а также грамотрицательных кокков. Наиболее активен цефазолин. Антибактериальная активность парентеральных цефалоспоринов несколько превосходит активность пероральных препаратов, однако все препараты разрушаются β-лактамазами.
По сравнению с цефалоспоринами I поколения, препараты II поколения более активны в отношении грамотрицательных микроор- ганизмов, особенно в отношении гемофильной палочки, сохранив действие на грамположительную микрофлору. Кроме того, они более устойчивы к действию β-лактамаз. Антибактериальная активность пероральных и парентеральных препаратов не различается.
Цефалоспорины III поколения высокоактивны в отношении большинства грамотрицательных микроорганизмов (в том числе неферментирующих микроорганизмов), уступая по действию на грамположительную флору препаратам I и II поколения. К действию большинства β-лактамаз препараты устойчивы. Ряд цефалоспоринов III поколения рассматриваются в качестве антипсевдомонадных препаратов, среди которых наиболее активны цефтазидим и цефоперазон.
На сегодняшний день среди цефалоспоринов препараты IV поколения имеют наиболее широкий спектр действия, сочетая высокую активность цефалоспоринов I-II поколений в отношении Staphylococcus aureus и цефалоспоринов III поколения в отношении грамотрицательных микроорганизмов.
Только один цефалоспорин (цефоперазон) применяется в сочетании с ингибиторами β-лактамаз (сульбактам). Данная комбинация позволяет расширить спектр действия цефалоспорина за счет снижения устойчивости грамотрицательных микроорганизмов, в том числе анаэробных.
Карбапенемы
• Имипенем.
• Меропенем (Меронем).
• Эртапенем (Инванз). Комбинированные препараты:
• Тиенам (имипенем + циластатин натрий).
Карбапенемам присущ наиболее широкий спектр антимикробной активности среди всех β-лактамов (см. табл. 6.13). При этом меропенем наиболее активен в отношении Pseudomonas aeruqinosa, превосхо- дя имипенем и цефалоспорины III поколения. К эртапенему данный возбудитель не чувствителен. По антианаэробной активности все карбапенемы сопоставимы с метронидазолом и превосходят линко-
замиды и цефокситин. Устойчивость к β-лактамазам очень высокая. Карбапенемы - единственные из β-лактамов, способные проявлять постантибиотический эффект.
Препараты данной группы могут рассматриваться в качестве оптимальных средств терапии тяжелых госпитальных инфекций, резис- тентных к цефалоспоринам и фторхинолонам.
Имипенем в организме разрушается почечным ферментом дигидропептидазой, что требует применения его совместно с ингибитором данного фермента - циластатином. Меропенем устойчив к действию дигидропептидазы.
Монобактамы
• Азтреонам (Азактам).
Азтреонам активен только в отношении грамотрицательных микроорганизмов (см. табл. 6.13) и имеет ограниченное применение в клинической практике.
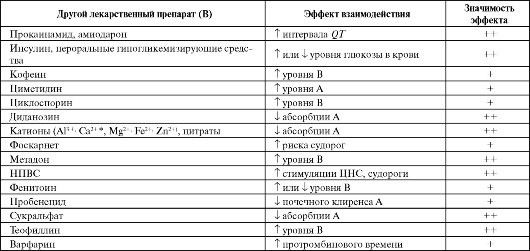
Лекарственные взаимодействия β-лактамов представлены в табл. 6.14.
Таблица 6.14. Лекарственные взаимодействия β-лактамов
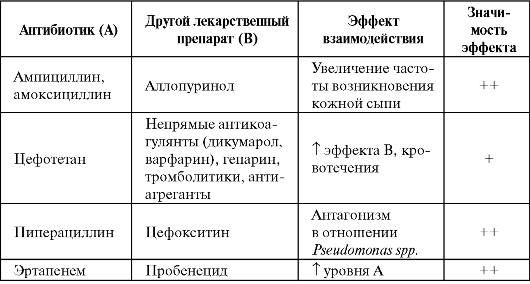
Примечание: «?» - теоретическая возможность; «+» - вероятно значимый; «++» - определенно значимый.
Побочные эффекты β-лактамов
β-лактамы являются одними из наименее токсичных антибиотиков, так как они нарушают синтез микробной стенки, отсутствующей в клетках человека. Тем не менее они могут вызывать следующие по- бочные эффекты:
- аллергические реакции от крапивницы до анафилактического шока (более характерны для биосинтетических пеницилли- нов);
- флебиты при внутривенном введении (все β-лактамы);
- диспепсические явления (тошнота, рвота, диарея) - наиболее часто наблюдаются при применении аминопенициллинов;
- гепатиты, холестаз - для оксациллина, азтреонама;
- нефротоксичность (гематурия, протеинурия) - встречается при применении оксациллина и цефалотина, особенно в комбинации с аминогликозидами;
- неврологические нарушения (головная боль, головокружения, тремор) - возможны при использовании всех β-лактамов;
- суперинфекцию (чаще в виде кандидозов).
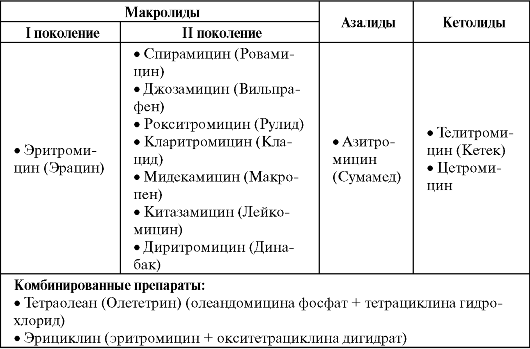
Макролиды, азалиды и кетолиды
Макролиды, азалиды, кетолиды, линкозамиды и стрептограмины имеют сходный механизм действия, который включает связывание препарата с каталитическим пептидилтрансферазным центром рибосомальной 50S субъединицы, что приводит к нарушению реакции транслокации и транспептидации и, соответственно, прекращению синтеза белка. Кетолиды связываются одновременно с двумя учас-
тками на бактериальной рибосоме, что дает им более высокую, чем у эритромицина, антимикробную активность и способность сохранять ее при резистентности к макролидам, линкозамидам, стрептограминам (MLS-резистентность).
Макролидам присущ бактериостатический тип действия, хотя, в некоторых условиях, определяемых видом микроорганизма и бактериальной нагрузкой, эффект может трансформироваться в бактерицидный. Кроме того, для азитромицина характерно так называемое постантибиотическое действие, проявляющееся подавлением бактериального роста на протяжении 5-7 дней после отмены препарата.
Все антибиотики этой группы обладают заметной противовоспалительной активностью за счет снижения индуцированного микро- организмами высвобождения IL-6 и IL-1, а также NO.
Препараты данной группы (в первую очередь азитромицин и кларитромицин) создают высокие концентрации в макрофагах и нейтрофилах и с ними транспортируются в очаг воспаления.
Спектр действия макролидов изменяется в зависимости от принадлежности к тому или иному поколению (табл. 6.15). Так, для препаратов I поколения он сопоставим с биосинтетическими пенициллинами, но при этом важной особенностью является их активность в отношении внутриклеточных атипичных возбудителей (хламидий, микоплазм, легионелл). Макролиды II поколения и азалиды отличаются более высокой антимикробной активностью (в первую очередь в отношении гемофильной палочки), расширенным спектром действия и улучшенной фармакокинетикой.
Кетолиды при близком к макролидам и азалидам антимикробном спектре действия высокоактивны против эритромицинорези- стентных штаммов кокковых микроорганизмов с MLS-резистентнос- тью, которая достаточно широко распространена. Это отличает кетолиды, например, от рокситромицина и азитромицина, которые в случае MLS-резистентности теряют активность подобно эритромицину. Внутри группы резистентность неперекрестная (т. е. микроорганизмы, резистентные к телитромицину, чувствительны к цетромицину).
Лекарственные взаимодействия макролидов, азалидов и кетолидов представлены в табл. 6.16.
Побочных эффектов, возникающих при применении макролидов, немного. Чаще всего наблюдаются:
- со стороны ЖКТ: тошнота, рвота, диарея, холестатический гепатит, псевдомембранозный колит;
Таблица 6.15. Спектр антибактериальной активности противомикробных средств, используемых при лечении пневмоний
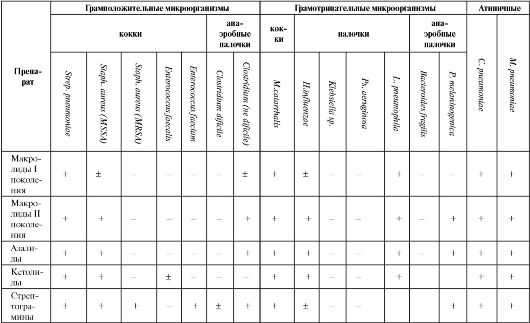
Продолжение табл. 6.15
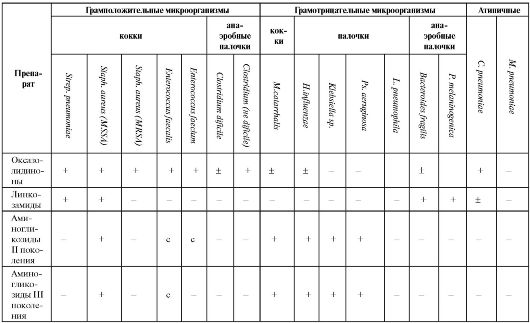
Окончание таблицы 6.15
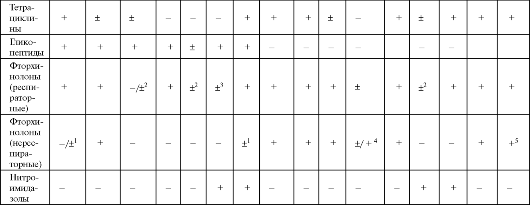
Примечание: С - синергизм с бензилпенициллином, аминопенициллинами, гликопептидами; 1 - офлоксацин, ципрофлоксацин; 2 - моксифлоксацин, гатифлоксацин; 3 - подавляют при смешанных интраабдоминальных инфекциях и инфекциях малого таза; 4 - ципрофлоксацин; 5 - кроме пефлоксацина.
Таблица 6.16. Лекарственные взаимодействия макролидов, азалидов, кетолидов
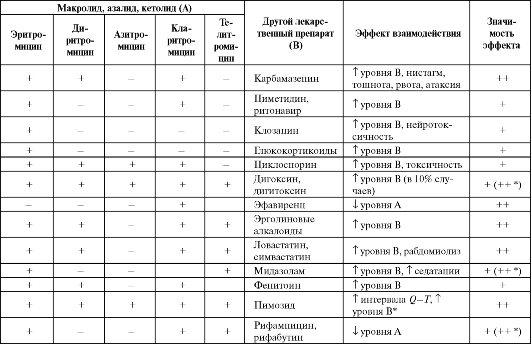
Окончание таблицы 6.16
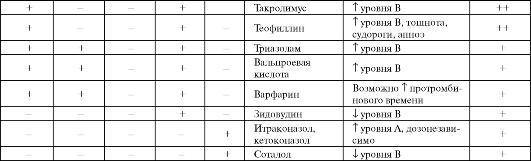
Примечание: «+» - теоретически возможные; «+» - вероятно значимые; «++» - определенно значимые; * - для телитромицина.
- со стороны сердечно-сосудистой системы: удлинение интервала Q-T, желудочковые тахикардии;
- аллергические реакции.
Стрептограмины
• Квинупристин-дальфопристин (Синерцид).
Синерцид представляет собой комбинацию двух молекул: стрептограмина А (дальфопристин) и В (квинупристин) в соотношении 30/70. Оба компонента имеют синергичный эффект в подавлении синтеза белка микроорганизмом, связываясь с разными участками 50S субъединицы рибосом. Интересно, что по отдельности эти антибиотики обладают бактериостатическим эффектом, а их комбинация бактерицидна.
Этот препарат активен против большинства грамположительных бактерий и атипичных возбудителей, таких как микоплазмы, хламидии, легионеллы (табл. 6.17). 90% стафилококков чувствительны к си- нерциду, в том числе метициллинрезистентные штаммы. В 100% он активен против пневмококков независимо от их чувствительности к пенициллину. Квинупристин-дальфопристин также активен против Enterococcus faecium, включая ампициллингентамицин- и ванкомицинрезистентные штаммы. Только Enterococcus fecalis обладает устойчивостью к стрептограминам.
Для предупреждения развития резистентности к квинупристиндальфопристину показанием к его применению является только тяже- лая инфекция, вызванная полирезистентными штаммами Enterococcus faecium и Staphylococcus aureus.
Линкозамиды
• Линкомицин (Линкоцин).
• Клиндамицин (Далацин).
Спектр действия линкозамидов относительно узкий, с преимущественным влиянием на грамположительную микрофлору (см. табл. 6.15). Особое значение имеет их влияние на стафилококки и анаэробы.
Оба препарата практически не отличаются по антибактериальному спектру, но клиндамицин более активен, лучше проникает в ткани (в том числе в легочную) и имеет меньшее число побочных эффектов. Однако период полувыведения клиндамицина короче, чем у линкомицина, что требует либо его более частого назначения (4 раза в сутки), либо увеличения разовой дозы (до 600 мг), что позволяет использовать его 3 раза в сутки.
Наиболее частыми побочными эффектами препаратов являются диспепсические явления, в редких случаях - развитие псевдомембранозного колита.
Аминогликозиды
I поколение:
• Стрептомицин.
• Канамицин (Канацин).
II поколение:
• Гентамицин (Гарамицин).
III поколение:
• Тобрамицин (Бруламицин).
• Амикацин (Амикин).
• Сизомицин (Экстрамицин).
• Нетилмицин (Нетромицин).
• Дибекацин (Нипоцин).
• Паромомицин (Хуматин).
Механизм действия аминогликозидов заключается в необратимом связывании со специфическими белками на 30S субъединице рибо- сом, что блокирует инициацию синтеза белка и нарушает считывание информации с иРНК. Это приводит к ошибочному включению некоторых аминокислот в образующийся полипептид и синтезу нефункционального белка. Кроме того, они способны разрушать полисомы и повреждать энергопродуцирующие системы в микроорганизмах и нарушать функцию клеточной мембраны. Тип действия - бактери- цидный с заметным постантибиотическим эффектом.
Аминогликозиды обладают широким спектром действия с преимущественным влиянием на грамотрицательную микрофлору (см. табл. 6.15). Препараты I поколения эффективны в отношении Mycobacterium tuberculosis и поэтому преимущественно используются для лечения ту- беркулеза.
Гентамицин активен при инфекциях, вызванных Pseudomonas aeruginosa, однако уровень резистентности к нему, по некоторым данным, достигает 70%.
Аминогликозиды III поколения имеют спектр действия, сопоставимый с таковым гентамицина, но проявляют несколько боль- шую активность против Pseudomonas aeruginosa и возбудителей рода Enterobacteriacea. К некоторым препаратам (амикацин, тобрамицин) чувствительны Mycobacterium tuberculosis.
В последние годы рекомендуется однократное введение суточной дозы аминогликозидов II-III поколений, что усиливает их бактери-
цидную активность, продолжительность постантибиотического действия, снижает количество побочных эффектов (особенно со стороны почек) и стоимость лечения.
Побочные эффекты включают нефротоксичность, ототоксичность, мышечные блокады и аллергические реакции. По нефро- и ототок- сичности: гентамицин = амикацин >нетилмицин. Препараты противопоказаны при беременности, так как способны приводить к тяжелым нарушениям слуха у плода.
Тетрациклины

Для лечения пневмоний, вызванных атипичными возбудителями, эффективны антибиотики группы тетрациклина, из которых в насто- ящее время по данному показанию применяется только доксициклин. Препарат, связываясь с 30S субъединицей рибосом, нарушает связывание аминоацил-Т-РНК с ацильным центром и препятствует включению аминокислот в строящуюся пептидную цепь. Доксициклин обладает бактериостатическим типом действия и достаточно широким антимикробным спектром (см. табл. 6.15).
Побочные эффекты наблюдаются в первую очередь со стороны пищеварительной системы (тошнота, рвота, боли в животе, диарея, запоры, транзиторное повышение трансаминаз и билирубина). Препараты противопоказаны при беременности, так как оказывают тератогенное действие. У детей может вызывать гипоплазию зубной эмали и изменение ее цвета.
Гликопептиды
• Ванкомицин (Ванкоцин).
• Тейкопланин (Тейкомицин А2).
• Телаванцин (Телаванс).
Гликопептиды являются базовыми препаратами при лечении госпитальных инфекций, вызванных Staphylococcus aureus (в том числе MRSA) и Enterococcus sp. Механизм действия гликопептидов связан с нарушением образования пептидогликана на более ранних этапах, чем у β-лактамов, повреждением мембран микроорганизмов, подавлением синтеза РНК на уровне рибосом. Тип действия бактерицидный. Спектр действия узкий (см. табл. 6.15). Наиболее высокая антибактериальная активность присуща телаванцину, который эффективен в отношении как MRSA Staphylococcus aureus, так и Staphylococcus aureus с промежуточной чувствительностью к гликопептидам (GISA).
Среди побочных эффектов следует отметить нефротоксичность и ототоксичность. Кроме того, препараты являются либераторами гистамина, что может приводить к развитию гипотензии, тахикардии, гиперемии кожного покрова, зуду. Наименьшее число побочных эффектов дает телаванцин.
Оксазолидиноны
• Линезолид (Зивокс).
• Эперезолид.
Линезолид является первым представителем нового класса антимикробных средств - оксазолидинонов, которые характеризуются уникальным механизмом действия на микробную клетку и отсутстви- ем перекрестной резистентности с другими антибиотиками.
Механизм действия препарата связан с ингибированием синтеза белка в рибосомах бактериальной клетки. В отличие от других антибиотиков, ингибирующих синтез белка, линезолид действует на ран- них этапах трансляции, необратимо связываясь как с 30S, так и с 50S субъединицей рибосом, что нарушает процесс образования 70S комплекса и формирование пептидной цепи. В результате уникального механизма действия не отмечается перекрестной устойчивости микроорганизмов к линезолиду и другим антибиотикам, действующим на рибосомы (макролиды, линкозамиды, стрептограмины, аминогликозиды, тетрациклины и амфениколы).
Линезолид проявляет активность в отношении грамположительных бактерий, в том числе характеризующихся множественной устойчивостью: Staph. aureus (MRSA), Str. pneumoniae (PRP), ванкомицинрезистентных Enterococcus sp. (см. табл. 6.15).
Особенности действия препарата: - выраженная активность против грамположительных бактерий, включая полирезистентные (в том числе ванкомицинрезистентные) штаммы;
- возможность проведения ступенчатой терапии (внутривенно и внутрь) - удобство лечения, лучшая переносимость, реаль- ность ранней выписки и амбулаторного долечивания;
- 100% биодоступность при пероральном приеме;
- лучшее по сравнению с ванкомицином проникновение в ткани;
- лучшая переносимость по сравнению с ванкомицином;
- возможность эффективного применения у тяжелобольных, в том числе с иммунодефицитом.
Большой недостаток - чрезвычайно высокая стоимость лечения препаратом.
Наиболее часто развиваются побочные эффекты со стороны ЖКТ (извращение вкуса, тошнота, рвота, диарея, боли в животе, метеоризм, изменение показателей общего билирубина, трансаминаз, щелочной фосфатазы) и системы кроветворения (анемия, тромбоцитопения, лейкопения, панцитопения).
Фторхинолоны

Фторхинолоны (фторхинолонкарбоновые кислоты) являются одним из наиболее быстро развиваемых классов современных синтети- ческих противомикробных средств. Они являются препаратами широкого спектра действия, активными в отношении грамположительных и грамотрицательных, аэробных и анаэробных микроорганизмов. Грибы, вирусы, трепонемы, большинствопростейшихустойчивы к действию фторхинолонов. Однако при всем сходстве антибактериального спектра существуют различия в чувствительности микроорганизмов как к представителям разных поколений фторхинолонов, так и к тем или иным препаратам внутри поколения.
Клиническая классификация фторхинолонов
I - фторхинолоны с ограниченными показаниями клинического применения, например, при инфекциях мочевыводящих путей (норфлоксацин, пефлоксацин).
II - «классические» фторхинолоны с широкими показаниями к клиническому применению, но недостаточной антипневмокок- ковой активностью (ципрофлоксацин, эноксацин, флероксацин, офлоксацин).
III - фторхинолоны с повышенной активностью против грамположительных и атипичных возбудителей (левофлоксацин, спарфлоксацин).
IV - фторхинолоны с повышенной активностью против грамположительных, атипичных и анаэробных возбудителей (моксифлоксацин, гемифлоксацин, гатифлоксацин).
III и IV поколения еще называют «респираторными» фторхинолонами. От других фторхинолонов их отличает более высокая активность в отношении респираторных возбудителей (Mycoplasma pneumoniae, Chlamydophila pneumoniae, Legionella pneumophila, Streptococcus pneumoniae), способность хорошо проникать в слизистую оболочку ды- хательных путей и секрет бронхов. Наибольшей антипневмококковой активностью обладает моксифлоксацин. Кроме того, препараты имеют улучшенные фармакокинетические показатели, которые позволяют назначать их 1 раз в сутки.
Механизм действия фторхинолонов связан с блокадой ферментов: ДНК-гиразы (топоизомеразы II) и топоизомеразы IV. ДНК-гираза обеспечивает процесс сверхспирализации ДНК, а топоизомераза IV вызывает разъединение цепей ДНК. Ингибирование этих ферментов приводит к необратимому нарушению синтеза ДНК и деления бактериальной клетки. Считается, что главной мишенью фторхинолонов в грамположительных микроорганизмах является топоизомераза IV, а в грамотрицательных - ДНК-гираза. Фторхинолоны II поколения блокируют только ДНК-гиразу, а фторхинолоны III-IV поколений ингибируют два фермента, что и объясняет более широкий спектр действия этих препаратов (табл. 6.17).
Фторхинолоны относительно малотоксичные препараты. Однако при их применении возможны аритмии (удлинение интервала QT), побочные эффекты со стороны ЖКТ (боль в эпигастральной области, тошнота, рвота, понос), аллергические реакции, редко отмечаются головные боли, головокружение, беспокойство, усталость, снижение артериального давления. При применении фторхинолонов возможно развитие фотосенсибилизации. По выраженности этого эффекта пре-
Таблица 6.17. Лекарственные взаимодействия фторхинолонов
Примечание: «+» - теоретическая возможность; «+» - вероятно значимый; «++» - определенно значимый; * - гати-, геми- и моксифлоксацин не взаимодействуют с ионами Са2+
параты можно расположить в ряду: ломефлоксацин = флероксацин > > спарфлоксацин > эноксацин > пефлоксацин > ципрофлоксацин = = гемифлоксацин = левофлоксацин = моксифлоксацин = офлоксацин.
Нитроимидазолы
• Метронидазол (Трихопол).
Среди большого числа производных 5-нитроимидазола в пульмонологической практике используется только метронидазол. Механизм действия метронидазола связан с восстановлением нитрогруппы препарата в анаэробных микроорганизмах под влиянием редуктаз, что сопровождается образованием высокотоксичных для бактериальной клетки соединений. В первую очередь происходит повреждение нуклеиновых кислот, что приводит к гибели микроорганизма.
Препарат обладает узким спектром действия (см. табл. 6.15), с преобладающим действием на анаэробную микрофлору. Побочные эффекты наиболее часто возникают при парентеральном введении и длительном применении (более 1 месяца):
- со стороны ЖКТ (тошнота, рвота, металлический привкус во рту, диарея);
- со стороны ЦНС (головная боль, головокружение, повышенная возбудимость, шум в ушах, судороги);
- со стороны системы кроветворения (лейкопения, тромбоцитопения).
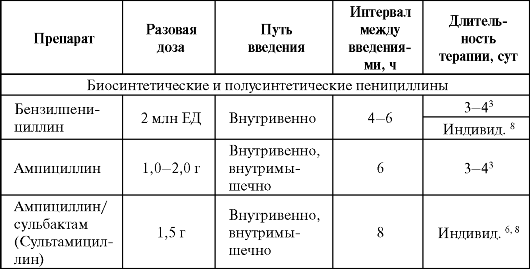
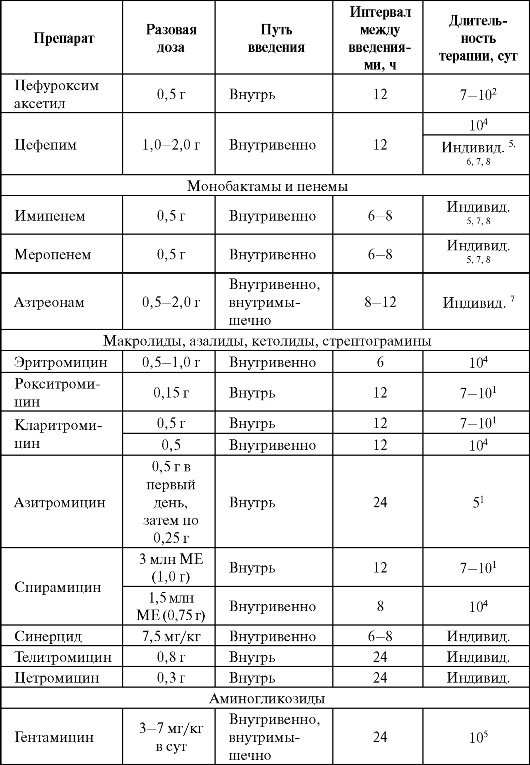
Дозы и ритм введения некоторых антибактериальных препаратов при пневмониях представлены в табл. 6.18.
Таблица 6.18. Дозы некоторых антибактериальных препаратов и кратность их введения при лечении пневмонии у взрослых
Продолжение табл. 6.18

Продолжение табл. 6.18
Продолжение табл. 6.18
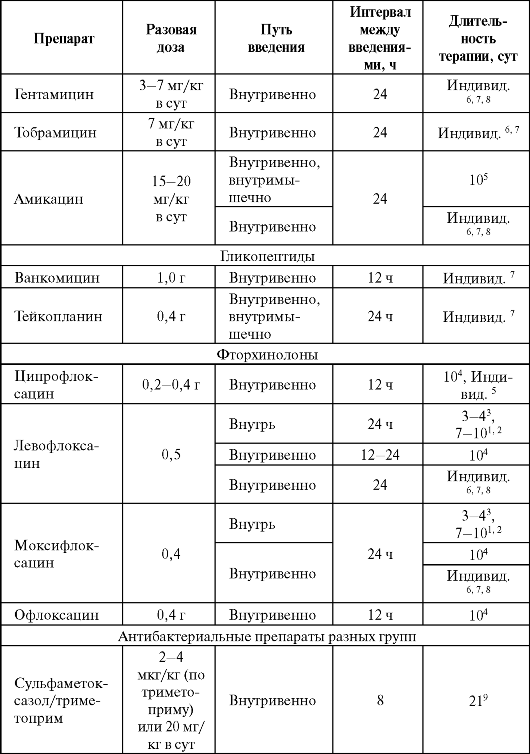
Окончание табл. 6.18
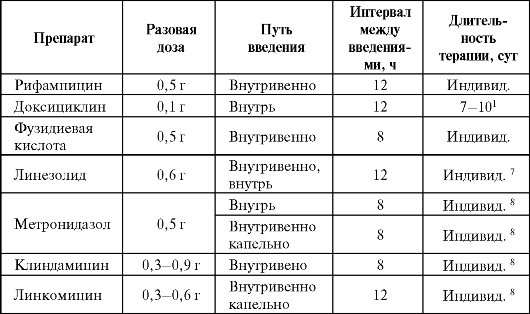
Примечание: 1 - амбулаторная терапия ВП у больных до 60 лет без сопутствующих заболеваний; 2 - амбулаторная терапия ВП у больных старше 60 лет и/или с сопутствующими заболеваниями; 3 - стартовая терапия для лечения ВП легкой и средней степени тяжести у госпитализированных пациентов. В дальнейшем предполагается переход на пероральный антибиотик; 4 - терапия для лечения тяжелых ВП у госпитализированных пациентов; 5 - терапия для лечения тяжелых ВП у госпитализированных пациентов, вызванных синегнойной палочкой; 6 - терапия пневмоний, развившихся у пациентов в отделении общего профиля без факторов риска или ранние ВАП, развившиеся в отделении интенсивной терапии и реанимации; 7 - терапия пневмоний, развившихся у пациентов в отделении общего профиля при наличии факторов риска или поздние ВАП, развившиеся в отделении интенсивной терапии и реанимации; 8 - терапия аспирационных пневмоний; 9 - терапия пневмоцистной пневмонии.
ЛИТЕРАТУРА
Авдеев С. Н. Тяжелая внебольничная пневмония / С. Н. Авдеев, А. Г. Чучалин // РМЖ. - 2001. - Т 9, ? 5. - С. 177-178.
Антибактериальная терапия: практическое руководство / под ред. Л. С. Страчунского, Ю. Б. Белоусова, С. Н. Козлова. - М.: Фармединфо, 2000. - 191 с.
Белобородов В. Б. Проблема нозокомиальной инфекции в отделениях реани- мации и интенсивной терапии и роль карбапенемов / В. Б. Белобородов // Клин. фармакол. и терапия. - 1998. - Т. 7, ? 2. - С. 13-16.
Белоусов Ю. Б. Клиническая фармакология болезней органов дыхания / Ю. Б. Белоусов, В. В. Омельяновский. - М.: Универсум Паблишинг, 1996. - 176 с.
Белоусов Ю. Б. Клиническая фармакология и терапия: руководство для врачей. - 2-е изд., испр. и доп. / Ю. Б. Белоусов, В. С. Моисеев, В. К. Лепахин. - М.: Универсум Паблишинг, 2000. - 539 с.
Белоусов Ю. Б. Современные представления о фармакодинамике теофиллина / Ю. Б. Белоусов, С. В. Лукьянов, А. А. Духанин // Качественная клиническая
практика. - 2002. - ? 3. - С. 4-9.
Гайдуль К. В. Аспирационная пневмония: некоторые аспекты этиологии, патогенеза, диагностики и проблемы рациональной антибактериальной терапии / К. В. Гайдуль, И. В. Лещенко, А. А. Муконин // Интенсивная терапия. -
2005. - ? 3. - С. 169-175.
Гайдуль К. В. Нозокомиальная пневмония: этиология, патогенез, диагностика, лечение и профилактика / К. В. Гайдуль, В. Л. Лимонов, А. А. Муконин. - Новосибирск, 2004. - 27 с.
Гельфанд Б. Р. Нозокомиальная пневмония, связанная с искусственной вентиляцией легких (НПивл), у хирургических больных / Б. Р. Гельфанд, В. А. Гологорский, Б. З. Белоцерковский и др. - М.: Б. и., 2000. - 44 с.
Зубков М.Н. Внебольничные пневмонии: этиологическая диагностика и антимикробная терапия / М. Н. Зубков // РМЖ. - 2004. - Т. 12, ? 5. -
С. 290-296.
Казанцев В. А. Пневмонии: руководство для врачей / В. А. Казанцев, Б. Б. Удальцов. - СПб.: СпецЛит, 2002. - 118 с.
Казанцев В. А. Современные представления о лечении пневмоний / В. А. Казанцев // ФАРМиндекс: ПРАКТИК. - 2003. - Вып. 5. - С. 33-72.
Леонова М. В. Принципы выбора антибактериальных препаратов при ин- фекциях нижних дыхательных путей / М. В. Леонова, А. А. Упницкий // Избранные темы по клинической фармакологии (демонстрационные материалы). - Часть 3. - М.: Б. и., 2005. - С. 99-112.
Лечение
внутрибольничной пневмонии у взрослых / Рекомендации Американского
торакального общества и Американского общества инфекционных болезней,
Новиков Ю. К. Внебольничные пневмонии / Ю. К. Новиков // РМЖ. - 1999. - Т. 7, ? 17. - С. 825-829.
Рациональная антимикробная терапия : руководство для практикующих врачей. - М.: Литтера, 2003. - 1008 с.
Рациональная фармакотерапия заболеваний органов дыхания : руководство для практикующих врачей. - М.: Литтера, 2004. - 874 с.
Синопальников А И. Внебольничная пневмония: диагностика, дифференциаль- ная диагностика и антибактериальная терапия / А. И. Синопальников // Материалы XII Российского национального конгресса «Человек и лекарство». - М., 2005.
Синопальников А И. Рациональная антибиотикотерапия пневмоний: методиче- ские рекомендации для врачей / А. И. Синопальников. - М.: Б. и., 1998. - 18 с.
Стандарты (протоколы) диагностики и лечения больных с неспецифическими заболеваниями легких / под ред. А. Г. Чучалина. - М.: Грантъ, 1999. - 40 с.
Чучалин А. Г. Внебольничная пневмония у взрослых: Практические рекомендации по диагностике, лечению и профилактике / А. Г. Чучалин, А. И. Синопальников, С. В. Яковлев [и др.]. - М.: Б. и., 2004. - 39 с.
Чучалин А. Г. Диагностика и лечение пневмоний с позиций медицины доказательств / А. Г. Чучалин, А. Н. Цой, В. В. Архипов // Consilium Medicum. - 2002. - Т 4, ? 12. - С. 620-644.
Bantar C. Acute community-acquired pneumonia in adults: guidelines for initial antimicrobial therapy based on local evidence from a South American working group (ConsenSur) / C. Bantar, L. Bavestrello, D. Curcio et al. // J. Chemother. - 2002. - Vol. 14, ? 6. - P. 635-636.
Bauer T. Streptococcus pneumoniae in community-acquired pneumonia. How important is drug resistance? / T. Bauer, S. Ewig, M. A. Marcos et al. // Med. Clin. North. Am. - 2001. - Vol. 85, ? 6. - P. 1367-1379.
Bodi M. Impact of Gram-positive resistance on outcome of nosocomial pneumonia / M. Bodi, C. Ardanuy, J. Rello // Crit. Care. Med. - 2001. - Vol. 29, ? 4 Suppl. -
P. N82-N86.
Bradley J. S. Old and new antibiotics for pediatric pneumonia / J. S. Bradley // Semin. Respir. Infect. - 2002. - Vol. 17, ? 1. - P. 57-64.
Bradley S. F. Staphylococcus aureus infections and antibiotic resistance in older adults / S. F. Bradley // Clin. Infect. Dis. - 2002. - Vol. 34, ? 2. - P. 211-216.
Carter A. B. Therapy for ventilator-associated pneumonia / A. B. Carter, D. B. Hornick // Clin. Chest. Med. - 1999. - Vol. 20, ? 3. - P. 681-691.
Chaisson R. E. Guidelines for the management of community-acquired pneumonia / R. E. Chaisson // Am. J. Manag. Care. - 2000. - Vol. 6, ? 23 Suppl. - P. S1211-
S.1215.
Cosentini R. Community-acquired pneumonia: role of atypical organisms / R. Cosentini, P. Tarsia, F. Blasi et al. // Monaldi. Arch. Chest. Dis. - 2001. -
Vol. 56, ? 6. - P. 527-534.
Craig W. Pharmacokinetics/pharmacodynamics parameters: rationale for antibacterial dosing of mice and men / W. Q-aig // Clin. Infect. Dis. - 1998. - Vol. 26. -
P. 1-12.
Cunha B. A. Empiric therapy of community-acquired pneumonia: guidelines for the perplexed? / B. A. Cunha // Chest. - 2004. - Vol. 125, ? 5. - P. 1913-1919.
De Roux A. Viral community-acquired pneumonia in nonimmunocompromised
adults / А. de Roux, M. A. Marcos, E. Garcia et al. // Chest. - 2004. - Vol. 125,
? 4. - P. 1343-1351.
Feldman C. Clinical relevance of antimicrobial resistance in the management of pneumococcal community-acquired pneumonia / C. Feldman // J. Lab. Clin. Med. - 2004. - Vol. 143, ? 5. - P. 269-283.
File T. M. A new dosing paradigm: high-dose, short-course fluoroquinolone therapy for community-acquired pneumonia / T. M. File // Clin. Cornerstone. - 2003. -
Suppl. 3. - P. S21-S28.
File T. M. Appropriate use of antimicrobials for drug-resistant pneumonia: focus on the significance of beta-lactam-resistant Streptococcus pneumoniae / T. M. File // Clin. Infect. Dis. - 2002. - Vol. 34, Suppl. 1. - P. S17-S26.
Fine M. J. A prediction rule to identify low-risk patients with community-acquired pneumonia / M. J. Fine, T. E. Auble, D. M. Yealy, B. H. Hanusa et al. // N. Engl. J. Med. - 1997. - Vol. 336, ? 4. - Р. 243-250.
Fine M. J. Processes and outcomes of care for patients with community-acquired pneumonia: results from the Pneumonia Patient Outcomes Research Team (PORT) cohort study / M. J. Fine, R. A. Stone, D. E. Singer, C. M. Coley et al. // Arch. Intern. Med. - 1999. - Vol. 159, ? 9. - Р. 970-980.
Garau J. Treatment of drug-resistant pneumococcal pneumonia / J. Garau // Lancet Infect. Dis. - 2002. - Vol. 2, ? 7. - P. 404-415.
Golden W. E. CMS releases new standards for community-acquired pneumonia / W. E. Golden, P. Brown, N. Godsey // J. Ark. Med. Soc. - 2003. - Vol. 99, ? 9. - P. 288-289.
Golledge C. Fusidic acid in other infections / C. Golledge // Int. J. Antimicrob. Agents. - 1999. - Vol. 12, Suppl. 2. - P. S11-S15.
Gupta S. K. The role of atypical pathogens in community-acquired pneumonia / S. K. Gupta, G. A. Sarosi // Med. Clin. North. Am. - 2001. - Vol. 85, ? 6. - P. 1349-1365.
Hoffken G. Nosocomial pneumonia: the importance of a de-escalating strategy for antibiotic treatment of pneumonia in the ICU / G. Hoffken, M. S. Niederman // Chest. - 2002. - Vol. 122, ? 6. - P. 2183-2196.
Holgate S. T. New targets for allergic rhinitis - a disease of civilization / S. T. Holgate, D. Broide // Nature Reviews Drug Discovery. - 2003. - Vol. 2, ? 11. - P. 903-915.
Hutt E. Evidence-based guidelines for management of nursing home-acquired
pneumonia / E. Hutt, A. M. Kramer // J. Fam. Pract. - 2002. - Vol. 51, ? 8. - P. 709-716.
Kaplan S. L. Review of antibiotic resistance, antibiotic treatment and prevention of pneumococcal pneumonia / S. L. Kaplan // Paediatr. Respir. Rev. - 2004. - Vol. 5,
Suppl. A. - P. S153-S158.
Koeman M. Ventilator-associated pneumonia: recent issues on pathogenesis, prevention and diagnosis / М. Koeman, van der A. J. Ven, G. Ramsay et al. // J. Hosp. Infect. - 2001. - Vol. 49, ? 3. - P. 155-162.
Leroy O. Hospital-acquired pneumonia: risk factors, clinical features, management, and antibiotic resistance / О. Leroy, S. Soubrier // Curr. Opin. Pulm. Med. - 2004. - Vol. 10, ? 3. - P. 171-175.
Linezolid for gram-positive infections // Drug. Ther. Bull. - 2001. - Vol. 39,
? 7. - P. 54-56.
Loeb M. Pneumonia in older persons / M. Loeb // Clin. Infect. Dis. - 2003. - Vol. 37, ? 10. - P. 1335-1339.
Macfarlane J. T. 2004 update of BTS pneumonia guidelines: what's new? / J. T. Macfarlane, D. Boldy // Thorax. - 2004. - Vol. 59, ? 5. - P. 364-366.
Marras T. K. Antibiotic guidelines for pneumonia in chronic-care facilities / T. K. Marras, C. K. Chan // Clin. Invest. Med. - 2002. - Vol. 25, ? 3. - P. 63-64.
McCullers J. A. Molecular pathogenesis of pneumococcal pneumonia / J. A. McCullers, E. I. Tuomanen // Front. Biosci. - 2001. - Vol. 6. - P. D877-D889.
McGahee W. Staphylococcal infections in the intensive care unit / W. McGahee, F. D. Lowy // Semin. Respir. Infect. - 2000. - Vol. 15, ? 4. - P. 308-313.
Miletin M. S. The use of guidelines for the empirical treatment of hospital-acquired pneumonia / M. S. Miletin, C. K. Chan // Can. Respir. J. - 2001. - Vol. 8, ? 4. -
P. 255-260.
Oosterheert J. J. Severe community-acquired pneumonia: what's in a name? /
J. J. Oosterheert, M. J. Bonten, E. Hak et al. // Curr. Opin. Infect. Dis. - 2003. - Vol. 16, ? 2. - P. 153-159.
Pfeifer L. T. Preventing ventilator-associated pneumonia / L. T. Pfeifer, L. Orser, C. Gefen // Am. J. Nurs. - 2001. - Vol. 101, ? 8. - P. 24AА-GG.
Puli V. Clinical aspects of pneumonia / V. Puli, S. C. Clarke // Br. J. Biomed.
Sci. - 2002. - Vol. 59, ? 3. - P. 170-172.
Smilack J. D. The tetracyclines / J. D. Smilack // Mayo. Clin. Proc. - 1999. -
Vol. 74, ? 7. - P. 727-729.
Smyth A. Pneumonia due to viral and atypical organisms and their sequelae / A. Smyth // Br. Med. Bull. - 2002. - Vol. 61. - P. 247-262.
Tauber M. G. Pneumonia due to resistant Streptococcus pneumoniae / M. G. Tauber // Schweiz. Med. Wochenschr. - 2000. - Vol. 130, ? 49. - P. 1873-1879.
The Sanford Guide to antimicrobial therapy / 34th edition. - Hyde Park: Antimicrobial Therapy inc., 2004. - 155 p.
Tillotson G. Fluoroquinolones as pneumococcal therapy: closing the barn door before the horse escapes / G. Tillotson, X. Zhao, K. Drlica // Lancet. Infect. Dis. - 2001. - Vol. 1, ? 3. - P. 145-146.
Yanagihara K. Japanese guidelines for the management of community-ac- quired pneumonia / K. Yanagihara, S. Kohno, T. Matsusima // Int. J. Antimicrob. Agents. - 2001. - Vol. 18, Suppl. 1. - P. S45-S48.