Клиническая фармакология: избранные лекции / С.В. Оковитый, В.В. Гайворонская, А.Н. Куликов, С.Н. Шуленин. - 2009. - 608 с.
|
|
|
|
ЛЕКЦИЯ 5 КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ СРЕДСТВ, ВЛИЯЮЩИХ НА БРОНХИАЛЬНУЮ ПРОХОДИМОСТЬ
Под бронхообструктивным синдромом понимают состояние, сопровождающееся периодически возникающими приступами экспи- раторной одышки вследствие бронхоспазма, отека слизистой оболочки бронхов и нарушения секреции бронхиальных желез. Бронхообструктивный синдром может возникнуть при многих патологических состояниях, однако в значительном числе случаев основной причиной является бронхиальная астма (БА).
Бронхиальная астма - это хроническое и широко распространенное заболевание, которым страдает 150 миллионов жителей планеты. Распространенность БА колеблется от 4 до 8% (9% детей и около 5% взрослых) с тенденцией к росту в последние годы. Ежегодно астма является причиной 180 ООО смертельныхисходов.
Факторы риска развития БА могут быть разделены на внутренние и внешние. К внутренним факторам относятся наследственная пред- расположенность, обусловленная, очевидно, дисгормональными нарушениями, повышенным синтезом иммуноглобулинов (Ig) класса Ε и особенностями распределения в бронхиальном дереве антигенов главного комплекса гистосовместимости.
Внешними факторами являются:
- неинфекционные аллергены (пылевые, пыльцевые, производственные, лекарственные и др.);
- инфекционные агенты;
- механические и химические ирританты (металлическая, древесная, силикатная, хлопковая пыль, дымы, пары кислот, ще- лочей и др.);
- физические и метеорологические агенты (изменение температуры и влажности воздуха, колебания барометрического давле- ния, магнитного поля и др.);
- нервно-психические воздействия.
До сих пор некоторые вопросы классификации, этиологии и патогенеза БА являются спорными. Тем не менее не вызывает сомнений тот факт, что БА представляет собой хроническое воспаление дыха- тельных путей, лежащее в основе клинической картины заболевания.
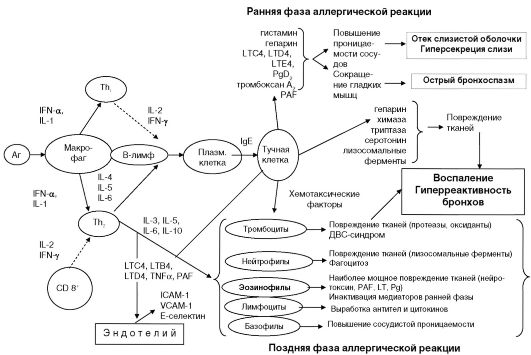
Схема 5.1. Патогенез бронхиальной астмы (Петров В. П., Смоленов И. В., 1998)
В патогенезе БА (схема 5.1) решающую роль играет воспалительная реакция бронхиального дерева.
Попадание аллергена приводит к образованию В-лимфоцитами иммуноглобулина (Ig)E, синтез которого увеличивается некоторыми цитокинами, в частности IL-4, IL-5, IL-6, вырабатываемыми активированными Т-хелперами/индукторами 2-го типа (Тп2-лимфоциты).
Взаимодействие IgE, Fc-рецепторов и аллергена на мембране тучных клеток приводит к высвобождению большого числа биологически активных веществ (БАВ) (гистамин, серотонин, лейкотриены (LT) В4, LTC4, LTD4, LTE4, простагландины (PG) D2, PGF2a, тромбоксан (Тх- А2) и др. Кроме того, тучные клетки секретируют фактор активации тромбоцитов (PAF), TNF-α, IL-3, IL-5, IL-6, IL-10. Все эти факторы вызывают спазм и отек бронхов, повышение сосудистой проницае- мости, усиление миграции гранулоцитов, моноцитов, Т-лимфоцитов и особенно эозинофилов, т. е. инфильтрацию клеточными элементами слизистой оболочки бронхиального дерева (так называемое эозинофильное воспаление).
Решающую роль в повреждении тканей бронхов играют эозинофилы, которые продуцируют PAF, PGD2, PGF2a, лейкотриены, IL-3, нейротоксин. Указанные БАВ оказывают цитотоксическое действие, приводя к десквамации эпителия бронхов, повреждению более глубоких тканей слизистой оболочки. Помимо эозинофилов в процесс повреждения тканей вовлекаются цитотоксические Т-лимфоциты, базофилы и нейтрофилы, тромбоциты, выделяющие ряд цитотоксических факторов (IL-3, IL-5, IL-6, IL-10, лизосомальные ферменты, высокоактивные формы и соединения кислорода).
Эпителиальные, эндотелиальные клетки и фибробласты выделяют ряд цитокинов, усиливающих и поддерживающих воспаление, что приводит к хронизации процесса. При хроническом течении заболевания аллергическое воспаление приобретает новые черты: к тканевому отеку присоединяются гиперпластические и склеротические изменения слизистой оболочки, сопровождающиеся слущиванием эпителия, утолщением базальной мембраны и гипертрофией гладкомышечных волокон. Мелкие сосуды подвергаются лимфоидно-плазмоцитарной инфильтрации.
Значительно возрастает количество бокаловидных клеток, продуцирующих липкую, вязкую слизь, в которой повышается содержание нейтральных гликопротеинов с параллельным увеличением вязко- эластических свойств бронхиального секрета.
Повышение вязкости слизи нарушает подвижность ресничек дыхательного эпителия, снижая их очистительную функцию (у больных БА скорость мукоцилиарного клиренса уменьшается на 10-55%). Вязкий, стекловидный бронхиальный секрет формирует плотные пробки, которые могут облитерировать просвет дистальных бронхов, приводя к развитию обструктивного синдрома, конечной стадией которого является тяжелое обострение БА.
Таким образом, в формировании бронхиальной обструкции можно выделить три фазы:
1 - острый бронхоспазм;
2 - отек слизистой оболочки и гиперсекреция слизи;
3 - воспаление и ремоделирование бронхов.
Кроме того, патогенез БА включает изменение плотности и распределения различных рецепторов в бронхах. В норме в бронхах преобладают β2-адренорецепторы, общее число которых достигает 80-90% от общего числа β-адренорецепторов. При БА снижается как количество этих рецепторов, так и их чувствительность к катехоламинам. Одновременно происходит увеличение плотности аденозиновых Aj-рецепторов и активация холинергической передачи через М3-холинорецепторы.
Определенное значение в патогенезе БА отводится формированию глюкокортикоидной недостаточности, что способствует увеличению уровня гистамина и лейкотриенов, снижению синтеза катехоламинов, повышениютонусагладкой мускулатуры бронхови снижениючувствительности β2-адренорецепторов к катехоламинам.
Прогресс в фармакотерапии БА обусловлен как созданием новых лекарственных препаратов, так и совершенствованием методов ихдоставки.
5.1. ОСНОВНЫЕ ПРЕПАРАТЫ ЛЕЧЕНИЯ БРОНХИАЛЬНОЙ АСТМЫ
Классификация средств лечения бронхиальной астмы
I. Препараты, контролирующие течение БА (средства для поддерживающей терапии БА):
• Глюкокортикоиды.
• Антилейкотриеновые препараты.
• Пролонгированные β2-адреномиметики.
• Пролонгированные ксантины.
• Кромоны.
• Антитела к IgE.
II. Препараты неотложной помощи (средства для облегчения симптомов БА):
• β2-адреномиметики короткого действия.
• Ксантины короткого действия.
• Глюкокортикоиды.
• Ингаляционные М-холиноблокаторы.
III. Вспомогательные препараты:
• Муколитики.
• Мукорегуляторы.
• Мукокинетики.
Классификация систем доставки препаратов в дыхательные пути
I. Дозированные аэрозольные ингаляторы (ДАИ):
• Со спейсером.
• С лицевой маской.
• Активируемые вдохом.
II. Дозированные жидкостные ингаляторы (ДЖИ).
III. Дозированные порошковые ингаляторы (ДПИ):
• Капсульные (спинхалер, ротахалер, дискхалер).
• Резервуарные (турбухалер, циклохалер, изихалер).
• Мультидозирующие (мультидиск).
IV. Небулайзеры (НБ) (в том числе активируемые вдохом):
• Струйные или компрессорные.
• Ультразвуковые.
Новым словом в создании систем доставки лекарственных препаратов в дыхательные пути стало создание ингаляторов типа «soft mist». В данном ингаляторе раствор лекарственного вещества по капилляр- ной трубочке подается к носику специальной формы за счет силы сжатия механической пружины, в результате чего создается медленно перемещающееся и долго сохраняющееся «облачко» мелкодисперсных частиц (менее 5,8 мкм) с высокой респирабельной фракцией. При применении таких ингаляторов не требуется четкой координации вдоха и нажатия на распылитель.
Основные
положения по лечению БА изложены в Глобальной стратегии по лечению и
профилактике бронхиальной астмы (GINA) пе- ресмотра
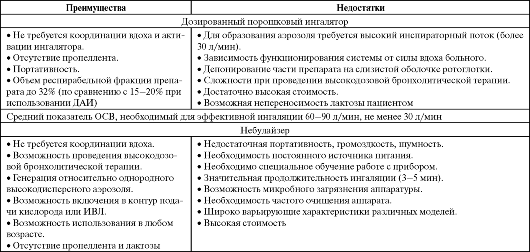
Преимущества и недостатки различных систем доставки препаратов в дыхательные пути (Чучалин А. Г., Авдеев С. Н., 2000; Синопальников А. И., Клячкина И. Л., 2003, с дополнениями)
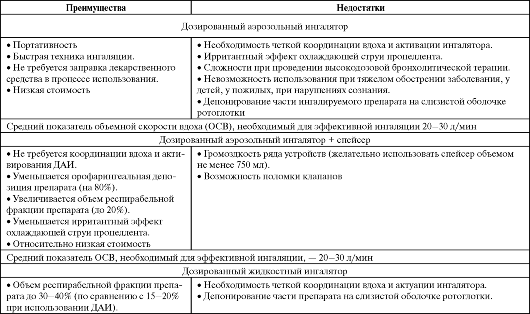
Окончание таблицы
Классификация тяжести БА по клиническим признакам перед началом лечения (GINA, 2006)

С точки зрения экспертов GINA, лечение БА должно преследовать такие цели, как достижение и поддержание контроля над астмой, сохранение физической активности пациентов, поддержание показателей спирометрии на максимально высоком уровне, эффективное предотвращение обострений БА и снижение летальности. При этом терапия БА должна быть максимально безопасной для больных. Неудовлетворительный контроль заболевания обусловливает повышенный риск развития жизнеугрожающих обострений, требующих лечения в отделениях неотложной/интенсивной терапии, а также риск частых госпитализаций и даже смерти.
Для достижения намеченных целей необходимо создание партнерских отношений между пациентом и врачом и обучение больных. В ходе обследования должны быть выявлены, а в последующем минимизированы факторы риска.
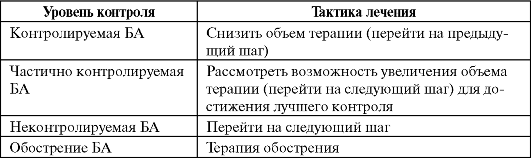
Для правильного выбора характера и объема терапии у больных следует периодически оценивать уровень контроля над заболеванием. Выделяют три уровня контроля заболевания (табл. 5.1).
Таблица 5.1. Критерии контроля бронхиальной астмы (GINA, 2006)
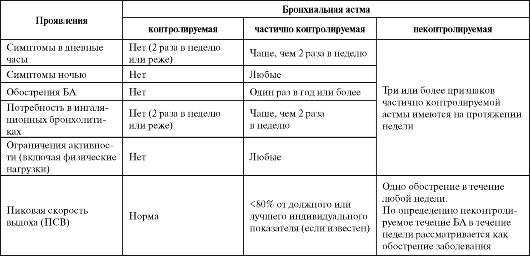
Контролируемое заболевание характеризуется полным отсутствием всех проявлений БА и нормальным уровнем спирометрии. У больных с длительно сохраняющимся контролируемым течением БА можно рассматривать вопрос об уменьшении объема базисной терапии.
Частично контролируемая астма отличается наличием ограниченного числа симптомов. Терапевтическая тактика при данном уровне контроля неоднозначна и зависит от выбора врача: представляется возможным либо увеличить объем терапии в ожидании более полного контроля над заболеванием, либо остаться на прежней базисной терапии.
При неконтролируемой астме увеличение объема терапии является обязательным. Кроме того, неконтролируемое течение БА на протяжении недели рассматривается как обострение и требует лечения по правилам терапии обострений астмы.
Учитывая, что тяжесть течения БА может изменяться с течением времени и зависит не только от характера самого заболе- вания, но и от ответа на лечение, выбор объема фармакотерапии в первую очередь зависит от ответа на проводимую терапию. Фармакотерапия БА является ступенчатой и в процессе лечения может изменяться. Если на определенном уровне лечения не удается достичь стабильного состояния, объем терапии может быть увеличен до достижения контроля. По достижении и сохранении стабильных ре- зультатов в течение 3 месяцев интенсивность фармакотерапии может быть снижена.
GINA описывает ведение больного БА как циклический процесс, который включает периодически повторяющиеся этапы:
- оценка уровня контроля у больного (контролируемая - частично контролируемая или неконтролируемая бронхиальная астма);
- лечение для достижения (или для поддержания) более высокого уровня контроля;
- мониторинг контроля астмы.
К препаратам, контролирующим течение БА (средства для поддерживающей терапии БА), относятся глюкокортикоиды (включая ингаляционные препараты - ИГК), кромоны, антилейкотриеновые препараты, пролонгированные β2-адреномиметики и теофиллины, блокаторы IgE.
Основная цель лечения: в максимально возможные сроки (от нескольких дней до недели) купировать обострение заболевания с последующим проведением эффективной поддерживающей терапии, обеспечивающей высокие показатели качества жизни.
У пациентов с легким и среднетяжелым течением заболевания целью лечения является достижение контроля астмы: минимальное (в идеале отсутствие) число хронических симптомов астмы, включая ночные симптомы; минимизация потребности в β2-адреномиметиках, применяющихся «по требованию»; отсутствие ограничения активности, включая физическую нагрузку; нормальное или близкое к норме значение пиковой скорости выдоха (ПСВ) при суточных колебаниях показателя <20%.
У пациентов с тяжелым течением БА целью лечения является достижение наилучших возможных результатов: наименьшее число симптомов и ограничения по активности; наименьшая потребность в β2-ΑΜ, применяющихся «по требованию»; наилучшие значения и наименьшие суточные колебания ПСВ; минимально возможное число побочных эффектов медикаментозной терапии (основная задача - снижение потребности в системных глюкокортикоидах).
Контроль эффективности проводимого лечения должен осуществляться на основе мониторирования бронхиальной проходимости с помощью пикфлуометра на основании определения ПСВ.
GINA описывает 5 «шагов» в увеличении (или уменьшении у больных с контролируемой астмой) объема базисной (контролирующей) терапии: от применения только лишь короткодействующих β2-ΑΜ (шаг 1) до использования высоких доз ИГК в сочетании с β2-ΑΜ длительного действия, ГКС для приема внутрь и блокаторами IgE (шаг 5) (табл. 5.2).
Начинать терапию БА у больных, ранее не получавших ГК, следует с низких доз ИГК, а при более тяжелом течении астмы - с комбинации длительно действующих β2-ΑΜ и низких доз ИГК. Опираясь на результаты рандомизированных клинических исследований, авторы GINA считают, что для окончательной оценки эффективности низких доз ИГК и решения вопроса о переходе с шага 2 к шагу 3 требуется 3- 4 месяца. Аналогичный процесс перехода с 3-го к 4-му шагу должен занимать 3-4 месяца, а от 4-го к 5-му - 3-6 месяцев, т. е. подбор терапии нередко может длиться более чем полгода. Это очень важно учитывать, так как именно в период подбора дозы ИГК, когда необходимый объем терапии еще не достигнут, риск обострений БА особен- но высок. Удвоение дозы ИГК у больных с недостаточным контролем малоэффективно и более не рекомендуется. В то же время увеличение дозы этих средств в 4 раза сопоставимо по эффективности с коротким курсом ГК внутрь и может применяться у пациентов с неконтролируемым течением бронхиальной астмы.
Таблица 5.2. «Шаги» увеличения или уменьшения объема терапии, контролирующей течение бронхиальной астмы
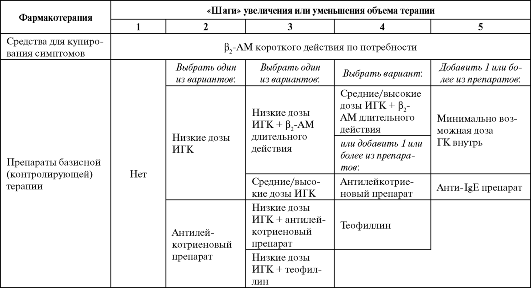
Примечание: ИГК - ингаляционный глюкокортикоид, β2-ΑΜ - β2-,-адреномиметик.
GINA предлагает новый подход в применении комбинированных препаратов: возможность использования комбинации формотерола и будесонида в одном ингаляторе в качестве средства, назначаемого и для базисной терапии, и в режиме «по требованию» для купирования симптомов БА (концепция SMART - Symbicort Maintenance and Reliever Therapy) в том случае, когда для достижения контроля над БА применения только лишь ИГК недостаточно. Такой подход к лечению приводит к уменьшению обострений и улучшению контроля астмы у взрослых и подростков при относительно низких дозах препаратов.
В отношении снижения объема терапии GINA предусматривает следующие положения:
• У больных, получающих только ИГК (средние и высокие дозы), дозу препарата можно снижать на 50% каждые 3 месяца.
• Если у больных, получающих низкие дозы ИГК, было достигнуто контролируемое течение заболевания, можно перейти на прием этих препаратов 1 раз в сутки (будесонид, циклесонид, мометазона фуроат).
• Снижение объема терапии у больных, получающих ИГК и длительно действующие β2-ΑΜ: доза ИГК снижается на 50%, доза длительно действующего β2-ΑΜ остается прежней. В последующем, если контроль сохраняется - можно перейти на низкую дозу ИГК и отменить длительно действующий β2-ΑΜ. В качестве альтернативы возможна комбинация ИГК и длительно действующего β2-ΑΜ. Она может назначаться 1 раз в сутки, или можно отменять длительно действующий β2-ΑΜ при сохранении прежней дозы ИГК.
• Базисную терапию можно полностью отменить, если больной получает минимальную дозу препарата и в течение года его состояние стабильно.
Тактика изменения базисной (контролирующей) терапии бронхиальной астмы
Течение БА может сопровождаться обострениями заболевания, тяжесть которых может варьировать от легких до жизнеугрожающих. Наиболее ранним симптомом обострения БА является увеличение потребности в ингаляциях бронхолитиков, а в целом для развития обострения БА обычно требуется около 5 суток. Под обострением астмы понимается не только быстрое и значительное ухудшение состояния больного, но и отсутствие контроля над астмой в течение недели (наличие любых 3 из перечисленных ниже признаков):
- появление симптомов в дневные часы хотя бы 3 дня в неделю;
- все случаи, при которых заболевание ограничивает повседневную активность больного;
- все случаи пробуждения ночью из-за симптомов БА;
- потребность в ингаляциях β2-ΑΜ короткого действия хотя бы 3 дня в неделю;
- снижение ПСВ/OФВ1 ниже 80% от должного.
Любое обострение бронхиальной астмы требует пересмотра фармакотерапии. Терапия обострений в амбулаторной практике скла- дывается из назначения ГК внутрь и применения высоких доз ингаляционных β2-ΑΜ. Быстрое и значительное увеличение объема противовоспалительной терапии одновременно с появлением первых симптомов (этот короткий период времени получил образное название «окна возможностей») способно предотвратить развитие обострения БА. Тактика лечения обострений в амбулаторных условиях и в стационаре представлена на схемах 5.2 и 5.3.
Нельзя откладывать обращение за следующим этапом медицинской помощи, если:
- пациент находится в группе высокого риска летального исхода от БА;
- обострение является тяжелым (т. е. после применения β2-aдpe- номиметика ПСВ остается менее 60% от должной или наилучшей индивидуальной величины);
- нет быстрой и сохраняющейся на протяжении не менее 3 ч явной реакции на бронхолитик;
- отсутствует улучшение в пределах 2-6 ч после начала лечения ГК;
- отмечается дальнейшее ухудшение состояния.
К группе пациентов, имеющих высокий риск смерти, связанной с БА, относятся:
- больные с угрожающими жизни обострениями БА, потребовавшими интубации и проведения искусственной вентиляции легких;
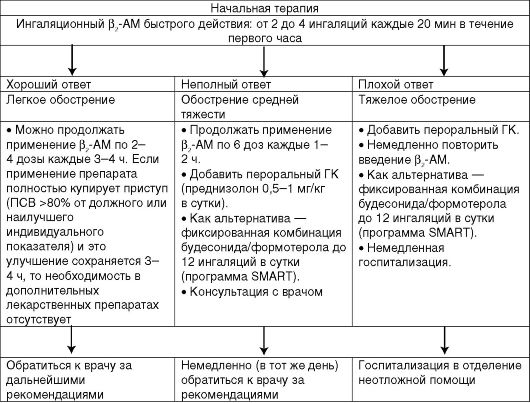
Схема 5.2. Лечение больных с обострением бронхиальной астмы на дому (GINA, 2002, 2006)
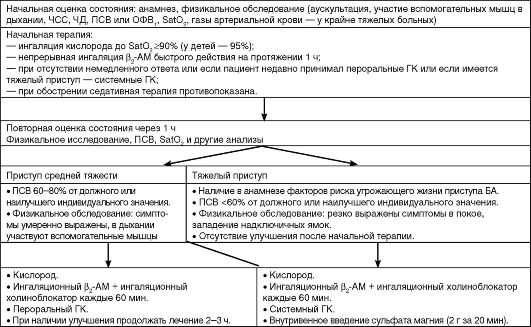
Схема 5.3. (начало)
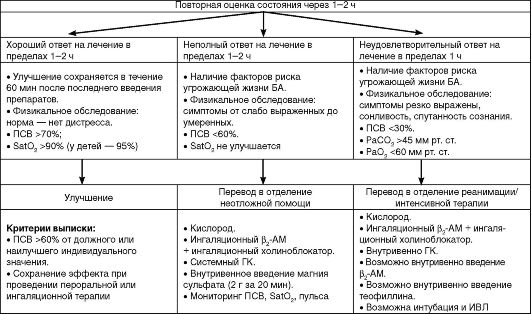
Схема 5.3. (продолжение)
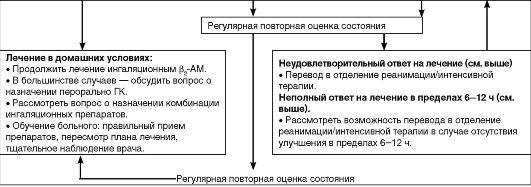
Схема 5.3. (окончание) Лечение больных с обострением бронхиальной астмы в стационаре (GINA, 2006)
- пациенты, госпитализированные или обращавшиеся за неотложной помощью по поводу БА в течение последнего года;
- больные, принимающие в настоящее время или недавно прекратившие прием пероральных ГК;
- лица, не получающие ИГК;
- больные с повышенной потребностью в ингаляционных β2-ΑΜ короткого (быстрого) действия, особенно нуждающиеся более чем в одном баллончике сальбутамола (или эквивалента) в месяц;
- пациенты с психическим заболеванием или психосоциальными проблемами в анамнезе, включая употребление седативных препаратов;
- пациенты, не выполнявшие назначения врача.
Препараты, контролирующиетечение бронхиальной астмы (средства для поддерживающей терапии БА)
Глюкокортикоиды
Бытовавшая ранее точка зрения о высокой потенциальной опасности развития системных побочных эффектов при назначении ГК в настоящее время пересмотрена, что обусловлено созданием новых препаратов и лекарственных форм ГК, совершенствованием методов их доставки. На сегодняшний день ИГК являются наиболее эффективными препаратами, применяемыми для поддерживающей терапии БА. Препараты данной группы эффективно уменьшают выраженность симптомов БА, улучшают функцию легких и качество жизни, уменьшают бронхиальную гиперреактивность, угнетают воспаление в дыхательных путях, снижают частоту и тяжесть обострений и частоту смертей при БА. Однако эти препараты не излечивают БА, и в случае их отмены у части пациентов в течение недель или месяцев происходит ухудшение состояния.
Препараты глюкокортикоидныхгормонов, используемые для лечения БА
1. Для ингаляционного применения
1.1. Негалогенированные:
• Будесонид (Пульмикорт).
• Циклесонид (Алвеско).
1.2. Галогенированные: 1.2.1. Хлорированные:
• Беклометазона дипропионат (Бекотид).
• Мометазона фуроат (Асманекс).
1.2.2. Фторированные:
• Флунисолид (Ингакорт).
• Триамцинолона ацетонид (Азмакорт).
• Флутиказона пропионат (Фликсотид). 1.3. Комбинированные:
• Серетид (флутиказон + сальметерол).
• Симбикорт (будесонид + формотерол). 2. Для системного применения
• Преднизолон (Дегидрокортизол).
• Метилпреднизолон (Урбазон).
• Гидрокортизон.
Механизм лечебного действия глюкокортикоидов при БА, прежде всего, связан с их противовоспалительной активностью. Глюко- кортикоиды взаимодействуют со своими рецепторами, локализованными в цитоплазме клеток-мишеней. После этого происходит модификация образовавшегося комплекса (диссоциация с белком теплового шока) и его проникновение в ядро, где он связывается со специфическим глюкокортикоидотвечающим элементом (GRE, glucocorticoid response elements), представляющим собой сегмент ДНК. В результате изменяется транскрипционная активность генамишени, что приводит к повышению или снижению образования иРНК, а следовательно, различных регуляторных белков, в том числе липокортинов.
Липокортины представляют собой семейство белков, обладающих высокой биологической активностью, одним из проявлений которой является блокада фермента фосфолипазы А2. Следствием этого является подавление образования простагландинов, тромбоксана (Тх) А2 и лейкотриенов в начальной стадии (на этапе образования арахидоновой кислоты).
Благодаря подавлению активности ряда транскрипционных факторов (например, NFkB), в значительной степени угнетается синтез интерлейкинов (IL-1, ΙL-3, ΙL-4, ΙL-5, ΙL-6, ΙL-8), TNF-α, играющих большую роль в развитии воспаления, снижется количество и угнетается активность эозинофилов, тучных клеток, Т-лимфоцитов. Нарушается синтез IgE и опосредованное им высвобождение медиаторов аллергии.
ГК активируют ангиотензинпревращающий фермент и нейтральную эндопептидазу, в результате чего ускоряется разрушение бради- кинина, участвующего в регуляции сосудистого тонуса, свертывания крови и процессов воспаления. Кроме того, под влиянием препаратов
происходит уменьшение проницаемости стенки сосудов за счет повышения синтеза вазокортина и понижения образования или активности лизосомальных ферментов (протеаз, гиалуронидазы и др.), гистамина, брадикинина, простагландинов и лейкотриенов. Дополнительным механизмом противовоспалительного эффекта ГК является нарушение ими синтеза молекул адгезии: ICAM (intercellular adhesion molecules), VCAM (vascular cell adhesion molecule), ЕLАМ-1 (endothelial-leukocyte adhesion molecule 1), принимающих участие в процессах миграции клеток и фиброзирования тканей.
Препараты ГК повышают плотность и активность β2-адренорецепторов в бронхах, которые в свою очередь запускают каскад внутриклеточных биохимических реакций, приводящих к активации глюкокортикоидного рецептора при меньших концентрациях ГК. Помимо этого, происходит увеличение плотности и активности А2-аденозино- вых рецепторов, через которые также реализуется бронходилатирующее действие.
Таким образом, клинические эффекты ИГК включают снижение выраженности симптомов заболевания, улучшения показателей спирометрии, понижения бронхиальной гиперреактивности, предотвращение обострений и ремоделирования бронхиальной стенки.
Высокая клиническая эффективность и безопасность ИГК в значительной мере определяется особенностями их фармакокинетики. Препараты данной группы обладают достаточно низкой системной биодоступностью, которая складывается из ингаляционной биодоступности и пероральной (определяемой количеством вещества, попавшего в ЖКТ после ингаляции). При использовании ДАИ примерно 10-30% дозы препарата поступает в легкие (80% попадает в ЖКТ), а затем в системный кровоток и печень, где и подвергается метаболизму. Важную роль в формировании общей системной биодоступности ИГК играет эффект «первого прохождения», благодаря которому происходит инактивация большей части лекарственного вещества и снижается выраженность его системного действия.
Перспективным направлением является создание препаратовпролекарств (например, циклесонида), превращающихся в активные соединения под влиянием эстераз в легких. Этот препарат в виде пролекарства обладает почти в 8 раз более низким сродством к глюкокортикоидным рецепторам по сравнению с дексаметазоном, в то время как после активации данный показатель возрастает более чем в 100 раз. Это позволяет резко снизить количество системных и местных (орофарингеальных) побочных эффектов.
Некоторые показатели фармакокинетики и фармакодинамики ингаляционных глюкокортикоидов представлены в табл. 5.3.
Для большинства пациентов, как правило, достаточно назначения ИГК 2 раза в сутки, а при легкой степени БА возможно однократное назначение (при использовании будесонида, циклесонида или мо- метазона фуроата). У некоторых больных при тяжелом течении БАдопустим четырехкратный режим дозирования. Однако для того чтобы достигнуть контроля над клиническими проявлениями заболевания, предпочтительнее добавить препарат другого класса к ИГК, а не увеличивать дозу последнего. Клинический эффект от проводимой ингаляционной глюкокортикоидной терапии наступает как правило че- рез 3-5 дней (иногда до 4 недель), поэтому начальный эффект от ИГК может быть оценен не ранее чем через 1 неделю после начала лечения препаратом. Максимальная выраженность эффекта развивается, как правило, к 6-й неделе лечения.
Одними из лучших препаратов ИГК на сегодняшний день могут быть признаны флутиказона пропионат и будесонид, обладающие небольшой биодоступностью, выраженным эффектом «первого прохождения», высокой клинической эффективностью и оптимальным соотношением цена/эффективность. Наиболее близкими по свойствам к этим препаратам являются недавно появившиеся на рынке мометазона фуроат (ДПИ, 220 мкг/доза), который может назначаться один раз в сутки, и циклесонид, который при однократном применениии (160 мкг 1 раз в сутки) имеет такой же профиль активности, как и флутиказона пропионат (250 мкг 2 раза в сутки).
Системное назначение ГК показано только при купировании приступов БА или тяжелом неконтролируемом течении заболевания. В первом случае препараты назначаются перорально или внутривенно. Предпочтительным для купирования обострения является системное применение преднизолона, метилпреднизолона или гидрокортизона, а для длительной терапии - преднизолона или метилпреднизолона. Эти препараты обладают минимальным минералокортикоидным эффектом, относительно коротким периодом полу выведения, незначительным действием на поперечно-полосатую мускулатуру. При приступе БА средние дозы препаратов составляют для преднизолона 40-50 мг/сут, метилпреднизолона 40-80 мг/сут, а гидрокортизона 200- 400 мг/сут в течение 5-10 дней в зависимости от тяжести обострения. При обострении БА иногда удается ограничиться использованием только пероральных форм ГК, которые могут быть также эффективны, как и внутривенное введение гидрокортизона.
Таблица 5.3. Сравнительная характеристика ингаляционных глюкокортикоидных препаратов
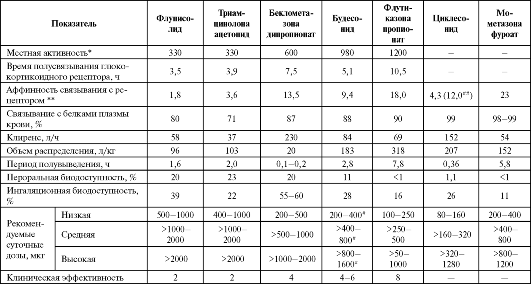
Примечание: * - в тесте по МакКинзи (McKenzie), где 1 - активность дексаметазона; ** - активность дексаметазона принята за 1; # - для порошкового ингалятора; ## - для активного метаболита циклесонида.
Начало действия ГК при однократном внутривенном введении развивается примерно через 4 ч (субъективное улучшение состояния), а объективное улучшение отмечается приблизительно через 6 ч. После приема внутрь ГК появления развернутого терапевтического эффекта следует ожидать примерно через неделю.
После купирования симптомов обострения и возвращения показателей функции легких к наилучшим индивидуальным показателям больного возможно постепенное снижение дозы или отмена системного ГК.
Если принято решение о проведении длительной поддерживающей терапии, доза ГК определяется тяжестью заболевания. Средние суточные дозы преднизолона составляют 20-40 мг, метилпреднизолона - 16-32 мг, которые, с учетом суточного ритма активности надпочечников, необходимо принимать в утренние часы однократно (или 2/3 дозы утром и 1/3 вечером) ежедневно либо через день.
При лечении обострения БА наряду с применением системных ГК обязательным условием эффективности проводимой терапии является одновременное назначение высокихдоз ИГК, так как монотерапия системными ГК не позволяет полностью контролировать активность воспалительного процесса в легочной ткани и вызывает большее количество побочных эффектов. В этом случае применение ИГК приводит к раннему (от 1 до 2 ч) клиническому и функциональному улучшению, если используются их повторные дозы с интервалом не более 30 мин на протяжении 90-120 мин. Даже если ГК для системного введения остаются терапией выбора при обострении БА, использование ИГК (например, флутиказона или будесонида каждые 15-30 мин через дозированный ингалятор со спейсером или в небулизированной форме) может быть эффективным у большинства тяжелых пациентов. Минимально эффективные дозы ИГК через небулайзер составляют: для флутиказона 500 мкг каждые 15 мин, для будесонида - 800 мкг каждые 30 мин. Применение будесонида через ингалятор со спейсером по 400 мкг каждые 30 мин также эффективно, а использование больших доз флутиказона через ингалятор (по 500 мкг каждые 10 мин) может быть еще более полезным. Длительность терапии ИГК должна составлять не менее 90 мин, но предполагается большая польза от более продолжительного лечения. Кроме того, при тяжелом течении БА дополнительно назначают ингаляционные β2-ΑΜ пролонгированного действия.
Побочные эффекты при использовании ГК зависят от способа доставки препарата. Назначение низких и средних доз ИГК не оказыва-
ет значимого влияния на функциональное состояние надпочечников, метаболизм костной ткани, иммунологические показатели, углеводный обмен и функции ЖКТ, т. е. является достаточно безопасным. Современные данные позволяют утверждать, что у взрослых применение ИГК в дозе, не превышающей эквивалентной 400 мкг/сут будесонида, не сопровождается системными побочными эффектами.
Среди побочных эффектов ИГК преобладают кандидоз ротовой полости (до 34%), дисфония (5-10%), рефлекторный кашель и бронхоспазм. Для профилактики побочных эффектов ИГКрекомендуется:
- использование спейсера;
- полоскание ротовой полости;
- назначение наименьших эффективных доз;
- у женщин в постменопаузе предусмотреть возможность применения препаратов кальция или витамина D для профилактики остеопороза.
Системная глюкокортикоидная терапия сопровождается большим количеством побочных эффектов, частота развития которых представлена в табл. 5.4.
Относительные противопоказания к применению системных глюкокортикоидов
• Сахарный диабет.
• Психические заболевания.
• Эпилепсия.
• Язвенная болезнь желудка и двенадцатиперстной кишки.
• Выраженный остеопороз.
• Тяжелая артериальная гипертензия.
• Тяжелая сердечная недостаточность.
Побочные эффекты системных глюкокортикоидов
• Миопатии, остеопороз.
• Неустойчивое настроение, психоз.
• Ульцерогенноедействие, кровотечения, эзофагиты, диспепсии.
• Задержка полового созревания, дисменорея, стероидный диабет, замедление роста у детей.
• Артериальная гипертензия, задержка натрия и воды, отеки, гипокалиемия.
• Активизация оппортунистических и латентных инфекций.
• Глаукома, задняя субкапсулярная катаракта.
• Гипергликемия, гиперлипидемия, повышение аппетита, кушингоидный синдром, отрицательный азотистый баланс.
Лекарственные взаимодействия системных глюкокортикоидов
• Азатиоприн (увеличение риска побочных эффектов).
• Амфотерицин В (гипокалиемия).
• Антациды (уменьшение всасывания глюкокортикоидов).
• Барбитураты (снижение эффекта глюкокортикоидов).
• Дифенгидрамин (ускорение инактивации глюкокортикоидов).
• Нестероидные противовоспалительные препараты (увеличение повреждения ЖКТ).
• Гексамедин, дифенин, карбамазепин (ускорение инактивации глюкокортикоидов в печени).
Особенности применения ГК при беременности и лактации
Системные глюкокортикоиды хорошо проникают через плаценту.
Природные и нефторированные препараты в целом безопасны для плода и не ведут к внутриутробному развитию кушингоидоподобного синдрома и угнетению гипоталамо-гипофизарно-надпочечниковой системы.
При кормлении грудью низкие дозы глюкокортикоидов, эквивалентные 5 мг преднизолона, не представляют опасности для ребенка, так как глюкокортикоиды плохо проникают в грудное молоко.
Более высокие дозы препаратов и их длительный прием могут вызвать задержку роста и угнетение гипоталамо-гипофизарно-надпо- чечниковой системы.
Таблица 5.4. Сравнительная характеристика побочного действия глюкокортикоидных препаратов
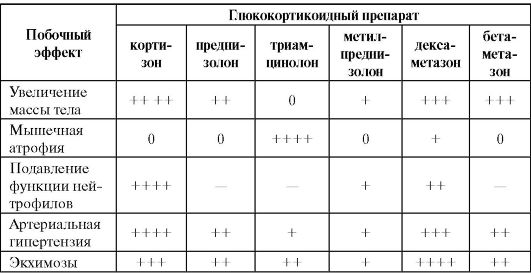
Окончаниетабл. 5.4
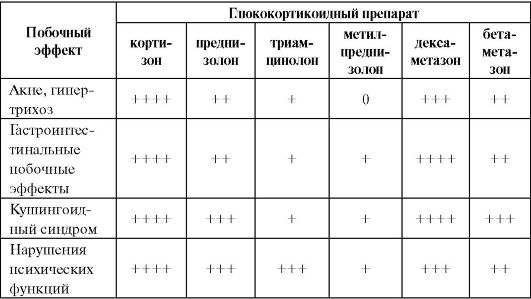
Примечание: 0 - эффект не отмечен; «+» - встречается редко; «++» - встречается достаточно часто; «+++» - встречается часто; «++++» - встречается очень часто.
Побочные эффекты обычно обратимы и исчезают после снижения доз или отмены препарата. По показаниям назначают гипотен- зивные или седативные средства, препараты калия, мочегонные средства. Обострение хронической инфекции предупреждают назначением адекватных доз антибиотиков. Катаболическое действие глюкокортикоидов можно уменьшить анаболическими средствами и препаратами кальция.
При длительной, особенно многолетней, глюкокортикоидной терапии развивается стойкая, но обратимая недостаточность коры надпочечников, которая может приводить в ряде случаев к смерти в связи с неожиданными стрессорными ситуациями (травмы, операции и т. д.). Поэтому даже при умеренной дополнительной нагрузке на надпочечники целесообразно повысить суточную дозу ГК на 1 таблетку (начинать повышение сделует за 1 день до увеличения нагрузки, заканчивать - через 1 день после ее прекращения).
Антилейкотриеновые препараты
Антилейкотриеновые препараты (АЛТП) включают блокаторы синтеза лейкотриенов и блокаторы лейкотриеновых рецепторов.
Блокаторы лейкотриеновых рецепторов
• Зафирлукаст (Аколат).
• Монтелукаст (Сингуляр).
• Пранлукаст (Онон).
Блокаторы синтеза лейкотриенов (ингибиторы 5-липоксигеназы)
• Зилеутон (Зифло).
Данные клинических исследований показали, что АЛТП обладают слабым и вариабельным бронхорасширяющим эффектом, но уменьшают выраженность симптомов БА, включая кашель, улучшают функцию легких, снижают активность воспаления в дыхательных путях и частоту обострений БА.
Они могут использоваться как препараты второго ряда для лечения взрослых пациентов с легкой персистирующей БА, а также в монотерапии БА в том случае, если применение ИГК противопоказано или недостаточно эффективно (но в этом их эффект уступает низким дозам ИГК). Кроме того, АЛТП могут быть добавлены в состав комбинированной терапии для потенцирования действия ИГК при среднетяжелой и тяжелой БА. Однако такое добавление менее эффективно, чем присоединение ингаляционного β2-ΑΜ длительного действия.
Механизм действия блокаторов лейкотриеновых рецепторов связан с уменьшением действия лейкориенов на бронхолегочную ткань. Лейкотриены (ГТ) представляют собой продукты метаболизма арахидоновой кислоты по липооксигеназному пути. В настоящее время выделяют четыре основных типа лейкотриенов: LТВ4, LТС4, LTD4, LТЕ4. Основной синтез лейкотриенов в организме осуществляется альвеолярными макрофагами, нейтрофилами и эозинофилами в легких, аорте, тонкой кишке. Образование лейкотриенов резко повышается при БА, что влечет за собой усиление секреции слизи, подавление ее клиренса, увеличение выработки катионных белков, повреждающих эпителиальные клетки. Возрастает миграция клеток, участвующих в развитии аллергического воспаления (активированные Т-клетки, тучные клетки, эозинофилы), повышается проницаемость сосудов, происходит сокращение гладких мышц бронхов. По бронхоконстрикторному действияю лейкотриены превосходят все известные эндогенные БАВ.
Выделяют 3 типа рецепторов для лейкотриенов, два из которых относятся к так называемым цистеиниловым (для LТС4, LTD4, LТЕ4), а третий является нецистеиниловым (для LТВ4). Цистеиниловые рецепторы в свою очередь подразделяются на два подтипа. В легочной ткани человека обнаружены пока только рецепторы 1-го типа, через которые реализуется
бронхоконстрикция, повышение проницаемости сосудов, гиперсекреция слизи, хемотаксис. Цистеиниловые рецепторы 2-го типа ответственны преимущественно за проницаемость сосудистой стенки. Через нецисте- иниловый рецептор для LTB4 опосредуется хемотаксис лейкоцитов, адгезия нейтрофилов к эндотелию, высвобождение протеаз и образование высокоактивных форм и соединений кислорода нейтрофилами.
Блокаторы лейкотриеновых рецепторов являются селективными блокаторами цистеиниловых LT рецепторов 1-го типа, что обуслов- ливает их умеренное бронхолитическое и противовоспалительное действие. Несколько иной механизм действия у зилеутона, который ингибирует липооксигеназу, нарушая синтез лейкотриенов из арахидоновой кислоты.
Блокаторы лейкотриеновых рецепторов обладают линейной кинетикой, поэтому их сывороточные концентрации прямо пропорцио- нальны дозе и предсказуемы на основе данных однократного приема.
Зафирлукаст назначают по 20-40 мг 2 раза в сутки. Одновременный прием с пищей уменьшает биодоступность препарата, поэтому его следует применять за 1 ч до или через 2 ч после еды. Монтелукаст на- значают по 10 мг 1 раз в сутки независимо от приема пищи, пранлукаст по 225 мг 2 раза в сутки, зилеутон по 600 мг 4 раза в сутки. Последние иследования показали, что монтелукаст обеспечивает сопоставимый с флутиказоном контроль БА.
До недавнего времени эти препараты не использовались для купирования приступов бронхиальной астмы, однако исследования, проведенные в последние годы, показали, что после внутривенного введение монтелукаста (7 или 14 мг) уже через 10 мин после инъекции уменьшается одышка, а через 20 мин увеличивается жизненная емкость легких (в среднем на 15%). Данный эффект сохраняется более 2 ч. Окончательное суждение о возможности применения блокаторов лейкотриеновых рецепторов для купирования приступов БА можно будет сделать после проведения крупных клинических исследований.
АЛТП достаточно хорошо переносятся больными и редко приводят к развитию серьезных осложнений. Побочные эффекты включают астению, лихорадку, диспепсические явления, головокружения и головную боль, транзиторное повышение трансаминаз (особенно для зилеутона), заложенность носа, кашель, чихание.
Хотя АЛТП в целом уступают ИГК по противовоспалительной активности и имеют более высокую стоимость, они являются перспективным классом препаратов благодаря уникальному механизму действия и высокой безопасности.
Р2-адреномиметики
1. Препараты короткого действия:
• Фенотерол (Беротек).
• Сальбутамол (Вентолин).
• Тербуталин (Бриканил).
2. Препараты пролонгированногодействия:
• Формотерол (Форадил).
• Сальметерол (Серевент).
• Индакатерол.
3. Комбинированные препараты: 3.1. С глюкокортикоидами:
• Серетид (флутиказона пропионат + сальметерол).
• Симбикорт (будесонид + формотерол). 3.2.С М-холиноблокаторами:
• Беродуал (ипратропия бромид + фенотерол).
• Комбивент (ипратропия бромид + сальбутамол). Механизм действия препаратов связан с активацией ими β2-адре-
норецепторов, локализованных в гладких мышцах бронхов, бронхиальных железах, эпителиальных и тучных клетках, базофилах. В результате этого происходит запуск ряда внутриклеточных процессов, приводящих к расслаблению гладкой мускулатуры бронхов (за счет цАМФ-зависимого снижения уровня внутриклеточного кальция (схема 5.4) и прямого взаимодействия с калиевыми каналами), увеличению выделения сурфактанта бронхиальными железами, улучшению дренажной функции бронхов и некоторому подавлению секреции ме- диаторов воспаления. Преобладающим является бронхолитический эффект препаратов.
Основные различия среди β2-ΑΜ определяются их характером взаимодействия с рецептором и длительностью действия. Сравнительная характеристика некоторых β2-ΑΜ по влиянию на β-адренорецепторы представлена в табл. 5.5.
Таблица 5.5. Влияние β2-ΑΜ на β-адренорецепторы
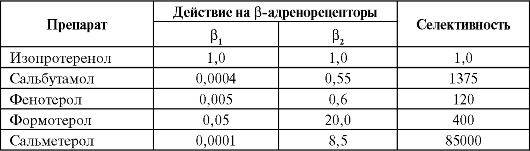
В настоящее время ингаляционные β2-ΑΜ короткого (быстрого) действия являются средствами выбора для купирования бронхоспазма, в то время как препараты длительного действия являются средс- твами базисной терапии БА. Применявшийся ранее неселективный β-адреномиметик орципреналин в настоящее время не применяется в связи с большим количеством побочных эффектов.
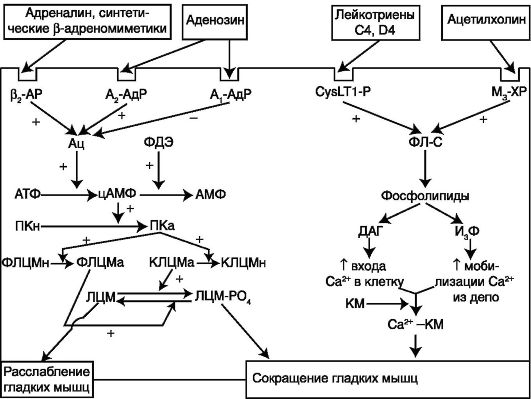
Схема 5.4. Роль различных рецепторов в регуляции тонуса бронхов: АР - адренорецептор; АдР - аденозиновый рецептор; CysLT-P - лейкотриеновый рецептор; ХР - холинорецептор; Ац - аденилатциклаза; цАМФ - циклический аденозинмонофосфат; ФЛ - фосфолипаза; ДАГ - диацилглицерол; ФДЭ - фосфодиэстераза; ПК - протеинкиназа (а - активная, н - неактивная); КМ - кальмодулин; И3Ф - инозитолтрифосфат; ЛЦМ - легкие цепи миозина; КЛЦМ - киназа легких цепей миозина (а - активная, н - неактивная); ФЛЦМ - фосфатаза легких цепей миозина (а - активная, н - неактивная)
Следует учитывать, что ингаляция одной дозы β2-ΑΜ приводит к развитию не более 50% максимально возможного эффекта, после второй ингаляции около 80%, после третьей - 83-85%. Каждая последу-
ющая ингаляция существенно не улучшает бронхиальную проводимость, но увеличивает концентрацию препарата в крови, что ведет к появлению побочных эффектов. Оптимальная дозировка - две инга- ляционные дозы. Ингаляция производится на максимуме вдоха, сделанного после наибольшего выдоха с последующей задержкой дыхания после ингаляции. Основные сведения по применению препаратов представлены в табл. 5.6.
Регулярное использование β2-ΑΜ короткого действия для лечения БА не рекомендуется, так как это может привести к ухудшению объективных показателей легочной функции и контроля за течением БА. Очевидно, что использование пациентом более одной упаковки β2-ΑΜ короткого действия в месяц - это сигнал того, что контроль астмы не оптимален и требует коррекции проводимой терапии.
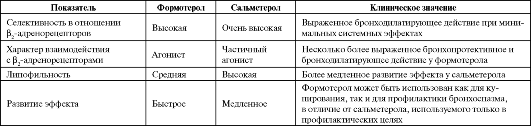
В конце 1980-х годов созданы два новых ингаляционных пролонгированных β2-ΑΜ - формотерол и сальметерол, длительность действия которых составляет не менее 12 ч, что позволило понизить кратность их назначения до 2 раз в сутки. В отличие от традиционных адреномиметиков, эффект сальметерола наступает позже (через 30-60 мин), что очевидно связано с его высокой липофильностью, поэтому он используется только для профилактики приступов бронхоспазма. Эффект формотерола развивается так же быстро, как и у β2-ΑΜ короткого действия, что позволяет его применять как для купирования, так и для профилактики приступов бронхоспазма.
Сальметерол и формотерол оказывают сходное бронхолитическое действие и обладают примерно одинаковой способностью предотвращать бронхоспазм. В то же время для формотерола характерна дозозависимость эффекта, что дает возможность для подбора минимально эффективной индивидуальной дозы. Однако по сравнению с сальметеролом к действию формотерола чаще развивается толерантность. Различия в фармакологических свойствах пролон- гированных β2-ΑΜ представлены в табл. 5.7.
Большие надежды возлагаются на новый β2-ΑΜ пролонгированного действия - индакатерол. Его важными отличиями от других пролонгированных препаратов является длительность действия до 24 ч и минимальный уровень побочных эффектов (в том числе и влияния на интервал QT).
Ингаляционные β2-ΑΜ длительного действия не должны использоваться в монотерапии БА, так как нет данных о том, что эти препа-
Таблица 5.6. Некоторые фармакокинетические показатели и применение ингаляционных β2-адреномиметиков
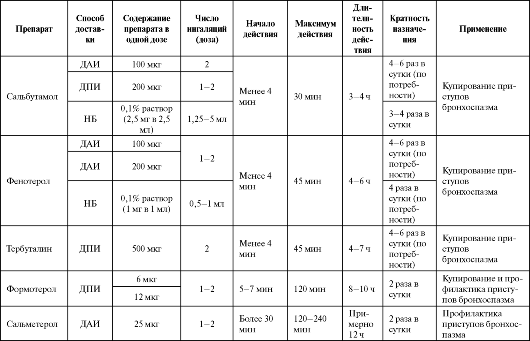
Окончание таблицы 5.6

Примечание:* - дозы препарата, использовавшиеся в различных исследованиях; ДАИ - дозированный аэрозольный ингалятор; ДПИ - дозированный порошковый ингалятор; НБ - небулайзер
Таблица 5.7. Некоторые фармакологические свойства формотерола и сальметерола
раты угнетают воспаление при БА и показано, что длительная монотерапия сальметеролом может увеличивать риск смерти в небольшой группе больных (в том числе у больных с редким генотипом β-адре- норецептора). Поэтому именно сочетанное применение β2-ΑΜ пролонгированного действия с ИГК на сегодняшний день является наиболее оптимальным в комбинированной терапии БА в том случае, если применение средних доз ИГК не позволяет достичь контроля над БА. Это позволяет уменьшить выраженность ночных и дневных симптомов БА и количество обострений заболевания, улучшить функцию легких и качество жизни больных, снизить потребность в β2-ΑΜ короткого (быстрого) действия, а также минимизировать риск развития возможных побочных эффектов препаратов. Комбинированная терапия β2-ΑΜ и ИГК позволяет достичь контроля над БА у бóльшего числа больных, быстрее и при меньшей дозе ИГК по сравнению с монотерапией ИГК. Некоторые эффекты, лежащие в основе взаимопотенцирующего действия препаратов данных групп, представлены в табл. 5.8.
Таблица 5.8. Некоторые эффекты β2-адреномиметиков и ингаляционных глюкокортикоидов при комбинированном применении

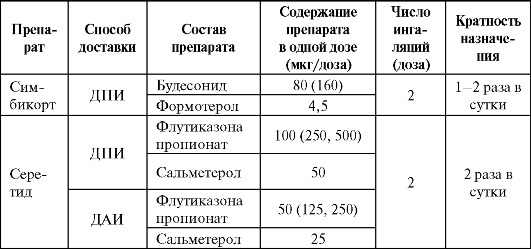
Существуют комбинированные препараты с фиксированным составом ИГК и β2-ΑΜ - серетид и симбикорт (табл. 5.9), эффективность и безопасность которых сопоставимы. Данные комбинации превосходят ИГК и пролонгированные β2-ΑΜ, используемые в разных ингаляторах по клинической эффективности и уровню контроля БА, влиянию на приверженность пациента к лечению и качество жизни. В ближайшее время ожидается появление фиксированной комбинации, содержащей индакатерол и мометазон. Добавление пролонгированного β2-ΑΜ к глюкокортикоиду (или использование фиксированной комбинации) у больных с БА любой степени тяжести является более эффективной схемой терапии по сравнению с увеличением дозы ИГК.
Таблица 5.9. Особенности состава и применения фиксированных комбинаций ингаляционных глюкокортикоидов и β2-адреномиметиков
Новым подходом к терапии БА стало использование комбинации формотерола и будесонида в одном ингаляторе в качестве средства, назначаемого как в качестве препарата, контролирующего течение заболевания, так и для купирования симптомов БА (концепция SMART - Symbicort Maintenance and Reliever Therapy) в том случае, когда для достижения контроля над БА применения только ИГК недостаточно. Такой подход к лечению приводит к уменьшению обострений и улучшению контроля астмы у взрослых и подростков при относительно низких дозах препаратов.
Концепция SMART заключается в том, что больной, получающий будесонид/формотерол (симбикорт 160/4,5 мкг) в качестве базисной терапии (как правило, по одной ингаляции утром и вечером), вместо дополнительных ингаляций β2-ΑΜ короткого действия по потребности использует также симбикорт. Учитывая, что при ухудшении состояния потребность в бронхолитике короткого действия для купирования симптомов возрастает, пациент, заменив β2-ΑΜ короткого действия симбикортом, не только эффективно купирует симптомы БА, но и восполняет дефицит ИГК, на фоне которого обычно развивается обострение. Кроме того, используя SMART, больные при необходимости имеют возможность увеличить суточную дозу ИГК более чем в 4 раза. Число дополнительных ингаляций определяется состоянием пациента, но общее число ингаляций симбикорта не должно превышать 12 в сутки. После стабилизации состояния потребность в допол-
нительных ингаляциях быстро исчезает, таким образом, общие дозы ИГК при SMART оказываются в среднем меньше, чем при стандартных способахдозирования.
Побочные эффекты, возникающие при применении комбинированных препаратов, не отличаются от таковых при использовании препаратов по отдельности.
Побочные эффекты β2-адреномиметиков
• Синдром «рикошета», проявляющийся парадоксальным бронхоспазмом. Возникает как правило при регулярном применении β2-ΑΜ. Его развитие по-видимому обусловлено образованием в печени неактивных метаболитов β2-ΑΜ, обладающих высоким сродством к β2-адренорецепторам и способных конкурировать с активным веществом за рецепторы. Для купирования необходимо парентеральное введение глюкокортикоидов.
• Синдром «запирания», который связан со способностью β2-ΑΜ расширять сосуды в бронхах, что сопровождается отеком слизистой и снижением эффективности препаратов. Для купирования используют смешанные симпатомиметики (например, эфедрин).
• Синдром «затыкания». Характеризуется невозможностью произвести в течение 2-3 с вдох или выдох в связи с нарушением функции диафрагмы. Специального лечения не требует.
• Кардиальные побочные эффекты, возникающие чаще при передозировке β2-ΑΜ и проявляющиеся тахиаритмиями, повышением кислородного запроса миокарда. Токсическое действие β2-ΑΜ на сердечно-сосудистую систему резко возрастает при комбинации с ксантинами.
Ксантины
1. Препараты короткого действия:
• Теофиллин (Эуфиллин).
2. Препараты пролонгированногодействия: I поколение:
• Теопэк.
• Теодур.
• Теотард.
• Систайр.
• Теобиолонг.
• Ретафил.
• Вентакс.
• Дурофиллин.
II поколение:
• Дилатран.
• Теодур-24.
• Эуфилонг.
• Унифил.
• Ретафил-ретард.
• Филоконтин.
• Диффумал-24.
• Тео-24.
В настоящее время препараты теофиллина короткого действия используются для купирования бронхоспазма, в то время как ТФ пролонгированного действия применяются для систематического лечения БА. В качестве монотерапии длительно действующие ТФ обладают небольшой эффективностью и, очевидно, не подходят для длительной поддерживающей терапии. В то же время у тех пациентов, у которых не удалось достичь контроля над БА только с помощью ИГК, комбинация последних с пролонгированными теофиллинами способна улучшить результаты лечения. При этом следует учитывать, что комбинация ИГК с ТФ пролонгированного действия менее эффективна, чем комбинация ИГК с β2-ΑΜ, но значительно дешевле.
Механизмдействия ксантинов до настоящего времени полностью не раскрыт. Показано, что метилксантины неселективно ингибируют III и IV изоформы фосфодиэстеразы (ФДЭ), что способствует накоплению цАМФ в клетках. ФДЭ III преобладает в гладкой мускулатуре бронхов, в то время как IV изоформа фермента наибольшее значение играет в клетках воспаления (тучные клетки, эозинофилы, Т-лимфоциты). В результате происходит фосфорилирование киназы легких цепей миозина с последующей бронходилатацией (см. схему 5.4), а также подавление высвобождения медиаторов воспаления.
Кроме того, препараты данной группы способны неселективно блокировать все подтипы аденозиновых рецепторов. Аденозин, явля- ясь эндогенным пуриновым нуклеотидом, рассматривается как природный лиганд, специфически взаимодействующий с аденозиновыми рецепторами (А1 А2А, А2В, А3). Активация в бронхах аденозиновых рецепторов 1-го типа приводит к повышению бронхиального тонуса, в то время как через рецепторы 2-го типа реализуется бронхолитическое действие (см. схему 5.4). При БА происходит изменение плотности аденозиновых рецепторов в бронхах с преобладанием A1-рецепторов и значительным снижением числа А2-аденозиновых рецепторов. Таким
образом, бронхолитическое действие ксантинов обусловлено блокадой A1-аденозиновых рецепторов и ингибирование ФДЭ.
При этом при лечении ксантинами свыше 3 недель в бронхах увеличивается плотность и активность А2-аденозиновых рецепторов.
Блокада аденозиновых рецепторов (особенно типов А2В и А3) на поверхности тучных клеток приводит к снижению выброса медиаторов воспаления. Определенную роль в механизме действия ксантинов может играть их антагонизм с TNF-α, имеющий большое значение при тяжелом течении БА. Эти компоненты механизма действия теофиллина, по-видимому, опосредуют его небольшое противовоспалительное действие (в низких дозах).
В настоящее время считается, что при систематическом применении теофиллина его способность предупреждать высвобождение медиаторов аллергии преобладает над прямым бронхолитическим действием.
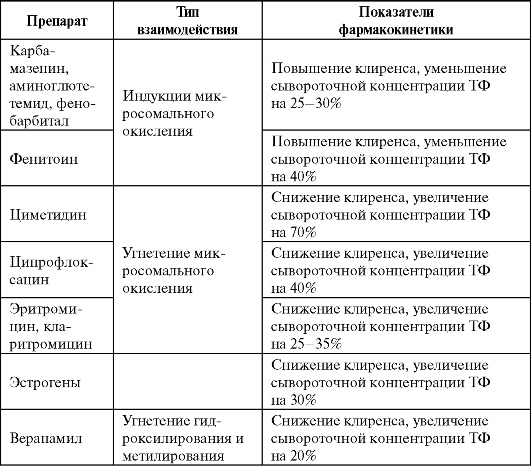
Фармакокинетика ТФ подвержена высокой вариабельности и не может быть предсказана у больных различного возраста, пола и массы тела. При пероральном приеме пролонгированных препаратов ТФ биодоступность определяется прежде всего особенностями лекарственной формы и может изменяться в широких пределах. Большое влияние на фармакокинетику оказывают сопутствующие заболевания и одновременный прием некоторых лекарственных препаратов (табл. 5.10, 5.11).
Таблица 5.10. Состояния, влияющие на фармакокинетику теофиллина
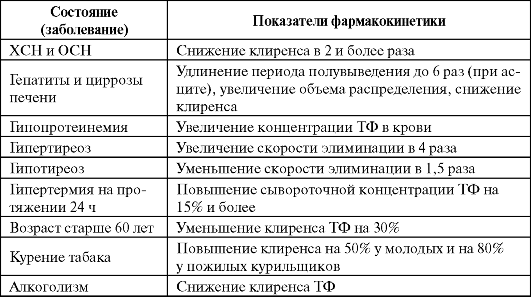
Таблица 5.11. Препараты, влияющие на фармакокинетикутеофиллина
ТФ метаболизируется в печени до кофеина и 3-метилксантина, тоже обладающих фармакологической активностью. Кинетика это- го процесса имеет нелинейный характер, что не позволяет точно прогнозировать зависимость метаболизма препарата от вводимой дозы.
Терапевтический эффект ТФ проявляется в узком интервале доз (от 10 до 20 мкг/мл), превышение которых ведет к развитию побочных эффектов. Стабильная сывороточная концентрация ТФ определяется дозой, интервалом введения и клиренсом препарата. Даже у одного больного показатели фармакокинетики могут колебаться в зависимости от тяжести состояния, длительности предшествующей терапии метилксантинами и др., что требует проведения фармакокинетического мониторинга на основании сывороточной концентрации ТФ (табл. 5.12).
Таблица 5.12. Выбор окончательной дозы теофиллина на основании его сывороточной концентрации
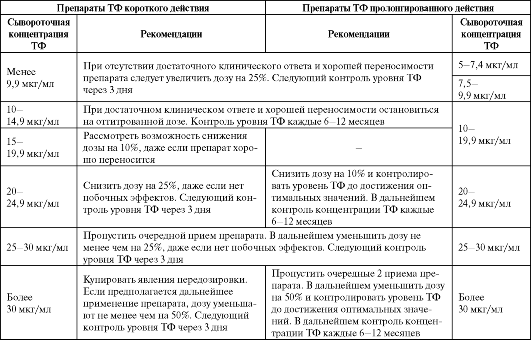
Таким образом, фармакокинетический мониторинг показан в следующих случаях:
- при купировании тяжелого приступа БА;
- для коррекции дозы у вновь поступающих больных, получавших ТФ в последние 12-24 ч;
- у больных с тяжелой БА (ежедневно);
- после подбора дозы не реже 1 раза в 6-12 месяцев;
- при наличии патологии, влияющей на фармакокинетику ТФ (см. выше);
- при использовании препаратов, изменяющих фармакокинетику ТФ (см. выше);
- при подозрении на развитие токсического действия ТФ;
- при снижении эффективности ТФ.
Для лечения БА могут быть использованы препараты ТФ пролонгированного действия, медленно высвобождающие теофиллин из лекарственной формы. В последней теофиллин может находиться либо в виде микрокапсул, либо наслаиваться на носитель (растворимая пленка). Начальная доза препаратов ТФ пролонгированного действия составляет 16 мг/кг в сутки или 400 мг/сут (предпочтение отдается меньшей дозе). Терапевтическая концентрация ТФ в крови в этом случае поддерживается на постоянном уровне до 12-24 ч (в зависимости от поколения препарата), что позволяет принимать их 1 раз (II поколение) или 2 раза (I поколение) в сутки. С позиций хронофармакологии, продотированные формы ТФ II поколения следует принимать вечером (в 18-19 ч), так как метаболизм ксантинов ночью значительно замедлен.
Если препарат переносится хорошо и не достигнут достаточный клинический эффект, доза препарата пролонгированного действия может быть увеличена на 25% с интервалом в 3 дня (см. табл. 5.10).
При
купировании приступов БА место теофиллина окончательно не определено.
Он может вводиться в виде 2,4% раствора эуфиллина по 10 мл внутривенно
струйно медленно или капельно. При невозможности вводить эуфиллин
внутривенно его вводят внутримышечно (1 мл 24% раствора). Однако
следует учитывать, что добавление теофиллина короткого действия к
адекватным дозам β2-ΑΜ короткого (быстрого) действия может
не давать дополнительного бронхолитического эффекта, хотя и стимулирует
акт дыхания. Кроме того, показано, что по выраженности
бронхолитического эффекта внутривенно вводимый эуфиллин уступает как β2-ΑΜ короткого (быстрого) действия, вводимым с помощью небулайзера, так и магния сульфату (внутривенно
Побочные эффекты, как правило, проявляются при сывороточной концентрации ТФ более 20 мкг/мл:
- со стороны нервной системы - бессонница (обычно исчезает через 5-6 дней), головная боль, тремор, обморочные состояния. Наиболее грозное осложнение - судороги, при возникновении которыхлетальность можетдостигать 40% и более;
- со стороны ЖКТ - тошнота, рвота, боли в животе, диарея;
- со стороны сердечно-сосудистой системы - тахикардия, нарушения ритма сердца, гипотензия;
- со стороны мочевыделительной системы - полиурия. Новым подходом в фармакотерапии бронхообстуктивных заболеваний стало создание селективных ингибиторов ФДЭ IV - циломиласта (арифло) и рофлюмиласта. Их особенностью является высокая селективность в отношении некоторых типов иммунокомпетентных клеток, участвующих в формировании воспаления в респираторном тракте и гладких мышцах бронхов. Помимо этого, препараты способствуют расслаблению гладких мышц бронхов, подавляют избыточную активацию нервных окончаний в бронхолегочной ткани, редуцируя явления бронхоспазма.
Кромоны
• Кромогликат натрия (КН) (Интал).
• Недокромил натрия (НН) (Тайлед). Комбинированные:
• Дитек (КН + фенотерол).
В настоящее время кромоны занимают скромное место в терапии БА, что обусловлено их низкой противовоспалительной активностью. Их применение ограничивается предупреждением бронхоспазма, провоцируемого физической нагрузкой, аллергенами, ирритантами.
Механизм действия препаратов данной группы обусловлен непрямой (очевидно через хлорные каналы) блокадой входа Са2+ в клетки и угнетением активности ФДЭ, что дает:
- подавление выделения БАВ (включая медиаторы воспаления и аллергии, цитокины) из тучных клеток;
- торможение активности эозинофилов, макрофагов, нейтрофилов, тромбоцитов, участвующих в развитии аллергического воспаления;
- подавление возбуждения волокон «С» типа в окончаниях блуждающего нерва.
Таким образом, кромонам присуща определенная противовоспалительная активность и способность снижать рефлекторную гиперре- активность бронхов.
Оба препарата данной группы обладают сходной фармакокинетикой. Ихсистемная биодоступность составляет 8-15%, степень связывания с белками 60-90%. Они не метаболизируются и не кумулируются в организме, выводятся печенью и почками. Клиническая эффективность препаратов практически сопоставима, однако, недокромил натрия обладает некоторыми преимуществами по сравнению с кромогликатом натрия. Так, НН обладает способностью блокировать не только раннюю, но и (в отличие от КН) позднюю астматическую реакцию. Вследствие этого он иногда оказывается эффективным в случаях резистентности к КН. Кроме этого, НН оказывает незначительное противокашлевое действие и лучше переносится больными.
При использовании кромонов необходимо учитывать следующие особенности:
- препараты оказывают только профилактическое действие, не обладают бронхолитической активностью;
- начальный терапевтический эффект наблюдается через 10- 14 дней после систематического применения кромонов (иног- да позднее), а полное суждение о клинической эффективности препаратов можно сделать примерно через 1-1,5 месяца.
Для предупреждения бронхоспазма, вызываемого холодным воздухом, физической нагрузкой, аллергенами, ирритантами, следует использовать препараты за 10-15 мин до предполагаемого контакта, но не более чем за 60 мин. Основные сведения по применению препаратов представлены в табл. 5.13.
Длительное применение кромонов практически не влияет на течение хронического воспаления у больных БА, а их клинический эф- фект менее предсказуем, чем у ИГК и ТФ. Подвергается сомнению целесообразность регулярного использования комбинированных препаратов, содержащих кромоны и β2-ΑΜ короткого действия, что обусловлено неблагоприятным влиянием регулярного применения симпатомиметиков на течение БА.
Достоинством кромонов является их высокая безопасность. Наиболее типичные нежелательные эффекты включают раздражение слизистой оболочки верхних дыхательных путей, что проявляется першением и сухостью в горле, сухим кашлем.
Особое место занимает кетотифен (задитен), который наряду со свойствами, присущими кромонам, обладает дополнительно Hj-гис-
Таблица 5.13. Некоторые фармакокинетические показатели и применение кромонов
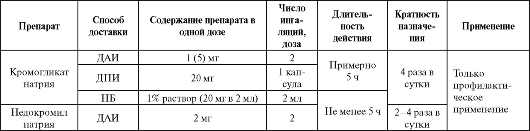
таминоблокирующим эффектом. Он наиболее эффективен при сезонной аллергической астме. Применяется он перорально по 1 мг 2 раза в сутки. Наиболее частыми побочными действиями являются седативное и снотворное.
Ингаляционные М-холиноблокаторы
I поколение:
• Ипратропия бромид (ИБ) (Атровент).
• Ипратропия йодид (Тровентол).
II поколение:
• Окситропия бромид (Оксивент).
III поколение:
• Тиотропия бромид (Спирива). Комбинированные:
• Беродуал (ИБ + фенотерол).
• Комбивент (ИБ + сальбутамол).
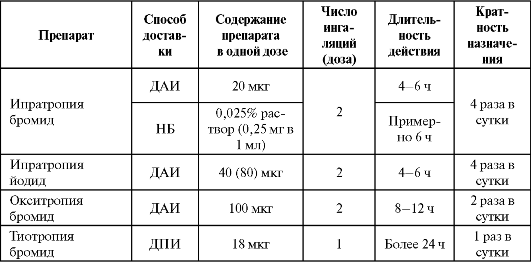
В настоящее время основным показанием к применению М-холиноблокаторов (М-ХБ) является хроническая обструктивная болезнь легких. При выборе базовой терапии БА при непереносимости или противопоказании к применению β2-ΑΜ в качестве единственного бронхолитика может применяться лишь ипратропия бромид (или йодид), он же является дополнением к β2-ΑΜ при среднетяжелых и тяжелых обострениях заболевания.
Кроме того, ипратропия бромид является препаратом выбора при преобладании у больных с БА признаков бронхита, служащего эквивалентом астмы, в первую очередь у пожилых людей, в том числе «поздняя астма»; при «кашлевой астме» (кашель как эквивалент приступа астмы), при бронхиальной обструкции, провоцируемой физической нагрузкой, холодом, ирритантами; при бронхообструктивном синдроме с выраженной бронхореей («влажная астма»); при психогенной астме и особенностях гормонального фона; при ошибочном назначении пациенту с БА адреноблокаторов (β2-ΑΜ в этом случае плохо снимают бронхоспазм).
В основе механизма действия препаратов этой группы лежит их способность блокировать М3-холинорецепторы в окончаниях парасимпатических нервов в бронхах и M1-холинорецепторы в интрамуральных ганглиях. В результате происходит расслабление гладкой мускулатуры бронхов (см. схему 5.4).
Препараты I-II поколений блокируют все три подтипа (М1, М2, М3) холинорецепторов в отличие от препарата III поколения - тиотропия
бромида, обладающего достаточно высокой избирательностью действия в отношении 1-го и 3-го подтипов М-холинорецепторов. Таким образом, он не действует на тормозные пресинаптические М2-холинорецепторы, через которые осуществляется ауторегуляция выброса ацетилхолина. Кроме того, считается, что ипратропия бромид и окситропия бромид способны снижать образование тромбоксана А2, индуцируемое гистамином, брадикинином и LTC4. Этот эффект не связан с М-холинолитической активностью препаратов.
Все ингаляционные М-холиноблокаторы обладают низкой биодоступностью при ингаляционном введении, что позволяет избежать выраженных системных побочных эффектов. Основные сведения по применению препаратов представлены в табл. 5.14.
Таблица 5.14. Некоторые фармакокинетические показатели ингаляционных М-холиноблокаторов
В целом М-ХБ обладают более низкой эффективностью при БА по сравнению с β2-ΑΜ. Это обусловлено тем, что наибольшая плотность М-холинорецепторов определяется в крупных и средних бронхах, в то время как в мелких бронхах их плотность значительно меньше.
Побочные эффекты ингаляционных М-холиноблокаторов обусловлены их резорбтивным действием при всасывании с поверхности бронхов и из ЖКТ (до 7% от введенной дозы). Они включают:
- ухудшение дренажной функции бронхов, обусловленное блокадой М3-холинорецепторов бронхиальных желез;
- со стороны ЖКТ (тошнота, сухость во рту, запоры);
- со стороны ССС (тахикардия, повышение кислородного запроса миокарда);
- со стороны органа зрения (нарушение аккомодации, повышение внутриглазного давления).
В настоящее время выпускаются комбинированные препараты (беродуал и комбивент), содержащие холиноблокатор и адреномиметик в форме ДАИ. Действие препарата развивается в течение 5-15 мин после ингаляции, максимальный эффект наблюдается через 30-60 мин и продолжается 6-8 ч. Основные сведения о комбинированных препаратах представлены в табл. 5.15.
Таблица 5.15. Особенности состава и применения фиксированных комбинаций М-холиноблокаторов и β2-адреномиметиков
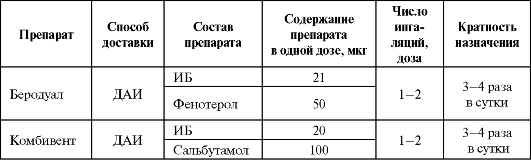
Комбинированное применение ИБ и β2-ΑΜ позволяет достичь потенцирования бронхолитического эффекта и снизить дозу короткодействующего адреномиметика, что уменьшает риск развития побочных эффектов. При этом кратность применения фиксированной комбинации определяется по β2-ΑΜ.
Блокаторы IgE
• Омализумаб (Ксолар).
Новым направлением в терапии бронхиальной астмы стало применение препарата омализумаба (ксолара). Омализумаб представляет собой хуманизированное моноклональное антитело, которое изби- рательно связывается с IgE, предотвращая его связывание с высокоафинными рецепторами FcεRI. В результате это приводит к снижению дегрануляции тучных клеток и базофилов. Важно отметить, что омализумаб не соединяется с IgE, уже связанным с FcεRI, что могло бы привести к агрегации рецепторов и выделению медиаторов аллергической реакции.
После лечения омализумабом уровень свободного IgE в сыворотке резко снижается. Кроме того, препарат существенно уменьшает
количество рецепторов FcεRI на базофилах (возможно, потому что плотность рецепторов FcεRI регулируется уровнем свободного IgE в сыворотке крови), и тем самым снижает чувствительность клетки к действию аллергенов.
Омализумаб назначают для лечения атопической бронхиальной астмы у взрослых и подростков (12 лет и старше), страдающих среднетяжелыми и тяжелыми резистентными формами заболевания, контроль над которыми не достигается ИГК (при уровне IgE в крови 30- 700 МЕ/мл) подкожно в дозе 150-375 мг (или в зависимости от уровня IgE по 15-30 мкг/кг) каждые 2-4 недели. Пиковые концентрации в плазме определяются через 7-8 дней после введения, а период полувыведения составляет около 26 дней.
Применение препарата существенно улучшает качество жизни больных с БА, в первую очередь с тяжелым персистирующим заболе- ванием, плохо контролируемым ингаляционными глюкокортикоидами, и является достаточно безопасным. Основными установленными побочными эффектами являются тромбоцитопения и аллергические реакции.
5.2. ВСПОМОГАТЕЛЬНЫЕПРЕПАРАТЫ ЛЕЧЕНИЯ БРОНХИАЛЬНОЙ АСТМЫ
Муколитические, мукорегуляторные и мукокинетические средства
Одним из патогенетических механизмов БА является образование вязкой трудно отделяемой мокроты. Ликвидации этой патологии способствует рациональное применение средств, улучшающих бронхи- альную проходимость.
В слизистой оболочке бронхов выделяют поверхностный эпителий, базальную мембрану, собственную пластинку, мышечный и подслизистый слой. Поверхностный эпителий состоит из четырех основных типов клеток - реснитчатых, бокаловидных, промежуточных и базальных и продуцирует бронхиальный секрет (слизь), выполняющий защитную функцию. Слизь на 90-95% состоит из воды с растворенными в ней ионами и макромолекулярных соединений (схема 5.5), к которым относятся:
- высоко- и низкомолекулярные нейтральные и кислые гликопротеины (муцины), обусловливающие вязкий характер секрета (2-3%);
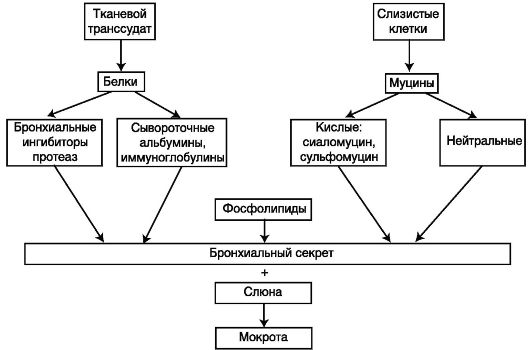
Схема 5.5. Состав мокроты (Белоусов Ю. Б., Омельяновский В. В., 1996)
- сложные белки плазмы - альбумины, глобулины, плазматические гликопротеины (молекулы которых связаны между со- бой дисульфидными и водородными связями), иммуноглобулины (Ig) классовА, G, Ε (2-3%);
- антипротеолитические ферменты - α1-антихимотрипсин, a1- антитрипсин (1-2%);
- фосфолипиды сурфактанта, небольшое количество глицеридов, холестеролов и свободных жирных кислот (0,3-0,5%).
По
физико-химической структуре бронхиальный секрет представляет собой
многокомпонентный коллоидный раствор, состоящий из двух фаз - золя и
геля, определяющих реологические свойства мокроты (вязкость,
эластичность, текучесть). Суточный объем бронхиального секрета в норме
составляет 10-150 мл, в среднем около 0,1- 0,75 мл на
При БА происходит перестройка слизистой оболочки, в том числе эпителия. Значительно возрастает количество бокаловидных клеток, изменяется физико-химический характер слизи (происходит увеличение нейтральных муцинов и уменьшение кислых), повышается содержание нейтральных гликопротеинов), повышается ее вязкость, что приводит к нарушению дренажной функции бронхов. Скопление бронхиального секрета не только влияет на дренажную функцию бронхов, но и снижает выраженность местных иммунных процессов.
Основными целями проводимой муколитической терапии являются уменьшение образования мокроты, ее разжижение, стимуляция выведения и регидратация. Но для всех муколитиков абсолютным противо- показанием к применению является БА без наличия вязкой мокроты!
Муколитические средства
Тиолсодержащие препараты:
• Ацетилцистеин (АЦЦ, Мукомист).
• Месна (Мистаброн). Вазициноиды:
• Бромгексин (Бисолвон).
• Амброксол (Амбробене). Ферментные препараты:
• Трипсин кристаллический.
• Рибонуклеаза.
• Дезоксирибонуклеаза (Пульмозим). Препараты других групп:
• Натрия гидрокарбонат.
Тиолсодержащие препараты
Препараты данной группы оказывают выраженное муколитическое действие за счет наличия в их молекулах тиоловых (-SH) групп, разрушающих дисульфидные связи кислых мукополисахаридов мокроты. Это сопровождается деполимеризацией макромолекул и мокрота становится менее вязкой и адгезивной, что приводит к улучшению дренажной функции бронхов. Помимо этого у ацетилцистеина (АЦЦ) предполагается наличие антиокисдантного эффекта, обусловленного прямым (за счет сульфгидрильных групп) и непрямым (за счет активации синтеза глутатиона) действием.
Препараты данной группы при БА используются только в случаях наличия у больного вязкой, трудноотделяемой мокроты. АЦЦ используется преимущественно в виде ингаляций; в случае невозможности ингаляционного введения (коматозное состояние, травма и т. д.) возможно его внутримышечное или внутривенное введение. Действие месны начинается быстрее и более выражено, чем у АЦЦ. В качестве муколитика препарат применяется только в виде ингаляций или капельных внутрибронхиальных вливаний.
Препараты, как правило, хорошо переносятся, но иногда могут провоцировать бронхоспазм, предупреждающийся предварительным введением β2-ΑΜ. Кроме того, возможно развитие диспепсических явлений и аллергических реакций, боли за грудиной (для мес- ны). Длительный прием АЦЦ подавляет мукоцилиарный транспорт и продукцию IgA.
Тиолсодержащие муколитики у больных с БА назначаются только на очень короткое время (1-2 суток) для разжижения мокроты в период обострения БА, и только в условиях стационара при наличии отсоса. Особенности отдельных препаратов представлены в табл. 5.16.
Вазициноиды
Бромгексин является синтетическим производным алкалоида вазицина. При приеме внутрь препарат превращается в активный метаболит - амброксол, который повышает активность лизосом бокаловидных клеток эпителия дыхательных путей. В результате происходит высвобождение лизосомальных ферментов, гидролизующих мукопротеиды, и мукополисахаридов. Помимо этого, бромгексин стимулирует выработку нейтральных полисахаридов и сурфактанта, восстанавливает мукоцилиарный клиренс. Таким образом, разжижается вязкий, липкий бронхиальный секрет и обеспечивается его продвижение по дыхательным
Таблица 5.16. Особенности фармакокинетики и применения некоторых муколитиков
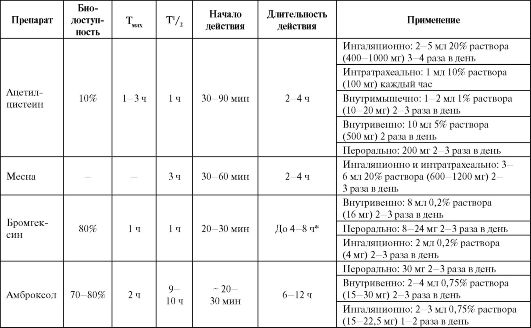
Примечание: * - для ингаляционной формы.
путям. Отличительной особенностью бромгексина является его самостоятельное противокашлевоедействие, нежелательное при БА.
При БА препараты данной группы используются с осторожностью, что связано с их способностью вызывать бронхоспазм. Более предпочтительным является назначение амброксола, не только восстанавливающего мукоцилиарный клиренс, но и обладающего менее выраженным противокашлевым эффектом. Особенности отдельных препаратов представлены в табл. 5.16.
Побочные эффекты редки: желудочно-кишечные расстройства (тошнота, рвота, диспепсии, возможно обострение язвенной болезни), кожные реакции (ангионевротический отек), повышение активности аминотрансфераз, для некоторых препаратов показана возможность увеличивать интервал PQ.
Ферментные препараты
В настоящее время ферментные препараты при БА практически не используются, что связано с их низкой эффективностью при неинга- ляционном введении, большим количеством побочных эффектов при эндобронхиальном использовании и отрицательном влиянии на мукоцилиарный клиренс (вчастности, химотрипсина и трипсина).
Мукорегуляторные средства
• Карбоцистеин (Мукодин).
Механизм действия карбоцистеина связан с активацией сиаловой трансферазы бокаловидных клеток слизистой оболочки бронхов, что приводит к нормализации соотношения кислых и нейтральных сиаломуцинов бронхиального секрета. Это восстанавливает вязкость и эластичность слизи. Кроме того, препарат активирует регенерацию слизистой оболочки, восстанавливает ее структуру, уменьшает количество бокаловидных клеток, особенно в терминальных бронхах, и снижает количество вырабатываемой слизи. При его применении вос- станавливаются секреция IgA, количество сульфгидрильных групп, улучшается мукоцилиарный клиренс.
Таким образом, карбоцистеин не только улучшает реологические свойства мокроты, но и восстанавливает структуру слизистой оболочки бронхов, что позволяет отнести его по фармакологическому эффекту к так называемым мукорегуляторам. При БА карбоцистеин является препаратом выбора не только в силу мукорегуляторного действия, но и благодаря способности потенцировать эффекты ксантинов и ГК.
Особенности фармакокинетики и применение препарата представлены в табл. 5.17.
Таблица 5.17. Особенности фармакокинетики и применения карбоцистеина
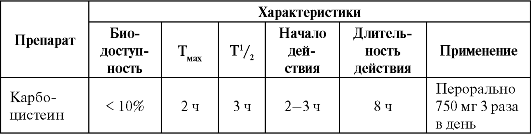
Побочные эффекты развиваются редко, преимущественно в виде диспепсических явлений и аллергических реакций.
Мукокинетические (отхаркивающие) средства
1. Препараты прямого действия:
• Корень алтея (настой).
• Лист мать-и-мачехи (настой).
• Йодиды или бромиды натрия и калия.
• Терпингидрат.
• Мукалтин.
2. Препараты рефлекторного действия:
• Трава термопсиса (настой, экстракт сухой).
• Корень истода (отвар).
• Корень девясила (отвар).
Ранее широко использовавшиеся при БА мукокинетические (отхаркивающие) средства, ускоряющие транспорт слизи, в настоящее время в значительной мере вытеснены гораздо более эффективными и безопасными муколитическими препаратами.
Иммунотропные препараты
Данная группа препаратов является новым направлением терапии БАи пока не отражена в GINA, однако прогресс иммунотропной фармакотерапии позволяет надеяться, что среди этих лекарственных средств будут найдены эффективные средства лечения бронхиальной астмы.
• Даклизумаб (Зенапакс).
Даклизумаб (зенапакс) является имуносупрессивным агентом и используется, в основном, для профилактики реакций острого отторжения трансплантата. Он представляет собой химерные монокло- нальные антитела, действие которых направлено против рецептора
IL-2 (CD25), экспрессируемого на поверхности Т-лимфоцитов в ответ на стимуляцию антигенами. Даклизумаб специфически связывается с антигеном CD25 на активированных Т-лимфоцитах, имеющих вы- сокоаффинный рецептор IL-2, и таким образом предотвращает связывание IL-2, служащее сигналом для пролиферации Т-клеток. В настоящее время предпринимаются попытки использовать препарат для лечения больных с тяжелой персистирующей БА, не контролируемой высокими дозами ИГК.
• Атракинцепт (Нюванс).
Атракинцепт является рекомбинантным растворимым рецептором ΙΓ-4, играющего важную роль в патогенезе БА, включая индуцирование продукции IgE, увеличение экспрессии таких молекул адгезии, как VCAM-1 и эндотелии, повышение активности липооксигеназы, увеличение продукции муцина, стимуляцию Тh2-лимфоцитов и вторичное возрастание продукции ΙΓ-4, ΙΓ-5 и ΙΓ-13. После попадания в организм атракинцепт связывается со свободным ΙΓ-4 без стимуляции внутриклеточных сигнальных путей.
Препарат вводится ингаляционно с помощью небулайзера (1500 мкг в дозе) и проявляет клинический эффект примерно к 4-му дню. Период полувыведения составляет 6-8 дней. По данным клинических иссле- дований, ингаляционное введение атракинцепта 1 раз в неделю эффективно у пациентов со среднетяжелой бронхиальной астмой и позволяет избежать ухудшения течения заболевания при снижении дозы ИГК или β2-ΑΜ. Хотя первые результаты применения препарата оказались весьма многообещающими, дальнейшие клинические исследования были неожиданно свернуты.
• Суплатаста тосилат (IPD-1151T).
Суплатаста тосилат является селективным ингибитором синтеза ΙL-4 и ΙL-5 в Тh2-лимфоцитах. Кроме того, препарат подавляет синтез IgE, пролиферацию эозинофилов и их проникновение в ткани бронхов, снижаетявления воспаления в бронхолегочной ткани.
Первый опыт применения препарата при легкой персистирующей БА (по 100 мг 3 раза в день на протяжении 6-8 недель) оказался успешным (уменьшение явлений бронхиальной обструкции, воспаления в тканях бронхов и эозинофилии), однако вынесение окончательного суждения о безопасности и эффективности препарата еще впереди.
В настоящее время разрабатываются также антагонисты ΙΓ-5 (например, меполизумаб), ΙΓ-9 и IL-13 (блокирующие антитела и растворимые рецепторы), низкомолекулярные небелковые ингибиторы TNF-α конвертирующего фермента, ингибиторы митоген-активируемой протеин-
киназы, белковые и небелковые антагонисты CCR3 рецептора (рецептор RANTES, хемоаттрактантного белка моноцитов 3, 4 и эотаксина). Активно исследуется возможность применения противовоспалительных цитокинов, веществ, усиливающих их синтез или активирующих соответствующие сигнальные пути, для угнетения атопического воспаления, например, рецепторного антагониста IL-1, IL-10, IFN-γ, IL-12, молекул адгезии (VLA-4, селектинов, ICAM-1), возможность применения веществ, приводящих к индукции апоптоза в ключевых клетках атопического воспаления, ингибиторов тирозинкиназы, играющей ключевую роль во внутриклеточной передаче сигнала с FceRI тучных клеток.
В
Еще одним новым направлением может стать применение антиселектиновых препаратов. Одним из них является биосиамос - панселектиновый антагонист, блокирующий три молекулы клеточной адгезии - Е-, Р- и L-селектины, играющие большую роль в процессах адгезии и воспаления. Р-селектин является быстро индуцибельной молекулой, обнаруживаемой на активированных тромбоцитах и эндотелиоцитах; Е-селектин имеет среднюю скорость индукции и определяется в основном на эндотелиоцитах, L-селектин конституционально экспрессируется на поверхности некоторых подтипов лейкоцитов (нейтрофилы, моноциты), большинстве циркулирующих Т- и В-лимфоцитов, NK-клетках. Применение антагонистов этих эндогенных соединений может открыть новую страницу в терапии бронхиальной астмы.
ЛИТЕРАТУРА
Авдеев С. Н. Хроническая обструктивная болезнь легких в таблицах и схемах / С. Н. Авдеев. - М.:Атмосфера, 2003. - 23 с.
Архипов В. В. GINA2006: новые рекомендации по фармакотерапии бронхиальной астмы / В. В. Архипов, А. Н. Цой //Русский медицинский журнал. - 2007. - Т. 15, ? 4. -http://www.rmj.ru/numbers_306.htm.
Белоусов Ю. Б. Клиническая фармакология болезней органов дыхания / Ю. Б. Белоусов, В. В. Омельяновский. - М.: Универсум Паблишинг, 1996. - 176 с.
Белоусов Ю. Б. Клиническая фармакология и терапия : руководство для врачей. - 2-еизд., испр. идоп./Ю. Б. Белоусов, В. С. Моисеев, В. К. Лепахин. - М.: Универсум Паблишинг, 2000. - 539 с.
Биджани X. Внутривенное применение сульфата магния в лечении больных тяжелой бронхиальной астмой, не отвечающих на традиционную терапию / X. Биджани, А. А. Могадамния, Е. Ислами Халили //Пульмонология. - 2003. - Вып. 6. - http://www.pulmonology.ru/magazine/archive/2003/356/3376.php.
Глобальная стратегия лечения и профилактики бронхиальной астмы. Пересмотр
Горячкина Л. А. Сравнительная эффективность монотерапии сальметеролом, флютиказоном пропионатом и их комбинации при атопической бронхиальной астме / Л. А. Горячкина, Е. П. Трехова, Τ Г. Арутюнов и др. // Пульмонология. - 1999. -?3.- С. 65-70.
Гуревич К. Г. Средства ингаляционной доставки лекарств / К. Г. Гуревич // Фарматека. - 2002. -?11.-С. 60-68.
Княжеская Н. П. Глюкокортикоидная терапия бронхиальной астмы / Н. П. Княжеская, М. О. Потапова // Consilium Medicum. - 2003. - Т. 5, ? 4. - С. 184-192.
Огородова Л. М. Клиническая фармакология бронхиальной астмы / Л. М. Огородова, Ф. И. Петровский, Ю. А. Петровская. - М.: Атмосфера, 2002. - 160 с.
ОгородоваЛ. М. Новые перспективные лекарственные препараты / Л. М. Огородова, Ф. И. Петровский, Ю. А. Петровская, -http://www.avpivnik.ru/works/ new/newmet_028.doc.
Петров В. И. Бронхиальная астма у детей. (Современные подходы к диагностике и лечению) / В. И. Петров, И. В. Смоленов. - Волгоград: Б. и., 1998. - 140 с.
Рациональная фармакотерапия заболеваний органов дыхания: руководство для практикующих врачей. - М.: Литтера, 2004. - 874 с.
Середа В. //.Ингаляционная терапия хронических обструктивных заболеваний легких / В. П. Середа, А. С. Свистов // ФАРМиндекс: ПРАКТИК. - 2003. - Вып. 4. - С. 54-96.
Синопальников А. //.Муколитические препараты в комплексной терапии бо- лезней органов дыхания: методические рекомендации для врачей / А. И. Сино- пальников, И. Л. Клячкина. - М.: Б. и., 1998. - 31 с.
Синопальников А. И. Пути оптимизации ингаляционной глюкокортикоидной терапии: субстанция, система доставки, пропеллент / А. И. Синопальников, И. Л. Клячкина // Consilium Medicum. - 2003. - Τ 5,?4.- С. 192-197.
Стандарты (протоколы) диагностики и лечения больных с неспецифическими заболеваниями легких / под ред. А. Г. Чучалина. - М.: Грантъ, 1999. - 40 с.
Цой А. //Комбинированные препараты кортикостероидов и β2-агонистов: какому из средств отдать предпочтение? / А. Н. Цой, В. В. Архипов // Consilium Medicum. - 2003. - Τ 5,?4.- С. 181-184.
Черняк Б. А. Новый этап комбинированной терапии бронхиальной астмы. Серетид: клиническая эффективность и безопасность / Б. А. Черняк, И. И. Вор- жева//Аллергология. - 2000. - ?1. - С. 32-39.
Adcock I. Μ. Molecular interactions between glucocorticoids and long-acting beta2-agonists / I. M. Adcock, K. Maneechotesuwan, O. Usmani //J. Allergy. Clin. Immunol. - 2002. - Vol. 110, ? 6, Suppl. - P. S261-S268.
Barnes P. J. Theophylline: new perspectives for an old drug / P. J. Barnes // Am. J. Respir. Crit. Care. Med. - 2003. - Vol. 167, ? 6. - P. 813-818.
Barnes P. J. Tiotropium bromide / P. J. Barnes // Expert. Opin. Investig. Drugs. - 2001. - Vol. 10, ? 4. - P. 733-740.
Belvisi M.G. Soft steroids: a new approach to the treatment of inflammatory airways diseases/M. G. Belvisi, D. J. Hele//Pulm. Pharmacol. Ther. - 2003. - Vol. 16, ? 6. - P. 321-325.
Bensch G. Combination therapy: appropriate for everyone? / G. Bensch, В. M. Prenner //J. Asthma. - 2003. - Vol. 40, ? 4. - P. 431-444.
Borish L. C. Efficacy of soluble IT-4 receptor for the treatment of adults with asthma / T.C. Borish, H. S. Nelson, J. Corran et al. //J. Allergy. Clin. Immunol. - 2001. - Vol. 107. - P. 963-970.
Boulet L. P. Once-daily inhaled corticosteroids for the treatment of asthma / L. P. Boulet // Curr. Opin. Pulm. Med. - 2004. - Vol. 10, ? 1. - P. 15-21.
Bundschuh D. S. In vivo efficacy in airway disease models of rofiumilast, a novel orally active PDE-4 inhibitor/ D. S. Bundschuh, M. Eltze, J. Barsiget al. //JPET - 2001. - Vol. 97. - P. 280-290.
Busse W. W. Management of asthma exacerbations / W. W. Busse, R. F. Temanske // Thorax. - 2004. - Vol. 59, ? 7. - P. 545-546.
Chapman K. R. The impact of budesonide and other inhaled corticosteroid therapies in the management of asthma in children and adults / K. R. Chapman // Clin. Ther. - 2003. - Vol. 25, Suppl. С. - P. C2-C14.
Chung K. F. Anti-IgE monoclonal antibody, omalizumab: a new treatment for allergic asthma / K. F. Chung // Expert. Opin. Pharmacother. - 2004. - Vol. 5, ? 2. - p. 439-446.
Ducharme F. M. Inhaled glucocorticoids versus leukotriene receptor antagonists as single agent asthma treatment: systematic review of current evidence / F. M. Ducharme // BMJ. - 2003. - Vol. 326 (7390). - P. 621.
Fahy J. V. Airway inflammation and remodeling in asthma / J. V. Fahy, D. B. Corry, H. A. Boushey // Curr. Opin. Pulm. Med. - 2000. - Vol. 6, ? 1. - P. 15-20.
FozardJ. R. Thecaseforaroleforadenosine in asthma: almost convincing?/J. R. Fozard // Curr. Opin. Pharmacol. - 2003. - Vol. 3, ? 3. - P. 264-249.
Gamble E. Antiinflammatory effects of the phosphodiesterase-4 inhibitor cilomilast (Arifio) in chronic obstructive pulmonary disease / E. Gamble, D. C. Grootendorst, С. E. Brightling et al. // Am. J. Respir. Crit. Care. Med. - 2003. - Vol. 168, ? 8. - P. 976-982.
Hadj TaharA. Omalizumab as add-on therapy to inhaled steroids for asthma / A. adj Tahar // Issues Emerg. Health Technol. - 2004. - Vol. 58. - P. 1-4.
Hansel Т. T. Theophylline: mechanism of action and use in asthma and chronic obstructive pulmonary disease / Τ T. Hansel, R. C. Tennant, A. J. Tan et al. // Drugs Today. - 2004. - Vol. 40, ? 1. - P. 55-69.
Hansel Т. T. Tiotropium bromide: a novel once-daily anticholinergic bronchodilator for the treatment of COPD / Τ. Τ Hansel, P. J. Barnes // Drugs Today. - 2002. - Vol. 38, ? 9. - P. 585-600.
Huss К. General principles of asthma management: environmental control / K. Huss, P. Travis, R.W. Huss // Nurs. Clin. North. Am. - 2003. - Vol. 38, ? 4. - P. 609-620.
Joos G. F. Potential usefulness of inhibiting neural mechanisms in asthma / G. F. Joos // MonaldiArch. Chest. Dis. - 2000. - Vol. 55, ? 5. - P. 411-414.
Joos L. Beta(2)-adrenergic receptor polymorphisms and asthma / L. Joos, P. D. Pare, A. J. Sandford // Curr. Opin. Pulm. Med. - 2001. - Vol. 7, ? 2. - P. 69-74.
Kawai M. Theophylline for the treatment of bronchial asthma: present status / M. Kawai, M. Kato // Methods. Find. Exp. Clin. Pharmacol. - 2000. - Vol. 22, ? 5. - P. 309-320.
Kemp J. P. Recent advances in the management of asthma using leukotriene modi- fiers/J. P. Kemp //Am. J. Respir. Med. - 2003. - Vol. 2, ? 2. - P. 139-156.
Kips J. C. New anti-asthma therapies: suppression of the effect of interleukin (IL)- 4 and IL-5 / J. C. Kips, K. G. Tournoy, R. A. Pauwels // Eur. Respir. J. - 2001. - Vol. 17. - P. 499-506.
Kohyama T. Cytokines modulate cilomilast response in lung fibroblasts / T. Kohyama, X. Liu, F. Q. Wen et al. // Clin. Immunol. - 2004. - Vol. Ill, ? 3. - P. 297-302.
Krawiec Μ. E. Inhaled nonsteroidal anti-Inflammatory medications in the treatment of asthma / Μ. E. Krawiec, S. E. Wenzel // Respir. Care. Clin. N. Am. - 1999. - Vol. 5, ? 4. - P. 555-574.
Lanier B. Q. Omalizumab is effective in the long-term control of severe allergic asth- ma/В. Q. Lanier, J. Corren, W. Lumry//Ann. of Allergy. Asthma. Immunol. - 2003. - Vol. 91. - P. 154-159.
Larj M. J. Effects of beta2-agonists on airway tone and bronchial responsiveness / M. J. Larj, E. R. Bleecker //J. Allergy. Clin. Immunol. - 2002. - Vol. 110, 6 Suppl. - P. S304-S312.
Lyseng-Williamson К A. Inhaled salmeterol/fluticasone propionate combination: a pharmacoeconomic review of its use in the management of asthma / K. A. LysengWilliamson, G. L. Plosker // Pharmacoeconomics. -2003. - Vol. 21, ? 13. - P. 951-989.
MancelE. Membrane stabilizers (chromones and ketotifen) / E. Mancel, M. Drouet, A. Sabbah //Allerg. Immunol. - 1999. - Vol. 31, ? 4. - P. 103-105.
National asthma education and prevention program (NAEPP). NAEPP expert panel report. Guidelines for the diagnosis and management of asthma-update on selected topics 2002 // J. Allergy. Clin. Immunol. -2002. - Vol. 110, Suppl. 5. - P. S141-S219.
Newman S. P. Deposition and effects of inhaled corticosteroids / S. P. Newman // Clin. Pharmacokinet. - 2003. - Vol. 42, ? 6. - P. 529-544.
Papiris S. Clinical review: severe asthma / S. Papiris, A. Kotanidou, K. Malagari, C. Roussos // Crit. Care. - 2002. - Vol. 6, ? 1. - P. 30-44.
Profita M. Effect of cilomilast (Ariflo) on TNF-alpha, IL-8, and GM-CSF release by airway cells of patients with COPD / M. Profita, G. Chiappara, Ε Mirabella [et al.] // Thorax. - 2003. - Vol. 58, ? 7. - P. 573-579.
Riccioni G. Antileukotrienes in the therapy of bronchial asthma / G. Riccioni, R. Delia Vecchia, V. Menna et al. // Recenti. Prog. Med. - 2003. - Vol. 94, ? 11. - P. 509-515.
Rodrigo G. J. Evaluation Rapid Effects of Inhaled Corticosteroids in Acute Asthma: An Evidence-Based Evaluation / G. J. Rodrigo // Chest. - 2006. - Vol. 130. - P. 1301-1311.
Rodrigo G. J. Inhaled therapy for acute adult asthma / G. J. Rodrigo // Curr. Opin. Allergy. Clin. Immunol. - 2003. - Vol. 3, ? 3. - P. 169-175.
Shore S. A. Beta-agonists and asthma: too much of a good thing? / S. A. Shore, J. M. Drazen //J. Clin. Invest. - 2003. - Vol. 112, ? 4. - P. 495-497.
Somerville L. L. Theophylline revisited / Т. T. Somerville // Allergy Asthma Proc. -
2001. - Vol. 22, ? 6. - P. 347-351.
Spina D. Theophylline and PDE4 inhibitors in asthma / D. Spina // Curr. Opin. Pulm. Med. - 2003. - Vol. 9, ? 1. - P. 57-64.
Sullivan S. D. Asthma in the United States: recent trends and current status / S. D. Sullivan // J. Manag. Care. Pharm. - 2003. - Vol. 9, 5 Suppl. - P. 3-7.
Wenzel S. E. The role of leukotrienes in asthma / S. E. Wenzel // Prostaglandins Leukot. Essent. Fatty. Acids. - 2003. - Vol. 69, ? 2-3. - P. 145-155.
Yoshida Af.Effects of suplatast tosilate on airway hyperresponsiveness and inflammation in asthma patients / M. Yoshida, H. Aizawa, H. Inoue et al. //J. Asthma. -
2002. - Vol. 39. - P. 545-552.