Клиническая фармакология: избранные лекции / С.В. Оковитый, В.В. Гайворонская, А.Н. Куликов, С.Н. Шуленин. - 2009. - 608 с.
|
|
|
|
ЛЕКЦИЯ 8 КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ АНТИГИПОКСАНТОВ
Гипоксия представляет собой универсальный патологический процесс, сопровождающий и определяющий развитие самой раз- нообразной патологии. В наиболее общем виде гипоксию можно определить как несоответствие энергопотребности клетки энергопродукции в системе митохондриального окислительного фосфорилирования. Причины нарушения продукции энергии в гипоксической клетке неоднозначны: расстройства внешнего дыхания, кровообращения в легких, кислородтранспортной функции крови, нарушения системного, регионарного кровообращения и микроциркуляции, эндотоксемия. Вместе с тем в основе характерных для всех форм гипоксии нарушений лежит недостаточность ведущей клеточной энергопродуцирующей системы - митохондриального окислительного фосфорилирования. Непосредственной же при- чиной этой недостаточности при подавляющем большинстве патологических состояний является снижение поступления кислорода в митохондрии. В результате развивается угнетение митохондриального окисления. В первую очередь подавляется активность NAD-зависимых оксидаз (дегидрогеназ) цикла Кребса при начальном сохранении активности FAD-зависимой сукцинат-оксидазы, ингибирующейся при более выраженной гипоксии.
Нарушение митохондриального окисления приводит к угнетению сопряженного с ним фосфорилирования и, следовательно, вызывает прогрессирующий дефицит АТФ - универсального источника энергии в клетке. Дефицит энергии составляет суть любой формы гипоксии и обусловливает качественно однотипные метаболические и структурные сдвиги в различных органах и тканях. Уменьшение концентрации АТФ в клетке приводит к ослаблению ее ингибирующего влияния на один из ключевых ферментов гликолиза - фосфофрукто- киназу. Активирующийся при гипоксии гликолиз частично компенсирует недостаток АТФ, однако быстро вызывает накопление лактата и развитие ацидоза с результирующим аутоингибированием гликолиза.
Гипоксия приводит к комплексной модификации функций биологических мембран, затрагивающей как липидный бислой, так и мембранные ферменты. Повреждаются или модифицируются глав-
ные функции мембран: барьерная, рецепторная, каталитическая. Основными причинами этого явления служат энергодефицит и ак- тивация на его фоне фосфолиполиза и перекисного окисления липидов. Распад фосфолипидов и ингибирование их синтеза ведут к повышению концентрации ненасыщенных жирных кислот, усилению их перекисного окисления. Последнее стимулируется в результате подавления активности антиоксидантных систем из-за распада и торможения синтеза их белковых компонентов, и в первую очередь, супероксиддисмутазы (СОД), каталазы (КТ), глутатионпероксидазы (ГП), глутатионредуктазы (ГР) и др.
Энергодефицит при гипоксии способствует накоплению Са2+ в цитоплазме клетки, поскольку блокируются энергозависимые насосы, выкачивающие ионы Са2+ из клетки или закачивающие его в цистерны эндоплазматического ретикулума, а накопление Са2+ активирует Са2+-зависимые фосфолипазы. Один из защитных механиз- мов, препятствующий накоплению Са2+ в цитоплазме, заключается в захвате Са2+ митохондриями. При этом повышается метаболическая активность митохондрий, направленная на поддержание постоянства внутримитохондриального заряда и перекачку протонов, что сопровождается увеличением расхода АТФ. Замыкается порочный круг: недостаток кислорода нарушает энергетический обмен и стимулирует свободнорадикальное окисление, а активация свободнорадикальных процессов, повреждая мембраны митохондрий и лизосом, усугубляет энергодефицит, что, в конечном счете, может вызвать необратимые повреждения и гибель клетки. Основные звенья патогенеза гипокси- ческих состояний представлены на схеме 8.1.
В отсутствие гипоксии некоторые клетки (например, кардиомиоциты) получают АТФ за счет расщепления ацетил-КоА в цикле Кребса, и основными источниками энергии выступают глюкоза и свободные жирные кислоты (СЖК). При адекватном кровоснабжении 60-90% ацетил-КоА образуется за счет окисления свободных жирных кислот, а остальные 10-40% - за счет декарбоксилирования пировиноградной кислоты (ПВК). Примерно половина ПВК внутри клетки образуется за счет гликолиза, а вторая половина - из лактата, поступающего в клетку из крови. Катаболизм СЖК по сравнению с гликолизом тре- бует большего количества кислорода для синтеза эквивалентного числа АТФ. При достаточном поступлении кислорода в клетку глюкозная и жирнокислотная системы энергообеспечения находятся в состоянии динамического равновесия. В условиях гипоксии количество поступающего кислорода недостаточно для окисления жирных кислот.
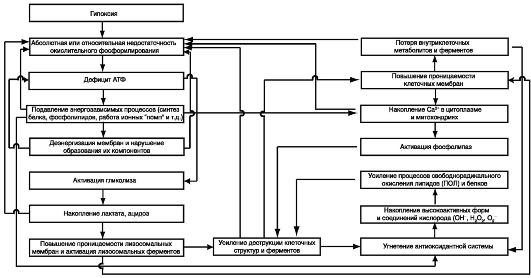
Схема 8.1. Некоторые звенья патогенеза гипоксических состояний
В результате в митохондриях происходит накопление недоокисленных активированных форм жирных кислот (ацилкарнитин, ацилКоА), которые способны блокировать адениннуклеотидтранслоказу, что сопровождается подавлением транспорта произведенного в митохондриях АТФ в цитозоль, и повреждать мембраны клеток, оказывать детергентное действие.
Для улучшения энергетического статуса клетки могут быть использованы несколько подходов:
- повышение эффективности использования митохондриями дефицитного кислорода вследствие предупреждения разобщения окисления и фосфорилирования, стабилизации мембран митохондрий;
- ослабление ингибирования реакций цикла Кребса, особенно поддержание активности сукцинатоксидазного звена;
- возмещение утраченных компонентов дыхательной цепи;
- формирование искусственных редокс-систем, шунтирующих перегруженную электронами дыхательную цепь;
- более экономное использование кислорода и снижение кислородного запроса тканей либо ингибирование путей его потребления, не являющихся необходимыми для экстренного поддержания жизнедеятельности в критических состояниях (нефосфорилирующее ферментативное окисление - терморегуляторное, микросомальное и др., неферментативное окисле- ние липидов);
- увеличение образования АТФ в ходе гликолиза без увеличения продукции лактата;
- снижение расходования АТФ клеткой на процессы, не определяющие экстренное поддержание жизнедеятельности в критиче- ских ситуациях (различные синтетические восстановительные реакции, функционирование энергозависимых транспортных систем и т. д.);
- введение извне высокоэнергетических соединений.
Классификация антигипоксантов
• Препараты с поливалентным действием.
• Ингибиторы окисления жирных кислот.
• Сукцинатсодержащие и сукцинатобразующие средства.
• Естественные компоненты дыхательной цепи.
• Искусственные редокс-системы.
• Макроэргические соединения.
8.1. ПРЕПАРАТЫ С ПОЛИВАЛЕНТНЫМ ДЕЙСТВИЕМ
• Гутимин.
• Амтизол.
Пионером в разработке антигипоксантов не только в нашей стране стала кафедра фармакологии Военно-медицинской академии. Еще в 1960-х гг. на ней под руководством профессора В. М. Виноградова были созданы первые антигипоксанты: гутимин, а затем амтизол, активно изучавшиеся впоследствии под руководством профессоров Л. В. Пастушенкова, А. Е. Александровой, А. В. Смирнова. Эти препараты показали высокую эффективность в клинических исследованиях, но, к сожалению, в настоящее время они не производятся и не применяются в медицинской практике.
8.2. ИНГИБИТОРЫ ОКИСЛЕНИЯ ЖИРНЫХ КИСЛОТ
• Триметазидин (Предуктал).
• Пергексилин.
• Мельдоний (Милдронат).
• Ранолазин (Ранекса).
• Этомоксир.
• Карнитин (Карнитен).
Средствами, близкими по фармакологическим эффектам (но не по строению) к гутимину и амтизолу, являются препараты - ингибиторы окисления жирных кислот, использующиеся в настоящее время пре- имущественно в комплексной терапии ишемической болезни сердца. Среди них выделяют прямые ингибиторы карнитин-пальмитоил- трансферазы-I (пергекселин, этомоксир), парциальные ингибиторы окисления жирных кислот (ранолазин, триметазидин, мельдоний) и непрямые ингибиторы окисления жирных кислот (карнитин). Точки приложения некоторых препаратов представлены на схеме 8.2.
Пергекселин и этомоксир способны угнетать активность карнитин- пальмитоил-трансферазы-I, нарушая таким образом перенос длинноцепочечных ацильных групп на карнитин, что приводит к блокаде образования ацилкарнитина. Вследствие этого снижается внутримитохондриальный уровень ацил-КоА и уменьшается NAD-H2/NAD соотношение, что сопровождается повышением активности пируватдегидрогеназы и фосфофруктокиназы, а следовательно стимуляцией окисления глюкозы, что является более энергетически выгодным по сравнению с окислением жирных кислот.
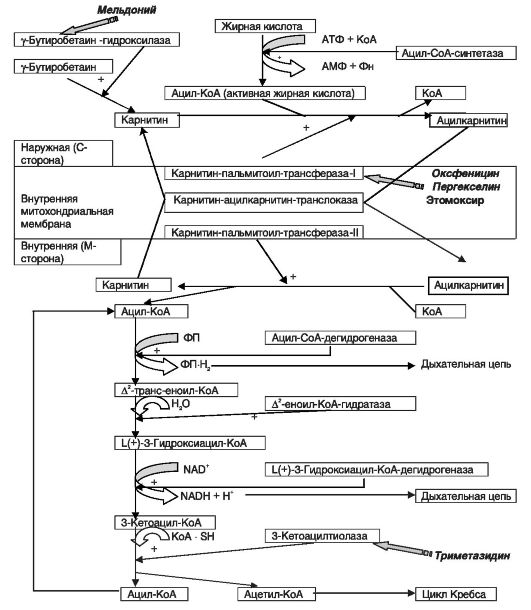
Схема 8.2. β-окисление жирных кислот и некоторые точки приложения лекарственных препаратов (адаптировано из Wolff A. A. [et al.], 2002)
Пергекселин назначается перорально в дозах 200-400 мг/сут длительностью до 3 месяцев. Препарат может комбинироваться с β-адреноблокаторами, блокаторами кальциевых каналов и нитратами. Однако его клиническое применение ограничивается неблагопри-
ятными эффектами - развитием нейропатии и гепатотоксичностью. Этомоксир используют в дозе 80 мг/сут длительностью до 3 месяцев. Однако для окончательного суждения об эффективности и безопасности препарата необходимо проведение дополнительных исследований. При этом особое внимание уделяется вопросу токсичности этомоксира, учитывая тот факт, что он является необратимым ингибитором карнитин-пальмитоилтрансферазы-I.
Триметазидин, ранолазин и мельдоний относят к парциальным ингибиторам окисления жирных кислот. Триметазидин (Предуктал) блокирует 3-кетоацилтиолазу, один из ключевых ферментов окисления жирных кислот. В результате тормозится окисление в митохондриях всех жирных кислот - как длинноцепочечных (количество атомов углерода больше 8), так и короткоцепочечных (количество атомов углерода меньше 8) однако никаким образом не изменяется накопление активированных жирных кислот в митохондриях. Под влиянием триметазидина увеличиваются окисление пирувата и гликолитическая продукция АТФ, уменьшается концентрация АМФ и АДФ, тормозятся накопление лактата и развитие ацидоза, подавляется свободнорадикальное окисление.
Триметазидин уменьшает скорость проникновения нейтрофильных гранулоцитов в миокард после реперфузии, вследствие чего уменьшается вторичное повреждение клеточных мембран продуктами перекисного окисления липидов. Кроме того, он обладает антитромбоцитарным действием и эффективен в предупреждении внутрикоронарной агрегации тромбоцитов, при этом, в отличие от аспирина, не влияя на коагуляцию и время кровотечения. По экспериментальным данным, триметазидин оказывает такое действие не только в миокарде, но и в других органах, т. е. по сути дела он является типичным антигипоксантом, перспективным для дальнейшего изучения и применения при различных критических состояниях.
В Европейском многоцентровом исследовании триметазидина (TEMS) у больных со стабильной стенокардией применение препарата способствовало уменьшению частоты и продолжительности эпизодов ишемии мио- карда на 25%, что сопровождалось повышением толерантности больных к физической нагрузке. Назначение триметазидина в сочетании с β-адреноблокаторами, нитратами и блокаторами кальциевых каналов способствует некоторому повышению эффективности антиангинальной терапии.
В настоящее время препарат применяется при ишемической болезни сердца, а также других заболеваниях, в основе которых лежит ишемия (например, при вестибулокохлеарной и хориоретинальной патологии) (табл. 8.1). Получены свидетельства эффективности пре-
парата при рефрактерной стенокардии. В комплексном лечении ИБС препарат назначается в виде лекарственной формы с замедленным высвобождением в разовой дозе 35 мг 2 раза в день, продолжительность курса может достигать 3 месяцев.
Раннее включение
триметазидина в комплексную терапию острого периода инфаркта миокарда
способствует ограничению размера некроза миокарда, предотвращает
развитие ранней постинфарктной дилатации левого желудочка, увеличивает
электрическую стабильность сердца, не влияя на параметры ЭКГ и
вариабельность сердечного ритма. В то же время в рамках закончившегося в
В небольшом рандомизированном контролируемом исследовании получены первые данные об эффективности триметазидина у больных с ХСН. Показано, что длительный прием препарата (в исследовании по 20 мг 3 раза в сутки на протяжении примерно 13 месяцев) улучшает функциональный класс и сократительную функцию левого желудочка у больных сердечной недостаточностью.
Побочные эффекты при приеме препарата (дискомфорт в области желудка, тошнота, головная боль, головокружения, бессонница) развиваются редко (табл. 8.2).
Ранолазин (Ранекса) также является ингибитором окисления жирных кислот, хотя его биохимическая мишень пока не установлена. Он оказывает антиишемическое действие вследствие ограничения использования в качестве энергетического субстрата свободных жирных кислот и повышения использования глюкозы. Это приводит к образованию большего количества АТФ на каждый моль потребленного кислорода.
Кроме того, показано, что ранолазин вызывает селективное ингибирование позднего натриевого потока и снижает индуцированную ишемией перегрузку клетки натрием и кальцием, тем самым улучшая перфузию и функциональные возможности миокарда. Как правило, разовая доза препарата составляет 500 мг 1 раз в сутки, так как одоб-
Таблица 8.1. Основные показания к применению и схемы назначения триметазидина
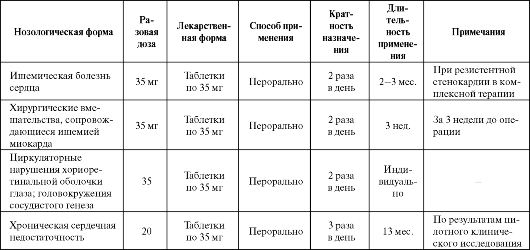
Таблица 8.2. Побочные эффекты и противопоказания к применению некоторых антигипоксантов
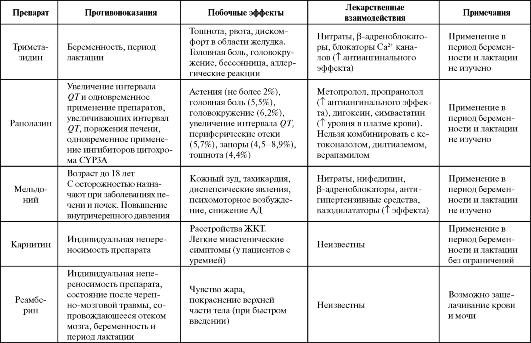
Продолжение табл. 8.2
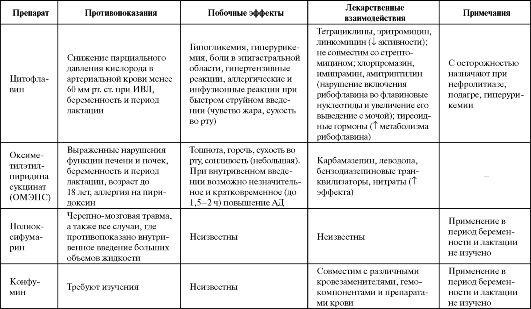
Продолжение таблицы 8.2
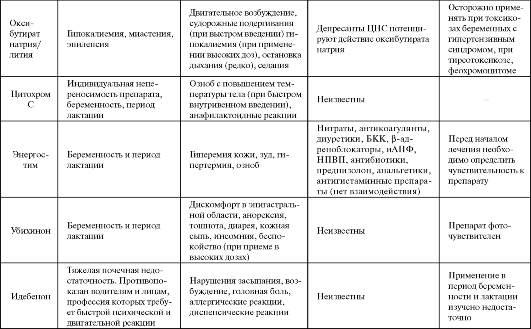
Окончание табл. 8.2
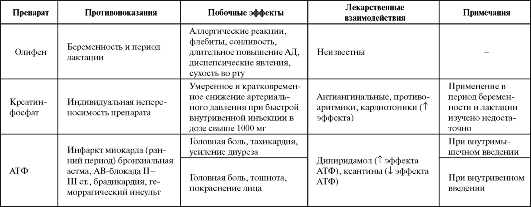
ренная для клинического применения форма ранолазина является препаратом с пролонгированным действием (ранолазин SR, 500 мг). Однако доза может быть увеличена до 1000 мг/сут.
Ранолазин обычно используется в комбинированной терапии больных ИБС вместе с пролонгированными нитратами, β-адреноблокаторами и дигидропиридиновыми блокаторами кальциевых каналов (например, амлодипином). Так, в рандомизированном плацебоконтролируемом исследовании ERICA показана антиангинальная эффективность ранолазина у больных со стабильной стенокардией, имевших приступы, несмотря на прием максимально рекомендуемой дозы амлодипина. Добавление 1000 мг ранолазина дважды в сутки на протяжении 6 недель привело к достоверному уменьшению частоты приступов стенокардии и доз нитроглицерина. У женщин влияние ранолазина на тяжесть симптомов стенокардии и толерантность к нагрузке ниже, чем у мужчин.
Результаты исследования MERLIN-TIMI 36, проводившегося для уточнения влияния ранолазина (внутривенно, затем перорально 1000 мг/сут) на частоту сердечно-сосудистых событий у больных с острым коронарным синдромом (нестабильная стенокардия или инфарктом миокарда без подъема сегмента ST), оценки эффективности и безопасности препарата в лечении ИБС продемонстрировали, что ранолазин уменьшает выраженность клинических симптомов, однако не влияет на долгосрочный риск смерти и инфаркта миокарда у пациентов с ИБС. Среднее время наблюдения составило 348 дней.
Частота регистрации основной конечной точки (сердечно-сосудистая смерть, ИМ, рецидивирующая ишемия миокарда) в данном исследовании была практически одинаковой в группах ранолазина и плацебо: 21,8 и 23,5%. Тем не менее риск рецидивирующей ишемии был достоверно ниже на фоне приема ранолазина: 13,9% против 16,1%. Риск сердечно-сосудистой смерти или ИМ в группах существенно не различался.
Анализ дополнительных конечных точек подтвердил антиангинальную эффективность ранолазина. Так, на фоне приема препарата был на 23% ниже риск ухудшения симптомов стенокардии и на 19% ниже вероятность назначения дополнительного антиангинального средства. Безопасность ранолазина и плацебо была сопоставимой.
В этом же исследовании была обнаружена антиаритмическая активность ранолазина у больных ОКС без подъема сегмента ST в течение первой недели после их госпитализации (уменьшение числа эпи- зодов желудочковой тахикардии (более 8 комплексов) (5,3% против 8,3% в контроле; р < 0,001), суправентрикулярной тахикардии (44,7% против 55,0% в контроле; р < 0,001) и тенденция к снижению парок-
сизмов фибрилляции предсердий (1,7% против 2,4%; р = 0,08). Более того, в группе ранолазина реже, чем в контроле, встречались паузы >3 с (3,1% против 4,3%; р = 0,01). Исследователями не отмечено межгрупповых различий в частоте развития полиморфной желудочковой тахикардии, а также в частоте внезапной смерти.
Предполагается, что антиаритмическая активность ранолазина связана с его способностью ингибировать позднюю фазу натриевого потока внутрь клетки во время реполяризации (поздний ток I), что вызывает снижение концентрации внутриклеточного натрия и перегрузки кардиомиоцитов кальцием, предотвращая развитие как механической дисфункции миокарда, сопровождающей ишемию, так и его электрической нестабильности.
Ранолазин обычно не вызывает выраженных побочных эффектов и не оказывает существенного влияния на ЧСС и АД, однако при применении относительно высоких доз и при комбинировании с β- адреноблокаторами или блокаторами кальциевых каналов могут наблюдаться умеренно выраженные головные боли, головокружения, астенические явления. Кроме того, возможность увеличения препаратом интервала QT накладывает определенные ограничения на его клиническое использование (см. табл. 8.2).
Мельдоний (милдронат) обратимо ограничивает скорость биосинтеза карнитина из его предшественника - γ-бутиробетаина. Вследствие этого нарушается карнитин-опосредованный транспорт длинноце- почечных жирных кислот через мембраны митохондрий без воздействия на метаболизм короткоцепочечных жирных кислот. Это означает, что мельдоний практически не способен оказывать токсического действия на дыхание митохондрий, так как не может полностью блокировать окисления всех жирных кислот. Частичная блокада окисления жирных кислот включает альтернативную систему производства энергии - окисление глюкозы, которая значительно эффективнее (на 12%) использует кислород для синтеза АТФ. Кроме того, под влиянием мельдония повышается концентрация γ-бутиробетаина, способного индуцировать образование NO, что приводит к уменьшению общего периферического сопротивления сосудов (ОПСС).
Мельдоний, как и триметазидин, при стабильной стенокардии уменьшает частоту приступов стенокардии, повышает толерантность больных к физической нагрузке и снижает среднее суточное потребление нитроглицерина (табл. 8.3). Препарат малотоксичен и не вызывает существенных побочных эффектов.
Карнитин (витамин ВТ) является эндогенным соединением и образуется из лизина и метионина в печени и почках. Он играет важную роль в
Таблица 8.3. Основные показания к применению и схемы назначения мельдония
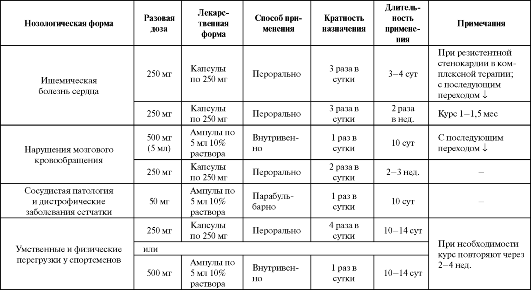
Таблица 8.4. Основные показания к применению и схемы назначения карнитина
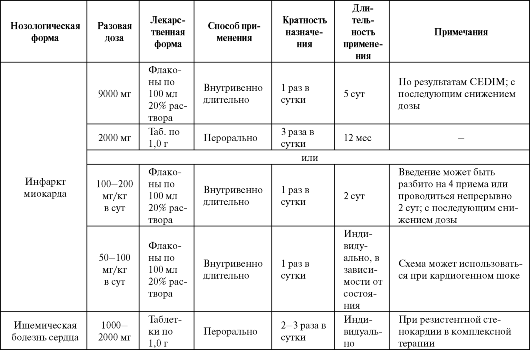
переносе длинноцепочечных жирных кислот через внутреннюю мембрану митохондрий, в то время как активация и проникновение низших жирных кислот происходит без картинитина. Кроме того, карнитин играет ключевую роль в образовании и регуляции уровня ацетил-КоА.
Физиологические концентрации карнитина обладают насыщающим действием на карнитин-пальмитоил-трансферазу-I, а увеличение дозы препарата не повышает транспорт ацильных групп жирных кислот в митохондрии при участии данного фермента. Однако это приводит к активации карнитин-ацилкарнитин-транслоказы (которая не насыщается физиологическими концентрациями карнитина) и снижению внутримитохондриальной концентрации ацетил-КоА, который транспортируется в цитозоль (через образование ацетилкарнитина). В цитозоле избыток ацетил-КоА подвергается воздействию ацетилКоА-карбоксилазы с образованием малонил-КоА, который обладает свойствами непрямого ингибитора карнитин-пальмитоил-трансфе- разы-I. Уменьшение же интрамитохондриального ацетил-КоА коррелирует с повышением уровня пируватдегидрогеназы, которая обеспечивает окисление пирувата и ограничивает продукцию лактата. Таким образом, антигипоксическое действие карнитина связано с блокадой транспорта жирных кислот в митохондрии, является дозозависимым и проявляется при назначении высоких доз препарата, в то время как низкие дозы обладают лишь специфическим витаминным действием.
Одно из самых больших исследований с применением карнитина - CEDIM. При проведении его было показано, что длительная терапия карнитином в достаточно высоких дозах у больных с инфарктом миокарда ограничивает дилатацию левого желудочка. Кроме того, положительный эффект от применения препарата получен при тяжелых черепно-мозговых травмах, гипоксии плода, отравлении угарным газом и т. д., однако большая вариабельность курсов применения и не всегда адекватная дозовая политика затрудняют интерпретацию ре- зультатов таких исследований. Некоторые показания к применению карнитина представлены в табл. 8.4.
8.3. СУКЦИНАТСОДЕРЖАЩИЕ И СУКЦИНАТОБРАЗУЮЩИЕ СРЕДСТВА
Сукцинатсодержащие средства
• Реамберин.
• Оксиметилэтилпиридина сукцинат (Мексидол, Мексикор).
Комбинированные:
• Цитофлавин (янтарная кислота + никотинамид + рибофлавина мононуклеотид + инозин).
Практическое использование в качестве антигипоксантов начали находить препараты, поддерживающие при гипоксии активность сукцинатоксидазного звена. Это FAD-зависимое звено цикла Кребса, позднее угнетающееся при гипоксии по сравнению с NAD-зависи- мыми оксидазами, может определенное время поддерживать энергопродукцию в клетке при условии наличия в митохондриях субстрата окисления в данном звене - сукцината (янтарной кислоты).
Одним из препаратов, созданных на основе янтарной кислоты, является реамберин - 1,5% раствор для инфузий, представляющий собой сбалансированный полиионный раствор с добавлением смешанной натрий N-метилглюкаминовой соли янтарной кислоты (до 15 г/л). Осмолярность этого раствора приближена к осмолярности плазмы человека. Изучение фармакокинетики реамберина показало, что при внутривенном введении в дозе 5 мг/кг максимальный уровень препарата (в пересчете на сукцинат) наблюдается в течение 1-й минуты после введения с последующим быстрым снижением до уровня 9-10 мкг/ мл. Через 40 минут после введения концентрация сукцината в крови возвращается к значениям, близким к фоновым (1-6 мкг/мл), что требует внутривенного капельного введения препарата.
Инфузия реамберина сопровождается повышением рН и буферной емкости крови, а также ощелачиванием мочи. В дополнение к антиги- поксантной активности, реамберин обладает дезинтоксикационным и антиоксидантным (за счет активации ферментативного звена антиоксидантной системы) действием. Основные показания к применению препарата представлены в табл. 8.5.
Применение реамберина (400 мл 1,5% раствора) у больных с многососудистым поражением коронарных артерий при аорто-маммар- но-коронарном шунтировании с пластикой левого желудочка и/или протезированием клапанов и использованием экстракорпорального кровообращения в интраоперационом периоде позволяет снизить частоту различных осложнений в раннем послеоперационном периоде (в том числе реинфарктов, инсультов, энцефалопатии). Для вынесения окончательного суждения об эффективности и безопасности препарата необходимо проведение крупных контролируемых клинических исследований.
Побочных эффектов у препарата немного, в основном это кратковременное чувство жара и покраснение верхней части тела. Противопоказан
Таблица 8.5. Основные показания к применению и схемы назначения реамберина в качестве антигипоксанта
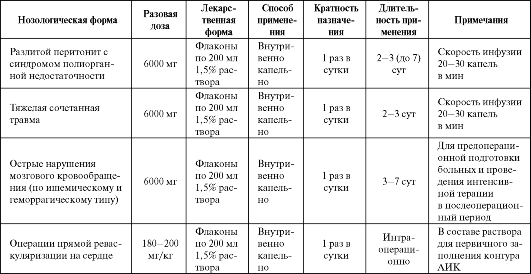
Примечание: * - разовая доза дана в пересчете на сукцинат; АПК - аппарат искусственного кровообращения.
реамберин при индивидуальной непереносимости, состояниях после черепно-мозговых травм, сопровождающихся отеком мозга (см. табл. 8.2).
Комбинированное антигипоксическое действие оказывает препарат цитофлавин (янтарная кислота, 1000 мг + никотинамид, 100 мг + + рибофлавина мононуклеотид, 20 мг + инозин, 200 мг). Основное антигипоксическое действие янтарной кислоты в данной рецептуре дополняется рибофлавином, способным за счет своих коферментных свойств увеличивать активность сукцинатдегидрогеназы и обладающим непрямым антиоксидантным действием (за счет восстановления окисленного глутатиона). Предполагается, что входящий в состав никотинамид активирует NAD-зависимые ферментные системы, однако этот эффект менее выражен, чем у NAD. За счет инозина достигается увеличение содержания общего пула пуриновых нуклеотидов, необходимых не только для ресинтеза макроэргов (АТФ и ГТФ), но и вторичных мессенджеров (цАМФ и цГМФ), а также нуклеиновых кислот. Определенную роль может играть способность инозина несколько подавлять активность ксантиноксидазы, уменьшая тем самым продукцию высокоактивных форм и соединений кислорода. Однако по сравнению с другими компонентами препарата, эффекты инозина отсрочены во времени. Основное применение цитофлавин нашел при гипоксических и ишемических повреждениях ЦНС (табл. 8.6). Наибольший эффект препарат оказывает в первые 24 ч после возникновения гипоксического расстройства.
В достаточно крупном многоцентровом плацебоконтролируемом клиническом исследовании, включившем 600 пациентов с хронической ишемией головного мозга, цитофлавин продемонстрировал способность уменьшать когнитивно-мнестические расстройства и неврологические нарушения; восстанавливать качество сна и повышать качество жизни. Однако для вынесения окончательного суждения об эффективности и безопасности препарата необходимо проведение крупных контролируемых клинических исследований.
Побочные эффекты цитофлавина представлены в табл. 8.2.
При применении препаратов, содержащих экзогенный сукцинат, необходимо учитывать, что он достаточно плохо проникает через биологические мембраны. Более перспективен здесь может быть оксиме- тилэтилпиридина сукцинат (мексидол, мексикор) - представляющий собой комплекс сукцината с антиоксидантом эмоксипином, обладающим относительно слабой антигипоксической активностью, но облегчающим транспорт сукцината через мембраны. Подобно эмоксипину, оксиметилэтилпиридина сукцинат (ОМЭПС) является ингибитором
Таблица 8.6. Основные показания к применению и схемы назначения цитофлавина
свободнорадикальных процессов, но оказывает более выраженное антигипоксическое действие. Основные фармакологические эффекты ОМЭПС можно суммировать следующим образом:
- активно реагирует с перекисными радикалами белков и липидов;
- оптимизирует энергосинтезирующие функции митохондрий в условиях гипоксии;
- оказывает модулирующее действие на некоторые мембрансвязанные ферменты (фосфодиэстеразу, аденилатциклазу), ионные каналы, улучшает синаптическую передачу;
- оказывает гиполипидемическое действие, снижает уровень перекисной модификации липопротеидов, уменьшает вязкость ли- пидного слоя клеточных мембран;
- блокирует синтез некоторых простагландинов, тромбоксана и лейкотриенов;
- улучшает реологические свойства крови, подавляет агрегацию тромбоцитов.
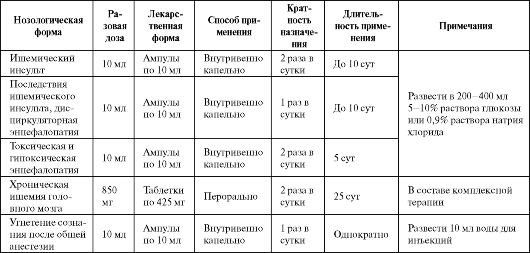
Основные клинические испытания ОМЭПС были проведены по изучению его эффективности при расстройствах ишемического генеза: в остром периоде инфаркта миокарда, ИБС, острых нарушениях мозгового кровообращения, дисциркуляторной энцефалопатии, вегетососудистой дистонии, атеросклеротических нарушениях функций мозга и других состояниях, сопровождающихся гипоксией тканей. Основные показания к назначению и схемы применения препарата приведены в табл. 8.7.
Продолжительность приема и выбор индивидуальной дозы зависят от тяжести состояния больного и эффективности терапии ОМЭПС. Для вынесения окончательного суждения об эффективности и безо- пасности препарата необходимо проведение крупных контролируемых клинических исследований.
Максимальная суточная доза не должна превышать 800 мг, разовая - 250 мг. Обычно ОМЭПС хорошо переносится. У некоторых больных возможно появление тошноты и сухости во рту (см. табл. 8.2). Противопоказан препарат при выраженных нарушениях функции печени и почек, аллергии к пиридоксину.
Сукцинатобразующие средства
• Оксибутират натрия/лития.
• Фумаратсодержащие препараты (Полиоксифумарин, Конфумин). Со способностью превращаться в сукцинат в цикле Робертса
(γ-аминобутиратном шунте) связано, очевидно, и противогипоксическое действие оксибутирата натрия/лития, хотя оно и не очень выражено. Трансаминирование γ-аминомасляной кислоты (ГАМК) с α-кетоглута-
Таблица 8.7. Основные показания к применению и схемы назначения ОМЭПС в качестве антигипоксанта
Окончание табл. 8.7
ровой кислотой является основным путем метаболической деградации ГАМК. Образующийся по ходу нейрохимической реакции полуальдегид янтарной кислоты с помощью сукцинатсемиальдегиддегидрогеназы при участии NAD окисляется в мозговой ткани в янтарную кислоту, которая включается в цикл трикарбоновых кислот (схема 8.3).
Такое дополнительное действие весьма полезно при использовании оксибутирата натрия в качестве общего анестетика (в высоких дозах). В условиях тяжелой циркуляторной гипоксии оксибутират в очень ко- роткие сроки успевает запустить не только клеточные адаптационные механизмы, но и подкрепить их перестройкой энергетического обмена в жизненно важных органах. Поэтому не стоит ожидать сколько-нибудь заметного эффекта от введения малых доз анестетика.
Средние дозы для натриевой соли оксибутирата составляют 70- 120 мг/кг (до 250-300 мг/кг, в этом случае антигипоксическое действие будет выражено максимально), для литиевой соли - 10-15 мг/кг 1-2 раза в сутки. Действие предварительно введенного оксибутирата предотвращает активацию перекисного окисления липидов в нервной системе и миокарде предупреждает развитие их повреждения при интенсивном эмоционально-болевом стрессе.
Кроме того, благоприятное действие оксибутирата натрия при гипоксии обусловлено тем, что он активирует энергетически более выгодный пентозный путь обмена глюкозы с ориентацией его на путь прямого окисления и образования пентоз, входящих в состав АТФ. Помимо этого, активация пентозного пути окисления глюкозы создает повышенный уровень NADPH, как необходимого кофактора синтеза гормонов, что особенно важно для функционирования надпочечников. Изменение гормонального фона при введении препарата сопровождается повышением в крови содержания глюкозы, которая дает максимальный выход АТФ на единицу использованного кислорода и способна поддерживать продукцию энергии в условиях недостатка кислорода. Оксибутират лития дополнительно способен подавлять тиреоидную активность (даже в низких дозах до 400 мг).
Натрия оксибутират нивелирует изменения в кислотно-основном равновесии, снижает количество недоокисленных продуктов в крови, улучшает микроциркуляцию, увеличивает скорость кровотока по капилля- рам, артериолам и венулам, ликвидирует явления стаза в капиллярах.
Мононаркоз оксибутиратом натрия представляет собой минимально токсичный вид общей анестезии и поэтому имеет наибольшую ценность у больных в состоянии гипоксии различной этиологии (тяжелая острая легочная недостаточность, кровопотеря, гипоксические
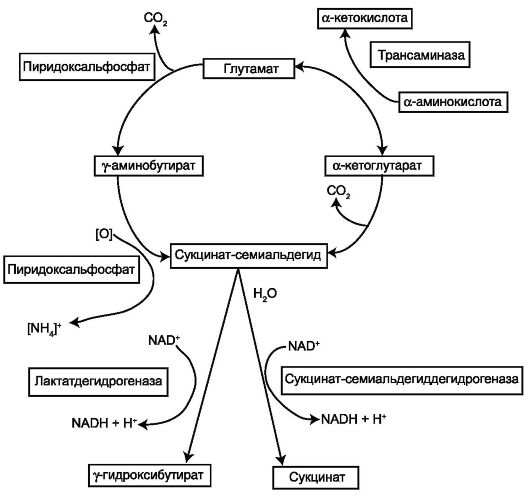
Схема 8.3. Метаболизм γ-аминобутирата (Rodwell V. W., 2003)
и токсические повреждения миокарда). Он также показан у пациентов с различными вариантами эндогенной интоксикации, сопровождающимися оксидативным стрессом (септические процессы, разлитой перитонит, печеночная и почечная недостаточность).
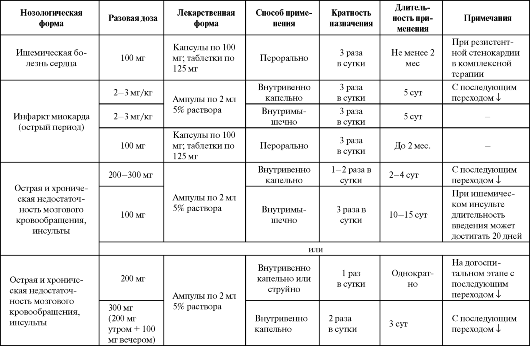
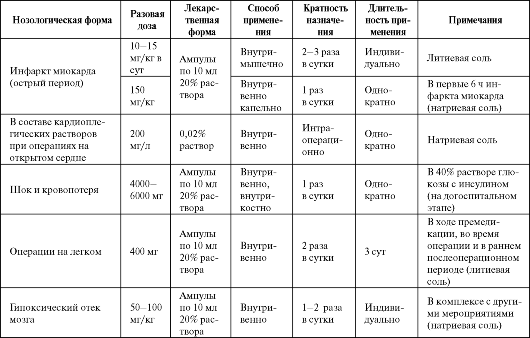
Отдельные показания к применению оксибутирата натрия/лития в качестве антигипоксанта представлены в табл. 8.8.
Использование оксибутирата лития при операциях на легких сопровождается более гладким послеоперационным течением, смягчением лихорадочных реакций, уменьшением потребности в обезболивающих средствах. Отмечается оптимизация функции дыхания и менее выраженная гипоксемия, стабильность показателей кровообра-
щения и ритма сердца, ускоренное восстановление уровня сывороточных трасаминаз и содержания лимфоцитов периферической крови. Натрия оксибутират вызывает перераспределение электролитов (Na+ и K+) между жидкостями организма, увеличивая концентрацию K+ в клетках некоторых органов (мозг, сердце, скелетные мышцы) с развитием умеренной гипокалиемии и гипернатриемии.
Побочные эффекты при применении препаратов редки, в основном при внутривенном введении (двигательное возбуждение, судорожные подергивания конечностей, рвота) (см. табл. 8.2). Эти неблагоприятные явления при применении оксибутирата могут быть предупреждены во время премедикации метоклопрамидом или купированы дипразином.
С обменом сукцината частично связан также противогипоксический эффект полиоксифумарина, представляющего собой коллоидный раствор для внутривенного введения (1,5% полиэтиленгликоля с молекулярной массой 17 000-26 000 Да с добавлением NaCl (6 г/л), MgCl (0,12 г/л), KI (0,5 г/л), а также фумарата натрия (14 г/л). Полиоксифумарин содержит один из компонентов цикла Кребса - фумарат, хорошо проникающий через мембраны и легко утилизируемый в митохондриях. При наиболее жесткой гипоксии происходит обращение терминальных реакций цикла Кребса, т. е. они начинают протекать в обратном направлении, и фумарат превращается в сукцинат с накоплением послед- него. При этом обеспечивается сопряженная регенерация окисленного NAD из его восстановленной при гипоксии формы, и, следовательно, возможность энергопродукции в NAD-зависимом звене митохондриального окисления. При уменьшении глубины гипоксии направление терминальных реакций цикла Кребса меняется на обычное, при этом накопившийся сукцинат активно окисляется в качестве эффективного источника энергии. В этих условиях и фумарат преимущественно окисляется после превращения в малат.
Солевой компонент кровезаменителя полностью метаболизируется, в то время как коллоидная основа (полиэтиленгликоль-20000) не метаболизируется. После однократной инфузии препарата 80-85% полимера выводится из кровеносного русла в первые сутки через почки, а полное выведение коллоидного компонента происходит к 5- 7-м суткам. Многократное введение полиоксифумарина не приводит к накоплению полиэтиленгликоля-20000 в органах и тканях и организм освобождается от него к 8-14 суткам.
Введение полиоксифумарина приводит не только к постинфузионной гемодилюции, в результате которой уменьшается вязкость крови и улучшаются ее реологические свойства, но и к повышению
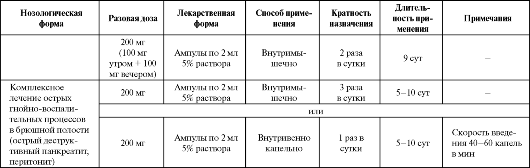
Таблица 8.8. Основные показания к применению и схемы назначения оксибутирата натрия/лития в качестве антигипоксанта
Окончание таблицы 8.8
диуреза и проявлению дезинтоксикационного действия. Входящий в состав фумарат натрия оказывает антигипоксическое действие. Некоторые показания к применению полиоксифумарина представлены в табл. 8.9.
Таблица 8.9. Основные показания к применению и схемы назначения полиоксифумарина
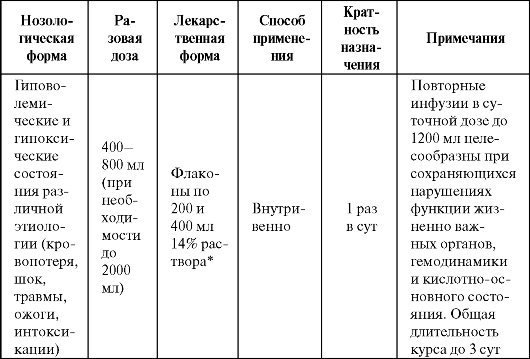
Примечание: * - в пересчете на фумарат.
Кроме того, полиоксифумарин используется в качестве компонента перфузионной среды для первичного заполнения контура АИК (150-400 мл, что составляет 11%-30% объема) при операциях коррекции врожденных и приобретенных пороков сердца в условиях искусственного кровообращения. При этом включение полиоксифумарина в состав перфузата положительно влияет на стабильность гемодинамики в постперфузионном периоде, снижает потребность в инотропной поддержке. Побочные эффекты препарата представлены в табл. 8.2.
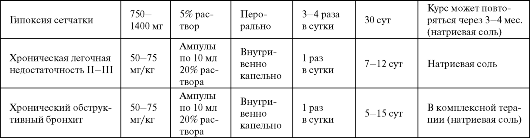
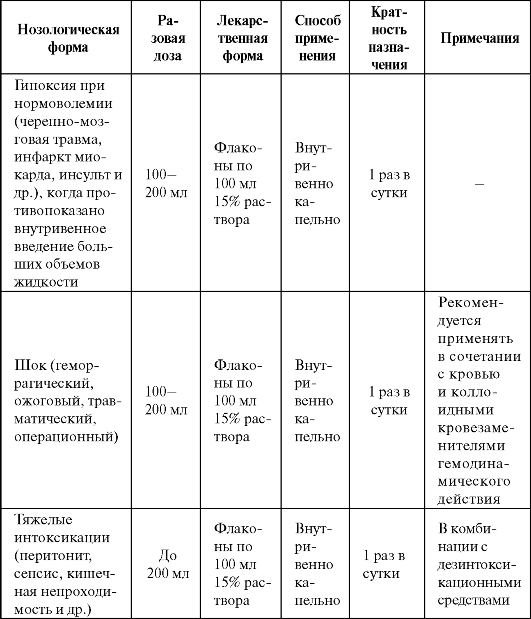
Конфумин - 15% раствор фумарата натрия для инфузий, дающий заметный антигипоксический эффект. Оказывает определенное кар- диотоническое и кардиопротекторное действие. Используется при различных гипоксических состояниях, в том числе в тех случаях, ког-
да противопоказано введение больших объемов жидкости и другие инфузионные препараты с антигипоксическим действием не могут быть использованы (табл. 8.10).
Таблица 8.10. Основные показания к применению и схемы назначения конфумина
Применение еще одного фумаратсодержащего препарата - мафусола - в настоящее время прекращено.
8.4. ЕСТЕСТВЕННЫЕ КОМПОНЕНТЫ ДЫХАТЕЛЬНОЙ ЦЕПИ
• Цитохром С (Цитомак).
• Убихинон (Убинон, Коэнзим Q10).
• Идебенон (Нобен). Комбинированные:
• Энергостим (цитохром С + NAD + инозин).
Практическое применение нашли и антигипоксанты, представляющие собой естественные для организма компоненты дыхательной цепи митохондрий, участвующие в переносе электронов. К ним от- носится цитохром С и убихинон (Убинон). Данные препараты, в сущности, выполняют функцию заместительной терапии, поскольку при гипоксии из-за структурных нарушений митохондрии теряют часть своих компонентов, включая переносчики электронов (схема 8.4).
В экспериментальных исследованиях доказано, что экзогенный цитохром С при гипоксии проникает в клетку и митохондрии, встра- ивается в дыхательную цепь и способствует нормализации энергопродуцирующего окислительного фосфорилирования.
Цитохром С может быть полезным средством комбинированной терапии критических состояний. Показана высокая эффективность препарата при отравлении снотворными средствами, окисью углерода, токсических, инфекционных и ишемических повреждениях миокарда, пневмониях, нарушениях мозгового и периферического кровообращения. Применяют также при асфиксии новорожденных и инфекционном гепатите. Обычная доза препарата составляет 10-15 мг внутривенно, внутримышечно или внутрь (1-2 раза в день).
У больных с инфарктом миокарда, получающих цитохром С, увеличиваются сократительная и насосная функции сердца, стабилизируется гемодинамика. Это улучшает прогноз инфаркта миокарда, уменьшает частоту и выраженность левожелудочковой недостаточности. Основные показания к применению цитохрома С представлены в табл. 8.11.
Комбинированным препаратом, содержащим цитохром С, является энергостим. В его состав помимо цитохрома С (10 мг) входят никотинамиддинуклеотид (0,5 мг) и инозин (80 мг). Данная комбинация дает аддитивный эффект, где эффекты NAD и инозина дополняют антигипоксическое действие цитохрома С. При этом экзогенно вводимый NAD несколько уменьшает дефицит цитозольного NAD и восстанавливает активность NAD-зависимых дегидрогеназ, участвующих в синтезе АТФ, способствует интенсификации работы дыхательной

Схема 8.4. Компоненты дыхательной цепи митохондрий и точки приложения некоторых антигипоксантов: комплекс I - NADH: убихинон-оксидоредуктаза; комплекс II - сукцинат: убихинон-оксидоредуктаза; комплекс III - убихинон: феррицитохром С-оксидоредуктаза; комплекс IV - ферроцитохром С: кислород-оксидоредуктаза; FeS - железо-серный белок; ФМН - флавинмононуклеотид; FAD - флавинадениндинуклеотид
цепи. За счет инозина достигается увеличение содержания общего пула пуриновых нуклеотидов. Препарат предлагается применять при инфаркте миокарда, а также при состояниях, сопровождающихся развитием гипоксии (табл. 8.12), однако доказательная база на настоящий момент достаточно слабая.
Побочные эффекты препарата представлены в табл. 8.2.
Убихинон (кофермент Q10) - кофермент, широко распространенный в клетках организма, в химическом отношении представляющий собой производное бензохинона. Основная часть внутриклеточного
Таблица 8.11. Основные показания к применению и схемы назначения цитохрома С
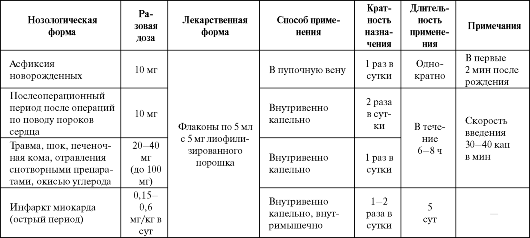
Таблица 8.12. Основные показания к применению и схемы назначения энергостима

Окончание таблицы 8.12
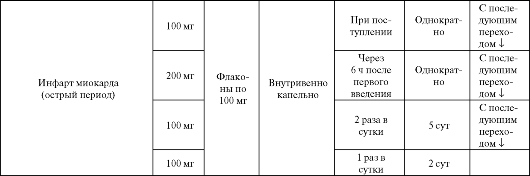
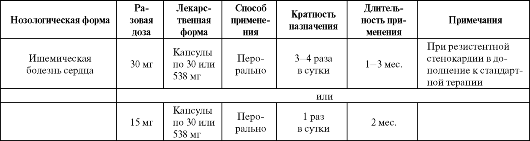
Таблица 8.13. Основные показания к применению и схемы назначения убихинона
Окончание табл. 8.13
убихинона сконцентрирована в митохондриях в окисленной (CoQ), восстановленной (СоН2, QH2) и полувосстановленной формах (семихинон, СоН, QH). В небольшом количестве он присутствует в ядрах, эндоплазматическом ретикулуме, лизосомах, аппарате Гольджи. Как и токоферол, убихинон в наибольших количествах содержится в органах с высокой интенсивностью метаболизма - сердце, печени, почках.
Он является переносчиком электронов и протонов от внутренней к наружной стороне мембраны митохондрий, компонентом дыхательной цепи (см. схему 8.4). Кроме того, убихинон кроме специфической окислительно-восстановительной функции способен выполнять роль антиоксиданта (см. лекцию «Клиническая фармакология антиоксидантов»).
Убихинон в основном используется в комплексной терапии больных ишемической болезнью сердца, при инфаркте миокарда, а также у пациентов с ХСН (табл. 8.13). Средние профилактические дозы препарата составляют 15 мг/сут, а терапевтические колеблются в интервале от 30-150 до 300 мг/сут. Максимальный уровень убихинона в крови отмечается примерно через 1 месяц регулярного приема, после чего стабилизируется.
При использовании препарата у больных с ИБС улучшается клиническое течение заболевания (преимущественно у больных с I- II ФК), снижается частота приступов; увеличивается толерантность к физической нагрузке; повышается в крови содержание простациклина и снижается тромбоксана. Однако необходимо учитывать, что сам препарат не приводит к увеличению коронарного кровотока и не способствует уменьшению кислородного запроса миокарда (хотя и может давать небольшой брадикардитический эффект). Вследствие этого антиангинальный эффект препарата проявляется через некоторое, иногда довольно значительное время (до 3 месяцев).
В комплексной терапии больных с ИБС убихинон может сочетаться с β-адреноблокаторами и ингибиторами ангиотензинпревращающего фермента. При этом снижается риск развития левожелудочковой сердечной недостаточности, нарушений сердечного ритма. Препарат малоэффективен у больных с резким снижением толерантности к физической нагрузке, а также при наличии высокой степени склеротического стенозирования коронарных артерий.
При ХСН использование убихинона в сочетании с дозированной физической нагрузкой (особенно в высоких дозах, до 300 мг/
сут) позволяет увеличить мощность сокращений левого желудочка и улучшить эндотелиальную функцию. Одновременно происходит существенное уменьшение плазменных уровней мочевой кислоты и значительное увеличение содержания липопротеидов высокой плотности (ЛПВП).
Следует отметить, что эффективность убихинона при ХСН в значительной мере зависит от его плазменного уровня, определяемого, в свою очередь, метаболическими потребностями различных тканей. Предполагается, что упомянутые выше положительные эффекты препарата проявляются только при превышении концентрации коэнзима Q10 в плазме свыше 2,5 мкг/мл (нормальная концентрация примерно 0,6-1,0 мкг/мл). Этот уровень достигается при назначении высоких доз препарата: прием 300 мг/сут коэнзима Q10 дает 4-кратное повышение его уровня в крови от исходного, но не при использовании низких доз (до 100 мг/сут). Поэтому, хотя ряд исследований при ХСН выполнялся с назначением пациентам убихинона в дозах 90-120 мг/сут, по-видимому, наиболее оптимальным при данной патологии следует считать использование высокодозовой терапии.
Согласно результатам небольшого пилотного исследования лечение убихиноном редуцирует выраженность миопатических симпто- мов у пациентов, получающих статины, уменьшает мышечную боль (на 40%) и улучшает ежедневную активность (на 38%) в отличие от токоферола, оказавшегося неэффективным.
Для вынесения окончательного суждения об эффективности и безопасности препарата необходимо проведение крупных контролируемых клинических исследований.
Препарат обычно хорошо переносится. Иногда возможны тошнота и расстройства стула, беспокойство и инсомнии (см. табл. 8.2), в этом случае прием препарата прекращают.
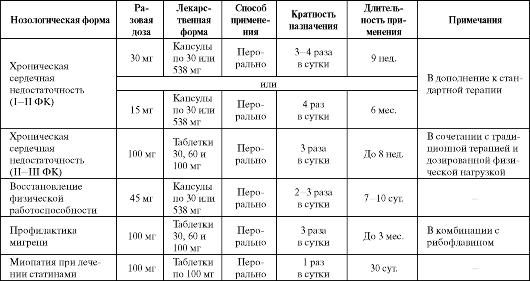
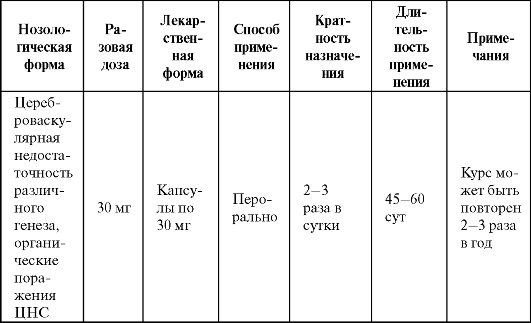
В качестве производного убихинона может рассматриваться идебенон, который по сравнению с коэнзимом Q10 обладает меньшим размером (в 5 раз), меньшей гидрофобностью и большей антиоксидантной активностью. Препарат проникает через гематоэнцефалический барьер и в значительных количествах распределяется в ткани мозга. Механизм действия идебенона сходен с таковым убихинона (см. схему 8.4). Наряду с антигипоксическим и антиоксидантным эффектами он оказывает мнемотропное и ноотропное действие, развивающееся после 20-25 дней лечения. Основные показания к применению идебенона представлены в табл. 8.14.
Таблица 8.14. Основные показания к применению и схемы назначения идебенона
Для вынесения окончательного суждения об эффективности и безопасности препарата необходимо проведение крупных контролируемых клинических исследований.
Наиболее частым побочным эффектом препарата (до 35%) является нарушение сна (см. табл. 8.2), обусловленное его активирующим действием, в связи с чем последний прием идебенона должен осущест- вляться не позднее 17 ч.
8.5. ИСКУССТВЕННЫЕ РЕДОКС-СИСТЕМЫ
• Олифен (Гипоксен).
Создание антигипоксантов с электроноакцепторными свойствами, образующими искусственные редокс-системы, преследует цель в какой-то мере компенсировать развивающийся при гипоксии дефи- цит естественного акцептора электронов - кислорода. Такие препараты должны шунтировать звенья дыхательной цепи, перегруженные электронами в условиях гипоксии, «снимать» электроны с этих звеньев и тем самым в определенной степени восстанавливать функцию дыхательной цепи и сопряженного с ней фосфорилирования. Кроме того, искусственные акцепторы электронов могут обеспечивать окис-
ление пиридиннуклеотидов (NADH) в цитозоле клетки, предупреждая в результате ингибирование гликолиза и избыточное накопление лактата.
Препараты, способные формировать искусственные редокс-сисемы, должны удовлетворять следующим основным требованиям:
- иметь оптимальный редокс-потенциал;
- обладать конформационной доступностью для взаимодействия с дыхательными ферментами;
- иметь свойство осуществлять как одно-, так и двухэлектронный перенос.
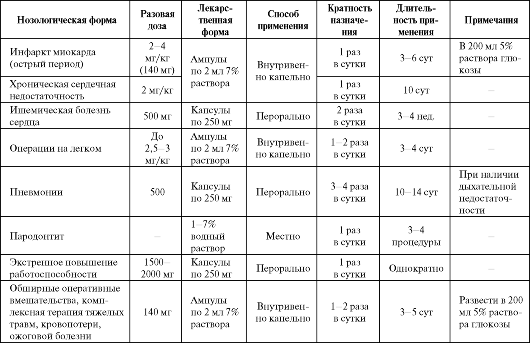
Из средств, формирующих искусственные редокс-системы, в медицинскую практику внедрен полидигидроксифенилентиосульфонат натрия (олифен, гипоксен), представляющий собой синтетический полихинон. В межклеточной жидкости препарат, очевидно, диссоциирует на полихиноновый катион и тиоловый анион. Антигипоксический эффект препарата связан, в первую очередь, с наличием в его структуре полифенольного хинонового компонента, участвующего в переносе электронов по дыхательной цепи.
• Олифен обладает высокой электрон-объемной емкостью, связанной с полимеризацией фенольных ядер в орто-положении, а антигипоксическое действие препарата осуществляется в результате шунтирования транспорта электронов в дыхательной цепи митохондрий (с I комплекса на III) (см. схему 8.4). В постгипоксическом периоде препарат приводит к быстрому окислению накопленных восстановленных эквивалентов (NADP H2, FADН). Способность легко образовывать семихинон обеспечивает ему заметное антиоксидантное действие, необходимое для нейтрализации продуктов перекисного окисления липидов.
При пероральном приеме препарат обладает высокой биодоступностью и достаточно равномерно распределяется в организме, несколько в большей степени накапливаясь в ткани головного мозга. Период полувыведения олифена составляет примерно 6 ч. Минимальная разовая доза, вызывающая отчетливый клинический эффект у человека при пероральном приеме, составляет около 250 мг.
Применение препарата разрешено при тяжелых травматических поражениях, шоке, кровопотере, обширных оперативных вмешатель- ствах. У больных с ИБС он уменьшает ишемические проявления, нормализует гемодинамику, снижает свертываемость крови и общее потребление кислорода. Клинические исследования показали, что
при включении олифена в комплекс терапевтических мероприятий понижается летальность больных с травматическим шоком, отмечается более быстрая стабилизация гемодинамических показателей в послеоперационном периоде.
У больных с ХСН на фоне приема олифена снижаются проявления тканевой гипоксии, но не происходит особого улучшения насосной функции сердца, что ограничивает применение препарата при острой сердечной недостаточности. Отсутствие положительного влияния на состояние нарушенной центральной и внутрисердечной гемодинамики при инфаркте миокарда не позволяет сформировать однозначного мнения об эффективности препарата при данной патологии. Кроме того, олифен не дает непосредственного антиангинального эффекта и не устраняет нарушений ритма, возникающих при инфаркте миокарда.
Курсовое применение препарата после операций сопровождается более быстрой стабилизацией главных гемодинамических показате- лей и восстановлением объема циркулирующей крови в послеоперационном периоде. Кроме того, выявлен антиагрегационный эффект препарата.
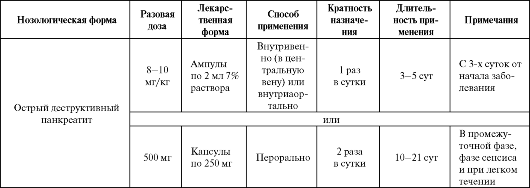
Олифен используется в комплексной терапии острого деструктивного панкреатита (ОДП). При данной патологии эффективность применения препарата тем выше, чем раньше начато лечение. При назначении олифена регионарно (внутриаортально) в раннюю фазу ОДП следует тщательно определять момент возникновения заболевания, так как по прошествии периода управляемости и наличии уже сформировавшегося панкреонекроза применение препарата противопоказано. Это связано с тем, что олифен, улучшая микро- циркуляцию вокруг зоны массивной деструкции, способствует развитию реперфузионного синдрома, и ишемизированная ткань, через которую возобновляется кровоток, становится дополнительным источником токсинов, что может спровоцировать развитие шока. Регионарная терапия олифеном при ОДП противопоказана: 1) при четких анамнестических указаниях, что длительность заболевания превышает 24 ч; 2) при эндотоксическом шоке или появлении его предвестников (нестабильность гемодинамики); 3) при наличии гемолиза и фибринолиза.
Местное использование олифена у больных с генерализованным пародонтитом позволяет устранить кровоточивость и воспаление десен, нормализовать показатели функциональной стойкости капилляров.
Остается открытым вопрос об эффективности олифена в остром периоде цереброваскулярных заболеваний (декомпенсация дисцир- куляторной энцефалопатии, ишемический инсульт). Показано отсутствие влияния препарата на состояние магистрального мозгового и динамику системного кровотока.
Применяют препарат перорально
(до приема пищи или во время еды с небольшим количеством воды),
внутривенно капельно или внут- риаортально (после трансфеморальной
катетеризации брюшной аорты до уровня чревного ствола. Средние разовые
дозы для взрослых составляют 0,5-1,0 г, суточные - 1,5-3,0 г. Для детей
разовая доза
Для вынесения окончательного суждения об эффективности и безопасности препарата необходимо проведение крупных контролируемых клинических исследований.
Среди побочных эффектов олифена можно отметить нежелательные вегетативные сдвиги, включая длительное повышение артериального давления или коллапсы у части больных, аллергические реакции и флебиты; редко кратковременное чувство сонливости, сухость во рту; при инфаркте миокарда может несколько пролонгироваться период синусовой тахикардии (см. табл. 8.2). При длительном курсовом применении олифена преобладают два основных побочных эффекта - острые флебиты (у 6% больных) и аллергические реакции в виде гиперемии ладоней и кожного зуда (у 4% больных), реже отмечаются кишечные расстройства (у 1% пациентов).
8.6. МАКРОЭРГИЧЕСКИЕ СОЕДИНЕНИЯ
• Креатинфосфат (Неотон).
Антигипоксантом, созданным на основе естественного для организма макроэргического соединения - креатинфосфата, - является препарат неотон. В миокарде и в скелетной мышце креатинфосфат выполняет роль резерва химической энергии и используется для ресинтеза АТФ, гидролиз которой обеспечивает образование энергии, необходимой в процессе сокращения актомиозина. Действие как эндогенного, так и экзогенно вводимого креатинфосфата состоит в непосредственном фосфорилировании АДФ и увеличении тем самым количества АТФ в клетке. Кроме того, под влиянием препарата ста- билизируется сарколеммальная мембрана ишемизированных кардиомиоцитов, снижается агрегация тромбоцитов и увеличивается плас-
Таблица 8.15. Основные показания к применению и схемы назначения олифена
Окончание табл. 8.15
тичность мембран эритроцитов. Наиболее изучено нормализующее влияние неотона на метаболизм и функции миокарда, так как при повреждении миокарда существует тесная связь между содержанием в клетке высокоэнергетических фосфорилирующих соединений, выживаемостью клетки и способностью к восстановлению функции сокращения.
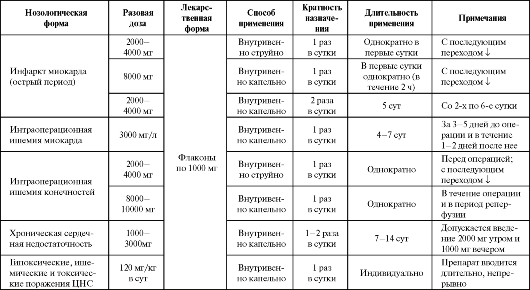
Основными показаниями к применению креатинфосфата являются инфаркт миокарда (острый период), интраоперационная ишемия миокарда или конечностей, хроническая сердечная недостаточность (табл. 8.16). При этом следует отметить, что однократная инфузия препарата не влияет на клинический статус и состояние сократительной функции левого желудочка.
Показана эффективность препарата у больных с острым нарушением мозгового кровообращения. Кроме того, препарат может быть использован и в спортивной медицине для предотвращения неблагоприятных последствий физического перенапряжения. Дозы внутривенно капельно вводимого препарата различаются в зависимости от вида патологии. Включение неотона в состав комплексной терапии ХСН позволяет, как правило, уменьшить дозу сердечных гликозидов и диуретиков.
Для вынесения окончательного суждения об эффективности и безопасности препарата необходимо проведение крупных контроли- руемых клинических исследований. Также требует дополнительного изучения экономическая целесообразность применения креатинфосфата, учитывая его высокую стоимость.
Побочные эффекты развиваются
редко (см. табл. 8.2), иногда возможно кратковременное снижение
артериального давления при быстрой внутривенной инъекции в дозе свыше
Иногда в качестве макроэргического антигипоксанта рассматривают АТФ (кислота аденозинтрифосфорная). Результаты применения АТФ в качестве антигипоксанта оказались противоречивы, а клинические перспективы сомнительны, что объясняется чрезвычайно плохим проникновением экзогенной АТФ через неповрежденные мембраны и ее дефосфорилированием в крови.
В то же время определенный терапевтический эффект, не связанный с прямым антигипоксическим действием, препарат все же оказывает, что обусловлено как его нейромедиаторными свойствами (влияние на адрено-, холино-, пуриновые рецепторы), так и влиянием на обмен веществ и клеточные мембраны продуктов де-
Таблица 8.16. Основные показания к применению и схемы назначения креатинфосфата
градации АТФ-АМФ, цАМФ, аденозина, инозина. В условиях кислороддефицитных состояний, вероятно, могут проявляться новые свойства адениннуклеотидов как эндогенных внутриклеточных регуляторов метаболизма, функция которых направлена на защиту клетки от гипоксии.
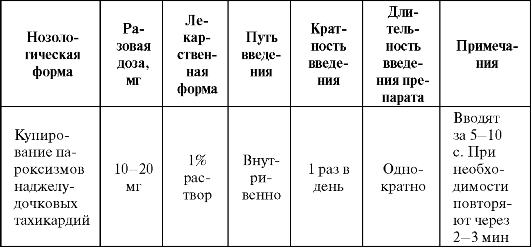
Дефосфорилирование АТФ приводит к накоплению аденозина, обладающего вазодилататорным, антиаритмическим, антиангинальным и антиагрегационным эффектом и реализующего свои эффекты через Р1-Р2-пуринергические (аденозиновые) рецепторы в различных тканях. Основные показания к применению АТФ представлены в табл. 8.17.
Таблица 8.17. Основные показания к применению и схемы назначения АТФ
Завершая характеристику антигипоксантов, необходимо еще раз подчеркнуть, что применение данных препаратов имеет самые широкие перспективы, поскольку антигипоксанты нормализуют саму основу жизнедеятельности клетки - ее энергетику, определяющую все остальные функции. Поэтому использование антигипоксических средств в критических состояниях может предотвращать развитие необратимых изменений в органах и вносить решающий вклад в спасение больного.
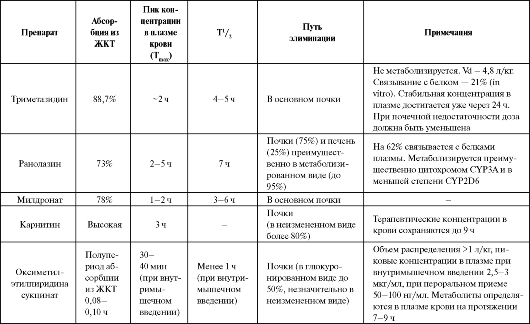
Практическое использование препаратов данного класса должно основываться на раскрытии их механизмов антигипоксического дейс- твия, учете фармакокинетических особенностей (табл. 8.18), результатах крупных рандомизированных клинических исследований и экономической целесообразности.
Таблица 8.18. Фармакокинетика некоторых антигипоксантов
Окончание таблицы 8.18

ЛИТЕРАТУРА
Александрова А. Е. Антигипоксическая активность и механизм действия олифена / А. Е. Александрова, С. Ф. Енохин, Ю. В. Медведев // Гипоксия: механизмы, адаптация, коррекция // Материалы Второй Всероссийской конференции. - М., 1999. - С. 5.
Андриадзе Н. А. Антигипоксант прямого действия энергостим в лечении острого инфаркта миокарда / Н. А. Андриадзе, Г. В. Сукоян, Н. О. Отаришвили и др. // Росс. мед. вести. - 2001. - ? 2. - С. 31-42.
Андрианов В. П. Применение антигипоксантов олифена и амтизола для ле- чения больных с хронической недостаточностью кровообращения 11Б стадии / В. П. Андрианов, С. А.Бойцов, А. В. Смирнов и др. // Терапевтический архив. - 1996. - ? 5. - С. 74-78.
Антигипоксанты: сб. трудов / под ред. Л. Д. Лукьяновой // Итоги науки и техники. ВИНИТИ. - Сер. Фармакология. Химиотерапевтические средства. - М., 1991. - Т. 27. - 196 с.
Афанасьев В. В. Цитофлавин в интенсивной терапии: пособие для врачей /
В. В. Афанасьев. - СПб.: Б. и., 2006. - 36 с.
Березовский В. А. Патогенные и саногенные эффекты действия гипоксии на организм человека / В. А. Березовский // Кислородное голодание и способы коррекции гипоксии: сб. науч. трудов. - Киев: Наукова думка, 1990. - С. 3-11.
Гипоксен. Применение в клинической практике (основные эффекты, механизм действия, применение). - М.: Б. и., 2006. - 16 с.
Гуревич К. Г. Применение триметазидина в современной клинической практике / К. Г. Гуревич // Фарматека. - 2006. - ? 5. - С. 62-65.
Калвиньш И. Я. Милдронат. Механизм действия и перспективы его применения / И. Я. Калвиньш. - Рига: Гриндекс, 2002. - 39 с.
Копцов С. В. Современные аспекты применения антигипоксантов в медицине критических состояний / С. В. Копцов, А. Е. Вахрушев, Ю. В. Павлов // Новые Санкт-Петербургские врачебные ведомости. - 2002. - ? 2. - С. 54-56.
Костюченко А. Л. Применение антигипоксантов в интенсивной терапии / Интенсивная терапия послеоперационных осложнений: руководство для врачей / А. Л. Костюченко, К. Я. Гуревич, М. И. Лыткин. - СПб.: СпецЛит,
2000. - С. 87-92.
Костюченко А. Л. Современные реальности клинического применения анти- гипоксантов / А. Л. Костюченко, Н. Ю. Семиголовский // ФАРМиндекс: ПРАКТИК. - 2002. - Вып. 3. - С. 102-122.
Коэнзим Q10 (убихинон) в клинической практике / под ред. Л. П. Гринио. -
М.: Медицина, 2006. - 120 с.
Куликов К. Г. Вторичная митохондриальная дисфункция при остром коро- нарном синдроме: возможности коррекции миокардиальными цитопротекторами / К. Г. Куликов, Ю. А. Васюк, О. Н. Кудряков и др. // Клиническая фармакология и терапия. - 2007. - Т 16, ? 3. - С. 80-85.
Левитина Е. В. Влияние мексидола на клинико-биохимические проявления перинатальной гипоксии у новорожденных детей / Е. В. Левитина // Эксперим. и клинич. фармакол. - 2001. - Т. 64, ? 5. - С. 34-36.
Лукьянова Л. Д. Молекулярные механизмы гипоксии и современные подходы: фармакологической коррекции гипоксических нарушений / Л. Д. Лукьянова // Фармакотерапия гипоксии и ее последствий при критических состояниях // Материалы Всероссийской научной конференции. - СПб., 2004. - С. 36-39.
Магомедов Н. М. Перекисное окисление липидов в структурно-функцио- нальных нарушениях различных мембран при гипоксии и ишемии: автореф. дисс. ... д-ра биол. наук / Н. М. Магомедов. - М., 1993. - 38 с.
Неверов И.В. Место антиоксидантов в комплексной терапии пожилых больных ИБС / И. В. Неверов // Русский медицинский журнал. - 2001. - Т. 9, ? 18. - http://speclit. med-lib. ru/card/104. shtml.
Оковитый С. В. Антигипоксанты / С. В. Оковитый, А. В. Смирнов // Эксперим. и клинич. фармакол. - 2001. - Т. 64, ? 3. - С. 76-80.
Оковитый С. В. Клиническая фармакология антигипоксантов (I) / С. В. Око-
витый // ФАРМиндекс: ПРАКТИК. - 2004. - Вып. 6. - С. 30-39.
Оковитый С. В. Клиническая фармакология антигипоксантов (II) / С. В. Око-
витый // ФАРМиндекс: ПРАКТИК. - 2005. - Вып. 7. - С. 48-63.
Перепеч Н. Б. Неотон (механизмы действия и клиническое применение). - 2-е изд. / Н. Б. Перепеч. - СПб.: Б. и., 2001. - 96 с.
Перепеч Н. Б. Олифен в терапии ишемической болезни сердца - результаты и перспективы клинического применения / Н. Б. Перепеч, И. Е. Михайлова,
A. О. Недошивин и др. // Международные медицинские обзоры. - 1993. - Т. 1, ? 4. - С. 328-333.
Попова Т. Е. Особенности развития и коррекции гипоксии у больных с ишемическим инсультом: автореф. дисс. . канд. мед. наук / Т. Е. Попова. - М.,
2001. - 22 с.
Проблемы гипоксии: молекулярные, физиологические м медицинские аспекты / под ред. Л. Д. Лукьяновой, И. Б. Ушакова. - М.; Воронеж: Истоки,
2004. - 590 с.
Реамберин: реальность и перспективы: сб. науч. статей. - СПб.: Б. и.,
2002. - 168 с.
Ремезова О. В. Применение антигипоксанта олифена в качестве средства профилактики и лечения атеросклероза / О. В. Ремезова, В. Е. Рыженков, Н. А. Беляков // Международные медицинские обзоры. - 1993. - Т. 1, ? 4. - С. 324-327.
Рысев А. В. Опыт применения цитопротекторов при остром коронарном синдроме и инфаркте миокарда / А. В. Рысев, И. В. Загашвили, Б. Л. Шейпак,
B. А. Литвиненко. - http://www. terramedica. spb. ru/1_2003/rysev. htm.
Рябов Г. А. Гипоксия критических состояний / Г. А. Рябов. - М.: Медицина, 1988. - 287 с.
Сариев А. К. Взаимосвязь глюкуроноконъюгации мексидола и особенностей его терапевтического действия у больных с органическим поражением ЦНС / А. К. Сариев, И. А. Давыдова, Г. Г. Незнамов и др. // Эксперим. и клинич. фармакол. - 2001. - Т 64, ? 3. - С. 17-21.
Семиголовский Н. Ю. Антигипоксанты в анестезиологии и реаниматологии: автореф. дисс. ... д-ра мед. наук / Н. Ю. Семиголовский. - СПб., 1997. - 42 с.
Семиголовский Н. Ю. Применение антигипоксантов в остром периоде инфаркта миокарда / Н. Ю. Семиголовский // Анестезиология и реаниматология. - 1998. - ? 2. - С. 56-59.
Семиголовский Н. Ю. Спорный опыт применения олифена в интенсивной терапии больных острым инфарктом миокарда / Н. Ю. Семиголовский, К. М. Шперлинг, А. Л. Костюченко // Фармакотерапия гипоксии и ее последствий при критических состояниях // Материалы Всероссийской научной конференции. - СПб., 2004. - С. 106-108.
Сидоренко Г. И. Опыт применения актопротектора реамберина в клинике кардиохирургии / Г. И. Сидоренко, С. Ф. Золотухина, С. М. Комисарова и др. // Клиническая фармакология и терапия. - 2007. - Т 16, ? 3. - С. 39-43.
Смирнов А. В. Антигипоксанты в неотложной медицине / А. В. Смир- нов, Б. И. Криворучко // Анестезиология и реаниматология. - 1998. -
? 2. - С. 50-55.
Смирнов А. В. Антиоксидантные эффекты амтизола и триметазидина / А. В. Смирнов, Б. И. Криворучко, И. В. Зарубина, О. П. Миронова // Эксперим. и клинич. фармакол. - 1999. - Т. 62, ? 5. - С. 59-62.
Смирнов А. В. Коррекция гипоксических и ишемических состояний с помощью антигипоксантов / А. В. Смирнов, И. В. Аксенов, К. К. Зайцева // Воен.- мед. журн. - 1992. - ? 10. - С. 36-40.
Смирнов В. П. Повреждение и фармако-холодовая защита миокарда при ишемии: автореф. дисс. ... д-ра мед. наук / В. П. Смирнов. - СПб., 1993. - 38 с.
Смирнов В. С. Гипоксен / В. С. Смирнов, М. К. Кузьмич. - СПб.: ФАРМиндекс, 2001. - 104 с.
Федин А. Клиническая эффективность цитофлавина у больных с хронической ишемией головного мозга (многоцентровое плацебоконтролируемое рандомизированное исследование) / А. Федин, С. Румянцева, М. Пирадов и др. //
Врач. - 2006. - ? 13. - С. 1-5.
Шах Б. Н. Отчет о клиническом испытании препарата Полиоксифумарин / Б. Н. Шах, В. Г. Вербицкий. - http://www. samson-med. com. ru/razrab_01. html.
Шилов А. М. Антигипоксанты и антиоксиданты в кардиологической практике / А. М. Шилов. - http://www. infarktu. net/catalog/articles/269.
Belardinelli R. Coenzyme Q10 and exercise training in chronic heart failure / R. Belardinelli, A. Mucaj, F. Lacalaprice, M. Solenghi et al. // European Heart Journal. - 2006. - Vol. 27, ? 22. - P. 2675-2681.
Bielefeld D. R. Inhibition of carnitine palmitoyl-CoA transferase activity and fatty acid oxidation by lactate and oxfenicine in cardiac muscle / D. R. Bielefeld, T. C. Vary, J. R. Neely // J. Mol. Cell. Cardiol. - 1985. - Vol. 17. - P. 619-625.
Caso G. Effect of coenzyme q10 on myopathic symptoms in patients treated with statins / G. Caso, P. Kelly, M. A. McNurlan, W. E. Lawson // Am. J. Cardiol. - 2007. - Vol. 99, ? 10. - 1409-1412.
Chaitman B. R. Anti-Ischemic effects and long-term survival during ranolazine monotherapy in patients with chronic severe angina / B. R. Chaitman, S. L. Skettino, J. O. Parker et al. // J. Am. Coll. Cardiol. - 2004. - Vol. 43, ? 8. - P. 1375-1382.
Chaitman B. R. Efficacy and safety of a metabolic modulator drug in chronic stable angina: review of evidence from clinical trials / B. R. Chaitman // J. Cardiovasc. Pharmacol. Ther. - 2004. - Vol. 9, Suppl. 1. - Р. S47-S64.
Chambers D. J. Creatine phosphate (Neoton) as an additive to St. Thomas' Hospital cardioplegic solution (Plegisol). Results of a clinical study / D. J. Chambers, M. V. Braimbridge, S. Kosker et al. // Eur. J. Cardiothorac. Surg. - 1991. - Vol. 5, ? 2. - P. 74-81.
Cole P. L. Efficacy and safety of perhexiline maleate in refractory angina. A doubleblind placebo-controlled clinical trial ofa novel antianginal agent / P. L. Cole, A. D. Beamer, N. McGowan et al. // Circulation. - 1990. - Vol. 81. - P. 1260-1270.
Colonna P. Myocardial infarction and left ventricular remodeling: results
of the CEDIM trial / P. Colonna, S. Illiceto. - Am. Heart J. - 2000. - Vol.
139. - Р. 124-S130.
Dzerve V. Mildronate improves peripheral circulation in patients with chronic heart failure: results of a clinical trial (the first report) / V. Dzerve, D. Matisone, I. Kukulis et al. // Seminars in Cardiology. - 2005. - Vol. 11, ? 2. - P. 56-64.
Effect of 48-th intravenous trimetazidine on shortand long-term outcomes of patients with acute myocardial infarction, with and without thrombolytic therapy; A double-blind, placebo-controlled, randomized trial. The EMIP-FR Group. European Myocardial Infarction Project-Free Radicals // Eur. Heart J. - 2000. - Vol. 21, ? 18. - С. 1537-1546.
Fragasso G. A. randomized clinical trial of trimetazidine, a partial free fatty acid oxidation inhibitor, in patients with heart failure / G. Fragasso, А. Palloshi, Р. Puccetti et al. // J. Am. Coll Cardiol. - 2006. - Vol. 48, ? 5. - Р. 992-998.
Geromel V. Coenzyme Q and idebenone in the therapy of respiratory chain disease: rationale and comparative benefits / V. Geromel, D. Chretien, P. Benit et al. // Mol.
Genet. Metab. - 2002. - Vol. 77. - P. 21-30.
GrynbergA.. The EMIP-FR Study: the evolution of scientific background as a non-controlled parameter / A. Grynberg // Eur. Heart J. - 2001. - Vol. 22, ? 11. - P. 975-977.
Hermann H. P. Energetic stimulation of the heart / H. P. Hermann // Cardiovasc Drugs Ther. - 2001. - Vol. 15, ? 5. - Р. 405-411.
Higgins A. J. Oxfenicine diverts rat muscle metabolism from fatty acid to carbohydrate oxidation and protects the ischaemic rat heart / A. J. Higgins, M. Morville, R. A. Burges et al. // Life Sci. - 1980. - Vol. 27. - P. 963-970.
Jeffrey F. M. N. Direct evidence that perhexeline modifies myocardial substrate utilization from fatty acids to lactate / F. M. N. Jeffrey, L. Alvarez, V. Diczku et al. // J. Cardiovasc. Pharmacol. - 1995. - Vol. 25. - P. 469-472.
Kantor P. F. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long-chain 3-keto- acyl coenzyme A thiolase / P. F. Kantor, A. Lucien, R. Kozak, G. D. Lopaschuk // Circ
Res. - 2000. - Vol. 86, ? 5. - Р. 580-588.
Kennedy J. A. Inhibition of carnitine palmitoiltransferase-
Killalea S. M. Systematic review of the efficacy and safety of perhexiline in the treatment of ischemic heart disease / S. M. Killalea, H. Krum // Am. J. Cardiovasc. Drugs. - 2001. - Vol. 1, ? 3. - P. 193-204.
Lopaschuk G. D. Optimizing cardiac energy metabolism: how can fatty acid and carbohydrate metabolism be manipulated? / G. D. Lopaschuk // Coron Artery Dis. - 2001. - Vol. 12, Suppl. 1. - Р. S8-S11.
Marti Masso J. F. Trimetazidine-Induced parkinsonism / J. F. Marti Masso // Neurologia. - 2004. - Vol. 19, ? 7. - P. 392-395.
Marzilli M. Cardioprotective effects of trimetazidine: a review / M. Marzilli // Curr. Med. Res. Opin. - 2003. - Vol. 19, ? 7. - P. 661-672.
McClella K J. Trimetazidine. A review of its use in stable angina pectoris and other coronary conditions / K. J. McClella, G. L. Plosker // Drugs. - 1999. - Vol. 58. - IP 143-157.
Mengi S. A. Carnitine palmitoyltransferase-I, a new target for the treatment of heart failure: perspectives on a shift in myocardial metabolism as a therapeutic intervention / S. A. Mengi, N. S. Dhalla // Am. J. Cardiovasc. Drugs. - 2004. - Vol. 4, ? 4. - Р. 201-209.
Minko T. Remediation of cellular hypoxic damage by pharmacological agents /T Minko, Y. Wang, V. Pozharov // Curr. Pharm. Des. - 2005. - Vol. 11, ? 24. -P. 3185-3199.
Morrow D. A. Effects of ranolazine on recurrent cardiovascular events in patients with non-ST-elevation acute coronary syndromes. The MERLIN-TIMI 36 randomized trial / D. A. Morrow, B. M. Scirica, E. Karwatowska-Prokopczuk et al. // JAMA. - 2007. -
Vol. 297. - P. 1775-1783.
Myrmel T. New aspects of myocardial oxygen consumption. Invited review / T. Myrmel, C. Korvald // Scand. Cardiovasc J. - 2000. - Vol. 34, ? 3. - Р. 233-241.
OnbasiliA. O. Trimetazidine in the prevention of contrast-Induced nephropathy after coronary procedures / A. O. Onbasili, Y. Yeniceriglu, P. Agaoglu et al. // Heart. - 2007. -
Vol. 93, ? 6. - Р. 698-702.
Philpott A. Development of a regimen for rapid initiation of perhexiline therapy in acute coronary syndromes / A. Philpott, S. Chandy, R. Morris, J. D. Horowitz // Intern.
Med. J. - 2004. - Vol. 34, ? 6. - P. 361-363.
Rodwell V. W. Conversion of amino acids to specialized products / Harper's Illustrated Biochemistry (26th Edition) / V. W. Rodwell, еd. by R. K. Murray. - N.Y.; London : McGraw-Hill, 2003. - 693 p.
Rousseau M. F. Comparative efficacy of ranolazine versus atenolol for chronic angina pectoris / M. F. Rousseau, H. Pouleur, G. Cocco, A. A. Wolff // Am. J. Cardiol. - 2005. -
Vol. 95, ? 3. - Р. 311-316.
Ruda M. Y. Reduction
of ventricular arrhythmias by phosphocreatine (Neoton) in patients
with acute myocardial infarction / M. Y. Ruda, M. B. Samarenko, N. I.
Afonskaya, V. A. Saks // Am Heart J. - 1988. - Vol. 116,
Sabbah H. H. Partial fatty acid oxidation inhibitors: a potentially new class of drugs
for heart failure / H. H. Sabbah, W. C. Stanley // Europ. J. Heart. Fail. - 2002. -
Vol. 4, ? 1. - Р. 3-6.
Sandor P. S. Efficacy of coenzyme Q10 in migraine prophylaxis: A randomized controlled trial / P. S. Sandor, L. Di Clemente, G. Coppola et al. // Neurology. -
2005. - Vol. 64, ? 4. - P. 713-715.
Schofield R. S. Role of metabolically active drugs in the management of ischemic heart disease / R. S. Schofield, J. A. Hill // Am. J. Cardiovasc. Drugs. - 2001. - Vol. 1, ? 1. - Р. 23-35.
Schram G. Ranolazine: ion-channel-blocking actions and in vivo electrophysiological effects / G. Schram, L. Zhang, K. Derakhchan et al. // Br. J. Pharmacol. - 2004. - Vol. 142, ? 8. - Р. 1300-1308.
Scirica B. M. Effect of ranolazine, an antianginal agent with novel electrophysiological properties, on the incidence of arrhythmias in patients with non-ST-segment-elevation acute coronary syndrome. Results from the metabolic efficiency with ranolazine for less ischemia in non-ST-elevation acute coronary syndrome-thrombolysis in myocardial infarction 36 (MERLIN-TIMI 36) randomized controlled trial / B. M. Scirica, D. A. Morrow, H. Hod et al. // Circulation. - 2007. - Vol. 116, ? 15. - P. 1647-1652.
Shah P. K. Ranolazine: a new drug and a new paradigm for management of myocardial ischemia and angina / P. K. Shah // Rev. Cardiovasc. Med. - 2004. - Vol. 5, ? 3. - Р. 186-188.
Shmidt-Schweda S. First clinical trial with etomoxir in patient with chronic congestive heart failure / S. Shmidt-Schweda, F. Holubarsch // Clin. Sci. - 2000. -
Vol. 99. - P. 27-35.
Sjakste N. Endotheliumand nitric oxide-dependent vasorelaxing activities of gam- ma-butyrobetaine esters: possible link to the antiischemic activities of mildronate / N. Sjakste, A. L. Kleschyov, J. L. Boucher et al. // Europ. J. Pharmacol. - 2004. - Vol. 495, ? 1. - P. 67-73.
Stanley W. C. Energy metabolism in the normal and failing heart: potential for theraputic interventions? / W. C. Stanley, M. P. Chandler // Cardiovasc. Res. - 2002. -
Vol. 7. - P. 115-130.
Stanley W. C. Partial fatty acid oxidation inhibitors for stable angina / W. C. Stanley // Expert Opin Investig Drugs. - 2002. - Vol. 11, ? 5. - Р 615-629.
Stanley W. C. Ranolazine: new approach for the treatment of stable angina pectoris / W. C. Stanley // Expert. Rev. Cardiovasc. Ther. - 2005. - Vol. 3, ? 5. - Р. 821-829.
Stone P. H. Antianginal Efficacy of Ranolazine When Added to Treatment With Amlodipine. The ERICA (Efficacy of Ranolazine in Chronic Angina) Trial / Ρ H. Stora, N. A. Gratsiansky, A. Blokhin [et al.] // J. Am. Coll Cardiol. - 2006. - Vol. 48. - Р 566-575.
Szwed H. Anti-Ischemic efficacy and tolerability of trimetazidine administered to patient with angina pectoris: result of three studies / H. Szwed, J. Hradec, I. Preda // Coron. Artery Dis. - 2001. - Vol. 12, Suppl. 1. - P. S25-S28.
Vetter R. CPT-1
inhibition by etomoxir has a chamber-related action on cardiac
sarcoplasmic reticulum and isomyosins / R. Vetter, H. Rupp // Am. J.
Physiol. - 1994. - Vol. 267, ?
Wolff A. A. Metabolic approaches to the treatment of ischemic heart disease: the clinicans' perspective / A. A. Wolff, H. H. Rotmensch, W. C. Stanley, R. Ferrari // Heart
Failure Reviews. - 2002. - Vol. 7, ? 2. - P. 187-203.