Инфекционные и паразитарные болезни развивающихся стран : учебник для вузов / Под ред. Н.В. Чебышева, С.Г. Пака. - 2008
|
|
|
|
ГЛАВА 3 ПРОТОЗООЗЫ
Многочисленные виды одноклеточных организмов по современной зоологической классификации относятся к подцарству простейших. Часть из них ведет паразитический образ жизни.
В настоящее время известно около 70 000 видов простейших, из которых 10 150 видов ведут паразитический образ жизни; более 50 из них являются специфическими паразитами человека и еще десятки видов являются факультативными паразитами человека (табл. 3.1).
Таблица 3.1. Подцарство protozoa (одноклеточные)

Медицинская протозоология занимается изучением распространения и эпидемиологии паразитарных болезней, имеющих медицинское и социальное значения, а также биологии их возбудителей. Разделы клиники, диагностики, лечения и профилактики могут быть использованы врачами лечебного и профилактического звеньев. Такие протозоозы, как малярия, висцеральный и кожный лейшманиозы, для России являются завозными болезнями из стран дальнего зарубежья.
Тело простейших состоит из цитоплазмы, ядра, различных органелл, обеспечивающих функции питания, движения, выделения. Простейшие передвигаются с помощью псевдоподий (саркодовые), жгутиков и ундулирующих мембран (жгутиконосцы), ресничек (ресничные инфузории). Пищей одноклеточным служат органические частицы, в том числе и живые организмы, а также растворенные в окружающей среде питательные вещества.
Питание простейших происходит по-разному. Одни заглатывают пищевые частицы ртом, другие поглощают пищевые частицы при помощи псевдоподий (ложноножек), образующихся в любом участке тела. При этом частица как бы обтекается и оказывается внутри вакуоли в цитоплазме простейшего, где и переваривается (пиноцитоз). У некоторых видов простейших питание происходит путем всасывания питательных соков и растворенных питательных веществ поверхностью тела (эндоосмотически).
Простейшие некоторых видов способны инцистироваться, т.е. округляться и покрываться плотной оболочкой. Цисты более устойчивы к воздействию неблагоприятных факторов, чем вегетативные формы. При попадании в благоприятные условия простейшие выходят из цисты и начинают размножаться. Размножение происходит бесполым (поперечное, продольное и множественное деление) и половым путем. Простейшие многих видов, ведущие паразитический образ жизни, размножаются последовательно в нескольких хозяевах. Например, маля- рийный плазмодий проходит цикл развития в теле комара и в организме человека.
Простейшие, обитающие в пищеварительной и мочеполовой системах, имеют простые жизненные циклы, в которые не включены промежуточные хозяева. Среди них встречается большое количество комменсалов. Большинство простейших этой группы образует цисты при выходе во внешнюю среду. Передача их от одного хозяина другому осуществляется без участия специфических переносчиков, но часто механическими переносчиками - мухами и тараканами.
Простейшие, обитающие в организме человека, относятся к 4-м типам: Sarcomastigophora, Apicomplexa, Ciliophora, Microspora (см. табл. 3.1).
Тип Sarcomastigophora.
Класс Sarcodina (саркодовые).
Отряд Amebiada.
3.1. Класс Sarcodina (Саркодовые)
Амебы в морфологическом отношении более просты по сравнению со жгутиконосцами, от которых они, по-видимому, произошли, утратив свой жгутик; некоторые из амеб имеют эти органеллы в продолжение части своего жизненного цикла. Цитоплазма паразитических видов амеб окружена только оболочкой, покрытой мукополисахаридным «пушистым слоем», а поддерживающие фибриллы отсутствуют. Движение и фагоцитоз осуществляются временными структурами - псевдоподиями. Цитоплазматические коллоидные вещества могут изменять свое физическое состояние от эктоплазматического геля до эндоплазматического золя. Пульсирующие движения обеспечиваются сократительными свойствами эктоплазматического геля. Псевдоподии образуются в тех местах, где эктоплазматический гель становится золем; эндоплазма
устремляется в это место и заполняет его новообразованным гелем, в результате чего на поверхности клетки образуется выпячивание.
6 видов амеб пищеварительного тракта, включая Entamoeba histolytica, являются облигатными паразитами, которые обитают в просвете кишечника человека как анаэробные комменсалы; митохондрии у этих амеб отсутствуют.
Всего насчитано 8-10 тыс. видов. Из 6 видов амеб, обитающих в толстом кишечнике, только Entamoeba histolytica является условно-патогенной для человека. 7-й вид - E. gingivalis - условно-патогенная амеба ротовой полости.
3.1.1. Амебиаз
Синонимы: амебная дизентерия, амебизм.
Протозойное антропонозное заболевание, протекающее в виде язвенного амебного колита или абсцессов печени и других органов.
Краткая историческая справка. Возбудитель открыл Ф. Леш (1875) при микроскопии испражнений больного в Санкт-Петербурге. Р. Кох (1883) выделил амебу из испражнений больных и органов умерших людей, Ф. Шаудинн (1903) детально описал и назвал ее Entamoeba histolytica. Заболевание под названием амебной дизентерии впервые описали У.Т. Каунсильмен и Ф. Леффлер (1891).
Этиология. Возбудитель - Entamoeba histolytica, относится к простейшим рода Entamoeba класса Sarcodina. Существует в виде четырехъядерных цист и одноядерных вегетативных форм (трофозоитов) - предцис- тной, просветной, большой вегетативной и тканевой. Морфологически E. histolytica неотличима от непатогенных видов E. dispar и E. Moshkovskii
(рис. 3.1).
Предцистная форма мало подвижна, обладает гомогенной цитоплазмой. Просветная форма E. histolytica, обитающая в просвете толстой кишки, крупнее предцистной (размер 10-20 мкм). Обе эти формы непатогенны и в большинстве случаев вновь трансформируются в цисты по мере продвижения по толстой кишке. В части случаев из просветной образуется большая вегетативная форма, а из нее - тканевая. Эти две патогенные формы подвижны, обладают протеолитическими ферментами и протеинами (специфический лектин N-acetyl-галактозамин и др.), определяющими их вирулентность.
Выделяясь с испражнениями во внешнюю среду, вегетативные формы быстро погибают. Цисты достаточно устойчивы: сохраняются в
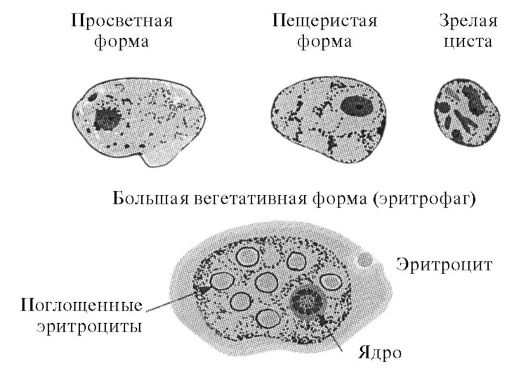
Рис. 3.1. Схема строения различных форм Entamoeba histolytica
испражнениях до 4 недель, в воде - до 8 мес, но быстро погибают при высушивании.
Эпидемиология. Резервуар и источники инвазии - люди, больные острым или хроническим амебиазом, реконвалесценты и бессимптомные цистоносители. В эндемических очагах инвазия в 90% случаев проявляется в виде продолжительного (до нескольких лет) бессимптомного носительства.
Механизм передачи - фекально-оральный; основные пути передачи - пищевой (особенно с овощами и зеленью), реже водный. Возможны бытовой путь передачи (через руки, загрязненные цистами амеб) и иногда контактный (при оральных и анальных половых контактах).
Естественная восприимчивость людей высокая, индекс контагиозности достигает 20%. В очагах инвазии клинически выраженные случаи амебиаза чаще отмечают у лиц среднего возраста; дети до 5 лет болеют редко. Амебный абсцесс печени возникает у мужчин в 10 раз чаще, чем у женщин.
Амебиаз широко распространен во многих странах. В некоторых тропических и субтропических регионах Центральной и Южной Америки, Африки и Азии пораженность населения амебами достигает 50-80%. Заболеваемость в основном спорадическая, хотя возможны и водные вспышки. По данным ВОЗ, ежегодно в мире регистрируют 40-50 млн случаев амебного колита и абсцесса печени, из которых 40 000-110 000 случаев заканчиваются летально, что ставит амебиаз по уровню смертности от протозойных заболеваний на 2-е место после малярии.
В развитых странах заболевание возникает прежде всего среди путешествовавших в эндемические области или недавних иммигрантов из них. К группам риска относят гомосексуалистов, пациентов психиатрических лечебных учреждений, иммуносупрессивных лиц.
Постинфекционный иммунитет относительный и кратковременный. Специфическая профилактика не разработана. Изучение протеинов, связанных с вирулентностью возбудителя, а также других его специфических поверхностных антигенов формирует предпосылки для создания противоамебных вакцин.
Патогенез. Принципиальная схема патогенеза представлена на рис. 3.2. После проглатывания цисты преодолевают кислотный барьер желудка, а затем вегетируют в тонкой кишке, последовательно трансформируясь в предцистную, а затем в просветную форму. На этих этапах развития возбудители непатогенные, инвазия проявляется в виде бессимптомного носительства. При замедленном продвижении каловых масс по слепой кишке и восходящему отделу толстой кишки просветные формы активно размножаются, в большинстве случаев вновь инцистируются, и цисты выделяются затем с фекалиями, а частично превращаются в большие вегетативные формы. Внедряясь в стенку кишки, большая вегетативная форма превращается в тканевую.
Полный эксплуатационный цикл Entamoeba histolytica
1. Инфекция обычно инициализируется при глотании цист Е. histolytica с фекалиями, загрязненной водой или продовольствием.
2. Цисты паразита проходят через желудок и тонкую кишку. В просвете кишки цисты формируются в подвижные и потенциально инвазивные трофозоиты.
3. В большинстве случаев трофозоиты скапливаются в слое кишечного муцина, превращаются в новые цисты, приводя к самоограничивающейся и бессимптомной инфекции.
4. В некоторых случаях, однако, трофозоиты адгезируются на эпителии ободочной и толстой кишок, и, вызывая их лизис, опосредованный галактозой и специфическим лектином - N-ацетил-Б-галактозамином (Gal/GalNAc).
5. В ответ на инвазию нейтрофилы способствуют повреждению клеток в местах инвазии.
6. Трофозоиты внедряются в слизистый и подслизистый слои толстой кишки, провоцируя развитие колита.
7. С момента внедрения трофозоитов в кишечный эпителий может начаться и гематогенная диссеминация в брюшину, печень и другие места.
8. Развиваются внекишечные формы амебиаза с поражением печени, легких, головного мозга и других органов. Они составляют около 1% от всех случаев амебиаза.
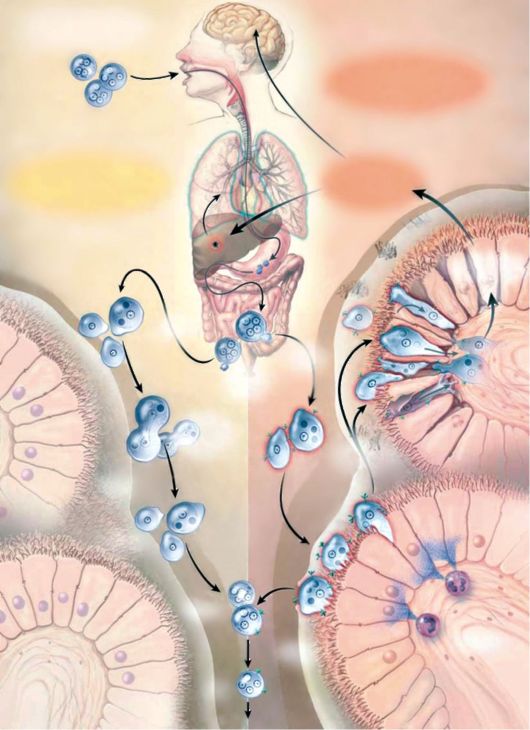
Рис. 3.2. Полный эксплуатационный цикл Entamoeba histolytica
Факторы, управляющие инвазией в противоположность инкапсулированию, наиболее вероятно включают Gal/GalNAc-специфический лектин паразита, взаимодействие амеб с бактериальной флорой кишки, а также факторы иммунного ответа организма.
Механизмы этих превращений и факторы патогенности амеб окончательно не изучены. Лектин большой вегетативной формы амебы играет первичную роль в процессах адгезии возбудителя к клеткам кишечного эпителия и последующего их лизиса. Специфические белки амебы формируют поры в клетках-мишенях, ингибируют подвижность и подавляют цитотоксическую функцию макрофагов. Entamoebа histolytica спо-
собна лизировать нейтрофилы, освобождающиеся при этом медиаторы активизируют диарею и повреждение тканей. Секреторные протеазы возбудителя и энзимы, сходные с бактериальными, вызывают деградацию тканей. Установлен факт активации апоптоза эпителиоцитов токсинами амебы. Повреждение слизистой оболочки и более глубоких слоев кишечной стенки происходит, прежде всего, в слепой, восходящей и поперечно-ободочной кишках и сопровождается воспалительной реакцией, типичной для раннего инвазивного амебиаза. В последующем нарастают явления цитолиза эпителия, некроза тканей с образовани- ем язв, нарушений микроциркуляции. Возможно развитие панколита с тяжелым течением заболевания.
При распаде некротизированных участков кишки повышается концентрация в крови биологически активных веществ, что обусловливает слабую или умеренную интоксикацию.
Разрастание грануляционной ткани в кишечной стенке может привести к ее утолщению и уплотнению, образованию так называемых амебом, суживающих просвет кишки, иногда до полной обтурации (рис. 3.3). При формировании глубоких язв возможны перфорация кишки, перитонит (с последующим развитием спаечного процесса).
Описанные патогенетические механизмы и патоморфологические изменения характерны для кишечной формы амебиаза.
Внекишечный амебиаз обусловлен гематогенной диссеминацией амеб по системам портальной и нижней полой вен и их последующей фиксацией во внутренних органах с развитием абсцессов или язв. Чаще всего абсцессы формируются в правой доле печени, реже в легких, иногда могут быть в головном мозге, почках, поджелудочной железе (рис. 3.4). Описаны случаи поражения перикарда. Поддиафрагмальный абсцесс печени может осложниться гнойным расплавлением диафрагмы с последующим гнойным плевритом.
Кожный амебиаз возникает при выделении возбудителей с жидкими испражнениями и загрязнении ими кожных покровов промежности, где образуются эрозии и язвы.
Иммунитет при амебиазе определяется активностью макрофагов, выработкой секреторных IgA и лимфокинов в толстой кишке, а также формированием гуморальных антител, сохраняющихся в организме при реконвалесценции до 1 года и более. Интересно то, что приобретенный иммунодефицит не ведет к увеличению вероятности инвазивного амебиаза.
Рис.3.3. Пациент с амебомой. Сужение просвета кишки из-за выпячивания амебомы
Клиническая картина. Инкубацционный период варьирует от 1 недели до 2-3 месяцев. Различают кишечный, внекишечный и кожный амебиаз.
Кишечный амебиаз развивается постепенно и может проявляться лишь дискомфортом в животе и слабо выраженной диареей. Для легкого течения заболевания характерны кратковременные периоды кашицеоб- разного или жидкого со слизью стула по 2-3 раза в день. Боли в животе умеренные, носят периодический схваткообразный характер или чаще отсутствуют. Самочувствие больных остается удовлетворительным, температура не повышается. Эпизоды диареи чередуются с периодами нормального стула или запоров с метеоризмом. Такое состояние без лечения продолжается от нескольких дней до нескольких недель.
Случаи средней тяжести вначале проявляются диареей с жидким, каловым, обильным стулом до 3-5 раз в день. При этом возникают умеренные боли в области слепой кишки и восходящего отдела толстой кишки, постепенно прогрессирует общая слабость, снижается аппетит. Лихорадка нетипична, лишь у 10-30% пациентов отмечается субфебрилитет. В дальнейшем на протяжении 7-10 дней боли могут стать диффузными и интенсивными, стул учащается. Объем испражнений уменьшается, они приобретают стекловидный, слизистый характер, иногда с
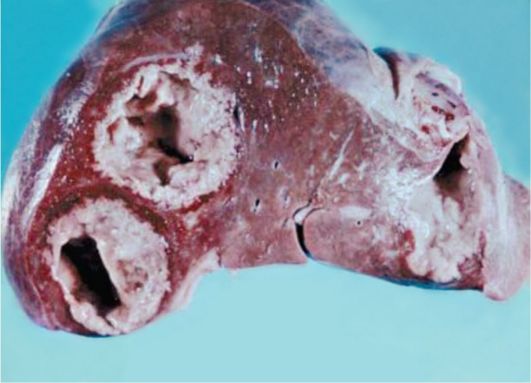
Рис. 3.4. Два абсцесса в правой доле и один абсцесс в левой доле у пациента с амебным абсцессом печени (макропрепарат)
примесью крови. Эпизоды оформленного стула или запоров становятся реже и короче. Возможно вовлечение в процесс аппендикса, что клинически проявляется аппендикулярной коликой.
При одновременном поражении начальных и дистальных отделов толстой кишки могут быть высокая лихорадка, тенезмы. В редких случаях появляется характерный бескаловый стул, состоящий из слизи, равномерно перемешанной с кровью («малиновое желе»). Снижается масса тела больных. При развитии панколита заболевание часто принимает тяжелое течение, без адекватного лечения летальность достигает 9-12%.
При осмотре больных можно выявить признаки метеоризма, болезненность при пальпации по ходу восходящего и других отделов толстой кишки, утолщение слепой кишки. Сигмовидная кишка может выглядеть в виде болезненного воспалительного тяжа. Печень и селезенка чаще всего не увеличены.
Хроническое течение кишечного амебиаза формируется значительно чаще, чем при шигеллезах, оно может быть рецидивирующим или
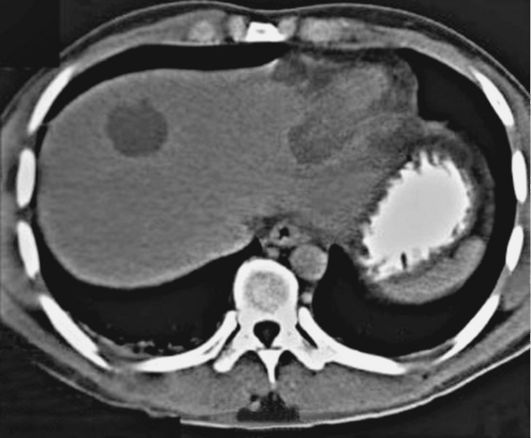
Рис. 3.5 Брюшная компьютерная томография у пациента с амебным абсцессом - один абсцесс в правой доле и второй в левой доле
непрерывным. Во время сравнительно длительных ремиссий больные чувствуют себя удовлетворительно. При непрерывном течении заболевания развиваются прогрессирующая слабость, анемия, трофические нарушения, безбелковые отеки. Из-за дефицита белков и витаминов снижается масса тела больного.
Редкие проявления кишечного амебиаза включают молниеносную форму, некротический колит, токсический мегаколон и амебому. Молниеносная форма встречается у детей раннего возраста, беременных и кормящих, ослабленных лиц с недостаточным питанием. Заболевание отличается выраженным токсикозом, сильными болями в животе, обширными язвенными поражениями толстой кишки. Некротический колит характеризуется очень тяжелым состоянием больных, высокой лихорадкой, диареей в виде мясных помоев, сильными схваткообразными болями в животе, развитием перитонита (при расплавлении стенок кишечника с выходом в брюшную полость каловых масс). При перфорации кишки, а также при отсутствии эффекта от консервативной антиамебной терапии требуется хирургическое вмешательство. Токсический
мегаколон может развиться при использовании в лечении кортикостероидов, ингибирующих продукцию интерлейкина-1-бета и интер- лейкина-8. Антиамебная терапия при этом обычно неэффективна, что обусловливает чрезвычайную важность раннего распознавания заболевания и проведения хирургического вмешательства. Амебома обычно формируется в слепой кишке или в восходящей толстой кишке вследствие разрастания кольцевидных грануляций в тканях кишечной стенки. Амебома может подражать раку толстой кишки, быть причиной сужения кишечника и кишечной непроходимости.
Внекишечный амебиаз чаще всего проявляется формированием абсцессов печени, реже - легких, головного мозга и других органов.
Амебный абсцесс печени (рис. 3.5) обычно возникает через 1-3 месяца от начала проявлений кишечного амебиаза, а иногда спустя несколько месяцев или даже лет. Он может развиться даже после легкого течения кишечного амебиаза, а в 6-10% случаев - без предшествовавших пора- жений толстой кишки.
Начало заболевания острое: возникают лихорадка ремитирующего, неправильного, постоянного или (редко) гектического характера, ознобы и выраженная ночная потливость, появляется тупая постоянная боль в правом верхнем квадранте живота или в эпигастрии. Может быть кашель, а при поражении диафрагмальной поверхности печени - плевральная боль справа с иррадиацией в плечо. Боль усиливается при кашле и движении, из-за чего нередко больные поддерживают руками область печени при ходьбе. Вместе с тем при единичном небольшом абсцессе часто сохраняется нормальная температура, а при глубоком внутрипеченочном расположении абсцесса боли могут отсутствовать. У части пациентов могут быть тошнота и рвота, схваткообразные боли в животе, понос или запор, метеоризм. Желтуха при абсцессах печени наблюдается редко.
При осмотре обнаруживают снижение тургора кожи, пастозность подкожной клетчатки в нижних отделах грудной клетки справа, увеличение печени (чаще правой доли). Типична выраженная точечная болезненность печени при пальпации в правом подреберье или в межреберных промежутках. При рентгенологическом исследовании можно выявить высокое стояние диафрагмы с ограничением подвижности ее правого купола, иногда изменения в легких в виде базальной правосторонней пневмонии или плеврита.
Абсцесс легкого чаще развивается при распространении абсцесса из верхних отделов печени на диафрагму и далее на легочную ткань.
Отмечают субфебрилитет с периодическими подъемами температуры до высоких цифр, кашель, боли в груди, иногда кровохарканье. На рентгенограмме видна полость в легком с горизонтальным уровнем жидкости. При прорыве абсцесса в бронх сильный кашель сопровождается выделением большого количества темно-коричневой мокроты.
Абсцесс мозга - редкая форма внекишечного амебиаза. Характерны нормальная или субфебрильная температура тела, головная боль, тошнота и рвота, центральная неврологическая симптоматика и психичес- кие нарушения, соответствующие локализации абсцесса.
В очень редких случаях наблюдают острый амебный перипортальный гепатит (с гепатомегалией, лихорадкой, болями в печени, лейкоцитозом), специфическую амебную плевропневмонию, воспалительно- язвенные поражения органов мочеполовой системы.
Кожный амебиаз регистрируют в основном у аборигенов тропических эндемических зон. Заболевание проявляется образованием эрозий и глубоких малоболезненных язв на ягодицах, в промежности и в пери- анальной области. Перианальные язвы могут вести к последующему формированию свищей.
Осложнения. При кишечном амебиазе возможно вовлечение в процесс аппендикса с развитием аппендикулярной колики, а также нагноение амебомы в стенке кишки с усилением болей в животе, высокой лихорадкой, напряжением мышц брюшного пресса. Сужение просвета кишки амебным инфильтратом может вызвать обтурационную непроходимость. Заболевание могут осложнить перфорация стенки кишки, перитонит с последующим развитием спаек, ректовагинальные фистулы.
Осложнения внекишечного амебиаза: разрыв абсцесса с развитием гнойного перитонита и плеврита, эмфизема легких, пневмоторакс, перикардит, формирование свищей и др.
Дифференциальная диагностика. Кишечный амебиаз дифференцируют с другими протозойными заболеваниями, шигеллезами, сальмонеллезами, эшерихиозами, иерсиниозами, кампилобактериозом, трихоцефалезом (см. соответствующие нозологии). Кишечный шистосомоз в ранней стадии болезни отличают от амебиаза возможные экзантемы и кожный зуд, в стадии развившейся интенсивной инвазии - миалгии и артралгии, кашель, гепатолиенальный синдром, выраженная эозино- филия, выделение яиц шистосом с испражнениями. При проведении дифференциальной диагностики кишечного амебиаза с новообразованиями толстой кишки, неспецифическим язвенным колитом, болезнью Крона, псевдомембранозным колитом решающую роль имеют методы эндоскопических исследований.
Амебный абсцесс печени следует отличать от эхинококкозов, висцерального лейшманиоза. При эхинококкозах не отмечают высокой лихорадки, интенсивные боли в печени и флюктуация не характерны, в гемограмме часто обнаруживают эозинофилию. Большое значение имеют рентгенологическое и ультразвуковое исследования печени. Для висцерального лейшманиоза характерны высокая длительная волнообразная лихорадка, увеличение и уплотнение печени, и особенно селезенки, их безболезненность при пальпации, лейкопения при резком повышении СОЭ.
Основные отличия амебного абсцесса легких от абсцедирующей пневмонии и туберкулеза устанавливаются при рентгенологическом исследовании.
Лабораторная и инструментальная диагностика. Характерные изменения гемограммы при амебиазе: умеренный лейкоцитоз и анемия, эозинофилия, моноцитоз и лимфоцитоз, увеличение СОЭ.
При микроскопии свежевыделенных испражнений (нескольких нативных мазков, а также препаратов, обработанных иодным раство- ром) можно найти трофозоиты E. histolytica. Обнаружение большой веге- тативной формы амебы, содержащей фагоцитированные эритроциты, подтверждает диагноз кишечного амебиаза, тканевая форма выявляется редко. Наличие в испражнениях просветной, предцистной форм и четырехъядерных цист E. histolytica может иметь место и при амебном носительстве. При невозможности проведения срочного исследования 4-6 образцов испражнений больного сохраняют в консервантах - 10% растворе формалина или поливиниловом спирте.
При внекишечном амебиазе редко удается обнаружить амебу в гное абсцесса, в связи с чем лабораторная диагностика базируется на серологических методах исследования - РНГА, ИФА, РИФ и др., дающих положительные результаты в среднем в 80% случаев. Серологические методы мало пригодны в эндемическом очаге вследствие длительного (до 1 года и более) сохранения «следовых» АТ у лиц, переболевших амебиазом. В последние годы в лабораторную практику внедряют ПЦР, а также высокоспецифичные методы выявления амебных АГ с помощью моноклональных АТ. Перспективно изучение секреторных АТ, а также АТ к антигенам ядерной мембраны амеб.
Диагностике кишечного амебиаза существенно помогает колоноскопия. При проксимальном колите можно видеть лишь катаральные и редко эрозивные изменения слизистой оболочки слепой и восходящей кишок. При преимущественном поражении дистальных отделов толс-
той кишки или при панколите слизистая оболочка кишки отечна, имеет очаги гиперемии, эрозии и язвы на разных стадиях развития, в просвете кишки много слизи. При колоноскопии возможно получение биоптата из краев язв для последующего паразитологического и гистологического исследований. Отмечают характерную колбообразную форму язв толстой кишки. Биопсия относительно противопоказана при молниеносном колите из-за повышенного риска кишечной перфорации.
С целью диагностики амебных абсцессов используют рентгенографию, ультразвуковое исследование (УЗИ), компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ). При необходимости срочного уточнения диагноза может быть проведена аспирационная биопсия абсцесса печени под контролем УЗИ или КТ. В этих случаях полученную желто-коричневую жидкость без запаха направляют в лабораторию для микроскопии, выделения антигенов возбудителя, культурального исследования.
Лечение амебиаза в большинстве случаев амбулаторное. Госпитализация больных показана при тяжелом колите и при внеки- шечных поражениях. Необходимость постельного режима определяют тяжесть заболевания и локализация ведущих поражений. Диету назначают индивидуально, в зависимости от переносимости продуктов питания. Необходимо поддержание электролитного баланса.
При локализации неинвазивных форм амебы в просвете кишки и бессимптомном течении инвазии возможен риск дальнейшего развития болезни. В этих случаях назначают просветные амебоциды:
- этофамид по 20 мг/кг/сут в 2 приема в течение 5-7 дней;
- дилоксанида фуроат (entamide, furamide) по 500 мг 3 раза в день (детям старше 2 лет - 20 мг/кг/сут в 3 приема) в течение 10 дней;
- дийодогидроксихин (iodoquinol, yodoxin) по 650 мг 3 раза в день (детям - по 30-40 мг/кг/сут в 3 приема) в течение 20 дней;
- паромомицин (humatin) взрослым и детям по 25-35 мг/кг/сут в 3 приема в течение 7 дней.
При легком и среднетяжелом неосложненном кишечном амебиазе с выделением инвазивных форм амеб показаны тканевые амебоциды из группы нитроимидазолов. Назначают метронидазол (трихопол, flagyl) внутрь по 30 мг/кг/сут в 3 приема в течение 7-10 дней. Поскольку после лечения метронидазолом паразиты сохраняются в кишечнике у 40-60% пациентов, вслед за этим для полного освобождения от просветных форм амеб назначают этофамид по 20 мг/кг/сут в 2 приема в течение 5-7 дней.
Для ускорения элиминации амеб и репарации слизистой оболочки кишки одновременно с метронидазолом полезно назначение энтеросидива по 2 таблетки 3 раза в день в течение 10 дней. Препарат, воздействуя на патогенную и условно патогенную флору кишечника, тормозит трансформацию комменсальных форм амеб в агрессивные. Параллельно с амебоцидными специфическими препаратами можно назначать доксициклин по 100 мг в сутки.
Из других препаратов, действующих на просветные формы амеб, применяют иодохинол (20-дневный курс) или дилоксанида фуроат (5- 10-дневный курс), их дозы приведены выше.
Альтернативно
при обнаружении неинвазивных форм амеб можно использовать метронидазол
(схему лечения см. выше). При клинически выраженном кишечном амебиазе
назначают трехдневные курсы тини- дазола (fasigyn) по 600 мг 2 раза в
день (детям 50 мг/кг/сут в 2 приема, но не более 2,0 г/сут) или
орнидазола (тиберал) по
При тяжелом кишечном амебиазе рекомендуют комплексный 10- дневный курс метронидазола в сочетании с доксициклином или энтеросидивом. Одновременно в течение первых 5 суток иногда проводят внутримышечные инъекции дегидроэметина в дозе 1 мг/кг/сут (но не более 60 мг/сут). Препарат обладает выраженным кардиотоксическим эффектом. В случае молниеносного амебного колита в лечение включают антибиотики широкого спектра, а при отсутствии эффекта от консервативной терапии может потребоваться хирургическое вмешательство.
При внекишечном амебиазе у взрослых вышеуказанный 10-днев- ный курс метронидазола сочетают с назначением хлорохина фосфата. В течение первых 2 дней лечения назначают по 300 мг хлорохина (осно- вания) 2 раза в день, затем на протяжении 2-3 недель 300 мг 1 раз в день. Одновременно возможно применение антибиотиков широкого спектра действия. Может быть использована и альтернативная схема лечения: тинидазол перорально по 2,0 г/сут в 1 прием (детям по 50 мг/кг/сут в 1 прием, но не более 2,0 г/сут) в течение 5-10 дней.
После завершения указанных курсов лечения для элиминации оставшихся амеб в кишечнике назначают этофамид по 20 мг/кг/сут в 2 приема в течение 5-7 дней.
Показания к чрескожной пункции абсцесса печени:
1) отсутствие эффекта от антимикробной терапии в течение 48 часов;
2) высокий
риск разрыва абсцесса при больших его размерах, сильной боли в животе и
напряжении мышц брюшной стенки (обычно при диаметре абсцесса более
Пункцию абсцесса проводят под контролем УЗИ с последующим его дренажем и промыванием полости с использованием амебицидных средств и антибиотиков широкого спектра.
В последние годы в связи с токсичностью эметина и дегидроэметина все чаще отказываются от их использования в лечении амебиаза. Вместе с тем отмечена эффективность трансумбиликального введения амеби- цидных препаратов.
Подострый аппендицит амебного происхождения не требует срочного хирургического вмешательства, больного наблюдают 2-3 дня, применяя консервативную терапию.
При развитии анемии назначают препараты железа, кровезаменители, реже проводят гемотрансфузии.
Правила выписки пациентов. При стационарном лечении выписка реконвалесцентов допустима после их клинического выздоровления и получения отрицательных результатов в 6 паразитологических исследованиях фекалий, взятых с интервалами в 1-2 дня.
Прогноз и исходы заболевания при адекватном лечении в целом благоприятны.
Рекомендации по последующему диспансерному наблюдению.
Диспансерное наблюдение за переболевшими проводят в течение 12 мес с паразитологическим исследованием фекалий через 1, 3, 6 и 12 мес после выписки. Носителей инфекции не допускают к работе на пище- вых предприятиях.
Профилактика амебиаза аналогична таковой при кишечных инфекциях. Общие санитарные мероприятия в очаге включают рациональ- ную очистку и канализацию населенных мест, повышение санитарной грамотности населения, питье только кипяченой воды, мытье овощей с детергентом или вымачивание их в уксусе в течение 10-15 минут перед употреблением. Испражнения больных подвергают дезинфекции (5% раствор лизола), белье замачивают в 3% растворе лизола. Лицам, общавшимся с больным, разобщение и химиопрофилактику не проводят, выявленным среди них бессимптомным носителям назначают амбула- торное лечение.
3.1.2. Акантамебиаз
Протозооз, вызываемый различными видами свободноживущих амеб, проявляющийся поражением глаз, кожи и ЦНС.
Этиология. Для человека патогенными являются несколько видов амеб, относящихся к роду Acanthamoeba (рис. 3.6).
Рис. 3.6. Свободноживущие патогенные амебы
Жизненный цикл акантамеб включает две стадии: трофозоит и циста. Трофозоит имеет овальную, треугольную или неправильную форму размерами 10-45 мкм, одно ядро с крупной эндосомой, а также имеется экстрануклеарная центросфера. Трофозоиты образуют узкие, нитевидные или шиловидные псевдоподии. Размер цист от 7 до 25 мкм. Цисты - одноядерные, с многослойной оболочкой.
Биология. Амебы рода Acanthamoeba - аэробы, обитают в почве и теплых пресноводных водоемах, преимущественно в придонном слое. Особенно много их в водоемах, образованных сбросами электростанций и загрязненных сточными водами. Наличие большого количества органических веществ и высокая температура воды (+28 ?С и выше) в этих водоемах способствуют резкому увеличению в них популяций амеб. При понижении температуры воды, изменении рН или подсыхании субстрата акантамебы инцистируются.
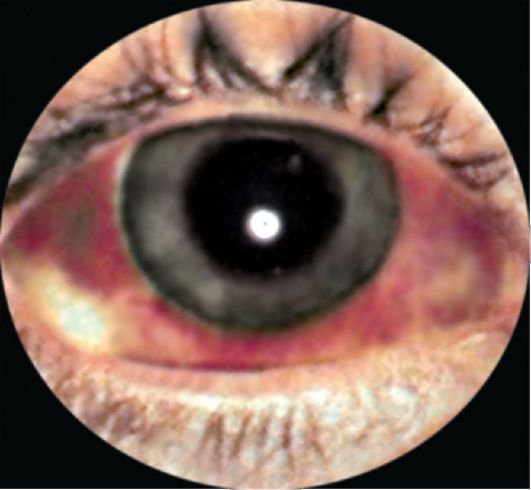
Рис. 3.7. Акантамебный стромальный круговой кератит и увеит после ношения контактных линз
Цисты устойчивы к высыханию, охлаждению и действию многих антисептиков в стандартных концентрациях, благодаря небольшим размерам они могут распространяться аэрогенно; выделяются из тканей и экскрементов многих видов рыб, птиц и млекопитающих.
Эпидемиология. Акантамебы - обычно свободноживущие животные, которые, попадая в организм человека, способны переходить к паразитизму и заканчивать в организме хозяина свой цикл развития, образуя цисты.
Источник инвазии - внешняя среда (контаминированные амебами вода, почва и др.). Человек заражается контактно-бытовым, водным и пищевым путями. Заболеваемость спорадическая, заражение возможно во все сезоны года. Возбудители распространены повсеместно. Наиболее часто случаи заболевания регистрируются в странах с тропическим и субтропическим климатом.
Патогенез и клиника. Акантамебы обнаруживаются в мазках из носоглотки и в фекалиях здоровых людей. Чаще всего развиваются акантамебный кератит (рис.3.7) и поражения кожи. В случае заноса амеб в головной мозг гематогенным путем из первичных поражений в роговице глаза или в респираторном тракте развивается гранулематозный акантамебный энцефалит. Инкубационный период обычно продолжается от нескольких недель до нескольких месяцев. В начальном периоде симптомы болезни проявляются в стертой форме. Появляются головные боли, сонливость, судороги, отмечаются нарушения психики.
Заболевание
постепенно прогрессирует, развивается коматозное состояние, которое
приводит к летальному исходу. При патолого-анатомическом исследовании
отмечаются отек полушарий мозга, очаги размягчения с экссудатом на
поверхности коры и утолщение мягких оболочек. На разрезах в большинстве
участков мозга находят множественные очаги размягчения с
геморрагическим некрозом размером от 1,5 до
Осложнения. При поражении глаз возможно развитие перфорации роговицы. Возможно формирование амебных абсцессов внутренних органов при диссеминации возбудителей из первичного очага поражения.
Диагноз и дифференциальный диагноз. Диагноз акантамебного кератита устанавливается на основании результатов микроскопического исследования на наличие вегетативных и цистных форм амеб в слезно-мейбомиевой жидкости, смывах и соскобах из язвенных поражений роговицы и склеры. Нативные препараты исследуют в обычном микроскопе при слабом освещении или при помощи фазового контраста. Постоянные препараты, окрашенные по методу Романовского-Гимза, проводят микроскопию сначала при малом и среднем увеличениях, а затем исследуют более подробно под иммерсионным объективом. Иногда прибегают к культивированию акантамеб на среде Робинсона и др. В некоторых случаях для диагностики применяют биопробу путем заражения лабораторных животных.
Диагноз акантамебного поражения кожи устанавливают на основании обнаружения амеб и их цист в нативных и окрашенных препаратах, приготовленных из субстрата инфильтратов и биоптатов пораженных тканей.
Наиболее эффективным методом диагностики амебного энцефалита является исследование нативных препаратов спинно-мозговой жидкости, в которых определяются подвижные трофозоиты. Для более точной их идентификации изучают постоянные препараты из осадка спинномозговой жидкости, окрашенные по Гимза-Райту. Трофозоиты и цисты окрашиваются в пурпурный цвет. Также используют культуральный метод с посевом спинно-мозговой жидкости на среду Кульберстона.
Дифференциальную диагностику при акантамебных поражениях глаз, мозга и кожи проводят с кератитами, энцефалитами и дерматозами другой этиологии.
Лечение. При акантамебных кератитах обязательным условием лече- ния является отказ от ношения контактных линз. Местно назначают макситрол или софрадекс в виде капель 6-12 раз в день или в форме
мази 3-4 раза в сутки. В комбинации с каплями мазь используют однократно на ночь. Применяют капли растворов гентамицина (0,3%), тобрамицина (0,3%), паромомицина (0,5%), тетрациклина (1%) или другие глазные мази, содержащие данные препараты. Можно также использовать инстилляции растворов неомицина, полимиксина В до 6 раз в день. В редких случаях, несмотря на медикаментозное лечение, приходится прибегать к кератопластике.
Лечение акантамебного поражения кожи проводится антибиотиками группы аминогликозидов (гентамицин, паромомицин). Местно применяются неомицин, полимиксин и др.
Лечение амебного энцефалита эффективно лишь при ранней его диагностике, что удается крайне редко. Известно только три случая излечения от гранулематозного акантамебного энцефалита.
Прогноз при поражении кожи и глаз благоприятный, при поражении ЦНС, как правило, неблагоприятный.
Профилактика заключается в соблюдении правил гигиены пользования контактными линзами. Нельзя хранить линзы в водопроводной воде или солевых растворах домашнего приготовления. Они должны храниться лишь в стерильных растворах, специально приготовленных в офтальмологических учреждениях. Эти растворы необходимо менять согласно инструкции по использованию контактных линз.
Профилактика развития акантамебного поражения кожи и энцефалита заключается в соблюдении правил личной гигиены и ограничении контактов с местами обитания акантамеб.
3.1.3. Неглериоз
Протозойное заболевание, вызываемое Naegleria fowleri, проявляющееся поражением кожи, легких, глаз и центральной нервной системы.
Этиология. Неглерия - свободноживущая амеба, в жизненном цикле которой существуют 3 морфологические формы: амебоидный трофозоит, жгутиковая стадия и циста. Размеры трофозоитов составляют 15-40 мкм. Энергичная пульсация сократительной вакуоли отличает ее от клеток хозяина. Ядро (5 мкм) имеет эндосому. Псевдоподии прозрачные и широкие. Как и у всех амеб, цитоплазма подразделяется на экто- и эндоплазму, но неглерии имеют пластинчатый комплекс Гольджи, выраженный эндоплазматический ретикулум и сократительную вакуоль. Цисты округлые, с гладкой двойной стенкой, размером 10-20 мкм.
Биология. N. fowleri - свободноживущая амеба, которая обитает в пресноводных водоемах (сточные воды, бассейны, термальные источники и др.). При повышении температуры до 35 ?С неглерии начинают активно
размножаться, и численность их значительно возрастает. Часть амеб при резких колебаниях температуры и изменении рН среды формирует два жгутика и активно плавает в толще воды в течение суток, затем вновь переходит в амебоидную форму.
При наступлении неблагоприятных условий амебы легко инцистируются. В отличие от акантамеб, цисты неглерий менее устойчивы к высыханию.
Эпидемиология. Заражаются неглериями чаще всего молодые люди и дети, главным образом при купании в открытых водоемах, бассейнах и горячих ваннах. По-видимому, это обусловлено наличием у неглерии жгутиковых стадий развития, находящихся в воде, что облегчает контакт человека с амебами.
Цисты
неглерий могут проникать также в носовую полость при вдыхании
содержащих их аэрозолей. Неглерии распространены достаточно широко, но
чаще встречаются в районах с тропическим и субтропи- ческим климатом.
До
Патогенез и клиника. Заражение человека амебами происходит, повидимому, при попадании их в ротовую и носовую полости с загрязненной водой. Из носоглотки через обонятельный эпителий амебы проникают в богато васкулизированное субарахноидальное пространство, откуда распространяются во все отделы мозга. В тканях мозга они локализуются вокруг кровеносных сосудов и бурно размножаются. Вследствие этого как в сером, так и в белом веществе мозга возникают кровоизлияния и некроз. Развивается первичный амебный менингоэнцефалит.
Инкубационный период продолжается 2-3 дня, реже 7-15 дней. Начало болезни внезапное. Вначале часто возникают нарушения вкусовых или обонятельных ощущений. Появляются головные боли, высокая лихорадка, тошнота, рвота, судороги. Отмечается ригидность затылочных мышц. На слизистой оболочке глотки нередко образуются язвы. Выявляются симптомы менингита и энцефалита. Развивается отек легких. Вскоре наступает кома. В большинстве случаев в течение недели после появления первых симптомов больные погибают вследствие отека легких и остановки дыхания. N. fowleri, так же как акантамебы, может вызывать поражения кожи, легких и глаз.
Осложнения. Наиболее грозным осложнением является развитие менингоэнцефалита в результате диссеминации возбудителей из первичного очага поражения на коже или глаза в центральную нервную систему.
Диагноз и дифференциальный диагноз. Клиническая диагностика затруднена вследствие сходства симптомов первичного амебного поражения мозга с менингитами и менингоэнцефалитами бактериальной или вирусной этиологии. Принимаются во внимание данные анамнеза (купание в богатых илом водоемах с теплой водой, контакт со сточными водами и т.д.). Окончательный диагноз первичного амебного менингоэнцефалита устанавливается микроскопически при обнаружении N. fowleri в осадке спинно-мозговой жидкости или в биоптатах мозга. От окружающих клеток они отличаются подвижностью. Используется также и культуральный метод. Неглерии - аэробные организмы, они, как и акантамебы, могут расти на простом агаре, на котором предварительно засеяны бактерии. При добавлении воды в культуру неглерии образуются жгутиковые формы, что служит их отличительным признаком от акантамеб. Дифференциальная диагностика при поражении ЦНС про- водится с энцефалитами и менингитами другой этиологии.
Лечение больных неглериозом не разработано. Используется амфотерицин В в дозе 0,25-1,5 мг/кг/сут в/в капельно, субарахноидально или непосредственно в желудочки мозга. Иногда его вводят в комбинации с миконазолом и (или) рифампином. Применяют внутривенные инъекции сульфадиазина (0,5 г/сут), левомицетина (2-4 млн МЕ/сут). В качестве симптоматических средств используются противосудорожные препараты, глюкокортикоиды и др. После неглериозного менингита выживали только больные, получавшие амфотерицин В.
Прогноз при поражении ЦНС крайне неблагоприятный.
Профилактика заключается в соблюдении правил личной гигиены. Особое внимание обращается на предотвращение заражения при купании в бассейнах и открытых водоемах, в которых температура воды составляет 35 ?С и более.
3.2. Класс Mastigophora (Жгутиконосцы)
Жгутиконосцы передвигаются с помощью длинных бичевидных жгутиков, которые прикреплены к поверхности клетки. Каждый жгутик отходит от небольшого образования, называемого кинетосомой, которая локализуется в эктоплазме и контролирует движение жгутика. Полагают, что кинетосомы аналогичны центриолям, регулирующим образование митотических веретен у высших организмов. Жгутик состоит из центрального тяжа - аксонемы, окруженной чехлом, который является продолжением клеточной мембраны; аксонему составляют располагающиеся кольцом 9 периферических фибрилл, окружающих 2
центральные фибриллы. По своему строению эти фибриллы аналогичны таковым ресничек и жгутиков, обнаруживаемых во всем царстве животных, а также у некоторых бактерий, например спирохет. Было высказано предположение, что все эти структуры первоначально образовались из симбионтных спирохет, которые стали эндопаразитами в эукариотных организмах. Эта гипотеза аналогична гипотезе о происхождении всех митохондрий эукариотов от эндосимбионтных бактерий.
Передвижение некоторых жгутиконосцев обеспечивается также ундулирующей мембраной, которая состоит из жгутика, располагающегося параллельно поверхности клетки у свободного края складки, образованной клеточной мембраной (рис. 3.8). Эти простейшие передвигаются также благодаря изменениям формы клетки, вызванным сокращениями их пелликулярных фибрилл. Жгутиконосцы - паразиты человека, они делятся на имеющих и не имеющих кинетопласт. Это сложная органелла, образующаяся из модифицированной митохондрии.
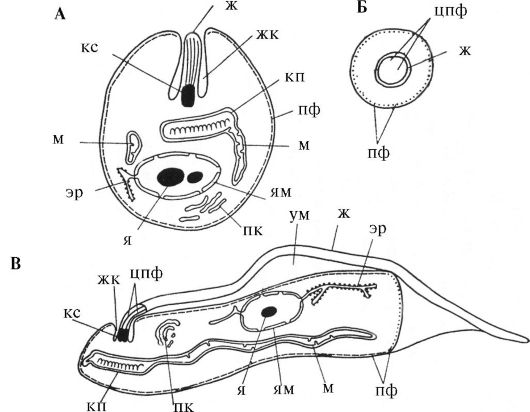
Рис. 3.8. Тонкая структура паразитов из отряда Kinetoplastida (жгутиконосцы, имеющие кинетопласт)
А - амастигота (лейшманиальная форма), Б - передний конец амастиготы в поперечном разрезе, В - трипомастигота (трипаносома) в частичном продольном разрезе: ж - жгутик, жк - жгутиковый карман, кп - кинетопласт, кс - кинетосома, м - митохондрия, пк - пластинчатый комплекс, пф - пелликулярные фибриллы, цпф - центральные и периферические фибриллы, образующие аксонему, ум - ундулирующая мембрана, эр - эндоплазмати- ческий ретикулум, я - ядрышко, ям - ядерная мембрана
Отряд Kinetoplastida. К этой группе относятся трипаносомы и лейшмании. Эти паразиты передаются кровососущими паразитами-переносчиками, которые одновременно являются промежуточными хозяевами.
В организме позвоночных животных паразиты находятся в крови и тканевых жидкостях, а также внутри клеток. Размножение всегда происходит путем бинарного деления. Единственный жгутик отходит от кинетосомы, располагающейся рядом с более крупным дисковидным или изогнутым образованием - кинетопластом; однако при исследовании в световом микроскопе эти два образования дифференцировать невозможно. Кинетопласт, который связан с крупной митохондрией, проходящей через большую часть клетки организма, содержит ДНК, которая генетически отличается от ДНК ядерной. В переносчике жгутик может функционировать как орган прикрепления. Эти паразиты меняют форму тела в процессе смены фаз жизненного цикла (рис. 3.9).
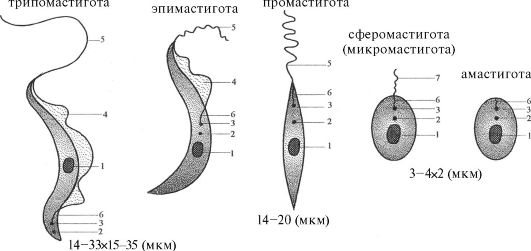
Рис. 3.9. Морфологические формы трипаносом и лейшманий: 1 - ядро,
2 - кинетопласт, 3 - кинетосома, 4 - ундулирующая мембрана, 5 - жгутик,
6 -ризопласт, 7 - рудиментарный жгутик
Амастигота или амастиготная (безжгутиковая) стадия, соответствующая прежней «лейшманиальной» стадии: присутствуют округлые или удлиненные формы, лишенные наружного жгутика у Leishmania, Tryponasoma cruzi.
Сферомастигота (микромастигота) или сферомастиготная стадия: присутствуют округлые формы, имеющие рудиментарный свободный жгутик (у лейшманий).
Промастигота или промастиготная («переднежгутиковая») стадия, соответствующая прежней «лептоманадной» стадии: присутствуют удли-
ненные формы, кинетопласт которых лежит впереди ядра, жгутик начинается там же и выходит наружу в переднем конце тела (у Leishmania, Tryponasoma cruzi).
Тримастигота или эпимастиготная («бокожгутиковая») стадия, соответствующая бывшей «криптидиальной» стадии: присутствуют удлиненные формы, кинетопласт которых лежит рядом с ядром, жгутик начинается там же и выходит наружу сбоку, после чего проходит по поверхности тела или вдоль короткой ундулирующей мембраны (у трипаносом).
Трипомастигота или трипомастиготная стадия, соответствующая «трипаносомной» стадии: присутствуют удлиненные формы, кине- топласт которых лежит позади ядра, жгутик начинается там же и выходит наружу сбоку, после чего проходит по поверхности тела или вдоль длинной ундулирующей мембраны.
Хотя эта форма сходна с эпимастиготной, эту важную стадию, свойственную роду Tryponasoma, желательно обозначить специальным термином, который определяет ее структуру, но не связан с родовым названием.
Наряду с полиморфизмом трипаносоматид (трипаносомы и лейшмании) в процессе их жизненных циклов выявлен также полиморфизм на уровне их геномов. Кариотипы трипаносоматид очень изменчивы. Они сильно различаются даже между разными изолянтами одного вида.
Кариотип трипаносом не поддается анализу в световом микроскопе. Но при применении гельэлектрофореза хромосомы могут быть разделены на четыре основных класса: большая ДНК (остающаяся вблизи щели геля), около пяти длинных хромосом, 5-7 хромосом промежуточного размера и от 0 до 100 сателлитных и теломерных мини-хромосом. Вероятно, эволюция кариотипа происходила в направлении увеличения разнообразия антигенной вариации. Одна особь трипаносомы несет на себе до 1000 поверхностных вариантов генов. Таким образом, такой полиморфизм является одним из важнейших способов уклонения пара- зитов от защитных механизмов своих хозяев благодаря изменчивости их поверхностных антигенов.
Так, в каждой новой генерации часть трипаносом несет поверхностный антиген, отличающийся от предыдущих. Эта смена антигенов трипаносом происходит в результате транспозиции и дупликации генов, кодирующих антигенные детерминанты. В результате меняется расположение гена по отношению к промотору.
Изменение поверхностных генов паразита в сторону сближения с антигенами хозяина обеспечивает так называемую молекулярную мимикрию или связывание антигенов хозяина.
Локализация паразитов в клетках иммунной системы целенаправленно инактивирует лизосомные ферменты макрофага, что обеспечивает им жизнедеятельность и условия для размножения.
3.2.1. Трипаносомозы (род Tryponasoma)
Для человека патогенны Т. gabiense и Т. rhodesiense, которые вызывают африканский трипаносомоз (сонную болезнь), и Т. cruzi - возбудитель американского трипаносомоза (болезнь Чагаса).
Трипаносомы по размерам более крупные, чем лейшмании. Они имеют узкую продолговатую форму (1,5-3 х 15-30 мкм), жгутик и ундулирующую мембрану. В процессе жизненного цикла изменяются мор- фологически.
Трипаносомозы - группа трансмиссивных тропических болезней, вызываемых простейшими рода Trypanosoma. Трипаносомы проходят сложный цикл развития со сменой хозяев, в процессе которого они находятся в морфологически различных стадиях. Трипаносомы размножаются продольным делением, питаются растворенными веществами.
Жизненный цикл трипаносом осуществляется со сменой двух хозяев, одним из которых являются позвоночные животные и человек, а другим- кровососущие членистоногие, служащие переносчиком возбудителя.
Различают африканский и американский трипаносомозы.
Африканский трипаносомоз (сонная болезнь) - облигатно-трансмиссивная инвазия, характеризующаяся лихорадкой, высыпаниями на коже, увеличением лимфатических узлов, появлением местных отеков и поражением центральной нервной системы, приводящим к летаргии, кахексии и летальному исходу.
Африканский трипаносомоз распространен в зоне саванн. Его нозоареал ограничен ареалом переносчика - мухи цеце. Сонная болезнь эндемична в 36 странах тропической Африки. Ежегодно регистрируется до 40 тысяч новых случаев. Вероятно, реальное число заболевших значительно больше и может составлять до 300 тысяч. Около 50 миллионов человек проживают в условиях риска заражения.
Известны две формы африканского трипаносомоза: гамбийская, или западно-африканская, и родезийская, или восточно-африкансая. Первая вызывается Tr. gambiense, вторая - Tr. rhoresiense.
Оба возбудителя африканского трипаносомоза относятся к секции Salivaria, т.е. передаются через слюну. Гамбийская форма африканского трипаносомоза - это облигатно-трансмиссивное заболевание, факти- чески антропоноз, хотя в передаче его возбудителя некоторое участие принимают и сельскохозяйственные животные.
Впервые клинику африканского трипаносомоза описал в
Этиология. Возбудитель - Trypanosoma gambiense. В крови позвоночных хозяев развиваются полиморфные стадии трипаносом - трипомас- тиготы и эпимастиготы. Среди них обнаруживаются тонкие трипомастиготные формы длиной 14-39 (в среднем 27) мкм с хорошо выраженной ундулирующей мембраной и длинной свободной частью жгутика. Задний их конец заострен, кинетопласт находится на расстоянии около 4 мкм от заднего конца тела. Встречаются также короткие формы трипомастигот - длиной 11-27 мкм (в среднем 18 мкм), с закругленным задним концом и очень короткой свободной частью жгутика. Имеются также разнообразные переходные между ними формы. При окраске по Романовскому- Гимза ядро, жгутик и кинетопласт окрашиваются в розовый цвет, а протоплазма - в голубой. Морфологические различия между различными возбудителями трипаносомозов несущественны.
Биология. Основным хозяином является человек, дополнительным - свиньи. Переносчиком служат кровососущие мухи рода Glossina, преимущественно G. palpalis. Отличительным признаком мухи цеце является сильно хитинизированный выступающий хоботок, способный прокалывать кожу даже таких животных как носорог и слон. В связи с этим никакая одежда человека не защитит от мухи цеце. Вторая особенность мухи - великолепная растяжимость стенок кишки, что позволяет ей поглощать кровь, превышающей вес голодной мухи в десятки раз. Эти особенности обеспечивают надежность передачи возбудителя от донора к реципиенту. Мухи цеце нападают в светлое время суток, преимущественно на открытой природе, некоторые антропофильные виды могут залетать в поселки. Кровь пьют и самцы, и самки. Цикл развития трипаносом в переносчике-мухе цеце представлен на рис. 3.10. Инвазионной стадией для переносчика является трипомастиготная форма. В организм переносчика трипаносомы попадают при питании кровью инвазированного позвоночного животного или человека. Около 90% трипаносом, поглощенных мухой цеце, погибают. Остальные размножаются в про- свете ее средней и задней кишок.
В первые дни после заражения разнообразные формы трипаносом находятся внутри комка поглощенной крови, окруженного перитрофической мембраной; они мало отличаются от тех, которые находятся в крови человека, но несколько более короткие и имеют слабо выражен-
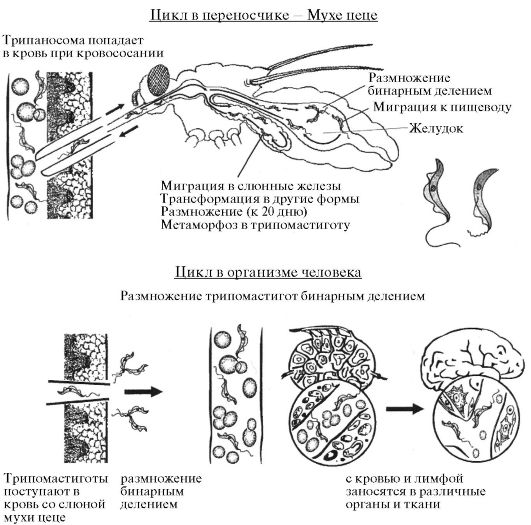
Рис. 3.10. Жизненный цикл возбудителей африканского трипаносомоза
ную ундулирующую мембрану. Затем трипаносомы выходят в просвет кишечника насекомого.
При попадании в желудок мухи цеце после кровососания трипаносомы к 3-4 дню изменяются и трансформируются в эпимастиготные формы, становятся более узкими и вытянутыми и интенсивно делятся. К 10-му дню большое число узких трипаносом проникают за перитро- фическую мембрану заднего конца желудка, мигрируют в сторону пищевода, где вновь проходят через перитрофическую мембрану в просвет желудка и далее в хоботок, а оттуда, к 20-му дню, - в слюнные железы мухи. Проникнуть в слюнные железы трипаносомы могут и через гемо-
цель. В слюнных железах трипаносомы претерпевают ряд морфологических изменений, многократно делятся и превращаются в инвазионную для человека и позвоночных животных стадию - трипомастиготу. Развитие трипаносом в переносчике продолжается в среднем 15-35 дней в зависимости от температуры среды. Эффективное заражение мух происходит при температуре от 24 до 37 ?С. После заражения муха цеце способна передавать трипаносом на протяжении всей жизни.
Цикл развития в позвоночном хозяине. Способ заражения африканским трипаносомозом позволяет отнести возбудителей к разряду Salivaria, а заболевание - к слюнным (саливарным) трипаносомозам. После проникновения в кожу трипаносомы сохраняются несколько дней в подкожной клетчатке, а затем проникают в кровеносное русло лимфу и СМЖ, где делятся простым бинарным делением. Иногда ее обнаруживают в сосудистом сплетении мозга в стадии амастиготы. При этом выделяются разные формы трипаносом: тонкие и длинные, короткие и широкие, а также промежуточные трипомастиготные формы. Инкубационный период сонной болезни продолжается от нескольких дней до нескольких недель.
Патогенез и клиника. В течение болезни выделяют две стадии: гемо- лимфатическую и менингоэнцефалитическую, или терминальную (сонную болезнь в узком смысле слова).
Гемолимфатическая стадия наступает через 1-3 недели после инвазии и связана с распространением трипаносом в организме (по лимфатической и кровеносной системам) из места их первичного внедрения.
Заболевание характеризуется длительным течением. Через 1-3 недели (или через несколько месяцев) после инвазии на месте укуса мухи цеце иногда развивается первичное поражение (первичный аффект), представляющее собой болезненный, эластичный, красный, фурункулоподобный узелок диаметром 1-2 см. В нем содержится большое количество лимфы с трипаносомами. Такой узелок называется трипаносомным шанкром. В течение 2-3 недель первичное местное поражение спонтанно исчезает, на его месте остается пигментированный рубец. Трипаносомный шанкр возникает главным образом у некоренных жителей Африки.
Одновременно с появлением первичного аффекта на коже туловища и конечностей могут возникнуть так называемые трипаниды, имеющие вид розовых или фиолетовых пятен различной формы диаметром 5-7 см. У африканцев на фоне темной кожи трипаниды заметны слабее, чем у европейцев. На лице, кистях, стопах и на местах эритематозных высыпаний заметны отеки, отмечается болезненность кожи при ее сжатии.
В период развития шанкра или через несколько дней после его исчезновения паразиты появляются в крови, и возникает лихорадка неправильного типа с подъемом температуры до 38,5 ?С (редко до 41 ?С). Лихорадочные периоды, чередуясь с периодами апирексии, могут про- должаться неделями.
Через несколько дней после появления лихорадки у больных гамбийским трипаносомозом увеличиваются периферические и мезентериальные лимфатические узлы, преимущественно заднешейные, которые могут достигать величины голубиного яйца. Вначале узлы имеют мягкую консистенцию, позднее они становятся плотными.
Симптомами гемолимфатической стадии болезни являются также слабость, потеря веса, тахикардия, боли в суставах, гепатоспленомегалия. У трети больных появляется уртикарная сыпь на коже век и развивается их отек. Отек обычно выражен так сильно, что отечная ткань иногда нависает над щекой. Наблюдается увеличение околоушной слюнной железы соответствующей стороны. В более поздние сроки развиваются односторонний или двусторонний кератит, иридоциклит, кровоизлияние в радужку и характерное диффузное сосудистое помутнение роговицы с поражением всех ее слоев. В тяжелых случаях происходит стойкое интенсивное рубцевание роговицы. Нарастают слабость и апатия, являющиеся ранними признаками поражения ЦНС.
Тяжесть описанных клинических симптомов и длительность первого периода болезни у различных больных может варьировать в широких пределах, иногда до нескольких лет.
Менингоэнцефалитическая стадия. Спустя несколько месяцев или лет у подавляющего большинства пациентов болезнь переходит во вторую фазу, которая характеризуется поражением ЦНС. Трипаносомы преодолевают гематоэнцефалический барьер и проникают в ЦНС, концентрируясь в лобных долях больших полушарий мозга, варолиевом мосту и продолговатом мозге, что сопровождается расширением желудоч- ков мозга, отеком мозговой ткани, утолщением извилин и развитием клинической симптоматики менингоэнцефалита и лептоменингита. Наблюдается периваскулярная инфильтрация вокруг кровеносных сосудов, набухание и дегенерация их стенок.
Наиболее характерной чертой второй стадии болезни является нарастающая сонливость, которая возникает преимущественно днем, в то время как ночной сон часто прерывистый и беспокойный. Сонливость настолько выражена, что больной может заснуть даже во время приема пищи. Постепенно нарастают и прогрессируют нейропсихические нарушения. При ходьбе больной волочит ноги, выражение его лица угрюмое,
нижняя губа отвисает, изо рта течет слюна. Пациент теряет всякий интерес к окружающему, медленно, неохотно отвечает на вопросы, жалуется на головную боль. Нарушение психического статуса сопровождается развитием маниакальных или депрессивных состояний. Появляются тремор языка, рук, ног, фибриллярные подергивания мышц лица, пальцев, невнятность речи, атаксическая походка. Давление на ладони вызывает появление острой боли вскоре после его прекращения (симптом Керанделя). Позднее возникают судороги, сменяющиеся параличами.
Диагноз. Предварительный диагноз сонной болезни можно поставить и на основании клинических симптомов, однако неопровержимым подтверждением диагноза сонной болезни служит обнаружение Т. gambiense при лабораторных паразитологических исследованиях.
Для выявления трипаносом проводятся исследования пунктатов шанкра и увеличенных лимфоузлов (до развития в них фиброзных изменений), крови, спинно-мозговой жидкости. Из полученного субстрата готовят нативные препараты и препараты, окрашенные по Романовскому-Гимза.
Лечение. Для лечения больных в первой стадии развития гамбийской формы трипаносомоза используют пентамидин (пентамидин изотионат) - ароматический диамидин. Препарат назначается внутримышечно в дозе 4 мг/кг/сут ежедневно или через день. Курс лечения составляет 7-10 дней.
Нередко применяется комбинированное лечение пентамидином (4 мг/кг внутримышечно 2 дня) или сурамином (2-3 дня в нарастаю- щей дозе 5-10-20 мг/кг) с последующим назначением меларсопрола (1,2-3,6 мг/кг в сутки в/в капельно) - 3 трехдневных цикла с недельными перерывами.
Имеются сведения о циркуляции резистентных к меларсопролу штаммов Т. gambiense в Уганде.
Для лечения всех стадий гамбийского трипаносомоза эффективен эфлорнитин. Препарат вводится в/в капельно, медленно, через каждые 6 часов в течение 14 дней. Разовая доза для взрослых составляет 100 мг/кг. При лечении эфлорнитином возможно развитие анемии, лейкопении, тромбоцитопении, судорог, отеков лица, анорексии.
Эпидемиология. Гамбийская форма трипаносомоза является пре- имущественно антропонозом. Основным источником инвазии служит человек, дополнительным - свинья. Эти виды мух тенелюбивы, активны в светлое время суток. Они обитают в зарослях растительности по берегам рек и ручьев в ряде районов Западной и Центральной Африки. Мухи цеце живородящие, самка откладывает единственную личин-
ку прямо на поверхность почвы, в расщелины, под корни деревьев. Личинка сразу вбуравливается в почву и через 5 часов превращается в куколку. Вылет имаго происходит через 3-4 недели после окукливания. Взрослая самка живет 3-6 месяцев; за всю свою жизнь она откладывает 6-12 личинок.
Эпидемическая значимость того или иного вида мух цеце определяется прежде всего степенью их контакта с человеком. Наиболее антропофильным видом является G. palpalis. Она часто концентрируется возле поселков и залетает в них, нападая на человека вне помещений. Однако наиболее часто мухи цеце этого и других видов нападают в природных ландшафтах, поэтому наиболее подвержены риску заражения этими возбудителями охотники, рыбаки, строители дорог, лесорубы и др.
Достаточно одного укуса зараженной мухи, чтобы человек заболел сонной болезнью, поскольку минимальная инвазируюшая доза трипаносом составляет 300-400 паразитов, а муха со слюной за один укус выделяет их около 400 тыс. Больной становится источником инвазии примерно с 10-го дня после заражения и остается им на протяжении всего периода болезни, даже в период ремиссии и отсутствия клинических проявлений.
Теоретически возможен механический занос трипаносом в кровь человека кровососущими членистоногими при дополнительных повторных кровососаниях больного человека, так как на хоботке мух, слепней, комаров, клопов и других членистоногих возбудители сохраняют жизнеспособность в течение нескольких часов. Заражение может происходить также при гемотрансфузиях или при недостаточной стерилизации шприцов во время инъекций. Гамбийская форма трипаносомоза встречается в виде очагов в Западной и Центральной Африке между 150 с. ш. и 180 ю. ш.
Летальность от трипаносомоза в Конго в середине прошлого века составляла около 24%, а в Габоне - 27,7%, поэтому трипаносомоз для стран тропической Африки представляет серьезную экономическую и социальную проблемы.
Заболеваемость носит сезонный характер. Пик приходится на сухой сезон года, когда мухи цеце концентрируются около оставшихся не пересохшими водоемов, интенсивно используемых населением для хозяйственных нужд.
Профилактика и меры борьбы. Комплекс мероприятий по оздоровлению очагов сонной болезни включает выявление и лечение больных, общественную и индивидуальную профилактику населения, борьба с переносчиками. Имеет значение серологическое обследование, прежде
всего людей, относящихся к группе риска (охотники, лесорубы, строители дорог и др.). Обследование должно проводиться не реже 2-х раз в год (перед сезоном и после сезона наибольшей опасности заражения).
Родезийская форма африканского трипаносомоза. Родезийская форма во многом сходна с гамбийской формой африканского трипаносомоза, но является зоонозом.
Этиология и биология. Возбудитель - Т. rhodesiense, по морфологии близка к Т. Gambiense. Основными хозяевами Т. rhodesiense служат различные виды антилоп, а также крупный рогатый скот, козы, овцы и реже человек.
Главными переносчиками родезийской формы являются мухи цеце группы «morsitans» (С. morsitans, G. Pallides и др.). Они обитают в саваннах и саванных лесах, более светолюбивы и менее влаголюбивы, чем виды «palpalis», более зоофильны и охотнее нападают на крупных копытных и мелких бородавочников, чем на людей.
Патогенез и клиника сонной болезни родезийского типа отличаются более острым и тяжелым течением. Инкубационный период при ней короче, чем при гамбийской форме, и составляет 1-2 недели.
На месте укуса возникает первичный аффект - «трипаносомный шанкр» - в виде фурункула, который исчезает через несколько дней, оставляя иногда небольшой рубец. Трипаносомный шанкр отмечается не у всех больных, чаще у европейцев, чем у африканцев. В период развития шанкра или через несколько дней после его появления паразит появляется в крови, и с этим ассоциируется начало лихорадочного периода. Лихорадка носит неправильный характер, сопровождается высоким подъемом температуры, головной болью. Смерть больных при отсутствии лечения нередко наступает через 9-12 месяцев. Гемолимфатическая фаза инвазии выражена слабо. У всех больных обнаруживаются трипаносомы в крови, у многих - в СМЖ.
Диагностика проводится так же, как при гамбийской форме.
Лечение. Проводится сурамином и меларсопролом.
Эпидемиология. Резервуарами Tryponasoma rhodesiense в природе являются различные виды антилоп и других копытных. В ряде случаев дополнительным резервуаром может быть крупный рогатый скот.
Зоонозная форма сонной болезни распространена в равнинной саванне, в отличие от антропонозной, тяготеющей к долинам рек. В естественных условиях саванны Т. rhodesiense циркулирует по цепочке: антилопа - муха цеце - антилопа, без участия человека. Человек заражается эпизодически при посещении энзоотичных очагов. Относительной редкости заражения людей в дикой природе способствует также выра-
женная зоофилия переносчика, вследствие чего мухи цеце этих видов неохотно нападают на человека. В этих условиях заболевают представители определенных профессий - охотники, рыболовы, путешественники, военнослужащие. Мужчины болеют значительно чаще, чем женщины и дети.
При сельскохозяйственном освоении территории и появлении постоянного населения сонная болезнь становится эндемичной и человек включается в цикл. При этом циркуляция Т. rhodesiense может осуществляться уже по такой цепочке: антилопа - муха цеце - человек - муха цеце - человек.
Было показано, что в ряде случаев передача сонной болезни может осуществляться мухами цеце механически, без прохождения многодневного цикла развития в переносчике. Такие случаи возможны во время прерванного кровососания, когда переносчик начинает пить кровь больного животного или человека, а затем перелетает и кусает здорового человека или животного.
Профилактика и меры борьбы такие же, как и при гамбийской форме.
Трипаносомоз американский. Американский
трипаносомоз (болезнь Чагаса, или Шагаса) - трансмиссивная
природно-очаговая протозойная болезнь, характеризуется наличием острой и
хронической фаз в течении процесса. В
Этиология. Возбудитель - Trypanosoma cruzi, отличается от возбудителей африканского трипаносомоза меньшей длиной тела (13-20 мкм) и более крупным кинетопластом трипомастиготных форм. В фиксированных препаратах крови Тг. cruzi часто имеет изогнутую форму, наподобие букв С или S (С- и S-формы).
Возбудитель американского трипаносомоза относится к разряду Stercoraria (лат. stercus - кал, oralis - ротовой), а заболевание - к стеркорарийным трипаносомозам, таким образом возбудитель передается через фекалии клопа - переносчика (рис. 3.11). Кроме того, для Tr. cruzi характерны пертистенция (лат. pertistere - оставаться, упорствовать) - способность паразита сохраняться в организме хозяи- на в течение всей жизни с развитием резистентности (устойчивости) к реинвазии (повторному заражению). При этом трипаносомы продолжают медленно размножаться в течение всей жизни хозяина в клетках некоторых тканей.
Цикл в переносчиках трипаносом - клопах триатомидах
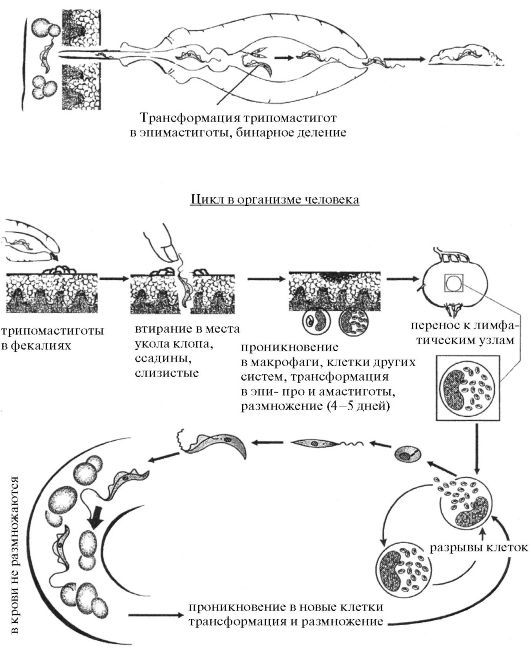
Рис. 3.11. Жизненный цикл Tripanosoma cruzi
Биология. Цикл развития Tr. cruzi проходит со сменой хозяев: а) позвоночные животные (более 100 видов) и человек; б) переносчик возбудителя (клопы подсемейства Triatominae).
Цикл развития в переносчике проходит в триатомовом клопе.
Инвазионной стадией для переносчика, как и для позвоночного животного и человека, являются трипомастиготы. Поскольку колющий ротовой аппарат, в отличие от мухи цеце, у клопов очень слабый и не способен проколоть даже кожу человека, они находят ссадины или слизистые оболочки, коньюнктивы, оболочки носа, губ (за что получили название - поцелуйный клоп).
Заражение клопов происходит при питании кровью человека или животных, содержащих трипомастиготы.
Попадая в организм триатомовых клопов (переносчиков американского трипаносомоза), трипаносомы T. cruzi также достигают желудка насекомого, превращаются здесь в эпимастиготы и размножаются в течение нескольких дней. Затем они проходят в заднюю и прямую кишки, где возвращаются к трипомастиготной форме. С этого момента клопы становятся заразными. После или во время засасывания крови клопы опорожняют прямую кишку, и возбудители попадают на кожу человека или слизистые оболочки (конъюнктиву, оболочки губ, носа). Возбудитель американского трипаносомоза относится в связи с этим к стеркорарийным трипаносомозам. Продолжительность цикла развития паразитов в переносчике составляет от 5 до 15 дней в зависимости от температуры воздуха. Однократно инвазированный клоп сохраняет паразитов до конца жизни (около 2 лет). Трансовариальная передача отсутствует.
Инвазийной стадией для позвоночного хозяина является трипомастиготная форма. Передача инвазии человеку и другим теплокровным происходит не прямо через укус клопа, а путем контаминации экскре- ментами клопов, содержащими трипаносомы, ранок от укуса или слизистых оболочек. На месте укуса формируется «чагома» - первичный симптом трипонасомоза.
Как правило, дефекация у клопов происходит непосредственно во время кровососания. Укусы клопов вызывают сильный зуд и воспаление, в результате этого паразиты могут быть занесены в ранку во время расчесывания. У человека зарегистрированы также случаи врожденного трипаносомоза.
После попадания в организм позвоночного животного (природного резервуара) или человека трипомастиготы некоторое время остаются в периферической крови, но не размножаются.
Затем они проникают в мышечные клетки и клетки эндотелия легких, печени, лимфатических узлов и других органов. Однако преимущественно паразиты скапливаются в клетках сердечной мышцы. Внутри клеток трипомастиготы трансформируются в эпимастиготную и промастиготную формы, и, наконец, в конце трансформации превращаются в округлую безжгутиковую форму - амастиготу, размером 2,5-6,5 мкм, содержащую круглое ядро и маленький овальной формы кинетопласт. Внутри клетки амастиготы размножаются бинарным делением.
Наполненная амастиготами клетка человека или животного увеличивается в размерах и превращается в псевдоцисту, оболочкой которой служит стенка клетки хозяина. Перед разрывом и сразу после разрыва такой псевдоцисты амастигота (минуя промастиготную эпимастиготную стадию) превращается в трипомастиготу. Последние инвазируют соседние клетки, размножаются в стадии амастигот с образованием новых псевдоцист. Таким образом, амастиготы - сугубо внутриклеточные паразиты. Часть трипомастигот, освободившихся из псевдоцисты и не попавших в соседние клетки, попадают в кровь, где циркулирует, и оттуда могут попадать в организм переносчика.
Эпидемиология. Основными переносчиками возбудителя американского трипоносомоза являются летающие клопы: Triatoma megistis, Triatoma infestens и др. Эти насекомые отличаются яркой окраской и сравнительно крупными размерами - 15-35 мм в длину, нападают на человека и животных ночью. Трансовариальной передачи трипаносом из поколения в поколение у триатомовых клопов не происходит.
Передача возбудителя болезни Чагаса происходит по типу специфической контаминации. Трипаносомы, выделенные с фекалиями клопов во время кровососания, проникают в организм человека или животных через поврежденную кожу или слизистые оболочки глаз, носа, полости рта вблизи места укуса. Заражение трипаносомозом возможно также алиментарным путем (в том числе, с молоком матери) и при гемотрансфузиях.
В настоящее время установлено, что возможна и трансплацентарная передача Т. cruzi, но уровень ее сравнительно невелик: в среднем у больных матерей рождаются 2-4% инфицированных детей. Механизм протективного действия плаценты полностью не изучен.
Известны синантропные и природные очаги болезни Чагаса. В очагах первого типа клопы обитают в глинобитных домах, хлевах, птичниках, норах домовых грызунов. Особенно много, до нескольких тысяч клопов (зараженность которых достигает 60% и выше), обнаруживается в глино- битных хижинах. В синантропных очагах, кроме человека, резервуарами
возбудителя являются собаки, кошки, свиньи и другие домашние животные. По имеющимся данным, инфицированность собак в синантропных очагах в отдельных районах Бразилии составляет 28,2%, в Чили - 9%, кошек - в Бразилии 19,7%, в Чили - 12%.
В природных очагах резервуарами возбудителя служат броненосцы (сами не болеют), опоссумы (наиболее важны, так как имеют высокий индекс паразитемии), муравьеды, лисы, обезьяны и др. В Боливии и некоторых районах Перу определенное значение в качестве резервуара Т. cruzi имеют морские свинки, которых население держит дома для употребления в пищу. Их естественная зараженность достигает 25-60%.
Заражение людей происходит при посещении таких очагов в теплое время года, когда активны переносчики. В природных очагах чаще заражаются мужчины. В целом, болезнь Чагаса регистрируется в течение всего года во всех возрастных группах, но чаще у детей. Более характерны спорадические случаи, но при массовом нападении зараженных триатомовых клопов на людей возможны эпидемические вспышки.
Болезнь Чагаса широко распространена, она выявляется практически во всех странах американского континента от 42? с. ш. до 43? ю. ш. Особенно активные и стойкие природные очаги болезни расположены в латиноамериканских странах к югу от Мексики, за исключением островов Карибского моря, Белиза, Гайяны и Суринама. Описаны единичные случаи американского трипаносомоза в США (штат Техас). Наиболее часто инфекция регистрируется в Бразилии, Аргентине, Венесуэле; также выявляется в Боливии, Гватемале, Гондурасе, Колумбии, КостаРике, Панаме, Парагвае, Перу, Сальвадоре, Уругвае, Чили, Эквадоре. В других частях света инфекция не встречается. Возможно, болезнь Чагаса распространена шире, чем принято считать. Под риском заражения Т. cruzi живут более 35 млн человек. По предварительным оценкам среди них инфицировано не менее 7 млн.
Патогенез и патолого-анатомическая картина. Паразитируют и раз- множаются Т. cruzi в организме человека и позвоночного хозяина сначала в макрофагах кожи и подкожной клетчатке, затем в регионарных лимфатических узлах, далее - во всех органах. Таким образом, при внедрении трипаносом развивается местная тканевая реакция в виде деструкции клеток, инфильтрации и отека тканей, затем увеличиваются регионарные лимфатические узлы. Следующим этапом патогенеза является паразитемия и гематогенная диссеминация трипаносом с последующей локализацией в тканях различных органов, где и происходит размножение возбудителей. Наиболее часто и тяжело поражаются сердце, скелетная и гладкая мускулатура, нервная система. В острой ста-
дии заболевания на ранних сроках паразитемия достаточно массивна, но со временем интенсивность ее падает, она выявляется лишь периодически, а на поздних сроках хронической стадии - в редких эпизодах. Существует, однако, мнение, что при отсутствии лечения паразитемия сохраняется пожизненно.
Постепенно на первый план выступает следующий важнейший этап патогенеза американского трипаносомоза -аллергические и аутоиммунные процессы, а также образование иммунных комплексов. В резуль- тате патогенного действия трипаносом и продуктов их распада, специфической сенсибилизации и аутоаллергии возникают воспалительные, инфильтративные и дегенеративные изменения клеток внутренних органов, центральной и периферической нервной систем.
Наиболее поражаемым органом при болезни Чагаса является сердце. В острой стадии инфекции в миокарде развивается распространенный интерстициальный воспалительный процесс с отеком и разруше- нием миофибрилл и инфильтрацией нейтрофильными лейкоцитами, моноцитами и клетками лимфоидного ряда. Соседние с инфильтратом мышечные клетки могут дегенеративно перерождаться. В хронической стадии болезни Чагаса в мышце сердца происходят неуклонный миоцитолиз, фиброзирование, сохраняется или нарастает клеточная инфильтрация.
У некоторых больных, инвазированных Т. cruzi (чаще у младших детей), в головном мозге развивается острый специфический менингоэнцефалит с мононуклеарной инфильтрацией мягких мозговых оболочек, периваскулярными воспалительными реакциями, иногда одновременно с геморрагией и пролиферацией глии.
Серьезно страдают структуры ганглиев вегетативной нервной системы, что приводит к расстройствам иннервации внутренних органов. Поражение периферических элементов вегетативной нервной системы усугубляет нарушение сердечной деятельности и является причиной воз- никновения мегаорганов в желудочно-кишечном тракте (мегаэзофагус, мегагастриум, мегаколон), мочевыделительной системе и др.
Клиника. Считается, что инкубационный период при американском трипаносомозе колеблется от 1 до 2 недель. На месте инокуляции паразитов возникает воспалительная реакция - «чагома». В случае проникновения паразитов через кожу первичное местное воспаление напоминает ненагноившийся фурункул. При проникновении через слизистую глаза возникают отек, конъюнктивит, одутловатость лица - симптом Романьи. В дальнейшем развиваются локальные лимфангоит и лимфаденит
(рис. 3.12).
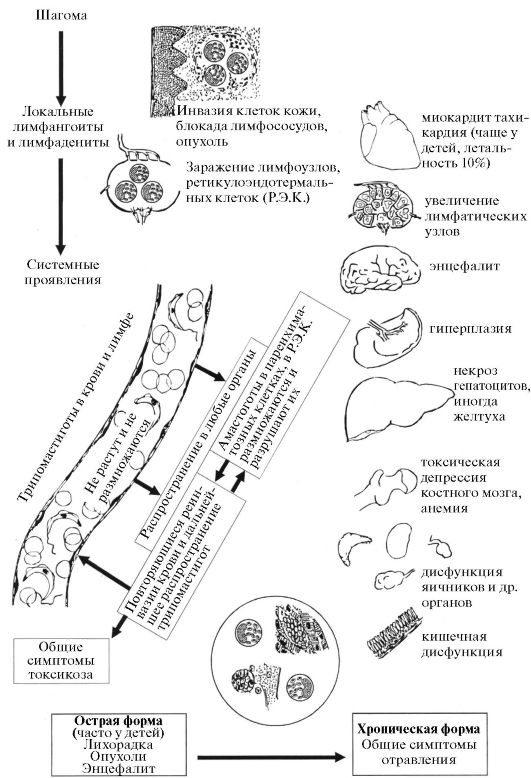
Рис. 3.12. Американский трипаносомоз (патогенез и патология)
Среди общих симптомов выявляются лихорадка постоянного или ремитирующего типа с повышением температуры до 39-40 оС, общая аденопатия, гепатоспленомегалия, отеки, иногда макулезные высыпания. Эти клинические симптомы возникают на фоне острого миокардита и раздражения менингеальной оболочки. Такая клиника, как правило, наблюдается в эндемичных районах у детей. При этом тяжесть течения тем выраженнее, чем меньше возраст больного. Примерно 10% случаев заканчиваются летально в результате прогрессирующего менингоэнцефалита или тяжелого миокардита с сердечной недоста- точностью.
По прошествии острого периода болезнь переходит в хроническую стадию. Симптоматика этой стадии неопределенная. Часто в течение многих лет болезнь протекает бессимптомно. В зависимости от серьез- ности поражений вегетативной системы и сердца на первый план выходят симптомы сердечной недостаточности, а также развитие мегаэзофагуса, мегадуоденума, мегаколона или мегасигмы с соответствующей симптоматикой.
Клиническая и лабораторная диагностика. В острой стадии паразиты легко обнаруживаются путем микроскопии препаратов периферической крови. Наряду с окрашенными фиксированными препаратами можно исследовать раздавленную каплю крови, при этом подвижные паразиты хорошо видны под микроскопом. В хронической стадии микроскопия малоэффективна.
Для диагностики используют серологические реакции, чаще - РСК с антигеном из пораженного трипаносомами сердца. Широкое распространение в эндемичных районах получила ксенодиагностика - кормление незараженных триатомовых клопов на больном с последующим исследованием экскрементов насекомых с целью обнаружения паразитов. Используются также изодиагностическая проба - инокуляция крови больного лабораторным животным, и внутрикожная проба с «круцином» (инактивированной культурой Т. cruzi).
Лечение. Специфическая терапия разработана недостаточно. Некоторой эффективностью в острой стадии, особенно в период «чагомы», обладают производные нитрофурана. Иногда в случаях мегаколона показано оперативное лечение.
Профилактика. Применение стойких контактных инсектицидов для уничтожения клопов-переносчиков. Благоустройство жилищ. В связи с наличием бессимптомных носителей в эндемичных районах обязательно обследование доноров серологическими методами и с помощью ксенодиагностики.
3.2.2. Лейшманиозы (род Leishmania)
Лейшманиозы - облигатные трансмиссивные заболевания, возбудите- лями которых являются простейшие рода Leishmania. Жизненный цикл лейшманий протекает со сменой хозяев и включает две морфологические формы: амастиготную (безжгутиковую) и промастиготную (жгутиковую) (рис. 3.13). В амастиготной форме лейшмании паразитируют в клетках (макрофагах) природных резервуаров (позвоночные животные) и человека; в промастиготной обитают в различных частях пищеварительного тракта москитов, которые служат их переносчиками и в пита- тельных средах. Переносчиками лейшманий являются двукрылые насекомые: Старого Света - москиты рода Phlebotomus, Нового Света - рода Lutzomya. Основные природными резервуарами - грызуны и представители семейства псовых.
Область распространения лейшманиозов включает страны с жарким и теплым климатом. Заболевания людей зарегистрированы в 76 государствах Азии, Африки, Южной Европы, Центральной и Южной Америки. Во многих странах лейшманиозы наносят существенный социально-экономический ущерб. В России локальные случаи заболевания лейшманиозами в настоящее время отсутствуют, однако ежегодно регистрируются завозные случаи, среди заразившихся - лица, посетившие страны ближнего и дальнего зарубежья, эндемичные по лейшманиозам. При этом больные выявляются среди граждан как зару- бежных государств, так и Российской Федерации, возвратившихся из деловых или туристических поездок в районы с субтропическим или тропическим климатом.
Различают три клинические формы лейшманиозов: кожный, кожнослизистый и висцеральный. При кожном лейшманиозе поражаются кожные покровы; при кожно-слизистом - кожа и слизистые оболочки, главным образом верхних дыхательных путей, иногда с разрушением мягких тканей и хрящей; при висцеральном лейшманиозе возбудитель локализируется в печени, селезенке, костном мозге и лимфатических узлах. В России чаще всего регистрируются кожный и висцеральный лейшманиозы.
Этиология. Возбудители кожных лейшманиозов описаны Куннигамом (Cuningham, 1884) и Фиртом (Firth, 1891). В
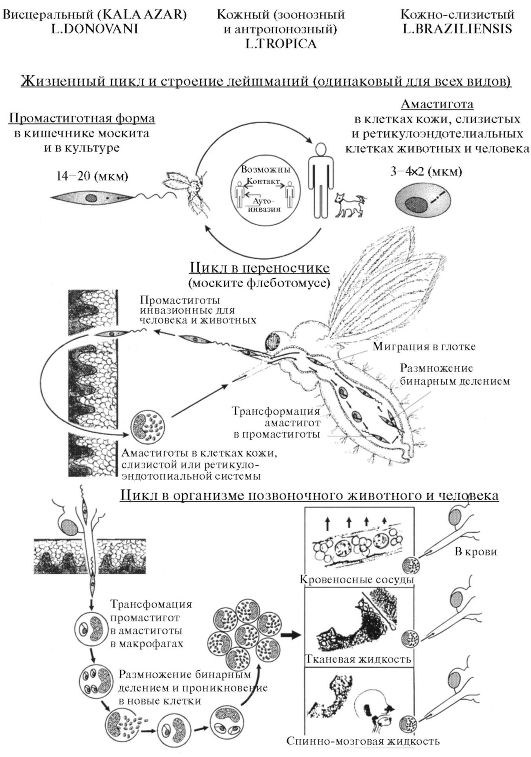
Рис. 3.13. Лейшманиозы
В
В организме теплокровных амастиготы и микромастиготы лейшманий обнаруживаются в протоплазме клеток ретикулоэндотелиальной системы, способных к фагоцитозу. Они имеют вид мелких овальных или округлых телец размером от 2 до 5 мкм.
Протоплазма окрашивается по Романовскому-Гимза в сероватоголубой цвет. В центральной части или сбоку расположено овальное ядро, которое окрашивается в красный или красно-фиолетовый цвет. Около ядра располагается кинетопласт (круглое зернышко или короткая палочка, лежащая эксцетрично и окрашивающаяся более интенсивно, чем ядро, в темно-фиолетовый цвет). Наличие ядра и кинетопласта является главным признаком, позволяющим отличить лейшманий от других образований (тромбоцитов, гистоплазм, дрожжевых клеток и т.д.).
Промастиготы лейшманий имеют удлиненную веретеновидную форму; длина их составляет 10-20 мкм, ширина - 3-5 мкм. Ядро, протоплазма и кинетопласт окрашиваются в те же тона, как и у амастигот. В культурах промастиготы часто собираются кучками в виде розеток, со жгутиками, обращенными к центру (явление агломерации).
Цикл развития лейшманий. Инфекционный процесс начинается, когда промастиготы проникают в организм хозяина со слюной москитов, которые кусают человека за лицо или конечности. Паразиты поглощаются дермальными макрофагами и вскоре превращаются в амастиготы или микромастиготы, размножающиеся поперечным делением, что в конечном счете приводит к разрыву макрофагов. Этот процесс про- должается продолжительное время, так как освобождающиеся амастиготы поглощаются новыми макрофагами, которые скапливаются в очаге поражения и пролиферируют здесь. Пораженные макрофаги способствуют дальнейшей диссеминации паразитов. Последующее развитие очага поражения зависит от индивидуальных особенностей паразита и состояния иммунных реакций организма хозяина. Положение осложняется тем, что в каждый таксон лейшманий может входить несколько отличающихся друг от друга штаммов; тем не менее, обычно каждый вид или подвид лейшманий вызывает достаточно характерное заболевание, которое входит в одну из основных групп.
Москит заражается амастиготами лейшманий при кровососании на инфицированном позвоночном. В кишечнике москита лейшма-
нии переходят в промастиготную стадию, размножаются продольным делением и развиваются в течение недели, превращаясь в инвазивные формы, которые концентрируются в передних отделах кишечника и в хоботке москита. Развитие промастигот в москитах происходит при температуре свыше 15 ?С. При повторном кровососании переносчика промастиготы попадают в кровь позвоночного хозяина, фагоцитируются клетками РЭС и превращаются в амастиготы.
Москиты - мелкие двукрылые насекомые, величиной от 1,2 до
Особенности распространения лейшманий и их циркуляции на эндемичной по лейшманиозам территории тесно связаны с особенностями экологии их переносчиков - москитов. Так, в Старом Свете лейшманиозы распространены в сухих (аридных) территориях - пустынях, полупус- тынях и оазисах; в Новом Свете - это (за редким исключением) болезни влажного тропического леса.
В населенных пунктах Центральной
Азии москиты обычно разлетаются на расстояние всего в десятки метров от
мест выплода; на открытой местности распространяются до
Эпидемиология. Лейшманиозы занимают одно из важнейших мест в тропической патологии. По данным Всемирной организации здравоохранения, лейшманиозы распространены в 88 странах мира, в 32 странах заболевания подлежат обязательной регистрации. По экспертным оценкам, число больных лейшманиозами в мире составляет 12 млн человек. Ежегодно возникает 2 млн новых случаев. Примерно 350 млн человек проживают на эндемичных по лейшманиозам территориях и находятся под угрозой заражения.
Лейшманиозы включены в специальную программу ВОЗ по изучению и борьбе с тропическими болезнями. В некоторых развивающихся
странах лейшманиозы могут выступать в качестве фактора, сдерживающего экономическое развитие тех или иных районов.
Существует несколько видов лейшманий, патогенных для человека, которые сходны по своей морфологии, но отличаются по антигенным, молекулярно-биологическим и биохимическим признакам, а также по клинической картине и эпидемиологии вызываемых ими заболеваний.
Можно выделить три основные группы лейшманиозов:
1. Кожный лейшманиоз.
2. Кожно-слизистый американский лейшманиоз.
3. Висцеральный лейшманиоз.
Однако такое деление нельзя считать абсолютным: в ряде случаев возбудители висцеральных форм болезни могут вызывать кожные поражения, а возбудители кожных форм - поражения внутренних органов.
Кожный лейшманиоз впервые описан английским врачом Pococke (1745). Клиническая картина болезни освещалась в трудах братьев Russel (1756), русских военных врачей Н.А. Арендта (1862) и Л.Л. Рейденрейха («Пендинская язва», 1888).
Большим
событием явилось открытие возбудителя кожного лейшманиоза русским
военным врачом П.Ф. Боровским (1898). Этот воз- будитель также
обнаружен американским врачом J.H. Wright (1903). В 1990-1903 гг. W.B.
Leishman и C. Donovan обнаружили в селезенке больных индийским
лейшманиозом возбудителя висцерального лейшманиоза, который был описан
A. Laveran и F. Mesnil (1903) под названием L. donovani, а возбудитель кожного лейшманиоза получил наименование L. tropica в
Только при кожном лейшманиозе заболевание может заканчиваться развитием напряженного стерильного иммунитета и резистентности (устойчивости) к реинвазии. Но даже при этом заболевании паразиты могут иногда персистировать (длительное время сохраняться) в орга- низме больного. Так, например, L. brasiliense могут распространяться и поражать носоглотку через много лет после первичного заболевания. L. tropica могут вызывать хронические рецидивирующие поражения, а у некоторых больных с отягощенным преморбидным фоном при инвазии L. mexicana или L. aethiopica может развиться анергическая форма болезни, известная под названием «диффузный кожный лейшманиоз». Невосприимчивость к реинвазии при наличии текущей инвазии обозначают термином премуниция (синоним нестерильного иммунитета).
Кожный лейшманиоз характеризуется поражениями кожи, которые называются лейшманиомами. Вследствие размножения лейшманий на месте введения их москитами, возникают специфические гранулемы,
состоящие из плазматических клеток, нейтрофилов, лимфоидных элементов. Сосуды в области инфильтрата и за его пределами расширены, отмечаются набухание и пролиферация их эпителия. Процесс развития лейшманиомы состоит из трех стадий: бугорка, изъявления и рубцевания. Возможно распространение инфекции по лимфатическим сосудам и развитие лимфангитов и лимфаденитов.
Различают антропонозный (АКЛ) и зоонозный (ЗКЛ) кожный лейшманиозы (табл. 3.2.1.).
Таблица 3.2.1. Особенности двух типов лейшманиоза
Антропонозный кожный лейшманиоз
Этиология. Возбудителем является Leishmania tropica minor. АКЛ (поздноизъязвляющийся, городской) является типичным антропонозом, при котором источником возбудителя служит больной человек. Болеют АКЛ большей частью жители городов.
Патогенез и клиника. Инкубационный период колеблется от 2-4 месяцев до 1-2 лет (возможно удлинение срока до 4-5 лет). По его истечении на месте укуса зараженными москитами (чаще лицо, верхние конечности) появляются малозаметные единичные, реже множественные бугорки - лейшманиомы. Они проходят три стадии: красного или бурого бугорка (стадия пролиферации), сухой язвы (стадия деструкции) и рубца (стадия репарации) (рис. 3.14). Они медленно увеличиваются и через 3-4 месяца достигают 5-15 мм в диаметре. Цвет их становится красновато-буроватым с синюшным оттенком. После нескольких месяцев бугорки могут постепенно рассосаться и почти бесследно исчезнуть. Однако подобное абортивное течение наблюдается редко. Чаще на поверхности бугорка появляется едва заметное западение и образуется чешуйка, которая пре-
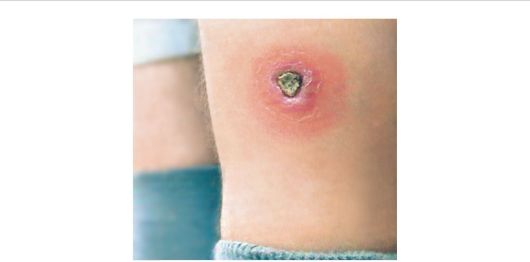
Рис. 3.14. Язва при кожном антропонозном лейшманиозе
вращается затем в плотно прикрепленную к бугорку желтовато-буроватую корочку.
После отпадания или насильственного снятия корки обнаруживается кровоточащая эрозия или неглубокая, часто кратерообразная язва с гладким или мелкозернистым дном, покрытым гнойным налетом. Края язвы неровные, изъеденные, иногда подрытые. На протяжении длительного времени язва покрыта плотной коркой. Через 2-4 месяца после формирования язв постепенно начинается процесс их рубцевания, который заканчивается в среднем через год с момента появления бугорка. Отсюда происходят местные народные названия заболевания - «годовик», «солек», «иыл-ярасы». В некоторых случаях заболевание затягивается на 2 года и более.
Иногда через тот или иной промежуток времени после первой лейшманиомы появляются новые бугорки, которые часто рассасываются, не подвергаясь язвенному распаду, особенно поздние. Поскольку невосприимчивость к суперинвазии развивается лишь через 6 месяцев после заболевания, клиническое течение последовательных лейшманиом почти не отличается от развития первичных.
У некоторых больных, чаще у лиц пожилого возраста, развиваются не ограниченные, а диффузно-инфильтрирующие лейшманиомы. Для них характерны более крупные, довольно резко ограниченные очаги поражения, образующиеся вследствие слияния близко расположенных друг к другу бугорков. Кожа на этих участках резко инфильтрирована и утолщена (в 3-10 раз толще нормальной). Поверхность ее синюшнокрасного цвета, слегка шелушащаяся, гладкая или бугристая. На общем
инфильтрате могут быть разбросаны отдельные небольшие язвочки, покрытые корочками.
После перенесенного антропонозного кожного лейшманиоза примерно в 10% случаев развивается вялотекущий хронический туберкулоидный кожный лейшманиоз (рецидивный кожный лейшманиоз), клинически напоминающий туберкулезную волчанку, (рис.3.15), который может длиться десятилетиями. Люди, перенесшие АКЛ, приобретают иммунитет к этой форме лейшманиоза, но могут заболеть ЗКЛ.
Диагностика. Лейшмании могут быть обнаружены в окрашенных по Романовскому-Гимзе мазках, приготовленных из содержимого язвы, или получены путем культивирования при комнатной температуре на среде NNN-агаре или в культуре тканей.
Дифференциальный диагноз проводится с другими кожными поражениями: фрамбезия, проказа, первичный сифилис, волчанка, различ- ные формы кожного рака, лепра, тропическая язва.
Начальный бугорок при болезни Боровского необходимо дифференцировать от обычного угря, папуло-пустулы фолликулита, стойкого волдыря, образовавшегося на месте укуса москита или комара. Для постановки правильного диагноза требуется всестороннее обследование больного, включая гистологические, бактериологические и иммунологические методы исследования.
Дифференциальный диагноз между антропонозной и зоонозной формами кожного лейшманиоза на основании клинической картины провести достаточно трудно.
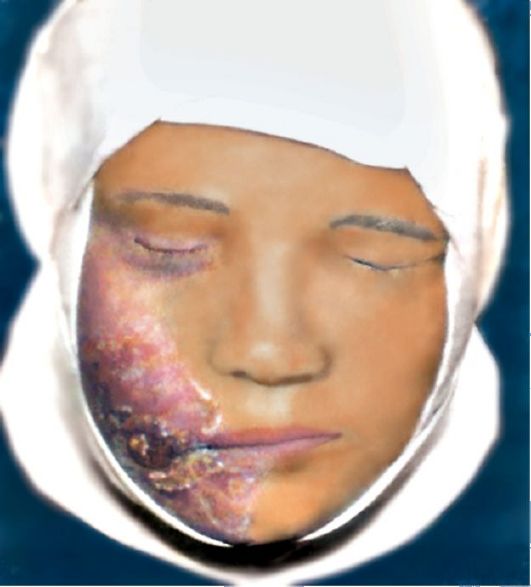
3.15. Хроническая туберкулоидная форма кожного лейшманиоза
Лечение. Прежде всего необходимо очистить язву и обработать ее антибиотиками для профилактики пиогенной инфекции.
Характер лечения лейшманиоза зависит от количества и распространения поражений. Локальное лечение бывает успешным при наличии небольшого количества язв. При множественных поражениях показано лечение, как и при висцеральном лейшманиозе, солюсурмином. Некоторые поражения сравнительно резистентны и требуют длительного лечения. Эффективным видом лечения, по данным зарубежных авторов, является применение внутрь дегидроэметина. При наличии пиогенных инфекций применяют антибиотики. Хорошие результаты получены от введения мономицина.
На ранних стадиях возможно обкалывание и применение мазей, содержащих хлориромазин (2%), паромолицин (15%) и клотримазол (1%).
Профилактика. Наряду с общими профилактическими мероприятиями, включающими борьбу с переносчиками (москитами и грызунами), проводят вакцинацию с использованием препарата L-тропина. Вакцинация приводит к образованию язвы, что сопровождается развитием длительного иммунитета. Подобная вакцинация не защищает от заболевания висцеральным лейшманиозом, против которого еще не имеется эффективной вакцины.
Зоонозный кожный лейшманиоз (ЗКЛ)
Синонимы: остро некротизирующийся, пустынно сельский лейшма- ниоз, влажный кожный лейшманиоз, пендинская язва.
Этиология. Возбудителем является L. major. Отличается от возбуди- теля антропонозного подтипа кожного лейшманиоза рядом биологических и серологических особенностей.
Патогенез и клиника. Патологическая картина близка к антропонозному лейшманиозу, но формирование изъязвления и рубцевания первичной лейшманиомы происходит ускоренными темпами.
Инкубационный период в среднем составляет 2-3 недели, но может быть и более длительным - до 3-х месяцев. Различают те же клинические варианты, что и при антропонозном кожном лейшманиозе. Формирование первичной лейшманиомы сходно с развитием гранулемы при антропонозном варианте, но с самого начала лейшманиома при зоонозном лейшманиозе имеет большие размеры, иногда напоминает фурункул с воспалительной реакцией окружающих тканей, но малоболезненный. Спустя 1-2 недели начинается центральный некроз лейшманиом, образуются различной формы язвы диаметром до 10-15 см и более с подрытыми краями, обильным серозно-гнойным экссудатом, болезненные при пальпации (рис. 3.16).
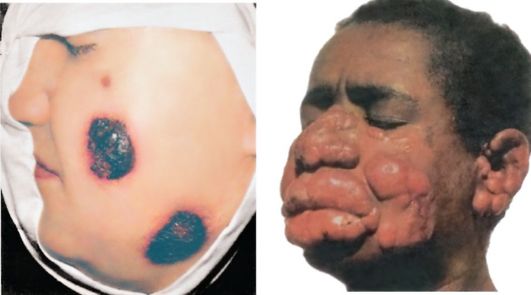
Рис. 3.16. Пендинская язва (зоонозный кожный лейшманиоз) и диффузная лепроподобная форма кожного лейшманиоза у больного из Эфиопии
Вокруг первичной лейшманиомы очень часто формируются множественные мелкие узелки - «бугорки обсеменения», которые затем превращаются в язвочки и, сливаясь, образуют язвенные поля. Число лейшманиом при сельском лейшманиозе может быть различным (обычно 5-10), описан случай, когда их насчитывалось более 100.
Локализуются лейшманиомы чаще на открытых частях тела - нижних и верхних конечностях, лице. Через 2-4 (иногда через 5-6) месяцев начинаются эпителизация и рубцевание язвы. От момента появления папулы до формирования рубца происходит не более 6-7 месяцев.
Весь процесс от момента появления папулы или бугорка до полного рубцевания продолжается от 2 до 5-6 месяцев, т.е. значительно короче, чем при антропогенезном кожном лейшманиозе.
Несмотря на различие поражений кожи при антропогенезной и зоозной формах лейшманиозов, иногда на основании клинической картины бывает трудно решить, к какому типу относится наблюдаемый случай.
После перенесенного заболевания развивается стойкий пожизненный иммунитет как к зоозной, так и антропонозной формах кожного лейшманиоза. Повторные заболевания возникают очень редко.
При локализации язв на суставных сгибах, а также множественных поражениях кожный лейшманиоз часто приводит к временной нетрудоспособности. Если обширные инфильтраты и изъязвления образуются на лице, особенно на носу и губах, впоследствии образуются косметические дефекты.
Диагностика кожного лейшманиоза основана на анамнестических, клинических и лабораторных данных. Существенное значение имеет
указание на пребывание больного в эндемичном по лейшманиозу районе в сезон передачи. Диагноз ЗКЛ в эндемичных районах, как правило, ставят на основании клинической картины. В неэндемичных районах (Россия) для подтверждения диагноза необходимы лабораторные исследования, при этом решающее значение имеет паразитологический диагноз - обнаружение возбудителя в материале, взятом из кожных поражений у больного. Материал для микроскопического исследования берут из нераспавшегося бугорка или краевого инфильтрата язвы. Для этого инфильтрированный участок кожи после обработки спиртом анемизируют сдавлением между большим и указательным пальцами, дела- ют надрез концом скальпеля или скарификатора и берут соскоб ткани со дна и стенок разреза. Соскоб размазывают на обезжиренном предметном стекле и высушивают на воздухе. Мазки фиксируют метиловым спиртом 3-5 мин или 96% этиловым спиртом - в течение 30 мин, затем окрашивают по Романовскому (35-40 мин) и исследуют в иммерсионной масленой системе (объектив - 90, окуляр - 7). Лейшмании (амастиготы) обнаруживаются в макрофагах, а также за их пределами в виде округлых или овальных телец длиной 3-5 мкм, шириной 1-3 мкм. Цитоплазма лейшманий окрашивается в серо-голубой цвет, ядро - в красно-фиолетовый. Рядом с ядром виден кинетопласт - округлое палочковидное образование меньше ядра и более интенсивно окрашенное.
При ЗКЛ число лейшманий в поражениях больше в начальной стадии болезни, на стадии заживления и при специфическом лечении они выявляются реже.
Эпидемиология. На значительной части ареала L. major основным резервуаром возбудителей является большая песчинка (Rhombomys opimus). Установлена естественная зараженность краснохвостой и полуденной песчанок, тонкопалого суслика и других грызунов, а также ежей и некоторых хищных животных (ласка). Переносчиками являются москиты нескольких видов рода Phlebotomus, главным образом Ph. papatasi, они становятся заразными через 6-8 дней после кровососания на грызунах.
Человек заражается через укус инвазированного москита. Характерна четкая летняя сезонность заболеваемости, совпадающая с летом москитов. Возбудитель встречается в сельской местности, к нему имеется всеобщая восприимчивость. В эндемических районах максимальная заболеваемость выявляется у детей и приезжих, так как большая часть местного населения переболевает в детстве и становится иммунной. Возможны эпидемические вспышки, иногда значительные. Повторные заболевания крайне редки.
Зоонозный кожный лейшманиоз распространен в странах Северной и Западной (возможно и других районах) Африки, Азии (Индия, Пакистан, Иран, Саудовская Аравия, Йеменская Арабская Республика и большинство других стран Западной Азии), встречается также в Туркменистане и Узбекистане.
Профилактика. Противоэпидемические и профилактические мероприятия в очагах зоонозного кожного лейшманиоза значительно сложны и менее эффективны, чем при антропонозном лейшманиозе, и зависят от структуры очага, вида преобладающего резервуара инфекции, состояния природного биоценоза в данной местности. Основа всех мероприятий - широкое использование всех способов истребления диких пустынных грызунов. Борьба с москитами проводится по тем же принципам, что и при антропонозном кожном лейшманиозе. Осуществляются прививки живой культуры L. major. Вакцинацию проводят в осенне-зимний сезон (но не позднее чем за 3 мес до выезда в эндемический по зоонозному кожному лейшманиозу очаг); в результате вакцинации развивается прочный, пожизненный иммунитет.
Высоко эффективной мерой профилактики ранее являлась лейшманизация - искусственное заражение («прививка») вирулентным штаммом L. major. Этот метод был предложен и изучен русским пара- зитологом Е.И. Марциновским в начале ХХ в. Развивающийся после «прививки» процесс не отличается от естественного течения зоонозного кожного лейшманиоза. Преимуществом такого метода является образование только одной лейшманиомы, локализующейся на выбранном прививаемом месте. После рубцевания у «привитого» развивается стойкая невосприимчивость к повторным заражениям. Подобная профи- лактика в прошлом проводилась в СССР (десятки тысяч привитых), Израиле (тысячи привитых), Иране (сотни тысяч привитых). Иногда (в 1-5%) на месте прививки развивались очень крупные язвы. После массовой прививочной кампании в Иране у части привитых (5%) развились незаживающие на протяжении нескольких лет язвы, которые плохо поддавались лечению. В настоящее время лейшманизация практически не применяется, за исключением Узбекистана, где проводятся ограниченные прививки.
По данным ученых
Туркменистана, хороший эффект был получен после проведения сезонной
(июль-август) химиопрофилактики, которая осуществлялась еженедельным
приемом
Весьма эффективной мерой профилактики лейшманиозов является защита от нападения москитов. Для этого в вечернее время непос-
редственно перед заходом солнца и в течение всей ночи целесообразно использовать специальные отпугивающие москитов вещества - репелленты, а также полог из мелкоячеистой сетки.
Граждане России, выезжающие за пределы страны, могут заразиться лейшманиозами при посещении в активный сезон передачи инфекции (май - сентябрь) стран ближнего зарубежья: Азербайджана (ВЛ), Армении (ВЛ), Грузии (ВЛ), Южного Казахстана (ВЛ, ЗКЛ), Кыргызстана (ВЛ), Таджикистана (ВЛ, ЗКЛ), Узбекистана (ЗКЛ, ВЛ). Эндемичным по ВЛ следует считать Крым, где в прошлом регистрировались единичные случаи ВЛ.
Из стран дальнего зарубежья в отношении кала-азара наибольшую опасность представляет Индия, где ежегодно регистрируются десятки тысяч случаев этого заболевания. ВЛ чаще всего можно заразиться в странах Среднего, Ближнего Востока и Северной Африки, где наряду с висцеральным имеются очаги распространения кожно-слизистого лейшманиоза.
Основной мерой профилактики для граждан, даже на короткое время выезжающих в названные регионы, служит защита от нападения москитов. Кроме того, для предупреждения ЗКЛ можно рекомендовать прививки живой культурой и химиопрофилактику пириметамином. При этом необходимо отметить, что прививки противопоказаны детям до 1 года, больным кожными или хроническими заболеваниями (туберкулез, сахарный диабет и др.) и людям, переболевшим ранее кожным лейшманиозом, а пириметамин противопоказан при заболеваниях кроветворных органов, почек и беременности.
Диффузный (эфиопский) кожный лейшманиоз, вызывается L. aephiopica.
Этиология. Возбудитель - L. aephiopica, имеет весьма ограниченное распространение на Африканском континенте (Кения, Эфиопия) и вызывает разнообразные клинические проявления.
Патогенез и клиника. Течение заболевания длительное (до нескольких лет), без тенденции к спонтанному выздоровлению. Инфильтративные высыпания на коже носят генерализированный характер, практически никогда не изъязвляются, но и не рассасываются. Терапия в большинстве случаев неэффективна, но некоторым больным помогает препарат сурьмы - пентамидин, а также антибиотик амфотерицин В.
По клинике заболевание сходно со среднеазиатским зоонозным кожным лейшманиозом. Редкими осложнениями являются поражения слизистых носа и глотки и развитие диффузного кожного лейш- маниоза. Поражения носа, ротовой полости и глотки проявляется
инфильтратами, папулами и множественными узлами на лице и верхних конечностях, напоминающими лепроматозную форму лепры. Поражения бровей и носа вызывают картину «львиного лица» (см. рис. 3.16, 3.17).
Эпидемиология. Природные очаги расположены в лесной местности на Востоке (1500-2000 м над уровнем моря): Эфиопии, Кении, Уганды и Танзании.
Основными природными резервуарами возбудителя являются даманы, а переносчиками - Ph. longipes, местами выплода и дневок которых являются пещеры, дупла деревьев, постройки человека, норы грызунов и т.п.
Американские кожно-слизистые и кожные лейшманиозы
В Восточном полушарии возбудителями кожного лейшманиоза являются паразиты комплекса L. tropica; заболевание нередко называют восточной язвой. В Западном полушарии возбудители этой формы заболевания представлены лейшманиями комплексов L. mexicana и L. brasiliensis. Некоторые паразиты комплекса L. brasiliensis могут распространяться по лимфатическим путям. У части людей, пораженных L. aephiopica и некоторыми видами комплекса L. mexicana, развивается диффузный кожный лейшманиоз; при этом из-за специфических нарушений в системе клеточного иммунитета амастиготы продолжают пролиферировать, а эпидермис не изъязвляется.
Диагностика и лечение кожного лейшманиоза Америки проводится теми же методами и при помощи тех же препаратов, как и при кожном лейшманиозе Старого Света.
Во всем мире 90% всех случаев кожного и кожно-слизистого лейшманиозов возникают в Бразилии, Перу, Алжире, Саудовской Аравии, Сирии и Иране.
Кожный лейшманиоз Нового Света комплекса L. mexikana Этиология. Возбудителем кожного лейшманиоза Нового Света является L. mexikana, включающая 5 подвидов лейшманий.
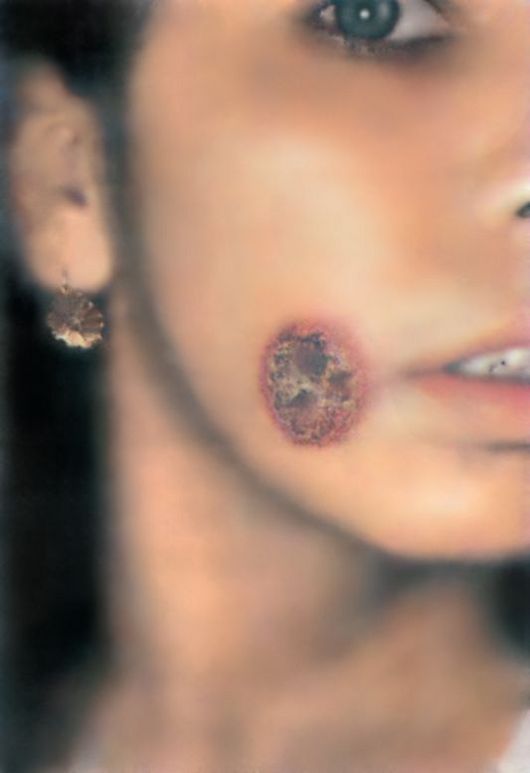
Рис. 3.17. Кожный лейшманиоз. Простая сухая язва на щеке
Мексиканская форма лейшманиоза встречается на юге Мексики (полуостров Юкатан), Гватемале и в сопредельных государствах. Представляет собой зооноз, природные очаги которого связаны с ландшафтами влажных тропических лесов. Чаще возникает одна лейшманиома, преимущественно на коже уха, которая заживает без осложнений. Однако нередки случаи (около 40%) хронического течения болезни с образованием глубоких язв и разрушением хрящевой ткани ушей, носа и гортани.
Эпидемиология. Большинство форм этого заболевания является при- родно-очаговыми зоонозами. Источниками и резервуарами возбудителей могут быть грызуны, сумчатые, многие дикие и домашние животные. Основные переносчики - москиты из родов Lutzomyia и Psychodopygus, многие виды которых в своих биотопах нападают на человека в дневные часы, во время производственной деятельности. Болезнь распространена преимущественно в сельских районах, в городах встречается как исключение. Максимальное число случаев заболевания приходится на сезон дождей. Восприимчивость всеобщая (болеют лица всех возрастов, как местные, так и приезжие). Заболевание регистрируется во всех странах Латинской Америки (возможно, за исключением Чили), в южных районах США (Техас).
В Бразилии (бассейн Амазонки) выделена L. mexicana amazonensis, поражающая преимущественно диких животных (крысы, мыши, опоссумы, лисы, паки), обитающих в лесу, на берегах рек и в заболоченных местностях. Человек включается в эпидемический процесс крайне редко. В случае заражения заболевание у человека протекает очень тяжело, в 30% случаев не поддается лечению, в форме течения диффузного кожного лейшманиоза приводит к обезображиванию.
Патогенез и патолого-анатомическая картина. Во многих чертах патогенез сходен с таковым при кожном лейшманиозе Старого Света. Отмечаются более глубокое поражение кожи (вплоть до гиподермы) и сравнительно частое распространение патологического процесса на слизистые оболочки (до подслизистого слоя) носа, рта, глотки, гортани, реже - половых органов. Иммунитет нестойкий и ненапряженный.
Клиническая картина. Инкубационный период продолжается от 2-3 нед до 1-3 мес. Принципиальных различий в клинической картине кожных поражений при лейшманиозе Нового и Старого Света нет.
При первом язвы обычно более глубокие, сопровождаются иногда лимфангитом и лимфаденитом. Важнейшей особенностью кожного лейшманиоза Нового Света является нередкое вовлечение в патологи-
ческий процесс слизистых оболочек. Как правило, слизистые оболочки поражаются через 1-2 года после развития язв на коже. Язвеннонекротические изменения на слизистых оболочках приводят к глубоким деформациям носа, ушей, носовой части глотки, дыхательных путей, половых органов, уродующим и инвалидизирующим больных.
Известно несколько форм кожного лейшманиоза Нового Света.
В Мексике эта болезнь называется язвой «чиклерос» - сборщиков каучукового сока, около 30% которых заболевают уже в первый год работы в лесу. Болезнь обычно протекает в относительно легкой форме. Чаще возникает одна лейшманиома на открытых, доступных для нападения москитов частях тела, которая заживает без осложнений через несколько месяцев. При локализации поражений на ушной раковине, что отмечается в 40% случаев, болезнь принимает длительное хроническое течение и приводит к деформации ушной раковины. Слизистые оболочки не поражаются. Однако известны единичные случаи, когда происходит образование глубоких язв с разрушением хрящевой ткани носа.
Возбудители обнаруживаются в язве только в течение первых трех месяцев болезни.
Кожный лейшманиоз, вызванный другими представителями комплекса L. mexicana - L. mexicana amazonemis и L. mexicana pifanoi, часто приводит к развитию диффузного кожного лейшманиоза. Клинически он напоминает диффузный кожный лейшманиоз Старого Света, плохо поддается лечению, а наиболее часто регистрируется в Доминиканской Республике
Диагностика и профилактика. Принципы диагностики и профилактики такие же, как и при кожном лейшманиозе Старого Света.
ЭСПУНДИЯ (ESPUNDIO)
Синоним: бразильский кожно-слизистый лейшманиоз.
Кожно-слизистый американский лейшманиоз имеет несколько нозологических форм, возбудители которых относятся к комплексу
L. brasiliensis.
Наиболее тяжелая форма - бразильский лейшманиоз (эспундия), при которой в 80% случаев кроме язв на коже в месте введения возбудителя возникают также обширные поражения слизистых оболочек носоглотки, гортани, а также хрящей мягких тканей и даже костей.
Этиология. Возбудителем является L. brasiliensis. Переносчики представляют собой более 12 видов москитов рода Lutzomya, но наиболее часто встречается Lu. Wilcomei.
Патогенез. Слизисто-кожные поражения начинаются в виде перивас- кулярного инфильтрата, затем развивается эндартериит, который может привести к разрушению окружающей ткани. Микроскопический характер кожных поражений может быть аналогичен восточной язве. Паразиты могут проникать через циркулирующие в крови макрофаги в нос, рот и мягкое небо, где они размножаются в макрофагах хрящевых или соединительных тканей, вызывая деструктивное воспаление. Процесс может распространяться на глотку и гортань; иногда поражаются также наружные половые органы. Частота этого тяжелого (иногда смертельного) осложнения зависит от штамма паразита и колеблется от 5 до 85%; штаммы, циркулирующие в южной части Бразилии и в Парагвае, отличаются особенно частой диссеминацией. Метастатические поражения могут появиться еще до формирования первичного очага; в других случаях они могут возникнуть даже через 30 лет после «выздо- ровления».
Клиника. При классической эспундии, встречающейся в Бразилии, Перу, Чили, Эквадоре, Боливии, Парагвае, первоначальные папулопустулезные кожные поражения отмечаются на лице, ушах и голенях. Поражения слизистых оболочек или сопровождают кожные поражения, или появляются через несколько лет. В слизистой носовой полости наблюдаются застойные явления, в дальнейшем происходит ее изъязвление (рис. 3.18). При внедрении паразитов в области губ, мягкого неба, зева здесь могут наблюдаться разрушения, которые приводят к тяжелым страданиям и деформациям. Нос обычно утолщается, деформируется, загибается книзу, а верхняя губа в результате отека и деформации заметно выступает вперед и вверх («нос тапира»). Длительность заболевания составляет от 4 месяцев до 4 лет.
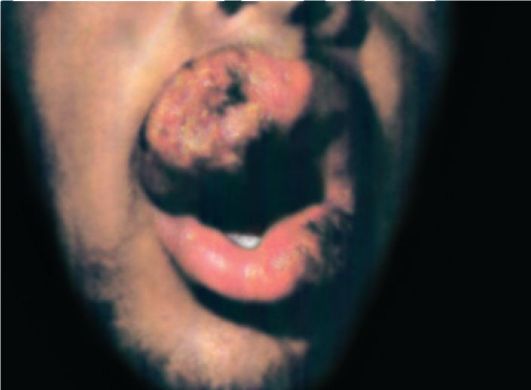
Рис. 3.18. Кожный лейшманиоз. Мокнущая язва рта, вызванная L.major
Кроме
эспундии в Южной Америке известно несколько эндемичных форм кожного
лейшманиоза, которые различаются ландшафтной приуроченностью,
эпидемиологией и клиническим течением. Например, в высокогорных долинах
Анд в Перу и Боливии известен кожный лейшманиоз ута, протекающий без
поражения слизистой оболочки. Заражение происходит на высоте около
Лечение. Эспундия лечению поддается плохо. Проводится длитель- ный курс терапии препаратами 5-валентной сурьмы. Выздоровление наблюдается лишь у 20%.
Распространение. Кожно-слизистый лейшманиоз (эспундия) встречается преимущественно в южной Америке. Случаи подобного заболевания известны в некоторых странах Азии и Африки (Судан, Сомали, Кения, Индия).
Эпидемиология. Распространение
заболевания связано с климатическими условиями, временем года и
характером местности. Высокая температура и большая влажность являются
необходимыми условиями, сопутствующими возникновению заболеваний.
Эспундия чаще отмечается в осеннее, дождливое время. Имеет значение
высота местности (не более
Переносчиками заболевания являются москиты, природными резервуарами-носителями - грызуны и, возможно, собаки. Kiri в
Висцеральный лейшманиоз
Этиология. Висцеральный лейшманиоз в Старом Свете имеет две разновидности - средиземноморский (детский) висцеральный лейшманиоз (ВЛ) и индийский висцеральный лейшманиоз (лейшманиоз взрослых, кала-азар).
ВЛ - типичный зооноз с природной очаговостью. Резервуаром возбудителя (L. infantum) в условиях дикой природы являются различные
представители семейства собачьих (Canidae) - лисица, шакал, корсак и др., а в населенных пунктах - собаки. У животных лейшманиоз развивается медленно, и источником заражения могут служить особи и без видимых внешних признаков болезни. У собак, наряду с поражением внутренних органов, часто наблюдаются кожные поражения (в основном на голове), которые являются местом локализации лейшманий и служат источником заражения москитов. Передача возбудителя от больных диких животных или собак человеку происходит через укус москита. Болеют ВЛ большей частью дети дошкольного возраста, гораздо реже - взрослые.
Инкубационный период при ВЛ может быть от 2 нед до 1 года и более, но в среднем составляет 3-5 мес, поэтому случаи заболевания регистрируются круглогодично, с преобладанием в зимние и весенние месяцы. Часто у детей до 1,5 лет на месте укуса москита можно обнаружить первичный аффект - небольшой узелок бледно-розового цвета. Заболевание характеризуется постепенным развитием перемежающейся лихорадки. Следующим признаком ВЛ является спленомегалия: селе- зенка увеличивается быстро и равномерно, а печень, как правило, менее интенсивно. Иногда наблюдается увеличение периферических лимфоузлов. Характерными признаками ВЛ также являются: прогрессирующая анемия, лейкопения, тромбоцитопения, гипер- и диспротеинемия, повышение СОЭ, нарастающее истощение, геморрагический синдром. Обычно возникают осложнения, связанные с присоединением вторичной инфекции. У детей раннего возраста все клинические проявления возникают более остро, у взрослых болезнь чаще протекает хроничес- ки; продолжительность заболевания составляет от 3 мес до 1 года, реже до 1,5-3 лет. У части инфицированных, главным образом взрослых, ВЛ имеет субклиническое течение и может проявиться через 2-3 года или даже 10-20 лет при воздействии провоцирующих факторов (ВИЧинфекция и др.). Без специфического лечения 98-99% больных ВЛ умирает от тяжелых осложнений и присоединившейся инфекции. При правильно поставленном диагнозе и своевременно начатой терапии почти во всех случаях наступает выздоровление.
Висцеральный лейшманиоз, как СПИД-ассоциированная инвазия, имеет одно важное, принципиальное отличие от остальных оппортунистических инвазий (инфекций), а именно: он неконтагиозен, т.е. не передается непосредственно от источника (животных, человека) инвазии к человеку. В странах Южной Европы в начале 90-х годов прошлого века 25-70% случаев ВЛ взрослых оказались связанными с ВИЧ-инфекцией, а 1,5-9% больных СПИДом страдали ВЛ. Из 692 учтенных случаев ко-
инфекции около 60% приходилось на Италию и Францию. Подавляющее большинство случаев ко-инфекции (90%) приходилось на мужчин в возрасте 20-40 лет.
В России первый случай ко-инфекции ВЛ/ВИЧ диагностирован в
Индийский висцеральный лейшманиоз
Синонимы: черная болезнь, лихорадка дум-дум, кала-азар.
Этиология. Возбудителем является Leishmania donovani, которая в организме человека паразитирует внутриклеточно в стадии амастиготы (безжгутиковой), а в организме переносчика - в стадии промастиготы (жгутиковой).
Кала-азар (в переводе с санскрита - «черная болезнь») поражает взрослых, и лишь в 5-6% случаев - детей и подростков. При этой разновидности лейшманиоза заболевания среди диких и домашних животных неизвестны. Резервуаром возбудителя и источником заражения москитов является больной человек. Передача возбудителя происходит непосредственно от больного человека к здоровому через укус москита.
Клинические признаки кала-азара в целом сходны с таковыми при ВЛ, однако существуют и отличия, имеющие важное эпидемиологическое значение. Наряду с поражением внутренних органов, для него характерны появления на коже вторичных папул - лейшманоидов с локализацией в них паразитов, а также незначительная циркуляция лейшманий в коже.
Клиника. Инкубационный период при кала-азаре (висцеральном лейшманиозе) составляет от 20 дней до 3-5 месяцев. Известны случаи удлинения инкубационного периода до 2-х лет. Болезнь развивается медленно. Нередко первичные симптомы висцерального лейшманиоза у инвазированных людей проявляются вследствие каких-либо провоцирующих факторов (инфекционное заболевание, беременность и др.). Одним из основных симптомов болезни является лихорадка. Чаще всего температура тела больных повышается постепенно, достигая 38-39 ?С. Реже повышение температуры наступает внезапно после озноба, температурная кривая обычно ундулирующего типа. Периоды лихорадки, длящиеся от нескольких дней до месяца и более, чередуются с периодами ремиссии, протекающими при нормальной температуре. В один и тот же лихорадочный период температура может быть постоянной, субфебрильной, ремитирующей.
Кожные покровы могут приобретать темный цвет (индийский калаазар), восковидный оттенок или сохраняться бледными. Темное окрашивание кожи объясняется гипофункцией надпочечников, что связано с поражением их коркового слоя лейшманиями.
При прогрессирующем течении болезни у больных развивается кахексия. Она сопровождается петехиальными или милиарными высы- паниями, преимущественно в области нижних конечностей, ломкостью волос с образованием на голове мелкоочаговых alopecia areata.
Лимфатические узлы могут быть увеличенными, но без выраженного периаденита.
Внутриклеточное паразитирование лейшманий обусловливает развитие селезеночно-печеночного синдрома. Селезенка значительно увеличивается в размерах в течение первых 3-6 месяцев болезни; она приобретает плотную консистенцию, верхняя ее граница доходит до VII-VI ребер; нижний край - до полости малого таза. Происходит также и увеличение печени. Гепатоспленомегалия выражена у всех больных висцеральным лейшманиозом и при сильном исхудании приводит к заметному расширению вен на коже живота.
Изменения со стороны сердечно-сосудистой системы проявляются в виде миокардиодистрофии, снижения артериального давления. Значительные изменения возникают в кроветворной системе, которые приводят к резко выраженной анемии. При этом наблюдаются лейкопения, анэозинофилия, тромбоцитопения, нейтропения со сдвигом влево, СОЭ ускорена (до 92 мм/час).
При висцеральном лейшманиозе изменения распространяются и на органы дыхания, но они чаще всего обусловлены осложнением течения заболевания патогенной микрофлорой.
В некоторых странах зон жаркого климата (Индия, Судан, Восточная Африка, Китай) у 5-10% больных спустя 1-2 года после видимого выздоровления наблюдается развитие посткала-азарных кожных лейшманоидов, которые могут держаться несколько лет. Кожные лейшманоиды появля- ются вначале в виде гипопигментированных или эритематозных пятен; в дальнейшем отмечается высыпания узелкового характера, величиной с чечевицу. В этих кожных образованиях могут обнаруживаться лейшмании.
Таким образом, лейшманоиды являются источниками заражения москитов лейшманиями, а сами люди, обладатели кожных лейшманоидов, служат резервуарами инфекции кала-азар.
Диагностика. Несколько изменчивая клиническая картина висце- рального лейшманиоза обычно подтверждается лейкопенией, высоким уровнем содержания гамма-глобулина в крови, обнаруживаемого с помощью бумажного электрофореза и положительного формолового теста (последний производится путем добавления 1 мл сыворотки больного). В положительном случае сыворотка становится плотной и непрозрачной спустя 20 мин после добавления формалина.
Может быть поставлена реакция связывания комплемента. Разработан также иммунолюминесцентный метод, который использу- ется в ранней диагностике до развития основных признаков болезни. L. donovani могут быть обнаружены в окрашенных препаратах из пунктата костного мозга, лимфатических узлов, селезенки и печени. При посеве инвазированной крови или пунктата на специальные среды (NNN-агар) или выращивании в культуре ткани могут быть получены жгутиковые формы лейшманий.
Кала-азар подлежит дифференциации от брюшного тифа и бруцеллеза, для диагностики которых применяются реакция агглютинации и посевы крови. Дифференциация лейшманиоза от малярии производится путем исследования мазков крови. Кала-азар следует дифференцировать также от шистомозиаза, туберкулеза, лейкемии и ретикулеза. Любая из этих инфекций может наблюдаться наравне с кала-азаром, особенно в эндемических очагах.
Посткала-азарные кожные лейшманоиды должны быть отдифференцированны от проказы, фрамбезии, сифилиса, lupus vulgaris, повышенной чувствительности к лекарственным препаратам и других дерматозов.
Лечение. Эффективность лечения зависит от того, в каком геогра- фическом районе произошло заболевание. В Индии заболевание легко излечивается, а в Судане и Восточной Африке оно более резистентно.
Специфическими средствами лечения ВЛ и кала-азара являются препараты пятивалентной сурьмы (меглюмина антиманат, стибоглюконат натрия). Продолжительность курса составляет 10-20 дней в зави- симости от эффективности терапии. Широко используют также дополнительные средства лечения: витамины, антианемические препараты, антибиотики, сульфаниламиды и др. Рецидивы заболевания возможны в течение 6-10 мес, поэтому проводят диспансерное наблюдение сроком до 1 года.
Диагностика ВЛ и кала-азара, как и кожного лейшманиоза, основана на анамнестических, клинических и лабораторных данных. Решающим является паразитологическое исследование - обнаружение возбудителя в мазках из пунктата костного мозга, реже - из лимфоузлов. Приготовление мазков, фиксация, окраска и микроскопирование аналогичны таковым при кожном лейшманиозе. В качестве дополнительных методов диагностики применяют реакцию иммунофлюоресценции.
Прогноз при своевременно начатом лечении благоприятный. Острые тяжелые формы без лечения заканчиваются летально. В случае легких форм возможно спонтанное выздоровление.
Эпидемиология. Кала-азар - антропоноз. Источник заражения - больной человек, у которого возбудитель присутствует в коже при развитии посткала-азарного кожного лейшманоида. Наибольшая заболеваемость регистрируется среди детей 5-9 лет. Второй наиболее пораженной группой являются подростки.
Переносчик - москит Phlebotomus (Euphlebotomus) argentipes. Кроме Индии кала-азар встречается в Бангладеш, Непале и, возможно, в Пакистане. Висцеральный лейшманиоз, по клинике сходный с индийским кала-азаром, распространен в северо-восточной части Китая, где переносчиком возбудителя служат Ph. chinensis и Ph. longidudus. Антропонозный висцеральный лейшманиоз, вызываемый L. donovani, встречается также на Африканском континенте - в Кении, Судане, Уганде и Эфиопии, где переносчиком выступает Ph. martini, и на Аравийском полуострове - на юго-западе Саудовской Аравии и в горных районах Йемена (переносчики - Ph. arabicus и Ph. orientalis).
Профилактика и меры борьбы. Активное выявление больных и своевременное их лечение. Обязательное лечение лиц с посткала-азарным кожным лейшманоидом. Борьба с москитами: уничтожение мест их выплода в населенных пунктах и их окрестностях; поддержание должного санитарного порядка на территории населенных пунктов; обработка помещений эффективными инсектицидами; применение защитных пологов и сеток, обработанных инсектицидами.
Различают следующие разновидности кала-азара.
Средиземноморско-среднеазиатский висцеральный лейшманиоз.
Синонимы: детский лейшманиоз, детский кала-азар.
Этиология. Возбудитель - L. infantum.
Эпидемиология. Зоонозное заболевание. Различают 3 типа очагов средиземноморско-среднеазиатского лейшманиоза:
1) природные очаги, в которых возбудитель циркулирует среди диких животных (шакалы, лисицы, грызуны, в том числе суслики и др.), являющихся резервуарами и источником инвазии в этих очагах;
2) сельские очаги, в которых возбудитель циркулирует преимущественно среди собак - главных источников инвазии, а также диких животных. При определенных условиях дикие животные в таких очагах могут служить значительным резервуаром и, следовательно, актуальным для населения источником заражения;
3) городские (синантропные) очаги, в которых основным источником инвазии служат собаки, но возбудитель обнаруживается и у синантропных крыс.
В целом, собаки сельских и городских очагов лейшманиоза представляют собой наиболее значимый источник заражения людей L. infantum.
Переносчиками лейшманий - являются различные виды москитов: Ph. ariasi. Ph. perniciosus, Ph. Smirnovi. Болеют в основном дети в возрасте от 1 года до 5 лет в Северной Африке и Юго-Западной Азии, а также дети в возрасте 5-9 лет в Восточной Африке. В Китае, странах Центральной Азии и Южной Европы болеют все возрастные группы.
Заболеваемость носит спорадический характер, в городах возможны небольшие эпидемические вспышки. Сезон заражения - лето, а сезон заболеваемости - осень того же или весна следующего года. Очаги располагаются между 45? с. ш. и 15? ю. ш., регистрируются в странах Средиземноморья, северо-западных районах Китая, на Ближнем Востоке. Спорадические случаи выявляются в государствах Средней Азии и Закавказья.
Патогенез и патолого-анатомическая картина. Существенно не отличаются от таковых при индийском лейшманиозе; особенностью является развитие у ряда больных первичного аффекта в месте укуса москита.
Клиническая картина. Инкубационный период продолжается от 20 дней до 3-5 мес. В месте укуса у детей 1-1,5 лет, реже у старших детей и взрослых, возникает первичный аффект в виде папулы, иногда покрытый чешуйкой. Важно правильно оценить этот симптом, так как он появляется задолго до общих проявлений болезни.
Клиническая картина принципиально не отличается от таковой при индийском лейшманиозе: развивается картина системного паразитарного ретикулоэндотелиоза. Наиболее существенные особенности среди- земноморско-среднеазиатского висцерального лейшманиоза - отсутствие кожного лейшманиоза и вовлечение в патологический процесс лимфатических узлов, как периферических, так и мезентериальных, перибронхиальных и др. В результате в клинической картине средиземноморско-среднеазиатского висцерального лейшманиоза возможны проявления периферического лимфаденита, реже - мезаденита. Увеличение перитрахеальных и перибронхиальных узлов может прово- цировать приступообразный кашель. Нередко развиваются пневмонии, вызванные вторичной инфекцией.
Болезнь может протекать в острой, подострой и хронической формах.
Острая форма проявляется в основном у детей младшего возраста и без лечения или при запоздалой терапии заканчивается смертью.
Подострая форма протекает тяжело, нередко с развитием осложнений. Без специфической терапии через 5-6 месяцев может наступить гибель больного.
Хроническая форма встречается преимущественно у детей старшего возраста, реже у взрослых. Характеризуется более легким течением и при своевременном лечении заканчивается выздоровлением.
Диагноз и дифференциальный диагноз. Диагноз основывается на эпидемиологическом анамнезе (пребывание в эндемичных районах) и клинической картине. Лабораторное подтверждение диагноза аналогично индийскому висцеральному лейшманиозу. У 75% таких больных лейшмании обнаруживаются в крови, у 88% - в коже и практически всегда - в плевральной жидкости.
Лечение такое же, как при индийском висцеральном лейшманиозе.
Прогноз, как правило, благоприятный, за исключением микстинфекции висцерального лейшманиоза и ВИЧ.
Профилактика лейшманиозов. В эндемичных районах профилактику лейшманиозов проводят дифференцированно в зависимости от формы заболевания по нескольким направлениям. Для антропонозов (кала-азар, АКЛ) основными мерами профилактики являются: выявление и лечение больных, борьба с москитами в населенных пунктах. Значительно более сложна и трудоемка профилактика ВЛ и ЗКЛ, при которых резервуарами возбудителей и источниками заражения человека являются в основном дикие животные. Профилактические мероприятия в очагах ВЛ включают: активное выявление и лечение больных, обнаружение и уничтожение в населенных пунктах больных собак (возможно лечение ценных пород), ограничение численности диких, хищных животных (лисицы, шакалы и др.) В окрестностях населенных пунк- тов проводят борьбу с москитами. Мероприятия в очагах ЗКЛ наряду с выявлением и лечением больных направлены на ликвидацию основного резервуара возбудителя в природе - различных видов грызунов и борьбу с норовыми москитами.
Кроме того, для защиты населения в очагах АКЛ и ЗКЛ применяют профилактические прививки живой вирулентной культурой L. major.
Весьма эффективной мерой профилактики лейшманиозов является защита от нападения москитов. Для этого в вечернее время непосредственно перед заходом солнца и в течение всей ночи целесообразно использовать специальные отпугивающие москитов вещества - репел- ленты, а также полог из мелкоячеистой сетки.
Граждане России, выезжающие за пределы страны, могут заразиться лейшманиозами при посещении в активный сезон передачи инфекции (май - сентябрь) стран ближнего зарубежья: Азербайджана (ВЛ), Армении (ВЛ), Грузии (ВЛ), Южного Казахстана (ВЛ, ЗКЛ), Кыргызстана (ВЛ), Таджикистана (ВЛ, ЗКЛ), Туркменистана (ЗКЛ, ВЛ), Узбекистана
(ЗКЛ, ВЛ). Эндемичным по ВЛ следует считать и Крым, где в прошлом регистрировались единичные случаи ВЛ.
Из стран дальнего зарубежья наибольшую опасность в отношении кала-азара представляет Индия, где ежегодно регистрируются десятки тысяч случаев этого заболевания. ВЛ чаще всего можно заразиться в странах Среднего, Ближнего Востока и Средиземноморья. Кожный лейшманиоз опасен для граждан, выезжающих в страны Среднего, Ближнего Востока и Северной Африки. В странах Центральной и Южной Америки наряду с висцеральным имеются очаги кожно-слизистого лейшманиоза.
Основной мерой профилактики для граждан, даже на короткое время выезжающих в названные регионы, служит защита от нападения москитов. Кроме того, для предупреждения ЗКЛ можно рекомендовать прививки живой культурой и химиопрофилактику пириметамином. При этом необходимо отметить, что прививки противопоказаны детям до 1 года, больным кожными или хроническими заболеваниями (туберкулез, сахарный диабет и др.) и людям, переболевшим ранее кожным лейшманиозом, а пириметамин - противопоказан при заболеваниях кроветворных органов, почек и беременности.
3.3. Класс Coccidica 3.3.1. Токсоплазмоз
Токсоплазмоз - широко распространенное заболевание, вызываемое внутриклеточным паразитом Toxoplasma gondii. Заражение человека в основном происходит алиментарным путем при употреблении пищи, зараженной токсоплазмами, или при контакте с инфицированными кошками.
В большинстве случаев токсоплазмоз протекает бессимптомно. При наличии клинических признаков они могут быть схожими с таковыми при мононуклеозе или гриппоподобных заболеваниях. Однако даже субклиническая инфекция может впоследствии привести к появлению признаков поражения отдельных органов, например неврологических заболеваний, патологии органа зрения и др.
Токсоплазмоз является оппортунистической СПИД-ассоциированной инфекцией. На фоне иммунодефицита у больных ВИЧ-инфекцией может развиваться острый энцефалит, который часто становится причиной гибели больного.
Конгенитальный токсоплазмоз приобретается путем трансплацентарной передачи паразита плоду при первичном заболевании женщины ток-
соплазмозом во время беременности. Это может привести к серьезным последствиям (выкидыш, поражение ЦНС, уродства развития и т.п.).
Установлено, что тяжелые формы поражения плода происходят при первичном инфицировании беременной в период органогенеза.
Согласно данным литературы, у женщин, инфицированных или переболевших токсоплазмозом до беременности, передача токсоплазм плоду не происходит.
Отсутствие специфической симптоматики при токсоплазмозе не позволяет диагностировать это заболевание без результатов лабораторного исследования.
В методических рекомендациях представлены основные методы серологической диагностики, наиболее доступные и применяемые в клинических лабораториях, а также перечень препаратов и схем их назначения для лечения токсоплазмоза.
Своевременное проведение профилактических мероприятий, обследование женщин перед планируемой беременностью, вовремя начатое специфическое лечение позволяют избежать серьезных поражений ток- соплазмами органов и систем человека.
Жизненный цикл. Возбудитель
токсоплазмоза - облигатный внутрик- леточный паразит, доказана
возможность внутриядерного паразитизма токсоплазмы. Возбудитель
обнаружен в
С общебиологической точки зрения T. gondii характеризуется признаками, позволяющими рассматривать его как паразита с очень глубокими приспособлениями. Он обнаружен на всех континентах и на всех географических широтах, может паразитировать и размножаться в сотнях видов млекопитающих и птиц, способен поражать самые разнообразные ткани и клетки своих хозяев.
В
Кишечная фаза жизненного цикла токсоплазмы включает в себя развитие в клетках слизистой кишечника окончательного хозяина, каковы-
ми являются домашняя кошка и другие представители кошачьих (дикая кошка, рысь, бенгальский тигр, оцелот, снежный барс, ягуарунди, эйр).
Полный цикл развития (от ооцисты до ооцисты) T. gondii может осуществляться только в организме представителей семейства кошачьих. Жизненный цикл токсоплазмы включает в себя 4 основных этапа развития: шизогонию, эндодиогению (внутреннее почкование), гаметогонию, спорогонию. Эти этапы проходят в разной экологической среде: шизогония, гаметогония и начало спорогонии протекают только в кишечнике представителей семейства кошачьих (окончательные хозяева токсоплазмы), спорогония завершается во внешней среде, в эндодиогения осуществляется в клетках тканей промежуточного хозяина (в том числе и человека) и в клетках основного хозяина - кошачьих.
Прежде чем перейти к детальному
рассмотрению жизненного цикла токсоплазмы, необходимо коснуться
вопроса терминологии стадий паразита. Ввиду того что цикл развития
токсоплазмы расшифрован лишь в
Так, для обозначения тканевой (внекишечной фазы развития токсоплазмоза, бесполой стадии - эндодиогении) в случае острой инвазии употребляют термины: «пролиферативная форма», «эндодиозоит», «эндозоит», «трофозоит», «тахиозоит», а стадию, характерную для хронического течения инвазии, обозначают терминами - «цистная форма», «зоит», «цистозоит» и «брадизоит». На данном уровне знаний о жизненном цикле токсоплазмы, по мнению большинства отечественных исследований, наиболее приемлемы термины: эндозоит - бесполая тканевая стадия токсоплазмы, обычно быстро размножающаяся, локализуется в токсоплазме или в вакуолях клетки, характерна для острой инфекции; начало цистозоита - тканевые формы, локализующиеся внутри цисты и характерные для хронического течения инфекции.
Все другие термины для обозначения тканевых стадий жизненного цикла токсоплазмы следует считать синонимами «эндозоита» и «цистозоита».
Терминология стадий развития токсоплазмы в эпителии кишечника основного хозяина аналогична таковой у типичных кокцидий.
Кишечная фаза развития токсоплазмы в организме окончательного хозяина. Кишечная стадия развития начинается при заражении (перорально) кошачьих - основных хозяев паразита как ооцистами со спорозоитами, так и вегетативными формами - эндозоитами и цистозоитами, заглоченными с тканями промежуточных хозяев. Цистозоиты попадают в кишечник в тканевых цистах, оболочка которых под действием проте-
олитических ферментов быстро разрушается. Эндозоиты и освободившиеся от оболочки цистозоиты проникают в клетки слизистой кишечника и путем бесполого размножения (эндодиогении и шизогонии) интенсивно размножаются.
Примерно через 2 суток в результате многократно повторяющихся циклов бесполого размножения (шизогонии) образуется особый тип шизонтов - мерозоиты, которые дают начало следующей стадии разви- тия паразита - гаметогонии.
При попадании в кишечник кошки зрелых ооцист токсоплазмы, освободившихся от оболочек, спорозоиты проникают в клетки рес- ничного эпителия кишечника и также начинают размножаться путем шизогонии. В результате бесполого размножения из одного шизонта образуется от 4 до 30 мерозоитов. Субмикроскопические исследования показали, что шизонт окружен пелликулой, которая состоит из внутренней и наружной мембран. Обнаружены одна или несколько митохондрий рибосомы, ядро, хорошо развитый эндоплазматический ретикулум и коноид на переднем конце. Подпелликулярные трубочки отсутствуют.
В отличие от кокцидий, при шизогонии токсоплазм мерозоиты образуются возле ядра, а не на периферии шизонта. В кишечнике кошачьих токсоплазмы проходят несколько последовательных шизогоний, после чего мерозоиты дают начало половой стадии развития паразита (гаметого- нии). Гаметоциты (незрелые половые клетки) обнаруживаются примерно через 3-15 дней после заражения на всем протяжении тонкого кишечника, но чаще в подвздошной кишке кошки. Начинается гаметогония путем образованием микрогаметоцитов, которая происходит в нижнем отделе тонкого кишечника и в толстой кишке основного хозяина. Развитие микрогаметоцитов сопровождается рядом последовательных делений яйца. По периферии макрогаметоцита путем эксвагинации его оболочки образуется 12-32 микрогаметы. Они имеют форму сильно вытянутого с острыми концами полумесяца и вместе со жгутиками достигают 3 мкм в длину, а также имеют 2 жгута (третий рудиментарный), с помощью которых двигаются в просвете кишечника и перемещаются к макрогамете.
Развитие макрогаметоцита происходит без деления ядра. При этом гаметоцит увеличивается в размере (от 5-7 до 10-12 мкм в длину), крупное ядро с ядрышком становится компактным, в цитоплазме накапли- вается большое количество гликогена, обнаруживаются много рибосом, митохондрий и эндоплазматический ретикулум.
Оплодотворение, т.е. слияние макро- и микрогамет, происходит в клетке эпителия, в результате чего образуется зигота, которая формирует плотную оболочку и превращается в оокинету, а затем в ооцис-
ту (рис. 3.19). Форма ооцист круглоовальная с диаметром от 9-11 до 10-14 мкм. Некоторое время ооцисты остаются в клетках эпителия, но затем выпадают в просвет кишечника, и токсоплазма вступает в следующий этап развития - спорогонию, которая продолжается в фекалиях и во внешней среде. Зрелые ооцисты имеют плотную бесцветную двухслойную оболочку, благодаря которой они устойчивы к воздействию различных факторов окружающей среды, в том числе ряда химических агентов. При достаточных влажности, температуре и доступе кислорода через несколько дней внутри ооцисты формируются две спороцисты с четырьмя банановидными спорозоитами в каждой. Спороцисты, в свою очередь, имеют плотную двухслойную оболочку. Размеры их в среднем от 6-7 χ 4-5 до 8 χ 6 мкм. Спорозоиты по строению сходны с эндозоитами и цистозоитами - тканевыми стадиями токсоплазмы. Зрелые ооцисты со спорозоитами являются инвазионными стадиями паразита как для окончательного хозяина (кошачьи), так и для промежуточных хозяев, в том числе и для человека. В условиях влажной среды спорозоиты в ооцистах сохраняются инвазионными до 2-х лет.
Рис. 3.19. Схематическое изображение ультраструктуры оокинеты токсоплазмы и малярийного плазмодия: п - протоки роптрий, пм - поверхност- ная мембрана, пк - полярное кольцо, в - воротник, к - кольцо, мт - микро- трубочки, р - роптрии
Внекишечная (тканевая) фаза развития токсоплазмы в организме промежуточных хозяев. В клетках различных тканей промежуточных хозяев, в том числе и человека, происходит бесполое размножение путем эндодиогении, т.е. образования двух дочерних клеток внутри материнской. В 1969-1970 гг. выявлен способ множественного внутреннего почкования, которому предложен термин эндополигения. Эти два способа бесполого размножения, наряду с шизогонией, были обнаружены также в кишечнике основного хозяина паразита - кошки.
Тканевая фаза развития токсоплазмы начинается при попадании в кишечник животных и человека (промежуточных хозяев) либо половых стадий развития паразита - ооцист со спорозонтами, либо бесполых стадий (эндозоитов и цистозоитов) с тканями инвазированных животных. В тонком отделе кишечника под влиянием протеолитических ферментов высвободившиеся из ооцист спорозоиты, либо из цист цистозоиты или эндозоиты проникают в эпителиальные клетки слизистой кишечника, где начинается бесполое размножение - эндодиогения и эндополигения.
В результате размножения появляются эндозоиты. Через 2-10 часов с момента внедрения в клетку спорозоита (эндозоита) из разрушенной клетки хозяина выходит 12-24-32 дочерних эндозоита. Вновь обра- зовавшиеся эндозоиты активно внедряются в соседние клетки. В тонкой кишке хозяина образуются местные некротические очажки, откуда эндозоиты могут попасть в кровеносные и лимфатические сосуды и далее - в различные ткани. Диссеминации эндозоитов по организму промежуточного хозяина способствует также фагоцитоз паразита клетками ретикулоэндотелиальной системы. На этой стадии быстрое бесполое размножение путем эндодиогении циклически повторяется. Вне клетки эндозоиты находятся в период времени после выхода из разрушенной клетки и до проникновения в новую клетку. Размножаются они только в живых клетках, где их скопление напоминает цисту. Но эти скопления эндозоитов локализуются непосредственно в цитоплазме или в цитоплазматической вакуоли. Нежная оболочка вокруг таких скоплений паразитов образуется клеткой хозяина в условиях острой стадии токсоплазмо. Собственной оболочки эти скопления не имеют, поэтому в действительности - это псевдоцисты. Если эндозоиты локализуются в цитоплазматических вакуолях, то такие вакуоли называют паразито- форными.
Постепенно вокруг скоплений эндозоитов образуется паразитная оболочка, и токсоплазма переходит в новую стадию - истинную тканевую цисту. В образовании сложной оболочки цисты принимают учас-
тие сами паразиты, и происходит это при хроническом токсоплазмозе. Такие оболочки непроницаемы для антител и обеспечивают жизнеспособность паразита в течение многих лет, а иногда и пожизненно. Как правило, цисты находятся внутри клетки, хотя доказана и внеклеточная локализация. Диаметр цист от 50-70 до 100-200 мкм. С формированием цисты эндозоиты в ней превращаются в новую стадию - цистозоиты. В зрелой цисте может быть несколько тысяч цистозоитов.
Биологическое назначение тканевых цист очень велико. Прежде всего цисты обеспечивают выживание паразита в иммунном организме и тем самым повышают шансы заражения токсоплазмозом как окончательного, так и новых особей промежуточных хозяев. Образование цистной стадии является важным этапом в жизненном цикле токсоплазмы, так как стадия цисты - цистозоиты - значительно устойчивее к внешним факторам. Так, если заглоченные эндозоиты под действием желудочного сока погибают уже через одну-две минуты, то цистозоиты сохраняют жизнеспособность в данной среде в течение 2-3 часов, хотя цистная оболочка под действием пепсина разрушается практически мгновенно. Экспериментально доказано, что из цистозоитов в кишечнике кошки с большим постоянством и быстрее, т.е. скорее, завершается кишечная фаза развития токсоплазмы в организме окончательного хозяина.
Таким образом, из описания жизненного цикла токсоплазмы следует, что промежуточные хозяева (дикие и сельскохозяйственные животные, а также человек) являются носителями вегетативных (тканевых) стадий паразита, какими являются эндозоиты в цистах. Именно с ними при диагностике токсоплазмоза приходится иметь дело врачам, ветеринарам и паразитологам.
Ультраструктура эндозоитов и цистозоитов идентична таковой мерозоитов кокцидий. С точки зрения паразитолога-эпидемиолога и клинициста, очень важно знать целый ряд особенностей биологии токсоплазмы. Первично токсоплазма - это паразит кошачьих, в организме которых она способна без участия других хозяев завершить как кишечную, так и внекишечную (тканевую) фазы развития. Тем самым кошачьи могут одновременно выполнять функции промежуточного и окончательного хозяев и обеспечить фазовое развитие токсоплазмы от ооцисты до ооцисты. Но токсоплазма - паразит не моноксенный: в его жизненном цикле принимают участие промежуточные хозяева, хотя их участие и необязательно; поэтому для токсоплазмы характерна факультативная гетерогенность. Причем эндозоитами и цистозоитами - стадиями из промежуточных хозяев - могут заражаться не только окончательные хозяева, но и новые промежуточные хозяева (плотоядные животные и
человек). Здесь имеет место как бы пассажирование или перевивка без участия окончательного хозяина и без выхода токсоплазмы во внешнюю среду.
У многих животных (мыши, крысы, морские свинки, хомяки, кролики, собаки, овцы, свиньи) и у человека отмечена трансплацентарная передача возбудителя на стадии эндозоита, тем самым обусловливая врожденный токсоплазмоз.
Клиническая картина. В соответствии с «Международной статистической классификацией болезней и проблем, связанных со здоровьем», принятой ВОЗ в
Токсоплазмозная окулопатия протекает по типу хориоретинита или гранулематозного увеита, катаракты. Она может также сочетаться с поражением ЦНС и сердца. Поражение глаз носит хронический характер, с рецидивами, постепенно развиваются очаги пигментной дегенерации, атрофические очаги на сетчатке глаза, атрофия диска зрительного нерва, приводящие к прогрессирующему ухудшению зрения, слепоте.
Токсоплазмозный гепатит характеризуется наличием основного симптома - увеличения печени, которая при пальпации может быть болезненной. Однако значительных нарушений функции печени, как правило, не наблюдается. Нередко регистрируется и увеличение селезенки. Токсоплазмозный гепатит развивается при хроническом течении инфекции.
Токсоплазмозный менингоэнцефалит проявляется симптомами общей интоксикации, высокой температурой, сильной головной болью, нарушением сознания, судорогами. Важное диагностическое значение имеет исследование ликвора, в котором можно обнаружить токсоплазмы.
Легочный токсоплазмоз обычно развивается в острой стадии заболевания при генерализации инфекции. Пневмония при этом чаще всего двусторонняя, интерстициальная, имеет затяжное течение. После угасания острого процесса в легких остаются мелкие рассеянные кальцификаты.
Токсоплазмозный миокардит диагностируется, когда доминирующим симптомом заболевания является поражение сердца. Однако следует подчеркнуть, что клиническая картина существенно не отличается от миокардитов другой этиологии.
Токсоплазмозный миозит характеризуется болями в мышцах. При рен- тгенологическом обследовании в них обнаруживают кальцификаты.
По характеру течения инфекции выделяют острую, хроническую и латентную формы. При острой форме токсоплазмоза после продромального периода (до 2 нед), во время которого отмечаются слабость, повышенная утомляемость, мышечные боли, наиболее характерным симптомом является появление увеличенных лимфатических узлов (в шейной, затылочной, подчелюстной и подмышечной областях), а также возможно повышение температуры. Могут наблюдаться образование кальцификатов, увеличение печени и селезенки, миокардиты и пневмонии, а также тяжелые поражения ЦНС (энцефалит, менингоэнцефалит). Инкубационный период составляет от 3 до 14 дней. Лечение токсоплазмоза в острой форме является наиболее эффективным.
Хроническая форма токсоплазмоза чаще всего протекает бессимптомно, но возможны и жалобы больных на слабость, быструю утомляемость, иногда на головные боли, а также на субфебрильную температуру. При поражении ЦНС могут развиваться энцефалит, менингит, арахноидит; при поражении органа зрения - хориоретинит, увеит, иридоциклит, атрофия зрительного нерва. Могут также наблюдаться поражения опорно-двигательной системы, миокардит, гепатит и эндометрит.
Для хронического приобретенного токсоплазмоза характерно длительное течение с периодическими обострениями. Заболевание протекает не тяжело, за исключением нейротоксоплазмоза. Лечение хроничес- кого токсоплазмоза целесообразно проводить в периоды обострения.
При латентной форме инфекция протекает скрытно, без клинических симптомов.
Врожденный токсоплазмоз. Трансплацентарное заражение плода возникает только при свежем инфицировании матери во время беременности. Врожденный токсоплазмоз может иметь острое течение, которое затем переходит в хроническую или латентную формы. Острая форма крайне тяжелая (судороги, параличи, тяжелые поражения мозга), с высокой летальностью, в том числе и внутриутробной (самопроизвольный выкидыш, мертворождение).
Хроническая форма токсоплазмоза характеризуется волнообразной лихорадкой с прогрессирующим поражением ЦНС (гидроцефалия, эпилепсия и др.), глаз (хориоретинит) и других органов (резидуальный врожденный токсоплазмоз). Клиническая картина врожденного токсо- плазмоза зависит от сроков беременности на момент заражения и массивности инвазии. Возможно и латентное течение врожденного токсоплазмоза, без клинических проявлений.
Токсоплазмоз и беременность. Актуальность проблемы токсоплазмоза обусловливает серьезные последствия первичного заражения женщин в период органогенеза, в ранние сроки беременности (гибель плода, уродства и т.д.). Поэтому все женщины, планирующие беременность, и беременные (желательно в ранние сроки) должны быть обследованы на наличие в сыворотке крови антител к токсоплазмам. Проведение исследования необходимо также в случае появления симптомов лимфаденопатии, утомляемости, мононуклеозоподобных заболеваний. Тестированию подлежат и беременные, прибывшие из регионов с высокими показателями заболеваемости токсоплазмозом, или употреблявшие полусырое мясо во время беременности, либо имевшие контакт с инфицированными кошками.
Лабораторную диагностику заболевания, перенесенного в прошлом, или обнаружение острой инфекции, вызванной T. gondii, у беременной проводят серологическими методами. Наблюдение за сероконверсией обычно осуществляют определением IgG или IgM к антигенам токсоплазм в двух постановках с интервалом в две три недели. Серологический мониторинг во время беременности рекомендуется проводить с интервалом от 1 до 3 месяцев.
При выявлении у беременной иммуноглобулинов класса М к антигенам токсоплазм возникает подозрение на наличие острой инфекции. Важным моментом диагностики в этом случае является наличие или отсутствие клинических симптомов токсоплазмоза (т.к. возможно, что инфицирование произошло за несколько месяцев до беременности), а также получение результатов серологического анализа в динамике. Если показатели анализа на содержание антител класса М отрицательные, а IgG - положительные по двум парным сывороткам, но без изменения титра, то исключают недавнюю инфекцию. Женщины с положительными результатами анализа на наличие IgG и IgM к антигенам токсоплазм в первых сыворотках через 2-3 недели снова должны быть обследованы, и по изменению уровня антител (увеличению или уменьшению титров) судят о характере приобретенной инфекции. Активация токсоплазмоза при последующей беременности возможна только в случае выраженной иммуносупрессии (например, у ВИЧ-инфицированных).
Токсоплазмоз у детей. Внутриутробный токсоплазмоз встречается как результат первичной, с клиническими симптомами или бессимптомной, инфекции у матери. Признаки внутриутробного токсоплазмоза у новорожденных при первичном заражении во второй половине беременности, проявляющиеся в первые месяцы жизни ребенка, чаще всего невро-
логические. Последствия или рецидив могут появиться в более поздние сроки развития ребенка (хориоретиниты, ретинопатия недоношенных или субклиническая симптоматика).
Подозрение на токсоплазмоз у новорожденных возникает в случае задержки внутриутробного развития, гидроцефалии, микроцефалии, гепатоспленомегалии, тромбоцитопении, гепатитов и наличия петехий.
Кроме того, доказательством инфекции могут служить положительные результаты офтальмологического исследования, анализа цереброспинальной жидкости и компьютерной томографии головного мозга при рождении ребенка.
Серологическим подтверждением токсоплазмоза у новорожденных являются положительные результаты обнаружения специфических иммуноглобулинов класса М, при этом инфекцию у матери регистрируют также определением IgM к антигенам токсоплазм. Показано, что антитела класса М не проходят через плаценту. Для обнаружения специфических IgM часто используют сыворотку крови, взятую из пуповины. Однако следует помнить о возможности ложноположительного результата за счет контаминации кровью матери. Все положительные результаты, полученные при исследовании пуповинной крови, должны быть проверены путем аналогичного анализа пробы крови из вены у ново- рожденного.
Таким образом, при выявлении специфических IgM в сыворотке новорожденного лабораторно диагностируют внутриутробный ток- соплазмоз. Однако чувствительность этого теста составляет примерно 80%.
При определении IgG к антигенам токсоплазм у новорожденных следует помнить, что эти антитела пассивно передаются от матери и сохраняются до 6-8-месячного возраста ребенка. Положительные результаты серологического анализа, свидетельствующие о наличии специфических антител позже этого времени, подтверждают возможную внутриутробную инфекцию, но при отсутствии антител у матери говорят о приобретенном токсоплазмозе у ребенка.
Следует отметить, что при диагностике внутриутробного токсоплазмоза ни один из серологических тестов не обладает абсолютной чувствительностью. Поэтому необходим комплексный подход к диагностике, включающий наряду с оценкой клинической симптоматики и серологического обследования обнаружение паразита в клиническом материале (кусочки плаценты, пуповины, кровь, ликвор и др.).
В позднем периоде новорожденности и у детей более старшего возраста подозрение на токсоплазмоз может возникнуть в том случае, если есть один или несколько следующих признаков: задержка развития, потеря зрения или слуха. Доказательством будет служить также выявление патологических изменений при углубленном исследовании органов зрения, слуха, а также при компьютерной томографии головного мозга. Положительные результаты серологического исследования подтверждают наличие инфекции, которая может быть как врожденной, так и приобретенной. Наблюдение за этой возрастной группой необходимо проводить совместно со специалистами других профилей (окулистами, невропатологами и др.).
Оценка тяжелой формы токсоплазмоза у ребенка включает:
- анализ истории течения беременности у женщины, анамнез заболевания (лимфаденопатия, утомляемость, мононуклеозо- подобное состояние);
- результаты УЗИ плода (если они есть);
- результаты ПЦР амниотической жидкости, передней камеры глаза, ликвора и т.д. (если есть возможности проведения такого исследования);
- физикальное обследование;
- углубленное обследование органа зрения;
- общий анализ крови;
- определение показателей функции печени;
- исследование цереброспинальной жидкости;
- проведение компьютерной томографии головного мозга (с контрастированием или без него);
- анализ содержания креатинина в сыворотке крови и исследование функции почек;
- серологическое обследование матери и ребенка в динамике с определением титра антител.
Лабораторная диагностика. Включает паразитологические и иммунологические методы. Для обнаружения токсоплазм применяют микроскопирование, прямой вариант метода флуоресцентного анализа (MOA) и метод биопроб на белых мышах с выделением T. gondii. Разработаны метод иммуноблоттинга для выявления белков возбудителя антителами IgM, IgG, IgA и полимеразная цепная реакция. Для диагностики внутриутробного токсоплазмоза используют методы кордоцентеза и амниоцентеза. Однако эти методики имеют ограниченное применение в практической медицине, поскольку являются дорогостоящими,
требующими специального оборудования и определенной подготовки персонала.
В подавляющем большинстве случаев при диагностике токсоплазмоза используют серологические тесты. Серодиагностика токсоплазмоза основана на обнаружении Ig классов G, M, А, Е. Они могут быть определены непрямым методом флуоресцирующих антител (HMФA), твердофазным иммуноферментным методом (ТИФМ) и др. Среди современных методов серодиагностики токсоплазмоза применяют также тесты дифференциальной агглютинации, латексагглютинации и ловушечный ТИФМ для выявления YgM к токсоплазмам. Такие тесты определения антител, как реакции преципитации (РП), связывания комплемента (РСК) и непрямой гемагглютинации (РНГА) в настоящее время применяют редко из-за низких чувствительности и специфичности. Наличие токсоплазмоза можно установить и с помощью кожной пробы с токсоплазмином. Однако этот тест в последние годы также практически не используют, поскольку существуют более чувствительные современные методы диагностики, исключающие введение препарата в организм обследуемого. При диагностике внутриутробного токсоплазмоза применяют наряду с НMФA и ТИФМ реакцию с красителем Сэбина- Фельдмана (РК). Тест основан на неспособности токсоплазм окрашиваться метиленовой синькой в присутствии антител к T. gondii. Данная реакция довольно сложна, трудоемка и требует живых токсоплазм, что возможно не во всех лабораториях.
Лечение. По данным Desmonts и Couvreur (1974), у беременных, заразившихся в период беременности и получивших спирамицин 4-кратно по 500-700 мг ежедневно в течение минимум 3 недель, инвазированные дети рождались почти в 2 раза реже, чем у нелеченых беременных (20,9% против 40,5%).
Очень существенно также, что у инвазированных детей, родившихся от леченых матерей, наблюдались преимущественно легкие формы инвазии.
Для лечения хронического токсоплазмоза некоторые авторы с успехом применяют десенсибилизирующую терапию возрастающим дозам токсоплазмина (Казанцев А.П., 1965; Шпак Н.И., 1975). Существует также рекомендация лечить хронический токсоплазмоз делагином с хиноцидом (Сокол А.С. и др., 1976).
Лечение приобретенного токсоплазмоза в нашей стране проводится по стандартной схеме комбинацией 2-х препаратов (табл. 3.3); после 10-дневного перерыва 7-дневный цикл может быть повторен. Эффективность лечения достигает при этом 80-90%.
Таблица 3.3. Схема лечения токсоплазмоза
Препараты | Первые 3 дня | 4-7 день | ||
Взрослые Дети | Взрослые Дети | |||
Тиндурин (хлоридин, пириметанин, дармаприм) однократно | 75 мг | 2 мг/кг | 25 мг | 1 мг/кг |
Сульфадиазин, сульфапиразин, сульфален, сульфалоксин (в 4 приема) | 2000 мг | 100 мг/кг | 2000 мг | 25 мг/кг |
Фолиновая кислота (филят кальция), лековорин | 1 мг | 2-10 мг | 1 мг/кг | |
Эпидемиология. Токсоплазмоз - первично природно-очаговая инвазия, т.е. зооноз диких животных (Засухин Д.Н., 1952; Jirovec, 1952). Однако токсоплазмоз в настоящее время (с эпидемиологической точки зрения) следует считать зоонозом сельскохозяйственных и домашних животных. Человек вовлекается в циркуляцию возбудителя, как правило, в населенном пункте, т.е. в санитарном очаге токсоплазмоза. Имеются основания считать, что наиболее частым фактором передачи возбудителя человеку является мясо инвазированных сельскохозяйственных животных. Геооральный механизм передачи инвазии человеку реализуется, по-видимому, существенно реже. Однако это не должно преуменьшать эпидемиологической значимости кошек.
Недавно было установлено, что в тех местностях, где кошек нет, например на некоторых тихоокеанских островах, не встречается и токсоплазмоз (Wallace et al., 1972). Это, несомненно, свидетельствует не только о том, что кошка - важнейший прямой источник заражения человека, но и о том, что без нее остаются незараженными сельско- хозяйственные животные, от которых человек заражается в дальнейшем опосредованно. В то же время в населенных пунктах, где имеются кошки, токсоплазмозом поражаются самые различные группы жителей, в том числе и строгие вегетарианцы, которые не могут заразиться иначе, как от кошки. Таким образом, имеются все основания утверждать, что
кошки в эпидемиологии токсоплазмоза занимают центральное место. Если бы мы могли предупредить обсеменение внешней среды ооцистами, постепенно прекратилось бы инвазирование сельскохозяйственных животных, и синантропный очаг был бы обречен на угасание. Уместно отметить, что человек как источник инфекции в эпидемиологическом смысле сколько-нибудь значимой роли не играет. Редкие, в общем, случаи трансплацентарной передачи инвазии (не более 1% всех случаев заражения людей токсоплазмозом) и, несомненно, еще более редкие случаи заражения при оказании акушерско-хирургической помощи (если они вообще бывают), при гемотрансфузии, а также при трансплантации органов не меняют справедливости этого предположения.
Заболеваемость токсоплазмозом в связи с трудностями распознавания клинически выраженного, а тем более субклинического токсоплазмоза, остается неизвестной во всех странах, в том числе пока и в России.
Пути заражения:
Пероральный. Основной путь заражение происходит ооцистами при употреблении овощей, ягод, сырой воды, при контакте с кошками и почвой, цистами либо тахизоитами - при употреблении непрожаренного мяса и сырого молока.
Контактный. Происходит через слизистые и поврежденную кожу, возможен при тесном контакте с больными животными.
Конгенитальный (трансплацентарный). Происходит внутриутробное заражение плода через плаценту. Источником инфекции является беременная со свежей инфекцией, когда наблюдается паразитемия, и возбудитель попадает через плаценту, где формируется первичный очаг инфекции, откуда токсоплазмы гематогенным путем попадают в плод.
Трансплантационный. Происходит при пересадке органов от донора с токсоплазмозом. Так же доказана передача возбудителя при переливании крови или лейкоцитов.
Показатель заболеваемости населения токсоплазмозом в различных странах (Франция, Голландия, США и др.) часто зависит от степени употребления полусырых мясных блюд в кулинарной практике (до 90% во Франции, в Голландии - 45-80%, США - 18-20%).
Для лучшего понимания эпидемиологии инфекции, вызванной Т. gondii, необходимо установить источник инфекции, возможные пути и факторы заражения. Эти данные позволят выработать определенную стратегию профилактики и при необходимости лечения токсоплазмоза в конкретном случае.
Вполне логично предположить, что различия напряженности иммунитета в указанных случаях связаны, в первую очередь, с неодинаковым
социальным положением обследованных групп и разным риском их заражения и реинвазии токсоплазмозом.
Профилактика. Теоретически наиболее радикальный путь профилактики токсоплазмоза человека - элиминация (лат. Eliminare - исключение, удаление) и надежная санация (лат. Sanacio - лечение) окончательного хозяина паразита, т.е. кошки. В этом смысле профилактика токсоплазмоза близка по своему содержанию к профилактике бешенства. Нет никакого сомнения в том, что полное уничтожение беспризорных кошек и действенный ветеринарный надзор за домашними кошками - залог если неполного оздоровления синантропных очагов токсоплазмоза, то во всяком случае снижения пораженности населения в них в десятки и тысячи раз. И что особенно важно, такие мероприятия послужат одновременно надежной гарантией предупреждения случаев врожденного токсоплазмоза. К сожалению, ни одного опыта радикальной профилактики токсоплазмоза еще ни в одной стране не было предпринято. Более того, до настоящего времени все рекомендации по профилактике токсоплазмоза основаны на молчаливом признании невозможности эффективно воздействовать на окончательного хозяина паразита - кошку.
С учетом изложенного выше, нам кажется вполне своевременным начать разработку системы активных профилактических противоток- соплазмозных мероприятий и организовать проверку ее эффективности в строго контролируемых эпидемиологических опытах. Речь идет о чувствительности различных стадий паразита к внешним факторам, в том числе химическим реагентам. Наиболее устойчивы к воздействию факторов внешней среды ооцисты. Устойчивость тахизоитов и тканевых цист крайне невелика, они погибают даже под воздействием водопроводной воды. Вот почему надо настаивать на проведении такого про- стейшего мероприятия, как мытье рук после контакта с сырым мясом. Температура в 100 ?С абсолютно непереносима для тканевых цист. Замораживание мяса при -20 ?С также гарантирует гибель цист.
3.3.2. Малярия
Малярия - острое протозойное заболевание человека с трансмиссивным механизмом заражения, характеризующееся выраженными симптомами интоксикации, циклическим течением с чередованием приступов лихорадки и периодов апирексии, увеличением селезенки и печени, развитием гемолитической анемии при проградиентном течении, рецидивами болезни.
История. Изучение малярии (одной из древнейших болезней челове- ка) неотрывно связано с самой историей развития человеческой цивилизации. Предполагается, что малярия стала распространяться на Земле (из Африканского региона Средиземноморья) около 10 000 лет назад в связи с интенсивным развитием земледелия, торговли, освоением новых земель. В старинных египетских папирусах, китайской древней литературе и канонах («Charaka» и «Sushrutha») классической древнеиндийской медицины («Ayurveda») сохранились до нашего времени описания клиники и эпидемий малярии; уже тогда высказывались предположения о возможной связи развития болезни с укусами комаров. Позже (5-6 вв. до н. э.) древние врачи Греции: Гиппократ, Герадот, Эмпедокл подробно описали клинику малярии. Гиппократу принадлежит заслуга в выделении малярии из группы лихорадочных заболеваний: он предложил выделять 3 формы болезни: «quotidian» (ежедневные приступы), «tertian» (приступы через день) и «quartan» (приступы через 2 дня).
Начало эры научных открытий в изучении малярии связано с
В
настоящее время малярия является одной из серьезнейших проблем
здравоохранения для более 100 стран Африки, Азии и Южной Америки, около
половины населения Земли живут в условиях риска заражения малярией.
Практически во всех странах Европы и Северной Америки ежегодно
регистрируют сотни завозных случаев малярии среди людей, прибывших из
регионов, где она распространена, растет число случаев так называемой
аэропортной малярии. По данным ВОЗ, ежегодно в мире заболевает малярией
200-250 млн человек, не менее 80% всех случаев малярии регистрируют в
странах Африки, расположенных к югу от Сахары. Каждый год от малярии
умирает от 1 до 2 млн человек, в основном детей в возрасте до 5 лет.
Социальные и экономические потери только в Африке оценивают в 2
миллиарда долларов США в год. С
ролю за малярией (в основном в развивающихся странах мира). Время действия программы рассчитано до 2010-2015 гг. Активно ведутся разработки по созданию эффективной противомалярийной вакцины, однако для этого потребуется как минимум еще 10-15 лет. Поиск, разработка и совершенствование препаратов для лечения малярии являются одной из приоритетных программ ВОЗ, различных фармацевтических компаний, научно-исследовательских институтов во всем мире. В последние годы в России в результате роста миграционных процессов, интенсивного развития международного туризма отмечено увеличение завозных случаев малярии.
Этиология. Название болезни «малярия» фактически обобщает четы- ре отдельных протозойных заболевания, обусловленных соответственно четырьмя видами возбудителей. Возбудители малярии относятся к подцарству Protozoa, типу Apicomplexa, роду Plasmodium, который подразделяется на два подрода: Plasmodium и Laverania (табл. 3.4).
Таблица 3.4. Возбудители малярии
Возбудитель | Форма малярии (в соответствии с МКБ-10) |
Plasmodium (Laverania) falciparum | Mалярия, вызванная Plasmodium falciparum (малярия-falciparum) |
Plasmodium (Plasmodium) vivax | Mалярия, вызванная Plasmodium vivax (малярия-vivax) |
Plasmodium (Plasmodium) ovale | Mалярия, вызванная Plasmodium ovale (малярия-ovale) |
Plasmodium (Plasmodium) malariae | Mалярия, вызванная Plasmodium malariae (малярия-malariae) |
В большинстве отечественных изданий (учебников, руководств, справочников) сохраняются прежние названия форм малярии: тропическая малярия (малярия-falciparum), трехдневная малярия (малярия- vivax), овале-малярия (малярия-ovale) и четырехдневная малярия (маля- рия-malanae).
Каждой из четырех форм малярии характерны свои клинические, патогенетические и эпидемиологические особенности. Важнейшее место занимает малярия-falciparum, составляющая 80-90% от всех случаев малярии в мире, возбудитель которой относится к особому подроду (Laverania). Только малярия-falciparum может протекать злокачественно, приводя к летальному исходу.
Эпидемиология. При малярии возможны различные механизмы передачи инфекции:
1. Трансмиссивный механизм (при укусе комара). Этот механизм является основным, обеспечивающим существование плазмодиев как биологического вида. Источник инфекции - человек (больной малярией или паразитоноситель), в крови которого имеются зрелые гаметоциты (мужские и женские половые клетки паразита). Переносчики малярии - только женские особи комаров рода Anopheles.
В желудке комара, куда вместе с кровью попадают мужские и женские гаметоциты, находящиеся внутри эритроцитов, происходят их дальнейшее созревание (после лизиса эритроцитов), слияние и многократное деление с образованием спорозоитов, которые накапливаются в слюн- ных железах комара. Бесполые формы паразита (трофозоиты, шизонты), попав в желудок комара, погибают.
Таким образом, в организме человека происходит бесполый путь развития паразитов (шизогония) с образованием и накоплением гаметоцитов, а в организме комара - половой (спорогония), слияние мужских и женских гаметоцитов с дальнейшим их развитием и образованием спо- розоитов.
2. Вертикальный механизм передачи (от матери - плоду) или от матери - новорожденному (в процессе родов - парентеральный механизм). При вертикальной передаче плод редко заражается через плаценту. Чаще заражение происходит в родах при попадании в кровоток новорожденного некоторого количества материнской крови, в эритроцитах которой находятся бесполые формы паразита.
3. Парентеральный механизм заражения приводит к развитию так называемой шизонтной малярии. Реализуется при гемотрансфузиях или реже при нарушениях асептики при инъекциях (например, среди наркоманов, использующих один шприц). В случае заражения при переливании крови источником инфекции является донор-паразитоноситель, часто с сублатентной паразитемией (количество паразитов ниже пяти в одном мкл крови). Поэтому в эндемичных по малярии регионах мира для контроля донорской крови необходимо использовать наряду с паразитологическими методами (определение паразита в препаратах толстой капли и мазках крови) и серологические (иммунологические) методы лабораторной диагностики малярии (РНИФ, ИФА и др.). Учитывая то, что при парентеральном заражении обычно вводится немного паразитов (особенно при инъекциях), инкубационный период может быть удлинен до 3-х месяцев (при массивном заражении инкубационный период, наоборот, может быть и очень коротким - несколько дней), что важно
знать при диагностике малярии у больных, перенесших оперативное лечение, наркоманов.
Для распространения малярии в определенном регионе (стране, крае, области) необходимы следующие условия:
1. Источник инфекции (больной малярией или паразитоноситель).
2. Наличие эффективного переносчика (комары рода Anopheles). Восприимчивость к малярийным паразитам - главное качество конкретного вида комаров из рода Anopheles. Численность комаров рода Anopheles среди популяций других видов не столь высока, как немалярийных комаров, и они редко серьезно беспокоят своими укусами. Однако и малочисленные виды при прочих благоприятных обстоятельствах (близость мест выплода комаров к жилищу людей) могут играть достаточно серьезную роль. Более 70 видов комаров рода Anopheles (среди более 200 известных видов) могут служить эффективными пере- носчиками малярии.
3. Благоприятные климатические условия: среднесуточная температура воздуха выше 16 оС и наличие мест для выплода комаров: водоемы, резервуары для воды, ирригационные сооружения и др. Минимальная среднесуточная температура воздуха, необходимая для развития в организме комара Pl. vivax, - 16 оС, для Pl. falciparum - 18 оС, при более низкой температуре спорогония не происходит. Продолжительность спорогонии тем меньше, чем выше температура (до определенного уровня, так как среднесуточная температура 30 оС и выше неблагоприятна для спорогонии). При оптимальной среднесуточной температуре (25-26 оС) спорогония у Pl. vivax занимает 8-9 дней, у Pl. falciparum - 10-11 дней.
Весь
ареал распространения малярии на земном шаре (между 45? с. ш. и 40? ю.
ш. до 64? с. ш. и 45? ю. ш. в разные годы) занимает малярия- vivax.
Ареалы малярии-falciparum и малярии-malariae несколько меньше
вследствие необходимой более высокой температуры для эффективной
спорогонии; ареал малярии-ovale располагается в двух, не связанных тер-
риториально между собой, регионах: тропической Африке и государств
западной части Тихого океана (Индонезия, Вьетнам, Филиппины, Новая
Гвинея и др.). В горных странах очаги малярии могут сформироваться до
высот
Малярия отличается выраженной сезонностью. В условиях умеренного и субтропического климатов малярийный сезон делится на периоды: эффективной заражаемости комаров, передачи инфекции и массовых проявлений заболевания. Начало периода эффективной
заражаемости комаров (при наличии источника инфекции - больных, паразитоносителей) совпадает с моментом устойчивого повышения среднесуточной температуры до 16 ?С. Начало периода передачи свя- зано с завершением спорогонии в организме комара, что зависит от конкретных среднесуточных температур данного года. В Московском регионе период передачи малярии-vivax может достигать 1,5-2 месяцев и более, до первых осенних заморозков. Границы периода массовых проявлений менее определены. В очагах, где передается только трехдневная малярия, массовая заболеваемость может начинаться задолго до начала периода передачи. Наблюдающиеся случаи представляют собой первичные проявления малярии-vivax с длительной инкубацией (3-10 мес) за счет заражения в прошлом сезоне и сохранения в печени гипнозоитов (без первичных проявлений с короткой инкубацией), а также отдаленные экзоэритроцитарные рецидивы (после серии приступов малярии с короткой инкубацией в прошлом сезоне, без адекватной противорецидивной терапии).
Восприимчивость к малярии всеобщая. Исход заражения после попадания возбудителя в кровоток и клиническое течение болезни определяются индивидуальным иммунологическим статусом, активностью факторов неспецифической врожденной резистентности, напряженностью постинфекционного иммунитета, а для новорожденных - уровнем специфических антител класса G, полученных от матери. Исключение составляют коренные жители Западной Африки и Новой Гвинеи, в большинстве своем невосприимчивые к заражению Pl. vivax, что связано с генетически детерминированным отсутствием у них эритроцитарных изоантигенов группы Даффи, выполняющих функцию рецепторов для мерозоитов Pl. vivax. Соответственно, в этом регионе значительно реже, чем в других регионах тропической Африки, наблюдаются случаи заражения малярией-vivax.
Относительной устойчивостью к заражению всеми видами плазмодиев обладают люди, являющиеся носителями аномального гемогло- бина (талассемия, серповидно-клеточная анемия, носительство гемоглобина Е, С и др.), с нарушениями строения цитоскелета эритроцитов (наследственный сфероцитоз, юго-восточный овалоцитоз, наследственный эллиптоцитоз) или имеющие дефицит фермента глюкозо-6- фосфатдегидрогеназы эритроцитов. В случае заражения малярией они болеют легко, численность паразитов в крови сохраняется на сравнительно низком уровне, случаи злокачественного течения (церебральной формы малярии-falciparum) практически отсутствуют. С другой стороны, у людей с дефицитом глюкозо-6-фосфатдегидрогеназы возникает
риск развития острого гемолиза при использовании ряда противомалярийных препаратов (примахин, хинин и др.). Механизмы естественной устойчивости к различным видам малярии во многом еще не ясны и продолжают изучаться.
Также определенной устойчивостью к заражению всеми формами малярии обладают новорожденные. Это обусловлено:
1) наличием пассивного иммунитета за счет антител класса G, получаемых новорожденным от гипериммунной матери (в очагах с высоким уровнем заболеваемости малярией);
2) поддержанием специфического иммунитета после рождения за счет антител класса А, получаемых новорожденным с грудным молоком;
3) наличием у новорожденного фетального гемоглобина, малопригодного для питания малярийного паразита.
После первых трех-шести месяцев жизни у новорожденных значительно возрастает риск развития тяжелых, злокачественных форм маля- рии-falciparum (смена эритроцитов, содержащих фетальный гемогло- бин, на эритроциты, содержащие нормальный гемоглобин; перевод на смешанное питание - поступление в пищу парааминобензойной кислоты, необходимой для развития паразита, которая отсутствует в материнском молоке).
Иммунитет при малярии нестерильный, видо- и штаммоспецифичный, нестойкий и непродолжительный. Для поддержания защитного уровня антител необходима постоянная антигенная стимуляция в виде повторных заражений малярией. Иммунитет к Pl. malariae и Pl. vivax устанавливается раньше и поддерживается дольше, чем к Pl. falciparum. Противомалярийный иммунитет включает клеточный и гуморальный ответы. Началом иммунных процессов, которые стимулируют синтез антител, является фагоцитирование малярийных паразитов макрофагами. Это проявляется гиперплазией гистиофагоцитарной системы селезенки, печени, костного мозга.
Стадии развития малярийных паразитов.
Патогенез. Жизненный цикл всех возбудителей малярии включает двух хозяев: человека (шизогония - бесполый цикл развития) и комаров рода Anopheles (спорогония - половой цикл развития) (рис. 3.20).
Традиционно в цикле шизогонии у всех видов малярийных паразитов выделяют три стадии: экзоэритроцитарную шизогонию (ЭЭШ), эритроцитарную шизогонию (ЭШ) и гаметоцитогонию. Кроме этого в жизненных циклах Pl. vivax и Pl. ovale выделяют отдельную стадию - спячку - вследствие возможного внедрения в организм человека при укусе
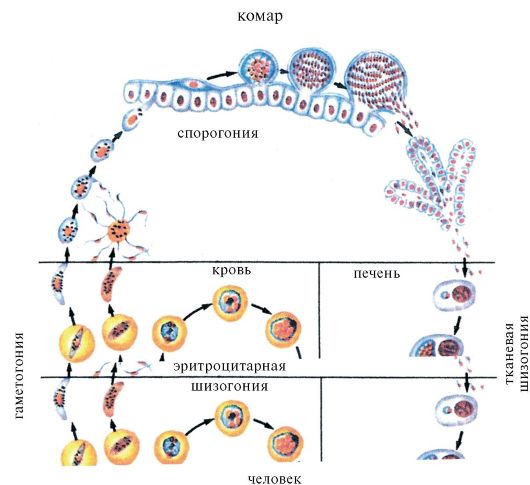
3.20. Цикл развития Plasmodium falciparum (по Генис Д.Е.,1985)
комара морфологически неоднородной группы спорозоитов (тахиспорозоитов и брадиспорозоитов или только брадиспорозоитов). В этих случаях брадиспорозоиты (гипнозоиты) длительно сохраняются в гепа- тоцитах в неактивном состоянии до начала ЭЭШ.
Экзоэритроцитарная шизогония. Внедренные со слюной комара в организм человека спорозоиты очень быстро (в течение 15-30 минут) с кровотоком попадают в печень, где активно проникают в гепатоциты, не повреждая их. Спорозоиты Pl. falciparum, Pl. malariae и тахиспорозоиты Pl. vivax и Pl. ovale немедленно начинают ЭЭШ с образованием большого количества экзоэритроцитарных мерозоитов (до 40 000 из одного спорозоита при малярии-falciparum). Гепатоциты разрушаются, и мерозоиты снова попадают в кровоток с последующим быстрым (в течение 15-30 минут) внедрением в эритроциты. Длительность ЭЭШ при маля- рии-falciparum обычно составляет 6 дней, при малярии-vivax - 8 дней, при малярии-ovale - 9 дней, при малярии-malariae - 15 дней.
Стадия спячки. При малярии-vivax и малярии-ovale брадиспорозоиты, внедрившиеся в гепатоциты, превращаются в неактивные формы - гипнозоиты, которые могут оставаться без деления в течение нескольких месяцев или даже лет до последующей реактивации (деление и образование мерозоитов). Таким образом, с гипнозоитами связаны характерные только для этих форм малярии длительная инкубация (до 3-10 месяцев и более) и развитие отдаленных экзоэритроцитарных рецидивов.
Эритроцитарная шизогония. После внедрения мерозоитов в эритроциты малярийные паразиты многократно (циклически) последовательно проходят стадии: трофозоита (питающаяся, одноядерная клетка), шизонта (делящаяся многоядерная клетка) и морулы (сформировавшиеся паразиты, находящиеся внутри эритроцита). В последующем, после разрушения эритроцитов, в плазму крови попадают мерозоиты. Наибольшее количество дочерних мерозоитов образуется при тропической малярии - до 40 в одном эритроците. Стадия ЭШ идет строго определенное время: 48 часов при малярии-falciparum, малярии-vivax, малярии-ovale и 72 часа при малярии-malariae.
Особенности цикла ЭШ и основные патогенетические механизмы развития тяжелых и осложненных форм малярии-falciparum:
- скопление (секвестрация) инвазированных эритроцитов, содержащих взрослые трофозоиты (со стадии амебовидного трофозоита), шизонтов в сосудах внутренних органов, преимущественно головного мозга, а также почек, печени, кишечника, костного мозга, плаценты и
др.;
- формирование так называемых розеток, состоящих из инвазированных и непораженных эритроцитов;
- развитие нарушений микроциркуляции, гипоксии тканей, метаболического ацидоза (значительное накопление молочной кислоты);
- активация МФС (преимущественно Th-1-иммунный ответ) с повышенным синтезом α-фактора некроза опухоли, γ-интерферона, интерлейкина-1 и других цитокинов, повреждающих эндотелий сосудов и вызывающих адгезию эритроцитов к эндотелию кровеносных сосудов. В последние годы рассматривается особая роль повышенного синтеза оксида азота (NO) клетками эндотелия сосудов головного мозга в развитии церебральной формы малярии-falciparum.
Важным патофизиологическим механизмом в развитии тяжелых форм малярии-falciparum, по сравнению с другими формами малярии, является гипогликемия, усугубляющая микроциркуляторные и метабо- лические нарушения (метаболический ацидоз) у больных, особенно у детей и беременных. В развитии гипогликемии при малярии-falciparum
выделяют три основных фактора: снижение глюкогенеза в печени, утилизация глюкозы паразитами и стимуляция секреции инсулина. В то же время гипогликемия может быть следствием гиперинсулинемии, развивающейся после назначения хинина для купирования приступов маля- рии-falciparum.
Как следствие длительной персистенции паразита (без адекватной терапии) при малярии-malariae возможно развитие нефротического синдрома в результате иммунного механизма (отложение иммунных комплексов, содержащих антигены паразита, на базальной мембране почечных клубочков).
Необходимо отметить, что основные клинические проявления всех форм малярии (интоксикация, увеличение печени и селезенки, анемия) связаны именно со стадией эритроцитарной шизогонии (многократное бесполое размножение паразитов в эритроцитах), и чем более высокое содержание паразитов у больного в 1 мкл крови, определяемое при микроскопии толстой капли, тем обычно тяжелее протекает малярия. Поэтому при лабораторной диагностике малярии важно не только установить вид малярийного плазмодия, но и определить уровень паразитемии. По максимальному уровню паразитемии формы малярии распределяются в порядке убывания: малярия-falciparum (до 100 тыс. в мкл и более), маля- рия-vivax (до 20 тыс. в мкл, реже более), малярия-ovale и малярия-malariae (до 10-15 тыс. в мкл). При малярии-falciparum, протекающей с высоким уровнем паразитемии (100 тыс. в мкл и выше), значительно возрастает риск развития тяжелых, фатальных осложнений, что определяет тактику интенсивной (парентеральной) противомалярийной терапии.
Возникновение лихорадочных пароксизмов при малярии обусловлено гемолизом эритроцитов, выходом мерозоитов в плазму, разрушением части из них (другая часть мерозоитов снова внедряется в эритроциты), активацией МФС и повышенным синтезом интерлейкина-1, -6, а-фак- тора некроза опухоли и других эндогенных пирогенов (провоспалительных цитокинов), оказывающих воздействие на центр терморегуляции гипоталамуса.
При наличии в крови одной генерации плазмодиев с первых дней болезни возникают правильно чередующиеся пароксизмы. Часто при малярии-falciparum и малярии-vivax (в гиперэндемичных регионах с интенсивной передачей малярии) у неиммунных лиц наблюдается инициальная (начальная) лихорадка, связанная с развитием в эритроцитах больных сразу нескольких генераций возбудителей с разным по времени окончанием цикла развития, что приводит к наслоению приступов, сглаживанию периода апирексии, искажению типичного пароксизма.
В процессе развития болезни, нарастания факторов специфической и неспецифической защит (к концу 1-2-й недели) часть генераций погибает, и остается одна (две) ведущие генерации паразитов с развитием типичных пароксизмов через день (или каждый день).
Увеличение печени и селезенки при всех формах малярии связано с их значительным кровенаполнением, отеком, гиперплазией МФС.
Малярия, как правило, всегда ведет к гемолитической гипохромной анемии, в патогенезе которой имеет значение ряд факторов:
- внутрисосудистый гемолиз инфицированных эритроцитов;
- фагоцитоз клетками ретикулоэндотелия селезенки как инфицированных, так и неинфицированных эритроцитов;
- секвестрация (накопление) эритроцитов, содержащих зрелые паразиты, в костном мозге, угнетение кроветворения;
- иммунный механизм (разрушение непораженных эритроцитов в результате адсорбции иммунных комплексов, содержащих С-3 фракцию комплемента, на мембране эритроцитов).
Стадия гаметоцитогонии является как бы ответвлением от стадии ЭШ. Часть мерозоитов (генетически детерминированный процесс) вместо того, чтобы после внедрения в эритроцит снова повторить бес- полый цикл развития, превращается в половые формы - гаметоциты (мужские и женские).
Особенности стадии гаметоцитогонии при малярии-falciparum:
- гаметоциты появляются в периферической крови не ранее 10-12 дня болезни;
- гаметоциты, накапливаясь в течение болезни, могут длительно циркулировать в кровотоке (до 4-6 недель и более).
При других формах малярии (vivax, ovale, malariae) гаметоциты могут определяться в периферической крови с первых дней болезни и быстро (в течение нескольких часов - дней) погибают (табл.3.5.).
Клиника. Клиническое течение малярии зависит от состояния имму- нитета больного и вида возбудителя. Необходимо отметить, что малярия- vivax, малярия-ovale и малярия-malariae протекают доброкачественно и почти никогда не приводят к летальному исходу, в то время как тропическая малярия при позднем или неадекватном лечении часто ведет к смерти больного.
Основу клиники любой формы малярии составляет малярийный пароксизм (приступ), включающий последовательные фазы разной дли- тельности: «озноб» (1-3 часа и более), «жар» (5-8 часов и более) и «пот». Общая продолжительность малярийного пароксизма может колебаться от 6-8 часов до 12-14 часов и более.
Таблица 3.5. Сравнительная характеристика четырех видов плазмодиев человека
P. vivax | P. falciparum | P. malariae | P. ovale | |
Типы малярии | 3-дневная | Тропическая | 4-дневная | 3-дневная |
Спорогония продолжительность цикла в комарах при 24?С | 9 дней | 11 дней | 21 день | 16 дней |
Шизогония в печени продолжительность первичного экзо- эритроцитарого цикла продолжительность вторичного экзоэритроцитарного цикла | 8 дней 5 лет | 5-6 дней отсутствует | 13-16 дней отсутствует | 9 дней 3 года |
Эритроцитарная шизогония продолжительность число меро- зоитов (в среднем) поражаемые эритроциты | 48 часов 12-24 Ретикулоциты | 48 часов 16 Независимо от возраста | 72 часа 6-12 Более старые эритроциты | 49-50 часов 8 Независимо от возраста |
Изменения в эритроцитах размеры и форма | Увеличены | Изменения отсутствуют | Изменения отсутствуют | Несколько увеличены, нередко деформированы |
Гаметогония первое появление гаметоцитов после инвазирования | 3-5 дней | 9-11 дней | 5-21 день | 5 дней |
Малярия-vivax и малярия-ovale. Существенных различий в клинических проявлениях этих форм малярии не отмечается. Заболевание развивается после короткой (12-17 дней) или (реже) длительной (до 3-10 мес и более) инкубации. За одни-двое суток или несколько часов до развития лихорадки может отмечаться продромальный период (недомогание, поз-
набливание, головная боль), который чаще наблюдается у неиммунных лиц. Может наблюдаться период инициальной лихорадки с постоянно повышенной температурой неправильного типа продолжительностью от 2 до 6 дней и более. Отсутствие типичных пароксизмов в этот период может быть причиной неправильной диагностики.
При сформировавшихся типичных малярийных пароксизмах приступы обычно начинаются в первой половине дня с озноба и быстрого повышения температуры тела до 39-40 ?С, а при последующих парок- сизмах - до 41 ?С. Продолжительность стадии «озноба» составляет от 15-30 мин до 2-3 часов и более. Затем озноб сменяется жаром, развивается следующий период малярийного пароксизма - «жар». Кожа становится горячей, гиперемированной, некоторые больные в этот период возбуждены, возникают тахикардия, снижение АД, олигурия. Жар сохраняется до 4-6 часов и более. В дальнейшем температура начинает снижаться, жар сменяется потоотделением, степень которого различна. Продолжительность этой фазы составляет 1-2 ч, после чего больной обычно на короткое время засыпает. Следующий пароксизм развивается через день. Через 3-5 дней от начала заболевания отмечаются гепато- и спленомегалия, через 10-14 дней - анемия, которые, как правило, выражены умеренно. Если больной не получает специфическую терапию, то приступы повторяются в течение 2-4 недель (и более), постепенно становясь более легкими, и затем самопроизвольно прекращаются.
При отсутствии специфической терапии (или при проведении неадекватной терапии) у больных через 1-2 месяца после окончания серии малярийных пароксизмов могут развиться ранние рецидивы, обусловленные активизацией эритроцитарной шизогонии, а через 6-8 месяцев (и более) - отдаленные рецидивы (экзоэритроцитарные). Рецидивы развиваются обычно при более высоком уровне паразитемии вследствие частичного развития иммунитета и повышения пирогенного порога. Редким осложнением малярии-vivax в настоящее время является разрыв селезенки.
Малярия-malariae. Инкубационный период обычно составляет от 3 до 5-6 нед. Заболевание начинается остро (в дневные часы), сразу устанавливается строгая периодичность приступов - через 2 дня на 3-й. Пароксизмы при малярии-malariae отличаются наиболее длительным ознобом по сравнению с другими формами малярии. Длительность пароксизма составляет до 13 часов и более. Анемия, сплено- и гепатомегалия развиваются более медленно, не ранее чем через 1-2 недели. При отсутствии лечения клинические проявления малярии-malariae купируются самостоятельно через 8-14 приступов. Через 2-6 нед воз-
можно развитие рецидивов. После перенесенной малярии-malariae (при неадекватном лечении) возможно развитие длительной паразитемии (несколько десятков лет) при отсутствии клинических проявлений болезни, вследствие продолжающейся эритроцитарной шизогонии на очень низком уровне (сублатентном). Поэтому в эндемичных районах значительно возрастает риск заражения этой формой малярии при переливании крови, оперативных вмешательствах. Также в эндемичных регионах (тропическая Африка) отмечается риск развития нефротического синдрома у больных, перенесших малярию-malariae, при длительно сохраняющейся паразитемии или повторных заражениях. При проведении адекватной терапии прогноз при малярии-malariae благоприятный.
Малярия-falciparum. Инкубационный период составляет 7-16 дней. Это самая злокачественная форма малярии; при отсутствии адекватной, своевременной терапии заболевание может принять опасное (фатальное) для жизни течение. В продромальном периоде (от нескольких часов до одного-двух дней) могут отмечаться головная боль, слабость, легкий озноб, субфебрильная температура, сниженный аппетит, диарея. При развитии малярии-falciparum у неиммунных лиц характерна инициальная лихорадка с колебаниями температуры от субфебрильной до фебрильной в течение дня, возможна и постоянная лихорадка. Через несколько дней у коренных жителей эндемичных регионов (иммунных лиц) или через 1-2 недели у впервые инфицированных (неиммунных лиц) после начала лихорадочного периода при благоприятном течении малярии-falciparum начинаются типичные пароксизмы. Длительность малярийного пароксизма не менее 12-24 часов, с быстрым повышением температуры до 39-41 ?С; больных беспокоят головная боль, слабость, выраженный озноб, тошнота, рвота. Крайне неблагоприятным прогностическим признаком клинического течения малярии-falciparum является сохраняющаяся ежедневная высокая лихорадка без периодов апирексии с нарастающей в динамике головной болью. Развитие сплено-игепатомегалии наблюдается через 3-4 дня.
Осложнения малярии: церебральная форма, гемолитическая анемия, инфекционно-токсический шок (алгид), гемоглобинурийная лихорадка (острый гемолиз), нефротический синдром, острая почечная недостаточность, отек легких (респираторный дистресс-синдром).
Церебральная форма - наиболее частое осложнение тяжелого течения малярии-falciparum. В современных условиях церебральная форма развивается в 10% всех случаев малярии-falciparum в мире, и 60- 80% всех летальных исходов болезни связано именно с данным осложнени-
ем. Церебральная форма может развиться с первых дней, но чаще регистрируется на 2-й неделе заболевания на фоне отсутствия специфической или неадекватно проводимой терапии. Летальный исход может наступить в течение 1-2 суток. Различают стадии энцефалопатии - I, II и III (сомноленция, сопор и кома). Длительность и выраженность каждой стадии могут варьировать, поэтому у ряда больных можно не заметить перехода из одной стадии в другую. Энцефалопатия I характеризуется развитием возбуждения или апатии, спутанностью сознания и сонливостью, дезориентацией в месте и пространстве, значительным снижением всех реакций на болевые, тактильные и звуковые раздражители, возможно повышение сухожильных рефлексов. Для энцефалопатии II характерны развитие сопора, бледность кожных покровов и их землисто-желтоватый оттенок, возможна иктеричность склер, слизистых, наблюдаются частое поверхностное дыхание, гипотензия, тахикардия, сухожильные рефлексы значительно повышены, появляются судороги (тонические и клонические) и патологические рефлексы. При энцефалопатии III сознание отсутствует, больной не реагирует на внешние раздражители, сухожильные и брюшные рефлексы отсутствуют, зрачки чаще расширены, могут наблюдаться патологические рефлек- сы, менингеальные симптомы (ригидность мышц затылка, симптом Кернига и др.). Температура в период энцефалопатии I интермиттирующая, при энцефалопатии II или III - неправильного типа или постоянная (40-41 ?C). В крови помимо большого количества кольцевидных форм могут быть обнаружены паразиты и на других стадиях развития (взрослые трофозоиты, шизонты), что характерно для синдрома злокачественной малярии-falciparum. На высоте комы резко ускорена СОЭ, отмечаются нейтрофильный лейкоцитоз с палочкоядерным сдвигом, выраженная гипохромная анемия.
Анемия при всех формах малярии характеризуется как гемолитическая, гипохромная. Степень анемии зависит от вида паразита, а также от интенсивности и длительности инфекции. Тяжесть малярии у коренных жителей тропических стран часто усугубляется дефицитом железа и фолиевой кислоты в пищевом рационе. Уже после первых приступов малярии возможно развитие анемии, которая при тропической малярии более выражена, чем при других формах.
Инфекционно-токсический шок (ИТШ) с развитием ДВС-синдрома - осложнение, характерное для малярии-falciparum, протекающей с высокой паразитемией. Характерно развитие острой надпочечниковой недостаточности. Течение ИТШ в условиях жаркого климата сопровождается гиповолемией.
Развитие острой почечной недостаточности обычно наблюдается при злокачественном, осложненном течении малярии-falciparum. Характерно развитие олигурии и анурии с нарастанием в крови креатинина, мочевины, в анализе мочи определяются выраженная протеинурия, цилиндрурия, пиурия, микрогематурия.
Нефротический синдром - характерное осложнение малярии- malariae, отличается медленным, неуклонно прогрессирующим течением, сопровождается отеками, артериальной гипертензией, протеинурией, развитием почечной недостаточности.
Гемоглобинурийная лихорадка (острый гемолиз до 20-50% всех эритроцитов) при малярии-falciparum обычно наблюдается у корен- ных жителей эндемичных регионов, часто при дефиците в эритроцитах глюкозо-6-фосфатдегидрогеназы. В последние годы рассматривается аутоиммунный характер развития острого гемолиза, связанный с длительным и частым приемом противомалярийных препаратов - хинина и примахина. Отмечается высокая лихорадка (при незначительной паразитемии), моча приобретает черный цвет, в анализе крови определяются анемия, лейкоцитоз, ускорение СОЭ, быстро прогрессирует почечная недостаточность, что приводит к летальному исходу при отсутствии адекватной терапии.
Рецидивы малярии. Уровень паразитемии во время рецидива обычно ниже, чем при первичных проявлениях заболевания. В силу возросшего по ходу течения инфекции пирогенного порога, клинические проявления во время рецидива наступают обычно при более высокой паразитемии. Рецидивы, как правило, протекают доброкачественно, с умеренно выраженным токсическим синдромом и правильным чередованием малярийных пароксизмов с начала рецидива; количество пароксизмов значительно меньше, чем при первичных проявлениях заболевания. По времени наступления выделяют ранние (развитие клинических проявлений в течение первых 2-х месяцев после первичных проявлений малярии) и поздние (после 2-х месяцев). По происхождению рецидивы подразделяют на эритроцитарные (все формы малярии) и экзоэритроцитарные (только при малярии-vivax и ovale) (табл. 3.6).
Диагностика. При диагностике малярии учитывают:
- острое начало болезни, выраженные симптомы интоксикации, циклическое течение с чередованием приступов лихорадки и периодов апирексии, увеличение печени и селезенки, развитие прогрессирующей гемолитической анемии;
- данные эпидемиологического анамнеза (пребывание в местности, неблагополучной по малярии, переливание крови, наркомания);
Таблица 3.6. Длительность течения малярии с учетом развития реци- дивов при однократном заражении и без адекватной этиотропной терапии
Форма малярии | Продолжительность инфекции | |
Обычная | Максимальная | |
Малярия-falciparum | до 1 года | до 3 лет |
Малярия-malariae | до 2-3 лет | возможна пожизненно |
Малярия-vivax и ovale | до 1,5-2 лет | до 4-5 лет |
- данные лабораторных исследований:
а) результаты гемограммы: снижение уровня гемоглобина, лейкопения, лимфомоноцитоз, увеличение СОЭ;
б) результаты микроскопии толстой капли крови (просмотр не менее 100 полей зрения в случаях низкой паразитемии): нахож- дение плазмодиев и установление уровня паразитемии (табл. 3.7) в 1 мкл крови (100 полей зрения - 0,2 мкл крови).
Это необходимо:
1. Для выбора степени интенсивности проведения специфической противомалярийной терапии (при высоком уровне паразитемии у больных тропической малярией предпочтительно парентеральное введение препаратов).
2. Для контроля эффективности проводимой специфической терапии.
Уровень паразитемии можно оценивать и при подсчете на 100 лейкоцитов в толстой капле крови процента пораженных эритроцитов (в данном случае для оценки количества паразитов в 1 мкл необходимо знать общее количество лейкоцитов и эритроцитов в 1 мкл у больного);
в) данные микроскопии мазка крови для определения вида плазмодия. Окраску толстой капли и мазка крови проводят по методу Романовского-Гимза.
В результате скопления инвазированных эритроцитов, содержащих взрослые трофозоиты и шизонты в сосудах внутренних органов, при исследовании препарата толстой капли при нетяжелой малярии- falciparum в эритроцитах определяются только молодые (юные) трофозоиты на стадии кольца. Появление в периферической крови инвазированных эритроцитов, содержащих взрослые стадии развития паразита (взрослые или амебовидные трофозоиты, шизонты), является неблагоприятным лабораторным признаком, указывающим на тяжелое (осложненное) течение малярии-falciparum.
Таблица 3.7. Степени паразитемии при малярии
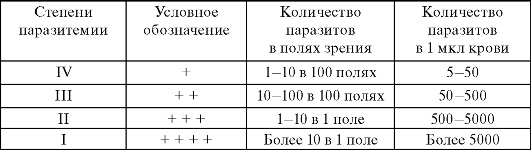
У лиц, впервые контактировавших (неиммунных) с данной инфекцией, детей младшего возраста первые приступы могут протекать при очень низкой паразитемии, иногда не выявляемой при микроскопии; с этим связана необходимость проведения повторного исследования крови (толстая капля) через 6-12 часов, но не позднее чем через 24 часа.
Вспомогательные методы (экспресс-диагностика):
- серологические (определение специфических антител) - РНИФ, ИФА, РНГА (используют при отрицательном результате микроскопии крови для обследования доноров или уточнения диагноза);
- биохимические (или иммуноферментные), направленные на определение специфических антигенов (ферментов) малярийных паразитов (HRP-2-тест; ParaSight F-тест, pLDH-тест и другие);
- ПЦР-диагностика (определение в крови ДНК малярийных плазмодиев).
В эндемичных очагах нередко диагностируют смешанные формы малярии - одновременное заражение двумя-тремя видами парази- тов (малярия-falciparum и vivax; малярия-falciparum, vivax и malariae и др.).
Дифференциальный диагноз. Дифференциально-диагностический поиск при малярии проводят в зависимости от остроты клинических проявлений болезни и ее длительности. В первую очередь малярию дифференцируют от заболеваний, протекающих с длительной лихорадкой, увеличением печени, селезенки, возможным развитием анемии: брюшным тифом и паратифами, бруцеллезом, лептоспирозом, сепсисом, лимфогранулематозом. В первые 5 суток с момента заболевания частым ошибочным диагнозом при малярии в неэндемичных регионах является грипп (или другие ОРВИ).
В тропических странах Южной Америки, Африки, Юго-Восточной Азии, Индии проводится дифференциальный диагноз малярии с гемор- рагическими вирусными лихорадками (желтая лихорадка, лихорадка денге и др.).
При церебральной форме малярии-falciparum необходимо проводить дифференциальный диагноз с энцефалопатиями (комой), развивающимися при декомпенсированном сахарном диабете, печеночной и почеч- ной недостаточностях, а также отеком и набуханием головного мозга при менингите или менингоэнцефалите бактериальной или вирусной этиологий.
Больных малярией госпитализируют в инфекционные больницы (отделения). В тропических странах (с высоким уровнем заболеваемости) госпитализации в основном подлежат больные малярией только по клиническим показаниям (тяжелое, осложненное течение), а также беременные и дети.
Этиотропная терапия больных малярией подразделяется на купирование клинических проявлений (купирующая терапия - назначение гематошизотропных препаратов) и радикальную терапию (при малярии- vivax и ovale - воздействие на гипнозоиты, при малярии-falciparum - на гаметоциты). Все противомалярийные препараты по механизму действия можно разделить на 3 группы: гематошизотропные, гистошизотропные и гамотропные (табл. 3.8). Препаратов, воздействующих непосредственно на спорозоиты, попавших в кровоток при укусе комара, не существует, поэтому исключить заражение человека малярией при использовании химиотерапии невозможно.
I. Купирующая терапия неосложненной (нетяжелой) малярии:
А. Малярия-vivax, малярия-ovale, малярия-malariae: хлорохин (Chloroquine diphosphate): 1 день -
Б. Малярия-falciparum: учитывая высокую резистентность Pl. falciparum к хлорохину, в настоящее время для лечения малярии- falciparum используют один из препаратов (или комбинации препаратов), представленных в табл. 3.9.
Имеются данные клинических испытаний по эффективному использованию в комбинированной терапии больных с неосложненной маля- рией-falciparum азитромицина и клиндамицина. В последние годы отмечается растущая устойчивость (особенно в регионах, неблагополучных по малярии-falciparum) Pl. falciparum к фансидару и другим химиопрепаратам. Имеются отдельные сообщения об устойчивости Pl. vivax (регион Индокитая) к хлорохину, в этом случае следует использовать мефлохин
Таблица 3.8. Принципы этиотропной терапии при разных формах малярии
Форма малярии | Препараты по типу действия | ||
Купирующая терапия | Радикальная терапия | ||
Гематошизотропные | Гистошизотропные | Гамотропные | |
Малярия- falciparum | + | - | + |
Малярия-vivax | + | + | - |
Малярия-ovale | + | + | - |
Малярия- malariae | + | - | - |
Таблица 3.9. Препараты для проведения купирующей терапии при малярии-falciparum
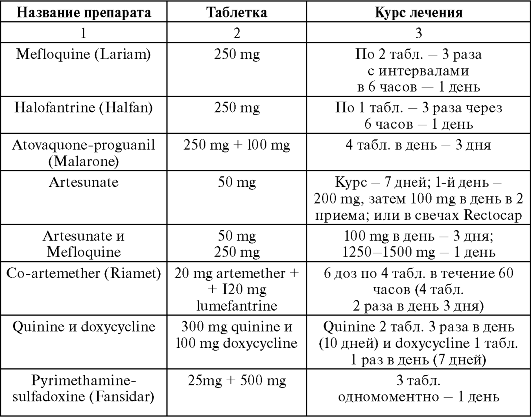

или другие препараты по схеме лечения неосложненной малярии. В процессе лечения больного необходимо контролировать уровень паразитемии, при отсутствии его существенного снижения через 2 дня (48 ч) от начала терапии следует заменить противомалярийный на специфический препарат другой группы.
Оценка эффективности лечения малярии. Эффективность этиотропной терапии у больных малярией оценивают по трем параметрам: ранняя неэффективность (РН), поздняя неэффективность (ПН) и эффективное лечение (табл. 3.10).
После приема противомалярийного препарата у больного может быть рвота (особенно у детей). Необходимо помнить, что если рвота возникла менее чем через 30 минут после приема препарата, то следует повторно принять ту же дозу, через 30-60 минут - половину используемой дозы препарата.
Таблица 3.10. Оценка эффективности лечения малярии (ВОЗ, 1996)

II. Радикальная терапия. Радикальную терапию проводят одновременно с купирующей или сразу после нее.
1. Для профилактики экзоэритроцитарных рецидивов малярии- vivax и малярии-ovale с целью воздействия на гиптозоиты назначают примахин (Primaquine) по 45 мг (27 мг основания) в день (3 табл.) - курс 14 дней или 6 табл. - 1 раз в неделю - 6-8 недель (при дефиците глю- козо-6-фосфатдегидрогеназы). Проходит клиническое испытание
препарат тафенохин (Tafenoquine) - аналог примахина, но с более высокой клинической эффективностью и меньшей частотой побочных реакций.
2. Для исключения передачи малярии-falciparum (путем воздействия на гаметоциты) используют примахин (Primaquine) по 45 мг (27 мг основания) в день (3 табл.) - 3 дня. Лечение проводится в регионах эндемичных по тропической малярии. При использовании в лечении фансидара больным, перенесшим малярию-falciparum, примахин не назначают вследствие эффективного воздействия пириметамина (Pyrimethamine), входящего в состав фансидара, на гаметоциты Pl. falciparum.
Лечение тяжелой и (или) осложненной малярии-falciparum проводят в отделениях интенсивной терапии, реанимации. При невозможности приема препаратов перорально проводят парентеральную терапию одним из указанных ниже препаратов:
- хинин дигидрохлорид (quinine dihydrochloride) - 10-20 мг/кг (до
- в современных условиях для лечения тяжелых форм малярии- falciparum в некоторых странах используют новые препараты растительного происхождения (в России эти препараты не сертифицированы): Artemether (Artenam) - в/м по 160 мг в первый день, затем по 80 мг - 6 дней; Artesunate - в/м (в/в) по 50 мг 2 раза в день - 7 дней; Artemisinine - в/м по 1200 мг - 7 дней.
Объем и длительность проводимой патогенетической терапии зависит от тяжести течения малярии и развития осложнений. Проводят дезинтоксикационную терапию, коррекцию метаболического ацидоза, гипогликемии, назначают мочегонные, антигистаминные препараты, глюкокортикостероиды (по показаниям), витамины, сердечно-сосудистые и другие препараты. При анурии возможно проведение перитонеального диализа. При лечении гемоглобинурийной лихорадки в первую очередь отменяют препараты, вызвавшие гемолиз, проводят переливание эритроцитарной массы.
Реконвалесцентов выписывают после окончания полного курса этиотропного паразитологического лечения (купирующая терапия) при наличии 2-3 отрицательных результатов исследовании крови (толстая капля). Больным, перенесшим малярию-vivax и малярию-ovale, последующий курс лечения примахином можно проводить амбулаторно. За больными, перенесшими малярию, проводят диспансерное наблюдение в течение 1-1,5 месяцев с повторными паразитологическими исследова-
ниями толстой капли крови каждые 7-10 дней. Диспансеризацию больных, перенесших малярию-vivax, малярию-ovale и малярию-malariae, проводят в течение двух лет, с обязательным паразитологическим исследованием толстой капли при любом повышении температуры.
Профилактика. Профилактические мероприятия в очаге направлены на своевременное выявление и лечение больных и паразитоносителей (источников инфекции), а также на борьбу с переносчиками малярии. В настоящее время эффективных вакцин для активной иммунизации против малярии нет.
Индивидуальная профилактика малярии при пребывании в эндемичном очаге направлена на профилактику заражения и профилактику малярийного приступа. Профилактика заражения заключается в при- нятии мер по защите от укусов комаров (использование репеллентов, сеток на окнах и дверях, надкроватных пологов, одежды, закрывающей руки и ноги при пребывании на открытом воздухе в вечернее и ночное время). В соответствии с рекомендациями ВОЗ профилактика малярийного приступа состоит в приеме противомалярийных препаратов, ее рекомендуется проводить только неиммунным лицам, выезжающим в очаги с высоким риском заражения малярией и отсутствием доступной медицинской помощи (удаленность медицинских учреждений, невоз- можность быстрого исследования крови на малярию).
Необходимость использования, длительность и кратность приема препаратов определяется только после консультации с врачом-инфекционистом. Важно выявить противопоказания для приема химиопре- паратов, наличие тяжелых сопутствующих заболеваний. Беременные неиммунные женщины, дети раннего возраста не должны посещать регионы, эндемичные по малярии.
Учитывая высокую резистентность Pl. falciparum к хлорохину, стандартом для профилактики малярии-falciparum, по рекомендации ВОЗ, в настоящее время является мефлохин (по 250 мг 1 раз в неделю, за 2 недели до выезда в эндемичный регион и в течение 4-х недель после возвращения). Использование других препаратов (доксициклин, хлорохин в сочетании с прогуанилом, атовакин в сочетании с прогуанилом, примахин и другие) определяет врач-инфекционист с учетом эпидемической обстановки в регионе пребывания и других вышеуказанных факторов.