Инфекционные и паразитарные болезни развивающихся стран : учебник для вузов / Под ред. Н.В. Чебышева, С.Г. Пака. - 2008
|
|
|
|
ГЛАВА 1 ВИРУСНЫЕ ИНФЕКЦИИ
1.1. Вирусные геморрагические лихорадки
Вирусные геморрагические лихорадки (ВГЛ) - группа особых природно-очаговых инфекционных заболеваний, которые регистрируют на всех континентах мира, кроме Австралии. Заболевания характеризуются специфическим поражением системы гемостаза (сосудистого, тромбоцитарного и плазменного звеньев) человека, полиорганной патологией с развитием выраженных геморрагического и интоксикационного синдромов, высокой летальностью.
ВГЛ обусловлены РНК-содержащими вирусами, которые относятся к четырем различным семействам: Arenaviridae, Bunyaviridae, Filoviridae и Flaviviridae. В настоящее время в эту группу включают около 20 вирусов. Учитывая тяжесть течения ВГЛ, способность к быстрому распространению, в соответствии с Международными санитарными правилами (ВОЗ, 2005) и Правилами по санитарной охране территории РФ их отно- сят к опасным и особоопасным инфекционным заболеваниям человека. При многих ВГЛ существует значительный риск передачи инфекции при прямых контактах с больным, что может реализоваться, в частности, и в распространении заболеваний в больничных условиях (табл. 1.1). Возбудителей ВГЛ относят к потенциальным агентам биотерроризма.
Природный резервуар ВГЛ. Большинство ВГЛ передаются через членистоногих (комары, москиты, клещи) и относятся к арбовирусным инфекциям. Однако возможна и прямая передача от человека к человеку (вирусы Lassa, Sabm, Crimean-Congo, Marburg, Ebola). Выделения от животных (грызунов) также имеют важное значение в распространении ВГЛ (Lassa, Hantaviruses). Особую роль в поддержании инфекции в природе чаще играют грызуны (крысы, мыши) с бессимптомным носительством. Возможно поддержание циркуляции вируса в диких условиях у обезьян и приматов (желтая лихорадка, денге). Природный резервуар заболевания не всегда установлен (вирусы Ebola, Marburg, Sabm).
Таблица 1.1. Риск передачи вирусных геморрагических лихорадок при прямых
контактах от человека к человеку

Особенности патогенеза ВГЛ. Патогенез ВГЛ остается недостаточно изученным до настоящего времени. В то же время установлено сходство основных патогенетических и клинических аспектов этих заболеваний, что позволило их объединить в одну группу, несмотря на то что возбудители относятся к различным РНК-содержащим семействам вирусов. При изучении патологических процессов, связанных с возбудителями ВГЛ, используют экспериментальные модели (обезьяны, крысы), клинических наблюдений у больных мало.
Для всех вирусов, вызывающих геморрагические лихорадки, характерно поражение различных клеток и тканей организма больного. Особое значение имеет способность вирусов поражать иммунокомпетентные клетки, играющие важную роль в противоинфекционном иммунитете, в результате чего у больных развиваются выраженная иммуносупрессия и высокая вирусемия. Наиболее выраженные иммуносупрессия и вирусемия отмечаются у больных с фатальным течением заболевания, при этом развивается молниеносный токсический шок, в патогенезе которого основную роль играют провоспалительные цитокины. С иммуносупрессией при ВГЛ связывают и низкие титры специфических антител, особенно в ранниих периодах тяжело протекающих заболеваний.
Как и многие РНК-содержащие вирусы, возбудители геморрагических лихорадок имеют множество факторов патогенности, обеспечивающих адгезию, инвазию и репликацию в различные клетки. Важным патогенетическим аспектом внедрения вирусов в различные клетки организма человека является наличие на поверхности этих клеток различных молекул (интегринов, лектинов, гликопротеинов и др.), играющих роль специфических поверхностных рецепторов. Репликация вирусов происходит в моноцитах, макрофагах, дендритных клетках, эндотелиальных клетках, гепатоцитах, в клетках коры надпочечников. Экспериментальные исследования на обезьянах, зараженных вирусом Эбола, показали, что возбудитель на ранних этапах преимущественно поражает моноциты, макрофаги и дентритные клетки; в то же время эндотелиальные клетки поражаются в более поздние сроки. Вместе с
тем раннее поражение эндотелия характерно для хантавирусных геморрагических лихорадок, хотя это обусловлено, как полагают, непрямым поражением вирусов. Иммунологические аспекты репликации ВГЛ в организме человека в настоящее время только изучаются.
Механизмы поражения эндотелия при ВГЛ остаются до конца не изученными и дискутабельными. Установлено два механизма: иммуноопосредованное (действие иммунных комплексов, компонентов системы комплемента, цитокинов) и прямое (цитотоксическое) поражение эндотелия в результате репликации вирусов. Сниженное функциональное состояние эндотелия при ВГЛ способствует развитию широкого спектра поражений - от повышенной сосудистой проницаемости до массивных кровотечений. При лихорадке Эбола в эксперименте было показано, что поражение эндотелия преимущественно связано с иммунопатологическими реакциями, а репликация вирусов в эндотелии регистрируется лишь в поздние сроки развития инфекционного процесса. В то же время при лихорадке Ласса установлено, что репликация вирусов в эндотелии происходит на самых ранних этапах болезни, но без выраженных структурных поражений клеток.
Наряду с лимфоидными тканями организма человека, содержащими большое количество макрофагов, важными мишенями для поражения вирусами геморрагических лихорадок являются клетки печени, почек и надпочечников. При развитии ВГЛ у обезьян в экспериментальных условиях выявлены различные степени поражения печени, однако эти поражения редко носят фатальный характер. Исключение представляет желтая лихорадка, при которой поражение печени является важным патогенетическим аспектом развития заболевания. Для желтой лихорадки характерна прямая корреляция уровней сывороточных показателей АЛТ и АСТ со степенью поражения печени, что имеет прогностическое значение при этом заболевании. Для всех ВГЛ характерно снижение бел- ково-синтетической функции печени, которое проявляется уменьшением уровней плазменных факторов коагуляции, что вносит свой вклад в развитие геморрагического синдрома. Кроме этого, сниженный синтез альбумина приводит к уменьшению осмотического давления плазмы, в результате чего развиваются периферические отеки, что особенно характерно для лихорадки Ласса.
Поражение почек в основном связано с развитием серозно-геморрагического отека межуточного вещества пирамид, тубулярного некроза и, как результат, - развитие острой почечной недостаточности.
Поражение клеток коры надпочечников сопровождается развитием гипотензии, гипонатриемии, гиповолемии. Сниженная функция коры
надпочечников играет важную роль в развитии токсического шока у больных с ВГЛ.
В экспериментальных исследованиях установлено, что для ВГЛ характерно развитие некротических процессов в селезенке и лимфатических узлах при минимально выраженных явлениях воспалительной реакции тканей. Вследствие этого при большинстве ВГЛ наблюдается быстро прогрессирующая лимфопения (при хантавирусных геморрагических лихо- радках - чаще лимфоцитоз). Несмотря на развитие значительной лимфопении, установлена минимальная репликация вирусов в лимфоцитах. В эксперименте при ГЛ Эбола, Марбург и Аргентинской показано, что лимфопения связана в основном с выраженным апоптозом лимфоцитов, обусловленным значительным синтезом ФНО, оксида азота, провоспалительных цитокинов. Имеются немногочисленные данные о развитии нейтрофилеза с палочкоядерным сдвигом в начальном периоде ВГЛ.
Вирусы геморрагических лихорадок у людей и приматов вызывают экспрессию множества воспалительных и противопоспалительных медиаторов, включая интерфероны, интерлейкины (1b, 6, 10, 12), ФНО-a, а также оксид азота, активные формы кислорода. В исследованиях in vitro, проведенных на различных клетках человека, показано, что вирусы геморрагических лихорадок стимулируют выброс многочисленных регуляторных медиаторов. Высокая экспрессия биологически активных медиаторов в крови приводит к иммунологическому дисбалансу и к прогрессированию заболевания. Установлена прямая зависимость между уровнем цитокинов (ИЛ-1Ь, 6, ФНО-a) и тяжестью течения ВГЛ.
В последние годы показана важная роль оксида азота в генезе патологических процессов при ВГЛ. Повышенный синтез оксида азота приводит, с одной стороны, к активации апоптоза лимфоидной ткани, а с другой - к развитию выраженной дилятации микроциркуляторного русла с артериальной гипотензией, играющей важную роль в развитии патогенетических механизмов токсического шока.
Роль интеферонов различных типов в патогенезе ВГЛ окончательно не изучена. При многих ВГЛ в крови больных отмечаются высокие уровни интерферона 1-го и 2-го типов.
Нарушения в системе гемостаза характеризуются развитием геморрагического синдрома: кровотечениями, наличием петехий на коже, слизистых оболочках. В то же время массивная кровопотеря при ВГЛ наблюдается редко, но даже в этих случаях уменьшение объема крови не является ведущей причиной смерти больного. Геморрагические высыпания на коже как проявления поражения микроциркуляторного русла обычно локализуются в области подмышечных впадин, в паху, на груд-
ной клетке, в области лица, что чаще наблюдается при лихорадках Эбола и Марбург. Для всех ВГЛ характерно развитие микрокровоизлияний во многих внутренних органах.
Тромбоцитопения - частый признак многих ВГЛ (в меньшей степени выраженный при лихорадке Ласса); в то же время абсолютно при всех лихорадках наблюдается резкое снижение функциональной активности тромбоцитов. Это связывают с выраженным угнетением синтеза мегакариоцитов - предшественников тромбоцитов. В результате снижения количества тромбоцитов и их функциональной активности значительно нарушается и функциональное состояние эндотелия, что усугубляет развитие геморрагического синдрома.
До настоящего времени не решен вопрос о генезе развития ДВС-синдрома при ВГЛ. Большинство исследователей рассматривают нарушения в системе гемостаза при ВГЛ как дисбаланс активации свертывающей и антисвертывающей систем. В сыворотке крови определяются многие маркеры ДВС-синдрома: повышение уровней фибриногена, продуктов деградации фибрина и фибриногена (ПДФ), Д-димеров, плазменных активаторов фибринолиза, снижение протеина С, изменение активированного частичного тромбинового времени (АЧТВ). Развитие ДВС-синдрома у больных с ВГЛ, особенно часто наблюдаемого при лихорадках Эбола, Марбург, Крым-Конго, Рифт-Валли, Аргентинской, хантавирусном пульмональном синдроме, является крайне неблагоприятным признаком.
Характерные особенности клинических проявлений ВГЛ. Инкубационный период при ВГЛ варьирует от 4 до 21 дней, чаще составляет 4-7 дней. Клинические проявления ВГЛ характеризуются:
1) острым началом заболевания, фебрильной лихорадкой, выраженными симптомами интоксикации (головная боль, миалгии, суставные боли), часто - болями в животе, возможной диареей;
2) признаками поражения эндотелия сосудов (посткапиллярной сети) с появлением геморрагической сыпи на коже и слизистых оболочках, развитием кровотечений (желудочно-кишечных, легочных, маточных и др.), ДВС-синдрома;
3) частым развитием печеночной и почечной недостаточностей с очаговыми и массивными некрозами в ткани печени и почек (тубулярными некрозами), полиорганной патологии - характерным поражением легких и других органов (миокардиты, энцефалиты и др.);
4) тромбоцитопенией, лейкопенией (реже лейкоцитоз), гемоконцентрацией, гипоальбуминемией, повышением АСТ, АЛТ, альбуминурией;
5) возможностью развития стертых форм и субклиническим течением заболевания с выраженной сероконверсией при всех ВГЛ.
Особенности диагностики и терапии ВГЛ. Лабораторная диагностика ВГЛ основана на определении специфических антител (к IgM и IgG) в ИФА и определении специфической РНК вирусов при ПЦР; реже выполняются вирусологические исследования. В сложных диагностических случаях с летальным исходом, не подтвержденных результатами серологических исследований, вирус может быть выделен из аутопсийного материала. Вместе с тем следует иметь в виду, что при несоблюдении мер безопасности работа с инфицированным материалом может послужить причиной последующих лабораторных и нозокомиальных случаев ВГЛ.
Патогенетическая терапия, направленная на проведение дезинтоксикации, регидратации и коррекции геморрагического синдрома, является основной в большинстве случаев ВГЛ. Антивирусная терапия рибавирином эффективна при ВГЛ, обусловленных лишь некоторыми вирусами из семейств Arenaviridae и Bunyaviridae.
Общие принципы проведения противоэпидемических мероприятий в условиях стационара. Необходимы: срочная госпитализация больного в специальный бокс с пониженным атмосферным давлением, изоляция полученных от него образцов инфицированного биологического материала, своевременное оповещение органов здравоохранения о случае заболевания. Уход за больным и работа с инфицированным материалом проводятся при строгом соблюдении индивидуальных универсальных мер предосторожности для персонала. Весь персонал также подвергается изоляции. При некоторых ВГЛ (желтая лихорадка, Крым-Конго и др.) возможна специфическая профилактическая вакцинация медицинского персонала.
При контакте с пациентом на расстоянии менее
1.1.1. Семейство Аrenaviridae
Этиология. Аренавирусы относятся к семейству РНК-содержащих безо- болочечных вирусов (табл. 1.2). Свое название семейство Arenaviridae получило от греч. arenosa - песчаный (из-за наличия в вирионе рибо-
сом, похожих на песчинки). Семейство включает вирус лимфоцитарного хориоменингита, а также вирусы Ласса, Хунин, Мачупо, Гуанарито, вызывающие тяжелые геморрагические лихорадки.
Таблица 1.2. Характеристика геморрагических лихорадок семейства Arenaviridae
Название вируса | Название заболевания | Распространение | Природный резервуар |
Lassa | Лихорадка Ласса | Западная Африка (особенно СьерраЛеоне, Гвинея, Нигерия) | Mastomys huberti, Mastomys erythroleucus Mastomys, natalensis |
Junin | Аргентинская ГЛ | Аргентина | Calomys Musculinis |
Machupo | Боливийская ГЛ | Боливия | Calomys callosus |
Guanarito | Венесуэльская ГЛ | Венесуэла | Zygodontomys brevicauda |
Sabia | Бразильская ГЛ | Бразилия | Неизвестен |
Структура и репродукция. Вирион имеет сферическую или овальную форму и диаметр около 120 нм. Снаружи он окружен оболочкой с булавовидными гликопротеиновыми шипами GP1 и GP2. Под оболочкой расположены 12-15 клеточных рибосом, похожих на песчинки. Капсид имеет спиральную форму. Геном представлен двумя сегментами (L, S) однонитевой минус-РНК; в нем кодируется 5 белков, в частности L-, Z-, N-, G-белки. Вирион содержит транскриптазу (L-белок, РНК-полимераза). Репродукция осуществляется в цитоплазме; после сборки и включения в вирион рибосомоподобных частиц происходит его почкование через плазматическую мембрану клетки.
Резистентность. Аренавирусы чувствительны к действию детергентов, УФ- и гамма-излучению, к нагреванию и нечувствительны к замораживанию и лиофилизации.
Культивирование. Аренавирусы культивируют в курином эмбрионе, в организме грызунов и на культуре клеток, например, Vero-культуре кле- ток почек зеленых мартышек.
В последние годы в Африке, Южной и Северной Америке идентифицированы еще несколько вирусов, относящихся к данному семейству
(Mopeia, Mobala, Ippy, Amapari, Flexal, Cupixni, Tamiami, Bear Canyon), но их роль в патологии человека еще не установлена. По мнению специалистов, каждые три года обнаруживается новый вирус этого семейства.
Естественная восприимчивость людей к аренавирусам высокая, а иммунитет - стойкий и продолжительный.
1.1.1.1. Лихорадка Ласса
Острое зоонозное природно-очаговое вирусное заболевание из группы особо опасных вирусных инфекций Африки. Характеризуется явлениями универсального капилляротоксикоза, поражением печени, почек, центральной нервной системы, высокой летальностью. Клинически проявляется лихорадкой, геморрагическим синдромом, развитием почечной недостаточности.
Краткие исторические сведения. Первые пять случаев заболевания зарегистрированы и описаны в городке Ласса (Нигерия) в
Эпидемиология. Резервуар и источник инфекции - африканские крысы рода Mastomys (M. natalensis, М. huberti, М. erythroleucus), инфицированность которых в эпидемических очагах может достигать 15-17%. Инфекция у грызунов может протекать пожизненно в виде хронической бессимптомной персистенции вируса, выделяющегося со слюной, калом и мочой. К источникам инфекции относятся и больные люди, контагиозность которых сохраняется в течение всего периода болезни; при этом заразными могут быть все выделения человека. Механизм передачи разнообразный. У грызунов вирус передается при питье и поедании корма, контаминированного мочой крыс-вирусоносителей, а также вертикальным путем. Заражение людей в природных очагах и в домашних условиях возможно при употреблении воды и продуктов, инфицированных мочой крыс, контактно-бытовым путем через предметы домашнего обихода, при сдирании шкурок убитых животных. Способность вируса проникать в организм человека через органы дыхания, поврежденную кожу, слизистые оболочки, желудочно-кишечный тракт обусловливает передачу инфекции различными путями - воздушно-капельным, алиментарным, контактным, половым, вертикальным.
Естественная восприимчивость людей. Лихорадка Ласса - заболевание со средним уровнем контагиозности, но высокой летальностью (от 18 до 60%). В большинстве эндемичных районов Африки его регистрируют круглогодично, с некоторым подъемом заболеваемости в январе-фев- рале (период миграций грызунов к человеческому жилью). Иммунитет изучен мало, но специфические АТ сохраняются у переболевших в течение 5-7 лет.
Основные эпидемиологические признаки. Наиболее высокая заболеваемость отмечается среди населения, проживающего в Западной Африке. Заболевание эндемично как в сельских районах, так и в городах, что объясняется высокой плотностью популяции грызунов рода Mastomys. Часто наблюдаются вторичные случаи заболевания (заражение от одного больного), но возможна и дальнейшая цепочка передачи вируса. Зарегистрированы завозные случаи инфекции в Нью-Йорке, Гамбурге, Японии, Великобритании.
Особую группу риска составляют работники здравоохранения. Заражение может произойти через различные биологические секреты больного, инфицированный кровью медицинский инструментарий, а также аэрогенным путем от больных, выделяющих большие порции вируса при кашле. Известны внутрибольничные вспышки лихорадки Ласса в Либерии, Нигерии и других странах.
Патогенез. Заболевания изучено недостаточно. Моделями для изу- чения механизмов развития инфекции являются грызуны и обезьяны различных видов.
Входными воротами вируса наиболее часто служат слизистые оболочки дыхательного и пищеварительного трактов. В инкубационном периоде возбудитель активно размножается в регионарных лимфати- ческих узлах, после чего развивается стойкая и выраженная вирусемия с диссеминированием вируса по органам мононуклеарно-фагоцитарной системы. Установлена важная патогенетическая роль МФС в развитии заболевания. При поражении вирусом моноцитов происходит значительный выброс цитокинов (ФНО, ИЛ-1,6 и др.); с последними связывают возникновение полиорганной патологии, нарушение проницаемости сосудов (повреждение эндотелия), развитие ДВС-синдрома, инфекционно-токсического шока, коллапса. Клетки жизненно важных органов, зараженные вирусом, становятся мишенью для цитотоксических Т-лимфоцитов. В результате образования иммунных комплексов и их фиксации на базальных мембранах клеток развиваются тяжелые некротические процессы в печени, селезенке, почках, надпочечниках, миокарде. Воспалительные явления при этом выражены слабо, изменения в головном мозге не выявляются.
Отсроченный характер выработки вируснейтрализующих АТ и нарушения клеточных иммунных реакций в остром лихорадочном периоде заболевания предположительно являются причиной развития тяжелого инфекционного процесса с ранним летальным исходом. При вскрытии погибших больных обращает на себя внимание значительное кровонаполнение в селезенке, печени, красном костном мозге.
Клиническая картина. Инкубационный период обычно длится 7-12 дней, с возможными колебаниями от 3-х до 16 дней.
Большинство случаев лихорадки Ласса протекает в виде стертой или субклинической форме.
В случаях средней тяжести заболевание чаще начинается постепенно с невысокой лихорадки, недомогания, миалгий, болей в горле при глотании, конъюнктивита. Через несколько дней температура тела (с ознобом) повышается до 39-40 ?С, усиливаются головная боль, слабость, развивается апатия. 60-75% больных отмечают значительные боли в ретростернальной и поясничной областях, в спине, грудной клетке, несколько реже в животе. Часто (в 50-60% случаев) возникают кашель, тошнота, рвота. Возможны диарея (иногда в виде мелены), дизурические явления, судороги. У части больных развивается нарушение зрения. При осмотре пациентов обращают на себя внимание гиперемия лица, шеи и кожи груди, иногда отек лица, проявления геморрагического синдрома различной локализации, экзантема петехиального, макулопапулезного или эритематозного характера, периферическая лимфаде- нопатия. Также развиваются ангина (в 60% случаев), реже - язвенный фарингит: на слизистой оболочке глотки, мягкого неба, дужек, миндалин появляются белые пятна, позднее превращающиеся в язвы с желтым дном и красным ободком, часто локализующиеся на дужках. Тоны сердца значительно приглушены, отмечаются брадикардия и артериальная гипотензия. Острый лихорадочный период может продолжаться до 3-х недель, температура снижается литически. Выздоровление протекает очень медленно, возможны рецидивы болезни.
Тяжелое течение (35-50% случаев) отличается симптоматикой полиорганных поражений - печени, легких (пневмонии), сердца (миокардит) и др. Поражение ЦНС может проявляться развитием энцефалопатии, энцефалита, менингита (серозного). Особенно тяжело заболевание протекает у детей моложе 2-х лет, с частым развитием геморрагического синдрома, кровотечений. Прогностически неблагоприятны следующие клинические признаки: гипотония (шок, колапс), выраженный геморрагический синдром (кровотечения), олиго- и анаурия, отек лица, развитие отека легких, асцит, миокардит, значительное повышение АЛТ,
высокий уровень виремии, определяемый в ПЦР. При неблагоприятном течении болезни в начале второй недели заболевания часто наблюдают летальные исходы.
Дифференциальная диагностика затруднена, особенно в ранней фазе развития лихорадки Ласса. При постановке предварительного диагноза большое клиническое значение придают сочетанию лихорадки, ретростернальной боли, язвенного фарингита, протеиноурии. Такая комбинация симптомов наблюдается у 70% больных и позволяет клинически заподозрить заболевание.
Лабораторная диагностика. Характерные изменения гемограммы: лейкопения, а в дальнейшем - лейкоцитоз и резкое увеличение СОЭ (до 40-80 мм в час), уменьшение времени свертываемости крови, удлинение протромбинового времени. Характерные изменения в моче - протеинурия, цилиндрурия, повышение количества лейкоцитов и эритроцитов.
С первых дней болезни возможно выделение вируса из глоточных смывов, крови и мочи. В качестве метода экспресс-диагностики применяют ИФА (выявление АГ вируса или определение IgМ-антител). В дальнейшем для определения противовирусных антител используют РНГА, РСК. По рекомендации ВОЗ, предварительный диагноз «лихорадка Ласса» ставят у лихорадящих больных в эндемичных районах при наличии антител IgG в титрах 1:512 и выше и одновременном выявлении IgM. Разработан также метод ПЦР-диагностики.
Осложнения. ИТШ, пневмонии, миокардиты, ОПН, делирий. На 2-3-й неделе болезни возможны перикардит, увеит, орхит, а также осложнения, связанные с поражением черепных нервов (чаще 8 пары - глухота). При тяжелых формах заболевания летальность составляет 30-50%. Летальность госпитализированных больных составляет от 15 до 25%.
Лечение. Обязательна госпитализация больных в специализирован- ные инфекционные отделения со строгой изоляцией и постельным режимом. Патогенетическая терапия направлена на коррекцию метаболических нарушений (метаболического ацидоза), восстановление объема циркулирующей крови, купирование геморрагического синдрома. Назначают симптоматические средства, при развитии осложнений могут быть использованы антибиотики, глюкокортикостероиды. Результативность применения плазмы реконвалесцентов сомнительна: положительный эффект наблюдается лишь в некоторых случаях при назначении в первую неделю заболевания, а при ее введении в более поздние сроки возможно ухудшение состояния больного. Применение рибавирина в ранней фазе (до 7-го дня болезни) позволяет уменьшить тяжесть течения заболевания и снизить летальность до 5%. Препарат
применяют перорально по 1000 мг/сут в течение 10 суток или внутривенно. При внутривенном введении начальная доза составляет 30 мг/кг веса, затем рибавирин вводят по 15 мг/кг веса каждые 6 часов в тече- ние 4 дней, а в последующие 6 дней - по 7,5 мг/кг веса каждые 8 часов. Разрабатываются этиотропные средства и вакцинные препараты.
Профилактика сводится к борьбе с проникновением в жилища крыс - источников инфекции, защите пищевых продуктов и предметов обихода от загрязнения испражнениями грызунов или пылью. Медицинский персонал должен быть обучен правилам работы с особо контагиозными больными и соблюдению строгого противоэпидемического режима. Для профилактики лихорадки Ласса можно использовать рибавирин по 500 мг перорально каждые 6 часов в течение 7 дней. Специфическая профилактика не разработана.
1.1.1.2. Южно-американские геморрагические лихорадки
Эпидемиология. Южно-американские
ГЛ (Аргентинская, Боливийская, Венесуэльская) распространены только в
этих регионах и представляют серьезную проблему для местных органов
здравоохранения. В Аргентине ежегодно диагностируют от 100 до 200
случаев ГЛ. В последние годы начато использование специфической вакцины
для профилактики Аргентинской ГЛ и отмечена достаточно высокая
эффективность вакцинации. Заболеваемость Боливийской ГЛ и Венесуэльской
ГЛ несколько меньше, чем Аргентинской, ежегодно регистрируют несколько
десятков случаев. В
Патогенез южно-американских ГЛ мало изучен. Его основные осо- бенности имеют большое сходство с патогенетическими механизмами лихорадки Ласса (роль МФГ в развитии заболевания, первичное вирусное поражение моноцитов, активация цитокинов, формирование полиорганных поражений, нарушение проницаемости сосудов из-за повреждения эндотелия, развитие ДВС-синдрома, токсического шока, коллапса) (см. соответствующий раздел). Установлена зависимость тяжести течения инфекции от уровня интерферона-альфа в сыворотке крови больных: при его значительном повышении к 6-12 дням болезни заболевание заканчивалось летальным исходом (при вскрытии находи-
ли значительное кровенаполнение в селезенке, печени, красном костном мозге).
Поражение сосудов при южно-американских ГЛ менее выражено, чем при лихорадке Ласса.
В большинстве случаев южно-американских ГЛ наблюдается присоединение вторичной бактериальной инфекции с развитием бронхопневмонии.
Клиническая картина. Инкубационный период составляет от 5 до 19 дней (чаще 7-12 дней), при парентеральной передаче инфекции он сокращается до 2-6 дней.
Клинические проявления южно-американских ГЛ имеют большое сходство.
Начало заболеваний острое: температура тела быстро поднимается до высоких цифр, развиваются миалгии различной локализации, особенно мышц спины, общая слабость. Больные часто жалуются на боли в глазных яблоках, светобоязнь, боли в эпигастрии, запоры. Часто возникает головокружение, возможны ортостатические коллапсы.
При осмотре пациентов отмечают гиперемию лица и шеи, конъюнктивит, увеличение периферических лимфатических узлов. Характерна экзантема в виде петехий и мелких везикул на коже (чаще в подмышеч- ных областях) и на слизистых оболочках. Геморрагические проявления в виде петехиальной сыпи и кровотечений (носовых, желудочных и др.) могут быть ранними клиническими признаками в первые дни болезни. Наблюдается угнетение или возбуждение ЦНС.
Течение заболевания может отягощаться развитием судорожного синдрома (клонические судороги) и комы, крайне осложняющими прогноз.
Особенно тяжело все южно-американские ГЛ протекают у беременных. Заболевания приводят к выкидышам (с высокой летальностью), возможна передача инфекции плоду.
В крови часто наблюдается выраженная лейкопения, тромбоцитопения, нарастание гематокрита, в моче - протенурия.
Период реконвалесценции может затягиваться до нескольких недель, длительно наблюдается астеновегетативный синдром (гипотония). Возможно выпадение волос на голове.
Летальность наблюдается в 15-30% случаев, при Венесуэльской
ГЛ - до 50%.
Лабораторная диагностика. Используется ИФА IgМ), разработана ПЦР-диагностика. Возможно выделение вируса из крови с первых дней болезни.
Лечение. Проводится патогенетическая терапия, направленная на коррекцию метаболических нарушений (метаболический ацидоз) и восстановление объема циркулирующей крови, используются гемостатические препараты. Показано назначение антибактериальных препаратов при присоединении вторичной бактериальной инфекции.
Эффективность рибавирина при южно-американской ГЛ не установлена, при лечении используют плазму реконвалесцентов.
Профилактика. Мероприятия при всех лихорадках направлены на ограничение популяций определенных видов грызунов; специфическая профилактика разработана только при Аргентинской ГЛ (живая вакцина).
1.1.2. Семейство Bunyaviridae
Этиология. Семейство Bunyaviridae насчитывает более 250 серотипов вирусов, входящих в состав пяти родов: Bunyavirus, Phlebovirus, Nairovirus, Hantavirus, Tospovirus (табл. 1 3.). Типовыми вирусами данных родов являются: вирус Буньямвера, вирус москитной лихорадки Сицилия, вирус болезни овец Найроби и вирус Хантаан соответственно. Тосповирусы непатогенны для человека и поражают растения.
Прототипом вирусов данного семейства является впервые выделенный в Центральной Африке и переносимый комарами вирус Буньямвера (название вируса дано по местности Буньямвера в Уганде).
Таблица 1.3. Характеристика геморрагических лихорадок (ГЛ) семейства Bunyaviridae
Название | Род вируса | Переносчик | Распространение |
1 | 2 | 3 | 4 |
ГЛ Долины Рифт (Рифт-Валли ГЛ) | Phlebovirus | Aedes mcintoshi, Aedes vexans и другие | Тропическая Африка |
Крым-Конго ГЛ | Nairovirus | Иксодовые клещи рода Hyalomma | Африка, юг России, страны Ближнего Востока, Центральной Азии, Балканы, Китай |
Окончание таблицы 1.3
Название | Род вируса | Переносчик | Распространение |
1 | 2 | 3 | 4 |
Геморрагическая лихорадка с почечным синдромом | Phlebovirus | Aedes mcintoshi, Aedes vexans и другие | Тропическая Африка |
Крым-Конго ГЛ | Hantavirus | Мышевидные грызуны | Европа, Азия. |
Геморрагическая лихорадка с почечным синдромом | Hantavirus | Мышевидные грызуны | Европа, Азия. |
Хантавирусный пульмональный синдром | Hantavirus | Крысы и мыши различных родов | Южная и Северная Америка |
Морфология. Вирионы имеют овальную или сферическую форму диаметром 80-120 нм, при электронной микроскопии напоминают пончик. Это сложные РНК-геномные вирусы, содержащие три внутренних нуклеокапсида со спиральным типом симметрии. Каждый нуклеокапсид состоит из нуклеокапсидного белка N, уникальной одноцепочечной минус-РНК и фермента транскриптазы (РНК-зависимой РНК-полимеразы). Три сегмента РНК, связанные с нуклеокапсидом, обозначают по размерам: L (long) - большой, М (medium) - средний и S (short) - малый. РНК не обладает инфекционной активностью. В отличие от других вирусов с минус-РНК геномом (Orthomixoviridae, Paramixoviridae и Rhabdoviridae) буньявирусы не содержат М-белка, поэтому они более пластичны. Сердцевина вириона, содержащая рибонуклеопротеин (РНП), окружена липопротеидной оболочкой, на поверхности которой находятся шипы - гликопротеины G1 и G2, которые кодируются М-сегментом РНК.
Антигены. Белок N является носителем группоспецифических свойств и выявляется в РСК. Гликопротеины (G1 и G2) - типоспецифические антигены, выявляемые в РН и РТГА. Это протективные антигены, обусловливающие гемагглютинирующие свойства, которые у буньявирусов не столь выражены, как у ортомиксо- и парамиксовирусов. Они индуцируют образование вируснейтрализующих антител. Гликопротеины - основные детерминанты патогенности, обусловливающие клеточную органотропность вирусов и эффективность их передачи членистоногими.
На основании анализа перекрестного связывания в РСК буньявирусы объединяют в роды, внутри которых на основании перекрестной РН и РТГА они распределяются по серогруппам.
Репродукция буньявирусов. Репродукция буньявирусов происходит в цитоплазме клетки, где сначала формируются РНП. При этом образуется три вида иРНК, каждая из которых кодирует соответствующий полипептид - L, N и предшественники белков G1 и G2. Вирусные белки в инфицированной клетке синтезируются быстро. Так, белок N можно выявить уже через 2 ч, a G1 и G2 - через 4 и 6-8 ч соответс- твенно. Созревание вирусов (приобретение внешней липидсодержащей оболочки) в результате почкования РНП, в отличие от других вирусов, происходит не на плазматических мембранах клетки, а при прохождении через стенки везикул в области аппарата Гольджи. В последующем вирусные частицы транспортируются к плазмолемме (клеточной мембране). Выход вирусных частиц происходит путем экзоцитоза, а иногда - лизиса клетки. Буньявирусы, как и другие представители арбовирусов, обладают способностью размножаться в двух температурных режимах: 36-40 и 22-25 ?С, что позволяет им репродуцироваться не только в организме позвоночных, но и в организме переносчиков - кровососущих членистоногих насекомых.
Устойчивость вирусов к действию физических и химических факторов. Буньявирусы чувствительны к действию эфира и детергентов, инактивируются при прогревании до температуры 56 ?С в течение 30 мин и почти мгновенно при кипячении, но длительно сохраняют инфекционную активность при замораживании. Буньявирусы стабильны в весьма ограниченном диапазоне значений рН - 6,0-9,0, инактивируются обычно применяемыми дезинфицирующими средствами.
Особенности культивирования буньявирусов и восприимчивость к ним лабораторных животных. К буньявирусам восприимчивы новорожденные белые мыши, белые крысы и хомячки при их заражении в головной мозг. Для культивирования вирусов применяют культуры клеток из переносчиков, почки эмбрионов человека, ВНК-21, фибробласты куриного эмбриона, где они не оказывают выраженного ЦПД. Вирусы можно культивировать в куриных эмбрионах. Универсальной моделью для выделения арбовирусов является заражение новорожденных белых мышей, у которых они вызывают развитие энцефалита, заканчивающегося летально.
1.1.2.1. Геморрагическая лихорадка долины Рифт
Геморрагическая лихорадка долины Рифт (ГЛДР) является зоонозом и прежде всего наблюдается у различных животных, значительно реже вызывает тяжелое заболевание у людей с высокой летальностью.
Летальность
домашнего скота (эпизоотии) от лихорадки приводит к серьезным
экономическим проблемам. Во время последней большой вспышки ГЛДР в
Саудовской Аравии и Йемене в
Вирус впервые был выделен и идентифицирован от больных овец в Кении (название местности - долина Рифт) в
Эпидемиология. Возможными переносчиками инфекции являются не менее 30 разновидностей комаров, относящихся к пяти родам. Разнообразие переносчиков вызывает определенное беспокойство в плане распространения заболевания среди животных и людей. В определенной эндемичной области может преобладать конкретный переносчик (на Аравийском полуострове - это в основном Aedes (Aedimorphus) vexans). Комары рода Aedes могут передавать инфекцию трансовариально. Таким образом, появляется потомство комаров, уже инфицированных и способных передавать инфекцию животным и людям. Важно, что инфицированные яйца комаров могут длительно (месяцы, годы) сохраняться в сухих условиях. Интенсивность передачи возрастает в дождливые периоды года.
Множество видов диких и домашних животных может поражаться вирусом, включая рогатый скот, овец, верблюдов, коз (овцы более восприимчивы среди других животных). При эпизоотии среди овец летальность у ягнят достигает 90%, у овец - 10%. Важным сигналом начала эпидемии среди животных является 100% абортов у овец.
Передача инфекции людям возможна:
- трансмиссивным путем (через укусы комаров);
- при контакте с кровью (другими жидкостями, органами) зараженного животного, при употреблении молока от больных животных;
- ингаляционный путь заражения (описан случай лабораторного заражения).
Патогенез в основном изучался на экспериментальных животных (ягнята, крысы), а у человека он мало изучен. Установлена высокая гепатотропность вируса, у новорожденных ягнят выявлялись массивный некроз гепатоцитов, эозинофильная инфильтрация. У экспериментальных грызунов происходит развитие поражений печени и ЦНС (энцефалит).
Отмечены выраженные изменения лимфатических узлов, сопровождающиеся некротическими изменениями с серозным или геморрагическим экссудатом. Установлены поражения гломерулярного и тубулярного отделов почек. У человека установлены (в единичных исследованиях) поражение печени, дегенеративные процессы в миокарде, интерстициальная пневмония.
Большое значение в патогенезе заболевания имеют сниженное функциональное состояние МФС, высокий уровень провоспалительных цитокинов (особенно при повреждении эндотелия сосудов).
Клиническая картина. Инкубационный период составляет от 2-х до 6 дней. Заболевание начинается остро с выраженных симптомов интоксикации, умеренной лихорадки; больных часто беспокоят слабость, миалгии, боль в пояснице, головная боль, рвота, боли в животе. Неосложненное течение ГЛДР наблюдается в 98% всех случаев, длитель- ность заболевания составляет от 4-х до 7 дней, при этом нарастают титры специфических антител, вирусемии не отмечается. При тяжелом течении превалируют симптомы поражения печени с развитием желтухи, явлений почечной недостаточночности, геморрагического синдрома.
В настоящее время рассматривают 3 типа осложненного течения лихорадки:
- развитие ретинита (чаще в центральных отделах сетчатки) в 0,5-2% случаев (через 1-3 нед после начала заболевания) - прогноз обычно благоприятный; по характерным изменениями сетчатки ретроспективно можно судить о возможном наличии в анамнезе перенесенной ГЛДР;
- развитие менигоэнцефалита в 1% случаев, прогноз неблагоприятен;
- развитие геморрагического синдрома (кровотечения, геморрагическая сыпь и др.), ДВС-синдрома; характерна длительная виремия до 10 дней и более; летальность может достигать 50%.
Лабораторная диагностика. При микробиологической диагностике, проводимой в первые 2-3 дня заболевания, вирус выделяют из крови, фекалий и глоточных смывов путем заражения новорожденных белых мышей и культур клеток. Серологическая диагностика основана на определении специфических антител в ИФА (IgМ). Для обнаружения антигенов вируса применяют РИФ. Прижизненное выявление маркеров вируса проводится в крови, а посмертно - из тканей с помощью ПЦР.
Лечение. Специфическая противовирусная терапия не разработана. В экспериментальных условиях установлена эффективность рибавири-
на, клиническая его эффективность у людей не доказана. В основном патогенетическая терапия направлена на дезинтоксикацию, купирование геморрагического синдрома. В настоящее время в стационарных условиях при адекватной патогенетической терапии летальность может не превышать 1%.
Профилактика направлена на:
- вакцинацию животных двумя видами вакцин - живой аттенуированной и убитой; после вакцинации аттенуированной вакциной иммунитет сохраняется пожизненно;
- профилактику заболевания у людей с помощью убитой формалином вакцины; в настоящее время методика находится на стадии клинической апробации;
- сдерживание популяции комаров, а также на индивидуальную профилактику их укусов.
1.1.2.2. Крым-Конго геморрагическая лихорадка
Острая зоонозная природно-очаговая вирусная инфекция с трансмиссивным механизмом передачи, характеризующаяся выраженным геморрагическим синдромом и двухволновой лихорадкой.
Краткие исторические сведения. Заболевание
впервые описано на основании материалов вспышки в Крыму (Чумаков М.П.,
1944-1947), поэтому было названо Крымской геморрагической лихорадкой
(КГЛ). Позднее случаи аналогичного заболевания были зарегистрированы в
Конго (1956), где в
Эпидемиология. Резервуар и источники инфекции - домашние и дикие животные (коровы, овцы, козы, зайцы и др.), а также более 20 видов иксодовых и аргасовых клещей, прежде всего, пастбищные клещи рода Hyalomma. Основной резервуар инфекции в природе составляют мелкие позвоночные животные, от них через клещей заражается домашний скот. Контагиозность животных определяется длительностью виремии, продолжающейся у них около недели. Клещи представляют собой более стойкий резервуар инфекции в связи с возможностью половой и трансовариальной передачи вируса. Отмечена высокая контагиозность больных людей. У животных и человека вирус обнаружен в крови при кишечных, носовых и маточных кровотечениях, а также в выделениях, содержащих кровь (рвотных массах, фекалиях).
Механизмы передачи - трансмиссивный (при укусах иксодовых клещей), а также контактный и аэрогенный. При заражении от человека или животных основным является контактный механизм передачи вследствие прямого контакта с кровью и тканями инфицированных животных и людей (внутривенные вливания, остановка кровотечения, проведение искусственного дыхания методом «рот в рот», взятие крови для исследования и т.п.). Аэрогенный механизм передачи инфекции описан при внутрилабораторном заражении персонала во время нештатных ситуаций при центрифугировании вируссодержащего материала, а также при других обстоятельствах, если вирус содержался в воздушной среде.
Естественная восприимчивость людей высокая. Постинфекционный иммунитет сохраняется в течение 1-2 лет после перенесенного заболевания.
Основные эпидемиологические признаки. Болезнь отличает выраженная природная очаговость. В странах с теплым климатом очаги инфекции в виде вспышек и спорадических случаев приурочены преимущественно к степным, лесостепным и полупустынным ландшафтам. Уровень заболеваемости связан с периодом активного нападения взрослых клещей (в тропиках - круглогодично). Чаще болеют мужчины 20-40 лет. Случаи заражения преобладают среди лиц определенных профессиональных групп - животноводов, сельскохозяйственных рабочих, ветеринарных и медицинские работников. Описаны внутрибольничные вспышки инфекции и внутрилабораторные заражения.
Патогенез заболевания сходен с другими вирусными ГЛ. Характерны развитие интенсивной вирусемии, тромбоцитопении, лимфопении в острой стадии заболевания, а также увеличение АСТ, как и при большинстве ВГЛ, менее выражено увеличение АЛТ. В терминальной стадии наблюдаются печеночная и почечная недостаточность, острая сердечнососудистая недостаточность. При аутопсии в печени выявляются эозинофильная инфильтрация без выраженной воспалительной реакции, некротические изменения в селезенке, лимфатических узлах. Возможно развитие массивных кровотечений. ДВС-синдром регистрируется в терминальной фазе, генез его не ясен. Как и при других ВГЛ, имеются дис- трофические процессы в мышечной ткани, потеря в весе.
Клиническая картина. Инкубационный период после укуса инфицированного клеща длится 1-3 дня, после контакта с кровью или зараженными тканями он может затягиваться максимально до 9-13 суток. Клинические проявления заболевания варьируют от стертых форм до тяжелых.
Начальный период болезни продолжается 3-6 дней. Характерно острое начало заболевания, высокая температура с ознобом. Пациенты жалуются на головную боль, боли в мышцах и суставах, в животе и в пояснице, сухость во рту, головокружение. Иногда бывают боли в горле, тошнота, рвота, диарея. Часто возникает возбуждение, а иногда и агрессивность больных, фотофобия, ригидность и болезненность затылочных мышц.
Через 2-4 дня от начала болезни возбуждение сменяется утомляемостью, депрессией, сонливостью. Появляются боли в правом подреберье, увеличивается печень. При осмотре больных отмечают гиперемию лица, шеи, плечевого пояса и слизистых оболочек полости рта, снижение АД, склонность к брадикардии. На 3-5-й день болезни возможен «врез» на температурной кривой, что обычно совпадает с появлением кровотечений и кровоизлияний. В дальнейшем развивается вторая волна лихорадки.
Период разгара соответствует последующим 2-6 дням. Развиваются геморрагические реакции в разных сочетаниях, степень выраженности которых широко варьирует от петехиальной экзантемы до обильных полостных кровотечений и определяет тяжесть и исход заболевания. Состояние больных резко ухудшается. При их осмотре обращают на себя внимание бледность, акроцианоз, прогрессирующая тахикардия и артериальная гипотензия, подавленность настроения пациентов. Может появляться лимфаденопатия. Нередко находят увеличение печени, иногда возникает желтуха смешанного характера (как гемолитического, так и паренхиматозного). В 10-25% случаев развиваются судороги, бред, кома, появляются менингеальные симптомы.
Реконвалесценция начинается после 9-10 дней болезни и занимает дли- тельное время, до 1-2 месяцев; астения может сохраняться до 1- 2 лет.
Дифференциальная диагностика в начальном периоде представляет большие сложности. В разгаре заболевания ККГЛ дифференцируют от других инфекций, протекающих с геморрагическим синдромом. Наиболее показательные клинические признаки болезни - лихорадка (часто двухволновая) и выраженные геморрагические проявления.
Лабораторная диагностика. Лабораторные исследования проводят в спе- циализированных лабораториях с повышенным уровнем биологической защиты. Характерные изменения гемограммы - выраженная лейкопения со сдвигом влево, тромбоцитопения, повышение СОЭ. В анализе мочи определяются гипоизостенурия, микрогематурия. Возможно выделение вируса из крови или тканей, однако на практике диагноз чаще подтверждается результатами проведенных серологических реакций (ИФА, РСК, РТНГА, НРИФ). Антитела IgM класса в ИФА определяются в течение 4-х месяцев после заболевания, IgG-антитела - в течение 5 лет. Возможно
определение антигенов вируса в ИФА. В последние годы разработана полимеразная цепная реакция (ПЦР) для определения генома вируса.
Осложнения заболевания разнообразны: тромбофлебит, пневмонии, отек легких, тяжелые желудочно-кишечные кровотечения, острая печеночная и/или почечная недостаточность, инфекционно-токсический шок. Летальность варьирует от 4% до 15-30% и обычно наступает на второй неделе болезни.
Лечение. Госпитализация и изоляция больных обязательны. Лечение проводят в соответствии с общими принципами терапии вирусных геморрагических лихорадок. В ряде случаев отмечен положительный эффект от введения 100-300 мл иммунной сыворотки реконвалесцентов или 5-7 мл гипериммунного лошадиного иммуноглобулина. В некоторых случаях хороший эффект может быть получен от применения рибавирина внутривенно и перорально (см. лихорадка Ласса).
Профилактика. При госпитализации больных следует строго выполнять требования по профилактике нозокомиальных инфекций и личной профилактике сотрудников, соблюдать осторожность при выполнении инвазивных процедур. Лицам, соприкасавшимся с кровью и выделениями больного, а также с секционным материалом в качестве экстренной профилактики, вводят специфический иммуноглобулин. Дератизационные и акарицидные мероприятия в природных очагах мало эффективны, поскольку переносчики многочисленны и широко распространены. Особое внимание уделяют защите людей от клещей. Меры личной профилактики - ношение защитной одежды, импрегнирование одежды, палаток и спальных мешков репеллентами. По эпидпоказаниям рекомендуют применять инактивированную формалином вакцину из мозга зараженных белых мышатили крысят-сосунков, однако надежной и эффективной вакцины против лихорадки Крым-Конго до настоящего времени не существует.
Медицинские работники, бывшие в контакте с больными или подозрительными на данное заболевание лицами, а также биоматериалом от них, должны находиться под наблюдением в течение трех недель с ежедневной термометрией и тщательной регистрацией возможных клинических проявлений заболевания. В очаге проводят дезинфекцию, контактных лиц не разобщают.
1.1.3. Семейство Filoviridae
1.1.3.1. Лихорадки Эбола и Марбург
Лихорадки Эбола и Марбург - острые филовирусные инфекции человека, регистрируемые на территории тропической Африки, характе-
ризуются сходной клинической картиной с выраженным интоксикационным и геморрагическим синдромами, полиорганной патологией, высокой летальностью. Относятся к особо опасным инфекционным заболеваниям.
Этиология. Вирусы полиморфны и могут иметь нитевидную, червеоб- разную, спиралевидную, округлую форму. Длина вируса варьирует в пределах 700-1200 нм, сечение - 70-80 нм. Вирус содержит однонитевую минус-РНК, заключенную в капсид, покрытый оболочкой, и полимеразу. Симметрия капсида спиральная, на оболочке имеются шипы (спикулы). Вирусы Марбурга и Эбола сходны по морфологической структуре, но именно этот признак отличает их от всех известных вирусов, поражающих человека. Вирусы рождаются из клетки почкованием через клеточную мембрану, хорошо размножаются в организме морских свинок. В отличие от вируса Эбола вирус Марбурга может размножаться в пере- виваемой культуре клеток почки зеленой мартышки. Вирус Марбурга отличается также по антигенной структуре от вируса Эбола, который встречается в 4-х серотипах.
Эпидемиология. Заболевания регистрируют в Африке, в регионе от 10о северной до 10о южной широты. Источник инфекции (природный резервуар) не установлен. Вирусы в природных условиях могут выделяться от различных животных, особое значение придается циркуляции вируса у обезьян и летучих мышей. В то же время эти животные не могут рассматриваться как основной резервуар поддержания инфекции в природе, так как заболевание у них протекает тяжело, с высокой летальностью, редко наблюдаются случаи с бессимптомным носительством.
Тяжесть и исходы при лихорадке Эбола зависят от штамма вируса, наиболее тяжелые случаи заболевания с летальностью до 90% наблюдаются при инфицировании вирусом Эбола-Заир; летальность при инфи- цировании вируса Эбола-Судан составляет 40-50%. Штамм Эбола-КотдИвуар менее вирулентен. Клинически выраженных случаев лихорадки Эбола, обусловленных штаммом Рестон, у людей не зарегистрировано, но этот вирус высокопатогенен для обезьян (Macaca fascicularis) на Филиппинах. Летальность при лихорадке Марбург в большинстве случаев составляет 50-70%.
В экспериментальных исследованиях на животных (обезьяны, летучие мыши) и отдельных исследованиях у людей вирусы Эбола и Марбург выделяются из различных органов и тканей, в том числе слезной жид- кости, спермы, легочного секрета. В связи с этим контакт с больными данными лихорадками представляет значительную угрозу заражения, особенно в условиях стационара (внутрибольничные вспышки).
Установлены различные механизмы заражения: контактный (перкутанный), воздушно-капельный, парентеральный, не исключаются также половой путь заражения и кишечно-оральный механизм. У больных, выживших после заболевания, отмечается выделение вируса с мочой, определяемое в сперме и слезной жидкости до 3-х месяцев.
Заражение человека происходит при контакте с дикими животными (обезьяны), а также при контакте с больными.
Вирусы лихорадок Эбола и Марбург рассматриваются как наиболее опасные биологические агенты биотерроризма.
Патогенез. Вирусы Эбола и Марбург, как установлено в эксперимен- тальных исследованиях, имеют высокий тропизм к клеткам различных органов и систем. После инфицирования репликация происходит в клетках МФС с последующей генерализацией и поражением других органов. Наиболее выраженные некротические изменения отмечают в печени. Высокая репликация вирусов отмечается в моноцитах, Купфферовских клетках и эндотелии.
Вирусы обладают выраженным иммуносупрессивным действием, поражая фагоциты (моноциты и тканевые макрофаги) и стимулируя апоптоз лимфоцитов. У больных с тяжелым, прогностически неблагоприятным течением заболевания в динамике регистрируется низкий уровень (или отсутствие) специфических антител. Высокий уровень специфических антител у больных с лихорадкой Эбола и Марбург является прогностически благоприятным признаком.
Нарушение проницаемости сосудов и развитие геморрагического синдрома (геморрагическая сыпь, кровотечения) обусловлены: имму- нопатологическим механизмом, ведущее значение в развитии которого имеют значительно повышенные уровни ФНО-α, ИЛ-2, интерферонов-β и -γ, а также прямым цитопатическим действием вирусов на эндотелий.
Установлено, что в генезе ДВС-синдрома играет большое значение резко сниженный уровень протеина С, нарастание продуктов деградации фибриногена-фибрина.
В генезе синдрома токсического шока ведущее значение придается резко повышенным уровням провоспалительных цитокинов.
Клиническая картина. Инкубационный период составляет от 4-х до 14 дней, в ряде случаев при лихорадке Марбург отмечено удлинение инкубационного периода до 17 дней.
Начало заболевания острое: высокая лихорадка, головная боль, миалгия, фарингит, выраженная слабость. В большинстве случаев отмечаются диарея (профузная, водянистая), тошнота, рвота. С первых часов заболевания возможно появление пятнисто-папулезной сыпи с после-
дующей десквамацией в периоде реконвалесценции (при благоприятном течении).
Геморрагический синдром чаще проявляется в первые дни болезни и характеризуется появлением геморрагической сыпи на коже, слизистых, развитием кровотечений. При тяжелом течении смерть больного может наступить к концу первой недели заболевания. Неблагоприятными симптомами являются нормализация температуры при нарастании клинических проявлений полиорганной патологии (респираторный дистресс-синдром, острая почечная и печеночная недостаточности, кома). Возможно появление симптомов обезвоживания.
В большинстве случаев в крови отмечается увеличение аминотрансфераз, уровня мочевины, креатинина, лейкопения, лимфопения, тромбоцитопения. Билирубин обычно не повышен. В то же время в 10-15% случаев возможно развитие желтухи, что приходится дифференцировать в первую очередь с желтой лихорадкой.
Реконвалесценция длительная (несколько недель или месяцев), возможно развитие артритов, конъюнктивита, орхита, значительного снижения слуха.
Дифференциальная диагностика. Дифференциальный диагноз проводят с вирусными геморрагическими лихорадками, эндемичными в регионах тропической Африки, а в остром периоде - с лептоспирозом, риккетсиозами, малярией, гриппом.
Лабораторная диагностика. В гемограмме уже в первые дни болезни отмечают выраженную лейкопению и тромбоцитопению. В качестве специфических методов исследования (возможны только в условиях лабораторий максимального уровня защиты) применяют прямую электронную микроскопию крови больных, метод непрямой иммунофлюоресценции, ИФА, постановку РСК, РИА, иммуноблота. В качестве экспресс-метода применяют ПЦР на выявление РНК-вируса.
Лечение. Специфической этиотропной терапии нет. Проводится патогенетическая терапия в соответствии с клиническими проявлениями заболевания. Эффективность иммунной плазмы (от реконвалесцентов) не доказана. Установлена эффективность внутривенного введения интерферона-a-2в.
Профилактика. Выявление больных, их изоляция, карантинные мероприятия. Разработан гетерогенный (лошадиный) сывороточный иммуноглобулин для иммунопрофилактики контингентов высокого риска. Специфической профилактики нет.
1.1.4. Семейство Flaviviridae
Название семейства Flaviviridae происходит от лат. flavus - желтый, по названию заболевания «желтая лихорадка», которое вызывает вирус данного семейства. Семейство объединяет три рода, два из которых патогенны для человека: род Flavivirus, включающий множество возбудителей арбовирусных инфекций (табл. 1.4) и род Hepacivirus, в состав которого входят вирус гепатита С (HCV) и G (HGV).
Типовым представителем семейства Flaviviridae является вирус желтой лихорадки, штамм Asibi, относящийся к роду Flavivirus.
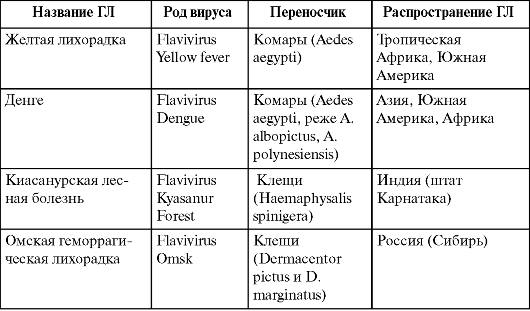
Таблица 1.4. Характеристика геморрагических лихорадок семейства Flaviviridae
Этиология. Возбудители - сложные РНК-геномные вирусы сфери- ческой формы. Они меньше, чем альфа-вирусы (их диаметр до 60 нм), имеют кубический тип симметрии. Геном вирусов состоит из линейной однонитчатой плюс-РНК. В состав нуклеокапсида входит белок V2, на поверхности суперкапсида содержится гликопротеин V3, а на его внутренней стороне - структурный белок V1.
При репродукции вирусы проникают в клетку путем рецепторного эндоцитоза. Вирусный репликативный комплекс связан с ядерной мембраной. Репродукция флавивирусов идет медленнее (более 12 часов), чем у альфа-вирусов. С вирусной РНК транслируется полипротеин, распадающийся на несколько (до 8) неструктурных белков, включая про-
теазу и РНК-зависимую РНК-полимеразу (репликазу), белки капсида и суперкапсида. В отличие от альфа-вирусов, в клетке образуется только один тип иРНК (45S) флавивирусов. Созревание происходит путем почкования через мембраны эндоплазматической сети. В полости вакуолей вирусные белки образуют кристаллы. Флавивирусы более патогенны, чем альфа-вирусы.
Гликопротеин V3 обладает диагностической значимостью: он содержит родо-, видо- и комплексоспецифические антигенные детерминанты, является протективным антигеном и гемагглютинином. Гемагглютинирующие свойства флавивирусов проявляются в узком диапазоне рН.
Флавивирусы по антигенному родству сгруппированы в комплексы: комплекс вирусов клещевого энцефалита, японского энцефалита, желтой лихорадки, лихорадки денге и т.д.
Универсальной моделью для выделения флавивирусов является интрацеребральное заражение новорожденных белых мышей и их сосунков, у которых развиваются параличи. Возможно заражение обезьян и куриных эмбрионов на хорионаллантоисную оболочку и в желточный мешок. Для вирусов лихорадки денге высокочувствительной моделью являются комары. К флавивирусам чувствительны многие культуры клеток человека и теплокровных животных, где они вызывают ЦПД. В культурах клеток членистоногих ЦПД не отмечено.
Флавивирусы малоустойчивы в окружающей среде. Они чувствительны к действию эфира, детергентов, хлорсодержащих дезинфектантов, формалина, УФ, нагреванию свыше 56 ?С. Сохраняют контагиозность при замораживании и высушивании.
Флавивирусы имеют широкое распространение в природе и вызывают природно-очаговые заболевания с трансмиссивным механизмом заражения. Основной резервуар флавивирусов в природе - кровососущие членистоногие, которые одновременно являются и переносчиками. Для членистоногих доказана трансфазовая и трансовариальная передача флавивирусов. Подавляющее большинство флавивирусов распространяется комарами (вирусы лихорадки денге, вирус желтой лихорадки), некоторые передаются клещами (вирус болезни леса Киассанур и т.д.). Комариные флавивирусные инфекции распространены преимущест- венно вблизи экваториальной зоны - от 15? с.ш. до 15? ю.ш. Клещевые инфекции, напротив, встречаются повсеместно. Важную роль в поддержании популяции флавивирусов в природе играют их прокормители - теплокровные позвоночные животные (грызуны, птицы, летучие мыши, приматы и т.д.). Человек - случайное, «тупиковое» звено в экологии
флавивирусов. Однако для лихорадки денге и городского типа желтой лихорадки больной человек может также являться резервуаром и источником вируса.
Заражение флавивирусами может происходить контактным, аэрогенным и пищевым путями. Человек высоковосприимчив к этим вирусам.
Иммунитет после перенесенных заболеваний напряженный, повторные заболевания не наблюдаются.
1.1.4.1. Желтая лихорадка
Острая вирусная инфекция человека с трансмиссивным механизмом передачи характеризуется развитием выраженного интоксикационного и геморрагического синдромов, желтухи, протеинурии.
Этиология. Выявляется три генотипа вируса (I, 11А, 11В). I и IIA генотипы распространены в Центральной и Западной Африке соответственно, генотип IIB - в Южной Америке. Генотип вируса IIA способен к передаче в городах между людьми через комаров Aedes aegypti.
Краткие исторические сведения. Впервые клиника желтой лихорадки описана во время вспышки в Америке в
Эпидемиология. Желтая лихорадка (ЖЛ) регистрируется только в Африке и Южной Америке. Источники инфекции - человек и обезьяны. Выделяют городскую и джунглевую формы ЖЛ. Переносчики - комары рода Aedes. После инкубационного периода (3-6 дней) вирус появляется в крови и может передаваться комарам. Период развития вируса в комаре 9-12 дней. Современные эпидемии в Африке и Южной Америке в основном городские. ЖЛ может протекать более легко у детей с соотношением субклинических и клинических случаев, как 2:1. В городских условиях чаще болеют дети, а взрослые, как правило, иммунны. Передача в Западной Африке самая высокая в дождливый сезон с июля по ноябрь, в Южной Америке - с января по март.
Патогенез. После укуса инфицированным комаром репликация виру- сов происходит первоначально в лимфатических узлах, затем - в печени, селезенке и костном мозге.
Для ЖЛ при минимально выраженной воспалительной реакции (мононуклеарного типа) характерно поражение печени, обусловленное активной репликацией вирусов в гепатоцитах и купферовских клетках, в результате этого развиваются:
- коагуляционные некрозы в центральных отделах дольки печени с вовлечением зон вокруг портальной и печеной вен;
- эозинофильная инфильтрация гепатоцитов;
- жировая инфильтрация гепатоцитов.
В миокарде развиваются дегенеративные процессы, жировая инфильтрация, в почках - тубулярный некроз. При аутопсии выявляется выраженный отек головного мозга. В результате нарушения детоксикационной и белково-синтетической функции печени возможно развитие нарушений гемостаза, развитие токсического шока, а также ДВС-синдрома, токсического шока (патогенез малоизучен).
В генезе токсического шока важная роль отводится повышенному синтезу вазоактивных воспалительных цитокинов (ИЛ-2, ФНО, ИЛ-1), полиорганным поражениям (в первую очередь миокарда, почек, печени).
Клиническая картина. Инкубационный период длится около недели. В Африке в основном наблюдаются стертые, бессимптомные или клинически маловыраженные формы. При классическом течении характерно острое начало, повышение температуры, головная боль, миалгии, боли в пояснице, анорексия, тошнота, рвота. При осмотре в первые часы заболевания отмечают конъюнктивит, гиперемию зева, относительную бра- дикардию. Через 2-3 дня возможно снижение температуры на несколько часов (6-24 ч) с последующим ее повышением с резко выраженным интоксикационным синдромом, появлением желтухи, болей в эпигастрии, развитием геморрагического синдрома (чаще желудочно-кишечных кровотечений). Развиваются гипотензия, альбуминурия, клиника острой печеночной недостаточности. Летальные исходы обычно развиваются между 7 и 10 днями болезни, при тяжелом течении летальность достигает 50%. У части больных могут превалировать симптомы острой почечной сердечно-сосудистой недостаточности.
В анализах крови определяются лейкопения, увеличение времени свертывания крови, повышение уровня фибриногена, тромбоцитопения. Значительно повышается уровень билирубина, трансаминаз, отмечаются альбуминурия, азотемия.
Возможно присоединение вторичной бактериальной инфекции с развитием пневмонии, сепсиса. Период реконвалесценции может затягиваться до 6-12 мес.
Дифференциальная диагностика. Дифференциальный диагноз проводится, в первую очередь, с другими ВГЛ (геморрагическая лихорадка денге), а также с малярией, лептоспирозом, вирусными гепатитами, брюшным тифом, риккетсиозами.
Характерным является то, что вспышки ЖЛ всегда сопровождаются частым развитием у больных тяжелых желудочно-кишечных кровотечений.
Лабораторная диагностика. Микробиологическая диагностика основана на выделении вируса из крови не позднее 3-4-го дня болезни, а при летальных случаях - из печени, путем заражения новорожденных белых мышей, комаров, развивающихся куриных эмбрионов и культур клеток. Серологическая диагностика основана на определении нарастания титров антител в парных сыворотках в ИФА. Экспресс-диагностика вирусного антигена в крови больных или в печени умерших осуществляется с помощью ИФА, РИФ. Обнаружение IgM в сыворотках крови свидетельствует о текущей инфекции. Генетические маркеры вируса определяют
в ПЦР.
Лечение. Специфической этиотропной терапии нет. Лечение направ- лено на проведение дезинтоксикации, назначают жаропонижающие препараты (парацетамол), проводят коррекцию водно-электролитных нарушений, гипогликемии. По показаниям производят переливание крови, плазмы, тромбоцитарной массы. При развитии почечной недостаточности показан перитонеальный диализ или гемодиализ.
Профилактика. Проводят уничтожение комаров и мест их выплода, применяют индивидуальные средства защиты. В очагах инфекции необходима специфическая иммунопрофилактика живой ослабленной вакциной. Ее вводят лицам всех возрастов подкожно в объеме 0,5 мл. Невосприимчивость развивается через 10 дней и сохраняется не менее 10 лет. Вакцинируют детей и взрослых перед выездом в эндемичные районы (Южная Африка), где заболевание вновь прибывших протекает очень тяжело и с высокой летальностью.
1.1.4.2. Киасанурская лесная болезнь
Киасанурская лесная болезнь (КЛБ) - острая вирусная зоонозная инфекция человека, протекающая с выраженной интоксикацией, часто с двухфазной лихорадкой, сопровождается выраженным геморрагическим синдромом, длительными астеническими проявлениями.
КЛБ была впервые выделена в отдельную нозологическую форму в
лю, но также к семейству Flaviviridae. По своим антигенным свойствам вирус КЛБ сходен с вирусом Омской геморрагической лихорадки.
Эпидемиология. Вспышки КЛБ регистрируются только в штате Картанака по нескольку десятков случаев ежегодно. В то же время в последние годы установлено наличие специфических антител к КЛБ у диких животных и людей в отдаленном от штата Картанаки северозападном регионе Индии (вспышек КЛБ там не зарегистрировано). Эндемичные очаги расположены в области тропических лесов на горных склонах и долинах с буйной растительностью и большим распространением клещей, преимущественно Haemaphysalis spinigera (до 90% всех случаев заболевания), среди диких млекопитающих (обезьяны, свиньи, дикобразы), птиц, лесных грызунов (белок, крыс). Трансовариальной передачи вируса у клещей нет. Человек преимущественно заражается через нимф клеща. Вирус может длительно сохраняться (в сухом сезоне) в организме клеща. Домашний скот существенной роли в распространении инфекции не имеет.
Заражение человека происходит трансмиссивным путем во время деятельности человека (охотники, земледельцы и др.) в лесах эндемичной области; в основном заболевают мужчины.
Патогенез сходен с патогенезом многих геморрагических лихорадок, у человека мало изучен. В экспериментальных моделях установлено, что наблюдается длительная циркуляция вируса у с 1-2-го дня болезни до 12-14-го дня с пиком между 4-м и 7-м днями болезни. Наблюдается генерализованная диссеминация вируса, поражение различных органов: печени (участки преимущественно центрального некроза долек), почек (поражение с некрозами гломерулярного и тубулярного отделов). Значительно усилен апоптоз различных клеток эритроцитарного и лейкоцитарного ростков. Отмечаются значительные очаги поражения эндотелия различных органов (кишечника, печени, почек, головного мозга легких). В легких может развиваться интерстициальное воспаление перибронхиального дерева с геморрагическим компонентом. Отмечаются воспалительные процессы в синусах селезенки с повышенным лизисом эритроцитов (эритрофагоцитоз). Возможно развитие миокардита, энцефалита, схожего с Омской геморрагической лихорадкой и геморрагической лихорадкой долины Рифт.
Клиническая картина. Инкубационный период длится от 3-х до 8 дней. Заболевание начинается остро - с высокой температуры, озноба, головной боли, выраженных миалгий, приводящих к изнеможению больных. Могут наблюдаться боли в глазах, рвота, диарея, боли в животе, гиперестезии. При осмотре отмечается гиперемия лица, конъюнктивит, часто
имеется генерализованная лимфаденопатия (возможно увеличение лимфоузлов только головы и шеи).
Более чем в 50% случаев заболевание сопровождает клиника пневмонии с летальностью от 10 до 33% случаев. Геморрагический синдром сопровождается развитием кровотечений из слизистых полости рта (десны), носа, желудочно-кишечного тракта. В 50% случаев отмечает- ся увеличение печени, редко развивается желтуха. Часто определяется замедленный пульс (AV-блокада). Могут наблюдаться менингизм и менингит (умеренно выраженный моноцитарный плеоцитоз). Развитие судорожного синдрома, часто сопровождающегося развитием геморрагического отека легких, является неблагоприятным прогнозом. Иногда могут наблюдаться признаки энцефалита.
В 15% случаев через несколько дней температура нормализуется, а через 7-21 день вновь повышается, и возвращаются все признаки заболевания. Риск развития осложнений при повторном повышении температуры значительно выше, а прогноз неблагоприятен.
Период реконвалесценции может длиться от несколько недель до месяцев - у больных отмечаются слабость, адинамия, головная боль.
Лабораторная диагностика. В периферической крови выявляются лейкопения, тромбоцитопения, анемия. Может наблюдаться повышение АЛТ и АСТ. Парные сыворотки в ИФА и РПГА демонстрируют увеличение титра в 4 раза, также при диагностике используют реакцию нейтрализации антител и РСК. Возможны перекрестные реакции с другими вирусами из этой группы. Используются вирусологические исследования, разработана ПЦР-диагностика.
Лечение. Специфической терапии нет. Проводится патогенентичес- кая терапия (как и при других геморрагических лихорадках). Разработана специфическая вакцина (инактивированная формалином) для профилактики, но использование ее ограничено.
1.1.4.3. Лихорадка денге
Доброкачественная форма лихорадки денге (ЛД) - острая вирусная инфекция человека с трансмиссивным механизмом передачи, клинически характеризуется лихорадкой (часто бифазной), миалгией, артралгией, экзантемой, лейкопенией, лимфаденопатией. Геморрагическая лихорадка денге (ГЛД) (Филиппинская, Тайская, Сингапурская геморрагическая лихорадка; острая инфекционная тромбоцитопеническая пурпура, лихорадка «жирафов», костоломная лихорадка) - тяжелое, часто фатальное инфекционное заболевание, вызванное повторным инфицированием вирусами денге, характеризуется выраженным интоксикационным и
геморрагическим синдромами, развитием ДВС-синдрома, токсического шока.
Вирусную этиологию лихорадки денге и механизм ее передачи комарами установили П.М. Ашберн и Ч.Ф. Крейг в
Выделено 4 серотипа вируса, отличающихся по антигенному составу. Наиболее чувствительны к вирусу новорожденные белые мыши, однако вирус быстро адаптируется к их организму и становится малопатогенным для человека.
Краткие исторические сведения. Заболевание
известно достаточно давно. В соответствии с основным
симптомокомплексом болезнь называли «костоломной лихорадкой». Понятие о
геморрагической лихорадке денге утвердилось лишь в
Эпидемиология. Резервуар и источники инфекции - больной человек. Кроме того, возможными хозяевами инфекции являются обезьяны. Человек становится заразным в последние часы (6-18 часов) инкубационного периода и в течение трех первых дней заболевания, в отсутствии переносчиков он не представляет опасности для окружающих.
Механизм передачи - трансмиссивный. Основные переносчики - комары Aedes aegypti и A. albopictus; вирус также могут передавать комары родов Anopheles и Culex. Насосавшийся инфицированной крови комар способен передавать вирус с 4-18-го дня и пожизненно (1-3 мес). Трансовариально возбудитель не передается. Попавший с кровью в организм комара вирус размножается, накапливается и попадает в слюнные железы комара, что обеспечивает передачу вируса при очередном кро- вососании.
Естественная восприимчивость людей - высокая, чаще болеют дети и лица, приехавшие в эндемичные районы. Постинфекционный иммунитет типоспецифичный, стойкий и длится несколько лет. Повторные заболевания возможны по истечении этого времени или при инфициро-
вании вирусом иного типа. В мире ежегодно наблюдается около 250 млн случаев ГЛД, из них более 25 тыс. заканчиваются летально. Около 2,5 млрд населения Земли живет в эндемичных регионах. ГЛД регистрируется только в тех тропических регионах мира, где циркулируют несколько серотипов вируса (1-4), или происходит последовательный занос различных серотипов вируса. В настоящее время неблагополучная эпидемиологическая ситуация сложилась практически на всей территории тропиков в Южной Америке и Азии.
Повторные инфекции могут протекать и легко. Дети имеют более высокий риск развития ГЛД, чем взрослое коренное население эндемичных регионов. У новорожденных от иммунных матерей первичная инфекция вирусом денге может протекать как геморрагическая лихорадка.
Патогенез. Патогенез не достаточно изучен, но проведенные эпи- демиологические исследования позволяют предполагать ведущее значение в развитии ГЛД последовательное инфицирование различными серотипами вирусов денге.
При повторной инфекции наблюдается значительная вирусемия, что и определяет выраженность клинических проявлений заболевания (особенно у новорожденных и детей в течение первых двух лет жизни). В развитии повторной инфекции происходит значительная активация системы комплемента, значительный выброс ФНО, интерферона-g, интрелейкина-2, что приводит к выраженным нарушениям функции эндотелия, преимущественно посткапиллярного русла. Происходит активация как плазменного звена гемостаза, так и фибринолиза. В патогенезе развития геморрагического синдрома при ГЛД играет комплекс факторов - ДВС-синдром, нарушение функции печени и тромбоцито- пения. Характерно развитие гиповолемии, гемоконцентрации, ацидоза, гипонатриемии. При аутопсии вирус редко изолируется из различных тканей.
Клиническая картина. Инкубационный период составляет 1-7 дней. Начало заболевания острое, резко выражены симптомы интоксикации, отмечается высокая температура, сопровождающаяся головной болью (в области лба, ретроорбитальная); иногда боли в пояснице и миалгии предшествуют повышению температуры. У маленьких детей заболевание может протекать в первые дни с явлениями фарингита, ринита, уме- ренного кашля.
В течение первых 2-х дней заболевания характерно появление папулезной сыпи, не захватывающей подошвы и ладони. Часто наблюдается относительная брадикардия. Выраженность миалгий и артралгий харак-
теризует тяжесть течения ЛД. Интоксикационный синдром сопровождается рвотой, анорексией, генерализованной лимфаденопатией.
При доброкачественном течении лихорадки денге (ЛД) со снижением проявлений интоксикации сыпь исчезает через 2-3 дня, возможна десквамация. Через несколько дней температура может повыситься вновь с появлением новой волны высыпаний. Через 3-4 дня в крови выявляется панцитопения до 2000 в мкм. Нейтропения сохраняется длительно в периоде реконвалесценции. При течении ЛД гемостазиологические показатели (время кровотечения, протромбиновый индекс, уровень фибриногена) остаются в пределах нормы, уровень тромбоцитов редко опускается ниже 100 000 в мкм. На ЭКГ регистрируются синусовая брадикардия, снижение зубца Т, увеличение интервала P-R.
При геморрагической лихорадке денге (ГЛД) на 2-5-й день болезни часто бывает значительное ухудшение состояния, сопровождающееся увеличением температуры, рвотой, сильной головной болью. При этом характерны эмоциональная лабильность, повышенное потоотделение, возможен кашель.
Геморрагический синдром вначале проявляется появлением петехий на лбу, конечностях, вокруг рта, затем появляются кровоизлияния в местах инъекций, развивается периферический цианоз (акроцианоз). Учащается дыхание, снижается АД, пульс становится нитевидным, значительно увеличивается печень. В 20-30% случаев развивается токсический шок, у 10% больных с ГЛД возможно развитие желудочно-кишечных и других кровотечений. При адекватной терапии в течение 24-36 часов наступает улучшение самочувствия, но сохраняются брадикардия, аритмия.
Наиболее характерные изменения показателей гемостаза, наблюдаемые при ГЛД, это - гемоконцентрация, тромбоцитопения, уменьшение уровня фибриногена, увеличение ПДФ, снижение протромбинового индекса (до 40%). Часто отмечаются декомпенсированный метаболический ацидоз с гипонатриемией, гипохлоремией, увеличение уровня трансаминаз и мочевины, гипоальбуминемия. На рентгенограмме практически всегда определяются признаки двустороннего плеврита (чаще слева). При ГЛД имеется положительный тест со жгутом, турникет-тест.
Для проведения турникет-теста вначале у больного определяется АД, затем накачивается манжета тонометра до величины среднего давления между систолическим и диастолическим и оставляется на 5 минут. Далее в области локтевого сгиба на площади в 1 кв. см определяется количество петехий. Тест считается положительным при наличии > 3 петехий.
Диагностика. Диагноз базируется на данных эпидемиологического анамнеза, а также на критериях ВОЗ, характерных для ГЛД:
- интоксикационный синдром (лихорадка и др.);
- наличие геморрагического синдрома;
- тромбоцитопения (меньше 100 000 в мкл);
- увеличение гемотокрита на 20% и более;
- плеврит (подтвержденный на рентгенограмме) или гипоальбуминемия.
При сочетании характерных для ГЛД критериев и артериальной гипотензии со снижением пульсового давления на
Лабораторная диагностика. Проводятся вирусологические исследования (выделение вируса из крови). Используются различные серологические реакции - РНГА, РСК, ИФА. При первичной денге характерно преобладание в серологических реакциях антител IgM-класса (сохраняются в течение 6-12 недель). При повторной инфекции диагноз подтверждается черехкратным увеличением антител в парных сыворотках, при этом большинство антител представлено IgG. Для определения РНК-возбудителей используется ПЦР.
Дифференциальный диагноз. В остром периоде заболевания его необходимо дифференцировать от гриппа, лептоспироза, вирусных гепатитов, малярии, желтой лихорадки. Проводят также дифференциальный диагноз с вирусными инфекциями, протекающими с артралгиями: лихорадкой чикунгунья (эндемичные регионы - Африка, Индия, Юго-Восточная Азия), лихорадкой Западного Нила (Америка, Европа, Африка, Индия, Ближний Восток), лихорадкой О-Ньонг-Ньонг (Западная Африка), карельской лихорадкой (Северная Европа).
Лечение. При доброкачественной форме лихорадки денге рекомен- дуют постельный режим на протяжении всего лихорадочного периода. Используют жаропонижающие препараты (аспирин противопоказан!), при выраженных артларгиях назначают аналгетики. Проводят дезинтоксикационную терапию: обычно ограничиваются обильным питьем, реже проводят парентеральную дезинтоксикационную терапию.
При развитии геморрагической формы ЛД активность лечебных мероприятий определяется выраженностью клинических проявлений интоксикационного и геморрагического синдромов, проявлений гемо- концентрации, дегидратации и нарушений КЩС. Очень важна своевременность проводимой терапии, особенно в течение первых 48 часов с момента развития геморрагических проявлений, явлений септического шока. Парентерально назначают полиионные растворы (Рингер-лактат, трисоль и др.), физиологический раствор, 5% раствор глюкозы, тромбоцитарную массу, свежезамороженную плазму, коллоидные растворы (при снижении гематокрита), проводят оскигенотерапию. Эффективность
вазопрессорых препаратов и кортикостероидов не доказана. В лечении ДВС-синдрома используют гепарин (в зависимости от лабораторных показателей), в последние годы установлена эффективность препаратов, содержащих активированный протеин С.
Прогноз ЛД обычно благоприятный. При неадекватном лечении ГЛД и развитии токсического шока летальность достигает 40%, при своевременной и адекватной терапии летальность не превышает 1%.
Профилактика. Специфическая профилактика не разработана. Проводят уничтожение комаров и мест их выплода, защиту от них помещений, используют индивидуальные средства защиты.
1.1.5. Семейство Togaviridae 1.1.5.1. Лихорадка Чикунгунья
Острая трансмиссивная болезнь, характеризующаяся лихорадкой, интоксикацией и геморрагическим синдромом.
Заболевание впервые описано в Танзании в 1952-1953 гг. Затем его зарегистрировали в Заире, Замбии, ЮАР, Анголе, Таиланде, Бирме, Сингапуре и Индии. Выделенные в Азии штаммы вируса мало отличаются от африканских изолятов, но заболевания, вызванные азиатскими вариантами, не сопровождаются геморрагическими проявлениями.
Этиология. Возбудитель является РНК-геномным вирусом рода Alphavirus из семейства Togaviridae, выделен из крови больных, от комаров Aedes aegypti, A. africanus и Culex fatigans, постельных клопов (оби- тающих в хижинах больных) и летучих мышей. Вирус малоустойчив во внешней среде, разрушается под воздействием ультрафиолетовых лучей, термолабилен и чувствителен к дезинфектантам.
Эпидемиология. Резервуар и источники инфекции - больной человек в течение 4-10 первых дней болезни, обезьяны-вирусоносители и, возможно, летучие мыши, грызуны и дикие птицы.
Механизм передачи возбудителя - трансмиссивный, переносчики вируса в Африке - комары A. aegypti и A. аfricanus, в городских районах Индии и Юго-Восточной Азии - A. аegypti. Данные о прямой передаче инфекции от человека к человеку отсутствуют.
Естественная восприимчивость людей не установлена. Продолжительность и напряженность постинфекционного иммунитета не изучены.
Основные эпидемиологические признаки. Четко выраженная природноочаговая болезнь распространена почти на всей территории тропической Азии, ряде стран Африки (Заир, Замбия, ЮАР, Ангола), в некоторых странах Карибского бассейна. Заболевание встречается исключительно
среди местных жителей и крайне редко у приезжих. Большинство случаев заболевания регистрируют у молодых людей и подростков. Вспышки, как правило, возникают в сезон дождей в районах с высоким выплодом комаров A. aegypti. Кроме городских и пригородных вспышек в ряде стран отмечают также джунглевый тип заболеваний, связанный с комарами, питающихся кровью обезьян.
Патогенез. Патогенетические механизмы сходны с другими геморра- гическими лихорадками.
Клиническая картина. Напоминает лихорадку денге, но заболевание протекает значительно легче. Инкубационный период составляет 3-12 дней. Начало заболевания сопровождают сильные артралгии и боли в позвоночнике, обездвиживающие больного. Согнутые положения в суставах несколько облегчают боли. Среди других симптомов отмечаются незначительная головная боль, анорексия, запоры. Лихорадка двухволновая: волны по нескольку дней разделены периодом апирексии в 1-3 дня. На туловище и разгибательной поверхности конечностей возникает макуло-папулезная сыпь, сопровождающаяся зудом. В.И. Покровский подчеркивает, что никаких геморрагических проявлений при ГЛЧ не бывает, их наличие исключает возможность ГЛЧ.
Через 6-10 дней состояние больных нормализуется. Летальные исходы не зарегистрированы.
Дифференциальная диагностика. При сходных клинических признаках с геморрагической лихорадкой денге заболевание отличают боли в суставах и позвоночнике, приводящие к обездвиженности больного, и отсутствие геморрагических проявлений.
Дифференциальная диагностика проводится с другими геморрагическими лихорадками.
Лабораторная диагностика основана на серологических и вирусологических исследованиях.
Лечение аналогично таковому при лихорадке денге.
Профилактика. Включает борьбу с комарами и меры индивидуальной защиты от них. Средства специфической профилактики не разработаны.
1.2. Вирусные гепатиты 1.2.1. Вирусный гепатит А
Синонимы - эпидемический гепатит, инфекционная желтуха, болезнь Боткина.
Вирусный гепатит А - острое циклическое инфекционное заболевание с фекально-оральным путем передачи, протекающее у большинства больных в легкой безжелтушной форме, характеризующееся синдромом интоксикации, поражением печени и, как правило, заканчивающееся полным выздоровлением при отсутствии хронизации процесса и хронического носительства.
Краткая историческая справка. Вирус гепатита А был идентифицирован в
Этиология. Вирус гепатита А (HAV) представляет собой РНК-содер- жащие сферические частицы от 27 до 32 нм в диаметре, имеющие сложную пространственную конфигурацию в виде икосаэдра и лишенные оболочки. Вирус отнесен к семейству Picornaviridae. До настоящего времени известен только один серотип этого вируса, который включает в себя 9 генотипов, обладающих перекрестным иммунным действием, но отличающихся географическим распространением.
HAV относительно устойчив к факторам окружающей среды: сохраняет свою патогенность в течение 3-х месяцев в пресной и морской воде. Полностью инактивируется при нагревании до 75 ?С в течение 20 мин, а при нагревании до 85 ?С - за 1 мин, но при температуре 60 ?С сохраняет свою патогенность в течении 4 часов. Алкоголь, эфир, хлороформ так же, как и кислоты, не инактивирует вирус, и особенно он устойчив к низким температурам, сохраняя свою инфекционность даже при охлаждении до -70 "С. Дезинфицирующие средства достаточно эффективны: раствор формалина инактивирует вирус при 37 ?С за 2 часа, хлорамин в концентрации 2,0 мг/л инактивирует вирус за 15 мин, раствор перманганата калия, 3% формалин, йодистые соединения, ультрафиолетовое облучение поверхностей устраняют инфекционность за 5 мин.
Эпидемиология. Гепатит А как инфекционное заболевание распространен повсеместно. Высокая заболеваемость гепатитом А характерна для регионов с неудовлетворительным санитарно-гигиеническим состоянием окружающей среды, плохим водоснабжением и фекальным загрязнением объектов окружающей среды. Простое хлорирование питьевой воды практически предупреждает распространение этого заболевания.
Посттранфузионный гепатит А встречается чрезвычайно редко и описан при переливаниях крови и плазмы от донора, находившегося в инкубационном периоде. Вирус гепатита А может быть выявлен в сыво-
ротке крови больных уже в инкубационном периоде заболевания методом ПЦР. HAV выявляется в фекалиях за 7-11 дней до появления клинических симптомов заболевания и сохраняется у 50% больных к концу 1-й недели заболевания, у 29% - на 2-й неделе заболевания, только у 4% - на 3-й неделе. При затяжном, рецидивирующем течении вирус гепатита А может быть выявлен в фекалиях методом ПЦР в течение 3-х месяцев. Установлено, что при появлении в сыворотке крови anti-HAV виремия исчезает, но с фекалиями вирус может выделяться в окружающую среду еще какое-то время.
После перенесенного гепатита А сохраняется пожизненный иммунитет. В настоящее время разработана и выпускается в промышленных масштабах инактивированная вакцина из вируса гепатита А, который выращен в культуре тканей. У привитых развивается стойкий активный иммунный ответ, и невосприимчивость к вирусу сохраняется до 10 лет.
Патогенез вирусного гепатита А еще до недавнего времени считался вполне изученным, но начиная с 90-х годов ХХ в. стали появляться данные о том, что предполагаемые патогенетические механизмы, лежащие в основе клинических проявлений при вирусном гепатите А, не объясняют некоторых особенностей, присущих данной нозологической форме. Было выявлено отсутствие прямого цитопатического действия вируса на гепатоциты. В соответствии с современными представлениями патогенез вирусного гепатита А выглядит следующим образом:
- вирус гепатита А попадает в организм человека энтерально, первоначально накапливаясь в эпителиальных клетках ЖКТ, затем проникает в лимфоидные узлы входных ворот (лимфоидное глоточное кольцо, мезентериальные узлы кишечника), где и происходит первичная презентация вируса иммунокомпетентным клеткам;
- затем вирус быстро проникает в кровь (первичная вирусемия) и накапливается в гепатоцитах, где он реплицирует и высвобождается в желчь без разрушения печеночных клеток, а также в кровоток, т.е. возникает вторичная вирусемия;
- вторичное попадание вируса в кровь приводит к взаимодействию его антигенов с иммунокомпетентными клетками в месте входных ворот, где в результате предшествующей сенсибилизации и развиваются реакции гиперчувствительности замедленного типа; клинически это выражается катаральными проявлениями в ротоглотке и слизистой ЖКТ, температурной реакцией и диспепсическими проявлениями и знаменует окончание инкубационного периода и начало дожелтушного периода;
- вирус не оказывает прямого цитопатического действия, а разрушение гепатоцитов с выбросом аминотрансфераз (АЛТ, АСТ) происходит в результате Т-клеточного иммунного ответа; в случае разрушения более 70% гепатоцитов возникают выраженные нарушения пигментного обмена (гипербилирубинемия), что соответствует появлению у больного желтушного синдрома; аnti-HAV IgM выявляются в крови уже в конце инкубационного периода в соответствии с презентацией вируса иммунокомпетентным клеткам на раннем этапе инфекционного процесса; в результате этого вирус быстро исчезает из крови, но с фекалиями может выделяться еще некоторое время;
- anti-HAV в сыворотке крови появляются после исчезновения из нее вируса, что практически соответствует завершению дожел- тушного периода и разгару заболевания с последующей регенерацией гепатоцитов и восстановлению функции печени;
- хроническое носительство HAV не выявлено. Патогистологически ВГА характеризуется некрозом паренхиматозных клеток и перипортальной гистиоцитарной воспалительной инфильтрацией. Одновременно выявляется большое количество гепатоцитов, находящихся на разных стадиях некротических и дегенеративных изменений, но структура печеночной клетки в основном сохраняется.
Дегенерировавшие гепатоциты мигрируют через межклеточные пространства в синусоиды, где поглощаются Купфферовскими клет- ками. Повреждение желчных канальцев ведет к застою желчи и отеку. Воспалительные инфильтраты состоят преимущественно из лимфоцитов с незначительной примесью нейтрофилов, эозинофилов и плазматических клеток. В тяжелых случаях отмечаются обширные сливные некрозы с нарушением структуры печеночных долек на фоне минимальной выраженности регенеративных процессов.
Клиническая картина. Клинические проявления ВГА могут варьировать по интенсивности от инаппарантного течения до желтушных форм различной степени тяжести. В различных возрастных группах течение заболевания имеет свои особенности: у детей до 5 лет желтушные формы составляют 10%, а у лиц после 40 лет - 50-70%.
Инкубационный период составляет от 2-х до 6 недель. В большинстве случаев ВГА протекает в инаппарантной форме, особенно у детей, под видом гастроэнтерита с незначительными катаральными проявлениями без последующего развития желтухи. У взрослых заболевание протекает в легкой или среднетяжелой форме с проявлениями желтушного синдрома.
Дожелтушный (продромальный) период разнообразен по клиническим проявлениям. Заболевание начинается остро - с повышения температу- ры от субфебрильной до гиперпиретической - и сопровождается катаральными проявлениями. Одновременно больного может беспокоить дискомфорт в эпигастрии, снижение или отсутствие аппетита, тошнота, рвота, возможны астеновегетативные явления. В этот период уже обнаруживается гепатоспленомегалия и повышение уровня трансаминаз. Продолжительность этого периода составляет от 1-2-х дней до недели.
Приблизительно у 10-30% заболевших затем наступает желтушный период. Катаральные явления стихают, но сохраняются диспепсические проявления. Первым признаком наступления желтушного периода считается потемнение мочи у больного. Проявления желтушного синдрома могут быть различной выраженности: от незначительной желтушности слизистых до интенсивного прокрашивания кожных покровов и обесцвеченности стула. Печень при этом увеличена, чувствительна при пальпации, иногда выявляется спленомегалия. На фоне желтухи у больного в разгаре заболевания отмечается адинамия, диспепсия, иногда расстройства сна, характерны брадикардия и гипотония. Нормализация пигментного обмена и уровня трансаминаз происходит на протяжении 1-3-х месяцев.
Иногда ВГА может протекать в острой холестатической форме на протяжении нескольких месяцев, причем в этом случае экскреция вируса может продолжаться до разрешения желтухи, что подтверждается выявлением HAV RNA в сыворотке крови.
Очень редко гепатит А принимает рецидивирующее течение, причем рецидивы по клинической картине соответствуют первичным проявлениям заболевания и характеризуются гипербилирубинемией и гиперферментемией, а в кале обнаруживается вирус гепатита А. Рецидивы протекают хоть и длительно, иногда до нескольких месяцев, но всегда заканчиваются выздоровлением.
Очень редко вирусный гепатит А может осложняться массивным некрозом печеночной ткани с развитием фульминантного гепатита (менее 1% случаев).
В настоящее время отсутствуют доказательства возможности существования хронического гепатита А и носительства HAV.
Дифференциальная диагностика. В дожелтушный период болезни необходимо дифференцировать гепатит А от кишечных и респираторных инфекций. В желтушный период ВГА дифференцируют от вирусных гепатитов другой этиологии на основании клинико-эпидемиологических данных и выявления серологических маркеров. Дифференциальный
диагноз проводят также с подпеченочными и гемолитическими желтухами, мононуклеозом, лептоспирозом, иерсиниозом, геморрагической лихорадкой, манифестацией аутоиммунных заболеваний печени, лекарственным гепатитом, стеатогепатитом.
Лабораторная диагностика. Для верификации диагноза вирусного гепатита А используют выявление anti-HAV IgM в сыворотке крови в дожелтушный и в желтушный периоды методами ИФА и РИА. Антитела сохраняются на протяжении 2-6 мес и являются единственными достоверными маркерами острого периода заболевания. Имеющиеся в настоящее время тест-системы для ПЦР диагностики HAV в сыворотке крови не получили пока широкого распространения. Anti-HAV IgG появляются в сыворотке после исчезновения из нее вируса, их титр быстро нарастает в течение нескольких месяцев и сохраняется пожизненно, предохраняя от повторного заражения. Вирус гепатита А можно выделить из фекалий как методом ПЦР, так и специальными вирусологическими методами. Широкого распространения эти методы пока также не получили.
Для оценки интенсивности желтухи обязательно определяют уровень билирубина, а для оценки интенсивности цитолиза гепатоцитов - активность аспарагиновой и аланиновой трансаминаз (АСТ и АЛТ). Нарушения белково-синтетической функции печени отражают показатели коллоидных проб (снижение сулемовой и повышение тимоловой проб), уменьшение уровня альбумина в крови и падение протромбинового индекса.
Прогноз. Длительность желтушной формы гепатита А не превышает 3 месяцев, за исключением редких холестатических вариантов заболевания (до 6 и даже 18 месяцев у 2-3% пациентов) и заканчивается выздоровлением, однако могут наблюдаться воспалительные процессы в желчных путях (холециститы, холангиты, дискинезии), манифестация аутоиммунного гепатита, очень редко - постнекротический фиброз. Фульминантный гепатит А очень редок и составляет 0,01%, но в связи с большой распространенностью общий вклад вирусных гепатитов в летальность составляет 1%.
Лечение. При подтверждении диагноза вирусного гепатита А больной может лечиться амбулаторно: назначают постельный режим, обильное питье, а при выраженном интоксикационном синдроме - инфузионную терапию. Из рациона исключаются тугоплавкие жиры, предпочтение отдается кисломолочным продуктам. При холестатической форме ВГА показано назначение препаратов урсодезоксихолевой кислоты, лактулозы, холестерамина. Противовирусная терапия не разработана.
Рекомендации по последующему диспансерному наблюдению.
Больные, перенесшие вирусный гепатит А, подлежат диспансерному наблюдению до 3-х месяцев, на протяжении которых рекомендуется соблюдение диеты (стол ? 5 по Певзнеру) и ограничение физической нагрузки. Снятие с учета предусматривает контрольное исследование сыворотки крови на печеночные пробы, УЗИ гепатобилиарной зоны.
Профилактика. В настоящее время для специфической профилактики предложена инактивированная вакцина против вирусного гепатита А, причем защитный титр антител выявляется уже на 7-е сутки от вакцинации, что позволило отказаться от иммуноглобулинопрофилактики. Вакцинация проводится внутримышечно двукратно, в дозе 0,5 мл детям от 2 до 18 лет и 1,0 мл - лицам старше 18 лет с интервалом в 6 месяцев. Иммунитет сохраняется до 10 лет. Показанием к введению иммуноглобулина является непереносимость компонентов вакцины, неблагоприятный аллергологический анамнез. Неспецифическую профилактику проводят по общим принципам профилактики кишечных инфекций.
1.2.2. Вирусный гепатит В
Синонимы: сывороточный гепатит; гепатит, передающийся парентеральным путем.
Гепатит В (ГВ) - широко распространенное инфекционное заболевание, вызываемое ДНК-содержащим вирусом, протекающее с преимущественным поражением печени, отличающееся многообразием клинических проявлений и исходов.
Краткая историческая справка. В
Термин «гепатит В» утвержден научной группой экспертов ВОЗ в
Этиология. Вирус гепатита В (ВГВ) представляет собой частицу сфе- рической формы диаметром 42 нм, которая состоит из ядра (нуклеоида), внутри которого находится двухцепочная ДНК и фермент ДНК-полимераза. Нуклеоид получил название НВсAg, и в его состав входит НВеАg.
Наружную оболочку вируса образует поверхностный антиген гепатита В - НВsAg. Вирус гепатита В уникален, т.к. его геном образован двухцепочной кольцевой ДНК, причем наружная минус-цепь длиннее внутренней плюс-цепи на 15-45% у различных изолятов вируса. В геноме ВГВ идентифицировано 4 гена (S, C, P, Х).
Ген Р ответственен за синтез фермента - РНК-зависимой ДНКполимеразы. Ген S кодирует синтез белков оболочки вируса - HBsAg, которые отвечают за прикрепление вируса к гепатоциту. Ген С кодирует синтез ядерного антигена - НВсAg. Ген Х ответственен за синтез белка, который активирует экспрессию всех генов вируса гепатита В.
С помощью электронной микроскопии установлено, что имеются две формы вируса: это полные частицы, содержащие ДНК ВГВ, и неполные частицы, содержащие только НВsAg без ДНК. Вирус очень устойчив по отношению к факторам окружающей среды. Он сохраняет свою инфекционность при -30 ?С в течение 6 мес, при -20 ?С - 15 лет; прогревание до +60 ?С разрушает его за 4 часа, при нагревании до 98 ?С происходит полное разрушение через 20 мин; обработка сухим жаром (+160 ?С) разрушает вирус в течение часа. В условиях комнатной температуры вирус сохраняется в среднем в течение 1 месяца, в холо- дильнике - 6 месяцев, в замороженном виде - до 20 лет, в высушенной плазме - 25 лет. Вирус противостоит действию практически всех дезинфицирующих средств и консервантов крови. Так, в 1-2% растворе хлорамина инактивация наступает через 2 часа. Вирус устойчив к лиофилизации, воздействию эфира, ультрафиолетовому облучению. Кипячение обеспечивает гарантированную инактивацию только при достаточной (не менее 30 мин) продолжительности. Автоклавирование при температуре 120 ?С позволяет подавить активность вируса через 5 минут, сухожаровое воздействие (160 ?С) - только через 1 час. Частицы ВГВ чувствительны к эфиру и неионным детергентам, которые разрушают внешнюю оболочку вириона; 3% хлорамин разрушает вирус только через 6 часов.
Неоднократные попытки культивирования вируса в культуре тканей не дали положительных результатов. В экспериментальных условиях ВГВ способен размножаться в организме человекообразных и некоторых низших обезьян, воспроизводя клинико-морфологические изменения, характерные для гепатита В у человека.
Эпидемиология. Гепатит В - антропонозная инфекция, распространенная повсеместно. Заболеваемость поддерживается стабильной циркуляцией НВV в человеческой популяции. Заражение гепатитом В происходит при попадании вируса в кровь, которое возможно различными
путями: при парентеральных вмешательствах или при гемотрансфузиях, через поврежденные слизистые оболочки и кожные покровы (при половых контактах, тесном бытовом контакте), а также через плаценту при вертикальном пути передачи. Источниками вируса являются больные всеми формами острого и хронического гепатита, а также лица с бессимптомными формами (инфицированные НВV, которые формируют вокруг себя очаги инфекции. Уже в инкубационном периоде у больных закономерно регистрируются в крови HВsAg и HВeAg, что подтверждает потенциальную эпидемиологическую опасность этих лиц.
Для заражения достаточно минимального количества материала, содержащего вирус гепатита В (10-9 мл крови). Восприимчивость к вирусу абсолютная во всех возрастных группах.
После перенесенного гепатита формируется стойкий постинфекционный иммунитет, случаи повторного заболевания не описаны. Специфическая профилактика хорошо разработана. В настоящее время создана высокоэффективная рекомбинантная вакцина, которая содержит очищенный поверхностный антиген гепатит В, полученный с помощью генно-инженерных методов. Трехкратное введение вакцины обеспечивает защитный уровень антител к вирусу у 95% вакцинированных в среднем на протяжении 5-7 лет.
Патогенез. В настоящее время установлено,что вирус гепатита В не обладает прямым цитопатическим действием, а поражение гепатоцитов опосредуется антивирусным клеточным иммунным ответом.
При попадании HBV в кровь он достигает печени в среднем через 48 час. Наружная оболочка вируса представлена HBsAg, причем белки, входящие в состав этого антигена, ответственны за прикрепление и про- никновение вируса в гепатоциты. Схематично воспроизводство вируса гепатита В в клетках печени происходит следующим образом:
- нуклеокапсид ВГВ проникает в ядро гепатоцита, где с помощью ДНК-зависимой РНК полимеразы синтезируется РНК преге- ном вируса;
- затем этот прегеном вместе с ДНК-полимеразой (ревертазой) «упаковывается» в капсид, который переходит в цитоплазму гепатоцита, где и происходит образование новой «минус»-цепи ДНК при транскрипции с прегенома;
- далее использованный прегеном разрушается, и так называемая «минус»- цепь ДНК служит матрицей для синтеза «плюс»- цепи ДНК, которая заключается в капсид и внешнюю оболочку, т.е. в HbsAg, синтезированный в цитоплазме гепатоцита, и уже сформированный новый вирион покидает клетку.
Описанный процесс воспроизводства вируса гепатита В получил названиерепликативной формы течения инфекции. Но в патогенезе ВГВ выделяют также интегративную форму, при которой происходит встраивание генома НВV в геном гепатоцита, в результате чего формируется хроническое инфицирование ВГВ. Следовательно, HBV не обладает цитотоксичностью, а эффект «избавления» от инфицированного гепатоцита является цитолитическим процессом, осуществляемым цитотоксическими Т-лимфоцитами и NK-клетками за счет распознавания ими на поверхности гепатоцита комплекса вирусных антигенов с МНС- 1, в результате чего и происходит лизис пораженных вирусом клеток. В настоящее время посредством электронной микроскопии представлены доказательства тесного контакта ЦТЛ с гепатоцитами и доказана их связь с антигенами МНС-1. Неспецифически сенсибилизированные против HBV ЦТЛ с помощью МНС-1 распознают представленный на поверхности гепатоцитов HBsAg, в то время как HBcAg и HBeAg представлены в мембранном и субмембранном пространствах гепатоцитов. Предполагается, что эффект разрушения ЦТЛ инфицированных НВV гепатоцитов опосредуется через выброс перфорина, активизацию синтеза TNF пораженной вирусом клетки и запуском процесса апоптоза. По-видимому, процессы некроза в печеночной ткани напрямую определяются экспрессией МНС-1 в комплексе с протеинами HBsAg c последующим уничтожением гепатоцита ЦТЛ. В то же время специфические Т-хелперные клетки, несущие на своей поверхности молекулы МНС-1 и также выявленные при НВV-инфекции в печени, считаются ответственными за координацию клеточного и гуморального иммунных ответов при гепатите В. Антителозависимая цитотоксичность, опосредованная активизацией макрофагального звена иммунитета, завершает процесс уничтожения инфицированных НВV клеток. Образующиеся в большом количестве в процессе распада гепатоцитов антигены связываются антителами (IgM, IgG-классов) с образованием иммунных комплексов. Но на первых этапах (в избытке антигена) ИК могут откладываться в стенках сосудов различного уровня, и уже опосредованно там развивается весь комплекс воспалительных реакций. Возможно, поэтому и клинические проявления реакции воспаления (лихорадка, диспепсия, астеновегета- тивные расстройства) выражены максимально в дожелтушный период ВГВ. Именно в этот период имеется избыток антигена при недостаточности антител, особенно IgG-класса, способных проникать в ткани организма, что ведет к снижению растворимости иммунных комплексов и оседанию их на эпителии сосудистой стенки. Предполагается, что повреждающее действие ИК обусловливает внепеченочные поражения при
ВГВ, например, гломерулонефрит, узелковый периартериит, сиалоденит и др. Активизация В-клеточного звена иммунитета приводит к формированию антительного ответа и к элиминации большого количества антигенов. В развитии патологического процесса при ВГВ значительную роль играют аутоиммунные реакции на собственные компоненты гепатоцитов (печеночно-специфический липопротеин, фрагменты мембран митохондрий и т.д.).
Следовательно, исход острого вирусного гепатита В зависит от иммунного ответа организма хозяина, состояние которого и определяет многообразие клинических форм, свойственных НВV-инфекции.
Патогистологические изменения при остром гепатите В затрагивают в основном печень. Все ацинусы печени вовлекаются в патологический процесс, характеризующийся очаговой гибелью клеток, ацидофиль- ным гепатоцеллюлярным некрозом и мононуклеарной воспалительной инфильтрацией. Гистологические признаки регенерации печеночной ткани обнаруживаются уже на ранней стадии болезни. Ретикулиновый остов в большинстве случаев сохраняется, но полное гистологическое восстановление возможно только в том случае, если некроз не захватывает полностью ацинусы. Иногда некрозы центральной или перипортальной зон печеночной дольки сливаются и образуют обширные «мос- товидные» некрозы. Воспалительные инфильтраты вокруг зон некрозов состоят из лимфоцитов, плазматических клеток, клеток макрофагального звена при отсутствии гранулоцитов. В очагах некроза происходит разрастание соединительной ткани, что неминуемо ведет к формированию фиброза. Повреждение и (или) смещение желчных канальцев приводит к отеку и застою желчи. Гистологически гепатит В можно диагносцировать по наличию «матовых» гепатоцитов (что обусловлено присутствием НВsAg в цитоплазме этих леток) с помощью специальных методов окрашивания или с использованием специальных иммунологических и вирусологических методов для выявления вирусных антигенов и НВV
ДHК.
Клиническая картина. Течение острого ВГВ у взрослых является более тяжелым, чем при гепатите А, однако общая клиническая картина при этих заболеваниях сходная.
Продолжительность инкубационного периода при ВГВ варьирует в широких пределах - от 45 дней до 6 месяцев, но чаще составляет 3-4 месяца.
Острый ВГВ может иметь циклическое и прогредиентное течение. Острый гепатит В циклического типа обычно развивается у лиц с адекватным, сбалансированным В- и Т-клеточным иммунным ответом,
сопровождается манифестной клинической симптоматикой и характеризуется последовательной сменой дожелтушного, желтушного и восстановительного периодов. Заболевание преимущественно протекает в среднетяжелой форме и заканчивается полным выздоровлением у 90% переболевших. У 10% лиц формируется хроническое гепатоцеллюлярное поражение с возможным переходом в цирроз печени.
Продолжительность дожелтушного периода составляет от 1-2 суток до недели. Заболевание начинается с ухудшения общего состояния, недомогания, слабости, быстрой утомляемости. Наблюдаются суставные боли, появляются уртикарные высыпания на коже, сопровождающиеся зудом. У многих больных развиваются диспепсические расстройства: ухудшение аппетита, снижение вкусового восприятия, тошнота, рвота.
Диагностически информативны жалобы «гепатогенной направленности»: горечь во рту, чувство тяжести и тупые боли в правом подреберье.
При клиническом исследовании отмечается прогрессирующее увеличение печени при ее мягкой консистенции. В дожелтушный период отмечается повышение уровня АЛТ, появляются специфические сероло- гические маркеры HBV инфекции - HВsAg, HВeAg и anti-НВс-IgM.
Первым признаком развития желтухи является потемнение мочи. В этот период в моче лабораторным путем определяется билирубин. Потемнение мочи может сочетаться с осветлением кала (что связано с ахолией). Желтуха при остром ВГВ обычно является выраженной у 35% больных (в 65% случаев она отсутствует). Общая продолжительность желтушного периода при среднетяжелом течении составляет 2-3 недели. Симптомы интоксикации (слабость, снижение аппетита, головные боли, нарушения сна, рвота) при ВГВ в отличие от гепатита А достигают наибольшей выраженности в желтушный период. У части больных, в основном при тяжелом течении ВГВ, отмечаются геморрагические проявления: кровоточивость десен, носовые кровотечения, микрогематурия, положительный «симптом щипка». Сывороточная активность трансаминаз (АЛТ и АСТ) всегда повышена, что указывает на цитолиз (лизис гепатоцитов).
Желтушный период соответствует активной фазе инфекционного процесса, что подтверждается выявлением антигенных маркеров - HBV-
ДНК, HBcAg, HBeAg и anti-HBc-IgM.
У 5-10% больных ВГВ отмечаются признаки выраженного холестаза: кожный зуд, субфебрильное повышение температуры в период желтухи. На холестаз указывает также затяжной характер желтушного периода. В сыворотке повышаются уровни щелочной фосфатазы и гамма-глютаминтрансферазы, а также общего билирубина.
Уже в инкубационном периоде у больных закономерно регистрируются в крови HВsAg и HВeAg, что подтверждает потенциальную эпидемиологическую опасность этих лиц.
Острый ВГВ характеризуется относительно быстрой нормализацией клинических и лабораторных данных, но иногда процесс затягивается до 4-х месяцев. Длительность восстановительного периода (или периода реконвалесценции) составляет 1,5-6 месяцев от начала болезни; реже этот период затягивается до года. Период реконвалесценции завершается появлением антител anti-HBs, anti-HBc и anti-HBe-IgG и полной нормализацией печеночных проб.
Фульминантное (молниеносное) течение ВГВ характеризуется стремительным (в течение нескольких часов или нескольких дней) развитием печеночной недостаточности и печеночной энцефалопатии. Признаком развития фульминантного ВГВ является резкое ухудшение состояния больного: развивается сильная слабость, усиливаются проявления диспепсического синдрома, появляется печеночный запах (foetor hepaticus). У большинства больных развивается геморрагический синдром - поверхностные кровоизлияния, кровоточивость десен, симптом «щипка». Желтуха при этом может как резко нарастать, так и отсутствовать. Рано развиваются признаки печеночной энцефалопатии: нарушается ориентировка во времени и окружающей обстановке, возникают периоды возбуждения, сменяющиеся апатией, развиваются выраженные когнитивные нарушения. Резкое ухудшение психического состояния больных может опережать другие клинические симптомы и являться первым признаком фульминантного гепатита. В наиболее тяжелых случаях при отсутствии адекватных лечебных мероприятий у больных развивается острая печеночная энцефалопатия. Смерть наступает в результате отека мозга, острой сердечно-сосудистой недостаточности, ДВС-синдрома, полиорганной недостаточности.
Фульминантное течение ВГВ в 80% случаев связано с присоединением HDV-инфекции.
Иногда ВГВ протекает в стертой форме, со скудной клинической симптоматикой, но при этом выявляется высокая репликативная активность HBV, что приводит к хронизации болезни.
Лабораторная диагностика. Для количественного определения вирусных частиц гепатита В применяют иммуноэлектронную микроскопию и определение ДНК-полимеразной активности. Наличие инфицированности ВГВ устанавливается также с помощью иммуноферментного и радиоиммунного анализа по выявлению соответствующих антигенных и антительных маркеров в ткани печени и сыворотке крови. Кроме того,
определенную роль в диагностике ВГВ играет пункционная биопсия печени (ПБП).
Наиболее значимы для диагностики ВГВ следующие маркеры HBV- инфекции:
1) HBsAg - появляется в сыворотке крови перед клинической манифестацией болезни, достигает максимальной концентрации в период, близкий к развертыванию клинических симптомов, и исчезает в фазе реконвалесценции;
2) HBcAg - обнаруживается в биоптатах печени (в ядрах гепатоцитов), но не в периферической крови, так как всегда окружен белком оболочки вируса);
3) HBeAg - при остром ВГВ обнаруживается в течение нескольких дней, иногда недель, косвенно указывая на наличие HBcAg в ткани печени; является показателем высокой контагиозности, вследствие чего получил название «антиген инфекционности»; его обнаружение в крови имеет большое диагностическое значение, так как свидетельствует о массивном размножении вируса;
4) Anti-HBc - появляется в период разгара клинических симптомов ВГВ; в сочетании с anti-HBs является признаком постинфекционного иммунитета;
5) Anti-HBc-IgM - главным образом выявляется в острый период заболевания; сохранение данного маркера более 6 месяцев указывает на высокую вероятность перехода ВГВ в хроническую форму (при остром гепатите обнаруживается в высоком титре, при хроническом - в низком);
6) Anti-HBe - обнаруживают в сыворотке крови у больных ВГВ по прошествии острого периода болезни, а также у хронических бессимптомных носителей HBV;
7) Anti-HBs - выявляется в период реконвалесценции; вместе с antiHBc свидетельствует о развитии иммунитета; изолированные anti-HBs выявляются у лиц, вакцинированных против ВГВ;
8) HBV-ДНК - обнаруживается методом ПЦР, приобретает все более возрастающее значение как маркер активной репликации вируса.
Особое значение для оценки состояния пациента и динамики заболевания имеют печеночные пробы (АЛТ, АСТ, общий билирубин, фракции билирубина, белки и белковые фракции, протромбиновый индекс), общий анализ крови и мочи.
Дифференциальная диагностика (см. в разделе вирусный гепатит А).
Лечение. Больных с остроциклическим течением гепатита В госпитализируют. При легком и среднетяжелом течении заболевания при выра-
женных симптомах интоксикации проводится дезинтоксикационная терапия, включающая массивную инфузию коллоидных и кристаллоидных растворов в соотношении 1:3 под контролем диуреза, а также коррекция электролитного состава крови и кислотно-щелочного равновесия. Средством детоксикации является дисахарид лактулоза, способствующая связыванию и выведению азотосодержащих шлаков из кишечника (в избытке образующихся при нарушении желчеобразования) и снижению их поступления в кишечник при морфофункциональных нарушениях печени. Лактулоза также способствует нор- мализации биоценоза флоры кишечника, т.к. при гепатитах всегда наблюдается активизация условно-патогенной бактериальной микрофлоры. Использование гепатопротекторов при острых вирусных гепатитах ограничено, т.к. большинство из них направлено на активизацию микросомального аппарата гепатоцитов, который находится в состоянии субкомпенсации на фоне выраженных морфологических нару- шений в архитектонике печени, в связи с чем подобная стимуляция физиологически не оправдана.
Лечение больных с вирусным гепатитом, осложнившимся ОПЭ, обязательно проводится в условиях специализированного отделения интенсивной терапии и реанимации. Интенсивные лечебные мероприятия основаны на мониторинге печеночной недостаточности в соответствии с принципами лечения печеночной энцефалопатии.
Прогноз. Свыше 90% больных ВГВ выздоравливают, при этом в крови исчезает HbsAg, и обязательно должны выявляться anti-HBs. Хронизация отмечается у 5-10% лиц, перенесших ВГВ.
Диспансерное наблюдение. Больные после перенесенного гепатита В подлежат диспансерному наблюдению в течение 6 месяцев с определением биохимических печеночных проб и НВsAg через 1, 3 и 6 месяцев после выписки из стационара. После 6 месяцев по результатам биохимических и серологических исследований принимается решение о снятии больного с учета или дальнейшем его наблюдении уже как пациента с хроническим вирусным гепатитом В.
Профилактика. Неспецифическая профилактика гепатита В основана на применении одноразовых инструментов при всех врачебных манипуляциях, связанных с повреждением кожных покровов и слизистых, тщательной стерилизацией медицинского инструментария. Необходим строгий контроль при обследовании доноров с целью обнаружения вирусных антигенов. Для специфической профилактики гепатита В используют вакцины. Наиболее распространенной схемой вакцинации является 0-1-6, где «0» - первая прививка, «1» - прививка, проведенная
через 1 месяц после первой, и «6» - прививка, проведенная через 6 месяцев от первой.
Вакцинации подлежат:
- медицинские работники;
- выпускники медицинских вузов и техникумов;
- новорожденные, родившиеся от матерей-носителей HBs-анти- гена и женщин, переболевших гепатитом В в 3-м триместре беременности;
- дети и персонал детских домов;
- пациенты, находящиеся в отделениях с высоким риском заражения гепатитом В (например, отделения гемодиализа, гема- тологии);
- лица, контактировавшие с больными гепатитом В в очагах заболевания.
Во многих странах предусмотрено проведение плановых прививок детям первого года жизни. Для защиты детей, чьи матери инфицированы вирусом гепатита В, прививки обязательно должны проводиться в 1-й день жизни ребенка.
1.2.3. Вирусный гепатит С
Вирусный гепатит С (ВГС) - это широко распространенное инфекционное заболевание, вызываемое РНК-содержащим вирусом, с преимущественным поражением печени, острое течение которого характеризу- ется преобладанием стертых и субклинических форм с высокой частотой перехода в хроническое течение.
Историческая справка. До
недавних пор ВГС обозначался как «вирусный гепатит ни А, ни В с
парентеральным механизмом передачи». Это заболевание с «невыявленным»
возбудителем входило в триаду наиболее распространенных вирусных
гепатитов. Впервые возбудитель был идентифицирован M. Houghton и
сотрудниками в
Этиология. Возбудитель гепатита С (hepatitis C virus, HCV) представ- ляет собой сложно организованный мелкий (50-65 нм) вирус сферической формы с однонитчатой линейной РНК, принадлежащий к семейству флавивирусов (Flaviviridae), роду Hepacivirus. Капсид вируса построен по кубическому типу симметрии, содержит структурный белок сердцевины (core), НСс-антиген и неструктурные белки: NS2, NS3, NS4, NS5. Белки
NS2 - NS4 участвуют в процессинге NS-района синтезированного в результате трансляции вирусной РНК полипептида. Белок NS3 является бифункциональным белком, обладающим протеолитической и хеликазной активностью. NS5-белок - это РНК-зависимая РНК-полимераза. Капсид окружен липопротеиновой оболочкой с гликопротеиновыми шипами gp Е1 и gp E2/NS1, кодирующими поверхностные белки вируса.
Геном, представленный «+» цепью РНК, высокомутабелен. Особой гипермутабельностью обладает район, детерминирующий синтез гликопротеинов Е1 и Е2, обладающие В-эпитом, на которые вырабатыва- ются вируснейтрализующие антитела. Замена аминокислот в гликопротеинах изменяет антигенные свойства вируса, позволяя ему избегать нейтрализующего действия антител. Известно около 6 основных генотипов вируса. Наибольшее распространение имеют генотипы 1-3, наиболее вирулентным является генотип 1b.
Экспериментальной моделью заболевания является шимпанзе. Вирус трудно адаптируется к культивированию в клетках. HCV чувствителен к эфиру, детергентам, УФ-лучам, нагреванию до 50 оС, относительно нестабилен при хранении при комнатной температуре.
Геном детерминирует синтез структурных и неструктурных белков вируса. Ко всем белкам, включая гликопротеины оболочки, вырабатываются антитела, выявляемые в крови больных. Существование разных серотипов вируса определяется вариабельностью соотношения циркулирующих антител. Подобно другим флавивирусам, HCV при репликации образует иммунологически различающиеся антигенные варианты, которые обладают значительными возможностями адаптации и избегают иммунного надзора, что делает сложной разработку вакцины. Важной особенностью HCV является не только антигенная, но и генетическая неоднородность, обусловленная изменчивостью последовательности нуклеотидов с образованием различных генотипов и субтипов. Разные авторы выделяют от 4 до 30 генотипов HCV. Для клинической практики имеют значение 6 генотипов возбудителя ВГС: 1a, 1b, 2a, 2b, 3a и 4. Отдельные генотипы HCV различаются в преимущественном географическом распространении. Для Японии и некоторых других стран Дальнего Востока характерны генотип 1b (получивший название «японского генотипа» и обусловливающий относительно неблагоприятное течение ВГС, сопровождающееся высоким содержанием HCV-РНК в сыворотке крови, низкой эффективностью противовирусной терапии и высокой частотой осложнений), а также генотипы 2a и 2b. В Северной Америке преобладает генотип 1a («американский»). В различных странах Европы преимущественно регистрируются генотипы 1a и 1b. Для
стран Ближнего Востока и Северной Африки характерен «египетский» генотип 4 (характеризуется неблагоприятным течением и переходом в хронические формы у 80-85% больных). Примечательно, что перекрест- ного иммунитета разные штаммы не дают.
Генетическая неоднородность, высокая изменчивость и внепеченочная репликация HCV в недоступных для иммунного надзора местах (лимфатические узлы, селезенка, моноциты) способствуют длитель- ной персистенции вируса в организме, что является главной причиной высокой (50-80%) частоты перехода острого ВГС в хронические формы. Механизмы неэффективной элиминации вируса изучены недостаточно, основное значение придается его изменчивости.
Эпидемиология. В настоящее время в разных странах мира ВГС поражено не менее 200 млн человек. Распространенность заболевания в популяции колеблется от 0,5-1% (Северная Европа) до 4-10% (Африка, Ближний Восток, Восточная Европа).
ВГС является одной из основных причин развития хронического диффузного поражения печени и ГЦК. Цирроз печени, развившийся в исходе ВГС, является одним из наиболее частых показаний к трансплан- тации печени.
Заражение HCV в основном происходит парентеральным путем. Сюда относят инфицирование при переливании зараженной консервированной крови и ее продуктов (факторов свертывания, плазмы, аль- буминов и др.), а также многократное использование инъекционных канюль. Повышают риск передачи HCV процедуры гемодиализа, парентеральные инъекции, нарушение целостности кожи при акупунктуре, нанесении татуировок и пирсинг. Считается, что профессиональное заражение HCV в среде медицинских работников происходит реже, чем инфицирование вирусом гепатита В.
В результате введения обязательного тестирования всех переливаемых доз консервированной крови и ее продуктов удалось достичь уменьшения частоты посттрансфузионного гепатита С. Сохраняющийся минимальный риск заражения связан, главным образом, с наличием у донора острого периода инфекции, не диагностируемого с помощью скрининговых методов обнаружения антител к HCV.
Очень высока (70-90%) распространенность ВГС в популяции больных наркоманиями, что связано с нестерильным парентеральным введением наркотиков и представляет наибольшую опасность в распространении заболевания.
Роль половых контактов в передаче ВГС достаточно скромна: половым путем инфекция передается не более чем в 5% случаев (тогда как
при ВГВ эта величина достигает 30%). Риск передачи ВГС внутри семьи, члены которой не являются половыми партнерами, близок к нулю.
Вопрос вертикального заражения HCV (от инфицированной матери к плоду) изучен не до конца. Трансплацентарный путь заражения не имеет существенного значения (однако риск заражения значительно возрастает при ассоциации ВГС и ВИЧ-инфекции). Вместе с тем необходимо принимать во внимание, что возможность заражения значительно возрастает в родах, что обусловлено нарушением целостности слизистых родовых путей инфицированной матери.
Патогенез. Патогенез вирусного гепатита С детально не изучен, хотя многие его звенья достаточно хорошо исследованы. В основе иммунного ответа на НCV-инфекцию лежат как гуморальные, так и клеточные иммунные реакции. Клеточно-опосредованные реакции считаются доминирующими при НCV-инфекции и включают дисбаланс между Т4- и Т8-лимфоцитами. На первом этапе, при первичном инфицировании гепатоцитов в культуре тканей, доказан прямой цитопатический эффект HCV. В дальнейшем, в связи с тем, что на поверхности гепатоцитов при персистенции в них НCV представлены поверхностные белки вируса в комплексе с МНС-1, начинается действие ЦТЛ против гепатоцитов. Аналогичный механизм поражения гепатоцитов подробно изучен при вирусном гепатите В и описан в главе, посвященной патогенезу ВГВ. Установлена большая роль В-клеток в реализации гуморального иммунитета при инфекции вирусом гепатита С, так как в лимфоидных инфильтратах пораженной при этой инфекции печени выявляются активированные В-клетки в комплексе с НCV-РНК и гамма-глобулином. Формирование антительного ответа при ВГС отличается большим своеобразием, обусловленным высокой мутационной способностью части генома, ответственного за синтез поверхностных белков вируса, что является одним из факторов ускользания его от иммунного надзора хозяина. Следовательно, быстро изменяющиеся поверхностные пептиды вируса гепатита С не являются полноценной мишенью для ЦТЛ, и образующиеся антитела не обладают вирус-нейтрализующим действием по отношению к вновь и вновь образующимся поверхностным вирусным белкам, но могут выявляться при лабораторном обследовании при подтверждении инфицированности НCV Формирующийся иммунный гуморальный ответ направлен против структурных и неструктурных белков вируса, но все время изменяющиеся поверхностные белки вируса не позволяют осуществить антитело-опосредованный цитолиз инфицированных гепатоцитов. Возможно, этим и объясняется частое течение острого вирусного гепатита С в безжелтушной форме (в 95% случаев).
В результате быстрой изменчивости вируса не происходит формирование протективного иммунного ответа даже к генетическим разновидностям одного и того же вида НСV (квазивидам), в избытке присутс- твующих у инфицированных вирусом гепатита С. Другой особенностью вируса является его способность размножаться в мононуклеарных клетках периферической крови. Эти лимфотропные свойства могут иметь значение при ряде иммунологических нарушений, в частности при криоглобулинемии II и III типов, наблюдающихся более чем у 50% больных
ВГС.
При инфекции HCV в остром периоде резко повышается уровень ЦИК, снижается уровень С3- и С4-компонентов комплемента, что свидетельствует о формировании иммунокомплексной патологии уже на ранних этапах заболевания. Перечисленные особенности вируса гепатита С обусловливают своеобразие иммунного ответа у инфицированных НСV и в какой-то степени объясняют высокий процент формирования хронических форм заболевания у перенесших острый гепатит С и предрасположенность к формированию В-лимфом.
Следовательно, в патогенезе ВГС играют роль как прямой цитопатический эффект HCV, так и вызванные вирусом иммунологические реакции, приводящие к повреждению клеток печени, а также других органов и тканей. Доказана репликация HCV во внепеченочных тканях как лимфоидного, так и нелимфоидного происхождения. Размножение вируса в иммунокомпетентных клетках (в том числе в моноцитах) приводит к нарушению их функции и способствует персистенции вируса.
Клиническая картина. Отличительной особенностью ВГС является многолетнее латентное или малосимптомное течение. Болезнь в большинстве случаев остается клинически нераспознанной и обычно выявляется на далеко зашедших стадиях (на стадии цирроза, либо при первичном раке печени).
Острый ВГС диагностируется редко в связи с преобладанием стертого течения с минимальными клиническими проявлениями. Длительность инкубационного периода вирусного гепатита С в зависимости от пути передачи колеблется от 2 до 26 недель и в среднем составляет 6-8 недель.
Лишь у 5% больных в острой фазе ВГС отмечается желтуха, в 95% случаев болезнь протекает в безжелтушной форме. Острый желтушный вирусный гепатит в основном регистрируется у лиц с посттрансфузионным заражением.
Болезнь преимущественно протекает в легкой форме, случаи тяжелого течения достаточно редки. Тяжелые формы могут быть неотличимы
от таковых при острых вирусных гепатитах А или В. Фульминантный ВГС с подострой печеночной недостаточностью отмечается не более чем в 1% случаев, но чаще встречается при коинфекции с HAV, HBV и HDV.
Продолжительность острой фазы ВГС обычно составляет 6-12 недель с крайне медленным формированием иммунного ответа в виде выработки антител, что существенно затрудняет серологическую диагностику острого ВГС.
Как уже было отмечено, острый ВГС, как правило, протекает бессимптомно или с минимальными клиническими проявлениями. 70- 80% пациентов предъявляют жалобы исключительно на быструю утомляемость и различной степени выраженности слабость. Только у 20-30% пациентов можно выявить клинически значимые проявления заболевания, из них у 20% присутствуют признаки желтушного синдрома или/и только неспецифические симптомы, включающие в себя слабость различной выраженности, анорексию, а также неопределенные, неинтенсивные, не связанные с приемом пищи боли в верхней половине живота. Если же имеются признаки желтушного синдрома, то клиническое течение ВГС, лабораторные биохимические тесты, гистологические изменения в печеночной ткани ничем не отличаются от других вирусных гепатитов. Этиология вирусного поражения печени может быть установлена только по серологическим или/и вирусологическим тестам.
Острая форма заболевания начинается с выраженной слабости, анорексии, тошноты и дискомфорта в абдоминальной области различной степени выраженности. Очень редко пациенты могут предъявлять жалобы на артралгии и «крапивницу», что обычно заставляет врачей скорее заподозрить вирусный гепатит В, нежели С. Желтушная фаза, как правило, не сопровождается исчезновением всех перечисленных симптомов, но иногда, крайне редко, все продромальные симптомы с наступлением желтушного периода исчезают. Выраженность желтушного синдрома значительно варьирует, а его продолжительность колеблется от 3 до 12 недель. У около 70% пациентов anti-HCV появляется во время желтушного периода заболевания, а у 97% - в течение 6 месяцев от момента заражения. Повышение уровня АЛТ начинается с момента появления первых, даже незначительных симптомов острого периода заболевания. Максимальный подъем уровня аминотрансфераз может в 10-20 и более раз превышать нормальный уровень, но он быстро снижается (намного быстрее, чем при вирусных гепатитах В или А). У пациентов с саморазрешившимся гепатитом С (от 5 до 20%) уровень сывороточных аминотрансфераз быстро нормализуется на фоне исчезновения клинических симптомов, а уровень HCV RNA становится неопределяемым на
фоне прогрессивного снижения уровня anti-HCV и его полного исчезновения. Уровень HCV RNA у таких пациентов в острую фазу заболевания достаточно низкий. Особо следует подчеркнуть, что иногда у пациентов с HCV-инфекцией anti-HCV может отсутствовать, либо выявляться в крайне низких титрах, поэтому при подозрении на острый ВГС одного серологического обследования недостаточно. В связи с тем, что острая фаза заболевания протекает у большинства пациентов практически бессимптомно, заболевание выявляется при случайном, рутинном обследовании при предъявлении неспецифических, непостоянных жалоб. Единственной постоянной жалобой у всей пациентов является стойкая, прогрессирующая утомляемость, несколько реже отмечается потеря веса на фоне отсутствия аппетита. Выраженность симптомов коррелирует с повышением уровня аминотрансфераз и носит интермиттирующий характер в соответствии с колебаниями проявлений клинических симптомов. Однако приблизительно у одной трети пациентов повышение уровня трансаминаз не выявляется даже на фоне выраженных клинических симптомов: Так, около 30% пациентов имеют нормальный уровень АЛТ на фоне персистирующей виремии. Несмотря на отсутствие симптомов, у таких пациентов выявляются выраженные изменения в паренхиме печени: воспалительные и некротические проявления на фоне начальных явлений фиброза. Этих пациентов крайне трудно отличить от пациентов со сформированным хроническим гепатитом С. В целом для таких пациентов прогностически плохими признаками является стойкое, а не интермиттирующее повышение уровня трансаминаз на фоне тромбоцитопении и/или повышенного уровня гаммаглобулинов и/или ферритина.
Ретроспективное многолетнее наблюдение за пациентами с HCV- инфекцией позволило нам выделить группу пациентов, у которых клиническая картина заболевания характеризуется внепеченочными прояв- лениями. Условно эти проявления подразделяются на две группы:
1 - указывающие на HCV-инфекцию (смешанная криоглобулинемия, гломерулонефрит, синдром Шьегрена, наличие аутоантител);
2 - возможно связанные с HCV-инфекцией (лимфопролиферативные заболевания, системные васкулиты-полиартерииты, аутоиммунные тромбоцитопении, артралгии и миалгии, диабет II типа).
Распространенность этих проявлений в значительной степени колеблется в зависимости от географической зоны и от популяции. Большинство пациентов с криоглобулинемией длительное время не демонстрируют каких-либо проявлений клинических признаков заболевания. А впервые попадают в поле зрения врачей при появлении у них
стойких артралгий, пурпуры, крапивницы. При обследовании у них в 40- 80% случаев выявляется хроническая HCV-инфекция. Гломерулонефрит (мембранопролиферативный, пролиферативный или мембранозный) часто является внепеченочной манифестацией вирусного гепатита С, причем он не обязательно сочетается с криоглобулинемией. Установлена потенциальная связь между лимфомой и HCV-инфекцией, но эти данные значительно колеблются в зависимости от популяции. Доказано наличие связи В-клеточной пролиферации у пациентов с гепатитом С и криоглобулинемией. Интересен факт превалирования в диагностически значимых титрах аутоантител у пациентов с вирусным гепатитом С (антинуклеарных, к гладкой мускулатуре, почечно-печеночных микросомальных), что заставляет углубленно обследовать этих пациентов на HCV-инфекцию методом ПЦР-диагностики. У таких больных результаты исследования сыворотки на наличие anti-HCV могут быть отрицательными, т.к. эти антитела захватываются иммунными комплексами в избытке присутствующими в сыворотке таких пациентов.
Условно считается, что диагноз хронического гепатита С ставится через 6 месяцев после начала острого вирусного гепатита и может быть вынесен на основании вирусологических и серологических методов диа- гностики. Однако серологическая диагностика имеет целый ряд особенностей.
Лабораторная диагностика. Для этиологической диагностики HCV-инфекции используется серологическое исследование и ПЦР Материалом для исследования является кровь.
Лабораторная диагностика острой инфекции носит запоздалый характер, что обусловлено существованием так называемого «антительного окна»: anti-HCV при исследовании с применением тест-систем 1-го и 2-го поколений у 61% больных появляется в течение 12-27 недель после заражения, у остальных - спустя 6 и более месяцев, т.е. существует «окно» серонегативности и потенциальной инфекционности. Обнаружение ВГС (РНК) возможно через несколько дней после заражения вирусом, поэтому ПЦР является методом выбора для ранней диагностики гепатита С.
Особое значение для оценки состояния пациента и динамики заболевания имеют печеночные пробы (АЛТ, АСТ, общий билирубин, фракции билирубина, белки и белковые фракции, протромбиновый индекс), общий анализ крови и мочи.
В острой фазе ВГС выявляется повышение сывороточной активности АЛТ и АСТ в 5-10 и более раз по сравнению с нормой, чаще с повторными пиками. При желтушной форме гепатита наряду с гипер-
ферментемией определяется умеренное повышение общего содержания билирубина.
Исходы заболевания. Хронизация ВГС отмечается в 50-70% клинических наблюдений, причем в 20-40% случаев развивается хронический персистирующий гепатит (ХПГ) или хронический лобулярный гепатит (ХЛГ), а у 5-10% больных - хронический активный гепатит (ХАГ), требующий целенаправленного лечения.
У больных хроническим ВГС в 20-50% случаев развивается цирроз печени, в большинстве случаев неактивный и компенсированный в течение многих лет. Так, даже при 15-летнем наблюдении больных ВГС при- знаки портальной гипертензии были установлены лишь в 9% случаев. Клинически выраженный хронический гепатит развивается в среднем через 14 лет, цирроз печени - через 25-50 лет, ГЦК - спустя 35 и более лет после первичного инфицирования. Только в некоторых эндемичных районах (Средиземноморье, Дальний Восток) средние сроки формирования цирроза и первичного рака печени уменьшаются до 7-8 лет.
ВГС - важнейший этиологический фактор развития первичного рака печени. В Японии роль HCV-инфекции в развитии ГЦК является ведущей и достигает 75%. Распространенность ГЦК при HCV-инфекции в России и сопредельных странах требует уточнения.
Лечение. Исследования последних лет доказали высокую эффектив- ность противовирусного лечения ОГС. Рекомендуемая схема независимо от генотипа вируса: альфа-интерферон по 5 млн МЕ 1 раз в сутки в течение 4 недель, затем по 5 млн МЕ через день на протяжении 20 недель. Симптоматическое лечение проводят так же, как при гепатите В.
Профилактика. Неспецифическая профилактика аналогична таковой при вирусном гепатите В (см. соответствующий раздел). Вакцинопрофилактика не разработана.
1.2.4. Вирусный гепатит D
Вирусный гепатит D (ВГD) - инфекционное заболевание, вызываемое РНК-содержащим вирусом, развивающееся в виде коинфекции или суперинфекции на фоне заражения HBV и протекающее с преимущественным поражением печени.
ВГD не существует в виде самостоятельного заболевания. При размножении возбудитель гепатита D (HDV) нуждается в одновременной репликации HBV. Отсюда существуют две возможные формы их взаи- модействия: одновременное заражение обоими гепатитами (коинфекция) или заражение HDV на фоне хронической HBV-инфекции (суперинфекция).
Этиология. Возбудитель ВГD впервые был обнаружен в
Вирус не культивируется на известных клеточных линиях. Экспериментальной моделью являются шимпанзе и лесные сурки, которых заражают ВГD совместно с вирусом гепатита В. Существует несколько генотипов HDV, из которых в настоящее время выделены три. Для Европы и Северной Америки характерен генотип I, ассоциируемый с более высокой частотой цирроза печени и ГЦК.
Взаимоотношения между HDV и HBV достаточно сложны. Известно, что HDV может подавлять репликацию HBV. HBeAg и HBV-ДНК на фоне массивной репликации HDV обычно не выявляются; у 2-10% больных исчезает HBsAg, что характерно для терминальной стадии болезни.
Эпидемиология. Считается, что более 5 из 350 млн инфицированных HBV заражены возбудителем гепатита D. Наиболее высокая заболеваемость HDV-инфекцией отмечается среди больных наркоманией. Возможность заражения HDV лиц, инфицированных HBV (особенно если они употребляют наркотики), должна всегда приниматься во внимание. Показано, что ВИЧ-инфекция способствует реактивации HDV
Патогенез. Заражение ВГD возможно лишь при наличии в организме человека репродуцирующегося вируса гепатита В. Вирус HDV с помощью НВsAg проникает в гепатоцит и затем уже самостоятельно проходит в ядро гепатоцита, а затем с помощью РНК-зависимой ДНК-полимеразы хозяина запускается каскад биохимических реакций, приводящих к синтезу готовых частиц НDV. Далее уже в комплексе Гольджи происходит «упаковка» этих частиц в HBsAg и дальнейшее высвобождение вирионов из гепатоцита без его гибели. Однако не исключено прямое цитопатическое действие ВГD на клетки печени. При одновременном заражении вирусами гепатитов В и D заболевание принято определять как коин-
фекцию; при попадании ВГD в организм больного, ранее зараженного вирусом гепатита В, говорят о суперинфекции. В последнем случае заболевание приобретает тяжелое течение с частым развитием ОПЭ и быстрым прогрессированием хронического процесса. Патоморфологические изменения печеночной ткани аналогичны таковым при тяжелом течении гепатита В и характеризуется выраженными некротическими изменениями гепатоцитов при отсутствии четко выраженной воспалительной реакции. Причем при суперинфекции все эти процессы протекают на фоне морфологических проявлений хронического процесса, обусловленного предшествующей инфекцией гепатитом В.
Клиническая картина. В случае коинфекции общая картина заболевания аналогична клиническим проявлениям ВГВ, но в целом данный тип вирусного поражения печени отличается преобладанием тяжелых, осложненных форм. Как правило, поначалу болезнь протекает как типичный ВГВ, но к концу первой недели заболевания состояние больных в ряде случаев резко ухудшается, что является признаком массивной репликации HDV (прямое цитопатическое действие вируса, что клинически проявляется цитолитическим синдромом с быстрым наступлением ОПЭ). При этом в большинстве случаев дожелтушный период болезни совпадает с инкубационным периодом, характерным для моноинфекции HBV. Отдаленный прогноз болезни при коинфекции с ВГВ, несмотря на тяжесть течения острого периода, обычно бывает благоприятным.
Суперинфекция HDV на фоне хронической HBV-инфекции протекает бурно, с резким началом и практическим отсутствием дожелтушного периода. Сравнительно редким является бессимптомное течение, выявляемое по лабораторным изменениям печеночных проб. Удельная доля фульминантной (молниеносной) формы ВГВ при суперинфекции HDV достигает 25%, что не наблюдается ни при одной форме изолированных вирусных гепатитов.
У больных наркоманией фульминантное течение вирусного гепатита с фатальным исходом в 60% случаев обусловлено HDV-инфекцией.
Фульминантный гепатит - см. раздел Вирусный гепатит В.
Лабораторная диагностика. Основными в диагностике гепатита D являются серологические исследования и метод ПЦР. В остром периоде HDV-инфекции в крови больных определяются HD-антиген, HDV- РНК и anti-HDV-IgM наряду с маркерами HBV-инфекции (маркерами острой инфекции ВГВ при коинфекции и маркерами обострения ХГВ при суперинфекции) с последующим появлением anti-HDV-IgG, титр которых постепенно возрастает. Репликация HDV подтверждается количественным и качественным определением HDV-РНК методом ПЦР
Прогностически неблагоприятным является исчезновение из крови HBsAg. Особое значение для оценки состояния пациента и динамики зыболевания имеют печеночные пробы (АЛТ, АСТ, общий билирубин, фракции билирубина, белки и белковые фракции, протромбиновый индекс), общий анализ крови и мочи.
Исходы заболевания. Частота развития хронического гепатоцеллюлярного поражения в исходе острого гепатита D составляет примерно 10% при коинфекции и приближается к 90% при суперинфекции с развитием быстро прогрессирующего цирроза печени. HDV-инфекция снижает частоту развития гепатоцеллюлярной карциномы, обусловленной HBV-инфекцией.
Лечение проводят так же, как при вирусном гепатите В (см. соответствующий раздел). Противовирусное лечение острого гепатита D не разработано, но при доказанной репликации HBV возможно назначение нуклеозидных аналогов (ламивудин по 100 мг/сут, энтекавир).
Профилактика. Аналогична профилактике вирусного гепатита В. Следует заметить, что вакцинация против гепатита В предупреждает заражение HDV.
1.2.5. Вирусный гепатит Е
Синонимы - фекально-оральный гепатит ни-А, ни-В; гепатит ни-А, ни- В, передающийся энтерально; эпидемический ни-А гепатит; гепатит ни- А, ни-В водного происхождения.
Вирусный гепатит Е (ВГЕ) - острое эндемическое инфекционное заболевание с фекально-оральным механизмом передачи, проявляющееся в виде эпидемических вспышек в странах тропического и субтропического пояса, а также в Центральной Азии, характеризующееся поражением печени различной степени, вплоть до развития острой печеночной недостаточности с летальным исходом.
Краткая историческая справка. Первые сообщения об эпидемической вспышке заболевания известного сегодня как вирусный гепатит Е относятся к
риалом, полученным из фекалий больных ни-А гепатитом (Балаян М.С. с соавт.).
Этиология. Вирус гепатита Е является безоболочечным вирусом, капсид которого построен по кубическому типу симметрии, диаметр вириона составляет 32-34 нм. Геном представлен одной «плюс»-цепью РНК, которая кодирует РНК-полимеразу, папаинподобую протеазу и трансмембранный белок, обеспечивающий внедрение вируса в клетку. HEV отнесен к новому роду вирусов, получившего название Heprvirus. Известно 3 серотипа вирусов гепатита Е.
HEV хорошо сохраняется при температуре ниже минус 20 "С, а уже при 0 ?С полностью разрушается, он чувствителен к воздействию хлор- и йодсодержащих дезинфектантов. Вирус не удалось культивировать в культуре тканей. Для выделения вируса используется заражение приматов. В результате успешного клонирования генома HEV в настоящее время изготавливаются рекомбинантные и синтетические антигены, используемые в серологических диагностических тестах. Антигенным компонентом этих тестов служит комбинация белков, располагающихся на поверхности HEV.
Эпидемиология. В настоящее время установлено, ВГЕ является зоонозом, природный резервуар - представители свиньих. Возбудитель ВГЕ в естественных условиях может инфицировать также некоторые виды диких и домашних животных (крыс, овец и т.д.). HEV передается фекально-оральным путем. Максимальное содержание вируса в крови, желчи и фекалиях совпадает с концом инкубационного периода. Вирус постепенно исчезает из крови к 10-му дню желтушного периода, а из фекалий - к 14 дню.
Пути передачи - водный и пищевой; некоторые исследователи признают, что возможен и контактно-бытовой путь при фекальном заражении предметов окружающей среды. HEV экскретируется с фекалиями, но в связи с тем, что устойчивость вируса низкая по отношению к факторам окружающей среды, контагиозность вируса очень незначительна. Риск заражения составляет 2,5% (для сравнения, при гепатите А - 20%).
Отличительной чертой ВГЕ является его преимущественное распространение в возрастной группе 15-40 лет. Сезонность в эндемичных районах четко соответствует пику заболеваемости во время и после сезона дождей, но в спорадических случаях наблюдаются в течение всего года. Прослеживается связь между частотой вспышек и коммунальным обустройством территорий и состоянием источников питьевого водоснабжения. Странами, эндемичными по ВНЕ, считаются Индия, Пакистан, Непал, Египет, Израиль, Сомали, Эфиопия, Турция, Австралия, Южная
Африка, отдельные регионы США, республики Средней Азии. Описаны случаи завоза инфекции в неэндемичные районы, но эпидемвспышки не были зарегистрированы. Существует предположение, что иммунитет после перенесенного ВГЕ нестойкий и возможно повторное заражение.
Патогенез. Патогенез ВГЕ во многом остается не изученным, но установлено, что единственной мишенью для вируса является печень. Имеющиеся сведения о гистологических изменениях в печени аналогичны таковым при остром вирусном гепатите А (существенное повреждение портальной зоны со значительной клеточной инфильтрацией и холестазом). Но эти поражения более интенсивно выражены при ВГЕ, что может приводить к формированию выраженного постнекротического фиброза. Предполагается, что вирус вызывает лишь первичное поражение клеток паренхимы печени в виде повышения проницаемости клеточной мембраны. Вторичные, более тяжелые поражения, осуществляются путем вовлечения иммунопатологических механизмов, что подтверждается наличием патогистологических изменений в паренхиме печени в виде очаговых некрозов с умеренной инфильтрацией Купфферовскими клетками и полиморфноядерными лейкоцитами, а также дисплазией гепатоцитов с образованием «розеток». При острой печеночной недостаточности, как и при других вирусных гепатитах, в паренхиме печени появляются множественные сливные некрозы с полным разрушением структуры данного органа.
Клиническая картина. В основном заболевание поражает лиц в возрасте 15-40 лет. Инкубационный период составляет от 2-х до 9 недель, в среднем - 30 дней.
Дожелтушный период кратковременный, в среднем - 2-3 дня (от 1-го до 10 дней), и характеризуется лихорадкой, выраженными диспепсическими проявлениями (тошнота, рвота, обильный жидкий стул). Часто отмечаются артралгический синдром и появление полиморфной сыпи, гепатомегалия. ВГЕ в основном протекает в желтушной форме. Для детей характерна субклиническая, безжелтушная форма заболевания.
Желтушный период может длиться от 2-х до 12 недель, но редко пре- вышает 2-4 недели и характеризуется интенсивным желтушным синдромом, гепатомегалией, многократным (10 раз и более) повышением уровней АЛТ, АСТ, билирубина, ЩФ и ГГТ. Восстановительный период длится от 1-го до 6 месяцев.
Осложнения и исходы заболевания. Зачастую ВГЕ протекает с явлениями выраженного холестаза, клинические проявления которого аналогичны при вирусных гепатитах независимо от этиологии (см. гепатит А).
Хронизации заболевания нет, и оно завершается полным выздоровлением, но у 5% формируется постнекротический фиброз. Летальность колеблется от 1-го до 5%. Особо следует отметить своеобразное течение ВГЕ у беременных во 2-3-м триместре беременности, у 25% из них забо- левание протекает в фульминантной форме или сопровождается самопроизвольным выкидышем. Клиническая картина фульминантного гепатита не отличается от фульминантного гепатита другой этиологии.
Диагностика. Большую роль при постановке диагноза ВГЕ играет эпиданамнез, т.е. пребывание больного в эндемичном по ВГЕ регионе, а также клиническое развитие заболевания (наличие дожелтушного периода). Сходство клинической картины ВГЕ с ВГА заставляют окончательно подтвердить или отвергнуть диагноз только после лабораторного исследования сыворотки крови на специфические антитела.
Лабораторная диагностика основана на выявлении anti-HEV IgM в сыворотке крови методом ИФА, которые появляются с 21-го дня от заражения и присутствуют на протяжении 2-24 недель. Быстрое исчезновение anti-HEV IgM из сыворотки не позволяет использовать их в качест- ве обязательного лабораторного критерия для подтверждения диагноза ВГЕ. Выявить anti-HEV IgG можно уже начиная с 40-го дня от заражения, причем они сохраняются до 2-х лет. В эксперименте на животных установлено, что инфицированность ВГЕ может быть подтверждена методом ПЦР уже на 21-й день от заражения с помощью выявления HEV RNA, которая исчезает на 40-й день от заражения у основной массы больных. Существует предположение, что иммунитет после перенесенного ВГЕ нестойкий, и возможно повторное заражение.
Дифференциальная диагностика. В дожелтушный период дифференциальная диагностика должна проводиться с заболеваниями кишечной группы, что существенно затруднено из-за кратковременности данного периода и в связи с этим невозможностью использования вирусологических и серологических исследований. В основном дифференциальная диагностика проводится на стадии желтушного периода с вирус- ным гепатитом А с учетом результатов серодиагностики из-за большого сходства клинической картины при данных заболеваниях.
Лечение. Аналогичное вирусному гепатиту А (см. соотвествующий раздел).
Профилактика. Профилактика ВГЕ в настоящее время сводится к общегигиеническим и санитарным мероприятиям, аналогичным при других кишечных инфекциях. При исследовании сывороток от переболевших ВГЕ установлено, что anti-HEV IgG персистируют до 2-х лет и более. Специфическая профилактика не разработана.
1.3. ВИЧ-инфекция
Инфекция вирусом иммунодефицита человека (инфекция ВИЧ) является заболеванием, вызываемым представителем семейства ретровирусов и характеризующимся различными проявлениями от бессимптомного носительства до тяжелых фатальных состояний, обусловленных прогрессирующим поражением иммунной системы. Терминальная фаза ВИЧ-инфекции - синдром приобретенного иммунодефицита (СПИД). Это вторичный иммунодефицит, для которого характерно развитие оппортунистических инфекций, злокачественных новообразований, поражение нервной системы в результате инфекции ВИЧ.
Историческая справка. Впервые аббревиатура «СПИД», обозначающая новое заболевание человека, появилась в
При
обследовании иммунного статуса у этих пациентов впервые было
установлено достоверное снижение показателей клеточного звена
иммунитета. Вскоре многочисленные случаи СПИД были описаны среди опре-
деленных групп населения: наркоманов, пациентов с гемофилией,
сексуальных партнеров лиц, больных СПИДом. На основании этих фактов
было сделано предположение о существовании инфекционного агента,
вызывающего СПИД, и путях его передачи. Следующим важным этапом в
изучении СПИДа явилось совместное заявление в
Этиология. Возбудитель ВИЧ-инфекции относится к семейству Retroviridae, роду Lentivirus. Известны два типа вируса - ВИЧ-1 и ВИЧ- 2, которые отличаются по строению генома и антигенной структуре. ВИЧ-1 является более распространенным. В силу своей изменчивости существует не менее 10 генотипов (подтипов) вируса. Частицы вируса имеют диаметр 100 нм и сферическую форму. Они состоят из конусооб-
разной сердцевины, окруженной наружной двухслойной липопротеиновой оболочкой, которая пронизана гликопротеиновыми комплекса- ми (шипами). Гликопротеиновый комплекс у ВИЧ-1 представлен gp160, состоящим из двух субъединиц: gp41 и gp120, а у ВИЧ-2 - комплексом gp 140, состоящим из субъединиц: gp36 и gp105.
В состав сердцевины входят геном вируса, сердцевинные белки (главными из которых у ВИЧ-1 является р24, а у ВИЧ-2 - р26), матриксные белки, а также ферменты ревертаза и интеграза. Ревертаза является бифункциональным ферментом, она синтезирует ДНК на матрице РНК, а также обладает рибонуклеазной активностью. Интеграза обеспечивает встраивание ДНК провируса в геном клетки. Геном представлен в виде двух идентичных однонитевых «плюс»-молекул РНК, состоящих из 3-х групп генов:
1. Структурные гены gag, env, pol детерминируют синтез структурных компонентов вириона, из которых ген gag кодирует структурные протеины сердцевины, pol - протеазу, ревертазу, интегразу, env - белки гликопротеинов оболочки.
2. Регуляторные гены (rev, tat, nef, vpr) ответственны за жизненный цикл вируса; ген tat является трансактиватором, увеличивая транскрипцию вирусных генов, он также репрессирует синтез рецепторов 1-го класса главного комплекса гистосовместимости на поверхности инфицированных вирусом клеток, что уменьшает способность цитотоксических Т-лимфоцитов убивать инфицированные вирусом клетки.
3. Третья группа генов (vif,vpu, vpt) необходима для осуществления процесса созревания и высвобождения вирусных частиц из клетки; у ВИЧ-2 vpu заменен на vpx; по концам молекул РНК расположены длинные терминальные нуклеотидные повторы.
Вирус ВИЧ имеет несколько антигенов, главными из которых являются: группоспецифический р24 (или р26); типоспецифические трансмембранные белки оболочки gp41, gp120, gp160, обеспечивающие слияние вирусной оболочки с клеточной мембраной, но именно gp120 имеет участок специфического взаимодействия с клеточным рецептором CD4. Этот же антиген обладает наиболее иммуногенным эпитопом, названным V3 петлей. Данный участок характеризуется гипервариабельностью вследствие высокой мутационной активности гена, кодирующего gp120, вызывая появление антигенных вариантов, обладающих высо- кой изменчивостью.
Вирус размножается, главным образом, в культуре клеток Т-лимфоцитов с добавлением иммуномодулятора интерлейкина-2 и образованием ЦПЭ в виде симпластообразования. При участии gp120
осуществляется прикрепление вируса к клеточным рецепторам CD4, а с помощью gp41 происходит проникновение вируса в клетку. После «раздевания вируса» и высвобождения вирусной РНК с помощью ревертазы осуществляется синтез двунитчатой провирусной ДНК на матрице РНК, которая благодаря длинным терминальным повторам замыкается в кольцо и затем интегрирует в геном клетки с образованием провируса. Синтез ДНК сопровождается ошибками считывания, при этом особой изменчивости подвергается ген env (кодирующий поверхностные белки). Процесс интеграции опосредуется ферментом интегразой. В геном клетки могут быть встроены множественные копии провирусной ДНК.
Сборка вирионов происходит в цитоплазме, а высвобождение вирусных частиц из клетки - путем «почкования». Полный жизненный цикл реализуется всего за 1-2 суток, причем в сутки формируется до 1-го млрд вирусных частиц. Репродукция ВИЧ сопровождается генетическими ошибками, обусловливающими высокую изменчивость вируса.
Вирус поражает в основном Т- (CD4) и В-лимфоциты, а также некоторые клетки моноцитарного ряда (макрофаги, лейкоциты, клетки Лангерганса, дендритные клетки), клетки микроглии мозга, эндотелий капилляров мозга и шейки матки, клетки роговицы глаза. Инфицированная клетка является важным фактором распространения ВИЧ как в отдельном организме, так и между индивидуумами.
ВИЧ сравнительно малоустойчив к факторам внешней среды, физическим и химическим факторам. При комнатной температуре сохраняется до 4-х суток, за 5-10 мин инактивируется спиртом, эфиром и дру- гими дезинфектантами, быстро гибнет при кипячении, при нагревании свыше 56 оС гибнет в течение 30 мин. Чувствителен к УФ-излучению, ионизирующей радиации. ВИЧ может до 2-х недель сохраняться в высушенном состоянии в высохшей крови, в донорской крови сохраняется годами, а в замороженной сперме сохраняется несколько месяцев.
Эпидемиология. Резервуар и источник инфекции - инфицированный человек. Высокое содержание вируса установлено в крови, сперме, вагинальном секрете, эти биологические субстанции представляют наибольшую эпидемиологическую опасность. Вирус выявлен также в слюне, грудном молоке, слезной и спинно-мозговой жидкости.
ВИЧ-инфекция относится к заболеваниям с контактным механизмом передачи. Основной естественный путь передачи - половой. Парентеральный путь передачи реализуется при переливании дериватов крови. Возможна вертикальная передача ВИЧ. Контактно-бытовая передача вируса не установлена. Хотя ВИЧ обнаруживается в организме кровососущих насекомых, эпидемиологического значения этот факт не имеет.
Патогенез. Несмотря на большие успехи, достигнутые в изучении этиологии, клиники и лечении инфекции ВИЧ, многие вопросы патогенеза этого заболевания остаются мало изученными. Однако установлено, что при первичном инфицировании мишенью для ВИЧ являются лимфоциты, выполняющие функцию посредников в иммунном ответе хозяина и несущие на своей поверхности CD4 молекулы. Таким образом, инфекция ВИЧ - это поражение иммунной системы, характеризующееся прогрессивным снижением CD4+ (положительных) лимфоцитов, что напрямую связано с развитием фатальной инфекции для хозяина. Несмотря на то что вирус иммунодефицита приводит к развитию иммуносупрессии, этому предшествует длительная бессимптомная фаза, хотя вирус и присутствует в организме. Снижение числа CD4+ лимфоцитов потенциально ведет к следующим нарушениям:
1. Активизация оппортунистических инфекционных агентов.
2. Деструкция клеток, имеющих на своей поверхности рецепторы, способные сорбировать gp120, располагающийся у вируса ВИЧ трансмембранно и способствующий связыванию вируса с клеткамимишенями.
3. Подавление регенерации периферических Т-лимфоцитов.
4. Аутоиммунные нарушения.
5. Появление суперантигенов.
6. Запуск апоптоза.
Известна центральная роль CD4+ лимфоцитов в развитии как клеточного, так и гуморального иммунных ответов, следовательно, для ВИЧ-инфекции характерно поражение этих двух компонентов одновременно. В то же время выявленные у ретровирусов (к которым относится вирус ВИЧ) белки обладают прямым иммуносупрессивным действием. Доказано, что трансмембранный белок ВИЧ gp41 ингибирует пролиферацию лимфоцитов в ответ на антигенные и митогенные стимулы и вносит свой вклад в тотальную иммуносупрессию при данном заболевании. Абсолютное снижение СД4+ лимфоцитов приводит к резкому падению выброса лимфокинов, депрессии рецепторов к ИЛ-2 и, следовательно, к падению функциональной активации В-лимфоцитов. Поскольку ВИЧ поражает стволовые клетки, одновременно падает общая продукция СД4+ лимфоцитов, и все это происходит на фоне индуцированной вирусом деструкции тимуса. В результате неизбежно развивается резкое падение противоинфекционной защиты.
Аутоиммунные механизмы (в результате перекрестно реагирующих антител) и (или) клеточный иммунный ответ на вирус приводят к разрушению неинфицированных СД4+ клеток. Суперантигенные эффекты
обусловлены вирусными белками, которые могут приводить к стимуляции СД4+ лимфоцитов по отношению к собственным Т-клеточным рецепторам. Вследствие триггерной роли белков вируса ВИЧ нарастают явления апоптоза (преждевременной запрограммированной смерти клеток). Следовательно, механизмы поражения СД4+ лимфоцитов, приводящие к иммунной дисфункции, так глубоки, что число СД4+ клеток напрямую характеризует прогрессирование заболевания и его стадию. Вероятность оппортунистических инфекций значительно возрастает, если СД4+ лимфоцитов становится менее 200 клеток в 1 мкл.
При ВИЧ-инфекции всегда присутствуют нарушения в В-лимфоцитарном звене иммунитета, причем как количественные, так и качественные. На первом этапе наблюдается интенсивная поликлональная активация В-клеток, проявляющаяся в резком нарастании уровня иммуноглобулинов и иммунных комплексов и увеличении на периферии циркулирующих В-лимфоцитов, спонтанно секретирующих IgG. Глубокое функциональное нарушение В-клеток состоит в неполноценном иммунном ответе на любую антигенную стимуляцию. В отличие от СД4+ лимфоцитов, макрофаги устойчивы к цитопатическому действию ВИЧ и могут даже быть резервуаром для этого вируса. Следовательно, макрофаги играют важную роль в диссеминации вируса ВИЧ, особенно если учесть, что вирус подобным образом проникает через гематоэнцефалический барьер в ЦНС. Согласно последним исследованиям поражение моноцитов и макрофагов приводит к нарушению презентации антигенов иммунокомпетентным клеткам, особенно на поздних стадиях заболевания, и может обусловливать секрецию ИЛ-1, экспрессию рецепторов к ИЛ-2 и хемотаксических рецепторов. Все это в совокупности ведет к нарушению презентации любого антигена и приводит к отсутствию готовности сформировать иммунный ответ не только против ВИЧ, но и других патогенов.
Следующий очень важный компонент иммунного ответа - NK- клетки (естественные киллеры), осуществляющие киллинг вирусинфи- цированных, опухолевых и аллогенных клеток. NK фенотипически и численно нормальны у инфицированных ВИЧ, но они функционально дефектны. Это приводит к нарушениям в запуске механизмов, осуществляющих лизис клеток-мишеней. В настоящее время показано, что NK- клетки не играют ведущую роль в процессах, обусловленных антителоопосредованной цитотоксичностью при ВИЧ-инфекции, но они могут связывать ВИЧ-специфические антитела посредством своих Fc-рецеп- торов, что приводит к атаке против ВИЧ-инфицированных клеток.
Глубокие аутоиммунные нарушения вносят свой вклад в патогенез ВИЧ. У большинства ВИЧ-инфицированных выявляется большое количество иммунных комплексов, что объясняет появление у этих пациентов ВИЧ-ассоциированных артралгий, миалгий, поражений почек, васкулитов. Аутоиммунные нарушения напрямую связаны с иммуносупрессией при ВИЧ.
Цитотоксические лимфоциты (ЦТЛ) осуществляют основной вид защиты против вирусных инфекций. ЦТЛ могут разрушать вирус- инфицированные клетки посредством распознавания вирусных белков (фрагментов оболочки вируса, представленных на поверхности инфицированных клеток), когда эти белки образуют бинарный комплекс с поверхностными молекулами HLA (системы гистосовместимости человека). ЦТЛ распознают этот комплекс, что ведет к лизису и элиминации инфицированных клеток. Этот ответ опосредуется СД8+ лимфоцитами, которые распознают белки ВИЧ на поверхности инфицированных кле- ток в комплексе с молекулами HLA I (A,B,C).
В настоящее время существует гипотеза, что прогрессирование инфекции ВИЧ ассоциируется со специфическими дефектами и дис- балансом в системе Th1 и Th2 типа. Для системы Th1 типа характерен цитокиновый ответ, ассоциирующийся с продукцией ИЛ-2 и ИФНгамма в результате антигенной или митогенной стимуляции мононуклеаров периферической крови. Цитокиновый ответ, присущий системе Th2 типа, ассоциируется с продукцией ИЛ-4, ИЛ-5, ИЛ-6 и ИЛ-10. Показано, что у лиц, формирующих иммунный ответ по первому типу, инфекция ВИЧ не развивается.
Описанные иммунологические нарушения у инфицированных ВИЧ глубоки и многообразны, что, естественно, находит отражение в своеобразии клинической картины при данном заболевании.
Клиническая картина. Инфекция ВИЧ характеризуется разнообразными клиническими проявлениями в соответствии со стадиями заболевания. Согласно Российской классификации ВИЧ-инфекции (Покровский В.И., 2006), различают следующие стадии заболевания:
1. «Стадия инкубации».
2. «Стадия первичных проявлений».
3. «Субклиническая стадия».
4. «Стадия вторичных заболеваний».
5. «Терминальная стадия».
1. «Стадия инкубации» - период от момента заражения до появления реакции организма в виде клинических проявлений «острой инфекции» и (или) выработки антител. Продолжительность ее обычно составляет
от 3-х недель до 3-х месяцев, но иногда может продолжаться и дольше. В этот период идет активное размножение ВИЧ, однако клинические проявления заболевания отсутствуют, и антитела к ВИЧ еще не выяв- ляются. Диагноз ВИЧ-инфекции на данной стадии ставится на основании эпидемиологических данных и лабораторно должен подтверждаться обнаружением в сыворотке крови пациента вируса иммунодефицита человека, его антигенов, нуклеиновых кислот ВИЧ.
2. «Стадия первичных проявлений». В этот период активная репликация ВИЧ в организме продолжается, однако проявляется уже первичный ответ организма на внедрение этого возбудителя в виде клинических проявлений и/или выработки антител. Стадия ранней ВИЧ-инфекции может протекать в нескольких формах.
2А. «Бессимптомная» - когда какие-либо клинические проявления ВИЧ-инфекции или оппортунистических заболеваний, развивающихся на фоне иммунодефицита, отсутствуют. Ответ организма на внедрение ВИЧ проявляется при этом лишь выработкой антител.
2Б. «Острая ВИЧ-инфекция без вторичньх заболеваний» может проявляться разнообразной клинической симптоматикой. Наиболее часто - это лихорадка, высыпания (уртикарные, папулезные, петехиальные) на коже и слизистых оболочках, увеличение лимфоузлов, фарингит. Могут отмечаться увеличение печени, селезенки, диарея. В крови больных с острой ВИЧ-инфекцией могут обнаруживаться широкоплазменные лимфоциты («мононуклеары»).
Острая клиническая инфекция отмечается у 50-90% инфицированных лиц в первые 3 месяца после заражения. Начало периода острой инфекции, как правило, опережает сероконверсию, т.е. появление антител к ВИЧ. В стадии острой инфекции часто отмечается транзиторное снижение уровня CD4+ лимфоцитов.
2В. «Острая ВИЧ-инфекция с вторичными заболеваниями». В 10-15% случаев у больных острой ВИЧ-инфекцией на фоне снижения уровня CD4+ лимфоцитов и развившегося вследствие этого иммунодефицита появляются вторичные заболевания различной этиологии (ангина, бактериальная и пневмоцистная пневмонии, кандидозы, герпетическая инфекция и др.).
Продолжительность клинических проявлений острой ВИЧ-инфекции варьируется от нескольких дней до нескольких месяцев, однако обычно она составляет 2-3 недели. У подавляющего большинства пациентов стадия начальной ВИЧ-инфекции переходит в латентную.
3. «Субклиническая стадия». Характеризуется медленным прогрессированием иммунодефицита, компенсируемого за счет модификации
иммунного ответа и избыточного воспроизводства CD4+ лимфоцитов. В крови обнаруживаются антитела к ВИЧ. Единственным клиническим проявлением заболевания является увеличение двух и более узлов не менее чем в двух не связанных между собой группах (не считая паховых).
Лимфатические узлы обычно эластичные, безболезненные, не спаяны с окружающей тканью, кожа над ними не изменена. Длительность латентной стадии может варьировать от 2-3-х до 20 и более лет, в среднем - 6-7 лет. В этот период отмечается постепенное снижение уровня CD4+ лимфоцитов, в среднем со скоростью 0,05-0,07Х 109/л в год.
4. «Стадия вторичньх заболеваний». Продолжается репликация ВИЧ, приводящая к гибели CD4+ клеток и истощению их популяций, развитию на фоне иммунодефицита вторичных (оппортунистических) заболеваний, инфекционных и/или онкологических. В зависимости от тяжести вторичных заболеваний выделяют стадии 4А, 4Б, 4В. В стадии вторичных заболеваний выделяют фазы прогрессирования (на фоне отсутствия противоретровирусной терапии или на фоне противоретровирусной терапии) и ремиссии (спонтанной или на фоне противоретровирусной терапии).
4А. Отмечаются: потеря веса менее 10%; грибковые, вирусные, бактериальные поражения кожи, слизистых оболочек; опоясывающий лишай; повторные фарингиты; синуситы; повышенная утомляемость.
Фазы: прогрессирования (на фоне отсутствия противоретровирусной терапии, на фоне противоретровирусной терапии) или ремиссии (спонтанной, после ранее проводимой противоретровирусной терапии, на фоне противоретровирусной терапии).
4Б. Отмечаются: потеря веса более 10%; необъяснимая диарея или лихорадка более одного месяца; волосистая лейкоплакия; туберкулез легких; повторные или стойкие вирусные бактериальные, грибковые, протозойные поражения внутренних органов; повторный или диссеминированный опоясывающий лишай; локализованная саркома Капоши, прогрессирующая общая слабость.
Фазы: (см. в разделе 4А).
4В. Отмечаются: кахексия; генерализованные бактериальные, вирусные, грибковые, протозойные и паразитарные заболевания; пневмоцистная пневмония; кандидоз пищевода, бронхов, легких; внелегочный туберкулез; атипичные микобактериозы; диссеминированная саркома Капоши; поражение центральной нервной системы различной этиологии.
Фазы: (см. в разделе 4А).
Стадия 5. «Терминальная стадия». В этой стадии имеющиеся у больных различные заболевания приобретают необратимый характер. Проводимая противоретровирусная терапия и терапия вторичных заболеваний неэффективна.
Клинически СПИД (по классификации В.И. Покровского 4-я стадия - «Стадия вторичных заболеваний») может манифестиро- вать угрожающими жизни оппортунистическими инфекциями и (или) злокачественными новообразованиями, без предшествующих клинических симптомов инфекции ВИЧ. Но зачастую клинике СПИДа предшествует комплекс симптомов, получивших название СПИД-ассоциированного комплекса.
Под СПИД-ассоциированным комплексом подразумевают комплекс постоянных симптомов, развивающихся у «носителей» ВИЧ, не имеющих присущих развернутой стадии СПИДа оппортунистических инфекций и злокачественных новообразований. Эти клинические симптомы и лабораторные признаки включают в себя генерализованную лимфоаденопатию, похудание, перемежающуюся лихорадку, утомляемость, хроническую диарею, лейкопению, анемию, иммуноопосредованную тромбоцитопению и (или) панцитопению, кандидоз ротовой полости, иногда присоединение синдрома истощения - похудание на 10% и более.
В мире в настоящее время общепринятой является следующая клиническая классификация ВИЧ-инфекции у взрослых и детей (ВОЗ):
I клиническая стадия: бессимптомное течение, генерализованная лим- фоаденопатия (ГЛП). 1-й уровень функциональных возможностей: бессимптомное течение, нормальный уровень повседневной активности.
IIклиническая стадия: поражение кожи и слизистых оболочек, herpes zoster, рецидивы инфекций дыхательных путей. Клинические проявления: потеря массы тела менее 10% исходной, легкие поражения кожи и слизистых (себорейный дерматит, зудящие дерматозы, грибковые поражения ногтей, рецидивирующий афтозный стоматит, ангулярный хейлит), опоясывающий лишай за 5 лет, рецидивирующие инфекции вер- хних дыхательных путей. 2-й уровень функциональных возможностей: на фоне клинических проявлений нормальный уровень повседневной активности.
III клиническая стадия: диарея, кандидоз полости рта и/или волосистая лейкоплакия языка, тяжелые бактериальные инфекции. Клинические проявления: потеря веса тела более 10% исходного, диарея неясного генеза длительностью более 1-го месяца, лихорадка неясной этиологии (постоянная или рецидивирующая) длительностью более месяца, кандидоз полости рта, волосатая лейкоплакия рта, туберкулез легких, тяже-
лые бактериальные инфекции (пневмонии, миозиты и др.). 3-й уровень функциональных возможностей: в течение последнего месяца пациент проводил в постели менее 50% дневного времени.
IVклиническая стадия: СПИД-индикаторные болезни. ВИЧ-кахексия: потеря веса более 10% исходного и/или хроническая диарея (более 1-го месяца) неясной этиологии либо хроническая слабость в сочетании с длительной (более 1-го месяца) лихорадкой неясной этиологии. Оппортунистические и онкологические поражения: пневмоцистная пневмония, церебральный токсоплазмоз, криптоспоридиоз с диареей более 1-го месяца, внелегочный криптококкоз, цитомегаловирусная инфекция с поражением любых органов (кроме печени, селезенки, лимфоузлов), инфекции, вызванные вирусом простого герпеса с поражением внутренних органов, или хроническим (более 1-го месяца) поражением кожи и слизистых оболочек, рак шейки матки у женщин, прогрессирующая мультифокальная лейкоэнцефалопатия, любой диссеминированный эндемический микоз, кандидоз пищевода, трахеи, бронхов, легких, диссеминированная инфекция, вызванная атипичными микобактери- ями, сальмонеллезная септицемия (кроме Salmonella typhi), внелегочный туберкулез, лимфома, саркома Капоши, ВИЧ-энцефалопатия. 4-й уровень функциональных возможностей: в течение последнего месяца пациент проводил в постели более 50% дневного времени.
Широкое распространение за рубежом получила клинико-лабораторная классификация для подростков и взрослых (СДС -
В основу классификации положен лабораторный признак: количество СД4+ Т-лимфоцитов.
Категория А. Клинико-лабораторная характеристика:
А1 - число СД4+ Т-лимфоцитов > 500 клеток в 1 мкл - бессимптомная, острая (первичная) ВИЧ-инфекция, или только персистирующая генерализованная лимфаденопатия;
А2 - число СД4+ Т-лимфоцитов 200-499 клеток в 1 мкл;
A3 - число СД4+ Т-лимфоцитов < 200 клеток в 1 мкл.
На этой стадии количество Т-клеток рассматривается как маркер развития СПИДа.
Категория В. Клинико-лабораторная характеристика (появление клинических проявлений ВИЧ-инфекции, оппортунистических инфекций):
B1 - число СД4+Т-лимфоцитов > 500 клеток в 1 мкл;
B2 - число СД4+Т-лимфоцитов 200-499 клеток в 1 мкл;
B3 - число СД4+ Т лимфоцитов < 200 клеток в 1 мкл (соответствует развитию СПИДа).
Категория С. Клинико-лабораторные признаки СПИД-ассоциированных заболеваний:
С1 - число СД4+ Т-лимфоцитов > 500 клеток в 1 мкл;
С2 - число СД4+ Т-лимфоцитов 200-499 клеток в 1 мкл;
С3 - число СД+4 Т лимфоцитов < 200 клеток в 1 мкл.
Клинико-лабораторная характеристика маркерных заболеваний, характерных для категории С: генерализованные, рецидивирующие бак- териальные инфекции; кандидоз бронхов, трахеи и легких, пищевода; рак шейки матки in situ; коккцидомикоз (диссеминированный или экстрапульмональный), экстрапульмональный криптококкоз, хронический интестинальный криптоспоридиоз (диарея > 1-го месяца); цитомегаловирусная инфекция (за исключением печени, селезенки и лимфоузлов); цитомегаловирусный ретинит; энцефалопатия, ассоциированная с ВИЧ; непрерывно рецидивирующий герпес-симплекс с вовлечением бронхов, легких, пищевода более 1-го месяца и оставляющий на коже глубокие язвы; диссеминированный или внелегочный гистоплазмоз; изоспороз - диарея более 1-го месяца; саркома Капоши; лимфома Беркитта; иммунобластная лимфома; лимфома головного мозга; микобактериальная инфекция (легочная и внелегочная); пневмоцистная пневмония; прогрессирующая, генерализованная лейкоэнцефалопатия; непрерывно рецидивирующий сальмонеллезный сепсис; токсоплазмоз головного мозга; ВИЧ-ассоциированная кахексия.
Основные клинические проявления СПИД-ассоциированного комплекса и СПИДа в соответствии с приведенными классификациями обусловлены оппортунистическими инфекциями и новообразования- ми. В связи с этим необходимо рассмотреть «маркерные» или «индикаторные» для инфекции ВИЧ оппортунистические и опухолевые образования.
I. Инфекции и инвазии
1. Протозойные и гельминтные инвазии: поражение ЦНС токсоплазмами; криптоспоридиоз и изоспоридиоз кишечника, которые вызывают диарею более 1-го месяца; стронгилоидоз, вызывающий пневмонию, поражение ЦНС или диссеминированную инвазию.
2. Инфекции, вызываемые грибами: пневмоцистная пневмония; кандидоз с поражением слизистых различных органов и систем, диссеминированные поражения; криптококкоз с поражением легких, ЦНС, диссеминированные поражения.
3. Бактериальные инфекции: микобактериальная инфекция независимо от вида возбудителя и локализации; легионеллез.
4. Вирусные инфекции: цитомегаловирусная инфекция (ЦМВ) с поражением легких, ЖКТ, ЦНС; вирусы простого герпеса 1-го и 2-го типа, вызывающие хроническое поражение слизистых оболочек и кожи.
II. Злокачественные новообразования
1. Саркома Капоши у лиц моложе 60 лет.
2. Системная лимфома.
Данный перечень все время пополняется в соответствии со все увеличивающейся продолжительностью жизни ВИЧ-инфицированных больных на фоне антиретровирусной терапии и с активизацией оппортунистических инфекций, а также формированием новообразований. Уровень развития лабораторной диагностики определяет возможности этиологической расшифровки у пациентов с инфекцией ВИЧ. Временная последовательность активации и перечень возбудителей СПИД-ассоциированных инфекций отличаются в различных регионах мира. Для стран Африки, Карибской зоны значимость и последовательность манифестации следующая: лидирующее место принадлежит туберкулезной инфекции (причина летальности в 65-75% случаев), далее следует криптоспоридиоз, изоспороз, токсоплазмоз, ЦМВ (цитомегаловирусная инфекция), пневмоцистоз (см. соответствующие разделы).
Наличие перечисленных заболеваний при отсутствии известных причин вторичного иммунодифицита (иммуносупрессивная терапия, новообразования, аутоиммунные заболевания, нерациональная антиби- отикотерапия, обменные нарушения, отравления, интоксикации и т.д.) позволяет предполагать диагноз ВИЧ-инфекции и рекомендовать соответствующее обследование (см. раздел Лабораторная диагностика).
Клиническая картина при перечисленных оппортунистических инфекциях описана в соответствующих разделах руководства. Остановимся на поражениях различных систем при инфекции ВИЧ и их коррекции.
Гастроинтестинальный тракт является, по мнению многих специалистов, наиболее уязвимым у ВИЧ-инфицированных и играет ключевую роль в прогрессировании заболевания, т.к. именно с ним связано развитие такого наиболее распространенного синдрома, как мальабсорбция. На основе множественных рандомизированных международных исследований установлено, что пациенты с ВИЧ-инфекцией имеют оральный кандидоз, серьезную инфекцию периодонта, а также тяжелые поражения аноректальной области, вызванные вирусами герпеса 1-го и 2-го типов. До 60% пациентов имеют постоянную или перемежающуюся хроническую диарею, и к моменту постановки диагноза снижение веса у них достигает 10-15 кг. В основном все эти клинические проявления
достигают своей максимальной выраженности на стадии иммуносупрессии, что соответствует снижению уровня Т4+ лимфоцитов менее 200 клеток на 1 мкл.
Поражения в ротовой полости. Оральный кандидоз присутствует у 80-90% пациентов с ВИЧ-инфекцией. Он хорошо поддается терапии нистатином, клотримазолом, кетоконазолом, флюконазолом, но по окончании лечения возникают рецидивы, что заставляет проводить длительные и повторные курсы терапии. Оральная волосистая лейкоплакия описана исключительно при ВИЧ-инфекции, ассоциируется в настоящее время с инфекцией вирусом Эпштейн-Барр и хорошо поддается терапии ганцикловиром. Вирусы герпеса 1-го и 2-го типов - частая причина болезненных поражений слизистой ротовой полости в виде типичных везикул на гиперемированном основании с последующим формированием на их месте изъязвлений, причем у ВИЧ-инфицированных герпетическая инфекция принимает непрерывно рецидивирующее течение, но, как правило, поддается лечению ацикловиром. Ротовая полость является также обычным местом локализации саркомы Капоши, которая длительно протекает бессимптомно и хорошо поддается лучевой терапии. Поражения периодонта в основном представлены гингивитами и периодонтитами, высоко чувствительными к местному применению хлоргексидина или к системному лечению метронидазолом.
Эзофагит. Одинофагия указывает на поражение пищевода и в основ- ном она обусловлена кандидозом. Далее по значимости имеет значение поражение вирусом простого герпеса, цитомегаловирусом или афтозными язвами. Диагноз ставится с помощью эндоскопического обследования и биопсии. Хорошие результаты получены при лечении кандидоза перорально флюконазолом и кетоконазолом, а в упорных случаях - коротким курсом амфотерицина В внутривенно. При поражении вирусом простого герпеса применяется ацикловир, при ЦМВ используется ганцикловир, афтозные явления купируются кортикостероидами.
Поражение желудка. Больные инфекцией ВИЧ, как правило, страдают желудочной ахлоргидрией, и на этом фоне при гастроскопии и биопсии выявляются поражения, типичные для саркомы Капоши и различные оппортунистические инфекции (см. классификацию).
Тонкий и толстый кишечник. Острые и хронические диареи присущи пациентам с инфекцией ВИЧ и могут присоединяться на любом этапе заболевания, причем для них характерно падение массы тела. От 30 до 60% инфицированных ВИЧ имеют интермиттирующие симптомы диареи, и это связано с патологическим процессом в тонком кишечнике. Основными оппортунистическими инфекциями, вызывающими
хроническую диарею (интермиттирующую или постоянную, продолжающуюся более 1-го месяца), являются: криптоспоридии, микроспоридии, атипичные микобактерии, ЦМВ; именно эти возбудители определяют до 40% всех тяжелых осложнений со стороны кишечника. Криптоспоридии - основная причина интермиттирующей диареи, длящейся месяцами и приводящей к дегидратации и тяжелым электролитным нарушениям. Биопсия тонкого кишечника позволяет выявить атрофию эпителия, гиперплазию крипт, инфильтрацию эпителия лимфоцитами. Функциональные тесты демонстрируют нарушенное всасывание Д-ксилозы, а при исследовании кала определяется отсутствие лейкоцитов. Обычным диагностическим тестом служит обнаружение в стуле ооцист. Частым осложнением криптоспоридиоза являются папиллярный стеноз и обструкция общего желчного протока. Эффективная противомикробная терапия отсутствует. Принято считать, что микроспоридии являются специфичными для ВИЧ-инфицированных; в кале их выявить не удается из-за крайне малых размеров, но они обнаруживаются с помощью электронной микроскопии при биопсии тонкого кишечника. Гистологические изменения подобны таковым при криптоспоридиозе, но возбудители локализуются внутри энтероцитов. Антимикробная терапия пока безуспешна. Атипичный микобактериоз вызывает патологические изменения в тонком кишечнике, характерные для болезни Уиппла, и часто сопровождается бактеремией. Для лечения применяется комбиниция кларитромицина с этамбутолом. ЦМВ - наиболее частая причина диссеминированной инфекции на последней стадии заболевания (СПИД) с поражением желудочно-кишечного тракта на всем протяжении: ротовая полость, пищевод, желудок, тонкий и толстый кишечник, периректальная область. Для нее наиболее характерен диффузный колит с поверхностными изъязвлениями, хорошо диагнос- цируемый при эндоскопии и компьютерной томографии. Симптомы, присущие данной инфекции, включают в себя диарею, абдоминальные боли и примесь крови в стуле. Наиболее частое осложнение - кровотечение из обширных язв, токсический мегаколон, перфорация кишечника. Диагноз окончательно ставится на основании типичных вирусных включений, обнаруживаемых в препаратах при биопсии кишечника. Рекомендуемая в подобных случаях терапия ганцикловиром и фоскарнетом не всегда эффективна.
Среди бактериальных инфекций следует отметить сальмонеллез (особенно вызванный S. typhimurium), который встречается в 20 раз чаще у пациентов с ВИЧ, чем в популяции в целом. Обычно клинические проявления, характерные для сальмонеллеза у ВИЧ-инфицированных,
помимо типичных проявлений этого заболевания включают в себя стойкую лихорадку, ассоциированную с бактеремией и возобновляющуюся после прекращения антибактериальной терапии. Лечение рекомендуется проводить ампициллином или амоксициллином, в случае неудачи назначаются цефалоспорины третьего поколения. Антибиотико-ассоциированные диареи или колиты, обусловленные клостридиями, - результат массивной и длительной антибиотикотерапии. Причиной диареи у данного контингента больных также могут быть шигеллы, кампилобактер, энтеровирусы.
Опухолевые процессы в ЖКТ характерны для пациентов с ВИЧ. Это, прежде всего, саркома Капоши, неходжкинская лимфома, карцинома прямой кишки и ануса. Наиболее типичной считается саркома Капоши, т.к. она встречается у 50% всех пациентов с наличием кожных поражений. Типичная эндоскопическая картина подтверждает диагноз. Обычно клинически саркома Капоши ЖКТ длительно себя не проявляет, но наиболее часто она манифистирует диарейным синдромом, подострой кишечной непроходимостью, нарушением всасывания белков и ректальными изъязвлениями. Лимфома, ассоциируемая с поражением ЖКТ у ВИЧ-инфицированных, - это высокодифференцированная В-лимфома, которая может поражать любую область от полости рта до прямой кишки.
Эндоскопия у пациентов с ВИЧ-инфекцией на стадии СПИДа часто выявляет морфологические изменения в слизистой тонкого кишечника при отсутствии признаков активизации оппортунистических агентов. Для поражения слизистой характерны наличие участков атрофии, редукция крипт, снижение числа клеток, находящихся на стадии митотического деления. При отсутствии оппортунистических и патогенных возбудителей кишечных инфекций подобные нарушения получили название «СПИД-ассоциированной энтеропатии». Клинически для таких пациентов характерно развитие синдрома мальабсорбции. Причина подобных изменений неизвестна, но большинство авторов считает, что в основе ее развития лежит прямое цитопатогенное действие ВИЧ, и хотя выявить в таких случаях оппортунистических агентов не удается, слизистая тонкой кишки атрофична, иннервация ее нарушена, иммунная дисфункция ярко выражена. Последний факт имеет очень большое значение, т.к. в кишечнике представлено 25% всей лимфоидной ткани человека.
Гепатобилиарная система. Превалирует поражение вирусами гепатитов В и С, о чем всегда следует помнить при обследовании ВИЧ-инфицированных. Другой частой причиной гепатоцеллюлярных нарушений является инфекция ЦМВ, вирусом простого герпеса, лекарственные
поражения (препараты группы нуклеозидных аналогов, изониазид, римфапицин). Холестаз зачастую является манифестацией таких серьезных инфекций, как типичный и атипичный микобактериоз, гистоплазмоз, лимфома. Холангиопатия с билиарной обструкцией, как правило, обусловлена криптоспоридиозом, ЦМВ, лимфомой или саркомой Капоши.
В заключение следует подчеркнуть, что основной причиной перитонита у ВИЧ-инфицированных являются перфорации, обусловленные инфекцией ЦМВ, лимфомой желудка (как правило, с вовлечением тер- минальной части подвздошной кишки с ее обструкцией или даже расплавлением), саркома Капоши ЖКТ, атипичные микобактерии при вовлечении в процесс селезенки и ретроперитонеальных лимфоузлов с их расплавлением. Пациенты с холангиопатией, обусловленной инфекцией ЦМВ или криптоспоридиями, зачастую дают спонтанную ремиссию после эндоскопической ретроградной холангиопанкреатографии, но с последующим рецидивом заболевания.
Обширные статистические исследования показывают, что хирургические вмешательства у ВИЧ-инфицированных пациентов малоэффективны и сопровождаются большим количеством самых различных осложнений как в связи с иммуносупрессией, так и с активизацией оппортунистических инфекций, толерантных к антимикробной терапии.
Поражения респираторного тракта (РС) у ВИЧ-инфицированных носят вторичный характер, т.к. эпителиальные клетки не являются мишенью для данного вируса, и развитие патологических изменений обусловлено иммунодефицитом. Этиологически поражение РС очень разнообразно. Среди возбудителей лидирует пневмоцистная пневмония - до 85%. Затем следует цитомегаловирусное поражение, нередко в сочетании с пневмоцистой, далее - туберкулезная микобактерия, легионелла, криптококки, различные грибы (аспергиллы, кандиды, кокцидии), герпес симплекс, токсоплазма; встречаются и пиогенные бактерии. Структура легочной патологии определяется также географическим фактором. В частности, пневмоцистная пневмония, занимающая лидирующее положение в США и Западной Европе (до 85%), уступает свое лидерство туберкулезу легких в Африке, Южной Америке, Восточной Европе. Некоторые поражения легких встречаются у больных ВИЧ на стадии СПИДа, преимущественно в эндемичных регионах, например, гистоплазмоз выявляется при поражении РС в 50% случаев в регионе реки Миссисипи, в Южной Америке, Карибском бассейне. Несмотря на то что поражения РС очень часто сопровождают ВИЧ, основной набор жалоб довольно ограничен и практически не патогномоничен для раз-
личных нозологических форм. В основном встречаются: сухой кашель (до 90%), продуктивный кашель (до 40%), диспное (до 60%), боли в области грудной клетки с большим разнообразием по выраженности и локализации (до 20%), кровохарканье, лихорадка (до 90%), тахипное (до 60-70%).
Трахеиты и бронхиты в основном обусловлены активизацией герпес симплекс 1-го и 2-го типа, кандидозом и аспергиллезом.
Очаговые бронхопневмонии ассоциируются с активизацией кандидоза, H. influenza, Str. pneumoniae, St. aureus, аспергиллеза, криптококкоза.
Пневмонии (интерстициальные и паренхиматозные), как правило, вызываются пневмоцистой, ЦМВ, вирусами герпеса 1-го и 2-го типа, криптококками, кандидой, гистоплазмой, криптоспоридиями, атипичными микобактериями, токсоплазмой (в порядке встречаемости могут быть большие различия в соответствии с географической зоной).
Вовлечение в процесс плевры возможно при токсоплазмозе, кандидозе, ЦМВ, легионеллезе, аспергиллезе, гистоплазмозе, кокцидиоидозе, саркоме Капоши, но все эти поражения не носят гнойного характера. В случае присоединения пиогенных бактерий возможно возникновение пиопневмоторакса.
Среди опухолей легких встречаются саркома Капоши, неходжкинская лимфома.
Особое место занимает туберкулез легких (см. соответствующие руководства).
Поражения центральной нервной системы (ЦНС) при ВИЧ-инфекции обусловлены как сложным сочетанием прямого воздействия вируса иммунодефицита на клетки нервной систем (см. этиологию), так и различными возбудителями, которые встречались у лиц с иммунодефицитом еще в «доспидовскую» эру. Среди наиболее часто встречаемых причин поражения ЦНС у ВИЧ-инфицированных можно выделить следующие:
- первичные поражения, вызванные ВИЧ (энцефалопатия, острый рецидивирующий менингит, миелопатия);
- вторичные вирусные инфекции (энцефалиты, ретиниты, васкулиты, миелиты) ассоциируются с активизацией ЦМВ, вирусов простого герпеса 1 и 2 типа, герпеса зостер, паповавируса;
- вторичные невирусные инфекции (энцефалиты, менингиты, абсцессы) могут быть обусловлены токсоплазмозом, криптококкозом, кандидозом, гистоплазмозом, аспергиллезом, туберкулезом, листериозом, нокардиозом;
- опухоли ЦНС - требуют исключения первичной лимфомы головного мозга и саркомы Капоши.
Могут иметь место также сосудистые нарушения - инфаркты, геморрагии, васкулиты. Непоследнее место при поражении ЦНС занимают побочные эффекты этиотропной (противовирусной) терапии. Поражения ЦНС при ВИЧ-инфекции могут быть распространенными или локальными. Неврологические расстройства крайне разнообразны, среди них различают энцефалит, менингит, ретинопатию, нейропатию, миелопатию. Наиболее часто встречаемыми симптомами являются: моно- и полиневралгии, нарушения чувствительности с разнообразной локализацией, парестезии, судороги, атаксии, нарушения функции тазовых органов, вялые параличи, прогрессирующая мышечная слабость, интеллектуально-амнестические расстройства, психоподобные изменения личности, расстройства памяти, идиотия.
Все вышеприведенные описания поражения при ВИЧ-инфекции свидетельствуют о системном, генерализованном поражении организма при данной патологии, что обусловливает полиморфизм клинических проявлений, и это следует учитывать при первичном выявлении, обследовании и лечении этого контингента пациентов.
Лабораторная диагностика. Используют в основном два теста на антитела к ВИЧ: иммуноферментный анализ, выявляющий антитела к белкам ВИЧ без их идентификации и вестерн-блот, позволяющий устанавливать наличие специфических белков вируса иммунодефицита человека. Материалом для исследования является сыворотка или плазма крови. Диагностика ВИЧ-инфекции может осуществляться определением:
- антител к ВИЧ;
- Р24 антигена;
- вирусной РНК или провирусной ДНК;
- самого вируса.
Выделение вируса может проводить только ограниченное число специализированных лабораторий. Наиболее общедоступным методом является определение антиВИЧ-антител. Скрининговые исследования проводят методом ИФА, подтверждающим методом является Western Blot (метод иммуноблоттинга, позволяющий разделить антитела к различным белкам вируса с их идентификацией). Каждый образец, показавший положительный результат при исследовании ИФА, в обязательном порядке должен подвергаться исследованию методом иммуноблоттинга. Вирусная РНК или провирусная ДНК определяется с помощью ПЦР или обратно-транскриптазной цепной реакции; учитывая нестабильность и быструю изменчивость вируса, данные методы не используются при первичной иденти-
фикации инфицированности ВИЧ. Широкое использование эти методы имеют при мониторинге эффективности противовирусной терапии.
Антитела начинают обнаруживаться с 4-6-й недели от момента инфицирования, но могут появляться и гораздо позже: через несколько месяцев и даже лет. Однажды появившись в крови, они персистируют пожизненно. Подтверждение диагноза инфекции ВИЧ возможно только при положительном результате в вестерн-блоте, т.е. при выявлении антител по крайней мере к двум из трех поверхностных белков вируса p41, p120, p160.
У новорожденных, родившихся от ВИЧ-позитивных матерей, наличие антител не является показателем инфицирования. Их наличие в крови может явиться результатом пассивного трансплацентарного иммунитета, а персистенция антител может продолжаться до 18 месяцев. Поэтому постановка окончательного диагноза у ребенка возможна только после 18 месяцев с помощью выявления в крови вируса, вирусной РНК, а также положительным иммуноблотом.
Лечение. Главным направлением в лечении больных с ВИЧ-инфек- цией является антиретровирусная терапия, в основе которой лежит воздействие на различные системы вируса, что приводит к стагнации его репликации. Одновременно должна проводиться лекарственная терапия, направленная на подавление оппортунистических инфекций. Целью антиретровирусной терапии является снижение вирусной нагрузки, вследствии чего восстанавливается иммунитет и снижается заболеваемость оппортунистическими инфекциями, что, естественно, приводит к повышению качества жизни. Основной показатель восстановления иммунитета - это увеличение числа лимфоцитов CD4. Показателями прогрессии ВИЧ-инфекции и начала антиретровирусной терапии являются уровень вирусной нагрузки более 100 000 копий РНК-ВИЧ, число CD4 лимфоцитов ниже 350 /мкл, клинические симптомы (см. клиническую классификацию), синцитий-образующий штамм ВИЧ.
Все антиретровирусные препараты, используемые в настоящее время, можно разделить на 3 группы: нуклеозидные ингибиторы обратной трансткриптазы (НИОТ), ненуклеозидные ингибиторы обратной транс- криптазы (ННИОТ), ингибиторы протеазы (ИП). Основой действия НИОТ является «замещение» нормальных, необходимых для размножения вируса нуклеотидов на «инертные», ингибирующие дальнейшее воспроизводство генома вируса. ННИОТ, в свою очередь, неконкурентно «ингибируют» обратную транскриптазу ВИЧ. ИП ингибируют протеазы ВИЧ. Учитывая высокую мутационную способность вирусов, в настоящее время лечение проводится комбинацией различных групп
препаратов. Монотерапия является недопустимой. Перечень препаратов все время расширяется и рассматривается в специальных руководствах. Конкретные антиретровирусные препараты, дозы и курсы лечения определяются национальными программами. Лечение оппортунисти- ческих инфекций приведено в соответствующих разделах.
Терапия пациентов с ВИЧ-ассоциированной энтеропатией. Поскольку у большинства пациентов с ВИЧ диарея продолжительна и клинически выражена, необходимо, прежде всего, постараться идентифицировать инфекционный агент, инициирующий ее. Исследования показывают, что инфекционный агент можно выявить только у 30-50% пациентов, и в большинстве случаев это криптоспоридии. Желательно также проведение у таких пациентов контрастной рентгенографии, компьютерной томографии брюшной полости, эндоскопии. Лечение пациентов основано на применении антимикробных препаратов в соответствии с выявленным инфекционным агентом (см. Поражения отделов ЖКТ). Широко используют неспецифические противодиарейные средства: лоперамид, индометацин, соматостатин, соли висмута.
Особое место занимает питание больных с хронической диареей. Многолетние исследования показали, что пациенты с ВИЧ-инфекцией на стадии СПИДа теряют от 15 до 20% своего веса. Диета таких пациентов должна быть высококалорийной, насыщенной белками и витаминами. Факторы, вносящие свою лепту в гиперметаболические процессы при инфекции ВИЧ, это, прежде всего, хронические инфекции, сопровождающиеся лихорадкой, боли при глотании и в ротовой полости, одинофагия, извращение вкусовой и тактильной чувствительности в ротовой полости, депрессия, ВИЧ-ассоциированная субкортикальная деменция, побочные эффекты лекарственных препаратов, СПИД-ассо- циированная энтеропатия (см. выше), оппортунистические инфекции, приводящие к развитию мальабсорбции. Все терапевтические подходы должны коррегироваться в соответствии с перечисленными причинами. Пациенты с диареей должны ограничивать потребление пищи, содержащей растительные волокна, лактозу, кофеин, жир. Эти пациенты зачастую нуждаются в дополнительном питании, в том числе и парентеральном введении питательных смесей.
Следует также учитывать глубокие электролитные нарушения, возникающие на фоне энтеропатии, и, прежде всего, требующие постоянного контроля и коррекции гипонатриемии и гиповолемии.
Профилактика. Основными путями профилактики ВИЧ в соответствии с рекомендациями ВОЗ являются:
- предупреждение половой передачи;
- предупреждение перинатальной передачи;
- предупреждение передачи при переливаниях дериватов крови;
- организация медико-социальной помощи ВИЧ-инфицированным и членам их семей.
Профилактика возможного инфицирования медперсонала сводится к соблюдению правил работы с инфицированными колюще-режущими инструментами. При подозрении на инфицирование рекомендуется прием азидотимидина в течение 1 месяца с последующим наблюдением специалиста 1 год. Беременным ВИЧ-инфицированным и рожденным ими детям назначают антиретровирусную терапию в соответствии с национальными программами. Новорожденные от ВИЧ-инфицированных матерей должны находиться только на искусственном вскармливании. Комплекс перечисленных мероприятий позволяет снизить риск рождения ВИЧ-инфицированных детей до 5%.
1.3.1. ВИЧ-ассоциированные оппортунистические инфекции
1.3.1.1. Изоспороз
Изоспороз - антропонозное заболевание, поражающее только человека и характеризующееся острым энтеритом или энтероколитом и самопро- извольным выздоровлением. У иммуносупрессивных лиц заболевание принимает хронический характер (хроническая диарея) и может приводить к летальному исходу.
Этиология. Возбудители изоспороза - представители простейших рода Isospora. У человека вызывают заболевание I. belli и I. natalensis. Жизненный цикл изоспор состоит из двух фаз - экзогенной (разви- тие во внешней среде) и эндогенной (развитие в организме человека). Характерным является чередование бесполого (во внешней среде и в организме человека) и полового (только в организме человека) размножения. После созревания ооцисты, попавшей в кишечник человека, из нее выходят спорозоиты, которые внедряются в эпителиальные клетки 12-перстной и тощей кишок, где они располагаются под ядром энтероцитов. Спорозоиты превращаются в трофозоиты, которые растут и увеличиваются в размерах, далее, после созревания, ядро многократно делится, и в результате формируется шизонт. Вокруг каждого дочернего ядра обособляется цитоплазма. Мерозоиты, образовавшиеся из шизонта, «выпадают» из пораженных эпителиальных клеток в просвет кишечника и поражают все новые и новые энтероциты. В дальнейшем часть мерозоитов трансформируются в мужские (микрогаметоциты) и женские (макрогаметоциты). Из макрогаметоцитов образуются зрелые мак-
рогаметы, занимающие весь энтероцит. В микрогаметоците происходит многократное деление ядра. Вновь образующиеся ядра имеют удлиненную форму, они обособляются друг от друга небольшим количеством цитоплазмы и превращаются в мелкие микрогаметы, имеющие по 2 жгутика, и покидают энтероцит. Затем микрогаметы активно проникают в макрогамету, которая превращается в зиготу, и далее - в незрелую ооцисту. Незрелые ооцисты выделяются в окружающую среду с фекалиями, где при температуре +25 ?С в течение 2-3-х суток превращаются в спороцисты, в каждой из которой через 18-36 часов образуется по 4 спорозоита. Зрелые ооцисты изоспор очень устойчивы в окружающей среде: низкие температуры 0-5 ?С замедляют споруляцию, но при наступлении благоприятных условий она возобновляется, при температуре -21 ?С спорулированные изоспоры выживают до 1-го месяца.
Эпидемиология. Изоспороз - антропонозное заболевание, единственным хозяином возбудителя которого является человек. Источник инвазии - только человек, больной острой или хронической формами изоспороза, или носитель. Ооцисты в фекалиях больного появляются лишь на 10-12-й день от начала заболевания. Непосредственная передача возбудителя от человека к человеку не происходит, т.к. ооцисты созревают в аэробных условиях почвы в течение 2-3-х суток. Таким образом, минимальное время оборота инфекции составляет 2 недели (2-3 суток в окружающей среде и 10-12 суток в организме человека). Наиболее активно выделение возбудителей происходит после 16-30 дней от начала болезни, следовательно, больные изоспорозом наиболее опасны в период стихания клинических симптомов. Механизм заражения - фекально-оральный.
Очаги изоспороза приурочены к тропическим и субтропическим регионам. Спорадические случаи встречаются повсеместно.
Патогенез. Эндогенные формы изоспор разрушают эпителий ворсинок тощей и подвздошной кишки, где завершается мерогония. При обширных поражениях образуется лейкоцитарный экссудат, изменяется структура цилиндрического эпителия, происходят атрофия ворсинок, метаплазия энтероцитов, гиперплазия крипт. Все это приводит к нарушению всасывания и развитию синдрома мальабсорбции.
Клиническая картина. Инкубационный период составляет в среднем 7 дней. У иммунокомпетентных лиц заболевание протекает в виде острого энтерита или энтероколита, сопровождается жидким стулом с примесью слизи, иногда крови и одновременным появлением общих симптомов интоксикации (тошнота, рвота, анорексия). Беспокоят боли по всей поверхности живота, как постоянные, так и схваткообразные. Заболевание самоизлечивается в течение 18-31 суток.
У иммуносупрессивных лиц, в том числе ВИЧ-инфицированных, развивается хроническая форма заболевания, сопровождающаяся стеатореей, потерей белков, что приводит к быстрому снижению массы тела до 25% и более. Нарушается всасывание Д-ксилозы и витамина В12. Исход может быть летальным. У больных СПИДом изоспороз встречается довольно часто и служит одной из причин смерти этих пациентов.
Лабораторная диагностика. Характерным признаком является нарастающая эозинофилия. Изоспоры можно обнаружить в фекалиях человека при использовании метода обогащения с последующей микроскопией мазков, т.к. паразитов в кале немного. Исследование проводят многократно, наиболее информативным его считают в период с 16-й по 31-й день клинических проявлений.
Лечение в основном симптоматическое (см. Криптоспоридиоз). Этиотропная терапия не разработана.
1.3.1.2 Криптококкоз
Криптококкоз - заболевание, вызываемое представителем дрожжепо- добных грибов рода Cryptoccocus, относящееся к оппортунистическим инфекциям. У иммунокомпетентных лиц возбудитель локализуется в легких, при иммунодефицитных состояниях происходит генерализация процесса с вовлечением мозговых оболочек, почек, кожи, костного аппарата. Криптококкоз относится к СПИД-маркерным заболеваниям.
Этиология. Возбудитель криптококкоза относится к дрожжеподобным грибам рода Cryptoccocus, включающего в себя большое число видов, из которых только C. neoformans считается патогенным для человека. Хорошо растет на большинстве питательных сред, в широком температурном диапазоне от -20 ?С до +37 "С. Возбудитель обладает значительной устойчивостью к факторам внешней среды, сохраняется в почве длительное время. Существует две разновидности C. neoformans. В Европе и Северной Америке распространен C. neoformans var. neoformans, а в тропической и субтропической зонах - C. neoformans var. gatti. Оба варианта патогенны для человека. У больных СПИДом преобладает C. neoformans var. neoformans (даже в тропических районах, где ранее был распространен только C. neoformans var. gatti, теперь у ВИЧинфицированных встречается преимущественно C. neoformans var. neoformans). Дрожжевая фаза C. neoformans имеет сферическую, округлую или овальную форму, средний размер клеток от 8 мкм до 40 мкм, причем у одного и того же пациента могут выделяться как мелкие, так и крупные разновидности. Возбудитель размножается почкованием. Толстая стенка гриба окружена светопреломляющей мукополисахаридной капсулой,
размеры которой варьируют от практически неопределяемой до толщины, равной двум диаметрам самой грибковой клетки. Описано явление филаментации C. neoformans в срезах тканей мозга и легких. В культуре возможно образование мицелий и псевдомицелий. Совершенные формы имеют гифы, на которых образуется большое количество боковых и концевых базидий, из которых формируются гаплоидные базидиоспоры. Наиболее часто встречаемой формой в тканях являются круглые, инкапсулированные клетки. Хотя возбудитель криптококкоза обладает способностью поражать все ткани организма, но в основном размножение происходит в ЦНС. Существует несколько предположений, объясняющих нейротропизм этого паразита. Считается, что в сыворотке крови человека содержится антикриптококковый (по другим источникам более универ- сальный - фунгистатический) фактор, который отсутствует в спинно-мозговой жидкости (СМЖ). Росту возбудителя также способствует наличие в высокой концентрации тиамина, глютаминовой кислоты, углеводов, в избытке присутствующих в СМЖ. В ЦНС отсутствуют клеточные факторы иммунитета, играющие ведущую роль в ограничении роста грибковой флоры. Однако основным фактором патогенности у криптококка является полисахаридная капсула, способствующая его внедрению, размножению и генерализации в инфицированном организме. Кроме капсульных антигенов у возбудителя имеются соматические антигены, обладающие свойствами эндотоксина грамотрицательных бактерий. Следует отметить, что все антигены криптококков, несмотря на выраженное патогенное действие, обладают низкой иммуногенностью.
Эпидемиология. Грибы рода Cryptoccocus убиквитарны, они постоянно обнаруживаются во внешней среде. Вариант neoformans встречается преимущественно в Северной Америке, Европе и Японии. Вариант gatti распространен в Австралии, Вьетнаме, Таиланде, Камбодже, Непале, Центральной Америке. Грибы были выделены из молока, масла, различных овощей и фруктов, из воздуха помещений. Считается, что основным источником инфицирования людей является помет голубей и обильно загрязненная их пометом почва. Заражение происходит аэрогенно путем вдыхания мелких дрожжевых клеток с частицами пыли, но при определенных условиях возможно заражение и через поврежденную кожу, слизистые оболочки, алиментарным путем. Внутриутробная передача, а также передача от человека человеку не описаны. Учитывая повсеместное распространение криптококка, принято считать, что инфицированию подвергаются практически все люди, но риск развития манифестных клинических форм очень мал. Группами риска развития клинически выраженных форм болезни являются лица с различными иммунодефицитными состояниями.
Патогенез. Входными воротами инфекции является дыхательный тракт. Аэрозоль, содержащий возбудителя (пыль, отделяемое со слизистых больного или носителя), попав в респираторный тракт, приводит к формированию в легких первичного очага, который у иммуносупрессивных лиц может явиться источником дальнейшей гематогенной диссеминации в органы и ткани. Считается, что инфицирующими являются мелкие, бескапсульные, дрожжеподобные клетки диаметром менее 2 мкм, способные с током воздуха достигнуть альвеол. Предполагается, что базидиоспоры вследствии их малого размера также могут считаться патогенными. В организм человека криптококки могут попасть также через поврежденную кожу, слизистые оболочки, ЖКТ. У иммунокомпетентных лиц болезнь протекает стерто, локально и спонтанно заканчивается санацией организма. Фактором, способствующим развитию криптококковой инфекции, является врожденный или приобретенный иммунодефицит, в основном его клеточного звена. У лиц с сохраненным иммунным статусом возбудитель криптококка, попав в легкие, персистирует там месяцами или годами и лишь при изменившихся условиях (иммуносупрессия) начинает размножаться и диссеминировать в организме, поражая различне ткани и органы. Косвенным доказательством данного положения служит высокая пораженность криптококкозом больных СПИДом.
Клиническая картина криптококкоза определяется состоянием иммунной системы инфицированного. Среди манифестных форм различают хроническое течение инфекции у практически здоровых лиц (хронический рецидивирующий менингоэнцефалит) и острое, зачастую молниеносное течение у лиц с различными дефектами иммунной системы.
Течение инфекции у иммунокомпетентных лиц, как правило, стертое, жалобы носят неспецифический характер - головные боли, вначале периодические, а затем постоянные, головокружение, тошнота, рвота, раздражительность, утомляемость, снижение памяти, психические расстройства. В результате повышения внутричерепного давления выявляются застойный диск зрительного нерва, симптомы менингизма. За счет поражения черепномозговых нервов могут снизиться острота зрения, появиться диплопия, нейроретиниты, нистагм, анизокария, птоз, атрофия зрительного нерва, паралич лицевого нерва. Температура может быть несколько повышена, но иногда отмечается стойкий субфебрилитет; бывают ночные поты, боли в грудной клетке. У здоровых лиц иногда возможны проявления со стороны дыхательного тракта - небольшой кашель, изредка с мокротой. Во многих случаях заболевание самоэли-
минируется, выявляясь в основном при профилактическом рентгенологическом исследовании в виде остаточных явлений в легких. У лиц без иммунодефицита возможно поражение кожных покровов при их повреждении. В целом криптококковая инфекция у лиц с нормальным иммунным статусом протекает доброкачественно, заканчивается выздоровлением и оставляет после себя резидуальные изменения, особенно после менингоэнцефалита.
Течение криптококкоза у иммуносупрессированных лиц острое. Чаще всего заболевание начинается с явлений острого менингоэнцефалита с лихорадкой и быстрыми нарастающими признаками дисфункции мозга: апатия, атаксия, нарушение сознания, сомноленция, кома. Процесс быстро принимает генерализованный характер. У пациента быстро нарастают явления гипотензии, ацидоза с быстро нарастающим дисбалансом перфузионно-вентиляционных показателей, что связано с вторичным вовлечением в процесс интерстиция легких. Иногда первичный очаг повреждения локализован в легких, в этом случае процесс начинается с появления тупых, ноющих болей в грудной клетке, кашля с мокротой и прожилками крови. Учитывая, что процесс охватывает интерстиций легочной ткани, на первый план выступает быстро нарастающая дыхательная недостаточность (тахипноэ, удушье, быстро нарастающий акроцианоз). На рентгенограммах при легочном криптококкозе выявляются изолированных паренхиматозных инфильтратов, очень характерно появление изолированных инфильтратов в виде «монет», хорошо очерченных в средних или нижних долях легкого (2-7 см в диаметре). Но могут встречаться и большие, нечеткие инфильтраты, зачастую напоминающие злокачественное поражение легких. Казеозные полости крайне редки и не характерны, но иногда встречаются мелкоочаговые распространенные поражения легких, напоминающие милиарный туберкулез. Вместе с тем для криптококкоза не характерна кальцификация, а также отсутствует фиброз. У больных с генерализованной формой может поражаться кожа на лице, шее, туловище, конечностях в виде небольших папул, пустул, язвенно-вегетирующих очагов или язвенных дефектов, сходных с базалиомой кожи. Лимфоузлы не увеличены. При диссеминированных поражениях возможен занос криптококков в кости черепа, ребра, крупные трубчатые кости. В месте поражения выявляется припухлость и болезненность, могут появляться так называемые холодные абсцессы, как и при туберкулезе костей. При рентгеновском исследовании, как правило, визуализируются деструктивные очаговые изменения. При диссеминированном криптококкозе возможно поражение надпочечников, миокарда, печени, почек, простаты.
Течение
инфекции у больных ВИЧ отличается своеобразием. На долю криптококкоза
ЦНС приходится от 60 до 90% всех случаев криптококкоза при ВИЧ.
Поражение ЦНС разворачивается у больных ВИЧ на стадии СПИДа на фоне
генерализованной формы криптококкоза. Температурная реакция редко
превышает
Криптококкоз легких у больных с ВИЧ протекает со снижением массы тела, лихорадкой, кашлем, иногда с отделением скудной мокро- ты, диспноэ, появлением болей в грудной клетке, обусловленных вовлечением плевры. Рентгенологически выявляются как одиночные, так и диффузные интерстициальные инфильтраты с поражением корней легкого и иногда наличием плеврального выпота. В случае диссеминированного криптококкоза легких развивается острая интерстициальная пневмония со скоплением криптококков в альвеолярном интерстиции.
Поражения кожи криптококком у больных с ВИЧ представлены пиг- ментированными папулами, пустулами, язвенно-некротическими очагами. Поражения кожи носят как локальный, так и диффузный характер.
У пациентов с ВИЧ часто поражаются почки, причем процесс протекает бессимптомно, но может протекать по типу пиелонефрита с медуллярным некрозом почек. Причем после первичного лечения очагом пер- систирующей инфекции может стать предстательная железа.
Дифференциальная диагностика. Клиническая картина криптококкоза столь полиморфна, что дифференциальный диагноз приходится проводить в зависимости от локализации поражения, и необходимо помнить, что это заболевание может всего лишь отражать иммуносупрессивное состояние, обусловленное основным заболеванием или неблагоприят-
ными факторами, приводящими к иммуносупрессии, или же оно может выступать как маркерное при ВИЧ-инфекции. Криптококковый менингит дифференцируют с туберкулезным менингитом, вирусным менингоэнцефалитом, метастатическим процессом, менингитами различной микотической природы, бактериальными менингитами. Легочные поражения заставляют исключать опухоль легкого, метастазы злокачественных новообразований, туберкулез, саркому. Кожные поражения при криптококкозе из-за их непатогномоничности требуют исключения сифилиса, туберкулеза кожи, базальноклеточного рака кожи. Поражение костей следует отличать от остеомиелита, периостита бактериальной или туберкулезной природы.
Диагностика. Диагностика криптококкоза основана на комплексе клинико-лабораторных данных. У больных с ВИЧ-инфекцией при развитии у них менингоэнцефалита и менингита всегда показано обследование на криптококкоз, т.к. именно этот возбудитель является одной из ведущих причин поражения ЦНС у этих больных. Лабораторные методы диагностики включают в себя микроскопическое исследование окрашенных тушью препаратов СМЖ, мокроты, гноя, другого биологического отделяемого и тканей организма. Возможно выявление антигена C. neoformans с помощью реакции латекс-агглютинации в этих же биологических средах.
Диагноз ставится при обнаружении почкующихся дрожжевых клеток, окруженных прозрачной капсулой при окраске тушью. Диагноз может быть подтвержден получением чистой культуры и идентификацией возбудителя, поскольку C.neoformans легко выделяется из крови больных СПИДом.
Лечение. При
развитии криптококкового менингита у лиц без ВИЧ- инфекции
рекомендуется амфотерицин В в/в 0,7-1,0 мг/кг 1 раз в сутки в сочетании
с флуцитозином в/в 25 мг/кг 4 раза в сутки - 2 недели, затем
флюконазол внутрь
ции показан флюконазол внутрь по 0,2-0,4 г 1 раз в сутки или итраконазол внутрь по
1.3.1.3. Криптоспоридиоз
Криптоспоридиоз - зоонозное заболевание, поражающее все группы позвоночных и человека и характеризующееся острой диареей и самопроизвольным выздоровлением; у иммуносупрессивных лиц принимает хронический характер (хроническая диарея) и может приводить к летальному исходу.
Этиология. Возбудители - представители рода Cryptosporidium, отно- сятся к простейшим. В настоящее время считается, что млекопитающие, в том числе человек, инфицируют только два вида криптоспоридий C. muris и C. parvum. Криптоспоридии имеют вид мелких (2-6 мкм) сферических образований и заселяют микроворсинки эпителия тощей кишки, располагаясь рядами вдоль щеточной каемки. Несмотря на то что микроорганизмы выглядят просто «приклеенными» к поверхности клетки, на самом деле они находятся внутриклеточно, внутри вакуоли образованной мембраной клетки хозяина, но вне ее цитоплазмы. Инфекционные формы - ооцисты - поступают в просвет кишечника и выходят с калом. Попав в ЖКТ другого животного или человека, ооцисты высвобождают спорозоиты, которые прикрепляются к поверхности эпителия и начинают новый жизненный цикл. Все варианты возбудителя морфологически неразличимы и рассматриваются как один возбудитель.
Эпидемиология. Люди заражаются от животных, друг от друга, а также через воду, предметы обихода, продукты питания, при несоблюдении правил гигиены. Заболевание встречается повсеместно, особенно высок риск заражения у детей, туристов, гомосексуалистов, а также медицинских работников, ухаживающих за больными криптоспоридиозом.
Патогенез. Основным местом обитания паразита является прокси- мальный отдел тонкой кишки, хотя инфекция, особенно у иммуносупрессивных лиц, может распространяться по всей длине пищеварительного тракта и поражать желчевыводящие пути и дыхательный тракт. Макроскопически кишечная стенка выглядит интактной, или имеются признаки катарального воспаления. Гистологически эндогенные стадии развития криптоспоридий выглядят как мелкие (3-5 мкм), одноклеточные, округлые тельца, которые кажутся приклеенными к поверхности щеточной кишечной каемки и неравномерно разбросаны по ворсинкам и криптам. Lamina propria инфильтрирована плазматическими клетками, нейтрофилами, лимфоцитами. Инфицированная клетка хозяина (энтероцит) теряет микроворсинки, у ее основания формируются паразито-
морфная вакуоль и питающие органеллы. В результате способность энтероцитов к всасыванию резко сокращается, и это приводит к повышению секреции воды и электролитов из плазмы, т.е. развивается осмотическая диарея и как следствие, синдром мальабсорбции. Предполагается, что выделение токсических метаболитов непосредственно в энтероцит в совокупности с распространением процесса на Lamina propria может обеспечить наблюдаемый патологический процесс. Следовательно, сокращение функционирующей поверхности пораженной слизистой и, как следствие, снижение выработки многих ферментов приводят к нарушению всасывательной способности тонкой кишки, в результате чего возникает осмотическая диарея. Имеющаяся лактазная недостаточность приводит к тому, что дисахариды накапливаются в просвете кишки и, являясь гидрофильными, остаются в ее просвете, связывая воду и продвигаясь в толстый кишечник. Здесь лактоза расщепляется бактериями, что увеличивает количество молекул данного субстрата, которые еще больше забирают на себя воду в просвет уже толстой кишки. Стул у больных криптоспоридиозом имеет кислую реакцию и содержит большое количество восстановленных сахаров.
Клиническая картина. У иммунокомпетентных лиц криптоспоридиоз протекает как острое непродолжительное кишечное заболевание. Инкубационный период колеблется от 5 до 14 дней. Основной клинический симптом - остро возникающая водянистая диарея. Отмечается стул от 2-х до 20 раз в сутки, испражнения имеют зловонный характер, не содержат примесей крови и слизи. Потеря жидкости может достигать более 10% массы тела. Одновременно с диареей у больного имеются подъем темпе- ратуры, тошнота, рвота, отсутствие аппетита, слабость, головная боль, миалгии. Боли в животе носят спастический характер и локализуются в верхних отделах живота, преимущественно в правом верхнем квадранте. Отмечается «урчание» по ходу тонкого кишечника. Заболевание длится 1-2 недели и заканчивается выздоровлением без лечения. Паразиты исчезают из стула через 1-3 недели после выздоровления.
Совсем другое течение криптоспоридиоз приобретает у лиц с иммунодефицитом, в частности, у ВИЧ-инфицированных. Заболевание у них принимает тяжелое хроническое течение, нередко заканчивающееся при отсутствии терапии летальным исходом. Большинство таких пациентов имеют частый стул до 6-25 и более раз в сутки, что приводит к значи- тельным водным потерям до 3-20 л в сутки, электролитным нарушениям. В стуле отсутствуют воспалительные клетки и кровь. Заболевание сопровождается стойкой лихорадкой, спастическими болями в верхней половине живота, быстрым развитием синдрома мальабсорбции, поте-
рей массы тела до 50% первоначальной. Отмечаются симптомы холецистита и холангита. Течение процесса может быть как непрерывным, так и рецидивирующим. Продолжительность диареи может составлять от нескольких недель до нескольких лет и находиться в прямой зависимости от иммунного статуса больного. В Африке криптоспоридиоз и сопутствующая ему кахексия послужили основанием для названия СПИДа как «slim disease», что означает «истощающая болезнь».
Дифференциальный диагноз. Дифференциальный диагноз следует проводить с холерой, для которой не характерна температурная реакция и зловонный, сохраняющий каловый характер стул. Дифференциальный диагноз с пищевыми токсикоинфекциями основан на лабораторных данных.
Диагностика. Диагноз подтверждается выделением кислотоустойчивых ооцист из кала с последующим окрашиванием мазков по ЦилюНильсену. Наиболее интенсивно ооцисты выводятся из организма в первые 4 суток заболевания, но продолжают выделяться вплоть до окончания диареи. Имеются моноклональные антитела, меченные флуоресцеином, которые обеспечивают надежное выявление ооцист в образцах кала.
Лечение. Эффективное лечение не разработано. Использование антибиотиков пока не доказало их эффективность. Основой лечения является восполнение потерь жидкости и восстановление электролитного баланса, НПВП, лоперамид, лечебное питание.
1.3.1.4. Пневмоцистоз
Пневмоцистоз - поражение легких, вызванное внеклеточным паразитом Pneumocystis carinii, отличающимся строгим тропизмом к легочной ткани и относящимся к грибам. Это типичная оппортунистическая инфекция, приводящая к летальному исходу пациентов с нарушенным иммунным статусом, прежде всего с ВИЧ-инфекцией.
Этиология. Pneumocystis carini является уникальным микробом, который относят к условно патогенным дрожжеподобным грибам. Однако по морфологии и циклу развития он являеся типичным простейшим.
В процессе жизненного цикла пневмоцисты проходят через стадии трофозоитов, предцист, цист и внутрицистных телец.
Трофозоиты представляют собой овальной или амебовидной формы клетки размером 1,5-5 мкм, которые покрыты пелликулой и капсулой. С помощью выростов пелликулы трофозоиты прикрепляются к пневмоцитам 1-го порядка.
Округляясь, трофозоиты образуют утолщенную клеточную стенку и превращаются в предцисту и цисту. Предцисты находятся в пенистом
экссудате альвеол. Циста размером 4-8 мкм имеет толстую трехслойную стенку, которая интенсивно окрашивается красителями для полисахаридов. Внутри цисты образуется розетка из 8 дочерних тел (спорозоитов). Внутрицистные тела размером 1- 2 мкм в диаметре имеют мелкое ядро и окружены двухслойной оболочкой. После выхода из цисты они превращаются во внеклеточные трофозоиты.
Эпидемиология. P. cаrinii распространена повсеместно. Источником инфекции в основном является больной пневмоцистозом человек или носитель, но не исключаются домашние и дикие животные. Описаны случаи падежа скота от пневмоцистоза (свиней, козлят, жеребят), а также собак. В эксперименте у лабораторных животных пневмоцистоз вызывают введением больших доз кортикостероидов или цитостатиков (имитируя состояние иммунодефицита). Механизм передачи - респираторный, другие пути не доказаны. В результате лабораторных экспериментов на животных показано, что пневмоцистоз развивается в основном в результате реактивации латентной инфекции при иммуносупрессии, нежели при первичной инфекции. Цисты паразита вне биологических организмов до настоящего времени обнаружить никому не удалось.
Основные группы риска заболевания пневмоцистозом: ослабленные и недоношенные дети, дети старшего возраста и взрослые с гематоло- гическими и онкологическими заболеваниями, реципиенты органов, больные ВИЧ на стадии СПИДа, у которых пневмоцистоз является причиной смерти в 60% случаев.
Патогенез. Макроскопически пневмоцистная пневмония представляет собой типичный диффузный интерстициальный легочный процесс. Наиболее типичным признаком поражения легочной ткани является билатеральное диффузное интерстициальное поражение, четко отграниченное от непораженной области паренхимы. При гистологическом исследовании альвеолы заполнены пенистым экссудатом, состоящим из фибрина, иммуноглобулинов, эозинофилов, десквами- рованных альвеолярных макрофагов. В пенистом экссудате при окраске его гематоксилин-эозином и толуидиновым синим видны цисты или внутрицистные тельца паразита. При электронной микроскопии видны также трофозоиты, предцисты, пустые цисты. Трофозоиты поражают стенку пневмоцитов 1-го типа, плотно прикрепляясь к ним с помощью филоподий.
В результате поражения альвеолярных капилляров повышается проницаемость эндотелия и запускается процесс дегенерации пневмоцитов 1-го порядка. Затем стенки альвеол инфильтрируются мононуклеарами, а интерстиций - плазматическими клетками. На этом фоне происходит
повреждение сурфактанта, что неизбежно ведет к отсутствию растяжения альвеол при дыхательной экскурсии. Совокупность всех этих процессов приводит к развитию альвеолярно-капиллярного блока и тяжелой аноксии.
Тяжесть процесса при пневмоцистозе в значительной степени определяется наличием интеркуррентных оппортунистических инфекций, среди которых лидирующее положение занимает ЦМВ, что позволяет предполагать симбиотическое взаимодействие этих возбудителей у лиц с иммунодефицитом.
Отличительной особенностью пневмоцистоза является его ограниченность в связи с тропностью данного возбудителя к альвеолярному эпителию. Имеются единичные сообщения об обнаружении данного воз- будителя во внутрилегочных лимфоузлах, печени, селезенке, в камерах сердца, в трансплантацитарной почке. В основе редкой диссеминации возбудителя лежат его биологические особенности, т.к. пневмоциста не является внутриклеточным паразитом и поэтому не может диссеминировать с моноцитами-макрофагами в кровеносное русло. Паразит также не выделяет биологических агентов, способствующих проникновению через биологические мембраны и циркуляции возбудителя.
Основной причиной возникновения патологических процессов в легких является механическое повреждение альвеолярной стенки и контактное воздействие на нее метаболитов паразита. Предполагается, что только в случае попадания цист эндоваскулярно возможна диссеминация возбудителя на фоне глубокой иммуносупрессии, обусловленной нарушением клеточного звена иммунитета (например, больные СПИДом) и различными формами агаммаглобулинемии. У иммунокомпетентных лиц большинство пневмоцист фагоцитируются альвеолярными макрофагами. О наличии контакта организма хозяина с паразитом можно судить по обнаружению сывороточных антител к пневмоцисте. При первичном инфицировании пневмоцистозом детей с пониженным питанием установлено повышение концентрации иммуноглобулинов класса М вскоре после заражения, а через 4-6 недель - и иммуноглобулинов G. Специфические антитела классов М, G и A обнаруживаются и у здоровых лиц. В настоящее время показано, что у иммунокомпетентных лиц специфические антитела фиксируют комплемент на поверхности P. carinii, способствуя тем самым фагоцитозу пневмоцист альвеолярными макрофагами. При иммунодефицитных состояниях в условиях дефекта гуморального звена иммунитета и снижения уровня комплемента альвеолярные макрофаги теряют способность не только к распознаванию и фиксации возбудителя, но и утрачивают способность к фагоцитозу.
У больных СПИДом с клиникой пневмоцистной пневмонии практически не определяются антитела класса М, в отличие от больных СПИДом без пневмоцистной пневмонии, что позволило сделать вывод о благо- приятном прогностическом значении наличия IgM к пневмоцисте при иммунодефиците. Все перечисленные патологические изменения свидетельствуют об отсутствии протективного иммунитета при пневмоцистной пневмонии, что и обусловливает ее рецидивы на стадии СПИДа у ВИЧ-инфицированных.
Клиническая картина. Течение инфекции у иммунокомпетентных лиц бессимптомное, в основном это паразитоносительство. Стадийность при этой форме заболевания не прослеживается. В случае развития у таких пациентов пневмоцистной пневмонии длительно, иногда до 6 месяцев, могут беспокоить сухой, постоянный кашель, сопровождающийся одышкой, нередко нарастающей, чувство заложенности в грудной клетке, иногда присоединяется отхождение пенистой мокроты. Выздоровление - спонтанное, при назначении этиотропной терапии - очень быстрое. Спорадический, клинически выраженный пневмоцистоз у взрослых развивается у лиц с врожденными или приобретенными иммунодефицитными состояниями. Инкубационный период составляет 3- 5 суток. Начало болезни острое: быстрое повышение температуры до фебрильных цифр, головная боль, слабость, выраженная потливость, боль в грудной клетке без четкой локализации, быстро нарастающие явления дыхательной недостаточности на фоне сухого кашля, тахипноэ. ЧДД быстро нарастает до 30-50 в минуту. Затем присоединяются цианоз носогубного треугольника, акроцианоз, втягивание межреберных промежутков, которое свидетельствует об участие в акте дыхания вспомогательной мускулатуры и развитие дистресс-синдрома; летальность без лечения составляет 90-100%. Причиной смерти является асфиксия.
Пневмоцистная пневмония у взрослых на стадии СПИДа развивается при снижении количества CD4 ниже 200 клеток/мкл. У большинства больных в анамнезе удается выяснить наличие длительной, постепенно нарастающей одышки и сухого кашля на протяжении нескольких недель, или же заболевание возникает остро, за несколько дней, без предшествующих продромальных явлений. На рентгенограммах грудной клетки на первых стадиях заболевания находят лишь усиление легочного рисунка, но у 10-20% больных рентгенологическая картина может не иметь выраженных изменений. Во второй стадии (выраженных дыхательных нарушений) уже присутствуют диффузные, двусторонние прикорневые инфильтраты, распространяющиеся от корней легких к периферии. Участки повышен-
ной пневматизации сочетаются с перибронхиальной инфильтрацией, картина легких на этой стадии получила целый ряд своеобразных названий: «матовое стекло», «хлопья снега», «ватные легкие». В этой же стадии появляются характерные для пневмоцистоза дисковидные ателектазы, которые, в свою очередь, осложняют течение заболевания с развитием спонтанного пневмоторакса, пневмомедиастинума. При этом признаки уплотнения легочной ткани нечеткие, плевральные выпоты отсутствуют, если же они присутствуют, то следует исключать поражение легких другой природы. После перенесенной пневмоцистной пневмонии на рентгенограмме выявляется деформация легочного рисунка, формируются клинико-рентгенологические признаки пневмофиброза. Для 30% больных ВИЧ на стадии СПИДа характерно отсутствие на рентгенограммах типичных клинико-рентгенологических признаков пневмоцистной пневмонии, или имеются следующие атипичные признаки: асимметричные инфильтраты; лобарные или сегментарные инфильтраты; локализация процесса только в верхних отделах легких; единичные легочные лимфоузлы; тонкостенные «кистоподобные» образования. Учитывая, что процесс не носит генерализованного характера (см. патогенез), клинически значимых проявлений со стороны паренхиматозных органов и клинико-лабораторных данных, за исключением функциональных дыхательных проб, нет. Диагноз строится по совокупности клинико-рентгенологических данных и подтверждается паразитологическим исследованием.
Диагностика и дифференциальная диагностика. Диагноз подтверждается выявлением P. carinii в материале, полученном при транстрахеальной аспирации, трансторакальной пункционной аспирации, открытой биопсии легких или при бронхоскопии используют микроскопический и серологический методы. Возбудитель обнаруживается путем окрашивания гистологического материала метаминовым серебром, по Гимса, по Граму-Вейгерту, Райту-Гимза или с помощью моноклональных антител.
Серологические исследования проводят с использованием РИФ и ИФА, определяя наличие специфических IgM или нарастание титра IgG в парных сыворотках. В качестве альтернативы используется бронхоско- пия с исследованием бронхоальвеолярного лаважа и щеточной биопсией. Для исследования берут также самостоятельно отходящую мокроту, либо мокроту, полученную с помощью стимуляции ингаляцией.
Дифференциальный диагноз следует проводить с туберкулезом, микоплазменной инфекцией, цитомегаловирусной инфекцией, гистоп- лазмозом, криптоспоридиозом (см. соответствующие разделы). Основой дифференциального диагноза является только лабораторное подтверждение (из-за сходства ренгенологических проявлений).
Лечение. Препаратом
выбора является триметоприм/сульфаметокса- зол (ТМП/СМК): 20/100
мг/кг/сут в 4 приема, внутрь или в/в в течение не менее 21 дня. Терапия
должна быть начата немедленно, причем раннее назначение терапии не
затрудняет лабораторное подтверждение, т.к. цисты сохраняются несколько
недель. Побочные эффекты, особенно у больных СПИДом, это - кожная
сыпь, нейтропения, лихорадка. Альтернативная терапия - пентамидин (4
мг/кг/ в/в 1 раз в день, 21 день), побочные эффекты также очень
выражены (почечная недостаточность, токсическое поражение печени,
гипогликемия, лейкопения, лихорадка, диспепсия). Летальность среди
пролеченных больных со СПИДом составляет от 10 до 30% (без лечения -
100%). Дополнительное лечение кортикостероидами рекомендуется при РаО2 <
сон с ТМП.
1.3.1.5. Цитомегаловирусная инфекция
Цитомегаловирусная инфекция относится к заболеваниям, вызываемым вирусами группы герпеса, для которых характерно персистирование в организме хозяина в латентном состоянии. При внутриутробном и перинатальном заражениях, а также у иммуносупрессивных лиц может протекать в тяжелой форме с вовлечением паренхиматозных органов, ЦНС и приводить к летальному исходу.
Этиология. Человеческий цитомегаловирус (ЦМВ) - самый большой и наиболее сложно организованный герпевирус человека. Цитомегаловирус (ЦМВ), или вирус герпеса человека 5-го типа (ВГЧ-5), относится к семейству Herpesviridae, подсемейству Betaherpesvirinae, роду Cytomegalovirus.
ЦМВ (ВГЧ-5) является сложно организованным ДНК-содержащим вирусом. Капсид, построенный по кубическому типу симметрии, снаружи окружен липопротеиновой оболочкой с гликопротеиновыми шипами пяти типов: gpA-E, из которых gpC является типоспецифическим антигеном. Геном представлен двухнитевой линейной ДНК. В состав капсида входит фермент ДНК-полимераза. В отличие от других герпесвирусов, в вирионе ЦМВ отсутствует фермент тимидинкиназа, который является мишенью для действия противовирусных препаратов группы ацикловира. Вирус культивируется в культуре клеток фибробластов и диплоидных
клеток легких эмбриона человека. Для вируса характерен медленный рост с образованием гигантских (цитомегалических) клеток с внутриядерными включениями.
ЦМВ вызывает латентную инфекцию в эпителии слюнных желез, в миндалинах, почках, лимфоцитах, в которых он оказывает цитомегалическое и лимфопролиферативное действия.
Вирус термолабилен, чувствителен к дезинфектантам и жирорастворителям, способен проходить через плаценту, вызывая тератогенный эффект.
Различают два вида инфекции: первичную и «возвратную». «Возвратная» инфекция является либо реактивацией первичной инфек- ции, либо реинфицированием суперинфекционным вирусным штаммом. Иммунитет, как правило, носит протективный характер, поэтому выраженные клинические проявления инфекции очень редки у иммунокомпетентных лиц. Нарушения иммунного ответа при ЦМВ имеются у лиц на иммуносуперессивной терапии при трансплантации органов и тканей, у пациентов с ВИЧ или при развитии иммунной дисфункции при поражении плода данным вирусом.
Эпидемиология. ЦМВ повсеместно распространен в человеческой популяции, ему не свойственна ни сезонность, ни эпидвспышки.
В большинстве развивающихся стран инфицирование ЦМВ происходит внутриутробно (через плаценту во время родов), в раннем детском возрасте, при прямом контакте, либо через предметы обихода. Серопозитивными становятся 100% лиц уже в детском возрасте. В социально незащищенных группах населения 90% детей становятся серопозитивными в подростковом возрасте, а в социально защищенных группах населения - только 50%. Другим значимым путем передачи вируса является половой. Имеются документально подтвержденные доказательства о высоком содержании вируса в семенной жидкости и в секрете шейки матки. Трансмиссия ЦМВ у детей младшего возраста играет большую роль в циркуляции вируса. Эпидемиологические исследования показали, что 1% детей рождается с врожденной ЦМВ инфекцией, полученной от своих матерей, и от 30 до 70% инфицируются от своих матерей при прямом контакте после рождения. Эти дети экскретируют ЦМВ в большом количестве со слюной и мочой в течение месяцев и даже лет и являются основным резервуаром этой инфекции в популяции.
Другой путь передачи - это донорские кровь, органы и ткани. Исследование крови и материала для пересадки органов и тканей должны включать скрининг на серопозитивность к ЦМВ (приблизитель-
но 2,5% донорской крови носят признаки инфекции этим вирусом). Многочисленные исследования показывают, что лейкоциты, присутствующие в большинстве препаратов крови, имеют отношение к передаче инфекции ЦМВ. Инфицированные лица выделяют вирус с мочой и слюной на протяжении многих месяцев после первичной инфекции или реактивации, вирус присутствует также в фекалиях и грудном молоке.
Патогенез. ЦМВ-инфекция в основном протекает в субклинических и инаппарантной формах. Как показали многочисленные исследования, тяжесть клинических проявлений и течение болезни определяются исключительно иммунным статусом инфицированного. В организм человека вирус проникает гематогенно (при внутриутробном инфицировании, гемотрансфузиях, трансплантации органов и тканей), аэрогенно (при кашле матери или другого инфицированного ребенка), перорально (при грудном вскармливании, поцелуях матери), а также половым путем (у взрослых). При гематогенном попадании ЦМВ в организм человека инфекция чаще всего протекает остро с генерализацией процесса. При попадании вируса другими путями инфекция протекает субклинически или латентно, если нет факторов, обусловливающих иммуносупрессию. У человека при активной ЦМВ-инфекции вирус может быть изолирован из самых различных органов и типов клеток - эндотелия сосудов, эпителия многих органов (включая эндокринные и экзокринные железы), нейроны ЦНС. Патологические изменения в органах крайне многообразны и выявляют как выраженную деструкцию тканей, так и изолированные цитомегалитические клетки. Типичная цитомегалитическая клетка представляет собой увеличенную клетку с обедненной или редуцированной цитоплазмой, содержащей большое ядро с отдельными нуклеолами или внутриядерными включениями.
Предполагается, что клеточный и антителоопосредованный иммунитет играет ведущую роль в ограничении инфекции ЦМВ. Большое число исследований костного мозга и изолированных органов от реципиентов выявили строгую корреляцию между депрессией ЦМВ-специфического Т-лимфоцитарного ответа и чувствительностью к ЦМВ-ассоциированной инфекции. Этот ответ включает как рестриктированные по МНС 1 CD+4 Т-лимфоциты, так и рестриктированные по МНС 1 CD+8 цитотоксические Т-лимфоциты. Хотя вирусоспецифические антигенымишени для этого клеточного иммунного ответа неизвестны, компоненты белков этого вируса сами по себе могут продуцировать иммунный протективный ответ. В нескольких исследованиях документально под- тверждено, что пассивная передача антивирусных антител не в состоянии предупредить развитие инфекции ЦМВ у чувствительных пациентов и модулирует заболевания, клинически ассоциируемые с ЦМВ.
Бактериальная и грибковая инфекции, сопутствующие инфекции ЦМВ у реципиентов органов, ассоциируются с иммуномодулирующим действием вируса, однако специфические механизмы, приводящие к иммуносупрессивной активности ЦМВ, неизвестны.
Клиническая картина. Инфекция ЦМВ у иммунокомпетентных лиц крайне редко сопровождается выраженными клиническими проявлениями, но иногда может маскироваться мононуклеозоподобным синдромом. Приблизительно 8% клинически выраженного инфекционного мононуклеоза вызывается ЦМВ. Клинически это заболевание не отличается от инфекционного мононуклеоза, вызванного вирусом Эпштейна-Барр, за исключением отсутствия гетерофильных антител. Клинически выраженной фазе инфекции ЦМВ предшествуют неспецифические симптомы, такие как недомогание, снижение аппетита, постепенно нарастающая лихорадка. Лабораторные нарушения включают в себя появление атипичных мононуклеаров, биохимические признаки гепатита и холестаза и, крайне редко, тромбоцитопению. Подобные же нарушения возникают при трансфузионной инфекции ЦМВ, включая постперфузионный синдром, который следует за кардиопульмональным синдромом.
Передача вируса при рождении хотя и имеет место, но лишь только 1% всех родов сопровождается инфицированием. 10% из этих детей имеют признаки врожденной цитомегаловирусной инфекции: петехии, гепатоспленомегалию, желтуху и микроцефалию. Тромбоцитопения, холестаз и наличие гепатоцеллюлярной патологии подтверждаются лабораторными данными. Поражения, ассоциируемые с врожденной ЦМВинфекцией, хотя и самоэлиминируются, но приводят к отставанию в развитии, снижению активности, большим неврологическим дефектам, и, наиболее часто, к снижению слуха. Субклиническая инфекция ЦМВ в меньшей степени ассоциируется с перманентным поражением ЦНС, однако до 15% детей перенесших врожденную инфекцию ЦВМ, имеют сенсоневральное снижение слуха. Но обе эти формы врожденной инфекции ЦМВ приводят к хронической экскреции персистирующего вируса в течение нескольких лет, что играет существенную роль в распространении вируса в популяции. Инфекция ЦМВ играет ведущую роль в возникновении инфекционных осложнений после транспланта- ции. В среднем от 60 до 100% серопозитивных реципиентов после трансплантации почки экскретируют ЦМВ. Хотя большинство пациентов не имеет признаков инвазивной ЦМВ инфекции, именно ЦМВ является причиной большинства случаев поражения сердца, легких, печени у реципиентов костного мозга. Согласно последним данным, именно
ЦМВ-пневмония является основной причиной (до 90%) смерти среди инфекционных осложнений у реципиентов.
Течение инфекции ЦМВ у реципиентов включает:
1. Реактивацию инфекции ЦМВ у серопозитивного реципиента.
2. ЦМВ, экзогенно поступивший из продуктов крови в посттрансплатационный период.
3. ЦМВ, полученный вместе с донорским органом при серопозитивности последнего (наиболее часто).
Наиболее опасна инфекция ЦМВ для серонегативного реципиента в случае получения им органа от серопозитивного по ЦМВ донора. Другими факторами, ассоциирующимися с клинически выраженной инфекцией ЦМВ, являются целые органы, полученные от трупа; продукты крови, контоминированные лейкоцитами; иммуносупрессивные агенты, снижающие уровень Т-лимфоцитов, такие как антитимоцитный глобулин, или анти-DC3 моноклональные антитела. Уреципиентов костного мозга тяжелая ЦМВ-инфекция, как правило, протекает пареллельно с развитием реакции «хозяин против трансплантата». Клинически выраженные проявления инфекции ЦМВ развиваются на 4-6 неделях после трансплантации и могут затрагивать различные органы-мишени, такие как легкие (пневмония), печень (гепатит), и наиболее часто проявляться симптомами, сходными с мононуклеозом (лихорадка, тромбоцитопения, гепатит). Вирус может быть изолирован из мочи у большинства инфицированных пациентов так же, как из крови. В дальнейшем у пациента развивается инвазивная мультиорганная патология. Потенциально фатальная инвазивная инфекция включает в себя пневмонит, тяжелое гастроинтестинальное язвенное поражение с перфорацией, угрожающий жизни гепатит. ЦМВ-пневмонит, как правило, проявляется как диффузная интерстициальная пневмония и без лечения заканчивается летально. Изменения в легких варьируют от мелкоочаговых альвеолитов до диффузных интерстициальных пневмоний. В результате активизации лимфокинами альвеолярных фибробластов развивается интерстициальный фиброз и альвеолярно-капилярный блок. Клинические проявления скудны и неспецифичны: больных беспокоит сухой, непродуктивный, изматывающий кашель, быстро нарастающая одышка, первоначально при физической нагрузке, а затем и в покое, удушье, тахипное, тахикардия. Без лечения летальность составляет до 90%.
Инфекция ЦМВ является основной причиной смерти у пациентов с
ВИЧ.
Учитывая, что основной путь передачи инфекции ЦМВ во взрослой популяции половой, не удивительно, что 100% инфицированных ВИЧ серопозитивны по ЦМВ. Ведущую роль в развитии заболевания в дан-
ной популяции играют как эндогенный вирус ЦМВ, так и полученный в результате суперинфицирования при половых контактах.
Предполагается, что коинфекция ЦМВ способствует прогрессированию ВИЧ, т.к. in vitro доказано, что ЦМВ играет поддерживающую роль в репликации вируса ВИЧ. Особо опасна инфекция ЦМВ при зна- чении CD4+ лимфоцитов < 50 на мл. При ВИЧ-инфекции поражаются многие органы и системы, но три системы поражаются наиболее часто: ЦНС, гастроинтестинальный тракт, легочная система. Поражение ЦНС хотя и редко встречается у реципиентов органов, но является достаточно частым явлением у ВИЧ-инфицированных. Энцефалопатия, как диффузная, так и фокальная, так же, как миелопатия и нейропатия, характерны для инфекции ЦМВ. Однако наиболее характерен ретинит. Установлено, что от 8 до 25% у пациентов с ВИЧ на стадии СПИДа развивается это поражение. Больные жалуются на «пелену» перед глазами, «преходящую» слепоту, боль за глазными яблоками, снижение остроты зрения. При офтальмоскопическом обследовании выявляются большие желтовато-белые зоны некроза с периваскулярным экссудатом и геморрагиями. При гистологическом исследовании выявляются коагуляционный некроз и микроваскулиты с муфтообразными изменениями сосудов сетчатки, впоследствии завершающиеся инфарктом сетчатки. ЦМВ-хориоретиниты при отсутствии лечения прогрессируют и заканчиваются слепотой.
Поражение ЖКТ включает в себя колит, эзофагит, энтероколит и несколько реже гастрит, в биоптатах слизистой определяются изменения язвенно-некротического характера. ЦМВ локализуется в стенках язвы, в эндотелии сосудов собственной пластинки слизистой оболочки. При поражении ЖКТ жалобы больных очень разнообразны и зависят от локализации поражения. Больных беспокоят дисфагия, «жжение» и боль за грудиной (при эзофагите). Диспепсия, резкое похудание, отсутствие аппетита, диарея, длительная, необъяснимая лихорадка, периодические кишечные кровотечения выявляются у пациентов с энтероколитами. При эндоскопическом исследовании находят диффузные геморрагии в подслизистом слое и диффузные язвы на слизистой кишечника.
Наиболее частой причиной пневмоний у ВИЧ-инфицированных также является ЦМВ.
Дифференциальная диагностика. Клиническая картина ЦМВ-инфекции очень полиморфна и не укладывается в четкие диагностические рамки. Круг заболеваний, с которыми приходится дифференцировать ЦМВ, включает инфекционный мононуклеоз (вирус Эпштейна-Барр), острый лейкоз, туберкулез, токсоплазмоз, лимфогранулематоз, вирус-
ные гепатиты. Основой диагностики ЦМВ является анамнез и лабораторное подтверждение активной инфекции ЦМВ. Угрожающими по развитию инфекции ЦМВ являются новорожденные, реципиенты крови и органов, гомосексуалисты, в/в наркоманы, проститутки и, прежде всего, ВИЧ-инфицированные, т.к. ЦМВ-инфекция отнесена к маркерной инфекции при подозрении на инфицированность ВИЧ.
Диагностика. Клинические анализ крови при инфекции ЦМВ не имеет патогномоничных признаков и характеризуется анемией, лейкоцитозом за счет лимфомоноцитоза, наличием атипичных мононуклеаров, тромбоцитопенией, ускорением СОЭ. В биохимическом анализе крови зачастую выявляется повышение АЛТ, АСТ на фоне нормального уровня билирубина, несколько может быть понижен уровень альбумина. Изменения в моче носят непостоянный характер и выявляются только при развитии ЦМВ-гломерулонефрита.
Диагностика инфекции ЦМВ строится на основании выделения вируса из мочи, слюны, крови или биопсийного материала у пациентов с признаками инфекции ЦМВ. Не существует метода, позволяющего различать острую инфекцию, реинфекцию и активацию латентной инфекции. У реципиентов органов и тканей, у ВИЧ-инфицированных выделение культуры ЦМВ из крови и органов прямо коррелирует с проявлениями заболевания и виремией.
Серологические методы выявления инфекции ЦМВ включают определение как IgM, так и IgG-антител, но только у здоровых лиц. IgG- антитела присутствуют у здоровых лиц либо как ответ на персистирующий вирус, либо как ответ на реинфекцию. Однако IgM-антитела у лиц с нормальным иммунным ответом при острой ЦМВ-инфекции персистируют от 2-х до 3-х месяцев, и их диагностическое значение у иммуносупрессивных лиц часто ограничено.
В настоящее время большое место отводится методу ПЦР, т.е. выявлению ЦМВ ДНК в крови, моче, биоптатах и т.д. Количественная ПЦР носит прогностический характер. Выявление белков, покрывающих вирус в нейтрофилах, методом моноклональных антител так же, как и выявление ЦМВ ДНК, является предиктором активной инфекции ЦМВ у иммуносупрессивных лиц.
Лечение. Основными препаратами, эффективными при ЦМВ-инфек- ции, являются: ганцикловир, валганцикловир; резервный препарат - фоскарнет. Ганцикловир назначают по 5 мг/кг 2 раза в день в/в капельно; валганцикловир - по 900 мг внутрь 2 раза в день. Длительность курса определяется локализацией и характером поражения и колеблется от 14 дней до клинического выздоровления (см. специальные руководства). Ганцикловир вызывает нейтропению, а фоскарнет нефротоксичен. При
длительном лечении иммуносупрессивных лиц развивается вирусная резистентность к этим двум препаратам.
Иммунопрофилактика инфекции ЦМВ включает в себя введение человеческих антител, полученных из плацентарной крови. Проведено клиническое испытание вакцины для профилактики реинфицирования у реципиентов почки, эти исследования продолжаются.
1.4. Тяжелый острый респираторный синдром (ТОРС)
Тяжелый острый респираторный синдром (ТОРС или SARS) - острое респираторное заболевание, вызываемое представителем семейства короновирусов, которое характеризуется комплексом симптомов, развивающихся на фоне лихорадки и включающих в себя головную боль, миалгии, анорексию и быстро прогрессирующее поражение респира- торного тракта с развитием тяжелой атипичной пневмонии.
Краткая историческая справка. Эпидемия тяжелой атипичной пневмонии впервые была зарегистрирована в Китае в провинции Гуандун в феврале
SARS).
В дальнейшем исследователи сосредоточили свое внимание на семействе Paramyxoviridae, т.к.
частицы, сходные с этими вирусами, были найдены при электронной
микроскопии в отделяемом из респи- раторного тракта у пациентов из
Гон-Конга и Франкфурта-на-Майне. И только 17 марта
Этиология. Возбудителем тяжелого респираторного синдрома (ТОРС-SARS) стал новый короновирус, идентифицированный практически одновременно в лабораториях Гон-Конга, Германии и США. Исследования включали изоляцию в культуре ткани и последующую электронную микроскопию вируса, выделение генома вируса с помощью полимеразной цепной реакции (ПЦР), а также создание непрямой
иммунофлюоресцентной антительной тест-системы, позволившей подтверждать лабораторно наличие SARS у пациентов.
Новый вирус был назван SARS-ассоциированным короновирусом (SARS-CoV). Расшифровка его генома показала, что он не относится ни к одной из известных групп короновирусов, включая двух человеческих представителей: HCoV-OC43 и HCoV-229E, с которыми он имеет незначительное сходство, что позволило выделить его в новую, 4-ю группу короновирусов. В настоящее время идентифицировано 3 группы короновирусов: к 1-й и 2-й группам относятся вирусы млекопитающих, а к 3-й группе - только вирусы птиц. Короновирусы ассоциируются с различными заболеваниями человека и домашних животных, включая гастроэнтериты и поражение нижних отделов дыхательного тракта. До настоящего времени считалось, что короновирусная инфекция у живот- ных, как правило, носит тяжелый характер (гепатит у мышей, инфекционный перитонит кошек и т.д.), а у человека в основном легкое течение. SARS-CoV - первый из короновирусов, способный вызывать тяжелое заболевание у человека. Имеются лишь единичные сообщения о тяжелом поражении нижних отделов дыхательного тракта у детей и взрослых, а также некротизирующего энтероколита у новорожденных при инфицировании 1-й и 2-й группам короновирусов. В настоящее время предложена гипотеза о возможной роли неизвестного короновируса живот- ных, который преодолел специфический защитный барьер человека и приобрел способность вызывать у него тяжелое заболевание.
С помощью электронной микроскопии удалось получить изображения вирусов SARS-CoV, которые оказались сходными с короновирусами частицами размерами от 60 до 130 нм в диаметре, покрытыми оболочкой и окруженные специфическими «пузырьками», имитирующими «корону» вокруг вирусных частиц в культуре ткани, с чем и связано название семейства. В инфицированных клетках вирусы находятся в вакуолях и цистернах вблизи мембран эндоплазматического ретикулума. При внеклеточной локализации вирусы располагаются большими гроздьями и часто видны на поверхности плазматических мембран.
SARS-CoV может быть выделен из различных тканей и сред инфицированного организма, включая экстракты из легочной ткани и почек, аспират или промывные воды из нижних отделов дыхательного тракта. Высокая концентрация вирусной РНК (до 100 млн молекул в 1 мл) установлена в мокроте и в плазме больного в острую фазу заболевания, а также в фекалиях во время поздней реконвалесценции (что способствует длительной передаче вируса от переболевших). Вирус обладает относительной устойчивостью к факторам окружающей среды и сохраняется на
открытых поверхностях до 3-х часов. По предварительным данным, вирус SARS-CoV сохраняет свою жизнедеятельность при комнатной температуре в моче и фекалиях до 2-х дней, причем его концентрация особенно велика в фекалиях больных с диарейным синдромом. При воздействии комнатной температуры в течение 48 часов концентрация вируса снижается всего на 1 log, что указывает на значительную устойчивость и стабильность вируса SARS-CoV по сравнению с другими короновирусами. Нагревание до 56 ?С относительно быстро инактивирует данный вирус, как и воздействие различных дезинфектантов.
Эпидемиология. Все вспышки SARS продемонстрировали крайне высокую контагиозность вируса, например, было установлено, что среди медперсонала, контактировавшего с больными, индекс контагиозности достигал 50%. В результате этого было подтверждено, что основной путь передачи вируса - воздушно-капельный, но не исключается передача и при прямом контакте, т.к. вирус устойчив к факторам окружающей среды и сохраняет свою заразительность до 3-х часов на различных предметах при комнатной температуре, до 24 часов - на пластиковых поверхностях и до 4-х дней - в фекалиях. Инфекционность пациентов с SARS в различные периоды заболевания вариабельна. Предварительные данные исследования назофарингеального отделяемого методом ПЦР установили, что максимальной концентрация вируса выявляется на 10-й день от появления респираторного синдрома и снижается до минимальных значений только к 15-м суткам, с фекалиями и мочой вирус выделяется переболевшими SARS до периода поздней реконвалесценции.
Патогенез. Патогенез изучен недостаточно. Результаты исследова- ния биопсийного материала легких больных с SARS выявили картину незначительного интерстициального воспаления с разрушением альвеолярных пневмоцитов. Не выявлено клеточных включений, характерных для герпетической или аденовирусной инфекций. Постмортальные гистологические изменения в легких выявили диффузные альвеолярные поражения различной степени выраженности, соответствующие патоморфологической картине респираторного дистресс-синдрома. Эти изменения включали в себя десквамацию пневмоцитов в альвеолярное пространство, воспалительную инфильтрацию мононуклеарами интральвеолярной перегородки, разрушение гиалиновых мембран. Исследование печени установило мелкодисперсную жировую инфильтрацию, точечные геморрагии, некроз гепатоцитов. В селезенке выявлялись обширные поля ишемического некроза и наличие атипичных лимфоцитов в периартериальных оболочках.
Клиническая картина. Клиническая картина SARS неспецифична и сходна с атипичной пневмонией, возбудителями которой являются легионеллы, микоплазма, хламидии. После инкубационного периода (от 2-х, до 10 дней) у пациента внезапно после потрясающего озноба возникает лихорадка выше 38 "С, и быстро ухудшается общее состояние с появлением головной боли, головокружения, недомогания, миалгий. Затем присоединяются тошнота, рвота, воспаление гортани, кашель с отделением мокроты, сопровождающийся нарастающей одышкой, иногда может присоединяться диарейный синдром. Основными симптомами часто являются гипертермия, нарастающая одышка (как ведущий симптом поражения легких), причем, как правило, выслушать хрипы не удается. Наиболее распространенными лабораторными нарушениями являются лимфопения (< 1,0 x 10/л), лейкопения (< 3,5 x 10/л), тромбоцитопения, высокие уровни лактатдегидрогеназы, аспартатдегидрогеназы, креатининкиназы, падение протромбинового индекса. Лейкопения в первые дни заболевания обусловлена резким падением числа лим- фоцитов. Пока остается неясным, может ли эта инфекция протекать в бессимптомной, легкой форме. В будущем широкое применение диагностических лабораторных тестов поможет ответить на этот вопрос. Рентгенографическое обследование грудной клетки может не выявить какие-либо нарушения во время начального периода заболевания. Однако у большинства пациентов с момента стабилизации температурной реакции на высоких цифрах при рентгеновском исследовании грудной клетки установлены множественные мелкие, неправильной формы, несимметричные очаги просветления, которые в течение 1-2-х дней приобретают характер множественных двусторонних интерстициальных и/или сливающихся инфильтратов. Следовательно, на начальных этапах заболевания поражение легких носит разнообразный характер от несимметричных единичных фокальных образований до двусторонних множественных очагов. Очаги затемнения в легочной ткани имеются у всех пациентов при развитии у них SARS, но они имеют разную степень выраженности. Первичные данные рентгеновского обследования лег- ких при SARS иногда могут отличаться от признаков, характерных для атипичной бронхопневмонии, вызванной другими возбудителями. При SARS это может быть поражение только периферической зоны легочных полей. При клиническом ухудшении очаги поражения быстро нарастают в размерах и к 7-10 дням заболевания процесс принимает тяжелое течение.
При сканировании установлено поражение задней поверхности нижних долей легких, которое характеризуется пневмонией, в основе кото-
рой лежит бронхолитическая облитерация, причем бронходилятация не выявляется. Группа исследователей, работающих в Гон-Конге, считает, что рентгенографическое исследование грудной клетки играет важную роль в прогнозировании течения заболевания, особенно если в конце первой недели заболевания незначительные асимметричные первичные единичные очаги поражения легких приобретают характер двусторонних, сливаются между собой и коррелируют с нарастающей легочной дисфункцией. По-видимому, SARS может быть рентгенографически неотличим от других тяжелых форм пневмонии, таких как облитерирующий бронхит и острая интерстициальная пневмония.
Следовательно, тяжесть течения SARS значительно варьирует от незначительных симптомов поражения респираторного тракта до развития тяжелых состояний, осложняющихся легочным дистресс-синдромом, приводящим к смерти пациентов. Летальность значительно колеблется в различных возрастных группах. В настоящее время установлено, что летальность у пациентов до 24 лет составляет 1%, от 25 до 44 лет - 6%, 15% - в возрастной группе от 45 до 65 лет, и у лиц старше 65 лет превышает 50%. Выявлено, что иногда температура тела может быть нормальной даже на фоне прогрессирования заболевания. В первых публикациях, подтвержденных позднее, у пациентов имели место вторая волна лихорадки (85,3% - от 4-го до 18-го дня, выраженная диарея (73,3%) на 3-15-й день, ухудшение рентгенографической картины (80%) на 3-13-й день, нарастание симптомов поражения дыхательного тракта (45,3%) на 5-19-й день.
У 45,5% пациентов важным предвестником ухудшения состояния является появление на рентгенограмме новых очагов в легочной ткани. Факторами риска быстрого прогрессирования заболевания и ухудшениея прогноза являются следующие: возраст старше 65 лет, хронический гепатит В, нейтрофилез на фоне лимфопении, высокий уровень лак- татдегидрогеназы, повышение уровня аланиновой аминотрансферазы после начала курса рибавиринотерапии и стероидов.
Выздоровление может сопровождаться развитием легочного фиброза различной степени выраженности, что требует дальнейшего мониторинга.
Имеются единичные сообщения о течении SARS у детей. Стойкая лихорадка, кашель, прогрессирующие рентгенографические изменения в легких, лимфопения не характерны для детей до 12 лет. У подростков могут наблюдаться симптомы, схожие со взрослыми пациентами, т.е. слабость, миалгии, озноб, лихорадка, а у детей, как правило, клинические проявления ограничиваются кашлем и насморком, и никогда не выявляются головная боль и миалгии. В целом клиническое течение у
детей до 12 лет легкое и непродолжительное, тогда как подростки болеют подобно взрослым.
Лабораторная диагностика. В результате проведенной работы по тестированию биологического материала на наличие SARS-CoV референслабораториями нескольких стран мира ВОЗ разработало рекомендации по лабораторной диагностике SARS.
Предложено несколько методов для диагностики, но не один из этих методов не является абсолютным и не исключает параллельное использование других методов, т.к. сходство клинической картины SARS с ати- пичными пневмониями различной этиологии (Legionella pneumophilia, Mycoplasma pneumophilia, parainfluenza) заставляет обследовать и на другие возбудители.
Молекулярный тест выявляет специфическую РНК SARS-CoV в различных биологических пробах, таких как кровь, фекалии, отделяемое респираторного тракта или ткани организма посредством полимеразной цепной реакции (ПЦР). Несмотря на высокую чувствительность этого метода, положительный результат еще не свидетельствует о наличии вируса SARS у пациента. Во-первых, полученный положительный результат может быть и ложноположительным, что требует дополни- тельного лабораторного контроля в подтверждающих тестах, во-вторых, позитивная ПЦР всего лишь свидетельство наличия генетического материала (РНК) SARS-CoV в биологическом материале. Негативная ПЦР не исключает инфицирования SARS, т.к. концентрация вируса просто может быть ниже порога чувствительности к тест-системам.
Выделение вируса. Присутствие вируса может быть подтверждено заражением чувствительной культуры клеток (Vero cells) при внесении в нее проб от пациента (кровь, стул, респираторный секрет) и последующим культивированием вируса. Полученный затем вирус должен быть идентифицирован с помощью различных методов.
Эта методика очень дорогостоящая, длительная и предусматривает также инфицирование чувствительного животного, в результате чего она подтверждает наличие «живого» вируса, но ответа на вопрос, явился ли этот вирус причиной заболевания атипичной пневмонией данного пациента, этот метод не дает. Отрицательный результат также не исключает наличие вируса в биологическом отделяемом, т.к. возможны методические ошибки при проведении исследования.
Выявление антител. Существуют различные методы для выявления антител, которые продуцируются в организме больного в ответ на инфицирование SARS-CoV. Это различные типы антител (IgM и IgG), появ-
ляющиеся у пациента во время инфекционного процесса. Они могут не выявляться на ранних стадиях процесса, в то же время IgG, как правило, появляется после разрешения инфекционного процесса. Коммерческих тест-систем в настоящее время нет. В основном используется два метода для выявления антител: энзим-связывающий иммуносорбентный метод (ELISA) и иммунофлюоресцентный метод (ИФА).
ELISA-тест выявляет смесь антител классов IgM и IgG в сыворотке пациентов с SARS, но дает положительные результаты не ранее 21-го дня от начала заболевания, т.е. носит ретроспективный характер.
Метод непрямой иммунофлюоресценции дает положительный результат на 10-й день от начала заболевания и выявляет IgM-антитела, но результаты могут быть оценены только в парных сыворотках.
Следовательно, результаты лабораторного исследования при подозрении на заболевание SARS носят вспомогательный характер и могут рассматриваться как подтверждающие только при наличии соответствующих эпидемиологических и клинических данных.
Лечение. В настоящее время высокоэффективное лечение SARS не разработано. Пациенты с прогрессирующим течением заболевания нуждаются в интенсивной поддерживающей терапии.
Необходимость применения стероидов основана на выявленных морфологических изменениях в легочной ткани, которые, как считается, связаны с повреждающим действием провоспалительных цитокинов, избыточный синтез которых индуцирован микробными агентами.
Комбинированная терапия рибавирином и стероидами основана на положительном клиническом эффекте их применения. Сами врачи, однако, подчеркивают низкий терапевтический эффект при использовании малых доз кортикостероидов. Наилучший эффект получен врачами госпиталя в Гон-Конге при назначении пациентам больших доз комбинированной терапии рибавирином и стероидами. Однако до сих пор остается открытым вопрос о длительности лечения. Имеются сообщения как о коротких, так и весьма длительных курсах лечения. Это приобретает особую актуальность, т.к., во-первых, получены отрицательные результаты воздействия рибавирина на вирус SARS-CoV in vitro, во-вторых, известны побочные эффекты этого препарата, такие как тератогенное действие и тяжелая гемолитическая анемия.
Приводим эмпирическую схему лечения больных с SARS, давшую наилучший эффект в госпиталях Гон-Конга:
- рибавирин - 8 мг/кг массы тела каждые 8 ч в/в или
нии функциональных почечных проб в пределах нормы; продолжительность курса составляет от 7 до 14 дней в зависимости от клинического эффекта и длительности приема кортикостероидов;
- гидрокортизон - из расчета 2 мг/кг массы тела каждые 6 ч или 4 мг/кг массы тела каждые 8 ч в/в; препарат отменяется через неделю при положительном клиническом эффекте; в тяжелых и быстро прогрессирующих случаях рекомендуется назначение метилпреднизолона каждые 24 ч в дозе 10 мг/кг массы тела в/в в течение 2 суток, и затем продолжа- ется лечение гидрокотизоном по вышеописанной схеме;
- антибактериальные препараты из группы макролидов или левофлоксацин назначаются на протяжении 7-14 дней;
Пациенты, получающие комбинированное лечение рибавирином и стероидами, обязательно должны получать противоязвенную терапию, и у них необходимо постоянно проводить контроль гемоглобина, числа ретикулоцитов, глюкозу крови и уровень калия.
Необходимой
терапевтической процедурой у пациентов SARS при развитии атипичной
пневмонии является введение бронходилятаторов с использованием
небулайзера (альбутерол 0,5 мг через небулайзер вместе с кислородом в
объеме
Приводим схему лечения детей с SARS:
- рибавирин по 40 мг/кг ежедневно на 2 или 3 приема в течение 1-2 недель;
- преднизолон назначается при лихорадке более 48 ч от 0,5 мг/кг до 2 мг/кг ежедневно в течение 2-4 недель.
В случае тяжелого течения заболевания рибавирин назначается в/в в дозе 20 мг/кг ежедневно в три приема и гидрокортизон из расчета 2 мг/кг каждые 6 часов (или пульс-терапия метилпреднизолоном из расчета 10-20 мг/кг).
Рекомендации Минздрава России предусматривают назначение пациентам с SARS интерферона.
Профилактика. Особую роль в предупреждении распространения SARS играют меры индивидуальной защиты при контакте с лицами, потенциально инфицированными вирусом. Прежде всего это индивидуальные маски у персонала и пациентов, резиновые перчатки у персонала, которые не рекомендуется использовать повторно, специальные халаты и шапочки (желательно одноразового применения), а также обязатель-
ное мытье рук с мылом перед и после контакта с больными. Если вода по тем или причинам недоступна, возможно использование для обработки рук спиртосодержащих растворов. Все биологические выделения боль- ного тщательно собираются и уничтожаются, а предметы окружающей среды обрабатываются раствором гипохлорита.
Особое место среди мер защиты от распространения эпидемии SARS принадлежит своевременному выявлению не только больных, но и контактных с ними лиц, а также лиц, прибывших из регионов, признанных очагами этой инфекции, с последующей их изоляцией на срок до 10 суток под медицинским контролем с ежедневной термометрией и осмотром для раннего выявления заболевших. Ведущими симптомами первых проявлений заболевания являются лихорадка, кашель и затруднение дыхания с быстро нарастающей одышкой. Основная роль в мероприятиях по обсервации принадлежит государственным органам.
Заключение. В соответствии с рекомендациями ВОЗ, диагноз SARS может быть заподозрен у лиц, прибывших из регионов, где документально подтверждена эпидемия данного заболевания, или есть сообщение о контакте человека с больными SARS, а также имеется соответствующая клиническая картина заболевания: острое начало с лихорадки выше 38 ?С, кашель, затруднение дыхания и изменения со стороны легких (рентгенографически подтвержденные атипичная пневмония, острый респираторный дистресс-синдром).
1.5. Оспа обезьян
Синонимы: variola vimus (лат.), monkeypox (англ.).
Острое вирусное зоонозное природно-очаговое заболевание, зарегистрированное в Центральной и Западной Африке, а в последние годы - и в США. Заболевание протекает в виде спорадических случаев и локальных вспышек с интоксикацией, лихорадкой и развитием высыпаний папулезно-везикулезно-пустулезного характера на коже и слизистых оболочках (рис. 1.1).
Краткие исторические сведения. В
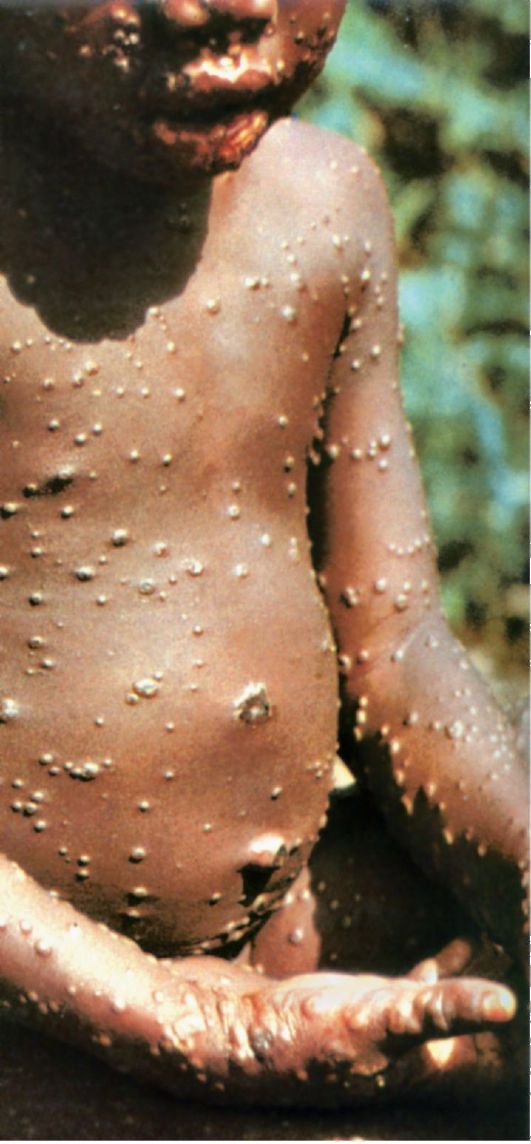
Рис. 1.1. Оспа обезьян
только в Демократической Республике Конго в 1996-1997 гг. выявлено более 400 больных.
Этиология. Возбудитель - вирус из семейства Poxviridae, подсемейс- тва поксвирусов позвоночных Chordopoxviridae, рода Orthopoxvirus, впер- вые выделен в
отличаясь от них некоторыми культуральными свойствами. Антигенная и генетическая структуры возбудителя наиболее близки к вирусу натуральной оспы. Однако существует мнение, что вирусы натуральной оспы и оспы обезьян генетически развивались независимо друг от друга, и мало вероятно, что обезьяний вирус может превратиться в вирус натуральной оспы.
Эпидемиология. Оспа
обезьян считается самой важной ортопоксвирусной инфекцией человека
после исчезновения натуральной оспы. Источники инфекции - обезьяны и
различные грызуны. Вероятный источник вспышки в США (81 случай
заболевания в
Патогенез оспы обезьян недостаточно изучен. Учитывая антигенное сходство возбудителей оспы обезьян и натуральной оспы, а также общие клинические черты вызываемых ими заболеваний, предполагают наличие общих закономерностей и в их патогенезе.
Клиническая картина. Инкубационный период колеблется от 4-х до 20 дней, в среднем составляя 10-14 дней.
Продромальный период. Заболевание начинается остро и проявляется повышением температуры и другими симптомами интоксикации - недомоганием, ознобом, головной болью, ломотой в пояснице, миалгиями, иногда головокружением и рвотой на фоне высокой лихо-
радки. При осмотре больных обнаруживают конъюнктивит, гиперемию слизистой оболочки ротоглотки, сухой кашель, одышку. Часто (до 90% больных) отмечают выраженную лимфаденопатию, что нетипично для натуральной оспы. Иногда на 2-й день болезни появляется и затем быстро исчезает продромальная сыпь. Длительность продромального периода составляет 2-3 дня.
Период высыпания. На 3-4-й день болезни температура снижается до субфебрильной, одновременно на коже головы (прежде всего, на лице) и слизистых оболочках появляются необильные элементы сыпи. Экзантема быстро захватывает кисти рук, а затем туловище и нижние конечности, поражая ладони и подошвы. Распространение экзантемы имеет в большинстве случаев центробежный характер: на туловище элементов меньше, чем на лице и конечностях. Однако бывают и исклю- чения из этого правила, и имеет место центростремительный характер распространения сыпи как при ветряной оспе. Элементы сыпи в течение 2-3-х недель последовательно проходят ряд этапов развития: пятна (2-5 мм в диаметре) - папулы - многокамерные везикулы - пустулы - корочки - рубцы. Особенностью сыпи является то, что на одном участке кожи она в большинстве случаев мономорфна (до 80%), как и при натуральной оспе. Геморрагические формы обезьяньей оспы у человека не описаны.
Период нагноения. При нагноении везикул формируются однокамерные пустулы. В это время вновь повышается температура, нередко до 39-40 "С, состояние больных значительно ухудшается, развиваются тахикардия, артериальная гипотензия, одышка, сильный зуд кожи. Могут быть диарея, лимфаденит (чаще шейный и паховый).
Период реконвалесценции. С 9-10-го дня болезни начинается подсыхание пустул и формирование корочек. Постепенно улучшается состояние больного. Отпадение корочек продолжается в течение 3-4-х недель, образование рубцов на месте отпавших корочек выражено значительно меньше, чем при натуральной оспе.
Клинические особенности заболевания у лиц, привитых против натуральной оспы: умеренный характер высыпаний, более частый плеоморфизм экзантемы (свыше 20% случаев), развитие лимфаденопатии лишь у 50% больных, отсутствие летальных исходов.
В целом оспа обезьян протекает легче натуральной оспы, с более скудной экзантемой. При легком течении болезни состояние больных остается удовлетворительным.
Осложнения и прогноз. Вторичная инфекция кожи, пневмонии, изредка поражения глаз (кератиты, ириты). При тяжелом течении заболевания возможно развитие энцефалита и инфекционно-токсическо-
го шока. Прогноз заболевания в большинстве случаев благоприятный. Летальность значительно варьирует - от 1 до 10%.
Дифференциальная диагностика. Заболевание дифференцируют от экзантем лекарственных, риккетсиозных, герпетиформных (ветряная оспа, герпес опоясывающий и простой), дерматитов, экземы, а также от поражений кожи, вызванных контагиозными моллюсками.
При постановке диагноза принимают во внимание данные эпидемиологического анамнеза и характерные клинические проявления болезни. В эпидемиологическом анамнезе учитывают недавние контакты с экзотическими животными и длительность инкубационного периода, предыдущие прививки против натуральной оспы. Характерные клинические проявления болезни - наличие продромального периода, лимфаденопатии, несвойственной натуральной оспе, а также преимущественно центробежный характер распространения сыпи с поражением ладоней и подошв, ее мономорфизм на отдельно взятом участке кожных покровов с поверхностными поражениями.
Лабораторная диагностика базируется на использовании вирусологических и, в меньшей степени, серологических методов исследования (электронная микроскопия, пассаж на куриных эмбрионах, выявление ДНК вируса в ПЦР, определение противовирусных антител). Близкое антигенное сходство вирусов натуральной и обезьяньей осп существенно снижает специфичность серологических реакций. Лабораторное подтверждение необходимо для окончательного диагноза каждого случая обезьяньей оспы.
Лечение. Рекомендуют противовирусные препараты: метисазон по
Проводят активную дезинтоксикационную терапию, пораженные участки кожи и слизистых оболочек обрабатывают растворами антисептиков. Учитывая наличие гнойной инфекции, назначают антибиотики широкого спектра действия (полусинтетические пенициллины, макролиды, цефалоспорины).
Профилактика и мероприятия в эпидемическом очаге. По эпидпоказаниям рекомендуют оспопрививание вакциной против натуральной оспы отдельных категорий лиц, имеющих повышенный риск заражения: ветеринаров и зоотехников, геологов, медицинских работников и др.