Инфекционные и паразитарные болезни развивающихся стран : учебник для вузов / Под ред. Н.В. Чебышева, С.Г. Пака. - 2008
|
|
|
|
ГЛАВА 2 БАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ
2.1. Холера
Холера - острое инфекционное заболевание из группы карантинных инфекций, вызываемое холерными вибрионами серотипов О1 и О139, характеризующееся в типичных случаях диареей и рвотой, быстро приводящих к обезвоживанию и обессоливанию организма.
Этиология. Возбудителями холеры являются вибрионы серогрупп О1 и О139 вида Vibrio cholerae, который
относится к роду Vibrio, семейства Vibrionaceae. Внутри вида Vibrio
cholerae различают два основных биовара - biovar cholerae classic,
открытый Р. Кохом в
Холерные вибрионы - грамотрицательные палочки в форме запятой, длиной 2-4 мкм, толщиной 0,5 мкм, не образуют спор и капсулы, монотрихи, чрезвычайно подвижны.
Культуральные свойства. Вибрионы являются факультативными анаэробами, но предпочитают аэробные условия роста, поэтому на поверхности жидкой питательной среды образуют пленку. Оптимальная температура роста 37 оС при рН 8,5-9,0. Для оптимального роста микроорганизмы требуют присутствия в среде 0,5% натрия хлорида. Средой накопления является 1% щелочная пептонная вода, на которой они образуют пленку в течение 6-8 часов. Холерные вибрионы неприхотливы и могут расти на простых средах. Элективной средой является среда TCBS (тиосульфат цитратный сахарозожелчесодержащий агар). Щелочной агар и триптон-соевый агар (ТСА) используют для субкультивирования.
Биохимические свойства. Возбудители холеры биохимически активны и оксидазопозитивны, обладают протеолитическими и сахаролитическими свойствами: продуцируют индол, лизиндекарбоксилазу. разжижают в воронковидной форме желатину, не продуцируют сероводород. Ферментируют глюкозу, маннозу, сахарозу лактозу (медленно), крахмал, не сбраживают рамнозу, арабинозу, дульцит, инозит, инулин. Обладают нитратредуктазной активностью.
Холерные вибрионы различаются по чувствительности к бактериофагам. Классический холерный вибрион лизируется бактериофагами IV группы по Mukerjee, а вибрион биовара Эль-Тор - бактериофагами
V группы. Дифференциация среди возбудителей холеры проводится по биохимическим свойствам, по способности гемолизировать эритроциты барана, агглютинировать куриные эритроциты, а также по чувстви- тельности к полимиксину к бактериофагам. Biovar El Tor резистентен к полимиксину, агглютинирует куриные эритроциты и гемолизирует эритроциты барана, имеет положительные реакцию Фогес-Проскауэра и гексаминовый тест. V. сholerae О139 по фенотипичесим признакам относится к биовару El Tor.
Антигенная структура. Холерные вибрионы обладают О- и Н- антигенами. В зависимости от строения О-антигена различают более 150 серогрупп, среди которых возбудителями холеры являются серогруппы О1 и О139. Внутри серогруппы О1 в зависимости от сочетания А-, В- и С- субъединиц происходит подразделение на серовары: Огава (АВ), Инаба (АС) и Гикошима (АВС). Вибрионы серогруппы О139 агглютинируются только сывороткой О139. Н-антиген является общеродовым антигеном.
Отношение к факторам окружающей среды. Возбудители холеры чувствительны к УФ, высушиванию, дезинфектантам (за исключением четвертичных аминов), кислым значениям рН, нагреванию. Возбудители холеры, особенно биовар Эль-Тор, способны к существованию в воде в симбиозе с гидробионтами, водорослями, в неблагоприятных условиях могут переходить в некультивируемую форму. Эти свойства позволяют отнести холеру к антропо-сапронозным инфекциям.
Факторы патогенности. Геном V. cholerae состоит из двух циркулярных хромосом: большой и малой. Все гены, необходимые для жизнедеятельности и реализации патогенного начала, локализованы на большой хромосоме. Малая хромосома содержит интегрон, который захватывает и экспрессирует кассеты антибиотикорезистентности.
Главным фактором патогенности является холерный энтеротоксин (СТ). Ген, опосредующий синтез этого токсина, локализован в кассете токсигенности, расположенной на геноме нитчатого бактериофага СТХ. Вдобавок к гену энтеротоксина на этой же кассете находятся гены zot и ace. Продуктом гена zot является токсин, (zonula occludens toxin), а ген аce детерминирует синтез добавочного энтеротоксина (accessory cholerae enterotoxin). Оба эти токсина принимают участие в увеличении проницаемости стенки кишечника. На геноме фага находится также ген серадгезина и последовательность RS2, кодирующая репликацию фага и его интеграцию в хромосому.
Рецептором для фага СТХ являются токсинкорегулируемые пили (Тср). Они являются пилями 4 типа, которые, помимо того, что являются
рецепторами для фага СТХ, необходимы для колонизации микроворсинок тонкого кишечника, а также принимают участие в образовании биопленки, в частности на поверхности панциря гидробионтов.
Тср координированно экспрессируются с геном СТ. На большой хромосоме также находится ген nan, определяющий синтез нейраминидазы, способствующей реализации действия токсина, и ген hap, опреде- ляющий синтез растворимой гемаллютининпротеазы, которая играет важную роль в выведении возбудителя из кишечника во внешнюю среду в результате ее деструктивного действия на рецепторы кишечного эпителия, ассоциированные с вибрионами.
Колонизация тонкого кишечника, осуществляемая токсинкорегулируемыми пилями, создает плацдарм для действия холерного энтеро- токсина, который представляет белок с молекулярной массой 84000D, состоящий из 1 субъединицы А и 5 субъединиц В. Субъединица А состоит из двух полипептидных цепочек А1 и А2, связанных между собой дисульфидными мостиками. В субъединичном комплексе В пять одинаковых полипептидов соединены друг с другом нековалентной связью в виде кольца. В-субъединичный комплекс ответственен за связывание всей молекулы токсина с клеточным рецептором - моносиаловым ганг- лиозидом GM1, которым очень богаты эпителиальные клетки слизистой тонкой кишки. Для того чтобы субъединичный комплекс мог взаимодействовать с GM1, от него должна быть отщеплена сиаловая кислота, что осуществляется ферментом нейраминидазой, которая способствует реализации действия токсина. Субъединичный комплекс В после прикрепления к 5-ти ганглиозидам на мембране кишечного эпителия меняет свою конфигурацию так, что позволяет А1 отсоединиться от комплекса А1В5 и проникнуть в клетку. Проникнув в клетку, А1 пептид активи- рует аденилатциклазу. Это происходит в результате взаимодействия А1 с НАД, следствием чего является образование АДФ-рибозы, которая переносится на ГТФ-связывающий белок регуляторной субъединицы аденилатциклазы. В результате происходит ингибиция функционально необходимого гидролиза ГТФ, приводящая к накоплению ГТФ в регуляторной субъединице аденилатциклазы, определяя активное состояние фермента, и как следствие - усиление синтеза ц-АМФ. Под влиянием ц-АМФ в кишечнике изменяется активный транспорт ионов. В области крипт эпителиоцитами усиленно выделяются ионы Cl-, а в области ворсинок затрудняется всасывание Na+ и Cl-, что составляет осмотическую основу для выделения в просвет кишечника воды.
Эпидемиология. Источники и резервуар инфекции составляют больные люди, бактерионосители, а также водная среда и гидробионты.
Носительство вибриона Эль-Тор встречается чаще, чем классического вибриона (на одного больного холерой Эль-Тор приходится от 10 до 1000 носителей). Выделение возбудителей во внешнюю среду происходит с испражнениями и рвотными массами. Наибольшую эпидемиологическую опасность в распространении вибрионов представляют вибриононосители ввиду отсутствия каких-либо клинических проявлений заболевания.
Механизм передачи - фекально-оральный, который реализуется всеми возможными для него путями: водным, пищевым, контактным. В условиях эпидемического распространения холеры бывают задействованы все пути передачи (смешанный путь): начавшись с водного пути, в последующем инфицирование реализуется пищевым и даже контактным путями. Инфицирующая доза (установлена на добровольцах) составляет 1011 КОЕ, а при условии предварительной нейтрализации кислой среды желудка бикарбонатом натрия - 106 КОЕ.
Пищевой путь передачи холерного вибриона чаще всего реализуется при употреблении в пищу устриц и моллюсков без термической обработки.
Восприимчивость людей к холере очень высокая. В эндемичных районах преимущественно болеют дети до 5 лет, за исключением детей грудного возраста, которые получают с молоком матери противохолерные антитела класса IgA. При развитии вспышки холеры в неэндемичном регионе заболеванию подвержены все возрастные группы в равной степени. К факторам, способствующими повышенному риску заболевания, относятся: высокая инфицирующая доза возбудителя, сопутствующие состояния, связанные с гипохлоргидрией (недоедание, атрофический гастрит, в том числе обусловленный инфекцией Helicobacter pylori, гас- трэктомия, прием препаратов, снижающих кислотность желудочного сока), недостаточность местного иммунитета. По неустановленным причинам более тяжелые формы заболевания, вызванные биоваром El Tor, регистрируют у лиц с 0 (I) группой крови.
Формирующийся иммунитет непродолжительный (до 1-го года), типо- и видоспецифический, протективное значение имеет местный иммунитет.
Патогенез. В случае прохождения холерными вибрионами желудоч- ного барьера происходит их адгезия и колонизация на слизистой оболочке тонкой кишки (преимущественно в двенадцатиперстной и тощей кишках). В процессе колонизации слизистая оболочка остается абсолютно интактной и без признаков воспалительной реакции. Ключевая
роль в развитии клинической картины заболевания отводится вырабатываемому холерному термолабильному энтеротоксину. Действие холерного энтеротоксина ограничивается только эпителиальными клетками слизистой оболочки тонкой кишки. Через активацию аденилатциклазного комплекса происходит усиление активной секреции хлоридов (Cl-) и натрия (Na+) пораженными эпителиальными клетками и ингибирование абсорбции ионов натрия клетками ворсинчатого эпителия, что, в конечном итоге, приводит к массивной секреции жидкости в просвет тонкой кишки. Объем секретируемой жидкости значительно превосходит абсорбционную способность кишечника, в результате чего развивается секреторная диарея. Секретируемая в просвет кишечника жидкость содержит значительное количество натрия, хлоридов, калия, бикарбоната и незначительное количество белка. Холерный энтеротоксин усиливает выработку бокаловидными клетками большого количества слизистого секрета, что имеет значение в формировании характерных испражнений больных в виде так называемого «рисового отвара». Другие факторы патогенности холерного вибриона (например, гемолизины) усиливают действие энтеротоксина.
Потеря богатой электролитами изотонической жидкости приводит к гиповолемии, гемоконцентрации, резкому повышению вязкости крови, нарушению перфузии органов и тканей, гипоксемии, гипоксии, мета- болическим нарушениям (лактат-ацидозу), гиповолемическому шоку и полиорганной недостаточности.
Выраженных патоморфологических изменений со стороны слизистой желудочно-кишечного тракта при холере не выявляется. На высоте клинических проявлений заболевания в слизистой и подслизистой обо- лочках тонкого кишечника определяется отек, признаки гиперсекреции эпителиальных и бокаловидных клеток тонкой кишки c сохранением их структуры, расширение просвета крипт.
На аутопсии отмечается резкое обезвоживание тканей всех органов, полнокровие серозных оболочек с точечными кровоизлияниями, дистрофические изменения в паренхиматозных органах.
Клиническая картина. Инкубационный период варьирует от 18 часов до 5 дней, чаще составляя 2-3 дня.
Считается, что клиническая картина холеры принципиально не зависит от типа возбудителя (его серотипа и биовара), тем не менее, как показывают наблюдения, биовар El-Tor V cholerae чаще вызывает более легкие формы заболевания (табл. 2.1).
Таблица 2.1. Особенности клинического течения холеры в зависимости от биовара возбудителя
Клинические формы | V. cholerae | |
Classica (asiatica) | El-Tor | |
Тяжелые | 11% | 2% |
Среднетяжелые | 15% | 5% |
Легкие | 15% | 18% |
Иннапарантные | 59% | 75% |
При холере наблюдают различные клинические формы развития заболевания - от бессимптомного вибриононосительства и субклини- ческих форм до крайне тяжелых и даже молниеносных форм с быстро развивающимся обезвоживанием и возможной смертью больных в течение 4-6 часов с момента начала заболевания.
В некоторых случаях (10-15%) острому началу заболевания предшествует продромальный период, который продолжается от нескольких часов до суток. В этот период больные отмечают появление слабости, недомогания, головокружения, головной боли, вегетативных расстройств в виде потливости, сердцебиения, похолодания конечностей.
В типичных случаях холера начинается внезапно, чаще в ночные или утренние часы, с появления разжиженного стула, который уже после 2-3-х дефекаций теряет каловый характер и становится обильным, водянистым, практически без запаха. Дефекация в типичных случаях не сопровождается болями в животе и тенезмами, однако около трети больных могут отмечать умеренно выраженные боли, причиной которых могут быть фоновые патологические процессы в желудочно-кишечном тракте (кишечные гельминтозы, хронические энтероколиты и др.).
При прогрессировании заболевания в течение первых 24-36 часов от момента его начала отмечается возрастание частоты дефекаций и объема стула при каждой последующей из них. При этом частота стула лишь относительно может свидетельствовать о выраженности водно-электролитных потерь, поскольку при одной дефекации больные теряют от 300 до 500 мл воды, а при тяжелом течении объем потерь жидкости со стулом может достигать 5000-1000 мл в час. При выраженной дегидратации (IV степени) в 5-7% случаев возможно развитие пареза кишечника, при этом дефекация и рвота становится реже с увеличением объема испражнений, а затем прекращаются.
В части случаев, преимущественно при обезвоживании III-IV степени, испражнения могут принимать характер так называемого «рисового
отвара» и выглядеть как мутная желтовато-зеленоватая жидкость с плавающими рыхлыми белыми хлопьями.
По мере прогрессирования заболевания присоединяется обильная водянистая рвота без предшествующей тошноты. Рвотные массы по внешнему виду также напоминают рисовый отвар. Появление обильной многократной рвоты, как правило, свидетельствует о выраженной секреции воды и электролитов в просвет кишечника.
Считается, что у больных холерой температура тела остается в пределах нормальных величин, а по мере нарастания обезвоживания организма развивается гипотермия. Тем не менее большинство исследователей считают, что примерно у 20% больных в начальном периоде холеры отмечается субфебрилитет, а в отдельных случаях и фебрильная лихорадка.
По мере нарастания признаков обезвоживания изменяется внешний вид больного: черты лица заостряются, глаза западают, появляются темные круги вокруг глаз (симптом «темных очков»), склеры тускнеют, что придает страдальческое выражение лицу больного («лицо Гиппократа»). Кожные покровы бледные, холодные на ощупь. Развивается акроцианоз, а при выраженной дегидратации - тотальный цианоз. Снижается эластичность и тургор кожи, вследствие чего кожа на подушечках пальцев и кистях сморщивается («холерная складка», «руки прачки»). Голос становится слабым, сиплым, вплоть до развития афонии. Температура тела по мере нарастания обезвоживания снижается до субнормальных цифр.
Пульс на периферических сосудах становится слабым, появляется и нарастает тахикардия. Артериальное давление падает, в тяжелых случаях не определяется. По мере нарастания признаков метаболического ацидоза прогрессирует тахипноэ, дыхание может принимать патологический характер (по типу Куссмауля, Чейна-Стокса).
Пальпация живота в типичных случаях холеры безболезненная, при этом отмечается выраженное урчание и переливание жидкости по ходу кишечника. Мочеотделение резко уменьшается, вплоть до анурии. Клиническую картину прогрессирующей холеры дополняет развитие судорожного синдрома. Мышечные судороги начинаются с дистальных отделов конечностей (кисти, стопы, икроножные мышцы), в последующем могут принять генерализованный характер с вовлечением мышц туловища и лица (поза «гладиатора»).
Сознание больных сохранено, однако по мере прогрессирования заболевания пациенты становятся безразличными, и в случае развития декомпенсированной дегидратации отмечается спутанность сознания, вплоть до его потери.
Поскольку важнейшими первичными клиническими признаками холеры является жидкий водянистый стул и рвота, приводящие к обезвоживанию организма, тяжесть течения и прогноз заболевания определяют по степени его выраженности. Одним из опорных признаков холеры является быстрота развития обезвоживания организма, не характерная для других острых диарейных инфекционных заболеваний. Дегидратация IV степени может развиться у больных уже в течение первых суток заболевания.
В настоящее время в практике используют клиническую классификацию холеры, предложенную В.И. Покровским с соавт. (1978), в соответствии с которой выделяют четыре (I-IV) степени обезвоживания, в зависимости от величины водных потерь относительно массы тела и, соответственно, отражающих тяжесть течения заболевания.
Дегидратация I степени. Уровень потерь жидкости не превышает 3% массы тела. Больные отмечают внезапное появление позыва на дефекацию, сопровождающегося кашицеобразным или водянистым стулом. В последующем подобные позывы повторяются, однако болевые ощущения со стороны кишечника отсутствуют. Чаще всего кратность дефекаций при I степени дегидратации не превышает 5-10 раз в сутки. Рвота регистрируется не более чем у половины больных и не превышает 1-2 раза в сутки. Пациенты отмечают только сухость во рту, жажду и небольшую слабость, их общее состояние и самочувствие остаются удовлетворительными.
Дегидратация II степени. Потери жидкости находятся в диапазоне от 4 до 6% массы тела. Наличие более интенсивных водно-электролитных потерь проявляется частым водянистым стулом (свыше 10 раз в сутки) и многократной рвотой (от 5 до 10 раз в сутки). Характерный стул по типу рисового отвара регистрируется не более чем у 1/3 больных. В ряде случаев рвота может доминировать в клинической картине, тогда как стул у этих больных будет сохранять каловый характер.
Больные предъявляют жалобы на сухость слизистых оболочек ротоглотки, выраженную жажду, слабость. При объективном осмотре выявляется бледность кожных покровов, а в четверти случаев цианоз носогубного треугольника и акроцианоз. Язык сухой, обложен налетом. Отмечаются тахикардия, снижение АД, олигурия. Примерно в трети случаев у больных возникают кратковременные судорожные подергивания мышц конечностей.
Дегидратация III степени. Потери жидкости соответствует 7-9% массы тела. Поскольку водно-электролитные потери происходят уже за счет сосудистого русла, клинические признаки обезвоживания у таких
больных резко выражены. Ввиду поддержания на минимальном уровне жизнеобеспечивающих функций сердечно-сосудистой системы эта стадия иногда обозначается как субкомпенсированная.
Уже с первых часов заболевания у больных отмечаются обильный многократный стул и неукротимая рвота, которые быстро приводят к обезвоживанию организма. Рано появляются длительные, повторяющиеся болезненные судороги в конечностях с возможным переходом на другие мышечные группы (например, мышцы брюшной стенки). Ввиду снижения ОЦК отмечается прогрессирующее снижение АД, тахикардия, развитие олигоанурии.
Дегидратация IV степени. Выраженность водно-электролитных расстройств максимальная, потери жидкости соответствуют 10% и более массы тела. Вариант течения холеры с дегидратацией IV степени характеризуется очень бурным развитием клинической картины заболевания, в результате чего нарастающие признаки обезвоживания у большинства больных выявляются уже через 6-12 часов от момента начала болезни. Раньше данная степень дегидратации классифицировалась как алгид ввиду выявления у больных гипотермии. Состояние больных крайне тяжелое. Вследствие электролитных расстройств иногда развивается парез гладкой мускулатуры желудочно-кишечного тракта, сопровождающийся прекращением рвоты и появлением икоты. Снижение тонуса ануса проявляется свободным истечением кишечной жидкости, усиливающимся даже при легкой пальпации живота. Типичны генерализованные судороги. В первые часы при IV степени дегидратации больные находятся в сознании, но они сонливы, апатичны, вербальный контакт с ними затруднен из-за резкой слабости и афонии. По мере прогрессирования вводно-электролитных и кислотно-щелочных нарушений у них может развиваться сопор, переходящий в кому. Несмотря на то, что у больных отмечаются критические вводно-электролитные потери, проявляющиеся резким падением уровня АД, отсутствием пульса на периферических артериях, анурией, все изменения носят обратимый характер, а успех лечения зависит от сроков начала регидратационной терапии и ее адекватности.
Клинико-лабораторная характеристика различных степеней дегидратации представлена в табл. 2.2.
Помимо клинически манифестных форм холера может протекать в субклинической форме и в виде вибриононосительства. Вибриононосительство может быть реконвалесцентным (после перенесенных клинически манифестных или субклинических форм) и «бессимптомным», при котором развитие инфекционного процесса ограни-
Таблица 2.2. Клинико-лабораторные критерии степеней дегидратации (по Покровскому В.И. с соавт., 1978)
Симптомы | Степени дегидратации | |||
I | II | III | IV | |
Рвота | до 5 раз | до 10 раз | до 20 раз | свыше 20 раз |
1 | 2 | 3 | 4 | 5 |
Жидкий стул | до 10 раз | от 10 до 20 раз | 20 раз и более | свыше 20 раз |
Жажда, сухость слизистых полости рта | умеренная | значительная | резкая | |
Цианоз | нет | носогубного треугольника | акроцианоз | общий цианоз |
Эластичность кожи и тургор подкожной клетчатки | норма | понижены у пожилых | понижены | резкое снижение |
Изменение голоса | не изменен | ослаблен | осиплость | афония |
Судороги | отсутствуют | кратковременные судорожные подергивания мышц конечностей (стоп, кислей) | продолжительные и болезненные с вовлече- нием большего объема мышечной массы | генерализованные, тонические, «поза Гладиатора» |
Пульс на периферических сосудах | норма | до 100 уд. в 1 мин | до 120 уд. в 1 мин, слабый, вплоть до нитевидного | не определяется |
Систолическое артериальное давление | норма | снижение на 10-20% ниже индивидуальной нормы | снижение до 50% от индивидуальной нормы | снижение ниже 50% от индивидуальной нормы |
Диурез | норма | олигурия | олигоанурия | анурия |
Индекс гематокрита (%) | 40-45% | 45-50% | 50-55% | свыше 55% |
Окончание таблицы 2.2
1 | 2 | 3 | 4 | 5 |
Величина рН крови | 7,36-7,40 | 7,36-7,40 | 7,30-7,36 | менее 7,30 |
Дефицит оснований (ВЕ) | норма | -2...-5 ммоль/л | -5.-10 ммоль/л | свыше -10 ммоль/л |
Нарушение электролитного обмена | норма | тенденция к снижению калия | гипокалие- мия, гипохлоре- мия | гипокалие- мия до 2,5 ммоль/л, гипохлоремия |
чивается только формированием носительства. Клинико-лабораторное обследование «бессимптомных» носителей показывает, что в подавляющем большинстве случаев (95%) у больных имеет место субклиническая форма заболевания.
Клинико-эпидемиологические особенности холеры, вызванной биотипом El-Ior:
а) увеличение количества стертых, субклинических форм и вибриононосительства;
б) удлинение периода реконвалесцентного вибриононосительства;
в) снижение эффективности этиотропной терапии в силу роста антибиотикорезистентности штаммов вибрионов.
Дифференциальная диагностика. Хотя типичное клиническое течение холеры характеризуется быстро прогрессирующим обезвоживанием, в современных условиях у больных холерой нередко может выявляться умеренно выраженная диарея, неотличимая от таковой при других острых кишечных заболеваниях, протекающих с явлениями гастроэнтерита.
Лабораторная диагностика. Предположительный диагноз холеры основывается на клинико-эпидемиологических данных. Особое значение имеют сведения об эпидемической обстановке в местности, где был выявлен больной или откуда он прибыл.
Основу микробиологической диагностики составляет выделение и идентификация возбудителя. Материалом для исследования служат пищевые продукты, вода, гидробионты, смывы с объектов окружающей среды. Для установления окончательного диагноза требуется положительный результат бактериологического исследования материала от больных (испражнения и рвотные массы, загрязненное ими белье, секционный материал из тонкой кишки).
Нативный материал должен быть доставлен в лабораторию не позднее трех часов с момента забора; если выполнить данное условие невозможно, забор материала осуществляют в стерильную посуду с щелочным 1% пептонным бульоном. Доставку материала в лабораторию осуществляют в специальной металлической герметичной таре. В лаборатории материал засевается на элективную питательную среду, TCBS-агар с последующем субкультивированием на неселективных средах и идентификацией по антигенной структуре и биохимическим свойствам. Дополнительно факультативно можно сделать посев и на щелочную пептонную воду с последующим субкультивированием на TCBS-агаре (см. схему 2.1).
Длительность проведения бактериологического исследования составляет от 36 до 48 часов.
Серологические методы, основанные на обнаружении специфических антител в сыворотке крови (РА, РНГА, ИФА), имеют второстепенное значение, поскольку с их помощью осуществляется ретроспектив- ная диагностика.
Кроме этого, в клинической практике могут использоваться экспресс-методы диагностики, которые, однако, носят лишь ориентировочный характер. К их числу относятся РИФ и ПЦР, темнопольная микро- скопия (позволяющая выявить микроорганизмы, подвижность которых ингибируется добавлением антисывороток О1 или О139) и серологические тесты, основанные на обнаружении соматических О-антигенов холерных вибрионов в копрофильтрате (РЛА, ИФА, РКА).
Осложнения и прогноз. Развитие осложнений при холере обусловлено длительным сохранением состояния дегидратации организма при отсутствии или неадекватности регидратационной терапии. К осложнениям относятся острая почечная недостаточность, острое нарушение мозгового кровообращения, инфаркт миокарда, тромбоз мезентериальных сосудов. Кроме того, вследствие активизации условно-патогенной флоры могут присоединяться вторичные бактериальные инфекции (пневмонии, холецистит, абсцессы, флегмоны и т.д.).
Прогноз заболевания зависит от своевременности и адекватности проводимой терапии. При отсутствии соответствующего лечения летальность достигает 50% и выше, что нередко связано с трудностями в организации неотложной терапии. Группы риска неблагоприятного исхода составляют дети до 3-х лет и лица пожилого возраста. Смерть больных обычно наступает спустя 18-24 часа от момента начала заболевания.
Лечение. Все больные с установленным диагнозом холеры либо с подозрением на нее подлежат госпитализации в специализированные
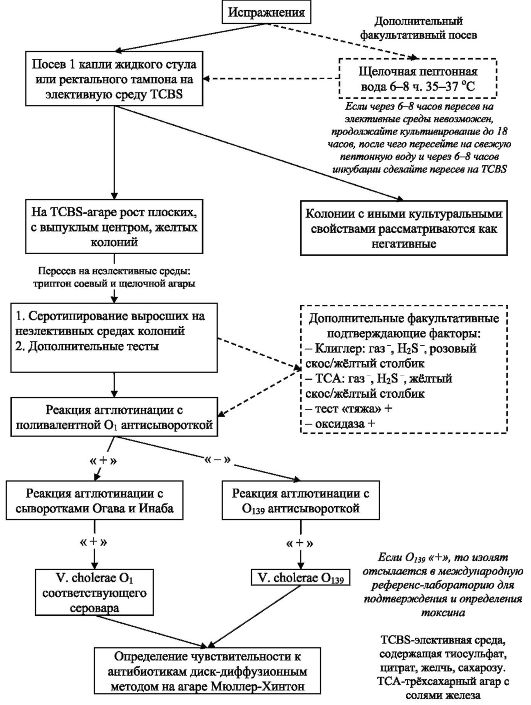
Схема 2.1. Изолирование и идентификация возбудителей холеры из испражнений
стационары. Ввиду отсутствия воспаления слизистой оболочки кишечника строгая диета не требуется.
Решающее значение в лечении больных холерой имеет патогенетическая терапия, направленная на быстрое и адекватное восполнение водно-электролитных потерь (по составу и объему) и с той же скоро- стью, с какой они происходят (табл. 2.3). Оценка степени обезвоживания при поступлении больного в стационар может производиться либо по снижению массы тела больного (что более предпочтительно), либо по комплексным клинико-лабораторным критериям.
Таблица 2.3. Сравнение электролитного состава стула больных холерой и используемых растворов для оральной и парентеральной регидратации*
Жидкости | Натрий (ммоль/л) | Хлориды (ммоль/л) | Калий (ммоль/л) | Бикарбонаты (ммоль/л) | Углеводы (г/л) |
Стул больных холерой | |||||
Взрослые | 130 | 100 | 20 | 44 | |
Дети | 100 | 90 | 33 | 30 | |
Растворы для оральной регидратации | |||||
Глюкозосолевой раствор (ВОЗ) | 90 | 80 | 20 | 30 | 111 ммоль/ л(20 г/л) |
Растворы для парентеральной регидратации | |||||
Раствор «Рингера» | 130 | 109 | 4 | 28 | |
Раствор «Трисоль» | 133 | 99 | 14 | 48 | |
Раствор «Квартасоль» | 112 | 101 | 20 | 12/19 | |
Раствор «Хлосоль» | 108 | 101 | 20 | 26 | |
Раствор «Ацесоль» | 100 | 99 | 14 | 15 | |
Раствор «Дисоль» | 117 | 103 | 15 | ||
*Примечание. Наиболее адекватными для парентеральной регидратации у больных холерой являются растворы «Квартасоль» и «Хлосоль». Использование растворов «Трисоль» и «Ацесоль» менее предпочтительно ввиду недостаточного содержания в них ионов К+.
Характер проводимой регидратационной терапии зависит от степени обезвоживания организма. Больным с умеренным обезвоживанием (I и частично II степенью дегидратации) назначается оральный прием глюкозо-солевых растворов («Цитроглюкосолан», «Регидрон», «Оралит» и др.). Больным с III и IV степенями обезвоживания проводится парентеральная регидратационная терапия, которая подразделяется на первичную и вторичную (корригирующую). Парентеральная регидратационная терапия проводится только полиионными растворами (табл. 2.3), состав которых соответствует водно-электролитному составу испражнений. Учитывая скорость и объемы вводимой жидкости, они должны прогреваться до 38-40 "С. Первичная регидратация независимо от степени обезвоживания должна быть проведена в течение первых 1,5-2 часов с момента поступления больного в стационар. Для достижения этой цели, особенно у больных с IV степенью обезвоживания, растворы вводят в 2 вены. Первые 2,0-2,5 литра вводятся струйно со скоростью 100-150 мл/мин с последующим снижением скорости введения до 50- 70 мл/мин. Столь интенсивное введение растворов способствует максимально быстрому восстановлению объема циркулирующей крови и тем самым предотвращает возможное развитие осложнений. С момента поступления больного в стационар необходимо учитывать у него все виды водных потерь, на основании чего определяют объем последующей регидратации. В процессе проведения регидратационной терапии необходимо контролировать водно-солевой и кислотно-основной гомеостаз.
Инфузионная регидратационная терапия проводится больным до стойкого улучшения состояния, что проявляется не только положительной динамикой параметров кардиогемодинамики, но и восстановлением диуреза, объем которого должен превышать объем испражнений за 6 часов наблюдения. Чаще всего длительность парентеральной регидратационной терапии не превышает 2-3 дня. Оральную регидратацию прекращают только после нормализации стула.
Помимо патогенетической терапии больные с холерой должны получать и этиотропную терапию, проведение которой сокращает продолжительность диарейного синдрома и способствует ускорению санации организма от холерного вибриона. Ввиду ограниченной колонизации возбудителя на слизистой оболочки тонкой кишки и отсутствия его диссеминации целесообразен оральный прием антимикробных препаратов. В последние 2 десятилетия отмечена тенденция к росту резистентных к антимикробным препаратам штаммов холерных вибрионов. Этот факт необходимо учитывать, поскольку все случаи холеры, выявленные в РФ, носят завозной характер. Больным назначают препараты тетра-
циклинового ряда (доксициклин) по 200-300 мг/сутки или фторхинолоны (ципрофлоксацин) по 500 мг 2 раза в сутки в течение 5 дней. При необходимости (в случае резистентности или непереносимости) могут использоваться препараты нитрофуранового ряда (фуразолидон) по 100 мг 4 раза в день, триметоприм-сульфометоксазол (бисептол, ко-тримоксазол) по 160/800 мг 2 раза в сутки курсом до 5 дней.
Выписка больных из стационара. Больные, перенесшие холеру (включая вибриононосителей), выписываются из стационара после полного клинического выздоровления, трех отрицательных результатов бактериологических исследований испражнений и однократного исследования желчи (порции В и С). Бактериологическое исследование проводится не ранее чем через 24-36 часов после окончания антибактериальной терапии в течение трех дней подряд. У лиц декретированных групп исследование испражнений производится пять раз в течение пяти дней подряд.
Рекомендации по последующему диспансерному наблюдению. В Российской Федерации после выписки из стационара все лица, перенесшие холеру, допускаются до работы, но находятся под медицинским наблюдением в течение трех месяцев. В первый месяц наблюдения они подвергаются бактериологическому исследованию 1 раз в 10 дней, а далее - 1 раз в месяц.
Профилактика. Специфическая профилактика имеет второстепенное значение.
2.2. Брюшной тиф
Брюшной тиф - острое антропонозное инфекционное заболевание с фекально-оральным механизмом передачи. Протекает в генерализованной форме с поражением лимфатического аппарата кишечника, мезентериальных лимфоузлов, паренхиматозных органов, бактериемией. Клинически проявляется выраженной интоксикацией с лихорадкой, развитием гепатолиенального синдрома, в ряде случаев - розеолезной сыпью и энтеритом.
Краткая историческая справка. Название болезни введено Гиппократом, оно происходит от греческого слова typhos (туман, спутанное сознание). Впервые возбудитель заболевания обнаружили в органах умерших людей Т. Брович (1874), Н.И. Соколов (1876) в России и К. Эберт (1880) в Германии. На основе феномена агглютинации брюшнотифозных бактерий с помощью специфических сывороток, открытого М. Грубером (1896), Ф. Видаль разработал реакцию агглютинации в диагностических целях (реакция Видаля). Клиническая картина брюш-
ного тифа подробно описана в различные периоды XIX в. рядом русских и французских авторов.
Этиология. Возбудитель заболевания - S. typhi (S. enterica серотип typhi) рода Salmonella, семейства Enterobacteriaceae. Тифозная палочка обладает соматическим О-антигеном, поверхностным Vi-антигеном, жгутиковым Н-антигеном. Vi-негативные тифозные палочки являются менее вирулентными и менее токсигенными, чем Vi-позитивные.
S. typhi экзотоксины не образуют, при их разрушении высвобождается липополисахаридный комплекс (эндотоксин), играющий основную роль в патогенезе заболевания. Возбудитель является факультативным внутриклеточным паразитом, способным инвазировать нефагоцитирующие клетки эпителия слизистой кишечника и размножаться в макрофагах. В определенной степени патогенность брюшнотифозных бактерий также определяют «ферменты агрессии» - супероксиддисмуаза, гиалуронидаза, фибринолизин, лецитиназа, гемолизин, каталаза и др.
По чувствительности к типовым бактериофагам выделяют более чем 100 стабильных фаговаров. Определение фаговара возбудителя - удобный маркер для выявления эпидемиологических связей между отдельными заболеваниями, выяснения источника и путей передачи возбудителя. В неблагоприятных условиях, например в иммунном организме, бактерии переходят в L-формы. Они умеренно устойчивы во внешней среде - в почве, воде могут сохраняться до 1-5 мес, в испражнениях - до 25 дней, на белье - до 2-х недель, на пищевых продуктах - от нескольких дней до недель. Дольше сохраняются в молоке, мясном фарше, овощных салатах, где при температуре выше 18 ?С они способны размножаться. При нагревании возбудители быстро погибают, дезинфицирующие растворы в обычных концентрациях действуют на них губительно. В последние годы отмечено появление новых фаговаров S. typhi, циркулирую- щих на различных территориях земного шара.
Установлено
наличие антибиотикорезистентных штаммов возбудителя, способных
вызывать крупные вспышки заболеваний (рис. 2.1). Устойчивость
возбудителя к антибактериальным средствам определяется плазмидами
pHCM1, R27 и др. Устойчивые штаммы к различным медикаментам
(хлорамфеникол, триметоприм, сульфаметоксазол, ампициллин)
распространены в Индии, Пакистане, Бангладеш, Вьетнаме, на Ближнем
Востоке, в Африке. В
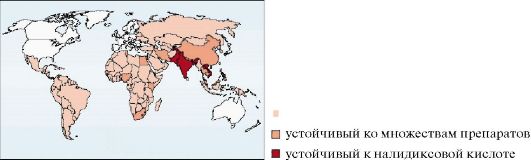
Рис. 2.1. Распространение резистентности Salmonella enterica serotype typhi
(S. typhi) в мире (ВОЗ, 1990-2002)
Эпидемиология. Резервуар и источник инфекции - человек (больной, реконвалесцент или здоровый бактерионоситель). В инкубационном периоде зараженный человек практически не опасен. Его опасность для окружающих увеличивается по мере развития болезни и достигает максимума на 2-3-й неделях заболевания при нарастающем выделении бактерий с фекалиями и мочой. Большинство реконвалесцентов освобождаются от возбудителя в течение 1-2-х недель, однако у 10% переболевших этот процесс затягивается до 2-3-х месяцев (острые бактерионосители). В 3-5% случаев бактерионосительство с периодическим выделением возбудителей в окружающую среду продолжается длительно, у некоторых - на протяжении всей дальнейшей жизни (хронические бактерионосители). Эпидемиологическая опасность хронического носителя зависит от соблюдения им правил личной гигиены. Особую опасность представляют носители, участвующие в приготовлении, хранении и реализации пищевых продуктов.
Механизм передачи - фекально-оральный. Пути заражения - водный (преимущественный в районах с повышенным уровнем заболеваемости), пищевой и контактно-бытовой. Водный путь заражения реализуется в виде вспышек заболевания при использовании воды загрязненных открытых водоемов, в том числе технических, а также при неудовлетворительном санитарно-техническом состоянии водопроводных и кана- лизационных сооружений. Наиболее важные факторы передачи при пищевом пути заражения - молоко и молочные изделия, кремы, салаты и другие продукты, представляющие хорошую среду для размножения бактерий, а также овощи, особенно при поливе их сточными водами или при удобрении фекалиями человека. Контактно-бытовой путь передачи возможен при инфицировании окружающих предметов бактериовыделителями или больными со стертой формой болезни.
Естественная восприимчивость людей к болезни в целом высокая, особенно у лиц с наличием антигенов гистосовместимости HLA- DRB1*0301/6/8, HLA-DQB1*0201-3 и TNFA*2. Устойчивость к болезни связана с антигенами HLA-DRB1*04, HLA-DQB1*0401/2 и TNFA*1. Постинфекционный иммунитет стойкий, пожизненный, однако изредка возможны повторные заболевания.
Брюшной тиф встречается во всех странах и климатических зонах (рис. 2.2). По данным ВОЗ, в мире ежегодно регистрируют 17-20 млн случаев заболевания и около 800 тыс. летальных исходов.
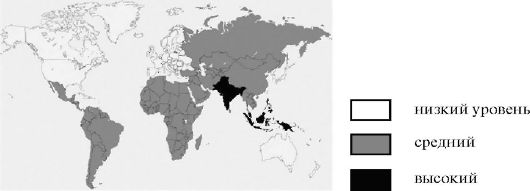
Рис. 2.2. Распространение тифо-паратифозных заболеваний в мире (ВОЗ,
Возникновение новых спорадических случаев заболевания и эпидемических вспышек связано с наличием в человеческой популяции хронических бактерионосителей и с отсутствием эффективных методов их санации. Крупные эпидемии брюшного тифа наблюдают в странах Азии, Африки и Южной Америки. Так, например, заболеваемость во Вьетнаме (область Меконг) составляет 198 на 100 000, в Дели (Индия) - 980 на 100 000 населения. В последние десятилетия заболеваемость брюшным тифом поддерживается не только за счет традиционно основного водного пути передачи, но и за счет активизации миграционных процессов, роста торговых связей, широкого распространения уличной торговли, в том числе пищевыми продуктами. Заболеваемость сельских жителей, особенно лиц младшего и среднего школьного возраста выше, чем жителей городов, что связано, главным образом, с одним из важных факторов - купанием в водоемах, загрязненных хозяйственно-фекальными стоками. Наиболее поражаемый контингент среди взрослых - молодые люди в возрасте от 15 до 30 лет.
Патогенез. Патологическая анатомия. Инфицирующая доза при брюшном тифе колеблется от 103 до 109 микробных клеток. При перораль-
ном заражении сальмонеллы, преодолевшие неспецифические защитные факторы полости рта, большей частью погибают в кислой среде желудка. Оставшиеся бактерии попадают в благоприятную щелочную среду тонкой кишки, где внедряются в солитарные и групповые лимфатические фолликулы кишечной стенки. При высокой инфицирующей дозе микроорганизмы частично могут проникать также в лимфоидные элементы лимфоглоточного кольца. В местах внедрения возбудителей происходит их первичное размножение, что сопровождается сенсибилизацией лимфоидной ткани с развитием гранулематозного воспаления. Лимфогенным путем бактерии диссеминируют в мезентериальные лимфатические узлы, где продолжают размножаться, обусловливая сенсибилизацию и гранулематозное воспаление в них. В лимфоузлах брыжейки может произойти гибель возбудителей в результате завершенного фагоцитоза. Описанные механизмы заболевания развиваются в течение инкубационного периода.
В начальном периоде заболевания вследствие незавершенного фагоцитоза брюшнотифозные палочки проникают в кровь через грудной лимфатический проток, развиваются бактериемия и эндотоксинемия. С кровотоком бактерии распространяются по паренхиматозным органам системы мононуклеарных фагоцитов (печень, селезенка, лимфатические узлы, костный мозг), оседают и размножаются в них, провоцируя формирование вторичных очагов гранулематозного воспаления - брюшнотифозных гранулем, включающих крупные «тифозные» клетки со светлыми ядрами.
В периоде разгара болезни тифозные гранулемы составляют основу для поддержания повторных волн бактериемии с токсинемией. При этом бактерии и их антигены частично вновь попадают в ранее сенсибилизированную лимфоидную ткань кишечной стенки. В результате развиваются реакции ГЗТ с некрозом пейеровых бляшек и солитарных фолликулов, что приводит к образованию брюшнотифозных язв, лока- лизующихся, в основном, в дистальных отделах подвздошной кишки, но иногда и в слепой кишке.
Патологические изменения лимфатического аппарата проходят ряд последовательных стадий. На 1-й неделе болезни развивается отек («набухание») лимфатических образований, на разрезе они серо-красного цвета и внешне напоминают вещество мозга ребенка («мозговид- ное набухание»). На 2-й неделе начинается некроз в центральных частях набухших лимфоидных образований (стадия некроза), в ряде случаев он распространяется на всю толщину кишечной стенки. Возникает опасность осложнений - перфорации стенки кишки и кишечного крово-
течения. На 3-й неделе начинается отторжение некротических масс, образуются так называемые «грязные» язвы, и, наконец, на 4-й неделе отторжение некротических масс заканчивается, формируются глубокие, так называемые «чистые» язвы. В эти периоды в ряде случаев содержимое кишечника удерживается от проникновения в брюшную полость только тонкой серозной оболочкой, что обусловливает максимальную опасность прободения кишечной стенки. В дальнейшем на 5-6-й неделях от начала болезни язвы заживают без образования рубцов.
Выделение возбудителей из организма больного с испражнениями, возникающее уже в начальном периоде болезни на фоне формирующихся иммунных реакций, в периоде разгара достигает своего максимума. Бактерии выделяются во внешнюю среду с фекалиями и мочой, возможна также их элиминация со слюной и грудным молоком.
В периоде реконвалесценции нарастает напряженность специфического гуморального и клеточного иммунитета, фагоцитоз становится завершенным. Эти процессы обусловливают клиническое выздоровление и освобождение организма от возбудителей (санацию).
Однако способность брюшно тифозной палочки к длительной персистенции в макрофагах в виде L-форм с последующей периодической реверсией в исходные бактериальные формы в части случаев обуслов- ливает возможность развития обострений и рецидивов заболевания, а также бактерионосительства, патогенез которого недостаточно изучен. Считается, что оно представляет собой хроническую брюшнотифозную инфекцию, формирование которой связано с фенотипическими особенностями иммунной системы макроорганизма. У 8-10% реконвалесцентов выделение брюшнотифозной палочки может продолжаться до 2-3-х месяцев после клинического выздоровления (острое бактерионоситель- ство). В дальнейшем у половины из них (3-5% случаев) формируется так называемое хроническое носительство, которое может продолжаться от нескольких месяцев до десятков лет и даже пожизненно.
Клиническая картина. Инкубационный период при брюшном тифе варьирует от 3-5 до 60 дней, в среднем он длится 10-14 суток. Начало заболевания может быть острым, с высокой лихорадкой в первый же день болезни, или постепенным, с нарастанием температурной реакции от субфебрильной до высокой в течение нескольких дней. В настоящее время острое начало брюшного тифа встречается более чем в 60% случаев.
Начальный период болезни продолжается в течение первых 5-7 дней. В это время развивается синдром интоксикации: возникают умеренная головная боль разлитого характера, головокружение, прогрессируют общая слабость, адинамия, снижение аппетита, нарушение сна (сон-
ливость днем и неглубокий сон ночью). Возможны небольшой сухой кашель, чувство дискомфорта в животе. При остром начале эти признаки становятся выраженными уже в первые 2 дня болезни.
При осмотре обращает на себя внимание вялость, адинамия, неразговорчивость больных, односложность в их ответах на поставленные вопросы. Можно отметить бледность кожных покровов, гиперемию или нормальный цвет лица (каждый вариант встречается приблизительно в 30-35% случаев). Характерна отечность языка, при этом по центру он обложен налетом, а края и кончик остаются чистыми, часто с отпечатками зубов. При развитии метеоризма живот несколько вздут, перистальтика кишечника замедлена, стул задержан. Однако в начальной стадии болезни возможно и послабление стула с каловыми массами в виде «горохового супа», что обычно характерно для более тяжелого течения заболевания. Формируются три симптома правой подвздошной области: небольшая болезненность при пальпации живота (проводить осто- рожно!), легкое урчание в кишечнике, а также притупление перкуторного звука (симптом Падалки). Сочетание указанных трех симптомов наблюдается далеко не у всех больных. Уже к 3-4 дням болезни можно выявить гепатолиенальный синдром. Печень и селезенка при пальпации несколько уплотнены, но безболезненные. Тоны сердца приглушены, АД склонно к умеренному снижению. Характерным признаком брюшного тифа считается относительная брадикардия. Однако в начальном периоде болезни она бывает обычно не чаще, чем в 25-30% случаев, а выявленная у больного тахикардия даже в периоде разгара не может говорить против диагноза брюшного тифа.
С конца 1-й - начала 2-й недели развертывается период разгара болезни. Он может продолжаться от нескольких дней до 2-3-х недель и отличается, прежде всего, нарастанием симптомов интоксикации, высокой температурой постоянного, волнообразного или неправильного характера, заторможенностью больных.
На 8-9 сутки болезни на передней брюшной стенке и нижней части груди пациентов можно обнаружить брюшнотифозные розеолы (рис. 2.3), мелкие (1-2 мм в диаметре) розовые пятна, исчезающие при растяжении кожи и слегка возвышающиеся над ее поверхностью (roseolae elevatae). Экзантема обычно скудная, иногда всего 2-5 элементов. Вслед за возникновением первых розеол в течение всего лихорадочного периода возможно появление новых элементов сыпи (феномен подсыпания) при быстром (за 2-3 суток) угасании предыдущих. Вместе с тем следует иметь в виду, что отсутствие экзантемы не исключает диагноз брюшного тифа. Относительная брадикардия выявляется несколько чаще, чем

Рис. 2.3. Розеолы на коже живота при брюшном тифе
в начальном периоде, при этом частота пульса значительно отстает от уровня температуры. Тоны сердца, как правило, глухие, пульс малого наполнения, артериальное давление снижено. В легких иногда про- слушивают жесткое дыхание и сухие хрипы. Возможна олигурия. При тяжелом течении заболевания может развиться так называемый status typhosus. Он проявляется гиперпирексией, бессонницей, нарастанием головной боли, прострацией больного, резкой слабостью, адинамией, апатией, помрачением сознания с дезориентацией и возникновением галлюцинаций, а в некоторых случаях психомоторным возбуждением. При современном течении брюшного тифа status typhosus встречается редко. В периоде реконвалесценции происходит постепенное или (реже) быстрое снижение температуры, при постепенном снижении иногда наблюдают большие размахи между ее утренними и вечерними показателями (амфибола). Уменьшаются и исчезают другие проявления интоксикации. Нормализуются размеры печени и селезенки, восстанавливаются функции органов и систем. Необходимо подчеркнуть, что, несмотря на заметное улучшение состояния больного, особенно под воздействием лечебных мероприятий, язвенный процесс в тонкой кишке может быть еще не завершен, что сохраняет опасность развития кишечных кровотечений и перфораций кишки.
При оценке тяжести течения брюшного тифа принимают во внимание выраженность проявлений интоксикационного синдрома, наличие или отсутствие осложнений. В легких случаях заболевания типичные клинические проявления скудны, температура чаще невысокая, признаки энцефалопатии отсутствуют. Для среднетяжелого течения болезни характерна длительная (до 2-х недель и более) лихорадка, нейротокси-
коз (вялость, адинамия, нарушение сна, заторможенность). Признаками тяжелого течения являются: гиперпирексия, развитие тифозного статуса и инфекционно-токсического шока, менингеальные явления, геморрагический синдром.
Клиническая картина брюшного тифа далеко не всегда проявляется описанным выше комплексом симптомов, многие из которых могут быть выражены слабо или полностью отсутствовать. Подобные варианты заболевания относят к атипичным формам, их диагностика весьма затруднительна («амбулаторный тиф»). К атипичным формам относятся и редкие, но обычно тяжело протекающие случаи брюшного тифа со специфическими признаками поражения легких, менингеальных оболочек, почек, толстой кишки («пневмотиф», «менинготиф», «нефротиф» и «колотиф» соответственно).
Известно абортивное течение брюшного тифа, обычно наблюдаемое у привитых брюшнотифозной вакциной, при котором острое развитие типичной клинической симптоматики внезапно быстро обрывается и сменяется прогрессирующей реконвалесценцией. Стертая форма болезни проявляется непродолжительным субфебрилитетом, слабо выраженными симптомами интоксикации, отсутствием экзантемы и некоторых других типичных симптомов. После перенесенного заболевания в 8-10% случаев развивается бактерионосительство брюшнотифозной палочки, при этом состоянии возбудители периодически выделяются из фекалий, мочи, дуоденального содержимого при отсутствии клинических проявлений брюшного тифа. При остром бактерионосительстве выделение микробов продолжается до 3-х месяцев после клинического выздоровления, при хроническом - в течение многих лет, даже пожизненно. Иногда наблюдают транзиторное бактерионосительство, всего лишь с однократным или двухкратным выделением возбудителей, не обусловленным наличием инфекционного процесса.
Обострения и рецидивы. В некоторых случаях брюшной тиф приобретает затяжной характер, что связано с развитием обострений болезни. Обострения представляют собой повторное усиление основных симптомов заболевания (повышение температуры, появление новых розеол, увеличение печени и селезенки и т.д.), обычно возникающее на фоне начавшейся реконвалесценции, снижающейся, но еще не нормализовавшейся температуры тела.
Рецидивы заболевания бывают в 10-20% случаев, частота их воз- никновения не зависит от назначения антибактериальной терапии. Клинические проявления обострений и рецидивов сходны, однако последние развиваются на фоне уже нормализовавшейся температуры
и удовлетворительного самочувствия больного. В большинстве случаев рецидивы возникают на 2-3-й неделях апирексии, но иногда и в более поздние сроки. У больного обычно бывает один рецидив, редко два и даже три. Основные клинические особенности рецидива: острое начало, быстрое развитие симптоматики (в течение 1-2-х дней), раннее (уже в первые сутки) появление экзантемы, более легкое и короткое течение по сравнению с основным заболеванием. Следует отметить, что при лечении фторхинолонами частота возникновения рецидивов значительно сокращается (до 1-6%).
Осложнения. Наиболее опасные и патогенетически обусловленные осложнения брюшного тифа - инфекционно-токсический шок, кишечное кровотечение и перфорация тонкой кишки. Чаще осложнения возникают в периоде разгара заболевания.
Инфекционно-токсический шок может возникнуть на фоне выраженной интоксикации. Клинические признаки ИТШ: нарастающая бледность кожи с акроцианозом, резкое снижение температуры тела, тахикардия и слабый пульс, падение артериального давления, одышка, прогрессирующая олигурия или анурия, повышенное потоотделение, заторможенность больного при отсутствии психомоторного возбуждения.
Перфорация тонкой кишки и кишечное кровотечение развиваются на различных этапах формирования язв в кишечнике (с конца 2-й по 5-ю недели болезни). Кишечное кровотечение возникает в 8-10% случаев. При медленном, почти бессимптомном развитии диагноз кровотечения устанавливают по наличию крови в каловых массах и падению гемоглобина. В случае массивного кровотечения внезапно снижается температура тела до нормальных или субнормальных показателей, и учащается пульс (croix de diable, «чертов крест» на температурной кривой), падает артериальное давление. Нарастают слабость, головокружение, появляется мелькание «мушек» перед глазами, возникает жажда. При массивном кровотечении каловые массы приобретают характер мелены. Возможно появление рвоты с рвотными массами в виде «кофейной гущи».
Перфорация тонкой кишки отмечается в 1-2% случаев. Сигнал перфорации - абдоминальная боль самого разнообразного характера, от незначительной локальной и нарастающей до «кинжальной». В правой подвздошной области возникает небольшое напряжение брюшных мышц, а позже - симптом Щеткина-Блюмберга. Однако иногда эти признаки могут отсутствовать, в таких случаях следует обратить внимание на косвенные симптомы: отсутствие перистальтики при аускультации живота, внезапное резкое снижение температуры тела, прогрессирующую тахикардию.
При одновременном развитии перфорации и кровотечения болевой синдром в большинстве случаев отсутствует. Задача инфекциониста - распознать перфорацию в первые часы после возникновения, поскольку при поздней диагностике у больного развивается клиническая картина разлитого перитонита.
Многочисленные неспецифические осложнения брюшного тифа обусловлены активизацией вторичной бактериальной флоры, при этом могут развиваться: пневмония, бронхит, пиелонефрит, миокардит, отит, паротит, холецистит и т.д.
Исходы заболевания. При спорадическом уровне заболеваемости выздоровление наблюдается в 98-99% случаев, при эндемическом вспышечном характере распространения летальность без лечения может достигать 20%, а при поздней постановке диагноза в некоторых эндемичных областях - до 50% случаев.
Дифференциальная диагностика. Брюшной тиф дифференцируют от многочисленных заболеваний, сопровождающихся развитием длительной лихорадки и признаков интоксикации: сыпного тифа, малярии, бруцеллеза, пневмонии, сепсиса, туберкулеза, лимфогранулематоза и других. При этом следует принимать во внимание такие характерные симптомы брюшного тифа, как длительная лихорадка, выраженная интоксикация, заторможенность и адинамия больного, бледность кожных покровов, розеолезная экзантема, отечность языка, обложенного по центру, симптомы правой подвздошной области (болезненность, урчание при пальпации, симптом Падалки), гепатолиенальный синдром, относительная брадикардия, развитие тифозного статуса при тяжелом течении заболевания. Постановка правильного диагноза особенно затруднительна при атипичных формах болезни. В связи с этим в каждом случае неясной лихорадки длительностью более трех дней необходимо проведение соответствующих лабораторных исследований, в том числе бактериологического анализа крови и фекалий, определения АГ возбудителя в сыворотке крови и испражнениях, сывороточных антител.
Лабораторная диагностика. Изменения гемограммы в типичных случаях брюшного тифа на высоте интоксикации характеризуются лейкопенией, нейтропенией со «сдвигом влево», анэозинофилией, относительным лимфомоноцитозом и умеренным повышением или нормальными показателями СОЭ. В начальном периоде заболевания можно выявить умеренный лейкоцитоз со сдвигом влево. Результаты анализа мочи отличаются повышенным количеством белка, эритроцитов, цилиндров.
Бактериологическая диагностика проводится с учетом периодов болезни (схема 2.2). Выделение возбудителя из крови возможно в течение всего лихорадочного периода. Для этого 10 мл крови засевают на 100 мл среды, содержащей желчь. Высев брюшно тифозной гемокультуры при наличии клинической симптоматики является абсолютным подтверждением диагноза брюшного тифа.
Копро- и уринокультуры тифозной палочки можно получить при посевах фекалий и мочи на плотные питательные среды на любом этапе заболевания, даже в течение первых дней после заражения, но особенно часто - на 2-3-й неделях болезни, при максимальной интенсивности выделения возбудителя. Вместе с тем необходимо помнить, что выделение S. typhi из кала и мочи возможно не только от больных брюшным тифом, но и от бактерионосителей при различных неспецифических лихорадочных состояниях.
Уже с первых дней болезни можно определять брюшнотифозный О-АГ в биологических жидкостях в реакциях коагглютинации (РКА), латекс-агглютинации (РЛА), а также методами иммунофлуоресцентной микроскопии и ИФА.
Серологическая диагностика может быть информативной уже с конца первой недели заболевания (РНГА в парных сыворотках с эритроцитарными брюшнотифозными О- и Vi-диагностикумами, реакция Видаля). Минимальные диагностические титры О-антител в РНГА и в реакции Видаля равны 1:200, Vi-антител в РНГА - 1:40. Однако нарастание концентрации АТ даже до минимальных диагностических титров в дина- мике заболевания может задерживаться, что связано с индивидуальными особенностями иммунного ответа пациента. Постановка Vi-РНГА у больных брюшным тифом имеет вспомогательное значение, чаще эту реакцию используют для отбора лиц, подозрительных на бактерионосительство. При титрах АТ 1:80 и выше этим лицам проводят многократное бактериологическое исследование фекалий, мочи и дуоденального содержимого.
Перспективна разработка полимеразной цепной реакции (ПЦР).
Лечение. Госпитализация больных целесообразна во всех случаях, даже при подозрении на брюшной тиф. Однако в эндемических областях зачастую эта рекомендация не соблюдается, и 60-90% больных получают лечение на дому с назначением антибиотиков и постельного режима. Назначают механически и химически щадящую диету - несколько видоизмененный стол ? 4 (в инфекционном стационаре его иногда обозначают как стол ? 4 abt, более близкий к противоязвенной диете 1а по Певзнеру). Блюда готовят отварными и протертыми, питание должно
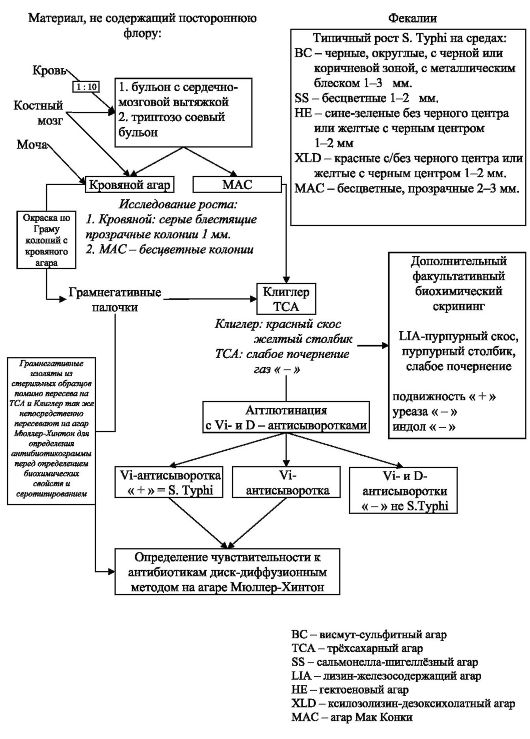
Схема 2.2. Выделение и идентификация S. Typhi
быть дробным, малыми порциями. Пищу рекомендуют запивать большим количеством жидкости. С 5-й недели от начала заболевания можно рекомендовать диету ? 13, близкую к общему столу и обычно назнача- емую лихорадящим больным. Постельный режим пациента обусловлен необходимостью избегать напряжения мышц живота, что может спровоцировать перфорацию кишки или кишечное кровотечение. Постельный режим и щадящую диету рекомендуют соблюдать до конца 4-й недели от начала болезни, вне зависимости от сроков исчезновения интоксикации, т.е. до развития репарации слизистой оболочки кишки.
Для этиотропной терапии брюшного тифа в настоящее время используют фторхинолоны и цефалоспорины третьего поколения, эти препараты считают антибиотиками выбора. В экономически слабых странах для лечения детей рекомендуют азитромицин и фуразолидон. Однако вышеуказанные препараты (за исключением фуразолидона) являются достаточно дорогостоящими. Кроме того, следует учитывать возможную резистентность к антибиотикам (например, резистентность к фторхинолонам в Индокитае, особенно во Вьетнаме, а также в Таджикистане). У детей фторхинолоны допустимо использовать лишь при тяжелом течении брюшного тифа, если нет менее токсичных препаратов.
Наиболее популярные схемы этиотропного лечения брюшного тифа:
- Ciprofloxacin в суточной дозе 20-30 мг/кг в течение 7-14 дней (по 250-500 мг 2 раза в день); не рекомендуют детям и беременным.
- Ofloxacin (Floxin) взрослым по 200-400 мг через 12 час, детям не рекомендуется.
- Levofloxacin (Levaquin) для лечения заболеваний, вызванных мультирезистентными грамотрицательными микроорганизмами; назначают взрослым по 500 мг/сут в течение 7-14 дней, детям не рекомендуется.
- Cefotaxime (Claforan) взрослым по
- Ceftriaxone (Rocephin) взрослым по 1-2 г/сут в/в в 2 приема с интервалом в 12 часов; младенцам и детям: по 50-75 мг/кг/сут в/в, в/м с интервалом в 12 часов, не превышая дозу 2 г/сут.
- Azithromycin (Zithromax) взрослым в суточной дозе 10 мг/кг (не превышая 500мг) в 1-й день и по 250 мг ежедневно в 2-5 дни лечения; детям в 1-й день - 10 мг/кг (не более 50 мг) и по 5 мг/кг/сут со 2 по 5 дни.
- Chloramphenicol, аmoxicillin, тrimethoprim/sulfamethoxazole остаются адекватными в регионах мира, где брюшнотифозная палочка все еще полностью чувствительна к этим препаратам.
- Chloramphenicol (левомицетин) обычно применяют по
4 раза в сутки по 10-й день апирексии; в тяжелых случаях заболевания назначают левомицетин-сукцинат в/м по
- Amoxicillin в суточной дозе 75-100 мг/кг (детям 20-50 мг/кг) в течение 14 дней.
- Trimethoprim/sulfamethoxazole (Bactrim DS, Septra) по 6,5-10 мг/кг/сут для взрослых и по 15-20 мг/кг/сут для детей в течение 14 дней.
При тяжелом течении брюшного тифа рекомендуют флюорохинолоны, которые, вероятно, можно считать антибиотиками выбора при тяжелых инфекциях. Лечение продолжают минимум 10 дней. Кроме того, в этих случаях в начале заболевания показаны кортикостероиды (дексаметазон в начальной дозе 3 мг/кг медленно внутривенно в течение 30 мин, далее по 1 мг/кг каждые 6 часов).
Для профилактики осложнений, вызванных анаэробной флорой, при длительных курсах этиотропной терапии назначают метрагил по 100 мг 3 раза в день. Учитывая наличие интоксикационного синдрома, всем больным необходима активная дезинтоксикационная терапия (обильное питье, энтеросорбенты, полиионные изотонические растворы, реополиглюкин, гемодез, свежезамороженная плазма). По показаниям назначают симптоматические средства - жаропонижающие, седативные, снотворные, витамины. В ряде клиник для профилактики рецидивов и формирования бактерионосительства применяют комплексную иммуно-антибиотикотерапию. Этиотропные средства используют одно- временно с брюшнотифозными вакцинами.При кишечном кровотечении больному назначают абсолютный покой в положении на спине на 12-24 часа, голод, ограничивают количество жидкости (не более 500 мл чайными ложками). Не ранее второго дня от начала кровотечения возможно расширение диеты: мясные и рыбные бульоны, соки, кисели, желе, яйца всмятку. После прекращения кровотечения в течение 3-
5 дней диету постепенно расширяют до стола ? 4abt. С первых часов кровотечения рекомендуют подвесить пузырь со льдом, слегка касающийся передней стенки живота больного. Применяют медикаментозные средства 5% раствор ε-аминокапроновой кислоты по 100 мл перорально и парентерально, 1% раствор викасола по 3 мл 2 раза в сутки в/м, 12,5% этамзилат натрия по 2 мл 3 раза в сутки парентерально, 10% раствор хло- рида кальция по 10 мл 2-3 раза в сутки в/в, свежезамороженную одно-
группную плазму; по витальным показаниям - переливания крови или эритроцитарной массы.
При перфорации кишки больному необходимо срочное хирургическое вмешательство.
Выписка реконвалесцентов из стационара после лечения антибиотиками возможна после 21-го дня нормальной температуры тела при полном клиническом выздоровлении, однако не может быть ранее окончания 4-й недели болезни.
По данным американских авторов, до 80-90% бактерионосителей могут быть санированы длительным курсом антибиотиков, если они не имеют желчных конкрементов. В последнем случае может потребоваться холецистэктомия или холелитиаз. Схемы лечения:
- ампициллин или амоксициллин перорально по 100 мг/кг/сут с пробенецидом по 30 мг/кг/сут; курс лечения - в течение 3-х месяцев;
- триметоприм-сульфаметоксазол по две таблетки 2 раза в день в течение 3 месяцев;
- ципрофлоксацин по 750 мг 2 раза в день в течение 28 дней;
- офлоксацин по 400 мг 2 раза в день в течение 28 дней. Профилактика. Профилактические мероприятия сводятся, прежде
всего, к выявлению бактерионосителей тифозной палочки и к пресечению путей передачи. Большое значение имеет санитарное просвещение населения. Наиболее рентабельная стратегия в эндемических регионах - гарантировать безопасную питьевую воду и санитарную обработку испражнений. При отсутствии такой стратегии целесообразна массовая иммунизация населения. Используют следующие тифозные вакцины:
- Парентеральная вакцина из убитых клеток тифозной палочки, эффективна в 50-80%.
- Парентеральная вакцина на основе Vi-антигена является подходящей для взрослых и детей старше двух лет и не имеет никаких серьезных побочных эффектов. Единственная доза 0,5 мл (25 μg) применяется внутримышечно. Подкрепляющие дозы рекомендуются каждые два года. Эффективность более - 70%.
- Живая пероральная ослабленная вакцина Ty21 (Vivotif Berna, Швейцария) по 1 капсуле в 1, 3, 5, 7 дни взрослым и детям старше шестилетнего возраста. Эффективность в различных регионах от 50 до 97%. Ревакцинация рекомендуется через каждые 5 лет.
- Во Вьетнаме испытана комплексная вакцина (Vi вакцина + экзотоксин Pseudomonas aeruginosa), защитная эффективность составила 91,5%. Предлагается для детей моложе 2-х лет.
- Инактивированная ацетоном парентеральная вакцина (пока доступна только в Вооруженных силах США).
Против S. enterica серотип paratyphi A в настоящее время вакцины нет.
Альтернативные пероральные вакцины находятся в различных стадиях разработки.
2.3. Паратифы А и В
Острые инфекционные заболевания c фекально-оральным механизмом передачи, сходные с брюшным тифом по патогенетическим механизмам и основным клиническим проявлениям.
Этиология. Возбудители - SS. paratyphi A и B, их морфологические, культуральные свойства и устойчивость к воздействию факторов внешней среды и дезинфектантов в основном аналогичны S. typhi. Паратифозные бактерии не имеют Vi-антигена, их антигенная структура представлена О- и Н-антигенами.
Эпидемиология. Резервуар возбудителя паратифа А-человек (больной и бактерионоситель), паратифа В - человек и животные (крупный рогатый скот, свиньи, домашняя птица). Носительство паратифозных бактерий формируется чаще, чем брюшнотифозных. Механизм передачи - фекально-оральный; пути передачи - водный (чаще при паратифе А), пищевой (чаще при паратифе В) и бытовой. Естественная восприимчивость людей высокая.
Патогенез паратифов и брюшного тифа идентичны.
Клиническая картина. Основные клинические проявления паратифов и брюшного тифа сходны, однако имеются и некоторые отличия.
Паратиф А может иметь укороченный инкубационный период (в среднем 6-10 дней). Характерно острое гриппоподобное начало заболевания с быстрым повышением температуры и возможными катаральными явлениями (насморк, кашель). У больных отмечают гиперемию лица, инъекцию сосудов склер, часто герпетические высыпания на губах и крыльях носа. Температурная реакция может быть короткой, часто принимает неправильный характер, сопровождается ознобом и потливостью. Экзантема довольно часто появляется раньше, чем при брюшном тифе (на 4-7-й день болезни), элементы сыпи преимущественно розеолезные, но иногда папулезные, кореподобные или петехиальные. Элементов сыпи больше, чем при брюшном тифе, они могут располагаться не только на коже живота и груди, но и на конечностях. Характерен полиморфизм экзантемы и «подсыпания» в динамике забо-
левания. Течение болезни чаще среднетяжелое, синдром интоксикации, как правило, выражен умеренно. Однако, как и при брюшном тифе, возможны тяжелые формы с осложнениями в виде кишечных кровотечений, перфораций кишечника, а также рецидивы заболевания.
Паратиф В после инкубации в 5-10 дней может проявиться острым началом с признаками гастроэнтерита (болями в животе, тошнотой, рвотой и жидким стулом), короткой температурной реакцией с лихорадкой неправильного типа, что в целом может быть ошибочно расценено как пищевая токсикоинфекция. Сыпь может отсутствовать или появляться рано (на 4-7-й дни болезни), быть полиморфной, нередко обильной, в том числе на коже конечностей. Обычно заболевание протекает в среднетяжелой форме, но в некоторых случаях может быть тяжелое течение, с развитием гнойного менингита, менингоэнцефалита и септикопиемии.
Дифференциальная диагностика аналогична таковой при брюшном тифе. Вместе с тем, учитывая клинические особенности начального периода, паратиф В необходимо дифференцировать от сальмонеллезов, пищевых токсикоинфекций, а паратиф А - от острых респираторных вирусных заболеваний.
Лабораторная диагностика - см. Брюшной тиф.
Осложнения. Возможны те же, что и при брюшном тифе.
Лечение и профилактика - см. Брюшной тиф.
2.4. Эшерихиозы
Полиэтиологическая группа инфекционных заболеваний человека, вызываемых энтеровирулентными (диареегенными) штаммами кишечной палочки, характеризующихся преимущественным поражением ЖКТ с развитием интоксикации и диарейного синдрома.
Историческая справка. Впервые Escherichia coli (первоначальное название Bacterium coli) была идентифицирована в конце 80-х годов XIX столетия, а в
группу различающихся между собой бактерий. В
На сегодняшний день по О-антигену идентифицировано более 170, а по Н-антигену - более 56 серогрупп E. coli, с общим числом разновидностей по О:Н антигенам около 9000, из которых только незначительная часть способна вызывать заболевания у человека. Основная масса E. coli является облигатными представителями нормальной микрофлоры кишечника и классифицируется как непатогенная флора, хотя в редких случаях (у иммунокомпромитированных лиц) они могут вызывать развитие инфекционных заболеваний. В зависимости от локализации возбудителя и степени его диссеминации выделяют три группы заболеваний: кишечные инфекции, проявляющиеся диарейным синдромом (энтеровирулентные штаммы); инфекции урогенитального тракта (уропатогенные штаммы) и генерализованные формы инфекции (сепсис и менингит).
Этиология. Род Escherichia включает несколько видов, из которых в патологии человека и животных имеет значение вид E. coli, впервые описанный в
Морфология. Прямые грамотрицательные палочки размером 0,4-0,6 x 2,0-6,0 мкм, подвижные за счет перитрихиально расположенных жгутиков.
Культуральные свойства. Эшерихии на плотных средах образуют колонии в R и S формах. Колонии в S формах гладкие, блестящие, полупрозрачные, на жидких средах образуют диффузное помутнение и придонный осадок
Биохимические свойства. Эшерихии обладают выраженной биохимической активностью. Биохимические свойства, составляющие основу дифференциальной диагностики при бактериологическом исследовании, следующие: ферментация до кислоты и газа глюкозы и лактозы, продукция индола, отсутствие способности продуцировать сероводород и расщеплять мочевину, положительная лизиндекарбоксилазная актив- ность, отрицательный тест Фогес-Проскауэра.
Антигенная структура E. coli обладает сложной антигенной структурой. Имеет соматический О-антиген, определяющий серогруппу. Известно около 171 разновидностей антигена. Поверхностный К-анти- ген может быть представлен 3 антигенами: А, В и L, отличающимися
по чувствительности к температуре и химическим веществам. У эшерихий встречается более 97 разновидностей К-антигена, преимущественно В-типа. К-антиген обладает способностью маскировать О-антиген, вызывая феномен О-иннагглютинабельности. В этом случае О-антиген можно выявить только после разрушения К-антигена кипячением.
Типоспецифичекским антигеном является Н-антиген, определяющий серовар, которых насчитывается более 57. Антигенная структура определяется формулами серогруппы.
Резистентность. В течение нескольких месяцев эшерихии сохраняются в воде и почве. Погибают при нагревании при 55 оС в течение 60 мин, при 60 оС - в течение 15 мин. В окужающей среде возбудители способны переходить в некультивируемую форму.
Экология и особенности распространения. Вид E. coli не является одно- родным: среди них выделяют условно-патогенные и патогенные эшерихии. Большинство эшерихий, которые являются условно-патогенными, входят в состав микрофлоры кишечника и влагалища. Патогенные эшерихии подразделяются на возбудителей парентеральных эшерихиозов и диареегенные. Патогенные возбудители отличаются от условно-патогенных возможностью синтезировать факторов патогенности, которые генетически связаны с наличием островков патогенности, конвертирующих фагов и плазмид вирулентности.
Диареегенные эшерихии также не являются однородной группой, они подразделяются на:
- энтеропатогенные кишечные палочки (ЭПКП);
- энтерогеморрагические кишечные палочки (ЭГКП);
- энтеротоксигенные кишечные палочки (ЭТКП);
- энтероинвазивные кишечные палочки (ЭИКП);
- энтероаггрегативные кишечные палочки (ЭАКП).
Кроме вышеперечисленных, в настоящее время имеется еще 3 недостаточно хорошо изученных групп кишечных палочек. Эти группы различаются по особенностям экологии, путям передачи, особенностям патогенеза и клинического проявления вызываемого ими заболевания, что обусловлено различиями в наличии факторов патогенности и их генетической детерминации. В пределах каждой категории имеется определенный состав О-серогрупп или О:Н-сероваров. Именно по составу О-серогрупп и проводится первичная дифференциация диареегенных эшерихий.
Энтеропатогенные и энтерогеморрагические кишечные палочки (ЭПКП и ЭГКП). Эти две группы значительно отличаются от других диареегенных эшерихий, так как они вызывают гистопатологические повреждения
на интестинальных эпителиальных клетках, известных как прикрепление и сглаживание (А/E attaching and effacing). A/E характеризуется как локализованная дегенерация поверхности интестинальной щеточной каймы с потерей эпителиальных микроворсинок и сборкой высокоор- ганизованной пьедесталподобной актиновой структуры в эпителиальной клетке в участке прикрепления бактерий. Все белки, связанные с образованием A/E повреждений, кодируются хромосомным островком патогенности (PI), известном как локус сглаживания энтероцитов (Locus of the enterocyte effacing LEE).
ЭПКП являются главным этиологическим агентом диареи новорожденных в развивающихся странах, может также протекать как внут- рибольничная инфекция в отделениях для новорожденных и грудных детей, находящихся на искусственном вскармливании. Заболевание передается контактно-бытовом путем. С ЭПКП связаны серогруппы О55, О11, О26, О18 (всего 13).
Факторы патогенности и молекулярный патогенез.
ЭПКП обладают способностью размножаться на поверхности эпителия тонкого кишечника с разрушением микроворсинок и повреждением апикальной поверхности эпителия. В этом процессе принимают участие следующие факторы патогенности:
- Bfp-пили (bundle-forming pili) - пучок-формирующие пили 4-го типа, кодируемые плазмидой 60МД.
- Интимин - белок наружной мембраны, синтез которого детерминируется eae-геном (effacing and attaching), входящим в состав островка патогенности, Lee.
- Секреторная система 3-го типа, секретирующая эффекторные Esp- белки, разрушающие клетки хозяина, синтез их детерминируется кластерами esc и esp генов, входящих в состав LEE.
- Tir (translocated intimin receptor.) - Bfp опосредуют начальное связывание ЭПКП с эпителиоцитом. В ответ на первичное связывание происходит синтез белка-интимина и белков секреторной системы третьего типа, которая представляет шприцеподобную структуру (см. рисунок), пронизывающую внешнюю мембрану бактериальной клетки и цитоплазматическую мембрану клетки эпителиоцита. По каналу этой шприцеобразной структуры транслоцируются Tir и эффекторные белки секреторной системы. В результате взаимодействия Tir с белком-интимином происходит тесное взаимодействие бактериальной клетки с эпителиоцитом, а в результате действия эффекторных белков секреторной системы в месте прикрепления бактериальной клетки к эпителиоциту формируется пьедестал, который является результатом реорганизации
клеточного цитоскелета эффекторными белками, представляя собой полимеризованный актин.
Некоторые серовары, например О55:Н10, O111H2, O26HNM, продуцируют шигаподобные токсины.
Энтерогеморрагические кишечные палочки. Наибольшее эпидемические значение имеют серовары О157:Н7 и О157 НNM. Источником инфекции являются крупный рогатый скот и овцы. Основной путь передачи - алиментарный (через мясо, не прошедшее достаточную термическую обработку). Поражаются слепая, восходящая и поперечные толстые кишки.
Факторы патогенности:
- Шигаподобные токсины (sl-t), синтез которых обеспечивается конвертирующими фагами.
- Интимин, белок синтез которого обеспечивается островком патогенности, Lee, локализованным на хромосоме.
- Секреторная система 3-го типа. Tir (translocated intimin receptor).
- Серин протеаза - синтез обеспечивается плазмидой. Действует на V-й фактор свертывания крови.
- Гемолизин, синтез обеспечивается плазмидой. Вызывает гемолиз эритроцитов.
Механизм взаимодействия ЭГКП с энтероцитами происходит аналогично таковому у ЭПКП. В этом процессе участвует белок наружной мембраны интимин и секреторная система 3-го типа. Развитие гемоли- тического колита и уремического гемолитического синдрома связаны со способностью продуцировать шигаподобные токсины, синтез которых опосредуется конвертирующими бактериофагами. В этом процессе принимают участие также кодируемые плазмидой О157 серинпротеаза, которая нарушает процесс свертывания крови, действуя на V фактор и гемолизин, который также способствует нарушению барьерной функции кишечника. У ЭГКП обнаруживаются 2 типа шигаподобных токсина. Серовар О157 Н7 может синтезировать как один, так и оба типа. Серовар О157 не обладает способностью утилизировать сорбит, что используется при проведении бактериологического исследования.
Энтероинвазивные кишечные палочки способны внедряться и размножаться в эпителиальных клетках слизистой стенке толстого кишечника, вызывая их деструкцию. Это обусловлено наличием плазмиды 140МД, идентичной таковой у шигелл, которая содержит «островок патогенности», вкючающий гены: ТТСС, ipa-локус, кодирующей синтез поверхностных белков, IPA-антигенов, опосредующих процесс инвазии в клетки
слизистой толстого кишечника и ген IcsA/VirG, продукт которого обеспечивает сборку актина. Результатом действия этих факторов патогенности является развитие дизентериеподобного заболевания.
Заражение ЭИКП происходит водным и алиментарным путями, возможны вспышки ВБИ. С ЭИКП связаны серогруппы О144, О124, О152 (более 9 серогрупп).
ЭИКП инвазируют эпителий кишечника, через М-клетки достигают базальной поверхности энтероцита, откуда они проникают в энтероцит. После инвазии микроб лизирует внутриэндоцитозную вакуоль, выделяется в цитозоль, быстро покрывается филаментозным актином и, в конце концов, образует актиновый хвост, который способствует продвижению бактерий внутри клеточного цитозоля и их проникновению в прилегающие клетки путем полимеризации актина. Таким образом, происходит внутриклеточное размножение и распространение бактерий от клетки к клетке внутриэпителиального клеточного слоя.
Энтероаггрегативные кишечные палочки являются преобладающим этиологическим агентом персистирующей диареи в развивающихся странах и медленно текущей диареи в индустриально развитых странах. Особенность возбудителя заключается в том, что они прикрепляются к эпителиальным клеткам в характерной манере, напоминающей укладку кирпичей. Прикрепляясь к слизистой поверхности кишечника, они сти- мулируют продукцию слизи, приводя к образованию толстой слизистой биопленки, инкрустированной ЕАГКП. Образование биопленки усиливает персистенцию микроба и создает барьер, препятствующий проникновению антибиотиков и антибактериальных факторов хозяина. В этом процессе участвуют:
- фимбриальные адгезины (AAF) ЕАКП продуцируют 3 фимбриальных адгезина, синтез которых опосредуется плазмидой 65 МД. В образовании биопленки обязательно участвует AAF2;
- дисперзин - высоко иммуногенный белок, который нековалентно связывается с клеточной поверхностью и принимает участие в образовании биопленки;
- термостабильный энтеротоксин1 (ЭАТС-1);
- Pet- и Pic токсины - вызывают повреждение слизистой.
ЭТКП являются причиной диареи путешественников среди взрослых в индустриальных странах и заболеваний детей в развивающихся странах. Их патогенность связана с наличием факторов колонизации CF (colonization factors) и выработкой двух энтеротоксинов: термолабильного (LT), структурно и функционально связанного с холерным токси- ном, и термостабильного (ST). Синтез факторов патогенности детерминируется 2 плазмидами.
Факторы колонизации CF являются пилями 4-го типа. Они различаются по антигенной специфичности, их иначе называют колонизационными антигенами, которых насчитывается более 21. Наиболее часто встречаются СF1 и CF2.
Благодаря СF, ЭТКП прикрепляются и размножаются на поверхности эпителия тонкой кишки. Колонизация поверхности тонкого кишечника обеспечивает массивный выброс энтеротоксинов, которые нарушают водно-солевой обмен в кишечнике, приводя к развитию водянистой диареи. Механизм развития диареи связывают с активацией LT аденилатциклазы кишечника и активацией ST гуанилатциклазы. С ЭТКП связано 17 серогрупп, включая серовары О6Н16, О8Н9, О78: Н11, О148:Н28. Заражение ЭТКП происходит водным и алиментарным путями.
Кишечные палочки (E. coli) представляют собой каталазоположителеные грамотрицательные бактерии, относящиеся к роду Escherichia, семейству Enterobacteriaceae. Несмотря на то что род Escherichia включает в себя обширную группу морфологически практически не отличимых друг от друга бактерий, они, тем не менее, имеют отличительные признаки по подвижности, антигенной структуре, ферментативным свойствам, факторам патогенности, чувствительности к бактериофагам и другим признакам. E. coli относится к доминирующей факультативной грамотрицательной флоре ЖКТ человека, млекопитающих, а также птиц, рептилий и рыб, в силу чего имеет убиквитарное распространение. По пока еще не совсем понятным причинам только некоторые О-серогруппы E. coli могут быть ассоциированы с определенными факторами патогенности и вызывать заболевания у человека.
Кишечные палочки устойчивы во внешней среде и способны сохранять жизнеспособность в воде, почве, испражнениях в течение нескольких недель и даже месяцев. Будучи неприхотливыми к условиям роста (хорошо растут на обычных питательных средах), они быстро размножаются в пищевых продуктах, особенно молоке. Возбудители резистентны к высушиванию, быстро погибают при кипячении и под действием дезинфицирующих веществ.
E. coli обладают сложной антигенной структурой:
- соматическим термостабильным О-антигеном, определяющим серогруппу штамма;
- поверхностным капсульным К-антигеном, способным экранировать О-антиген, вызывая феномен О-неагглютинабельности;
- типоспецифический (термолабильный) жгутиковый Н-антиген, определяющий серовар.
Хотя существуют многочисленные схемы дифференциации E. coli на различные категории (табл. 2.4) по их антигенным свойствам, тем не менее они не всегда соответствуют присущим им факторам вирулентности, поскольку кодируются мобильными генетическими элементами (плазмидами или бактериофагами), которые бактерии могут как приобретать, так и терять. Патогенность энтеровирулентных E. coli сопряжена со строго специфическими факторами патогенности, в зависимости от чего их подразделяют на следующие категории: энтеропатогенные - ЭПЭК, энтероинвазивные - ЭИЭК, энтеротоксигенные - ЭТЭК и энтерогеморрагические - ЭГЭК. Кроме этого, в настоящее время выделяют группы энтероаггрегативных (ЭАЭК) и диффузно адгезированных кишечных палочек, патогенное значение которых для человека уточняется.
Таблица 2.4. Классификация энтеровирулентных (диареегенных) E. coli
Категория E. coli | Наиболее частые серогруппы по О-антигену | Основные факторы патогенности |
ЭПЭК | O55, O86, O111, O119, O125ac, O126, O127, O128, O142 | Пили 4-го типа (Bfp), интимин, эффектор- ные белки ТТСС |
ЭТЭК | O6, O8, O11, O15, O20, O25, O27, O78, O128, O148, O149, O159, O173 | Факторы колонизации (CF), термолабильный (LT) и термостабильный (ST) энтеротоксины |
ЭИЭК | O28ac, O29, O112ac, O124, O136, O143, O144, O152, O159, O164, O167 | Ipa-BDC-антигены, белок VirG |
ЭГЭК | O26, O55, O111ab, O113, O117, O157 | Интимин, эффекторные белки ТТСС, шигаподобные токсины, серин-протеаза, гемолизин |
ЭАЭК | O3, O15, O44, O86, O77, O111, O127 | Биопленку формирующие фимбриальные адгезины (AAF) и белок дисперзин, энтеротоксины: термостабильные (ЭАСТ-1), Pet, Pic |
Эпидемиология. Некоторые категории кишечной палочки (например, ЭТЕК и ЭПЭК) являются возбудителями острых диарейных заболеваний у сельскохозяйственных и домашних животных (телят, поросят, кроликов, собак и др.), однако они серологически отличаются от штаммов, патогенных для человека, и имеют свои закономерности развития эпидемического процесса. Естественным резервуаром и источником инфекции при энтеровирулентных (диареегенных) эшерихиозах является человек, больной манифестными или асимптоматическими формами заболевания, или бактерионоситель. Единственным исключением является штамм E. coli О157:Н7 (категория ЭГЭК), для которого естественным резервуаром является преимущественно крупный рогатый скот, а также некоторые другие животные (овцы, козы, свиньи, кошки, собаки, цыплята).
Механизм передачи возбудителя при всех без исключения энтеровирулентных эшерихиозов - фекально-оральный, однако его реализация у различных категорий кишечной палочки будет отличаться, что обус- ловлено не только различиями в их вирулентности, но и особенностями восприимчивого организма. Наиболее высоко восприимчивы к эшерихиозам дети, хотя взрослые также могут переносить клинически манифестные формы заболевания. Эпидемиологические отличия различных категорий E. coli представлены в табл. 2.5.
Таблица 2.5. Эпидемиологическая характеристика различных категорий E. coli


Таким образом, ключевыми факторами, способствующими распространению эшерихиозов, является фекальное загрязнение окружающей среды и недостаточные санитарно-гигиенические условия жизни людей.
Патогенез. Несмотря на относительную устойчивость E. coli к факторам внешней среды, они проявляют высокую чувствительность к желу- дочному соку, действие которого может в 100 и даже 1000 раз снижать поступающую дозу возбудителя, особенно категорий ЭПЭК, ЭТЭК и
ЭИЭК.
Общим признаком всех диареегенных E. coli является их способность к адгезии и колонизации слизистой оболочки тонкой кишки с помощью фимбрий. Помимо общих с непатогенными E. coli фимбрий диареегенные кишечные палочки обладают своими определенными типами фимбрий, которые существенно повышают их адгезивные свойства, способствуя колонизации тех мест тонкой кишки, которые в естественных
условиях не колонизируются. Дальнейшее развитие заболевания зависит от вырабатываемых ими факторов патогенности, т.е. принадлежности к определенной категории.
ЭПЭК. До сих пор многие стороны патогенеза остаются недостаточно изученными. Полагают, что повышенная восприимчивость детей к ЭПЭК обусловлена возрастными особенностями рецепторного аппарата эпителиоцитов слизистой оболочки тонкой кишки. Развитие инфекционного процесса, вызванное этой категорией кишечной палочки, протекает в несколько стадий. После прохождения через желудочный барьер возбудитель пенетрируют муциновый слой и адгезируется к эпителиоцитам с помощью фимбрий IV типа, которые обеспечивают взаимодейс- твие бактерий не только с эпителиальными клетками, но и между собой. Последующая колонизация слизистой оболочки ЭПЭК сопровождается повреждением апикальной поверхности эпителия и разрушением («сглаживанием») микроворсинок. Данный механизм повреждения обеспечивается секрецией специфического бактериального протеина (интимина), который, транслоцируясь внутрь клетки, разрушает ее цитоскелет. Указанные структурно-функциональные повреждения эпителиоцитов приводят к развитию мальабсорбции, которая рассматривается как основной механизм развития диарейного синдрома при ЭПЭК. Кроме этого, морфологические изменения в слизистой оболочки кишечника включают признаки умеренно выраженного воспаления в собственной пластинке и гиперплазию крипт.
ЭТЭК. После поступления в ЖКТ ЭТЭК колонизируют проксимальный отдел тонкой кишки. Механизм развития диареи напоминает патогенез холеры (подробнее см. Патогенез холеры) с той лишь разницей, что ЭТЭК способны вырабатывать не только термолабильные (LT-I, LT-II), но и термостабильные (STa, STb) энтеротоксины, причем различные штаммы кишечных палочек могут продуцировать либо один из них, либо несколько одновременно. Кишечные палочки данной категории не обладают инвазивными свойствами, а развитие заболевания обусловлено действием энтеротоксинов. Термолабильные энтеротоксины, подобно холерному, связываются с ганглиозидом GM1, активируют регуляторный протеин аденилатциклазного комплекса энтероцитов, способствуя внутриклеточному образованию цАМФ и развитию диареи. Особенностью действия группы термостабильных энтеротоксинов является их взаимодействие с компонентами системы цГМФ, посредством которого происходит активация секреции жидкости в просвет кишечника и развитие диареи.
ЭИЭК. В общих чертах патогенез данной категории кишечных палочек напоминает шигеллез и может быть представлен следующими этапами:
1) пенетрация эпителиальных клеток;
2) лизис эндоцитоплазматической вакуоли;
3) внутриклеточное размножение;
4) распространение на соседние эпителиальные клетки с повторением цикла;
5) развитие эрозий слизистой оболочки и воспалительной реакции в подслизистом слое. Кроме этого, ЭИЭК могут продуцировать энтеротоксины, ответственные за развитие секреторной диареи, которая развивается у больных в начальном периоде заболевания, поскольку активация секреции жидкости происходит именно в тонкой кишке.
ЭГЭК. Патогенез этой категории кишечной палочки изучен, прежде всего, на модели штамма E. coli O157:H7. Начальные этапы взаимодействия возбудителя с эпителиальными клетками кишечника практически идентичны ЭПЭК. Однако последующее развитие заболевания обусловлено способностью ЭГЭК продуцировать шигаподобные токсины (Stx1 и Stx2), являющиеся мощными цитотоксинами. Действуя через гликолипидные рецепторы Gb3, обнаруживаемые на эндотелиальных клетках, шигаподобные токсины вызывают выраженные микроцирку- ляторные нарушения, приводящие к развитию геморрагического колита. Возможное развитие гемолитико-уремического синдрома при ЭГЭК объясняется тем, что наиболее высокая концентрация рецепторов Gb3 обнаруживается кортикальном слое почек.
Клиническая картина. Клинические проявления заболевания находятся в прямой зависимости от категории возбудителя и могут иметь следующие формы.
Эшерихиоз, вызванный энтеропатогенными штаммами E. coli. Инкубационный период обычно составляет от 2-х до 7 дней, однако по некоторым наблюдениям может быть и несколько часов, что зависит как от возраста больного, так и инфицирующей дозы. Типично острое или подострое начало заболевания. Учитывая отсутствие в патогенезе заболевания гематогенной диссеминации возбудителя, в большинстве случаев развитие симптомов болезни происходит на фоне нормальной или субфебрильной температуры тела (повышение температуры тела регистрируется только в половине случаев). Больные отмечают появление слабости, тошноты, спастических болей в животе, метеоризма. Рвота отмечается в 30% случаях. Жидкий, умеренно обильный стул обычно появляется уже в первые часы заболевания. Для данной группы
эшерихиозов типичен «брызжущий» стул. Учитывая водянистый характер стула, тяжесть течения заболевания определяется степенью обезвоживания, которую определяют общепринятыми методами (см. Холера). Диарейный синдром может продолжаться до 1,5-2-х недель.
Наиболее тяжело заболевание протекает у новорожденных детей с быстрым развитием эксикоза, токсикоза и возможной генерализацией процесса.
Эшерихиоз, вызванный энтеротоксигенными штаммами E. coli. Данная категория кишечной палочки представляет ведущий этиологический фактор так называемой «диареи путешественников». Длительность инкубационного периода составляет от 12 часов до 3-х дней. Заболевание начинается остро, внезапно, без клинических проявлений интоксикации. Больные отмечают появление тошноты, возможна рвота, боли в эпигастральной области и жидкий водянистый стул. Повышение температуры тела отмечается менее чем в трети случаев и, как правило, не превышает фебрильных значений. Обычно стул бывает до 5 раз в сутки. Только в редких случаях частота дефекаций может достигать 10 и более раз в сутки. Учитывая умеренно выраженные признаки обезвоживания, самочувствие и состояние больных остается относительно удовлетворительным. Длительность диареи обычно составляет 4-5 дней. Стул может содержать примесь слизи, но никогда в копрограмме не определяется повышенное содержание лейкоцитов.
Эшерихиоз, вызванный энтероинвазивными штаммами E. coli. По своему клиническому течению эта группа эшерихиозов напоминает шигеллез. Инкубационный период обычно составляет 1-3 дня, но может укорачиваться и до 6-8 часов. Заболевание начинается остро с явлений интоксикации: озноба, слабости, недомогания, головной боли, снижения аппетита, чувства дискомфорта в животе. В большинстве случаев у больных уже в первые сутки заболевания выявляется повы- шение температуры тела, однако она редко достигает 39 ?С и более. Так же, как и при шигеллезах, заболевание может протекать в различных формах - от гастроэнтеритической до колитической, что и будет определять клиническую картину как начального периода болезни, так и ее разгара. Чаще заболевание протекает в колитическом варианте. В этих случаях у больных признаки поражения верхних отделов ЖКТ не выявляются. Жидкий стул обычно появляется уже в течение первых суток заболевания. Первые дефекации могут быть относительно обильными, однако с каждой последующей дефекацией объем испражнений умень- шается, и стул приобретает типичный колитический характер (скудный, с патологическими примесями). У больных могут быть ложные позывы
и тенезмы. Длительность заболевания обычно составляет 1-1,5 недели. Затяжное течение не типично. Тяжести течения заболевания определяется так же, как и при шигеллезах.
Эшерихиоз, вызванный энтерогеморрагическими штаммами E. coli. Несмотря на то что впервые заболевание человека, вызванное штаммом E. coli О157:Н7, было описано только в
Инкубационный период обычно составляет 3-4 дня, хотя может укорачиваться до 1-х суток или удлиняться до недели. Крайне редко заболевание может протекать асимптоматически. Типично острое начало заболевания: у больных появляются тошнота, спастические боли в животе и жидкий водянистый стул. Рвота чаще отсутствует, синдром интоксикации не характерен. Подъем температуры тела отмечается только у трети больных и не превышает фебрильных цифр. Характерным признаком энтерогеморрагического эшерихиоза является появление признаков гемоколита: примесь крови в стуле появляется спустя 1-2-х суток от начала диареи и сохраняется в течение 3-4-х дней. Поскольку у больных имеется водянистый стул, появление крови окрашивает его в розово-красный цвет («мясные помои»). Частота дефекаций в течение суток обычно составляет до 10-12 раз. Нередко наряду с гемоколитом у больных появляются боли в правой подвздошной области. В периферической крови у больных нередко отмечается лейкоцитоз со сдвигом формулы влево, а в моче - гематурия и протеинурия. При неосложненном течении длительность заболевания составляет 8-10 дней, и в большинстве случаев отмечается спонтанное купирование клинической картины. В 10% случаев через неделю после прекращения диареи у больных могут развиться гемолитико-уремический синдром (ГУС) или тромботическая тромбоцитопеническая пурпура (реже), являющиеся следствием цитотоксического действия шигаподобного токсина. Чаще ГУС развивается у детей и лиц старше 60 лет, при этом больные отмечают ухудшение самочувствия и состояния, появляется рвота. Типичными признаками ГУС являются гемолитическая анемия, снижение количества тромбоцитов, олигоанурия, поражение ЦНС. Летальность в случае развития ГУС может достигать 7%.
Дифференциальная диагностика. Диагностика эшерихиозов возможна только на основании комплексных клинико-эпидемиологических и специальных лабораторных методов исследования. Дифференциальная диагностика проводится, в первую очередь, с другими острыми кишеч-
ными диарейными инфекциями - сальмонеллезами, шигеллезами, холерой, вирусными гастроэнтеритами.
Лабораторная диагностика. Решающее значение в диагностике эшерихиозов имеет бактериологическое исследование испражнений и рвотных масс (а при генерализованных формах - крови, ликвора, мочи), которое необходимо проводить в максимально ранние сроки заболевания и до начала этиотропной терапии. Посев производится на среды Плоскирева, Эндо, Левина. Исключение составляет E. coli О157:Н7 (категория ЭГЭК), рост которой возможен только на специальных средах. Поскольку кишечная палочка входит в состав нормальной эндогенной микрофлоры кишечника, при проведении бактериологического исследования необходимо учитывать интенсивность ее роста (не менее 106 на мл) и доминирование над другими условно-патогенными микроорганизмами.
Микробиологическая диагностика проводится обычным бактериологическим методом. Материалом для исследования являются испражнения, которые засевают на дифференциальные лактозосодержащие питательные среды; после инкубации при 37 оС в течение 18 часов отбираются колонии, агглютинирующиеся поливалентно ОВ-агглютинирующей сывороткой, которые подвергаются идентификации до вида по биохимическим тестам с последующим определением их серологического варианта.
Разработаны также молекулярно-биологические стрип-системы (DNA STRIP Tecnology) Hain lifescience, позволяющие быстро обна- руживать и дифференцировать между собой ЭПКП, ЭГКП и ЭИКП с использованием молекулярных зондов к генам интимина (еае), шигатоксинам (stx 1,2) и ipa.
Учитывая сходство соматических О-антигенов у различных категорий кишечных палочек (как, впрочем, и с другими представителями семейства Enterobacteriaceae, особенно шигеллами), обычное серологическое исследование малорезультативно. С целью установления этиологической роли кишечной палочки в развитии заболевания целесообразна постановка реакции агглютинации с аутоштаммом в динамике заболевания при условии нарастания (не менее чем в 4 раза) титра антител.
Осложнения. Хотя в целом развитие осложнений при эшерихиозах не типично, тем не менее, в редких случаях они могут развиваться. Особую группу риска составляют дети грудного возраста и лица с недостаточностью иммунитета (ВИЧ-инфекция, сахарный диабет), у которых течение заболевания может осложняться гиповолемическим шоком (дегидратацией IV степени), ОПН, ИТШ. Особую группу эшерихиозов составляют
ЭГЭК, при которых могут развиваться такие тяжелые осложнения, как гемолитико-уремический синдром и тромботическая тромбоцитопеническая пурпура.
Исход заболевания, как правило, благоприятный. Хронические формы инфекции не регистрируются. После перенесенного заболевания, особенно при нерациональном применении антибактериальных препаратов, может развиваться дисбиоз (дисбактериоз) кишечника.
Лечение. Показания к госпитализации больных определяется тяжес- тью состояния больного (среднетяжелые и тяжелые формы заболевания, наличие сопутствующего иммунодефицита, дети до 2-летнего возраста), а также по эпидемиологическим показаниям (лица, проживающие в коммунальных квартирах, из организованных коллективов).
Рекомендуемые режим и диета больным с эшерихиозами в зависимости от категории кишечной палочки соответствуют другим острым инфекционным диарейным заболеваниям (при ЭТЭК - см. раздел Холера, а при ЭПЭК, ЭИЭК и ЭГЭК - см. разделы Сальмонеллез, Шигеллез). Исключаются из употребления продукты, усиливающие бродильные процессы, содержащие грубую клетчатку, а также жареное, копчености, острые приправы, консерванты.
Независимо от категории возбудителя, вызвавшего заболевание, больным показана регидратационная терапия, которая проводится по общепринятым принципам (см. раздел Холера). По показаниям проводится дезинтоксикационная терапия с введение коллоидных растворов (гемодез, реополиглюкин и др.).
Назначение этиотропной терапии производится по индивидуальным показаниям, которые, как правило, определяются тяжестью течения заболевания (при среднетяжелых, тяжелых и осложненных формах), наличием сопутствующего иммунодефицитного состояния и возрастом больных (в частности, детям до 2-х лет).
Из этиотропных препаратов показаны нитрофурановые препараты (фуразолидон по
Выписка реконвалесцентов из стационара осуществляется после клинического выздоровления и получения отрицательного результата бактериологического исследования кала. Работники пищевых и приравненных к ним предприятий (декретированные группы) выписываются после клинического выздоровления и получения 3-х отрицательных результатов бактериологического исследования кала, проведенного не ранее 2-го дня после окончания этиотропного лечения с интервалом в 1-2 дня.
Рекомендации по последующему диспансерному наблюдению. Лица, относящиеся к декретированным группам, подлежат диспансерному наблюдению в течение 1-го месяца после клинического выздоровления и однократного бактериологического исследования кала в конце срока наблюдения.
2.5. Пятнистая лихорадка Скалистых гор
Синонимы: клещевой риккетсиоз Америки, техасская лихорадка, бра- зильский сыпной тиф и др.
Острый природно-очаговый зоонозный риккетсиоз, передающийся иксодовыми клещами и характеризующийся ремиттирующей лихорадкой, выраженной интоксикацией, поражением нервной и сосудистой системы, обильной макуло-папулезной сыпью.
Краткая историческая справка. Впервые заболевание описано Maxcy в
Этиология. Возбудитель - мелкая полиморфная грамотрицательная палочка Rickettsia rickettsi, относится к роду Rickettsia. Паразитирует в цитоплазме и ядрах чувствительных клеток. Хорошо культивируется в организме клещей различных видов, в перевиваемых линиях клеток, в желточных мешках куриных эмбрионов и в организме морских свинок, у которых он вызывает развитие токсикоза. Возбудитель обладает гемолитическими свойствами, окрашивается по Рамановскому-Гимзе и Гименесу.
Эпидемиология. Источники и резервуар инфекции - дикие грызуны (полевки, суслики, бурундуки, белки, кролики), некоторые домашние животные (рогатый скот, собаки, овцы) и различные виды иксодовых клещей. У теплокровных животных инфекция протекает бессимптомно в виде временного носительства. Основной и более стойкий резервуар формируют 15 видов иксодовых клещей, являющихся специфическими
переносчиками риккетсий. Наибольшее эпидемиологическое значение имеют Dermacentor andersoni (лесной клещ) и D. variabilis, нападающие на человека. У клещей наблюдается трансовариальная и трансфазовая передачи возбудителя, что объясняет возможность длительного, пожизненного носительства риккетсий.
Механизм передачи инфекции реализуется при укусах клещей, реже - при их раздавливании и втирании тканей клеща в кожу при расчесах.
Естественная восприимчивость людей высокая. В странах умеренного климата заболевание имеет весенне-летнюю сезонность (период максимальной активности иксодовых клещей), в тропиках передача инфек- ции осуществляется круглогодично. Чаще заражаются сельские жители и лица определенных профессий (лесники, охотники, геологи и др.) при работе в лесу или на пастбищах. Заболеваемость в основном спорадическая. Постинфекционный иммунитет напряженный.
Пятнистая лихорадка Скалистых гор эндемична на большей части территории США, в Канаде, а также в странах Центральной и Южной Америке.
Патогенез. Риккетсии проникают в организм при укусе инфицирован- ных клещей без образования первичного аффекта, попадают в системный кровоток и поражают преимущественно мелкие и средние кровеносные сосуды кожи, подкожной клетчатки, ЦНС, легких, сердца, надпочечников, печени и селезенки. В эндотелии сосудов происходит фиксация и размножение риккетсий, развивается некроз эндотелиальных клеток с последующим накоплением биологически активных веществ и усилением токсикоза. При тяжелом течении инфекции некротические изменения захватывают даже гладкомышечные волокна мезотелия, что лежит в основе возможного развития микроинфарктов в веществе головного мозга, ДВС-синдрома, специфического гломерулонефрита, экзантемы. Патогистологические изменения в сосудах имеют сходство с таковыми при эпидемическом сыпном тифе.
Клиническая картина. Инкубационный период длится от 2-х до 14 суток, в среднем - 7 суток. Иногда в начале болезни могут быть короткие продромальные явления в виде недомогания, слабого озноба и умеренной головной боли. В большинстве случаев начало заболевания острое, внезапное, с сильной головной болью, ознобом, выраженной слабостью, артралгиями и миалгиями, быстрым повышением температуры тела до 39-41 0С. В тяжелых случаях возникают рвота, прострация, носовые кровотечения.
В дальнейшем лихорадка приобретает ремиттирующий характер, с колебаниями между утренними и вечерними показателями до 1-1,5 0С.
При осмотре больных в начале болезни обнаруживают геморрагическую энантему на слизистойх оболочке ротовой полости, брадикардию, приглушение сердечных тонов, снижение АД. На 2-5-й день болезни обычно возникает экзантема, хотя в исключительных случаях сыпь может отсутствовать. Пятнистые элементы сыпи быстро превращаются в макуло-папулезные, распространяются по всему телу, в том числе на лицо, волосистую часть головы, ладони и подошвы. В течение последующих дней сыпь становится более четкой, местами сливной, геморрагической, с некротическим компонентом. В тяжелых случаях возникает некроз кончиков пальцев, ушных раковин, гениталий. Экзантема сохраняется 4-6 дней (иногда больше недели) и исчезает после снижения температуры, надолго оставляя шелушение и пигментацию.
Интоксикационный синдром проявляется нарастанием симптомов энцефалопатии, включающих мучительную головную боль, бессонницу, раздражительность, возбуждение, нарушение сознания, галлю- цинации, бред, делирий и даже кому, что свидетельствует о развитии энцефалита. При тяжелом течении болезни могут наблюдаться парезы и параличи, нарушения слуха и зрения, патологические рефлексы и другие признаки поражения ЦНС, сохраняющиеся впоследствии неделями и даже месяцами.
Нарушения со стороны сердечно-сосудистой системы в разгаре заболевания проявляются гипотонией, брадикардией, расширением границ сердца, приглушенностью сердечных тонов. Возможны внезапные коллапсы. Возникновение тахикардии в этом периоде говорит о плохом прогнозе заболевания. Со стороны органов дыхания, мочевыводящей системы и желудочно-кишечного тракта существенных нарушений не возникает. Гепатолиенальный синдром развивается непостоянно, иногда с проявлениями желтухи.
Длительность острого периода заболевания составляет 2-3 недели. Тяжесть течения болезни и выраженность отдельных ее симптомов могут варьировать в широких пределах. Встречаются легкие, средне- тяжелые, тяжелые и фульминантные формы заболевания с развитием комы и летальным исходом в первые дни болезни.
Период реконвалесценции отличается длительностью и медленным обратным развитием нарушенных функций организма.
Осложнения и прогноз. Наиболее частые осложнения - тромбофлебиты, пневмонии. Возможны острая сосудистая недостаточность, некрозы кожи, гангрена, нефриты, невриты, нарушения зрения и слуха. В периоде реконвалесценции иногда развивается облитерирующий эндартериит.
Прогноз всегда достаточно серьезен, в тяжелых случаях в различных очагах летальность колеблется от 20 до 80%, раннее назначение антибиотиков снижает ее до 7%.
Дифференциальная диагностика. Заболевание следует дифференцировать с другими клещевыми риккетсиозами, геморрагическим васкулитом, инфекционной эритемой, лептоспирозом, вторичным сифилисом, иерсиниозами. При постановке диагноза принимают во внимание данные эпиданамнеза (недавнее посещение или пребывание в эндемичной зоне), острое циклическое развитие болезни с интермиттирующей лихорадкой, выраженным токсикозом, геморрагической энантемой, маку- ло-папулезной и геморрагической экзантемой, симптомами поражения
ЦНС.
Лабораторная диагностика. Гемограмма не имеет характерных изменений. Типична протеинурия. Методами подтверждения диагноза являются реакция иммунофлюоресценции и РСК с риккетсиозными антигенами. Могут использоваться биопробы с лабораторными животными (морскими свинками) для выделения возбудителя.
Лечение. Для этиотропной терапии используют препараты, обладаю- щие противориккетсиозной активностью: тетрациклины (доксициклин по
Профилактика. С целью неспецифической профилактики на эндемичных территориях проводят истребление грызунов и клещей, используют защитную одежду и репелленты. По эпидпоказаниям осуществляют профилактическую вакцинацию лиц из групп риска.
2.6. Лихорадка цуцугамуши
Синонимы: Japanese river fever (англ.), schichito disease (яп.-англ.), малайский сельский тиф, лихорадка Новой Гвинеи.
Острый трансмиссивный природно-очаговый риккетсиоз, характеризующийся лихорадкой и другими проявлениями интоксикации, развитием типичного первичного аффекта, обильной макуло-папулезной сыпью, лимфаденопатией.
Краткие исторические сведения. В Китае болезнь известна с III в. под названием «шу-ши», что означает «укус маленького красного насеко-
мого»
(краснотелковых клещей). Научное описание заболевания впервые
представлено японским врачом H.K. Hashimoto (1810). Возбудитель болезни
- O. tsutsugamushi - открыт Н. Хаяши в 1905-1923 гг. В
Этиология. Возбудитель представляет собой мелкую полиморфную грамотрицательную палочку Orientia tsutsugamushi, относится к роду Orientia семейства Rickettsiaceae. В отличие от представителей рода Rickettsia, у ориенций отсутствуют в клеточной стенке некоторые составные элементы пептидогликана и ЛПС (мурамовая кислота, глюкозамин и окисленные жирные кислоты). Возбудитель культивируется в клещах, перевиваемых культурах клеток и желточном мешке куриного эмбриона; в зараженных клетках паразитирует в цитоплазме и в ядре. Подразделяется на 6 серологических групп, имеет общий антиген с протеем ОХ19.
Эпидемиология. Резервуар и источники возбудителя - мышевидные грызуны, насекомоядные и сумчатые, а также их эктопаразиты - краснотелковые клещи. Животные переносят инфекцию в латентной форме, длительность их период заразительности не известна. У клещей заразительность сохраняется пожизненно, осуществляется трансовариальная и трансфазовая передача риккетсий. Больной человек эпидемиологической опасности не представляет.
Механизм передачи - трансмиссивный, переносчиками являются личинки краснотелковых клещей, паразитирующие на животных и человеке.
Естественная восприимчивость людей высокая. Постинфекционный иммунитет гомологичный и длительный, однако в эндемичных очагах могут быть случаи реинфекции.
Заболевание встречается (рис. 2.4) во многих странах Центральной, Восточной и Юго-Восточной Азии и на островах Тихого океана (Индия, Шри-Ланка, Малайзия, Индонезия, Пакистан, Япония, Южная Корея, Китай и др.). В России природные очаги инфекции известны в Приморском крае, на Курильских островах, Камчатке, Сахалине.
На эндемичных территориях лихорадку цуцугамуши регистрируют в виде спорадических случаев и групповых вспышек, описаны массовые взрывные вспышки среди приезжих. Выражена летняя сезонность с пиком в июле-августе, что объясняется биологической активностью клещей в это время. Заболевают лица всех возрастных и половых групп (преимущественно занятые на сельскохозяйственных работах в речных долинах с кустарниковыми и травянистыми зарослями - биотопом краснотелковых клещей).
Рис. 2.4. Географическое распространение цуцугамуши (Blake А. et al., 1975, цит. по Лысенко А.Я., 1983)
Патогенез. На месте укуса клеща возникает первичный аффект. Лимфогенным путем из места входных ворот возбудители попадают в регионарные лимфатические узлы, формируются лимфангит и регионарный лимфаденит. После первичного накопления риккетсий в лимфоузлах развивается фаза гематогенной диссеминации. Размножение возбудителей в цитоплазме клеток организма, прежде всего в эндотелии сосудов, объясняет развитие васкулитов и периваскулитов - ключевого звена патогенеза лихорадки цуцугамуши. Поражаются преимущественно мелкие сосуды миокарда, легких и других паренхиматозных органов. Десквамация эндотелиальных клеток лежит в основе дальнейшего формирования гранулем, похожих на сыпнотифозные, но гистологические изменения в сосудах при лихорадке цуцугамуши бывают менее выраженными и не достигают стадии развития тромбоза и некроза сосудистых стенок, как при сыпном тифе.
Клиническая картина. Инкубационный период продолжается в среднем 7-12 дней, с вариациями от 5 до 20 дней. По основным клиническим проявлениям заболевание имеет достаточно большое сходство с другими инфекциями из группы риккетсиозных пятнистых лихорадок, но в
различных очагах клиническая картина и тяжесть течения заболевания существенно различаются.
Первичный аффект (рис. 2.5) возникает далеко не у всех больных. Он может быть обнаружен уже в конце инкубационного периода в виде мелкого (до
Рис. 2.5. Лихорадка цуцугамуши, первичный аффект
При осмотре больных с первых дней заболевания отмечают гиперемию и одутловатость лица, выраженные явления конъюнктивита и склерита. Менее чем у половины пациентов на 5-8-й день болезни на груди и животе появляется пятнистая сыпь, в последующем элементы сыпи становятся макуло-папулезными, распространяются на конечности, без поражения ладоней и подошв. Частое отсутствие первичного аффекта и экзантемы значительно затрудняет диагностику лихорадки цуцгамуши.
Экзантема сохраняется в среднем в течение недели. В этот период развивается выраженная интоксикация, формируется генерализован-
ная лимфаденопатия, (что отличает заболевание от всех других риккетсиозов), выявляются тахикардия, приглушенность сердечных тонов, систолический шум, снижение АД. Чаще, чем при других риккетсиозах, развивается миокардит. Легочная патология проявляется признаками диффузного бронхита, а при тяжелом течении - интерстициальной пневмонией. Печень обычно не увеличена, чаще развивается спленомегалия. По мере нарастания интоксикации усиливаются проявления энцефалопатии (нарушение сна, головная боль, возбуждение). При тяжелом течении болезни возможны делирий, сопор, судороги, развитие менингеального синдрома, гломерулонефрита.
Лихорадочный период без лечения может продолжаться до 3-х недель. Затем происходит снижение температуры ускоренным лизисом в течение нескольких дней, однако в безлихорадочном периоде могут возникать повторные волны апирексии. В периоде реконвалесценции возможно развитие осложнений - миокардита, сердечно-сосудистой недостаточности, энцефалита и других. Общая длительность заболевания часто составляет от 4-х до 6 недель.
Осложнения и прогноз. При тяжелом течении заболевания возможны миокардит, тромбофлебит, пневмония, абсцесс легких, гангрена, гломерулонефрит. При своевременной адекватной терапии температура тела нормализуется уже в первые 36 ч лечения, осложнения не развиваются. Прогноз зависит от тяжести течения болезни и осложнений. Летальность без лечения варьирует от 0,5 до 40%.
Дифференциальная диагностика. Заболевание следует дифференцировать от других риккетсиозов (клещевого сыпного тифа Северной Азии, марсельской лихорадки), лихорадки денге, кори, инфекционной эритемы, вторичного сифилиса, псевдотуберкулеза.
Лабораторная диагностика. Изменения гемограммы неспецифичны. Наибольшое значение имеют обнаружение специфических антител в РСК или РНГА, иммунофлюоресцентный метод и ИФА. Возможна постановка биопробы на белых мышах с последующим выделением возбудителей или культивирование микроорганизмов на культуре клеток.
Лечение. Этиотропную терапию проводят препаратами тетрацикли- нового ряда (доксициклин по
Профилактика. Неспецифическая профилактика дезинсекция и дера- тизация в природных биотопах вблизи расположения людей, уничтожение грызунов, применение репеллентов и защитной одежды, расчистка территории от кустарников. Специфическая иммунопрофилактика не разработана, вакцинация населения живой ослабленной вакциной (применявшаяся по эпидпоказаниям в эндемичных районах) оказалась малоэффективной.
2.7. Лептоспироз
Синонимы: иктеро-геморрагический лептоспироз, болезнь Вейля- Васильева, водная лихорадка, болотная лихорадка, болезнь свинопасов, инфекционная желтуха, штутгартская болезнь и др.
Острая зоонозная природно-очаговая инфекция с преимущественным поражением почек, печени и нервной системы. Сопровождается развитием интоксикации, геморрагического синдрома и нередко желтухи.
Краткие исторические сведения. Первое описание заболевания под названием fievre jaune («желтая лихорадка») дано в
Этиология. Возбудители - облигатно аэробные подвижные спира- левидные бактерии рода Leptospira, семейства Leptospiraceae (порядок Spirochaetaceae). В соответствии с серологической классификацией до
Морфологически все лептоспиры неразличимы. Выделяют три основных структурных элемента лептоспир: осевую нить (аксистиль), цитоплазматический цилиндр и наружную оболочку. Осевая нить играет роль жгутиков. Спирали возбудителей очень плотно примыкают друг к другу, что придает им вид «нитки жемчуга» при микроскопии в темном поле; один или оба конца могут быть изогнутыми. Движение лептоспир винтообразное: сгибательное или вдоль продольной оси; некоторое время они могут быть неподвижными, напоминая веревку или прихотливо изогнутые петли. В культурах часто можно обнаружить образование клубков из лептоспир. Температурный оптимум составляет 28-30 ?С, оптимум рН - 7,2-7,4. Возбудители растут медленно (от 2 до 13 недель) на жидких и полужидких средах с добавлением 10-15% кроличьей сыворотки и витаминов В2 и В12 (факторы роста). Разработаны безбелковые среды, используемые для производства вакцинных штаммов. Лептоспиры плохо окрашиваются по Граму и Романовскому-Гимзе, но становятся хорошо различимыми (окрашенными в коричневый или черный цвет) при импрегнации серебром. Легко выявляются темнопольной микроскопией.
Лептоспиры содержат и РНК, и ДНК. В соответствии с новой концепцией определения вида у бактерий на основании результатов ДНКДНК гибридизации (генотипическая классификация) в настоящее время выделен ряд геномовидов патогенных лептоспир, подразделяемых более чем на 250 серологических вариантов. Серовары, сходные по антигенной структуре, сгруппированы в 24 серологические группы. Наиболее часто встречают варианты L. interrogans - grippothyphosa, icterohaemorrhagica, pomona, canicola и др. Патогенные возбудители вызывают поражения у человека и различных животных; также обнаружены сапрофитные серовары (более 60 сероваров L. biflexa). Предполагают вероятность дальнейших таксономических пересмотров.
Для паразитических лептоспир характерна специализация патогенных свойств: каждый серовар циркулирует в популяции определенного вида животного. Патогенные серовары чувствительны к действию сол- нечного света и высоких температур (при 45 ?С в воде погибают через 45 минут, при 70 ?С - через 10 секунд), высушивание вызывает их немедленную гибель. Выживаемость лептоспир в пресноводных водоемах вариабельна: от нескольких часов до 30 суток (наиболее длительная в чистой воде с рН около 7,0 и низкой минерализацией). В сухой почве возбудители сохраняются в течение 2-3 часов, в заболоченной - до 280 суток. При низких температурах лептоспиры могут сохраняться несколько месяцев, они способны переживать зиму во влажной почве
и в водоемах, не утрачивая при этом вирулентность. На пищевых продуктах микроорганизмы выживают 1-2 дня, не теряют активности при замораживании, но моментально погибают при кипячении. Растворы 0,1% хлористоводородной кислоты, 0,5% фенола убивают лептоспир в течение 20 мин, активный хлор в дозе 0,3-0,8 мг/л - через 2 ч.
Эпидемиология. Резервуар и источники инфекции разделяют на две группы. Основной природный резервуар первой группы - грызуны (мыши, крысы, серые полевки) и насекомоядные (ежи, землеройки). Основной резервуар второй группы - различные домашние животные, формирующие антропургические (сельскохозяйственные) очаги: свиньи, крупный рогатый скот, овцы, козы, лошади, собаки, а также пушные звери клеточного содержания (лисицы, песцы, нутрии). Антропургические очаги составляют более 90% всех заболеваний. Инфекционный процесс у животных протекает в виде бессимптомного носительства или заболевания, иногда тяжелого. Носительство лептоспир установлено у млекопитающих более 100 видов, нескольких видов птиц и пресмыкающихся. Контагиозность источника сохраняется на протяжении всех периодов заболевания, а при бессимптомном носительстве лептоспиры могут жить в почечных канальцах животных в течение многих лет, периодически выделяясь в окружающую среду с мочой. Бактерии каждого серовара поражают, главным образом, популяции определенных видов животных, и структуру заболеваний в каждом очаге в основном определяет преобладающий в нем вид животных-хозяев возбудителя. Крысы являются носителями варианта icterohaemorrhagica, свиньи - рomona, крупный рогатый скот - grippotyphosa, собаки - сanicola. Больной человек может выделять лептоспиры с мочой до 2-х месяцев, но эпидемиологического значения не имеет в связи с недостаточной концентрацией возбудителей в моче и их быстрой гибелью в кислой мочевой среде.
Механизм передачи - фекально-оральный, основной путь передачи возбудителя - водный, меньшее значение имеют контактный и пищевой (кормовой) пути. Последний обусловливает не более 3% всех заражений. Заражение в эндемичном очаге чаще происходит при сельскохозяйственных и других работах, а также при умывании, купании и заглатывании воды. Ингаляция воды или аэрозолей может также привести к заражению через слизистые оболочки дыхательных путей. Описаны случаи передачи инфекции с морской водой. Случаи заражения желтушной формой лептоспироза чаще происходят при употреблении пищи, инфицированной мочой зараженных крыс, а также при контакте с животными-бактерионосителями. Известны случаи заражения при укусах животных. Прямая передача между людьми возможна, но
бывает исключительно редко. Имеются сообщения о передаче инфекции от реконвалесцентов половым путем.
Естественная восприимчивость людей высокая. Перенесенное заболевание оставляет прочный, но серовароспецифичный иммунитет. Возможна реинфекция другими сероварами лептоспир.
Лептоспироз является наиболее распространенным зоонозом в мире, он встречается на всех континентах, кроме Антарктиды. Особенно высока заболеваемость в тропических странах, где до 80% населения имеют положительные результаты серологических исследований на лептоспироз. В последние годы крупные вспышки заболевания зарегистрированы в Бразилии, Индии, странах Юго-Восточной Азии, Центральной и Южной Америки. Уровень заболеваемости во многом зависит от природно-климатических условий: он наиболее высок в районах с теплым влажным климатом, способствующим более длительному выживанию лептоспир, с густой речной сетью, частыми многократными летними паводками и ливневыми дождями, а также с высокой плотностью поголовья сельскохозяйственных животных. Заболевание может эпидемически распро- страняться во время наводнений (Никарагуа, 1995). В тропиках высокая спорадическая и вспышечная заболеваемость лептоспирозом связана со специфическими факторами - загрязнением питьевой воды, высокой численностью грызунов, ходьбой босиком по влажной почве и др.
30-50% случаев заболевания имеют профессиональный характер. Чаще заболевают дератизаторы, лица, работающие на заболоченных лугах и рисовых полях, работники животноводческих ферм, боен, доярки, пастухи, ветеринары, ассенизаторы. Косвенный контакт важен для шахтеров, солдат, рыбаков, участников спортивных водных соревнований. Известны спорадические случаи и эпидемические вспышки, причем последние чаще связаны с купанием в открытых водоемах, загрязненных выделениями грызунов и других животных.
Для лептоспироза в средней полосе характерна выраженная летнеосенняя сезонность (особенно июль и август), в странах тропического пояса - во время дождливых сезонов. В последние годы отмечена склонность к урбанизации заболевания и к распространению инфекции на территории рекреационных зон. При этом в крупных городах формируются антропургические очаги, в которых преимущественную роль в качестве источников инфекции играют крысы и собаки. Во многих странах и, в первую очередь, в странах тропического пояса, отмечают резкий рост заболеваемости лептоспирозом, вызванный сероваром canicola, в связи с чем этот вариант заболевания относят к категории «возвращающихся» инфекций.
Патогенез и патологическая анатомия. Лептоспиры проникают в организм человека через незначительно поврежденные, а иногда и неповрежденные кожные покровы, а также через интактные слизистые оболочки полости рта, желудочно-кишечного тракта, глаз, носа, не вызывая никаких изменений в области входных ворот. При употреблении инфицированной пищи или воды предполагают, что лептоспиры преимущественно внедряются через слизистые оболочки рта и пищевода, поскольку в кислой среде желудка они быстро гибнут. В дальнейшем по лимфатическим сосудам возбудители попадают в регионарные лимфатические узлы, откуда гематогенным путем (кратковременная лептоспиремия) распространяются по органам и тканям системы мононуклеарных фагоцитов, преимущественно накапливаясь в печени и почках, селезенке, легких. Первичная диссеминация способствует быстрому размножению возбудителей в указанных органах. Эта фаза патогенеза соответствует инкубационному периоду.
В начальный период болезни (первые дни клинических проявлений) нарастают лептоспиремия и токсинемия. Возбудители распространяются по новым органам и системам (надпочечники, ЦНС и др.), адгезируются на эпителиоцитах (например, почечных). Фагоцитоз, осуществляемый макрофагами, активизируется только при определенной концентрации антител и на этом этапе заболевания является незавершенным, чему способствует антифагоцитарный компонент внешней оболочки лептоспир.
Факторы патогенности лептоспир мало изучены в эксперименте и различны у разных сероваров. Наружная мембрана возбудителей содержит липополисахаридный комплекс (ЛПС) и несколько липопротеинов (белков наружной мембраны). ЛПС отличается более низкой эндотоксиновой активностью, чем ЛПС других грамотрицательных бактерий, но высокой иммуногенностью, он ответственен за специфичность серовара. ЛПС лептоспир стимулирует прилипание нейтрофилов к эндотелиальным клеткам и тромбоцитам, способствуя их агрегации и тромбоцитопении. Предполагают, что компоненты наружной мембраны могут играть важную роль в развитии интерстициального нефрита. Есть указания на наличие у лептоспир и экзотоксинов.
Среди других факторов известны различные белки, в частности фибронектин-связывающий белок, а также гликолипопротеины, обладающие цитотоксической активностью, гемолизины и ферменты параоксоназа, коллагеноза, фосфолипаза С (серовар canicola). Совместное действие факторов патогенности лептоспир обусловливает развитие васкулита с повреждением сосудистого эндотелия, образованием воспалительных инфильтратов из моноцитов, плазмацитов, гистиоцитов и нейтрофилов,
повышением проницаемости капилляров, последующими нарушениями гемостаза с петехиальными кровотечениями различной интенсивности. Выдвинуто предположение, что геморрагические проявления при леп- тоспирозах в определенной степени связаны также с механическим воздействием лептоспир на ткани при их спиралевидных движениях.
Одновременно в пораженных органах и тканях развиваются дегенеративные и некротические изменения, накапливаются токсичные метаболиты. Эти процессы развиваются в гепатоцитах, эпителии почечных канальцев, поперечно-полосатых мышцах, в эндотелии капилляров. Под влиянием гемолизина лептоспир происходит гемолиз эритроцитов. Возникают лихорадка, ознобы, миалгии, быстро прогрессируют симптомы интоксикации.
В разгаре заболевания токсинемия, патоморфологические и функциональные изменения в органах достигают максимальной степени. Возбудители и их токсические продукты обладают выраженным действием на сосудистую стенку и на свертывающую систему крови. Прогрессирует генерализованный капилляротоксикоз с повышением проницаемости стенок сосудов, развитием ДВС-синдрома, нарушениями микроциркуляции и геморрагическими явлениями различной степени выраженности (геморрагическая сыпь на коже и слизистых оболочках, мелкие диапедезные органные кровоизлияния, внутренние и наружные кровотечения).
Возможно прогрессирование признаков гемолиза и острой почечной недостаточности. В развитии ОПН важную роль играют патоморфологические нарушения, развивающиеся в результате непосредственного действия лептоспир и их токсических продуктов жизнедеятельности. Отмечены явления внутритканевого нефрита с интенсивной нейтрофильно-моноцитарной инфильтрацией коркового и подкоркового веществ почек, тяжелые повреждения эпителия почечных канальцев (тубулярный некроз), незначительные изменения в клубочках. Способствующими факторами могут служить также гиповолемия при дегидратации на фоне повышенной капиллярной проницаемости и (в некоторых случаях) выраженное снижение АД.
Поражения печени обусловлены развитием центролобулярного некроза и отека печеночной ткани, токсическим действием ЛПС, выделяющимся при гибели бактерий, механическим повреждением гепатоцитов активно подвижными лептоспирами. Массивный цитолиз гепатоцитов отсутствует, выражены гипертрофия и гиперплазия Купфферовских клеток, возможны явления внутрипеченочного холестаза. Указанные механизмы могут приводить к развитию желтухи, носящей смешанный
характер, в связи с параллельно развивающимся активным гемолизом эритроцитов. Существенная роль в происхождении желтухи принадлежит массивному гемолизу вследствие множественных кровоизлияний. Для лептоспироза характерно своеобразное патогномоничное поражение скелетной мускулатуры, особенно выраженное в икроножных и спинных мышцах. Развиваются деструктивные процессы (отек, вакуолизация миофибрилл, фокальный некроз), нарушения микроциркуляции и кровоизлияния, образуются гистиолимфоцитарные инфильтраты. Возникают резкие мышечные боли. При выздоровлении взамен пора- женных миофибрилл формируются новые.
В тяжелых случаях возможно развитие ИТШ, специфических лептоспирозных поражений сердца (миокардит с лимфоплазмоцитарной инфильтрацией, петехиальные кровотечения в эпикарде, выпот в полость перикарда), легких (пневмонии, легочные кровотечения) и глаз (ириты, иридоциклиты, увеиты). У 10-30% больных лептоспиры преодолевают гематоэнцефалический барьер, и поражение центральной нервной системы проявляется в виде менингитов. Патоморфологические изменения в ЦНС проявляются периваскулярным воспалением, кровоизлияниями, отеком мозга. Кровоизлияния в надпочечники могут обусловить острую недостаточность коры надпочечников.
Иммунные механизмы развертываются на второй стадии лептоспироза, вслед за острой фазой заболевания, продолжающейся приблизительно около недели. Формирование иммунитета связано с нарастанием в крови титров специфических АТ (агглютининов, опсонинов, комплементсвязывающих АТ) и активацией фагоцитоза. Однако формирующиеся при этом иммунные комплексы могут вести к активизации воспалительных реакций в центральной нервной системе и отягощению заболевания. В то же время происходит формирование аутоантител к АГ тканей глаза и миокарда, нейтрофилам, тромбоцитам. В течение определенного времени лептоспиры еще могут сохраняться в организме. Начиная со 2-й недели болезни возбудитель депонируется преимущественно в извитых канальцах почек и исчезает из крови и других тканей. Избирательная концентрация лептоспир на эпителии и в межклеточном пространстве приводит к тяжелым повреждениям почечных канальцев и нарушению мочеобразования, а в тяжелых случаях - к анурии и уремии. Лептоспиры могут длительно сохраняться в почках и выделяться с мочой до 40-60 дней от начала болезни даже при клиническом выздоровлении.
После выздоровления формируется стойкий гуморальный иммунитет лишь по отношению к гомологичному серовару лептоспир, снижаются уровни ИК. Возможно повторное инфицирование другим серотипом.
Клиническая картина. Единой клинической классификации лептоспирозов до настоящего времени нет. В РФ используется классификация, предложенная рядом авторов (Покровский В.И. и др.). Она учитывает форму заболевания (желтушная, безжелтушная), тяжесть течения, ведущие синдромы (гепаторенальный, геморрагический, менингеальный, ренальный), течение и исходы болезни.
Клинические проявления лептоспироза чрезвычайно разнообразны. Преобладают безжелтушные формы легкого и среднетяжелого течения (90% клинически распознанных случаев), а также субклинические формы инфекции, выявляемые лишь при ретроспективном серологи- ческом обследовании. Вместе с тем бывают тяжелые желтушные формы (болезнь Васильева-Вейля) с полиорганными поражениями и высокой летальностью. Ранее существовавшее предположение о связи различных клинических синдромов и тяжести заболевания в целом с определенными серологическими группами лептоспир не подтвердилось. Заболевание отличает цикличность, что позволяет выделить в его развитии последовательные периоды: инкубационный, начальный, разгара и реконвалесценции.
Инкубационный период варьирует от нескольких дней до 1-го месяца, чаще продолжается 1-2 недели.
Начальный период длится около 1-й недели, но при тяжелом течении инфекции может быть короче. Характерно острое начало болезни. У 75- 100% пациентов на фоне озноба, нередко сильного, температура тела в течение 1-2-х дней достигает высоких цифр - 39-40 ?С, в дальнейшем приобретая неправильный, с большими суточными размахами, а иногда двухволновый характер с ремиссией в течение 3-4-х дней. Лихорадка длится от 5 до 15 дней, снижаясь впоследствии литически. Больные жалуются на интенсивную головную боль, преимущественно в ретроорбитальной области, светобоязнь (фотофобию), выраженные боли в мышцах (особенно в икроножных), слабость, головокружение, бессонницу, жажду, отсутствие аппетита. Мышечные боли усиливаются при пальпации. Быстро нарастают симптомы интоксикации. В 25-50% случаев развиваются сухой кашель и диспепсические явления - анорексия, тошнота, рвота, диарея.
При объективном обследовании обращает на себя внимание внешний вид больного. Его лицо становится одутловатым, гиперемиро- ванным, нередко с герпетическими высыпаниями на губах и крыльях носа. Сосуды склер инъецированы, конъюнктивы гиперемированы. Возможны кровоизлияния на склерах и конъюнктивах, геморрагическое пропитывание герпетических высыпаний, гиперемия слизистой
оболочки ротоглотки. Можно выявить увеличение периферических лимфатических узлов, брадикардию, снижение АД. С 4-5 дня болезни у большинства пациентов отмечается увеличение печени и ее болезненность при пальпации, редко - увеличение селезенки. У части больных развиваются признаки менингизма.
В середине первой недели заболевания у 20-50% больных на кожных покровах туловища и конечностей появляется экзантема кореподобного, уртикарного или петехиального характера. Длительность проявле- ний экзантемы в большинстве случаев составляет менее суток, но может варьировать от нескольких часов до нескольких дней. Следует помнить, что в последнее время увеличивается число случаев заболевания, протекающих без сыпи.
Уже с первых дней можно наблюдать характерные проявления геморрагического синдрома: петехии, геморрагии в местах инъекций. В более тяжелых случаях появляются геморрагические высыпания, часто лока- лизующиеся в подмышечных областях и на локтевых сгибах, кровоизлияния в склеры (рис. 2.6), микроили макрогематурия, носовые кровотечения. Геморрагический синдром, прежде всего, обусловлен развитием капилляротоксикоза; тромбоцитопения не характерна, нарушения коагуляции могут отсутствовать.
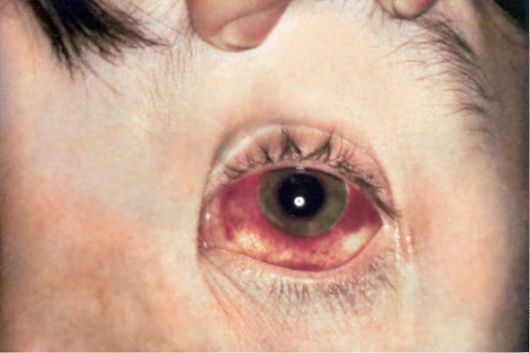
Рис. 2.6. Лептоспироз. Кровоизлияние в склеру
В разгар болезни сохраняются признаки начального периода - лихорадка, аденопатия, экзантема, увеличение печени и селезенки, геморрагические проявления и др. При сочетании капилляротоксикоза
с развитием ДВС-синдрома могут возникнуть обширные кровоизлияния в подкожную клетчатку, мышцы поясницы и брюшной стенки, желудочные, кишечные, маточные кровотечения и т.д.
Клиническая патология со стороны органов дыхания в разгар заболевания (особенно при его тяжелом течении) обычно связана с проявлениями геморрагического синдрома (альвеолярными кровоизлияниями) и дыхательной недостаточности. Могут быть тахипноэ, кашель, одышка, кровохарканье, боли в груди, выделение кровянистой мокроты, влажные хрипы в легких, очаговые легочные инфильтраты на рентгенограмме.
Брадикардия, возможная в первые дни заболевания, сменяется тахикардией, тоны сердца становятся глухими, снижается АД, иногда возникает аритмия. При тяжелом течении болезни снижение тонуса сосудов и возможное развитие инфекционно-токсического миокардита приводят к сердечно-сосудистой недостаточности.
Язык сухой, покрывается бурым налетом. Печень и, реже, селезенка увеличены. Нарушения микроциркуляции и геморрагии в слизистой оболочке желудочно-кишечного тракта могут обусловливать появление болей в животе и расстройства стула с примесью крови в испражнениях, тяжесть в правом подреберье, тошноту и рвоту, анорексию. При развитии некалькулезного лептоспирозного холецистита появляется положительный симптом Мерфи.
Характерны боли в поясничной области, симптом поколачивания положительный. Моча может приобрести темный или кровянистый оттенок, содержать повышенное количество белка, лейкоцитов, свежих и выщелоченных эритроцитов, цилиндров. В период разгара болезни развивается олигурия, а при тяжелом течении - даже анурия с прогрессирующей почечной недостаточностью. Могут появиться признаки уремии - язвенное поражение толстой кишки, шум трения перикарда, судороги, расстройства сознания, уремическая кома.
Поражение нервной системы проявляется сильными головными болями, которые плохо купируются болеутоляющими средствами, бессонницей, возбуждением и беспокойством больных, иногда бредом. В разгаре болезни нередко (от 10-15% до 50% больных) развивается менингит, преимущественно серозный, без поражений черепных нервов и энцефалитических признаков, с лимфоцитарным плеоцитозом. Менингит обычно длится в течение нескольких дней, но может затягиваться и до 2-х недель, приобретая более тяжелое течение. В таких случаях отмечают поражения черепных нервов, нарушения сознания, бред, изменения ликвора как при гнойном менингите с цитозом до 3-4-х тыс. в 1 мкл и более с преобладанием нейтрофилов.
Лихорадка длится около недели и снижается литически, изредка (до 14%) критически. Возможно повторное повышение температуры еще на 3-4 дня (двухволновость лихорадки).
Желтушная форма лептоспироза (рис. 2.7) чаще наблюдается при заболеваниях, вызванных L. icterohaemorrhagiса и L. ротона, и имеет, как правило, более тяжелое течение. Она развивается в случаях нарушений пигментного обмена и не связана с гепатоцеллюлярным некрозом. Иктеричность может появиться уже на первой неделе болезни, в период разгара ее интенсивность нарастает и соответствует тяжести течения забо- левания. Желтуха яркая, шафранового оттенка, сопровождается проявлениями геморрагического диатеза - кровоизлияниями в кожу и слизистые оболочки. Увеличиваются размеры печени, появляются темная моча и обесцвеченный кал, кожный зуд. Билирубинемия может быть высокой и стойкой, вместе с тем показатели аминотрансфераз умеренные, повышение щелочной фосфатазы незначительное. Часто развиваются признаки коагулопатии, дисфункции почек и легких. Легочные проявления включают кашель, одышку, боли в груди, кровохарканье, признаки дыха- тельной и сердечно-сосудистой недостаточности. Возможна олигурия или анурия. Желтуха может сохраняться в течение недель.
Рис. 2.7. Иктеричность кожи, геморрагическая сыпь
При благоприятном течении заболевания на фоне полноценной и своевременной терапии его длительность составляет 3-4 недели, с постепенным уменьшением органных расстройств (период реконвалесценции). При выздоровлении в течение длительного времени могут сохраняться депрессия, раздражительность, беспокойство.
Клиническое течение лептоспироза может быть легким, среднетяжелым и тяжелым. Прямой связи между видом лептоспир и тяжестью течения болезни не отмечают. При легком течении заболевания прояв- ления интоксикации умеренные, лихорадка не длительная (2-4 дня), выраженных органных поражений нет. Желтуха, проявления тромбогеморрагического синдрома, развитие ОПН, менингита характерны для тяжелого течения болезни. При этом часто отмечают многоволновое течение заболевания.
Рецидивы лептоспироза возникают нередко, приблизительно в 20- 30% случаев, длятся в течение нескольких дней. Лихорадка и органные нарушения менее значительны, чем во время основного заболевания. При наличии повторных рецидивов длительность болезни может затягиваться до 2-3-х месяцев.
Дифференциальная диагностика. В начальный период лептоспироз следует отличать от острых лихорадочных состояний, включая грипп, брюшной тиф и риккетсиозы; при развитии органных поражений - от вирусных гепатитов, геморрагических лихорадок (ГЛПС, хантавирусный пульмональный синдром, денге и др.), малярии, бруцеллеза, иерсиниозов, инфекционного мононуклеоза, менингитов и менингоэнцефалитов, сепсиса.
При дифференциально-диагностическом поиске необходимо ориентироваться на острое начало лептоспироза, высокую и иногда двухволновую лихорадку, боли в икроножных мышцах, гиперемию лица с герпетическими высыпаниями, инъекцию склер и гиперемию конъюнктивы, экзантему кореподобного и в дальнейшем петехиального характера, множественные геморрагические высыпания на различных участках тела, боли в пояснице, микро- и макрогематурию, олигоили анурию, увеличение в размерах печени, в части случаев развитие желтухи. Одновременно следует учитывать данные эпидемиологического анамнеза: пребывание больного в эндемичных по лептоспирозу районах, купание в природных водоемах и питье сырой воды из них, участие в сельскохозяйственных работах.
Лабораторная и инструментальная диагностика. Характерны изменения гемограммы: лейкоцитоз (12-20 х 109/л), нейтрофилез со сдвигом влево, значительное нарастание СОЭ (40-60 мм/ч). В разгар болезни
уменьшается число эозинофилов, эритроцитов и тромбоцитов, снижается содержание гемоглобина; в моче повышена концентрация белка, выявляются большое количество лейкоцитов (вплоть до пиурии), гиали- новые и зернистые цилиндры, часто микрогематурия.
Изменения биохимических показателей крови при желтушной форме лептоспироза включают: повышение показателей билирубина (с преобладанием связанного), аминотрансфераз (умеренно), щелочной фосфатазы, мочевины и сывороточного креатинина, гипохолестеринемию.
При развитии менингеальной симптоматики повышено давление спинномозговой жидкости, в ликворе определяют вначале нейтрофильный, а затем лимфоцитарный плеоцитоз, белок нормален или умеренно повышен, показатели глюкозы нормальные.
На рентгенограмме можно выявить неоднородные множественные мелкоочаговые инфильтраты, иногда сливающиеся (геморрагический пневмонит), расширение границ сердца и признаки отека легких в результате миокардита.
Бактериоскопические, бактериологические и серологические исследования проводят в специализированных лабораториях. В начальном периоде болезни при темнопольной микроскопии раздавленной капли крови можно обнаружить живых подвижных лептоспир. В периоде разгара с помощью этого же метода возбудители чаще выявляются при микроскопии мочи или ликвора, поскольку лептоспиремия обычно заканчивается к концу первой недели болезни. В моче лептоспиры сохраняются в дальнейшем на протяжении нескольких недель, а иногда и месяцев. Бактериоскопический метод мало чувствителен и недостаточно специфичен: для обнаружения хотя бы одной лептоспиры в поле зрения концентрация возбудителей должна быть более 100 в 1 мл. Кроме того, при прямой темнопольной микроскопии крови за лептоспиры могут быть ошибочно приняты нити фибрина или белковые конгломераты. Достоверность результатов может быть несколько повышена с помощью окрашивания препаратов серебрением, а также использования метода иммунофлюоресценции.
С целью выделения возбудителей по 3-5 мл свежего биологического материала (крови, мочи, ликвора), взятого непосредственно у постели больного, засевают в каждую из 3-5 чашек Петри с питательной средой. В качестве жидкой среды можно использовать 5 мл воды с добавлением 0,5 мл сыворотки крови кролика. Лептоспиры относят к медленно растущим микроорганизмам, поэтому выделение культуры и определение серовара возбудителя имеет значение только для ретроспективного под-
тверждения диагноза и более детальной расшифровки этиологии случая или вспышки.
Значительно более популярны в клинической практике серологические методы: РНГА с высокой чувствительностью и специфичностью (до 92 и 95% соответственно), а также реакции микроагглютинации (РМА), агглютинации-лизиса (РАЛ), РСК. За минимальный диагностический титр принимают разведение сыворотки крови 1:100 при наличии клинических признаков лептоспироза. Агглютинины в низких титрах могут появиться уже на 4-5-й день болезни, при этом положительным результатом исследования считают четырехкратное нарастание титров АТ в парных сыворотках, взятых в период разгара болезни или в стадии реконвалесценции. При постановке РМА, РАЛ и РСК возможны ложно- положительные результаты реакций, связанные с наличием перекрестно реагирующих АТ при других инфекциях: лайм-боррелиозе, легионеллезе, сифилисе.
В целях ранней экспресс-диагностики лептоспирозов на первой неделе болезни могут быть проведены определение IgM-антител методом ИФА и выявление ДНК патогенных лептоспир с помощью тестсистем, разработанных на основе ПЦР. Последний метод целесообразно также использовать для контроля над течением инфекции и эффективностью лечения. Вместе с тем ни один из вариантов постановки ПЦР не обладает стопроцентной чувствительностью, в большинстве случаев не может четко идентифицировать серовар возбудителя и лишь различает патогенные и непатогенные серовары лептоспир. Выявление антигенов возбудителей с помощью радиоиммунного анализа или ИФА обычно возможно лишь при достаточно высокой концентрации лептоспир в исследуемом биоматериале (более 100 в 1 мл).
Разработана биологическая проба: 3-5 мл крови, мочи или ликвора больного вводят морским свинкам внутривенно, внутрибрюшинно или подкожно, после гибели животных лептоспиры обнаруживают в различных органах при окраске срезов азотнокислым серебром.
Осложнения и прогноз. Большинство осложнений лептоспироза связано с концентрацией лептоспир в тканях организма на фоне развития иммунных процессов, начиная со второй недели болезни.
Наиболее частое (от 15 до 40% случаев) и опасное осложнение лептоспироза - ОПН с нарастающей азотемией, что обусловливает более 60% летальных исходов. При тяжелом течении заболевания ОПН может развиться уже на первой неделе.
Опасными осложнениями, характерными для периода разгара болезни (периода органных поражений), являются острый респираторный
дистресс-синдром, ИТШ, миокардит и перикардит, кровотечения, кровоизлияния в легкие, мышцы, надпочечники. Возможно развитие легочного кровотечения и геморрагического отека легких.
Острая печеночная и почечная недостаточность при лептоспирозе обычно носит обратимый характер. Могут развиться менингиты, энцефалиты. Изменения со стоны психической сферы наблюдают редко.
Поражения органа зрения проявляются в виде субконъюнктивальных кровоизлияний (более 90% пациентов), а также увеитов, иритов, иридоциклитов, хориоретинитов с длительным течением (до нескольких лет). Могут быть также неспецифические осложнения, вызванные патогенной бактериальной флорой: пневмонии, пролежни, абсцессы и др.
У детей, кроме того, среди осложнений могут быть холецистит, панкреатит, артериальная гипертензия, синдром Кавасаки (сочетание таких проявлений, как экзантема, покраснение и припухлость ладоней и подошв с последующей десквамацией кожи, миокардит, водянка желчного пузыря). При лептоспирозе у беременных возможна трансплацентарная передача инфекции, приводящая к нарушениям развития плода и даже его внутриутробной смерти.
Летальные исходы при безжелтушной форме лептоспирозов чрезвычайно редки, при спорадической заболеваемости желтушным лептоспирозом составляют 1-2%, при эпидемических вспышках лептоспироза - до 15-20% и более.
Лечение. Целесообразность госпитализации больных лептоспиро- зом объясняется необходимостью динамического клинико-лабораторного обследования и возможностью развития тяжелых осложнений. Назначают постельный режим в течение всего лихорадочного периода, при наличии признаков почечно-печеночной недостаточности его продлевают. Диета, в основном молочно-растительная, предусматривает ограничения, необходимые при заболеваниях печени и почек.
Этиотропное лечение необходимо начинать как можно раньше, оно не должно быть отсрочено до получения результатов лабораторных исследований. При нетяжелом течении заболевания препаратом выбо- ра является доксициклин по 100 мг 2 раза в день в течение 7 дней; аль- тернативные средства - ампициллин, амоксициллин, азитромицин. Препараты назначают в средних терапевтических дозах. Применяют введение гетерологичного противолептоспирозного иммуноглобулина дробно по Безредке. В первый день вводят 0,1 мл разведенного (1:10) иммуноглобулина под кожу, через 30 мин под кожу вводят 0,7 мл разведенного (1:10) иммуноглобулина и еще через 30 мин - 10-15 мл неразведенного иммуноглобулина внутримышечно. На 2- и 3-й дни лечения
вводят по 5 мл (при тяжелых формах по 10 мл) неразведенного иммуноглобулина внутримышечно. Комбинированная терапия (антибиотики плюс иммуноглобулин) дает наилучший клинический эффект и значи- тельно уменьшает вероятность рецидивов.
В более тяжелых случаях рекомендуют бензилпенициллин внутримышечно в суточной дозе 6-12 млн ЕД (при лептоспирозном менингите до 18-20 млн ЕД) или пенициллин G 0,6-1 млн ЕД/сут внутривенно; альтернативные препараты для внутривенного применения - ампицил- лин по 500-1000 мг 4 раза в сутки, амоксициллин до 3 г/сут, эритромицин до 2 г/сут.
Необходимы дезинтоксикационная терапия, интенсивность которой зависит от тяжести течения заболевания, а также коррекция метаболических и электролитных нарушений. Показаны препараты для улучшения свертываемости крови и повышения резистентности сосудов, аналгетики, витамины. При выраженной интоксикации в сочетании с проявлениями геморрагического синдрома в лечение добавляют преднизолон по 40-60 мг с постепенным снижением дозы в течение 8-10 дней.
В случае острой печеночной энцефалопатии лечение проводят как при вирусных гепатитах с аналогичным осложнением. Учитывая почечную патологию, при начальных проявлениях почечной недостаточности больным можно назначить осмотические диуретики (маннитол, 40% раствор глюкозы). Прогрессирование острой почечной недостаточности является показанием к проведению гемодиализа.
Выписка больных производится по клиническим показаниям. После выписки из стационара реконвалесценты подлежат диспансерному наблюдению в течение 6 месяцев с участием инфекциониста, нефролога, офтальмолога и невропатолога. Продолжение лечения в амбулаторных условиях особенно необходимо при остаточных нарушениях функции почек и сердечно-сосудистой системы.
Профилактические мероприятия. Включают в себя мероприятия, направленные на профилактику и борьбу с лептоспирозом среди сельскохозяйственных и домашних животных, и профилактику заболеваний людей на территории эпизоотического очага. Значительную часть общесанитарных мероприятий проводят ветеринарная служба и руководство животноводческих ферм и других хозяйств. Особое внимание уделяют охране водоемов от инфицирования воды больными животными-леп- тоспироносителями. Запрещено строительство животноводческих и звероводческих помещений, а также лагерное содержание сельскохозяйственных животных на берегу водоемов без соблюдения соответс-
твующих водоохранных правил. Устанавливают строгий контроль над источниками централизованного водоснабжения, а также местами купания людей, водопоя скота и спуском сточных вод от животноводческих ферм. Для предупреждения распространения иктерогеморрагического лептоспироза в наиболее заселенных крысами объектах осуществляют дератизационные мероприятия. Их проводят в жилых застройках, на животноводческих фермах, продовольственных складах, зверофермах, предприятиях по переработке животноводческого сырья и продуктов, в шахтах и канализационных сооружениях, а также в открытых станциях городов (свалки, пустыри, парковая зона) и сельской местности, местах массового отдыха, охоты и рыбной ловли. На неблагополучных по лептоспирозу животноводческих фермах, а также в убойных и субпродуктовых цехах мясокомбинатов, в шахтах, рудниках, на земельных работах персонал должен работать в специальной одежде: халатах (комбинезонах), резиновых перчатках, сапогах, фартуках, предохраняющих от проникновения лептоспир через кожные покровы и слизистые оболочки. Специфической вакцинации путем введения убитой лептоспирозной вакцины подлежат лица высокого риска заражения (сельскохозяйственные рабочие, животноводы, работники боен и др.), хотя специфической профилактике отводят довольно скромную роль.
Профилактическую иммунизацию против лептоспироза проводят населению по эпидемическим показаниям, определяемым местными органами здравоохранения в зависимости от эпидемической и эпизоотической ситуаций. Разработаны моновалентные (серовар icterohaemorrhagiae) и поливалентные вакцины. Прививки животных мало эффективны и при инфицировании в некоторых случаях приводят к бессимптомному носительству лептоспир. В очагах лептоспироза необходима санитарно-просветительная работа среди населения по разъяснению мер профилактики данной инфекции. Эта задача возлагается на медицинских и ветеринарных работников, руководителей хозяйств.
2.8. Менингококковая инфекция
Острое антропонозное заболевание с аэрогенным механизмом передачи возбудителя, характеризующееся поражением слизистой оболочки носоглотки и возможным развитием генерализованных форм инфекции (менингококкемии и менингита).
Краткие исторические сведения. Neisseria meningitidis впервые была идентифицирована как этиологический фактор бактериальных менингитов Weichselbaum в
инфекции (МИ) была описана еще Vieusseux в
В течение ХХ столетия эпидемическое распространение МИ в странах с умеренным климатом происходило нечасто, тогда как в экваториальных странах Африки, в настоящее время известных как страны «менингитного пояса», периодически повторялись несоразмерно более крупные вспышки, чем в европейских странах. По оценочным данным, только в период с 1951 по 1960 гг. в странах «менингитного пояса» переболело около 350 тыс. человек, умерло около 53 тыс. человек. В настоящее время менингококковая инфекция стала глобальной проблемой, и случаи заболевания регистрируется во всех странах мира.
Этиология. Возбудителем менингококковой инфекции является Neisseria meningitidis, которая впервые была подробно изучена в
Морфология. Менингококки - мелкие грамнегативные диплококки. Для них характерно расположение в виде пары кофейных зерен, обращенных вогнутыми поверхностями друг к другу. Менингококки неподвижны, спор не образуют, имеют пили IV типа, клинические изоляты образуют микрокапсулу полисахаридной природы, которая утрачивается при культивировании микроба на питательных средах.
Культуральные и биохимические свойства. Менингококки - строгие аэробы, капнофилы. Культивируются на сложных питательных средах, содержащих сыворотку, дефибринированную кровь или специальный набор аминокислот. Средами для культивирования являются: сывороточный, кровяной и «шоколадный» агары, а также среда Мюллер-Хинтона. Элективная среда должна содержать ристомицин для ингибиции роста сопутствующей флоры. Менингококки растут при температуре 37 оС, 5% концентрация СО2 стимулирует их рост. Биохимическая активность возбудителей низкая: они оксидазо- и каталазоположительны, ферментируют только глюкозу и мальтозу, протеолитической активностью не обладают; в отличии от условно-патогенных нейссерий не разлагают сахарозу с образованием крахмалоподобного полисахарида, который выявляется на сывороточном агаре с добавлением 5% сахарозы при помощи раствора Люголя.
Антигенная структура. Менингококки обладают сложной антигенной структурой. По капсульным полисахаридным антигенам менингококки делятся на основные серогруппы - A, B,C,D и дополнительные - X, Y, Z, W-135 и 29E. По белковым антигенам клеточной стенки
менингококки внутри серогрупп В, С, Y и W-135 подразделяются на серовары (1, 2, 3 и т.д.). Штаммы серогруппы А вызывают эпидемические вспышки, в то время как штаммы серогрупп В, С и Y - спорадичес- кие заболевания.
Факторы патогенности. Neisseria meningitidis обладает пилями IV типа, которые совместно с белками наружной мембраны являются факторами адгезии. Микрокапсула является антифагоцитарным фактором. Микроб также продуцирует ферменты, обеспечивающие его инвазию: IgA-протеазу, нейраминидазу, гиалуронидазу. Большое значение в патогенезе заболевания принадлежит эндотоксину, который вследствие склонности менингококка к аутолизу образуется в большом количестве.
Эпидемиология. Менингококковая инфекция является типичной антропонозной инфекцией. Естественным резервуаром и источником инфекции является только человек с любой формой заболевания, включая здоровое носительство, вследствие чего заболевание регистрируется повсеместно.
Механизм передачи - аэрогенный, реализуемый воздушнокапель- ным путем при кашле, чиханье и даже разговоре. Ввиду нестойкости возбудителя во внешней среде инфицирование воздушно-пылевым путем не происходит. Кроме этого, передача возбудителя может происходить при контакте с секретом дыхательных путей при поцелуях, через столовые приборы и посуду, при проведении дыхания «рот в рот» и инструментарий для интубации трахеи.
Естественная восприимчивость человека высокая, однако контагиозность возбудителя небольшая, и для инфицирования людей большое значение имеет длительность контакта. Наибольшее значение в распространении заболевания играют «здоровые» носители менингококка и больные менингококковым назофарингитом. Больные генерализованными формами могут представлять значительную эпидемическую опас- ность, поскольку выделяют во внешнюю среду вирулентные штаммы менингококка, однако в силу тяжести процесса они теряют социальную активность и круг их общения ограничен.
Носительство менингококков распространено достаточно широко и может достигать 20-30% в период эпидемического подъема заболеваемости, снижаясь в межэпидемический период до 1-3%.
На территории РФ циркулируют менингококки преимущественно серогруппы В. Заболеваемость регистрируется во всех возрастных группах, однако наиболее высокой остается у детей до 5 лет (более 70% всех заболевших). Для менингококковой инфекции типична зимне-весенняя сезонность заболеваемости.
Классическим регионом с эпидемическим распространением менингококковой инфекции являются страны экваториальной Африки, обозначаемые как «менингитный пояс» (рис. 2.8). Африканский «менин- гитный пояс» включает страны от Эфиопии на востоке до Сенегала на западе. Официально в список этих страны включены Бенин, Буркина Фасо, Северный Камерун, Чад, Эфиопия, Гамбия, Гана, Мали, Нигер, Северная Нигерия, Сенегал и Судан. За 20 летний период (с 1970 до 1992 гг.) в странах «менингитного пояса» было зарегистрировано около 800 тыс. случаев заболевания, вызванных преимущественно менингококками серогруппы А.
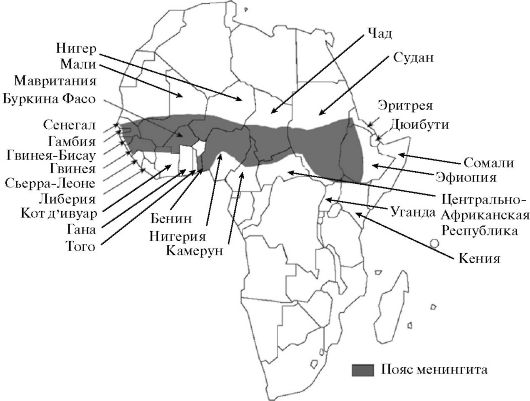
Рис. 2.8. Менингитный пояс Африки (ВОЗ, 1997)
В большинстве стран мира заболеваемость менингококковой инфекцией составляет от менее 1 до 5 на 100 тыс. населения, тогда как в африканских странах «менингитного пояса», даже в межэпидемический период, она может превышать 20 человек на 100 тыс.
После перенесенного заболевания формируется стойкий иммунитет.
Патогенез и патологическая анатомия. Воздушно-капельный механизм заражения предопределяет попадание менингококка на слизистые
оболочки носо- и ротоглотки, где и происходит их первичная адгезия и колонизация. Обнаружение менингококка на слизистой носоглотки без признаков воспалительной реакции типично для «здорового» носи- тельства. Дальнейшее развитие инфекционного процесса при менингококковой инфекции в значительной степени зависит от инфицирующей дозы, вирулентности возбудителя, его способности противодействовать защитным системам организма, а также от наличия дефектов в функционировании защитных систем макроорганизма (врожденных или приобретенных).
В том случае, если колонизация менингококка вызывает на слизистой носоглотки развитие катаральных явлений, появляется клиническая картина острого назофарингита. Разрушение менингококков под дейс- твием защитных факторов сопровождается высвобождением эндотоксина (липополисахарида), который из-за снижения барьерной функции слизистых оболочек ротоглотки вследствие развития воспалительной реакции поступает в кровоток, вызывая развитие умеренно выраженного интоксикационного синдрома.
Наличие в организме человека дефицита С3- и С5-факторов комплемента, дефицит IgM и IgG способствуют формированию генерализованных форм заболевания. Выраженное снижение барьерной функции слизистых оболочек верхних дыхательных путей способствует поступлению в кровоток не только эндотоксина, но и самих менингококков. Очень быстро развивается массивная бактериемия (менингококкемия), сопровождающаяся частичным разрушением менингококков в циркуляторном русле и высвобождением большого количества эндотоксина. Вследствие нарастающей бактериемии и сверхвысоких концентраций эндотоксина в крови происходит угнетение фагоцитарной активности нейтрофилов (незавершенность фагоцитоза). Внутри и внеклеточно менингококки распространяются по органам и системам, формируя множественные метастатические очаги гнойного воспаления. В местах диссеминации возбудителя происходит активация клеток крови (преимущественно лейкоцитов и тромбоцитов), сопровождающаяся высвобождением эндогенных медиаторов липидной (простагланди- нов, тромбоксана, недоокисленных продуктов пероксидации липидов) и белковой (интерлейкинов, интерферонов, тумор некротизирующего фактора и др.) природы, активных форм кислорода. Гиперпродукция указанных биологически активных веществ, а также формирующиеся иммунные комплексы оказывают прямое повреждающее действие на эндотелиальные клетки мелких кровеносных сосудов, что проявляется развитием типичного патоморфологического признака менингококке-
мии - ДВС-синдрома. Повышенное тромбообразование в мелких кровеносных сосудах приводит к нарушению микроциркуляции и тканевой гипоксии во всех вовлеченных в процесс органах и тканях. Клинически ДВС-синдром проявляется появлением на кожных покровах и видимых слизистых оболочках кровоизлияний (петехий). Поражение жизненно важных органов (прежде всего центральной нервной системы, сердечнососудистой системы, печени, почек, надпочечников и др.) существенно снижает адаптационные возможности макроорганизма, что нередко приводит к развитию инфекционно-токсического шока и органной недостаточности. Фактически у больных при менингококкемии развивается септический процесс.
Гематогенная диссеминация возбудителя на фоне существенного снижения фагоцитарной активности нейтрофилов и функций других гуморальных защитных систем способствует пенетрации менингококком гематоэнцефалического барьера с поражением мягкой и паутинной мозговых оболочек (менингит) и даже вещества головного мозга (энцефалит). Не исключено, что проникновение менингококка в субарахноидальное пространство может происходить и периневрально. Вследствие проникновения менингококка через гематоэнцефалический барьер в субарахноидальном пространстве развивается гнойное воспаление, сопровождающееся гиперпродукцией цереброспинальной жидкости (ликвора), нарушением ликвородинамики, внутричерепной гипертензии.
Формирующиеся в процессе заболевания иммунопатологические реакции могут обусловливать развитие миокардитов, перикардитов, артритов.
В редких случаях вторичные очаги гнойного воспаления могут формироваться в других органах.
Вследствие исключительного подавления защитных систем организма спонтанное прекращение бактериемии практически невозможно, в силу чего только использование антибактериальных препаратов позволяет остановить и прекратить бактериемию, а последующее формирование специфического гуморального и клеточного иммунитета, восстановление неспецифических защитных реакций (прежде всего, фагоцитоза) способствуют окончательной санации макроорганизма от возбудителя.
Патоморфологически при генерализованных формах заболевания выявляются диффузный васкулит и внутрисосудистая коагуляция крови. Кровоизлияния обнаруживаются в коже, слизистых оболочках, легких, сердечной мышце, эндокарде, перикарде, в паренхиме почек, надпочечниках, на мозговых оболочках и в веществе головного мозга. Сгустки
крови, заполняющие мелкие сосуды, состоят из фибрина, лейкоцитов, менингококков. Гистологически в местах формирования тромбов обнаруживаются некрозы сосудистой стенки. Во внутренних органах обна- руживаются дистрофические изменения и некрозы. У больных с развившейся клинической картиной шока типичным являются кровоизлияния в надпочечники - синдром Уотерхауса-Фридериксена.
Патоанатомические изменения при менингите характеризуются гнойным воспалением мягкой, паутинной оболочек головного мозга и частично вещества головного мозга (гиперемия, отек). Типичным местом скопления гноя являются основание головного мозга и нижняя поверхность мозжечка. У погибших больных гнойные наложения распространяются на верхние полушария головного мозга, покрывая их поверхность и образуя своеобразный «гнойный чепчик». В некоторых случаях в процесс вовлекается эпендима желудочков мозга.
Клиническая картина. Инкубационный период варьирует от 2-х до 10 дней, составляя чаще 2-5 дней.
В соответствии с общепринятой клинической классификацией менингококковой инфекцией, предложенной В.И. Покровским, выде- ляют следующие формы и варианты:
I. Первично-локализованные формы:
- менингококковыделительство;
- острый назофарингит;
- пневмония.
II. Гематогенно-генерализованные формы:
- менингококкемия (типичная, молниеносная, хроническая);
- менингит;
- менингоэнцефалит;
- смешанная (менингококкемия + менингит);
- редкие формы (эндокардит, артрит, иридоциклит).
I. Первично-локализованные формы
Менингококковыделительство характеризуется полным отсутствием какой-либо клинической манифестации. Выявление таких пациентов, как правило, происходит при массовом обследовании людей в очаге инфекции. Длительность выделения менингококка со слизистых верхних дыхательных путей обычно сохраняется в течение 1-2-х недель, а у лиц с хронической патологией верхних дыхательных путей - более длительное время.
Менингококковый назофарингит является самой распространенной формой заболевания. В подавляющем большинстве случаев назофарин-
гит представляет собой самостоятельную форму заболевания, однако в редких случаях может предшествовать развитию генерализованной формы.
Инкубационный период варьирует от 1 до 10 дней, чаще составляя 3-5 дней. Заболевание начинается остро. Больные отмечают появление чувства першения в горле, небольшую болезненность при глотании, заложенность носа, сухой кашель, умеренно выраженную головную боль. Повышение температуры тела, как правило, не превышает фебрильных значений, но в отдельных случаях может достигать высоких величин.
Хотя клинические проявления назофарингита при менингококковой инфекции имеют большое сходство с назофарингитами иной эти- ологии, при объективном осмотре можно выявить некоторые отличительные признаки. В частности, при менингококковом назофарингите у больных отмечается бледность кожных покровов лица, возможно появления конъюнктивита и склерита, а при осмотре ротоглотки типичны гиперемия и зернистость задней стенки глотки со стекающими по ней слизисто-гнойными наложениями. Выделения из носа скудные. В отдельных случаях определяются несколько увеличенные и слабоболезненные подчелюстные лимфатические узлы. Кроме этого, у больных обнаруживается гиперемия миндалин, мягкого неба и дужек. Длительность заболевания обычно не превышает 1-3 дней, хотя в некоторых случаях может продолжаться до 2-х недель. Заболевание обычно протекает в легкой и среднетяжелой формах. Тяжелое течение менингококкового назофарингита следует рассматривать как начало гематогенной диссеминации возбудителя, что свидетельствует о формировании генерали- зованной формы.
Менингококковая пневмония встречается исключительно редко. Клинически она проявляется как очаговая или долевая пневмония тяжелого течения. Этиологическая диагностика возможна только при обнаружении возбудителя в мокроте.
II. Гематогенно-генерализованная форма
Менингококкемия (менингококковый сепсис). В подавляющем большинстве случаев развитию менингококкемии предшествует назофарингит, однако не исключается возможность и острого развития заболевания, без предшествующего назофарингита. В этом случае больные отмечают внезапное появление озноба, температура тела в течение нескольких часов повышается до 39-41 ?С, и в случае отсутствия этиотропной терапии сохраняется на высоких цифрах, нося постоянный или интермиттирующий характер.
Больные предъявляют жалобы на слабость, миалгии, артралгии, головокружение и головную боль, повторную рвоту.
При осмотре больных выявляется бледность и сухость кожных покровов, нередко отмечается цианоз. Важнейшим клиническим проявлением менингококкемии является геморрагическая сыпь, которая появляется в течение первых часов заболевания (обычно в первые 5-15 часов). Значительно реже сыпь появляется на вторые сутки заболевания. Хотя геморрагический характер экзантемы является типичным для менингококкемии, в некоторых случаях первично на кожных покровах появляются розеолезные элементы сыпи, которые очень быстро трансформируются в геморрагические. Типичные элементы геморрагической сыпи имеют неправильные очертания различной величины, плотные на ощупь. Обильность высыпаний придает им вид «звездчатого неба», в силу чего и саму сыпь называют «звездчатой». Чем выраженней интоксикация, тем многочисленнее и крупнее элементы сыпи. Обычно сыпь локализуется на ягодицах, нижних и верхних конечностях, туловище, в подмышечных впадинах и имеет тенденцию к слиянию. Сливаясь, элементы геморрагической сыпи образуют крупные геморрагические поля, обозначаемые как экхимозы. В тяжелых случаях экзантема приобретает генерализованный характер и обнаруживается на любых частях тела. Крупные эле- менты сыпи подвергаются сухому некрозу, и при их обратном развитии могут образовываться язвенно-некротические поверхности, особенно в дистальных отделах (ушных раковинах, кончике носа, пальцах верхних и нижних конечностей). В более тяжелых случаях сыпь локализуется на лице. Поскольку патогенетической основой появления геморрагической сыпи является ДВС-синдром, аналогичные кровоизлияния образуются на слизистых и во внутренних органах. Нередко при менингококкемии отмечаются кровоизлияниям на конъюнктивах, склерах и слизистых оболочках ротоглотки. В более тяжелых случаях могут развиваться носовые, желудочные, почечные и прочие кровотечения. Одним из самых тяжелых состояний, развивающихся при менингококкемии, является кровоизлияние в надпочечники (синдром Уотерхауса-Фридериксена), что клинически проявляется инфекционно-токсическим шоком.
Вследствие диссеминации возбудителя в ранние сроки заболевания могут отмечаться поражения мелких и крупных суставов с развитием признаков артритов.
Со стороны органов дыхания и сердечно-сосудистой системы отмечаются одышка, тахикардия, снижение уровня артериального давления вплоть до коллапса. В более поздние сроки заболевания возможно развитие миокардита и даже перикардита.
Вследствие выраженного нарушения микроциркуляции нередко у больных в ранние сроки заболевания развиваются олиго- и анурия. В общем анализе мочи повышается уровень белка, при микроскопии определяется повышенное количество лейкоцитов, эритроцитов, появляются цилиндры. В случае развития анурии в крови нарастают уровни креатинина и мочевины.
Несмотря на наличие в системном кровотоке менингококка, увеличение печени и селезенки при менингоккемии не происходит.
Уже с первых часов формирования менингококкемии в периферической крови отмечается значительное повышение количества лейкоцитов (до 20-40 х 1012 в 1 мкл), резкий сдвиг лейкоцитарной формулы влево, вплоть до миелоцитов, тромбоцитопения, ускорение СОЭ (до 40-50 мм/час).
Тяжесть состояния больных при менингококкемии оценивается по выраженности интоксикационного синдрома, функциональному состо- янию жизнеобеспечивающих систем (прежде всего, ЦНС, сердечнососудистой и мочевыделительной), выраженности геморрагического синдрома.
При молниеносном варианте менингококкемии отмечается исключительно высокая скорость нарастания признаков заболевания с развитием ИТШ уже с первых часов. Начало заболевания внезапное, на фоне бурного нарастания признаков интоксикации рано появляется обильная, сливная геморрагическая сыпь на кожных покровах и слизистых. У больных отмечаются значительное снижение уровня артериального давления, обморочные состояния, нарушение сознания, менингеальный синдром. Фактически уже в течение 4-8 часов от момента начала заболевания у больных выявляются признаки ИТШ, в силу чего они нуждаются в реанимационной помощи.
Хроническая менингококкемия является редким вариантом МИ. У больных отмечаются длительная интермиттирующая лихорадка, полиморфные высыпания на кожных покровах, поражение суставов, гепатолиенальный синдром. Диагностика возможна только на основании результатов бактериологического исследования крови.
Менингиту в 1/3 случаев предшествует назофарингит. Чаще начало заболевания бывает внезапным. Больной даже может указать час заболевания. Первыми проявлениями заболевания бывают озноб, подъем температуры тела до высоких цифр, постоянная, нарастающая головная боль распирающего характера. На высоте головной боли появляется повторяющаяся рвота без предшествующей тошноты и не приносящая облегчения. К числу ранних проявлений менингита относится гипере-
стезия к различным раздражителям. Больные испытывают дискомфорт, раздражение и усиление головной боли при различных шумах, ярком свете, посторонних звуках. Отмечается повышение тактильной чувствительности.
Достаточно рано отмечается возбуждение больных при сохраненном сознании, однако в последующем отмечаются нарушения психической деятельности и уровня сознания.
При осмотре больных отмечаются бледность кожных покровов, хотя может выявляться гиперемия лица, на губах и крыльях носа появляются элементы герпетической сыпи. Выражены тахикардия, артериальная гипотензия, одышка.
Уже с первых часов заболевания появляются менингеальные (оболочечные) симптомы, к которым относятся реактивные болевые феномены и мышечно-тонические напряжения и контрактуры.
К числу реактивных болевых феноменов относятся выявление болевых реакций при слабом надавливании на глазные яблоки, при пальпации точек выхода ветвей тройничного нерва, на переднюю стенку наружного слухового прохода, при поколачивании по скуловой дуге. Появление мышечно-тонических напряжений и контрактур обусловлено ригидностью мышц к растяжению, что обнаруживается в виде таких признаков, как ригидность мышц затылка, симптомов Кернига, Брудзинского (верхнего, нижнего и в меньшей степени - среднего) и ряда др.
Тяжесть течения менингита в первые дни болезни связана с выраженностью интоксикационного синдрома, тогда как в последующем (а при молниеносном течении уже с первых часов заболевания) - с развитием гнойно-воспалительных процессов в оболочках головного мозга и ткани мозга. Нередко менингеальные симптомы сочетаются с признаками поражения черепно-мозговых нервов. Чаще поражаются III, IV, VI пары нервов, что клинически проявляется развитием диплопии, птоза, анизокории, стобизма. Кроме этого, могут также поражаться лицевой и слуховой нервы.
При тяжелом течении заболевания или в случаях позднего обращения за медицинской помощью больной принимает характерное вынужденное положение: лежит на боку с запрокинутой головой и приведенными к животу ногами, согнутыми в тазобедренных и коленных суставах (в медицинской литературе такое положение больного обозначается как поза «взведенного курка»).
Наиболее тяжелое течение менингококкового менингита наблюдается при молниеносном варианте, когда у больных уже с первых часов
заболевания выявляются признаки отека и набухания вещества головного мозга и ИТШ.
Менингоэнцефалит развивается в том случае, когда воспалительный процесс с мозговых оболочек переходит на вещество мозга. Клинически данный вариант заболевания характеризуется ранним появлением и быстрым нарастанием сонливости, судорог, психических нарушений, нарушением уровня сознания, развитием стойких парезов и параличей. У больных определяются патологические рефлексы Бабинского, Россолимо, Гордона, Оппенгейма. Проявления менингеальной симпто- матики у этих больных могут быть выражены минимально. Определяют характерные для поражения вещества мозга патологические рефлексы - Бабинского, Оппенгейма, Россолимо, Гордона и др.
Гематогенно-генерализованные формы могут протекать по смешанному варианту, когда у больных одновременно выявляются признаки менингококкемии и менингита.
Летальность при генерализованных формах заболевания составляет около 10%, что в значительной степени зависит от своевременности диагностики заболевания и начала антибактериальной терапии.
Дифференциальная диагностика. При менингококковой инфекции дифференциальный диагноз проводится в зависимости от формы заболевания. Поскольку клинические проявления менингококкового назофарингита неотличимы от поражений носоглотки иной этиологии, дифференциальная диагностика невозможна без бактериологического обследования.
Менингококкемию следует дифференцировать с сепсисом другой этиологии, гриппом, лептоспирозом, геморрагическими лихорадками, сыпным тифом, а также заболеваниями неинфекционной этиологии, проявляющиеся геморрагической сыпью (геморрагические васкулиты, токсико-аллергическим дерматиты и др.).
Менингококковый менингит необходимо дифференцировать с менингитами иной этиологии, особенно в случаях получения гнойного характера ликвора, а также с субарахноидальным кровоизлиянием, коматозными состояниями. Для окончательной дифференциальной диагностики необходима спинномозговая пункция с бактериологическим исследованием ликвора.
Лабораторная и инструментальная диагностика. Для микробиологической диагностики используют бактериоскопический, бактериологический и серологический методы. Материалом для исследования являются ликвор, кровь, носоглоточная слизь с задней стенки глотки (которую берут специальным изогнутым тампоном, вводя его за мягкое
небо), сыворотка крови, трупный материал. Поскольку менингококки очень неустойчивы вне организма человека, материал транспортируют в лабораторию в утепленных контейнерах при температуре 35-37 оС.
Бактериоскопическое исследование ликвора и «толстой» капли крови используется только для получения предварительного ориентировочного ответа. Основным методом исследования является бактериологический. Бактериологическому исследованию подвергают носоглоточную слизь, кровь и ликвор. Кровь и ликвор засевают на полужидкий агар с последующим высевом на плотные питательные среды. Носоглоточную слизь непосредственно засевают на плотные питательные среды. Посевы инкубируют при 37 оС в СО2-инкубаторе в течение 18-24 часов. Идентификацию выделенной чистой культуры проводят по оксидазному тесту, способности ферментировать глюкозу и мальтозу, серотипированию.
Вспомогательное значение имеет серологическое исследование. Серологическое исследование направлено на определение в ликворе и моче группоспецефических антигенов методами ИФА, реакцией коагглютинации, латекс-агглютинации, РОНГА встречным иммуноэлектрофорезом, а также на обнаружение в парных сыворотках специфических антител. Антитела обнаруживается с конца 1-й недели заболевания, достигая максимума на 2-3-й недели, а потом титр их снижается.
Осложнения и прогноз. Наиболее грозными и тяжелыми осложнениями являются инфекционно-токсический шок (ИТШ), острая надпочечниковая недостаточность (синдром Уотерхауса Фридериксена), острый отек и набухание вещества головного мозга, острая почечная недостаточность.
К числу редких, но возможных осложнений также относятся: эпендиматит (вентрикулит), блокада ликворных путей вследствие консолидации гноя.
Лечение. Госпитализация больных с менингококковой инфекцией осуществляется по клинико-эпидемиологичеким показаниям. Больные с назофарингитом и менингококковыделители могут лечиться в амбулаторных условиях, тогда как при установлении генерализованных форм госпитализация обязательна. В случае развития осложнений больные подлежат госпитализации в ОРИТ.
Антибактериальные препараты показаны всем больным менингококковой инфекцией, независимо от формы заболевания.
При назофарингите и носительстве менингококка больным показан оральный прием антибиотиков: ампициллина, левомицетина, рифам- пицина в общетерапевтических дозах в течение 4-5 дней. Кроме этого,
показано местное лечение в виде полоскания горла дезинфицирующими растворами.
При генерализованных формах антибактериальную терапию целесообразно назначать уже на догоспитальном этапе, что диктуется быстрой динамикой инфекционного процесса. Следует помнить, что прогноз и исход генерализованных форм в значительной степени зависят от своевременности назначения и используемых доз антибактериальных препаратов.
До сих пор одним из наиболее эффективных антибактериальных препаратов при менингококковой инфекции остается бензилпенициллин. В целях создания в крови достаточной для преодоления гематоэнцефалического барьера концентрации антибиотика используют массивные дозы бензилпенициллина, которые рассчитываются, исходя из 200 000-500 000 ЕД на килограмм массы тела больного в сутки. Полученную суточную дозу вводят через 4 часа (6 раз в сутки) внутри- мышечно. При внутривенном применении препарат вводят каждые 2 часа, а его суточная доза должна быть увеличена на 30%.
При отсутствии бензилпенициллина может быть использован ампициллин из расчета суточной дозы 200-400 мг на килограмм массы тела больного. В случаях неустановленной этиологии менингита целесообразно использовать цефалоспорины III поколения (цефтриаксон, цефотаксим) в суточной дозе 2-4 г.
При менингококкемиях и в случаях развившегося ИТШ больным парентерально (внутримышечно) может назначаться левомицетин (левомицетина сукцинат) в суточной дозе 50-100 мг на килограмм массы тела. Целесообразность применения левомицетина сукцината у этих больных диктуется его бактериостатическим действием на менингококки. Препаратом выбора при МИ может быть ципрофлоксацин.
Длительность антибактериальной терапии составляет 5-6 дней, что, в конечном итоге, будет определяться регрессом клинических проявлений заболевания, а у больных менингитом - санацией ликвора. При необходимости курс антибактериальной терапии может быть пролонги- рован до 10-14 дней.
Кроме антибактериальной терапии больным проводится дезинтоксикационная терапия кристаллоидными (глюкозо-солевыми растворами) и коллоидными (альбумин, криоплазма, реополиглюкин и др.) раствора- ми в соотношении 3:1, назначаются диуретики, по показаниям - корти- костероидные препараты (преднизолон из расчета 5-10 мг на килограмм массы тела или дексазон в суточной дозе 0,25-0,5 мг на килограмм массы тела), аналгетики, седативные и противосудорожные средства.
Профилактические мероприятия. Важное место в профилактике менингококковой инфекции (особенно в организованных коллективах) занимает своевременное выявление менингококковыделителей и заболевших любыми формами заболевания.
Специфическая профилактика (вакцинация моно- и дивакциной) проводится по эпидемиологическим показаниям. Иммунитет формиру- ется уже через 2 недели после введения вакцины и сохраняется в течение 2-х лет.
2.9. Столбняк
Столбняк - острое инфекционное заболевание из группы раневых инфекций, характеризующееся токсическим поражением нервной системы, проявляющимся клонико-тоническими судорогами скелетной мус- кулатуры, с возможным нарушением дыхания (вплоть до асфиксии).
Этиология. Таксономия. Clostridium tetani относится к отделу Firmicutes, роду Clostridium. Возбудитель открыт в
Морфология и тинкториальные свойства. Возбудитель - подвижная грамположительная палочка, имеет жгутики перитрих, образует спору, расположенную терминально, капсулу не образует. Под микроскопом напоминает теннисную ракетку. В культуре старше 24 часов бактерии становятся грамотрицательными.
C. tetani - строгий анаэроб. Неприхотлив к питательным средам Не расщепляет углеводов, обладает слабыми протеолитическими свойствами.
Антигенная структура и токсинообразование. По жгутиковому Н- антигену C. tetani делится на 10 сероваров. О-антиген является общим для всех представителей вида. Кроме того, возбудитель продуцирует токсин, обладающий антигенными свойствами
Факторы патогенности. Основным фактором патогенности является экзотоксин, представляющий собой белок с молекулярной массой 150 кД, идентичный для всех сероваров. Токсин состоит из двух фракций: тетанолизина и тетаноспазмина. Тетанолизин обладает гемолитическим действием, патогенетически менее значим. Тетаноспазмин, протеин, вызывает спастическое (непроизвольное сокращение мышц) действие. Механизм его действия связан с нарушением функционирования постсинаптических мембранах синапсов. Связываясь в них с синаптичесими белками - синаптобревином и целлюбревином, токсин подавляет высвобождение тормозных нейромедиаторов.
К столбнячному токсину чувствительны человек, лошадь, мыши, морские свинки, кролики и другие животные.
Резистентность. Споры столбнячной палочки отличаются термо- устойчивостью: при кипячении погибают лишь через 50-60 минут. Вегетативные формы чувствительны к большинству антимикробных средств, включая дезинфектанты, антибиотики.
Эпидемиология. Заболевание относится к группе сапрозоонозов. Естественным резервуаром и источником инфекции являются многие виды животных (преимущественно травоядные, грызуны) и даже птицы, у которых Clostridium tetani является естественным обитателем кишечника и с испражнениями выделяется во внешнюю среду. При попадании во внешнюю среду столбнячная палочка быстро превращается в спору. В испражнениях людей возбудитель столбняка также может обнаруживаться, однако ввиду отсутствия оптимальных микроэкологических условий в просвете кишечника вегетация спор с последующим токсинообразованием не происходит. По разным данным, носительство столбнячной палочки у людей может варьировать от 6 до 40%.
Особенности выделения возбудителя столбняка во внешнюю среду способствуют его широкому распространению в окружающей среде (преимущественно в почве), независимо от климато-географических условий. Наиболее высокая заболеваемость столбняком регистрируется в странах с жарким климатом, чему способствуют оптимальные условия не только к более длительному сохранению спор в почве, но и даже возможность их вегетации с последующим размножением вне организма хозяина. В таких случаях инфекционность столбнячной палочки существенно возрастает.
Механизм передачи - контактный, который реализуется при попадании возбудителя на поврежденные кожные покровы и слизистые оболочки (раны, порезы, потертости, ожоги и т.д.). Любой характер раневой поверхности может представлять угрозу развития столбняка. Заболеваемости способствует высокий уровень бытового, производственного, военного и прочего травматизма.
В мирное время основную группу риска заболеваемости столбняком в Российской Федерации составляют сельскохозяйственные рабочие, удельный вес которых может достигать 85%. Заболеваемость носит спорадический сезонный (весенне-летний) характер. В странах тропического климата поступление столбнячной палочки в организм человека может происходить через повреждения кожных покровов в результате пирсинга (в т.ч. ритуального), перкутанного заражения тропическими гельминтозами (преимущественно дракункулез) и даже в родах (как у
рожениц, так и новорожденных), принимаемых в негигиенических условиях, и абортах, проводимых вне медицинских учреждений. Передача возбудителя от больного человека к здоровому невозможна.
Ввиду отсутствия официальной регистрации заболеваемости столбняком истинное количество заболевших не известно. По данным ВОЗ, ежегодно в мире от столбняка погибает свыше 1000 человек.
Естественная восприимчивость человека высокая. Ввиду слабой иммуногенности экзотоксина и его небольшого количества антитоксический иммунитет после перенесенного заболевания не формируется.
В настоящее время в странах, в которых проводится активная иммунизация против столбняка, заболеваемость среди новорожденных не регистрируется.
Патогенез и патологическая анатомия. Развитие заболевания возможно только в случае, если споры столбнячной палочки попадают в раны на кожных покровах и слизистых оболочках. Наиболее опасна контаминация спорами глубоких колотых ран и ран, имеющих некротизированные ткани, сочетающихся с открытыми переломами костей, в которых создаются анаэробные условия, необходимые для прорастания спор в вегетативные формы с последующим размножением и продукцией экзотоксинов (тетаноспазмина и тетанолизина).
Ведущее значение в развитии заболевания отводится тетаноспазмину, обладающему нейротропностью. Проникновение тетаноспазмина в спинной, продолговатый мозг и в ретикулярную формацию ствола происходит невральным и гематогенным путями. Только не связавшийся токсин может быть нейтрализован антитоксическими антителами. Мишенью действия тетаноспазмина являются вставочные нейроны полисинаптических рефлекторных дуг, в результате чего происходит снятие всех видов торможения, и к мышцам непрерывно поступают импульсы возбуждения. Постоянное, дискоординированное поступление двигательных импульсов от мотонейронов к мышцам сопровождается гиперпродукцией и гиперсекрецией ацетилхолина в нервно-мышечных синапсах, что приводит к постоянному тоническому напряжению скелетной мускулатуры. Одновременно происходит повышение возбудимости коры и ретикулярных структур головного мозга и усиление афферентной импульсации в ответ на тактильные, слуховые, зрительные, обонятельные, вкусовые и прочие раздражители, что провоцирует периодическое возникновение клонико-тонических и тетанических судорог. Постоянное мышечное напряжение и периодически возникающие судороги сопровождаются выраженными кардиоваскулярными расстройствами в виде тахикардии, гипертонии, аритмии, фибрилля-
ции желудочков сердца, в основе которых лежат как метаболические расстройства (ацидоз), так и гиперактивность симпатической нервной системы.
Кроме этого, тетаноспазмин может поражать жизненно важные центры головного мозга (дыхательный, сердечно-сосудистый и др.), вызывая развитие бульбарного столбняка, заканчивающегося, как правило, летально.
Наиболее часто причиной летального исхода при столбняке являются асфиксия, наступающая вследствие судорог, и развитие вторичных бактериальных осложнений (прежде всего, пневмонии и сепсиса). Постинфекционный иммунитет при столбняке не формируется. Патологоанатомические изменения скудны, а при неосложненном течении заболевания могут вообще отсутствовать. Чаще выявляют венозный застой и мелкие кровоизлияния во внутренних органах, в редких случаях - гематомы, разрывы мышц и даже компрессионные переломы позвоночника. Отмечается быстрое наступление трупного окоченения.
Клиническая картина. Единой и общепринятой клинической классификации столбняка не существует. По месту входных ворот инфекции выделяют: раневой, травматический, постоперационный, послеродовой и др. столбняк. В тех случаях, когда входные ворота установить не удается, говорят о криптогенном, или идиопатическом, столбняке. В зависимости от характера и распространенности процесса выделяют общий (генерализованный) и местный столбняк. В типичных случаях у больных развивается общий столбняк, в течение которого выделяют следующие периоды: инкубационный, начальный, разгара и реконвалесценции.
Инкубационный период при столбняке, как правило, составляет от 5 до 14 суток, но может удлиняться до 30 дней. Продолжительность инкубационного периода предопределяет тяжесть течения заболевания: короткий инкубационный период свидетельствует о тяжелом течении заболевания. Крайне неблагоприятным признаком течения столбняка является возникновение тетанических судорог менее чем через 48 часов от момента появления первых признаков болезни.
Заболевание начинается остро. Лишь в некоторых случаях у больных могут выявляться продромальные явления в виде неприятных ощущений и мышечных подергиваний в области раны, явившейся входными воротами инфекции, общего недомогания, головной боли и некоторых других невыраженных субъективных проявлений.
Ранним признаком начального периода столбняка является появление тупых тянущих болей и кратковременных судорог в области входных
ворот инфекции. Эти признаки выявляются у больных даже с уже полностью зажившими ранами.
К числу ранних характерных симптомов столбняка относятся затруднение открывания рта, боли в жевательных мышцах и тризм (напряжение и судорожное сокращение) жевательной мускулатуры. Поскольку генез развития указанных признаков идентичен, появляются они практически одновременно. Повышение тонуса мимической мускулатуры и появление тонических судорог приводят к появлению сардонической улыбки (risus sardonicus), придающей своеобразное выражение лица больного (морщинистый лоб, поднятые вверх брови, суженные глазные щели, растянутые губы и опущенные уголки рта) и дисфагии - затруд- ненного болезненного глотания, обусловленного судорожным спазмом мышц глотки.
Сочетание таких признаков, как тризм, сардоническая улыбка и дисфагия составляет классическую триаду ранних симптомов, характерную только для столбняка.
Последовательность появления и нарастание описанных симптомов у различных больных может отличаться: в некоторых случаях первыми признаками столбняка может быть расстройство глотания. Важной чертой начального периода столбняка является усиление и прогрессирование всех признаков заболевания.
Нередко в начальный период болезни у больных выявляется ригидность мышц шеи и затылка, обусловленная тоническим сокращением скелетной мускулатуры. Вовлечение в процесс скелетной мускулатуры происходит по направлению сверху-вниз. Больные отмечают «скованность» при движении головы, затруднения при изменении положения тела и ходьбе, тяжесть в поясничной области.
Распространение тонических судорог на мышцы туловища и конечностей свидетельствует о периоде разгара заболевания, что обычно наблюдается в течение нескольких дней от начала заболевания, однако в отдельных случаях это может происходить в течение первых суток.
В этот период отмечается постоянное напряжение скелетной мускулатуры тела, не проходящее даже во время сна. По мере прогрессирования процесса выраженность гипертонуса нарастает. Напряжение шейных и затылочных мышц приводит к запрокидыванию головы назад, вследствие чего приведение подбородка к груди делается невозможным. Напряжение продольных мышц спины приводит к выгибанию позвоночника вперед, образуя лордоз. Тоническое напряжение распространяется на мышцы груди, передней брюшной стенки и передней части бедер.
Вследствие вовлечения в процесс межреберных мышц дыхательные движения в грудной клетке резко ограничены. Дыхание становится учащенным и поверхностным. Существенному ухудшению функции внешнего дыхания способствует и выраженный тризм, при котором челюсти остаются плотно сомкнутыми.
Тоническое напряжение мышц промежности приводит к затруднению дефекации и мочеиспускания.
Несмотря на вовлеченность в процесс всей скелетной мускулатуры тела, в меньшей степени отмечается тоническое напряжение мышц плечевого пояса, крайне редко отмечается поражение мышц предплечий, кистей и стоп.
Хотя в общепринятом понимании клинические проявления интоксикации у больных отсутствуют, в периоде разгара, как правило, отмечается повышение температуры тела (вплоть до высоких цифр).
На фоне постоянного тонического напряжения скелетной мускулатуры под действием различных внешних раздражителей (слуховых, зрительных, тактильных и др.) у больных возникает одновременное судорожное сокращение всех вовлеченных в процесс мышц (тетанические судороги). Больной вздрагивает, вытягивается в постели, черты лица искажаются в сардонической улыбке, голова запрокидывается назад, дыхание приостанавливается, лицо становится цианотичным, тело дрожит от напряжения, кожа покрывается крупными стекающими каплями пота. Пульс частый, напряженный, артериальное давление повышено. Поскольку сознание больных остается ясным, развитие тетанических судорог приносит им большие страдания. Нередко во время приступа больные стонут и кричат.
Исключительное по выраженности тетаническое напряжение мышц может привести к развитию опистотонуса - классической иллюстрации столбняка, когда больной, лежащий на спине, упирается только на затылок, ягодицы и пятки. Поясничная часть тела приподнята над кроватью, и между спиной и постелью можно просунуть руку. Напряжение мышц достигает такой степени, что слышен скрежет зубов и хруст в суставах. Во время развития одного из таких приступом может наступить смерть больного от асфиксии.
Частота развития и продолжительность тетанических судорог определяет тяжесть течения столбняка. При легком течении регистрируются единичные и непродолжительные (до нескольких секунд) приступы в течение суток, тогда как при тяжелом они следуют один за другим до 5-10 раз в течение одного часа. Приступы чаще развиваются в ночные часы.
Одной из тяжелейших форм столбняка является бульбарный столбняк (форма Бруннера), при котором поражаются дыхательный, сосудодвигательный центры и ядра блуждающего нерва.
В редких случаях при неблагоприятном течении столбняка у больных может развиться паралитическая стадия, при которой на фоне спутанного сознания и даже бреда отмечается расслабление вовлеченных в пато- логический процесс скелетных мышц. Тризм исчезает, нижняя челюсть отвисает. Температура тела резко повышается, и через несколько часов наступает смерть больного.
Период реконвалесценции знаменуется укорочением продолжительности и ослаблением судорожных приступов. Интервал между приступами удлиняется, отмечается уменьшение тризма и ослабление мышечного тонуса. Период реконвалесценции после перенесенного столбняка довольно длительный. При благоприятном исходе клинические проявления столбняка постепенно ослабевают, и к 3-4 неделям приступы полностью прекращаются. Полное выздоровление больных с восстановлением мышечного тонуса, нормализацией состояния сердечно-сосу- дистой системы и др. функций наступает в более поздние сроки - от 1 до 3-х месяцев.
Местный столбняк (лицевой столбняк Розе, или паралитический столбняк Крейтера) является очень редкой формой заболевания, отличительной особенностью клинического проявления которого является преимущественное развитие двигательных расстройств в месте входных ворот возбудителя (в области головы и лица). У больных появляется одностороннее или двустороннее (более выраженное на стороне ранения) поражение мускулатуры лица с развитием тризма, ригидности мышц затылка, сардонической улыбки и последующим присоединением парезов черепно-мозговых нервов. Развитие тетанических судорог у больных не происходит.
Дифференциальная диагностика. Столбняк следует дифференцировать с истерией, эпилепсией, отравлением стрихнином, тетанией, менингитами, энцефалитами, миозитами, сочетающимися с травмами и другими заболеваниями, сопровождающимися развитием судорожного синдрома.
Лабораторная и инструментальная диагностика. При типичной клини- ческой картине столбняка специфическое лабораторное исследование не проводится, поскольку диагноз устанавливается на основании клинико-анамнестических и эпидемиологических данных.
В периферической крови у больных типичны лейкоцитоз и нейтрофилез, которые являются следствием сгущения крови ввиду чрезмерно-
го потоотделения и высокого риска развития вторичных бактериальных осложнений.
Отсутствие противостолбнячных антител в сыворотке крови не может служить критерием наличия или отсутствия у больного столбняка.
Лабораторная диагностика возможна, но она имеет второстепенное значение и носит ретроспективный характер.
Микробиологическая диагностика. Микробиологические исследования лишь подтверждают клинический диагноз. Применяют бактериоскопический, бактериологический и биологический методы исследования. Для бактериологического исследования берут материал из раны и воспалительных очагов, а также кровь. В культурах выявляют наличие столбнячного токсина, проводя опыт - биологическую пробу на мышах, у которых развивается характерная клиническая картина. Обнаружение столбнячного токсина при наличии грамположительных палочек с круглыми терминальными спорами позволяет сделать заключение, что в исследуемом материале присутствует C. tetani.
Осложнения и прогноз. Нарушение глотания может приводить к развитию бронхопневмоний (27-85% случаев), абсцессов легких. Одними из наиболее опасных осложнений могут быть асфиксия на высоте тетанических приступов, отек легких. К числу возможных осложнений относятся отрыв мышц от мест прикрепления, разрывы мышц, гематомы, переломы костей, компрессионные деформации позвоночника, динамическая кишечная непроходимость, длительная задержка мочеиспускания, пролежни. Развитие гипоксемии и гипоксии может сопровож- даться спазмом коронарных сосудов с возможным развитием инфаркта миокарда.
Прогноз столбняка всегда серьезный. Летальные исходы наблюдают в 20-50% случаев.
После перенесенного столбняка могут сохраняться мышечные контрактуры, параличи черепно-мозговых нервов (чаще III, VI и VII пар).
Лечение. Больные подлежат обязательной госпитализации в ОРИТ с обязательным обеспечением охранительного режима, исключающего воздействие любых раздражителей. Ввиду затруднения глотания больным необходимо проводить зондовое и парентеральное питание. За больными осуществляют тщательный уход с целью профилактики пролежней.
В максимально ранние сроки проводится специфическая дезинтоксикационная терапия - вводится противостолбнячная сыворотка (ПСС), направленная на нейтрализацию только свободно циркулирую-
щего столбнячного экзотоксина (со связанным токсином противостолбнячные антитела не взаимодействуют). С этой целью после выполнения внутрикожной пробы однократно внутримышечно вводится 50 000 МЕ (максимально разрешенная доза - 150 000 МЕ) противостолбнячной сыворотки (ПСС) или 1500-10 000 ЕД (средняя доза 3000 ЕД) специфического иммуноглобулина. После введения ПСС за больным необходимо наблюдать в течение 1 часа из-за опасности развития анафилактического шока.
Практически одновременно необходима консультация хирурга с целью проведения хирургического лечения первичного очага инфекции. Края раны, послужившей входными воротами инфекции, обкалываются противостолбнячной сывороткой.
С целью предупреждения и лечения бактериальных осложнений больным проводится антибактериальная терапия. Чаще всего применяются бензилпенициллин по 2 млн ЕД внутримышечно 4 раза в сутки, тетрациклин per os по 500 мг 4 раза в сутки.
Важное место в лечении больных столбняком занимает противосудорожная терапия. С этой целью больным назначают седативно-наркотические, нейроплегические средства и миорелаксанты: диазепам по 5-10 мг внутрь каждые 2-4 часа (в тяжелых случаях - внутривенно по 10-20 мг каждые 3 часа), литические смеси (по 2 мл 2,5% раствора аминазина, 1% раствора промедола и 1% раствора димедрола с добавлением 0,5 мл 0,05% раствора скополамина гидробромида). Больным назначают седуксен, барбитураты, оксибутират натрия, в тяжелых случаях - дроперидол, фентанил, курареподобные миорелаксанты (панкуроний, d-тубокурарин).
При критическом нарушении функции внешнего дыхания (по жизненным показаниям) проводят интубацию трахеи или трахеотомию, миорелаксацию обязательно сочетают с искусственной вентиляцией легких.
Кроме этого, больным проводится коррекция водно-электролитного баланса, кислотно-щелочного состояния, гипертермии, поддержание функции сердечно-сосудистой системы.
Профилактические мероприятия. Неспецифическая профилактика столбняка направлена на предупреждение травматизма. Специфическая профилактика столбняка включает плановые и экстренные мероприятия. Плановая иммунизация против столбняка входит в национальный календарь прививок. В целях экстренной профилактики используют столбнячный анатоксин, противостолбнячный человеческий имму-
ноглобулин и противостолбнячную сыворотку. Экстренную иммунопрофилактику целесообразно проводить в максимально ранние сроки с момента получения травмы. Схема ее проведения не зависит от характера полученных травм и включает первичную обработку раны с одновременным проведением специфической иммунопрофилактики по одной из следующих схем, в зависимости от предшествующей привитости: (1) пассивную иммунизацию, (2) активно-пассивную профилактику, включающую одновременное введение ПСС и анатоксина, (3) экстренную ревакцинацию АС для стимуляции иммунитета у ранее привитых лиц.