Эндоскопия. Базовый курс лекций: учебное пособие / Хрячков В.В., Федосов Ю.Н., Давыдов А.И., Шумилов В.Г., Федько Р.В. - 2009. - 160 с.
|
|
|
|
ГЛАВА 4 ЭНДОСКОПИЯ ПИЩЕВОДА, ЖЕЛУДКА И ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ (ЭГДС) (ЛЕКЦИЯ 6-7)
Пищеварительная система выполняет в организме человека ряд жизненно важных функций. Это механическая и химическая обработка пищевых продуктов, всасывание питательных веществ и воды, формирование и удаление непереваренных остатков пищи, иммунная защита, регуляция водно-электролитного, белкового, углеводного и липидного обмена и др.
Запомни! Эндоскопически выделяют: верхние (ротовая полость, глотка, пищевод, желудок, двенадцатиперстная, тощая и подвздошная кишки) и нижние (ободочная и прямая кишки) отделы желудочно-кишечного тракта.
4.1. АНАТОМИЯ И ФИЗИОЛОГИЯ ВЕРХНИХ ОТДЕЛОВ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Пищеварительный канал представляет собой полую трубку, начинающуюся с ротовой полости, заканчивающуюся анальным отверстием прямой кишки и имеющую ряд физиологических расширений: желудок, ампулу прямой кишки и др. Длина пищеварительного канала взрослого человека составляет 8-12 м.
Ротовая полость -
начальный отдел пищеварительного канала. В ней в процессе приема пищи
еда пережевывается (измельчается) и, перемешиваясь со слюной,
формируется в пищевой комок (рис.
Глотка является частью пищеварительной трубки, по которой пищевой комок из полости рта перемещается в пищевод. В то же время глотка является путем, по которому проходит воздух из полости носа в гортань и обратно. Длина глотки составляет 12-15 см. Полость глотки делят на три части: верхнюю - носоглотку, среднюю - ротовую часть и нижнюю - гортанную часть.
Пищевод имеет вид трубки, соединяющей глотку с желудком. Место перехода глотки в пищевод у взрослого соответствует уровню VI шейного позвонка или нижнему краю перстневидного хряща. Место пере-
хода в желудок проецируется на уровне XI грудного позвонка. Длина пищевода взрослого человека составляет 25-32 см. Залегая небольшой частью в области шеи, пищевод опускается в грудную полость, а затем через отверстие диафрагмы проникает в полость живота, переходя в кардиальную часть желудка.
Просвет пищевода неодинаков на всем протяжении и имеет три физиологических сужения. Первое находится в месте перехода глотки в пищевод, второе - на уровне дуги аорты, третье - в месте прохождения пищевода через отверстие диафрагмы.
Стенка пищевода состоит из четырех слоев: слизистой оболочки, подслизистой основы, мышечной и адвентициальной оболочек. Брюшная часть пищевода покрыта висцеральной брюшиной.
Желудок (Ventriculus) представляет мешкообразное расширение пищеварительной трубки. Величина желудка сильно варьирует как индивидуально, так и в зависимости от степени его наполнения. Край желудка, вогнутый, обращенный вверх и вправо, называется малой кривизной, край выпуклый, обращенный вниз и влево, - большой кривизной. На малой кривизне заметна вырезка, где два ее участка сходятся под острым углом. Это угол желудка.
В
желудке различают следующие части: место входа пищевода в желудок
называется кардия; прилежащая часть желудка - кардиальный отдел; место
выхода - привратник (pylorus); прилежащая часть желудка -
пилорический канал; куполообразная часть желудка влево от кардии
называется дном, или сводом. Тело протянуто от свода желудка до
пилорического отдела. Пилорическая часть желудка разделяется в свою
очередь на антральный отдел - ближайший к телу желудка участок и
пилорический канал - более узкую, трубкообразную часть, прилежащую
непосредственно к pylorus (рис.
Рельеф внутренней поверхности желудка представлен продольными желудочными складками, желудочными полями и желудочными ямками.
Стенка желудка состоит из четырех слоев: слизистой оболочки, подслизистой основы, мышечной и серозной оболочек.
Железы желудка представлены тремя видами: собственными, кардиальными и пилорическими. Собственные железы желудка наибо- лее многочисленные (порядка 35 млн). Они располагаются в области тела и дна желудка (фундальные железы). Входящие в их состав главные клетки секретируют пепсиноген (профермент, зимоген, который в присутствии соляной кислоты превращается в активную форму - пепсин1), липазу (расщепляющую жиры молока) и лизоцим (фермент,
1 Смотри словарь терминов.
разрушающий оболочки бактерий). Париетальные или обкладочные клетки собственных желез синтезируют ионы Н+ и хлориды, из которых образуется соляная кислота1.
Желудок выполняет в организме ряд важнейших функций:
- секреторную - выработка желудочного сока1, в состав которого входят ферменты пепсин, ренин, липаза, а также соляная кислота и слизь, участвующие в процессах пищеварения;
- механическую - депонирование принятой пищи, перемешивание ее с желудочным соком и порционная эвакуация желудоч- ного содержимого в двенадцатиперстную кишку;
- выработка антианемического фактора, способствующего поглощению витамина В12, поступающего с пищей;
- эндокринную - выработка ряда биологически активных веществ (гормонов) - гастрин1, гистамин1, серотонин1, мотилин, энтероглюкагон и других оказывающих стимулирующее или тормозящее действие на моторику и секреторную активность желудка и другие отделы пищеварительного тракта;
- экскреторную - выведение продуктов метаболизма. Двенадцатиперстная кишка (Duodenum) является начальным отделом
тонкой
кишки. Анатомически выделяют луковицу двенадцатиперстной кишки,
верхнюю горизонтальную ветвь, нисходящий отдел, нижнюю горизонтальную
ветвь, восходящий отдел (рис.
Внутренняя поверхность двенадцатиперстной кишки представлена структурами, характерными для рельефа тонкой кишки: циркулярными складками, ворсинками и криптами (кишечными железами), но имеющими свои функциональные и анатомические особенности.
Циркулярные складки образованы слизистой оболочкой и подслизистой основой. В начальном отделе кишки (луковице) складки отсутствуют. Дистальнее появляются редкие и низкие циркулярные и продольные складки. В месте сращения стенки ДПК с поджелудочной железой у основания одной из продольных складок находится большой дуоденальный сосочек (БДС).
Кишечные ворсинки представляют собой выпячивания слизистой оболочки пальцевидной или листовидной формы, обращенные в просвет кишки. В двенадцатиперстной кишке ворсинки широкие и короткие, их количество составляет порядка 22-40 на 1 мм2. В образовании каждой ворсинки участвуют структурные элементы всех слоев слизистой оболочки.
Смотри словарь терминов.
Кишечные крипты (железы) представляют собой углубления эпителия кишки в виде многочисленных трубочек, располагающихся в собственной пластинке слизистой оболочки. Устья желез открываются в просвет между ворсинками. Их количество составляет порядка 100 крипт на 1 мм2. Глубина крипт и высота ворсинок в двенадцатиперстной кишке примерно равны и составляют 0,2-0,5 мм.
Особенности строения и функции двенадцатиперстной кишки делают ее основным звеном в пищеварительном конвейере транспорта, химической обработки и всасывания продуктов питания. Двенадцатиперстная кишка осуществляет в организме ряд важных, последовательных функций:
- под действием собственных пищеварительных ферментов и ферментов, поступающих из печени и поджелудочной железы, здесь осуществляется дальнейшая химическая обработка пищевых масс, поступающих из желудка, расщепление и всасывание основных питательных элементов - белков, жиров и углеводов;
- благодаря перистальтическим сокращениям гладкой мускулатуры кишки происходит механическое проталкивание химуса в нисходящие отделы тонкого кишечника;
- биологически активные вещества, вырабатываемые эндокринными клетками, выполняют ряд важнейших функций гормо- нальной регуляции процессов пищеварения.
В гидролизе пищевых веществ, поступающих в двенадцатиперстную кишку, особенно велика роль поджелудочной железы. Сок под- желудочной железы богат ферментами (трипсиноген, химотрипсин, энтерокиназа, пептидазы, щелочная фосфатаза, нуклеаза, липаза, фосфолипаза, амилаза, сахараза и др.), участвующими в расщеплении белков, жиров и углеводов. Трипсиноген, вырабатываемый поджелудочной железой под действием энтерокиназы, превращается в трипсин1.
На скорость эвакуации желудочного содержимого в двенадцатиперстную кишку влияют:
- объем (количество) содержимого желудка;
- характер и консистенция пищи (жидкая и углеводистая пища эвакуируется из желудка быстрее, чем грубая с большим содер- жанием белков и жиров);
- химический состав желудочного содержимого (чрезмерно высокий кислотный уровень желудочного сока, гипертониче- ские растворы приводят к замедлению эвакуации желудочного
1 Смотри словарь терминов.
содержимого в двенадцатиперстную кишку и одновременно стимулируют процессы желчеотделения, секреции дуоденальных желез и поджелудочной железы);
- градиент давления между полостями пилорического отдела желудка и двенадцатиперстной кишки;
- состояние водно-солевого гомеостаза и др.
Все эти факторы играют важную роль в адекватной химической и механической обработке пищи, нейтрализации кислого желудочного содержимого под влиянием общих и местных нервно-гуморальных процессов регуляции.
Двенадцатиперстная кишка является основным «химическим реактором» желудочно-кишечного тракта, где под действием желчи, собственных пищеварительных ферментов и ферментов поджелудочной железы осуществляется дальнейший гидролиз белков, жиров и углеводов до конечных продуктов, мономеров, пригодных для усвоения организмом.
4.2. ЭЗОФАГОГАСТРОДУОДЕНОСКОПИЯ ДИАГНОСТИЧЕСКАЯ
С внедрением в клиническую практику гибких гастроскопов с волоконной оптикой в 1960-х гг. значительно расширились показания к проведению эндоскопических исследований верхних отделов желудоч- но-кишечного тракта. Появилась возможность не только качественной визуализации патологических изменений полых органов, проведение визуально-контролируемой биопсии с морфологическим исследованием субстрата, но и выполнение различных лечебно-диагностических манипуляций, значительно расширяющих возможности гастроскопии.
Сформировалось множество эндоскопических школ, взглядов и течений, подходов к диагностике и интерпретации полученных результатов.
На сегодняшний день эти процессы стабилизировались, были выработаны единые взгляды и подходы к описанию эндоскопической картины, разработаны четкие критерии, показания и противопоказания для проведения исследований и манипуляций.
4.2.1. Эзофагогастродуоденоскопия диагностическая плановая
Плановая диагностическая эзофагогастродуоденоскопия показана во всех случаях, когда необходимо выявить характер, степень
выраженности, локализацию, распространенность патологических изменений в пищеводе, желудке, двенадцатиперстной кишке и при- лежащих к ним органах.
Для проведения эзофагогастродуоденоскопии используют приборы, отличающиеся различным расположением оптики на дистальном конце эндоскопа (торцевым, косым, боковым), диаметром вводимой части эндоскопа, диаметром и количеством инструментальных каналов.
Показания:
- всем больным с подозрением на заболевания пищевода, желудка, двенадцатиперстной кишки и окружающих их органов;
- с целью дифференциальной диагностики злокачественной или доброкачественной природы заболевания (морфологической верификации опухоли, активности гастрита, очагов дисплазии и метаплазии), определения распространенности процесса, сочетанности поражения и сопутствующей патологии;
- оценка качества и эффективности консервативного и хирургического лечения болезней пищевода, желудка, двенадцатиперстной кишки, поджелудочной железы, желчевыводящих путей;
- уточнения локализации патологических процессов и образований органов брюшной полости и др.
Противопоказания (абсолютные):
- инфаркт миокарда (острая стадия, нарушения ритма)*;
- инсульт (острая стадия);
- сердечная недостаточность 3-й степени;
- стенокардия покоя;
- гемофилия;
- узловой зоб 4-й степени;
- выраженные стриктуры пищевода.
* После перенесенного инфаркта миокарда при положительной динамике основного заболевания больному возможно проведение ЭГДС не ранее чем через 3 нед.
Противопоказания (относительные):
- острые воспалительные заболевания миндалин, гортани, брон- хов*;
- глаукома;
- эпилепсия**;
- психические заболевания**.
* Если на эндоскопическое исследование направляются больные с инфекционной желтухой, ВИЧ-инфекцией, открытой формой туберкулеза, ЭГДС таким больным производится в последнюю очередь. ** Исследование выполняется на фоне премедикации или в/в наркоза.
Медикаментозная подготовка к ЭГДС зависит от целей исследования, характера и объема предполагаемого вмешательства, соматического состояния больных (сопутствующей патологии) и направлена на устранения психического напряжения, купирования болевого синдрома, подавление секреторной функции желудка, снижение или полное выключение гастродуоденальной моторики.
Премедикация
Для проведения плановой ЭГДС премедикация обычно не требуется. Однако больным с лабильной психикой иногда назначают следующие комбинации препаратов.
1. Накануне перед исследованием (на ночь) - седативные или снотворные препараты (нозепам, реланиум, барбамил) в средней терапевтической дозе.
2. За 20 мин до исследования - атропин 0,1% раствор 0,5-1 мл + баралгин 5 мл + реланиум (10 мг) в/м.
3. С целью подавления гастродуоденальной моторики и снижения саливации - атропин, метацин, бензогексоний.
4. Для снятия болевого синдрома - 2% раствор промедола 1 мл.
5. Для снижения секреторной функции желудка - гастроцепин, фамотидин, омепразол, сандостатин.
6. Для проведения ЭГДС детям и больным с нарушенной психикой иногда прибегают к в/в наркозу.
Анестезия
Методом выбора при эндоскопических исследованиях является местная анестезия (орошение зева и глотки) спрей-аэрозолем 10% раствора лидокаина.
Методика выполнения ЭГДС
Исследование проводят в положении больного на левом боку. Для предотвращения закусывания аппарата применяют загубник, через отверстие которого и вводится аппарат. Изогнув конец эндоскопа по форме ротоглотки, врач под визуальным контролем вводит эндоскоп в ротовую полость. Первым анатомическим ориентиром служит язычок мягкого нёба. При дальнейшем продвижении аппарата в поле зрения появляется второй анатомический ориентир - надгортанник.
Придерживаясь средней линии, минуя надгортанник, становится видным преддверие гортани, истинные голосовые складки, черпаловидные хрящи, правый и левый глоточные синусы. Введение прибора в гипофаринкс к входу в пищевод возможно через синусы или по центру, сразу же за черпаловидными хрящами, скользя по задней стенке глотки. Прибор должен вводиться с легкостью, без усилий и согласованно с актом глотания. Вход в пищевод является третьим анатомическим ориентиром. Прохождение этого участка требует особого внимания. Здесь по задней стенке глотки может располагаться дивертикул Ценкера. Риск перфорации значительно возрастает при визуально неконтролируемом, насильственном введении эндоскопа. Следует помнить, что расстояние от резцов до входа в пищевод составляет примерно 14-16 см. Длина же самого пищевода вариабельна и в среднем составляет 24-32 см.
Анатомически пищевод делится на шейный, грудной и абдоминальный отделы. Осмотр пищевода производят как во время продвижения эндоскопа вперед, так и при его выведении. В шейном отделе пищевода продольные складки слизистой оболочки соприкасаются своими вершинами. Расправить складки и осмотреть слизистую оболочку этого отдела удается лишь при интенсивном нагнетании воздуха, добиться полного расправления складок трудно. В тот момент, когда пищевод легко расправился под действием воздуха, можно констатировать, что конец эндоскопа достиг грудного отдела пищевода. Здесь слизистая оболочка становится гладкой, просвет пищевода приобретает округлую форму.
Место
прохождения пищевода через диафрагму определяют по характерному
кольцевидному сужению пищевода и небольшому рас- ширению над ним.
Брюшной отдел пищевода хорошо расправляется воздухом и представляет
собой воронку, дном которой является пищеводно-желудочный переход. Для
определения местонахождения дистального конца прибора используется
правило «шестерки». В среднем длина каждого отдела пищевода, шейного и
трех грудных отделов равна
Осмотр желудка производят в определенной последовательности после четкой ориентации положения дистального конца эндоскопа. После расправления желудка воздухом в поле зрения обычно попадает большая кривизна, которую определяют по характерному виду складок. Последовательно осматривая отделы желудка и продвигая аппарат вперед, достигают большой кривизны, после чего, увеличив угол изгиба дистального конца кверху, осматривают малую кривизну и угол желудка сначала на расстоянии, а затем вблизи. Продвигая эндоскоп по большой кривизне и ориентируясь по направлению перистальтики, подводят его к антральному отделу, а далее к привратнику. Осмотр угла желудка со стороны антрального отдела и кардии возможен лишь при резком сгибании конца эндоскопа. Пилорический отдел желудка представляет собой гладкостенный цилиндр, в конце которого легко можно обнаружить пилорический канал. При осмотре кардии и свода желудка, а также угловой складки и участков слизистой малой кривизны тотчас за углом рекомендуем обязательно использовать инверсионные методы: верхний U-образный и нижний J-образный типы ретрофлексии.
Довольно часто патология локализуется в области свода и дна желудка, угла Гиса, на малой кривизне за угловой складкой и поэтому при прямом обзоре не попадает в поле зрения, но отчетливо видна при инверсии. Дуоденоскопию с помощью эндоскопов с торцевой оптикой начинают с осмотра привратника, который производят, сгибая дистальный конец эндоскопа вверх и продвигая аппарат вперед. Чем ниже тонус желудка и чем больше он провисает, тем сильнее приходится сгибать конец эндоскопа. Если эндоскоп располагается у привратника, то можно видеть большую часть передней и верхней стенок луковицы, а при нерезком изгибе кишки кзади можно осмотреть даже область постбульбарного сфинктера Капанджи.
Пройдя через кольцо привратника и изменив положение дистального конца эндоскопа, можно осмотреть большую часть стенок луковицы двенадцатиперстной кишки и изгиб ее кзади, область сфинктера Капанджи. При дальнейшем проведении эндоскопа необходимо повернуть его вокруг собственной оси по часовой стрелке и согнуть дистальный конец кзади. Гладкая поверхность луковицы сменяется складчатым рельефом в дистальной части верхней горизонтальной ветви ДПК, особенно выраженным в области сфинктера.
Для осмотра малого и большого дуоденальных сосочков необходимо, продвигая эндоскоп вперед, вращать его против часовой стрелки
и сгибать влево и книзу. Для более детального осмотра двенадцатиперстной кишки используют аппараты с боковой оптикой, так называемые дуоденоскопы. Техника дуоденоскопии аппаратами с боковой оптикой несколько отличается от эзофагогастродуоденоскопии аппаратами с торцевой оптикой и будет описана ниже.
Техника выполнения ЭГДС аппаратами с боковым расположением оптики
Перед введением в пищевод дистальный конец эндоскопа с боковой оптикой слегка сгибают соответственно изгибу ротоглотки. В момент глотка аппарат без усилия вводят в пищевод, отпуская в этот момент рычаги, сгибавшие конец эндоскопа. Свободное продвижение аппарата, отсутствие кашля и резкого изменения голоса указывают на нахождение его в пищеводе. В течение этого периода в окуляре видно лишь ярко-красное поле зрения. Прохождение эндоскопа через пищеводно-желудочный переход ощущается по наличию легкого сопротивления. Подавая с этого момента воздух в желудок, можно наблюдать постепенное изменение цвета поля зрения: оно бледнеет, становится оранжево-желтым, и вскоре появляется изображение слизистой оболочки желудка.
При осмотре желудка ориентиром служат угол, а также тело желудка, по которому определяют его ось и устанавливают прибор таким образом, чтобы дуга малой кривизны в поле зрения занимала горизонтальное и симметричное положение. Вращая прибор вокруг оси, сначала осматривают малую кривизну, субкардиальную зону и прилегающие к ним переднюю и заднюю стенки тела желудка, а также большую кривизну. Изгибая конец эндоскопа, осматривают дно и кардиальный отдел. Следующим этапом гастроскопии является осмотр тела желудка. Эндоскоп ориентируют на 12 ч и сгибают к большой кривизне, в результате в поле зрения оказывается все тело желудка. После панорамного обзора осуществляют осмотр слизистой оболочки с близкого расстояния. Особенно тщательно осматривают угол желудка и обе его поверхности. При продвижении эндоскопа вперед из-за полукруглой складки, образуемой углом, появляются антральный отдел желудка и пилорический канал, имеющий округлую форму. Необходимо учитывать, что просвет желудка, форма складок и вид слизистой оболочки значительно изменяются при нагнетании воздуха. Для того чтобы лучше оценить функциональные и органические изменения, осматривать желудок следует при различных степенях расширения его воздухом.
В норме слизистая оболочка кардиальной зоны имеет нежно-розовую окраску с невысокими продольными складками. Через слизистую оболочку просвечивают мелкие кровеносные сосуды. Слизистая оболочка проксимального отдела и дна желудка розово-желтого цвета, бугристая, величина складок в области дна значительно увеличивается. Конфигурация тела и антрального отдела желудка изменяется в соответствии с количеством инсуфлируемого воздуха. Полость желудка сначала имеет щелевидную форму с выраженной складчатостью слизистой оболочки, степень которой уменьшается по мере нагнетания воздуха. На большой кривизне складки резко выражены и имеют вид длинных, лежащих параллельно и тесно прилегающих друг к другу валиков. По направлению к антральному отделу количество и выраженность складок уменьшаются. Слизистая оболочка антрального отдела ровная, блестящая, складки нежные, едва выраженные, имеющие неправильную форму.
Даже при незначительной инсуфляции воздуха антральный отдел приобретает конусовидную форму, складки полностью расправля- ются. В зависимости от интенсивности перистальтики привратник может постоянно менять свою форму. Иногда это узкий канал, и тогда область привратника напоминает розетку. Такой вид ему придают короткие утолщенные складки, сходящиеся к отверстию. В момент прохождения перистальтической волны привратник расправляется, и через него можно осмотреть весь пилорический канал. Слизистая оболочка в зоне канала гладкая, блестящая, иногда собирается в широкие продольные складки. Здесь же можно обнаружить валикообразные циркулярные складки, которые при прохождении перистальтической волны могут пролабировать в желудок.
Через зияющий пилорический канал, что чаще наблюдается при атонии желудка, можно увидеть луковицу двенадцатиперстной кишки. При прохождении привратника конец эндоскопа достигает луковицы, и обзор ее стенок осуществляется за счет вращательных движений эндоскопа вокруг собственной оси, движений вперед и назад и сгибания дистального конца книзу. При продвижении эндоскопа в нисходящую ветвь ДПК необходимо вначале повернуть его вокруг оси по часовой стрелке и согнуть книзу, а после достижения верхнего угла и изгиба, наоборот, вращать против часовой стрелки. В поле зрения попадает весь просвет кишки, включая большой дуоденальный сосочек, расположенный обычно на ее медиально-верхней стенке.
Для выведения БДС из «профильного» в «фасное» положение нередко необходимо перевести больного в положение на животе, а конец эндоскопа завести ниже сосочка, сгибая дистальный конец аппарата книзу и вправо. Осмотр нижней горизонтальной и восходящей ветвей двенадцатиперстной кишки и тощей кишки производят при постепенном мягком продвижении эндоскопа вперед и изменении положения прибора путем вращения его вокруг собственной оси и сгибания дистального конца в той или другой плоскости.
Запомни! К манипуляциям, проводимым во время плановой диагностической эзофагогастродуоденоскопии, относятся:
• биопсия - взятие материала на цитологическое и/или гистологическое исследование;
• эндоскопическая пристеночная рН-метрия (определение кислотности желудочного сока);
• хромогастроскопия (определение границ кислотопродуцирующей зоны желудка).
4.2.2. Методика забора материала для гистологического исследования
Гистологическое исследование биоптатов слизистой оболочки желудка и двенадцатиперстной кишки является обязательным для морфологической верификации заболевания позволяет достоверно оценить наличие и степень активности воспалительных изменений и дисрегенераторных процессов в слизистой оболочке, а также выявить сопряженность их с Helicobacter pylori1.
Достоверность результатов микроскопической диагностики в тканевых срезах обеспечивается исследованием не менее четырех кусочков слизистой оболочки желудка (по два биоптата с передней и задней стенки в теле и антральном отделах желудка). При опухолях и изъязвлениях желудка гистологический материал забирается по той же схеме с дополнительным забором тканей из опухолевой и периульцерозной зоны (не менее 5-6 кусочков). Каждый фрагмент маркируется, и ему присваивается индивидуальный номер.
При гистологическом исследовании врачом-патологоанатомом должны быть оценены и описаны в протоколе следующие признаки: - полнота забора материала;
1 Смотри словарь терминов.
- толщина слизистой оболочки до мышечной пластинки собственного слоя;
- состояние покровно-ямочного и железистого эпителия с уточнением клеточной дифференцировки и характера секреции;
- признаки метаплазии и дисплазии эпителия;
- состояние собственной пластинки слизистой оболочки (фиброз, отек, расстройства кровообращения);
- наличие и характер воспалительной инфильтрации, глубина ее распространения, активность воспаления;
- присутствие лимфатических фолликулов и их структура;
- признаки атрофических и гиперпластических изменений;
- выявление Helicobacter pylori при бактериоскопии с указанием степени обсемененности;
- наличие других изменений, характерных для особых форм гастритов.
Для того чтобы описание было полноценным, кусочки слизистой должны быть правильно ориентированы в гистологическом препарате. Детальное описание покровно-ямочного и железистого эпителия позволяет оценить состояние и топику секреции слизи, представительство париетальных (HCl) клеток, клеток концевых отделов желез, ответственных за выработку пепсиногена, клеток АПУД-системы.
Характеристика клеточного состава необходима для оценки дифференцировки, выявления признаков метаплазии и дисрегенератор- ных процессов.
4.2.3. Хромогастроскопия
Впервые
методика хромогастроскопии, орошение слизистой желудка метиленовым
синим с последующей визуальной оценкой окрашен- ных участков, была
описана Tsuda (1967). Сущность метода заключается в нанесении через
распылительный катетер на отдельные, подозрительные участки слизистой
оболочки желудка 0,25-0,5% раствора метиленового синего или 0,5-1,5%
раствора индигокармина, окрашивания их с последующим отмыванием
красителя струей чистой воды. При этом очаги кишечной метаплазии,
изъязвления, доброкачественные и злокачественные опухоли становятся
более заметными, так как краситель, проникая и абсорбируясь на
поверхности поврежденного (измененно- го) эпителия, дольше удерживается
в тканях (рис.
Таким образом, хромогастроскопия позволяет определять:
- участки метаплазированного эпителия;
- границы изъязвления, качество формирующихся на месте язвы рубцов;
- злокачественные опухоли на ранних стадиях развития заболевания.
Следует помнить, что для уточнения диагноза необходимо обязательное выполнение прицельной биопсии с последующей морфологической верификацией заболевания.
Хромогастроскопию с конго-красным используют для изучения секреторной топографии желудка перед оперативным лечением, при этом удается увидеть четкую границу между телом желудка, приобретающим черный цвет, и антральным отделом, имеющим красное окрашивание. Для проведения хромогастроскопии используют до 50 мл 0,5% раствора конго-красного, вводимого в желудок через зонд. Через 8-10 мин краситель эвакуируют, зонд извлекают и производят ЭГДС.
4.2.4. Эндоскопическая пристеночная рН-метрия
Показания:
- заболевания, при которых нарушение кислотопродуцирующей функции желудка имеет определенное значение в патогенезе и требует коррекции для достижения максимального лечебного эффекта;
- выявленные при эндоскопическом осмотре патологические изменения слизистой оболочки, которые могут быть обусловлены нарушением кислотопродукции.
Противопоказания:
- такие же, что и для плановой ЭГДС;
- нецелесообразно назначение рН-метрии больным, получающим антисекреторные препараты*.
* Блокаторы Н2-гистаминовых рецепторов должны быть отменены за 24 ч до исследования, блокаторы Н+К+АТФ-азы - за 36 ч.
В нашей стране широкое распространение получил отечественный прибор ацидогастрометр микропроцессорный «АГМ-03». В комплект входят:
- преобразователь первичный эндоскопический (рН-зонд с кольцевым измерительным электродом) в полимерной оболочке;
- накожный хлорсеребряный электрод сравнения для взрослых.
Описание методики
Перед
проведением рН-метрии осуществляется эндоскопический осмотр верхних
отделов пищеварительного тракта. После окончания осмотра накожный
электрод сравнения присоединяется к запястью пациента. Эндоскопический
рН-зонд проводят через инструментальный канал эндоскопа и погружают в
«желудочное озерцо». Озерцо располагается, как правило, по большой
кривизне, на границе тела и свода желудка. Под визуальным контролем
регистрируются значения рН в стандартных точках с последующим
составлением карты кислотности желудка (рис.
Количество исследуемых точек может увеличиваться в зависимости от полученных данных, выявленной патологии и задач исследования. Так, например, при язве желудка обязательно определение рН слизистой оболочки, прилежащей к язве. Оценка полученных данных осуществляется по функциональным зонам.
В желудке выделяют две основные функциональные зоны:
- активного кислотообразования, которая обычно соответствует телу и своду желудка;
- выработки щелочного секрета, которая обычно соответствует антральному отделу.
Активность кислотообразования оценивается по данным рН в теле и своде желудка:
- рН > 5,0 - анацидное состояние;
- рН 5,0-2,1 - гипоацидное состояние;
- рН 1,2-2,0 - нормацидное состояние;
- рН < 1,2 - гиперацидное состояние.
Ощелачивающая функция антрального отдела считается сохраненной при рН > 5 в средней трети антрального отдела.
Запомни! Эндоскопическое исследование, сопровождающееся эмоциональным напряжением и механическим раздражением желудка, является стимулятором кислотопродукции. Поэтому кислотность, определяемая во время эндоскопической рН-метрии, является стимулированной, а не базальной, и этот факт нужно учитывать при оценке полученных данных.
4.3. ЭЗОФАГОГАСТРОДУОДЕНОСКОПИЯ ЛЕЧЕБНАЯ
ПЛАНОВАЯ
Показания
Комплекс лечебных манипуляций и вмешательств, выполняемых во время ЭГДС, может включать следующие лечебные мероприятия:
- лигирование варикозно расширенных вен пищевода, желудка;
- эндоскопическое бужирование стриктур пищевода, желудка, бужирование стриктур анастомозов;
- электроэксцизию (фотокоагуляцию) доброкачественных новообразований (полипов) пищевода, желудка;
- лечение длительно не рубцующихся язв желудка и ДПК и др. Противопоказания
Противопоказания к проведению лечебной ЭГДС зависят от общего состояния больного, объема предполагаемого оперативного вмешательства, обоснованности и срочности (плановые, экстренные) проведения эндоскопических манипуляций и др.
4.3.1. Лечение варикозно расширенных вен пищевода
Варикозное расширение вен пищевода является следствием портальной гипертензии, развившейся на фоне цирроза печени, и часто является первым ее симптомом.
Старейшим методом эндоскопической профилактики кровотечений при варикозном расширении вен пищевода является склеротерапия. Используются различные типы склерозантов, причем их эффективность в целом сходна, и выбор зависит от доступности того или иного препарата и личных предпочтений доктора. Вводится, как правило, 1-2 мл склерозанта в каждую точку (в зависимости от размера вены), но не более 20 мл препарата за 1 сеанс. Склерозирующее вещество может вводиться как в саму вену, так и паравазально. Чаще всего применяется комбинированная техника. В большинстве случаев склерозант вначале вводится в точку вены, которая служит источником кровотечения, а затем поочередно инъецируется в каждый венозный столб начиная с гастро-эзофагиального соединения до средней трети пищевода. Прокол стенки вены иглой может вызвать дополнительное кровотечение. В этом случае рекомендуется с помощью аппарата произвести временное «тампонирование» кровоточащей вены путем проведения его в желудок на 1-2 мин. Классическим доказательством эффективности склеротерапии считается исследование, выполненное Hartigan et al., в котором сообщается о достижении

Рис. 12. Гильза, надетая на конец эндоскопа с О-образными лигатурами для лигирования варикозно расширенных вен пищевода
гемостаза при использовании этой методики у 91% больных. Другие авторы приводят сходные результаты. Применение баллонной тампонады после склеротерапии улучшает ее результаты.
Эндоскопическое лигирование варикозно расширенных вен пищевода основывается на странгуляции варикозных узлов эластичными О-образными лигатурами (рис. 12).
Сначала
эндоскоп со специальной насадкой на конце (в виде короткой прозрачной
гильзы, на которую надеты латексные кольца) подводится вплотную к вене,
включается отсос, и участок вены всасывается внутрь трубки. Всасывание
должно проводиться до превращения поля зрения в «красное пятно» (рис.
С помощью специального приспособления одно из колец сбрасывается с гильзы, пережимая варикозно расширенную вену. Кольца накладываются последовательно на каждый венозный ствол, начиная с гаст- ро-эзофагиального соединения, а затем в проксимальном направлении по спирали. За один сеанс может быть наложено от 6 до 10 колец.
4.3.2. Эндоскопическое бужирование стриктур пищевода, желудка, бужирование стриктур анастомозов
Рубцовые сужения пищевода (РСП), развившиеся в результате химических ожогов, относятся к числу тяжелых осложнений, при- водящих к значительным нарушениям гомеостазиса больных, выражающегося в расстройствах водно-электролитного, жирового, белкового, витаминного и других балансов и заканчивающихся нередко алиментарной дистрофией.
Эндоскопическая техника бужирования рубцовых сужений пищевода стала возможной с внедрением в клиническую практику спе- циальных рентгенконтрастных полых бужей и металлических проводников. Использование данной методики позволило значительно уменьшить риск возникновения перфорации стенки пищевода, повышая при этом эффективность самой процедуры.
Показания для бужирования РСП с использованием гибкого проводника
Протяженные РСП, осложненные:
- сложным ходом канала;
- множественностью сужений;
- максимальной степенью сужения (менее
- эксцентричным расположением просвета.
Противопоказания для бужирования РСП
К абсолютным противопоказаниям для бужирования РСП следует отнести:
- пищеводно-трахеальные, пищеводно-бронхиальные свищи;
- перфорацию пищевода;
- тяжелое септическое состояние;
- кровотечения.
Ошибочным следует считать (относительные противопоказания) бужирование в период нарастания клинических проявлений и развития эзофагита, медиастинита.
Методика выполнения процедуры
Плавно извлекая эндоскоп из желудка, пищевода и одновременно продвигая струну-направитель вниз по инструментальному каналу, под контролем зрения металлическая струна устанавливается в антральном отделе желудка и затем, после извлечения аппарата, фиксируется у загубника ассистентом. По установленной струне-направителю выполняется бужирование.
При протяженных, множественных сужениях, со сложным рубцово-измененным ходом и наличии псевдодивертикулов проведение бужирования состоит из следующих этапов.
1. Проведение по инструментальному каналу эндоскопа гибкого проводника-струны диаметром
2. После введения струны в желудок эндоскоп извлекается.
3. Далее проводится бужирование по струне-направителю полыми, рентгенконтрастными бужами.
Для придания большей эластичности и облегчения введения в ротоглотку и устье пищевода кончик бужа (10-15 см) предварительно разогревается в горячей воде, за исключением тонких бужей (? 14-22), так как они теряют упругость. Для улучшения скольжения поверхность бужей смазывается растительным маслом или 2% гелем лидокаина.
Бужирование следует начинать с проведения бужа диаметром, не превышающим размер наиболее суженного участка, установленного по рентгенограммам, или с наименьшего бужа, в случае недостаточ- ной информативности рентгенологического исследования.
Буж по струне-направителю проводят в желудок, оценивая степень сопротивление тканей. Если выбранный буж проведен в желудок свободно, то в зависимости от опыта врача последующий буж можно применить на 2-3 номера больше, что сократит травматизацию и длительность болезненных ощущений для пациента. За один сеанс применяется от 2 до 3 бужей.
Время нахождения бужа в пищеводе составляет в среднем 1-2 мин. Буж максимального диаметра рекомендуется оставлять в просвете пищевода на 5-10 мин.
В тех случаях когда возникают подозрения на наличие осложнений или появляются жалобы, не типичные для обычного бужирования, выполняется контрольное эндоскопическое исследование. После расширения просвета пищевода бужами ? 34-40 появляется возможность выполнить диагностическую ЭГДС для оценки состояния слизистой оболочки всего верхнего отдела пищеварительного тракта. На фоне поддерживающего бужирования ЭГДС контроль достаточно осуществлять 1 раз на 3-4 бужирования в течение всего периода лечения при отсутствии особых показаний. Для максимального расширения пищевода (бужи ? 38-40) обычно проводится 5-8 сеансов с интервалом в 1-3 дня. Перерывы между бужированиями необходимы для уменьшения проявлений эзофагита. При возникновении эзофагоспазма не следует с усилием проводить бужи, удобнее и безопаснее осуществлять бужирование на фоне глотательных движений. При выраженном болевом синдроме, продолжающемся спазме от дальнейших манипуляций следует временно воздержаться.
Морфологическое исследование тканей из области стриктуры необходимо проводить при рецидиве РСП, возникшем через длительный срок после окончания лечения, так как в этих случаях велик риск развития злокачественных опухолей.
4.3.3. Электроэксцизия (фотокоагуляция) доброкачественных новообразований (полипов) пищевода, желудка
Согласно классификации ВОЗ к доброкачественным полиповидным образованиям желудка относятся патологические образования,
возвышающиеся над слизистой оболочкой. Чаще это могут быть воспалительные, гиперпластические или аденоматозные полипы, гамартомы, гетеротопии и др. Операцией выбора при данном виде патологии остается эндоскопическая полипэктомия, позволяющая удалить патологический очаг, сохранив при этом анатомическое и функциональное состояние оперированного органа.
Показания к эндоскопической полипэктомии:
1) единичные и множественные полипы, имеющие диаметр у основания не более
2) аденоматозные полипы, подтвержденные гистологически;
3) кровоточащие полипы;
4) полипы, ущемленные в кардиальном жоме либо привратнике.
Противопоказания к эндоскопической полипэктомии:
1) полипы на широком основании - более
2) гнездно расположенные полипы, ближе чем на
3) нарушения свертывающей системы крови;
4) тяжелое общее состояние больного;
5) воспалительные заболевания ротоглотки.
Подготовка больного
Амбулаторное обследование больных включает: определение группы крови и резус-фактора, исследование свертывающей системы крови, общий анализ крови и мочи, ЭКГ, флюорографию.
Аппаратура и инструменты
Для эндоскопического удаления полипов используют фиброэндоскопы, электрохирургический блок или хирургический (высокоэнергетический) лазер, диатермические петли для отсечения полипов, кварцевые световоды для проведения фотокоагуляции, щипцы для «горячей биопсии».
Методика выполнения эндоскопической полипэктомии
Эндоскопическое удаление полипов следует производить в условиях хирургического стационара с тем, чтобы вовремя диагностировать осложнения, которые могут возникнуть в послеоперационном периоде.
В настоящее время используют следующие методы эндоскопической полипэктомии.
Электрокоагуляция. Электрокоагуляция применяется для удаления полипов небольших размеров на широком (но не более
основании. Одним из условий полипэктомии методом электрокоагуляции является обязательное предварительное гистологическое исследование структуры подлежащего удалению полипа. Суть метода заключается в том, что полип по частям захватывается щипцами для горячей биопсии. После каждого захвата на бранши щипцов подается ток высокой частоты в режиме «коагуляции» экспозицией 2-3 с. Происходит постепенное сжигание полипа. На его месте остается посткоагуляционный дефект. При удалении полипов методом электрокоагуляции посткоагуляционный дефект всегда должен быть несколько больше основания полипа - это условие радикальности полипэктомии.
Электроэксцизия. Через инструментальный канал эндоскопа вводится диатермическая петля, набрасывается на полип и низводится к его основанию так, чтобы не захватить стенку желудка. Петлю медленно затягивают, при этом происходит ишемизация тканей полипа и тромбоз сосудов его ножки. После затягивания полип на петле приподнимается над слизистой оболочкой, а на петлю подается ток высокой частоты.
Начинать эксцизию следует в режиме «коагуляция», после чего включается «смешанный» режим (автоматическое чередование резания и коагуляции). После отсечения полипа тщательно осматривается его ложе на случай возможного кровотечения. Убедившись, что гемостаз надежен, отсеченный полип извлекается. Полип можно извлечь с помощью той же диатермической петли, захватов типа «корзинка», трехстворчатых щипцов. Извлеченный полип направляется на морфологическое исследование. Для профилактики кровотечения и ускорения регенерации на участок посткоагуляционного некроза целесообразно нанести клеевую аппликацию МК-8 в объеме 2-4 мл.
Фотокоагуляция. Эндоскопическая полипэктомия методом лазерной фотокоагуляции используется сравнительно недавно. Преимуществом метода является надежность гемостаза и быстрая регенерация (без рубца) зоны фотокоагуляционного некроза. К недостаткам можно отнести невозможность послеоперационного гистологического исследования удаленного полипа. Поэтому, как и в случае использования электрокоагуляции, обязательно предварительное гистологическое исследование структуры подлежащего удалению полипа.
Для фотокоагуляции полипов используют три параметра мощности: 20, 30 и 60 Вт.
Послеоперационное ведение. В ближайшие часы после эндоскопической полипэктомии больному показан постельный режим. Прием пищи в день полипэктомии не разрешается. В дальнейшем назначается стол ? 1. Первое контрольное исследование проводится через 7-9 дней, повторное - через 6 мес.
4.3.4. Лечение длительно не рубцующихся язв желудка и двенадцатиперстной кишки
В настоящее время накоплен богатейший арсенал всевозможных оригинальных методик, позволяющих с помощью эндоскопического оборудования напрямую воздействовать на язвенный дефект и окружающие его ткани различными лечебными факторами. По способам и механизму воздействия их можно условно разделить на 5 основных групп: механические, химические, физические, медикаментозные и сочетанные (табл. 1).
Таблица 1. Способы и механизмы воздействия лечебных факторов
? | Способ воздействия | Механизм воздействия |
1 | Механический | а) скусывание нависающих, омозолелых краев язвенного дефекта б) механическая очистка (гидропрепаровка) дна язвы от некротических тканей |
2 | Химический | а) прижигание (химическая коагуляция) б) биостимуляция |
3 4 | Физический | а) диатермокоагуляция б) холодовое (криогенное) воздействие в) лучевое воздействие (лазер, некогерентный красный свет) г) ультразвуковое воздействие д) гальванизация (электрофорез) |
Медикаментозный | а) орошение б) нанесение пленкообразующих препаратов в) периульцелярные инъекции г) спирт-новокаиновые блокады д) озонотерапия е) NO-терапия | |
5 | Сочетанный | а) озонотерапия с клеевыми аппликациями б) орошение хлорэтилом в) эндогастральный ультрафонофорез г) внутриполостной лекарственный электрофорез д) сочетанная электролучевая терапия |
Механическое воздействие преследует две основные задачи:
- очищение язвенного дефекта от детрита некротических тканей, замедляющих процессы регенерации;
- одновременный забор тканей на гистологическое и цитологическое исследования (своевременный контроль озлокачествления язв желудочной локализации).
Основные приемы:
а) скусывание с помощью фарцепта омозолелых или нависающих краев язвы, удаление фиброзной и хрящевидной тканей, мешающих процессам регенерации и восстановления нормальной архитектоники всех слоев слизистой оболочки желудка;
б) очищение язвенного дефекта от фибрина и некротических тканей с помощью цитологической щетки;
в) гидропрепаровка - промывание язвы струей физиологического раствора или растворами антисептиков.
Химическое воздействие на язвенный дефект препаратами, стимулирующими процессы регенерации, подавляющими микрофлору в области язвенного дефекта, уменьшающими процессы воспаления в зоне патологического очага. К ним относятся: 30-96% этанол, сок каланхоэ, 1% раствор танина, 1% раствор протаргола или колларгола, спиртовая настойка прополиса, 5-10% раствор димексида и др.
Медикаментозное воздействие включает:
а) нанесение аппликаций из пленкообразующих препаратов типа клей МК-6, МК-7, МК-8; МИРК, лифузоль, статизоль, гастрозоль и др., предохраняющих язвенный дефект от повреждающего воздействия желудочного сока;
б) орошение язвенного дефекта препаратами, обладающими цитопротективными свойствами: масло облепихи, шиповника, нанесение пенообразующих препаратов олазоль, гипозоль, аппликации аутогенного криопреципитата, плазана;
в) периульцелярные инъекции репарантов - солкосерил, актовегин, даларгин, аскорбиновая кислота, метиленовый синий и др., введение в дно и по краям язвы аллопланта;
г) медикаментозная денервация вагуса (спирт-новокаиновые блокады): зон кардиоэзофагеального перехода, малой кривизны и/или препилорического отдела желудка;
д) залуковичные новокаиновые блокады. Физическое воздействие включает:
а) криовоздействие с помощью специального зонда;
б) использование озона, озонированных растворов и масел для эндогастрального воздействия на язвенный дефект;
в) эндогастральная инсуфляция оксида азота (NO) с помощью аппарата «Плазон»;
г) использование низкоинтенсивного лазерного излучения (НИЛИ) гелий-неоновым лазером (ГНЛ) длиной волны 0,63-0,69 мкм и мощностью на конце световода 5-35 мВт с экспозицией 1-30 мин;
д) воздействие высокоинтенсивным (ВИЛИ) аргоновым лазером, работающим в сине-зеленом диапазоне спектра излучения, длиной волны 0,48-0,51 мкм, мощностью 1-10 Вт в постоянном режиме генерации;
е) использование ВИЛИ лазера на парах меди дихроматического воздействия: длина волн 0,51-0,58 мкм, квазинепрерывный режим генерации частотой 12 кГц, средняя мощность на конце световода 600-1000 мВт с экспозицией 10 с.
Сочетанные способы воздействия:
а) физический и медикаментозный - воздействие на язвенный дефект хлорэтилом;
б) озонотерапия в сочетании с аппликациями антибиотико-клеевой композиционной массы;
в) трансэндоскопическое эндогастральное ультразвуковое воздействие на язвенный дефект через масло шиповника с помощью специального зонда;
г) внутриорганный (внутрижелудочный) электрофорез геля актовегина;
д) локальный контактный внутриполостной лекарственный электрофорез композицией лекарственных препаратов;
е) электролучевая терапия (локальный контактный внутриполостной лекарственный электрофорез + НИЛИ) и др.
По точке приложения лечебных факторов и клиническому эффекту методы можно условно разделить на местные, региональные и системные.
К местным лечебным факторам относятся: механический - скусывание краев язвенного дефекта фарцептом; химический - орошение язвы прижигающими растворами; медикаментозный - пломбировка язвенного дефекта, периульцелярные инъекции; физический - лазерное облучение; сочетанный - локальный электрофорез и фонофорез. Патогенетической основой методов являются: очищение язвенного дефекта от некротических тканей и остатков пищевых масс, рецеп-
торная блокада болевых импульсов, стимуляция репаративных процессов и процессов ангиогенеза, подавление микрофлоры в зоне патологического очага, защита раневой поверхности от внешней агрессивной среды и др.
К региональным лечебным факторам относят физический (использование озона и озонированных растворов, эндогастральные инсуфляции оксида азота) и медикаментозный (этаноловая денервация вагуса) лечебные факторы, преследующие цели: стимуляции репаративных процессов, улучшения трофики тканей, усиления эффекта эрадикации НР, подавления желудочной кислотопродукции и др.
К системным лечебным факторам можно отнести нейрорефлекторный механизм воздействия (применение капиллярного гастроинтестинального зонда для питания) с целью ликвидации болевого синд- рома и восстановления гастродуоденальной моторики и др.
4.3.5. Некоторые частные методики местного (эндоскопического) лечения гастродуоденальных язв
Очищение язвенного дефекта от некротических тканей и остатков пищевых масс с помощью цитологических щеток или путем промывания (гидропрепаровки) язвенной ниши физиологическим раствором (либо другими растворами антисептиков). При глубоких язвах с подрытыми нависающими краями, фиброзно-измененными тканями края иссекаются (скусываются) большими биопсийными щипцами, придав аяей конусовидную форму. В случае подтекания крови целесообразно чередовать скусывание с электрокоагуляцией.
Весь материал, получаемый в результате скусывания краев язвы, необходимо направлять на гистологическое исследование.
Орошение язвенного дефекта препаратами, обладающими прижигающим, стимулирующим и цитопротективным действием, подавляющими микрофлору в области патологического очага, уменьшающими процессы перифокального воспаления. К ним относятся 30-96% этанол, сок каланхоэ, 1% раствор танина, 1% раствор протаргола или колларгола, спиртовая настойка прополиса, масло облепихи, шиповника, олазоль и др.
Масляно-клеевые аппликации: клей МК-6, МК-7, МК-8 по 1 мл + 2,0 мл масла шиповника или облепихи.
Нанесение на язвенный дефект пленкообразующих препаратов (лифузоль, статизоль, гастрозоль), предохраняющих язвенный дефект
от повреждающего действия желудочного сока (воздействие производится с помощью хлорвинилового катетера и специальных переходников, адаптированных к аэрозольным баллонам).
Лечебные гастроскопии с использованием аутогенного криопреципитата (Агаджанян В.В., Губин А.Л., Заикин С.И., Кузьмичева Е.Н., Горчакова Т.Л., Кравченко А.И., 2002) выполняли больным с дуоденальными язвами, резистентными к традиционной терапии (отсутствие лечебного эффекта от консервативной терапии на протяжении 3 нед). Аутогенный криопреципитат получали из плазмы больных (100 мл) путем добавления в нее 10-30 МЕ/мл гепарина и инкубации в течение 12 ч при температуре 20 ?С. Образующийся осадок содержал более 80% плазменного фибронектина, что составляло 1-1,5 мг/мл. Полученный преципитат наносили на язвенный дефект дуоденальных язв во время ЭГДС. По мнению авторов, правомочно предположение, что искусственное локальное повышение количества фибронектина в участках поврежденной слизистой будет способствовать развитию грануляционной ткани и эпителизации. В пользу такого предположения свидетельствуют данные о том, что рост эндотелия сосудов, а также миграция фибробластов, макрофагов происходит по градиенту концентрации фибронектина. Эпителизация дуоденальных язв (стадия «красного рубца»), по мнению авторов, наступает уже на 8-10-е сут от начала лечения, а среднее количество лечебных сеансов составило 4 на курс лечения.
Применение аллогенного препарата «ПЛАЗАН» из плаценты человека при лечении язвенной болезни желудка и двенадцатиперстной кишки (ГКБ ?
Препарат рекомендуется при язвенной болезни желудка и двенадцатиперстной кишки, эрозиях и травматических повреждениях слизистой оболочки желудочно-кишечного тракта. Для лечения болезни «ПЛАЗАН» в количестве 5-10 мл через фторопластовый катетер наносится на язвенный дефект и окружающие ткани с предварительной очисткой щеткой дна язвы от налета фибрина. После процедуры больному запрещается прием пищи в течение 2 ч. Специалисты отмечают высокий терапевтический эффект от использования препарата.
Периульцелярные инъекции репарантов и цитопротекторов
Тимен Л.Я., Черепанин А.И., Стоногин С.В. (ГКБ ?
Субмукозное введение препаратов проводится методом ползучего инфильтрата, средней терапевтической дозой 20-100 мл. Рецепторная блокада болевых импульсов, восстановление энергообеспечения и стимуляция репаративных процессов в зоне язвы составляют патогенетическую основу предлагаемого метода.
Периульцелярные инъекции аллопланта.
Иванова Н.А., Подшивалов В.Ю., Совцов С.А., 2002 (БСМП, г. Челябинск) в качестве метода местного эндоскопического лечения больших и гигантских, длительно не рубцующихся язв, используют инъекции алло- планта в периульцелярную зону. Препараты серии Аллоплант разработаны во Всероссийском центре глазной и пластической хирургии г. Уфы и представляют собой соединительнотканные биоматериалы, полученные из тканей человека. Аллоплант, являясь стимулятором репаративных процессов, вводится с помощью эндоскопического инъектора в периульцелярную зону в 3-4 точки по 0,5-1 мл в каждую.
В результате экспериментальных исследований установлено снижение сроков заживления язв на 5-7 дней в сравнении с другими методами лечения.
Залуковичные новокаиновые блокады (Короткевич А.Г., 2000).
С целью купирования болевого синдрома и улучшения микроциркуляции в зоне патологического очага (при дуоденальной локализации язв) проводятся залуковичные блокады: подслизистое введение по игле-инъектору в область второй циркулярной складки постбульбарного отдела 5-10 мл 0,5% раствора новокаина или 1% раствора лидокаина.
Медикаментозная денервация вагуса (спирт-новокаиновые блокады) желудочных ветвей блуждающего нерва (Баунов В.А., Введенский В.П., Шакола А.К., 2002) путем введения по игле-инъектору в подслизистый слой кардиоэзофагеального перехода смеси, состоящей из 2,0 мл 0,1% раствора атропина + 50,0 мл 0,5% раствора новокаина + 5,0 мл 96? спирта, до появления циркулярного инфильтрата. Через отдельные вколы по игле-инъектору субмукозно вводится смесь 20,0 мл 30? спирта и 20,0 мл 1% раствора новокаина вокруг привратника, по
малой кривизне желудка и в области кардиоэзофагеального перехода по 2,0 мл на каждый вкол.
Использование низкоэнергетических лазеров. (Нагаллер А.М., 1984; Брискин Б.С. и соавт., 1986; Кошелев В.Н. и соавт., 1988).
Используют ГНЛ лазеры ЛГ-75, УЛФ-01, ЛЮЗАР и др. длиной волны 0,63-0,69 мкм, мощностью 25-35 мВт. Плотность мощности излучения на выходе 2-8 мВт/см2. Воздействие проводится с помощью кварцевого волоконного световода с полимерной отражающей оболочкой проведенного через инструментальный канал эндоскопа с расстояния 1-5 см, время экспозиции - 2-5 мин. Сеансы воздействия проводятся 1 раз в 3-4 дня, курс лечения эндогастральной лазеротерапии (ЭЛТ) - 3-5 сеансов.
Использование высокоэнергетических лазеров (Матюшичев В.Б. с соавт., 1987; Солдатов А.И., 2000 и др.).
Фотообработку язвенных дефектов двенадцатиперстной кишки проводили светом лазера на парах меди ИЛГИ-101 бихроматического воздействия: длина волн - 0,51-0,58 мкм, квазинепрерывный режим генерации частотой 12 кГц, мощность на конце световода - 600 мВт. Длительность воздействия - 10 с и разовой дозой 6 Дж. Воздействие проводится 1 раз в 3-4 дня. Курс лечения - 3-5 сеансов.
Внутриорганный (внутрижелудочный) электрофорез геля актовегина в лечении больных с хроническими гастродуоденальными язвами. Лях М.О., 2002, после орошения язв желудка или двенадцатиперстной кишки гелем актовегина (с помощью хлорвинилового катетера, проведенного через инструментальный канал эндоскопа) осуществил гальванизацию области желудка по стандартной методике (в накожной проекции язвы). Использование актовегина на гелеевой основе обус- ловливает (по мнению автора) значительную дисперсность и быструю усваиваемость лекарственного препарата, его обволакивающий защитный эффект, способность «прилипать» к слизистой оболочке на время, достаточное для проведения гальванизации. Гальванизация в накожной проекции язвы после орошения ее гелем актовегина наряду с собственным лечебным эффектом позволяла ускорить введение лекарственных веществ и создать депо препарата в слизистой оболочке проекции язвы.
Нейрорефлекторный механизм воздействия. Тимен Л.Я., Черепанин А.И., Стоногин С.В., 2001, представили концепцию патогенетической терапии язвенной болезни, основанную на нейрорефлекторном механизме купирования болей и ликвидации мотор- но-эвакуаторных нарушений, постановкой капиллярного гастроин-
тестинального
зонда, уложенного в виде петель на рефлексогенные зоны, ответственные
за моторную деятельность желудочно-кишеч- ного тракта. То есть там, где
расположены водители ритма и интрамуральные нервные сплетения: в
субкардиально-фундальном и антропилорическом отделах желудка, в области
Фатерова соска и связки Трейтца (рис.
Для обоснования патогенетической терапии язвенной болезни авторы акцентируют внимание клиницистов на значении моторно-эвакуационных расстройств и болевого фактора в патогенезе язвенной болезни.
Особенности сосудистой архитектоники слизистой оболочки желудка заключаются в том, что при пустом желудке мелкие артерии, артериолы и капилляры имеют вид завитков, спиралей и клубочков, вызывающих сопротивление кровотоку. Во время пищеварительной фазы желудок растягивается, артериальные сосуды распрямляются, и кровенаполнение слизистой оболочки возрастает. Изучение моторики желудочно-кишечного тракта позволило установить, что межпищеварительные, мигрирующие в каудальном направлении сокращения значительно превосходят сокращения во время пищеварения, и выделить 4 фазы межпищеварительной активности желудка и двенадцатиперстной кишки: I - покоя, II - нерегулярных сокращений, III - сильных сокращений и IV - нерегулярных сокращений, предшествующих фазе покоя. При язвенной болезни фаза покоя отсутствует, а дискоординированная хаотичная перистальтика и сокращения пустого («голодного») желудка значительно ухудшают местное кровообращение, в том числе и в зоне язвы. В результате моторной дискинезии, непрерывных сокращений собственного мышечного слоя и мышечной пластинки слизистой оболочки происходит постоянное растяжение краев язвенного дефекта, что вызывает боль, ухудшение микроциркуляции и препятствия репаративной регенерации.
Представляется логичным, что болевой синдром, моторно-эвакуаторные нарушения и сосудистый фактор играют ведущую роль в патогенезе язвенной болезни, поддерживают и усугубляют развитие местных деструктивных изменений.
4.3.6. Обоснование эффективности методов местного лечения
Как видно из представленного материала, эндоскопические методы, применяемые для лечения гастродуоденальных язв, могут существенно отличаться друг от друга как по механизму и способам воздей- ствия, так и по точке приложения лечебных факторов.
Сравнение предлагаемых методов по эффективности или экономической целесообразности считаем некорректным, так как каждому методу свойственны свои показания и противопоказания, у каждого имеются сильные и слабые стороны. Кроме того, большинство из представленных методик чаще используются комплексно в сочетании с другими методами, например:
1-й этап. Скусывание нависающих краев язвы, очищение (промывание) язвенного дефекта растворами антисептиков (механическое и химическое воздействие);
2-й этап. Периульцелярные инъекции репарантов, анестетиков, спазмолитиков (медикаментозное воздействие);
3-й этап. Орошение язвы и окружающей слизистой хлорэтилом (физическое воздействие);
4-й этап. Клеевые аппликации, пломбировка язвенного дефекта средствами, обладающими цитопротекторным действием (медика- ментозное воздействие).
Нетрудно представить, что количество комбинаций (сочетание методов, действующих на разные звенья патологического процесса) может быть очень большим. Очевидно, что в каждом конкретном случае необходимо учитывать три основных фактора:
- характеристики больного (возраст, пол, длительность язвенного анамнеза, наследственная отягощенность, сопутствующая патология и, наконец, желание пациента лечиться предлагаемыми ему методами);
- состояние самого морфологического субстрата язвы (локализация, размеры, глубина, одиночные/множественные, острые/ хронические, наличие/отсутствие осложнений и т. д.);
- квалификация врача, материально-техническое оснащение лечебного учреждения (наличие/отсутствие необходимого оборудования, медикаментов), опыт владения теми или иными способами лечения.
4.4. ЛОКАЛЬНЫЙ КОНТАКТНЫЙ ВНУТРИПОЛОСТНОЙ ЛЕКАРСТВЕННЫЙ ЭЛЕКТРОФОРЕЗ
На кафедре госпитальной хирургии Ханты-Мансийского государственного медицинского института и отделения эндоскопии ОКБ г. Ханты-Мансийска коллективом авторов разработаны, апробиро-
ваны и внедрены в клиническую практику ряд новых устройств и методик проведения внутриполостных (эндогастральных) форм лекарственного электрофореза в комплексном лечении больных с хроническими гастродуоденальными язвами.
Процесс начался с создания в
Разработанная методика позволяет, минуя кожный барьер (дерматопарамибно), воздействовать на язвенный дефект различными лечебными факторами: механическим, химическим, физическим и медикаментозным, суммируя и потенцируя лечебный эффект каждого из них.
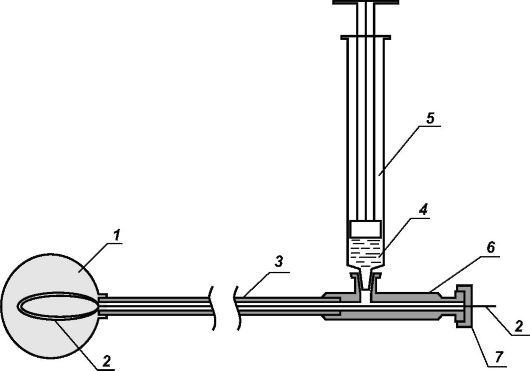
Рис. 16. Схема электрода:
1 - контактный элемент; 2 - металлический электропровод (концевой участок провода выполнен в виде петли); 3 - хлорвиниловый катетер; 4 - лекарственное вещество (электролит); 5 - шприц; 6 - коннектор; 7 - резиновая заглушка
Аппаратура и общие указания по выполнению процедур
Стандартный набор эндоскопического оборудования включает:
- эндоскопы фирмы OLYMPUS GIF-Q140, GIF-XQ140, GIF Q20, GIF К20;
- гальванический аппарат ПОТОК-1;
- электрод для контактной электротерапии полых органов. Отбор больных для внутриполостной электротерапии осуществля- ется врачом-эндоскопистом, выполнявшим диагностическое исследование.
П р и м е ч а н и е. Всем больным перед началом лечения проводится морфологическое исследование субстрата и окружающих тканей на предмет атипии и наличия Helicobacter pylori.
Обязательными условиями для успешного проведения лечения считаем:
а) госпитализацию больного в отделение гастроэнтерологического профиля по типу дневного стационара;
б) лечение должно проводиться на фоне традиционной противоязвенной терапии с соблюдением режима питания и отдыха.
Лечение проводится натощак утром. Накануне - легкий ужин, не позднее 20 ч.
Иногда больным с лабильной психикой лечение проводится на фоне предварительного в/в введения 10 мг реланиума и 0,5-1 мл 0,1% раствора атропина.
Показания: язвенная болезнь желудка и двенадцатиперстной кишки с непрерывно рецидивирующим течением, стойким болевым синдромом.
Абсолютные противопоказания: язвы, угрожаемые кровотечением, малигнизацией, перфорацией.
Относительные противопоказания: хронические каллезные язвы желудка на фоне дисплазии I-II степени, язвы, подозрительные на пенетрацию, дуоденальные язвы на фоне субкомпенсированного стеноза привратника.
Описание методики выполнения локального контактного внутриполостного лекарственного электрофореза
Перед началом лечения электрод катетер (3) в разобранном состоянии (отсоединяются детали 5, 6, 7) с помощью катетера-проводника (на рисунке не изображен) ретроградно вводится в инструментальный канал эндоскопа (8, 9, 10) через дистальный конец до появления
в проксимальной части канала. Электрод подтягивается так, чтобы контактный элемент (1) соприкасался с дистальным концом эндоскопа. Электрод вновь собирается (присоединяются детали 6, 5, 7)
(рис. 17).
Металлический провод электрода соединяется с одноименным вводимому иону (4) полюсом аппарата гальванизации (11). Пассивный электрод (свинцовая пластина S 150-200 см2) (12) через гидрофиль- ную прокладку (13) с помощью эластического бинта крепится на эпигастральную область больного (14) и соединяется с противоположным полюсом аппарата гальванизации. После введения аппарата вместе с электродом в полость желудка (15) и обнаружения патологического очага осуществляется прицельный локальный контактный внутриполостной лекарственный электрофорез непосредственно на патологический субстрат язву (16).
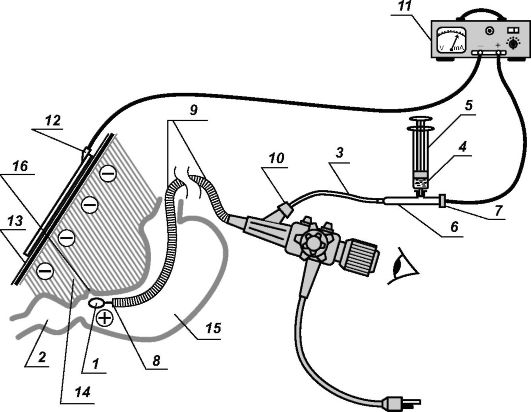
Рис. 17. Схема проведения методики ЛОК-Э/ф. Обозначения в тексте
Используются комбинации лекарственных препаратов (1-5% растворы):
- ферменты ЛИДАЗА, ТРИПСИН, ХИМОТРИПСИН, ускоряющие процессы аутолиза и способствующие очищению язвенного дефекта от некротических тканей и детрита;
- местные анестетики ЛИДОКАИН, НОВОКАИН, устраняющие болевой синдром, снимающие спазм прекапиллярных сфинктеров, улучшая при этом микроциркуляцию в ишемизированных тканях;
- аминокислоты МЕТИОНИН и витамины С, В1, принимающие участие в синтезе и построении белков;
- димексид (ДМСО) 5% раствор как универсальный растворитель для всех используемых лекарственных препаратов.
Электрофорез осуществляется в режиме 2-3 мА на 1 см2, продолжительностью 6-10 мин. В результате дозированной подачи количество вводимого лекарственного препарата (электролита) не превышает 20-30 мл.
Под влиянием постоянного электрического тока и вводимых с его помощью лекарственных препаратов улучшаются крово- и лимфообращение, трофические, обменные и регенераторные процессы, заметно повышается иммунологическая реактивность организма.
Противовоспалительное
действие гальванического тока определяется увеличением фагоцитарной
активности лейкоцитов, стимулированием ретикулоэндотелиальной системы,
повышением активности гуморальных факторов неспецифического иммунитета
(рис.
С
помощью устройства и методики локального контактного внутриполостного
лекарственного электрофореза на базе отделения эндоскопии ОКБ г.
Ханты-Мансийска начиная с
Получены хорошие клинические результаты в виде сокращения сроков рубцевания гастродуоденальных язв (в 1,5-2 раза по сравнению со среднестатистическими), улучшения качества формирующихся на месте язвы рубцов, снижения процента осложнений и рецидивов в отдаленном периоде (4-5% рецидивов в год).
К положительным характеристикам методики ЛОК-Э/ф следует отнести:
• возможность использования сразу нескольких лечебных факторов: механического, химического, физического и медикаментозного (дополняющих и потенцирующих друг друга, воздействующих на разные звенья патологического процесса);
• проведение манипуляций не требует специальной подготовки врача (эндоскописта), так как техника введения аппарата, «заряженного» электродом, не отличается от дуоденоскопии, проводимой аппаратами с боковой оптикой;
• использование устройства возможно во всех ЛПУ, где имеется базовый набор эндоскопического и физиотерапевтического оборудования;
• используемое устройство (электрод) имеет низкую себестоимость, является одноразовым, стерильным.
4.5. СОЧЕТАННАЯ ЭЛЕКТРОЛУЧЕВАЯ ТЕРАПИЯ (СЭТ) В ЛЕЧЕНИИ ДУОДЕНАЛЬНЫХ ЯЗВ
С
целью повышения эффективности эндоскопических методов лечения
хронических гастродуоденальных язв на кафедре госпитальной хирургии
ХМГМИ и отделения эндоскопии ОКБ г. ХантыМансийска начиная с
Конструктивной особенностью данного устройства является гибкий, моноволоконный кварцевый световод, проходящий внутри по всей длине электрода. Излучающая поверхность дистального конца волокна, выполненная в виде светопреломляющей «бусинки», способствует преломлению и более равномерному распределению светового излучения. В дистальном конце электрода располагается коннектор с двумя (тремя) входами, представляющий съемную конструкцию, соединяющую и разъединяющую основные звенья электрода (катетер, моноволоконный световод, электропровод и канюлю со шприцем для подведения лекарственных препаратов - электролита).
Легкое, прочное, съемное и герметичное соединение коннектора с катетером и основными несущими элементами электрода является необходимым условием для беспрепятственного ретроградного проведения электрода через инструментальный канал эндоскопа.
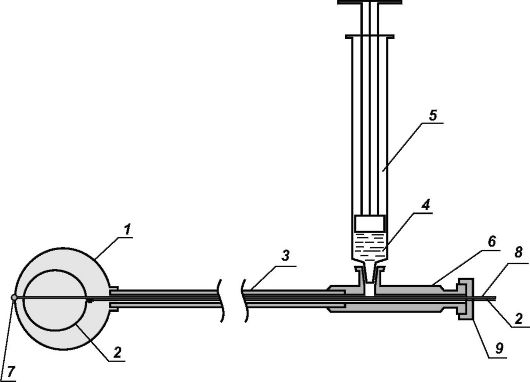
Рис. 19. Электрод для сочетанной электролучевой терапии: 1 - контактный элемент; 2 - металлический провод (концевой участок провода выполнен в виде петли); 3 - хлорвиниловый катетер; 4 - лекарственное вещество (электролит); 5 - шприц; 6 - коннектор; 7 - светопреломляющая «бусинка»; 8 - моноволоконный световод; 9 - резиновая заглушка
Описание устройства
Электрод содержит контактный элемент (1), выполненный в виде шаровидной головки из пористого, эластичного материала, металлический провод (2), располагающийся внутри контактного элемента, выполнен в виде петли с целью увеличения площади соприкосновения лекарственного вещества с электрическим током, поступающим от аппарата гальванизации (аппарат на чертеже не показан), далее металлический провод проходит по всей длине электрода внутри хлорвинилового катетера (3) и выходит через канюлю коннектора (6). Кроме того, по всей длине электрода внутри катетера проходит моноволоконный световод (8), заканчивающийся на активной поверхности контактного элемента, в виде светопреломляющей «бусинки» (7), дис- тальный конец катетера плотно соединен с контактным элементом, а проксимальный - с коннектором, путем разъемного, но герметичного соединения.
Хлорвиниловый катетер (3) наряду с выполнением функции доставки лекарственных веществ (4) с помощью шприца (5) на поверхность контактного элемента (1) играет еще и изолирующую функцию, предотвращая прямой контакт металлического провода (2) с окружающими тканями. Резиновые заглушки (9) на концевом участке коннектора (6) обеспечивают герметичность полостной системы электрода (рис. 19).
Аппаратура и общие указания по выполнению процедур
Стандартный набор эндоскопического оборудования включает:
- эндоскопы фирмы OLYMPUS GIF-Q140, GIF-XQ140, GIF Q20, GIF К20;
- аппарат для гальванизации и электрофореза ПОТОК-1;
- низкоэнергетический гелий-неоновый лазер «ЛЮЗАР»;
- электрод для проведения сочетанной электролучевой терапии. Отбор больных для лечения осуществляется врачом-эндоскопистом, выполнявшим диагностическое исследование.
1. Всем больным перед началом лечения выполняется морфологическое исследование субстрата и окружающих тканей на предмет атипии и наличия Helicobacter pylori.
2. Лечение проводится на фоне традиционной противоязвенной терапии с соблюдением режима питания и отдыха.
Показания
Язвенная болезнь желудка и двенадцатиперстной кишки с непрерывно рецидивирующим течением, стойким болевым синдромом.
Абсолютные противопоказания
Язвы, угрожаемые кровотечением, малигнизацией, перфорацией.
Относительные противопоказания
Хронические каллезные язвы желудка на фоне дисплазии I-II степени, язвы, подозрительные на пенетрацию, дуоденальные язвы на фоне субкомпенсированного стеноза привратника.
Описание методики проведения сочетанной электролучевой терапии (СЭТ)
Перед началом процедуры электрод разбирают: отсоединяют шприц (5), заполненный лекарственным веществом (4), и коннектор (6) с заглушками (7). Хлорвиниловый катетер (3) с размещенными в нем металлическим проводом и моноволоконным световодом (цифрами на чертеже не обозначены) ретроградно вводят в инструменталь-
ный канал (8) фиброгастроскопа (9) до появления в проксимальной части инструментального канала (10).
Хлорвиниловый катетер максимально подтягивается. После этого производят герметичное соединение коннектора с хлорвиниловым катетером так, чтобы металлический провод и моноволоконный све- товод прошли через раздельные каналы коннектора (можно использовать коннектор с двумя входами, тогда световод и электропровод пройдут через один выход, в этом случае понадобится лишь одна резиновая заглушка). К коннектору присоединяется шприц, заполненный лекарственными препаратами (электролитом).
Герметичность полостной системы электрода обеспечивают резиновые заглушки. После этого дистальный конец моноволоконного световода соединяют с выходом лазерного аппарата типа ГНЛ (17), а металлический провод к одной из клемм аппарата гальванизации ПОТОК-1 (11) с учетом полярности вводимых лекарственных веществ (при использовании аппарата РЕФТОН-01 ФЛС отдельный источник лазерного излучения не нужен). Свинцовая пластина (12), S = 120-160 см2, выполняющая роль пассивного электрода, через гидрофильную прокладку (13) крепится на эпигастральную область больного и с помощью электропровода соединяется с противоположным полюсом аппарата гальванизации.
В полость желудка больного (15) под постоянным визуальным контролем вводят фиброгастроскоп (9) с адаптированным к нему активным электродом. При обнаружении патологического очага (язвы) контактный элемент электрода плотно прижимается к язвенной нише (16), после чего осуществляется сеанс электролучевой терапии (рис. 20).
Адаптированный к инструментальному каналу фиброгастроскопа электрод делает процедуру введения эндоскопа в желудок безболезненной и безопасной. Постоянный визуальный контроль при продвижении аппарата позволяет точно подвести контактный элемент электрода к патологическому очагу. После соединения выходящих элементов электрода с аппаратами гальванизации и лазерного излучения осуществляется комбинированное воздействие на пораженный участок (эрозия, язва) лазерным излучением с одновременным проведением локального контактного внутриполостного лекарственного электрофореза.
Лекарственный электрофорез проводится в режиме 2-3 мА на 1 см2 продолжительностью 6-10 мин. Обычно используются те же
комбинации лекарственных препаратов, что и для ЛОК-Э/ф: ферменты, местные анестетики, аминокислоты и витамины, димек- сид*.
*Препараты вводятся в размерах, не превышающих средней терапевтической
дозы.
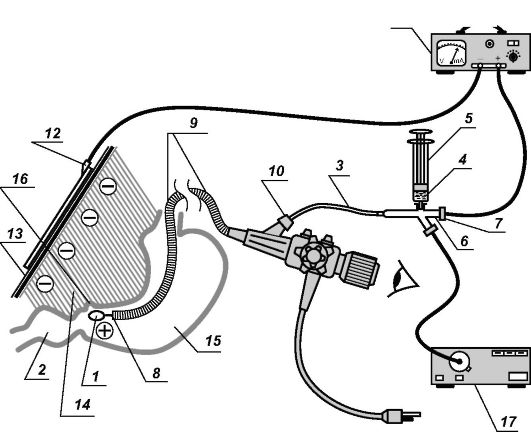
Рис. 20. Схема проведения методики (СЭТ). Описание в тексте
В результате дозированной подачи количество необходимого лекарственного вещества не превышает 20-30 мл.
Для лучевой терапии чаще использовали аппараты «ЛЮЗАР» и РЕФТОН-01 ФЛС, генерирующие видимый (красный) спектр излу- чения с длиной волны 0,63-0,69 мкм. Лазеры такого класса имеют небольшие значения выходной мощности (25-30 мВт).
Облучение лазером проводится при плотности потока, не превышающей 3-5 мВт/см2, и дозе облучения 1-2 Дж/см2. Продолжительность облучения - 4-6 мин (рис.
Методика сочетанной электролучевой терапии находится в стадии апробации и клинических испытаний. Но уже первые результаты показали высокую эффективность метода в комплексной терапии больных с хроническими, длительно не рубцующимися дуоденальными язвами.
4.6. ЭЗОФАГОГАСТРОДУОДЕНОСКОПИЯ ЭКСТРЕННАЯ
Показания:
- выявление причин, локализации, определение интенсивности кровотечений из верхних отделов желудочно-кишечного тракта, проведение эндоскопического гемостаза;
- дифференциальная диагностика между функциональными и органическими причинами гастродуоденальной непроходимости у больных в ближайшем послеоперационном периоде;
- обнаружение и извлечение инородных тел пищевода, желудка, двенадцатиперстной кишки.
Противопоказания
Противопоказания для проведения экстренной ЭГДС значительно сужены по сравнению с плановыми исследованиями. Экстренная гастроскопия, выполняемая зачастую по жизненным показаниям, может явиться единственным методом исследования, позволяющим определить не только истинную причину заболевания, но и способствовать выработке правильной тактики лечения, являясь одновременно эффективным компонентом лечебного воздействия (проведение эндоскопического гемостаза, извлечение инородных тел и др.). Так, абсолютными противопоказаниями для проведения экстренной ЭГДС следует считать заболевания, требующие проведения неотложных реанимационных мероприятий, таких как мерцательная тахиаритмия, агональное состояние больного, клиническая смерть. Сюда же относят ряд других заболеваний, при которых риск осложнений во время проведения исследования (например, на фоне перфорации пищевода с явлениями медиастинита, химического ожога пищевода в сроки 7-10 сут и др.) превышает ценность информации, которую можно получить во время исследования.
4.6.1. Эндоскопические методы гемостаза
Для проведения эндоскопических приемов гемостатической терапии используют различные методы, отличающиеся по своим физическим характеристикам и механизму действия. Подбор арсенала методов зависит от клинической результативности, а при равенстве показателей - эффективности, простоты выполнения, безопасности, доступности и надежности. Поэтому выбор конкретного метода или их комбинации зависит порой от технического оснащения лечебно-профилактического учреждения необходимым эндоскопическим оборудованием и инструментарием, опыта и квалификации врача-эндоскописта, выполняющего манипуляции, а также характеристики источника кровотечения, состояния больного и других факторов.
По способам воздействия на источник кровотечения методы эндоскопического гемостаза можно разделить на 3 основные группы (табл. 2).
Таблица 2. Методы эндоскопической остановки кровотечения
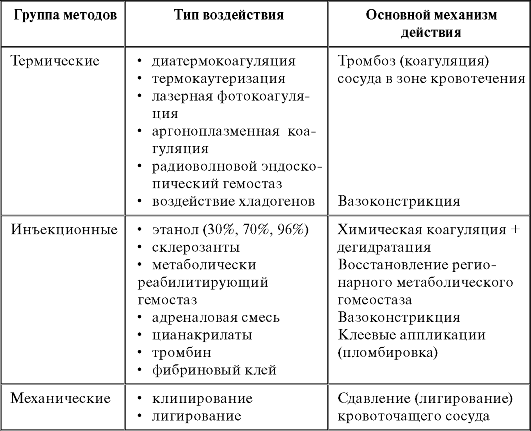
4.6.2. Термические методы воздействия
Диатермокоагуляция
Для электрокоагуляции чаще используются электроды моно-, би- и мультиполярной коагуляции, электрохирургические блоки высокой частоты (UES, PSD и др.).
При моноактивной диатермокоагуляции один электрод (пассивный) в виде широкой пластины крепится к наружной поверхности тела (бедро, голень), другой (активный) подводится через инструментальный канал эндоскопа к источнику кровотечения.
При биполярном и мультиполярном методе коагуляции все токонесущие элементы выведены на дистальный конец зонда, воздействие же тока осуществляется на ткани, расположенные в межэлектродном пространстве. При этом распространение тока вглубь субстрата исключается.
Запомни! Продолжительность непрерывной диатермокоагуляции не должна превышать 2-3 с (с целью предупреждения возможности перфорации органа), после чего оценивается эффект воздействия, при необходимости осуществляется прицельное промывание источника кровотечения. Затем можно вновь повторить коагуляцию короткими сериями.
Термокаутеризация (термокоагуляция)
Проводится с помощью блока HPU и термозондов CD-10Z, CD-20Z и др. Действующим началом термокаутеризации является разогреваемый свыше 100 ?С наконечник термозонда. Рабочая поверхность термозонда покрыта тефлоновым слоем, что предупреждает прикипание его к кровяному сгустку. Подаваемая под давлением струя жидкости одновременно охлаждает зонд и смывает с источника кровотечения накопившуюся кровь. Степень нагрева термозонда легко дозируется и регулируется, не вызывая глубоких ожогов.
Лазерная фотокоагуляция
Фотокоагулирующий эффект лазерного излучения как бесконтактного метода воздействия на кровоточащий сосуд обладает несомненными преимуществами по сравнению с электрокоагуляцией.
Goodale с соавт. в
лазер и волоконный кварцевый световод, проведенный через инструментальный канал эндоскопа. С этого времени началась эра широкого применения высокоэнергетических (интенсивных) лазеров (ВИЛИ) в эндоскопической хирургии желудочно-кишечного тракта, в том числе и для остановки язвенных кровотечений. Коагуляционное повреждение от лазерного воздействия, по данным гистологических исследований, не распространяется, как правило, глубже подслизистого слоя, что свидетельствует о довольно высокой безопасности метода.
Для эндоскопической остановки кровотечения используют три параметра мощности излучения: 20 Вт, 30 Вт и 60 Вт. Лазерное воздействие осуществляют кратковременными импульсами (1 с) общей продолжительностью 4-45 с. Эффективность гемостаза лазерной фотокоагуляции колеблется от 70-94% (Панцырев Ю.М. и соавт.,
2000).
Аргоноплазменная коагуляция
Аргоноплазменная коагуляция является электрохирургическим, монополярным, бесконтактным методом воздействия на биологические ткани высокочастотным током с помощью ионизированного и, как следствие, электропроводящего аргона - аргоновой плазмы.
Для выполнения
эндоскопической аргоноплазменной коагуляции через инструментальный
канал гастроскопа проводят специальный зонд-аппликатор с наружным
диаметром не менее
Радиоволновой эндоскопический гемостаз
В последнее время ряд авторов (Алексанян А.А., Гоголашвили Д.Г., 2004) для эндоскопического гемостаза кровотечений язвенного генеза используют радиоволновой метод с помощью аппарата «СУРГИТРОНТМ», основанный на высокочастотном радиоволновом воздействии на биологические ткани и образующемуся в результате теплу в самих тканях. Под воздействием радиоволн внут-
риклеточная жидкость «вскипает» и разрывает клеточную оболочку, образуя зону некроза. Для эндоскопической остановки кровотечения используют специальные электроды с цилиндрическим или шаровидным наконечником. Поверхностное прижигание осуществляется в режиме «фульгурации», при котором возникает искрение, что приводит к точечному ожогу кровоточащего сосуда. После первичной остановки кровотечения работа установки переводится на режим «коагуляции». Радиоволновая коагуляция сопровождается эффектом вскипания при отсутствии искрения. Производя смещение в шахматном порядке, обрабатывают всю язву. Формируется плотная коагуляционная пленка белого цвета.
По данным авторов, с помощью радиоволновой коагуляции удается добиться окончательного гемостаза у 96,7% пациентов (Чернеховская Н.Е. и соавт., 2004).
Воздействие хладогенов
Для
эндоскопической остановки кровотечения часто используется криогенное
воздействие различными средствами, преследующи- ми цель вызвать эффект
временной вазоконстрикции кровоточащего сосуда. Одновременно возможно
отмыть источник кровотечения (язву) от старой крови и рыхлых сгустков и
тромбов, подготовив ее к более радикальным методам воздействия.
Кушниренко О.Ю., Совцов С.А., Подшивалов В.Ю., Эрдман З.В. (2003) для
остановки язвенных кровотечений используют специальное устройство,
«низкотемпературный омыватель» (приоритетная справка 2001117413 от 5
июня
Устройство содержит термоизолированный сосуд с водой, охлажденной с помощью полупроводниковых термоэлектрических преобразователей до температуры 2-4 ?С. Вода из сосуда под большим давлением с помощью насоса через специальный переходник подается в полость органа через инструментальный канал эндоскопа, очищая при этом дно язвы и улучшая возможность поиска источника кровотечения.
С этой же целью многие авторы часто используют орошение кровоточащей язвы хлорэтилом с помощью зонда, проведенного через канал эндоскопа.
4.6.3. Инъекционные методы гемостаза
Инъекции этанола
Среди препаратов, применяемых для остановки желудочных кровотечений, наиболее часто используется этиловый спирт. Концентрация
и дозировка этилового спирта зависят от природы источника и характера кровотечения. Так, 30% этанол в объеме 4-6 мл вводится обычно по окружности язвы из разных точек при нечетко локализованном кровоточащем сосуде. Чистый (96,6%) спирт общим объемом 0,8 мл вводится обычно из 1-2 вколов непосредственно в кровоточащий сосуд (Панцырев Ю.М., Федоров Е.Д., 2001).
Инъекции склерозантов
С этой же целью ряд авторов предлагают вводить 0,5-1% раствор этоксисклерола, 40% раствор глюкозы, тромбовар, варикоцид и другие концентрированные растворы препаратов, вызывающих склероз слизистой оболочки желудка (Тимен Л.Я., Шерцингер А.Г. и соавт., 2001; Липницкий Е.М. и соавт., 2003, и др.). Однако в своих работах те же авторы отмечают ряд побочных эффектов и осложнений после введения концентрированных растворов препаратов: выраженный склероз в дне и краях язвы, часто возникающие зоны некроза в месте введения склерозантов и др. А это в свою очередь может приводить к увеличению размеров и глубины язв, возобновлению скорых рецидивом кровотече- ний и даже возникновению перфорации стенки органа.
В экспериментальных исследованиях на животных Тимен Л.Я. и соавт. показали, что введение в слизистую оболочку желудка кон- центрированных растворов (1% раствора этоксисклерола, 70-90% этанола, 40% раствора глюкозы) приводит к развитию некроза всех слоев стенки органа, секвестрации участков тканей, медикаментозной инфильтрации и образованию острых язв. При гистологическом исследовании в краях язвенного дефекта преобладал отек слизистой оболочки и подслизистого слоя. В перифокальной области и регионарной зоне присутствовала картина прогрессирующих воспалительнодеструктивных изменений: острые эрозии с тенденцией к соединению с образованием острых язв, а также острые эрозии, расположенные в неизмененной слизистой оболочке (Тимен Л.Я. и др., 2001).
Антонов Ю.А. и соавт. (2003) предлагают с гемостатической целью при язвенных кровотечениях использовать периульцелярные инъекции 1% раствора перекиси водорода в количестве 10-20 мл. По мнению авторов, использование 1% раствора перекиси водорода при язвенных кровотечениях обладает высокой эффективностью и безопасностью.
Инъекционный метаболически реабилитирующий гемостаз
Тимен Л.Я., Шерцингер А.Г., Сидоренко Т.П. и др. (2001) предложили модель эндоскопического гемостаза, предусматривающего
«осуществление триединой задачи»: проведение экстренного, превентивного (противорецидивного) гемостаза и местное лечение язв. Экстренный эндоскопический гемостаз достигается формированием инъекционного инфильтрационного «жгута» 10-20% растворами глюкозы и 5% раствором аминокапроновой кислоты с последующим орошением язвы и окружающей слизистой хлорэтилом. Для превентивного гемостаза и лечебной эндоскопии используются препараты, обеспечивающие восстановление регионарного метаболического гомеостаза: 5% растворы аскорбиновой кислоты и глюкозы в объеме от 40 до 200 мл. Превентивный гемостаз назначается повторно (2-4 раза) в первые сутки, а затем ежедневно и однократно в течение 6 сут.
Инъекционный гемостаз сосудосуживающими препаратами
Механическое сдавление сосудов растворами жидкостей в сочетании с местным гемостатическим действием и спазмом мелких сосудов в большинстве случаев приводит к временной остановке кровотечения или уменьшению его интенсивности. Данный метод чаще используется как «скрининговый» вспомогательный, создающий условия для применения более радикальных методик. С этой целью чаще используется новокаин-адреналовая смесь (1 мл 0,1% раствора адреналина + 30 мл 0,25% раствора новокаина), в качестве буферного растворителя можно использовать и физиологический раствор 60-100 мл.
Местным гемостатическим действием обладает раствор аминокапроновой кислоты, вводимый по игле инъектору в периульцелярную область (5% раствор в количестве 30-40 мл).
Аналогичным действием обладает такая смесь: 10% раствора желатина + 10% раствора аминокапроновой кислоты (в соотношении 1:2) + 1 мл 0,1% раствора адреналина общим объемом 40 мл (Хрячков В.В., Тимченко И.В., Подшивалов В.Ю., 1998).
4.6.4. Использование метода клеевых аппликаций
Среди клеевых композиций, применяемых в эндоскопии, широкое применение нашли пленкообразующие препараты лифузоль, гаст- розоль, статизоль и др. При нанесении этих препаратов на источник слабого кровотечения образуется пленка, которая создает гемостаз, кроме того, при контакте этих препаратов со слизистой оболочкой происходит эффект местной гипотермии до 16-18 ?С за счет испарения растворителя, что также усиливает гемостатический эффект.
Более сильными и стойкими синтетическими клеевыми композициями являются так называемые цианакрилатные соединения. На их
основе созданы специальные медицинские клеи: МК-7, МК-8, МК-14, МИРК-Т и др., применяемые в хирургии и эндоскопии. Данная группа клеев широко используется для профилактики рецидивов кровотечения, когда они наносятся на культю тромбированного сосуда или на язвенные дефекты с массивными наложениями гематина.
Необходимо помнить, что перед нанесением клеевой аппликации кровоточащая (язвенная) поверхность предварительно орошается 70% спиртом. В некоторых случаях в эндоскопии с гемостатической целью для остановки язвенных кровотечений используют биокомпозитные соединения (криопреципитат, фибриновый клей и др.). Широкому внедрению данных препаратов в клиническую практику препятствуют высокая стоимость препаратов, технические сложности производства и изготовления.
4.6.5. Механические методы гемостаза
К ним относятся клипирование и лигирование видимых кровоточащих сосудов в дне и краях язвы с помощью эндоскопов и специ- альных аппаратов-клипаторов, использующих в качестве зажимов клеммы, петли или латексные кольца. Данный вид гемостаза чаще применяется для остановки кровотечений из варикозно расширенных вен пищевода, для остановки язвенных кровотечений используется достаточно редко. Недостатками метода являются достаточно высокая цена основного и расходного оборудования, техническая сложность выполнения манипуляций, часто требующих помощь подготовленной бригады специалистов, что не всегда возможно в ночное время, недостаточная эффективность при остановке кровотечения из хронических каллезных язв, кровоточащих сосудов, расположенных в ригидных опухолевых тканях.
4.6.6. Комбинированный гемостаз, повышение эффективности эндоскопических способов гемостаза
Ни один из вышеописанных эндоскопических методов гемостаза при кровоточащих язвах желудка и двенадцатиперстной кишки не обеспечивает стопроцентной гарантии окончательной остановки кровотечения. Говорить о целесообразности применения или сравнивать эффективность того или иного метода эндоскопического воздействия считаем некорректным и неправильным. Практика показывает, что наиболее надежного гемостаза удается добиться в тех случаях, когда использовалось несколько приемов местного воздействия на
язву - комбинированный гемостаз. Эндоскопическая остановка кровотечения должна идти от более простых способов гемостаза к более сложным.
Пример. У
больного во время проведения экстренной ЭГДС обнаружена хроническая
язва угла желудка, констатировано кровотечение Forrest Ib (рис.
В данном случае остановку кровотечения можно начать с орошения (отмывания) язвы струей холодной воды с одновременной аспираци- ей старой крови и промывных вод. После снижения интенсивности или полной остановки кровотечения возможно проведение инъекционного гемостаза, например метаболически реабилитирующего гемостаза, либо сразу использовать тот или иной метод термического воздействия: диатермо-, фотоили аргоноплазменную коагуляцию кровоточащего участка язвы. В последующем гемостатическую терапию можно дополнить клеевой аппликацией или нанесением на язву одного из пленкообразующих препаратов. Мероприятия по профилактике рецидива кровотечения (превентивный гемостаз) необходимо проводить повторно через 6-12 и 24 ч в течение первых суток, а затем ежедневно однократно в течение 3-4 сут.
В целом эндоскопические методы гемостаза при язвенных кровотечениях обладают высокой эффективностью и позволяют:
- осуществить временный гемостаз у подавляющего числа больных;
- в ряде случаев дают возможность предотвратить рецидив кровотечения и отодвинуть операцию на этап плановой хирургии;
- провести эндоскопический мониторинг (при необходимости повторный гемостаз) у больных с предельными степенями анестезиологического риска, когда выполнение срочной операции может привести к гибели больного (Fullarton G.M., Murray W.R., 1990).
4.6.7. Неудачи, связанные с проведением эндоскопического гемостаза
Неудачи, связанные с невозможностью добиться эндоскопического гемостаза при язвенных кровотечениях, зависят от многих факторов:
- локализации кровоточащей язвы, ее глубины и размеров;
- характера (профузное, струйное, артериальное) кровотечения;
- объема и интенсивности кровопотери, длительности кровотечения;
- общего состояния больного (возраст, сопутствующая патология);
- нарушений свертывающей системы крови, общих нарушений в системе гомеостаза (геморрагический шок, полиорганная недо- статочность);
- недостаточного оснащения ЛПУ необходимым оборудованием, инструментарием, медикаментами, подготовленными специалистами;
- опыта и квалификации врача-эндоскописта (бригады врачей), выполняющего исследование (лечение);
- времени суток (ночное, ранние утренние часы) и многих других. При обнаружении источника кровотечения следует определиться
с характером кровотечения. Если кровотечение струйное, профузное, артериальное, а источником кровотечения является язва Дьелафуа, следует по возможности быстрее доставить больного в операционную и прибегнуть к экстренному оперативному вмешательству. Попытка остановить такое кровотечение эндоскопическими методами часто приводит к усугублению тяжести состояния больного в результате продолжающейся кровопотери, а также необоснованной потере времени.
Следует также помнить, что ни один из существующих методов остановки язвенного кровотечения (консервативная терапия, эндоскопический гемостаз, хирургическая операция) не гарантируют стоп- роцентного успеха излечения больного. Данная патология опасна развитием неожиданных осложнений как со стороны самой язвы (ранние рецидивы кровотечения, перфорация), так и других органов и систем (сердечно-сосудистой, дыхательной, выделительной, свертывающей и др.). Поэтому больной с язвенным кровотечением должен постоянно находиться под круглосуточным наблюдением хирурга, эндоскопис- та, реаниматолога. А лечащий врач должен быть готов в любое время возобновить интенсивные мероприятия, направленные на спасение жизни больного.
4.7. ИНОРОДНЫЕ ТЕЛА ПИЩЕВОДА И ЖЕЛУДКА
Инородные тела попадают в пищевод вместе с плохо разжеванной пищей при неосторожной, поспешной еде. Предрасполагающими моментами являются отсутствие зубов и ношение съемных зубных протезов, алкогольное опьянение.
Дети младшего возраста нередко проглатывают монеты, мелкие игрушки, которые любят брать в рот. Половина всех инородных тел
пищевода приходится на людей в возрасте старше 40 лет, около четверти - на детей в возрасте до 10 лет.
Чаще всего инородные тела пищевода представлены костями (рыбьими, мясными, птичьими). Нередко встречаются мясные завалы, зубные протезы, монеты, пуговицы, мелкие игрушки, запонки, даже крупные шахматные фигуры и кости домино. Кости и мясные завалы нельзя назвать инородными телами в собственном смысле слова, так как они являются составными частями пищи и застревают в пищеводе только при большой величине.
Инородные тела застревают в пищеводе в местах физиологических сужений, чаще в шейном отделе (50-60%). Объясняется это тем, что шейное сужение является первым значительным препятствием на пути постороннего предмета. Далее по частоте застревания инородных тел занимают грудной и кардиальный отделы пищевода (30- 40%). Если в пищеводе имеются сужения, например рубцовые, после химических ожогов, то в месте сужений могут застревать даже мелкие предметы (косточки вишни и др.).
Клинические симптомы при инородных телах пищевода определяются характером инородного тела, его величиной, наличием или отсутствием острых краев, а также локализацией и расположением, параллельно или поперек пищевода. Больные жалуются на плохое прохождение пищи, давящие боли за грудиной или чувство покалывания. Обычно из анамнеза удается выяснить, что данные симптомы появились во время поглощения мясного супа или рыбы и пациент вдруг почувствовал, как что-то у него застряло в горле и пища перестала проходить. Попытки протолкнуть ее глотком воды, коркой хлеба остались безуспешными. Проглатываемая вода с рвотными движениями выходит обратно. Иногда этими жалобами больной и ограничивается. В некоторых случаях непроходимость пищевода больные связывают с исчезновением изо рта зубного протеза. Общее состояние таких пациентов, как правило, не страдает.
Исследование нужно начинать с тщательного осмотра глотки и гортани. Часто больные не могут точно определить местонахождение инородного тела. Иногда при указании на застревание инородного тела в пищеводе в действительности оно оказывается в нёбной миндалине, корне языка, грушевидном синусе. Поэтому исследование нужно начинать именно с глотки. При осмотре нижнего отдела глотки можно отметить весьма характерный признак, позволяющий предположить наличие инородного тела в пищеводе. Признак этот заключа-
ется в скоплении пенистой слюны в грушевидном синусе на соответствующей стороне. Одновременно можно увидеть здесь инфильтрацию слизистой оболочки, вследствие чего один синус представляется мельче другого. Если в шейном отделе пищевода имеется острое инородное тело, то при надавливании на гортань и трахею отмечается болезненность. При отсутствии этих симптомов можно провести пробу с глотком воды. В момент глотания часто можно наблюдать болезненную гримасу на лице больного, а также вынужденные движения головой и всем корпусом.
При подозрении на металлическое инородное тело (монеты, иглы) больным выполняют рентгенографию (скопию) пищевода. С помощью рентгеноскопии можно точно определить положение и локализацию инородного тела. Так, монеты обычно располагаются во фронтальной плоскости над вырезкой грудины. Однако наиболее информативным методом исследования является эзофагоскопия. С помощью гастроскопа можно не только определить характер и локализацию инородного тела, но и удалить его с помощью специальных инструментов. В качестве захватов используют фарцепты, щипцы типа «крысиные зубы» - треноги, корзинки Дормиа, диатермические петли и др.
Осложнения
При длительно находящихся в организме инородных телах возможны осложнения как со стороны самого пищевода, так и окружающих его тканей и органов. Это могут быть эзофагиты и абсцессы стенки пищевода. При перфорации стенки пищевода острым предметом может возникнуть кровотечение или развиться гнойный медиастинит.
Инородные тела желудка клинически,
как правило, никак себя не проявляют. Обычно пациент сам указывает на
то, что случайно проглотил тот или иной предмет. Возможно умышленное
проглатывание инородных тел психически больными людьми. Мелкие
предметы, до
4.8. ЭНДОСОНОГРАФИЯ ЖЕЛУДКА
Эндоскопическая ультрасонография (ЭУС) явилась еще одним шагом в направлении объективизации и повышения достоверности данных, связанных с диагностикой заболеваний желудка и органов дуоденопанк- реатобилиарной системы. ЭУС поднимает рутинные эндоскопические и ультразвуковые исследования на новый, более информативный уровень, существенно повышая качество и точность диагностики.
Сочетание в одной диагностической процедуре эндоскопического и ультразвукового исследований значительно расширяет границы диагностических возможностей, позволяя врачам под визуальным контролем максимально приблизить ультразвуковой датчик к объекту исследования и получить четкую картину не только органов желудочно-кишечного тракта и их подслизистых слоев, но и прилегающих органов, лимфатических узлов и других анатомических структур.
Заметно превосходя по качеству эхограммы, получаемые при экстракорпоральных ультразвуковых исследованиях, эндоскопические ультразвуковые изображения позволяют с большей достоверностью определить зону патологических изменений в органах желудочнокишечного тракта, а также точно оценить глубину проникновения, протяженность и границы пораженного участка.
Оборудование
В состав современного ультразвукового эндоскопического комплекса входят (рис.
- ультразвуковой эндоскопический центр;
- ультразвуковые видеоэндоскопы;
- ультразвуковые зонды;
- вспомогательное оборудование и инструментарий. Ультразвуковой эндоскопический центр представляет собой сложную систему электронного оборудования, предназначенного для наблюдения и сохранения ультразвуковых параметров (изображений) в режиме реального времени.
Ультразвуковые видеоэндоскопы отличаются от обычных эндоскопов тем, что в дистальный конец данных приборов встроен специальный УЗ-датчик - трансдъюсер (рис.
Датчик позволяет проводить широкополосное сканирование на различную глубину. При высокочастотном сканировании (15-20 MHz) более четко отображаются поверхностные структуры, расположенные в стенке желудка и/или кишечника (опухоли, пенетрирующие язвы и др.). Низкочастотное сканирование (5-12 MHz) более эффективно
в оценке состояния органов, расположенных глубже поджелудочной железы, желчного пузыря, печени, селезенки и др. При этом сохраняется четкость и контрастность ультразвукового изображения.
Показания к проведению ЭУС
Показаниями к проведению эндосонографии являются опухоли верхнего и нижнего отделов ЖКТ и гепатопанкреатодуоденальной зоны. ЭУС проводится с целью определения глубины поражения органа, степени распространения метастазов в региональные лимфоузлы. Подозрительные на подслизистую локализацию образования стенки кишечной трубки, язвенные поражения желудка и двенадцатиперстной кишки являются подтверждением холедохолитиаза, острого и хронического панкреатита и др.
Противопоказания
Противопоказания для эндосонографии те же, что и для плановой диагностической эндоскопии верхних отделов ЖКТ.
Методика выполнения эндосонографии
Исследование
проводится, как правило, на фоне премедикации. Положение больного на
левом боку. Введение аппарата осуществляется так же, как и при обычной
эзофагогастродуоденоскопии. Последовательно проводится осмотр пищевода,
желудка и двенадцатиперстной кишки. В зависимости от локализации и/или
глубины залегания патологического очага выбирается тот или иной режим
сканирования (рис.
Для улучшения проведения УЗ-сигнала в желудок дополнительно вводится 400-600 мл жидкости. С этой же целью используют и специальный баллончик, заполненный жидкостью, расположенный на конце эндоскопа.
Осложнения
По литературным источникам (Sivak M.V., Boyce G.A., 1990), угрожающие жизни осложнения при проведении данного исследования не превышают 0,05%. Значительная доля при этом приходится на риск перфорации пищевода при попытке проведения эндоскопа через стенозирующую опухоль, прежде всего после предварительного бужирования. В остальных случаях процент осложнений такой же, что и при обычных диагностических эндоскопиях верхних отделов ЖКТ.
Ультразвуковые зонды используют
в тех случаях, когда необходимо исследовать участки
желудочно-кишечного тракта, доступ к которым затруднен, например при
рубцовых сужениях пищевода различной этиологии (рис.