Медицина, основанная на доказательствах: учебное пособие. Петров В.И., Недогода С.В. 2012. - 144 с.
|
|
|
|
ГЛАВА VI ДОКАЗАТЕЛЬНАЯ МЕДИЦИНА И МЕДИЦИНСКАЯ РЕКЛАМА
В настоящее время данные научных медицинских исследований все больше влияют не только на разработку новых стандартов и протоколов ведения пациентов, но и фармацевтический бизнес. В качестве такого примера можно привести резкое увеличение объема тиазидных диуретиков после опубликования результатов исследования ALLHAT, представивших их в очень выгодном свете. Результаты ALLHAT стали активно обсуждаться в медицинской и, увы, немедицинской литературе. В качестве примеров эволюции представлений о значимости исследования можно привести две цитаты. Более сдержанное высказывание Dr. Curt Furberg (Wake Forest University Baptist Medical Center, chairman of the ALLHAT study's steering committee): «Важно, какое лекарство используется для контроля АД. Диуретики предпочтительны по трем причинам, они обеспечивают лучший контроль АД; более существенно снижают риск осложнений артериальной гипертензии - особенно сердечной недостаточности; и в 10-20 раз дешевле, чем другие препараты». И совсем радикальную и провокационную цитату из British Medical Journal: «Нет ничего яснее. Диуретики - наиболее дешевый и наиболее эффективный класс препаратов «первой линии» для практически всех пациентов с артериальной гипертензией.... У любого, кто продолжает назначать антагонисты кальция в качестве препаратов «первой линии» при неосложненной артериальной гипертензии, должен быть проверен багажник машины на наличие в нем большого количества принадлежностей фармацевтической кампании, а сам он должен ответить на вопрос о том, кто заплатил за его ужин прошлой ночью». (POEM - BMJ 2003;327, 30 August).
Поэтому все более актуальной становится проблема анализа информации, которую предоставляют различные медицинские издания, представители фармацевтических компаний и ведущие в своей области специалисты.
Врачу необходимо научиться самостоятельно оценивать достоверность информации и отличать ее от скрытой рекламы. Кроме этого, ему необходимо взвешенно подходить к мнению авторитетов и чужому опыту.
Прежде всего из источников, которые могут быть использованы врачом для поддержания своего профессионального уровня и решения клинических проблем, должны быть исключены научно-популярные статьи.
Критичным должно быть отношение врача к рекламной информации, предоставляемой фармацевтическими компаниями, поскольку главная их цель - получение прибыли, а не непрерывное образование врачей. В брошюрах, щедро раздаваемых медицинскими представителями фармацевтических компаний во время посещений врача, может содержаться достоверная информация, если речь идет о многоцентровых исследованиях. Фактически стандартными стали методы продвижения новых лекарственных препаратов на медицинский рынок:
• поскольку большинство РКИ выполнены с участием оригинального препарата, но они дорого стоят, то полученные в них данные вольно экстраполируются на воспроизведенные препараты (генерики);
• употребление общих, не подтверждаемых ссылками фраз: «по данным ученых (неизвестно, каких) или исследований крупных медицинских центров и т.д., препарат N...» и следующее за этим перечисление его исключительно полезных свойств и примеры высокой эффективности;
• по аналогичной схеме строятся утверждения: «клинические исследования (испытания) выявили. Далее вновь следуют хвалебные оды препарату и при этом часто упоминается отсутствие у него побочных эффектов. При этом совершенно неясно, кто, где, когда и какие клинические исследования проводил;
• приводятся данные обычных регистрационных исследований, где отсутствует сравнение с «эталонным» в настоящее время препаратом для лечения данной патологии;
• привести результаты инициированных фирмой-производителем, но не опубликованных исследований. В этом случае у многих исследователей есть искушение не обмануть ожиданий спонсора;
• привести данные обзоров по интересующей тематике, в выгодном свете выставляющие препарат N, но при этом не привести данные первоисточников и литературные ссылки на них;
• просто апеллировать к титулам и регалиям ученого или учреждения, которые работали с препаратом N.
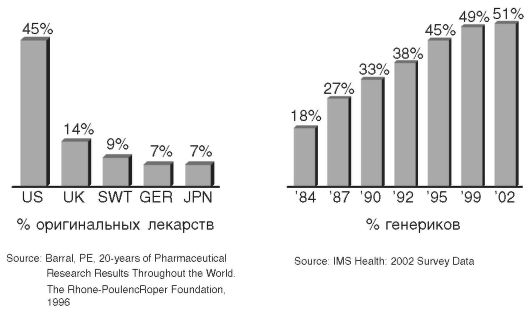 Рис. 6.1. Динамика роста генерических препаратов на фармацевтическом рынке и доля оригинальных препаратов на нем в различных странах US - США, UK - Великобритания, SWT - Швейцария, GER - Германия, JPN - Япония
Рис. 6.1. Динамика роста генерических препаратов на фармацевтическом рынке и доля оригинальных препаратов на нем в различных странах US - США, UK - Великобритания, SWT - Швейцария, GER - Германия, JPN - Япония
В принципе, чем наукообразнее преподнесение фактического материала, тем меньше доверия он должен вызывать.
Для России особенно актуальна разработка алгоритма оценки возможности замены оригинального препарата на генерик при лечении пациентов.
Во всем мире наблюдается устойчивая тенденция к увеличению доли генерических препаратов на лекарственном рынке (рис. 6.1). В этой связи оценка их качества, терапевтической эквивалентности и эффективности становится ключевой для оптимизации фармакотерапии (1, 2, 5, 9).
Высокая стоимость разработки оригинальных препаратов обусловлена целым рядом факторов (рис. 6.2) и в настоящее время может составлять около миллиарда долларов США. Обращает внимание тот факт, что только на научные и клинические (GCP) исследования тратится около 40% средств, хотя это и предопределяет в основном появление принципиально новых направлений в фармакотерапии, по которым потом и движутся генерики. Затраты на создание генериков как минимум на
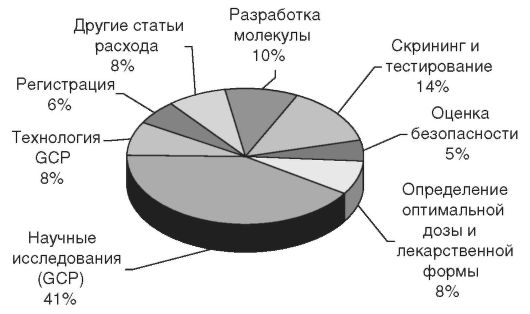 Рис. 6.2. Статьи расходов при разработке нового оригинального препарата
Рис. 6.2. Статьи расходов при разработке нового оригинального препарата
несколько порядков ниже, а часто отсутствуют вовсе. Поэтому более высокая цена оригинального препарата является фактической платой или своеобразным «налогом» за прогресс в медицинских знаниях.
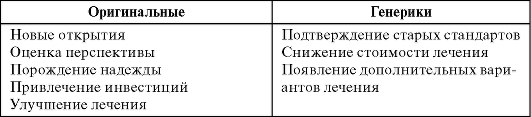
Оригинальные препараты и генерики выполняют разные роли в улучшении качества оказания медицинской помощи (табл. 6.1).
Таблица. 6.1. Оригинальные препараты против генериков
 Основные задачи генерических препаратов хорошо известны:
Основные задачи генерических препаратов хорошо известны:
• снизить стоимость лечения и профилактики осложнения;
• обеспечить безопасность, эффективность, экономичность, доступность и правовые нормы лечения;
• обеспечить удовлетворенность врача и пациента от проводимого лечения;
• быть источником данных для последующего анализа.
Как видно, генерики должны обладать двумя важными функциями - обеспечивать приемлемую стоимость лечения и соответствовать тем стандартам терапии, которые были разработаны на основании данных, полученных при использовании оригинальных препаратов.
Основные требования к генерическим препаратам четко сформулированы:
• тот же активный ингредиент;
• тот же путь введения;
• та же дозировка;
• та же эффективность;
• те же показания и противопоказания;
• допустимы некоторые изменения (их эффективность и безопасность должны быть доказаны).
Однако если проанализировать такие популярные справочные издания (8) по лекарственным средствам в России, как РЛС и Видаль, становится ясно: нередко у генериков появляются не только новые режимы дозирования, показания и противопоказания, но и новые механизмы действия по сравнению с оригинальными.
В настоящее время (3) об эквивалентности оригинального и генерического препаратов судят по их биоэквивалентности (рис. 6.3 и 6.4).
Как видно, уже при этом уровне контроля официально допускается 20% различие между оригинальным препаратом и генериком. Но, к сожалению, подобная информация становится фактически недоступной для врачей. Хотя у любого из них возникнет определенная настороженность в отношении того препарата, биоэквивалентность которого составляет 80% от оригинального.
Именно поэтому в повседневной практике приходится ориентироваться на научные публикации (6, 7) или попытаться разработать алгоритм оценки эффективности и безопасности генерического препарата (рис. 6.5).
Безусловно, предлагаемый алгоритм оценки («экспертизы») качества генерического препарата не является идеальным, но он позволяет в значительной мере объективизировать ее, используя балльную шкалу оценок.
1. Существуют ли рандомизированные клинические исследования?
Для оригинального препарата такие исследования существуют всегда, а для генерического препарата нет. Никого не надо убеждать в том, что достоверность их результатов отвечает жестким требованиям
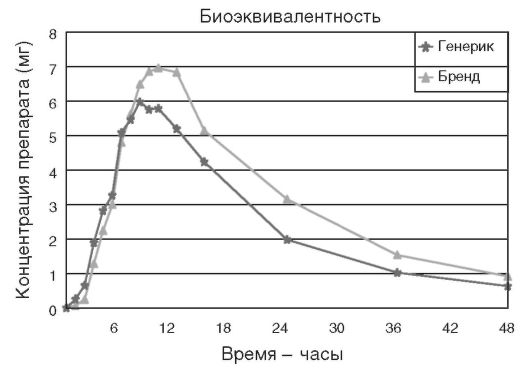 Рис. 6.3. Пример тестирования оригинального и генерического препарата на биоэквивалентность
Рис. 6.3. Пример тестирования оригинального и генерического препарата на биоэквивалентность
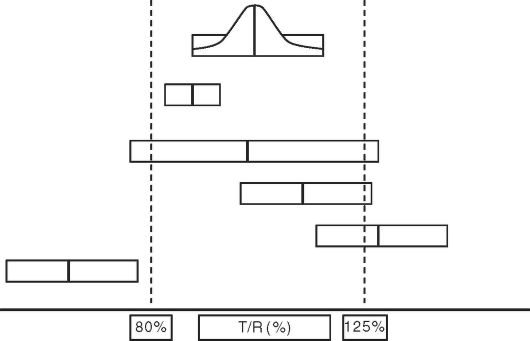 Рис. 6.4. Возможные результаты проверки генерика на биоэквивалентность (90% ДИ)
Рис. 6.4. Возможные результаты проверки генерика на биоэквивалентность (90% ДИ)
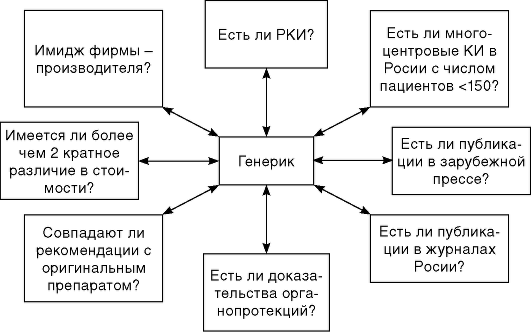 Рис. 6.5. Алгоритм экспертной оценки эффективности и безопасности генерического препарата
Рис. 6.5. Алгоритм экспертной оценки эффективности и безопасности генерического препарата
«доказательной» медицины. Наличие подобных исследований у генерического препарата позволяет объективно оценить его клиническую эффективность, безопасность и возможно получить представление о влиянии на «суррогатные» точки. Кроме этого, необходимо учитывать, что проведение рандомизированных клинических исследований свидетельствует о достаточно высоком научном и организационном потенциале фирмы-производителя. Учитывая высокую достоверность и значимость подобных исследований, за каждое из них можно присвоить препарату 10 баллов.
2. Существуют ли многоцентровые клинические исследования в России, выполненные по единому протоколу и включающие не менее 150 пациентов?
Число пациентов обусловлено тем, что это нижняя граница при проведении III фазы клинических исследований. И хотя в данном случае речь, как правило, идет о пострегистрационных исследованиях, данное количество пациентов позволяет объективнее оценить
клиническую эффективность и безопасность. За каждое подобное исследование можно присвоить 5 баллов.
3. Наличие публикаций, посвященных препарату, в зарубежной медицинской прессе.
Учитывая достаточно высокие требования, предъявляемые к материалам, публикуемым в зарубежных журналах и материалах медицинских конгрессов, за каждую публикацию присваивают 3 балла.
4. Наличие публикаций в российских медицинских журналах.
За каждую такую публикацию предлагается начислять по одному баллу.
5. Существуют ли доказательства влияния препарата на соответствующие нозологии суррогатные точки?
Могут быть использованы как зарубежные, так и российские данные (4). За каждую публикацию - 1 балл.
6. Совпадают ли официальные рекомендации по применению оригинального препарата и генерика?
При наличии различий из суммы баллов вычитается 5.
7. Имеются ли более чем двукратные различия в стоимости за 1 мг препарата?
При наличии различий из суммы баллов вычитается 5 баллов. Допустимость двукратного различия в стоимости может обусловлена объективными причинами: затратами фирмы производителя на разработку молекулы и проведение клинических исследований, а также разницей в стоимости затрат на производство и стоимости рабочей силы.
8. Имидж фирмы-производителя генерического препарата оценить достаточно сложно. Но есть ряд критериев, которые позволяют объективизировать оценку этой позиции:
• наличие зарегистрированных препаратов в США и странах Евросоюза помимо собственной страны - 15 баллов;
• стаж работы на российском рынке более 10 лет - 5 баллов; 5-9 лет - 3 балла; менее 5 лет - 1 балл.
Проблема эффективного и безопасного использования генерических препаратов в России имеет особую актуальность по нескольким причинам. Во-первых, в «жизненном» цикле развития большинства современных сердечно-сосудистых средств наступает фаза конкурен-
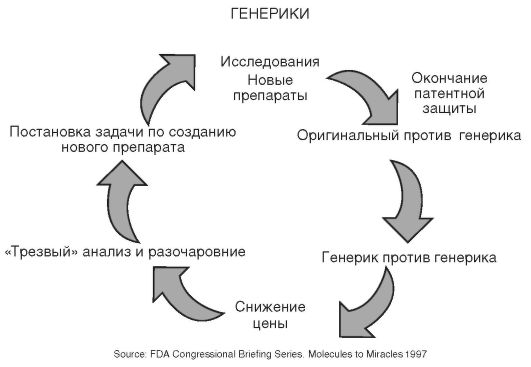 Рис. 6.6. «Жизненный цикл» лекарственных препаратов
Рис. 6.6. «Жизненный цикл» лекарственных препаратов
ции генерика с генериком (рис. 6.6). Во-вторых, налицо стремление государственных структур оптимизировать потребление лекарств в стационарах и льготными категориями пациентов, причем в обоих этих случаях решающим фактором выбора конкретного препарата является его цена.
Наиболее ярко продемонстрировать «жизненный цикл» препарата на российском рынке можно на примере группы антигипертензивных средств. В качестве примера можно рассмотреть эволюцию двух препаратов эналаприла и индапамида, поскольку они находятся на ее разных этапах: эналаприл - на этапе «снижение цены», а индапамид - на переходе между «оригинальный препарат против генерика» и «генерик против генерика».
В настоящее время в России зарегистрировано 35 «эналаприлов» и 13 «индапамидов» (Федеральное руководство...), существенно отличающихся по стоимости между собой (табл. 6.2, 6.3).
Таблица 6.2. Стоимость 1 мг эналаприла различных производителей
(данные с сайта национального дистрибьютора «ПРОТЕК»)
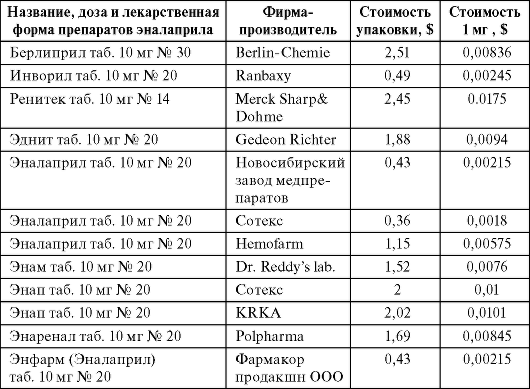 Таблица 6.3. Стоимость 2,5 мг индапамида различных производителей (данные с сайта национального дистрибьютора «ПРОТЕК»)
Таблица 6.3. Стоимость 2,5 мг индапамида различных производителей (данные с сайта национального дистрибьютора «ПРОТЕК»)
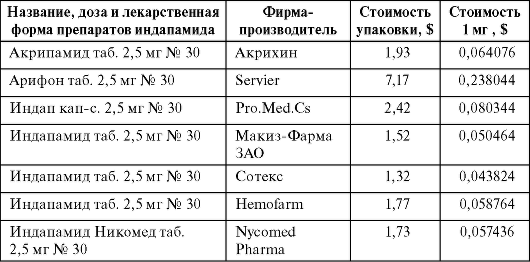 Как видно из представленных данных, различия в стоимости 1 мг эналаприла Ренитек/Эналаприл (Сотекс) составляют 9,72 раза, а различия в стоимости 2,5 мг индапамида Арифон/Индапамид (Сотекс) составляют 5,43 раза. Это естественно ставит вопрос об их терапевтической эквивалентности. Если же использовать для сравнения указанный алгоритм, приоритеты в выборе конкретного препарата становятся совершенно очевидными (табл. 6.4, 6.5).
Как видно из представленных данных, различия в стоимости 1 мг эналаприла Ренитек/Эналаприл (Сотекс) составляют 9,72 раза, а различия в стоимости 2,5 мг индапамида Арифон/Индапамид (Сотекс) составляют 5,43 раза. Это естественно ставит вопрос об их терапевтической эквивалентности. Если же использовать для сравнения указанный алгоритм, приоритеты в выборе конкретного препарата становятся совершенно очевидными (табл. 6.4, 6.5).
Для анализа использованы журналы «Кардиология», «Терапевтический архив», «Русский медицинский журнал», «Артериальная гипертензия», «Сердце», «Сердечная недостаточность», «Российский кардиологический журнал», «Кардиоваскулярная терапия и профилактика», а также тезисы докладов, представленные на Европейских конгрессах по кардиологии и артериальной гипертензии за последние 10 лет.
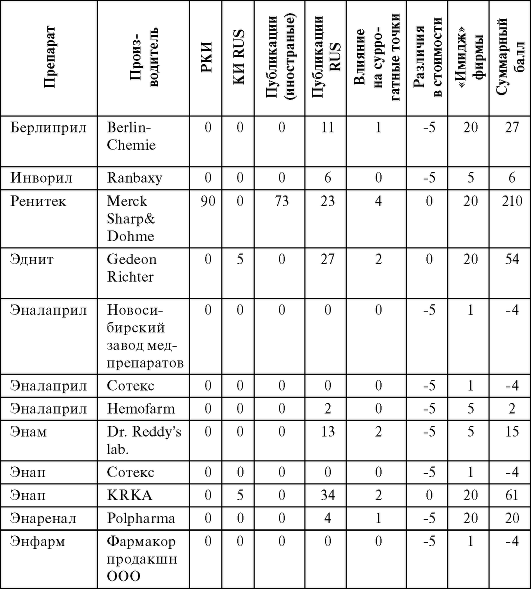
Если по предложенной схеме оценить оригинальные препараты, то Ренитек набирает 210 баллов, а Арифон - 198 баллов, причем обращает на себя внимание, что на «российскую» составляющую приходится более 20% от общей суммы баллов. Так, например, Арифон набрал 37 баллов (5 баллов исследование АРГУС, 32 публикации).
Таким образом, предложенная схема сравнения позволяют более объективно подойти к оценке качества генерического препарата, даже при отсутствии прямых сравнительных исследований с оригинальным препаратом.
Таблица 6.4. Экспертная оценка генериков индапамида
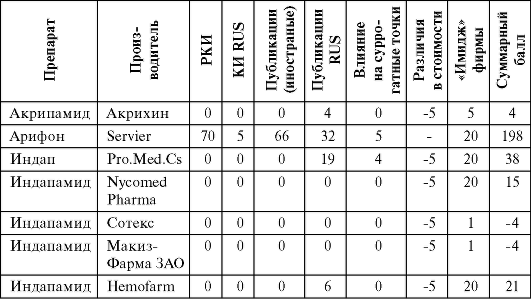 Таблица 6.5. Экспертная оценка генериков эналаприла
Таблица 6.5. Экспертная оценка генериков эналаприла
 При чтении специальной медицинской литературы необходимо дифференцировать научные и псевдонаучные публикации. Отличительной чертой этих публикаций является наличие прямой или скрытой рекламы нового вмешательства и очевидное смещение эффективности в сторону предлагаемого метода. Очень показательны результаты анализа медицинских публикаций, представленные в табл. 6.6.
При чтении специальной медицинской литературы необходимо дифференцировать научные и псевдонаучные публикации. Отличительной чертой этих публикаций является наличие прямой или скрытой рекламы нового вмешательства и очевидное смещение эффективности в сторону предлагаемого метода. Очень показательны результаты анализа медицинских публикаций, представленные в табл. 6.6.
Таблица. 6.6. Почему некоторые страны дают только положительные результаты при клинических исследованиях. Curt D. Furberg, Amerikan Heart Association Scientic Section, 2000. Plenary session VI
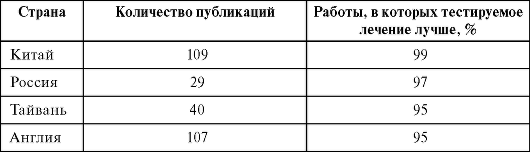 Очевидно, что такой высокий процент положительного эффекта вмешательств далек от истины. Поэтому врачу необходимо обращать внимание на издание, где опубликованы данные. Так, например, журнал Lancet, чей авторитет в медицинском сообществе достаточно высок, не станет публиковать заведомо слабые и псевдонаучные работы.
Очевидно, что такой высокий процент положительного эффекта вмешательств далек от истины. Поэтому врачу необходимо обращать внимание на издание, где опубликованы данные. Так, например, журнал Lancet, чей авторитет в медицинском сообществе достаточно высок, не станет публиковать заведомо слабые и псевдонаучные работы.
В России особую значимость имеет стоимостной аспект применения лекарственного или современного диагностического вмешательства, которые, как правило, отражены в публикациях по фармакоэкономике. Если не вдаваться в детали, можно констатировать острый дефицит подобных исследований. В связи с этим фармакоэкономические исследования должны не только получить широкое распространение, но и отвечать требованиям доказательной медицины. Для этого необходимо адекватно оценивать имеющиеся в настоящее время возможности.
Во-первых, для получения объективной информации возможно использование результатов уже проведенных многоцентровых, рандомизированных клинических исследований. Несомненным достоинством такого подхода является высокая степень надежности полученных данных, низкие финансовые затраты на обработку уже имеющихся данных. Единственной сложностью является адаптация полученных данных к условиям России, причем проблема заключается не в стоимостной разнице препаратов, а в отсутствии общепринятой оценки стоимости конечных точек (например, острого инфаркта миокарда, госпитализации в связи с хронической сердечной недостаточностью или инсультом).
Во-вторых, правильно спланированное фармакоэпидемиологическое исследование в условиях реальной практики позволяет оце-
нить экономические затраты, связанные с лекарственной терапией, по исходу любого заболевания, а также временной утратой нетрудоспособности или инвалидизацией пациентов.
В-третьих, необходимо, как об этом уже неоднократно писали в медицинской литературе, создать систему хорошо спланированных многоцентровых фармакоэкономических исследований.
В-четвертых, в настоящее время накопилась достаточная «критическая» масса российских исследований по фармакоэкономике различных групп лекарственных препаратов, главным недостатком которых является малочисленность групп пациентов, однако самих исследований вполне достаточно для проведения их мета-анализа.
Три подхода из указанных не требуют больших финансовых затрат, но позволяют при наличии желания и воли объективнее подойти к разработке стандартов и протоколов лечения, а также «ограничительных» списков.
Среди проблем, актуальных для России, - использование биологически активных добавок (БАД) в качестве лекарств. Их применение в лечении заболеваний и в качестве профилактических средств не имеет никакой доказательной базы. В нашей стране единственным требованием при регистрации БАДов является их безопасность, проверяемая в экспериментах на животных, тогда как в крупных исследованиях с участием людей она не доказана.
Агрессивная реклама БАДов в средствах массовой информации с участием известных людей подталкивает людей к самолечению и отвлекает большие финансовые средства от действительно необходимых лекарственных препаратов. Практически все публикации по БАДам могут служить классическим примером «недоказательной» медицины.
Интересные данные приводит журнал Newsweek (9/1/89), почти 20 лет назад оценивший объем ранка БАДов для похудания в 33-50 миллиардов долларов в год. Было констатировано, что «...для американского бизнеса диеты и продукты для похудания являются самым перспективным направлением, так как есть возможность продавать то же самое тем же самым людям снова и снова».
В свою очередь журнал Obesity and Health Journal присудил приз за самую возмутительную рекламу средств для похудания, которая гласила: «Озабочены прибавкой в весе после праздников? Synchronol поможет вам, уникальный гель для душа из морских водорослей,
который проникает через открытые поры кожи и атакует целлюлитные отложения». На втором месте оказались рекомендации специалиста по нетрадиционным методам лечения: «вешайте эти магниты на 15 минут на ушные раковины несколько раз в течение дня и ждите, когда у вас начнут исчезать лишние килограммы. Но помните, если вы слишком сильно похудеете, немедленно прекратите лечение акупунктурой».
В своей известной монографии (?) приводит следующие рекомендации для практического врача по анализу медицинских публикаций.
1. Требуйте обоснованных сведений, используя сокращение STEP:
• безопасность (S, от англ. safety), т.е. вероятность отдаленных или серьезных побочных эффектов, вызванных лекарственным препаратом (помните, что редкие, но серьезные побочные реакции на новые препараты могут быть плохо документированы);
• переносимость (T, от англ. tolerability) - лучше всего измеряется путем сравнения частоты прекращений приема данного лекарственного препарата и его наиболее популярного конкурента;
• эффективность (E, от англ. efficacy) - наиболее значимый аспект этого показателя состоит в сравнении препарата с тем, который вы в настоящий момент предпочитаете больше всего;
• стоимость (Р, от англ. price) - должна учитывать прямые и непрямые затраты.
2. Требуйте предоставления независимых сведений, опубликованных в известных рецензируемых журналах.
3. Не читайте рекламных брошюр, которые часто содержат неопубликованные материалы, обманчивые схемы и выборочные цитаты.
4. Игнорируйте такие «доказательства», как, например, использование данного препарата известным уважаемым специалистом.
5. Строго оценивайте научные сведения, обращая особое внимание на размер:
• выборки, методологическое качество клинических испытаний и использование;
• суррогатных конечных точек. Не принимайте теоретических доводов в пользу того или иного метода лечения.
Итак, анализ медицинских публикаций не так прост, как кажется, поэтому современный врач должен быть в известной степени критически настроенным при оценке предлагаемых ему новых методов лечения.
Литература
1. Белоусов Ю.Б. Быков А.В. Фармакоэкономика: оптимальный выбор для формуляров // Фарматека. - 2003. - ? 3. - С. 10-12.
2. Воробьев П.А. Развитие системы рационального лекарственного обеспечения населения Российской федерации - больше вопросов, чем ответов // Проблемы стандартизации в здравоохранении. -
2001. - ? 3. - С. 3-10.
3. Кутишенко Н.П., Марцевич С.Ю., Шальнова С.А., Деев А.Д., Якусевич В.В. Изучение клинической эквивалентности двух препаратов эналаприла у больных артериальной гипертонией // Российский кардиологический журнал. - 2003. - ? 5. - С. 68-72.
4. Леонова М.В. Современный взгляд на конечные точки для оценки антигипертензивной терапии // Качественная клиническая практика. - 2002. - ? 4. - С. 18-22.
5. Недогода С.В., Марченко И.В., Чаляби Т.А. Сравнительная антигипертензивная эффективность генериков ангиотензинпревращающего фермента эналаприла (ренитека, энапа, эднита, инворила, энванса и энама) и стоимость лечения у больных гипертонической болезнью // Артериальная гипертензия. - 2000. - ? 1. - С. 52-55.
6. Остроумова О.Д., Недогода С.В., Мамаев В.И., Шорикова Е.Г. Фармакоэкономические аспекты эффективности ингибиторов ангиотензипревращающего фермента при артериальной гипертонии и сердечной недостаточности // Р.М.Ж. Кардиология. - 2003. -
Т. 11. - ? 5. - С. 1-6.
7. Петров В.И., Фисенко В.П., Герасимов В.Б., Недогода С.В., Яворский А.Н. Фармакоэкономический аспект затрат на лечение при использовании различных генерических препаратов // Проблемы стандартизации в здравоохранении. Тезисы II научно-практической конференции «Проблемы стандартизации в здравоохранении». -
2000. - ? 1. - С. 134.
8. Федеральное руководство по использованию лекарственных средств. (Формулярная система) Выпуск VI. - М.: «ЭХО», 2005. -
944 с.
9. Wilson-Davis K. Study design and the use of statistics in drug use research // McGavock H., editor. Handbook of Drug Use Research Methodology. 1st ed. - Newcastle: The United Kingdom Drug Utilization Research Group,
2000. - P. 36-55.