Медицина, основанная на доказательствах: учебное пособие. Петров В.И., Недогода С.В. 2012. - 144 с.
|
|
|
|
ГЛАВА IV БАЗОВЫЕ СТАТИСТИЧЕСКИЕ ЗНАНИЯ, НЕОБХОДИМЫЕ ДЛЯ ИНТЕРПРЕТАЦИИ ДАННЫХ ПО ДОКАЗАТЕЛЬНОЙ МЕДИЦИНЕ
Неправильная оценка статистической достоверности полученной информации может привести к игнорированию клинически важных сведений и использованию на практике бесполезных данных. Классическим приемом искажения реальных тенденций является значительное увеличение числа наблюдений, что позволяет доказать наличие даже столь небольших различий, которые не имеют реального клинического значения (как это было, например, в исследовании ALLHAT в отношении повышения уровня глюкозы крови при терапии тиазидными диуретиками). Необходимо помнить, что статистическая достоверность не является синонимом клинической значимости результатов исследования.
В настоящее время существует немало программ для статистической обработки данных и руководств по медицинской статистике, где приведены необходимые формулы, даны подробные инструкции по обработке результатов медицинских исследований. Это значительно облегчило и сделало доступным проведение качественного статистического анализа практически любому врачу, имеющему навыки работы с персональным компьютером.
Основы медицинской статистики преподаются в медицинских университетах, поэтому цель настоящей главы - не изложение сухих математических формул, а попытка дать тот минимум знаний, который необходим практическому врачу.
Для адекватного анализа полученных данных необходимо применять:
• для оценки выживаемости - методы, основанные на принципе построения таблиц доживания, кривые Каплана-Мейера, модель Кокса, формулы множественной пошаговой регрессии, показатели абсолютного и относительного риска;
• для выявления существенности различий между кривыми выживаемости - тест Вилкоксона-Гехана, обобщенный показатель кси-квадрат и критерий logrank.
При проведении клинических исследований наиболее часто используют две модели:
• модель постоянных эффектов, когда изучаемое вмешательство во всех исследованиях оказывает одинаковый эффект, а имеющиеся различия обусловлены только дисперсией внутри самих исследований;
• модель случайных эффектов, когда влияние вмешательства в разных исследованиях может быть разным. Она уже учитывает дисперсию не только внутри одного исследования, но и между разными исследованиями.
При количественной оценке результата существует два вида ошибки - систематическая и случайная. Случайная ошибка - отклонение результата отдельного наблюдения или измерения от его истинного значения, обусловленное исключительно случайностью. Систематическая ошибка - это систематическое (неслучайное) отклонение результатов от истинных значений. Чтобы понять природу случайной ошибки, представим себе, что мы подкидываем монетку и смотрим, что выпадет: «орел» или «решка». Оба исхода равновероятны, однако если мы подкинем монетку 10 раз, вполне возможно, что «решка» выпадет 7 раз, а «орел» только 3. Означает ли это, что «решка» всегда выпадает примерно в 2,5 раза чаще, чем «орел»? Конечно же нет: чем больше будет число опытов, тем ближе частота выпадения «орла» или «решки» будет приближаться к 50 %. Точно так же различия в опытной и контрольной группе пациентов могут быть обусловлены чистой случайностью (часть больных выздоровела благодаря лекарству, а часть просто выздоровела). Чтобы избежать случайных ошибок, эксперимент проводят с привлечением большего числа испытуемых. Количество больных, как правило, исчисляется десятками тысяч. Для получения надежных данных больные наблюдаются и обследуются годами - от 4 до 10 лет, а иногда дольше. Нередко для большей достоверности исследование неоднократно повторяют, а также используют доверительные интервалы, табл. 4.1.
Для того чтобы учесть влияние случайности, и узнать, насколько результат достоверен, применяют методы статистической обработки данных. Однако остаются еще систематические ошибки, избежать которых гораздо сложнее.
Систематические ошибки могут быть обусловлены:
• эффектом плацебо;
• нарушением правил отбора пациентов;
• неудачно выбранным методом оценки результатов (субъективная оценка всегда дает завышенный результат по сравнению с данными прибора);
• неправильно проведенным статистическим анализом.
Таблица 4.1. Доверительные интервалы показателя вероятности, равного 0,5, в эксперименте с подбрасыванием монеты
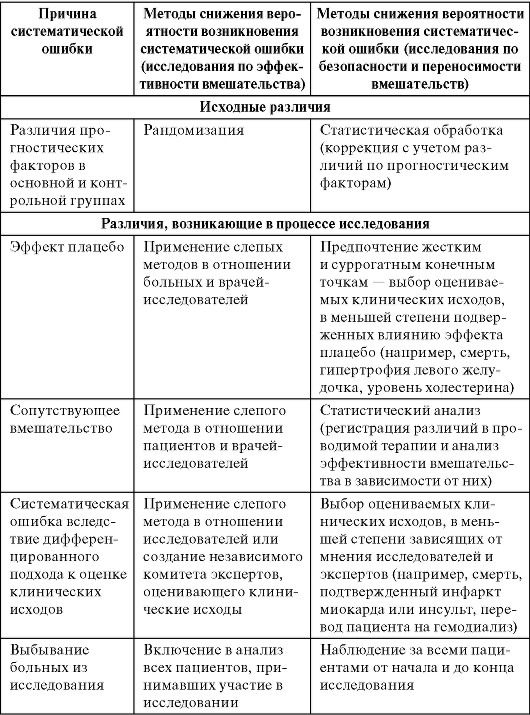
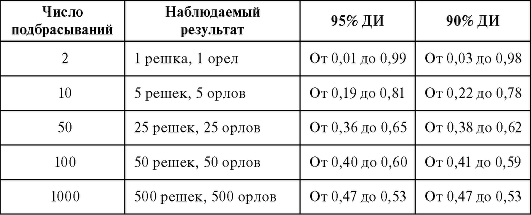 В настоящее время предложены различные методы для снижения вероятности систематической ошибки (табл. 4.2). Главным из них является рандомизированное исследование (от англ., random - случайный, произвольный), при котором группы испытуемых подбираются случайно. Для максимального уменьшения влияния «человеческого фактора» на результаты применяют двойной или тройной слепой метод, когда пациенты и врачи не знают, какая группа получает плацебо, а какая - исследуемый препарат. Для этого на упаковки с препаратом и плацебо наносится маркировка, смысл которой раскрывается только в конце исследования или при появлении тяжелых осложнений, связанных с приемом препарата. Врачи-исследователи узнают о том, чем лечился пациент (плацебо или испытуемым препаратом), только после сбора и анализа полученных результатов.
В настоящее время предложены различные методы для снижения вероятности систематической ошибки (табл. 4.2). Главным из них является рандомизированное исследование (от англ., random - случайный, произвольный), при котором группы испытуемых подбираются случайно. Для максимального уменьшения влияния «человеческого фактора» на результаты применяют двойной или тройной слепой метод, когда пациенты и врачи не знают, какая группа получает плацебо, а какая - исследуемый препарат. Для этого на упаковки с препаратом и плацебо наносится маркировка, смысл которой раскрывается только в конце исследования или при появлении тяжелых осложнений, связанных с приемом препарата. Врачи-исследователи узнают о том, чем лечился пациент (плацебо или испытуемым препаратом), только после сбора и анализа полученных результатов.
Одной из наиболее частых является систематическая ошибка при отборе больных. Она также называется смещением. Причины ее возникновения:
• центростремительное смещение (centripetal bias). В его основе лежит концентрация больных в специализированных центрах при оказании квалифицированной помощи. Это приводит к тому, что в них собираются самые сложные и тяжелые больные, используются наиболее современные и эффективные методы диагностики и лечения, а также работают наиболее квалифицированные специалисты. Следовательно, результаты, полученные в таком центре, не в полной мере будут соответствовать реальной клинической практике;
Таблица 4.2. Методы снижения вероятности возникновения систематической ошибки в исследованиях с жесткими и суррогатными конечными точками
•  смещение вследствие популярности (popularity bias). В специализированных центрах в связи с их более мощными диагностическими возможностями и другими субъективными факторами (например, престижность госпитализации в это высокотехнологичное учреждение) часто наблюдаются непрофильные пациенты, которым проводится лечение, не соответствующее принятому в реальной клинической практике, так как у специалистов центра меньше опыта в лечении «атипичной» патологии, что также сказывается на результатах лечения;
смещение вследствие популярности (popularity bias). В специализированных центрах в связи с их более мощными диагностическими возможностями и другими субъективными факторами (например, престижность госпитализации в это высокотехнологичное учреждение) часто наблюдаются непрофильные пациенты, которым проводится лечение, не соответствующее принятому в реальной клинической практике, так как у специалистов центра меньше опыта в лечении «атипичной» патологии, что также сказывается на результатах лечения;
• смещение вследствие фильтрации (referral filter bias). По мере движения пациентов от поликлиники к специализированным центрам происходит дифференциация больных по ряду особенностей: тяжести течения заболевания, демографическим характеристикам, финансовым возможностям. Очевидно, что пациенты, наблюдаемые в специализированных центрах, по качеству обследования и проводимому лечению будут существенно отличаться от контингента сельских участковых больниц и амбулаторий;
• смещение вследствие доступности диагностики (diagnostic access bias). По сути является частным вариантом приведенного выше смещения вследствие фильтрации.
Поскольку именно в специализированных центрах проводится большинство качественных клинических исследований, полученные в них данные нельзя игнорировать, но необходимо учитывать приведенные особенности в отборе пациентов при экстраполяции результатов исследования на реальную клиническую практику.
Частая причина возникновения систематической ошибки - эффект плацебо, который может завышать эффективность лекарства на 30-40%. Поэтому при применении лекарств с доказанной эффективностью число положительных эффектов должно существенно и достоверно превышать их частоту при приеме плацебо.
Исключительную роль играет плацебо при оценке безопасности испытуемого препарата. Если новый препарат безопасен, число побочных, нежелательных и серьезных явлений должно быть одинаковым в группах лечения и плацебо.
По завершении исследования важно не только статистически грамотно доказать достоверность полученных результатов, но и корректно определить клинико-демографические пределы эффективности нового вмешательства. Необходимо выяснить, окажется ли действие препарата аналогичным на любого другого пациента с исследуемой патологией. Эта задача сложна, поскольку обобщаемость проводится
на большей или меньшей выборке (части популяции), и даже самая большая из них всегда будет меньше популяции. Для повышения обобщаемости результатов исследование проводят в разных исследовательских центрах и клиниках (многоцентровое исследование), на разных по своим демографическим характеристикам выборках.
Важнейшим понятием в клинических исследованиях является исход - клинически значимое явление, изменение лабораторного показателя или признака у лиц опытной и контрольной группы. Исходы являются основными критериями оценки эффективности диагностического, лечебного или профилактического вмешательства.
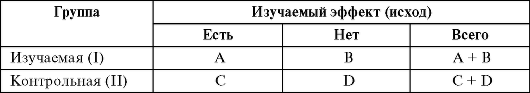 ЧИЛ - частота исходов в группе лечения A/(A+B). ЧИК - частота исходов в контрольной группе C/(C+D). На основании исходов вмешательства строят таблицу сопряженности, с помощью которой рассчитываются другие важные показатели.
ЧИЛ - частота исходов в группе лечения A/(A+B). ЧИК - частота исходов в контрольной группе C/(C+D). На основании исходов вмешательства строят таблицу сопряженности, с помощью которой рассчитываются другие важные показатели.
1. ОР (относительный риск) = (ЧИЛ/ЧИК)
2. Шанс = А/В или С/D.
3. ОШ (отношения шансов) = (А/В)/(С/D).
Большинство результатов клинических исследований выражается в терминах, не всегда легко применимых и понятных практическому врачу.
Одним из наиболее часто используемых понятий, описывающих полученные результаты, является термин «риск», отражающий частоту определенного исхода (под риском понимают вероятность какоголибо события, которая может изменяться в диапазоне от 0 до 1. При вероятности, равной 0, событие никогда не произойдет, а при вероятности, равной 1, происходит всегда).
В качестве примера можно рассмотреть виртуальное исследование, где сравнивается частота госпитализаций пациентов с хронической сердечной недостаточностью в контрольной группе больных, получающих плацебо, и в группе больных, получающих новый препарат Х, способный уменьшать число сердечных сокращений. Допустим, что в конце исследования при госпитализации в стационар у 50% больных в контрольной группе риск госпитализации равнялся 0,50, и только у 10% больных, получавших препарат Х, риск госпитализации рав-
нялся 0,10. Исходя из того что относительный риск в группе лечения, сравниваемый с риском в контрольной группе, - простое отношение риска в двух группах и является частным от деления риска в группе лечения на риск в контрольной группе. Следовательно, в разбираемом примере он составляет 0,10 : 0,50 = 0,20. Эти сравнительные данные можно также представить в виде снижения относительного риска (отношение между снижением риска в группе лечения и риском в контрольной группе) или рассчитать как 1 - относительный риск.
Главным недостатком показателя относительного риска является его значение (например, 0,2), которое одинаково вне зависимости от того, снижается ли он с 0,50 до 0,10 или с 0,05 до 0,01. В этой связи большее значение имеет снижение абсолютного риска при вычитании риска в одной группе из риска в другой (риск в группе лечения вычитается из риска в группе плацебо). В нашем примере снижение абсолютного риска будет равно 0,50 - 0,10 = 0,40 или 40%. В то же время при снижении риска с 0,05 до 0,01 снижение абсолютного риска составит 0,05 - 0.01 = 0,040 или 4%, т.е. будет существенно меньше.
Таким образом, показатели относительного риска и снижения относительного риска количественно отражают результаты вмешательства в относительных величинах, но не дают информации о размере влияния в абсолютном выражении. Абсолютный риск в меньшей степени отражает относительную эффективность вмешательства, но наглядно показывает, будет ли эффект от вмешательства клинически значимым.
Абсолютный риск является основой для расчета другого более понятного для практического врача показателя - числа больных, которых необходимо лечить определенным методом в течение определенного времени, чтобы достичь определенного эффекта или предотвратить неблагоприятный исход у одного больного (ЧБНЛ).
В тех случаях, когда исследуемое вмешательство снижает вероятность развития неблагоприятного исхода, используются следующие показатели.
• СОР (снижение относительного риска) - относительное уменьшение частоты неблагоприятных исходов в группе лечения по сравнению с контрольной группой, рассчитываемое как (ЧИЛ - ЧИК)/ЧИК; приводится вместе с 95% ДИ.
• САР (снижение абсолютного риска) - абсолютная арифметическая разница в частоте неблагоприятных исходов между группами лечения и контроля. Рассчитывается как (ЧИЛ - ЧИК).
• ЧБНЛ - число больных, которых необходимо лечить определен-
ным методом в течение определенного времени, чтобы предотвратить неблагоприятный исход у одного больного. Рассчитывается как 1/САР и приводится вместе с 95% ДИ. Низкое значение ЧБНЛ, приближающееся к 1, означает, что благоприятный исход наблюдается почти у каждого больного, получающего лечение. Когда исследуемое вмешательство повышает вероятность развития благоприятного исхода, используют следующие показатели.
• ПОП (повышение относительной пользы) - относительное увеличение частоты благоприятных исходов в группе лечения по сравнению с контрольной группой, рассчитываемое как (ЧИЛ -
ЧИК)/ЧИК; приводится с 95% ДИ.
• ПАП (повышение абсолютной пользы) - абсолютная арифметическая разница в частоте благоприятных исходов между группами лечения и контроля. Рассчитывается как (ЧИЛ - ЧИК).
• ЧБНЛ - число больных, которых необходимо лечить определенным методом в течение определенного времени, чтобы достичь определенного благоприятного эффекта у одного больного. Рассчитывается как 1/ПАП и приводится вместе с 95% ДИ.
Если исследуемое вмешательство повышает вероятность развития неблагоприятного исхода, используются следующие показатели.
• ПОР (повышение относительного риска) - относительное увеличение частоты неблагоприятных исходов в группе лечения по сравнению с контрольной группой. Рассчитывается как (ЧИЛ - ЧИК)/ЧИК; приводится вместе с 95% ДИ. ПОР также используется для оценки влияния факторов риска на развитие заболевания.
• ПАР (повышение абсолютного риска) - абсолютная арифметическая разница в частоте неблагоприятных исходов между группами вмешательства и контроля. Рассчитывается как (ЧИЛ - ЧИК). ПАР также используется для оценки влияния факторов риска на развитие заболевания.
• ИПВ (индекс потенциального вреда) - число больных, которые должны получить экспериментальное лечение, чтобы у одного дополнительного больного развился неблагоприятный исход, - по сравнению с больными из контрольной группы. Рассчитывается как 1/ПАР и приводится вместе с 95% ДИ.
Литература
1. Begg С., Cho M., Eastwood S., Horton R., Moher D., Olkin I. et al. Improving the quality of reporting of randomized controlled trials. The CONSORT statement. JAMA 1996; 276: 637-9.
2. Berlin J.A., Antman E.M. Advantages and limitations of metaanalytic regressions of clinical trials data. Online J Curr Clin Trials. 4 June 1994: Doc. ? 134.
3. Counsell С. Formulating questions and locating primary studies for inclusion in systematic reviews. Ann Intern Med 1997; 127: 380-7.
4. DerSimonian R., Laird N. Meta-analysis in clinical trials. Control Clin
Trials 1986; 7: 177-88.
5. Dickersin К. The existence of publication bias and risk factors for its
occurrence. JAMA 1990; 263: 1385-9.
6. Dickersin К., Chan S., Chalmers T.C., Sacks H.S., Smith H. Jr. Publication bias and clinical trials. Control Clin Trials 1987; 8: 343-53.
7. Feinstein A.R. Clinical biostatistics. St. Louis, MO: C.V. Mosby Co,
1977: 468.
8. Greenland S., Salvan A. Bias in the one-step method for pooling study results. Stat Med 1990; 9: 247-52.
9. Hedges L.V., Olkin I. Statistical Methods for Meta-Analysis. Orlando: Academic Pr; 1985.
10. McQuay H.J., Moore R.A. Using numerical results from systematic reviews in clinical practice. Ann Intern Med 1997; 126: 712-20.
11. Meade М.О., Richardson W.S. Selecting and appraising studies for a systematic review. Ann Intern Med 1997; 127: 531-7. Международный журнал медицинской практики 1999; 5:7-13.
12. Michels K.B., Rosner B.A. Data trawling: to fish or not to fish. Lancet
1996; 348: 1152-3.
13. Oxman A.D., Guyatt G.H. A consumer's guide to subgroup analyses. Ann
Intern Med 1992; 116: 78-84.
14. Sinclair J.C., Bracken M.B. Clinically useful measures of effect in binary analyses of randomized trials. J. Clin Epidemiol 1994; 47: 881-90.
15. Власов В.В., Никольский В.А. Вероятность отклонения от референтных интервалов при скрининге по множеству параметров // Лаб.
дело. - 1984. -? 1. - С. 46-49.
16. МакМан Б., Пью Т., Ипсен Д. Применение эпидемиологических методов при изучении неинфекционных заболеваний. - М., 1965. - 318 с.
17. Сепетлиев Д.А. Статистические методы в научных медицинских исследованиях. - М., 1968. - 419 с.
18. Флетчер Р., Флетчер С., Вагнер Э. Клиническая эпидемиология. Основы доказательной медицины / Пер. с англ. - М.: Медиа Сфера,
1998. - 352 с.