Медицина, основанная на доказательствах: учебное пособие. Петров В.И., Недогода С.В. 2012. - 144 с.
|
|
|
|
ГЛАВА III ОСНОВНЫЕ ПОНЯТИЯ И МЕТОДЫ ДОКАЗАТЕЛЬНОЙ МЕДИЦИНЫ
Оценка уровня доказательности является основным рабочим инструментом в доказательной медицине (рис. 3.1). Поэтому важнейшим механизмом, позволяющим врачу ориентироваться в огромном количестве публикуемых медицинских данных, является рейтинговая система оценки научных исследований. Однако до настоящего времени отсутствует общепринятая шкала по оценке степени доказательности.
Категорий доказательности исследования может быть несколько - от 3 до 7. Меньшей цифре соответствует меньшая доказательность. Также выделяют три категории доказательности исследования.
• Категория I - хорошо разработанные, крупные, рандомизированные, контролируемые исследования, данные мета-анализа или систематических обозрений.
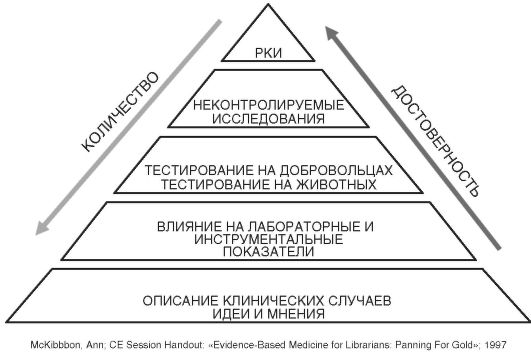 Рис. 3.1. Пирамида медицинских публикаций
Рис. 3.1. Пирамида медицинских публикаций
• Категория II - когортные исследования и исследования типа случай-контроль.
• Категория III - неконтролируемые исследования и консенсусы специалистов.
Практические рекомендации по диагностике и лечению могут опираться как на данные исследований, так и на их экстраполяцию. С учетом этого обстоятельства рекомендации подразделяют на 3-5 уровней, которые принято обозначать латинскими буквами - A, B, C, D, E.
А - доказательства убедительны: есть веские доказательства в пользу применения данного метода;
В - относительная убедительность доказательств: есть достаточно доказательств в пользу того, чтобы рекомендовать данное предложение;
С - достаточных доказательств нет: имеющихся доказательств недостаточно для вынесения рекомендации, но рекомендации могут быть даны с учетом иных обстоятельств;
D - достаточно отрицательных доказательств: имеется достаточно доказательств, чтобы рекомендовать отказаться от применения данного метода в определенной ситуации;
Е - веские отрицательные доказательства: имеются достаточно убедительные доказательства, чтобы исключить данный метод из рекомендаций.
В большинстве стран Западной Европы и Канаде выделяют три уровня доказательности - A, B, C. Рекомендации уровня А базируются на результатах исследований, относимых к I категории доказательности и, следовательно, отличаются наиболее высоким уровнем достоверности. Достоверность рекомендаций уровня В также достаточно высока, так как при их формулировании используются материалы исследований II категории или экстраполяции исследований I категории доказательности. Рекомендации уровня С строятся на основании неконтролируемых исследований и консенсусов специалистов (III категории доказательности) или содержат экстраполяции рекомендаций I и II категории.
Одной из наиболее всеобъемлющих является Oxford Centre for Evidence-based Medicine Levels of Evidence, опубликованная в мае 2001 г. (оригинал приведен в приложении 1). В ней использованы следующие критерии достоверности медицинской информации:
• высокая достоверность - информация базируется на результатах нескольких независимых клинических исследований с совпадением результатов, обобщенных в систематических обзорах;
• умеренная достоверность - информация основана на результатах нескольких близких по целям клинических независимых исследований;
• ограниченная достоверность - информация основана на результатах одного клинического исследования;
• строгие научные доказательства отсутствуют (клинические испытания не проводились) - утверждение основано на мнении экспертов.
Совершенно очевидно, что использовать данные рекомендации в повседневной практике затруднительно не только практическому врачу, но и научному сотруднику.
Американское Агентство по политике здравоохранения и научным исследованиям предложило более простую шкалу с выделением следующих уровней доказательств в порядке убывания их достоверности:
I а - мета-анализ РКИ;
I b - как минимум одно РКИ;
II а - хорошо организованное контролируемое исследование без рандомизации;
II b - как минимум одно хорошо организованное квази-экспериментальное исследование;
III - не экспериментальные исследования;
IV - отчет экспертного комитета или мнение и/или клинический опыт авторитетных специалистов.
В последнем случае главную роль играет субъективный фактор, в частности личный опыт врача и мнение экспертов, выбор которых может иметь тенденциозный характер. Шотландской Межколлегиальной медицинской сетью также разработана система оценки уровня доказательств, опирающаяся на элементы, рассмотренные выше:
А - при уровне I а, I b;
В - при уровне II а, II b, III;
С - при уровне IV (только если нет А и В).
Движением «Доказательная медицина» предложена шкала для оценки уровня достоверности знаний, учитывающая в первую очередь схему получения соответствующего знания (табл. 3.1).
Таблица 3.1. Уровни достоверности знаний для терапии (по журналу Critical Care Medicine (1995), 23, N l, 395 с.). Используются три градации достоверности (А, В, С) и пять уровней со знаками I, I-, II, II-, III, IV, V)
Градация | Доступен высококачественный обзор | Нет высококачественного обзора |
А | Случай, когда нижняя граница доверительного интервала для эффекта лечения превышает клинически значимый выигрыш: - результаты исследований однородны - результаты исследований неоднородны (I-) | Рандомизированные испытания с низким уровнем ошибок первого и второго рода (I) |
B | Случай, когда нижняя граница доверительного интервала для эффекта лечения ниже клинически значимого выигрыша, но точечная оценка выше: - результаты исследований однородны (11+); - результаты исследований неоднородны (II-) | Рандомизированные испытания с высоким уровнем ошибок первого и второго рода (II) |
С | Нерандомизированные одновременные когортные исследования (III) Нерандомизированные исторические когортные исследования (IV) Серии отдельных случаев (V) |
Несмотря на то что, по мнению авторов, данная шкала наиболее понятна рядовому практикующему врачу, она требует от пользователя достаточно хорошего знания дизайна исследований. Авторы шкалы призывают считать ее компромиссной, выстраданной, но вместе с тем ставящей заслон перед неподкрепленными опытом «физиологическими принципами» и «клиническими рассуждениями». Ею, считают авторы, следует пользоваться до тех пор, пока в медицине не возникнут условия для использования более объективной шкалы.
Для практических врачей, имеющих самые элементарные представления о клинической эпидемиологии и статистике, вполне приемлемой может быть оценка достоверности доказательств из различных источников по рекомендациям Шведского совета по методологии оценки в здравоохранении, Согласно им достоверность убывает в следующем порядке:
• рандомизированное контролируемое клиническое исследование;
• нерандомизированное клиническое исследование с одновременным контролем;
• нерандомизированное клиническое исследование с историческим контролем;
• когортное исследование;
• «случай-контроль»;
• перекрестное клиническое исследование;
• результаты наблюдений.
Систематизированные обзоры
Рост количества и повышение качества результатов клинических исследований в последние 10 лет играют важную роль в принятии практических решений в повседневной клинической деятельности. Практикующему врачу разобраться в беспрерывном и нарастающем информационном потоке достаточно сложно, существенную помощь в этом ему оказывают систематизированные обзоры по разным проблемам профилактики, диагностики и лечения широкого круга заболеваний. Главное достоинство обзора - объединение информации о нескольких исследованиях, что позволяет получить объективное представление о клиническом эффекте анализируемого вмешательства по сравнению с отдельно взятым клиническим исследованием. Систематизированные обзоры являются одной из наиболее важных составляющих доказательной медицины.
Результаты отдельных исследований, пусть даже с большим количеством пациентов, в значительной мере отражают эффективность вмешательства на ограниченной выборке больных, которая определяется критериями включения и исключения, а также ее клинико-демографическими показателями. Поэтому надо весьма осторожно экстраполировать сделанные по результатам конкретного исследования выводы на всю популяцию пациентов. В исследованиях с участием небольшого количества больных возрастает роль случайного фактора, что может привести к получению неверных результатов.
Атрибутивные признаки систематизированного обзора (четкое описание принципов и критериев отбора исследований для включения в него методов анализа и стандартов качества исследований) позволяют существенно снизить риск систематической ошибки, а также получить более широкую выборку пациентов.
Прежде всего для систематизированного обзора отбираются исследования в соответствии с конкретным клиническим вопросом. Главной целью систематизированного обзора является получение ответа на следующие вопросы в доступной для понимания практического врача форме.
1. Действительно ли эффективно анализируемое вмешательство?
2. Насколько эффективнее анализируемое вмешательство по сравнению с плацебо, «традиционной» терапией или по сравнению с другими схожими вмешательствами, применяемыми при конкретной патологии в настоящее время?
3. Насколько безопасно анализируемое вмешательство, в том числе и при сравнении с уже применяющимися вмешательствами?
4. Оправдано ли применение анализируемого вмешательства у конкретного больного с учетом соотношения польза (эффективность)/ риск (безопасность)?
5. Возможна ли замена анализируемого вмешательства на уже применяющееся вмешательство и какие последствия будет иметь такая замена?
Результаты систематизированных обзоров, как правило, изобилуют не только цифрами, но специальной терминологией и сокращениями, которые трудно понять и правильно интерпретировать практикующему врачу. Наиболее употребительные в доказательной медицине термины и сокращения приведены в приложении, в настоящее время большинство из них используется уже не только в специальной медицинской литературе, но и во время презентаций на национальных конгрессах и симпозиумах.
Одним из наиболее важных понятий является показатель NNT (the number needed to treat; русская аббревиатура ЧБНЛБИ или ЧБНЛ - число больных, которых необходимо лечить определенным методом в течение определенного времени, чтобы достичь определенного эффекта или предотвратить неблагоприятный исход у одного больного). Достоинством этого показателя является возможность его применения в условиях реальной клинической практики обычного врача. Кроме этого, при различных вмешательствах, приводящих к
одинаковому результату при одном заболевании, знание величины ЧБНЛ позволяет выбрать оптимальную тактику лечения конкретного пациента (табл. 3.2).
Таблица 3.2. Влияние ИАПФ на смертность в РКИ по профилактике и лечению ХСН
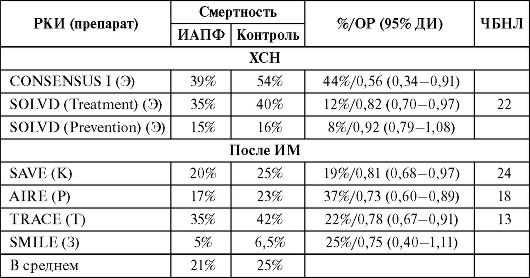 Примечание. Э - эналаприл; К - каптоприл; Р - рамиприл; Т - трандалоприл; З - зофеноприл
Примечание. Э - эналаприл; К - каптоприл; Р - рамиприл; Т - трандалоприл; З - зофеноприл
Показатель ЧБНЛ всегда предполагает существование группы сравнения (референтной группы), в которой больные получают плацебо или какое-то другое лечение или вообще не получают его. Показатель ЧБНЛ может быть различным в рамках одного исследования в зависимости от выбранного критерия оценки эффективности вмешательства (чаще всего это «суррогатные» конечные точки, принятые для конкретного заболевания).
Противоположным по смыслу является показатель «число больных, которых необходимо лечить определенным методом в течение определенного времени, чтобы вмешательство могло нанести вред одному больному». Особую важность этот показатель приобретает при оценке целесообразности профилактического вмешательства. Знание этого показателя и ЧБНЛБИ позволяет оценить степень риска вмешательства у конкретного пациента.
ЧБНЛ для определенного вида вмешательства (чаще всего лечения) является величиной, обратной снижению абсолютного риска при этом
вмешательстве. Рассмотрим это на конкретном примере. В результате проведенного исследования было показано, что в результате лечения препаратом Х риск развития одного из характерных осложнений для анализируемого заболевания снизился с 0,5 до 0,3, относительный риск составил 0,20, снижение относительного риска - 0,80, а снижение абсолютного риска - 0,20. Следовательно ЧБНЛ равно 1 : 0,20 = 5. С практической точки зрения это означает, что врачу надо лечить препаратом Х 5 больных, чтобы предотвратить развитие одного осложнения у одного больного.
На величину показателя ЧБНЛ существенное влияние оказывает степень снижения абсолютного риска. Простота расчета показателя ЧБНЛ позволяет широко использовать его в качестве основного цифрового показателя эффективности (или потенциального вреда) анализируемого вида вмешательства. Главное преимущество ЧБНЛ состоит в том, что его может использовать любой врач применительно к условиям своей практики.
В этой связи становится очень важным понять возможности и пределы использования показателя ЧБНЛ в условиях реальной клинической практики.
Особенности показателя:
• строго специфичен для определенного вида вмешательства и у конкретной категории пациентов;
• описывает различие по клинически важным исходам между группой вмешательства и контрольной группой;
• низкий показатель (около 1) означает, что благоприятный исход наблюдается почти у каждого больного, получающего лечение, и лишь у небольшой части больных в группе сравнения;
• на практике показатель, равный единице, встречается крайне редко даже при исследовании антибиотиков;
• абсолютное значение показателя не является критерием для принятия решения о целесообразности вмешательства, а отражает вероятность достижения положительного эффекта. Так, при сердечной недостаточности эффективность различных, в том числе и официально рекомендованных лечебных вмешательств, колеблется от 20 до более чем 100, но при этом все они используются у этой категории пациентов, потому что считаются эффективными, причем часто одновременно (например, комбинация ИАПФ с β-адреноблокаторами и спиронолактоном).
Ограничения для использования показателя:
• может корректно использоваться только в пределах 95% доверительного интервала (означает, что в 9 из 10 случаев истинное значение ЧБНЛ находится в пределах данного диапазона) для исследуемой выборки;
• при отсутствии значений доверительного интервала даже при наличии низких значений показателя не исключено отсутствие благоприятного эффекта вмешательства ввиду дискретного значения ЧБНЛ;
• можно сравнивать значения ЧБНЛ только для одинаковых заболеваний, так как их клинические исходы могут быть различны. Так, последствия профилактики тромбообразования при инсульте и геморрое различны;
• прямое сравнение значений показателей ЧБНЛ допустимо только в том случае, если они рассчитаны для различных вмешательств при одном заболевании, одинаковой степени тяжести и в отношении одного и того же исхода;
• значения показателя могут изменяться для одного вида вмешательства у конкретной группы пациентов в зависимости от исходного уровня риска (низкий, промежуточный или высокий) в ней. Причем закономерности между степенью риска и эффективностью вмешательства не существует. Так, тяжелое заболевание может легче поддаваться лечению, чем то же заболевание легкой или умеренной степени тяжести и наоборот. В конечном счете все определяется самим заболеванием и его прогнозом для жизни и инвалидизации;
• определение показателя ЧБНЛ предполагает оценку влияния вмешательства на исход в течение определенного периода времени (чаще всего это средняя длительность РКИ). Поэтому сравнение показателей ЧБНЛ при различных вмешательствах, но одной патологии, правомерно только в том случае, когда оценивается эффективность вмешательств в течение одинакового периода времени. Нельзя сравнивать эффективность лечения с использованием одного вида вмешательства на протяжении 1 года, другого - на протяжении 3 лет, а третьего - на протяжении 5 лет.
Различия в показателе ЧБНЛ при лечебном и профилактическом вмешательстве:
• при лечебном вмешательстве во всех группах сравнения проводится лечение, поэтому ключевым вопросом является определение и сравнение эффективности различных вмешательств;
• при профилактике важно выяснить, будет ли профилактическое вмешательство предотвращать неблагоприятный исход более эффективно, чем отсутствие всякого вмешательства;
• при лечебных и профилактических вмешательствах необходимо взвесить соотношение риска и пользы для каждого из возможных вмешательств;
• при профилактических вмешательствах существует возможность получить нежелательные явления у части лиц без достижения какого-либо благоприятного эффекта;
• показатель ЧБНЛ позволяет расположить сравниваемые виды вмешательств в порядке их убывания или возрастания, что упрощает выбор варианта лечения. Однако при окончательном решении необходимо учитывать и такие факторы, как стоимость лечения, сопутствующую клинически значимую патологию и особенности больного, так как они существенно влияют на приверженность пациента к терапии. Оценивая эффективность вмешательства со стороны врачей и пациентов, необходимо отдавать предпочтение последним, поскольку оценка врача всегда менее чувствительна, чем оценка больных;
• профилактическое вмешательство чаще всего не влияет на большую часть популяции за исключением лиц из группы риска. Величина ЧБНЛ при профилактических вмешательствах свидетельствует об их эффективности в популяции, однако в меньшей степени применима к каждому конкретному случаю;
• показатель ЧБНЛ при профилактике должен всегда использоваться одновременно с показателем ЧБНЛНИ (количество больных в экспериментальной группе по сравнению с контрольной, необходимое для выявления дополнительного неблагоприятного исхода). Также необходима оценка индивидуального исходного риска. поскольку при его исходно низком уровне целесообразность профилактического вмешательства отсутствует.
Принцип расчета показателя ЧБНЛ позволяет оценивать и безопасность вмешательств. Число больных, у которых при вмешательстве возникает нежелательное явление, у одного пациента рассчитывается так же, как ЧБНЛ. Однако в тех случаях, когда частота нежелательных явлений низка, статистически достоверную величину доверительного интервала определить невозможно, он становится неопределенным. В этом случае вред от вмешательства имеет только точечную оценку. Выраженные неблагоприятные явления в
РКИ выявляются по количеству случаев выбывания из него в связи с проводимым вмешательством. Отсутствие в систематизированных обзорах и результатах РКИ информации о побочных эффектах и частоте выбывания пациентов вследствие нежелательных явлений существенно снижает их ценность.
В систематизированных обзорах могут также рассматриваться и другие последствия лечения, которые не укладываются в обычные представления о желательных и нежелательных эффектах вмешательства. Например. снижение риска развития новообразований кишечника при длительном применении ацетилсалициловой кислоты для первичной и вторичной профилактики сердечно-сосудистых осложнений.
Принцип расчета показателя ЧБНЛ при его отсутствии в публикации
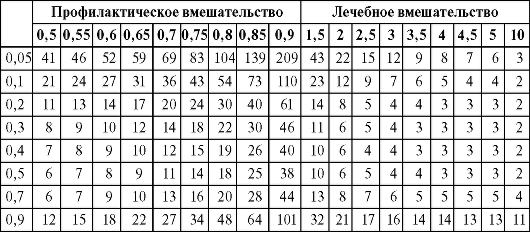
Риск развития исхода (вероятность) выражается по отношению к общей выборке определенного размера, например когда 15 случаев одного исхода наблюдаются в выборке из 100 человек, риск этого исхода равен 0,15. В этом случае шанс такого исхода в выборке рассчитывается как число развившихся исходов по отношению к числу неразвившихся (например, 15 к 85 или 0,17). Тогда отношение шансов рассчитывается просто как шанс исхода в группе лечения, деленный на шанс этого исхода в группе сравнения. Поэтому если в систематизированном обзоре приводится только отношение шансов, но нет значений ЧБНЛ, последний показатель можно рассчитать по табл. 3.3. Для этого необходимо выбрать колонку с наиболее близким к опубликованному значением отношения шансов и строку с самым близким к ожидаемому значением частоты исхода, а затем на их пересечении найти соответствующее значение ЧБНЛ. В левой ее части приведены значения отношения шансов меньше 1,0. Это означает, что при профилактических вмешательствах, когда исход - это возникновение заболевания, рецидив, осложнения или ухудшение течения болезни, интересующий исход в группе лечения встречается реже, чем в группе сравнения. В правой части рисунка значения отношения шансов больше 1,0 - значит, интересующий исход чаще встречается в группе лечения, что типично для исследований по изучению эффективности лечебных вмешательств (где исход - это полное выздоровление, ремиссия, отсутствие осложнений или стабилизация течения заболевания).
Таблица позволяет определить, как различная частота исхода влияет на величину ЧБНЛ при определенном значении отношения шансов.
Таблица 3.3. Расчет ЧБНЛ по величине отношения шансов
 При экстраполяции данных систематизированного обзора врач прежде всего должен оценить степень его соответствия той группе пациентов, для которой был выявлен положительный эффект вмешательства. Несомненно, что личный опыт врача и существующие стандарты лечения должны быть учтены при принятии окончательного решения. Представление об эффективности препаратов может изменяться по мере появления дополнительных данных после завершения крупных рандомизированных контролируемых испытаний. Появляются новые данные и меняются результаты систематизированных обзоров. Поэтому в практической работе необходимо использовать наиболее свежие из них. Главное состоит в том, что систематизированные обзоры могут предоставлять объективную информацию, позволяющую пациенту и врачу прогнозировать эффективность и возможные последствия от конкретного вмешательства еще до начала лечения.
При экстраполяции данных систематизированного обзора врач прежде всего должен оценить степень его соответствия той группе пациентов, для которой был выявлен положительный эффект вмешательства. Несомненно, что личный опыт врача и существующие стандарты лечения должны быть учтены при принятии окончательного решения. Представление об эффективности препаратов может изменяться по мере появления дополнительных данных после завершения крупных рандомизированных контролируемых испытаний. Появляются новые данные и меняются результаты систематизированных обзоров. Поэтому в практической работе необходимо использовать наиболее свежие из них. Главное состоит в том, что систематизированные обзоры могут предоставлять объективную информацию, позволяющую пациенту и врачу прогнозировать эффективность и возможные последствия от конкретного вмешательства еще до начала лечения.
Для профилактических вмешательств ЧБНЛ рассчитывается по формуле:
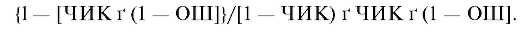 Для лечебных вмешательств ЧБНЛ рассчитывается по формуле:
Для лечебных вмешательств ЧБНЛ рассчитывается по формуле:
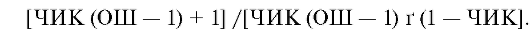 Систематические обзоры подразделяются на качественные и количественные. Последние отличаются использованием специальных статистических методов для обобщения результатов (мета-анализ)
Систематические обзоры подразделяются на качественные и количественные. Последние отличаются использованием специальных статистических методов для обобщения результатов (мета-анализ)
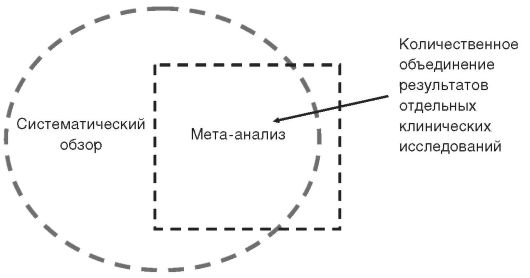 Рис. 3.2. Взаимодействие систематических обзоров и мета-анализа
Рис. 3.2. Взаимодействие систематических обзоров и мета-анализа
различных исследований с целью получения вывода об эффективности вмешательства или диагностического метода. Часто систематический обзор, выполненный с использованием статистических методов, также называют мета-анализом, однако это не совсем корректно. Их соотншение представлено на рис. 3.2.
Мета-анализ
Одной из разновидностей систематизированных обзоров является мета-анализ. Часто мета-анализ рассматривается как высшая ступень доказательности и становится основой для выбора наиболее эффективных лечебно-профилактических и диагностических вмешательств. Мета-анализ, появившийся в конце 1980-х годов, сегодня относится к одной из самых популярных и быстро развивающихся методик системной интеграции результатов отдельных научных исследований. Например, в Великобритании до 50% всех используемых сегодня методов лечения заболеваний внутренних органов основаны на результатах рандомизированных контролируемых испытаний (РКИ), а также соответствующих мета-анализов. Сегодня мета-анализ - это «объединение результатов различных исследований, складывающееся из качественного компонента (например, использование таких заранее определенных критериев включения в анализ, как полнота данных, отсутствие явных недостатков в организации исследования и
т.д.) и количественного компонента (статистическая обработка имеющихся данных)». В то же время I. Chalmers и D.G. Altman в монографии «Систематические обзоры» характеризуют мета-анализ как «количественный систематический обзор литературы или количественный синтез первичных данных с целью получения суммарных статистических показателей».
Целью мета-анализа является оценка эффективности изучаемого вмешательства, а также выявление, изучение и объяснение неоднородности или гетерогенности в результатах исследований и подгруппах пациентов. Он должен представить точечные и интервальные (95% доверительный интервал) оценки обобщенного эффекта вмешательства.
Как указывалось выше, в мире ежегодно публикуется более 2,5 миллиона медицинских статей, не считая материалов многочисленных национальных и международных конференций, книг. Естественно, в этой ситуации велика потребность в анализе и синтезе имеющейся информации. Ее анализ по типу литературного обзора для журнала или диссертации носит чисто описательный и субъективный характер, хотя и является предпосылкой для проведения мета-анализа после актуализации некой проблемы. Главный недостаток такого подхода состоит в том, что он не использует строго научные и математические методики. Все это приводит к появлению так называемой β-ошибки (ошибка второго рода - ложное утверждение об отсутствии различий между эффективностью сравниваемых методов лечения, когда на самом деле они различны) из-за противоречивых результатов исследований и недостаточного числа пациентов в них. Примеров расхождения результатов описательного обзора литературы и ее метаанализа очень много (публикация вывода лауреата Нобелевской премии профессора Л. Полинга о снижении заболеваемости простудой в результате применения аскорбиновой кислоты, эффективность антиоксидантов в профилактике сердечно-сосудистой патологии, целесообразность профилактики нарушений ритма с использованием лидокаина в остром периоде инфаркта миокарда, возможность снижения риска сердечно-сосудистой патологии у женщин на фоне заместительной гормональной терапии). Ни один из этих выводов впоследствии не был подтвержден результатами соответствующих мета-анализов. В то же время кумулятивный мета-анализ 33 клинических исследований мог еще в 1973 г. (почти за 20 лет до широкого внедрения в практику внутривенного тромболизиса) сделать рутинной практику введения
стрептокиназы при остром инфаркте миокарда.
Однако существуют и противоположные примеры. В качестве одного из них можно привести дискуссию середины 1990-х годов прошлого века о целесообразности и безопасности применения антагонистов кальция при артериальной гипертензии. По данным двух мета-анализов было показано их негативное влияние на риск развития инфаркта миокарда, но последующие крупные исследования ALLHAT и ASCOT полностью опровергли эти опасения, также как и новый мета-анализ BPTLC.
В целом мета-анализ позволяет более точно, чем результаты отдельно взятого клинического исследования, определить категории больных, у которых применимы полученные результаты.
На основании результатов мета-анализа часто принимаются не только лечебно-диагностические, но и управленческие решения (например, развертывание специализированных инсультных отделений, снижающих риск смертности и тяжелой инвалидизации более чем на треть). Интересно, что ни в одном из более чем 10 рандомизированных клинических исследований преимущества специализированных отделений не были доказаны.
Постоянно обновляемые мета-анализы позволяют существенно сократить время между научным открытием и широким внедрением его результатов в практику здравоохранения. В качестве примера можно привести результаты мета-анализа по применению β-адреноблокаторов при артериальной гипертензии, которые существенно сузили показания для их назначения у этой категории пациентов.
Существует два основных подхода к выполнению мета-анализа: статистический ре-анализ отдельных исследований на основании первичных данных о включенных в них пациентах и альтернативный ему, базирующийся на обобщении результатов опубликованных исследований по конкретной теме.
Главными преимуществом мета-анализа является возможность увеличения статистической мощности исследования и достоверности оценки эффекта анализируемого вмешательства, относительно низкая стоимость и оперативность его проведения.
В соответствии с рекомендациями «The Cochrane Collaboration. Preparing, maintaining and disseminating systematic reviews of the effects of health care» (The Cochrane Collaboration, UK, 1995) для анализа качества выполненного мета-анализа необходимо проанализировать следующее.
Насколько специфична и четко определена его цель (см. во введении).
Цель проведения мета-анализа должна быть конкретной и оформлена в виде правильно сформулированного клинического вопроса. Это позволяет четко определить контингент и клинико-демографические характеристики популяции пациентов, к которым могут быть применены его результаты. Формулирование цели мета-анализа предопределяет стратегию отбора оригинальных исследований и выработки критериев включения соответствующих данных. Наиболее типичной целью мета-анализа является ответ на вопрос, приносит ли анализируемое вмешательства больше пользы, чем вреда по сравнению с другими методами, включая плацебо.
Насколько всеобъемлюща и четко описана тактика поиска соответствующих публикаций, не является ли она тенденциозной (см. в материалах и методах).
Прежде всего необходимо максимально снизить риск возникновения систематической ошибки из-за включения исследований только с положительным результатом.
Методология поиска публикаций по теме мета-анализа достаточно сложна и включает четыре основные этапа:
• поиск в максимально большем количестве электронных базах данных (типа MЕDLINE, Medscape. EMBASE, Science Citation Index), названиях и текстах публикаций по ключевыми словам;
• анализ библиографических ссылок в статьях и книгах по интересующей теме, которые могут содержать ссылки на публикации, пропущенные на первом этапе;
• запросы в фармацевтические компании, производящие препараты, эффективность которых оценивается в мета-анализе. Особое внимание нужно уделить получению неопубликованных результатов их собственных исследований так называемых Data on file;
• личные контакты с экспертами и ведущими специалистами в области предмета мета-анализа, которые позволят выявить ранее неизвестные исследования, получить разъяснения по достоинствам и недостаткам дизайна исследований, включаемых в мета-анализ.
Еще одно правило отбора исследований для включения в метаанализ: если с участием одной группы выполнено несколько исследо-
ваний на одной популяции больных, то в мета-анализе используются данные последнего.
Поиск и выявление всех относящихся к теме мета-анализа публикаций является синтезом трудоемкого и медленного ручного просмотра всех журналов и сборников, которые могут содержать относящиеся к мета-анализу публикации с более производительным компьютерным просмотром электронных библиографических баз данных. Однако даже такое сочетание выявляет около 65% от всех публикаций по проблеме мета-анализа. Существуют специальные способы оценки полноты выявления и включения в мета-анализ исследований, чтобы снизить вероятность публикационного смещения результатов из-за преимущественного опубликования неотрицательных результатов исследований. Для качественной оценки наличия этой систематической ошибки выполняют построение воронкообразной диаграммы рассеяния результатов отдельных исследований в координатах (величина эффекта, размер выборки). При полном выявлении исследований эта диаграмма имеет симметричный характер.
Описание и обоснованность критериев включения и исключения отдельных исследований для мета-анализа (см. в материалах и методах).
Определение критериев включения и исключения исследований из мета-анализа зависит от первоначального определения прогностически значимых исходов, типичных для исследуемой патологии.
Считается, что качество мета-анализа зависит от характеристик отобранных исследований:
• принципа отбора его участников (общая популяция или конкретная нозология);
• места проведения (университетская клиника, стационар общего типа или специализированная клиника, поликлиника);
• продолжительности (должна быть сопоставимой и достаточной для анализа влияния вмешательства на исходы);
• характеристики больных, включенных в исследование (сопоставимость клинико-демографических характеристик);
• диагностических критериев заболевания, являющегося предметом исследования в мета-анализе;
• дозы, частоты использования, путей введения, времени начала и продолжительности использования лекарственного препарата (или метода лечения);
• дополнительного лечения и наличия сопутствующих заболеваний у больных, включенных в исследование;
• отклонений от протокола исследования, изучавшихся клинических исходов и критериев их оценки (сопоставимость использованных диагностических методов);
• наличия в материалах исследования абсолютных величин, характеризующих включенных в него больных и адекватных для исследуемой патологии клинических исходов.
Количество включенных в исследование больных играет важную, но не решающую роль при их отборе для мета-анализа. Необходимое число пациентов зависит от распространенности исследуемой патологии и выбранных конечных точек.
В мета-анализ не включают исследования и публикации:
• не удовлетворяющие критериям включения;
• в которых отсутствуют данные об изучаемых клинических исходах у всех больных;
• где вмешательство, эффективность которого планируется оценить в мета-анализе, не было определено заранее и детально описано в разделе «Методы»;
• в которых приведены несопоставимые виды вмешательств (дозировка лекарственного препарата, частота и путь введения, сроки начала и продолжительности лечения);
• которые не дают четкого определения терминов «благоприятный» и «неблагоприятный» исход.
Наличие оценки качества отдельных исследований, включенных в метаанализ (см. в материалах и методах).
Оценка качества исследований проводится всеми авторами метаанализа. Объективизировать ее может оценка независимого эксперта и балльная система оценки качества.
Максимальные баллы получают исследования с четко определенными критериями исходов и участием большого числа пациентов. Большее количество баллов следует присваивать исследованиям, которые соответствуют рекомендациям «The Cochrane Collaboration. Preparing, maintaining and disseminating systematic reviews of the effects of health care», анализируемых в данной главе. Баллы по всем параметрам суммируют, делят на общий максимально возможный и умножают на 100%. Суммарная оценка методологического качества каждого ана-
лизируемого исследования может колебаться от 0 до 100%. Авторам любого мета-анализа необходимо заранее определить минимальное количество баллов, ниже которого методологическое качество исследования признается неудовлетворительным и недостаточным для его включения в мета-анализ.
Наличие описания методики извлечения данных из оригинальных исследований (публикаций).
Какие методы (Mantel-Haenszel для модели постоянных эффектов; DerSimonian и Laird для модели случайных эффектов или логистического регрессионного анализа, проводимого с учетом прогностических факторов для анализа данных обсервационных исследований) и программы статистической обработки полученных данных использованы, насколько они валидны и приемлемы для данного исследования (см. в материалах и методах).
Результаты мета-анализа могут быть представлены как в относительных (соотношение шансов, относительный риск, снижение относительного риска и других), так и в абсолютных (снижение абсолютного риска, число больных, которых нужно лечить определенным методом в течение определенного времени, чтобы достичь определенного благоприятного эффекта или предотвратить определенный неблагоприятный исход у одного больного и других) показателях. Как показывает опыт, абсолютные показатели более понятны практическим врачам.
Описание применяемых методов статистической обработки должно быть достаточным для воспроизведения данного мета-анализа или выполнения другого.
Наиболее достоверными считаются результаты мета-анализа, основанного на первичных данных о каждом включенном в оригинальное исследование больном, однако эта задача трудновыполнима из-за «закрытости» информации, а также материальных и временных затрат. Последние сопоставимы с проведением оригинального исследования. Но именно такой подход снижает вероятность ошибок, связанных с возможной неточностью совокупных данных оригинальных исследований, позволяет определить время до развития того или клинического исхода в зависимости от проводимого лечения, в том числе и отдельных подгруппах.
Существуют различные прикладные статистические программы для проведения мета-анализа. Одной из наиболее популярных явля-
ется программа ReviewManager (Cochrane Collaboration). Пакет содержит набор программных средств для проведения любого варианта мета-анализа. Выбор конкретного метода диктуется типом данных (дихотомические, непрерывные) и модели (с фиксированными, случайными эффектами).
Дихотомические данные - это результат оригинальных исследований (соотношение шансов, относительный риск, разница рисков в выборках), характеризующий эффективность вмешательства. Непрерывными данными обычно является диапазон (минимальная и максимальная величина) изучаемых параметров или нестандартизованная разница взвешенных средних в группах сравнения (при этом исходы должны оцениваться одинаковым способом). Если же они оценивались по-разному, необходима стандартизация разницы средних в сравниваемых группах, что негативно отразится на качестве анализа.
Для анализа дихотомических данных используются модели с фиксированными или случайными эффектами (метод DerSimonian and Laird).
В случае нулевой дисперсии между исследованиями используются методики Mantel-Haenszel, Peto и модель с фиксированными эффектами (предполагает, что изучаемое вмешательство во всех исследованиях имеет одну эффективность, а выявляемые различия между различными исследованиями обусловлены только дисперсией внутри исследований). Модель случайных эффектов, напротив, предполагает, что эффективность изучаемого вмешательства в разных исследованиях может быть различной, учитывает дисперсию не только внутри одного исследования, но и между ними, использует методику DerSimonian и Laird.
К вариантам мета-анализа относятся многомерный мета-анализ, байесовский мета-анализ, кумулятивный мета-анализ, мета-анализ выживаемости.
Байесовский мета-анализ (confidence profile method) применяется при малом числе анализируемых исследований и позволяет рассчитать априорные вероятности эффективности вмешательства с учетом косвенных данных.
Регрессионный мета-анализ (логистическая регрессия, метод наименьших квадратов, модель Кокса) используется при существенной гетерогенности результатов исследований. Он позволяет построить модель изменения анализируемого показателя в зависимости
от нескольких характеристик исследования (размера выборки, дозы препарата, способа его введения, клинико-демографических характеристик пациентов). Результаты регрессионного мета-анализа обычно представляют в виде регрессии и линии регрессии с коэффициентом наклона и указанием доверительного интервала.
В некоторых случаях мета-анализ может использоваться не только для обобщения результатов контролируемых, но и когортных исследований. Однако при этом вероятность появления систематической ошибки существенно возрастает.
Особый вид мета-анализа - обобщение оценок информативности диагностических методов, полученных в разных исследованиях. Цель такого мета-анализа - построение характеристической ROC-кривой взаимной зависимости чувствительности и специфичности с использованием взвешенной линейной регрессии.
Для мета-анализа обязательным является проведение теста на статистическую гетерогенность (Хи-квадрат) включенных в анализ исследований. При обнаружении существенных различий между исследованиями выводы мета-анализа можно поставить под сомнение. Для оценки гетерогенности используют критерий Хи-квадрат с нулевой гипотезой о равном эффекте во всех исследованиях и с уровнем значимости 0,1 для повышения чувствительности теста.
Источником гетерогенности результатов разных исследований считается дисперсия внутри (случайные отклонения результатов разных исследований от единого истинного фиксированного значения эффекта) и между исследованиями (различия изучаемых выборок по клинико-демографическим показателям или характеру вмешательств, приводящая к различию в эффективности вмешательства).
Если дисперсия между исследованиями полагается близкой к нулю, то каждому из исследований приписывается вес, величина которого обратно пропорциональна дисперсии результата данного исследования. На величину дисперсии прямое влияние оказывает величина выборки.
Как суммировались данные отдельных исследований, и применялся ли кумулятивной подход с представлением промежуточных результатов (см. в материалах и методах).
Исследования, включенные в мета-анализ, должны быть максимально однородными по виду вмешательства, клинико-демографическим характеристикам популяции пациентов, изучаемым исходам,
дизайну (например, недопустимо объединение результатов открытых и слепых исследований).
Использование кумулятивного подхода с промежуточными результатами позволяет оценить вклад каждого исследования. При выполнении кумулятивного мета-анализа исследования добавляют по одному в заранее оговоренном определенном порядке (например, в соответствии с датой публикации или фамилией первого автора и т.д.). Кумулятивный мета-анализ является вариантом байесовского мета-анализа с пошаговым включением результатов исследований и позволяет рассчитывать априорные и апостериорные вероятности по мере включения исследований в анализ.
Каково общее число исследований и пациентов, включенных в мета-анализ, наличие анализа в подгруппах (см. в результатах).
Анализ эффективности вмешательства в подгруппах является признаком качественного мета-анализа. Регламентированных нормативов о необходимом числе исследований для мета-анализа нет. Важно, чтобы исследований оказалось достаточно для получения статистически достоверной информации, и они отражали всю палитру эффективности вмешательства.
Приведены ли доверительные интервалы показателей эффективности вмешательства и как проводилась стандартизация факторов, влияющих на конечный результат (см. в результатах).
Отсутствие доверительных интервалов позволяет скептически относится к результатам мета-анализа в целом.
Вытекают ли приведенные заключения из представленных в мета-анализе данных и указаны ли ограничения для применения его результатов (см. в обсуждении результатов).
Результаты мета-анализа обычно представляются графически (точечные и интервальные оценки величин эффектов каждого из включенных исследований и обобщенного результата мета-анализа) и в виде таблиц.
Надежность выводов мета-анализа проверяется анализом чувствительности, который может проводиться с использованием различных методик:
• включение и исключение из мета-анализа исследований, выполненных на низком методологическом уровне;
• изменение параметров данных, отбираемых из каждого включенного исследования;
• исключение из мета-анализа наиболее крупных исследований и пересчет результатов с последующей оценкой гетерогенности результатов по критерию Хи-квадрат.
Одним из способов проведения последнего является сопоставление результатов, получаемых в двух моделях:- с фиксированными и случайными эффектами. Во второй модели результаты обычно становятся менее статистически значимыми. Если величина эффекта того или иного анализируемого вмешательства при анализе чувствительности существенно не изменяется, то выводы первичного метаанализа обоснованы.
Есть ли четкие рекомендации для практики и дальнейших научных исследований по результатам мета-анализа (см. в обсуждении результатов).
Четко сформулированные рекомендации, понятные практическим врачам, являются целью анализа.
Приведены ли библиографические ссылки на все исследования, включенные в мета-анализ (см. литературу).
Отсутствие данных о первоисточниках ставит под сомнение качество мета-анализа.
Приведен ли структурированный реферат мета-анализа.
Структурированный реферат позволяет существенно экономить время практического врача.
Немаловажно, в каком журнале (индекс цитируемости) были опубликованы результаты анализа, есть ли опыт в его проведении у авторов (наличие публикации с мета-анализом).
Проведение мета-анализа - это коллективное творчество. Уже на этапе отбора исследований необходимо участие как минимум двух исследователей, чтобы максимально расширить и объективизировать поиск.
Результаты мета-анализа имеют важное научное и практическое значение:
• являются источником объективной информации о современных методах диагностики, профилактики и лечения;
• служат основой при разработке формулярной системы, стандартов диагностики и лечения и научно-обоснованных рекомендаций;
• стимулируют проведение конкретных клинических исследований, так как формируют научную гипотезу и позволяют более точно определить объем планируемой выборки пациентов;
• позволяют оценить не только эффективность, но и безопасность вмешательств.
Мета-анализ является достаточно новым подходом к обобщению данных клинических исследований, однако не может заменить их. При наличии противоречий между данными мета-анализа и результатами клинических исследований принятие решения должно быть отложено до появления данных новых исследований и мета-анализа, поскольку его некорректное проведение ведет к ошибочным результатам. До настоящего времени нет однозначного ответа на вопрос о том, что важнее для клинической практики результаты мета-анализа или мега-трайлов.
Клинические исследования
Некоторые клинические исследования являются не только основой для систематизированных обзоров и мета-анализа, но и сами являются важным источником данных для доказательной медицины.
Главным отличием научных исследований является стремление получить максимально объективную информацию, для чего необходимо устранить влияние случайных (посторонних) факторов, учесть особенности обследуемых и сформировать исследуемые группы пациентов с минимальными различиями по клинико-демографическим показателям между ними. Для решения конкретной клинической задачи используют совершенно определенный тип исследований, который переопределяет особенности его подготовки и проведения. Именно правильно выбранная структура исследования определяет, насколько доказательными и убедительными будут его выводы.
Для решения этих задач существуют различные по дизайну и структуре исследования.
Поперечные (одномоментные) исследования:
• описания симптомов и проявлений болезни, диагноза/стадии болезни, вариаций, тяжести болезни;
• аналитические (эксплораторные);
• наблюдательные;
• описания случаев.
Продольные исследования:
• проспективные (наблюдательные, естественного развития, прогноза, причинных факторов и заболеваемости, неконтролируемого вмешательства, с преднамеренным вмешательством, нормальных вариаций, тяжести болезни, параллельные, последовательные, перекрестные, с самоконтролем, с внешним контролем);
• ретроспективные исследования типа «случай-контроль» (с преднамеренным вмешательством, наблюдательные, псевдопроспективные).
В поперечных, или одномоментных (cross-sectional), исследованиях интересующие параметры оцениваются однократно. Они позволяют оценить связь признаков, но не динамику развития анализируемого состояния. Это самые ненадежные с точки зрения их доказательности исследования, так как простое наблюдение за совокупностью данных может легко привести к ошибке.
В продольных (longitudinal, лонгитудинальными) исследованиях выделяют группы лиц, за которыми наблюдают в течение некого промежутка времени и обязательно хотя бы раз повторно оценивают у них интересующие (мониторируемые) показатели. Длительность наблюдения может быть любой и определяется здравым смыслом и реальной возможностью изменения показателя (например, при хронической сердечной недостаточности изменение фракции выброса возможно уже через несколько дней лечения, а уменьшение гипертрофии левого желудочка не ранее чем через три месяца).
Отслеживание изменения показателей в специально сформированной группе осуществляется в проспективных (prospective) исследованиях. В популяционных проспективных (когортных) исследованиях наблюдение ведется за большой по численности выборкой пациентов из популяции. В них отслеживается появление новых заболеваний, осложнения при уже имеющейся патологии (исследования естественного развития заболеваний.
Проспективные исследования являются наиболее доказательными, (но дорогостоящими), так как в них имеется четкое определение наблюдаемой группы, патологии, критериев диагностики, методов обследования и мониторируемых показателей до начала исследования, что существенно уменьшает риск систематической ошибки.
Преднамеренное вмешательство в естественное течение заболевания в проспективных исследованиях применяется для оценки
эффективности и безопасности при изучении средств диагностики, профилактики и лечения.
При ретроспективном продольном исследовании проводится анализ имеющихся данных в первичной медицинской документации. Недостатком таких исследований является необходимость обнаружения практически всех пациентов с интересующей патологией или вмешательством за большой промежуток времени, невозможность формирования однородных групп, разная полнота обследования и использование различных диагностических приборов. Однако в этих исследованиях подкупает доступность первичного материала, отсутствие биоэтических проблем, оперативность и низкая стоимость.
Вариантом ретроспективного продольного исследования являются исследования типа «случай-контроль» (ИСК, case-control studies) в котором сопоставляют частоту встречаемости некого анализируемого фактора в исследуемой и контрольной группах. Если этот встречается реже или чаще, то можно предположить, что он связан с патологией. Считается, что этот вариант исследований является более современной формой научного осмысления обычной медицинской практики, его методология постоянно совершенствуется. Помимо простоты, малозатратности и несмотря на достаточно низкую степень доказательности, этот метод исследований является единственно приемлемым для редких заболеваний.
Литература
1. Antman E.M., Lau J., Kupelnick B., Mosteller F., Chalmers I. A comparison of results of meta-analysis of randomised control trials and recommendations of clinical experts. Treatment for myocardial infarction. JAMA 1992; 268: 240-8.
2. Bobbio M., Demichelis B., Giustetto G. Completeness of reporting trial results: effect on physicians' willingness to presciibe. Lancet 1994; 343:
1209-11.
3. Chalmers I., Altman D.G. Systematic reviews. London: BMJ Publishing Group; 1995: 1.
4. Chatellier G., Zapletal E., Lemaitre D., Menard J., Degoulet P. The number needed to treat: a clinically useful nomogram in its proper context. BMJ 1996;
312: 426-9.
5. Cook R.J., Sackett D.L. The number needed to treat: a clinically useful measure of treatment effect. BMJ 1995; 310: 452-4.
6. DerSimonian R., Laird N. Meta-analysis in clinical trials. Control Clin Trials 1986; 7: 177-88.
7. Dickersin K., Hewitt P., Mutch L., Chalmers I., Chalmers T.C. Perusing the literature: comparison of MEDLINE searching with a perinatal trials
database. Controlled Clinical Trials 1985; 6: 306-17.
8. Ellis J., Mulligan I., and Sacket D.L. Inpatient general medicine is
evidence based. Lancet 1995; 346: 407-10.
9. Fahey T., GriffithsS., Peters T.J. Evidence based purchasing; understanding results of clinical trials and systematic reviews. BMJ 1995; 311: 1056-60.
10. Last J..M. A dictionary of epidemiology. New York: Oxford University
Press; 1988: 81.
11. Lau J., Ioannidis J.P.A., Schmid C.H. Quantitative synthesis in systematic
reviews. Ann Intern Med 1997; 127:820-826.
12. Laupacis A., Sackett D.L., Roberts R.S. An assessment of clinically useful measures of the consequences of treatment. N Engl J Med 1988; 318:
1728-33.
13. Lubsen J. Mega-trials: is meta-analysis an alternative? Eur J Clin
Pharm 1996; 49: 29-33.
14. Mantel N., Haenszel W. Statistical aspects of the analysis of data from retrospective studies of disease. J Natl Cancer Inst 1959; 22: 719-48.
15. McQuay J., Moore R. A. Using numerical results from systematic reviews in clinical practice. Ann Intern Med 1997; 126: 712-20.
16. Mohiuddin A.A., Bath F.J, Bath P.M.W. Theophylline, aminophylline, caffeine and analogues, in acute ischaemic stroke. (Cochrane Review). In: The Cochrane Library. Oxford, Updated Software; 1998 Issue 2: Updated quarterly.
17. Naylor C.D., Chen E., Strauss B. Measured enthusiasm; does the method of reporting trial results alter perceptions of therapeutic effectiveness? Ann
Intern Med 1992; 117: 916-21.
18. Sackett D., Richardson W.S., Rosenberg W., Haynes B. Evidence Based Medicine. London: Churchill Livingstone; 1996.
19. Sackett D.L., Decks J.J., Altman D.G. Down with odds ratios! Evidence-
Based Medicine 1996; 1: 164-6.
20. Sinclair J.C., Bracken M.B. Clinically useful measures of effect in binary analyses of randomized trials. J Clin Epidemiol 1994; 47: 881-9.
21. The Cochrane Collaboration Handbook Version 3.0.2, 1997.
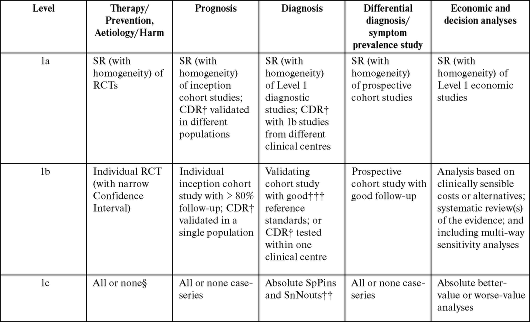
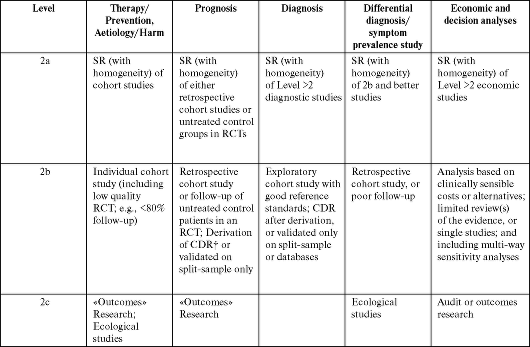
ПРИЛОЖЕНИЕ 1
Oxford Centre for Evidence-based Medicine Levels of Evidence