Медицина, основанная на доказательствах: учебное пособие. Петров В.И., Недогода С.В. 2012. - 144 с.
|
|
|
|
ПРИЛОЖЕНИЕ 1
ТЕРМИНЫ И СОКРАЩЕНИЯ, НАИБОЛЕЕ ЧАСТО ИСПОЛЬЗУЕМЫЕ В ЛИТЕРАТУРЕ ПО ДОКАЗАТЕЛЬНОЙ МЕДИЦИНЕ
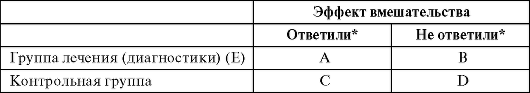 *Приводится числовое значение
*Приводится числовое значение
N (общее число наблюдений) = A+B+C+D
Absolute Benefit Increase (ABI): разность частот благоприятных исходов между экспериментальной и контрольной группами:
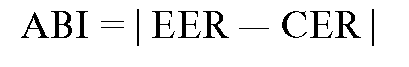 Absolute Risk Increase (ARI): абсолютная разность частот неблагоприятных исходов, которых больше в экспериментальной группе по сравнению с контрольной; ARI используется также в оценке влияния факторов риска на болезнь.
Absolute Risk Increase (ARI): абсолютная разность частот неблагоприятных исходов, которых больше в экспериментальной группе по сравнению с контрольной; ARI используется также в оценке влияния факторов риска на болезнь.
Absolute Risk Reduction (ARR). Абсолютное снижение риска. Разность частот неблагоприятных исходов между экспериментальной и контрольной группами:
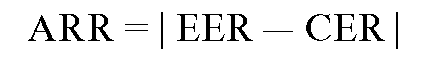 Best evidence. Обоснованное доказательство. Основание для принятия решений в здравоохранении. Для оценки эффективности воздействия лучшим считается удачно спланированное и проведенное рандомизированное контролируемое испытание, но в ряде случаев более подходящими могут быть другие типы испытания.
Best evidence. Обоснованное доказательство. Основание для принятия решений в здравоохранении. Для оценки эффективности воздействия лучшим считается удачно спланированное и проведенное рандомизированное контролируемое испытание, но в ряде случаев более подходящими могут быть другие типы испытания.
1За основу взята проектная версия Московского центра доказательной медицины (МЦДМиФ), в которую внесены некоторые изменения.
Blind Study. Слепое исследование. Одна или несколько участвующих сторон не знают, как распределены пациенты по группам лечения и контроля. При простом слепом (Single Blind) - распределение неизвестно пациентам, в двойном слепом (Double Blind) - исследователям и пациентам, в тройном (Triple Blind) - также и лицам, организующим исследование и анализирующим его результаты, а в полном слепом - в неведении все, кто взаимодействует с пациентами, исследователем и данными; а коды пациентов готовят люди, не связанные с исследованием. Применяется для устранения систематической ошибки в клинических исследованиях.
Clinical trials. Клинические испытания - специальный вид исследований для оценки разных вмешательств, условия проведения которых (отбор групп вмешательства, характер вмешательства, организация наблюдения и оценка исходов) направлены на устранение влияния систематических ошибок на получаемые результаты.
Clinical epidemiology. Клиническая эпидемиология - это наука, разрабатывающая методы клинических исследований, которые дают возможность делать справедливые заключения, контролируя влияние систематических и случайных ошибок.
Comparator (Drug). Препарат сравнения. Плацебо или активное вещество, эффективность и безопасность которого заранее известны.
Comparative Study. Сравнительное исследование. Исследование, в котором новый препарат сравнивается с известным, плацебо или отсутствием лечения вообще.
Compliance. Соблюдение больным инструкций по приему исследуемого препарата.
Confidence Interval (CI). Русское сокращение - ДИ. Доверительный интервал. 95% CI дает пределы, внутри которых с достоверностью 95% находятся значения изучаемой величины для популяции больных, из которой выбрана изучаемая группа. При увеличении групп значения CI сужаются и достоверность различий растет. Предпочтительнее использовать CI вместо p, так как CI характеризует степень достоверности, а p оценивает только вероятность отсутствия различий между группами (нулевую гипотезу). Это статистический показатель, позволяющий оценить, в каких пределах может находиться истинное значение параметра в популяции; диапазон колебаний истинных значений. Величины, полученные в исследованиях на выборке больных, отличаются от истинных величин в популяции вследствие влияния случайности. Так, в 95% наблюдений доверительный интервал означает, что
истинное значение величины с вероятностью 95% лежит в его пределах. Доверительные интервалы помогают сориентироваться, соответствует ли данный диапазон значений представлениям читателя о клинической значимости эффекта и каких результатов можно ожидать, применив описанную методику на сходной группе больных.
Continuous data. Непрерывные данные - это количественные данные, которые могут принимать любое значение на непрерывной шкале. Примеры: масса тела, артериальное давление, отношение парциального давления кислорода к артериальной крови).
Control Group. Контрольная группа (группа сравнения). Группа пациентов, принимающая в ходе сравнительного исследования препарат, эффективность и безопасность которого хорошо известны (препарат сравнения). Это может быть плацебо, стандартная терапия или отсутствие лечения вообще. Результаты измерений в контрольной группе сравниваются с результатами измерений в экспериментальной группе для оценки эффекта исследуемого метода лечения.
Control Event Rate (CER). Русское сокращение ЧНБИ. Частота неблагоприятных исходов в контрольной группе.
Controlled Study. Русское сокращение - КИ. Контролируемое исследование. Термин используется в двух значениях:
1) как синоним сравнительного (имеющего контрольную группу) исследования;
2) всякое исследование, проводимое в соответствии с протоколом. Cost-Benefit. «Стоимость-выгода» - в денежном выражении оцениваются и стоимость, и результаты лечения.
Cost-Effectiveness. «Стоимость-эффективность» - в денежном выражении оценивается стоимость лечения, а результаты рассматриваются как выполнение определенных задач. В отечественной литературе часто используется схожий по смыслу термин «цена-эффективность».
Cost-Utility. «Стоимость-польза» - оценка результатов в терминах качества жизни как преимущества одного вида лечения перед другим.
Cost-Minimization. «Минимизация стоимости» - сравнивается стоимость равноэффективных видов лечения.
Cost-of-Ilness. «Стоимость заболевания» - оценка прямых и косвенных затрат на лечение отдельного заболевания.
Crossover Study. Перекрестное исследование. Исследование, в котором каждый пациент получает поочередно сравниваемые препараты
в случайной последовательности. Применяется у пациентов со стабильным течением заболевания, обычно хронического характера. В настоящее время подобный дизайн не распространен из-за эффектов переноса при смене препаратов.
Crude Agreement: Предварительное согласие. Пропорция совпадений между всеми оценщиками. Если их всего двое, то оценка составляет (A+D)/N.
Decision sciences. Наука о принятии решений. Область методологических исследований, связанная с пониманием и улучшением процесса принятия решений.
Design (of a Study). Дизайн исследования. Способ, схема проведения исследования.
Discrete data. Дискретные данные - это количественные данные, которые выражаются целыми числами. Например, число приступов мигрени у больного в течение месяца.
Dichotomous data. Дихотомические данные - признаки, которые могут иметь только два противоположных значения (присутствует - отсутствует, да - нет, жив - умер).
Ecological fallacy. Экологическая ошибка - систематическая ошибка, связанная с тем, что заболевшие лица в группе обследования на самом деле могли не испытывать влияния факторов риска. Возникает, когда группу выделяют по общим косвенным признакам (проживание на одной территории, принадлежность к одной профессии), а не по наличию фактора риска у отдельных субъектов (например, по потреблению алкоголя).
Efficacy. Эффективность. Способность препарата вызывать желаемое терапевтическое воздействие на течение болезни.
Experimental Event Rate (EER). Частота неблагоприятных исходов в экспериментальной группе:
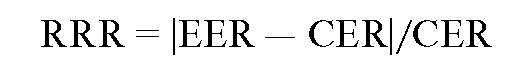 Experimental group. Экспериментальная группа - это группа, подвергающаяся вмешательству (лечению) в ходе исследования. Иначе называется группой лечения или группой вмешательства (treatment group или Intervention group).
Experimental group. Экспериментальная группа - это группа, подвергающаяся вмешательству (лечению) в ходе исследования. Иначе называется группой лечения или группой вмешательства (treatment group или Intervention group).
Historical Control. Исторический контроль. Сравнение получающих исследуемую терапию с получавшими ранее другую терапию. Метод применяется при невозможности рандомизировать пациентов в раз-
ные группы. Например, при исследовании долговременной выживаемости после трансплантации почки невозможно рандомизировать пациентов в «операционную» и «безоперационную» группы, так как неэтично лишать человека возможности трансплантации. Лучшим решением будет сравнение с лечившимися ранее, когда не существовало возможности трансплантации.
Inform consent. Информированное согласие. Подписывается участниками исследования до начала РКИ.
Kappa-критерий: (греч. κ - каппа). Критерий согласия, скорректированный для ситуации, в которой оценщики договорятся между собой на определенной пропорции случайных событий. Если pо - наблюдаемая часть случаев общего согласия, а pе - пропорция предполагаемых случайных событий, то:
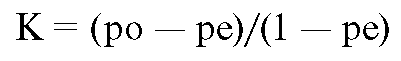 Likelihood Ratio for a Positive Test Result. Отношение правдоподобия для положительных результатов теста; вероятность положительного результата тестирования у человека, страдающего расстройством:
Likelihood Ratio for a Positive Test Result. Отношение правдоподобия для положительных результатов теста; вероятность положительного результата тестирования у человека, страдающего расстройством:
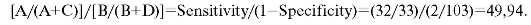 Likelihood Ratio for a Negative Test Result. Отношение правдоподобия для отрицательных результатов теста. Вероятность отрицательного результата тестирования у человека, страдающего расстройством:
Likelihood Ratio for a Negative Test Result. Отношение правдоподобия для отрицательных результатов теста. Вероятность отрицательного результата тестирования у человека, страдающего расстройством:
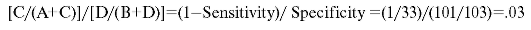 Long term Trial. Долгосрочное исследование. Исследовани эффективности и безопасности препарата при длительном лечении заболевания. Обычная длительность более 6 месяцев. Часто используется при оценке влияния вмешательства на жесткие конечны точки.
Long term Trial. Долгосрочное исследование. Исследовани эффективности и безопасности препарата при длительном лечении заболевания. Обычная длительность более 6 месяцев. Часто используется при оценке влияния вмешательства на жесткие конечны точки.
Matched pairs Design. Схема соответствующих пар (аналогично по смыслу «исследование в параллельных группах»). План исследования в котором субъектов изучения объединяют попарно в соответствии с определенными факторами (по полу, возрасту и т.д.). Один из ни получает исследуемое лечение, другой - препарат сравнения.
Meta-Analysis. Мета-Анализ. Методология объединения разнородных и выполненным различными авторами исследований, относящихся к одной теме, для повышения достоверности оценок одноименных результатов. Количественный анализ объединенных результатов нескольких клинических испытаний одного и того же вмешательства. Такой подход обеспечивает большую статистическую мощность, чем в каждом отдельном испытании за счет увеличения размера выборки. Используется для обобщенного представления результатов многих испытаний. Кумулятивный метаанализ - метод расчета обобщенной точечной оценки изучаемого эффекта, при котором исследования добавляются по одному в определенном порядке. Мета-регрессионный анализ - регрессионный анализ, где в качестве единицы наблюдения рассматриваются отдельные исследования.
Negative Predictive Value. Отрицательное предсказывающее значение. Отношение числа людей с реальным и протестированным отсутствием расстройства.
Noncomparative Study. Несравнительное исследование. Исследование, в котором препарат сравнения не используется.
Numerical, or interval data. Количественные данные - величины, которым присущ естественный порядок расположения с равными интервалами между последовательными значениями, независимо от их места на шкале (масса тела, уровень глюкозы, холестерина или креатинина в крови).
Number Needed to Harm (NNH). Русское сокращение - ЧБНЛНИ. Количество больных в экспериментальной группе по сравнению с контрольной, необходимое для выявления дополнительного неблагоприятного исхода:
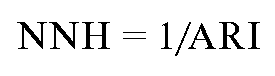 То есть для предупреждения одного дополнительного неблагоприятного исхода в экспериментальной группе должно быть 30 больных.
То есть для предупреждения одного дополнительного неблагоприятного исхода в экспериментальной группе должно быть 30 больных.
Number Needed to Treat (NNT). Русское сокращение - ЧБНЛБИ. Число больных в экспериментальной группе, необходимое для получения дополнительного благоприятного исхода:
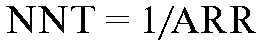 Этот показатель является величиной, обратной снижению абсолютного риска.
Этот показатель является величиной, обратной снижению абсолютного риска.
Это способ оценки относительной эффективности двух методов лечения показывает, какое количество больных необходимо подвергнуть лечению исследуемым методом для предотвращения одного случая изучаемого исхода. Например, если для предотвращения одного случая инсульта надо лечить антигипертензивным средством 100 пациентов с артериальной гипертензией в течение 5 лет, то NNT равно 100 за 5 лет.
Odds Ratio (OR). Русское сокращение - ОР. Отношение шансов исхода между группами больных в испытании. Отношение вероятности того, что событие произойдет, к вероятности того, что событие не произойдет. Шансы и вероятности содержат одну и ту же информацию, но по-разному выражают ее. Если вероятность того, что событие произойдет обозначить Р, то шансы этого события будут равны Р/(1-Р). Например, если вероятность выздоровления 0,3, то шансы выздороветь равны 0,3/(1-0,3) = 0,43. Шансы удобнее использовать для некоторых расчетов, чем вероятности.
Используется в систематизированных обзорах или конкретных клинических испытаниях. Если, например:
у а = 20 из (а + b) = 100 экспериментальных больных наблюдали определенный исход, а у b = 80 - не наблюдали, то шансы этого исхода в данной группе составляют: a/b = 20/80 = 0,25. То же для контрольной группы при (c + d) = 100, c = 40 и d = 60 составляет c/d = 40/60 = 0,67 и отношение шансов: OR = (a/b)/(c/d) = 0,25/0,67 = 0,37.
Отношение шансов похоже на относительный риск, но численно они подобны лишь при очень низких частотах исхода. Так, для этого примера RR = (a/(a+b) : c/(c+d)) = 20/100 : 40/100 = 0,50, а если бы частоты исхода были 1% и 2%, то величина RR = 0,5 и OR = 1/99:2/98 = 0,49.
В исследованиях «случай-контроль» отношение шансов используется для оценки самостоятельного риска.
Open Study. Открытое исследование. Исследование, где распределение пациентов по группам лечения известно всем. Это может быть исследование, в котором изучается один или несколько видов лечения.
Ordinal datа. Порядковые данные - величины, которые могут быть расположены в естественном порядке (ранжированы), например, от малого до большого или от хорошего до плохого, но размер интервала
между такими категориями не может быть выражен количественно (например: стадии болезни; оценки «высокий, средний, низкий» или «отсутствует, слабый, умеренный, тяжелый»).
Р value. Величина р - вероятность того, что полученный результат абсолютно случаен. Величина p может изменяться от 1 (результат точно случаен) до 0 (результат точно не случаен). Величина p, меньшая или равная заданному уровню альфа-ошибки (например, 0,05), свидетельствует о статистической значимости полученного различия. В то же время она совсем не отображает клиническую значимость результата.
Patient Expected Event Rate (PEER) - специфичный для конкретного пациента исходный риск по отношению к среднему пациенту, выраженный десятичной дробью F, на которую делится значение NNT. Если подверженность неблагоприятному исходу F = 0.5, а NNT = 15, то:
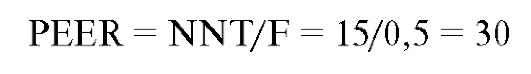 Pharmacoepidemiology. Фармакоэпидемиология. Наука о применении эпидемиологических знаний, методов и доводов к изучению благоприятных и нежелательных эффектов для рационального использования лекарств в различных человеческих популяциях. Предметом исследования являются результаты наблюдений, собранных при повседневном клиническом обслуживании больных, в отличие от рафинированных данных рандомизированных, двойных слепых клинических испытаний. Цель исследований - определить реальную эффективность лекарств в клинической практике.
Pharmacoepidemiology. Фармакоэпидемиология. Наука о применении эпидемиологических знаний, методов и доводов к изучению благоприятных и нежелательных эффектов для рационального использования лекарств в различных человеческих популяциях. Предметом исследования являются результаты наблюдений, собранных при повседневном клиническом обслуживании больных, в отличие от рафинированных данных рандомизированных, двойных слепых клинических испытаний. Цель исследований - определить реальную эффективность лекарств в клинической практике.
Pharmacoeconomics. Фармакоэкономика. Анализ стоимости лекарственной терапии для системы здравоохранения и общества с целью выявить наиболее выгодные препараты (виды лечения) для финансирующих организаций, пациентов и производителей. На результатах специальных (см. ниже) типов фармакоэкономического анализа основываются решения о планах финансирования различных программ здравоохранения, приоритетах среди возможных альтернатив, возможностях пациента использовать оптимальный вариант лечения.
Placebo. Плацебо. Препарат (таблетки, капсулы, растворы), содержащий фармакологически неактивные компоненты. Его эффектив-
ность может объяснятся лишь психологическим фактором, а не объективным эффектом. При сомнениях в безопасности компонентов они не должны включаться в состав плацебо. В качестве плацебо используется лекарственная форма, неотличимая от исследуемого препарата по внешнему виду, цвету, вкусу и запаху, но не оказывающая специфического действия (например, таблетки глюкозы или инъекции изотонического раствора хлорида натрия), или иное безразличное вмешательство, используемое в медицинских исследованиях для имитации лечения с целью устранения систематической ошибки, связанной с плацебо-эффектом.
Placebo effect. Плацебо-эффект - изменение состояния пациента (отмечаемое самим пациентом или лечащим врачом), связанное с фактом лечения, а не биологическим действием препарата.
Placebo-Controlled Trial. Плацебо-контролируемое исследование. Активность нового препарата сравнивается с плацебо в параллельных группах или перекрестном исследовании.
Protocol. Протокол. Документ, регламентирующий испытание, включая обоснование, цели, статистический анализ, методологию, условия проведения, критерии включения и исключения пациентов и др.
Positive Predictive Value. Положительное предсказывающее значение. Отношение числа людей, действительно страдающих расстройством, к числу людей с положительным результатом теста на расстройство. Эта величина зависит от распространенности расстройства:
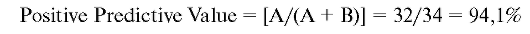 Prevalence. Распространенность. Доля страдающих данным расстройством в исследуемой выборке:
Prevalence. Распространенность. Доля страдающих данным расстройством в исследуемой выборке:
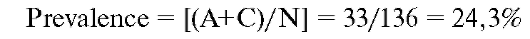 Prospective Study. Проспективное исследование. Пациенты набираются по критериям протокола, получают исследуемый препарат и наблюдаются для оценки результатов лечения. Проспективными является большинство клинических исследований.
Prospective Study. Проспективное исследование. Пациенты набираются по критериям протокола, получают исследуемый препарат и наблюдаются для оценки результатов лечения. Проспективными является большинство клинических исследований.
Randomization. Рандомизация - процедура, обеспечивающая случайное распределение больных в экспериментальную и контрольную
группы. Случайным распределением достигается отсутствие различий между двумя группами и таким образом снижается вероятность систематической ошибки в клинических исследованиях вследствие различий групп по каким-либо признакам.
Relative risk. Относительный риск или отношение рисков (risk ratio) отношение заболеваемости среди лиц, подвергавшихся и не подвергавшихся воздействию факторов риска. Относительный риск не несет информации о величине абсолютного риска (заболеваемости). Даже при высоких значениях относительного риска абсолютный риск может быть совсем небольшим, если заболевание редкое. Относительный риск показывает силу связи между воздействием и заболеванием.
Relative Risk Reduction (RRR). Русское сокращение - СОР. Снижение риска относительно контрольной группы с указанием доверительного интервала.
Relative Benefit Increase (RBI). Относительное увеличение частоты благоприятных исходов в экспериментальной группе по сравнению с контрольной:
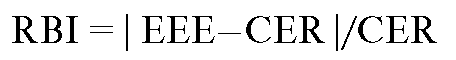 Relative Risk Increase (RRI). Русское сокращение - ПОР. Относительное увеличение частоты неблагоприятных исходов в экспериментальной группе по сравнению с контрольной оценивается так же как RBI и тоже используется в оценке воздействия факторов риска на болезнь:
Relative Risk Increase (RRI). Русское сокращение - ПОР. Относительное увеличение частоты неблагоприятных исходов в экспериментальной группе по сравнению с контрольной оценивается так же как RBI и тоже используется в оценке воздействия факторов риска на болезнь:
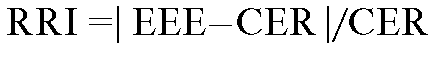 Randomized Clinical Study. Русское сокращение РКИ. Рандомизированное клиническое исследование. Пациенты распределяются по группам лечения на основе рандомизации и все имеют одинаковую вероятность получать каждый из препаратов.
Randomized Clinical Study. Русское сокращение РКИ. Рандомизированное клиническое исследование. Пациенты распределяются по группам лечения на основе рандомизации и все имеют одинаковую вероятность получать каждый из препаратов.
Retrospective Study. Ретроспективное исследование. Исследование, в котором исследователь просматривает медицинскую документацию и подбирает по определенным критериям истории болезни или опубликованные отчеты с целью изучения результатов лечения.
Risk. Риск. Вероятность нанесения ущерба здоровью пациента или причинения ему дискомфорта.
Safety. Безопасность. Одна из ключевых характеристик препарата (наряду с эффективностью), обратно пропорциональная частоте возникновения нежелательных лекарственных реакций.
Sensitivity. Чувствительность теста. Доля реально страдающих расстройством среди выделенных с помощью нового теста:
Sensitivity = [A/(A=C)] = 32/33 = 97,0%.
Short term Trial. Краткосрочное исследование. Исследование эффективности препарата при краткосрочном лечении заболевания. Обычная длительность от 1 до 3 месяцев. Часто используется при оценке фармакодинамических эффектов лекарственных препаратов.
Specificity. Специфичность. Отношение числа людей, не страдающих расстройством, и людей, у которых отсутствие расстройства установлено с помощью нового теста:
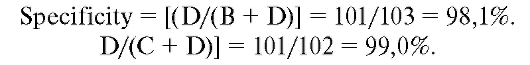 Study/Trial. Клиническое исследование/испытание. Система оценки медицинских препаратов приборов или иного вида вмешательств у человека (пациента или добровольца) с целью выявления любых положительных и отрицательных явлений, возникших в результате приема исследуемых препаратов и/или изучения их всасывания, распределения, метаболизма и выведения для оценки эффективности и безопасности препаратов.
Study/Trial. Клиническое исследование/испытание. Система оценки медицинских препаратов приборов или иного вида вмешательств у человека (пациента или добровольца) с целью выявления любых положительных и отрицательных явлений, возникших в результате приема исследуемых препаратов и/или изучения их всасывания, распределения, метаболизма и выведения для оценки эффективности и безопасности препаратов.
Surveillance. Наблюдение за лекарственным препаратом. Сбор данных о всех нежелательных явлениях, связанных с использованием лекарственных препаратов. Как правило, проводится на протяжении длительного времени.
Survival Analysis. Анализ выживаемости. Проводится в конце исследования у пациентов с высоким риском смертности. Необходимость проведения может возникнуть в кардиологических исследованиях для оценки выживания после сердечного приступа.
Systematic error, bias. Систематическая ошибка - это неслучайное, однонаправленное отклонение результатов от истинных значений. Систематическая ошибка может возникать вследствие отбора (при создании выборки) - sampling, или assembling bias, вследствие измерений - measurement bias, при воздействии неучтенных факторов - confounding bias и во многих других случаях. О систематической ошибке говорят также, имея ввиду предвзятость при публикации
положительных результатов исследований и отклонении отрицательных - publication bias. Для борьбы с систематическими ошибками и получения достоверных данных используются организационные методы (например, рандомизация, «слепой метод» и т.п.), а также внесение поправок, учитывающих величину смещения.
Systematic Review. Систематизированный обзор. Обобщение первичных данных по одной частной четко сформулированной проблеме стандартными воспроизводимыми методами с применением мета-анализа. В медицине используется для оценки и сравнения терапевтических и побочных эффектов лечения и принятия решений об индивидуальном, субпопуляционном и популяционном выборе способа лечения.
Three E's Concept: Efficacy/Effectiveness/Efficiency. Концепция трех Е: эффективность/действенность/выгода. Польза для отдельного больного, популяций больных и общества в целом.
Validity. Пригодность, соответствие теста своему назначению. Однозначный критерий пригодности отсутствует, поскольку ее можно определить по-разному. Достоверность - характеристика, показывающая, в какой мере результат измерения соответствует истинной величине. Достоверность исследования определяется тем, в какой мере полученные результаты справедливы в отношении данной выборки (internal validity). Это внутренняя характеристика и касается именно данной группы больных и не обязательно распространяется на другие группы.