Акушерство. Курс лекций: учебное пособие Под ред. А.Н. Стрижакова, А.И. Давыдова. 2009. - 456 с.
|
|
|
|
ЛЕКЦИЯ 3 ПРИВЫЧНАЯ ПОТЕРЯ БЕРЕМЕННОСТИ
В последние годы сфера научных интересов в перинатальной охране плода сместилась к ранним срокам беременности - к I триместру, так как именно в этот период происходит формирование фетоплацентарной системы, закладка органов и тканей плода, экстраэмбриональных структур и провизорных органов, что в большинстве случаев определяет дальнейшее течение беременности. В более поздние сроки беременности при возникновении осложнений и наличии у женщины экстрагенитальной патологии, усложняются вопросы диагностики состояния фетоплацентарной системы и плода, акушерской тактики. Благодаря внедрению высокоинформативных методов исследования, появилась возможность комплексной диагностики нарушений состояния плода с самых ранних сроков, определение их степени тяжести и патогенетических особенностей развития клинических проявлений плацентарной недостаточности.
Одной из наиболее частых причин формирования хронического страдания плода являются угрожающее и начавшееся прерывание беременности, наиболее часто отмечаемые у женщин с привычной потерей беременности. Медицинская и социальная значимость проблемы невынашивания беременности, влияние ее на показатели перинатальной заболеваемости и смертности и репродуктивное здоровье женщин ставит научные исследования в этой области в ряд важнейших задач современной фундаментальной и клинической медицины.
Невынашивание беременности - самопроизвольное прерывание беременности в сроки от зачатия до 37 нед, считая с первого дня последней менструации при регулярном менструальном цикле. Прерывание беременности в сроки от зачатия до 22 нед называют самопроизвольным абортом (выкидышем). Прерывание беременности в сроки от 28-37 нед гестации называют преждевременными родами. Патологическое состояние при этом носит название недонашивание беременности. Дети при преждевременных родах считаются недоношенными. Срок гестации 22-28 нед по номенклатуре ВОЗ относят к очень ранним преждевременным родам и в большинстве
стран с указанного срока гестации исчисляют перинатальные потери. В случае гибели новорожденного проводят патологоанатомическое исследование. Если ребенок пережил 7 сут после родов, эту смерть относят к показателям перинатальной смертности.
Самопроизвольный аборт относят к основным видам акушерской патологии. Частота самопроизвольных выкидышей составляет 15- 20% от всех желанных беременностей, однако в статистику не входит большое количество прерываний беременности в очень ранние сроки (в том числе субклинические самопроизвольные выкидыши).
Привычная потеря беременности (ППБ) - самопроизвольное прерывание беременности, включая и неразвивающиеся беременности, 2 раза подряд и более. Частота ППБ в популяции составляет 2% от числа беременностей, в структуре невынашивания частота привычного выкидыша составляет от 5 до 20%.
Кроме того, существует термин синдром потери плода, клиническими критериями которого являются один или более самопроизвольных выкидыша на сроке 10 нед или более; неонатальная смерть морфологически нормального новорожденного как осложнение преждевременных родов из-за тяжелого гестоза или плацентарной недостаточности; мертворождение; 3 или более самопроизвольных выкидыша на предимплантационной или ранней эмбриональной стадиях в наблюдениях, когда исключены анатомические, генетические и гормональные причины невынашивания. Этот термин подразумевает не только невынашивание и недонашивание беременности, но и перинатальные потери в доношенном сроке беременности, поэтому не аналогичен привычной потере беременности. Следует отметить, что наиболее часто он используется для клинической характеристики антифосфолипидного синдрома (АФС).
Привычная потеря беременности - полиэтиологичное осложнение гестационного процесса, в основе которого лежат нарушения функции репродуктивной системы. Наиболее частыми причинами ППБ являются эндокринные нарушения репродуктивной системы; стертые формы дисфункции надпочечников; поражение рецепторного аппарата эндометрия, клинически проявляющиеся в виде неполноценной лютеиновой фазы (НЛФ); хронический эндометрит с персистенцией условно патогенных микроорганизмов и/или вирусов; истмико-цервикальная недостаточность; пороки развития матки, внутриматочные синехии; антифосфолипидный синдром и другие аутоиммунные нарушения. Хромосомная патология для
пациенток с синдромом потери беременности менее значима, чем при спорадических абортах, однако у женщин с ППБ структурные аномалии кариотипа абортусов выявляются в 2,4%. Причины спорадического прерывания беременности и ППБ могут быть идентичны, но при этом у супружеской пары с привычной потерей беременности всегда отмечается более выраженная степень патологии репродуктивной системы и больший риск возникновения осложнений гестационного процесса. Своевременная оценка развития фетоплацентарной системы, начиная с самых ранних сроков гестации, позволяет добиться значительного снижения перинатальной заболеваемости и смертности. Применение высокотехнологичных методов исследования состояния эмбриона/плода, провизорных органов, экстраэмбриональных структур позволяет оценить становление системы мать-плацента-плод, выявить особенности ее развития при различных причинах ППБ, разработать индивидуальную тактику ведения беременности, обосновать необходимость проведения тех или иных профилактических мероприятий, а также оценить эффективность медикаментозной терапии. Указанные мероприятия, основанные на глубоком понимании процессов, происходящих в организме женщины и плода, позволяют добиться благополучного исхода беременности - дать супружеской паре живого, доношенного и здорового новорожденного.
Одной из наиболее частых и значимых причин неблагоприятного исхода гестационного процесса является привычное невынашивание беременности, или привычная потеря беременности. Значимость данного осложнения для акушерства очевидна при рассмотрении его распространенности, неоднозначных и сложных подходах к терапии, частоты сопутствующих осложнений и неблагоприятных исходов беременности. Несмотря на достигнутые в последние годы успехи в профилактике и лечении данной патологии, частота самопроизвольных выкидышей остается стабильной и достаточно высокой. Так, по данным разных авторов она составляет от 2 до 55%, достигая в I триместре 50%. В свою очередь, по мере увеличения числа спонтанных выкидышей резко возрастает риск прерывания последующих беременностей. Отсутствие снижения частоты данной патологии указывает на трудности, возникающие при ведении пациенток с ППБ. С одной стороны, они обусловлены многофакторностью этиологии и патогенетических механизмов заболевания. С другой - несовершенством применяемых диагностических методик и отсутствием
адекватного мониторинга осложнений, возникающих во время беременности.
Крайне важной для разработки оптимальной тактики ведения беременной является оценка факторов риска спорадического прерывания и привычной потери беременности. Принято выделять 4 группы факторов риска невынашивания беременности.
1. Социально-биологические факторы: низкое социально-экономическое положение (низкий среднедушевой доход в семье, низкий уровень образования и социальной адаптации, недостаточное и неполноценное питание), психоэмоциональные и физические перегрузки при выполнении трудовой деятельности, стрессовые ситуации.
2. Особенности акушерско-гинекологического анамнеза: возраст первородящей матери менее 18 и более 30 лет, преждевременные роды в анамнезе, отягощенный акушерско-гинекологический анамнез.
3. Наличие экстрагенитальной патологии: сахарный диабет, артериальная гипертензия и другие заболевания сердечно-сосудистой системы, бронхиальная астма, пиелонефрит, привычные интоксикации (табакокурение, алкоголизм, наркомания), хронические инфекции.
4. Осложнения беременности: многоплодие, многоводие, тазовое предлежание плода (преждевременные роды в 20% наблюдений), предлежание плаценты (преждевременные роды в 5 раза чаще), отслойка плаценты (преждевременные роды в 4 раза чаще), генитальные инфекции и внутриутробное инфицирование плода, гестоз.
В структуре привычных потерь беременности выделяют генетические, анатомические, эндокринные, иммунологические, аутоиммунные и инфекционные факторы. При исключении всех перечисленных причин, по данным многих исследователей, в 25-57% наблюдений генез самопроизвольного выкидыша остается неустановленным (идиопатические самопроизвольные аборты). Согласно существующим в настоящее время представлениям, кроме генетических и частично инфекционных причин, ведущих к закладке аномального эмбриона, реализация повреждающего действия других факторов (анатомических, эндокринных, иммунологических, аутоиммунных) состоит в создании неблагоприятного фона для развития генетически полноценного плодного яйца, что ведет к истощению резервных возможностей хориона и остановке развития (эмбриогенеза). Критическими сроками в I триместре беременности являются 6-8 нед - гибель эмбриона, 10-12 нед - экспульсия плодного яйца.
Следует отметить, что у большинства пациенток обследование и лечение приходится осуществлять во время беременности, зачастую на поздних сроках, что не всегда позволяет своевременно выявить и устранить имеющиеся нарушения, несмотря на доказанную высокую эффективность предгравидарной терапии. В связи с этим, у женщин с ППБ в 51% наблюдений отмечается неблагоприятный для плода исход беременности, что обуславливает самый высокий уровень перинатальной заболеваемости и смертности.
ГЕНЕТИЧЕСКИЕ ПРИЧИНЫ ПРИВЫЧНОЙ ПОТЕРИ БЕРЕМЕННОСТИ
В связи с использованием методов генетических исследований появились возможности для расширения представлений о генезе самопроизвольных прерываний беременности. Потери гамет начинаются с момента овуляции. Согласно современным данным у женщин с ненарушенной репродуктивной функцией в 15% наблюдений не происходит оплодотворения, из оплодотворенных яйцеклеток 10-15% начинают дробление, но не в состоянии имплантироваться. Из 70-75% имплантированных бластоцист, только 58% переживают 2-ю нед гестации, но 16% из них будут иметь те или иные аномалии кариотипа.
Генетические факторы в структуре причин ППБ составляют 3-6%. При спорадическом прерывании беременности в I триместре 50% абортусов имеют хромосомные аномалии. Большинство из них (95%) составляют числовые изменения хромосом - моносомии (потеря одной хромосомы), трисомии (наличие добавочной хромосомы), являющиеся результатом ошибок при мейозе, а также полиплоидии (увеличение на полный гаплоидный набор хромосом), в том числе и вследствие унипарентальной дисомии (оплодотворение яйцеклетки 2 сперматозоидами и более). При спорадических выкидышах наиболее распространенной патологией являются трисомии - 60% всех мутаций (чаще всего по 16, 13, 18, 21 и 22 парам хромосом), на втором месте по частоте находится синдром Шерешевского-Тернера (45 XO) - 20%, остальные 15% приходятся на долю полиплоидий (особенно триплоидий). При наличии у абортуса числовых изменений хромосом при исследовании кариотипа родителей чаще всего патология не выявляется и вероятность хромосомной болезни плода при последующих бере-
менностях составляет не более 1%. При исследовании абортусов у пар с привычной потерей беременности в 3-6% наблюдений имеют место структурные изменения хромосом (внутри- и межхромосомные). При изучении кариотипа родителей в 7% наблюдений удается выявить сбалансированные хромосомные перестройки. Чаще всего это реципрокные транслокации, при которых сегмент одной хромосомы располагается на месте другого сегмента негомологичной хромосомы, а также мозаицизм половых хромосом, инверсии и хромосомы в виде кольца. При наличии подобных перестроек у одного из супругов при мейозе затруднены процессы спаривания и разделения хромосом, результатом чего является утрата (делеция) или удвоение (дупликация) участков хромосом в гаметах. В результате образуются несбалансированные хромосомные перестройки, определяющие нежизнеспособность эмбриона или носительство им тяжелой хромосомной патологии. Вероятность рождения ребенка с несбалансированными хромосомными аномалиями при наличии в кариотипе одного из родителей сбалансированных хромосомных перестроек составляет 1-15%. Подобный разброс статистических данных обусловлен особенностями повреждения хромосомного аппарата, пола носителя и семейного анамнеза.
ЭНДОКРИННЫЕ ПРИЧИНЫ ПРИВЫЧНОЙ ПОТЕРИ
БЕРЕМЕННОСТИ
По данным разных авторов, эндокринные причины невынашивания беременности составляют 8-20%. Наиболее значимыми из них являются недостаточность лютеиновой фазы (НЛФ), гиперсреция лютеинизирующего гормона (ЛГ), дисфункция щитовидной железы, сахарный диабет. Тяжелые заболевания щитовидной железы или сахарный диабет могут привести к повторным прерываниям беременности, однако при компенсированном сахарном диабете риск привычных выкидышей не отличается от такового в популяции. В то же время высокая частота гипотиреоидизма в популяции требует скрининга с измерением уровня тиреотропного гормона (ТТГ). У женщин с ППБ недостаточность лютеиновой фазы отмечается в 20-60% наблюдений, а клинические и ультразвуковые признаки поликистозных яичников - в 44-56%. Недостаточность лютеиновой фазы (недостаточность желтого тела) может быть результатом действия целого ряда неблагоприятных факторов:
• нарушения среции фолликулстимулирующего (ФСГ) и лютеинизирующего гормонов (ЛГ) в первой фазе менструального цикла;
• раннего или, напротив, слишком позднего пика выброса ЛГ;
• гипоэстрогении как следствия неполноценного фолликулогенеза.
Указанные выше состояния не подвергаются коррекции заместительной терапией гестагенными препаратами в постовуляторный период. Повреждающее действие несвоевременного выброса ЛГ связывают с преждевременным возобновлением II мейотического деления и овуляцией незрелой яйцеклетки, а также индукцией продукции андрогенов клетками внутренней оболочки фолликула наряду с нарушением рецепции эндометрия под действием гестагенной недостаточности. Тем не менее, даже если механизм формирования НЛФ не связан с уровнем прогестерона у данной категории женщин, механизм прерывания беременности связан с теми изменениями, которые происходят в эндометрии в результате нарушения процессов среторной трансформации. В эндометрии наблюдается недоразвитие желез, стромы, сосудов, недостаточное накопление гликогена, белков, факторов роста, избыточное количество провоспалительных цитокинов, что и ведет к неадекватному развитию плодного яйца, в результате происходит выкидыш. Предварительное снижение преовуляторного уровня ЛГ агонистами гонадолиберинов без дополнительных мер, направленных на пролонгирование наступившей беременности, не дает ожидаемого снижения частоты выкидышей.
Золотым стандартом диагностики НЛФ является гистологическое исследование материала, полученного при биопсии эндометрия во второй фазе цикла в течение 2 менструальных циклов. Следует отметить, что неполноценная лютеиновая фаза у многих женщин с ППБ связана с другими причинами, а не с неполноценным стероидогенезом: частые аборты с выскабливанием слизистой оболочки матки, хронический эндометрит, пороки развития матки и инфантилизм, внутриматочные синехии. Терапия препаратами прогестерона клинического эффекта у данной категории женщин не дает. Существует мнение, что снижение уровня гормонов при беременности обусловлено не нарушениями в репродуктивной системе женщины, а отсутствием стимуляции выработки гормонов со стороны неадекватного плодного яйца. Формирование неполноценного плодного яйца может быть обусловлено гиперсрецией ЛГ и гипосрецией ФСГ в
первую фазу менструального цикла. Гипоэстрогения на этапе селекции доминантного фолликула приводит к снижению овуляторного пика ЛГ и уровня эстрадиола, замедлению темпов развития преовуляторного фолликула, преждевременной индукции мейоза, внутрифолликулярному перезреванию и дегенерации ооцита. Снижение продукции эстрадиола ведет к неполноценной продукции прогестерона и отсутствию должной среторной трансформации эндометрия. В указанных условиях стимуляция фолликулогенеза даст лучший эффект, чем постовуляторное назначение прогестерона (Speroff L., Gloss R.H., 1994). Диагностика других причин овуляторной дисфункции (гиперпролактинемии, гипотиреоза, функционального избытка яичниковых или надпочечниковых андрогенов) должна сопровождаться назначением соответствующего лечения.
Среди гормональных нарушений, приводящих к невынашиванию беременности, очень большое место занимает гиперандрогения - патологическое состояние, обусловленное изменением среции и метаболизма андрогенов. По данным многочисленных исследований, 46-77% нарушений менструального цикла, 60-74% эндокринного бесплодия и 21-32% невынашивания беременности в той или иной степени обусловлены гиперандрогенией. Для ППБ характерны стертые «неклассические» формы гиперандрогении, представляющие собой наибольшую сложность в выявлении источника избыточного уровня андрогенов, оценке патогенеза, диагностики и тактики ведения. Стертые формы гиперандрогении надпочечникового генеза являются ведущим фактором невынашивания у 30% женщин с гиперандрогенией. Кора надпочечников состоит из трех зон: клубочковой, вырабатывающей альдостерон; пучковой зоны, вырабатывающей кортизол; сетчатой зоны, вырабатывающей в большей степени андрогены и в меньшей степени кортизол. В процессе метаболизма дефект ферментных систем вызывает целый ряд нарушений на путях биосинтеза гормонов, что ведет к накоплению предшественников выше места дефекта ферментной системы. Передаваясь по аутосомно-рецессивному типу, такие дефекты затрагивают различные ферменты и вызывают их дефицит различной степени тяжести, что обуславливает различную степень тяжести клинических проявлений.
В норме синтез гормонов в надпочечниках осуществляется следующим образом (рис. 17).
Основными андрогенами, продуцируемыми надпочечниками, являются ДЭА, ДЭА-С и андростендион. Они являются слабыми
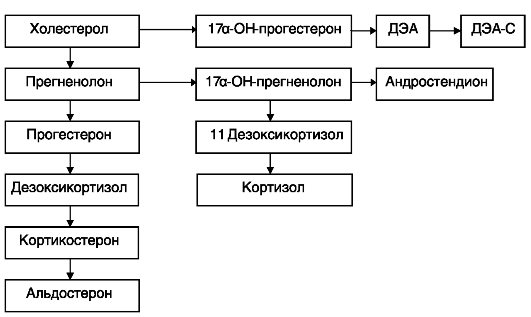 Рис. 17. Синтез гормонов в надпочечниках в норме
Рис. 17. Синтез гормонов в надпочечниках в норме
андрогенами, но в тканях организма, особенно в жировой, они метаболизируются в андрогены с более высокой активностью - тестостерон и дигидротестостерон. Неклассические, «стертые» формы АГС начинают проявляться в зрелом возрасте и напоминают синдром поликистозных яичников, но эти состояния необходимо дифференцировать, так как тактика ведения различна. Ферментные нарушения при этом могут проявляться в виде недостаточности 21-гидроксила- зы (аутосомно-рецессивный тип наследования), дефицита 11β-гидроксилазы или 3β-гидроксистероиддегидрогеназы. Для последней формы адреногенитального синдрома характерно наличие опухоли надпочечника. Чаще опухоль поражает один из надпочечников, поэтому продукция кортизола и АКТГ поддерживается в состоянии баланса. Следует отметить, что для привычной потери беременности тяжелые заболевания не характерны. Механизм прерывания беременности при стертых формах адреногенитального синдрома обусловлен нарушением процессов метаболизма гормонов, наличием ановуляции и неполноценной второй фазой менструального цикла. При классической форме заболевания наблюдается аменорея и бесплодие. Чаще всего у пациенток с ППБ с надпочечниковой формой гиперандрогении отмечались повышенные уровни 17-ОП, 17-КС и ДЭА, что свидетельствует о нарушении стероидогенеза по типу
поздно возникающего адреногенитального синдрома с дефицитом 21-гидроксилазы.
Гиперадрогения яичникового генеза - синдром поликистозных яичников (СПКЯ) выявляется только у 12,1% женщин с ППБ. Характерными клиническими проявлениями данной формы гиперандрогении являются бесплодие, нерегулярные менструации, вплоть до аменореи, гирсутизм, ожирение. Основным источником гиперпродукции андрогенов у данной группы женщин являются яичники. Дисрегуляция цитохром-р450 c 17-андроген-образующего фермента в яичниках и надпочечниках является центральным патогенетическим механизмом развития СПКЯ. Причины формирования СПКЯ до настоящего времени четко не определены. Полагают, что это заболевание начинается с адренархе. В период адренархе происходит стимуляция сетчатой зоны коры надпочечников (сходной с таковой при стрессе), что приводит к повышению среции надпочечниками андрогенов и, вследствие этого, усиление образования эстрогенов на периферии (жировая ткань, кожа). Повышенный уровень эстрогенов нарушает соотношение ЛГ/ФСГ, что стимулирует яичники к выработке андрогенов. Андрогенная основа этого синдрома смещается с надпочечников на яичники. Нарушение среции андрогенов корой надпочечников наблюдается у 50% больных с СПКЯ, и данная сочетанная форма гиперандрогении отмечается наиболее часто при обследовании женщин с ППБ. Значительная роль в генезе этих нарушений принадлежит средовым факторам (различные заболевания, травмы, инфекции, психоэмоциональный стресс и др.), которые являются триггерами в реализации патологического процесса у больных с отягощенным генетическим фоном. Согласно полученным авторами данным, женщины с надпочечниковой гиперандрогенией могут быть отнесены к начальной стадии заболевания. Об этом свидетельствуют особенности клинико-гормонального статуса со незначительно выраженными симптомами андрогенизации, высокая частота реабилитированных больных. По мере углубления нарушений в системе гипоталамус-гипофиз-надпочечники в патологический процесс вовлекаются яичники с возникновением в них структурных и функциональных нарушений, что приводит к образованию более тяжелых смешанных форм, представляющих значительные трудности в диагностике и лечении, ведении беременности у этого контингента больных.
ИНФЕКЦИОННЫЕ ПРИЧИНЫ ПРИВЫЧНОЙ ПОТЕРИ БЕРЕМЕННОСТИ
Роль инфекционного фактора как причины ППБ в настоящее время не вызывает сомнений. Известно, что первичном инфицировании на ранних сроках беременности возможны эмбрио- и фетопатии, несовместимые с жизнью, что приводит к спорадическому прерыванию беременности. Вероятность реактивации инфекции в те же сроки с исходом в повторные потери беременности ничтожно мала. Исследования последних лет показали, что у большинства женщин с привычной потерей беременности и наличием хронического эндометрита отмечается превалирование в эндометрии 2-3 видов и более облигатно-анаэробных микроорганизмов и вирусов.
Смешанная персистентная вирусная инфекция (вирус простого герпеса, Коксаки А, Коксаки В, энтеровирусы 68-71, цитомегаловирус) встречается у больных с привычным выкидышем достоверно чаще, чем у женщин с неосложненным акушерско-гинекологическим анамнезом. Бактериально-вирусная колонизация эндометрия является, как правило, следствием неспособности иммунной системы и неспецифических защитных сил организма (системы комплемента, фагоцитоза) полностью элиминировать инфекционный агент, и в тоже время имеет место ограничение его распространения за счет активации Т-лимфоцитов (Т-хелперов, естественных киллеров) и макрофагов.
Вирусные заболевания во время беременности (грипп, краснуха, корь, полиомиелит, эпидемический паротит, вирусные гепатиты, парвовирусная, цитомегаловирусная, герпес-вирусная, коксаки-вирусная инфекции) могут приводить к анэмбрионии, неразвивающейся беременности, самопроизвольным выкидышам, антенатальной гибели плода, порокам развития плода (совместимым и несовместимым с жизнью), внутриутробной инфекции, проявляющейся в постнатальном периоде. Большое значение в характере нарушений, вызванных вирусной инфекцией, имеет срок беременности, в котором произошло внутриутробное инфицирование. Чем меньше срок гестации, тем выше вероятность остановки развития и формирования пороков развития. Инфицирование плода в более поздние сроки развития обычно не приводит к формированию грубых мальформаций, но может нарушать функциональные механизмы дифференцировки клеток и тканей.
Плацента представляет собой физиологический барьер, препятствующий проникновению вируса к плоду, однако на ранних этапах беременности быстроделящиеся клетки формирующегося трофобласта, имеющие высокий уровень обменных процессов, являются прекрасной средой для репликации вирусных частиц, которые могут оказывать прямое повреждающее действие на плаценту. При неосложненной беременности клетки цитотрофобласта не экспрессируют антиген главного комплекса гистосовместимости и являются иммуноиндифферентными. Если же на этих клетках экспрессируется вирус, то они становятся пусковым механизмом активации иммунных клеток и мишенью для иммунной агрессии, которая усугубляет повреждения плаценты и тем самым нарушает ее функцию с очень ранним формированием плацентарной недостаточности. Значительно облегчается проникновение вирусов через плацентарный барьер к развивающемуся эмбриону/плоду при различных повреждениях плацентарной ткани, например при угрозе прерывания, аутоиммунных нарушениях, токсикозах.
Бактериальная внутриутробная инфекция условно-патогенными микроорганизмами развивается в основном вследствие проникновения восходящей инфекции из родовых путей - 82,5%. Этот путь также характерен для микоплазм, хламидий, грибов рода Candida и лишь отдельных вирусов, в частности простого герпеса.
Околоплодные воды женщины в поздние сроки беременности обладают антимикробной активностью, однако она выражена слабо и может только задерживать (но не подавлять) рост микроорганизмов. Бактериостатический эффект непродолжителен (от 3 до 12 ч). Плодные оболочки проницаемы для многих условнопатогенных микроорганизмов, поэтому заражение плода может происходить и при целом плодном пузыре. Возбудитель проникает в околоплодные воды, происходит его интенсивное размножение и накопление. Формируется очаг инфекции и плод оказывается в инфицированной среде. Таким образом, развивается «синдром инфекции околоплодных вод» к проявлениям которого относятся признаки внутриутробной инфекции у новорожденного; децидуит, хорионит, васкулиты (преждевременное созревание плаценты); многоводие, маловодие; плацентарная недостаточность (гипоксия, синдром задержки развития плода); невынашивание беременности; преждевременный разрыв плодных оболочек; респираторные расстройства у новорожденного.
Наиболее чувствительной фазой к воздействию повреждающих факторов являются первые 3-6 нед органогенеза. Инфекционные эмбриопатии, возникающие в это время, характеризуются возникновением уродств, реже наблюдается эмбриотоксическое действие. В первую очередь поражаются ткани, которые на момент действия агента находились в процессе активной дифференцировки. У различных органов периоды закладки не совпадают по времени, поэтому от длительности воздействия повреждающего агента будет зависеть множественность поражения.
С началом раннего фетального периода (13-27 нед) у плода появляется специфическая чувствительность к возбудителям внутриутробных инфекций. При фетопатиях септической этиологии возможно формирование пороков развития. Морфологической основой для этого служат альтеративные и пролиферативные процессы, приводящие к облитерации или сужению естественных каналов и отверстий. Подобные изменения ведут к нарушению дальнейшего развития уже сформированного органа. Так, инфекция мочевыводящих путей может привести к гидронефрозу, перенесенный менингоэнцефалит - к гидроцефалии на фоне сужения или облитерации сильвиева водопровода. После 27 нед гестации плод приобретает способность специфически отвечать на внедрение возбудителя инфекции лейкоцитарной инфильтрацией, гуморальными и тканевыми изменениями. Поражающее действие инфекционного агента реализуется в данном случае в виде функциональных дефектов.
Персистируя длительное время, вирусно-бактериальная инфекция может приводить к изменению антигенной структуры инфицированных клеток за счет собственно инфицированных антигенов, включаемых в структуру поверхностных мембран, так и образования новых клеточных антигенов, детерминированных клеточным геномом. Развивается иммунный ответ на гетерогенезированные аутоантигены, приводящий к появлению аутоантител, который, с одной стороны, оказывает разрушающее действие на клетки собственного организма, но с другой - является защитной реакцией, направленной на сохранение гомеостаза. Аутоиммунные реакции, вируснобактериальная колонизация эндометрия относится к наиболее частым этиологическим факторам, вызывающим развитие хронической формы ДВС-синдрома.
Таким образом, хроническая смешанная вирусно-бактериальная инфекция у пациенток с ППБ, персистируя длительное время в орга-
низме и оставаясь при этом бессимптомной, приводит к гиперкоагуляции, аутоиммунным нарушениям на локальном уровне, подавлению интерфероногенеза, активации провоспалительных цитокинов. Все вышеуказанные механизмы непосредственно участвуют в процессах гибели и отторжения плодного яйца.
АНАТОМИЧЕСКИЕ ПРИЧИНЫ ПРИВЫЧНОЙ ПОТЕРИ
БЕРЕМЕННОСТИ
К анатомическим причинам привычной потери беременности относятся:
1. Врожденные аномалии развития матки (полное удвоение матки, двурогая, седловидная, однорогая матка, частичная или полная внутриматочная перегородка).
2. Приобретенные анатомические дефекты:
- внутриматочные синехии (синдром Ашермана);
- подслизистая миома матки.
3. Истмико-цервикальная недостаточность (ИЦН).
Частота анатомических аномалий репродуктивной системы у пациенток с привычной потерей беременности колеблется в пределах 10-16%. Частота встречаемости пороков развития матки, при которых возможно невынашивание беременности (но не бесплодие), следующая: двурогая матка - 37%, седловидная матка - 15%, внутриматочная перегородка - 22%, полное удвоение матки - 11%, однорогая матка - 4,4% по отношению ко всем порокам развития матки.
У большинства женщин с нарушением репродуктивной функции пороки развития матки сочетаются с гормональными нарушениями, формированием неполноценной лютеиновой фазы менструального цикла. Возможно, это связано с действием на гонады того же повреждающего фактора, который привел к аномалиям развития матки. Механизм прерывания беременности при пороках развития матки связан с нарушениями процесса имплантации плодного яйца, недостаточным развитием эндометрия, недостаточной васкуляризацией органа, тесными пространственными взаимоотношениями, функциональными особенностями миометрия.
Нередко прерывание беременности может быть обусловлено гипоплазией матки вследствие генитального инфантилизма, представляющего собой частное проявление сложного патологического процесса. Он характеризуется недоразвитием половых органов и
различными нарушениями в системе гипоталамус-гипофиз-яичники-матка.
Патогенез развития генитального инфантилизма сложен и до конца не ясен. С половым инфантилизмом связано большое число осложнений (нарушения менструального цикла, ссуальной жизни и детородной функции). При изучении репродуктивной функции и особенностей течения беременности у женщин с генитальным инфантилизмом обнаружено, что у пациентов с ППБ, как правило, отмечаются нормальные антропометрические данные и хорошо выраженные вторичные половые признаки. При гормональном обследовании уровень гормонов соответствовал колебаниям, характерным для нормального менструального цикла. Несоответствие между уровнем гормонов в плазме крови и тестами функциональной диагностики позволило предположить наличие неадекватной тканевой реакции на гормоны, продуцируемые яичниками. При данной нозологической форме правильнее говорить не о гипофункции яичников, а о недостаточности и неполноценности эндометрия. В механизме прерывания беременности при генитальном инфантилизме ведущим является маточный фактор: недостаточная подготовка эндометрия, повышенная возбудимость миометрия инфантильной матки, тесные пространственные соотношения. Угроза прерывания беременности наблюдается на всех этапах беременности у женщин с генитальным инфантилизмом, так же как у женщин с пороками развития матки. Во II триместре беременности наиболее частым осложнением является истмико-цервикальная недостаточность. В более поздние сроки отмечается легкая возбудимость матки, повышение тонуса, нередко развивается плацентарная недостаточность. На фоне генитального инфантилизма и пороков развития матки часто проявляется неблагоприятное действие других факторов самопроизвольного прерывания беременности.
В структуре невынашивания во II триместре беременности на долю истмико-цервикальной недостаточности (ИЦН) приходится 40%, а в III триместре беременности ИЦН встречается в каждом третьем наблюдении преждевременных родов. Недостаточность шейки матки вызывается структурными и функциональными изменениями истмического отдела матки, состояние которого определяется циклическими изменениями в организме женщины. Так, при двухфазном менструальном цикле в первой фазе отмечается повышение тонуса маточной мускулатуры и, соответственно, расширение ист-
мического отдела, а во второй - снижение тонуса матки и сужение ее истмического отдела. Различают органическую и функциональную ИЦН. Органическая (посттравматическая, вторичная) ИЦН возникает в результате предшествующих выскабливаний полости матки, сопровождавшихся предварительным механическим расширением цервикального канала, а также патологических родов, в том числе с применением влагалищных родоразрешающих операций, приведших к глубоким разрывам шейки матки. Патогенез функциональной ИЦН изучен недостаточно. Определенную роль в ее развитии играет раздражение α-адренорецепторов и торможение β-адренорецепторов. Чувствительность α-адренорецепторов усиливается при гиперэстрогении, β-адренорецепторов - при повышении концентрации прогестерона. Активация α-адренорецепторов ведет к сокращению шейки матки и расширению перешейка, обратный процесс наблюдается при активации β-адренорецепторов. Функциональная ИЦН, таким образом, возникает при эндокринных нарушениях. При гиперандрогении данный вид ИЦН встречается у каждой третьей больной. Кроме того, указанная патология может возникать в результате нарушения пропорционального соотношения между мышечной тканью, содержание которой возрастает до 50% (при норме 15%), что приводит к раннему размягчению шейки и соединительной ткани, а также изменения реакции структурных элементов шейки матки на нейрогуморальные раздражители. Очень часто наблюдается врожденная ИЦН у женщин с генитальным инфантилизмом и пороками развития матки.
Многие женщины с миомой матки имеют нормальную репродуктивную функцию, беременность и роды у них протекают без осложнений. Тем не менее многие авторы отмечают, что угроза прерывания отмечается у 30-75% больных с миомой матки. Прерывание беременности у женщин с миомой матки может быть в том случае, если размеры матки и расположение узлов неблагоприятно для течения беременности. Особенно неблагоприятные условия для развития беременности создаются при межмышечной и подслизистой локализации узлов. Подслизистая миома наиболее часто осложняет течение беременности в I триместре. Большие миоматозные узлы могут деформировать полость матки и создавать неблагоприятные условия для прогрессирования гестационного процесса и плацентации. Самым неблагоприятным является вариант, когда плацентация происходит в области нижнего сегмента и на миоматозных узлах. Не
меньшее значение в генезе привычной потери беременности имеют гормональные нарушения у больных с миомой матки. Так, некоторые исследователи полагают, что миома матки сопровождается абсолютной или относительной прогестероновой недостаточностью, что может явиться одним из способствующих моментов самопроизвольного прерывания беременности. Нередко угроза прерывания беременности обусловлена нарушениями питания миоматозных узлов, развитием отека или некроза опухолевого образования. При решении вопроса о сохранении беременности у больных с миомой матки необходим индивидуальный подход. Следует учитывать возраст, длительность заболевания, данные о наследственности, наличие сопутствующей экстрагенитальной патологии.
ИММУНОЛОГИЧЕСКИЕ ПРИЧИНЫ ПРИВЫЧНОЙ
ПОТЕРИ БЕРЕМЕННОСТИ
В настоящее время известно, что около 80% всех ранее необъяснимых привычных потерь беременности (после исключения генетических, эндокринных, анатомических и инфекционных причин) обусловлено иммунологическими нарушениями. Принято различать аутоиммунные и аллоимунные нарушения, ведущие к привычному невынашиванию беременности.
При аутоиммунных процессах предметом агрессии иммунной системы являются собственные ткани материнского организма, т.е. имеет место направленность антительного ответа против собственных антигенов. В этой ситуации плод страдает вторично в результате повреждения материнских тканей. При аллоиммунных нарушениях иммунный ответ женщины направлен против антигенов эмбриона/ плода, полученных от отца и являющихся потенциально чужеродными для организма матери.
К аутоиммунным нарушениям, наиболее часто встречающимся у больных с привычной потерей беременности, относится наличие в сыворотке антифосфолипидных, антитиреоидных, антинуклеарных аутоантител. Так, установлено, что у 31% женщин с ППБ вне беременности выявляются аутоантитела к тироглобулину, пероксидазе щитовидной железы [thyroid microsomal (thyroid peroxidase) autoantibodies]; при этом риск самопроизвольного прерывания беременности в I триместре гестации возрастает до 20%.
При привычной потере беременности наличие антинуклеарных и антитиреодных антител указывает на необходимость дальнейшего обследования для выявления аутоиммунного процесса и верификации диагноза. Общепризнанным аутоиммунным состоянием, ведущим к гибели эмбриона/плода, в настоящее время остается антифосфолипидный синдром (синдром Хьюса). Он описан в 1986 г. G.R.V. Hughes. Одним из трех клинических критериев которого является синдром потери плода, а также открытие в конце XX в. целого ряда генетически обусловленных тромбофилий - дефициты протеинов С, S, мутация фактора V Leiden, мутация протромбина G20210A, синдром липких тромбоцитов и др. позволило предположить новый механизм эндотелиальных повреждений, лежащий в основе развития синдрома потери плода и целого ряда других осложнений беременности. Более того, исследователи проблемы тромбофилии в разных странах мира независимо друг от друга получили данные о доминирующей роли приобретенной и генетически обусловленной тромбофилии, а также их сочетания в синдроме потери плода. По обобщенным данным мировой литературы роль тромбофилии в структуре причин синдрома потери плода составляет от 40 до 75%.
К аутоиммунным факторам привычной потери беременности относят наличие антител к хорионическому гонадотропину человека (ХГЧ). Механизм действия антител состоит не только в препятствовании связыванию ХГЧ с рецепторами желтого тела яичников, но и в прямом повреждающем влиянии на клетки эмбриональной трофэктодермы. У 95% женщин с высокими титрами антител к ХГЧ наблюдалась угроза прерывания беременности в I триместре. Антитела к ХГЧ при проведении иммуноферментного анализа перекрестно реагируют с ЛГ и ФСГ, что обусловлено наличием общих антигенных детерминант. Подобные гормональные и аллоиммунные нарушения ведут к раннему развитию ДВС-синдрома (с 3-8 нед беременности) и как следствие к угнетению гормонпродуцирующей и трофической функции трофобласта.
Аллоиммунные нарушения. В настоящее время к аллоиммунным процессам, ведущим к потере беременности, относят наличие у супругов повышенного (более 3) количества общих антигенов системы главного комплекса гистосовместимости (часто наблюдается при родственных браках); низкий уровень блокирующих факторов в сыворотке матери; повышенное содержание естественных клетоккиллеров (NK-клеток CD56, CD16) в эндометрии и периферической
крови матери как до, так и во время беременности; высокие уровни в эндометрии и сыворотке ряда цитокинов, в частности γ-интерферона, фактора некроза опухоли-α, интерлейкинов-1 и -2. В настоящее время аллоиммунные факторы, ведущие к ранним потерям беременности, и пути коррекции указанных выше состояний находятся в стадии изучения. Нет единого мнения о методах терапии. По данным одних исследователей, активная иммунизация лимфоцитами донора не оказывает ожидаемого эффекта, другие описывают значимый положительный эффект при такой иммунизации и лечении иммуноглобулинами. В настоящее время одним из иммуномодулирующих средств в ранние сроки беременности является прогестерон. В частности, в исследованиях доказана роль дидрогестерона в суточной дозе 20 мг у женщин с привычной потерей беременности в I триместре беременности при повышенном уровне CD56-клеток в эндометрии.
Таким образом, привычная потеря беременности является сложной мультифакториальной патологией, обуславливающей высокую перинатальную смертность и заболеваемость, и требующей индивидуального и тщательного подхода к обследованию, лечению и ведению беременности.
Изучение эхографических особенностей развития эмбриона и экстраэмбриональных структур при привычной потере беременности позволило нам установить прогностические неблагоприятные маркеры, представленные в табл. 9. На сегодняшний день, по данным большинства исследователей, важнейшим ультразвуковым критерием, подтверждающим патологическое течение беременности, является несвоевременное обнаружение в полости матки эмбриона.
У 15,24% выявляется отставание КТР от ожидаемых значений на 6-10 дней, и у 25% из них сохраняется отставание копчико-теменного размера эмбриона от гестационного срока не более чем на 7 дней. Прогрессирующее снижение КТР эмбриона в сочетании с уменьшением объема плодного яйца позволило диагностировать задержку роста эмбриона, что явилось клиническим симптомом первичной плацентарной недостаточности. При отставании КТР от должного для гестационного срока более чем на 2 нед при сроке менее 9 нед (КТР менее 18 мм) все беременности закончились самопроизвольным выкидышем. Одним из крайне важных маркеров адекватного развития плода и его нормального функционального состояния являются особенности его сердечной деятельности. В нашем исследовании в группе беременных с ППБ в большинстве наблюдений (74,29%)
Таблица 9. Эхографические особенности эмбриона при осложненном течении гестационного процесса у пациенток с привычной потерей беременности
Эхографический признак | Частота, % | Течение беременности | Исход беременности |
Отсутствие эмбриона в плодном яйце >14 мм | 2,78 | Угрожающее прерывание беременности | Анэмбриония |
Отсутствие сердцебиения при КТР>16 мм | 3,81 | Угрожающее прерывание беременности | Неразвивающаяся беременность (100%*) |
Отставание КТР от срока на 6-10 дней | 15,24 | Без осложнений 59,38%* | При прогрессировании отставания КТР: самопроизвольный выкидыш (60%*), неразвивающаяся беременность (40%*) |
Отставание КТР от срока >14 дней | 3,33 | Угроза прерывания (57,14%*), КТР>18 мм | Самопроизвольное прерывание беременности (42,86%*), КТР<18мм |
Брадикардия | 3,33 | Угроза прерывания (100%*) | Самопроизвольное прерывание беременности (100%*) |
Тахикардия | 18,57 | Субхориальная гематома V>25 ml (41,03%*) Угроза выкидыша (58,97%*) | Самопроизвольный выкидыш (при выраженной тахикардии на фоне начавшегося выкидыша) (12,5%) |
Примечание. *Процент рассчитан из числа беременных с указанными изменениями сердечной деятельности эмбриона/плода.
динамика изменений частоты сердечных сокращений (ЧСС) эмбриона соответствовала параметрам физиологически протекающей беременности. У беременных с клинической картиной угрожающего прерывания у 10,95% эмбрионов отмечена тахикардия. Выраженное возрастание ЧСС в пределах 190-210 уд/мин отмечается на фоне начавшегося самопроизвольного прерывания беременности.
Выявлено также снижение частоты сердечных сокращений (брадикардия до 90 уд/мин) у 3,33% пациенток с клинической картиной угрожающего самопроизвольного выкидыша и диагностированной впоследствии гибелью эмбриона. Сравнение результатов исследования сердечной деятельности плода в I триместре с дальнейшим течением и исходом беременности установило, что величина ЧСС имеет прогностическое значение, прежде всего для первых 12 нед. Наблюдаемые нами изменения сердечной активности в 96% свидетельствовали о патологическом течении I триместра беременности.
Кроме исследования эмбриона и оценки его жизнедеятельности, самого пристального внимания на ранних сроках беременности заслуживает изучение экстраэмбриональных структур плодного яйца, при этом наибольшего внимания заслуживают желточный мешок, хориальная и амниотическая полости. Из экстраэмбриональных структур наибольший интерес исследователей привлекает желточный мешок, так как данное образование первым (после плодного яйца) выявляется при ультразвуковом сканировании. В нашем исследовании эхографические отклонения в размере, форме и структуре желточного мешка выявлены у 31,48% беременных. Из них у 48,53% пациенток эти изменения встречались изолированно, у остальных 51,47% они сочетались с другими отклонениями в развитии структур плодного яйца. У беременных с ППБ увеличение диаметра желточного мешка с эхопозитивным содержимым сочетается с многоводием и частичной корпоральной отслойкой хориона (рис. 18). В этом наблюдении на сроке 9 нед была диагностирована неразвивающаяся беременность. В дальнейшем течение беременности у пациенток с большим размером желточного мешка осложняется угрозой прерывания, преждевременным созреванием плаценты, гестозом. Таким образом, изучение размеров, структуры и формы желточного мешка позволяет не только прогнозировать неблагоприятные исходы беременности в I триместре, но и формирование ПН в последующем. Таким образом, благоприятный перинатальный исход
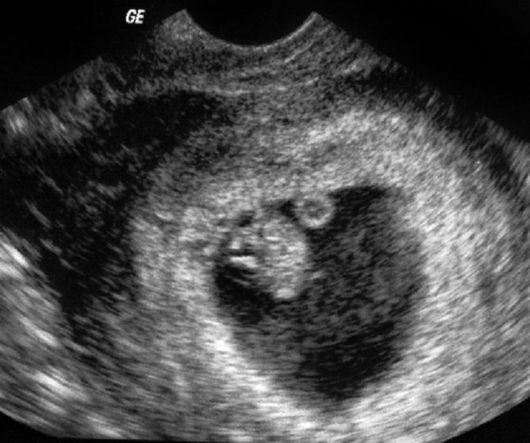 Рис. 18. Увеличение
диаметра желточного мешка свыше 7 мм у пациентки с ретрохориальной
гематомой, ранним маловодием и утолщением хориона в I триместре
беременности
Рис. 18. Увеличение
диаметра желточного мешка свыше 7 мм у пациентки с ретрохориальной
гематомой, ранним маловодием и утолщением хориона в I триместре
беременности
отмечен у 65% пациенток с эхографическими особенностями желточного мешка, неблагоприятный - в 35% наблюдений при условии сочетания с нарушениями развития других структур плодного яйца. Следовательно, эхографически регистрируемые аномалии желточного мешка не могут однозначно свидетельствовать о патологическом развитии беременности, однако их выявление является обязательным показанием для детального изучения эмбриона и экстраэмбриональных образований (амниотической и хориальной полостей).
При исследовании объемов плодного яйца раннее маловодие было нами установлено у 21,76% плодов. Во всех наблюдениях уменьшение объема плодного яйца и амниотической полости (раннее маловодие) сопровождалось клиническими признаками угрозы прерывания беременности.
Несомненный интерес представляет выявленная нами взаимосвязь между ранним маловодием и наличием в анамнезе нарушений менструального цикла в виде недостаточности лютеиновой фазы, гиперандрогении, гиперпролактинемии различного генеза. Малые размеры плодного яйца выявлены у каждой пятой женщины старше 32 лет.
Ультразвуковое обследование установило у 65% женщин основной группы наличие корпорального расположения гематомы, для которой явились характерными жалобы на тянущие боли внизу живота. Вместе с тем при супрацервикальной отслойке хориона (35%) пациенток беспокоили преимущественно мажущие кровянистые выделения из половых путей.
Анализ течения и исхода беременности установил отрицательное прогностическое значение большого объема гематомы и ее корпорального расположения. Так, в 41% наблюдений выраженная клиническая картина угрозы прерывания сочеталась с отслойкой плодного яйца в области одной из стенок полости матки. Наряду с этим, у двух пациенток с гематомой, расположенной в области проекции корня пуповины, произошел самопроизвольный выкидыш. Сопоставление клинических симптомов с данными ультразвуковой эхографии у женщин с частичной отслойкой хориона позволило выделить следующие особенности течения беременности. Так, симптомы угрожающего выкидыша, проявляющиеся болями внизу живота, явились наиболее характерными для корпорально расположенной гематомы. В свою очередь, супрацервикальная отслойка хориона сопровождалась преимущественно кровянистыми выделениями из половых путей.
Кроме желточного мешка, мы оценили эхографические характеристики хориона при ППБ. Исследование показало, что его патологические изменения в виде истончения, утолщения, нарушения структуры отмечались в 6,94% наблюдений. У активно курящих женщин (4,2%) хорион отличается диффузной неоднородностью за счет эхонегативных включений небольших размеров. В свою очередь, в 14,81% установлено повышение эхогенности структуры, которое в 66,7% происходило на фоне уреаплазменной инфекции.
Важно отметить, что у 88,2% пациенток с патологией хориона диагностирован благоприятный исход беременности. Сравнительный анализ полученных результатов не выявил связи эхографического изображения хориона с особенностями течения беременности при
ППБ.
Наряду с эхографической оценкой развития плодного яйца, в работе определено влияние параметров маточно-плацентарно-плодового кровотоков в I триместре на течение и исход беременности при ППБ.
На основании результатов проведенного нами исследования определены особенности патогенеза ПН у женщин с ППБ и угрозой прерывания беременности:
• ранние признаки задержки роста эмбриона;
• нарушение сердечной деятельности эмбриона;
• изменения структуры провизорных органов и трофики эмбриона;
• недостаточные гестационные изменения в спиральных артериях;
• патология амниона;
• нарушение сопряженности становления маточно-плацентарного кровотока, кровотока в сосудах желточного мешка и плодовоплацентарной гемодинамики.
Нами было установлено, что существует четкая взаимосвязь неблагоприятных исходов беременности в I триместре с выявленными нарушениями кровотока в различных сосудистых звеньях системы мать-плацента-плод, сосудистой сети провизорных органов, артериальной и венозной гемодинамики плода позволяет рассматривать некоторые из них как прогностически неблагоприятные признаки, что позволяет скорректировать терапию и тактику ведения беременной.
Для самопроизвольного прерывания беременности прогностически неблагоприятными являются:
• наличие ретрохориальной гематомы большого (более 20 мл) объема и повышение сосудистого сопротивления в межворсинчатом пространстве и спиральных артериях;
• повышение сосудистого сопротивления в артериях желточного мешка и желточного протока;
• сохранение пульсирующего спектра кровотока в вене пуповины. В настоящее время, несмотря на большое количество работ,
доказывающих высокую эффективность предгравидарной подготовки женщин с привычной потерей беременности, в практической деятельности мы имеем дело с пациентками, не получившими должного обследования и лечения перед следующей беременностью. В связи с этим, при осложненном течении последующей беременности у пациенток с ППБ врачу приходится эмпирически подбирать адекватную патогенетическую терапию еще до получения результатов лабораторных методов исследования, поэтому особенно актуально использование разработанных эхографических критериев, позволя-
ющих не только своевременно диагностировать отклонения в течении беременности и становления системы мать-плацента-плод, но и выбирать наиболее рациональную лечебную тактику в отношении каждой пациентки с ППБ.
На основании результатов комплексного клинико-лабораторного, эхографического и допплерометрического обследования женщин в I триместре гестации с учетом клинико-анамнестических и лабораторных данных предложен дифференцированный подход к ведению беременности у пациенток с ППБ (табл. 10).
При наличии у пациенток с клинической картиной угрожающего выкидыша, осложненным акушерским анамнезом и низкими значениями базальной температуры сочетанное снижение объемов амниотической и хориальной полостей по данным эхографии производится назначение традиционной спазмолитической терапии (ношпа, папаверин, «Магне Вб») не вызвает положительной динамики клинической симптоматики. Кроме того, при эхографии, как правило, выявляется отсутствие полноценного желтого тела яичника, а у части женщин отмечается снижение базальной температуры до 36,8-37,0 °С.
В связи с этим целесообразно также назначение гормональной терапии гестагенами (дидрогестерон по 20 мг 2-3 раза в сут или микронизированный прогестерон по 200 мг 2-3 раза в сут перорально или интравагинально с последующим снижением до 16 нед беременности). В результате данного лечения отмечается регресс всей клинической симптоматики на фоне достоверного увеличения размеров плодного яйца и адекватный прирост эмбриометрических параметров (КТР). Указанная терапия также позволяет в 2 раза снизить преждевременное созревание плаценты, избежать формирования плацентарной недостаточности и в 84% - появления клинической картины угрожающего прерывания беременности во II-III триместрах.
У каждой пятой беременной с угрожающим выкидышем при ультразвуковом исследовании выявляют сочетанные эхографические изменения размеров плодного яйца (маловодие или многоводие), структуры хориона и желточного мешка. У каждой четвертой беременной после 10 нед зарегистрированы изолированные нарушения кровотока в венозном протоке плода. Гемостазиологическое исследование в этих наблюдениях обычно выявляет повышение агрегационной активности тромбоцитов. Учитывая полученные данные, всем
Таблица 10. Основные эхографические критерии и тактика ведения беременных с ППБ
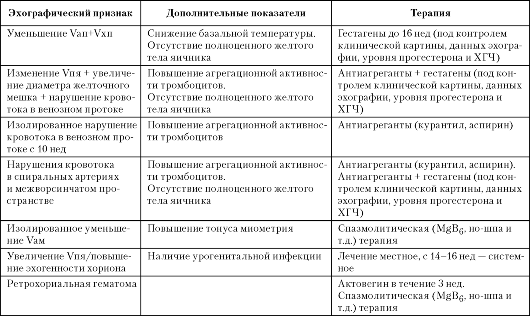 пациенткам
следует назначать терапию гестагенами (Дюфастон по 20 мг 2-3 раза в сут
или Утрожестан по 200 мг 2-3 раза в сут перорально или интравагинально с
последующим снижением до 16 нед беременности) и антиагреганты
(дипиридамол по 0,25 мг 3 раза в сут; ацетилсалициловая кислота 100
мг/сут на протяжении 3 нед). На фоне лечения отмечается положительная
динамика клинических и эхографических данных, в среднем к 14-15 нед
беременности установлен нормальный прирост фетометрических показателей.
При контрольном допплерометрическом исследовании выявляется нормализация
кровотока в венозном протоке к 18-20 нед гестации.
пациенткам
следует назначать терапию гестагенами (Дюфастон по 20 мг 2-3 раза в сут
или Утрожестан по 200 мг 2-3 раза в сут перорально или интравагинально с
последующим снижением до 16 нед беременности) и антиагреганты
(дипиридамол по 0,25 мг 3 раза в сут; ацетилсалициловая кислота 100
мг/сут на протяжении 3 нед). На фоне лечения отмечается положительная
динамика клинических и эхографических данных, в среднем к 14-15 нед
беременности установлен нормальный прирост фетометрических показателей.
При контрольном допплерометрическом исследовании выявляется нормализация
кровотока в венозном протоке к 18-20 нед гестации.
В тех наблюдениях, где угроза выкидыша сопровождается изолированным уменьшением объема амниона без изменения других структур плодного яйца, а так же при нормальной гемодинамике в венозном протоке плода после 10 нед, эффективной является традиционная спазмолитическая и седативная терапия (пиридоксин, дротаверин, папаверин, экстракт валерианы и др.; физиотерапия).
При выявлении ретрохориальной гематомы, наряду со спазмолитической терапией, является целесообразным назначение депротеинизированного гемодеривата с целью коррекции выявленных изменений и улучшения плацентации. Актовегин применяют в виде драже по 200 мг 3 раза в сут на протяжении 3 нед с последующим эхографическим и допплерометрическим контролем.
У женщин на фоне указанной терапии отмечалось быстрое уменьшение размеров корпорально расположенной гематомы, нормализация кровотока в межворсинчатом пространстве и спиральных артериях, сердечного ритма плода, наблюдается значительное уменьшение размера гематомы, наряду с ее организацией. Терапия Актовегином при наличии ретрохориальных гематом больших размеров позволяет снизить количество осложнений во время беременности, тем самым, способствуя ее пролонгированию до срока нормальных родов.
Выявление при эхографии многоводия и повышенной эхогенности хориона при наличии клинических проявлений угрожающего выкидыша в I триместре сочетается с наличием урогенитальной инфекции (хламидиоза, уреаплазмоза, кандидоза). Ранняя диагностика данного осложнения способствует своевременному проведению адекватной антибактериальной терапии в начале II триместра гестации, что снижает частоту возникновения угрозы прерывания до 13%, в основном за счет уменьшения в 2,7 раза частоты развития многоводия.
Особого внимания заслуживает тактика ведения и терапия при привычной потерей беременности у женщин с антифосфолипидным синдромом. Терапия низкомолекулярным гепарином у беременных с впервые диагностированным АФС в сроки гестации 12-20 нед и выраженными исходными клинико-гематологическими нарушениями позволяет купировать клинические признаки угрожающего прерывания беременности в 60% наблюдений, а также обеспечить адекватное становление маточно-плацентарно-плодового кровотока по данным допплерометрии в 81%. На фоне терапии низкомолекулярным гепарином (НМГ) в непрерывном режиме практически полностью отсутствуют лабораторные признаки активации внутрисосудистого свертывания и в 74% удается обеспечить нормальную функцию тромбоцитарного звена. В 26% наблюдений в сроке гестации 28-30 нед на фоне длительного применения НМГ наблюдается гиперактивация тромбоцитов, которая купируется коррекцией дозы НМГ. Ликвидация исходной тромбофилии в 94% наблюдений происходит на 7-10-й день применения профилактических доз НМГ. В 6% наблюдений для купирования выраженной активации внутрисосудистого свертывания требуется применение лечебных доз препарата.
Женщины с синдромом потери плода нуждаются в комплексном дифференциально-диагностическом обследовании и плановой предгравидарной подготовке. Беременные с АФС должны находиться под тщательным динамическим контролем, направленным на выявление ранних признаков гестоза, плацентарной недостаточности, тромбоза. Наблюдение следует осуществлять с обязательным допплерометрическим исследованием маточно-плацентарно-плодового кровотока и ультразвукового сканирования каждые 4-6 нед после 18-20 нед беременности. После выявления циркуляции антифосфолипидных антител и подтверждения диагноза АФС определение волчаночного антикоагулянта в динамике не представляется целесообразным, так как не является значимым для прогнозирования течения беременности и выработки тактики ведения, не служит критерием эффективности проводимой терапии, и, кроме того, может давать ложноположительные результаты на фоне антиагрегантной и антикоагулянтной терапии. Монотерапия НМГ у беременных с АФС должна начинаться с I триместра после подтверждения наличия плодного яйца в полости матки, проводиться непрерывно до родов и 7-10 дней в послеродовом периоде. НМГ применяются в профилактическом режиме:
150 ICU/кг подкожно 1 раз в сут или 5000 ЕД/сут подкожно 1 раз. При начале терапии на фоне выраженной активации внутрисосудистого свертывания и/или клинических проявлениях тромбоза необходимо применять лечебные дозы НМГ: 250 ICU/кг подкожно 2 раза в сут или 200 ЕД/кг подкожно 1 раз в сут либо 100 ЕД/кг подкожно 2 раза в сут с дальнейшим переходом на профилактический режим.
На фоне длительной терапии НМГ рекомендуется определять количество тромбоцитов в периферической крови до начала лечения, на 7-10-е сут и далее каждые 6-8 нед. При изменении дозы препарата также требуется определение уровня тромбоцитов с целью ранней диагностики возможной иммунной тромбоцитопении. Определение хронометрических параметров системы гемостаза (АВР, АЧТВ и др.) не является необходимым для контроля безопасности терапии НМГ. С целью контроля эффективности терапии НМГ при исходной активации внутрисосудистого свертывания рекомендуется определять маркеры ДВС (ТАТ, ПДФ, D-димер) на 10-е сут терапии. При проведении профилактики с ранних сроков беременности в постоянном режиме без выраженных клинических осложнений, определение маркеров ДВС не является необходимым. Срок беременности 28- 30 нед является оптимальным для контроля функции тромбоцитарного звена гемостаза на фоне длительной монотерапии фраксипарином. В это время возможна своевременная коррекция дозы препарата в зависимости от изменения массы тела при выявлении нарушений гемостаза без выраженных осложнений течения гестационного процесса. При наличии клинических признаков угрожающего прерывания беременности, гестоза и/или плацентарной недостаточности проводить контрольные исследования и осуществлять коррекцию необходимо раньше.
Критериями эффективности противотромботической профилактики, проводимой беременным с синдромом потери плода и тромбофилией, являются клинические и лабораторные критерии, представленные в табл. 11.
По данным А.Д. Макацария, В.О. Бицадзе, Т.Е. Матвеевой (2000), у беременных с гипергомоцистеинемией назначение дифференцированной противотромботической профилактики, включающей низкомолекулярный гепарин, антиоксиданты и витамины группы В, позволило в 90%, а при своевременном (до 28 нед) назначении терапии - в 100% наблюдений довести беременность до успешного завершения. Дифференцированная противотромботическая профи-
Таблица 11. Критерии эффективности противотромботической
профилактики у беременных с синдромом потери плода и тромбофилией
Критерии эффективности | |
Клинические | Лабораторные |
Купирование угрозы прерывания беременности | Отсутствие циркуляции маркеров тромбофилии: ТАТ, PF4, F1+2, D-димер |
УЗИ-контроль | Нормализация агрегации тромбоцитов |
Допплерометрия маточно-плацентарного кровотока | Нормализация количества тромбоцитов |
Отсутствие тромботических осложнений | |
лактика, включающая низкомолекулярный гепарин, антиоксиданты и витамины группы В, при своевременном ее назначении, позволила в 100% наблюдений избежать возникновения и рецидивов тромботических осложнений.
Таким образом, использование эхографических критериев оценки роста эмбриона, развития плодного яйца и становления фетоплацентарной гемодинамики в I триместре гестации у пациенток с ППБ позволяет не только определить риск неблагоприятного течения и исхода беременности, но и своевременно подобрать адекватную патогенетическую терапию.