Акушерство. Курс лекций: учебное пособие Под ред. А.Н. Стрижакова, А.И. Давыдова. 2009. - 456 с.
|
|
|
|
ЛЕКЦИЯ 2 МЕТОДЫ ОЦЕНКИ СОСТОЯНИЯ ПЛОДА
Тщательный сбор соматического и акушерско-гинекологического анамнеза беременной является первым и предопределяющим этапом оценки состояния внутриутробного плода и прогнозирования особенностей дальнейшего его развития. Экстрагенитальная патология у женщины является фактором риска развития плацентарной недостаточности, синдрома задержки развития плода, рождения недоношенного ребенка и даже пороков развития плода (сахарный диабет). Наличие самопроизвольного прерывания беременности, особенно в I триместре, может указывать на влияние наследственного фактора. Рождение ребенка с пороком развития от предыдущих беременностей требует проведения тщательной оценки состояния плода при данной, начиная с I триместра.
Клинические методы пренатальной диагностики несложны, но диагностическая точность их недостаточна. Почти у 60% беременных клиническими методами не выявляется СЗРП, почти у всех беременных с внутриутробным инфицированием плода и пороками его развития клиническими методами их выявить не удается. С другой стороны, только у 30% беременных, направляемых в стационар с диагнозом «плацентарная недостаточность», ее подтвердить не удается. Один из наиболее простых клинических методов - планиметрическая оценка (определение высоты стояния дна матки и окружности живота и их оценка). Но на высоту стояния дна матки могут оказывать влияние различные факторы (количество плодов, тип предлежания, предлежание плаценты и т.д.). Может быть полезной также аускультация плода и определение двигательной активности плода (количество его движений за определенный период времени, определяемое самой беременной). В целом они носят ориентировочный характер и не заменяют скринингового ультразвукового и биохимического исследования.
ПОНЯТИЕ О ПРЕНАТАЛЬНОЙ ДИАГНОСТИКЕ. ОРГАНИЗАЦИЯ СЛУЖБЫ ПРЕНАТАЛЬНОЙ
ДИАГНОСТИКИ
Основные задачи акушерства - создание оптимальных условий для осуществления женщиной функции материнства, сохранение ее здоровья и обеспечение рождения здорового потомства. Наблюдаемое в России снижение рождаемости и возрастание смертности в большой степени обусловлено социально-экономическими причинами (нестабильная экономическая ситуация, напряженная психологическая обстановка, снижение уровня и качества жизни) и не может быть решено только усилиями учреждений здравоохранения. В этих условиях задачей первостепенной важности является снижение перинатальной заболеваемости и смертности. На фоне низкой рождаемости перинатальная смертность, хотя и имеет тенденцию к снижению за последние 10 лет, остается достаточно высокой (13,18%о в 2001 г). Особое звучание приобретает своевременная диагностика пороков развития и хромосомных аномалий плода, что позволяет принять решение о целесообразности пролонгирования беременности до достижения плодом жизнеспособности. Пороки развития различной степени выраженности и различных систем наблюдаются у 2-3% живорожденных детей. Кроме того, еще у 2-3% пороки развития проявляются в возрасте до 5 лет жизни. Так называемые «малые» нарушения эмбрионального развития, чаще определяемые как стигмы, наблюдаются у 15% новорожденных, и у 3-15% из них отмечаются также более грубые структурные, морфологические или функциональные нарушения. У 40-60% новорожденных с пороками развития причина возникновения аномалии неизвестна.
Хромосомные болезни человека, большинство из которых представлены нарушением числа хромосом (хромосомными аберрациями) - анэуплоидиями, являются не только медицинской проблемой, поскольку часто сопровождаются наличием пороков развития, но и имеют весомый социальный аспект. Частота анэуплоидий составляет 7 на 1000 новорожденных. До 80% наблюдений нарушения числа хромосом является результатом вновь возникших мутаций (мутации de novo). В связи с этим общепринятым подходом при пренатальной диагностике пороков развития и хромосомных аномалий является формирование групп беременных с «высоким» риском рождения детей с хромосомной патологией с помощью применения комплек-
сных схем и различных скрининговых методов, в первую очередь ультразвукового и биохимического.
В последние 40 лет, благодаря успехам репродуктивной биологии и внедрению в клиническую практику новых технологий, отмечается значительный прогресс в накоплении и использовании знаний о законах развития эмбриона и плода, который позволил сформулировать концепцию пренатальной диагностики.
Пренатальная диагностика, согласно рекомендациям ВОЗ и Европейской ассоциации пренатальной медицины, может быть определена как «совокупность всех методов диагностики состояния плода, которая направлена на дородовое выявление врожденных дефектов, представляющих из себя любые аномалии в морфологическом, структурном, функциональном или молекулярном развитии, диагностируемые при рождении (хотя могут манифестировать и позднее), наружные или внутренние, наследственные или спорадические, единичные или множественные». Основными задачами пренатальной диагностики, согласно рекомендациям Королевского медицинского колледжа в Лондоне (1989), являются:
• предоставление супружеской паре, относящейся к группе высокого риска рождения ребенка с пороками развития или хромосомными аномалиями, максимально возможной информации о риске рождения больного ребенка;
• обеспечение психологической поддержки супружеской паре;
• предоставление супружеской паре на основании максимально полной информации о состоянии плода возможности выбрать оптимальное решение о пролонгировании или прерывании беременности;
• выбор оптимальной тактики ведения беременности, метода родоразрешения и лечения новорожденного при пороках, совместимых с жизнью.
Согласно Приказу Министерства здравоохранения Российской Федерации ? 457 от 28.12.2000 г. «О совершенствовании пренатальной диагностики в профилактике наследственных и врожденных заболеваний у детей» основой проведения пренатального (дородового) обследования является искусственный внутриутробный отбор (элиминация) генетически дефектных плодов. Используются методы, направленные на точную диагностику аномалий у плода как хромосомного, так и генного происхождения, а также других пороков развития.
В целях повышения эффективности дородовой диагностики тяжелых, не поддающихся лечению наследственных и врожденных болезней, обследование беременных проводится по определенной схеме. Основными методами пренатальной диагностики во всем мире признаны ультразвуковое исследование, биохимический (сывороточный) скрининг и инвазивные методы диагностики с последующим кариотипированием плода.
Общепринятыми факторами риска в отношении развития врожденной и наследственной патологии плода являются возраст беременной старше 35 лет, наличие в семье наследственного заболевания, рождение ребенка с пороками развития или хромосомной патологией, хромосомные аберреции у одного из супругов, кровнородственный брак.
При формировании групп риска беременных с точки зрения рождения детей с врожденной и наследственной патологией необходимо учитывать не только факторы, которые могли привести к развитию патологии у детей, но и те, которые являются причиной осложнения течения беременности. Уже при первичном обращении пациентки важна оценка социальных, экологических факторов, а также особенностей анамнеза (семейного, гинекологического, акушерского) и течения настоящей беременности. Наиболее часто встречающимся фактором риска и, следовательно, показанием к тщательному обследованию пациентки является угроза прерывания беременности на ранних сроках (3-6 нед). У женщин с невынашиванием беременности структурные аномалии кариотипа встречаются в 10 раз чаще, чем в популяции, и составляют около 2,5%. Вторым по частоте встречаемости признаком являются неблагоприятные экзогенные факторы (вредные привычки, прием тератогенных препаратов, профессиональные вредности, проживание в зонах экологических бедствий). Одним из важных показаний к обследованию беременных является бесплодие в анамнезе. Кроме того, доказано тератогенное воздействие на плод с формированием врожденных пороков таких инфекций, как цитомегаловирус, вирус простого герпеса, краснуха, токсоплазмоз.
Внедрение эхографии в практическое акушерство в середине XX в. совершило революционный переворот в развитии пренатальной диагностики.
У подавляющего большинства плодов с крупными хромосомными дефектами отмечают либо внешние, либо внутренние пороки развития, которые могут быть диагностированы при тщательно проведен-
ном ультразвуковом исследовании. Следует отметить, что на сегодняшний день выявление маркеров хромосомной патологии плода при эхографии является одним из методов формирования группы беременных для проведения инвазивных процедур и последующего кариотипирования. В I триместре наиболее значимыми эхографическими признаками патологии плода являются увеличение толщины воротникового пространства, несоответствие копчико-теменного размера эмбриона сроку беременности, кистозная гигрома шеи, омфалоцеле, врожденные пороки сердца, мегацистик. Воротниковое пространство - область между внутренней поверхностью кожи плода и наружной поверхностью мягких тканей, покрывающих шейный отдел позвоночника. Оценка толщины воротникового пространства (ТВП) проводится в 10-14 нед беременности при численных значениях копчико-теменного размера плода от 45 до 84 мм. Частота хромосомных аномалий находится в прямо пропорциональной зависимости от величины ТВП. По данным P. Pandya et al. (1995), при ТВП 3 мм хромосомные дефекты были обнаружены у 7% плодов, при 4 мм - у 27%, при 5 мм - у 53%, при 6 мм - у 49%, при 7 мм - у 83%, при 8 мм - у 70%, при 9 мм и более - 100%. Кроме того, следует отметить, что частота врожденных пороков развития плода возрастает с увеличением воротникового пространства. В исследовании A. Souka et al. (1997) было отмечено, что при ширине воротникового пространства до 3,4 мм врожденные пороки развития отмечены у 2,4% плодов, от 3,5 до 4,4 мм - у 7,1%, от 4,5 до 5,4 мм - у 12,3%, а при 6,5 мм и более - в 35,6% наблюдений. Представленные данные могут быть использованы в ходе пренатального консультирования и для определения тактики динамического эхографического наблюдения в случаях обнаружения расширенного воротникового пространства у плодов с нормальным кариотипом. В настоящее время в России приказом МЗ ? 457 от 28.12.2000 г. установлено, что определение толщины воротникового пространства должно являться обязательным при проведении первого скринингового ультразвукового исследования в 10-14 нед беременности. Несоответствие копчико-теменного размера определятся как маркер патологии беременности при отклонениях ±2 нед. При наличии кистозной гигромы плода средняя выявляемость хромосомных аномалий плода составляет 68%, при этом доминирует синдром Тернера. При наличии у плода после 10 нед беременности омфалоцеле, особенно если оно сдержит только петли кишечника, должно проводиться кариотипирование.
Спектр выявляемых маркеров хромосомной патологии во II триместре намного больше и включает в себя изменения со стороны различных органов и систем. Например, при исследовании головного мозга могут быть выявлены вентрикуломегалия, голопрозэнцефалия, микроцефалия, кисты сосудистых сплетений, аномалии задней черепной ямки, аномальные формы черепа («клубника», «лимон»). Кроме того, к наиболее значимым маркерам относятся врожденные пороки сердца, гиперэхогенный кишечник, дуоденальная атрезия, патология лица, расширение чашечно-лоханочной системы плода, прочие аномалии почек, киста яичника у плода, диспропорция длины трубчатых костей, аномалии кистей и стоп, патология пуповины, неиммунная водянка плода, многоводие и маловодие, симметричная форма синдрома задержки роста плода. На сегодняшний день данные, получаемые при ультразвуковом исследовании, являются во многих случаях предопределяющими в выборе дальнейших методов обследования (прежде всего инвазивных), а следовательно, и тактики ведения беременности.
При выборе рациональной программы обследования беременных необходимо помнить о том, что точность пренатальной диагностики повышается при использовании нескольких диагностических тестов и тщательной оценке нескольких факторов риска.
Показания к обследованию с применением инвазивных методов в I триместре мало отличаются от показаний во II триместре беременности. Согласно традиционным принципам формирования группы риска беременных, угрожаемых по рождению детей с врожденной и наследственной патологией, инвазивные исследования следует предлагать:
• беременным в возрасте 35 лет и старше;
• пациенткам с отягощенным анамнезом (рождение детей с хромосомной патологией или с моногенными заболеваниями, подлежащими дородовой диагностике);
• семьям, в которых один из супругов является носителем хромосомной перестройки или оба супруга - носителями генной мутации;
• беременным, у которых при эхографии выявлены ультразвуковые маркеры хромосомной патологии (например, расширение воротникового пространства);
• беременным, у которых при проведении скрининговых биохимических исследований зарегистрированы отклонения сывороточных маркеров крови;
• кровнородственный брак.
Существует несколько классификаций инвазивных методов исследования во время беременности.
1. По характеру доступа (транцервикальный, транабдоминальный).
2. По технике получения материала (путем аспирации, путем биопсии).
3. По характеру контроля за проведением процедуры (под ультразвуковым контролем, под контролем эндоскопических приборов).
4. По характеру получаемого материала (ворсины хориона, околоплодные воды, кровь из пуповины).
В настоящее время, согласно рекомендациям Европейской Ассоциации пренатальной медицины, в зависимости от срока беременности проводят следующие процедуры:
• 9-12 нед - биопсия ворсин хориона (трансцервикальная или трансабдоминальная).
• 13-14 нед - возможно проведение раннего амниоцентеза, однако риск осложнений при использовании данного метода достаточно высок. Самопроизвольное прерывание беременности наблюдается в 3,8-5,3%, а неудачи культивирования клеток, полученных из околоплодных вод, составляют порядка 11-12%.
• 15-17 нед - амниоцентез и ранний плацентоцентез.
• 18 нед и более - кордоцентез, амниоцентез, плацентоцентез.
Проведение всех инвазивных процедур в России регламентируется Приказом Минздрава ? 45 от 28.12.2000 г. Инвазивные вмешательства проводятся только с согласия беременной под контролем ультразвукового исследования после обязательного гинекологического обследования женщины при ее удовлетворительном состоянии. К относительным противопоказаниям для проведения инвазивных вмешательств относят в I триместре угрожающее прерывание беременности с кровянистыми выделениями, наличие множественных миоматозных узлов в матке, предшествующие лапаротомии и операции на матке, воспалительные заболевания с повышением температуры тела. Эти же факторы учитывают и при проведении кордоцентеза, хотя по утверждению некоторых авторов абсолютных противопоказаний для забора крови из вены пуповины плода не существует. Среди возможных осложнений инвазивных процедур - мажущие кровянистые выделения из половых путей и кровотечение (1-4%), внутриматочная инфекция и сепсис (0,2-0,5%). Очень раннее проведение аспирации ворсин хориона сопряжено с риском возник-
новения редукции конечностей и оромандибулярной гипогенезией. К осложнениям кордоцентеза относят транзиторную брадикардию (у 18,3%), кровотечение из места пункции, воспалительные осложнения (0,6-2,91%), потери плодов после проведения процедуры (2-2,5%). Как видно из представленных данных, несмотря на высокую диагностическую ценность, проведение инвазивных процедур требует тщательной оценки как возможного риска рождения больного ребенка, так и риска осложнений беременности при нормальном кариотипе плода.
Кроме вышеуказанных диагностических тестов, занявших свое определенное место в системе пренатальной диагностики, в клиническую медицину постепенно стали внедряться новые технологии, к которым относятся и эндоскопические методы.
В последние годы, в связи с наличием осложнений при проведении инвазивных процедур, направленных на получение клеток плода для последующего непосредственного генетического исследования, возрастает интерес к новому неинвазивному подходу в пренатальной диагностике - исследованию клеток плода, находящихся в периферической крови беременных женщин.
УЛЬТРАЗВУКОВЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
За последние годы в акушерской практике все большее распространение для оценки развития плода получает эхография, обладающая высокой информативностью, безвредностью для матери и плода. В основе ультразвуковой диагностики лежит обратный пьезоэлектрический эффект. Ультразвуковые волны, отражаясь от разнородных структур излучаемого объекта, преобразуются в электрические импульсы и воспроизводятся на экране прибора пропорционально расстоянию от датчика до соответствующей структуры, от которой этот сигнал отразился. В настоящее время применяются только приборы, работающие в режиме реального времени. Особенности использования данной системы заключаются в возможности быстрого выбора плоскости оптимального сечения и непрерывного наблюдения за состоянием изучаемого объекта, что особенно важно при обследовании деятельности различных органов и систем плода. В акушерстве наибольшее распространение получили линейные датчики, так как сторальные обеспечивают лишь ограниченное поле наблюдения. Кроме того, околоплодные воды представляют собой
идеальную среду для прохождения ультразвуковых волн, что устраняет необходимость сканирования из небольшого акустического окна.
В акушерстве наибольшее распространение получили две основные методики: трансабдоминальное и трансвагинальное сканирование. При трансабдоминальном сканировании применяются датчики 3,5 и 5 Мгц, при трансвагинальном - с более высокой разрешающей способностью (частота волновых колебаний 6,5 МГц и выше). Применение при трансвагинальном ультразвуковом сканировании акустических преобразователей с такой частотой позволило коренным образом пересмотреть аспекты эхографической диагностики беременности и ее осложнений, особенно в I триместре. Кроме того, трансвагинальное сканирование более комфортно для обследуемой женщины в ранние сроки беременности, чем трансабдоминальное, так как для его проведения не требуется наполнения мочевого пузыря. Среди преимуществ трансвагинального сканирования для диагностики беременности и связанной с ней патологии по сравнению с трансабдоминальным можно выделить следующие (Стрижаков А.Н., Давыдов А.И., 1994).
1. Применение трансвагинальной эхографии способствует обнаружению акустических признаков беременности в более ранние сроки, что имеет большое значение в выборе тактики ведения пациенток с отягощенным акушерско-гинекологическим анамнезом, особенно с привычным невынашиванием.
2. Трансвагинальное ультразвуковое сканирование открывает возможность ранней диагностики осложнений беременности и своевременной их коррекции в I триместре.
3. Использование трансвагинальной эхографии позволяет в более ранние сроки и с большей точностью изучить акустические аспекты эмбриологии, оценить развитие органов и систем плода, а также выявить пороки их развития; в ряде случаев с помощью трансвагинального ультразвукового сканирования уже в I триместре беременности удается установить пол плода.
При трансабдоминальном ультразвуковом исследовании поверхность датчика для лучшего его контакта с поверхностью передней брюшной стенки смазывают звукопроводящим гелем, при трансвагинальном исследовании для соблюдения асептики применяется защитная резиновая оболочка.
В России, согласно приказу ? 457 МЗ РФ, система пренатальной диагностики включает обязательное троекратное скрининговое ультразвуковое исследование беременных: в сроки 10-14 нед (для оценки наличия маркеров хромосомной патологии), в 20-24 нед (для выявления пороков развития и маркеров хромосомной патологии), в 32-34 нед (для диагностики пороков развития с поздней манифестацией и функциональной оценке состояния плода).
При ультразвуковом исследовании в I триместре беременности осуществляют:
• установление маточной беременности на основании визуализации плодного яйца с эмбрионом или без него в полости матки;
• биометрию (средний внутренний диаметр плодного яйца, копчико-теменной размер эмбриона);
• оценку жизнедеятельности эмбриона (сердечная деятельность, двигательная активность);
• определение локализации хориона и исключение его патологии;
• изучение экстраэмбриональных образований (желточный мешок, амниотическая оболочка и полость, хорион);
• исследование анатомии эмбриона/плода, выявление маркеров хромосомной патологии;
• оценку внутреннего зева;
• визуализацию стенок матки и придатков.
Дополнительными показаниями для проведения ультразвукового исследования в I триместре (до 10 нед беременности) являются следующие:
• наличие миомы матки и опухоли придатков;
• подозрение на внематочную беременность;
• несоответствие величины матки сроку беременности;
• наличие внутриматочного контрацептива и беременности;
• травма и интоксикация у беременной;
• необходимость проведения биопсии (аспирации) хориона;
• отягощенный акушерско-гинекологический анамнез.
При осложненном течении беременности ультразвуковое исследование проводится в любые сроки.
Результаты многочисленных исследований свидетельствуют о возможности установления беременности с помощью трансабдоминальной эхографии, начиная с 3-4-й нед после оплодотворения. Эхографическим признаком беременности является наличие в полости матки плодного яйца в виде округлого эхонегативного образования
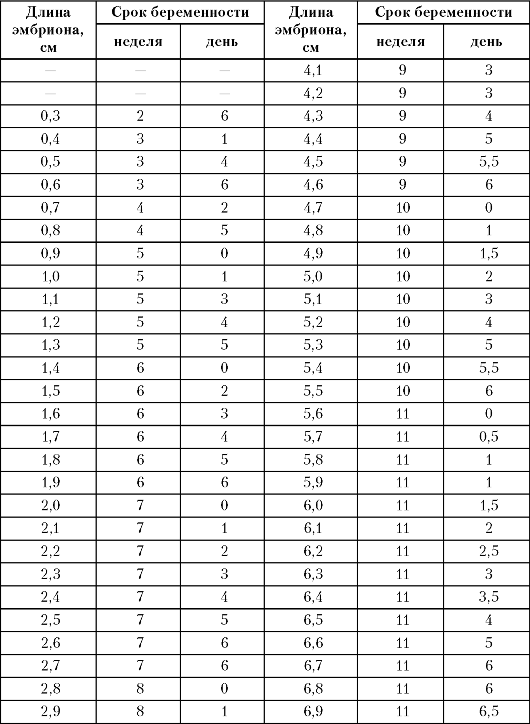
Таблица 5. Длина эмбриона (копчико-теменной размер) в различные сроки
беременности в I триместре
 с
четкими контурами и средним диаметром 5-7 мм. Визуализация самого
эмбриона и регистрация признаков его жизнедеятельности достигается
только к 4-5 нед от дня зачатия. Появление трансвагинальной эхографии
позволило диагностировать беременность на 1-3 нед ранее, чем при
трансабдоминальном сканировании, в некоторых случаях (при динамическом
наблюдении за пациентками, которым производилась стимуляция овуляции)
установление наличия беременности возможно при отсутствии задержки
менструации.
с
четкими контурами и средним диаметром 5-7 мм. Визуализация самого
эмбриона и регистрация признаков его жизнедеятельности достигается
только к 4-5 нед от дня зачатия. Появление трансвагинальной эхографии
позволило диагностировать беременность на 1-3 нед ранее, чем при
трансабдоминальном сканировании, в некоторых случаях (при динамическом
наблюдении за пациентками, которым производилась стимуляция овуляции)
установление наличия беременности возможно при отсутствии задержки
менструации.
При обследовании беременных с отягощенным акушерско-гинекологическим анамнезом важное значение отводится обнаружению эмбриона и оценке его жизнедеятельности на начальных этапах развития. Визуализация эмбриона с помощью трансвагинальной эхографии возможна, начиная с 3-4-й нед беременности от момента зачатия (при трансабдоминальном сканировании удается не ранее 5-6-й нед). В указанные сроки на трансвагинальных эхограммах эмбрион определяется в виде структуры продолговатой формы, с высокой эхоплотностью, длиною 4-5 мм, расположенной внутри плодного яйца. Наиболее точным показателем срока беременности в I триместре является копчико-теменной размер эмбриона и плода. В табл. 5 приведены данные о величине копчико-теменного размера в I триместре беременности.
С 4-5-й нед беременности идентифицируется желточный мешок в виде кольцеобразной структуры, локализующейся вблизи эмб-
риона. Форма желточного мешка варьирует от сферической до овальной, средний диаметр его медленно возрастает с увеличением срока беременности. Обычно желточный мешок определяется до 12 нед от момента зачатия и достигает в диаметре 7-9 мм. В дальнейшем происходит спадение его стенок и кистозное перерождение. Наиболее достоверным критерием жизнедеятельности эмбриона является регистрация его сердечной деятельности и двигательной активности. Уровень метаболизма зародыша предполагает начало пульсаций сердца, как правило, на 22-й день после зачатия. Использование трансвагинальной эхографии позволяет обнаружить сердечные сокращения у эмбриона длиною 4-5 мм (3,0-3,5 нед беременности), а диагностика сердечной деятельности при трансабдоминальном сканировании возможна не ранее 5-6 нед. Частота сердечных сокращений в 5-6 нед составляет 150-160 уд/мин, в 7-8 нед - 175-185 уд/мин, в 9-10 нед - 160-170 и в 11-12 нед - до 150 уд/мин. Такое изменение частоты сердечных сокращений связано с последовательной дифференциацией анатомических структур сердца плода и формированием проводящей системы миокарда и функции блуждающего нерва. Крайне неблагоприятными ультразвуковыми признаками в I триместре беременности, свидетельствующими о наличии тяжелых пороков развития сердца, являются блокады сердца, расширение воротникового пространства (при ширине более чем 5 мм частота пороков, по данным разных авторов, колеблется от 23 до 75% в зависимости от кариотипа плода), изменение частоты сердечных сокращений (брадикардия менее 100 уд/мин после 9 нед беременности).
Двигательная активность плода выявляется с 7-8 нед. Различают два типа движений: движения конечностями, туловищем и комбинированные движения. Отсутствие сердечной деятельности плода и двигательной активности указывают на гибель эмбриона.
Высокая разрешающая способность трансвагинальных датчиков позволяет диагностировать непрогрессирующую беременность, начиная с 5-7-й нед после оплодотворения. В подобных наблюдениях у эмбриона длиной 6-8 мм отсутствует сердечная деятельность и двигательная активности. Кроме того, установление неразвивающейся беременности обосновывается на выявлении «пустого» плодного яйца (анэмбрионии). В этом случае диаметр плодного яйца не превышает 2-3 см, при этом выявляются нечеткие, утолщенные его стенки вследствие дегенеративных изменений.
Особую актуальность представляют сведения о возможности эхографической визуализации внутренних органов и частей плода в I триместре беременности. С помощью трансвагинального сканирования дифференциация частей эмбриона возможна не ранее 9 нед. Использование трансвагинальной эхографии позволяет идентифицировать головку эмбриона с 5-6-й нед, туловище и конечности эмбриона как отдельные анатомические структуры - с 7-й нед беременности. С 8-9-й нед удается дифференцировать позвоночник, желудок, печень, легкие и пуповину. С 10-й нед определяется аорта, сосудистые сплетения боковых желудочков мозга, отдельные структуры лица. На 12-й нед беременности выявляют почки, надпочечники, мочевой пузырь, магистральные сосуды (брахиоцефальный ствол, сонные артерии, легочная артерия), а также основные экстракардиальные структуры - желудочки, предсердия, межпредсердную и межжелудочковую перегородки, атриовентрикулярные клапаны). В конце I триместра осуществима и детальная оценка внутричерепной анатомии плода.
В последние годы немаловажное значение отводится трансвагинальной ультразвуковой диагностике аномалий развития плода. Наиболее доступными из них для антенатальной ультразвуковой диагностики являются аномалии передней брюшной стенки (омфалоцеле и гастрошизис), анэнцефалия, экзэнцефалия, шейное менингомиелоцеле, синдактилия, поликистоз почек, неиммунная водянка плода, тетрада Фалло, косолапость. Важное практическое значение трансвагинальная эхография находит в оценке состояния шейки матки и нижнего маточного сегмента в течение беременности. Данный метод исследования позволяет с высокой степенью точности оценить состояние маточного зева, диагностировать его преждевременное открытие, предлежание хориона (плаценты) и его частичную или полную отслойку.
Угроза прерывания беременности характеризуется наличием локального утолщения миометрия вследствие повышенного его тонуса. Важно подчеркнуть, что данный эхографический признак появляется ранее клинических симптомов и исчезает позднее их.
Пузырный занос выявляется при ультразвуковом исследовании по наличию в полости матки множественных эхо-комплексов, напоминающих «снежную бурю». В 50% наблюдений выявляют многокамерные текалютеиновые кисты яичников различных размеров.
Некоторые трудности возможны при эхографическом исследовании с целью выявления внематочной беременности, при этом неоспоримое преимущество имеет трансвагинальное сканирование. В процессе трансвагинального ультразвукового исследования при подозрении на внематочную беременность последовательно оценивают состояние матки, маточных труб, яичников, пузырно-маточного и прямокишечно-маточного углублений. Принимая во внимание крайне редкое сочетание маточной и внематочной беременностей, важное значение отводится выявлению плодного яйца в полости матки. Наиболее достоверным акустическим критерием внематочной беременности является установление эктопической локализации плодного яйца с живым эмбрионом. Кроме того, в многообразной ультразвуковой картине (особенно при нарушенной трубной беременности) внематочной беременности рекомендуется учитывать увеличение матки при отсутствии органических изменений или маточной беременности, утолщение срединного М-эха, выявление в области придатков матки (изолированно от яичника) образования негомогенной структуры и свободной жидкости в углублениях малого таза. Возможности ультразвуковой диагностики необходимо рассматривать в комплексе других диагностических мероприятий.
Неоспоримое преимущество имеет ультразвуковое исследование у беременных с миомой матки и опухолевидными образованиями придатков матки, позволяющее точно определить анатомо-топографические взаимоотношения между узлами и плодово-плацентарной системой, структуру новообразования придатков, его локализацию и размеры. Значительно более ценные данные на ранних сроках беременности дает трансвагинальное сканирование. Результаты исследования имеют важное значение для тактики ведения беременности и родов.
Ультразвуковая диагностика многоплодной беременности основана на визуализации в полости матки нескольких плодовместилищ или эмбрионов. Опыт проведенных исследований показывает, что существует расхождение между количеством двоен, выявленных в ранние сроки беременности, и количеством рожденных близнецов. Подобное расхождение обусловлено анэмбрионией одного из плодных яиц или последующей гибелью одного из эмбрионов, поэтому у беременных с многоплодной беременностью необходимо проведение ультразвукового исследования в динамике для раннего выявления нарушений развития плода.
Следует отметить, что на сегодняшний день выявление маркеров хромосомной патологии плода при эхографии является одним из методов формирования группы беременных для проведения инвазивных процедур и последующего кариотипирования. В I триместре наиболее значимыми эхографическими признаками патологии плода являются увеличение толщины воротникового пространства, несоответствие копчико-теменного размера эмбриона сроку беременности, кистозная гигрома шеи, омфалоцеле, врожденные пороки сердца, мегацистик. Воротниковое пространство - область между внутренней поверхностью кожи плода и наружной поверхностью мягких тканей, покрывающих шейный отдел позвоночника. Оценка толщины воротникового пространства (ТВП) проводится в 10-14 нед беременности при численных значениях копчико-теменного размера плода от 45 до 84 мм. Частота хромосомных аномалий находится в прямо пропорциональной зависимости от величины ТВП. По данным P. Pandya et al. (1995), при ТВП 3 мм хромосомные дефекты были обнаружены у 7% плодов, при 4 мм - у 27%, при 5 мм - у 53%, при 6 мм - у 49%, при 7 мм - у 83%, при 8 мм - у 70%, при 9 мм и более - 100%. Кроме того, следует отметить, что частота врожденных пороков развития плода возрастает с увеличением воротникового пространства. В исследовании A. Souka et al. (1997) было отмечено, что при ширине воротникового пространства до 3,4 мм врожденные пороки развития отмечены у 2,4% плодов, от 3,5 до 4,4 мм - у 7,1%, от 4,5 до 5,4 мм - у 12,3%, а при 6,5 мм и более - в 35,6% наблюдений. Представленные данные могут быть использованы в ходе пренатального консультирования и для определения тактики динамического эхографического наблюдения в случаях обнаружения расширенного воротникового пространства у плодов с нормальным кариотипом. В настоящее время в России приказом МЗ от 28.12.2000 г. установлено, что определение толщины воротникового пространства должно являться обязательным при проведении первого скринингового ультразвукового исследования в 10-14 нед беременности. Несоответствие копчико-теменного размера определятся как маркер патологии беременности при отклонениях ±2 нед. При наличии кистозной гигромы плода средняя выявляемость хромосомных аномалий плода составляет 68%, при этом доминирует синдром Тернера. При наличии у плода после 10 нед беременности омфалоцеле, особенно если оно содержит только петли кишечника, должно проводится кариотипирование.
Во время проведения второго скринингового ультразвукового обследования во время беременности необходимо:
• определить количество плодов, их положение и предлежание;
• произвести измерение основных фетометрических показателей и оценить их соответствие сроку беременности;
• изучить основную ультразвуковую анатомию плода;
• оценить количество околоплодных вод, локализацию, толщину и структуру плаценты;
• произвести изучение анатомических особенностей тела, шейки матки и придатков.
Минимальный обязательный объем фетометрии включает определение бипариетального размера головки, длины бедренной кости и среднего диаметра (длины окружности) живота.
Скрининговая ультразвуковая оценка анатомии плода обычно проходит по следующей схеме:
• визуализация поперечных сечений головки на различных уровнях;
• исследование структур лица;
• оценка позвоночника плода при продольном и поперечном сканировании;
• визуализация поперечного сечения грудной клетки с изучением четырехкамерного среза сердца и легких плода;
• продольное сечение туловища плода для оценки диафрагмы;
• исследование передней брюшной стенки;
• визуализация желудка, печени, селезенки и кишечника;
• оценка почек и мочевого пузыря;
• исследование костей конечностей плода.
При изучении плода во II и III триместрах беременности основное внимание уделяют измерению бипариетального размера головки (БПР), средних диаметров грудной клетки и живота (ДГ и ДБ) и окружности живота (ОЖ), а также длины бедра (ДБ) (рис. 7-9). Бипариетальный размер головки следует определять только при наилучшей визуализации срединной М-структуры от наружной поверхности верхнего контура до внутренней поверхности нижнего контура головки.
При сканировании головки плода четко визуализируются зрительные бугры, мозжечковый намет, полушария мозжечка, ствол и ножки мозга, а также желудочки. Средний диаметр грудной клетки измеряют на уровне створчатых клапанов сердца плода, средний диаметр живота - в месте отхождения пупочной вены. Для опреде-
ления длины бедра датчик необходимо сместить на тазовый конец плода и, меняя угол и плоскость сканирования, добиться наилучшего изображения продольного сечения бедра. Измерять следует наибольшее расстояние между проксимальным и дистальным концом. Изображение конечностей при ультразвуковом сканировании удается получить с 7-й нед беременности, т.е. с момента закладки в диафизе первичной точки окостенения. Производить точное измерение длины бедра удается с 12-13 нед беременности, когда процесс окостенения захватывает весь диафиз.
Установлено, что при развитии плода прогрессивно увеличиваются все перечисленные показатели, однако к концу беременности скорость их роста постепенно снижается. Так, скорость прироста БПР снижается от 4 мм/нед в 14-15 нед беременности до 1,3 мм/нед к ее концу, ДБ - от 4,8 мм/нед до 1,7 мм/нед. В табл. 6 приведены изменения данных фетометрии во II и III триместрах беременности с учетом индивидуальных колебаний.
Определение массы тела плода при ультразвуковом исследовании осуществляется по формулам, основанным на измерении окружности живота и БПР. Наиболее приемлемыми для клинической практики являются формулы S. Campbell и A. Thoms (1977), S. Warsof et al. (1977) и M. Shepard et al. (1982).
Важным также является вычисление предполагаемой длины плода по измерению длины бедра для определения степени зрелости плода. Установлено (Стрижаков А.Н. и соавт., 1989), что в конце внут-
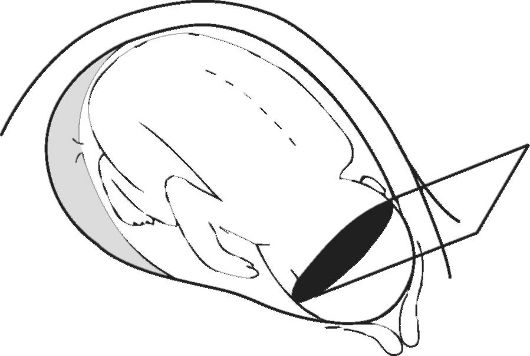 Рис. 7. Измерение бипариетального диаметра головки плода
Рис. 7. Измерение бипариетального диаметра головки плода
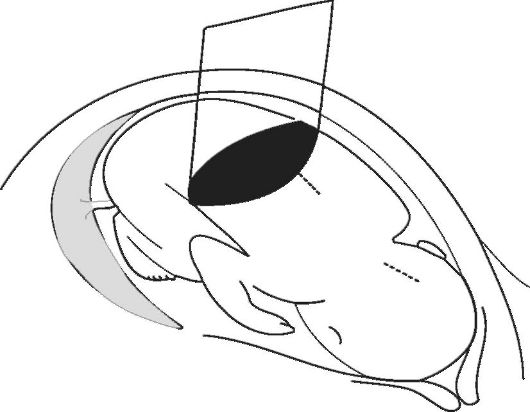 Рис. 8. Измерение окружности живота плода
Рис. 8. Измерение окружности живота плода
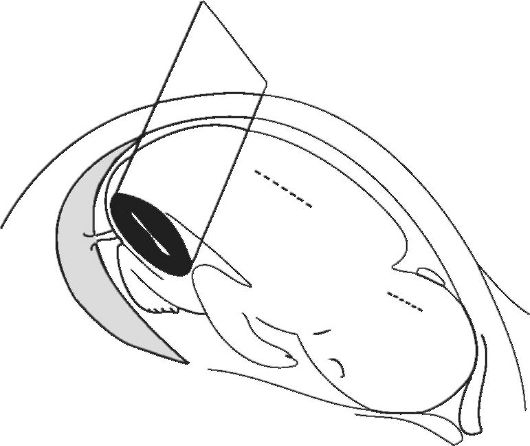 Рис. 9. Измерение длины бедра плода
Рис. 9. Измерение длины бедра плода
риутробного периода развития при ультразвуковом исследовании возможно визуализировать вторичную точку окостенения в дистальном эпифизе бедра (ядро Беклара). При достаточной зрелости плода общая длина его бедра составляет 7 см и более, размер ядра Беклара колеблется в пределах 5-7 мм. Взаимоотношение между длиной плода и длиной бедра выражается следующим уравнением:
Таблица 6. Основные параметры фетометрии в различные сроки
беременности*
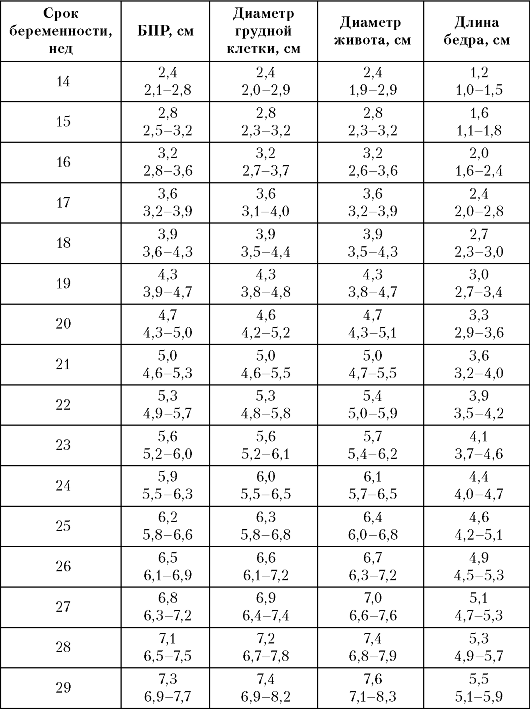
 Примечание. *
Бипариетальный размер головки (БПР), средние диаметры грудной клетки и
живота приведены по данным Л.С. Персианинова и В.Н. Демидова (1982),
длина бедра - по данным А.Н. Стрижакова и М.В. Медведева (1984).
Примечание. *
Бипариетальный размер головки (БПР), средние диаметры грудной клетки и
живота приведены по данным Л.С. Персианинова и В.Н. Демидова (1982),
длина бедра - по данным А.Н. Стрижакова и М.В. Медведева (1984).
Д = 0,508Б - 0,56Б + 28,68,
где: Д - длина плода, см; Б - длина бедра плода, см.
Использование данного уравнения позволяет предсказать длину новорожденного с точностью ±1 см в 71,4% и ±2 см - в 88,6% наблюдений.
Ультразвуковое исследование является одним из наиболее объективных методов диагностики внутриутробной задержки роста плода. Ультразвуковой диагноз данной патологии основывается
на сопоставлении полученных при исследовании данных фетометрии с нормативными показателями для данного срока беременности. Различают симметричную и асимметричную формы задержки роста плода, которые характеризуются различными соотношениями основных фетометрических показателей, сроками возникновения и этиологическими факторами. При симметричной форме все фетометрические показатели (бипариетальный размер головки, средние диаметры грудной клетки и живота, длина бедра) находятся ниже нормальных значений индивидуальных колебаний для соответствующего срока беременности. Асимметричная форма характеризуется преимущественным уменьшением размеров живота и грудной клетки. Бипариетальный размер головки и длина бедра плода остаются в пределах нормальных значений. Следовательно, именно эти два показателя могут служить критериями для разграничения форм внутриутробной задержки роста плода. При ультразвуковой фетометрии возможно определение степени тяжести внутриутробной задержки роста плода. При I степени отмечается отставание параметров фетометрии на 2 нед, при II степени - на 3-4 нед, при III степени отмечается уменьшение размеров более чем на 4 нед. Важным показателем оценки эффективности проводимой терапии являются темпы прироста фетометрических показателей. Прекращение роста параметров, а также наличие симметричной формы задержки роста плода III степени свидетельствует о значительном нарушении его жизнедеятельности и служит показанием к досрочному родоразрешению. Высокая частота сочетания врожденных пороков развития с симметричной формой внутриутробной задержки его роста требует тщательного исследования внутренних органов плода.
В настоящее время эхография позволяет исследовать большинство внутренних органов плода: сердце, печень, желудок, почки и надпочечники, мочевой пузырь, что дает возможность при выраженных аномалиях развития досрочно прервать беременность.
Наиболее легко распознаются врожденные поражения центральной нервной системы. Так, анэнцефалия характеризуется отсутствием контуров головки, выявляется лишь основание черепа с крупными «выпученными» глазницами. Диагностика гидроцефалии основывается на выявлении жидкости в желудочках головного мозга (внутренняя гидроцефалия) и под твердой мозговой оболочкой (наружная гидроцефалия). Большое количество жидкости сопровождается значительным увеличением бипариеталь-
ного размера головки плода. В таких случаях резко увеличивается соотношение между окружностью головки и окружностью живота (окружностью грудной клетки).
Позвоночник плода визуализируется в виде отдельных эхопозитивных образований, соответствующих телам позвонков. Возможно определение всех отделов позвоночника, включая крестец и копчик. В связи с этим диагностика spina bifida обычно не вызывает затруднений. Исключение составляют случаи с небольшими размерами грыжевого выпячивания.
Обследование сердца плода необходимо осуществлять по 6 сечениям для прицельного исключения врожденных повреждений сердечно-сосудистой системы: четырехкамерный срез, четырехкамерный срез с основанием аорты, срез по длинной оси левого желудочка, срез по длинной оси правого желудочка через полые вены, срез через дугу аорты и срез через легочный ствол. Эти обследования требуют специальной подготовки и достаточного опыта, поэтому в широкой клинической практике может быть с успехом использован четырехкамерный срез сердца плода, получаемый при строго поперечном сканировании грудной клетки на уровне створчатых клапанов. Достаточно четко визуализируются левый и правый желудочки, левое и правое предсердие, межжелудочковая и межпредсердная перегородки, створки митрального и трикуспидального клапанов, а также клапан овального отверстия. Для выявления кардиомегалии необходимо пользоваться кардиоторакальным индексом, который в норме составляет 0,50-0,54.
Использование М-метода позволяет оценить особенности насосной и сократительной функций миокарда в антенатальном периоде по определению размеров желудочков сердца в различные фазы сердечного цикла (рис. 10). Необходимо отметить, что с конца II триместра и на протяжении III триместра беременности наблюдается функциональное преобладание размеров правого желудочка над левым, что связано с особенностями внутриутробного кровообращения. Показатели центральной гемодинамики плода важны для определения его компенсаторных возможностей при осложненном течении беременности.
В настоящее время возможна диагностика большинства врожденных пороков сердца. При эхокардиографическом исследовании обнаруживается значительное увеличение правых отделов сердца плода за счет правого предсердия. Правый желудочек состоит из двух
частей: собственно желудочка и атриализованного пространства, эхографически определяющегося как составная часть правого предсердия. Дефекты интракардиальных перегородок устанавливаются по отсутствию их целостности в нескольких эхографических срезах сердца.
Ультразвуковая регистрация дыхательных движений плода помогает определить зрелость дыхательных мышц и регулирующей их нервной системы. С 32-33 нед дыхательные движения плода становятся регулярными и происходят с частотой 30-70 движений в 1 мин. Дыхательные движения представляют собой одновременные перемещения грудной и брюшной стенки. При апноэ грудная клетка расширена. Когда происходит дыхательное движение, передняя грудная стенка перемещается внутрь, передняя брюшная стенка - кнаружи. Затем они возвращаются в исходное состояние. При осложненной беременности число дыхательных движений увеличивается до 100- 150 в 1 мин либо уменьшается до 10-15 в 1 мин, при этом отмечаются отдельные судорожные движения, что является признаком хронической внутриутробной гипоксии плода.
С использованием антенатальной ультразвуковой диагностики удается установить врожденные пороки развития желудочно-кишечного тракта и своевременно, до развития осложнений, перевести новорожденных в специализированные хирургические отделения для оперативного лечения. В норме у плода визуализируется распо-
 Рис. 10. М-метод регистрации сердечной деятельности плода
Рис. 10. М-метод регистрации сердечной деятельности плода
ложенное в верхних отделах живота сравнительно больших размеров овоидной формы только жидкостное образование, которое соответствует желудку. При определении размеров желудка установлено, что они подвержены индивидуальным колебаниям. Врожденные пороки развития кишечника выявляются при ультразвуковом исследовании обычно по наличию объемных жидкостных, чаще множественных, образований в брюшной полости плода. Не представляет значительных трудностей и диагностика врожденных грыж, визуализируемых в виде примыкающего непосредственно к брюшной стенке плода объемного образования округлой формы с грыжевым содержимым. Использование эхографии позволяет четко идентифицировать почки, надпочечники и мочевой пузырь. Мочевой пузырь в зависимости от наполнения имеет овоидную или грушевидную форму. Установлено, что при нормально протекающей беременности продукция мочи у плода составляет 20-25 мл/ч. При гестозе и внутриутробной задержке роста плода продукция мочи снижается, что является признаком нарушения функционального состояния плода. Возможна диагностика таких аномалий развития почек, как агенезия, гидронефроз и поликистоз.
Антенатальное определение пола плода имеет важное значение как для диагностики, так и для лечения патологически протекающей беременности (главным образом при подозрении на генные и хромосомные нарушения у плода). Внутриутробное установление половой принадлежности плода с помощью трансабдоминальной эхографии возможно не ранее 20 нед беременности. Применение трансвагинального ультразвукового сканирования позволяет идентифицировать вторичные половые признаки пола плода начиная с 13-16 нед беременности. Диагностика мужского пола основывается на визуализации полового члена в виде простого линейного эха и мошонки, выявляемых при поперечном сканировании туловища и нижних конечностей плода. Для плода женского пола характерно появление 2 или 4 параллельных линий, отражающих большие и малые половые губы.
Заслуживает особого внимания вопрос о диагностике свободной жидкости, находящейся в полостях плода, так как в большинстве случаев ее наличие свидетельствует о тяжелых врожденных пороках развития или выраженной отечной форме гемолитической болезни. Выраженный асцит характеризуется наличием эхонегативного пространства, занимающего значительную часть брюшной полости
плода. При ультразвуковом исследовании гидроторакс, особенно при большом количестве жидкости, проявляется наличием эхонегативных пространств, занимающих всю грудную клетку. Легкие плода не визуализируются. Гидроперикард лучше выявляется в виде эхонегативной полости между перикардом и миокардом при применении М-метода. Следует отметить, что патологическим гидроперикард считается при толщине полоски, превышающей 2 мм. При обнаружении свободной жидкости в полостях плода необходимо детально обследовать сердце, так как отмечается высокая частота сочетания врожденных пороков сердца с наличием асцита, гидроперикарда и гидроторакса.
Внутриутробная гибель плода при ультразвуковом обследовании характеризуется отсутствием сердечной деятельности, при этом отмечаются расширенные камеры сердца, деформация головки и признаки аутолиза внутренних органов плода, а также изменение срединных структур мозга.
Спектр выявляемых маркеров хромосомной патологии во II триместре намного больше и включает в себя изменения со стороны различных органов и систем. Например, при исследовании головного мозга могут быть выявлены вентрикуломегалия, голопрозэнцефалия, микроцефалия, кисты сосудистых сплетений, аномалии задней черепной ямки, аномальные формы черепа («клубника», «лимон»). Кроме того, к наиболее значимым маркерам относятся врожденные пороки сердца, гиперэхогенный кишечник, дуоденальная атрезия, патология лица, расширение чашечно-лоханочной системы плода, прочие аномалии почек, киста яичника у плода, диспропорция длины трубчатых костей, аномалии кистей и стоп, патология пуповины, неиммунная водянка плода, многоводие и маловодие, симметричная форма синдрома задержки развития плода. На сегодняшний день данные, получаемые при ультразвуковом исследовании, являются во многих случаях предопределяющими в выборе дальнейших методов обследования (прежде всего инвазивных), а следовательно, и тактики ведения беременности.
Использование ультразвукового исследования при плацентографии позволяет точно установить локализацию плаценты, ее толщину и структуру. При сканировании в реальном масштабе времени четкое изображение плаценты удается получить обычно с 7-8 нед беременности. В большинстве случаев плацента визуализируется в виде эхопозитивного образования средней плотности, расположенного на
нескольких стенках матки, на фоне околоплодных вод, свободных от эхосигналов.
Форма плаценты может быть различной: плосковыпуклая - при локализации плаценты на передней или задней стенке матки с переходом на одну из боковых стенок; в виде полумесяца - при расположении на боковой стенке матки с переходом на переднюю и заднюю стенки. Плацента располагается чаще на передней или задней поверхности матки с переходом на одну из боковых стенок. В единичных наблюдениях она локализуется в дне матки.
Локализация плаценты в различные сроки беременности нестабильна. Установлено, что частота низкого расположения и предлежания плаценты до 20 нед беременности составляет 11%. Впоследствии в большинстве наблюдений происходит «миграция» плаценты от нижнего сегмента к дну матки. Окончательное заключение о расположении плаценты следует делать только в конце беременности, проводя сравнительную оценку с результатами предыдущих исследований. Низким принято считать такое прикрепление плаценты, когда при эхографическом исследовании расстояние между ее нижним краем и внутренним зевом шейки матки будет меньше 7 см.
Для установления предлежания плаценты исследование необходимо осуществлять при хорошо наполненном мочевом пузыре с целью лучшей визуализации шейки матки и области внутреннего зева. Предлежание плаценты при эхографическом исследовании характеризуется наличием плацентарной ткани в области внутреннего зева. Иногда при локализации плаценты на задней стенке матки возможны трудности при постановке диагноза вследствие значительного поглощения ультразвуковых волн предлежащей головкой плода. В таких случаях предлежание плаценты может быть установлено на основании увеличения расстояния между задней стенкой матки и головкой плода на 2 см и более. Если это расстояние не уменьшится при надавливании на головку плода рукой со стороны передней брюшной стенки, то это явится дополнительным признаком, подтверждающим данный диагноз (рис. 11). При обнаружении предлежания плаценты в срок до 20 нед беременности ультразвуковое исследование необходимо проводить через каждые 4 нед до окончания беременности или до того момента, пока плацента не сместится от внутреннего зева шейки матки на расстояние, превышающее 2-3 см.
С использованием ультразвуковой плацентографии стала возможной диагностика преждевременной отслойки нормально расположенной плаценты на ранних этапах ее возникновения. Для данной патологии характерно наличие эхонегативного пространства между стенкой матки и плацентой, что свидетельствует о скоплении крови с образованием ретроплацентарной гематомы, иногда достигающей гигантских размеров. Если отслоившийся участок расположен по краю плаценты и имеет небольшие размеры, то на эхограмме в месте отслойки определяется линейная эхонегативная полоска. С использованием ультразвуковой плацентографии стало возможным проводить динамическое наблюдение за изменением размеров и признаками организации участка отслойки.
Эхографический диагноз преждевременной отслойки нормально расположенной плаценты иногда приходится дифференцировать с расширенной decidua basalis, визуализируемой в виде эхонегативного пространства с линейными структурами, толщиной до 1,5 см. Подобное расширение обычно связано с гипотонией у матери и затруднением тока крови через густые венозные сплетения decidua basalis. По краям decidua basalis более компактна. Отличие состоит в том, что расширенное пространство определяется почти по всей пло-
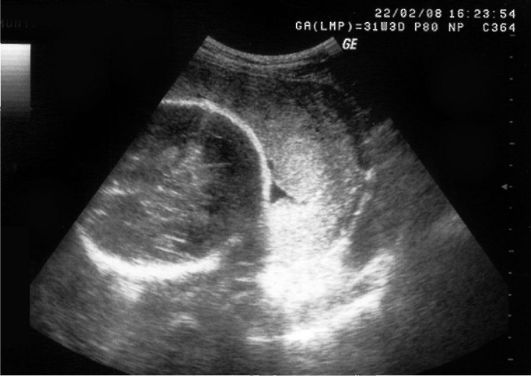 Рис. 11. Предлежание плаценты. Визуализация плацентарной ткани в области внутреннего зева
Рис. 11. Предлежание плаценты. Визуализация плацентарной ткани в области внутреннего зева
щади плаценты одинаковой структуры. После отторжения плаценты этот слой представлен лишь обрывками оболочки.
В ряде случаев выявляются кисты плаценты в виде четко очерченных эхонегативных образований. Кальциноз плаценты характеризуется наличием в ее паренхиме множественных мелких и крупных включений повышенной акустической плотности. Плацента приобретает выраженное дольчатое строение в связи с распространением процесса и на плацентарные перегородки (рис. 12).
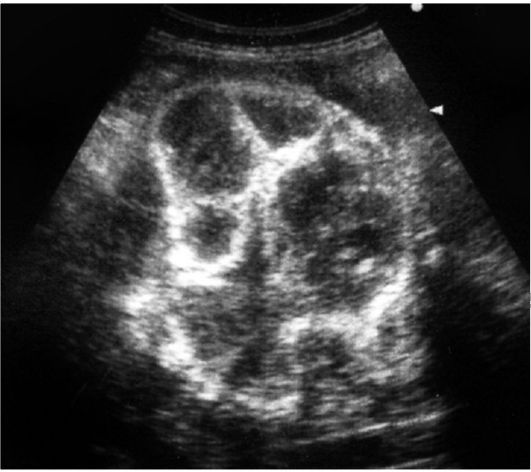 Рис. 12. Кальциноз плаценты
Рис. 12. Кальциноз плаценты
Заслуживает внимания вопрос об изменении структуры плаценты, ее «созревании», на протяжении беременности. Изменения структуры плаценты при ультразвуковом исследовании на протяжении беременности представлены в табл. 7. При неосложненной беременности I стадия структурности плаценты обнаруживается преимущественно с 26-й нед беременности, II стадия - с 32-й нед, а III - c 36-й нед. Появление эхографических признаков различных стадий структурности плаценты раньше установленных сроков расценивается как преждевременное «старение» плаценты.
Установлено, что при физиологически протекающей беременности толщина плаценты постоянно увеличивается в линейной зависимости от 10,9 мм в 7 нед до 35,6 мм в 36 нед. К концу беременности ее толщина несколько уменьшается.
Таблица 7. Ультразвуковые изменения в плаценте в зависимости от степени ее зрелости (P. Grannum et al., 1979)
Степень зрелости плаценты | Хориальная мембрана | Паренхима | Базальный слой |
0 | Прямая, гладкая | Гомогенная | Не идентифицируется |
I | Слегка волнистая | Небольшое количество эхогенных зон | Не идентифицируется |
II | С углублениями | Линейные эхогенные уплотнения (в виде запятой) | Линейное расположение небольших эхогенных зон (базальный пунктир) |
III | С углублениями, достигающими базального слоя | Округлые уплотнения с разрежением в центре | Большие и отчасти слившиеся эхогенные зоны, дающие акустическую тень |
При резус-сенсибилизации и развитии гемолитической болезни, а также при сахарном диабете толщина плаценты может увеличиваться до 50 мм и более. Плацентарная недостаточность, напротив, характеризуется истончением плаценты и преждевременным ее созреванием.
Представленные данные о диагностических возможностях ультразвукового исследования делают его незаменимым в клинической практике в качестве скринингового метода обследования беременных для ранней диагностики заболеваний плода.
Третье скрининговое ультразвуковое исследование проводится в 30-34 нед в целях выявления пороков развития с поздней манифестацией, а также для оценки функционального состояния плода (диагностика внутриутробной задержки роста плода и его гипоксии, а также выявление функциональных резервов маточно-плацентарноплодового кровотока).
Объем обследования и схема проведения третьего ультразвукового обследования соответствует таковым для второго скрининга, но достаточно часто для оценки функционального состояния плода требуется проведение допплерометрического исследования кровотока в сосудах матери, плода и плаценты и кардиотокография.
ДОППЛЕРОМЕТРИЯ В АКУШЕРСКОЙ ПРАКТИКЕ
Общепринятым считается утверждение, что ведущим патогенетическим механизмом нарушения состояния плода при различных осложнениях беременности и экстрагенитальных заболеваниях являются гемодинамические нарушения в единой функциональной системе мать-плацента-плод. В большинстве наблюдений гемодинамические нарушения характеризуются универсальностью и однотипностью изменений вне зависимости от состояния плода и этиопатогенетического фактора. Кроме того, системные нарушения гемодинамики у матери наблюдаются при таком тяжелом осложнении беременности, как гестоз, а также при многих экстрагенитальных заболеваниях.
Первая публикация о применении допплерометрии в акушерстве относится к 1977 г., когда D. FitzGerald и J. Drumm зарегистрировали кривые скоростей кровотока (КСК) в артерии пуповины с помощью датчика непрерывной волны. Впервые допплерометрию в России для оценки состояния плода применил А.Н. Стрижаков и соавт. в 1985 г.
Высокая информативность, неинвазивность, относительная простота, безопасность и возможность использования на протяжении всей беременности, в том числе и на ранних сроках гестации, делает этот метод исследования кровообращения незаменимым в акушерстве.
Новейшим методом, основанным на эффекте Допплера, является цветное допплеровское картирование. Высокая разрешающая способность метода позволяет визуализировать и идентифицировать мельчайшие сосуды микроциркуляторного русла, что делает этот метод незаменимым в диагностике сосудистой патологии, в том числе и в перинатологии. Первый опыт использования ЦДК в акушерской практике связан с именами D. Maulik et al. и A. Kurjak (1986). С 1987 г. (Kurjak A. et al.) в акушерстве используется трансвагинальное ЦДК. ЦДК обеспечивает возможность исследования кровотока в ветвях маточной артерии (вплоть до спиральных артерий), терминальных ветвях артерии пуповины, межворсинчатом пространстве. Это позволило изучить особенности становления и развития внутриплацентарной гемодинамики и открыло новые перспективы для ранней диагностики акушерских осложнений, связанных с формированием плацентарной недостаточности.
Основными показаниями для проведения допплеровского исследования кровотока в маточных артериях и сосудах плода (артерия пуповины и ее терминальные ветви, средняя мозговая артерия, аорта, венозный проток) являются:
'заболевания беременной: гестоз, гипертоническая болезнь, гипотония, заболевания почек, коллагеновые сосудистые заболевания, диабет;
'заболевания плода: задержка внутриутробного развития плода, несоответствие размеров плода сроку беременности, необъяснимое маловодие, преждевременное созревание плаценты, многоплодная беременность;
• отягощенный акушерский анамнез: задержка внутриутробного развития и дистресс плода, гестоз и мертворождение при предыдущих беременностях;
• переношенная беременность.
Наиболее широкое распространение в акушерской практике получил качественный анализ кривых скоростей кровотока, показатели которого не зависят от диаметра сосуда и величины угла инсонации. Основное значение при этом имеет соотношение между скоростью кровотока в различные фазы сердечного цикла. Наиболее часто используются систолодиастолическое отношение (СДО) (Stuart B. et al., 1980), пульсационный индекс (ПИ) (Gosling R., King D., 1975), индекс резистентности (ИР) (Pourcelot L., 1974).
СДО = МССК / КДСК,
ПИ = (МССК-КДСК) / ССК,
ИР = (МССК-КДСК) / МССК,
где: МССК - максимальная систолическая скорость кровотока, КДСК - конечная скорость диастолического кровотока, ССК - средняя скорость кровотока.
Повышение сосудистого сопротивления, проявляющееся, в первую очередь, снижением диастолического компонента кровотока, приводит к повышению численных значений указанных индексов.
С использованием аппаратуры с высокой разрешающей способностью оценивают кровоток в большинстве сосудов плода (аорта, легочный ствол, нижняя и верхняя полые вены, артериальный проток, общая, внутренняя и наружная сонные артерии, передняя, средняя и задняя мозговые артерии, почечные артерии, печеночные и пупочная вены, а также артерии верхних конечностей).
Наиболее важным для диагностики состояния плацентарного комплекса, эмбриона и плода, прогнозирования дальнейшего развития беременности и ранней диагностики ее осложнений является допплерометрическое исследование кровотока во всех указанных сосудистых звеньях.
С помощью цветного допплеровского картирования циркуляция крови в межворсинчатом пространстве визуализируется, начиная с 6-й нед беременности. Спектр кровотока при этом имеет венозный характер, с высокой турбулентностью и низкой пульсацией. Следует отметить, что у пациенток с анэмбрионией и ранними самопроизвольными выкидышами отмечается более высокая пульсация кровотока. Это отражает преждевременное попадание материнской крови в межворсинчатое пространство, приводящее к отслойке плаценты и прерыванию беременности.
Визуализация кровотока в спиральных артериях при использовании методики цветного допплеровского картирования возможна уже с 6-й нед беременности, причем с ранних сроков он характеризуется низкой пульсацией и высокими диастолическими скоростями. Наиболее выраженное снижение сосудистого сопротивления в маточных артериях происходит в сроки 12-13 нед и 20-22 нед, а в спиральных артериях - в 8-10 и 13-14 нед гестации, что отражает завершение процессов инвазии трофобласта и завершением гестационных изменений спиральных артерий. Эти сроки являются критическими для развития маточно-плацентарного кровообращения. Оценка его параметров в конце I триместра беременности позволяет прогнозировать дальнейшее ее течение. В основе механизма, обеспечивающего постоянство маточного кровотока при прогрессировании беременности, лежит снижение преплацентарного сопротивления току крови. Это достигается процессом инвазии трофобласта, заключающемся в дегенерации мышечного слоя, гипертрофии эндотелиальных клеток и фибриноидном некрозе концевых участков спиральных артерий, который обычно полностью завершается к 16-18 нед беременности. Сохранение высокой резистентности маточных артерий, обусловленное нарушением или отсутствием инвазии трофобласта, составляет основной морфологический субстрат нарушений маточно-плацентарного кровообращения (рис. 13).
В норме КСК в маточных артериях после 18-20 нед беременности характеризуются наличием двухфазных кривых с высокой диастолической скоростью кровотока. На протяжении второй половины
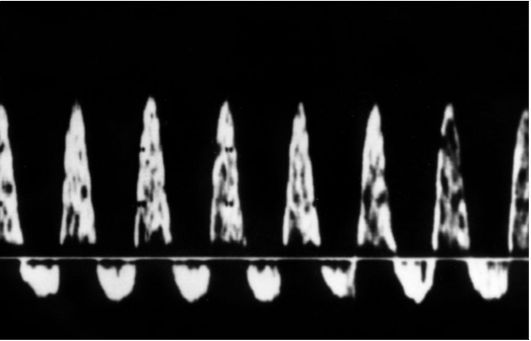 Рис. 13. Реверсный диастолический кровоток в артерии пуповины плода
Рис. 13. Реверсный диастолический кровоток в артерии пуповины плода
неосложненной беременности численные значения индексов, отражающих резистентность сосудистой стенки, остаются достаточно стабильными с некоторым снижением к концу беременности. При неосложненном течении беременности значения СДО в маточных артериях после 18-20 нед не должны превышать 2,4. Во II и III триместрах беременности значение исследования кровотока в маточных и спиральных артериях приобретает характер ранней диагностики гестоза и плацентарной недостаточности. Характерными признаками патологических КСК в маточных артериях являются снижение диастолического компонента кровотока и появление дикротической выемки в фазу ранней диастолы, при этом отмечается достоверное повышение значений СДО, ИР, ПИ.
Как доказано многочисленными исследованиями и практикой, это имеет большое значение для выработки рационального подхода к терапии и акушерской тактике. Наиболее изучаемым сосудом в акушерской практике в настоящее время является артерия пуповины (АП). Визуализация пуповины при трансвагинальном ультразвуковом исследовании возможна в большинстве наблюдений уже с 7-8 нед беременности. Наибольшую ценность анализ кривых скоростей кровотока в артерии пуповины имеет только начиная с 10-й нед беременности. Диастолический компонент кровотока в артерии пуповины до 14 нед беременности может отсутствовать. У плодов с хромосомными аномалиями в сроки 10-13 нед может регистри-
роваться реверсный диастолический кровоток, у здоровых плодов не регистрирующийся. Более информативным является определение пульсационного индекса в артерии пуповины. Повышение ПИ и наличие расширения воротникового пространства позволяет с большей достоверностью диагностировать хромосомные аномалии у плода, в том числе и трисомии. На протяжении второй половины неосложненной беременности наблюдается достоверное снижение показателей сосудистой резистентности в АП, выражающееся в уменьшении численных значений СДО, ИР, ПИ. До 14-15 нед беременности при использовании фильтра 50 Гц диастолический кровоток в большинстве наблюдений не визуализируется. После 15-16 нед он регистрируется постоянно. Снижение индексов сосудистой резистентности в АП на протяжении II и III триместров беременности свидетельствует об уменьшении сосудистого сопротивления плаценты, которое вызвано интенсивным ростом ее терминального русла, связанного с процессами развития и васкуляризации концевых ворсин плаценты. При неосложненной беременности значения СДО в АП не должны превышать 3,0. Патологические КСК в АП характеризуются снижением конечной диастолической скорости кровотока, вплоть до полного исчезновения или появления ретроградного диастолического компонента, что свидетельствует о значительном повышении периферического сосудистого сопротивления плодовой части плаценты. Морфологическим субстратом этого является снижение васкуляризации концевых ворсин плодовой части плаценты и поражение микрососудов ворсин, проявляющееся облитерацией мелких мышечных артерий в их третичных стволах.
Значение исследования кровотока в артерии пуповины, ее терминальных ветвях, маточных и спиральных артерий во II и III триместрах беременности четко определено и широко используется в клинической практике как с целью оценки состояния плодового кровообращения, так для определения функционирования всей фетоплацентарной системы, особенно при угрожающем прерывании беременности, гестозе, плацентарной недостаточности, внутриутробном инфицировании. Для более точной и объективной допплерометрической оценки кровообращения в системе матьплацента-плод предложен комплексный учет получаемых данных. А.Н. Стрижаковым и соавт. (1989) была разработана классификация нарушений маточно-плацентарного и плодово-плацентарного кровотока по оценке КСК в маточных артериях и АП. При I степени
отмечаются нарушения только маточного (А) (рис. 14) или только плодового (Б) кровотока. II степень характеризуется нарушениями как маточного, так и плодового кровотока, не достигающих критических значений. При III степени нарушения кровотока в АП достигают критических значений, выражающихся наличием нулевых или отрицательных значений диастолического компонента кровотока. Отмечается четкая прямо пропорциональная зависимость между степенью гемодинамических и частотой внутриутробной задержки развития плода, досрочного родоразрешения, операции кесарева сечения и состоянием новорожденных.
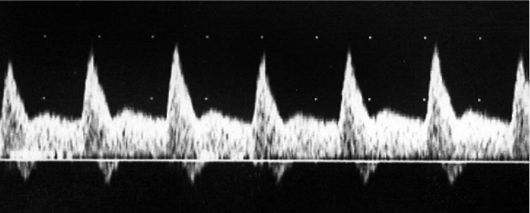 Рис. 14. Патологический спектр кровотока в маточных артериях
Рис. 14. Патологический спектр кровотока в маточных артериях
Наибольшее внимание привлекает оценка гемодинамики плода и маточно-плацентарного кровотока при плацентарной недостаточности. Типичным проявлением плацентарной недостаточности является внутриутробная задержка развития плода (ВЗРП). Первичным звеном развития ВЗРП в большинстве случаев на протяжении второй половины беременности являются нарушения маточно-плацентарного кровотока. При одновременном вовлечении в процесс двух маточных артерий ВЗРП наблюдается в 100% случаев и бывает более выраженной, а новорожденные нуждаются в более интенсивном лечении и наблюдении.
Важной является допплерометрическая оценка состояния плода при внутриутробной гипоксии. Допплерометрия позволяет несколько ранее, чем кардиотокография, диагностировать внутриутробную гипоксию плода. Наиболее информативно в этом случае исследование и оценка КСК в аорте плода. В патогенезе антенатальных децелераций ведущее место занимают нарушения плодовой гемодинамики
(особенно при критическом состоянии плодово-плацентарного кровотока). Своевременная точная оценка состояния плода в динамике приобретает первостепенное значение для выбора оптимальных сроков и метода родоразрешения.
В настоящее время большое внимание уделяется исследованию кровотока в венах плода, начиная с I триместра беременности.
Венозный проток представляет собой сосуд, являющийся прямой коммуникацией между пупочной веной и центральной венозной системой, через которую формируется поток с хорошо оксигенированной кровью. С конца I триместра беременности при нормальном развитии плода кровоток в венозном протоке характеризуется трехфазной кривой, обусловленной различными фазами сердечного цикла: желудочковой систолой, ранней желудочковой диастолой и предсердной систолой. При нормальном развитии беременности кровоток в венозном протоке остается однонаправленным на протяжении всех фаз сердечного цикла. Нарушения кровотока в венозном протоке в сроки 10-14 нед беременности (нулевой или реверсный кровоток в фазу сокращения предсердий) являются маркером хромосомной патологии плода. Во II и III триместрах беременности изменение венозной гемодинамики является вторичным по отношению к перераспределению артериального кровотока и выявляется при субкомпенсированном и декомпенсированном состоянии плода. Сочетание нарушений артериального и венозного кровотока является крайне неблагоприятным для перинатального прогноза. Исследование кровотока в аорте и мозговых сосудах плода приобретает значимое диагностическое и прогностическое значение, только начиная с 22-24 нед беременности, так как до этого срока имеющиеся нарушения не выявляются в связи с большими компенсаторными возможностями плодовой гемодинамики. Изменения кровотока в аорте плода, характеризующиеся снижением диастолического компонента кровотока, отражают степень нарушения плодовой гемодинамики. Их следует рассматривать как следствие возрастания резистентности периферического сосудистого русла плода и компенсаторного уменьшения резистентности сосудов головного мозга в условиях прогрессирующей внутриутробной гипоксии. Наиболее неблагоприятным является нулевой или реверсный диастолический кровоток в аорте плода, отражающий его критическое состояние.
Увеличение мозгового кровотока, в свою очередь, является проявлением компенсаторной централизации плодового кровообращения
при внутриутробной гипоксии в условиях сниженной плацентарной перфузии. Повышение периферического сосудистого сопротивления головного мозга является фактором риска осложненного течения неонатального периода, ведет к снижению компенсаторных возможностей новорожденного и нарушает процессы адаптации.
Большое клиническое значение имеет допплерометрия при гестозе. Отмечена прямопропорциональная зависимость между степенью тяжести гестоза, с одной стороны, и частотой и степенью тяжести нарушений кровотока в маточных артериях - с другой. При тяжелых формах гестоза изменения КСК в маточных артериях происходят параллельно нарушениям кровотока в АП. Нарушения маточно-плацентарно-плодового кровотока находятся в прямой зависимости от степени тяжести гестоза и могут рассматриваться как объективный показатель степени тяжести заболевания вне зависимости от его клинических проявлений. Наиболее неблагоприятными прогностическими признаками являются нарушения КСК в обеих маточных артериях, появление дикротической выемки и выраженные нарушения плодовой гемодинамики. Допплерометрия позволяет прогнозировать возникновение гестозов и ВЗРП в III триместре на основании выявления патологических КСК в маточных артериях во II триместре беременности. Важным при гестозах является и исследование почечной и мозговой гемодинамики беременных. Формирование маточно-плацентарного кровообращения при неосложненном течении беременности сопровождается увеличением почечного кровотока, особенно в сроки 13-18 нед. При гестозах наблюдается прогрессивное снижение почечной гемодинамики в зависимости от степени тяжести заболевания и выраженности клинических проявлений.
Для оценки степени тяжести гестоза проводится допплерометрия кровотока в системе внутренней сонной артерии. Особенностью мозговой гемодинамики у беременных является снижение периферической сосудистой резистентности в системе внутренней сонной артерии при неосложненной беременности и повышение сосудистого сопротивления головного мозга при гестозе. Значительное повышение резистентности в бассейне внутренней сонной артерии (особенно появление ретроградного кровотока в надблоковой артерии) является прогностически неблагоприяным признаком в отношении развития преэклампсии и эклампсии.
Таким образом, знание особенностей становления и развития маточно-плацентарного, плодово-плацентарного и плодового кро-
вотоков дает возможность не только оценивать состояние плода во второй половине беременности, но и оценивать его анатомические особенности, диагностировать пороки развития сосудистой системы, выявлять маркеры хромосомной патологии уже в I триместре беременности. Это позволяет осуществлять своевременную диагностику клинически значимых отклонений в развитии плода и решать вопрос о целесообразности пролонгирования беремености или выбора оптимальной акушерской тактики. Кроме того, использование допплерометрической оценки кровотока в сосудах матери (маточные и спиральные артерии, мозговые и почечные артерии, оценка параметров центральной гемодинамики) позволяет прогнозировать развитие гестоза, что делает возможным проведение профилактических мероприятий, способствующих улучшению исходов беременности для матери и плода.
АНТЕ- И ИНТРАНАТАЛЬНАЯ КАРДИОТОКОГРАФИЯ ПЛОДА
В современном акушерстве, наряду с традиционными методами оценки состояния плода, широко используются ультразвуковые приборы, которые позволяют проводить кардиомониторное наблюдение в процессе беременности и родах. Поведенческие реакции плода и характер его сердечной деятельности тесно связаны с его внутриутробным состоянием и сроком беременности. Реакции со стороны плода на воздействие внешних факторов, на изменения собственного метаболизма достаточно типичны, что позволяет систематизировать их для оценки его состояния. Интенсивное наблюдение за сердечной деятельностью плода расширило диагностические возможности, позволило своевременно выявлять показания к экстренному родоразрешению и тем самым снизить показатели перинатальной смертности.
Современные кардиомониторы основаны на принципе Допплера, использование которого позволяет регистрировать изменение интервалов между отдельными циклами сердечной деятельности плода, преобразующихся в изменении частоты сердечных сокращений и отображающихся в виде светового, звукового, цифрового сигналов и графического изображения. В современных фетальных мониторах обычно используются ультразвуковые датчики частотой 1,5 и 2,0 МГц. В ходе кардиотокографического исследования пациентки
предполагают, что они слышат тоны сердца плода, однако это не что иное, как частотный сдвиг отраженных ультразвуковых волн. Современные приборы оснащены также датчиками, регистрирующими одновременно сократительную деятельность матки и движения плода. В клинической практике наибольшее распространение имеют наружные датчики, применение которых практически не имеет противопоказаний и лишено каких-либо осложнений или побочных действий.
Наружный ультразвуковой датчик помещают на передней брюшной стенке беременной в точке наилучшей слышимости сердечных тонов плода. В современных фетальных кардиомониторах предусмотрен индикатор, демонстрирующий качество регистрации сердцебиений плода. На поверхность датчика наносят слой специального геля для обеспечения оптимального контакта. Наружный тензометрический датчик накладывают в области правого угла матки. На его поверхность гель не наносят. После прикрепления датчика необходимо установить оптимальный базальный уровень регистрации. Применение наружной кардиотокографии (КТГ) позволяет проводить непрерывное наблюдение за сердечной деятельностью плода в течение длительного времени. Кроме датчиков, фетальные мониторы снабжены специальным устройством для регистрации шевелений плода. С его помощью пациентка самостоятельно отмечает каждый эпизод шевеления. Кардиотокографическое исследование можно проводить в положении беременной на спине, но лучше при легком повороте на левый бок. Для получения максимально точной информации о состоянии плода запись следует производить не менее 40-60 мин. Такая продолжительность связана с наличием у плода периодов сна и активности. При использовании внутренних датчиков специальный спиралевидный электрод накладывают на кожу головки плода, для регистрации сократительной деятельности интраамниально вводят катетер.
Проведение кардиотокографии считается обоснованным только с 32-й нед беременности. При использовании приборов с автоматическим анализом кардиотокограмм исследование можно проводить начиная с 26-й нед беременности.
Показания к кардиотокографическому исследованию:
• отягощенный акушерский анамнез (перинатальные потери, задержка внутриутробного развития плода, преждевременные роды и др.);
• заболевания беременной (гипертоническая болезнь, сахарный диабет, заболевания почек, системные заболевания) и осложнения беременности (резус-иммунизация, гестоз);
• многоплодная беременность;
• переношенная беременность;
• снижение числа шевелений, ощущаемых беременной;
• задержка внутриутробного развития;
• маловодие;
• преждевременное созревание плаценты;
• курабельные врожденные пороки развития плода;
• предыдущая подозрительная или патологическая кардиотокограмма;
• гемодинамические нарушения в системе мать-плацента-плод - по данным допплерометрии.
Задача мониторного наблюдения в родах заключается в своевременном распознавании ухудшения состояния плода, что позволяет адекватно проводить его коррекцию, а при необходимости ускорить родоразрешение. При характеристике состояния плода в родах оценивают следующие параметры кардиотокограммы: базальный ритм частоты сердечных сокращений, его вариабельность, а также характер медленных ускорений (акцелераций) и замедлений (децелераций) сердечного ритма, сопоставляя их с данными, отражающими сократительную деятельность матки.
Изучение КТГ начинают с определения базального ритма. Под базальным ритмом понимают среднюю величину между мгновенными значениями частоты сердцебиения плода в промежутке между схватками; при этом не учитывают значения акцелераций и децелераций. Величину базального ритма подсчитывают за 10-минутный интервал. Нормальный базальный ритм составляет 120-160 уд/мин (в среднем 140-145 уд/мин). Базальный ритм ниже 120 уд/мин расценивают как брадикардию, выше 160 уд/мин - как тахикардию. В первом периоде родов тахикардия встречается чаще и более выражена. В связи с этим выделяют умеренную (161-180 уд/мин) и тяжелую (выше 181 уд/мин) тахикардию. Степень тяжести тахикардии соответствует степени выраженности гипоксии плода.
О снижении резервных возможностей плода в большей степени свидетельствует брадикардия. Постоянная брадикардия может быть признаком врожденного порока развития сердца плода. Так же как тахикардия, брадикардия по степени тяжести делится на умерен-
ную и выраженную (соответственно 119-100 и менее 100 уд/мин). Необходимо отметить, что базальный ритм является одним из наиболее инертных параметров сердечной деятельности плода, поэтому при оценке КТГ необходимо учитывать и другие патологические изменения, что значительно повышает диагностическую ценность метода.
При характеристике базального ритма необходимо оценить его вариабельность, т.е. частоту и амплитуду мгновенных изменений частоты сердечных сокращений плода (мгновенных осцилляций). Подсчет частоты и амплитуды мгновенных осцилляций проводят в течение каждых последующих 10 мин. Амплитуду осцилляций определяют по величине отклонения от базального ритма, частоту - по количеству осцилляций за 1 мин. В клинической практике наибольшее распространение имеет следующая классификация типов вариабельности базального ритма: немой (монотонный) ритм характеризуется низкой амплитудой - 0-5 уд/мин; слегка ундулирующий - 5-10 уд/мин; ундулирующий - 10-25 уд/мин; сальтаторный - 25-30 уд/мин. Вариабельность амплитуды мгновенных осцилляций может сочетаться с изменением их частоты (в норме 7-12 осцилляций в 1 мин).
При физиологическом течении родов могут встречаться все типы вариабельности базального ритма, но наиболее часто присутствуют слегка ундулирующий и ундулирующий ритмы. При осложненном течении родов необходимо обращать внимание на появление немого и сальтаторного типа вариабельности базального ритма, особенно в сочетании с тахикардией или брадикардией. Наиболее неблагоприятным считается немой тип, особенно при одновременном снижении амплитуды (менее 3 уд/мин) и частоты осцилляций (менее 6 осцилляций в 1 мин). Такая кривая обычно свидетельствует о глубоком гипоксическом воздействии на центральную нервную систему и миокард плода и является в сущности предагональной (терминальной). При неосложненном течении родов немой тип вариабельности базального ритма может быть обусловлен воздействием наркотических и седативных средств.
При анализе КТГ необходимо обращать внимание на периодические медленные ускорения (акцелерации) базального ритма, которые отражают степень компенсаторных возможностей сердечно-сосудистой системы плода. При физиологическом течении родов акцелерации наблюдаются почти постоянно с частотой 4-5 и более за 30 мин, про-
должительность их составляет 20-60 с, амплитуда - более 15 уд/мин. Периодические акцелерации возникают в начале родов и связаны с сокращениями матки или сдавлением пуповины. Спорадические акцелерации чаще всего связаны с двигательной активностью плода. Снижение частоты акцелераций или тем более их отсутствие является неблагоприятным прогностическим признаком.
Важное значение для диагностики состояния плода имеет оценка медленных волн урежений базального ритма. Появление децелераций указывает на определенные патологические изменения фетоплацентарной системы.
Для диагностического применения КТГ W. Fischer (1973) предложил шкалу, в которой по балльной системе оценивают основные показатели. Оценка 8-10 баллов характеризует удовлетворительное состояние плода, 6-7 баллов - компенсированное и менее 6 - декомпенсированное нарушение состояния плода (табл. 8).
Предложено достаточно много и других систем оценки состояния плода по данным кардиотокографии (Готье Е.С, 1982; классификация FIGO, 1987), а также специальные уравнения для определения показателя состояния плода (Демидов В.Н., 1983).
Следует подчеркнуть, что при использовании КТГ в родах необходимо соблюдать мониторный принцип, т.е. постоянную динамическую оценку КТГ на протяжении родов с учетом максимального числа показателей. Диагностическая ценность метода повышается при тщательном сопоставлении данных КТГ с акушерской ситуацией и другими критериями оценки состояния плода.
Большую помощь в оценке состояния плода и резервных возможностей фетоплацентарной системы оказывают функциональные пробы. Разработано большое число методик проведения функциональных проб (атропиновый, эуфиллиновый тесты, проба с нагрузкой, задержкой дыхания). При проведении антенатальной КТГ в настоящее время наиболее распространены стрессовый (окситоциновый) и нестрессовый тесты.
Сущность окситоцинового теста заключается в изучении реакции сердечно-сосудистой системы плода в ответ на сокращения матки, вызванные введением раствора окситоцина. Для проведения теста внутривенно вводят раствор окситоцина, содержащий 0,01 ЕД в 1 мл изотонического раствора хлорида натрия. Скорость введения 1 мл/мин.Тест можно интерпретировать, если в течение 10 мин возникло не менее 3-4 схваток, при достаточных компенсаторных воз-
Таблица 8. Шкала оценки КТГ по W. Fischer et al. (1973)
Параметр КТГ | Баллы | ||
0 | 1 | 2 | |
Базальный ритм, уд/мин | <100 >180 | 100-119 161-180 | 120-160 |
Вариабельность: - амплитуда, уд/мин; - частота, в 1 мин | <3 <3 | 3-5 3-6 | 6-25 >6 |
Акцелерации, за 30 мин | 0 | Периодические, 1-4 спорадические | 5 и более спорадических |
Децелерации, за 30 мин | Dip II, тяжелые, Dip III, тяжелые, атипичные | Легкие Dip III, средней степени Dip III | Dip I, Dip 0 |
можностях фетоплацентарной системы в ответ на сокращение матки наблюдается нерезко выраженная кратковременная акцелерация. Отсутствие реакции или появление медленных децелераций в ответ на индуцированные сокращения матки свидетельствует о фетоплацентарной недостаточности. Окситоциновый тест имеет ряд противопоказаний (угроза прерывания беременности, рубец на матке, патология прикрепления плаценты), поэтому в последнее время его используют редко.
Высоко информативен так называемый нестрессовый тест. Его суть заключается в изучении реакции сердечно-сосудистой системы плода в ответ на движения. В норме движения плода сопровождаются кратковременным ускорением базального ритма (медленные акцелерации). В этом случае тест считается положительным. Более чем в 99% наблюдений положительный нестрессовый тест является достоверным критерием благополучного состояния плода. В том случае, если в ответ на движения плода акцелерации возникают менее чем в 80% случаев, тест считается сомнительным. При отсутствии реакции сердечной деятельности плода в ответ на движения тест считается отрицательным, что свидетельствует о напряженности и истощении компенсаторных реакций. Тест может быть ложноотрицательным, если исследование проводится в период физиологического покоя плода. В этом случае исследование необходимо повторить.
Диагностическая ценность антенатальной КТГ имеет место только при динамическом исследовании. В этих условиях практически любая патологическая терапия может оцениваться как функциональная проба. Отсутствие положительной динамики на КТГ, а тем более - отрицательная на фоне проводимого лечения свидетельствуют о прогрессировании фетоплацентарной недостаточности и ставят вопрос о целесообразности дальнейшего пролонгирования беременности. Вопрос о времени и методе родоразрешения должен решаться не только на основании детального динамического анализа антенатальной КТГ, но и учете всей акушерской ситуации и данных других дополнительных методов исследования.
Однако визуальная интерпретация полученных кардиотокограмм не лишена фактора субъективности, она трудно воспроизводима как между разными специалистами, так в разное время у одного и того же специалиста. В связи с этим в последние годы во многих клиниках мира предпринимались попытки разработать различные компьютерные программы для оценки кардиотокографических кривых. Наибольшее распространение в настоящее время получила компьютерная система 8000 (Oxford, UK). Она была разработана профессорами G. Dawes и C. Redman (1991). Программа позволяет проводить детальные анализ многих параметров кардиотокограммы в антенатальном периоде в реальном времени, рассчитывать различные индексы и сравнивать их с нормативными показателями. Кроме того, в 1995 г. ими же была предложена Система 8002, позволяющая соотносить показатели со сроком беременности, что значительно повысило диагностическую ценность метода.
Система оценки кардиотокограмм, названная критериями Dawes/ Redman, включает в себя:
• оценку вариабельности базального ритма (количество эпизодов высокой и низкой вариабельности, которые отражают состояние плода лучше, чем наличие акцелераций);
• показатель STV (при нормальном состоянии плода - более 3 мс);
• оценку базальной частоты сердечных сокращений (в норме в пределах 115-160 уд/мин).
Критериями нормального состояния плода, согласно G. Dawes и C. Redman, является отсутствие глубоких децелераций и наличие по крайней мере 1 эпизода шевеления или акцелераций за 10 мин записи.
К преимуществам компьютерной оценки кардиотокограмм относятся:
• ранние сроки проведения исследования (начиная с 26 нед беременности);
• объективность оценки сердечной деятельности плода;
• получение данных при динамическом контроле за состоянием плода в виде стандартного отчета;
• небольшая продолжительность исследования (более чем в 50% наблюдений критерии Dawes/Redman регистрируются уже после 10 мин записи, и только в 17% требуется запись в течение 60 мин).
Таким образом, кардиотокография, особенно при наличии компьютерного анализа, позволяет получить ценную информацию о состоянии плода.
ПОНЯТИЕ О БИОХИМИЧЕСКОМ СКРИНИНГЕ
При выборе рациональной программы обследования беременных необходимо помнить о том, что точность пренатальной диагностики повышается при использовании нескольких диагностических тестов и тщательной оценке нескольких факторов риска.
В 1984 г. L.R. Merkatz показал наличие корреляции между низкими значениями альфафетопротеина (АФП) в сыворотке крови матери и наличием у плода трисомии по 21 паре хромосом. С тех пор была изучена диагностическая ценность определения и ряда других биохимических маркеров с целью выявления пороков развития и хромосомной патологии плода. К ним относятся β-субъединица хорионического гонадотропина человека (ХГЧ) и неконъюгированный эстриол (НЭ), концентрация которых в сыворотке крови матери при наличии трисомий у плода повышается. В России формирование группы риска среди беременных по рождению детей с хромосомными болезнями и некоторых врожденных пороков развития (spina bifida, анэнцефалия, омфалоцеле и др.) проводится по результатам исследования крови матери на АФП и ХГЧ в сроки 16-20 нед беременности (так называемый дуплекс-тест). В ряде стран более принятым является проведения так называемого триплекс-теста, т.е. определение всех вышеперечисленных биохимических маркеров, что повышает диагностическую точность сывороточного скрининга. Следует помнить о том, что уровень АФП и особенно хорионического гонадотропина может изменяться и по другим причинам (неправильное опре-
деление срока беременности, многоплодная беременность, расовые особенности беременных), что приводит к ложноположительной диагностике генетической неполноценности плода.
В конце 80-х гг. ХХ в. постепенно стали накапливаться данные о характере изменений АФП и НЭ в ранние сроки беременности. Было выявлено, что при трисомии по 21 паре хромосом (синдроме Дауна) отклонения уровней этих маркеров можно зарегистрировать уже в 9-11 нед. H. Cuckle, N. Wald, G. Barkai (1988) установлен тот факт, что при трисомиях медианы традиционных биохимических маркеров практически не отличаются от медиан в сроки традиционного скрининга (16-22 нед) и составляют: для АФП - 0,75 МоМ (в 16-22 нед - 0,72 МоМ), для НЭ - 0,73 МоМ (0,72 МоМ), для общего ХГЧ - 1,90 МоМ (2,01 МоМ). Одновременно с изучением динамики хорошо известных маркеров велся поиск других ранних маркеров хромосомной патологии. Особое внимание уделялось изучению РАРР-А (плазменный белок, ассоциированный с беременностью - pregnancy associated plasma protein A), так как большинство исследований, проведенных в 90-е гг. ХХ в., показали высокую диагностическую ценность определения β-ХГЧ и РАРР-А. В норме в интервале от 9 до 13 нед концентрация РАРР-А прогрессивно растет с 1,48 до 4,71 МоМ, а свободного β-ХГЧ сначала растет, а к концу I триместра - снижается. При трисомиях наблюдается возрастание уровня второго и значительное снижение уровня РАРР-А. D. Wheeler, M. Sinosich (1998) сделали вывод, что конец I триместра является оптимальным сроком для скрининга с применением РАРР-А и свободного β-ХГЧ и о том, что этот тест можно применять и для прогнозирования неперспективных беременностей. Особенную прогностическую ценность в выявлении хромосомной патологии плода в I триместре имеет сочетание определения биохимических маркеров, возраста беременной старше 35 лет и оценкой толщины воротникового пространства (выявляемость трисомий - до 90%).
ИНВАЗИВНЫЕ МЕТОДЫ ОЦЕНКИ СОСТОЯНИЯ ПЛОДА
Эмбриоскопия - исследование эмбриона с помощью оптического прибора в сроки до 12 нед беременности с целью визуальной оценки его органов. Первую попытку визуализировать плод непосредственно в полости матки с помощью гистероскопа в 1954 г. предпринял
J. Westin. За прошедшие полвека оптическая техника претерпела значительные изменения и сегодня пренатальная медицина располагает миниатюрными приборами с высокой разрешающей способностью и великолепным качеством оптики. Основным показанием для проведения эндоскопических исследований в ранние сроки беременности является высокий риск наличия у плода врожденной и наследственной патологии, которая не может быть выявлена с помощью традиционной эхографии и не дает характерных изменений при цитогенетическом, биохимическом или ДНК-анализах. В литературе имеются сообщения о возможностях применения эмбриоскопии для диагностики патологии плода. М. Dommergues et al. в 1995 г. опубликовали данные о диагностике синдрома Меккеля-Грубера в 10-11 нед на основании выявления постаксиальной полидактилии. Описаны наблюдения диагностики полидактилии, косолапости, энцефалоцеле, микрогении, расщелин и других аномалий лица в сроки от 8 до 13 нед. Кроме того, интраамниальные эндоскопические процедуры могут использоваться не только для визуальной оценки органов и частей плода, но и с целью получения материала для генетического исследования. Основной недостаток исследований в I триместре с применением оптических приборов - высокий риск осложнений. Например, частота прерывания беременности составляет 12-35%, что ограничивает применение метода в широкой клинической практике. До сих пор в литературе, посвященной эндоскопическим методам, ведутся дискуссии о возможном поражении глаз плода ярким светом, используемым при проведении процедуры. Наличие эндоскопических методов в арсенале пренатальной медицины позволяет надеяться на расширение их применения в клинической практике.
Кафедрой акушерства и гинекологии ? 2 ММА им. И.М. Сеченова (Стрижаков А.Н., Давыдов А.И., Соколов А.В., 2003) предложена схема проведения пренатальной диагностики в ранние сроки беременности с использованием трансвагинальной эхографии и трансцервикальной эмбриоскопии. Исследование рекомендуется проводить в два этапа. На 1-м этапе всем беременным в I триместре проводится трансвагинальная эмбриосонография, в ходе которой проводится измерение эмбриофетометрических показателей с последующей качественной оценкой анатомических структур эмбри- она/плода, выявлением маркеров хромосомной патологии (толщина воротникового пространства, соответствие копчико-теменного
размера сроку гестации, длина костей носа плода, частота сердечных сокращений плода), а также допплерометрией (исследование кровотока в венозном протоке, артерии и вене пуповины). На 2-м этапе всем обследованным проводили эндоскопическую визуализацию плодного яйца - трансцервикальную эмбриоскопию, которую осуществляют с помощью эндовидеокомплекса, обеспечивающего проецирование изображения на экран монитора в 6-8-кратном увеличении (рис. 15).
 Рис. 15. Трансцервикальная эмбриоскопия. 10 нед. гестации. Сформированы верхние и нижние конечности плода
Рис. 15. Трансцервикальная эмбриоскопия. 10 нед. гестации. Сформированы верхние и нижние конечности плода
Амниоскопия. Для изучения состояния околоплодных вод и плода во время беременности применяют амниоскопию - трансцервикальный осмотр нижнего полюса плодного пузыря. Этот метод предложил E.M. Saling в 1962 г. Для проведения исследования применяют амниоскоп длиной 20-25 см, диаметром 12-20 мм в зависимости от раскрытия шейки матки. Осмотр проводят на гинекологическом кресле в положении женщины с приведенными к животу ногами. В асептических условиях в цервикальный канал вводят амниоскоп с мандреном до нижнего полюса плодного яйца, затем мандрен удаляют и включают осветительную систему. При неосложненном течении беременности выделяется достаточное количество светлых, прозрачных, опалесцирующих околоплодных вод с наличием белой сыровидной смазки. Недостаточное количество вод, обнаружение
мекония и зеленоватая их окраска указывают на гипоксию плода, обнаружение околоплодных вод коричневого цвета свидетельствует о внутриутробной гибели плода.
Амниоскопию следует производить с 37-й нед беременности при подозрении на внутриутробную гибель плода и его гемолитическую болезнь, низкое расположение плаценты, при гестозе, у пожилых первородящих, отягощенном акушерско-гинекологическом анамнезе, хронической фетоплацентарной недостаточности, аномалиях сердечной деятельности плода, перенашивании беременности.
При амниоскопии могут наблюдаться осложнения, в частности разрыв плодных оболочек, кровяные выделения в результате травматизации слизистой оболочки цервикального канала или повреждения сосудов в месте отслоения плодных, инфицирование родовых путей, возникновение преждевременных родов.
Амниоскопия противопоказана при предлежании плаценты, воспалительных заболеваниях влагалища и шейки матки.
Показания к обследованию с применением инвазивных методов в I триместре мало отличаются от показаний во II триместре беременности. Согласно традиционным принципам формирования среди беременных группы риска, угрожаемой по рождению детей с врожденной и наследственной патологией, инвазивные исследования следует предлагать:
• беременным в возрасте 35 лет и старше;
• пациенткам с отягощенным анамнезом (рождение детей с хромосомной патологией или с моногенными заболеваниями, подлежащими дородовой диагностике);
• семьям, в которых один из супругов является носителем хромосомной перестройки или оба супруга - носителями генной мутации;
• беременным, у которых при эхографии выявлены ультразвуковые маркеры хромосомной патологии (например, расширение воротникового пространства);
• беременным, у которых при проведении скрининговых биохимических исследований зарегистрированы отклонения сывороточных маркеров крови.
Существует несколько классификаций инвазивных методов исследования во время беременности:
• по характеру доступа (транцервикальный, транабдоминальный);
• по технике получения материала (путем аспирации, путем биопсии);
• по характеру контроля за проведением процедуры (под ультразвуковым контролем, под контролем эндоскопических приборов);
• по характеру получаемого материала (ворсины хориона, околоплодные воды, кровь из пуповины).
В настоящее время, согласно рекомендациям Европейской Ассоциации пренатальной медицины, в зависимости от срока беременности проводятся следующие процедуры:
*9-12 нед - биопсия ворсин хориона (трансцервикальная или трансабдоминальная).
• 13-14 нед - возможно проведение раннего амниоцентеза, однако риск осложнений при использовании данного метода достаточно высок. Самопроизвольное прерывание беременности наблюдается в 3,8 до 5,3%, а неудачи культивирования клеток, полученных из околоплодных вод, составляют порядка 11-12%.
• 15-17 нед - амниоцентез и ранний плацентоцентез.
• 18 нед и более - кордоцентез, амниоцентез, плацентоцентез.
Проведение всех инвазивных процедур в России регламентируется Приказом Минздрава от 28.12.2000 г. Инвазивные вмешательства проводят только с согласия беременной под контролем ультразвукового исследования после обязательного гинекологического обследования женщины при ее удовлетворительном состоянии. К относительным противопоказаниям для проведения инвазивных вмешательств относят в I триместре угрожающее прерывание беременности с кровянистыми выделениями, наличие множественных миоматозных узлов в матке, предшествующие лапаротомии и операции на матке, воспалительные заболевания с повышением температуры тела. Эти же факторы учитывают и при проведении кордоцентеза, хотя, по утверждению некоторых авторов, абсолютных противопоказаний для забора крови из вены пуповины плода не существует. Среди возможных осложнений инвазивных процедур прежде всего следует отнести кровомазание и кровотечение (1-4%), внутриматочную инфекцию и сепсис (0,2-0,5%). Раннее проведение аспирации ворсин хориона сопряжено с риском возникновения редукции конечностей и оромандибулярной гипогенезией. К осложнениям кордоцентеза относят транзиторную брадикардию (у 18,3%), кровотечение из места пункции, воспалительные осложнения (0,6-2,91%),
потери плодов после проведения процедуры (2-2,5%). Как видно из представленных данных, несмотря на высокую диагностическую ценность, проведение инвазивных процедур требует тщательной оценки как возможного риска рождения больного ребенка, так и риска осложнений беременности при нормальном кариотипе плода.
Амниоцентез. С целью получения околоплодных вод для исследования производят пункцию амниотической полости - амниоцентез. Для этого используют несколько способов забора околоплодных вод: трансабдоминальный, трансвагинальный, трансцервикальный. Амниоцентез производят начиная с 16-й нед беременности. Его применяют для оценки зрелости легких плода, латентной внутриутробной инфекции, при подозрении на врожденные аномалии развития плода, его гемолитическую болезнь, перенашивание беременности, хроническую гипоксию плода (рис. 16).
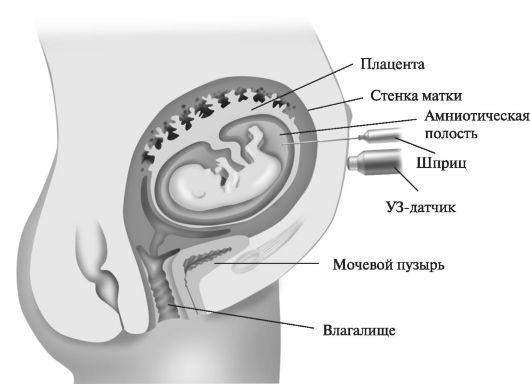 Рис. 16. Амниоцентез
Рис. 16. Амниоцентез
С помощью амниоцентеза изучают биохимический и бактериологический состав, кислотно-основное состояние околоплодных вод, а также производят диагностику генетических заболеваний, что позволяет выработать тактику дальнейшего ведения беременности.
Биопсия ворсин хориона. Операция, цель которой заключается в получении клеток ворсинчатого хориона для кариотипирования плода и определения хромосомных и генных аномалий (в том числе определение наследственно обусловленных нарушений метаболизма). Взятие проб проводится трансцервикально или трансабдоминально в сроки от 8 до 12 нед беременности под контролем ультразвука. В полость матки вводят стерильный полиэтиленовый гибкий катетер (длиной 26 см и внешним диаметром 1,5 мм) и осторожно, под визуальным контролем, продвигают к месту локализации плаценты и далее между стенкой матки и плацентарной тканью. Затем шприцем, объемом 20 мл, содержащим 3-4 мл питательной среды с гепарином, соединенным с вакуумной помпой, хориальная ткань аспирируется и в дальнейшем исследуется. Возможно взятие проб хориальной ткани и в случаях дихориальной двойни. Осложнениями биопсии ворсин хориона могут быть внутриматочная инфекция, кровотечения, самопроизвольные выкидыши, образование гематом. К более поздним осложнениям относятся преждевременные роды, низкий вес новорожденных (<2500 г), пороки развития плода. Перинатальная смертность достигает 0,2-0,9%.
Кордоцентез. Операция, цель которой получение проб крови плода путем пункции вены пуповины под контролем ультразвука, при этом возможно быстрое кариотипирование плода и иммунологические исследования. Предварительно проводится тщательное ультразвуковое исследование для определения признаков жизни плода, локализации плаценты, позиции и вида позиции плода, объема околоплодных вод. Определяется место пункции и траектория введения пункционной иглы. Затем, после обработки передней брюшной стенки антисептическим раствором, под местной анестезией производится пункция передней брюшной стенки иглой, соединенной с ультразвуковым датчиком. Обычно берется 2 мл крови плода из вены пуповины соединенным с пункционной иглой шприцем. После извлечения иглы ультразвуковое наблюдение за плодом ведется еще 4-5 мин для исключения возможных кровотечений. После операции женщина находится в стационаре еще 6-12 ч. Перед выпиской повторно проводится ультразвуковое исследование и кардиотокография (после 32 нед). Получить «чистую» (без примеси крови матери) порцию крови плода удается в 95-97%. Относительными противопоказаниями для кордоцентеза являются маловодие, многоводие, неудачное расположение плода. Потенциальные осложнения (1-2%) -
хорионамнионит, излитие околоплодных вод, резус-иммунизация, кровотечения у плода, гематома сосудов пуповины, внутриутробная задержка роста плода.
ЭЛЕКТРО- И ФОНОКАРДИОГРАФИЯ ПЛОДА
В настоящее время одними из достаточно распространенных методов оценки сердечной деятельности плода являются электрокардиография (ЭКГ) и фонокардиография (ФКГ). Различают прямую и непрямую ЭКГ плода. Непрямую ЭКГ проводят при наложении электродов на переднюю брюшную стенку беременной женщины. Этот метод используют преимущественно в антенатальном периоде. При таком виде регистрации кривая ЭКГ состоит только из желудочкового комплекса, иногда записывается зубец Р. Непрямую ЭКГ используют после 32 нед беременности. ЭКГ записывают при наложении электрода непосредственно на головку плода во время родов при открытии шейки матки на 3 см и более. Прямая ЭКГ характеризуется наличием предсердного зубца Р, желудочкового комплекса QRS и зубца Т.
При анализе антенатальной ЭКГ определяют частоту сердечных сокращений, характер ритма, величину и продолжительность желудочкового комплекса, а также его форму. В норме сердечный ритм плода правильный, частота сердечных сокращений колеблется от 120 до 160 уд/мин. Зубец R заострен, продолжительность желудочкового комплекса составляет 0,03-0,07 с, вольтаж колеблется от 9 до 65 мкВ, с увеличением срока беременности отмечается его постепенное повышение. Прямая запись позволяет оценивать все показатели ЭКГ. В конце беременности продолжительность зубца Р составляет 0,06-0,07 с, интервала P-Q - 0,08-0,12 с, интервала S-T - 0,04-0,05 с, зубца Т - около 0,14 с.
ФКГ регистрируется при наложении микрофона в точку наибольшего прослушивания сердцебиения плода. Фонокардиограмма обычно представлена двумя группами осцилляций, которые отражают I и II тоны сердца, иногда регистрируются III и IV тоны. Колебания продолжительности и амплитуды тонов сердца весьма вариабельны в III триместре беременности и составляют в среднем: I тон - 0,09 с (0,06-0,13 с), II - 0,07 с (0,05-0,09 с).
Наиболее информативной является одновременная регистрация ЭКГ и ФКГ плода и их сопоставление, что дает возможность прове-
дения фазового анализа сердечной деятельности. Вычисляют фазу асинхронного сокращения, механическую систолу, общую систолу и диастолу. Фаза асинхронного сокращения выявляется между началом зубца Q и I тоном длительностью 0,02-0,05 с. Механическая систола представляет собой расстояние между началом I и II тона и продолжается 0,15-0,22 с. Общая систола включает механическую систолу и фазу асинхронного сокращения и составляет 0,17-0,26 с. Диастолу высчитывают как расстояние между II и I тоном, имея численные значения в пределах 0,15-0,25 с. Важен также расчет соотношения длительности общей систолы к длительности диастолы, который в конце неосложненной беременности составляет в среднем 1,23 с.
Применение ЭКГ и ФКГ оказывает существенную роль в диагностике гипоксии плода и патологии пуповины. Нарушение проводимости ритма сердца при гипоксии плода характеризуется удлинением и изменением зубца Р, увеличением интервала P-Q, а также желудочкового комплекса до 0,06 с и более. Кроме того, внутриутробная гипоксия плода характеризуется изменением структуры сердечных комплексов: становится плоским или отрицательным сегмент S-T, появляется расщепление зубца R и др.
Установить гипоксическое повреждение миокарда плода позволяет также фазовый анализ сердечной деятельности. Поскольку изменения фаз сокращения возникают раньше других нарушений миокарда, длительности механической систолы следует уделять особое внимание. При внутриутробной гипоксии вследствие нарушения в первую очередь проводимости и сократительной способности сердечной мышцы отмечается отклонение длительности механической систолы от нормальных величин более чем на ±0,02 с.
При гемолитической болезни плода нередко отмечается удлинение диастолы, удлинение и умеренное снижение желудочкового комплекса, что свидетельствует о нарушении внутрижелудочковой проводимости. При отечной форме обнаруживается резкое снижение амплитуды и тонов комплекса QRS вследствие выраженных дистрофических изменений в миокарде. К особенностям ФКГ плода при тяжелой форме заболевания относится появление сердечных шумов.
Патологические изменения пуповины в антенатальном периоде характеризуются появлением систолического шума и неравномерностью амплитуды сердечных тонов. При переношенной беремен-
ности отмечается повышение комплекса QRS, а также деформация и расщепление зубца R.
С использованием ЭКГ и ФКГ стало возможным также антенатально диагностировать многие врожденные нарушения сердечного ритма. Следует отметить, что если синусовая тахикардия или экстрасистолия выявляется как изолированный феномен, то это обычно не свидетельствует о нарушении состояния плода. При серьезных нарушениях ритма (полная атриовентрикулярная блокада) более чем в 50% случаев отмечаются врожденные пороки сердца.
НЕИНВАЗИВНЫЕ МЕТОДЫ КАРИОТИПИРОВАНИЯ ПЛОДА
В последние годы, в связи с наличием осложнений при проведении инвазивных процедур, направленных на получение клеток плода для последующего непосредственного генетического исследования, возрастает интерес к новому неинвазивному подходу в пренатальной диагностике - исследованию клеток плода, находящихся в периферической крови беременных женщин. E. dayton, W. Feldhays в 1964 г. показали, что с ранних этапов нормально протекающей беременности происходит процесс трансплацентарного переноса плазмы, форменных элементов крови и трофобластов плода в кровеносное русло матери. Клетки миелоидного ряда (так называемой белой крови) и трофобласты могут депонироваться в кроветворных органах матери и персистировать в ее кровеносном русле в течение длительного времени после родов. Клетки эритроидного ростка (эритробласты плода) не сохраняются в организме матери и не должны присутствовать в крови взрослого здорового человека, поэтому эритробласты являются оптимальным объектом генетического исследования плода при неинвазивном подходе к пренатальной диагностике. Концентрация клеток плода в клетках крови матери очень низкая - одна ядерная клетка встречается среди 105-108 ядерных клеток крови матери. Это состояние материнского организма принято обозначать термином «микрохимеризм», наличие которого создает во время беременности определенную толерантность матери по отношению к развивающемуся плоду. Низкая концентрация клеток плода в крови матери требует для их использования в диагностических целях многоэтапных и высокочувствительных методов обогащения, выявления и анализа. В связи с тем, что фоновая частота соматических анэуплоидных кле-
ток в нормальном организме человека не превышает 1-2%, обнаружение большего числа клеток с аномальным кариотипом позволяет диагностировать у плода хромосомную аберрацию.
В связи с абсолютной безопасностью данного метода для матери и плода исследователи проявляют к нему возрастающий интерес, так как при доказательстве его достоверности и надежности в перспективе этот подход можно рассматривать в качестве потенциального при проведении пренатальных генетических исследований. Наиболее часто применяемые методики включают в себя последовательное соблюдение нескольких этапов. Периферическую кровь матери предварительно центрифугируют в градиенте плотности и получают фракцию одноядерных клеток, обогащенную эритробластами плода. В дальнейшем сепарацию эритробластов плода проводят тремя методами: с использованием положительной проточной флюоресцентноактивированной клеточной сортировки (ФАКС) с моноклональными антителами CD71 и GPA, отрицательной магнитно-активированной клеточной сортировки (МАКС) с моноклональными антителами CD45 двухэтапного центрифугирования в двух градиентах плотности. Детекцию клеток плода осуществляют FISH-методом с Y-хромо- сомоспецифичным зондом, а также с ДНК-зондами на определенные центромерные участки хромосом. Несмотря на то, что клетки плода, присутствующие в крови беременных женщин, могут быть выделены всеми методиками, они значительно отличаются по трудоемкости, стоимости и воспроизводимости. В то же время многими исследователями отмечается значительная индивидуальная вариабельность концентрации клеток плода в крови матери. Кроме того, при попытках использовать клетки лимфоидного ряда плода была отмечена их способность депонироваться в кроветворных органах матери, делиться в них и персистировать в крови матери в течение длительного времени (до 27 лет) после родов. Это главная причина диагностических ошибок, в силу чего исследование лимфоцитов плода ограничено паритетом и возможно только при первой беременности у женщин. Убедительные результаты получены практически только для антенатального неинвазивного определения пола плода в случаях заболеваний, сцепленных с полом, при этом эффективность диагностики, по данным различных авторов, составила 87,5-100%.
Таким образом, несмотря на достаточно обширный спектр диагностических методов, применяемых в пренатальной диагностике, конкретные программы скрининга, проводимого в различных стра-
нах, определяются конкретными медико-социальными, экономическими и юридическими факторами. До сих пор ряд методик относится к разряду экспериментальных, однако, независимо от региона, наиболее значимыми тенденциями в развитии пренатальной медицины являются меньшая инвазивность, большая информативность, максимально ранние сроки обследования и минимальный риск для плода.