Руководство по кардиологии: учебное пособие в 3 т. / под ред. Сторожакова Г.И., Горбаченкова А.А. - 2009. - Т. 3. - 512 с.: ил.
|
|
|
|
ГЛАВА I НАРУШЕНИЯ РИТМА СЕРДЦА
Нарушения ритма сердца являются осложнением многих сердечно-сосудистых и экстракардиальных заболеваний. Возникновение аритмий часто значительно утяжеляет клиническое течение заболеваний и нередко является причиной смерти кардиологических больных. Вместе с тем существуют и абсолютно безопасные нарушения ритма. К основным клиническим формам аритмий относятся экстрасистолия, тахиаритмии, синдром слабости синусового узла и атриовентрикулярные блокады. Для уточнения характера и точного диагноза аритмий используют специальные способы исследования: ЭКГ, суточное мониторирование ЭКГ, программированную электрическую стимуляцию сердца, усреднение сигнала ЭКГ. Для лечения больных с нарушениями ритма сердца применяют антиаритмические препараты и немедикаментозные способы: катетерная аблация аритмогенных участков миокарда, электрокардиостимуляция, электрическая кардиоверсия и дефибрилляция. В большинстве случаев с помощью лечебных мероприятий удается достигнуть частичного или полного клинического эффекта, однако применение любых способов лечения нарушений ритма сердца сопряжено с повышенным риском осложнений и неблагоприятных исходов. Вылечить аритмию можно, если причина возникновения ее известна и устранима с помощью тех или иных лечебных мероприятий. К сожалению, в большинстве случаев причина аритмии является или неизвестной, или неустранимой.
Ключевые слова: нарушения ритма сердца, аритмии, диагностика, лечение.
Нарушения ритма сердца (аритмии) являются одним из самых сложных разделов клинической кардиологии. Отчасти это объясняется тем, что для диагностики и лечения аритмий необходимо очень хорошее знание электрокардиографии, отчасти - огромным
разнообразием аритмий и большим выбором способов лечения. При внезапных аритмиях нередко требуется проведение неотложных мероприятий. Желудочковые тахиаритмии являются основной причиной внезапной смерти. Значительные трудности представляет предупреждение рецидивирования нарушений ритма. Более того, лечебные мероприятия, направленные на устранение аритмии, сами могут вызвать усиление аритмии и тяжелые осложнения. В последние годы существенно изменились принципы медикаментозного лечения аритмий, значительное распространение получили методы инвазивного лечения, имплантация кардиовертеров-дефибрилляторов.
ОПРЕДЕЛЕНИЕ ОСНОВНЫХ ПОНЯТИЙ И ТЕРМИНОВ, ИСПОЛЬЗУЕМЫХ ДЛЯ ХАРАКТЕРИСТИКИ НАРУШЕНИЙ РИТМА
1. Синусовый ритм - нормальный ритм сердца. На ЭКГ регистрируется синусовый зубец Р (положительный во II отведении), предсердные импульсы проводятся к желудочкам.
2. Экстрасистолы - преждевременные сокращения.
3. Эктопические сокращения и ритмы - сокращения и ритмы несинусового происхождения (т.е. не из синусового узла, например, «ритм атриовентрикулярного соединения»).
4. Асистолия - прекращение сокращений предсердий и/или желудочков (короткий эпизод асистолии называют паузой).
5. Выскальзывающие сокращения - сокращения (комплексы ЭКГ несинусового происхождения), появляющиеся после паузы.
6. Выскальзывающие ритмы - эктопические ритмы с частотой менее 60 в минуту.
7. Брадикардия - частота сердечных сокращений менее 60 в минуту.
8. Ускоренные эктопические ритмы - эктопические ритмы с частотой от 60 до 100 в минуту.
9. Тахикардия - частота сокращений предсердий или желудочков более 100 в минуту.
10. Трепетание - частота сокращений предсердий или желудочков более 250-300 в минуту, «пилообразная» форма комплексов на ЭКГ (волны трепетания).
11. Фибрилляция - полностью дезорганизованная электрическая и механическая активность предсердий или желудочков (фибрилляцию предсердий называют мерцанием).
12. Блокада - замедление или прекращение проведения через тот или иной отдел сердца.
13. Преждевременное возбуждение желудочков - начало деполяризации желудочков раньше, чем это происходит при нормальном проведении импульсов (укорочение интервала РR).
14. Атриовентрикулярная (АВ) диссоциация - независимые сокращения предсердий и желудочков.
ОСНОВНЫЕ КЛИНИЧЕСКИЕ ФОРМЫ
НАРУШЕНИЙ РИТМА
1. Экстрасистолия.
2. Тахиаритмии (тахикардии).
2.1. Наджелудочковые.
2.2. Желудочковые.
3. Синдром слабости синусового узла. 3.1. Синусовая брадикардия.
3.1. Синоатриальная блокада II степени.
4. Нарушения атриовентрикулярной и внутрижелудочковой проводимости.
4.1. Атриовентрикулярные блокады.
4.2. Внутрижелудочковые блокады.
4.3. Преждевременное возбуждение желудочков.
К клиническим формам нарушения ритма не относятся «чисто электрокардиографические» понятия, как например, выскальзывающие сокращения и ритмы, так как эти изменения сами по себе не являются первичными нарушениями ритма, они возникают вследствие замедления синусового ритма или АВ-блокады II-III степени; АВ-диссоциация - тоже всегда следствие, а не клиническая форма нарушения ритма.
По характеру клинического течения нарушения ритма могут быть острыми и хроническими, преходящими и постоянными. Для характеристики клинического течения тахиаритмий используют такие определения, как «пароксизмальные», «рецидивирующие», «непрерывно рецидивирующие».
Основными клиническими формами нарушений ритма сердца являются: экстрасистолия, тахиаритмии, синдром слабости синусового узла и атриовентрикулярные блокады
Причины возникновения нарушений ритма нередко очень трудно определить. К аритмогенным факторам относятся:
1) любые заболевания сердечно-сосудистой системы;
2) многие экстракардиальные заболевания (например, заболевания легких, поражения пищевода, тиреотоксикоз);
3) нарушения нейро-гуморальной регуляции, кислотно-щелочного равновесия, обмена электролитов;
4) алкогольное поражение сердца;
5) при выявлении нарушений ритма у лиц без признаков поражения сердечно-сосудистой системы и экстракардиальных нарушений используют термин «идиопатическое нарушение ритма».
Следует отметить, что даже у больных с явным заболеванием сердечно-сосудистой системы установить, является ли это заболевание причиной возникновения аритмии или оно просто сопутствующее, не всегда возможно.
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ
НАРУШЕНИЙ РИТМА
1. Нарушение образования импульсов.
1.1. По типу нормального автоматизма.
1.2. Возникновение патологического автоматизма.
1.3. Триггерная активность: ранние постдеполяризации, поздние постдеполяризации.
2. Повторный вход импульса.
2.1. По анатомически определенному пути.
2.2. Без анатомического субстрата: по типу ведущего круга, по типу отражения.
3. Блокада проведения импульсов.
Эти механизмы установлены и изучены в эксперименте. В клинических условиях точный электрофизиологический механизм определен только при некоторых вариантах аритмий, например, если установлено, что реципрокные атриовентрикулярные тахикардии
обусловлены механизмом повторного входа импульса («re-entry»), циркулирующего по анатомически определенному пути.
Электрофизиологические механизмы возникновения аритмий: нарушения автоматизма, триггерная активность и повторный вход импульсов
Клиническое значение определения точного электрофизиологического механизма аритмии в настоящее время невелико, так как подбор антиаритмической терапии проводится эмпирически, независимо от конкретного механизма, лежащего в основе нарушения ритма. Только при проведении хирургического лечения необходимо определение точной локализации «аритмогенного субстрата» - источника аритмии или путей циркуляции импульса.
КЛИНИЧЕСКИЕ СИМПТОМЫ НАРУШЕНИЙ РИТМА
К основным клиническим симптомам нарушений ритма относятся ощущение сердцебиения или перебоев в работе сердца. Кроме того, аритмии могут сопровождаться появлением головокружения или эпизодов потери сознания. Эпизоды потери сознания во время аритмий называют приступами Морганьи-Адемса-Стокса («приступы МЭС»). Тахиаритмии могут вызвать стенокардию напряжения у больных ИБС, а у больных с хронической сердечной недостаточностью во время пароксизмов тахикардии усиливается одышка, может развиться приступ удушья, вплоть до отека легких. Резко выраженные нарушения гемодинамики при аритмиях могут вызвать «аритмогенный» шок, фибрилляцию желудочков и внезапную смерть. В то же время у многих пациентов аритмии протекают абсолютно без симптомов или вызывают лишь ощущение легкого дискомфорта. Постоянные или непрерывно-рецидивирующие тахиаритмии могут быть причиной так называемой аритмогенной кардиомиопатии - увеличение размеров сердца и снижение фракции выброса с симптомами недостаточности кровообращения. Единственным способом лечения «аритмогенной кардиомиопатии» является восстановление нормального синусового ритма или урежение ЧСС.
Основными клиническими симптомами нарушений ритма являются: ощущение сердцебиения или перебоев в работе сердца, головокружение, эпизоды потери сознания
Физикальное обследование во время аритмии (пальпация пульсации артерий, аускультация) позволяет определить характер нарушения ритма: экстрасистолия, тахиаритмия или брадиаритмия, а регистрация ЭКГ во время аритмии позволяет установить точный диагноз формы нарушения ритма. В связи с тем, что многие аритмии носят преходящий характер, возможность регистрации нарушения ритма имеется далеко не всегда. В этих случаях основное значение имеют анамнез и применение дополнительных методов инструментального исследования.
СПЕЦИАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
К основным специальным методам исследования больных с нарушениями ритма относятся:
1) длительное мониторирование ЭКГ;
2) проба с физической нагрузкой;
3) чреспищеводная стимуляция сердца;
4) усреднение сигнала ЭКГ;
5) внутрисердечное электрофизиологическое исследование.
Длительное мониторирование ЭКГ
Длительное мониторирование ЭКГ обычно называют холтеров-ским мониторированием по имени изобретателя этого метода N.J. Holter, который в 1961 г. впервые его применил. Чаще всего ЭКГ регистрируют в течение суток, отсюда второе название - суточное мониторирование ЭКГ. Длительная регистрация ЭКГ в условиях обычной активностибольного позволяетвыявитьмногие преходящие изменения, которые «не улавливаются» при регистрации стандартной ЭКГ. В научно-клинических исследованиях применяют многосуточное мониторирование или дажемногомесячное мониторирование ЭКГ (с использованием имплантируемых рекордеров). При Холтеровском мониторировании (ХМ) ЭКГ регистриуется непрерывно или в прерывистом режиме - в моменты появления клинических симптомов
или бессимптомных аритмий. После завершения мониторирования производится автоматическая расшифровка полученных результатов на специальных приборах-дешифраторах. В любом случае врач осуществляет контрольный просмотр выделенных отклонений и при необходимости корректирует заключения автоматического анализа.
Во время ХМ чаще всего регистрируются нарушения ритма сердца. Проведение ХМ значительно расширило наши представления о границах нормы в плане аритмий. Так оказалось, что экстрасистолы, синусовая брадикардия, эктопические ритмы, синоатриальные и атриовентрикулярные блокады наблюдаются у многих здоровых людей. Условно можно считать, что у любого здорового человека могут регистрироваться до 200 наджелудочковых и до 200 желудучковых экстрасистол в течение суток, брадикардия во время сна может достигать 30 сокращений в минуту (кстати, первое исследование было проведено студентами-медиками), паузы при синоатриальной блокаде могут достигать 2-3 секунд, во время сна может регистрироваться атриовентрикулярная блокада II степени типа Мобитц-I (периодика Самойлова-Венкебаха).
ХМ проводится больным с клиническими симптомами, возможно, обусловленных преходящими нарушениями ритма, если аритмия не зарегистрирована на обычной ЭКГ. При редко возникающих симптомах перспективно использование прерывистых мониторов - включающихся только в момент возникновения симптомов (автоматических или включаемых самим больным).
Холтеровское мониторирование ЭКГ проводится больным с клиническими симптомами, возможно, обусловленными преходящими нарушениями ритма, если аритмия не зарегистрирована на обычной ЭКГ
Показаниями для проведения длительного мониторирования ЭКГ у больных с аритмиями являются:
1) приступы устойчивого сердцебиения;
2) обмороки неясной этиологии;
3) оценка эффективности антиаритмической терапии.
Проба с физической нагрузкой
Пробу с физической нагрузкой у больных с аритмиями применяют, если возникновение аритмии происходит во время нагрузки. В этих случаях можно зарегистрировать аритмию, определить ее характер и переносимость, с помощью повторных проб с физичесой нагрузкой оценить эффективность антиаритмического лечения. Очень важное значение имеет проба с физической нагрузкой в плане выявления ишемии миокарда и взаимосвязи между появлением признаков ишемии и возникновением нарушений ритма.
Показаниями к назначению пробы с физической нагрузкой у больных с аритмиями являются:
1) приступы внезапного устойчивого сердцебиения, возникающие во время физической нагрузки (или при психоэмоциональном напряжении);
2) подбор антиаритмической терапии больным с аритмиями, возникающими при физической нагрузке.
Чреспищеводная электростимуляция сердца
С помощью чреспищеводной электростимуляции сердца (ЧПЭС) можно индуцировать пароксизмальные наджелудочковые тахиаритмии (у больных со спонтанными приступами наджелудочковых тахиаритмий). При подозрении на синдром слабости синусового узла как причину эпизодов головокружения или обмороков выявление удлинения времени восстановления функции синусового узла (корригированное ВВФСУ более 600 мс) свидетельствует в пользу этого диагноза. Однако нормальные результаты пробы ни в коем случае не исключают наличия синдрома слабости синусового узла. Среди больных с предвозбуждением желудочков с помощью чреспищеводной стимуляции можно выделить больных с низким риском - у которых максимальная ЧСС во время индуцированного приступа мерцательной аритмии (или во время стимуляции предсердий с частотой до 300 импульсов в минуту и более) не превышает 250 уд/мин. С другой стороны, если максимальная ЧСС превышает 250 уд/мин, нельзя исключить возможность очень высокой ЧСС в случае спонтанного возникновения мерцательной аритмии и опасностью появления выраженных нарушений гемодинамики или даже трансформации в фибрилляцию желудочков. Наконец, чреспищеводную стимуляцию сердца удобно использовать для ускорения
подбора антиаритмической терапии больным с относительно редко возникающими, но достаточно тяжелыми приступами наджелудочковых тахиаритмий (при частых или легко переносимых приступах нет необходимости в искусственной индукции тахиаритмии). Кроме того, при проведении ЧПЭС возможно выявление ишемии миокарда и ее связи с возникновением аритмии.
Показаниями для проведения чреспищеводой электростимуляции сердца у больных с аритмиями являются:
1) приступы устойчивого сердцебиения;
2) обмороки неясной этиологии;
3) оценка риска возникновения мерцательной аритмии с высокой ЧСС у больных с преждевременным возбуждением желудочков;
4) подбор антиаритмической терапии больным с пароксизмальными наджелудочковыми тахиаритмиями.
Усреднение сигнала ЭКГ
Метод усреднения сигналов ЭКГ («ЭКГ высокого разрешения» - компьютерное усреднение, фильтрация и усиление 150-300 последовательных циклов) позволяет зарегистрировать так называемые поздние потенциалы желудочков - низкоамплитудную высокочастотную электрическую активность в конце комплексов QRS и начале сегмента ST. Поздние потенциалы являются отражением наличия в миокарде участков замедленного проведения импульсов, которые могут быть аритмогенным субстратом для возникновения аритмий по типу повторного входа импульса («re-entry»).
Применение метода усреднения сигнала ЭКГ позволяет провести оценку вероятности возникновения пароксизмальной желудочковой тахикардии у больных, перенесших инфаркт миокарда, или у больных с приступами устойчивого сердцебиения или обмороками неясной этиологии. Во всех этих случаях гораздо большее значение имеет отрицательный результат - в этом случае вероятность желудочковой тахикардии очень низка. А положительные результаты - выявление поздних потенциалов лишь свидетельствует о наличии потенциально аритмогенного субстрата, который может быть следствием любого органического повреждения миокарда.
Показания для проведения метода усреднения сигнала ЭКГ:
1. Оценка вероятности желудочковой тахикардии как причины обмороков неясной этиологии.
2. Выявление аритмогенного субстрата у больных с повышенным риском возникновения желудочковых тахиаритмий.
Внутрисердечное электрофизиологическое исследование
Для проведения внутрисердечного электрофизиологического исследования в полости сердца вводятся один или несколько зондов - электродов для регистрации внутрисердечных электрограмм и электрической стимуляции сердца. С помощью электростимуляции можно индуцировать наджелудочковую и желудочковую тахикардию у больных со спонтанными приступами. Это облегчает процесс подбора антиаритмического лечения: невозможность повторной индукции тахикардии на фоне приема того или другого антиаритмического препарата является признаком эффективности этого препарата и при длительном приеме. При тяжелых, рефрактерных к медикаментозной терапии желудочковых тахиаритмиях во время электрофизиологического исследования проводится картирование для определения локализации источника тахикардии (аритмогенного субстрата или критического участка пути циркуляции импульса) и последующего хирургического лечения. У больных с наджелудочковыми тахиаритмиями внутрисердечное электрофизиологическое исследование проводится только, если показано хирургическое лечение тахиаритмии, так как практически все вопросы, связанные с диагностикой и медикаментозным лечением наджелудочковых тахиаритмий, можно решить с помощью чреспищеводной электростимуляции сердца.
Во время электрофизиологического исследования проводится программированная электростимуляция сердца с целью оценки функционального состояния проводящей системы сердца, индукции тахиаритмий, определения локализации аритмогенного субстрата, механизма аритмии и выбора способа лечения
Показаниями к проведению электрофизиологического исследования являются:
1) подбор терапии больным с относительно редкими, но тяжело протекающими приступами желудочковой тахикардии (в том числе реанимированным после внезапной смерти);
2) обмороки неясной этиологии;
3) проведение хирургического лечения аритмий;
4) имплантация кардиостимулятора или кардиовертера-дефибриллятора больным с тахиаритмиями.
ЛЕЧЕНИЕ НАРУШЕНИЙ РИТМА СЕРДЦА
Показания для лечения нарушений ритма:
1. Выраженные нарушения гемодинамики.
2. Субъективная непереносимость аритмии.
3. Бессимптомные, но потенциально опасные для жизни аритмии (например, при синдромах удлиненного QT).
Безопасные, бессимптомные и малосимптомные легко переносимые аритмии не требуют назначения специального антиаритмического лечения. В этих случаях основным лечебным мероприятием является рациональная психотерапия.
Методы лечения нарушений ритма:
1. Лечение основного заболевания и коррекция возможных аритмогенных факторов.
2. Антиаритмические препараты.
3. Электроимпульсная терапия (кардиоверсия и дефибрилляция).
4. Электрокардиостимуляция.
5. Хирургические способы лечения аритмий.
Антиаритмические препараты
Основным способом лечения аритмий является применение антиаритмических препаратов. Хотя антиаритмические препаты не могут «вылечить» от аритмии, они могут уменьшить аритмическую активность или предотвратить рецидивирование аритмий. После отмены антиаритмических препаратов нарушения ритма, как правило, возобновляются. Большинство антиаритмических препаратов имеют довольно много неприятных побочных эффектов. Поэтому больной выбирает, что лучше - жить без аритмии на фоне приема антиаритмического препарата (если препарат эффективен) или отменить препарат и терпеть нарушения ритма.
Применение антиаритмических препаратов является основным способом лечения аритмий. Лечение назначают, если аритмия вызывает нарушения гемодинамики, субъективно плохо переносится или является прогностически неблагоприятной, т.е. опасной для жизни
Наиболее распространенной классификацией антиаритмических препаратов является классификация Вогана Вильямса, согласно которой все антиаритмические препараты подразделяются на 4 класса:
I класс - блокаторы натриевых каналов;
II класс - блокаторы бета-адренергических рецепторов;
III класс - препараты, увеличивающие продолжительность потенциала действия и рефрактерность миокарда;
IV класс - блокаторы кальциевых каналов.
Эта классификация основана на различиях в механизмах действия и изменениях электрофизиологических свойств изолированных клеток миокарда под влиянием антиаритмических препаратов в эксперименте. Подавляющее большинство препаратов относятся к I классу. Препараты I класса дополнительно подразделяют на 3 подкласса: I «А», I «В» и I «С». Все препараты I класса за счет блокады натриевых каналов замедляют скорость деполяризации (а значит, и скорость проведения импульсов) в рабочем миокарде предсердий и желудочков, в системе Гиса-Пуркинье. Но при этом наиболее выраженное замедление скорости деполяризации вызывают препараты класса I «С». Препараты класса I «А», кроме замедления проведения, увеличивают продолжительность эффективного рефрактерного периода.
Антиаритмический эффект бета-блокаторов (класс II) происходит вследствие антиадренергического действия. Антиаритмические препараты класса III устраняют аритмии за счет увеличения продолжительности рефрактерных периодов во всех отделах сердца.
Классификация Вогана Вильямса, даже в современной модификации, не позволяет проводить целенаправленный выбор антиаритмических препаратов для лечения аритмий в клинических условиях. Действие препаратов в условиях целостного организма нередко отличается от предполагаемого. Изменения электрофизиологических свойств миокарда при различных патологических состояниях могут значительно изменить характер действия антиаритмических препаратов. Наконец, многие антиаритмические препараты прояв-
ляют свойства сразу нескольких (или даже всех) классов, например амиодарон (кордарон).
Попытки усовершенствования классификации ААП предпринимались неоднократно, наиболее известной из таких попыток является так называемый Сицилианский гамбит. Ведущие специалисты по аритмиям собрались в Сицилии и предприняли попытку связать воедино данные теоретических, экспериментальных и клинических исследований, весь спектр знаний о механизмах возникновения аритмий и действии антиаритмических препаратов. Свой доклад они назвали «Сицилианский гамбит» (Сицилия, 1990 г.), по аналогии с королевским гамбитом в шахматах, использование которого предоставляет шахматисту «широкий выбор агрессивных действий». Это был действительно «мозговой штурм» проблемы лечения нарушений ритма. Этот доклад является прекрасным обзором и систематизацией современных представлений об электрофизиологии сердца, механизмах возникновения аритмий и действии антиаритмических препаратов. В Сицилианском гамбите суммированы и систематизированы все, известные к настоящему времени сведения о действии ААП (в том числе на клеточном и субклеточном уровне). Каждый ААП имеет свое собственное место с учетом всех особенностей его действия. Однако практического значения Сицилианский гамбит не имеет. При попытках его использования в практической работе создается иллюзия определенности там, где ее нет. Это по сути ситуация, когда при исходно очень грубых измерениях, потом начинают считать до пятого знака после запятой. Новый подход направлен на повышение эффективности дальнейших научных исследований по проблеме нарушений ритма сердца и может способствовать пониманию различных аспектов проблемы медикаментозного лечения аритмий.
Антиаритмические препараты устраняют нарушения ритма вследствие изменения электрофизиологических свойств миокарда: замедления скорости проведения и/или удлинения рефрактерных периодов в различных структурах сердца
Кроме перечисленных антиаритмических препаратов, при лечении аритмий нередко используют препараты, не вошедшие в классификацию: дигоксин, препараты калия и магния, в/в введение АТФ или аденозина, карбамазепин. При брадиаритмиях применяют атропин, симпатомиметики, эуфиллин.
Антиаритмические препараты не излечивают от аритмии - не ликвидируют аритмогенный субстрат. Они устраняют нарушения ритма, изменяя электрофизиологические свойства миокарда и частоту сердечных сокращений. При этом любое действие антиаритмических препаратов может вызывать как антиаритмический, так и аритмогенный эффект (т.е., наоборот, способствовать возникновению или продолжению аритмии). Вероятность антиаритмического эффекта для большинства препаратов составляет в среднем 40-60% (и очень редко у некоторых препаратов при отдельных вариантах аритмии достигает 90%). Вероятность аритмогенного эффекта в среднем около 10%, причем аритмогенный эффект может проявляться в виде возникновения опасных для жизни аритмий. К наиболее серьезным осложнениям антиаритмической терапии относятся возникновение опасных для жизни желудочковых аритмий, например, желудочковой тахикардии типа «пируэт» (аритмогенный эффект). Тахикардия типа «пируэт» чаще всего наблюдается на фоне приема препаратов, удлиняющих интервал QT: хинидина, новокаинамида, дизопирамида и соталола. В нескольких клинических исследованиях было выявлено заметное повышение общей смертности и частоты случаев внезапной смерти (в 2-3 раза и более) больных с органическим поражением сердца (постинфарктный кардиосклероз, гипертрофия или дилатация сердца) на фоне приема антиаритмических препаратов класса I, несмотря на эффективное устранение аритмий. У больных с тяжелыми желудочковыми аритмиями и выраженным поражением миокарда эффективность антиаритмических препаратов снижается, а частота аритмогенного действия значительно возрастает. В этих случаях вероятность аритмогенного действия препаратов I класса иногда превышает вероятность антиаритмического эффекта!
Побочные действия самого различного характера и степени выраженности нередко возникают на фоне приема любого антиаритмического препарата. Наиболее часто наблюдаются расстройства желудочно-кишечного тракта, нарушения центральной нервной системы. Выраженность побочных явлений, как правило, зависит от дозы и нередко уменьшается через несколько дней или недель приема препарата. Наиболее опасным, но редким осложнением длительного приема амиодарона является развитие интерстициального фиброза легких (как правило, на фоне длительного приема сравнительно высоких доз - 400 мг в день и более).
Антиаритмические препараты, кроме положительного антиаритмического действия, могут вызывать нежелательные побочные явления или даже аритмогенный эффект
Отрицательным влиянием на гемодинамику обладают дизопирамид (ритмилен) и бета-блокаторы. Эти препараты значительно снижают сократимость миокарда и, кроме того, одновременно повышают периферическое сопротивление сосудов. В результате, на фоне приема дизопирамида или бета-блокаторов нередко отмечается появление или усиление признаков сердечной недостаточности. Остальные антиаритмические препараты в меньшей степени снижают сократимость миокарда, к тому же большинство из них являются вазодилататорами, поэтому серьезные нарушения гемодинамики при лечении антиаритмическими препаратами (за исключением дизопирамида и бета-блокаторов) наблюдаются редко. Есть данные, свидетельствующие о том, что кордарон, например, даже обладает положительным инотропным действием.
В то же время бета-блокаторы, при назначении очень небольших доз с последующим постепенным увеличением дозы, являются препаратами выбора при сердечной недостаточности. Бета-блокаторы
Таблица 1.1
Основные антиаритмические препараты
 Таблица 1.2
Таблица 1.2
Антиаритмические препараты (в/в введение)
Препарат | Форма | Суточная доза |
Новокаинамид | Амп. 1 г | 0,5-1,5 г за 20-50 мин |
Дизопирамид | Амп. 50 мг | 150 мг за 3-5 мин |
Этмозин | Амп. 50 мг | 150 мг за 3-5 мин |
Лидокаин | Амп. 40 мг | 100 мг за 3-5 мин |
Пропранолол | Амп. 5 мг | 5 мг за 5 мин |
Амиодарон | Амп. 150 мг | 300-400 мг за 10-15 мин |
Верапамил | Амп. 5 мг | 5-10 мг за 1-3 мин |
АТФ | Амп. 10 мг | 10 мг за 1-3 с |
Аденозин | Амп. 6 мг | 6 мг за 1-3 с |
Магния сульфат | Амп. 2,5 г | 2,5 г за 2-5 мин |
Нибентан | Амп. 20 мг | 5-10 мг за 5-10 мин |
Таблица 1.3
Антиаритмические препараты (прием внутрь)
Препарат | Форма | Суточная доза |
Хинидин | 0,25 г | 0,75-1,5 г/ сут |
Новокаинамид | 0,25г | 3,0-6,0 г/сут |
Дизопирамид | 0,1 г | 0,4-0,8 г/сут |
Этмозин | 0,1 г | 0,6-1,2 г/сут |
Этацизин | 0,05 г | 0,15-0,2 г/сут |
Аллапинин | 0,025 г | 0,075-0,125 г/сут |
Пропафенон | 0,15 г | 0,45-0,6 г/сут |
Пропранолол | 0,04 г | 0,08-0,24 г/сут |
Атенолол | 0,05 г | 0,1-0,2 г/сут |
Амиодарон | 0,2 г | По 0,6-1,0 г/сут в течение 5-10 дней, далее по 0,2 г/сут |
Соталол | 0,08-0,16 г | 0,16-0,32 г/сут |
Верапамил | 0,04 г | 0,24-0,32 г/сут |
и кордарон являются единственными препаратами, на фоне приема которых отмечено снижение частоты внезапной смерти и общей
смертности у больных с постинфарктным кардиосклерозом и с сердечной недостаточностью.
При обсуждении антиаритмических препаратов следует отдельно остановиться на некоторых особенностях применения амиодарона. Амиодарон обладает уникальными фармакокинетическими свойствами. Кроме приведенной в таблице схемы лечения амиодароном, существует множество других. Одна из схем: прием амиодарона в течение 1-3 недель по 800-1600 мг/сут (т.е. по 4-8 таблеток в день), далее прием по 800 мг (4 таблетки) в течение 2-4 недель, после этого
- по 600 мг/сут (3 таблетки) в течение 1-3 месяцев и после этого
- переход на поддерживающие дозы - 300 мг/сут и менее (титрование по эффекту до минимальных эффективных доз). Есть сообщения об эффективном применении очень высоких доз амиодарона - по 800-2000 мг 3 раза в день (т.е. до 6000 мг/сут - до 30 таблеток в день) у больных с тяжелыми, рефрактерными к другим способам лечения опасными для жизни желудочковыми аритмиями. Однократный прием амиодарона в дозе 30 мг/кг веса официально рекомендован как один из способов восстановления синусового ритма при мерцательной аритмии.
Применение комбинаций антиаритмических препаратов в ряде случаев позволяет достичь существенного повышения эффективности антиаритмической терапии. Одновременно отмечается уменьшение частоты и выраженности побочных явлений, вследствие того, что препараты при совместном назначении используют в уменьшенных дозах.
Следует отметить, что показаний для назначения так называемых метаболических препаратов больным с нарушениями ритма не существует. Эффективность «курсового» лечения такими препаратами, как кокарбоксилаза, АТФ, инозие-Ф, рибоксин, неотон и т.п. не отличается от плацебо. Исключением является препарат цитопротективного действия милдронат, так как есть данные об антиаритмическом эффекте милдроната при желудочковой экстрасистолии.
Принципы подбора антиаритмической терапии при постоянных или часто рецидивирующих аритмиях
С учетом безопасности антиаритмических препаратов оценку эффективности целесообразно начинать с бета-блокаторов или амиодарона. При неэффективности монотерапии оценивают эффект
сочетания амиодарона и бета-блокаторов. Если нет брадикардии или удлинения интервала PR, можно сочетать с амиодароном любой бета-блокатор. У больных с брадикардией к амиодарону добавляют пиндолол (вискен). Показано, что совместный прием амиодарона и бета-блокаторов в значительно большей степени снижает смертность у больных с сердечно-сосудистыми заболеваниями, чем каждый из препаратов в отдельности. Некоторые специалисты даже рекомендуют имплантацию двухкамерного стимулятора (в режиме DDDR) для безопасной терапии амиодароном в сочетании с бета-блокаторами. У больных с органическим поражением сердца антиаритмические препараты класса I назначают только при отсутствии эффекта от бета-блокаторов и/или амиодарона. При этом препараты класса I, как правило, назначают на фоне приема бета-блокатора или амиодарона. Кроме бета-блокаторов и амиодарона, больным с органическим поражением сердца возможно назначение соталола (бета-блокатора со свойствами препарата класса III). У больных с идиопатическими аритмиями (т.е. без признаков органического поражения сердца) возможно назначение любых антиаритмических препаратов в любой последовательности.
Электроимпульсная терапия
Электроимпульсная терапия (ЭИТ), или электрическая кардиоверсия и дефибрилляция, - самый эффективный метод восстановления синусового ритма при тахиаритмиях. Абсолютным показанием для проведения ЭИТ является возникновение тахиаритмий, сопровождающихся выраженными нарушениями гемодинамики. При возникновении фибрилляции желудочков ЭИТ является практически единственным способом восстановления ритма (дефибрилляция). В неотложных ситуациях, сопровождающихся потерей сознания, ЭИТ проводят максимально быстро без обезболивания. В менее неотложных ситуациях (при сохранении сознания больного) и при плановой ЭИТ применяют обезболивание с помощью в/в введения реланиума, тиопентала натрия, гексенала или других препаратов.
Для проведения ЭИТ на грудную клетку больного накладывают и плотно прижимают специальные электроды и набирают необходимую мощность разряда. При использовании энергии разряда в пределах 75-100 Дж, как правило, достаточно в/в введения реланиума. При наджелудочковых тахикардиях и трепетании предсердий
используют энергию разряда от 25 до 75 Дж, при желудочковой тахикардии - от 75 до 100 Дж, при мерцании предсердий - 200 Дж, при полиморфной желудочковой тахикардии и фибрилляции желудочков - 200-360 Дж.
Электрокардиостимуляция
Временную электрокардиостимуляцию (ЭКС) чаще всего используют при внезапных брадиаритмиях: при выраженных нарушениях функции синусового узла или АВ-блокадах II-III степени с продолжительными эпизодами асистолии, особенно, если возникают приступы Морганьи-Адемса-Стокса.
С помощью ЭКС возможно купирование пароксизмальных тахикардий. Чрезвычайно высока эффективность ЭКС при купировании пароксизмальных наджелудочковых тахикардий (почти 100%). Менее эффективно применение ЭКС для купирования трепетания предсердий и желудочковых тахикардий (40-80%).
Постоянную ЭКС с имплантацией кардиостимулятора также чаще используют у больных с брадиаритмиями (синдром слабости синусового узла или АВ-блокады II-III степени). Современные двухкамерные электрокардиостимуляторы, работающие в режиме DDDR, обеспечивают практически полную замену функции синусового узла и проводящей системы сердца. Показаниями к имплантации кардиостимулятора при брадиаритмиях являются:
1. Абсолютные:
- головокружения или предобморочные состояния;
- эпизоды потери сознания.
2. Относительные:
- признаки сердечной недостаточности;
- бессимптомная АВ-блокада II степени, тип II (Мобитц II);
- бессимптомная полная АВ-блокада дистального типа (на уровне системы Гиса-Пуркинье).
Намного реже используют имплантацию антитахикардиальных кардиостимуляторов - для купирования и/или предупреждения пароксизмальных тахикардий.
В наше время во многих странах все более широкое распространение получают имплантируемые кардиовертеры-дефибрилляторы (ИКД). Эти приборы чаще всего имплантируют больным с тяжелыми, рефрактерными к лечению желудочковыми тахиаритмия-
ми, особенно реанимированным больным, перенесшим внезапную смерть. Имплантируемые кардиовертеры-дефибрилляторы способны автоматически генерировать разряды при возникновении желудочковых тахиаритмий (1-2 Дж при желудочковой тахикардии и 25-35 Дж - при фибрилляции желудочков). Эффективность ИКД в предотвращении внезапной смерти гораздо выше, чем применение антиаритмических препаратов. При возникновении желудочковой тахиаритмии сразу автоматически проводится кардиоверсия или дефибрилляция.
Постоянная электрокардиостимуляция и дефибрилляция подробно обсуждаются в гл. 2 этого тома.
Хирургическое лечение аритмий
Хирургическое лечение показано больным с тяжелым течением наджелудочковых и желудочковых тахиаритмий, рефрактерных к медикаментозной антиаритмической терапии. Основными направлениями хирургического лечения аритмий являются:
1) удаление, разрушение или изоляция аритмогенного субстрата, или разрушение критического участка миокарда, необходимого для возникновения аритмии;
2) деструкция дополнительных путей проведения при синдроме Вольфа-Паркинсона-Уайта (WPW);
3) разрушение АВ-соединения - создание искусственной АВ-блокады с имплантаций искусственного водителя ритма при наджелудочковых тахиаритмиях, модификация АВ-соединения;
4) непрямые методы: симпатэктомия, аневризмэктомия, АКШ, трансплантация сердца.
Кроме хирургического вмешательства на «открытом сердце», используют так называемые закрытые способы воздействия на аритмогенный субстрат: эндокардиальную катетерную деструкцию аритмогенных участков сердца с помощью радиочастотного воздействия (аблация). При многих тахикардиях катетерная деструкция (или модификация) аритмогенных участков становится методом выбора, например, при АВ-узловой тахикардии и АВ-тахикардии с участием дополнительного пути проведения.
Подробно вышеназванные проблемы обсуждаются в гл. 3 этого тома.
ОБСЛЕДОВАНИЕ И ЛЕЧЕНИЕ БОЛЬНЫХ С РАЗЛИЧНЫМИ КЛИНИЧЕСКИМИ ФОРМАМИ НАРУШЕНИЙ РИТМА
Экстрасистолия
Преждевременные комплексы подразделяются на экстрасистолы и парасистолы (рис. 1.1). Клиническое значение и лечебные мероприятия при экстрасистолии и парасистолии абсолютно одинаковы. По локализации источника аритмии преждевременные комплексы разделяют на наджелудочковые (предсердные и из АВ-соединения) и желудочковые.
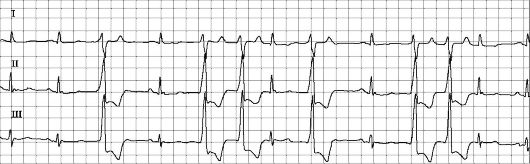 Рис. 1.1. Экстрасистолы. На ЭКГ регистрируются одиночные и парные преждевременные желудочковые комплексы - желудочковые экстрасистолы.
Рис. 1.1. Экстрасистолы. На ЭКГ регистрируются одиночные и парные преждевременные желудочковые комплексы - желудочковые экстрасистолы.
В практической работе и научных исследованиях основное внимание уделяют желудочковой экстрасистолии. Одной из наиболее известных классификаций желудочковых аритмий является классификация B. Lown и M. Wolf (1971).
1. Редкие одиночные мономорфные экстрасистолы - менее 30 в час.
2. Частые экстрасистолы - более 30 в час.
3. Полиморфные экстрасистолы.
4. Повторные формы экстрасистол: 4А - парные, 4Б - групповые (включая эпизоды желудочковой тахикардии).
5. Ранние желудочковые экстрасистолы (типа «R на Т»). Предполагалось, что высокие градации экстрасистол (классы
III-V) являются наиболее опасными. Однако в дальнейших исследо-
ваниях было установлено, что клиническое и прогностическое значение экстрасистолии (и парасистолии) практически целиком определяется характером основного заболевания, степенью органического поражения сердца и функциональным состоянием миокарда. У лиц без признаков поражения миокарда с нормальной сократительной функцией левого желудочка (фракция выброса больше 50%) наличие экстрасистолии не влияет на прогноз и не представляет опасности для жизни. У больных с органическим поражением миокарда, например с постинфарктным кардиосклерозом, наличие экстрасистолии считается дополнительным прогностически неблагоприятным признаком.
В 1983 г. J.T. Bigger предложил прогностическую классификацию желудочковых аритмий.
1. Безопасные аритмии - любые экстрасистолы и эпизоды желудочковой тахикардии, не вызывающие нарушений гемодинамики, у лиц без признаков органического поражения сердца.
2. Потенциально опасные аритмии - желудочковые аритмии, не вызывающие нарушений гемодинамики, у лиц с органическим поражением сердца.
3. Опасные для жизни аритмии («злокачественные аритмии») - эпизоды желудочковой тахикардии, сопровождающиеся нарушениями гемодинамики или фибрилляция желудочков. У больных с опасными для жизни желудочковыми аритмиями, как правило, имеется выраженное органическое поражение сердца (или «электрическая болезнь сердца»: синдром удлиненного интервала QT, синдром Бругады).
Однако независимое прогностическое значение экстрасистолии не определено. Экстрасистолию даже называют «косметической» аритмией, подчеркивая этим ее безопасность. В любом случае лечение экстрасистолии с помощью антиаритмических препаратов класса I не улучшает прогноз. Более того, в крупном хорошо организованном исследовании CAST («исследование подавления аритмий сердца») у больных, перенесших инфаркт миокарда, на фоне эффективного устранения желудочковой экстрасистолии препаратами класса I «С» (флекаинид и энкаинид) выявлено достоверное увеличение смертности в 2,5 раза и частоты внезапной смерти в 3,6 раза по сравнению с больными, принимавшими плацебо! На фоне приема морацизина (этмозин) также наблюдалось увеличение смертности. Только на фоне приема бета-блокаторов и амиодарона отмечено снижение
смертности больных с постинфарктным кардиосклерозом, сердечной недостаточностью или у реанимированных больных.
Клиническое и прогностическое значение экстрасистолии определяется характером основного заболевания, степенью органического поражения сердца и функциональным состоянием миокарда. Сама по себе экстрасистолия безопасна, ее называют «косметической аритмией»
Антиаритмические препараты не излечивают от аритмии, а только устраняют ее на период приема препаратов. При этом побочные реакции и осложнения, связанные с приемом практически всех препаратов, могут быть гораздо более неприятными и опасными, чем экстрасистолия. Таким образом, само по себе наличие экстрасистолии (независимо от частоты и «градаций») не является показанием для назначения антиаритмических препаратов. Бессимптомные или малосимптомные экстрасистолы не требуют проведения специального лечения.
Показаниями для лечения экстрасистолии являются:
1) очень частая, как правило, групповая экстрасистолия, вызывающая нарушения гемодинамики;
2) выраженная субъективная непереносимость ощущения перебоев в работе сердца.
Лечение экстрасистолии
Необходимо объяснить больному, что экстрасистолия безопасна, а прием антиаритмических препаратов может сопровождаться неприятными побочными эффектами или даже вызвать опасные осложнения. При наличии показаний лечение экстрасистолии проводят методом проб и ошибок, последовательно (по 2-4 дня) оценивая эффект приема антиаритмических препаратов в средних суточных дозах (с учетом противопоказаний), выбирая наиболее подходящий для данного больного. Для оценки антиаритмического эффекта амиодарона может потребоваться несколько недель или даже месяцев (применение больших доз амиодарона может сократить этот период до нескольких дней). Критерий эффективности антиаритмического препарата - исчезновение ощущения перебоев, улучшение самочувствия. Многие кардиологи предпочитают начинать подбор препаратов
с назначения бета-блокаторов. При отсутствии эффекта применяют амиодарон, в том числе в комбинации с бета-блокаторами. У больных с экстрасистолией на фоне брадикардии подбор лечения начинают с назначения препаратов, ускоряющих ЧСС: можно попробовать прием вискена, эуфиллина, препаратов класса I, особенно дизопирамида (назначение холинолитических препаратов типа белладонны или симпатомиметиков менее эффективно и сопровождается многочисленными побочными явлениями). В случае неэффективности монотерапии оценивают эффект комбинаций различных антиаритмических препаратов в уменьшенных дозах. Особенно популярны комбинации с бета-блокаторами или амиодароном. На фоне приема комбинации бета-блокаторов и амиодарона наблюдалось еще большее снижение смертности, чем от каждого препарата в отдельности. Более того, есть данные, что одновременное назначение бета-блокаторов (и амиодарона) нейтрализует повышение риска приема любых антиаритических средств.
Амиодарон в малых поддерживающих дозах (100-200 мг в день) редко вызывает серьезные побочные явления или осложнения и является скорее даже более безопасным и лучше переносимым, чем большинство других антиаритмических препаратов. В любом случае при наличии органического поражения сердца выбор небольшой: бета-блокаторы, амиодарон или соталол. При отсутствии эффекта от приема амиодарона (после «периода насыщения» - как минимум по 0,6-1,0 г в течение 10 дней) можно продолжить его прием в поддерживающей дозе - 0,2 г в день и, при необходимости, оценить эффект последовательного добавления препаратов класса I «С» (пропафенон, аллапинин, этацизин) в половинных дозах.
У больных с сердечной недостаточностью заметное уменьшение количества экстрасистол может отмечаться на фоне приема ингибиторов АПФ, антагонистов ангиотензина и верошпирона.
Бессимптомные или малосимптомные экстрасистолы не являются показанием для назначения антиаритмической терапии
Тахиаритмии
В зависимости от локализации источника аритмии различают наджелудочковые (предсердные или атриовентрикулярные) и желудоч-
ковые тахиаритмии. По характеру клинического течения выделяют 2 крайних варианта тахиаритмий - постоянные и пароксизмальные. «Классически» пароксизмальные тахиаритмии имеют 2 основных критерия - приступообразный характер и абсолютную внезапность (только что ЧСС была, например, 60 уд./мин и через мгновение уже 200 уд./мин, затем такое же внезапное прекращение приступа). Промежуточное положение занимают преходящие или рецидивирующие тахиаритмии. В последнее время нередко используют термины «устойчивая» и «неустойчивая» тахикардия. Устойчивой принято считать тахикардию продолжительностью более 30 с для желудочковых и более 2 мин для наджелудочковых тахиаритмий, неустойчивой - продолжительностью соответственно менее 30 с или менее 2 мин. Электрокардиографическая классификация тахиаритмий (рис. 1.2):
1) тахикардия с неуширенными комплексами QRS (<0,11 c) - наджелудочковая тахикардия;
2) тахикардия с уширенными комплексами QRS (>0,11 c) - могут быть как наджелудочковыми (с блокадой ветвей пучка Гиса или пред-
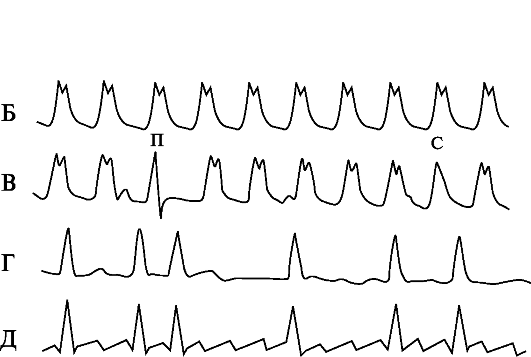 Рис. 1.2. Тахиаритмии.
Рис. 1.2. Тахиаритмии.
А - Наджелудочковая тахикардия; Б - Тахикардия с расширенными комплексами QRS (точно определить локализацию источника тахикардии невозможно); В - Желудочковая тахикардия (видны АВ-диссоциация и «захваты желудочков» - проведенные (П) и сливные (С) комплексы); Г - Мерцание (фибрилляция) предсердий; Д - Трепетание предсердий.
возбуждением желудочков), так и желудочковыми. Формулировка заключения по ЭКГ - тахикардия с уширенными желудочковыми комплексами;
3) желудочковая тахикардия - тахикардия с уширенными комплексами QRS, при наличии АВ-диссоциации и/или проведенных или сливных комплексов;
4) мерцание предсердий - отсутствие зубцов Р и полная нерегулярность сокращений желудочков, независимо от ширины комплексов QRS («абсолютная» аритмия, «нерегулярная нерегулярность»). Между комплексами QRS, как правило, видны волны мерцания;
5) трепетание предсердий - между комплексами QRS вместо зубцов Р регистрируется «пилообразная кривая» - волны трепетания.
Для врачей-терапевтов и врачей линейных бригад скорой помощи вполне достаточно этой классификации. В соответствии с этими вариантами тахиаритмий разработаны алгоритмы и схемы оказания неотложной помощи. Врачам-кардиологам необходимо более глубокое знание тахиаритмий.
В зависимости от локализации источника аритмии выделяют наджелудочковые и желудочковые тахиаритмии, по характеру клинического течения различают пароксизмальные, рецидивирующие и постоянные тахиаритмии
Дифференциальная диагностика тахиаритмий по ЭКГ
Детальный анализ ЭКГ позволяет более точно определить конкретный вариант тахикардии. Следует отметить, что более точный диагноз и определение электрофизиологического механизма тахикардии не влияет на выбор и эффективность медикаментозного лечения больных с тахиаритмиями. Только при проведении хирургического лечения, включая катетерную аблацию, необходимо максимально точное определение локализации аритмогенного субстрата и так называемых уязвимых параметров тахикардии.
1. Тахикардия с неуширенными комплексами QRS. Если во время тахикардии комплексы QRS имеют нормальную форму (не уширены) - тахикардия наджелудочковая (рис. 1.2). Если зубцы Р не видны между комплексами QRS - это АВ-узловая тахикардия. Если имеется АВ-блокада II степени (выпадение комплексов QRS на фоне регулярных зубцов Р во время тахикардии) - значит, это предсерд-
ная тахикардия. Если же зубцы Р расположены между желудочковыми комплексами и нет АВ-блокады II степени - возможны все 3 варианта наджелудочковых тахикардии: предсердная тахикардия, АВ-тахикардия с участием дополнительных путей проведения или редкий вариант АВ-узловой тахикардии.
2. Тахикардия с уширенными комплексами QRS: если есть АВдиссоциация и/или проведенные или сливные комплексы - тахикардия желудочковая (рис. 1.2 В; рис. 1.3).
Если незаметно АВ-диссоциации и проведенных или сливных комплексов, определенное значение имеют дополнительные признаки: в пользу желудочковой тахикардии - ширина комплексов более 0,14 с, отклонение электрической оси вверх, конкордантность комплексов в грудных отведениях, монофазная или двухфазная форма комплексов в отведениях V1 и в пользу наджелудочковой тахикардии - ширина комплексов менее 0,14 с, комплексы типа «классической» блокады правой или (реже) левой ножки (рис. 1.3).
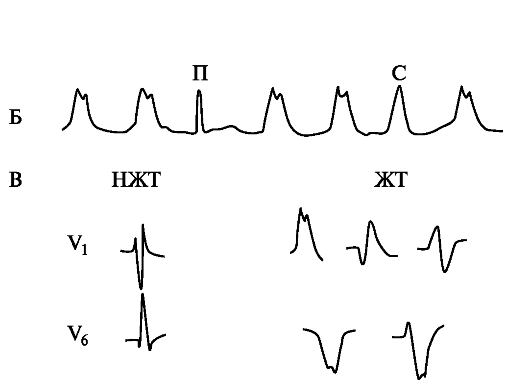 Рис. 1.3. Желудочковая тахикардия.
Рис. 1.3. Желудочковая тахикардия.
А - Желудочковая тахикардия (видна АВ-диссоциация - зубцы Р после 1-го, перед 4-м и после 6-го комплексов); Б - Желудочковая тахикардия (видны АВ-диссоциация и «захваты желудочков» - проведенные (П) и сливные (С) комплексы); В - Форма комплексов QRS, характерных для наджелудочковой тахикардии с блокадой правой ножки пучка Гиса (НЖТ) и для желудочковой тахикардии (ЖТ).
При регистрации во время тахикардии неуширенных комплексов QRSустанавливают диагноз: наджелудочковая тахикардия. При регистрации во время тахикардии расширенных комплексов QRSдля определения варианта тахикардии необходим анализ дополнительных ЭКГ-признаков
П. Бругада с соавторами (1991 г.) предложили алгоритм дифференциальной диагностики тахикардии с уширенными комплексами QRS, основанный на выявлении 4 последовательных признаков:
1. Комплексы типа RS в грудных отведениях.
2. Интервал R-S более 0,1 с (интервал R-S измеряется от начала зубца R до самой нижней точки зубца S).
3. АВ-диссоциация.
4. Морфологические признаки желудочковой тахикардии в отведениях V1-2 и V6 (при форме комплексов, напоминающих блокаду правой ножки: в V1 - R, QR, RS; в V6 - R меньше S, QR или QS, R; при форме комплексов типа блокады левой ножки: в V1 или V2 - ширина зубца R больше 30 мс, интервал R-S более 0,06 с, зазубренность нисходящего колена зубца S; в V6 - QR или QS).
При наличии первого признака - диагноз: желудочковая тахикардия, при отсутствии первого признака («нет») - смотрят, имеется ли следующий признак, и т.д. При отсутствии всех 4 признаков
- диагноз: наджелудочковая тахикардия (с нарушением внутрижелудочковой проводимости).
В сомнительных случаях (если нет АВ-диссоциации, проведенных или сливных комплексов) тахикардию следует считать желудочковой и проводить лечебные мероприятия как при желудочковой тахикардии, особенно при оказании неотложной помощи. Дополнительные морфологические ЭКГ-признаки при оказании неотложной помощи не используют.
Следует отметить, что у больных с преходящими тахиаритмиями с уширенными комплексами QRS во время нормального ритма на ЭКГ могут отмечаться выраженные нарушения реполяризации
- депрессия сегмента ST и отрицательные зубцы Т. Это следствие так называемого посттахикардиального синдрома. Нарушения реполяризации в таких случаях не связаны с ишемией миокарда.
ЛЕЧЕНИЕ РАЗЛИЧНЫХ ВАРИАНТОВ ТАХИАРИТМИЙ
Лечение тахиаритмий
В случаях возникновения выраженных нарушений гемодинамики, сопровождающихся возникновением клинических симптомов: резкое падение АД, сердечная астма и отек легких, потеря сознания - необходимо проведение неотложной электрической кардиоверсии. При более стабильном состоянии основой лечения является применение антиаритмических препаратов. При оказании неотложной помощи нередко возникает необходимость во введении нескольких антиаритмических препаратов. Промежуток до введения следующего препарата определяется клинической ситуацией и реакцией на введение того или иного препарата. Для предупреждения рецидивирования тахиаритмий назначают антиаритмические препараты для постоянного приема или используют хирургические способы лечения.
Возникновение во время тахикардии выраженных нарушений гемодинамики является показанием для проведения электрической кардиоверсии
НАДЖЕЛУДОЧКОВЫЕ ТАХИАРИТМИИ
Как было уже отмечено, для врачей-некардиологов достаточно подразделение тахиаритмий на наджелудочковые, желудочковые и мерцательную аритмию. В этом разделе представлена более подробная характеристика наджелудочковых тахиаритмий. Наджелудочковые тахикардии подразделяются на предсердные и атриовентрикулярные.
Предсердные тахиаритмии
К предсердным тахиаритмиям относятся предсердная тахикардия (рис. 4.5) и мерцательная аритмия (рис. 1.2 Г, Д; рис. 1.4 В, Г; рис. 1.5 Б, В). Предсердная тахикардия может быть мономорфной и полиморфной (когда форма предсердных комплексов изменяется).
Полиморфная предсердная тахикардия встречается очень редко, в основном у больных с тяжелыми заболеваниями легких, с выражен-
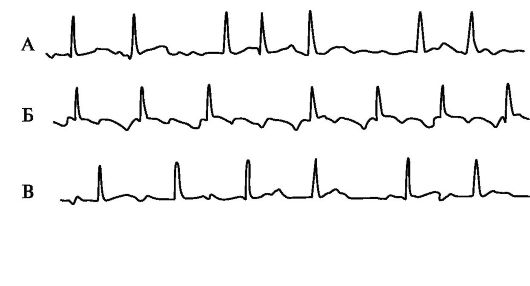
Рис. 1.4. Предсердные тахиаритмии.
А - Мерцание (фибрилляция) предсердий; Б - Трепетание предсердий; В - Предсердная тахикардия с АВ-блокадой II степени (периодика Самойлова-Венкебаха, «выпадение» 5-го комплекса QRS); Г - Полиморфная предсердная тахикардия с АВ-блокадой II степени.
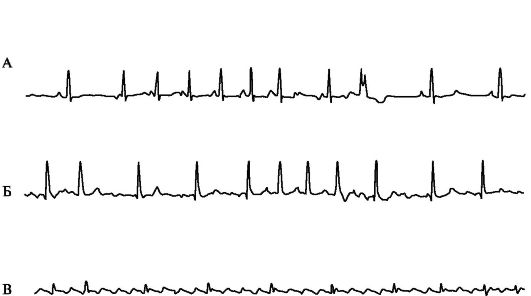 Рис. 1.5. Предсердные тахиаритмии.
Рис. 1.5. Предсердные тахиаритмии.
А - Короткий эпизод предсердной тахикардии с АВ-блокадой II степени (периодика Самойлова-Венкебаха, «выпадение» 6-го комплекса QRS, последний желудочковый комплекс - аберрантный); Б - Мерцание (фибрилляция) предсердий; В - Трепетание предсердий.
ной дыхательной недостаточностью (но даже в этой группе больных полиморфная предсердная тахикардия наблюдается чрезвычайно редко). Полиморфная предсердная тахикардия это, по сути, ритм с миграцией водителя ритма по предсердиям, но с частотой предсердных сокращений более 100 в минуту (рис. 1.7 Е).
Главным отличительным признаком всех предсердных тахиаритмий является сохранение тахикардии в случае развития АВ-блокады II степени. Поэтому если АВ-блокада II степени во время тахикардии отсутствует, ее стараются вызвать с помощью вагусных приемов (массаж сонной артерии) или в/в введения АТФ. В случае тахикардии с АВ-блокадой II степени диагноз предсердной тахикардии не вызывает сомнений.
Лечение предсердных тахикардий. Для купирования предсердных тахикардий применяют любые антиаритмические препараты, кроме лидокаина. При лечении редко встречающейся полиморфной предсердной тахикардии препаратом первого выбора является верапамил.
Мерцательная аритмия
Самой частой тахиаритмией, встречающейся в клинической практике, является мерцательная аритмия - она наблюдается в 10-20 раз чаще, чем все другие наджелудочковые и желудочковые тахиаритмии вместе взятые. Мерцательная аритмия включает трепетание и мерцание предсердий (мерцание предсердий нередко называют фибрилляцией предсердий). Основным признаком мерцания предсердий является отсутствие зубцов Р, наличие волн мерцания и абсолютная нерегулярность ритма желудочков (рис. 1.2 Г; рис. 1.4 А; рис. 1.5 Б). Основным признаком трепетания предсердий является отсутствие зубцов Р и регистрация между комплексами QRS «пилообразной» кривой (рис. 1.2 Д; рис. 1.4 Б; рис. 1.5 В).
К основным вариантам клинического течения мерцательной аритмии относят пароксизмальную и постоянную формы мерцательной аритмии. Эксперты Американской ассоциации сердца (ААС), Американской коллегии кардиологов (АКК) и Европейского общества кардиологов (ЕОК) предложили считать пароксизмальной мерцательной аритмией случаи, когда аритмия прекращается самостоятельно. Если синусовый ритм восстанавливается с помощью лечебных мероприятий (медикаментозная или электрическая кар-
диоверсия - такой вариант предложено называть устойчивой мерцательной аритмией, а постоянной мерцательной аритмией считают случаи, когда синусовый ритм восстановить не удается (или такие попытки не предпринимались). На практике (по крайней мере, в России) чаще используют разделение мерцательной аритмии на пароксизмальную и постоянную формы. При этом они различаются только по продолжительности аритмии, независимо от эффективности лечебных мероприятий. Постоянной считают аритмию продолжительностью более 1 недели.
Мерцательная аритмия встречается в 10-20 раз чаще, чем все остальные варианты тахиаритмий вместе взятые
Пароксизмальная мерцательная аритмия. В последние годы рекомендации по лечению мерцательной аритмии несколько усложнились. Если от начала приступа прошло более 2 суток, восстановление нормального ритма может быть опасным - повышен риск так называемых нормализационных тромбоэмболий (чаще всего в сосуды мозга с развитием инсульта). При неревматической мерцательной аритмии риск нормализационных тромбоэмболий составляет от 1 до 5% (в среднем около 2%). Поэтому, если мерцательная аритмия продолжается более 2 суток, надо прекратить попытки восстановления ритма и назначить больному непрямые антикоагулянты (варфарин или фенилин) на 3 недели, в дозах поддерживающих международное нормализованное отношение (МНО) в пределах от 2,0 до 3,0 (протромбиновый индекс около 50%). Через 3 недели можно предпринять попытку восстановления синусового ритма с помощью медикаментозной или электрической кардиоверсии. После кардиоверсии больной должен продолжить прием антикоагулянтов еще в течение 1 мес. Таким образом, попытки восстановления синусового ритма можно предпринимать в течение первых 2 суток мерцательной аритмии или через 3 недели приема антикоагулянтов.
При тахисистолической форме (когда ЧСС превышает 100- 120 уд./мин) сначала следует уменьшить ЧСС с помощью препаратов, блокирующих проведение в АВ-узле (перевести в нормосистолическую форму). Цель - контролировать ЧСС на уровне около 70 в мин. Для урежения ЧСС наиболее эффективным препаратом является верапамил (изоптин). В зависимости от ситуации верапамил вводят в/в - 10 мг или назначают внутрь - 80-120 мг. Кроме верапамила,
для урежения ЧСС можно использовать обзидан - 5 мг в/в или 80-120 мг внутрь, или атенолол - по 50 мг внутрь, дигоксин - 0,5- 1,0 мг в/в, амиодарон - 150-450 мг в/в, соталол - 20 мг в/в или 160 мг внутрь, сульфат магния - 2,5 г в/в. При наличии сердечной недостаточности назначение верапамила и бета-блокаторов противопоказано, препаратами выбора являются амиодарон и дигоксин.
В некоторых случаях после введении этих препаратов происходит не только урежение ЧСС, но и восстановление синусового ритма (особенно после введения кордарона). Если приступ мерцательной аритмии не прекратился, после урежения ЧСС решают вопрос о целесообразности восстановления синусового ритма.
Для восстановления синусового ритма наиболее эффективны:
Амиодарон - 300-450 мг в/в (можно использовать однократный прием кордарона внутрь в дозе 30 мг/кг, т.е. 12 таблеток по 200 мг для человека весом 75 кг);
Пропафенон - 70 мг в/в или 600 мг внутрь;
Соталол - 20 мг в/в или 160 мг внутрь;
Новокаинамид - 1 г в/в или 2 г внутрь (далее - по 0,5 г через 1 ч - до 4-6 г);
Хинидин - 0,4 г внутрь, далее по 0,2 г через 1 ч до купирования (максимальная доза - около 1,6 г); Нибентан - 10 мг в/в.
При тахисистолической форме мерцательной аритмии необходимо в первую очередь уменьшить ЧСС. Для урежения ЧСС используют верапамил, бета-блокаторы, амиодарон и дигоксин
В настоящее время в связи с высокой эффективностью, хорошей переносимостью и удобством приема все большую популярность приобретает восстановление синусового ритма при мерцательной аритмии с помощью приема внутрь однократной дозы амиодарона или пропафенона. Среднее время восстановления синусового ритма после приема амиодарона составляет 6 ч, после пропафенона - 2 ч. При нормосистолической форме сразу используют препараты для восстановления синусового ритма. Если хинидин, новокаинамид, дизопирамид или другие препараты класса I назначать при тахисистолической форме, без предварительного введения препаратов, блокирующих АВ-проведение, возможен переход мерцания в тре-
петание предсердий и резкое ускорение ЧСС - до 250 в минуту и более.
При трепетании предсердий, кроме медикаментозного лечения, можно использовать чреспищеводную стимуляцию левого предсердия с частотой, превышающей частоту трепетания, - обычно около 350 импульсов в мин, продолжительностью 15-30 с. Кроме того, при трепетании предсердий очень эффективно проведение электрической кардиоверсии разрядом мощностью 25-75 Дж после в/в введения реланиума.
Особенности лечения пароксизмальной мерцательной аритмии у больных с синдромом Вольфа-Паркинсона-Уайта. При мерцательной аритмии у больных с синдромом WPW противопоказано назначение верапамила и сердечных гликозидов. Под влиянием этих препаратов у части больных с синдромом WPW происходит резкое ускорение ЧСС, сопровождающееся выраженными нарушениями гемодинамики, известны случаи возникновения фибрилляции желудочков. Поэтому для купирования мерцательной аритмии у больных с синдромом Вольфа-Паркинсона-Уайта применяют амиодарон или новокаинамид. В сомнительных случаях (при отсутствии уверенности в наличии синдрома WPW) надежнее всего использовать амиодарон, так как он одинаково эффективен при всех наджелудочковых тахиаритмиях.
При мерцательной аритмии у больных с синдромом WPW противопоказано применение верапамила и сердечных гликозидов
Постоянная форма мерцательной аритмии. Мерцание предсердий является самой частой устойчивой аритмией. У 60-80% больных с постоянной формой мерцательной аритмии основным заболеванием является артериальная гипертония, ИБС или митральный порок сердца. У 10-15% больных с постоянной формой мерцательной аритмии выявляют тиреотоксикоз, легочное сердце, дефект межпредсердной перегородки, кардиомиопатии, алкогольное поражение сердца. У 5-30% больных не удается выявить какого-либо заболевания сердца или экстракардиального заболевания, которое могло бы быть причиной мерцательной аритмии - в таких случаях аритмию называют идиопатической, или «изолированной». Следует отметить, что обнаружить причинно-следственную связь между основным заболеванием и мерцательной аритмией удается далеко
не всегда. Во многих случаях это, вероятно, обычное сочетание двух заболеваний. Например, установлено, что ИБС является возможной причиной мерцательной аритмии примерно у 5% больных. В России существует колоссальная гипердиагностика ИБС у больных с мерцательной аритмией. Для постановки диагноза ИБС всегда необходимо продемонстрировать наличие ишемии миокарда. Диагноз ИБС правомочен только в случае выявления одного из 4 клинических проявлений ишемии миокарда: стенокардия, инфаркт миокарда, постинфарктный кардиосклероз и безболевая ишемия миокарда. Кроме того, необходимы доказательства, что ишемия вызвана поражением коронарных артерий.
Мерцательная аритмия сама по себе, как правило, не представляет непосредственной опасности для жизни. Однако она вызывает неприятные ощущения в грудной клетке, нарушения гемодинамики и повышает риск возникновения тромбоэмболий, прежде всего в сосуды мозга. Некоторые из этих осложнений могут представлять опасность для жизни. Мерцательная аритмия вызывает выраженные нарушения гемодинамики - уменьшение ударного объема и сердечного выброса примерно на 25%. У больных с органическим поражением сердца, особенно с митральным стенозом или выраженной гипертрофией миокарда, возникновение мерцательной аритмии может привести к появлению или усилению признаков недостаточности кровообращения. Одним из наиболее серьезных осложнений, связанных с мерцательной аритмией, являются тромбоэмболии, особенно в сосуды головного мозга с развитием тромбоэмболического инсульта. Частота возникновения тромбоэмболий при неревматическом мерцании предсердий составляет около 5% в год. Особенно высока вероятность тромбоэмболий у больных с ревматическим пороком сердца и с тромбоэмболей в анамнезе. Факторами риска тромбоэмболий являются артериальная гипертония, сердечная недостаточность, сахарный диабет, ишемическая болезнь сердца и тиреотоксикоз. Для снижения риска тромбоэмболий назначают антикоагулянты непрямого действия (варфарин, фенилин). Менее эффективно применение аспирина.
Одним из наиболее серьезных осложнений, связанных с мерцательной аритмией, являются тромбоэмболии в сосуды головного мозга. Частота возникновения тромбоэмболий при неревматическом мерцании предсердий составляет около 5% в год
Основным показанием для восстановления синусового ритма при постоянной форме мерцательной аритмии является «желание больного и согласие врача». Формально показаниями для восстановления ритма являются сердечная недостаточность и/или тромбоэмболии. Однако на практике эти состояния нередко рассматривают скорее как противопоказания, мотивируя это тем, что при сердечной недостаточности, как правило, имеется увеличение размеров сердца, а это (особенно увеличение левого предсердия) является признаком повышенной вероятности рецидивирования мерцательной аритмии, несмотря на прием антиаритмических препаратов. Наличие тромбоэмболии в анамнезе является фактором риска возникновения тромбоэмболии и при восстановлении синусового ритма - получается, что врач сознательно идет на возможную провокацию эпизода тромбоэмболии.
Для восстановления синусового ритма используют антиаритмические препараты или электроимпульсную терапию. Антикоагулянты назначают при продолжительности мерцательной аритмии более 2 суток (особенно высок риск тромбоэмболий при митральном пороке сердца, гипертрофической кардиомиопатии, недостаточности кровообращения и тромбоэмболиях в анамнезе). Антикоагулянты назначают в течение 3 недель до попытки кардиоверсии и в течение 3-4 недель после восстановления синусового ритма.
Без назначения антиаритмических препаратов после кардиоверсии синусовый ритм сохраняется в течение 1 года у 15-50% больных. Применение антиаритмических препаратов повышает вероятность сохранения синусового ритма. Наиболее эффективно применение амиодарона - даже при рефрактерности к другим антиаритмическим препаратам синусовый ритм сохраняется у 30-85% больных. Кордарон нередко эффективен и при выраженном увеличении левого предсердия. Кроме кордарона, для предупреждения повторного возникновения мерцательной аритмии эффективно применение соталола, пропафенона, этацизина и аллапинина, несколько менее эффективны хинидин и дизопирамид. Следует отметить, что в случае рецидивирования мерцательной аритмии на фоне приема пропафенона, этацизина, аллапинина, хинидина или дизопирамида (препаратов класса I «А» и I «С») у больных с тахисистолической формой возможно еще большее ускорение ЧСС - поэтому эти препараты необходимо принимать в сочетании с препаратами, блокирующими проведение по АВ-узлу: верапамилом, бета-блокаторами, дигокси-
ном. При отсутствии эффекта от монотерапии, при повторном восстановлении синусового ритма назначают комбинации антиаритмических препаратов. Наиболее эффективны комбинации амиодарона с перечисленными препаратами класса I «А» и I «С». Следует отметить, что на фоне приема антиаритмических препаратов класса I при мерцательной аритмии у больных с органическим поражением сердца отмечено увеличение смертности, например, при лечении хинидином - примерно в 3 раза. Поэтому у больных с органическим поражением сердца целесообразно назначение амиодарона. Для увеличения эффективности антиаритмических препаратов в плане сохранения синусового ритма к лечению добавляют ингибиторы АПФ, антагонисты ангиотензина, статины и омега-3-жирные кислоты.
При сохранении постоянной формы мерцательной аритмии больным с тахисистолией для урежения ЧСС назначают дигоксин, верапамил или бета-блокаторы. При редко встречающемся брадисистолическом варианте мерцательной аритмии может быть эффективным назначение эуфиллина (теопек, теотард).
Недавно проведенные исследования показали, что две стратегии: стремление к сохранению синусового ритма или нормализация ЧСС при сохранении мерцательной аритмии на фоне приема непрямых антикоагулянтов обеспечивают примерно одинаковые качество и продолжительность жизни.
Атриовентрикулярные тахикардии
Атриовентрикулярные тахикардии включают два основных варианта (рис. 1.6-1.9):
1) атриовентрикулярная (АВ) узловая тахикардия;
2) атриовентрикулярная тахикардия с участием дополнительных путей проведения.
Эти варианты, как правило, носят пароксизмальный характер (нередко их объединяют термином «пароксизмальная наджелудочковая тахикардия). Если не учитывать пароксизмальную мерцательную аритмию, то более 90% всех пароксизмальных наджелудочковых тахикардий составляют АВ-тахикардии, и только менее 10% - предсердные. С другой стороны, у больных с хроническими тахикардиями (постоянными или рецидивирующими) чаще выявляются предсердные тахикардии (примерно у 30-50% больных). Очень редко наблюдается так называемая тахикардия из АВ-соединения
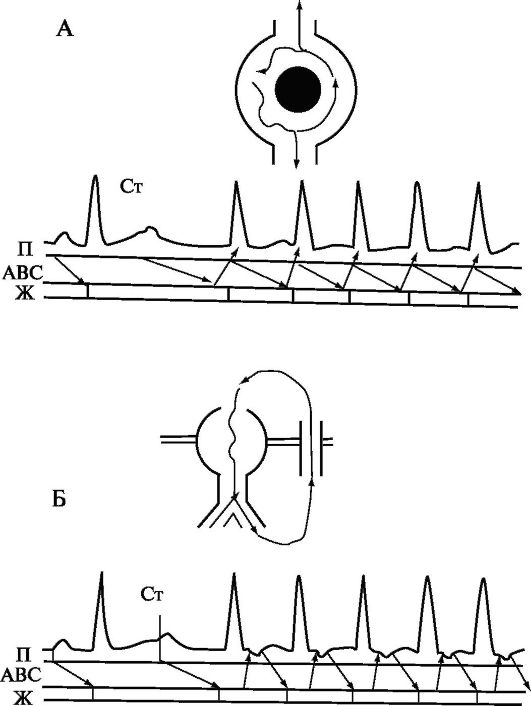 Рис. 1.6. Индукция
атриовентрикулярных тахикардии. Ст - Электрический стимул, индуцирующий
тахикардию; А - Реципрокная АВ-узловая тахикардия (вверху - схема
циркуляции импульса в АВузле, внизу - схема циркуляции импульса на
лестничной диаграмме: П - предсердия, АВС - атриовентрикулярное
соединение, Ж - желудочки); Б - Реципрокная атриовентрикулярная
тахикардия с участием дополнительного пути проведения (вверху - схема
циркуляции импульса: вниз по нормальной проводящей системе сердца, вверх
(ретроградно) - по дополнительному пути проведения, внизу - схема
циркуляции импульса на лестничной диаграмме: П - предсердия, АВС -
атриовентрикулярное соединение, Ж - желудочки).
Рис. 1.6. Индукция
атриовентрикулярных тахикардии. Ст - Электрический стимул, индуцирующий
тахикардию; А - Реципрокная АВ-узловая тахикардия (вверху - схема
циркуляции импульса в АВузле, внизу - схема циркуляции импульса на
лестничной диаграмме: П - предсердия, АВС - атриовентрикулярное
соединение, Ж - желудочки); Б - Реципрокная атриовентрикулярная
тахикардия с участием дополнительного пути проведения (вверху - схема
циркуляции импульса: вниз по нормальной проводящей системе сердца, вверх
(ретроградно) - по дополнительному пути проведения, внизу - схема
циркуляции импульса на лестничной диаграмме: П - предсердия, АВС -
атриовентрикулярное соединение, Ж - желудочки).
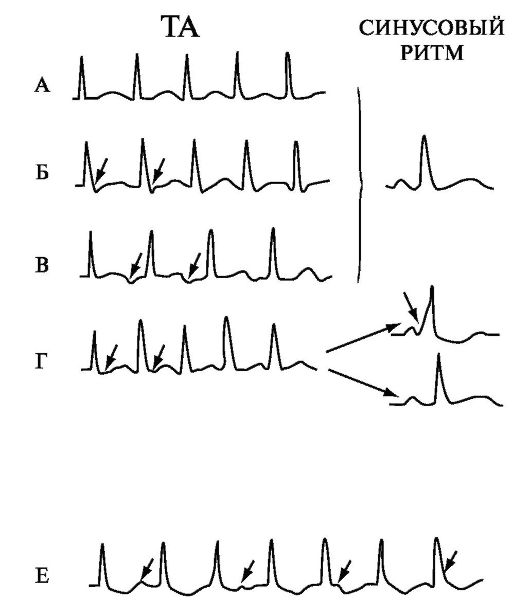
Рис. 1.7. Атриовентрикулярные тахикардии.
А - Реципрокная АВ-узловая тахикардия с одновременной деполяризацией предсердий и желудочков; Б - Реципрокная АВ-узловая тахикардия с отставанием деполяризации предсердий от деполяризации желудочков (вторая половина ретроградных зубцов Р видна позади комплекса QRS в виде зубцов S, «псевдозубцы» S указаны стрелками); В - Редкая форма реципрокной АВ-узловой тахикардии, при которой ретроградные зубцы Р регистрируются перед комплексами QRS; Г - Реципрокная атриовентрикулярная тахикардия с участием дополнительного пути проведения (предсердные комплексы регистрируются после комплексов QRS), во время синусового ритма может регистрироваться преждевременное возбуждение желудочков (синдром WPW) или нормальные желудочковые комплексы (ретроградно проводящий дополнительный путь проведения); Д - Возникновение блокады левой ножки пучка Гиса во время тахикардии у больного с левосторонним дополнительным путем проведения (отмечается замедление тахикардии); У - Тахикардия из АВ-соединения с АВ-диссоциацией.
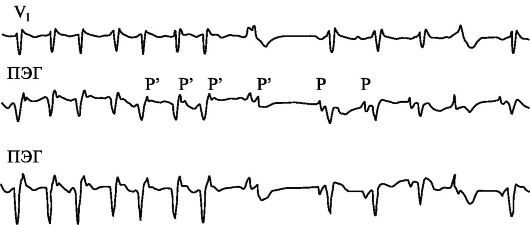 Рис. 1.8. Прекращение
реципрокной АВ-узловой тахикардии. На ЭКГ - купирование реципрокной
АВ-тахикардии после в/в введения АТФ (1,0 мл - 10 мг). ПЭГ - пищеводная
электрограмма; во время тахикардии комплексы, обозначенные Р' - это
ретроградные зубцы Р.
Рис. 1.8. Прекращение
реципрокной АВ-узловой тахикардии. На ЭКГ - купирование реципрокной
АВ-тахикардии после в/в введения АТФ (1,0 мл - 10 мг). ПЭГ - пищеводная
электрограмма; во время тахикардии комплексы, обозначенные Р' - это
ретроградные зубцы Р.
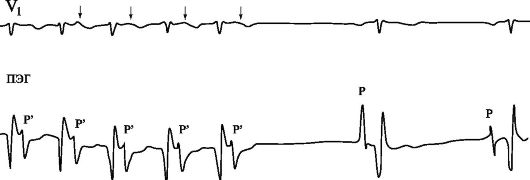 Рис. 1.9. Прекращение реципрокной атриовентрикулярной тахикардии с участием дополнительного пути проведения.
Рис. 1.9. Прекращение реципрокной атриовентрикулярной тахикардии с участием дополнительного пути проведения.
ПЭГ - пищеводная электрограмма; во время тахикардии комплексы, обозначенные Р' - это ретроградные зубцы Р, отражающие деполяризацию предсердий через дополнительный путь ретроградного АВ-проведения.
(рис. 1.7 Е). Это по сути ритм АВ-соединения, но с частотой более 100 в минуту.
Для АВ-узловой тахикардии, при которой импульс циркулирует внутри АВ-узла, характерна одновременная деполяризация предсердий и желудочков - в результате ретроградные зубцы Р, как правило,
не видны на ЭКГ во время тахикардии (рис. 1.2 А; рис. 1.6 А; рис. 1.7 А, Б, В; рис. 1.8) или слегка видна вторая часть ретроградных зубцов Р - у части больных с АВ-узловой тахикардией деполяризация предсердий и желудочков происходит не совсем одновременно и после комплекса QRS видна последняя часть ретроградного зубца Р в форме «псевдозубца» S в отведениях II, III, avF и «псевдозубца» R в отведениях avR и V1 (рис. 1.7 Б).
При АВ-тахикардии с участием дополнительных путей проведение циркуляции импульса происходит через все отделы сердца: предсердия - АВ-соединение - желудочки - дополнительный путь проведения, соединяющий предсердия и желудочки, - вновь предсердия, поэтому зубцы Р расположены между желудочковыми комплексами, обычно ближе к предыдущему комплексу QRS (рис. 1.6 Б; рис. 1.7 Г; рис. 1.9 ).
Существует также так называемая редкая форма реципрокной АВтахикардии, во время которой ретроградные зубцы Р регистрируются между желудочковыми комплексами, обычноперед комплексами QRS (рис. 1.7 В). При этой форме АВ-тахикардии циркуляция импульсов может происходить как внутри АВ-узла, так и с участием дополнительного пути в ретроградном направлении («медленно проводящий» дополнительный путь). По ЭКГ эти варианты редкой формы АВ-тахикардии дифференцировать невозможно. Редкая форма реципрокной АВ-тахикардии или тахикардии с участием медленнопроводящего дополнительного пути обычно носит рецидивирующий или непрерывно-рецидивирующий характер.
Существуют 2 основных варианта атриовентрикулярных тахикардии: АВ-узловая тахикардия и тахикардия, обусловленная наличием дополнительного пути проведения
Во время атриовентрикулярных тахикардий у многих больных отмечается выраженная депрессия сегмента ST. У больных без признаков ИБС эта депрессия не связана с ишемией миокарда. У больных с установленным диагнозом ИБС депрессия сегмента ST может быть отражением ишемии миокарда.
Синдром Вольфа-Паркинсона-Уайта (синдром WPW)
У больных с синдромом WPW в сердце имеется дополнительный путь АВ-проведения - пучок Кента, который соединяет предсердия с желудочками.
В результате импульс проводится одновременно по двум путям - нормальной проводящей системе сердца и пучку Кента.
По пучку Кента импульсы проводятся быстрее, поэтому деполяризация желудочков начинается раньше, чем при проведении только по нормальной проводящей системе сердца - на ЭКГ регистрируется дельта-волна в начале комплекса QRS. За счет дельта-волны на ЭКГ отмечаются укорочение интервала РR, уширение комплекса QRS и дискордантное смещение сегмента ST и зубца Т (рис. 1.10).
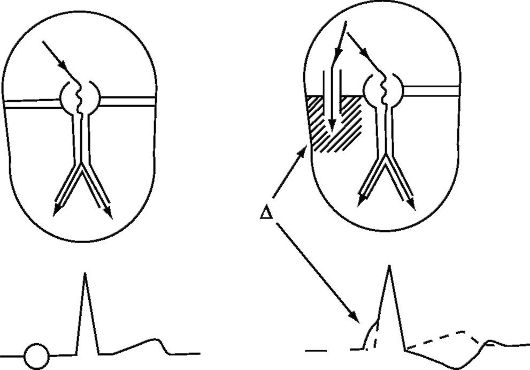 Рис. 1.10. Преждевременное
возбуждение желудочков (синдром WPW). Слева - деполяризация желудочков в
норме; справа - преждевременная деполяризация желудочков при наличии
правостороннего пучка Кента, отражением преждевременной деполяризации
желудочков на ЭКГ является наличие дельта-волны (Δ - дельта-волна)
Рис. 1.10. Преждевременное
возбуждение желудочков (синдром WPW). Слева - деполяризация желудочков в
норме; справа - преждевременная деполяризация желудочков при наличии
правостороннего пучка Кента, отражением преждевременной деполяризации
желудочков на ЭКГ является наличие дельта-волны (Δ - дельта-волна)
У большинства больных с синдромом WPW возникают пароксизмальные наджелудочковые тахикардии. Чаще всего (до 80%) отмечается пароксизмальная АВ-тахикардия, во время которой исчезают признаки предвозбуждения желудочков (комплексы QRS нормализуются, если нет блокады ветвей пучка Гиса). Циркуляция
импульсов при этой тахикардии происходит с захватом всех отделов сердца: предсердия - АВ-узел - пучок Гиса и его ветви - желудочки
- пучок Кента - вновь предсердия (рис. 1.6 Б; рис. 1.11). Этот вариант тахикардии называют ортодромным.
Синдром WPW обусловлен наличием дополнительного пути АВ-проведения - пучка Кента. У больных с синдромом WPW часто развиваются пароксизмальные наджелудочковые тахикардии и мерцание предсердий
Гораздо реже (около 5%) отмечается другой вариант реципрокной АВ-тахикардии - антидромный, при котором циркуляция импульса происходит в обратном направлении: вниз (антероградно) - по пучку Кента, а вверх (ретроградно) от желудочков к предсердиям
- по нормальной проводящей системе. Желудочковые комплексы во время антидромной тахикардии уширены (рис. 1.11 Б).
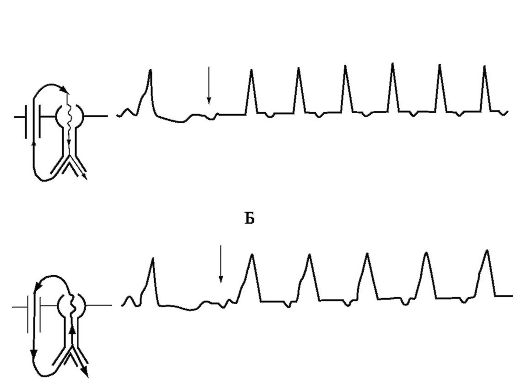 Рис. 1.11. Реципрокные атриовентрикулярные тахикардии у больных с синдромом WPW.
Рис. 1.11. Реципрокные атриовентрикулярные тахикардии у больных с синдромом WPW.
А - Ортодромная тахикардия; Б - Антидромная тахикардия. Слева - схемы циркуляции импульса во время тахикардий, стрелками указаны предсердные экстрасистолы, «запускающие» тахикардии
Кроме этих двух вариантов тахикардии, у больных с синдромом WPW нередко (у 10-40%) возникают пароксизмы мерцательной аритмии, с очень высокой частотой сокращений желудочков - более 200 уд/мин, иногда до 300 уд./мин и более (рис. 1.12 В). При такой высокой ЧСС возможно возникновение выраженных нарушений гемодинамики вплоть до эпизодов потери сознания и трансформации в фибрилляцию желудочков.
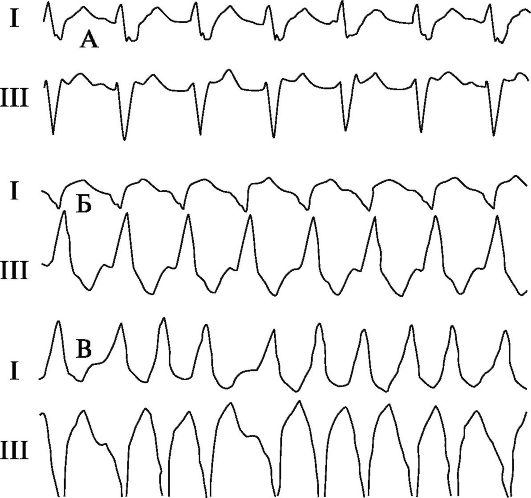 Рис. 1.12. Тахиаритмии с расширенными комплексами QRS. А - Желудочковая тахикардия (видна АВ-диссоциация - зубцы Р после
1-го, после 3-го (Р на Т), сразу после 5-го и перед последним
комплексом QRS); Б - Тахикардия с расширенными комплексами QRS (точно
определить локализацию источника тахикардии невозможно); В - Мерцание
(фибрилляция) предсердий у больного с синдромом WPW (Расширенные
комплексы, высокая частота желудочковых сокращений и полная
нерегулярность ритма сокращений желудочков)
Рис. 1.12. Тахиаритмии с расширенными комплексами QRS. А - Желудочковая тахикардия (видна АВ-диссоциация - зубцы Р после
1-го, после 3-го (Р на Т), сразу после 5-го и перед последним
комплексом QRS); Б - Тахикардия с расширенными комплексами QRS (точно
определить локализацию источника тахикардии невозможно); В - Мерцание
(фибрилляция) предсердий у больного с синдромом WPW (Расширенные
комплексы, высокая частота желудочковых сокращений и полная
нерегулярность ритма сокращений желудочков)
Лечение пароксизмальных атриовентрикулярных тахикардии
Купирование пароксизмальных АВ-тахикардий начинают с применения вагусных приемов. Наиболее часто используют пробу Вальсальвы (натуживание на вдохе около 10 с) и массаж сонной артерии (массаж каротидного синуса). Кроме этих приемов, можно применить надувание воздушного шарика (до тех пор, пока шарик не лопнет) и «рефлекс ныряния» - погружение лица в холодную воду. Наиболее эффективным является «рефлекс ныряния» - восстановление синусового ритма отмечается у 90% больных.
Купирование пароксизмальных атриовентрикулярных тахикардии начинают с проведения вагусных приемов: проба Вальсальвы, массаж каротидного синуса, «рефлекс ныряния»
При отсутствии эффекта от вагусных воздействий назначают антиаритмические препараты. Наиболее результативными являются верапамил, АТФ или аденозин. Эффективность этих препаратов не менее 90% (а эффективность АТФ или аденозина - около 100%). Эти препараты блокируют проведение в АВ-узле. Вместо верапамила можно использовать обзидан или дигоксин - но их эффективность намного ниже. АТФ и аденозин вводят в/в очень быстро - за 1-3 с, это препараты ультракороткого действия. Единственным недостатком АТФ и аденозина является возникновение довольно неприятных субъективных ощущений: одышки, покраснения лица, головной боли или ощущения «дурноты». Но эти явления быстро исчезают - их продолжительность не более 30 с. Примерную последовательность введения препаратов при копировании пароксизмальной АВтахикардии можно представить в следующем виде.
1) верапамил - в/в 5-10 мг;
2) АТФ - в/в 10 мг или аденозин - 6 мг (очень быстро - за 1-3 с);
3) вмиодарон - 300-450 мг в/в;
4) новокаинамид - в/в 1 г (или дизопирамид, гилуритмал).
В купировании пароксизмальных АВ-тахикардий очень эффективно использование электрокардиостимуляции, в том числе чреспищеводной ЭКС. Однако к электрокардиостимуляции прибегают редко, потому что в большинстве случаев удается купировать приступ тахикардии медикаментозно.
Наиболее эффективными препаратами для купирования пароксизмальных наджелудочковых тахикардий являются АТФ (аденозин) и верапамил
У больных с легко переносимыми и сравнительно редко возникающими приступами тахикардии целесообразно использование самостоятельного перорального купирования приступов. Если эффективно в/в введение верапамила - можно назначить его внутрь в дозе 160-240 мг однократно в момент возникновения приступов. Эффективно использование комбинаций препаратов: 120 мг верапамила в сочетании с 15 мг вискена или 80-120 мг анаприлина с 90- 120 мг дилтиазема. Если более эффективно в/в введение новокаинамида - назначают прием 2 г новокаинамида. Можно использовать 0,5 г хинидина, 600 мг пропафенона или 30 мг/кг амиодарона внутрь.
ЖЕЛУДОЧКОВЫЕ ТАХИАРИТМИИ
Желудочковыми называют тахикардии, источник которых расположен в желудочках (ниже ствола пучка Гиса). По электрокардиографическим признакам можно выделить несколько основных вариантов желудочковых тахиаритмий:
1. Мономорфная желудочковая тахикардия (рис. 1.2 В; рис. 1.3;
рис. 1.12 А).
2. Полиморфная желудочковая тахикардия (в том числе желудочковая тахикардия типа «пируэт»).
3. Двунаправленная желудочковая тахикардия.
4. Идиопатическая желудочковая тахикардия с комплексами типа блокады левой ножки пучка Гиса (чаще всего так называемая желудочковая тахикардия из выходного тракта правого желудочка).
5. Идиопатическая желудочковая тахикардия с комплексами типа блокады правой ножки пучка Гиса и отклонением электрической оси влево («Верапамил-чувствительная» желудочковая тахикардия).
6. Желудочковая тахикардия при аритмогенной дисплазии правого желудочка с комплексами типа блокады левой ножки пучка Гиса.
7. Трепетание и фибрилляция желудочков.
В отличие от наджелудочковых тахикардий, которые, как правило, наблюдаются у больных без какого-либо заболевания сердца, кроме самого факта наличия аритмии, желудочковые тахикардии в подав-
ляющем большинстве случаев развиваются у больных с выраженным органическим поражением сердца, например постинфарктным кардиосклерозом. Гораздо реже наблюдаются «идиопатические» желудочковые тахикардии у здоровых, в остальном, людей («у лиц без признаков органического поражения сердца»). Еще реже встречаются так называемые каналопатии - поражение различных ионных каналов клеточных мембран миокарда: синдромы удлиненного интервала QT, синдром короткого интервала QT, синдром Бругада, катехоламинергическая полиморфная желудочковая тахикардия.
Желудочковые тахикардии в подавляющем большинстве случаев развиваются у больных с выраженным органическим поражением сердца, чаще всего с постинфарктным кардиосклерозом
Лечение желудочковой тахикардии. Для купирования желудочковой тахикардии можно использовать амиодарон, лидокаин, соталол или новокаинамид: амиодарона - 300-450 мг в/в; лидокаина - 100 мг в/в, новокаинамида - 1 г в/в. Есть сообщения об использовании очень больших доз амиодарона. При тяжелых рефрактерных к медикаментозной и электроимпульсной терапии угрожающих жизни желудочковых тахиаритмиях, например, - это внутрь до 4-6 г в сутки в течение 3 дней (т.е. по 20-30 таблеток), далее по 2,4 г в сутки 2 дня (по 12 таблеток) с последующим снижением дозы. Кроме этих препаратов возможно применение гилуритмала, обзидана, сульфата магния. Интервалы между введением каждого препарата зависят от клинической ситуации. При выраженных нарушениях гемодинамики на любом этапе проводят электрическую кардиоверсию.
Для купирования желудочковой тахикардии используют амиодарон, лидокаин и новокаинамид
При идиопатической желудочковой тахикардии с комплексами типа блокады правой ножки и отклонением электрической оси влево наиболее эффективно назначение верапамила - в/в 10 мг или внутрь
240-320 мг.
Некоторые особенности имеет лечение желудочковой тахикардии типа «пируэт». У взрослых чаще всего эта тахикардия возникает при удлинении интервала QТ вследствие приема препаратов, в боль-
шинстве случаев - антиаритмических препаратов (приобретенный синдром удлиненного интервала QT). Лечение: отмена препарата, в/в введение сульфата магния - 2,5 г за 2-5 мин и далее капельно 3-20 мг в минуту. При отсутствии эффекта - электрокардиостимуляция с частотой 100 и более в минуту или капельное введение изадрина (2-10 мкг в минуту до ЧСС около 100 в минуту).
При врожденных и идиопатических синдромах удлинения интервала QT для предупреждения рецидивирования тахикардии типа «пируэт» назначают большие дозы бета-блокаторов, производят удаление левого звездчатого ганглия, а при неэффективности этих мероприятий применяют имплантацию кардиостимулятора (стимуляция с частотой 70-125 в минуту) в сочетании с приемом бета-блокаторов или имплантацию кардиовертера-дефибриллятора.
Трепетание и фибрилляция желудочков. Единственным способом прекращения трепетания или фибрилляции желудочков является проведение электрической дефибрилляции. Последовательность лечебных мероприятий при трепетании или фибрилляции желудочков, если это произошло в стационаре, можно представить в следующем виде.
1. Дефибрилляция - 360 Дж.
2. Реанимационные мероприятия по общим правилам: закрытый массаж сердца с частотой 100 в минуту, искусственная вентиляция легких в соотношении 15:2 (в рекомендациях Американской ассоциации сердца 2005 г. рекомендуется соотношение компрессий и вдохов 30:2).
3. Повторные попытки дефибрилляции - на фоне продолжения общих реанимационных мероприятий и повторного введения 1 мг адреналина через каждые 5 мин (желательно введение в центральные вены, но при отсутствии такой возможности вводят внутрисердечно). Кроме адреналина повторно, также через 5 мин вводят амиодарон - сначала 300 мг, далее - по 150 мг (реже используют новокаинамид).
4. Интубация, ИВЛ, продолжение реанимационных мероприятий.
ПРЕДУПРЕЖДЕНИЕ РЕЦИДИВИРОВАНИЯ ТАХИАРИТМИЙ
При частых приступах (например, около 1 раза в неделю) - последовательно назначают антиаритмические препараты и их комбинации до прекращения приступов. Наиболее эффективным является
назначение амиодарона или комбинаций амиодарона с другими антиаритмическими препаратами, прежде всего с бета-блокаторами.
При редко возникающих, но тяжелых приступах тахиаритмий подбор эффективной антиаритмической терапии удобно проводить с помощью чреспищеводной электростимуляции сердца - при наджелудочковых тахиаритмиях, и программированной эндокардиальной стимуляции желудочков (внутрисердечное электрофизиологическое исследование) - при желудочковых тахиаритмиях. С помощью электростимуляции в большинстве случаев удается индуцировать приступ тахикардии, идентичный спонтанно возникающим приступам у данного больного. Невозможность индукции приступа при повторной электрокардиостимуляции на фоне приема препаратов обычно совпадает с их эффективностью при длительном приеме. Следует отметить, что в некоторых проспективных исследованиях продемонстрировано преимущество «слепого» назначения амиодарона и соталола при желудочковых тахиаритмиях перед тестированием антиаритмических препаратов класса I с помощью программированной электростимуляции желудочков или мониторирования ЭКГ.
Препараты для предупреждения рецидивирования тахиаритмий подбирают методом «проб и ошибок», выбирая для постоянного приема наиболее эффективный и хорошо переносимый препарат
При тяжелом течении пароксизмальных тахиаритмий и рефрактерности к медикаментозной терапии применяют хирургические способы лечения аритмий, имплантацию кардиостимулятора и кардиовертера-дефибриллятора. Наиболее эффективным способом снижения риска внезапной смерти и общей смертности у больных с опасными для жизни желудочковыми аритмиями является имплантация кардиовертера-дефибриллятора.
Примерная последовательность подбора эффективной медикаментозной терапии у больных с рецидивирующими аритмиями:
1. Бета-блокатор или амиодарон
2. Бета-блокатор + амиодарон
3. Соталол или пропафенон
4. Другие антиаритмические препараты
5. Амиодарон + ААП класса Ic (Ib)
6. Бета-блокатор + любой препарат класса I
7. Амиодарон + бета-блокатор + ААП класса 1с (Ib)
8. Соталол + ААП класса Ic (Ib).
Эта схема предназначена для больных с органическим поражением сердца. У них препаратами выбора являются бета-блокаторы, амиодарон и соталол. У больных с идиопатическими тахиаритмиями возможен просто перебор антиаритмических препаратов с учетом противопоказаний, переносимости и эффективности, сначала в виде монотерапии, далее - различных комбинаций антиаритмических препаратов.
БРАДИАРИТМИИ
Существуют 2 причины брадиаритмий: нарушение функции синусового узла и АВ-блокады II-III степени.
Синдром слабости синусового узла
Термин «синдром больного синуса» предложен B.Lown в 1965 г. для обозначениия выраженных синусовых брадиаритмий, возникающих у некоторых больных с хронической мерцательной аритмией после проведения электрической кардиоверсии. В дальнейшем понятие «синдром больного синуса» было значительно расширено I.Ferrer (1968; 1973 гг.), которая включила в него не только нарушения функции синусового узла (СУ), но также мерцание предсердий и нарушения атриовентрикулярной проводимости. В нашей стране наибольшее распространение получили термины синдром слабости синусового узла (СССУ) и дисфункция синусового узла.
Термины СССУ и дисфункция синусового узла (синдром дисфункции СУ) являются синонимами и обозначают любые нарушения функции СУ, проявляющиеся брадиаритмиями. Электрокардиографические признаки дисфункции СУ:
1) синусовая брадикардия; 2) синоатриальная блокада II степени; 3) эпизоды остановки СУ.
Синусовой брадикардией принято считать урежение частоты синусового ритма менее 60 в минуту в дневное время. Синоатриальная (СА) блокада II степени и эпизоды остановки СУ на ЭКГ проявляются в виде так называемых синусовых пауз - периодов отсутствия зубца Р (прямая линия на ЭКГ). Во время синусовых пауз на ЭКГ часто регистрируются выскальзывающие сокращения и ритмы.
Если продолжительность синусовой паузы точно соответствует величине двух или трех интервалов РР, диагностируют СА-блокаду II степени (рис. 1.13). Вторым признаком СА-блокады является «классическая» периодика Самойлова-Венкебаха: прогрессивное укорочение интервалов РР перед синусовой паузой. В первом случае имеется СА-блокада II степени типа Мобитц-II , во втором - типа Мобитц-I. Во всех остальных случаях, когда продолжительность синусовых пауз не кратна величине интервала РР или не отмечается периодики Самойлова-Венкебаха, определить механизм возникновения пауз невозможно. Во время остановки электрической активности СУ продолжительность синусовой паузы может быть любой. Появление выскальзывающих сокращений еще более затрудняет дифференциальную диагностику. Следует отметить, что в исследованиях с прямой регистрацией электрограммы СУ выявлено, что причиной синусовых пауз, независимо от их продолжительности, в подавляющем большинстве случаев является СА-блокада. Клинические проявления, показания и характер лечебных мероприятий при остановках СУ и СА-блокаде абсолютно одинаковы, поэтому точное разграничение этих состояний не имеет никакого клинического значения.
Синдром слабости синусового узла включает выраженную синусовую брадикардию и/или синоатриальную блокаду
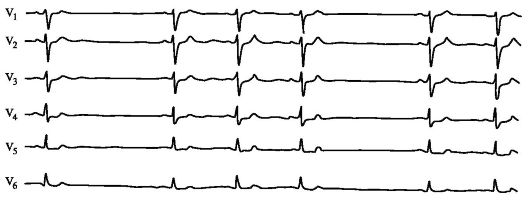 Рис. 1.13. Синоатриальная блокада II степени.
Рис. 1.13. Синоатриальная блокада II степени.
На ЭКГ - 2 эпизода синоатриальной блокады II степени (продолжительность пауз равна продолжительности двух сердечных циклов)
При сочетании синусовых брадиаритмий с пароксизмальными тахикардиями нередко используют термин «синдром брадикардиитахикардии». При этом в диагнозе необходимо указать конкретные электрокардиографические и клинические проявления СССУ и клиническую форму тахиаритмии. Чаще всего тахикомпонентом синдрома брадикардии-тахикардии у больных с СССУ является пароксизмальная мерцательная аритмия. Ее возникновению способствует как органическое поражение миокарда предсердий, так и повышение влияния блуждающего нерва на предсердия. У больных с синдромом брадикардии-тахикардии вероятность возникновения выраженных брадиаритмий особенно велика в момент прекращения пароксизмов тахикардии и восстановления синусового ритма.
Непосредственными причинами дисфункции СУ могут быть органическое поражение синоатриальной зоны или нарушения вегетативной регуляции сердца - преобладание вагусных воздействий. Термины СССУ и дисфункция СУ (синдром дисфункции СУ) являются синонимами. Как и любое нарушение ритма сердца, СССУ может быть бессимптомным или сопровождаться возникновением клинических симптомов. Основными клиническими проявлениями выраженной дисфункции СУ являются симптомы сердечной недостаточности и эпизоды внезапной потери сознания.
Симптомы сердечной недостаточности у больных с СССУ возникают вследствие отсутствия адекватного ускорения синусового ритма во время физической нагрузки.
Сердечный выброс или минутный объем кровообращения является одним из основных показателей функционального состояния сердца. Сердечный выброс равен произведению ударного объема на частоту сердечных сокращений. Поэтому при снижении ЧСС ниже определенной критической величины происходит уменьшение СВ. При СССУ отмечается снижение ЧСС в состоянии покоя. Кроме этого, у 40-50% больных с СССУ наблюдается так называемая хронотропная недостаточность (хронотропная несостоятельность) - неспособность к адекватному ускорению ЧСС под влиянием симпатико-адреналовой стимуляции. При физической нагрузке у таких больных не происходит адекватного повышения сердечного выброса. В покое и при небольших физических нагрузках сохранение и увеличение сердечного выброса обеспечивается за счет увеличения ударного объема, однако возможности этого компенсаторного механизма имеют предел и при повышении интенсивности физической нагруз-
ки возникают симптомы недостаточности кровообращения. Поэтому примерно у половины больных c СССУ само наличие дисфункции синусового узла является непосредственной причиной сердечной недостаточности, даже в отсутствие нарушения функционального состояния миокарда.
Эпизоды потери сознания (синкопальные состояния, приступы Морганьи-Адемса-Стокса) наступают при внезапном урежении ЧСС или во время асистолии продолжительстью более 5-10 с. Эти симптомы могут наблюдаться только при отсутствии адекватных выскальзывающих эктопических сокращений и ритмов. При хорошей функции центров вторичного автоматизма клинических симптомов может не быть даже при полном прекращении электрической активности СУ. На выраженность клинических симптомов влияет также функциональное состояние миокарда, наличие и степень поражения сосудов мозга. Известны случаи бессимптомной асистолии продолжительностью 15 с или ощущение всего лишь легкого головокружения при асистолии в течение 30 с (!).
При обследовании больных с СССУ примерно у 40% не удается обнаружить признаков какого-либо заболевания сердца. В таких случаях СССУ считается вариантом идиопатического поражения СУ, проводящей системы сердца или миокарда предсердий. В остальных случаях диагностируют ИБС, артериальную гипертонию, пороки сердца, кардиомиопатии, специфические поражения миокарда (2, 3). Определить, являются ли эти заболевания просто сопутствующими или играют этиологическую роль, в большинстве случаев очень трудно или невозможно. Кроме того, в России наблюдается значительная гипердиагностика ИБС и «постмиокардитического» кардиосклероза у больных с нарушениями ритма сердца вообще и при СССУ в частности.
Основной непосредственной причиной вторичной дисфункции СУ является повышенная активность блуждающего нерва или повышение чувствительности СУ к вагусным влияниям. Признаком вторичной (вагусной) дисфункции СУ является нормальная реакция синусового ритма на атропин - повышение ЧСС более 90 в минуту после внутривенного введения атропина (0,02 мг/кг).
При проведении научных исследований нередко используют определение так называемой внутренней ЧСС после фармакологической вегетативной блокады сердца (вегетативной денервации сердца). «Внутреннюю ЧСС» определяют после внутривенного введения
обзидана 0,2 мг/кг), а затем атропина (0,04 мг/кг): «внутренняя ЧСС» = 118,1 - (0,57 X возраст). «Внутренняя ЧСС» у здоровых лиц выше, чем ЧСС в состоянии покоя, и у людей в возрасте 19-30 лет составляет в среднем 105 в минуту, в возрасте 55-64 лет - 85 в минуту. Недостаточное увеличение, а тем более снижение «внутренней ЧСС» является признаком органического поражения СУ. Интересно, что применение фармакологической вегетативной денервации сердца было сначала предложено как метод неинвазивной оценки функционального состояния миокарда - у больных с дисфункцией левого желудочка выявлено снижение «внутренней ЧСС», не связанное с нарушением функции СУ.
Причиной СССУ может быть органическое поражение синусового узла и синоатриальной зоны или нарушение вегетативной регуляции - преобладание вагусных влияний на сердце
Следует отметить, что практическая необходимость в проведении фармакологических проб возникает крайне редко. Выявление причины, возможно, вторичной дисфункции СУ проводится на основании данных анамнеза и общеклинического обследования.
Всех больных с СССУ можно разделить на три группы.
1. Больные с клиническими симптомами (прежде всего с синкопальными состояниями или с симптомами сердечной недостаточности), у которых на обычной ЭКГ регистрируются признаки выраженной дисфункции СУ (синусовая брадикардия менее 40 в минуту, СА-блокада II степени). Очевидно, что причиной этих симптомов почти наверняка является дисфункция СУ. Таким больным показана имплантация кардиостимулятора.
2. Больные без клинических симптомов, у которых признаки дисфункции СУ выявлены случайно при регистрации ЭКГ. Такие больные в дополнительном обследовании и лечении не нуждаются.
3. Больные с симптомами сердечной недостаточности и с эпизодами головокружения или синкопальными состояниями, у которых имеются признаки умеренно выраженной дисфункции СУ, но не ясно, является ли дисфункция СУ причиной этих симптомов. Наибольшие трудности представляет обследование и лечение больных 3-й группы. Этим больным показано полное обследование с целью установления взаимосвязи между клиническими симптомами и нарушением функции СУ.
Применяют два метода инструментального исследования: мониторирование ЭКГ и пробу с частой стимуляцией предсердий. Мониторирование ЭКГ в течение суток и более значительно повышает вероятность выявления явных признаков дисфункции СУ и в ряде случаев позволяет документировать взаимосвязь между клиническими симптомами и нарушениями ритма, включая дисфункцию СУ. С другой стороны, регистрация нормального ритма во время ощущения головокружения или в момент потери сознания исключает нарушения ритма как причину этих симптомов. Однако даже при использовании повторого суточного мониторирования ЭКГ или мониторирования ЭКГ в течение двух суток установить или исключить нарушения ритма как причину синкопальных состояний удается довольно редко, в основном у больных с частыми симптомами. Признаками дисфункции СУ при проведении суточного мониторирования ЭКГ является регистрация эпизодов синусовой брадикардии менее 40 в минуту в дневное время и менее 30 в минуту во время сна или синусовых пауз продолжительностью более 3 с. Больным, у которых не удалось точно определить, что причиной клинических симптомов является дисфункция СУ, показано проведение пробы с частой стимуляцией предсердий. Вполне достаточно использование чреспищеводной электростимуляции. Основным электрофизиологическим способом оценки функции СУ является определение времени восстановления функции СУ (ВВФСУ) - продолжительность паузы после прекращения частой стимуляции предсердий. Увеличение ВВФСУ более 1,5 с (1500 мс) свидетельствует о нарушении функции СУ. Поскольку продолжительность ВВФСУ зависит от исходной частоты синусового ритма, обычно используют так называемое корригированное ВВФСУ (КВВФСУ), которое равняется разнице между длительностью ВВФСУ и величиной исходного интервала РР. Значения КВВФСУ, превышающие 500-600 мс, крайне редко выявляются у лиц с нормальной функцией СУ и считаются высокоспецифичным признаком СССУ. Вместе с тем примерно у 50% больных с выраженной дисфункцией СУ эти показатели находятся в пределах нормы. Таким образом, нормальные результаты пробы с частой стимуляцией предсердий не позволяют исключить наличие дисфункции СУ.
Имеются сообщения, что ВВФСУ можно также определить с помощью внутривенного введения аденозина (12 мг) или АТФ (10 мг). Максимальную продолжительность интервала РР после
введения аденозина или АТФ оценивают так же, как и ВВФСУ при пробе с частой стимуляцией предсердий.
Примерная формулировка диагноза у больных с синдромом слабости синусового узла: «СССУ: выраженная синусовая брадикардия, частые эпизоды СА-блокады II степени. Пароксизмальное мерцание предсердий (синдром брадикардии-тахикардии). Синкопальные состояния. ХСН-I ст., ФК-II.
Лечение больных с СССУ. Единственным способом, эффективно устраняющим проявления дисфункции СУ, является имплантация кардиостимулятора. Документация связи клинических симптомов с наличием дисфункции СУ или выявления значительного увеличения ВВФСУ (например, более 3-5 с) у больных с клиническими симптомами служит показанием к имплантации кардиостимулятора. В остальных случаях решение принимают в зависимости от клинической ситуации: повторное проведение мониторирования ЭКГ и пробы с частой стимуляцией предсердий или имплантация кардиостимулятора ex juvantibus.
Не так давно представление о СССУ связывалось с непосредственной угрозой для жизни. Казалось очевидным, что у больных с СССУ повышен риск внезапной смерти. В результате длительное время были необоснованно расширены показания к «профилактической» имплантации кардиостимулятора. В настоящее время установлено, что прогноз при СССУ целиком определяется характером основного заболевания. Дисфункция СУ сама по себе не является фактором риска внезапной смерти. Продолжительность жизни лиц с дисфункцией СУ, но без других признаков поражения сердечно-сосудистой системы такая же, как и у здоровых людей. Имплантация кардиостимулятора не увеличивает продолжительности жизни даже у больных с выраженными клиническими симптомами дисфункции СУ, а только устраняет симптомы, прежде всего синкопальные состояния. Эта операция является не жизнеспасающим, а только симптоматическим способом лечения.
Следует отметить, что все эти данные получены при длительном наблюдении за больными с имплантированными кардиостимуляторами для электростимуляции желудочков в режиме «деманд». В последние 10 лет появились сообщения о существенных преимуществах «физиологической» электростимуляции: стимуляции предсердий (или двухкамерной стимуляции). При стимуляции предсердий гораздо реже наблюдается развитие хронической мерцательной
аритмии или появление сердечной недостаточности, чем при стимуляции желудочков. Более того, отмечена тенденция к увеличению продолжительности жизни у больных с сердечной недостаточностью при проведении стимуляции предсердий по сравнению со стимуляцией желудочков. При наличии хронотропной недостаточности эффективна ритм-адаптивная стимуляция, когда частота стимуляции изменяется в зависимости от активности больного, полностью имитируя функцию нормального синусового узла. Кроме того, при ритм-адаптивной стимуляции желудочков отмечается заметное повышение физической работоспособности и улучшение состояния больных.
Лекарственных средств, эффективно устраняющих хроническую или рецидивирующую дисфункцию СУ, не существует. Применение холинолитических или симпатомиметических препаратов оправдано при острых эпизодах брадиаритмии. Тем не менее при невозможности применения электрокардиостимуляции или при отказе больного от имплантации кардиостимулятора больным с клиническими симптомами можно назначить эуфиллин (0,45 г/сут) или апрессин (50- 150 мг/сут). Чаще всего используют пролонгированные препараты теофиллина - теопек или теотард. На фоне приема этих препаратов отмечено ускорение синусового ритма примерно на 20-25%, повышение физической работоспособности и прекращение синкопальных состояний у многих больных. Более того, в исследовании THEOPACE показано, что прием теофиллина предотвращает возникновение или прогрессирование сердечной недостаточности у больных с СССУ.
Заслуживает отдельного обсуждения вопрос о тактике лечебных мероприятий у больных СССУ с сопутствующими пароксизмальными аритмиями - синдром брадикардии-тахикардии. Как было отмечено, тахикардиальным компонентом синдрома брадикардии-тахикардии в большинстве случаев (в 80-90%) является пароксизмальная мерцательная аритмия. Больным с клиническими симптомами, вызванными дисфункцией СУ, особенно с повторными синкопальными состояниями, показана имплантация кардиостимулятора. У больных с кардиостимулятором можно использовать любые антиаритмические препараты. При возникновении пароксизма мерцания или трепетания предсердий у больных без кардиостимулятора, если частота сокращений желудочков превышает 130-160 в минуту, для ее урежения используют внутривенное введение дигоксина. Назначение верапамила или бета-блокаторов для
урежения ЧСС при тахисистолической форме может быть опасным, так как эти препараты нередко вызывают угнетение функции СУ после восстановления синусового ритма. После достижения ЧСС менее 100 в минуту (или при исходной нормосистолической форме мерцательной аритмии) можно попытаться восстановить синусовый ритм с помощью внутривенного введения или приема внутрь новокаинамида, дизопирамида (ритмилена) или хинидина. Вместе с тем во многих случаях, возможно, нецелесообразно добиваться обязательного купирования мерцательной аритмии и восстановления синусового ритма, достаточно только контролировать ЧСС с помощью продолжения приема дигоксина. У 25-40% больных рано или поздно устанавливается постоянная форма мерцательной аритмии, что некоторые авторы даже приравнивают к «самоизлечению» от дисфункции СУ.
Для предупреждения возникновения повторных пароксизмов мерцательной аритмии наиболее эффективна имплантация кардиостимулятора и проведение постоянной стимуляции предсердий и/или назначение антиаритмических препаратов: кордарона, этацизина, аллапинина, хинидина или дизопирамида. Однако назначение антиаритмических препаратов больным без кардиостимулятора требует повышенной осторожности. В этих случаях подбор профилактической терапии желательно проводить в условиях стационара. Больным с синдромом брадикардии-тахикардии при частом рецидивировании мерцательной аритмии, наличии выраженного органического поражения миокарда или сердечной недостаточности для предотвращения тромбоэмболий показано назначение аспирина (300 мг/сут) или варфарина (МНО = 2,0-3,0).
Атриовентрикулярные блокады
Различают 3 степени АВ-блокады. Удлинение интервала PR более 0,2 с считается АВ-блокадой I степени.
Среди АВ-блокад II степени принято различать АВ-блокады типа
I (Мобитц I, периодика Самойлова-Венкебаха) и типа II (Мобитц
II).
При типе I отмечается прогрессивное удлинение интервала PR вплоть до выпадения желудочкового комплекса (рис. 1.14), а при типе
II происходит внезапное выпадение комплексов QRS, интервал PR остается стабильным (рис. 1.15). При АВ-блокаде типа I происходит
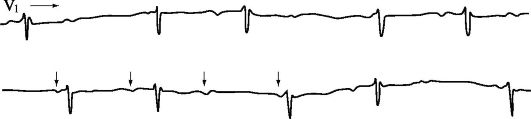 Рис. 1.14. АВ-блокада II степени (Мобитц I).
Рис. 1.14. АВ-блокада II степени (Мобитц I).
На ЭКГ АВ-блокада II степени типа Мобитц I (заметна периодика Самойлова-Венкебаха 3:2; удлинение каждого 2-го интервала PR и выпадение каждого 3-го комплекса QRS)
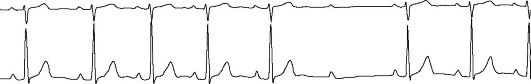 Рис. 1.15. АВ-блокада II степени (Мобитц II).
Рис. 1.15. АВ-блокада II степени (Мобитц II).
На ЭКГ регистрируется выпадение 6-го комплекса QRS без изменений продолжительности интервала PR
нарушение проведения импульсов на уровне АВ-узла, а при блокаде типа II - на уровне системы Гиса-Пуркинье. При АВ-блокаде типа II, если комплексы QRS нормальные (неуширенные) - значит, уровень поражения - пучок Гиса, если желудочковые комплексы уширены (как правило, по типу бифасцикулярной блокады) - вероятно, уровень поражения - все три ветви пучка Гиса. АВ-блокаду II степени, при которой выпадают 2 и более комплексов QRS подряд, называют «далекозашедшей» АВ-блокадой или «АВ-блокадой высокой степени».
Полная АВ-блокада также может быть или на уровне АВ-узла, или на уровне системы Гиса-Пуркинье. В первом случае регистрируется выскальзывающий ритм АВ-соединения - обычно около 50 в минуту (рис. 1.16), во втором - идиовентрикулярный ритм, как правило, с частотой около 30-40 в минуту.
АВ-блокады могут быть на уровне АВ-узла (проксимальные блокады) и на уровне системы Гиса-Пуркинье (дистальные блокады)
 Рис. 1.16. Полная АВ-блокада.
Рис. 1.16. Полная АВ-блокада.
На ЭКГ регистрируется полная АВ-блокада, ритм АВ-соединения с частотой 50 в мин. Стрелками указаны зубцы Р (отмечаются независимые сокращения предсердий и желудочков)
Если при АВ-блокаде II степени выпадают более 1 комплекса подряд, такую блокаду принято называть «далекозашедшей АВ-блокадой II степени» или «неполной АВ-блокадой высокой степени». В острых ситуациях при возникновении блокад II-III степени на уровне АВ-узла, в случае появления признаков нарушения гемодинамики используют в/в введение атропина и/или эуфиллина; при возникновении АВ-блокад на уровне системы Гиса-Пуркинье обычно необходимо применение симпатомиметиков или электрокардиостимуляции.
Неотложное лечение брадиаритмий при возникновении эпизодов потери сознания (приступов Морганьи-Адемса-Стокса):
1. «Кулачный ритм» (ритмичное покалачивание в области грудины).
2. Атропин - в/в 0,75-1,0 мг (при отсутствии эффекта - эуфиллин в/в 240 мг).
3. Адреналин - в/в капельно 2-10 мкг/мин (можно использовать астмопент, алупент, изадрин, ингаляции бета-2-стимуляторов).
4. Временная электрокардиостимуляция.
Единственным способом лечения хронических АВ-блокад II-III степени, сопровождающихся возникновением клинических симптомов (прежде всего эпизодов потери сознания), является имплантация электрокардиостимулятора. Многие специалисты считают показанием к имплантации кардиостимулятора наличие даже бессимптомной блокады II степени типа II или полной АВ-блокады дистального типа (на уровне системы Гиса-Пуркинье).
При стимуляции желудочков стимулирующие электроды расположены в области верхушки правого желудочка, поэтому комплексы QRS напоминают блокаду левой ножки пучка Гиса с отклонением электрической оси сердца влево - во всех отведениях, кроме aVL регистрируются комплексы типа rS или QS. Если стимулятор работает в режиме «деманд» («по требованию», режим VVI), то в моменты восстановления собственного ритма на ЭКГ отмечаются изменения сегмента ST и зубца Т, чаще всего появление отрицательных зубцов Т почти во всех отведениях. Это постстимуляционный синдром, причиной которого являются чисто электрические явления, не связанные с ишемией миокарда, отрицательные зубцы Т, как правило, появляются в тех отведениях, в которых во время стимуляции комплексы QRS отрицательны.
Единственным способом лечения хронических АВ-блокад II-III степени, сопровождающихся возникновением клинических симптомов (прежде всего эпизодов потери сознания), является имплантация кардиостимулятора
Кроме изолированной стимуляции предсердий или желудочков, возможно проведение двухкамерной (бифокальной) стимуляции, когда сначала стимулируются предсердия, а через определенный интервал - желудочки (режим DDD). Еще одним вариантом электрокардиостимуляции является «Р-управляемая» или «Р-синхронизированная» стимуляция желудочков, когда желудочки стимулируются через определенный интервал после спонтанного зубца Р.