Руководство по кардиологии: учебное пособие в 3 т. / под ред. Сторожакова Г.И., Горбаченкова А.А. - 2009. - Т. 3. - 512 с.: ил.
|
|
|
|
ГЛАВА 2 ПОСТОЯННАЯ ЭЛЕКТРОКАРДИОСТИМУЛЯЦИЯ И ДЕФИБРИЛЛЯЦИЯ
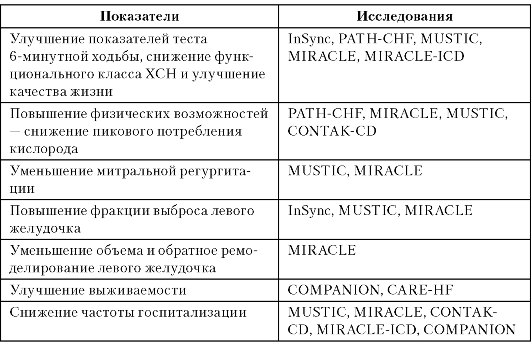
В главе рассматриваются актуальные проблемы электрокардиотерапии сердечной недостаточности (установка кардиоресинхронизирующих устройств) в том числе у больных, относящихся к категории высокого риска внезапной сердечной смерти (использование электрокардиостимуляторов, кардиовертеров-дефибрилляторов). Обсуждаются этиология, патогенез, классификация, клинические проявления, возможности методов клинической, инструментальной и интервенционной диагностики, показания и противопоказания к электрокардиотерапии.
Ключевые слова: электрокардиостимуляция, дисфункция синусового узла, блокады сердца, кардиовертеры-дефибрилляторы, внезапная сердечная смерть, сердечный арест, желудочковая тахикардия, фибрилляция желудочков, сердечная недостаточность, желудочковая десинхронизация, кардиоресинхронизирующие устройства.
постоянная электрокардиостимуляция
Имплантация электрокардиостимуляторов
Постоянная электрокардиостимуляция реализуется путем имплантации системы электрокардиостимуляции, состоящей из электрокардиостимулятора (ЭКС) и электродов. Как правило, оперативное вмешательство выполняется с использованием сочетанной анестезии (местная анестезия и парентеральные седативные средства). Перед операцией с помощью программатора оценивают состояние батареи электрокардиостимулятора. Для имплантации электродов в большинстве случаев используется эндокардиальная методика. Электроды под флюороскопическим контролем устанавливают и фиксируют в правом предсердии и/или правом желудочке, с помощью наружного стимулятора проводится их тестирование (оцениваются импедансы, пороги стимуляции и амплитуда спонтанных биоэлектрических потенциалов). Ложе аппарата ЭКС формируется в подключичной области подкожно или субфасциально. Для профилактики инфекционных осложнений внутривенно назначают антибиотики.
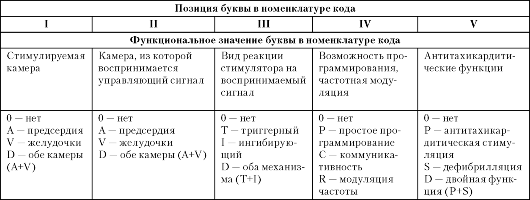
Единый номенклатурный код
В настоящее время в международной практике для обозначения имплантируемых ЭКС и кардиовертеров-дефибрилляторов используется пятибуквенный номенклатурный код, который был разработан рабочей группой Североамериканского общества по электрокардиостимуляции и электрофизиологии (NASPE) и Британской группой по электрокардиостимуляции и электрофизиологии (BPEG) (см. табл. 2.1).
Буква в первой позиции кода обозначает камеру сердца, к которой поступает стимулирующий импульс. Вторая буква указывает на камеру сердца, из которой электрокардиостимулятором воспринимается спонтанный биоэлектрический сигнал. Буква в третьей позиции кода иллюстрирует режим, в котором система стимуляции
Таблица 2.1
Единый код ЭКС номенклатура NBG NASPE/BPEG (1987 г.)
 отвечает
на спонтанную электрическую активность сердца (I - стимуляция
запрещается спонтанным сигналом из сердца, т.е. если есть спонтанная
электрическая активность, то устройство не работает; Т - стимуляция
запускается спонтанным сигналом из сердца, т.е. спонтанная электрическая
активность предсердий запускает P-синхронизированную стимуляцию
желудочков при двухкамерной ЭКС). Четвертая позиция кода характеризует
возможности наружного (неинвазивного) программирования параметров
стимуляции, а также наличие в системе ЭКС частотно-адаптивной функции.
Буква в пятой позиции свидетельствует о наличии в системе ЭКС функции
антитахикардитической стимуляции, включая кардиоверсию или
дефибрилляцию.
отвечает
на спонтанную электрическую активность сердца (I - стимуляция
запрещается спонтанным сигналом из сердца, т.е. если есть спонтанная
электрическая активность, то устройство не работает; Т - стимуляция
запускается спонтанным сигналом из сердца, т.е. спонтанная электрическая
активность предсердий запускает P-синхронизированную стимуляцию
желудочков при двухкамерной ЭКС). Четвертая позиция кода характеризует
возможности наружного (неинвазивного) программирования параметров
стимуляции, а также наличие в системе ЭКС частотно-адаптивной функции.
Буква в пятой позиции свидетельствует о наличии в системе ЭКС функции
антитахикардитической стимуляции, включая кардиоверсию или
дефибрилляцию.
В октябре 2001 г. рабочими группами NASPE и BPEG была предложена обновленная версия пятибуквенного номенклатурного кода для антибрадикардитических устройств, приведенного в табл. 2.2.
Как правило, для обозначения вида и режима электрокардиостимуляции используются первые три буквы кода (например: VVI, AAI, DDD), а буква R (IV позиция) используется для обозначения программируемых ЭКС с функцией частотной адаптации сердечного
ритма (например, VVIR, AAIR, DDDR).
Под частотной адаптацией или модуляцией следует понимать способность устройства увеличивать или уменьшать частоту стимуляции в пределах запрограммированных величин при активации сенсора нагрузок во время нарастания или прекращения физической активности, изменения психо-эмоционального статуса пациента.
Режимы постоянной электрокардиостимуляции
Далее приведены краткие характеристики наиболее часто используемых в современной практике режимов постоянной электрокардиостимуляции.
VVI - однокамерная желудочковая стимуляция в режиме «по требованию». Под данным режимом стимуляции понимают однокамерную "demand"-стимуляцию желудочков, которая осуществляется при снижении частоты спонтанного ритма сердца ниже установленного значения фиксированной частоты стимуляции и прекращается в случае превышения спонтанным ритмом сердца установленных частотных границ (I - ингибирующий механизм управления работы ЭКС). На рис. 2.1 приведен фрагмент ЭКГ, иллюстрирующий элек-
Таблица 2.2
Обновленный единый код ЭКС - номенклатура NBG - NASPE/BPEG (2001)
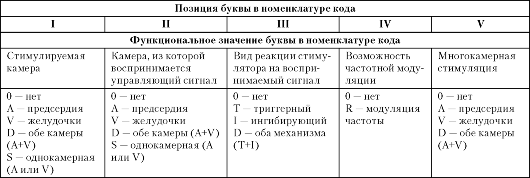
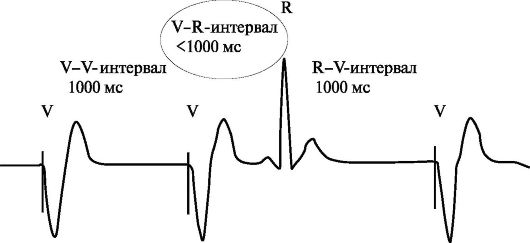 Рис. 2.1. Фрагмент
ЭКГ, иллюстрирующий однокамерную желудочковую стимуляцию «по
требованию» (VVI-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Рис. 2.1. Фрагмент
ЭКГ, иллюстрирующий однокамерную желудочковую стимуляцию «по
требованию» (VVI-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Примечание. V-V-интервал - интервал между двумя последовательными желудочковыми стимулирующими импульсами - интервал желудочковой стимуляции (например, при базовой частоте стимуляции 60 имп/мин V-V-интервал равен 1000 мс); V-R-интервал - интервал между стимулирующим импульсом и последующим спонтанным сокращением желудочков сердца (при базовой частоте стимуляции 60 имп/мин V-R-интервал менее 1000 мс); R-V-интервал - интервал между спонтанным сокращением желудочков сердца и последующим стимулирующим импульсом в случае снижения частоты спонтанных сокращений желудочков ниже базовой частоты стимуляции (при базовой частоте стимуляции 60 имп/мин R-V-интервал равен 1000 мс)
трокардиостимуляцию в режиме VVI-60 имп/мин (базовая частота стимуляции).
Базовая частота стимуляции (нижняя граница частоты стимуляции) - частота, с которой осуществляется стимуляция желудочков или предсердий в отсутствие спонтанных сокращений (спонтанного ритма). Как показано на рис. 2.1, при снижении спонтанной частоты желудочковых сокращений менее 60 уд/мин (R-R интервал более 1000 мс) начинает осуществляться однокамерная стимуляция желудочков с частотой 60 имп/мин (V-V интервал 1000 мс). В том случае, если после нанесенного импульса в течение 1000 мс происходит детекция спонтанного желудочкового сокращения,
работа кардиостимулятора ингибируется (ингибирующий механизм управления работы ЭКС), и пациент находится на спонтанном сердечном ритме (при этом ЧСС более 60 уд/мин). Если после спонтанного сокращения желудочков в течение 1000 мс не происходит детекция очередного спонтанного комплекса QRS, возобновляется стимуляция желудочков с частотой 60 имп/мин. Необходимо отметить, что интервалы V-V и R-V равны и превышают интервал V-R (см. рис. 2.1).
Точка приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположена в правом желудочке сердца. Недостатками данного вида электрокардиотерапии является то, что в ходе стимуляции нарушается адекватная предсердно-желудочковая синхронизация, что и обусловливает клинические признаки хронотропной недостаточности. По мнению большинства авторов, это является основным механизмом развития синдрома электрокардиостимулятора.
AAI - однокамерная предсердная стимуляция в режиме «по требованию» (рис. 2.2). Под данным режимом стимуляции понимают однокамерную «demand» стимуляцию предсердий, которая осуществляется при снижении частоты спонтанного предсердного ритма ниже установленного значения фиксированной частоты стимуляции и прекращается в случае превышения спонтанным ритмом сердца установленных частотных границ (I - ингибирующий механизм управления работы ЭКС).
При снижении частоты спонтанного предсердного ритма (рис. 2.2) ниже базовой частоты стимуляции (P-P-интервал больше запрограммированного интервала стимуляции (A-A-интервал), при базовой частоте стимуляции 60 имп/мин A-A-интервал равен 1000 мс) осуществляется однокамерная стимуляция предсердий с базовой частотой. В ситуации, когда после нанесенного на предсердия стимулирующего импульса в течение интервала стимуляции регистрируется спонтанное сокращение предсердий, работа кардиостимулятора ингибируется, и пациент находится на спонтанном синусовом ритме (при этом ЧСС превышает базовую частоту стимуляции). Если после спонтанного предсердного сокращения в течение интервала стимуляции не происходит детекция очередной спонтанной Р-волны, возобновляется предсердная стимуляция с фиксированной частотой. Необходимо отметить, что интервалы A-A и P-A равны и превышают интервал A-P (рис. 2.2).
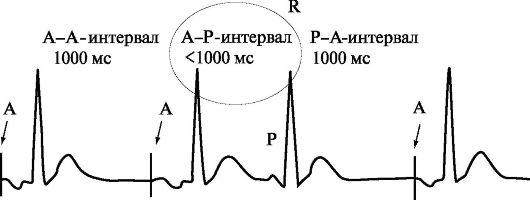 Рис. 2.2. Фрагмент
ЭКГ, иллюстрирующий однокамерную предсердную стимуляцию «по требованию»
(AAI-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Рис. 2.2. Фрагмент
ЭКГ, иллюстрирующий однокамерную предсердную стимуляцию «по требованию»
(AAI-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Примечание. A-A-интервал - интервал между двумя последовательными предсердными стимулирующими импульсами - интервал предсердной стимуляции (например, при базовой частоте стимуляции 60 имп/мин A-A-интервал равен 1000 мс); A-P-интервал - интервал между стимулирующим импульсом и последующим спонтанным сокращением предсердий сердца (при базовой частоте стимуляции 60 имп/мин A-P-интервал менее 1000 мс); P-A-интервал - интервал между спонтанным сокращением предсердий сердца и последующим стимулирующим импульсом в случае снижения частоты спонтанных сокращений предсердий ниже базовой частоты стимуляции (при базовой частоте стимуляции 60 имп/мин P-A-интервал равен 1000 мс)
Точка приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположена в правом предсердии сердца. При данном виде электрокардиотерапии сохраняется адекватная предсердно-желудочковая синхронизация, что позволяет определить ее как физиологическую. Недостатками AAI-ЭКС является отсутствие возможности частотной адаптации сердечного ритма у пациентов с хронотропной недостаточностью, так как нет функции частотной модуляции (R в четвертой позиции кода), а также невозможность использовать данный вид ЭКС у пациентов с нарушением атриовентрикулярной проводимости.
VVIR - однокамерная желудочковая частотно-адаптивная стимуляция. При данном виде стимуляции осуществляется однокамерная частотно-адаптивная стимуляция желудочков с ингибирующим механизмом управления работы ЭКС. Ингибирующий механизм управления подразумевает отсутствие (прекращение) стимуляции
при адекватной электрической активности сердца, сенсируемой устройством в указанной камере сердца (V - желудочек, т.е. R-запре- щающая стимуляция желудочков, где R - зубец комплекса QRS, не путать с R - функция частотной модуляции). Точка приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположена в правом желудочке сердца. Данный вид электрокардиотерапии, так же как и в VVI-ЭКС, приводит к нарушению адекватной предсердно-желудочковой синхронизации.
AAIR - однокамерная предсердная частотно-адаптивная стимуляция. При данном виде стимуляции осуществляется однокамерная частотно-адаптивная стимуляция предсердий с ингибирующим механизмом управления работы ЭКС. Ингибирующий механизм управления подразумевает отсутствие (прекращение) стимуляции при адекватной электрической активности сердца, сенсируемой устройством в указанной камере сердца (А - предсердие, т.е. P-запрещающая стимуляция предсердий, где Р - зубец, иллюстрирующий электрическую активацию предсердий). Точка приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположена в правом предсердии сердца (невозможно использовать у пациентов с нарушениями АВ-проводимости). При данном виде электрокардиотерапии сохраняется адекватная предсердно-желудочковая синхронизация и имеется возможность частотной адаптации (модуляция) ритма сердца у пациентов с признаками хронотропной недостаточности.
VDD - однокамерная Р-синхронизированная стимуляция, при которой осуществляется стимуляция желудочков с сохранением адекватной предсердно-желудочковой синхронизации. При данном виде ЭКС используется как ингибирующий (R-запрещающая стимуляция желудочков, где R - зубец комплекса QRS, не путать с R - функция частотной модуляции), так и триггерный механизмы управления работы электрокардиостимулятора. Триггерный механизм управления подразумевает запуск стимуляции желудочков в ответ на адекватную электрическую активность сердца, сенсируемую в предсердиях (P-индуцированная стимуляция желудочков, где Р - зубец, иллюстрирующий электрическую активацию предсердий).
На рис. 2.3 приведен фрагмент ЭКГ, иллюстрирующий электрокардиостимуляцию в режиме VDD с базовой частотой стимуляции 60 имп/мин. Необходимым условием эффективной стимуляции в режиме VDD является превышение частоты спонтанного предсер-
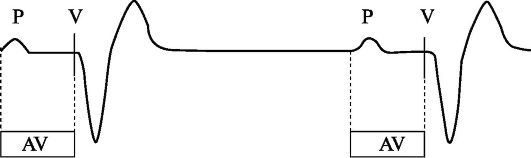 Рис. 2.3. Фрагмент ЭКГ, иллюстрирующий однокамерную предсердно-синхронизированную стимуляцию желудочков (VDD-стимуляция). Примечание. P
- спонтанное сокращение предсердий (спонтанная P-волна); AV -
предсердно-желудочковая (атриовентрикулярная) задержка; V -
стимулирующий импульс, нанесенный на желудочки (синхронизированный со
спонтанной P-волной)
Рис. 2.3. Фрагмент ЭКГ, иллюстрирующий однокамерную предсердно-синхронизированную стимуляцию желудочков (VDD-стимуляция). Примечание. P
- спонтанное сокращение предсердий (спонтанная P-волна); AV -
предсердно-желудочковая (атриовентрикулярная) задержка; V -
стимулирующий импульс, нанесенный на желудочки (синхронизированный со
спонтанной P-волной)
дного ритма базовой частоты стимуляции. После восприятия спонтанного предсердного сигнала запускается интервал атриовентрикулярной (АВ) задержки. Атриовентрикулярная (АВ) задержка - это интервал, который начинается от предсердного события (искусственно вызванного или спонтанного) и заканчивается нанесением стимула на желудочек при условии того, что в этот временной период не будет воспринято спонтанное желудочковое сокращение. В большинстве случаев значение АВ-задержки устанавливается в пределах от 150 до 180 мс. Таким образом, если за период АВ-задержки не происходит спонтанного сокращения желудочков, осуществляется P-синхронизированная стимуляция желудочков. Адекватная предсердно-желудочковая синхронизация будет сохраняться до момента достижения спонтанным ритмом предсердий частоты, равной установленному значению максимальной частоты синхронизации. Максимальная частота синхронизации (верхняя граница частоты стимуляции) - частота, до достижения которой синхронизированная со спонтанной предсердной активностью стимуляция желудочков осуществляется в соотношении 1:1, а при превышении ее начинается пейсмейкерная периодика Венкебаха.
При VDD-стимуляции точка приложения ЭКС расположена в правом желудочке сердца, а точки детекции спонтанных биоэлектрических сигналов - в правом предсердии и правом желудочке.
Существенным недостатком данного вида ЭКС является то, что при снижении частоты спонтанного предсердного ритма ниже установленных значений базовой частоты стимуляции нарушается предсердно-желудочковая синхронизация (режим VDD переходит в режим VVI), так как отсутствует возможность стимуляции предсердий. Данный вид постоянной электрокардиотерапии не применим у пациентов с признаками хронотропной недостаточности синусового узла.
DDD - двухкамерная электрокардиостимуляция. Данный вид стимуляции позволяет сохранять адекватную предсердно-желудочковую синхронизацию постоянно, так как при снижении частоты спонтанного предсердного ритма ниже установленных значений минимальной (базовой) частоты стимуляции осуществляется последовательная стимуляция как предсердий, так и желудочков. В ситуации, когда частота спонтанного предсердного ритма превышает минимальную частоту стимуляции, осуществляется однокамерная Р-синхронизированная (т.е. предсердно-синхронизированная) стимуляция желудочков (VDD-ЭКС).
При DDD-ЭКС используется как ингибирующий (P- и R-запре- щающая стимуляция, где R - зубец комплекса QRS, не путать с R - функцией частотной модуляции, а Р - зубец, иллюстрирующий электрическую активацию предсердий), так и триггерный (P-инду- цированная стимуляция желудочков, где Р - зубец, иллюстрирующий электрическую активацию предсердий) механизмы управления работы электрокардиостимулятора. Если частота спонтанного предсердного ритма ниже установленного значения базовой частоты стимуляции, наносится стимулирующий импульс на предсердия. В том случае, если за период запрограммированной АВ-задержки не происходит спонтанного сокращения, стимулятором наносится импульс на желудочки (рис. 2.4).
При DDD-ЭКС точки приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположены в двух камерах сердца (в правом предсердии и правом желудочке). Недостатком данного вида ЭКС является отсутствие возможности частотной адаптации сердечного ритма у пациентов с признаками хронотропной недостаточности.
В зависимости от частоты спонтанного предсердного ритма и состояния атриовентрикулярной проводимости возможны несколько вариантов двухкамерной DDD-стимуляции.
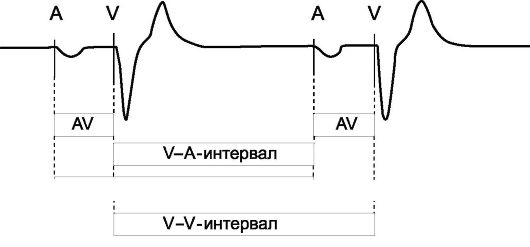
Рис. 2.4. Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (DDD-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Примечание. A - стимулирующий импульс, нанесенный на предсердия; AV - предсердно-желудочковая (атриовентрикулярная) задержка; V - стимулирующий импульс, нанесенный на желудочки; A-A-интервал - интервал между двумя последовательными предсердными стимулирующими импульсами - интервал предсердной стимуляции (при базовой частоте стимуляции 60 имп/мин A-A интервал равен 1000 мс); V-V-интер- вал - интервал между двумя последовательными желудочковыми стимулирующими импульсами - интервал желудочковой стимуляции (при базовой частоте стимуляции 60 имп/мин V-V интервал равен 1000 мс); V-A-интервал - интервал между желудочковым импульсом и последующим стимулирующим импульсом на предсердия (V-A равен V-V (A-A) минус AV-задержка))
При низкой частоте спонтанного предсердного ритма (ниже базовой частоты стимуляции) и нарушенном атриовентрикулярном проведении будет осуществляться двухкамерная «секвенциальная» электрокардиостимуляция с установленной базовой частотой (рис. 2.5).
В ситуации, когда частота спонтанного предсердного ритма ниже базовой частоты стимуляции, а АВ-проводимость не нарушена (т.е. в период установленной атриовентрикулярной задержки происходят спонтанные желудочковые сокращения), осуществляется предсердная стимуляция с установленной базовой частотой (рис. 2.6).
При сохраненной адекватной спонтанной активности предсердий (частота предсердного ритма превышает базовую частоту сти-
 Рис. 2.5. Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (DDD-стимуляция).
Рис. 2.5. Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (DDD-стимуляция).
Примечание. A - стимулирующий импульс, нанесенный на предсердия; V - стимулирующий импульс, нанесенный на желудочки
1
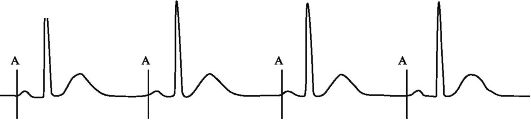 Рис. 2.6. Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию при сохраненной нормальной АВ-проводимости (AAI-сти- муляция).
Рис. 2.6. Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию при сохраненной нормальной АВ-проводимости (AAI-сти- муляция).
Примечание. A - стимулирующий импульс, нанесенный на предсердия
муляции), но в условиях нарушенной АВ-проводимости (за период установленной АВ-задержки не происходит спонтанных сокращений желудочков), будет реализована предсердно-синхронизированная стимуляция желудочков в режиме VDD (рис. 2.7). Адекватная предсердно-желудочковая синхронизация будет сохраняться до момента достижения спонтанным ритмом предсердий частоты, равной установленному значению максимальной частоты синхронизации.
Если имеются эпизоды, когда частота предсердного ритма сердца превышает базовую частоту стимуляции и нет признаков нарушения атриовентрикулярной проводимости, будет происходить полное ингибирование работы электрокардиостимулятора.
DDDR - двухкамерная частотно-адаптивная электрокардиостимуляция. Данный вид постоянной электрокардиостимуляции является наиболее современным и полностью устраняет недостатки вышеописанных режимов ЭКС.
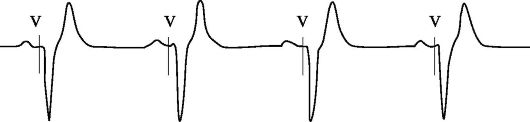 Рис. 2.7. Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (VDD-стимуляция)
Рис. 2.7. Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (VDD-стимуляция)
Блокады сердца Определение
Под блокадами сердца понимают полные или частичные нарушения проведения импульсов, возникающие на различном уровне проводящей системы сердца вследствие изменений функционального или органического характера (см. табл. 2.3).
Общая классификация
По локализации:
1. Синоатриальные блокады.
2. Внутри- и межпредсердные блокады.
3. Атриовентрикулярные блокады.
4. Фасцикулярные блокады. По степени выраженности: Блокада I степени (неполная). Блокада II степени (неполная). Блокада III степени (полная). По стойкости: Преходящая. Перемежающаяся. Постоянная.
Латентная.
Дисфункция синусового узла Определение
Дисфункция синусового узла - это гетерогенный клинический синдром различной этиологии, связанный с нарушением хронотропной функции структурных компонентов, составляющих зону синоаурикулярного узла.
Классификация
Клинические формы дисфункции синусового узла (М.С. Кушаковский, 1992):
• Синдром слабости синусового узла (СССУ) - дисфункции синусового узла органической природы.
• Регуляторные (вагусные) дисфункции синусового узла.
• Лекарственные (токсические) дисфункции синусового узла. Электрокардиографические эквиваленты СССУ:
1. Синусовая брадикардия с частотой менее 40 уд/мин в состоянии покоя.
2. Синус-арест (остановка синусового узла).
Критерии определения минимальной продолжительности синусовой паузы, которую можно было бы классифицировать как эпизод синус-ареста, не определены. Однако возникновение пауз более 3 с позволяет с большой долей вероятности предположить остановку синусового узла.
3. Синоатриальная (СА) блокада по степени выраженности подразделяется на:
• СА-блокаду I степени - характеризуется замедлением проведения импульсов от синоатриального узла к предсердиям, что не находит отражения на ЭКГ;
• СА-блокаду II степени тип I (с периодикой Самойлова-Венкебаха) - при этом наблюдается постепенное укорочение интервалов Р-Р, предшествующих выпадению зубца Р;
• СА-блокаду II степени тип II - на ЭКГ отмечается выпадение одного или нескольких зубцов Р, что приводит к возникновению пауз, кратных двум или нескольким интервалам Р-Р;
• СА-блокаду III степени - ни один импульс из синоатриального узла не проводится на предсердия.
4. Чередование замедленного синусового ритма или медленного замещающего ритма с пароксизмами тахикардии, как правило, суправентрикулярного происхождения (синдром брадикардии-тахикардии).
Наиболее часто наблюдаемым пароксизмальным суправентрикулярным нарушением ритма сердца у пациентов с СССУ является фибрилляция предсердий (синдром Шорта). Однако также возможна верификация трепетания предсердий, ускоренного ритма из АВсоединения, реципрокной АВ-узловой тахикардии. В редких случаях может наблюдаться и желудочковая тахикардия.
5. Замедленное восстановление функции синусового узла (появление синусовых пауз) после электрической или медикаментозной кардиоверсии.
Атриовентрикулярные блокады Определение
Атриовентрикулярная блокада - замедление или полное нарушение проведения импульсов от предсердий к желудочкам. Классификация По степени выраженности:
1. АВ-блокада I степени - определяется как аномальное удлинение интервала P-Q (более 210-220 мс).
2. АВ-блокада II степени тип Мобиц I (с периодикой СамойловаВенкебаха) - для нее характерно прогрессивное удлинение интервала P-Q до возникновения блокирования проведения. Максимальный прирост интервала P-Q отмечается между первым и вторым сокращением в цикле Венкебаха. Интервал P-Q имеет наибольшую продолжительность в сокращении, предшествующем блокированию АВ-проведения, и наименьшую - после выпавшего комплекса QRS. В большинстве случаев данный вид блокады ассоциируется с узким комплексом QRS.
3. АВ-блокада II степени тип Мобиц II - интервалы P-Q до и после блокирования проведения имеют фиксированную продолжительность. Для данного типа АВ-блокады в большинстве случаев характерен широкий комплекс QRS. При АВ-блокаде II степени с проведением 2:1 она не может быть классифицирована на первый или второй тип, однако о типе блокады можно косвенно судить по ширине комплекса QRS.
4. АВ-блокада III степени - АВ-проведение отсутствует полностью, на ЭКГ признаки полной АВ-диссоциации.
По анатомическому уровню нарушения проводимости:
• супрагисиальные АВ-блокады;
• интрагисиальные АВ-блокады;
• инфрагисиальные АВ-блокады.
Фасцикулярные блокады Определение
Фасцикулярная блокада - нарушение проведения импульсов в системе Гиса-Пуркинье.
Классификация
I. Монофасцикулярные блокады:
1. Блокада правой ножки пучка Гиса.
2. Блокада передневерхнего разветвления левой ножки пучка Гиса.
3. Блокада задненижнего разветвления левой ножки пучка Гиса.
II. Бифасцикулярные блокады:
1. Односторонняя - блокада левой ножки пучка Гиса.
2. Двухсторонняя:
а) правой ножки и передневерхнего разветвления левой ножки пучка Гиса.
б) правой ножки и задненижнего разветвления левой ножки пучка Гиса.
III. Трифасцикулярные блокады - сочетание АВ-блокады с любой из вышеперечисленных бифасцикулярных блокад.
IV. Периферические блокады (системы Гиса-Пуркинье).
Патофизиология блокад сердца
Дисфункция синусового узла и АВ-блокады характеризуются клиническими проявлениями хронотропной некомпетентности вследствие задержки или отсутствия проведения импульсов от синусового узла к предсердиям или от предсердий к желудочкам. Клиническая симптоматика обусловлена гипоперфузией жизненно важных органов, в особенности головного мозга и сердца, как результат синдрома малого сердечного выброса вследствие брадисистолии (см. табл. 2.4).
Нарушение меж- и внутрижелудочкового проведения импульсов приводит к десинхронизации работы правого и левого желудочков, что способствует прогрессии сердечной недостаточности, повышает риск развития пароксизмальных желудочковых нарушений ритма сердца.
Таблица 2.3
Этиология блокад сердца

 Таблица 2.4
Таблица 2.4
Клиническая симптоматика при синдроме слабости синусового узла
Симптомы цереброваскулярной недостаточности | Симптомы со стороны сердечно-сосудистой системы | Другие симптомы |
Головокружение Синкопе Пресинкопе Снижение памяти Деменция Бредовые идеи Раздражительность Вялость Бессонница | Учащение приступов стенокардии Ухудшение течения сердечной недостаточности Сердцебиения Перебои в работе сердца | Слабость Олигурия Диспепсия |
Пациенты с СССУ могут иметь клиническую симптоматику, обусловленную тахикардией, брадикардией или сочетанием данных форм нарушений сердечного ритма. Для определения показаний к постоянной электрокардиотерапии у данной категории пациентов необходимо выявить четкую связь клинической симптоматики с аритмией. Определение этой связи может быть затруднено в связи с преходящим характером нарушений ритма сердца и проводимости.
Клинические проявления при нарушении атриовентрикулярного проведения аналогичны симптомам при СССУ. Наиболее характерными являются жалобы на общую слабость, быструю утомляемость,
наличие пре- и синкопальных состояний, а также на развернутые приступы Морганьи-Адамса-Стокса (см. табл. 2.4).
У пациентов с биили трифасцикулярными блокадами часто отмечаются слабость, головокружение, снижение толерантности к физическим нагрузкам, синкопальные состояния. Основными причинами синкопальных состояний у данных пациентов могут быть преходящие нарушения атриовентрикулярной проводимости высокой степени, пароксизмальные желудочковые нарушения ритма сердца.
Рекомендации к постоянной электрокардиостимуляции
при синдроме слабости синусового узла (ACC/AHA/NASPE, 2002)
Класс I:
1. Дисфункция синусового узла с документированной симптомной синусовой брадикардией, включающей частые паузы, обуславливающие симптомы. У некоторых пациентов брадикардия является ятрогенной и возникает вследствие длительной медикаментозной терапии и/или ее передозировки.
2. Симптомная хронотропная недостаточность. Класс IIa:
1. Дисфункция синусового узла, возникающая спонтанно или как результат необходимой медикаментозной терапии с ЧСС менее 40 в минуту, когда четкая связь симптомов с брадикардией не документирована.
2. Синкопе неясного генеза со значимыми нарушениями функции синусового узла, выявленными или спровоцированными при электрофизиологическом исследовании.
Класс IIb:
1. Постоянная ЧСС при пробуждении менее 40 в минуту у пациентов с незначительной симптоматикой.
Класс III:
1. Дисфункция синусового узла у асимптомных пациентов, включая тех, у кого синусовая брадикардия (ЧСС менее 40 в минуту) является следствием длительной медикаментозной терапии.
2. Дисфункция синусового узла у пациентов с симптомами, похожими на брадикардитические, когда четко документировано отсутствие их связи с редким ритмом.
3. Дисфункция синусового узла с симптомной брадикардией в результате неадекватной медикаментозной терапии.
На наш взгляд, заслуживают внимания показания к постоянной электрокардиотерапии пациентов с синдромом слабости синусового узла, разработанные Д.Ф. Егоровым с соавт. (1995).
Клинико-электрофизиологические показания:
1) наличие приступов Морганьи-Адамса-Стокса на фоне брадиаритмии либо при купировании пароксизмов наджелудочковой тахикардии;
2) прогрессирующая недостаточность кровообращения на фоне брадиаритмии;
3) отсутствие эффекта или невозможность проведения медикаментозной терапии СССУ при наличии клинических проявлений брадиаритмии;
4) спонтанная асистолия по данным мониторирования ЭКГ длительностью 2000-3000 мс и более;
5) остановка или отказ синусового узла;
6) синоатриальная блокада степени с периодами асистолии более 2000 мс;
7) периодическое урежение числа сокращений желудочков менее 40 уд./мин, особенно в ночные часы.
Электрофизиологические показания:
• время восстановления функции синусового узла (ВВФСУ) - 3500 мс и более;
• коррегированное время восстановления функции синусового
узла (КВВФСУ) - 2300 мс и более;
• время истинной асистолии после стимуляции предсердий - 3000 мс и более;
• время синоатриального проведения (ВСАП) более 300 мс при наличии:
- признаков «вторичных» пауз во время ЭФИ;
- «парадоксальной» реакции на введение атропина во время
ЭФИ;
- признаков синоатриальной блокады на ЭКГ;
• отрицательная проба с атропином (прирост ЧСС менее 30% от исходной, уменьшение ВВФСУ менее чем на 30% от исходного).
Необходимо также добавить, что проведение постоянной электрокардиостимуляции абсолютно показано пациентам с постоянной формой фибрилляции предсердий с редким проведением на желудочки, симптоматичной брадикардией и клиническими проявлениями сердечной недостаточности. Напротив, имплантация ЭКС не пока-
зана при отсутствии клинической симптоматики на фоне брадиаритмии при фибрилляции предсердий (с ЧСС менее 40 в 1 минуту), даже если длительность отдельных интервалов R-R превышает 1500 мс.
Рекомендации к постоянной электрокардиостимуляции
при приобретенных нарушениях атриовентрикулярной проводимости
у взрослых (ACC/AHa/nASPE, 2002)
Класс I:
1. АВ-блокада III степени и далеко зашедшая АВ-блокада II степени на любом анатомическом уровне, связанные с любым из следующих условий:
1) симптомная брадикардия (включая сердечную недостаточность) предположительно вследствие АВ-блокады;
2) аритмия или другие медицинские обстоятельства, требующие назначения лекарственных препаратов, вызывающих симптомную брадикардию;
3) документированные периоды асистолии равные 3,0 сек или более, а также любой выскальзывающий ритм менее 40 уд/мин при пробуждении, у асимптомных пациентов;
4) состояние после катетерной радиочастотной абляции АВсоединения (нет исследований по оценке исхода без электрокардиостимуляции, стимуляция всегда планируется в данных ситуациях, за исключением тех случаев, когда была выполнена процедура модификации АВ-соединения);
5) АВ-блокада после кардиохирургических вмешательств, когда не ожидается ее спонтанное разрешение;
6) нейромышечные заболевания в сочетании с АВ-блокадой, такие как миотоническая мышечная дистрофия, синдром Кернса-Сейра, дистрофия Эрба (опоясывающая) и перонеальная мышечная атрофия, с симптомами или без них, так как возможно непредвиденное ухудшение АВ-проводимости.
2. АВ-блокада II степени вне зависимости от типа и уровня поражения при сочетании с симптомной брадикардией.
Класс IIa:
1. Асимптомная АВ-блокада III степени на любом анатомическом уровне со средней частотой сокращения желудочков при пробуждении 40 уд/мин или более, особенно при наличии кардиомегалии или дисфункции левого желудочка.
2. Асимптомная АВ-блокада II степени тип Мобиц II с узким комплексом QRS (когда при АВ-блокаде II степени тип Мобиц II имеется широкий комплекс QRS, класс рекомендации становится первым).
3. Асимптомная АВ-блокада I степени на интраили инфрагисиальном уровне, выявленная при электрофизиологическом исследовании, проведенном по другому поводу.
4. АВ-блокада I или II степени с симптоматикой, сходной с синдромом электрокардиостимулятора.
Класс IIb:
1. Значимая АВ-блокада I степени (P-Q более 300 мс) у пациентов с дисфункцией левого желудочка и симптомами застойной сердечной недостаточности, у которых укороченная АВ-задержка приводит к улучшению гемодинамики, предположительно за счет снижения давления наполнения левого предсердия.
2. Нейромышечные заболевания, такие как миотоническая мышечная дистрофия, синдром Кернса-Сейра, дистрофия Эрба (опоясывающая) и перонеальная мышечная атрофия, с любой степенью АВ-блокады, симптоматичная или нет, так как возможно непредвиденное ухудшение АВ-проводимости.
Класс III:
1. Асимптомная АВ-блокада I степени.
2. Асимптомная АВ-блокада I степени на супрагисиальном уровне (уровень АВ-узла) или при отсутствии данных об интраили инфрагисиальном уровне блока.
3. Ожидаемое разрешение АВ-блокады и/или малая вероятность ее рецидива (например, токсическое действие лекарств, болезнь Лайма, гипоксия при апноэ во время сна в отсутствие симптоматики).
Рекомендации к постоянной электрокардиостимуляции
при хронической бифасцикулярной и трифасцикулярной блокаде
(ACC/AHA/NASPE, 2002)
Класс I:
1. Преходящая АВ-блокада III степени.
2. АВ-блокада II степени тип Мобиц II.
3. Альтернирующая блокада ножек пучка Гиса.
Класс IIa:
1. Синкопальные состояния при недоказанной связи с АВ-блокадой, когда другие их причины исключены, в особенности желудочковая тахикардия.
2. Случайно выявленное при электрофизиологическом исследовании значительное удлинение интервала H-V (более 100 мс) у асимптомных пациентов.
3. Случайно выявленный при электрофизиологическом исследовании нефизиологический инфрагисиальный блок, вызванный стимуляцией.
Класс IIb:
Нейромышечные заболевания, такие как миотоническая мышечная дистрофия, синдром Кернса-Сейра, дистрофия Эрба (опоясывающая) и перонеальная мышечная атрофия, с любой степенью фасцикулярной блокады, с симптоматикой или без, так как возможно непредвиденное ухудшение атриовентрикулярного проведения.
Класс III:
1. Фасцикулярная блокада без АВ-блокады и клинической симптоматики.
2. Асимптомная фасцикулярная блокада в сочетании с АВ-блокадой I степени.
Показания к постоянной электрокардиостимуляции при атриовентрикулярных блокадах при остром инфаркте миокарда
(ACC/AHA/NASPE, 2002)
При возникновении симптоматической брадикардии, обусловленной нарушением атриовентрикулярной проводимости в остром периоде инфаркта миокарда, некурабельной медикаментозно, показано проведение временной эндокардиальной электрокардиостимуляции. Данный вид электрокардиотерапии целесообразно использовать 12-14 дней. Согласно рекомендациям ACC/AHA по лечению пациентов с острым инфарктом миокарда, потребность во временной электрокардиостимуляции в острый период инфаркта миокарда сама по себе не определяет показаний к постоянной электрокардиостимуляции. По истечении вышеуказанного периода времени устанавливается степень нарушения АВ-проводимости, ее необратимость и определяются показания к проведению постоянной электрокардиотерапии.
Показания к постоянной электрокардиостимуляции у пациентов, перенесших инфаркт миокарда, осложненный нарушением атриовентрикулярной проводимости, в большей степени обусловлены нарушениями внутрижелудочковой проводимости. В отличие от показаний к постоянной электрокардиотерапии нарушений АВ-проводимости, критерии для отбора пациентов с инфарктом миокарда часто не зависят от наличия симптомной брадикардии. При рассмотрении показаний к постоянной электрокардиостимуляции у данной категории больных должны быть учтены тип нарушения атриовентрикулярной проводимости, локализация инфаркта миокарда и констатирована причинно-следственная связь указанных электрических нарушений с ним.
Рекомендации к постоянной электрокардиостимуляции
при приобретенных нарушениях атриовентрикулярной проводимости
после острого инфаркта миокарда (ACC/AHA/NASPE, 2002)
Класс I:
1. Персистирующая АВ-блокада II степени в системе ГисаПуркинье с билатеральной блокадой ножек пучка Гиса или АВ-блокада III степени на уровне или ниже системы Гиса-Пуркинье после острого инфаркта миокарда.
2. Транзиторная, далеко зашедшая (АВ-блокада II или III степени) инфранодальная АВ-блокада в сочетании с блокадой ножек пучка Гиса. Если уровень АВ-блокады неясен - показано проведение электрофизиологического исследования.
3. Персистирующая и симптомная АВ-блокада II или III степени.
Класс IIb:
1. Персистирующая АВ-блокада II или III степени на уровне атриовентрикулярного соединения.
Класс III:
1. Транзиторная АВ-блокада при отсутствии нарушений внутрижелудочковой проводимости.
2. Транзиторная АВ-блокада при изолированной блокаде передней ветви левой ножки пучка Гиса.
3. Появившаяся блокада передней ветви левой ножки пучка Гиса при отсутствии АВ-блокады.
4. Персистирующая АВ-блокада I степени при ранее имевшейся блокаде ножки пучка Гиса неизвестной давности.
Программа инструментального обследования пациентов
1. ЭКГ.
2. Суточное мониторирование ЭКГ.
3. Проба с физической нагрузкой.
4. Рентгенография органов грудной клетки.
5. Эхокардиография.
6. Тил т-тест.
7. УЗДГ брахиоцефальных артерий.
8. Чреспищеводное электрофизиологическое исследование.
9. Эндокардиальное электрофизиологическое исследование (при необходимости).
ИМПЛАНТИРУЕМЫЕ КАРДИОВЕРТЕРЫДЕФИБРИЛЛЯТОРЫ У ПАЦИЕНТОВ КАТЕГОРИИ ВЫСОКОГО РИСКА ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ
Имплантация кардиовертеров-дефибрилляторов
Технически процедура установки имплантируемого кардиовертера-дефибриллятора (ИКД) мало отличается от имплантации постоянных электрокардиостимуляторов. Перед операцией с помощью программатора оценивают состояние батареи устройства и функцию конденсатора, а антибрадикардитическую стимуляцию и функции ИКД-терапии отключают. После установки электродов в камерах сердца проводят их тестирование с помощью наружного стимулятора. В пекторальной области подкожно или субфасциально формируют ложе аппарата ИКД, который коммутируется с имплантированными электродами. С помощью программатора устанавливают параметры детекции и терапии. Затем проводится определение порога дефибрилляции и эффективность запрограммированного алгоритма ИКДтерапии. Для этого пациенту проводят кратковременный внутривенный наркоз и с помощью программатора индуцируют фибрилляцию желудочков (режимы T-shock (разряд дефибриллятора, синхронизированный с Т-волной) или 50 Hz burst-pacing)). При оптимально установленных параметрах терапии устройство должно нанести разряд и купировать фибрилляцию желудочков. Величина энергии разряда ИКД, устанавливаемая в устройстве, должна в 2 раза превышать величину порога дефибрилляции. При неэффективной терапии
ИКД неотложные мероприятия осуществляют с помощью наружного дефибриллятора.
Основы терапии кардиовертерами-дефибрилляторами
Современный ИКД представляет собой систему, состоящую из устройства, заключенного в небольшой титановый корпус, и одного или более электродов, установленных в камеры сердца. Аппарат содержит источник питания (литиево-серебряно-ваннадиевую батарею), преобразователь напряжения, резисторы, конденсатор, микропроцессор, системы анализа сердечного ритма и высвобождения разряда, а также базу данных электрограмм аритмических событий. В клинической практике используются желудочковые и предсердные электроды как с пассивным, так и с активным механизмами фиксации для проведения дефибрилляции, антитахикардической, антибрадикардической электрокардиостимуляции и ресинхронизирующей терапии. На сегодняшний день применяются одно-, двух- и трехкамерные (бивентрикулярные) системы. В большинстве систем само устройство, заключенное в титановый корпус, является частью цепи разряда дефибриллятора (рис. 2.8).
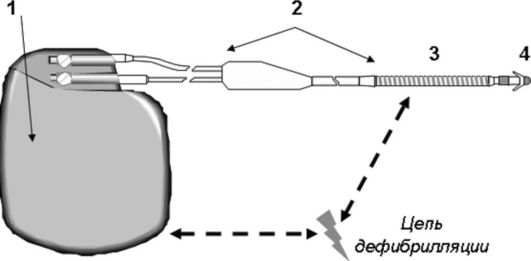 Рис. 2.8. Имплантируемый кардиовертер-дефибриллятор. Примечание. (1)
титановый корпус, (2) внутрисердечный электрод. Цепь разряда
имплантируемого кардиовертера-дефибриллятора заключена между корпусом
устройства и катушкой (3), находящейся на электроде. С помощью
дистального кончика электрода (4) осуществляется детекция аритмических
событий и проведение антитахи- и антибрадистимуляции
Рис. 2.8. Имплантируемый кардиовертер-дефибриллятор. Примечание. (1)
титановый корпус, (2) внутрисердечный электрод. Цепь разряда
имплантируемого кардиовертера-дефибриллятора заключена между корпусом
устройства и катушкой (3), находящейся на электроде. С помощью
дистального кончика электрода (4) осуществляется детекция аритмических
событий и проведение антитахи- и антибрадистимуляции
Таблица 2.5
Режимы антитахикардитической стимуляции
 Функции имплантируемых кардиовертеров-дефибрилляторов
Функции имплантируемых кардиовертеров-дефибрилляторов
1. Антитахикардитическая стимуляция (АТС).
Режимы подавляющей желудочковой стимуляции в зоне детекции желудочковых тахикардий представлены в табл. 2.5.
2. Кардиоверсия - низковольтный шок (разряд высокой энергии постоянного электрического тока), который наносится вне уязвимой фазы сердечного цикла (через 20-30 мс после вершины зубца R) в зоне детекции желудочковой тахикардии (ЖТ).
3. Дефибрилляция - высоковольтный шок (разряд высокой энергии постоянного электрического тока) в зоне детекции высокочастотной ЖТ и фибрилляции желудочков (ФЖ).
4. Антибрадикардитическая стимуляция - электрокардиостимуляция в зоне детекции брадикардии.
В основе детекции аритмий лежит анализ R-R интервалов, форма желудочкового сигнала, стабильность R-R интервалов, соотношение характеристик предсердной и желудочковой активности (в двухкамерных системах). Входящий сигнал проходит фильтрацию, в результате которой элиминируются и не подвергаются детекции низкочастотные (обусловленные Т-волной) и высокочастотные компоненты (обусловленные активностью скелетной мускулатуры). Параметры детекции и алгоритмы терапии для каждой зоны устанавливаются интраоперационно во время тестирования устройства с помощью программатора (рис. 2.9). В зависимости от клинической ситуации проводимой медикаментозной терапии эти значения в дальнейшем могут корректироваться.
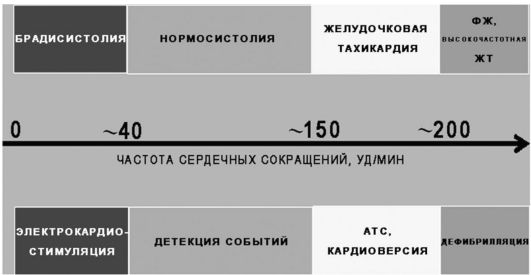 Рис. 2.9. Зоны детекции и возможные режимы работы кардиовертерадефибриллятора
Рис. 2.9. Зоны детекции и возможные режимы работы кардиовертерадефибриллятора
Для предотвращения неоправданных разрядов во время суправентрикулярных аритмий, синусовой тахикардии применяются функции анализа стабильности R-R интервалов (при тахисистолической форме фибрилляции предсердий), морфологии желудочкового сигнала, регистрируемого желудочковым электродом, внезапности начала тахиаритмии (при возникновении ЖТ или ФЖ величина интервала R-R внезапно уменьшается), а также двухкамерная регистрация сигналов в предсердиях и желудочках. Алгоритм терапии подбирается врачом на основании переносимости больным клинической тахикардии. При ФЖ или быстрой ЖТ первым шагом в терапии является дефибрилляция, мощностью на 10 Дж превышающая интраоперационный порог дефибрилляции с последующим автоматическим нарастанием мощности разрядов до максимальных значений (30 Дж), а также изменением полярности в цепи дефибрилляции от корпуса ИКД к внутрисердечному электроду и наоборот.
Профилактика внезапной сердечной смерти Определения
Внезапная сердечная смерть (ВСС) - смерть, развившаяся моментально или наступившая в течение часа с момента возникновения острых изменений в клиническом статусе пациента.
Сердечный арест - это состояние, сопровождающееся потерей сознания вследствие асистолии, желудочковой тахикардии или фибрилляции желудочков. Обязательным условием диагноза сердечного ареста является регистрация этих эпизодов электрокардиографическим методом.
Устойчивая желудочковая тахикардия - это тахикардия продолжительностью более 30 с.
Неустойчивая желудочковая тахикардия - это тахикардия от 3 комплексов до 30 с, которая самостоятельно прерывается.
Факторы риска - это клинические признаки, указывающие на вероятность развития ВСС у конкретного пациента в текущем году в процентах.
Профилактика внезапной сердечной смерти - это комплекс мероприятий, проводимых у лиц, переживших сердечный арест (вторичная профилактика), или у пациентов, имеющих высокий риск развития ВСС без эпизодов сердечного ареста в анамнезе (первичная).
Патофизиология внезапной сердечной смерти
Наиболее частыми электрофизиологическими механизмами развития ВСС являются желудочковая тахикардия и фибрилляция желудочков. Приблизительно в 20-30% случаев причинами ВСС являются брадиаритмия и асистолия. Часто довольно сложно определить первичный механизм ВСС у пациентов с документированной брадиаритмией, так как асистолия может быть следствием устойчивой ЖТ. С другой стороны, исходная брадиаритмия, обусловленная ишемией миокарда, может спровоцировать ЖТ или ФЖ. Ниже приводится этиология внезапной сердечной смерти по J. Ruskin (1998)
Ишемическая болезнь сердца Дилатационная кардиомиопатия Гипертрофия левого желудочка Гипертрофическая кардиомиопатия Приобретенные пороки сердца Врожденные пороки сердца Острый миокардит
Аритмогенная дисплазия правого желудочка
Аномалии развития коронарных артерий
Саркоидоз
Амилоидоз
Опухоли сердца
Дивертикулы левого желудочка
Синдром WPW
Синдром удлиненного интервала QT Лекарственная проаритмия Кокаиновая интоксикация Выраженный электролитный дисбаланс Идиопатическая желудочковая тахикардия
В большинстве случаев ВСС развивается у пациентов со структурной патологией миокарда. Пациенты с врожденными аритмическими синдромами при отсутствии морфологических изменений сердца составляют небольшой процент в структуре ВСС. На молеку-
Таблица 2.6
Эффективность терапии имплантируемыми кардиовертерами-дефибрилляторами
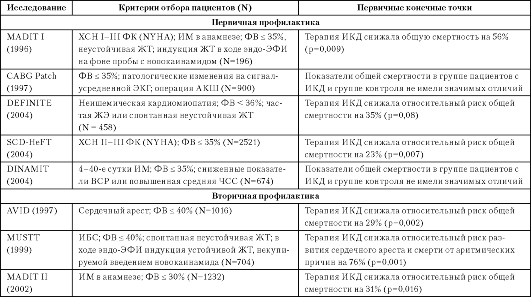 Примечание. ВСР
- вариабельность ритма сердца; ИБС - ишемическая болезнь сердца; ИМ -
инфаркт миокарда; ЖТ - желудочковая тахикардия; ЖЭ - желудочковая
экстрасистолия; ХСН - хроническая сердечная недостаточность; ФВ -
фракция выброса; ЧСС - частота сердечных сокращений; эндо-ЭФИ -
эндокардиальное электрофизиологическое исследование; ФК - функциональный
класс
Примечание. ВСР
- вариабельность ритма сердца; ИБС - ишемическая болезнь сердца; ИМ -
инфаркт миокарда; ЖТ - желудочковая тахикардия; ЖЭ - желудочковая
экстрасистолия; ХСН - хроническая сердечная недостаточность; ФВ -
фракция выброса; ЧСС - частота сердечных сокращений; эндо-ЭФИ -
эндокардиальное электрофизиологическое исследование; ФК - функциональный
класс
лярном уровне причинами электрической нестабильности миокарда могут быть изменения концентрации ионов калия и кальция, нейрогормональные сдвиги, мутации, обусловливающие дисфункцию натриевых каналов, что приводит к повышенному автоматизму и формированию re-entry.
Отбор пациентов для имплантации кардиовертеров-дефибрилляторов
В 1984 г. J.T. Bigger провел анализ вероятностной характеристики развития ВСС в каждом клиническом случае. Он выделил группы лиц с высоким и умеренным факторами риска развития ВСС. Данные представлены в табл. 2.7.
Таблица 2.7
Факторы риска внезапной сердечной смерти
Группа умеренного риска | Риск развития ВСС в текущем году |
ОИМ в анамнезе или ФВ ниже 40% | 5% |
ОИМ+ФВ ниже 40% или ОИМ + частая ЖЭ или ФВ ниже 40% + ЖЭ | 10% |
ОИМ + ФВ ниже 40% + ЖЭ | 15% |
Группа высокого риска | |
Пациенты, пережившие ВСС | 30-50% |
ЖТ + синкопе | 30-50% |
ЖТ + минимальные клинические проявления | 20-30% |
Примечание. ОИМ - острый инфаркт миокарда; ФВ - фракция выброса; ЖЭ - частая желудочковая экстрасистолия; ЖТ - желудочковая тахикардия; ВСС - внезапная сердечная смерть.
Важно отметить, что эти данные нашли свое отражение в исследовании AVID, которое было проведено 13 лет спустя после работы J.T. Bigger. Таким образом, наиболее значимыми предикторами ВСС являются: дисфункция левого желудочка, эпизод сердечного ареста в анамнезе, гипертрофия миокарда, а также ряд заболеваний, основу которых составляет наличие электрически нестабильного миокарда (см. табл. 2.6).
Рекомендации по имплантации кардиовертеров-дефибрилляторов (ACC/AHA/NASPE, 2002)
Класс I:
1. Лица, пережившие сердечный арест, произошедший вследствие ФЖ или ЖТ, которые были обусловлены не транзиторными и обратимыми причинами (AVID-пациенты).
2. Пациенты со спонтанной, устойчивой ЖТ, верифицированной на ЭКГ или при холтеровском мониторировании в сочетании со структурной патологией сердца.
3. Пациенты с синкопальными состояниями неустановленной этиологии и с выявленной, гемодинамически значимой, устойчивой ЖТ или ФЖ, индуцированной во время ЭФИ. При этом постоянная ААТ неэффективна, плохо переносима или сам пациент не желает ее получать.
4. Пациенты с ИБС, указанием на ОИМ в анамнезе и неустойчивой ЖТ при имеющейся умеренно сниженной ФВ левого желудочка (ниже 35%), а также индуцированной ФЖ или устойчивой ЖТ во время ЭФИ, которая не подавляется антиаритмическими препаратами Ia класса (MADIT I-пациенты).
5. Пациенты с ФВ левого желудочка ниже 30% как минимум по прошествии одного месяца после ОИМ и трех месяцев после операции реваскуляризации миокарда (MADIT II- и SCD-HF-пациенты).
6. Пациенты со спонтанной, устойчивой ЖТ, верифицированной на ЭКГ или при холтеровском мониторировании без структурной патологии сердца, и которая не устраняется другими методами лечения.
Класс II:
1. Пациенты с указаниями в анамнезе на перенесенную ФЖ, которым проведение ЭФИ противопоказано.
2. Пациенты с плохо переносимой, гемодинамически значимой устойчивой ЖТ в периоде ожидания трансплантации сердца.
3. Пациенты с наследственными или приобретенными заболеваниями, которые сопровождаются высоким риском развития сердечного ареста вследствие ФЖ или ЖТ (синдром удлиненного интервала QT, гипертрофическая кардиомиопатия, синдром Бругада, аритмогенная дисплазия правого желудочка).
4. Пациенты с синкопальными состояниями в сочетании с дисфункцией левого желудочка и индуцированной во время эндо-ЭФИ ЖТ при исключении других причин развития синкопального состояния.
5. Пациенты с распространенной структурной патологией сердца и синкопальными состояниями, у которых предыдущие исследования не дали определенного результата в установлении причины.
Класс III:
1. Пациенты без структурной патологии сердца и синкопальными состояниями неясной этиологии без выявленной ЖТ во время ЭФИ, и когда другие причины развития синкопе не исключены окончательно.
2. Пациенты с постоянно рецидивирующей ЖТ.
3. Пациенты с идиопатическими ЖТ, которые могут быть успешно элиминированы радиочастотной катетерной деструкцией (идиопатические ЖТ из области выходных трактов правого и левого желудочков, ЖТ с циркуляцией импульса по проводящей системе сердца (bundle branch re-entry) и др.
4. Пациенты с желудочковыми нарушениями ритма, возникающими вследствие транзиторных и обратимых причин (расстройства электролитного баланса, острые отравления, эндокринные нарушения, применение адреномиметиков и проч.).
5. Больные с выраженными психическими расстройствами, которые могут препятствовать наблюдению за больным в раннем и отдаленном послеоперационном периодах.
6. Пациенты с терминальными заболеваниями, у которых предполагаемый прогноз продолжительности жизни менее 6 мес.
7. Пациенты с ишемической болезнью сердца без индуцированной в ходе эндо-ЭФИ ЖТ, с дисфункцией левого желудочка, которым планируется проведение реваскуляризационных мероприятий.
8. Пациенты с IV функциональным классом сердечной недостаточности по NYHA, рефрактерной к медикаментозной терапии, и пациенты, которые не могут быть кандидатами на трансплантацию сердца.
Программа инструментального обследования пациентов
1. ЭКГ.
2. Суточное мониторирование ЭКГ.
3. Проба с физической нагрузкой.
4. Рентгенография органов грудной клетки.
5. Эхокардиография.
6. Тилт-тест.
7. УЗДГ брахиоцефальных артерий.
8. Коронарография.
9. Эндокардиальное электрофизиологическое исследование (при необходимости).
ИСПОЛЬЗОВАНИЕ РЕСИНХРОНИЗИРУЮЩЕЙ ЭЛЕКГРОКАРДИОТЕРАПИИ У ПАЦИЕНТОВ С ВЫСОКИМ ФУНКЦИОНАЛЬНЫМ КЛАССОМ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Имплантация кардиоресинхронизирующих устройств
За исключением установки электрода для стимуляции левого желудочка сердца методика имплантации кардиоресинхронизирующего устройства (КРСУ) мало чем отличается от хирургической техники имплантации двухкамерного ЭКС. На первом этапе имплантации КРСУ осуществляется установка предсердного и правожелудочкового эндокардиальных электродов (рис. 2.10, панель В). При имплантации желудочкового электрода с пассивным механизмом фиксации последний необходимо установить в области верхушки, ближе к межжелудочковой перегородке, таким образом, чтобы кончик электрода проецировался вблизи тени диафрагмы, что обеспечивает наилучшую фиксацию. Желудочковые электроды с активным механизмом фиксации можно позиционировать в области межжелудочковой перегородки или выходном тракте правого желудочка сердца.
Эндокардиальные J-образные предсердные электроды с пассивной фиксацией устанавливаются в ушке правого предсердия. При имплантации предсердных электродов с активным механизмом фиксации возможно их позиционирование как в ушке правого предсердия, так и в области межпредсердной перегородки.
На следующем этапе операции выполняют катетеризацию и контрастирование коронарного синуса (рис. 2.10, панель А). Наиболее выраженный клинический эффект бивентрикулярной стимуляции может быть достигнут при позиционировании левожелудочкового электрода в латеральной, переднелатеральной или заднелатеральной венах сердца (рис. 2.10, панель Б). Установка электрода в большой или средней вене сердца приводит к стимуляции переднего или
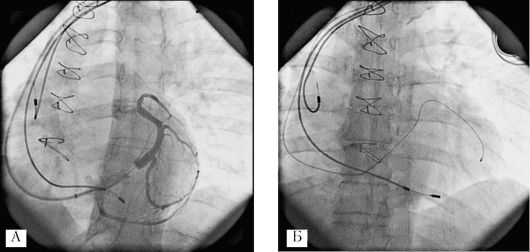
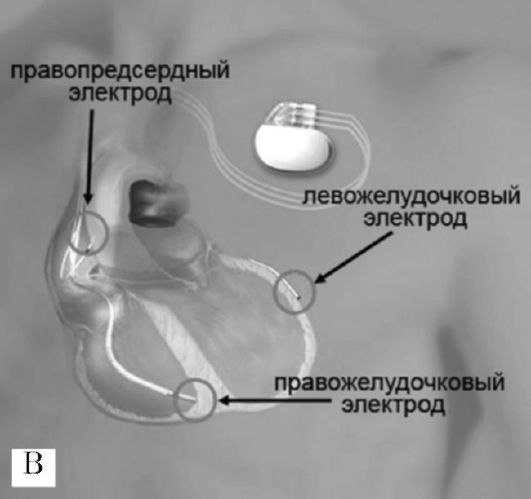 Рис. 2.10. Имплантация
электродов кардиоресинхронизирующего устройства. Панель А:
контрастирование коронарного синуса. Панель Б: имплантация
левожелудочкового электрода трансвенозным доступом через коронарный
синус в латеральную вену сердца. Панель В: схема расположения электродов
кардиоресинхронизирующего устройства
Рис. 2.10. Имплантация
электродов кардиоресинхронизирующего устройства. Панель А:
контрастирование коронарного синуса. Панель Б: имплантация
левожелудочкового электрода трансвенозным доступом через коронарный
синус в латеральную вену сердца. Панель В: схема расположения электродов
кардиоресинхронизирующего устройства
верхушечного сегментов левого желудочка, что ассоциируется с увеличением степени митральной регургитации и, следовательно, сопровождается отрицательным гемодинамическим эффектом. Для проведения и установки левожелудочкового электрода в венозные сосуды системы коронарного синуса используют специальный набор инструментария - систему доставки электрода коронарного синуса.
Желудочковая десинхронизация как звено патогенеза хронической сердечной недостаточности
В основе синдрома хронической сердечной недостаточности (ХСН) лежит диастолическая и/или систолическая дисфункция
левого желудочка. ХСН характеризуется прогрессирующим течением и сопровождается процессом ремоделирования левого желудочка, который проявляется изменением геометрии камер сердца в виде их гипертрофии и/или дилатации. Возникающие механические нарушения в работе сердца как насоса способствуют поддержанию и прогрессированию процессов ремоделирования, а также сопровождаются сложными компенсаторными и патофизиологическими изменениями, включающими в себя в том числе нарушения фазовой структуры сердечного цикла (рис. 2.11).
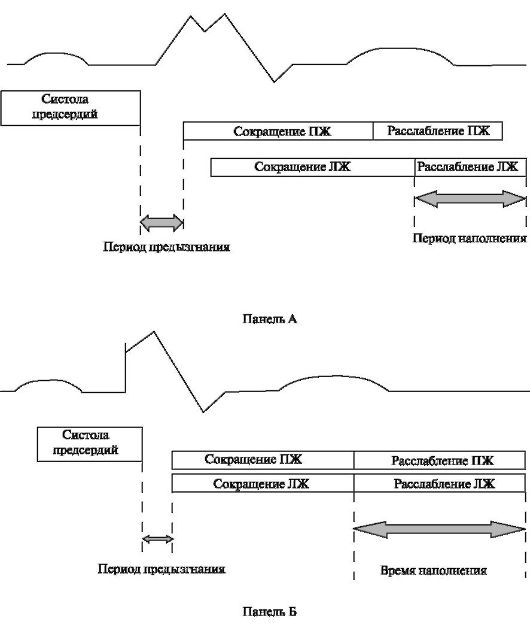 Рис. 2.11. Нарушение фазовой структуры сердечного цикла. Примечание: Панель
А: схематическое изображение нарушения фазовой структуры сердечного
цикла при блокаде левой ножки пучка Гиса. Обращает на себя внимание
увеличение периода предызгнания и уменьшение времени наполнения левого
желудочка. Панель Б: Нормализация фазовой структуры сердечного цикла в
результате проведения ресинхронизирующей терапии. Происходит
синхронизация систолы правого и левого желудочков, увеличение времени
наполнения левого желудочка и сокращение периода предызгнания
Рис. 2.11. Нарушение фазовой структуры сердечного цикла. Примечание: Панель
А: схематическое изображение нарушения фазовой структуры сердечного
цикла при блокаде левой ножки пучка Гиса. Обращает на себя внимание
увеличение периода предызгнания и уменьшение времени наполнения левого
желудочка. Панель Б: Нормализация фазовой структуры сердечного цикла в
результате проведения ресинхронизирующей терапии. Происходит
синхронизация систолы правого и левого желудочков, увеличение времени
наполнения левого желудочка и сокращение периода предызгнания
Нарушения внутрижелудочковой проводимости (в 90% случаев в форме блокады левой ножки пучка Гиса (БЛНПГ)) встречаются у 35% пациентов с ХСН. При этом имеется прямая корреляция между длительностью комплекса QRS и смертностью среди этой группы пациентов с ХСН (рис. 2.12).
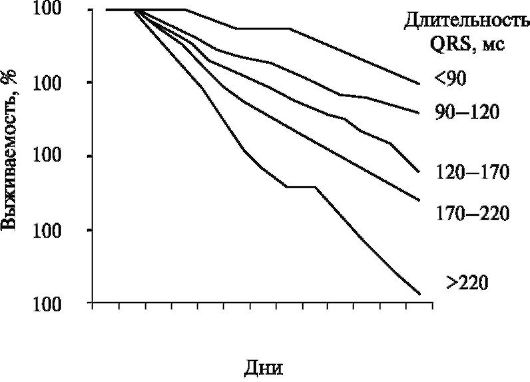
Рис. 2.12. Выживаемость среди пациентов с хронической сердечной недостаточностью в зависимости от длительности желудочкового комплекса
Нарушения проведения по ножкам системы Гиса-Пуркинье приводят к механической меж- и внутрижелудочковой десинхронизации. Наиболее ярко это выражено при БЛНПГ. В этом случае происходит чередование активного сокращения и пассивного растяжения контралатеральных областей левого желудочка: ранне-систолическое сокращение межжелудочковой перегородки с растяжением боковой стенки левого желудочка и последующее поздне-систолическое сокращение латеральной стенки с выраженным конечно-систолическим перерастяжением межжелудочковой перегородки. В результате происходит пассивное смещение межжелудочковой перегородки в сторону правого желудочка, ошибочно называемое «парадоксальным». Существующая последовательность деполяризации миокарда левого желудочка ведет к уменьшению длительности фазы быстрого наполнения левого желудочка, задержке сокращения левого желудочка и замедлению общей продолжительности систолического выброса из него, уменьшению времени диастолического расслабления и наполнения левого желудочка, увеличению периода предыз-
гнания (см. рис. 2.11). Изменения фаз сердечного цикла в условиях десинхронизации приводят к увеличению конечно-систолического и конечно-диастолического давлений в полостях сердца, уменьшению фракции изгнания и фракции укорочения волокон левого желудочка, повышению давления в легочной артерии, являясь отражением прогрессирования систолической и диастолической дисфункции у пациентов с ХСН.
Появление патологической митральной регургитации у пациентов с ХСН служит неблагоприятным прогностическим признаком. Значительный вклад в ее формирование вносят наличие подклапанной дисфункции левого желудочка, дискоординации движения групп папиллярных мышц и перерастяжение фиброзного кольца. При наличии БЛНПГ раннее активное движение межжелудочковой перегородки, возникающее до закрытия створок митрального клапана, также ведет к появлению нечеткости границы между диастолой и систолой, что может усиливать степень митральной регургитации.
Патологическое систолическое растяжение поперечных мышечных мостиков левого желудочка создает условия для поддержания re-entry и увеличивает вероятность появления жизнеугрожающих желудочковых нарушений ритма сердца.
Представленные механизмы десинхронизации у пациентов с ХСН снижают эффективность сократительной функции сердца и сопровождаются повышением энергозатрат, что ухудшает его функциональное состояние независимо от этиологического фактора сердечной недостаточности.
Десинхронизация складывается из нескольких компонентов: предсердно-желудочкового, межжелудочкового и внутрижелудочкового.
Первый компонент отражает разобщение координации систолы предсердий и желудочков. В клинической практике для верификации предсердно-желудочковой десинхронизации используется оценка трансмитрального потока допплеровским методом при выполнении трансторакальной эхокардиографии (Эхо-КГ). Слияние пиков Е (пассивное диастолическое наполнение предсердий) и А (систола предсердий) иллюстрирует предсердно-желудочковую десинхронизацию (рис. 2.13).
Показателями межжелудочковой десинхронизации являются длительность комплекса QRS более 120 мс, задержка движения латеральной стенки левого желудочка относительно движения межжелудочковой перегородки более 140 мс, регистрируемая во время
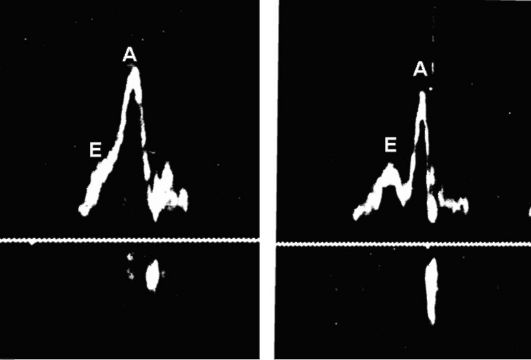 Рис. 2.13. Определение
трансмитрального кровотока допплеровским методом у пациента с
имплантированным КРСУ и установленной величиной АВ-задержки 140 мс.
Рис. 2.13. Определение
трансмитрального кровотока допплеровским методом у пациента с
имплантированным КРСУ и установленной величиной АВ-задержки 140 мс.
Примечание. В левой части рисунка потоки Е и А, характеризующие пассивное диастолическое наполнение и предсердную систолу, неразличимы. В правой части рисунка представлены данные допплерографии у того же пациента при изменении величины АВ-задержки (было установлено 110 мс). Отмечается расхождение пиков Е (первый, низкоамплитудный) и А (второй, высокоамплитудный), свидетельствующих об оптимизации диастолического наполнения
проведения Эхо-КГ в М-режиме, увеличение показателя кумулятивной асинхронии более 100 мс при проведении тканевого допплеровского сканирования, разница интервалов от начала комплекса QRS до начала потока в аорте и легочной артерии, превышающая 40 мс (рис. 2.14, 2.15, см. на вклейке).
Внутрижелудочковая десинхронизация может быть верифицирована методом тканевой допплерографии. Использование различных режимов тканевой допплерографии позволяет отразить задержку между началом комплекса QRS на поверхностной ЭКГ и появлением тканевого допплеровского сигнала, отображающего систолическую волну в соответствующих сегментах миокарда левого желудочка (рис. 2.16, см. на вклейке).
Внутрижелудочковая десинхронизация является независимым предиктором неблагоприятного течения сердечно-сосудистых заболеваний у пациентов, перенесших инфаркт миокарда.
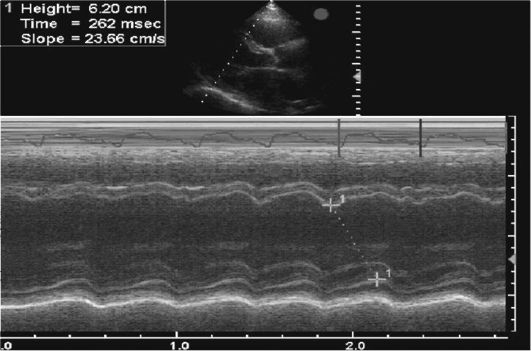 Рис. 2.14. Признаки межжелудочковой десинхронизации. Примечание. М-режим
трансторакальной эхокардиографии: верифицируется задержанное сокращение
латеральной стенки левого желудочка относительно межжелудочковой
перегородки у пациента с блокадой левой ножки пучка Гиса
Рис. 2.14. Признаки межжелудочковой десинхронизации. Примечание. М-режим
трансторакальной эхокардиографии: верифицируется задержанное сокращение
латеральной стенки левого желудочка относительно межжелудочковой
перегородки у пациента с блокадой левой ножки пучка Гиса
Таблица 2.8
Клинические эффекты ресинхронизирующей терапии
 Выбор режима и определение параметров ресинхронизирующей электрокардиостимуляции
Выбор режима и определение параметров ресинхронизирующей электрокардиостимуляции
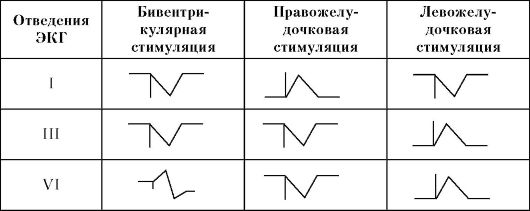
Порядок тестирования КРСУ мало отличается от тестирования обычного электрокардиостимулятора. Дополнительно в ходе проверки КРСУ проводят определение параметров, относящихся к левожелудочковому электроду (порог электрокардиостимуляции, импеданс). В устройствах, не обладающих функцией отдельного программирования левожелудочкового канала электрокардиостимуляции, в ходе определения порога стимуляции целесообразно мониторирование ЭКГ в 12 отведениях. Если во время данного теста происходит изменение морфологии стимулированного желудочкового комплекса на поверхностной ЭКГ при сохраняющемся желудочковом захвате, то это свидетельствует о том, что достигнут порог стимуляции в одном из желудочковых каналов. При этом желудочковые «захваты» осуществляются благодаря более низкой величине порога стимуляции во втором желудочковом канале. На основании анализа 12 отведений ЭКГ можно определить, какой режим стимуляции используется у пациента (табл. 2.9 и рис. 2.17, см. на вклейке).
Таблица 2.9
Морфология комплекса QRS в отведениях I, III и V1 при проведении различных видов электрокардиостимуляции
 Пациенты с синусовым ритмом
Пациенты с синусовым ритмом
При отсутствии у пациента с имплантированным КРСУ хронической фибрилляции предсердий важным моментом является оптимизация предсердно-желудочковой ресинхронизации методом под-
бора оптимальных параметров АВ-задержки. Существуют несколько методик определения этой величины. Наиболее часто используется формула Риттера, которая позволяет вычислить оптимальную величину АВ-задержки на основании регистрации формы трансмитрального потока, регистрируемого в М-режиме при трансторакальной эхокардиографии:
ABопт. - ABдл. + QAдл. - QA.коротк.
АВдл - величина устанавливается на программаторе и составляет 75% от интервала PQ.
АВкоротк - величина устанавливается на программаторе и составляет 25% от интервала PQ.
QAдл - измеряется от начала стимуляционного желудочкового комплекса (Q) до конца пика А при запрограммированной удлиненной АВ-задержке (АВдл.).
QАкOрOTK - измеряется от начала стимуляционного желудочкового комплекса (Q) до конца пика А при запрограммированной короткой АВ-задержке (АВкоротк ).
В ряде случаев АВ-задержка программируется на основании визуальной регистрации оптимальной формы пиков трансмитрального потока (рис. 2.13). Особо подчеркнем, что величина программируемой АВ-задержки должна быть меньше величины интервала PQ, так как только в этом случае будет обеспечиваться постоянная бивентрикулярная стимуляция.
Оптимизация параметров межжелудочковой ресинхронизации возможна только в аппаратах, обладающих функцией отдельного программирования лево- и правожелудочкового каналов. Установка величины межжелудочковой задержки в диапазоне 5-20 мс с левожелудочковым опережением является оптимальной в гемодинамическом отношении, по сравнению с одновременной право- и левожелудочковой стимуляцией. При этом целесообразно проводить подбор величины межжелудочковой задержки под эхокардиографическим контролем методом вычисления разницы интервалов от начала комплекса QRS до начала потока в аорте и легочной артерии (не более 40 мс) и задержки движения латеральной стенки левого желудочка относительно межжелудочковой перегородки (не более 40 мс).
Пациенты с хронической формой фибрилляции предсердий
В этой категории пациентов подбор АВ-задержки невозможен, так как систола предсердий отсутствует как таковая. Поэтому ключевым моментом является достижение постоянной бивентрикулярной стимуляции за счет установки частоты ЭКС не ниже 70-80 в минуту и контроля частоты желудочковых сокращений. Нормосистолия достигается либо медикаментозным подавлением АВ-проведения, либо проведением модификации атриовентрикулярного соединения методом радиочастотной деструкции. Принципы оптимизации межжелудочковой ресинхронизации не отличаются от тех, которые применимы в отношении пациентов с синусовым ритмом.
По данным клинических исследований, установлено, что приблизительно у 25-30% пациентов с высоким функциональным классом ХСН не отмечается положительного эффекта от проведения кардиоресинхронизации по ряду причин. Во-первых, это отсутствие выраженных признаков десинхронизации правого и левого желудочков до имплантации системы. Во-вторых, неадекватное позиционирование электрода для левожелудочковой стимуляции. Электростимуляция латеральной стенки левого желудочка более эффективна через электрод, проведенный в латеральную или заднелатеральную вены сердца. В то же время электростимуляция из сердца или большой вены сердца часто не оказывает положительного влияния на систолическую функцию левого желудочка. В-третьих, некорректная установка параметров кардиоресинхронизации. Улучшение клинической симптоматики возникает только при условии постоянной бивентрикулярной стимуляции.
Показания к имплантации кардиоресинхронизирующих устройств (ЕСС/ACC/AHA, 2005)
Класс I:
1. Сердечная недостаточность III/IV ФК (NYHA), несмотря на оптимальную медикаментозную терапию.
2. Длительность комплекса QRS >130 мс.
3. Фракция выброса левого желудочка <35%.
4. Конечно-диастоличсекий размер левого желудочка >55 мм.
5. Эхокардиографические признаки желудочковой десинхронизации.
Программа инструментального обследования пациентов
1. ЭКГ.
2. Суточное мониторирование ЭКГ.
3. Проба с физической нагрузкой.
4. Тест с 6-минутной ходьбой.
5. Рентгенография органов грудной клетки.
6. Эхокардиография.
7. Коронарография.