Руководство по кардиологии: учебное пособие в 3 т. / под ред. Сторожакова Г.И., Горбаченкова А.А. - 2009. - Т. 3. - 512 с.: ил.
|
|
|
|
ГЛАВА 13 СЕРДЕЧНЫЕ ГЛИКОЗИДЫ
Сердечные гликозиды (СГ) объединяют растительные вещества и их полусинтетические производные с кардиотоническими и антиаритмическими свойствами. СГ широко применяют в лечении сердечной недостаточности, мерцательной аритмии и трепетании предсердий. СГ способствуют повышению ударного объема, улучшают переносимость физических нагрузок, снижают риск декомпенсации сердечной недостаточности. СГ ослабляют чрезмерную симпатическую активность и восстанавливают чувствительность кардиопульмональныхрефлексов. СГ различаются по своим фармакокинетическим свойствам, которые определяют скорость развития и продолжительность действия, способность накапливаться в организме. Узкий терапевтический индекс и множество факторов, изменяющих их фармакокинетику и чувствительность миокарда к ним, создает высокий риск токсических эффектов и требует регулярного контроля в процессе лечения.
Ключевые слова: сердечные гликозиды, инотропное действие, антиаритмическое действие, фармакокинетические параметры, кумуляция в организме, дигиталисная интоксикация.
МЕХАНИЗМ ДЕЙСТВИЯ И ФАРМАКОДИНАМИЧЕСКИЕ ЭФФЕКТЫ
Сократимость миокарда. СГ являются мощными ингибиторами натрий-калиевой АТФазы, фермента, обеспечивающего перенос ионов натрия и калия через мембрану кардиомиоцита. Блокада работы натриевого насоса приводит к повышению содержания внутриклеточного натрия и снижению натриевого трансмембранного градиента, который в норме создает электродвижущую силу для переноса внутриклеточного кальция через клеточную мембрану во время реполяризации миоцита. Возникающее при этом накопление ионов кальция вызывает усиление сократимости миокардиальных волокон, что и определяет положительное инотропное действие препаратов. СГ в равной степени повышают сократимость миокарда как при сердечной недостаточности, так и в ее отсутствии. Однако назначение СГ здоровым людям не сопровождается повышением минутного выброса, так как величина последнего определяется не только силой сердечных сокращений, но и зависит от ЧСС, пред- и постнагрузки. Рефлекторная регуляция этих гемодинамических механизмов препятствует заметному повышению минутного выброса при усилении сократимости недекомпенсированного сердца.
Активность симпатической нервной системы. Важным дополнительным механизмом терапевтического действия СГ является их способность снижать нейрогуморальную активность симпатической нервной системы, компенсаторное повышение которой наблюдается при снижении насосной функции сердца ниже уровня, необходимого для поддержания адекватного метаболизма тканей. Показано, что снижение активности симпатической нервной системы не является результатом положительного инотропного действия СГ, а обусловлено их прямым эффектом на чувствительность каротидного синуса.
Электрофизиологические свойства. Действие СГ на возбудимость, проводимость и автоматизм объясняется подавлением натрий-калиевой АТФазы, повышением вагусного тона и снижением активности симпатической нервной системы. В терапевтических дозах СГ удлиняют эффективный рефрактерный период и снижают скорость проведения импульсов через атриовентрикулярный узел. Удлинение а-в проводимости проявляется урежением частоты сокращений желудочков при суправентрикулярных аритмиях и удлинением интервала PQ при синусовом ритме. Дальнейшее угнетение проводимости
может привести к брадикардии или полной поперечной блокаде. В высоких дозах СГ могут повышать активность симпатической нервной системы и прямо воздействовать на автоматизм сердечной мышцы. Эти эффекты лежат в основе аритмогенного действия СГ, так как одновременое повышение автоматизма и подавление проводимости в системе Гиса-Пуркинье создают условия для развития желудочковых тахиаритмий и фибрилляции желудочков.
Действие СГ на сосудистый тонус. Определяется как прямыми, так и непрямыми эффектами препаратов, которые по-разному реализуются в условиях здорового и декомпенсированного сердца. В отсутствие сердечной недостаточности СГ проявляют прямое миотропное вазоконстрикторное действие на артериолы и вены. В ряде случаев вазоспастический эффект может сопровождаться повышением конечно-диастолического давления, что необходимо учитывать при парентеральном введении препаратов, когда транзиторное повышение сосудистого сопротивления и АД может оказаться нежелательным. Этот эффект можно избежать при медленном введении препарата. В условиях сердечной недостаточности действие на сосуды обусловлено непрямыми эффектами СГ. Повышение сократимости миокарда, улучшение гемодинамики и снижение активности симпатической нервной системы, вызываемые СГ, приводят к подавлению механизмов нейрогуморальной вазоконстрикции, что влечет за собой понижение общего периферического сопротивления и венозного тонуса. Снижение постнагрузки, в свою очередь, способствует дальнейшему улучшению работы сердца.
Влияние на функцию почек и диурез. СГ оказывают прямое подавляющее действие на канальциевую реабсорбцию натрия, что также связано с подавлением натрий-калиевой АТФазы. Однако в терапевтических дозах прямой мочегонный эффект СГ проявляется слабо и не имеет самостоятельного клинического значения. Увеличение диуреза, вызываемое СГ, в большей степени обусловлено восстановлением общей и почечной гемодинамики.
КЛАССИФИКАЦИЯ СГ
Все СГ имеют в своей основе стероидное ядро с ненасыщенным лактоновым кольцом и один или несколько гликозидных остатков (сахаров). Основные фармакодинамические эффекты обусловлены
общностью стероидной структурой молекулы, а свойства сахаристой части определяют многие фармакокинетические характеристики СГ, такие как механизмы, скорость и полноту всасывания, прочность связи с белками, особенности метаболизма. В соответствии с фармакокинетическими особенностями все СГ делят на 3 группы: жирорастворимые препараты, препараты с умеренной растворимостью в жирах и водорастворимые средства (табл. 13.1). Представителями 1-й группы является дигитоксин и бета-ацетилдигитоксин. Ко 2-й группе относятся дигоксин, ланатозид С, метилдигоксин и мепросцилларин, к 3-й - строфантин-К, оуабаин и коргликон.
Таблица 13.1
Фармакокинетические свойства СГ
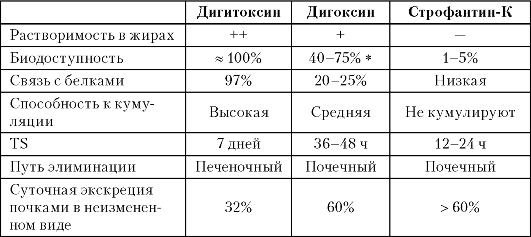 * - 20-40% для ланатозида С, характеризуется нестабильностью всасывания.
* - 20-40% для ланатозида С, характеризуется нестабильностью всасывания.
Не все эти препараты одинаково широко используются в клинической практике. Частота применения зависит от степени их изученности, фармакокинетических особенностей, доступности, наличия или отсутствия преимуществ перед основными представителями и традициями медицинской школы.
ФАРМАКОКИНЕТИКА
Всасывание. Полнота всасывания определяется степенью растворимости СГ. Гидрофильные препараты практически не всасываются и должны вводится в/в. Биодоступность СГ, частично растворимых
в жирах, во многом зависит от лекарственной формы коммерческих препаратов. Наибольшей биодоступностью (до 75%) обладают эликсиры и гелевые инкапсулированные формы. Биодоступность таблетированных препаратов часто не превышает 40-60%. Пища, заболевания, сопровождающиеся нарушением всасывания, и некоторые препараты могут изменять скорость и полноту всасывания СГ (см. «Взаимодействие СГ с другими препаратами»).
Распределение. Жирорастворимые СГ способны проникать во все органы и ткани. Они прочно связываются с белками плазмы, что определяет длительную циркуляцию в кровотоке и высокую способность к кумуляции. В большом количестве препараты определяются в миокарде, ЦНС, скелетной мускулатуре. Они способны проходить через плацентарный барьер. Препараты группы дигоксина также имеют большой объем распределения (4-6 л/кг). Они активно проникают во многие органы и ткани организма. Однако благодаря их меньшей липофильности они скорее выводятся из организма и меньше кумулируют. Основным местом их накопления является скелетная мускулатура, поэтому их дозы следует рассчитывать исходя из идеальной, а не фактической массы тела. Водорастворимые гликозиды имеют непрочную связь с белками. Время их циркуляции в кровотоке еще меньше.
Биотрансформация и экскреция. Чем выше липофильность препаратов, тем в большей степени они подвергаются метаболизации в печени. Для дигитоксина, как наиболее липофильного препарата, характерна не только высокая степень биотрансформации, но и печеночный путь экскреции. Его TS мало изменяется при заболеваниях как почек, так и печени. Жирорастворимые препараты частично выделяются в неизмененном виде с желчью в просвет кишечника, откуда полностью или частично всасываются обратно в кровь, повторяя печеночно-кишечный круг циркуляции до полного метаболического превращения, что вносит свой вклад в продолжительность действия этих гликозидов. Препараты группы дигоксина значительно слабее метаболизируются и в большой степени выводятся почками в виде активных соединений (и 80%). Период полувыведения этой группы препаратов зависит от функции почек. Показана высокая корреляция между клиренсом креатинина и концентрацией дигоксина в плазме, что помогает корректировать дозы гликозидов этой группы в условиях почечной недостаточности. При сниженной функции почек дозы водорастворимых гликозидов также необходимо корректиро-
вать, поскольку они практически полностью экскретируются почками, мало подвергаясь метаболизации.
Скорость развития эффектов и длительность циркуляции СГ в крови зависят от скорости и полноты всасывания, прочности связывания с белками, продолжительности биотрансфомации и выраженности печеночно-кишечной циркуляции. Эффекты водорастворимых препаратов развиваются наиболее быстро, в течение нескольких минут, но длительность их пребывания в организме не превышает 1-3 дней. Действие умеренно жирорастворимых гликозидов развивается медленнее, но они длительнее циркулируют в крови и полностью выводятся из организма только через 1 неделю после прекращения приема. Жирорастворимые препараты, обладающие выраженной способностью к кумуляции, покидают организм только через 3-4 недели (табл. 13.2).
Таблица 13.2
Скорость развития эффектов и продолжительность действия СГ
Препараты | Путь введения | Начало действия | Максимум действия | Длительность циркуляции |
Дигитоксин | п/о | 3-6 ч | 6-12 ч | 3-4 недели |
Дигоксин | в/в п/о | 5-30 мин 1,5-6 ч | 1,5-4 ч 4-6 ч | 7 дней 7 дней |
Ланатозид С | п/о | 1,5-3 ч | 2-4 ч | 5 дней |
Строфантин К | в/в | 2-10 мин | 15 мин-2 ч | 3 дня |
Корглюкон | в/в | 5-10 мин | 30мин-2 ч | 1-2 дня |
Регулярное введение терапевтических доз СГ вызывает повышение концентрации препаратов в организме, которое продолжается до развития стабильного концентрационного равновесия между плазмой крови и периферическими органами и тканями, при котором проявляется полный терапевтический эффект данной дозы СГ. Это состояние, получившее название дигитализации, достигается через 3-5 TS препарата. При необходимости сократить период дигитализации в первые несколько дней лечения назначают более высокие, насыщающие, дозы с последующим переходом на поддерживающие. Схемы быстрой дигитализации связаны с более высоким риском развития побочных и токсических явлений и требуют постоянного врачебного контроля.
ПРИМЕНЕНИЕ СГ
Наиболее важной областью применения СГ является СН, однако по сравнению с другими препаратами СГ занимают небольшое место в современной терапии данной патологии. Это объясняется неоднозначностью действия СГ на течение и прогноз СН. СГ наиболее эффективны в ситуациях, когда сердечная недостаточность обусловлена систолической дисфункцией миокарда с дилатацией сердца и снижением фракции выброса (постинфарктный и атеросклеротический кардиосклероз, дилатационная кардиомиопатия и др.). Результаты многоцентровых плацебо-контролируемых исследований свидетельствуют, что прекращение приема СГ при сочетанном их использовании с диуретиками и ингибиторами ангиотензинпревращающего фермента (АПФ) статистически значимо чаще ведет к развитию декомпенсации СН (исследования PROVED, RADIANCE). Положительное влияние на течение СН было выявлено в исследовании DIG, в котором частота госпитализаций по любым причинам была несколько меньше в группе больных, получавших дигоксин, по сравнению с контрольной группой. При этом терапия дигоксином сопровождалась статистически значимым уменьшением числа госпитализаций в связи с декомпенсацией хронической СН. Наибольшая польза от применения дигоксина отмечалась у больных с низкой, менее 35%, ФВ левого желудочка.
Препараты неэффективны или малоэффективны, если сердечная недостаточность протекает с повышенным минутным объемом сердца (гипертиреоз, анемия) или обусловлена нарушением диастолической функции желудочков (митральный стеноз, амилоидоз сердца, выпотной и констриктивный перикардит), или связана с гипертрофией левого желудочка без выраженной дилатации и снижения фракции выброса (как при артериальной гипертонии). СГ не следует назначать не только в остром периоде ИМ, но и в раннем постинфарктном периоде, так как у больных этой категории дигоксин является независимым фактором повышенного риска смерти. Влияние дигоксина на смертность было оценено в исследовании DIG. В целом длительная терапия дигоксином не оказывала статистически значимого влияния на общую смертность и смертность от сердечно-сосудистых заболеваний, но статистически значимо снижала смертность от прогрессирующей СН (в среднем на 14%). При этом в группе больных,
получавших дигоксин, отмечалась отчетливая тенденция к повышению смертности от острого инфаркта миокарда (ИМ) и от аритмий (на 26 и 12% соответственно). Результаты других исследований, в которых оценивалась безопасность дигоксина и дигитоксина после ИМ, также свидетельствовали об увеличении риска смерти при лечении СГ примерно в 1,5-2,0 раза. Вместе с тем добавление ингибитора АПФ к терапии СГ снижает смертность больных, перенесших острый ИМ, в среднем на 40%.
Учитывая результаты значительных многоцентровых исследований, следует признать, что СГ не являются средством выбора для длительной терапии СН с систолической дисфункцией левого желудочка. Предпочтение следует отдавать ингибиторам АПФ, которые при необходимости комбинируют с диуретиками и малыми дозами β-блокаторов. И лишь при недостаточной эффективности такой терапии больным с хронической СН III-1V функционального класса рекомендуется добавлять дигоксин.
Другим показанием для назначения СГ является урежение сердечного ритма при мерцании предсердий, пароксизмальной наджелудочковой тахикардии, перевод трепетания предсердий в мерцание или синусовый ритм. Несмотря на то что антиаритмическим эффектом в большей или меньшей степени обладают все СГ, при нарушениях ритма чаще всего используют дигоксин. Наиболее сильное ваготропное влияние дигоксин оказывает на синоатриальный и атриовентрикулярный узлы, поскольку именно в этих структурах парасимпатическая иннервация максимальна. Поэтому он может быть полезен при любой аритмии, в возникновении которой атриовентрикулярный узел играет ключевую роль, например, при АВузловой реципрокной тахикардии (при которой атриовентрикулярный узел является прямым участником аритмии), при фибрилляции и трепетании предсердий. Антиаритмический эффект дигоксина проявляется не в восстановлении ритма, а в урежении числа предсердных импульсов, которые могут быть проведены на желудочки в единицу времени. Как показали результаты исследования DAAF (1997 г.), способность дигоксина восстанавливать синусовый ритм при мерцательной аритмии немногим отличалась от эффекта плацебо. Не получило подтверждения ранее широко распространенное представление о способности дигоксина «переводить» пароксизмальную форму фибрилляции предсердий в постоянную, а также его
способность предупреждать рецидивы фибрилляции предсердий. Дигоксин сохраняет свое значение в качестве ЛС, обеспечивающего контроль частоты ритма желудочков у больных с тахикардитическими формами наджелудочковых аритмий. Он особенно эффективен при сочетании нарушений ритма и СН независимо от того, связана ли она с дисфункцией левого желудочка или нет, т.е. в случаях, когда другие антиаритмические ЛС, также блокирующие проведение импульсов через атриовентрикулярный узел (антагонисты кальция и β-блокаторы), могут вызвать ухудшение сердечной деятельности.
ПРОТИВОПОКАЗАНИЯ
СГ противопоказаны при выраженной брадикардии, атриовентрикулярной блокаде различной степени, за исключением полной атриовентрикулярной блокады без приступов Морганьи-Адамса-Стокса. При лечении мерцательной аритмии или трепетании предсердий на фоне синдрома Вольфа-Паркинсона-Уайта СГ могут укорачивать эффективный рефрактерный период дополнительного пучка и ускорять частоту желудочковых сокращений. СГ не рекомендуется назначать при нестабильной стенокардии и остром инфаркте миокарда, так как состояние ишемии значительно повышает риск развития токсических эффектов со стороны сердца.
Токсические эффекты. СГ относятся к лекарственным веществам, оказывающим выраженное токсическое действие. В основе механизма гликозидной интоксикации лежит чрезмерное (более чем на 60%) угнетение мембранной Na+/К+АТФазы миоцитов и нейронов и связанное с этим нарушение транспорта электролитов. Накопление внутриклеточного кальция, натрия и истощение внутриклеточного калия приводит к изменениям, несовместимым с жизнедеятельностью клетки.
Токсичность СГ трудно предсказать и диагностировать, поскольку начальные симптомы интоксикации носят неспецифический характер, а мониторирование плазменных концентраций не дает надежных результатов. Последнее объясняется выраженной вариабельностью индивидуальной чувствительности к СГ и большим количеством факторов, способных изменять их фармакокинетику.
Часто первыми симптомами дигиталисной интоксикации бывают потеря аппетита, тошнота, слабость, брадикардия. Интоксикация СГ может проявляться каким-либо одним симптомом или несколькими нарушениями функции желудочно-кишечного тракта, ЦНС, сердца или зрения (табл. 13.3).
Таблица 13.3
Токсические эффекты СГ
Желудочно-кишечные |
Анорексия, тошнота, рвота, дискомфорт и боли в животе, диарея |
Психоневрологические |
Головная боль, утомляемость, слабость, бессонница, спутанность сознания, боль и парестезии в конечностях, беспокойство, апатия, делирий, галлюцинации, редко судороги |
Зрительные |
Выпадение полей зрения, нарушение цветового восприятия |
Сердечные |
Нарушения проводимости и ритма сердца, корытообразная депрессия сегмента ST на ЭКГ |
Другие |
Усиление легочной вентиляции в ответ на гипоксию, редко гинекомастия |
Наиболее серьезными являются токсические эффекты со стороны сердца. СГ могут вызывать практически все виды аритмий отдельно или в сочетании с нарушением проводимости. К ним относятся желудочковая экстрасистолия, атриовентрикулярная блокада разной степени, чрезмерное замедление желудочкового ритма при мерцательной аритмии, ускоренный атриовентрикулярный ритм, наджелудочковая и желудочковая тахикардия, мерцание предсердий, фибрилляция желудочков. Нередко у больного наблюдается несколько видов аритмий одновременно. Выраженность токсических эффектов СГ в определенной степени зависит от уровня внеклеточного калия. Известно, что ионы калия препятствуют связыванию СГ с калий-натриевой АТФазой. Таким образом, повышение уровня внеклеточного калия ослабляет действие СГ, а гипокалиемия усиливает его.
Лечение дигиталисной интоксикации. Наиболее частые проявления интоксикации (единичные желудочковые экстрасистолы, экстрасистолы из атриовентрикулярного соединения, атриовентрикулярная блокада 1 степени, брадисистолическая форма мерцательной аритмии) требуют только временной отмены препарата, ЭКГ контроля и последующей коррекции дозы СГ для избежания повторных нарушений. При частой желудочковой экстрасистолии и пароксизмах тахиаритмии назначают препараты калия внутривенно даже при отсутствии гипокалиемии. Они противопоказаны при нарушении атриовентрикулярной проводимости и хронической почечной недостаточности. Для лечения желудочковых аритмий, угрожающих нарушением сердечной гемодинамики, назначают лидокаин (100 мг в/в в виде болюса) или фенитоин (100 мг в/в медленно, затем по 100 мг 4-6 раз в сутки внутрь), имеющие минимальный эффект на проводимость атриовентрикулярного узла. Антиаритмические средства группы хинидина могут быть полезны, но их применение связано с высоким риском развития новых аритмий и блокадой проведения. При наджелудочковых нарушениях ритма применяют β-адреноблокаторы. При атриовентрикулярных блокадах II-III степени вводят атропин (0,5-1мг в/в). Электроимпульсная терапия при интоксикации СГ малоэффективна. Для устранения дигиталисной интоксикации используют также унитиол и изучают возможности иммунологического способа детоксикации - введения антител к сердечным гликозидам, нейтрализующих сам препарат.
Состояния, повышающие риск развития интоксикации. Дигиталисная интоксикация может развиться не только в результате передозировки препаратов, но и при приеме терапевтических доз вследствие повышения чувствительности к ним или изменения их фармакокинетики. Многие заболевания и состояния способны изменять чувствительность миокарда к СГ (табл. 13.4).
Причиной этого в большинстве случаев являются нарушения электролитного и кислотно-щелочного балансов, которые стимулируют связывание СГ с Na+/К+-АТФазой. В результате происходит чрезмерное угнетение процессов регуляции ионного транспорта, что и приводит к развитию симптомов интоксикации. В других случаях причиной повышения чувствительности к СГ является снижение скорости экскреции или метаболизации препаратов, приводящее к повышению их концентрации в крови.
Таблица 13.4
Заболевания и состояния, повышающие риск развития интоксикации
Заболевания,состояния | Факторы, повышающие чувствительность |
Диализ, прием диуретиков | Гипокалиемия, гипомагниемия |
Печеночная недостаточность | Гипокалиемия |
Выраженные нарушения вентиляции легких | Гипоксия, ацидоз |
Миелома, длительный постельный режим Заболевания паращитовидной железы | Гиперкальциемия |
Ишемия миокарда, усиление декомпенсации сердца | Гипоксия, ацидоз |
Почечная недостаточность | Снижение клиренса дигоксина |
Гипотиреоз | Снижение клиренса дигоксина |
Пожилой возраст | Снижение объема распределения и клиренса дигоксина |
Необходимо иметь в виду, что усиление застойных явлений, так же как и ишемия миокарда, может усугублять гипоксию и ацидоз и способствовать повышению токсических эффектов СГ.
Если в пожилом возрасте, как правило, требуются меньшие дозы гликозидов, то детям младшего возраста (от 1 мес жизни до 2 лет) для достижения терапевтического эффекта необходимы более высокие дозы, чем взрослым и детям до 12 лет (в пересчете на единицу массы тела). Это связано не только с более низкой чувствительностью миокарда детей к СГ, но и с различиями в их кинетике (объем распределения, общий и почечный клиренс). В то же время лечение недоношенных и новорожденных детей требует более низких доз гликозидов, что, возможно, связано с более низкой клубочковой фильтрацией почек в этом возрастном периоде и накоплением препарата.
ВЗАИМОДЕЙСТВИЕ СГ С ДРУГИМИ ПРЕПАРАТАМИ
Большое число лекарственных препаратов может вступать в потенциально значимые взаимодействия с СГ, ослабляя основные эффек-
Таблица 13.5
Фармакодинамическое взаимодействие
Препараты | Эффекты взаимодействия |
β-блокаторы, верапамил, дилтиазем, группа хинидина | Замедление синоатриальной или атриовентрикулярной проводимости или автоматизма |
Калийвыводящие диуретики, амфотерицин В | Усиление блокады К+/?+ насоса в условиях сниженного содержания ионов К в плазме и тканях |
Симпатомиметики | Повышение автоматизма |
Верапамил, дилтиазем, β-блокаторы | Снижение сократимости миокарда |
ты СГ или усиливая их токсическое действие. Фармакодинамическое взаимодействие осуществляется через механизмы фармакологической регуляции функций миокарда (табл. 13.5).
Многие препараты способны изменять содержание дигоксина в крови, взаимодействуя с ним на разных фармакокинетических этапах (табл. 13.6).
Некоторые лекарственные препараты (хинидин, верапамил, дилтиазем) могут вступать с СГ как в фармакокинетические, так и фармакодинамические взаимодействия, что требует тщательного контроля за безопасностью терапии.
Таблица 13.6
Фармакокинетические взаимодействия