Биология: учебник: в 2 т. / под ред. В. Н. Ярыгина. - 2011. - Т. 2. - 560 с. : ил.
|
|
|
|
Глава 12. ДЕЙСТВИЕ ЭЛЕМЕНТАРНЫХ ЭВОЛЮЦИОННЫХ ФАКТОРОВ В ПОПУЛЯЦИЯХ ЛЮДЕЙ
12.1. ПОПУЛЯЦИЯ ЛЮДЕЙ. ДЕМ, ИЗОЛЯТ
Размножение человека осуществляется половым путем, а репродуктивные ареалы в той или иной степени ограничены определенной группой населения. Это позволяет выделить в человечестве сообщества, аналогичные популяциям в биологическом понимании этого термина. В антропогенетике популяцией называют группу людей, занимающих общую территорию и свободно вступающих в брак. Изоляционные барьеры, препятствующие заключению брачных союзов, нередко носят выраженный социальный характер (например, различия в вероисповедании). Благодаря этому в формировании популяций людей главную роль играет не общность территории, а социальные факторы.
Демографические показатели популяций людей - размер, уровень рождаемости и смертности, возрастной состав, экономическое состояние, уклад жизни. Генетически популяции характеризуются генофондами (аллелофондами). Демографические показатели оказывают серьезное воздействие на состояние генофондов человеческих популяций, главным образом через структуру браков. Большое значение в определении структуры браков имеет размер группы.
Популяции из 1500-4000 человек называют демами, популяции численностью до 1500 человек - изолятами. Для демов и изолятов типичен относительно низкий естественный прирост населения - соответственно порядка 25% и не более 20% за поколение. Частота внутри-групповых браков в них составляет 80-90% и свыше 90%, а приток лиц из других групп сохраняется на уровне 1-2% и менее 1%. В силу высокой частоты внутригрупповых браков члены изолятов, просуществовав-
ших четыре поколения (примерно 100 лет) и более, являются не менее чем троюродными братьями и сестрами (сибсами).
В больших по размерам популяциях распределение аллелей отдельных генов в генотипах индивидуумов последовательных поколений подчиняется закону Харди-Вайнберга. Это используют в медико-генетической практике для расчета доли гетерозигот - носителей определенного рецессивного аллеля. Так, в Швеции в 1965-1974 гг. страдающие фенилкетонурией встречались с частотой примерно 1 : 40 000. Исходя из закона Харди-Вайнберга, по локусу, представленному двумя аллелями, три возможных генотипа (A1A1, А1А2 и А2A2) распределяются с частотой р2, 2pq, q2. Следовательно, q2 = 1/40 тыс., a q = 1/200. Частота доминантного аллеля нормального обмена фенила-ланина р = 1 - q = l - 1/200 = 199/200. Тогда частота гетерозигот составляет 2pq = 2х(1/200)х(199/200) = 2х(199/40 000). При найденных частотах доминантного и рецессивного аллелей популяция численностью 40 000 человек содержит одного больного фенилкетонурией (А2А2) и 400 носителей неблагоприятного аллеля в гетерозиготном состоянии (А1А2). Остальные члены популяции гомозиготны по благоприятному доминантному аллелю (А1А1). Ниже приведены данные о частоте гетерозиготного носительства и соответствующей ей частоте рецессивных гомозигот с фенотипическим проявлением определенного аллеля.
Таблица 12.1. Частота встречаемости гетерозигот в популяции в зависимости от частот встречаемости гомозигот
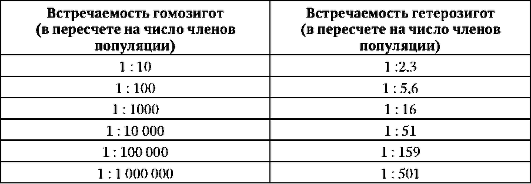
Даже по редким рецессивным аллелям число гетерозигот оказывается достаточно высоким, чтобы это учитывалось при МГК вступающих в брак.
12.2. ВЛИЯНИЕ ЭЛЕМЕНТАРНЫХ ЭВОЛЮЦИОННЫХ ФАКТОРОВ НА ГЕНОФОНДЫ ЧЕЛОВЕЧЕСКИХ
ПОПУЛЯЦИЙ
Клеточные и физико-химические механизмы наследственности и изменчивости универсальны для всех живых существ, включая человека. Установлена определенная зависимость жизнеспособности индивидуума от особенностей его генотипа. Большую часть своей истории человечество было совокупностью более или менее изолированных в репродуктивном отношении относительно малочисленных групп. Вплоть до настоящего времени сохраняются изоляты. В отдельные исторические периоды происходили миграции значительных масс людей. Они сопровождались объединением ранее разобщенных групп, освоением новых территорий со своими климато-географическими условиями. В настоящее время миграции населения усилились в связи с ростом численности людей, совершенствованием средств транспорта, неравномерным развитием экономики. Благодаря отмеченному генофонды популяций людей испытывали ранее и продолжают испытывать действие элементарных эволюционных факторов. Социальность человека вносит в это действие определенную специфику.
12.2.1. МУТАЦИОННЫЙ ПРОЦЕСС
Мутационный процесс у человека сходен с таковым у других организмов по всем основным показателям - средней частоте мутирования на локус или геном за поколение, генетико-физиологическим характеристикам мутаций, наличию антимутационных барьеров. Это совпадение неслучайно. Основные характеристики спонтанного мутагенеза формировались на начальных этапах эволюции жизни под действием таких постоянных факторов, как ультрафиолетовое и иные виды излучения, температура, определенная химическая среда.
Хотя оценка частоты возникновения мутаций у людей встречает серьезные трудности, некоторые подходы к получению таких данных имеются. Согласно одному из них, максимальная определяемая вероятность новой мутации составляла 2,24х10-5 на один локус в поколении.
В настоящее время давление мутационного процесса на генофонд человечества, по-видимому, усиливается благодаря росту индуцированных мутаций. Их причиной нередко служат факторы, возникающие в связи с производственной деятельностью человека в условиях научно-
технической революции, например ионизирующее излучение. Подсчет прироста количества мутаций сверх фоновых значений встречается с теми же трудностями, о которых шла речь выше. Согласно ориентировочным данным, доза в 1 Гр (грей), получаемая при низком уровне радиации мужчинами, индуцирует от 1000 до 2000 мутаций с серьезными фенотипическими последствиями на каждый миллион живых новорожденных. У женщин эта цифра ниже - 900.
Мутагенные факторы индуцируют мутации как в половых, так и в соматических клетках. В последнем случае результат может состоять в повышении частоты определенных заболеваний, прежде всего злокачественных опухолей. В отношении ионизирующих излучений, в частности, это лейкозы. Далее идут рак молочной железы и щитовидной железы (рис. 12.1).
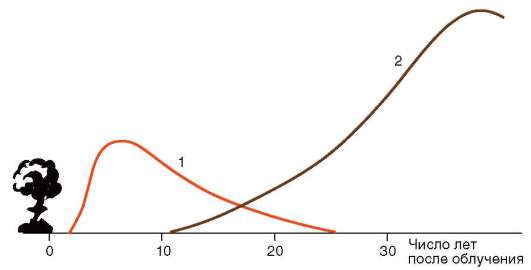
Рис. 12.1. Относительная среднестатистическая вероятность заболевания раком после однократного равномерного облучения тела дозой в 0,01 Гр в популяции людей, переживших атомную бомбардировку: 1 - лейкозы; 2 - все другие виды раковых заболеваний
12.2.2. ПОПУЛЯЦИОННЫЕ ВОЛНЫ
Численность населения планеты за обозримый исторический период в целом значительно возросла. В эпоху неолита (10-6 тыс. лет назад) число людей было равно примерно 5 млн, в период появления городов (4,5-3,5 тыс. лет назад) - 20-40 млн, во времена Римской империи к началу новой эры - 200 млн, к 1600 г. - 500 млн, в 1800 г. - 1 млрд,
в настоящее время - более 6 млрд. Представляя общую тенденцию в истории человечества, эти данные указывают также на изменение во времени темпов прироста народонаселения. Этот показатель, однако, изменялся в историческом развитии неравномерно.
Моменты ускорения прироста численности людей совпадают с важнейшими достижениями человечества - развитием земледелия примерно 8000 лет назад, началом индустриализации, эрой научно-технической революции. Важное следствие увеличения темпа прироста - изменение плотности населения. Так, в эпоху охотников и собирателей (3020 тыс. лет назад) она составляла менее 1 человека на 3 км2, в век бронзы и железа (4-3 тыс. лет назад) - 10 человек, в настоящее время - от 4 до 900-1200 человек на 3 км2. Даже сейчас 50% населения размещаются всего на 5% площади обитаемой суши. Крайне неравномерное распределение людей на Земном шаре имело место на любом этапе развития человечества. Ускорение роста численности при ограниченности заселяемой территории способствует усилению миграций.
На фоне общей тенденции к повышению численности людей имели место отдельные снижения этого показателя (рис. 12-2). Причиной снижения, отраженного на диаграмме динамики населения планеты, была эпидемия чумы с большой смертностью, которая в средние века распространилась на значительные территории. Предполагают, что сокращение численности людей на территории Европы происходило также в начале каменного века. Причина состояла в уничтожении племенами, освоившими технику коллективной охоты, основного источника пищи - крупных травоядных животных. Заметные колебания численности на ограниченных территориях происходили вследствие, например, особо опасных инфекций. Они были закономерными явлениями в жизни целых народов еще в начале прошлого столетия (рис. 12.3). Периодические колебания численности людей на обширных или ограниченных территориях, изменяя плотность населения и вызывая миграции, влияли на состояние генофондов человеческих популяций.
12.2.3. ИЗОЛЯЦИЯ
Человеческое общество длительно развивалось как совокупность изолированных производственных коллективов, внутри которых в основном и совершались браки. Природа изоляционных барьеров между популяциями людей разнообразна. В ранней истории человечества важное место принадлежало, по-видимому, географической изоляции.
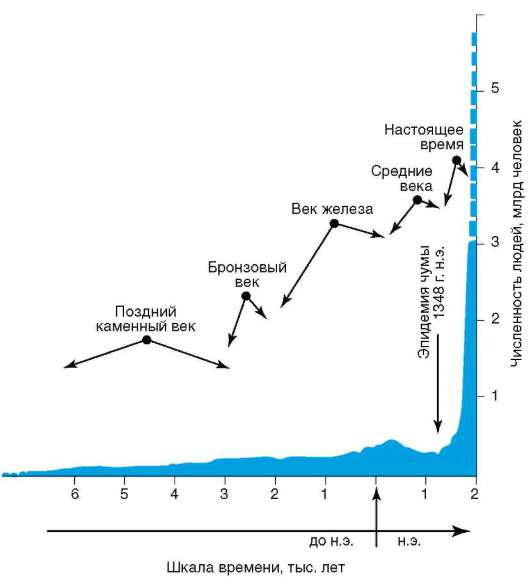
Рис. 12.2. Сокращение численности людей в Средние века в связи с эпидемией чумы
В человеческом обществе встречаются специфические формы изоляции, зависящие от разнообразия культур, экономических укладов, религиозных и морально-этических установок.
Фактор изоляции оказывал влияние на генофонды популяций людей. Длительным проживанием в состоянии относительной культурной и географической изоляции объясняют, например, некоторые антропологические особенности представителей малых народностей: своеобразный рельеф ушной раковины бушменов, большая ширина нижнечелюстного диаметра коряков и ительменов, исключительное развитие бороды ай-
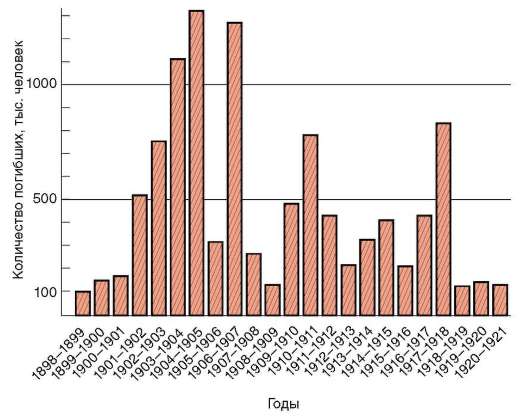
Рис. 12.3. Смертность от чумы в Индии по годам (1898-1922)
нов. Среди горных таджиков, проживающих в одном районе, выделены группы с разным соотношением индивидуумов по антигенам эритроцитов системы АВ0. Причина различий - изолированность от главных перевальных путей сообщения.
Сохранению высокого уровня генетической изоляции двух популяций, существующих на одной территории, способствуют отличия по физическим признакам или образу жизни. Однако такие барьеры со временем ослабевают. Об этом свидетельствует судьба популяций белых и негров в США и Бразилии. К настоящему времени доля генов от белых составляет у американских негров 25%, а у бразильских - 40%. Между двумя генетически различающимися популяциями, разделенными географически, иногда вклиниваются другие популяции, через которые и происходит обмен генами. В таких случаях наблюдается градиент признака. Так, частота аллеля группы крови В в Европе постепенно повышается с запада на восток (рис. 12.4). У коренного населения Пиренейского полуострова этот ген практически отсутствует, тогда как в районе Астра-
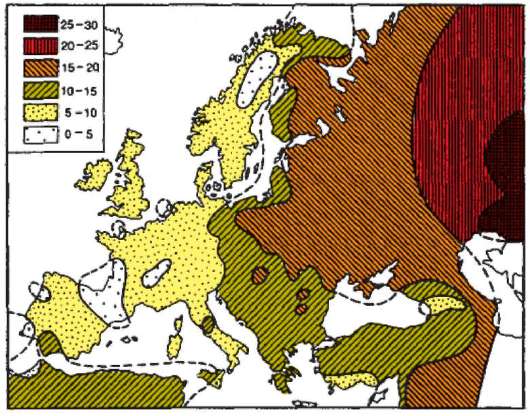
Рис. 12.4. Градиент распределения аллеля В системы группы АВ0 в Европе
хани его частота достигает 30%. Это может объясняться массовой миграцией кочевого населения центрально-азиатского происхождения, в популяциях которого антиген В встречается с высокой частотой, на территорию Восточной и Центральной Европы в XII-XIII вв. н.э. Большая часть населения Западной Европы не имела тесных контактов с мигрантами из Азии и поэтому частота аллеля В их популяциях остается крайне низкой.
В настоящее время круг возможных браков неуклонно расширяется. Разрушение многовековых изоляционных барьеров - процесс, по-видимому, необратимый.
12.2.4. ГЕНЕТИКО-АВТОМАТИЧЕСКИЕ ПРОЦЕССЫ
Предположительно, в палеолите человеческие популяции состояли из нескольких сотен индивидуумов. Всего одно-два столетия тому назад люди жили преимущественно поселениями в 25-35 домов. Вплоть до самого последнего времени число индивидуумов в отдельных популяциях, непосредственно участвующих в размножении, редко превышало
400-3500 человек. Причины географического, экономического, расового, религиозного, культурного порядка ограничивали брачные связи масштабами определенного района, племени, поселения, секты. Высокая степень репродуктивной изоляции малочисленных человеческих популяций на протяжении многих поколений создавала благоприятные условия для дрейфа генов.
Генетико-автоматические процессы, или дрейф генов, приводят к сглаживанию изменчивости внутри группы и появлению случайных, не связанных с отбором различий между изолятами. Именно это выявили наблюдения за особенностями фенотипов малочисленных групп населения в условиях, например, географической изоляции. Так, среди жителей Памира резус-отрицательные индивидуумы встречаются в 2-3 раза реже, чем в Европе. В большинстве кишлаков такие люди составляют 3-5% популяции. В некоторых изолированных селениях, однако, их насчитывается до 15%, т.е. примерно как в европейской популяции.
В крови человека имеются гаптоглобины, которые связывают свободный гемоглобин после разрушения эритроцитов, чем предотвращают его выведение из организма. Синтез гаптоглобина Нр1-1 контролируется геном Нр1. Частота этого гена у представителей двух соседних племен на Севере Южной Америки составляет 0,205 и 0,895, отличаясь более чем в 4 раза.
Примером действия дрейфа генов в человеческих популяциях служит эффект родоначальника. Он возникает, когда несколько семей порывают с родительской популяцией и создают новую на другой территории. Такая популяция обычно поддерживает высокий уровень брачной изоляции. Это способствует случайному закреплению в ее генофонде одних аллелей и утрате других. В результате частота очень редкого алле-ля может стать значительной.
Хорошо известна ситуация в изолированной популяции пенсильванских амишей - религиозной общине немцев, переселившихся в США из Эльзаса и северной Швейцарии в середине XVIII в. В настоящее время община насчитывает более чем 30 000 человек и постепенно расселяется за пределы Пенсильвании, однако строго сохраняет генетическую изоляцию. Так, члены религиозной секты амишей в округе Ланкастер, насчитывавшей к середине XIX века примерно 8000 человек, являются потомками только двенадцати семей, и поэтому за время их существования в Америке все они уже давно стали близкими родственниками. В быту они используют диалект немецкого языка, на котором общались их предки. Религиозные запреты не позволяют им предохраняться от
беременности, и поэтому большинство их семей многодетны. Очевидно, среди членов первых семей, основавших популяцию, находились носители рецессивных мутантных аллелей - «родоначальники» соответствующих фенотипов.
За счет генетико-автоматических процессов в популяции амишей накопилось большое количество редких рецессивных аллелей, которые в гомозиготном состоянии постоянно проявляются с большой частотой практически во всех семьях в виде разнообразных наследственных заболеваний. Всего известно 16 таких заболеваний, но 2 из них - особая форма карликовости, сопровождающаяся полидактилией и тяжелой умственной отсталостью, а также «болезнь кленового сиропа» описаны только в популяции амишей и больше нигде не встречаются. Оба заболевания наследуются аутосомно-рецессивно. Последнее заболевание представляет собой серьезное нарушение функции почек и углеводного обмена, при котором часть продуктов аномального метаболизма углеводов выделяется с мочой, приобретающей в результате специфический запах. Интересно, что в дочерних популяциях амишей, расселившихся в штатах Огайо и Индиана, карликовость, сопровождающаяся полидактилией, не встречается. Таким образом, в малых изолированных популяциях редкие рецессивные аллели, резко снижающие жизнеспособность, имеют тенденции не только к накоплению, но и к исчезновению. Это объясняется тем, что генотипы всех членов вновь возникшего изолята малых размеров случайно могут оказаться лишенными соответствующих редких рецессивных аллелей. Вероятно, крайне низкая частота встречаемости фенилкетонурии, одного из самых известных наследственных заболеваний аутосомно-рецессивной природы, у евреев-ашкенази и финнов обусловлена именно этой причиной.
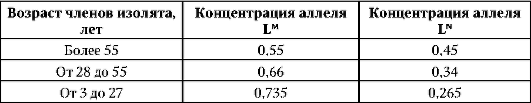
В XVIII в. из Германии в США иммигрировало 27 семей, основавших в штате Пенсильвания секту дункеров. За 200-летний период существования в условиях жесткой брачной изоляции генофонд популяции дункеров изменился в сравнении с генофондом населения Рейнской области Германии, из которой они произошли. При этом степень различий во времени увеличивалась. У лиц в возрасте 55 лет и выше частоты аллелей системы групп крови MN ближе к цифрам, типичным для населения Рейнской области, чем у лиц в возрасте 28-55 лет. В возрастной группе 3-27 лет сдвиг достигает еще больших значений (табл. 12.2).
Таблица 12.2. Прогрессивное изменение концентрации аллелей системы групп крови MN в популяции дункеров
Рост среди дункеров числа лиц с группой крови М и снижение - с группой крови N нельзя объяснить действием отбора, так как направление изменений не совпадает с таковым в целом для населения штата Пенсильвания. В пользу дрейфа генов говорит также то, что в генофонде американских дункеров увеличилась концентрация аллелей, контролирующих развитие заведомо биологически нейтральных признаков, например оволосения средней фаланги пальцев, способности отставлять большой палец кисти (рис. 12.5).
На территории нашей страны малые изолированные популяции имеются в областях традиционного расселения малочисленных народностей Севера, Приамурья и в высокогорных районах Северного Кавказа. Так, на территории Дагестана, в малых популяциях, населенных людьми разной этнической и конфессиональной принадлежности, встречаются с разной частотой многочисленные формы гемоглобинопатий: серповид-ноклеточная анемия, различные формы талассемий, гемоглобинопатии С, D, E, наследственное персистирование фетального гемоглобина и т.д.
На протяжении большей части истории человечества дрейф генов оказывал влияние на генофонды популяций людей. Так, многие особенности узкоместных типов в пределах арктической, байкальской, центрально-азиатской, уральской групп населения Сибири, айнов Ку-
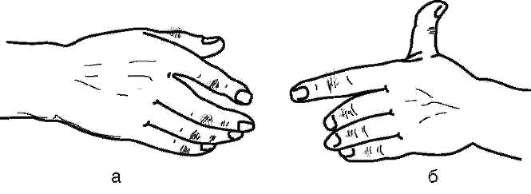
Рис. 12-5. Распространение нейтральных признаков в изоляте дункеров штата Пенсильвания: а - рост волос на средней фаланге пальцев кисти; б - способность отставлять большой палец кисти
рильских островов, индейцев Огненной Земли являются, по-видимому, результатом генетико-автоматических процессов в условиях изоляции малочисленных коллективов. Эти процессы, однако, не имели решающего значения в эволюции человека.
Последствия дрейфа генов, представляющие интерес для медицины, заключаются в неравномерном распределении по группам населения Земного шара некоторых наследственных заболеваний. Так, изоляцией и дрейфом генов объясняется, по-видимому, относительно высокая частота церебромакулярной дегенерации в Квебеке и Ньюфаундленде, детского цистиноза во Франции, алкаптонурии в Чехии, одного из типов порфирии среди европеоидного населения в Южной Америке, адреноге-нитального синдрома у эскимосов. Эти же факторы могли быть причиной низкой частоты фенилкетонурии у финнов и евреев-ашкенази.
Изменение генетического состава популяции вследствие генетико-автоматических процессов приводит к гомозиготизации индивидуумов. При этом чаще фенотипические последствия оказываются неблагоприятными. Вместе с тем следует помнить, что возможно образование и благоприятных комбинаций аллелей. В качестве примера рассмотрим родословные Тутанхамона (рис. 12.6) и Клеопатры VII (рис. 12.7), в которых близкородственные браки были правилом на протяжении многих поколений.
Тутанхамон умер в возрасте 18 лет. Анализ его изображения в детском возрасте и подписи к этому изображению позволяют предположить, что он страдал генетическим заболеванием - целиакией, которая проявляется в изменении слизистой оболочки кишечника, исключающем всасывание продуктов переваривания клейковины. Тутанхамон родился от брака Аменофиса III и Синтамоне, которая была дочерью Аменофиса III. Таким образом, мать фараона была его сводной сестрой. В могильном склепе Тутанхамона обнаружены мумии двух, по всей видимости, мертворожденных, детей от брака с Анкесенамон, его племянницей. Первая жена фараона была или его сестрой, или дочерью. Брат Тутан-хамона Аменофис IV предположительно страдал болезнью Фрелиха и умер в 25-26 лет. Его дети от браков с Нефертити и Анкесенамон (его дочерью) были бесплодны. С другой стороны, известная своим умом и красотой Клеопатра VII была рождена в браке сына Птоломея X и его родной сестры, которому предшествовали кровнородственные браки на протяжении по крайней мере шести поколений. Это можно объяснить тем, что при постоянных кровнородственных браках на протяжении многих поколений несостоятельные в генетическом отношении эмбри-
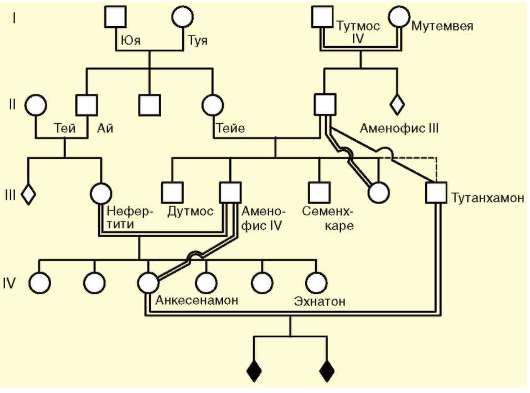
Рис. 12.6. Родословная фараона XVIII династии Тутанхамона
оны и плоды гибнут задолго до завершения развития, а часто - уже на стадии зиготы. Поэтому эмбрионы с нормальным сочетанием генов в генотипе имеют высокие шансы выжить и благополучно завершить внутриутробное развитие.
12.2.5. ЕСТЕСТВЕННЫЙ ОТБОР
В процессе видообразования естественный отбор переводит случайную индивидуальную изменчивость в биологически полезную групповую - популяционную, видовую. Стабилизирующая его форма сохраняет «удачные» комбинации аллелей от предшествующих этапов эволюции. Отбор поддерживает также состояние генетического полиморфизма. Смена биологических факторов исторического развития социальными привела к тому, что в человеческих популяциях отбор утратил функцию видообразования. За ним сохранились функции стабилизации генофонда и поддержания наследственного разнообразия.
В пользу действия стабилизирующей формы естественного отбора говорит, например, большая смертность среди недоношенных и перено-
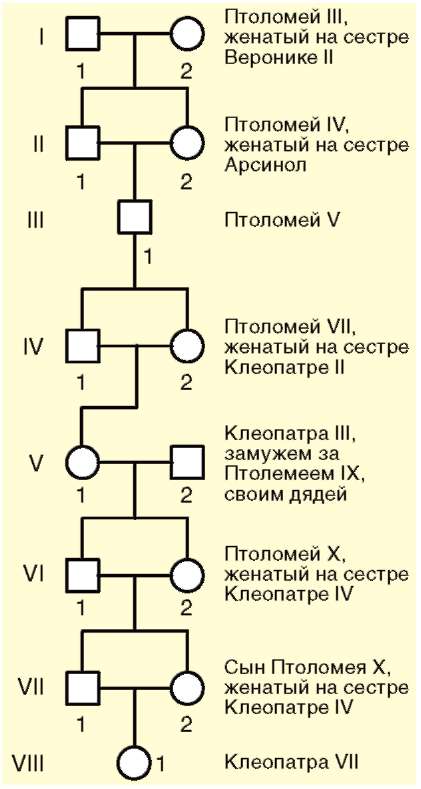
Рис. 12.7. Родословная Клеопатры VII
шенных новорожденных по сравнению с доношенными. Направление отбора среди таких детей зависит, по-видимому, от снижения общей жизнеспособности. Отрицательный отбор по одному локусу можно проиллюстрировать на примере системы групп крови «резус» (Rh).
Около 85% населения Европы имеет в эритроцитах антиген Rh и образует группу Rh-положительных индивидуумов. Остальные люди из европейской популяции лишены этого антигена и являются Rh-отрицательными. Синтез антигена Rh контролируется доминантным аллелем D и происходит у лиц с генотипами DD и Dd. Резус-отрицательные люди - рецессивные гомозиготы (dd). При беременности Rh-отрицательной женщины (dd) Rh-положительным плодом (мужчина DD или Dd, плод Dd) при нарушении целостности плаценты в родах Rh-положительные эритроциты плода проникают в организм матери и иммунизируют его (рис. 12-8).
При последующей беременности Rh-положительным плодом (Dd) анти-Rh-антитела проникают через плаценту в организм плода и разрушают его эритроциты. Развивается гемолитическая болезнь новорожденного, ведущий симптом которой - тяжелая анемия.
В настоящее время медицина располагает способами борьбы с этой формой патологии в виде быстрого переливания младенцу Rh-отрицательной крови или введения анти-Rh-антител для предотвращения иммунизации матери. В отсутствие медицинской помощи новорожденный с гемолитической болезнью нередко погибал. При Rh-отрицательном фенотипе матери Rh-положительный плод всегда гетерозиготен (Dd). Это означает, что со смертью такого индивидуума
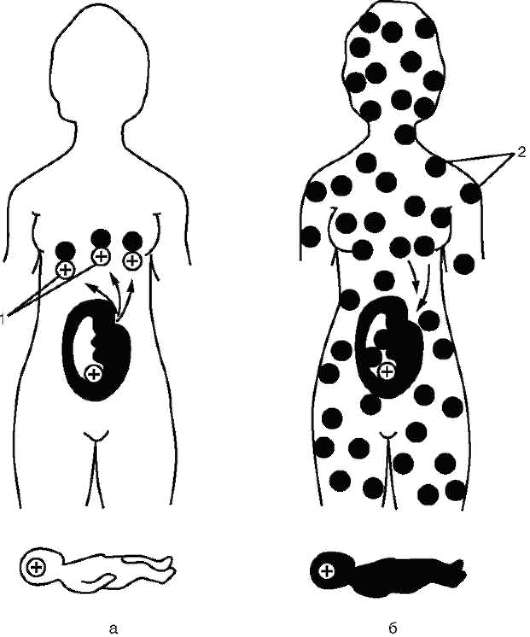
Рис. 12.8. Генетическая основа резус-конфликта: а - первая беременность; б - вторая беременность; 1 - резус-антигены; 2 - антитела к резус-антигену
из генофонда популяции, к которой он принадлежит, удаляется равное количество доминантных и рецессивных аллелей локуса «резус». Отбор в данном случае направлен против гетерозигот. При неравенстве исходных частот, удаляемых из генофонда аллелей, такой отбор приводит к постепенному снижению доли более редкого из них. В европейской популяции это рецессивный аллель d. Подсчитано, что снижение его доли с 15 до 1% путем отбора против гетерозигот потребует 600 поколений, или около 15 000 лет.
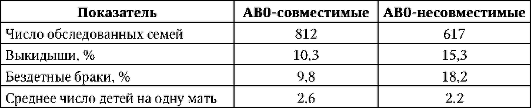
Под действием отбора находятся аллели, контролирующие синтез антигенов системы групп крови AB0. Об этом свидетельствует снижение против ожидаемого числа детей в АВ0-несовместимых браках женщин 0-группы с мужчинами А, В или АВ-групп (табл. 12.3).
Таблица 12.3. Влияние АВ0-несовместимости на плодовитость и эмбриогенез
Особенность отбора по локусам группоспецифичных антигенов эритроцитов, таких, как «резус» или АВ0, заключается в том, что он действует на уровне зиготы или ранних стадий эмбриогенеза. Замечено, что в браках, где мать и отец несовместимы по фактору «резус», число детей с гемолитической болезнью меньше ожидаемого. Так, среди белого населения США Rh-отрицательные люди составляют примерно 16%. В такой популяции частота аллеля d равна 40%, а вероятность развития гемолитической болезни при случайном подборе брачных пар - 9%. На самом деле частота этой болезни составляет 1:150-1:200. Один из факторов снижения - одновременная несовместимость родителей по локу-су АВ0. В этом случае Rh-положительные эритроциты плода, попавшие в организм матери, разрушаются, и иммунизации не происходит.
Отрицательный отбор действует в большинстве популяций людей по аллелям аномальных гемоглобинов. Его особая жесткость обусловлена тем, что он направлен против гомозигот. Ребенок, умирающий, например, от серповидноклеточной анемии, гомозиготен по аллелю S. Каждая такая смерть устраняет из генофонда популяции аллели одного вида. Это приводит к сравнительно быстрому снижению изменчивости по соответствующему локусу. Во многих популяциях людей частота аллелей аномальных гемоглобинов, в том числе и S, не превышает 1%.
Высокая частота аллелей таких аномальных гемоглобинов, как S, С, D, Е, в некоторых районах планеты иллюстрирует действие естественного отбора по поддержанию в человеческих популяциях состояния балансированного генетического полиморфизма. Отрицательный отбор в отношении аллеля S перекрывается мощным положительным отбором гетерозигот HbAHbS благодаря высокой жизнеспособности последних в очагах тропической малярии (рис. 12.9).
Исследования в Уганде показали, что количество возбудителей в 1 мл крови зависит от генотипа ребенка и составляет до 10 тыс. у HbSHbS, до 160 тыс. у HbAHbS и до 800 тыс. у HbAHbA. В Северной Греции обследовали 48 семей, в которых наблюдались и серповидноклеточность, и малярия. Среди братьев и сестер, больных серповидноклеточной анемией,
болело малярией 16 из 25 с генотипами НbАНbА и 1 из 23 с генотипами HbAHbS. Это объясняется тем, что аномальные эритроциты как у гомо-, так и у гетерозигот (см. рис. 12.9) разрушаются быстрее, чем нормальные, и это стимулирует ускоренный гемопоэз, при котором возбудите-
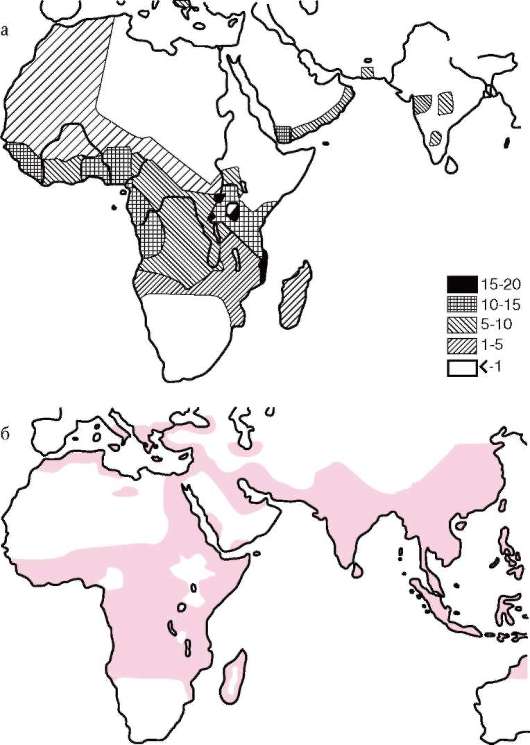
Рис. 12.9. Совпадение распространения в Старом Свете аллеля серповиднокле-точности (а) и тропической малярии (б)
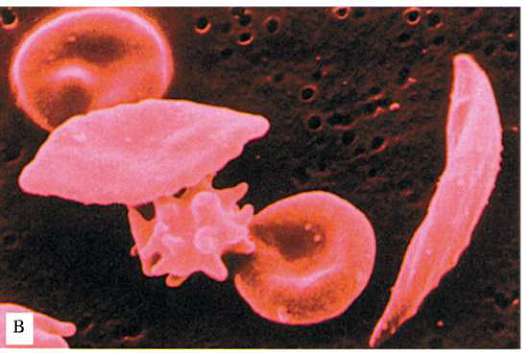
Рис. 12.9. Окончание: в - форма эритроцитов при сер-повидноклеточной анемии
ли малярии не успевают завершить свой цикл развития, так и тем, что S-гемоглобин неблагоприятен для паразита.
Таким образом, нормальные люди болеют в 13 раз чаще, чем индивидуумы с аномальным генотипом. Устранение фактора контротбора приводит к снижению частоты аллеля серповидноклеточности. Этой причиной, действующей на протяжении уже нескольких столетий наряду с метизацией, объясняют относительно низкую частоту гетерозигот HbAHbS среди афроамериканцев (8-9%) в сравнении с африканцами (около 20%).
В приведенных примерах действию отрицательного отбора, снижающего в генофондах некоторых популяций людей концентрацию определенных аллелей, противостоят контротборы, которые поддерживают частоту этих аллелей на достаточно высоком уровне. Результатом наложения многочисленных и разнонаправленных векторов отбора становится формирование и поддерживание генофондов популяций в состоянии, обеспечивающем возникновение в каждом поколении генотипов достаточной приспособленности с учетом местных условий. Благодаря социально-экономическим преобразованиям, успехам лечебной и особенно профилактической медицины влияние отбора на генетический состав популяций людей прогрессивно снижается.
12.3. ГЕНЕТИЧЕСКОЕ РАЗНООБРАЗИЕ В ПОПУЛЯЦИЯХ
ЛЮДЕЙ
Человечеству свойствен высокий уровень наследственного разнообразия, что проявляется в многообразии фенотипов. Люди отличаются друг от друга цветом кожных покровов, глаз, волос, формой носа и ушной
раковины, рисунком эпидермальных гребней на подушечках пальцев и другими сложными признаками. Выявлены многочисленные варианты отдельных белков, различающиеся по одному или нескольким аминокислотным остаткам и, следовательно, функционально. Белки являются простыми признаками и прямо отражают генетическую конституцию организма. У людей не совпадают группы крови по системам эритро-цитарных антигенов «резус», АВ0, MN. Известно более 130 вариантов гемоглобина и более 70 вариантов фермента Г6ФД, участвующего в бескислородном расщеплении глюкозы в эритроцитах. В целом не менее 30% генов, контролирующих у человека синтез ферментных и других белков, имеют несколько аллельных форм. Частота встречаемости разных аллелей одного гена варьирует.
Так, из многих вариантов гемоглобина лишь четыре обнаруживаются в некоторых популяциях в высокой концентрации: HbS (тропическая Африка, Средиземноморье), HbС (Западная Африка), HbD (Индия), НЬЕ (Юго-Восточная Азия). Концентрация других аллелей гемоглобина повсеместно не превышает, видимо, 0,01-0,0001 (см. п. 12.2.5).
Считают, что генетическое разнообразие по многим локусам могло быть унаследовано ныне живущими людьми от предковых групп. Вариабельность по таким системам групп крови, как АВ0 и Rh, обнаружена у человекообразных обезьян. Наследственное разнообразие долго было препятствием успешному переливанию крови. В настоящее время оно же создает большие трудности в решении проблемы пересадок тканей и органов. Подбор пар донор-реципиент осуществляется при сравнении антигенов HLA классов I и II. Антигены HLA представляют собой глико-протеиды, находящиеся на поверхности клеток и кодируемые группой тесно сцепленных генов хромосомы 6 (рис. 12.10). Традиционно гены, кодирующие HLA, и их продукты подразделяются на 3 класса - I, II и III. Первоначально в классах I и II выделяли по 3 гена. Исследования последних лет не только значительно расширили протяженность самого локуса HLA (в 2 раза с 1987 по 2007 г.), но и привели к увеличению числа генов внутри каждого класса. По современным представлениям, система HLA обеспечивает регуляцию иммунного ответа и, в целом, выживание человека как вида в условиях экзогенной и эндогенной агрессии. Многообразие чуждых агентов порождает значительную вариабельность генов MHC, и, следовательно, кодируемого ими спектра антигенов, при этом реализация антигенных свойств у гетерозигот осуществляется на основе кодоминирования. Очевидно, чем выше аллельное разнообразие, тем эффективнее защита. И, действительно, ни одна другая функциональ-
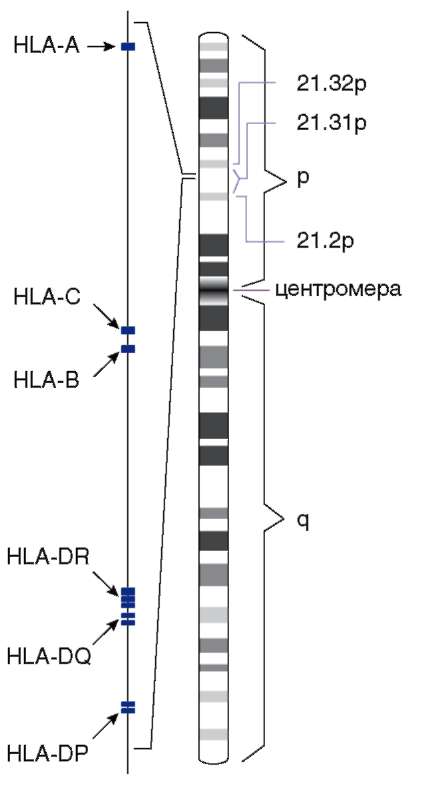
Рис. 12.10. Локализация генов HLA в хромосоме 6 человека
ная группа генов не имеет такого числа аллельных форм. Каждый из генов может иметь многие десятки вариантов (рис. 12.11). При этом установлены выраженные межрасовые и межэтнические различия встречаемости тех или иных антигенов HLA (рис. 12.12), что вероятнее всего является следствием выживания этих групп людей в условиях непрерывного воздействия факторов внешней среды и, прежде всего, инфекционного и паразитарного окружения.
Различия распространенности аллелей в современных популяциях людей, безусловно, определялись действием элементарных эволюционных факторов в ходе эволюции человека. Важная роль принадлежит мутационному процессу, естественному отбору, генетико-автоматическим процессам, миграциям.
В зависимости от влияния перечисленных факторов эволюции на частоту встречаемости того или иного аллеля в разных популяциях все многообразие вариантов белков, от-
ражающее разнообразие аллелей в генофонде человечества, можно разделить на две группы.
К одной из них относятся редкие варианты, встречающиеся повсеместно с частотой менее 1%. Появление их объясняется исключительно мутационным процессом, который создает новые аллели и действует ненаправленно, случайным образом, что и определяет столь невысокую частоту их встречаемости. В этом случае речь идет о генетической гетерогенности (см. п. 11.7). Так, в примере с гемоглобинами к первой группе относятся все варианты, кроме HbS, HbС, HbD и HbЕ.
Вторую группу белков составляют варианты, обнаруживаемые относительно часто в избранных популяциях. Длительные различия в концентрации отдельных аллелей между популяциями, сохранение в
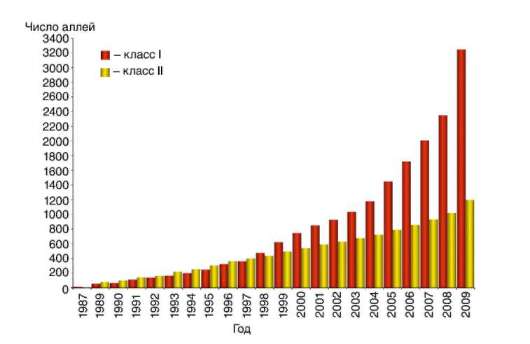
Рис. 12.11. Установленное разнообразие аллельных форм генов HLA классов I и II (данные с сайта hla.allels.org)
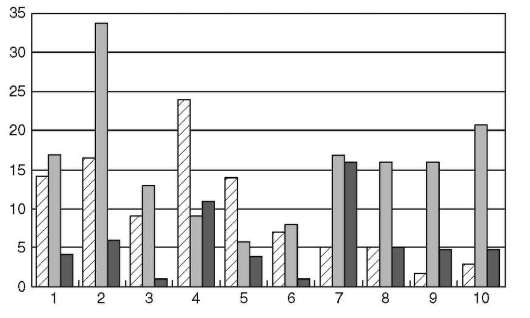
Рис. 12.12. Межэтнический полиморфизм в распределении трех антигенов HLA-DR-B1 в 10 популяциях: светлый столбик - DRB*01, серый - DRB*04, темный - DRB*09; 1 - русские поморы; 2 - саамы; 3 - русские москвичи; 4 - мари; 5 - удмурты; 6 - татары; 7 - ненцы; 8 - калмыки; 9 - тувинцы; 10 - буряты (из: М.А. Пальцев, Р.М. Хаитов, Л.П. Алексеев. Иммуногенетика человека и биобезопасность. - М., 2007)
достаточно высокой концентрации нескольких аллелей в одной популяции зависят от действия естественного отбора или дрейфа генов.
Действием последнего из названных факторов можно объяснить различия частоты группы крови А в популяциях индейцев из одного географического района, но изолированных в репродуктивном отношении: в племени черноногих этот показатель достигает 80%, а у индейцев из штата Юта - 2%. Другой пример влияния дрейфа генов - высокая частота редкого варианта мутации гена BRCA2, повышающего вероятность развития рака груди в популяции женщин Исландии. Известно, что все население этой страны произошло от небольшой группы норвежцев, высадившихся здесь в 900-х гг. н.э.
Естественный отбор, обеспечивая приспособленность групп людей к разнообразным условиям существования, также приводит к межпопу-ляционным различиям, повышая концентрации определенных аллелей, что определяет генетический полиморфизм популяций (см. п. 11.7). Ряд аллелей, имеющих приспособительное значение, представлен в табл. 12.4.
Учитывая слабую техническую оснащенность, плохие экономические и гигиенические условия жизни основной массы населения планеты на протяжении значительной части истории человечества, можно представить, какую большую роль играли возбудители особо опасных инфекций, паразитарных заболеваний, туберкулеза в изменении генофондов популяций. В этих условиях наследственный полиморфизм способствовал расселению людей, обеспечивая удовлетворительную жизнеспособность в разных экологических ситуациях. Именно различной выживаемостью лиц, отличающихся по группе крови, в условиях частых эпидемий особо опасных инфекций может быть, например, обусловлено неслучайное распределение по планете аллелей эритроци-тарных антигенов АВ0. Области сравнительно низких частот аллеля I0 и относительно высоких частот аллеля IB в Азии примерно совпадают с очагами чумы. Возбудитель этой инфекции имеет Н-подобный антиген. Люди с группой крови 0, имея такой же антиген, не могут вырабатывать противочумные антитела в достаточном количестве, поэтому они особенно восприимчивыми к чуме. Указанному объяснению соответствует факт, что относительно высокие концентрации аллеля I0 обнаруживаются в популяциях аборигенов Австралии и Полинезии, индейцев Америки, которые практически не поражались чумой. Аналогично, частота заболеваемости оспой, тяжесть симптомов этого заболевания и смертность от него выше у лиц с группой крови А или АВ в сравнении с лица-
ми, имеющими группу крови 0 или В (рис. 12.13). Объяснение состоит в том, что у людей первых двух групп отсутствуют антитела, частично нейтрализующие оспенный антиген А. По образному выражению генетиков - в генофондах человеческих популяций отпечатались свирепствовавшие эпидемии.
Помимо возбудителей болезней на эволюцию человеческих популяций оказывали влияние и другие факторы, в частности, появление в рационе новых продуктов питания. Известно, что ген, кодирующий синтез фермента лактазы, расщепляющего молочный сахар, активен у всех людей в младенчестве в период вскармливания молоком. Однако в процессе взросления активность этого гена резко падает или выключается совсем. Несколько тысяч лет назад люди научились получать молоко от домашних животных и стали использовать его в пищу постоянно. Это стало тем фактором, который способствовал закреплению в генофонде популяций, разводивших животных и использовавших в пищу свежее
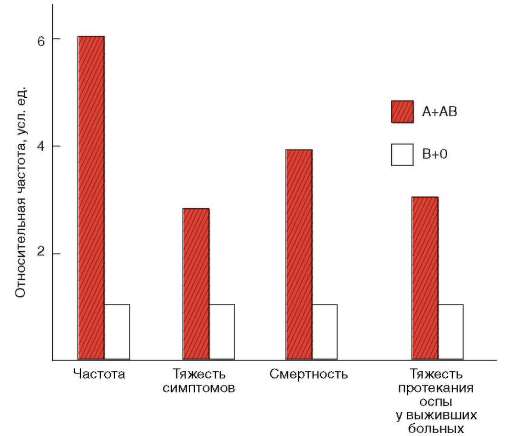
Рис. 12.13. Относительная частота и показатели тяжести заболеваний оспой у лиц с разными группами крови АВ0
молоко, мутации в одном из регуляторных генов. В результате влияния измененного продукта гена-регулятора ген лактазы стал сохранять свою активность на протяжении всей жизни человека. Сейчас примерно 70% европейцев легко усваивают молоко в зрелом возрасте, тогда как в отдельных районах Африки, Центральной и Восточной Азии только 30% взрослого населения имеют активный фермент.
Приведенные выше примеры полиморфизма по конкретным локусам объясняются действием известных факторов отбора и указывают на их экологическую природу. Для подавляющего большинства локусов факторы отбора, действие которых создавало современную картину распределения аллелей в популяции людей, точно не установлены.
В естественных условиях в силу воздействия на фенотипы организмов комплекса факторов отбор осуществляется по многим направлениям. Конечный результат определялся соотношением интенсивности разных направлений отбора. В результате формировались генофонды, сбалансированные по набору и частотам аллелей, обеспечивающие в данных условиях достаточную выживаемость популяций. При этом зачастую действие отбора в направлении, повышающем устойчивость популяции в отношении одного фактора, приводило к закреплению в ее генофонде аллелей, снижающих жизнеспособность в отношении другого фактора. Так, например, мутация в гене рецептора витамина D, которую связывают с предрасположенностью к оспеопорозу (заболевание, характеризующееся хрупкостью костей), повышает устойчивость ее носителя к туберкулезу. Другой пример - мутация гена CFTR, ведущая к муковисцидозу, но защищающая организм от сальмонеллезов, в частности, брюшного тифа. Данный ген кодирует белок на поверхности клеток, который бактерии рода Salmonella используют для проникновения в них. У гетерозигот по этой мутации муковисцидоз не проявляется, а мутантный аллель предохраняет их от кишечных инфекций, делая затруднительным проникновение бактерий в клетки. Таким образом, один и тот же аллель гена может оказаться как вредным, так и полезным, в зависимости от его дозы в генотипе, подверженности его носителя тому или иному влиянию среды и др.
Выявлены также и аллели, обеспечивающие приспособление популяции к определенному фактору в ходе предшествующей эволюции, но оказавшиеся полезными и в новых условиях существования. Так, делеция в гене, кодирующем белок CCR5, увеличивающая сопротивляемость бубонной чуме, возникла примерно 2,5 тыс. лет назад. Мутация распространилась по Европе после эпидемий 1347 г.,
а в Скандинавии еще и в 1711 г. Наличие такой мутации в генотипе ныне живущего человека приводит к невосприимчивости ее носителя к ВИЧ. Частота этой делеции у финнов и русских - 16%, у скандинавов - 1415%, а в Сардинии - 4%. В среднем к ВИЧ сейчас устойчиво примерно 10% европейцев.
Определенный вклад в формирование генетического разнообразия в популяциях человека внесли помимо перечисленных факторов массовые миграции населения и сопутствующая им метизация. Так, выявлено пять центров, из которых осуществлялся поток различных аллелей генов в генофонды европейских популяций. Первый из них в Средней Азии, откуда происходила миграция земледельцев в Европу во времена неолита, что обусловило 28% генетического разнообразия у современных жителей этого континента. Влиянием расселения из второго региона народов уральской языковой группы объясняется 22% варьирования генов у европейцев. 11% гетерогенности аллелей - вклад из третьего центра - междуречья Волги и Дона, откуда кочевники пришли в Европу за 3000 лет до н.э. Следующий по величине вклад миграций, вероятно, отображает распространение античных греческих мегаполисов во II и I тысячелетиях до н.э. и особенно четко прослеживается в популяциях Греции, Южной Италии и Западной Турции. Пятый центр распространения необычных мутаций в районе древней страны басков в Северной Испании и в Южной Франции внес наименьший вклад в аллельное разнообразие современных европейцев.
Аналогичные процессы происходили и в других регионах мира. Известно, что в период до великих географических открытий и начала колониальной экспансии смешение больших групп людей разной расовой принадлежности имело место в Восточной Африке, Индии, Средней Азии, Западной Сибири, Алтае-Саянском нагорье, Индокитае. Впоследствии это наблюдалось в Южной и Центральной Америке.
Различия по разнообразию и частоте встречаемости аллелей генов в генофондах популяций человека - основа межпопуляционных и вну-трипопуляционных фенотипических различий людей - изменчивости. Изменчивость проявляется в неравномерном распределении по планете некоторых заболеваний, тяжести их протекания в разных человеческих популяциях, разной степени предрасположенности людей к определенным болезням, индивидуальных особенностях развития патологических процессов, различиях в реакции на лечебное воздействие. Знание перечисленных особенностей для человечества в целом и для оценки за-
болеваемости в конкретной популяции необходимо для современного профессионально подготовленного врача.
Так, люди с группой крови 0 более восприимчивы к чуме, чем индивидуумы с группой В . Туберкулез легких у них лечится с большим трудом, чем у лиц с группой крови А. Вместе с тем лечение больных сифилисом людей с группой крови 0 быстрее вызывает переход болезни в неактивную стадию. Для лиц с этой группой крови вероятность заболеть раком желудка, раком шейки матки, ревматизмом, ишемической болезнью сердца, холециститом, желчно-каменной болезнью примерно на 20% ниже, чем для людей, имеющих кровь группы А. Как указывалось выше, индивидуумы с группой крови 0 в среднем имеют возможность прожить дольше в условиях эпидемии оспы, однако для них выше вероятность заболеть язвенной болезнью. Люди с этой группой крови более чувствительны к возбудителю холеры, при этом они несколько устойчивее к возбудителю малярии.
Различия по аллелям гена АРОЕ, локализованного у человека на хромосоме 19 и участвующего в обмене холестеринов, значительно влияют на риск сердечно-сосудистых заболеваний, одной из основных причин смертности. Среди большого разнообразия аллелей этого гена наиболее часто встречаются три основных варианта: Е2, Е3, Е4. Аллель Е3 характеризуется наибольшей функциональной активностью. Он встречается у 80% европейцев, причем 39% из них - гомозиготы. При наличии в генотипах аллелей Е4 и Е2 наблюдаются нарушения липид-ного обмена. Для аллеля Е4 показана ассоциация с увеличением уровня общего холестерина и липопротеидов низкой плотности, а для аллеля Е2 - с увеличением уровня триглицеридов в сыворотке крови. Наличие в гомозиготном состоянии аллеля Е4 у 7% жителей Европы и аллеля Е2 у 4% значительно повышает для них риск развития сердечно-сосудистых заболеваний. При этом прослеживается четкая географическая закономерность в распределении трех указанных вариантов гена. Например, при продвижении на север Европы частота аллеля Е4 возрастает, Е3 падает, а Е2 остается постоянной. В Швеции и Финляндии вариант Е4 встречается в 3 раза чаще, чем в Италии. Примерно в такой же пропорции увеличивается частота обсуждаемых заболеваний. В целом частота встречаемости аллеля Е4 значительно выше в тропических и субтропических регионах, чем в районах с холодным климатом. У африканцев и полинезийцев более 40% людей содержат хотя бы одну копию этого аллеля, а в Новой Гвинее - более 50%. Считают, что это распределение отражает долю жирной пищи в питании людей за несколько последних
тысячелетий. Здоровье популяций, преимущественно использующих пищу растительного происхождения, не столь значительно зависело от работы этого гена, что и отразилось в сохранении в генофондах варианта Е4.
Этот же ген - АРОЕ - причастен к развитию болезни Альцгеймера, которая проявляется прогрессирующей потерей памяти и деградацией личности. И в этом случае при наличии аллеля Е4 вероятность развития болезни значительно возрастает. 7% гомозиготных по этому варианту гена европейцев с вероятностью 91% могут заболеть в возрасте 68 лет. В случае отсутствия этого аллеля в генотипе риск заболевания в возрасте 84 года не превышает 20%. Установлено, что одно из разрабатываемых в настоящее время лекарств от болезни Альцгеймера, которое уже готовится к выпуску, эффективно для больных с аллелями Е2 или Е3 и практически не действует при наличии Е4.
12.4. ГЕНЕТИЧЕСКИЙ ГРУЗ В ПОПУЛЯЦИЯХ ЛЮДЕЙ
Так же, как и в популяциях других организмов, наследственное разнообразие снижает реальную приспособленность популяций людей. Бремя генетического груза человечества можно оценить, введя понятие летальных эквивалентов . Считают, что число их в пересчете на гамету колеблется от 1,5 до 2,5 или от 3 до 5 на зиготу. Это означает, что то количество неблагоприятных аллелей, которое имеется в генотипе каждого человека, по своему суммарному вредному действию эквивалентно действию 3-5 рецессивных аллелей, приводящих в гомозиготном состоянии к смерти индивидуума до наступления репродуктивного возраста. К таким неблагоприятным рецессивным аллелям могут быть отнесены варианты генов, приводящие к развитию гемофилии, серпо-видноклеточной анемии, микрофтальмии и многих других наследственных болезней.
При наличии неблагоприятных аллелей и их сочетаний примерно половина зигот, образующихся в каждом поколении людей, в биологическом плане несостоятельна. Такие зиготы не участвуют в передаче генов следующему поколению. Около 15% зачатых организмов гибнет до рождения, 3 - при рождении, 2 - непосредственно после рождения, 3 - умирает, не достигнув половой зрелости, 20 - не вступают в брак, 10% браков бездетны.
Неблагоприятные последствия генетического груза в виде рецессивных аллелей, если они не приводят к гибели организма, проявляются
в снижении ряда важных показателей состояния индивидуума, в частности его умственных способностей. Исследования, проведенные на популяции арабов в Израиле, для которой характерна высокая частота близкородственных браков (34% между двоюродными и 4% между дважды двоюродными сибсами), показали снижение умственных способностей у детей от таких браков.
Исторические перспективы человека в силу его социальной сущности не связаны с генетической информацией, накопленной видом Homo sapiens в ходе эволюции. Тем не менее человечество продолжает «оплачивать» эти перспективы, теряя в каждом поколении часть своих членов из-за их генетической несостоятельности. К факторам, приводящим к увеличению в генофондах популяций человека числа вредных рецессивных аллелей, в настоящее время относятся развитие медицины и научно-технический прогресс. Роль последнего обсуждалась в разделе 12.2.1. Парадокс в отношении медицины состоит в следующем. Усовершенствование существующих и появление новых методов диагностики и лечения наследственных заболеваний приводят к тому, что люди, имеющие в своем генотипе вредные рецессивные аллели, даже в гомозиготном состоянии имеют нормальную жизнеспособность и способность к репродукции. Указанные аллели воспроизводятся в генотипах их детей и сохраняются в генофондах популяций. Ярким примером может служить фенилкетонурия. Для выявления данного заболевания осуществляется биохимический скрининг новорожденных, выявляющий аномальные продукты белкового обмена в моче. Далее для обнаруженных случаев болезни проводится диетическая коррекция и лекарственная терапия заболевания, которая в большинстве случаев успешна.
Вопросы для самоконтроля
1. Приведите примеры действия мутаций, популяционных волн, изоляции, генетико-автоматических процессов и естественного отбора в человеческих популяциях.
2. Каков механизм формирования генетического полиморфизма в человеческих популяциях?
3. Что называется генетическим грузом и каково его медицинское и эволюционное значение?