Биология: учебник: в 2 т. / под ред. В. Н. Ярыгина. - 2011. - Т. 2. - 560 с. : ил.
|
|
|
|
Глава 19. МЕДИЦИНСКАЯ ПРОТОЗООЛОГИЯ
19.1. ТИП ПРОСТЕЙШИЕ PROTOZOA
К типу Простейшие относят организмы, тело которых состоит из одной клетки, функционирующей, однако, как целый организм. Клетки простейших способны к самостоятельному питанию, передвижению, защите от врагов и к переживанию неблагоприятных условий. В строении простейших обнаруживаются как все особенности эукариотических клеток, так и специфические органеллы, обеспечивающие выполнение организменных функций.
Питание простейших происходит с помощью пищеварительных вакуолей, содержащих пищеварительные ферменты и связанных по происхождению с лизосомами. Оно осуществляется за счет фаго- или пиноцитоза. Остатки непереваренной пищи выбрасываются наружу. Некоторые простейшие содержат хлоропласты и способны питаться за счет фотосинтеза.
Большинство простейших имеют органеллы передвижения: жгутики, реснички и псевдоподии (временные подвижные выросты цитоплазмы). Формы органелл движения лежат в основе систематики простейших.
Пресноводные свободноживущие простейшие имеют органеллы, регулирующие водно-солевой баланс, - сократительные вакуоли. Периодически они сокращаются и выделяют во внешнюю среду избытки воды и жидкие продукты диссимиляции. Морские и паразитические простейшие, живущие в среде с высокой концентрацией солей, могут не иметь сократительных вакуолей.
Размножение простейших осуществляется обычно разными формами деления - разновидностями митоза. Характерен также половой процесс: в виде слияния клеток - копуляция, или обмен наследственным материалом - конъюгация.
Большинство простейших имеют одно ядро, но встречаются и многоядерные формы. Ядра некоторых простейших характеризуются по-липлоидностью.
В жизненном цикле большинства простейших выделяют стадию тро-фозоита - активно питающуюся и перемещающуюся форму, и стадию цисты. Циста - неподвижная форма жизненного цикла простейших, покрытая плотной оболочкой и характеризующаяся резко замедленным обменом веществ. Паразитические простейшие инцистируются, попадая во внешнюю среду. В таком состоянии они способны переноситься ветром, водой и животными на огромные расстояния и таким образом расселяться. При попадании цисты в благоприятные условия происходит эксцистирование и простейшее начинает активно функционировать в состоянии трофозоита.
В настоящее время известно около 10 тыс. видов простейших. Основные среды их обитания - вода и почва. Многие простейшие перешли к паразитическому или к комменсальному образу жизни.
Болезни, вызываемые простейшими, называют протозойными. Большинство простейших имеют время генерации от 6 до 24 ч. В связи с этим их размножение в организме хозяина обычно сопровождается экспоненциальным увеличением размеров их популяций до тех пор, пока этот процесс не замедлится или не остановится защитными механизмами хозяина или другими внешними факторами. Это означает, что один паразитический организм в принципе способен, размножившись, привести к гибели своего хозяина. В этом плане простейшие - возбудители заболеваний - сходны с возбудителями инфекционных болезней, например с патогенными бактериями и вирусами.
Медицинское значение имеют простейшие, относящиеся к классам Саркодовые, Жгутиковые, Инфузории и Споровики.
19.1.1. КЛАСС САРКОДОВЫЕ SARCODINA
Представители этого класса - самые примитивные простейшие. Форма их тела непостоянна. Передвигаются они с помощью ложноножек. Обитают в пресных водах, в почве, морях. В биогеоценозах выполняют функции консументов и редуцентов. Некоторые саркодовые адаптировались к комменсальному и паразитическому образу жизни. Медицинское значение имеют представители отряда амеб Amoebina. Паразитические амебы обитают у человека в основном в пищеварительной системе. Некоторые саркодовые, ведущие свободный образ жизни и обитающие в почве и загрязненной воде, при попадании в организм человека могут вызывать тяжелые заболевания, нередко заканчивающиеся смертью.
19.1.2. КЛАСС ЖГУТИКОВЫЕ FLAGELLATA
Тело жгутиковых, кроме цитоплазматической мембраны, покрыто еще и пелликулой - специальной оболочкой, обеспечивающей постоянство его формы. Имеется один или несколько жгутиков, органелл движения, представляющих собой нитевидные выросты эктоплазмы. Внутри жгутиков проходят фибриллы из сократительных белков. Некоторые жгутиковые имеют также ундулирующую мембрану - своеобразную органеллу передвижения, в основе которой лежит тот же жгутик, не выступающий свободно за пределы клетки, а проходящий по наружному краю длинного уплощенного выроста цитоплазмы. Жгутик приводит ундулирующую мембрану в волнообразное движение. Основание жгутика всегда связано с кинетосомой, видоизмененной митохондрией, обеспечивающей его энергией. Ряд жгутиковых имеет также и опорную органеллу - аксостиль - в виде плотного тяжа, проходящего внутри клетки.
Ряд видов паразитических жгутиковых обитает в различных органах человека. Циклы их развития очень разнообразны.
19.1.3. КЛАСС ИНФУЗОРИИ INFUSORIA
Для инфузорий, как и для жгутиковых, характерно наличие пелликулы, им свойственна постоянная форма тела. Органеллы передвижения - многочисленные реснички, покрывающие все тело и представляющие собой полимеризованные жгутики. У инфузорий обычно два ядра: крупное - макронуклеус, регулирующее обмен веществ, и малое - микронуклеус, служащее для обмена наследственной информацией при конъюгации. Макронуклеусы инфузорий полиплоидны, микронуклеусы - гаплоидны или диплоидны. Сложно организован аппарат пищеварения. Имеется постоянное образование: клеточный рот - цитостом, клеточная глотка - цитофаринкс. Пищеварительные вакуоли перемещаются по эндоплазме, при этом литические ферменты выделяются поэтапно. Это обеспечивает полноценное переваривание пищевых частиц. Непереваренные остатки пищи выбрасываются через порошицу - специализированный участок клеточной поверхности.
Инфузории - наиболее высоко организованные простейшие. Паразитов среди них относительно немного. У человека паразитирует единственная инфузория - балантидий, которая обитает в пищеварительной системе.
19.1.4. КЛАСС СПОРОВИКИ SPOROZOA
Все споровики - паразиты и комменсалы животных и человека. Органеллы движения у них отсутствуют. Питание споровиков осуществляется за счет поглощения пищи всей поверхностью тела. Многие споровики - внутриклеточные паразиты. Они претерпели наиболее глубокую дегенерацию. Цикл развития включает стадии бесполого размножения, полового процесса в виде копуляции и спорогонии. Бесполое размножение осуществляется путем простого или множественного деления - шизогонии. Половому процессу предшествует образование половых клеток - мужских и женских гамет. Гаметы сливаются, а образовавшаяся зигота покрывается оболочкой, под которой происходит спорогония - множественное деление с образованием спорозоитов (рис. 19.1).
Ниже описаны паразитические и комменсальные простейшие, обитающие в разных органах человека. От специфики органа, являющегося средой обитания паразита, зависят пути проникновения и патогенное действие паразита, методы диагностики соответствующих заболеваний
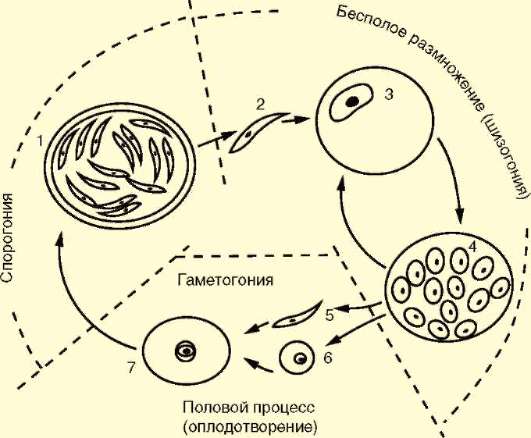
Рис. 19.1. Цикл развития споровиков: 1 - спорозоиты под оболочкой цисты; 2 - спорозоит; 3 - паразит в клетке хозяина; 4 - дочерние паразиты в клетке хозяина; 5 и 6 - мужская и женская гаметы; 7 - зигота
и меры их профилактики. Поэтому простейшие с медицинской точки зрения могут быть разделены на виды, обитающие в полостных органах, которые имеют связь с внешней средой, и живущие в тканях внутренней среды человека. Кроме того, выделяют группу свободноживущих простейших, случайное попадание которых в организм человека может приводить к острейшим патологическим процессам и даже к смерти. Соответствующие три экологические группы простейших описаны отдельно.
19.2. ПРОСТЕЙШИЕ, ОБИТАЮЩИЕ В ПОЛЫХ ОРГАНАХ, СООБЩАЮЩИХСЯ С ВНЕШНЕЙ СРЕДОЙ
Простейшие, относящиеся к этой экологической группе, став паразитами, не претерпели глубокой дегенерации в связи с тем, что условия их обитания относительно мало отличаются от условий внешней среды. Большинство этих паразитов анаэробны. Циклы их развития просты: у многих имеются стадии трофозоита и цисты. Некоторые не образуют и цист. Заражение большинством этих паразитов осуществляется путем проглатывания цист или трофозоитов. В их распространении большое значение имеют насекомые - механические переносчики возбудителей. Диагностика соответствующих заболеваний основана на обнаружении цист или трофозоитов в выделениях из пораженных органов. В профилактике заражения основное значение имеет соблюдение правил личной гигиены.
Многие виды, живя в просвете пищеварительной трубки и других органов и находя там благоприятную среду, являются комменсалами. Однако возможно усиление степени их контакта с хозяином и переход к паразитированию.
19.2.1. ПРОСТЕЙШИЕ, ОБИТАЮЩИЕ В ПОЛОСТИ РТА
Ротовая амеба Entamoeba gingivalis (кл. Саркодовые) - комменсал, обитающий на деснах, зубном налете и в криптах нёбных миндалин более чем у 25% здоровых людей (рис. 19.2, а). У лиц с заболеванием полости рта встречается чаще. Размеры клетки 6-30 мкм, псевдоподии широкие. Питается бактериями и лейкоцитами, при кровотечении из десен может захватывать и эритроциты. Цист не образует.
Trichomonas tenax (кл. Жгутиковые) - такой же комменсал, как и предыдущий вид. Форма тела грушевидная, длина 6-13 мкм (рис. 19.2, б). На
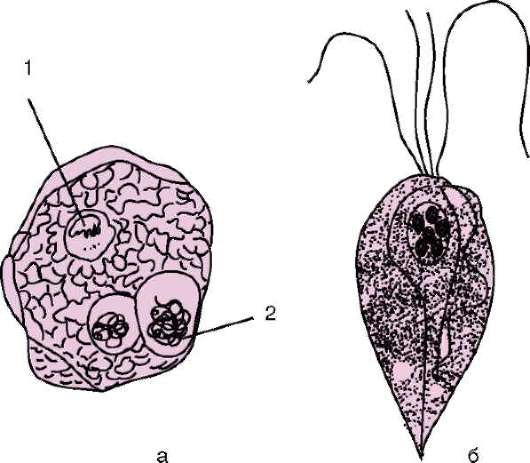
Рис. 19.2. Комменсальные простейшие, обитающие в полости рта: а - ротовая амеба: 1 - ядро; 2 - пищеварительная вакуоль; б - Trichomonas tenax
переднем конце расположены четыре жгутика, сбоку находится ундули-рующая мембрана длиной около 3/4 длины тела. Встречается у 30% здоровых людей, причем у взрослых чаще, чем у детей. Обитает в складках слизистой оболочки рта, кариозных полостях зубов, криптах миндалин при хроническом тонзиллите, а при низкой кислотности желудочного сока встречается и в желудке. Цист не образует, как и предыдущий вид. Передача от человека к человеку обоих видов осуществляется при поцелуях, пользовании общей посудой и зубными щетками, а также с капельками слюны и мокроты при чихании и кашле.
Оба вида самостоятельного медицинского значения не имеют, однако считается, что при патологических процессах в полости рта могут утяжелять их течение.
19.2.2. ПРОСТЕЙШИЕ, ОБИТАЮЩИЕ В ТОНКОЙ КИШКЕ
В тонкой кишке человека паразитирует единственный вид простейших - лямблия Lamblia intestinalis (кл. Жгутиковые) - возбудитель лямблиоза, которым чаще болеют дети. Форма паразита напоминает грушу, разрезанную вдоль. Длина тела 10-18 мкм. В расширенной части на уплощенной стороне расположен присасывательный диск, с помощью
которого лямблии присасываются к ворсинкам кишечника. Вдоль тела проходят две тонкие опорные органеллы - аксостили. Симметрично в клетке располагаются два ядра и четыре пары жгутиков (рис. 19.3, а).
Трофозоиты используют питательные вещества с поверхности клеток кишечного эпителия. Захват пищи осуществляется пиноцитозом.
Большие количества лямблий, которые покрывают обширные поверхности кишечной стенки, нарушают процессы всасывания и при-
Рис. 19.3. Простейшие, обитающие в тонкой и толстой кишке: а - лямблия; б - цисты лямблии; в - дизентерийная амеба; г - кишечная трихомонада; д - балантидий кишечный: 1 - трофозоиты, 2- цисты
стеночного пищеварения. Попадая в нижние отделы тонкой кишки, лямблии инцистируются. Зрелые цисты имеют овальную форму, четыре ядра и несколько аксостилей. Во внешней среде цисты сохраняют жизнеспособность в течение нескольких недель. Заражение человека происходит при проглатывании цист.
Лабораторная диагностика - обнаружение цист в фекалиях и тро-фозоитов в содержимом двенадцатиперстной кишки, полученном при дуоденальном зондировании.
Личная профилактика - соблюдение правил гигиены питания. Общественная профилактика - санитарное благоустройство туалетов, предприятий общественного питания.
19.2.3. ПРОСТЕЙШИЕ, ОБИТАЮЩИЕ В ТОЛСТОЙ КИШКЕ
Толстая кишка очень благоприятна для обитания простейших. Паразиты располагаются вблизи слизистой оболочки, в слизи, покрывающей эпителий крипт. Большинство этих простейших - комменсалы, питающиеся бактериями и слущенными клетками кишечника. Два вида простейших - дизентерийная амеба и балантидий - патогенны, но в организме здорового человека они могут долгое время вести коммен-сальный образ жизни.
Дизентерийная амеба Entamoeba histolytica (кл. Саркодовые) - возбудитель амебиаза (рис. 19.3, б). Амебиаз встречается повсеместно, но чаще в зонах с влажным жарким климатом. В цикле развития амебы имеется несколько стадий, морфологически и физиологически отличающихся друг от друга. Мелкая вегетативная форма обитает в просвете кишки. Размеры ее 8-20 мкм. В цитоплазме можно обнаружить бактерии и грибки - элементы микрофлоры кишечника.
Крупная вегетативная форма также обитает в просвете кишки в гнойном содержимом язв кишечной стенки. Ее размеры - до 45 мкм. Цитоплазма четко разделена на прозрачную, стекловидную эктоплазму и зернистую эндоплазму. В ней расположены ядро с характерной темно окрашенной кариосомой и эритроциты, которыми она питается. Крупная форма энергично передвигается с помощью широких псевдоподий. В глубине пораженных тканей располагается тканевая форма. Она мельче крупной вегетативной формы и не имеет в цитоплазме эритроцитов. Цисты обнаруживаются в фекалиях хронически больных и пара-зитоносителей, у которых заболевание проходит бессимптомно. Цисты имеют округлую форму, диаметр 8-15 мкм и от одного до четырех ядер.
Возможность длительного паразитирования дизентерийной амебы в организме человека обеспечивается как возможностью аутоинвазии, так и специфической адаптацией этого вида к паразитизму: амеба экс-прессирует белок, близкий по строению к рецепторному протеину CD59, который в качестве маскирующего агента защищает ее от лизиса мембранным лизирующим комплексом хозяина.
Жизненный цикл паразита сложен (рис. 19.4). Человек заражается амебиазом, проглатывая цисты паразита с водой или пищевыми продуктами, загрязненными землей. В просвете толстой кишки из цисты образуется, за счет следующих друг за другом делений, восемь мелких клеток, превращающихся в мелкие вегетативные формы. Вреда человеку они не приносят. Они могут вновь инцистироваться и выходить наружу. При ухудшении условий существования хозяина мелкие вегетативные формы способны превращаться в крупные, которые вызывают образование язв в стенке кишки и кровотечения. Питаются крупные формы эритроцитами. Погружаясь глубже, они превращаются в тканевые формы, которые в особо тяжелых случаях могут попадать в кровь и разноситься по всему организму. При этом возможно образование абсцессов в печени, легких и других органах. В остром периоде заболевания у больного в фекалиях обнаруживаются не только цисты, но и трофозоиты.
Диагноз ставится на основе обнаружения в фекалиях трофозоитов с заглоченными эритроцитами. Четырехъядерные цисты могут свиде-
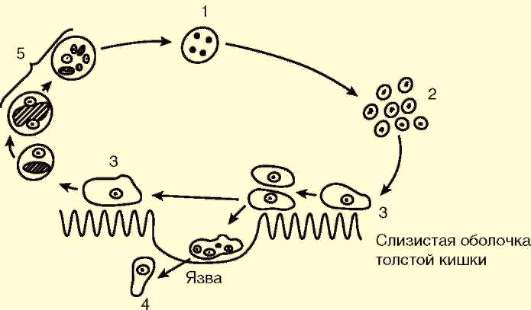
Рис. 19.4. Цикл развития дизентерийной амебы: 1 - циста; 2 - мелкая вегетативная форма; 3 - крупная вегетативная форма; 4 - тканевая форма; 5- инци-стирование
тельствовать скорее о хроническом течении заболевания или о парази-тоносительстве.
Профилактика - как при лямблиозе. В настоящее время методом генетической инженерии получены штаммы дизентерийной амебы, не патогенные для человека. На основе этих штаммов получена живая вакцина, введение которой в организм человека стимулирует выработку активного иммунитета против патогенных форм возбудителя.
Балантидий кишечный , Balantidium coli (кл. Инфузории) - возбудитель балантидиаза. Это крупное простейшее, длиной до 200 мкм. Сохранены многие признаки свободноживущих инфузорий: все тело покрыто ресничками, имеются цитостом и цитофаринкс. Под пелликулой расположен слой прозрачной эктоплазмы, глубже находится эндоплазма с органеллами и двумя ядрами. Макронуклеус имеет гантелевидную или бобовидную форму, рядом с ним находится маленький микронуклеус, который обычно не виден, а в цитоплазме отчетливо выделяется сократительная вакуоль (см. рис. 19.3, д). Циста балантидия овальна, диаметром до 50-60 мкм, покрыта двухслойной оболочкой, ресничек не имеет.
Балантидий может жить в кишечнике человека, питаясь бактериями и не принося ему вреда, но иногда внедряется в стенку кишки, вызывая образование язв с гнойным и кровянистым отделением. В этом случае в его цитоплазме часто обнаруживаются форменные элементы крови хозяина. Для заболевания характерны длительные поносы с кровью и гноем, а иногда и перфорация кишечной стенки с последующим развитием перитонита. Как и при амебной дизентерии, В. coli может попадать в кровеносное русло и оседать в печени, легких и других органах, вызывая там образование абсцессов.
Особенность этих инфузорий в их способности вырабатывать фермент гиалуронидазу, благодаря которой они внедряются и в неповрежденную стенку кишки, где на гистологических препаратах обнаруживаются целые скопления тканевых трофозоитов, морфологически неотличимых от живущих в просвете кишки, но не способных к образованию цист. Кроме человека, балантидий встречается также у крыс и свиней, которые и являются его основным резервуаром.
Лабораторная диагностика - обнаружение цист и трофозоитов в мазках фекалий больного.
Профилактика - как при лямблиозе, однако в связи с зоонозной природой балантидиаза следует также вести борьбу с грызунами и обеспечивать гигиеническое содержание свиней.
Кроме описанных паразитов в пищеварительной трубке человека, особенно в ее нижних отделах, обитает ряд условно патогенных видов простейших. Среди них особенно интересна Dientamoeba fragilis , имеющая необычные адаптации к обитанию в кишечнике человека: она сосуществует в своеобразном симбиозе с острицами (см. п. 20.2.1.1). Цист эта амеба не образует, а трофозоиты прикрепляются к яйцам остриц, через которые и происходит заражение новых хозяев одновременно двумя паразитами. Вероятно, заражение этой амебой возможно и без яиц острицы, при прямом контакте. Размножаясь в большом количестве в кишке человека, эта амеба может вызвать недолгие поносы. Такое же медицинское значение имеет и известный жгутиконосец - кишечная трихомонада Trichomonashominis (см. рис. 19.3, г).
В плане дифференциальной диагностики следует упомянуть также кишечную амебу Entamoeba coli - нормального симбионта толстой кишки человека. Она очень похожа на дизентерийную амебу, но является типичным комменсалом. Трофозоиты имеют размеры 20-40 мкм и передвигаются медленно. Питаются бактериями, грибами, а если у хозяина имеется кишечное кровотечение, то и форменными элементами крови.
В окружающую среду выделяется в виде цист, содержащих восемь ядер и имеющих более крупные размеры, чем у Е. histolytica (около 18 мкм).
19.2.4. ПРОСТЕЙШИЕ, ОБИТАЮЩИЕ В ПОЛОВЫХ ОРГАНАХ
В половых органах человека обитает влагалищная трихомонада
Trichomonas vaginalis (кл. Жгутиковые) - возбудитель трихомоноза. Длина этого паразита 14-30 мкм. Форма тела грушевидная. На переднем конце находятся четыре жгутика. До середины клетки доходит также небольшая ундулирующая мембрана. По середине тела тянется аксостиль, выступающий из клетки на ее заднем конце. Характерна форма ядра, овального, заостренного с двух концов и напоминающего косточку сливы (рис. 19.5).
В пищеварительных вакуолях располагаются лейкоциты, эритроциты и бактерии, которыми этот паразит питается. Цист не образует. Эта трихомонада обитает у женщин во влагалище и в шейке матки, а у мужчин - в мочеиспускательном канале, мочевом пузыре и в предстательной железе. Зараженность женщин достигает 20-40%, мужчин - 15%. Серьезных повреждений хозяину эта трихомонада не наносит,
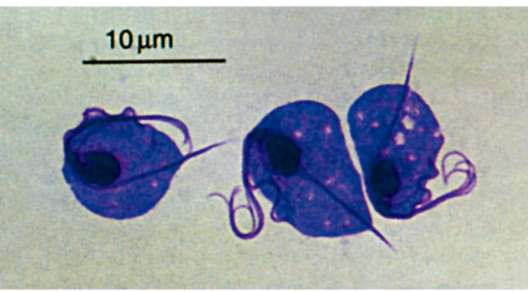
Рис. 19.5. Трихомонада влагалищная
но, тесно контактируя с эпителием мочеполовой системы, она вызывает возникновение мелких воспалительных очагов под эпителиальным слоем и слущивание поверхностных клеток слизистой оболочки. Через нарушенную эпителиальную выстилку в просвет органа поступают лейкоциты. У мужчин заболевание обычно завершается спонтанным выздоровлением примерно через 1 мес. У женщин трихомоноз может протекать несколько лет.
Лабораторная диагностика - обнаружение живых подвижных три-хомонад в мазке из выделений мочеполовых путей.
Профилактика - соблюдение правил личной гигиены при половых контактах.
19.2.5. ОДНОКЛЕТОЧНЫЕ ПАРАЗИТЫ, ОБИТАЮЩИЕ В ЛЕГКИХ
Pneumocystis carinii (син. Pneumocystis jiroveci) относится к своеобразной группе паразитов, не имеющих полового процесса. Является возбудителем пневмоцистоза. Современные исследования особенностей биохимической и генетической организации позволили отнести этого паразита не к типу простейших, а к особой группе царства Грибов (Furgi). Однако в связи со сходством жизненного цикла пневмоцистиса со многими паразитическими простейшими и с его серьезным медицинским значением авторы сочли уместным поместить его описание в данном разделе книги.
Паразиты имеют неправильную форму, размеры их от 1 до 5 мкм. В цитоплазме содержатся митохондрии, а диссимиляция происходит аэробно.
Обитает в альвеолах легких человека и многих млекопитающих. Человек заражается воздушно-капельным путем, вдыхая клетки пневмоцистиса.
В легких паразиты располагаются на альвеолярном эпителии, прикрепляясь к нему псевдоподиями. Здесь они размножаются простым делением, увеличиваются в размерах, образуют толстую оболочку и делятся обычно несколько раз, образуя споры. При разрыве оболочки споры паразитов выходят из нее, и начинается следующий цикл размножения в данном организме или в другом хозяине, в случае попадания к нему при вдыхании (рис. 19.6).
У 1-10% здоровых людей отмечены P. carinii. Инвазия протекает обычно бессимптомно, однако в случае ослабления иммунитета хозяина размножение паразитов усиливается, они закупоривают бронхиолы, что приводит в тяжелых случаях к смерти от асфиксии.
Анализ смертности больных СПИДом в США, Европе и Японии показал, что в 70% случаев основной причиной смерти стал пневмоцистоз. Имеются сведения о том, что если больных СПИДом удается спасти от пневмоцистоза, то жизнь их значительно продлевается.
Обнаружить P. carinii в мокроте больных крайне сложно. Поэтому для диагностики используют иммунологические методы, которые не обладают высокой специфичностью. В настоящее время разработан метод диагностики пневмоцистоза с использованием генетических зондов. У погибших больных диагноз ставят на основании обнаружения паразитов на разных стадиях их жизненного цикла в гистологических срезах легких.
Профилактика пневмоцистоза сложна в связи с широкой распространенностью паразита у здоровых людей и домашних животных. Поэтому из мер профилактики эффективна только вакцинация людей с иммунодефицитом специальными вакцинами, получаемыми методами генетической инженерии.
19.3. ПРОСТЕЙШИЕ, ОБИТАЮЩИЕ В ТКАНЯХ
Простейшие, обитающие в тканях, - более специализированные паразиты по сравнению с предыдущей группой организмов. В связи с этим у большинства из них, особенно живущих внутриклеточно, обнаруживаются признаки глубокой дегенерации: исчезают органеллы передвижения и питания, форма тела становится непостоянной, поглощение питательных веществ осуществляется всей поверхностью тела за счет пиноцитоза и активного транспорта через мембраны.
На протяжении эволюции у них выработались адаптации к проникновению в организм хозяина разными способами, к перемещению в тканях. Многие из них инвазируют хозяина трансмиссивным путем, другие ис-
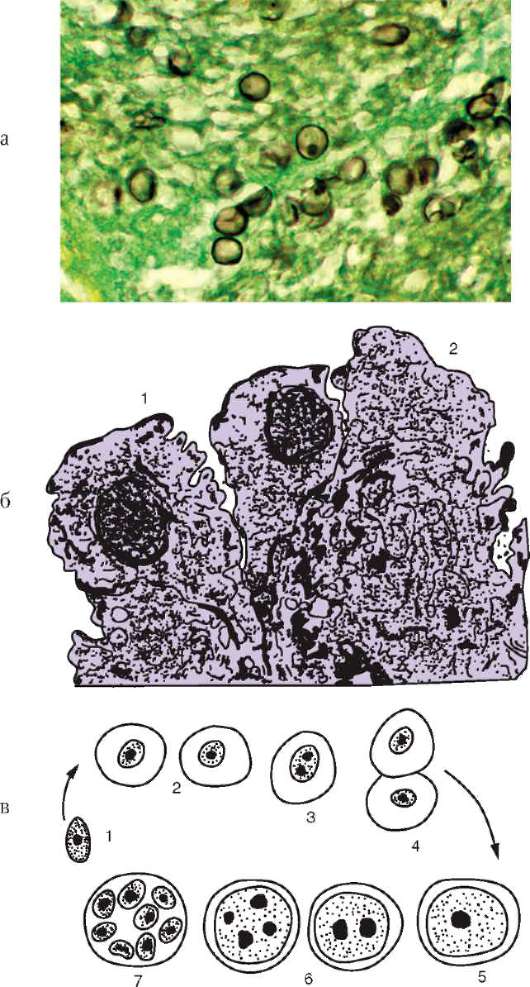
Рис. 19.6. Пневмоцистис: а - паразиты в мокроте больного; б - паразиты (1) на клетках эпителия альвеол (2); в - цикл развития: 1-4 - паразиты в процессе деления, 5-7 - образование спор
пользуют промежуточных хозяев, которыми питаются основные. Циклы развития большинства простейших этой группы сильно усложняются и часто лабильны: в ряде случаев возможно заражение одного промежуточного хозяина от другого, минуя основного. Часть паразитов этой группы адаптировалась к человеку не только как к биологическому, но и как к социальному существу, используя такие необычные факторы заражения, как хирургический инструмент и медицинские манипуляции.
Длительный контакт этих паразитов с иммунной системой хозяина выработал своеобразные адаптации к избеганию действия иммунитета хозяина: наиболее специализированные паразиты этой группы обитают не просто в тканях, а внутри клеток, в том числе даже в клетках иммунной системы. Другие, находящиеся в тканевой жидкости, в межклеточных пространствах и плазме крови, вынуждены на протяжении всего онтогенеза постоянно подвергаться действию гуморальных факторов иммунитета. В результате у них возникли своеобразные особенности клеточной поверхности, выражающиеся в том, что постоянно меняется ее антигенный состав.
Простейших, обитающих в тканях, следует подразделить на передающихся нетрансмиссивно и передающихся трансмиссивно.
19.3.1. ПРОСТЕЙШИЕ, ОБИТАЮЩИЕ В ТКАНЯХ И ПЕРЕДАЮЩИЕСЯ НЕТРАНСМИССИВНО
К этой группе простейших относятся близкие друг другу виды кок-цидий (кл. Споровики), ведущих внутриклеточный образ жизни. Они паразитируют не только у человека, но и у большого числа видов домашних и диких животных. Таким образом, вызываемые ими заболевания являются зоонозными и природно-очаговыми, профилактика их осложнена. Не менее сложна и диагностика, что связано, с одной стороны, со слабой выраженностью симптомов заболеваний, а с другой - с тем, что паразиты могут обитать в разных клетках и тканях хозяина, и вероятность обнаружения их невелика.
Обнаружить паразитов в тканях человека весьма сложно, поэтому для диагностики токсоплазмоза используют иммунологические исследования крови и биоптатов тканей. В настоящее время широко применяется метод ПЦР-диагностики.
Токсоплазма Toxoplasma gondii - возбудитель токсоплазмоза. Имеет форму полумесяца, один конец которого заострен более другого. В центре располагается крупное ядро. Длина паразита 4-7 мкм (рис. 19.7).
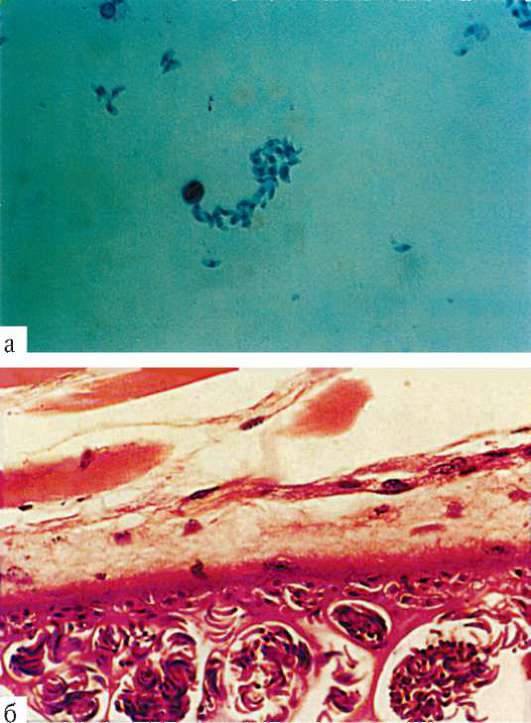
Рис. 19.7. Споровики, передающиеся нетрансмиссивно: а - токсоплазма; б - сарко-цисты в мышечном волокне
Токсоплазма поражает огромное количество видов животных и человека. Иммунологические исследования показали, что на Земле токсо-плазмами заражено более 500 млн человек.
Жизненный цикл токсоплазмы типичен для споровиков: в нем чередуются стадии шизогонии, гаметогонии и спорогонии.
Основные хозяева паразита - домашние кошки и дикие виды сем. Кошачьи. Они заражаются, поедая больных грызунов, птиц или инвазиро-ванное мясо крупных животных. Паразиты у них сосредоточиваются в клетках кишечника, размножаются шизогонией, а затем образуют гаметы. После копуляции гамет формируются ооцисты, которые выделяются во внешнюю среду. В них происходит спорогония, т.е. деление зиготы под оболочкой.
Такие спороцисты со спорозоитами рассеиваются кошками и попадают к промежуточным хозяевам, которыми могут быть человек, почти все млекопитающие, птицы и даже пресмыкающиеся. В клетках большинства их органов происходит бесполое размножение токсоплазм в форме
множественного деления. В результате образуются группы, состоящие из многих сотен отдельных паразитов. Эти группы могут распадаться, и тогда отдельные токсоплазмы внедряются с помощью специфической органеллы проникновения - коноида - в непораженные клетки, в которых вновь происходит шизогония.
Другие такие группы покрываются плотной оболочкой и формируют цисты. Цисты очень устойчивы и могут длительное время находиться в состоянии покоя в органах хозяев, иногда на протяжении всей их жизни. В окружающую среду они не выделяются. Цикл развития замыкается при поедании кошками органов промежуточных хозяев с цистами.
Своеобразной особенностью цикла развития токсоплазм является то, что промежуточные хозяева могут заражаться ими не только от основного хозяина, но и при поедании друг друга. Так, возможно заражение свиней при поедании ими трупов грызунов, погибших от токсоплазмоза, грызуны же заражаются друг от друга при каннибализме. Возможно и внутриутробное заражение плода от больной беременной самки, когда паразиты проникают через плаценту. Этот способ заражения обеспечивает устойчивое существование природных очагов токсоплазмоза и среди мелких грызунов, не склонных к каннибализму.
В соответствии с этим и человек как промежуточный хозяин может заразиться токсоплазмозом разными путями:
• при поедании мяса инвазированных животных;
• с молоком и молочными продуктами;
• через кожу и слизистые оболочки при уходе за больными животными, при обработке шкур и разделке животного сырья;
• внутриутробно через плаценту;
• при медицинских манипуляциях переливания крови и лейкоцитарной массы, при пересадках органов, сопровождающихся приемом иммунодепрессивных препаратов.
Последнее свидетельствует о том, что общее снижение иммунитета повышает вероятность заражения токсоплазмозом.
Беременность у женщин, больных токсоплазмозом, прерывается существенно чаще, чем у здоровых, причем доля родившихся в таких случаях мальчиков составляет 72%, а девочек - 28%. Это означает разную чувствительность эмбрионов и плодов человека к возбудителю в зависимости от пола.
Обычно паразиты обладают весьма низкой патогенностью, но в некоторых условиях они могут вызвать очень тяжелые нарушения, что зависит как от индивидуальной чувствительности хозяев, так и от пу-
тей проникновения токсоплазм в организм человека, а главное - от их локализации. Существенное значение имеет также индивидуальная чувствительность хозяина к патогенному действию паразита. В головном мозге токсоплазмы колонизируют средний мозг и гипоталамус, поражая в первую очередь глиальные клетки - астроциты, причем клетки, экспрессирующие мембранный белок GD34, инвазируются интенсивнее по сравнению с клетками, мембрана которых не содержит этого белка. В нейронах токсоплазма вызывает усиленную секрецию дофамина - медиатора и нейрогормона, что, в свою очередь, приводит к изменениям эмоционального состояния и поведения зараженного хозяина. Инвази-рованные токсоплазмой мыши и крысы при этом перестают бояться кошек, активно перемещаются и заселяют новые территории. Повышается вероятность их поедания кошками.
У зараженных людей также наблюдаются изменения поведения и психики, причем мужчины и женщины реагируют на паразитов по-разному: женщины становятся более отзывчивыми, радушными, контактными, а мужчины - более грубыми и агрессивными. В остальном у представителей разных полов проявляются и общие симптомы: усиление беспокойства, чувство вины, неуверенность, подозрительность, принятие неадекватных решений, невротизм. При повышенном уровне невротизма люди часто стараются снимать стресс, общаясь с домашними животными, особенно с кошками. Это способствует более активной циркуляции паразита между окончательными и промежуточными хозяевами. Исследования европейских психологов и социологов показали, что общий уровень невротизма в Европе наиболее высок в Нидерландах и в Венгрии. В этих же странах зарегистрировано наибольшее число кошек на душу населения и наиболее часто встречается токсоплазмоз.
Известно, что при шизофрении в первую очередь наблюдаются поражение глиальных клеток в мозге, повышенная секреция дофамина, изменяются поведенческие реакции, возникают галлюцинации, психозы. Есть данные о том, что шизофрения часто ассоциируется с инвазией токсоплазмой. Поэтому в психиатрической практике пациентов, страдающих шизофренией, необходимо обследовать в отношении возможности инвазии токсоплазмой, и при получении положительных результатов - пролечивать от токсоплазмоза.
Больные с синдромом приобретенного иммунодефицита (СПИД) становятся наиболее чувствительными к заражению любыми инфекционными и паразитарными заболеваниями, в частности токсоплазмозом, и если это происходит, то у них также проявляются симптомы наруше-
ния сенсорной, психоэмоциональной и волевой сфер, характерные для шизофрении.
На молекулярном уровне токсоплазма приводит к перепрограммированию метаболизма клеток хозяина: изменяет экспрессию многих белков, в том числе митохондриальных, как на уровне трансляции, так и при посттрансляционных модификациях, нарушает прохождение клетками митотического цикла, а также энергетический обмен. В моноцитах и макрофагах крови усиливается синтез мембранного белка CD36, который принимает участие в аутоиммунных процессах, наблюдаемых, например, при болезни Альцгеймера. Наблюдается также нарастание числа макрофагов и моноцитов с активированными гликопротеинами CD4+ и CD8+, а также стимуляция Т-лимфоцитов к размножению. Кроме того, при заражении токсоплазмозом происходит активация синтеза мембранных белков CD200 и CD200R нейронами, клетками микроглии и эндотелием желудочков головного мозга. В экспериментах с мышами показано, что тяжесть заболевания зависит от генетической конституции организма: у животных, гетерозиготных по аллелям CD200/CD200R по сравнению с мышами, имеющими иные генотипы, токсоплазмоз протекает в более легкой форме и обычно не заканчивается летально.
Наиболее опасно трансплацентарное заражение токсоплазмозом. При этом возможно рождение детей с множественными врожденными пороками развития, в первую очередь головного мозга.
При постановке диагноза используют методы иммунологических реакций, обнаружение токсоплазм при прямом микроскопировании материала, взятого от больного человека или трупа. Для исследования используют плаценту, печень, кровь, лимфатические узлы, головной мозг. Применяют также метод биологических проб. В этом случае лабораторным животным вводят кровь или спинномозговую жидкость больного. Мыши заболевают токсоплазмозом при таком способе заражения в острой форме, и обнаружение возбудителя у них не представляет сложности.
Профилактика - термическая обработка животных продуктов питания, санитарный контроль на бойнях и мясокомбинатах, предотвращение тесных контактов детей и беременных женщин с домашними животными.
Считается, что в настоящее время токсоплазмами инвазированы не менее 2 млрд человек, но у большинства из них инвазия протекает бессимптомно.
Несколько близких к токсоплазме паразитов - саркоцисты (Sarco-cystis hominis, S. suihominis, S. lindemanni) - являются возбудителями сарко-цистозов и имеют сходный с ней цикл развития (см. рис. 19.7, б). Человек для этих паразитов - основной хозяин, а животные - промежуточные. Поэтому у человека, как и у кошки при токсоплазмозе, поражается кишечник. Но степень поражения его очень незначительна. По некоторым данным, частота инвазии людей саркоцистами достигает 7-60%, особенно там, где в соответствии с традициями население употребляет в пищу сырое или полусырое мясо. Врачи обычно не ставят правильного диагноза, а заболевание заканчивается быстрым самоизлечением.
19.3.2. ПРОСТЕЙШИЕ, ОБИТАЮЩИЕ В ТКАНЯХ И ПЕРЕДАЮЩИЕСЯ ТРАНСМИССИВНО
В эту экологическую группу паразитических простейших входит большое число видов из классов Жгутиковые и Споровики, имеющих сложные циклы развития. Все переносчики этих паразитов являются специфическими. Распространенность заболеваний приурочена к зонам встречаемости переносчиков. Некоторые паразиты этой группы вызывают заболевания только у человека, поэтому соответствующие заболевания являются антропонозными. Другие формируют устойчивые природные очаги, поражая разные виды диких животных. Цист эти паразиты не образуют и непосредственно во внешнюю среду не выделяются. Диагностика заболеваний, вызываемых этими паразитами, основана на обнаружении их трофозоитов в крови и биоптатах тканей или на результатах иммунологических реакций.
Профилактика включает общие меры профилактики трансмиссивных заболеваний (борьба с переносчиками) и конкретные, зависящие от видовой специфики паразитов.
Лейшмании Leischmania (кл. Жгутиковые) - возбудители лейшма-ниозов.
Лейшмании в основном паразитируют у пресмыкающихся, но некоторые виды освоили более широкий спектр хозяев и обитают в организмах млекопитающих, в том числе человека.
Они имеют очень древнее происхождение. Среди многообразия эу-кариот лейшмании обладают одним из самых простых геномов: геном одного исследованного вида имеет только 8300 генов, ответственных за синтез белков, и 900 генов, кодирующих регуляторные РНК. Около 6200 генов лейшманий практически полностью соответствуют генам
трипаносом, с которыми они находятся в близком родстве, а около 1000 генов являются специфическими. Кариотип лейшманий включает 35 или 36 хромосом.
Заболевания человека вызывают несколько видов и подвидов паразитов, которые объединяются в четыре комплекса: L. donovani - возбудитель висцерального лейшманиоза, L. tropica - возбудитель кожного лейшманиоза, L. mexicana - возбудитель лейшманиоза Центральной Америки, L. brasiliensis - возбудитель бразильского лейшманиоза. Все виды сходны морфологически и имеют одинаковые циклы развития. Они существуют в двух формах: в безжгутиковой, или лейшманиальной, и жгутиковой, или промастиготной (рис. 19.8).
Лейшманиальная форма очень мелка - диаметром 3-5 мкм. Ее характерная черта - круглое ядро, занимающее около 1/4 цитоплазмы; жгутика нет, но перпендикулярно клеточной поверхности располагается палочковидный кинетопласт. Эти формы обитают в клетках рети-кулоэндотелиальной системы человека и ряда других млекопитающих (грызунов, собак, лис). Промастиготная форма удлинена - до 25 мкм, спереди находится жгутик, у основания которого хорошо виден такой же кинетопласт, что и в безжгутиковой стадии паразита. Обитает в пищеварительной системе москитов. Безжгутиковая форма, посеянная на культуральную среду, превращается в жгутиковую.
Лейшманиозы широко распространены в странах с тропическим и субтропическим климатом на всех континентах там, где обитают москиты. Они - типичные природно-очаговые заболевания (см. п. 18.13). Природными резервуарами являются грызуны, дикие и домашние хищники. Заражение человека происходит при укусе инвазированными москитами.
По патогенному действию лейшманий заболевания, которые они вызывают, делят на три основные формы: кожный, слизисто-кожный и висцеральный лейшманиозы.
При кожном лейшманиозе очаги поражения находятся в коже. Это самый распространенный тип лейшманиоза, протекающий относительно доброкачественно. Возбудителями кожного лейшманиоза в Африке и Азии являются L. tropica, а в Западном полушарии - L. mexicana и ряд штаммов L. brasiliensis. L. tropica и L. mexicana вызывают на коже длительно не заживающие язвы на месте укусов москитами. Язвы заживают через несколько месяцев после образования, а на их месте на коже остаются глубокие рубцы. Некоторые формы L. brasiliensis способны распространяться по лимфатическим сосудам
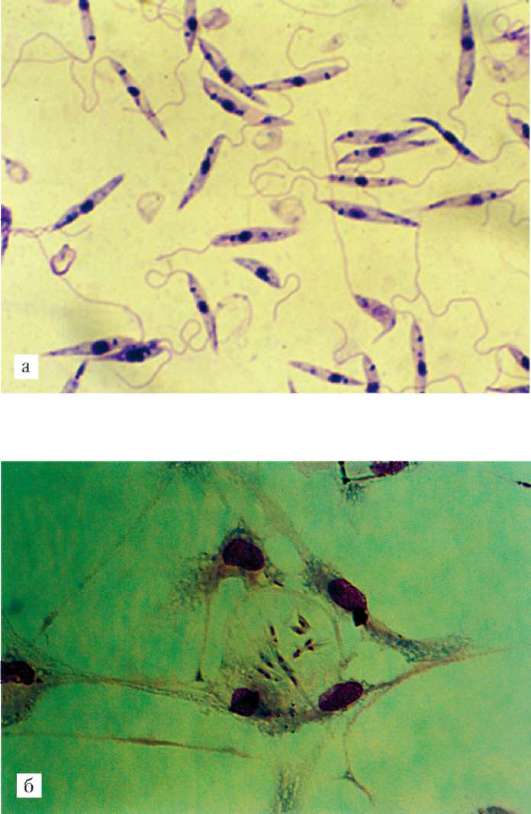
Рис. 19.8. Лейшмания: а - жгутиковая форма в культуре; б - паразиты в межклеточном пространстве соединительной ткани
кожи с образованием многочисленных кожных язв в отдалении от мест укусов.
Слизисто-кожный лейшманиоз вызывается подвидом L. brasiliensis brasiliensis. При этой форме заболевания паразиты проникают из кожи по кровеносным сосудам в носоглотку, гортань, мягкое нёбо, половые органы, поселяются в макрофагах соединительных тканей этих органов и вызывают здесь деструктивные воспаления.
Висцеральный лейшманиоз вызывает L. donovani. Заболевание начинается через несколько месяцев или даже лет после заражения как системная инфекция. Паразиты размножаются в макрофагах и в моноцитах крови. Нарушаются функции печени, кроветворение. Очень велика интоксикация. При отсутствии лечения заболевание заканчивается летально.
Лабораторная диагностика основана на микроскопировании мазков из кожных язв при кожном и слизисто-кожном лейшманиозах, пунктатов лимфатических узлов и костного мозга при висцеральном лейшманиозе. В окрашенных препаратах обнаруживается лейшмани-альная форма паразитов как внутри клеток, так и внеклеточно. В сомнительных случаях производят посев материала, взятого от больного, на специальную культуральную среду, на которой лейшманий приобретают промастиготную форму, активно передвигаются и легко обнаруживаются при микроскопировании. Используют также и биологические пробы - заражение лабораторных грызунов.
Профилактика - в первую очередь это борьба с переносчиками и уничтожение природных резервуаров (грызунов и бродячих собак), а также профилактические прививки.
В настоящее время, по данным Международной организации здравоохранения, разными формами лейшманиоза болеет около 12 млн человек в 88 странах в основном тропического и субтропического региона. Ежегодно диагностируются около 1,5 млн новых случаев заражения лейшманиозами.
Trypanosoma brucei gambiense и T.b. rhodesiense (кл. Жгутиковые) - возбудители африканского трипаносомоза, или сонной болезни.
Паразит имеет извилистую заостренную с обеих сторон форму. Длина его 17-28 мкм. Стадии, паразитирующие у человека, имеют один жгутик, ундулирующую мембрану сбоку и хорошо заметный кинетопласт у основания жгутика.
Трипаносомы поселяются у человека в крови, лимфе, спинномозговой жидкости, в тканях головного и спинного мозга и в серозных полостях.
T.b. gambiense встречается в Западной Африке, а T.b. rhodesiense - в Восточной и Юго-Восточной Африке.
Жизненный цикл этих паразитов протекает в организме человека, домашних и диких млекопитающих, в первую очередь копытных. T.b. gambiense чаще поражает человека, свиней и собак, T.b. rhodesiense - диких животных - антилоп и носорогов. Переносчик первого подвида - муха цеце Glossina palpalis, живущая поблизости от жилища человека, второго - G. morsitans, обитающая в открытых саваннах и саванновых лесах. В связи с этим сонная болезнь, возбудителем которой является T. b. gambiense, встречается в антропогенных очагах культурных ландшафтов. Ежегодно регистрируется около 10 000 новых случаев заражения. Восточноафриканский трипаносомоз распространен значительно меньше и встречается в основном в естественной природе. В основном им заболевают охотники, туристы, сезонные рабочие, каждый год - около 1500 человек.
Сонная болезнь без лечения протекает около 5 лет и выражается в нарастающей мышечной слабости, депрессии, истощении и сонливости. Возможны случаи самоизлечения, но обычно заболевание заканчивается смертью больного.
Восточноафриканский трипаносомоз протекает более злокачественно, длится не более 6 мес и также заканчивается смертью.
Для паразитирования трипаносом у млекопитающих, в том числе человека, характерны циклические подъемы интенсивности инвазии за счет их размножения, сопровождающиеся изменениями строения и антигенных свойств паразитов. Во время увеличения количества паразитов в крови преобладают трипаносомы удлиненной формы. Антигены, которые они образуют, вызывают формирование антител в организме хозяина. Под действием антител многие паразиты гибнут и интенсивность инвазии снижается. Выжившие трипаносомы укорачиваются и начинают вырабатывать другие антигены. Укороченные формы паразита, инвазионные для мухи цеце, в ее организме вновь приобретают удлиненную форму, инвазионную для человека.
Trypanosoma brucei в организме человека может размножаться, только находясь внутри клеток, в основном эритроцитов. Паразит попадает туда активно через мембранные рецепторы CD, индуцируя фагоцитоз. В тяжелых случаях трипаносома внедряется и в клетки головного мозга. Больные ощущают слабость, головную боль, боль в суставах. Эти симптомы сопровождаются анемией, нарушением функций сердца и почек. Часто заболевание заканчивается истощением и смертью больного
Жизненная форма трипаносомы, обитающая в крови человека, получает энергию за счет гликолиза в связи с тем, что она содержит незначительное количество цитохрома. При попадании в пищеварительную систему мухи цеце происходит реорганизация структуры паразита, в его цитоплазме появляется большое количество нормально функционирующих митохондрий, и он переключается на аэробный тип метаболизма.
Каждая новая волна размножения паразитов представляет собой новую популяцию трипаносом, обладающую поверхностным белком, несколько отличным от предыдущего, состоящим из тех же аминокислот, но расположенных в другом порядке. Один клон трипаносом может последовательно образовывать от 1000 до 2000 разных гликопротеи-нов оболочки. Гены этих протеинов относятся к одному мультигенному семейству и возникли в процессе эволюции, вероятно, путем дупликаций и последующей дифференцировки, как и другие семейства генов. В геноме трипаносомы имеется сайт экспрессии, в который поочередно перемещаются гены поверхностных гликопротеинов, приближаясь к промотору, обеспечивающему их специфическую активацию. Там они транслируются. Не исключено, однако, что сайт экспрессии в геноме трипаносомы не единственный, и даже возможно, что разные гены гли-копротеинов активируются несколькими механизмами. В любом случае речь идет о своеобразной адаптации паразита к специфическим условиям существования, повышающей его выживаемость и открывающей ему широкие эволюционные перспективы.
Таким образом паразит избегает иммунной реакции со стороны хозяина.
Кроме описанного варианта адаптации трипаносом к обитанию во внутренней среде хозяина этот паразит использует и механизм генетической рекомбинации, широко распространенный среди свободноживу-щих простейших. Так, при попадании в организм человека более одного штамма трипаносом за счет укусов несколькими насекомыми, паразиты в процессе конъюгации способны претерпевать комбинативную изменчивость, создающую практически неограниченные возможности защиты от иммунных реакций хозяина. Естественный отбор паразитов как в одном хозяине, так и в его популяциях приводит к сохранению и воспроизводству наиболее жизнеспособных форм. Описанные особенности трипаносом дают им возможность эффективно использовать соответствующие экологические ниши.
Эффективная мера профилактики сонной болезни, как и в случае борьбы с малярией, - стерилизация самцов переносчика и выпуск в
окружающую среду. Такие самцы эффективно конкурируют за самок с нормальными самцами, а самки, бывшие в контакте с ними, остаются бесплодными.
В Африке широко используются специальные ловушки со специфическими аттрактантами, при попадании в которые мухи гибнут.
В настоящее время зарегистрировано около 66 млн больных африканской сонной болезнью.
Лабораторная диагностика - исследование мазков крови и спинномозговой жидкости больного для выявления в них возбудителя. Используются также иммунологические реакции и заражение лабораторных животных.
Профилактика - кроме борьбы с переносчиками применяют профилактическое лечение здоровых людей, живущих в очагах трипаносомоза, делающее организм невосприимчивым к инвазии. Практиковавшийся ранее отстрел диких животных, являющихся природным резервуаром паразита, вряд ли рационален в связи с возможным нарушением экологического баланса, который складывался в биогеоценозах на протяжении тысячелетий.
Trypanosoma cruzi - возбудитель американского трипаносомоза, или болезни Чагаса (Шагаса). Длина этой трипаносомы в крови человека достигает 20 мкм. Кинетопласт очень крупный, округлой формы. Характерная особенность этого возбудителя - способность к внутриклеточному паразитизму. При этом трипаносомы проникают вначале в макрофаги кожи и слизистых оболочек, а затем и в клетки миокарда, нейроглии и мышц, теряя жгутики, ундулирующие мембраны, и превращаясь в безжгутиковые, или амастиготные, формы. Здесь и происходит размножение паразитов. В крови эти трипаносомы никогда не делятся. В конечном счете пораженная клетка вся заполняется амастиготными формами трипаносом и разрывается, а паразиты инвазируют новые клетки. При этом часть их, превращаясь вновь в жгутиковую форму, поступает в кровь, откуда в дальнейшем они могут попасть в организм переносчика (рис. 19.9).
Переносчики болезни Чагаса - триатомовые клопы родов Tria-toma, Rhodnius и Panstrongylus (см. п. 21.2.2). В них трипаносомы размножаются и достигают состояния инвазионности, поступая в заднюю кишку. Вскоре после кровососания клопы испражняются на покровы человека или животного, и трипаносомы проникают в кровь через раневое отверстие от хоботка или через неповрежденные слизистые оболочки губ, носа и глаз. Окончательными хозяевами кроме человека являются
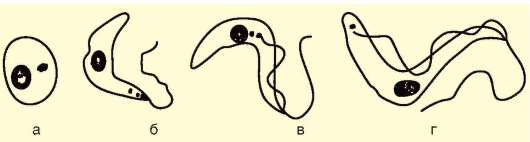
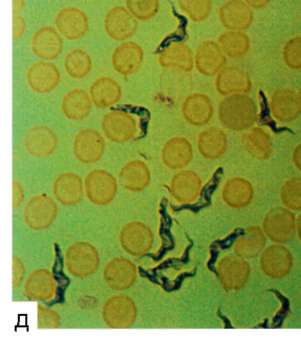
Рис. 19.9. Трипаносома. Жизненные формы: безжгутиковая (а) и жгутиковые (б-г) формы; д - трипаносомы в мазке крови
броненосцы, опоссумы, крысы, обезьяны и домашние животные - собаки, кошки, свиньи и даже куры. Кроме трансмиссивного способа заражения описано также заражение половым путем, при переливании крови, а также через плаценту.
Болезнь поражает в основном детей младшего возраста, у которых протекает остро. В старшем возрасте заболевание часто переходит в хроническую форму.
Различные штаммы возбудителя отличаются друг от друга преимущественным поражением разных органов и тканей: сердца, отделов нервной системы, клеток печени, селезенки, глиальных клеток, ретику-лоцитов.
Патогенное действие выражается в поражении органов, в клетках которых развиваются паразиты: характерны миокардиты, кровоизлияния в мозговые оболочки и менингоэнцефалит. Иногда заболевание протекает легко и заканчивается самопроизвольным излечением. Trypanosoma cruzi у детей вызывает умственную отсталость, увеличение размеров толстой кишки и пищевода - мегаколон и мегаэзофагус. Характерно повреждение сердечной мышцы, что может привести к летальному исходу.
Трипаносомы этого вида обладают комплексом механизмов защиты от реакции со стороны организма хозяина. Это внутриклеточная лока-
лизация, ингибирование апоптоза инвазированных клеток, синтез белковых молекул, связывающих антитела, вырабатывающиеся хозяином, подавление системы комплемента.
В настоящее время на территории Центральной и Южной Америки ежегодно регистрируется около 18 млн новых случаев заболевания, а 100 млн человек находятся в группе риска.
Диагностика - в острой форме заболевания возможно обнаружение трипаносом в крови, в пунктатах лимфатических узлов, в спинномозговой жидкости. Иммунологический метод позволяет выявить в организме больного специфические антитела. Посев крови больного на культуральную среду позволяет выявить возбудителя в чистой культуре. При хроническом течении со слабовыраженными симптомами рационально введение крови больного морским свинкам, у которых возбудители обнаруживаются в большом количестве на 14-е сутки. Существует и своеобразный метод диагностики - кормление на больном неинва-зированных переносчиков-клопов, в кишечнике которых трипаносомы быстро размножаются и легко обнаруживаются.
В экспериментах на мышах, которым были привиты клетки злокачественных опухолей HeLa, саркомы 37 и других, обнаружено явление туморотропизма Trypanosoma cruzi. Паразиты внедряется в опухолевые клетки в 30-40 раз активнее, чем в нормальные. У 50% мышей опухоли после инвазии трипаносом вообще не развивались, а у остальных рост опухолей существенно задерживался. Кроме того, обнаружено, что паразит способствует ускоренному образованию Т-лимфоцитов, приводя к повышению уровня неспецифического иммунитета. Считается, что противоопухолевая активность трипаносом связана с особенностями организации и функционирования генетического материала митохондрий паразита. Этот феномен является своеобразной адаптацией паразита к среде обитания, в результате чего у него появляется возможность прожить дольше, эффективнее размножиться и широко расселиться.
Трипаносомы представляют большой медицинский интерес не только потому, что возбуждают серьезные, смертельно опасные заболевания и одновременно обладают противоопухолевым действием.
Колоссальная экологическая пластичность трипаносом, обеспечивающая им возможность паразитирования в организме хозяина на протяжении нескольких лет в условиях постоянно действующих механизмов иммунитета, позволяет этим паразитам осваивать и новых хозяев. Так, описанная в последние годы вспышка трипаносомоза в Эфиопии была
вызвана адаптацией к человеку T.b. brucei - подвида, паразитирующего обычно только у крупного рогатого скота и антилоп. Та же причина, вероятно, лежит в основе существования периодических вспышек трипаносомозов в Индии и Малайзии, где у больных были выделены паразиты, обитающие обычно в крови грызунов и низших обезьян. В Центральной и Южной Америке кроме Т. cruzi известна и еще одна трипаносома - Т. rangeli, которая чаще паразитирует у кошек и собак, но способна инвазировать и человека, вызывая у него нетяжелую, быстро проходящую лихорадочную реакцию.
Описанный выше противоопухолевый эффект трипаносом и изучение особенностей метаболизма этого паразита стали основой для разработки противоопухолевых препаратов - круцина и трипанозы.
Малярийные плазмодии Plasmodium (кл. Споровики) - возбудители малярии. Известны следующие виды малярийных плазмодиев, паразитирующие у человека: P. vivax - возбудитель трехдневной малярии, P. falciparum - возбудитель тропической малярии, P. malariae - возбудитель четырехдневной малярии, P. ovale - возбудитель овале-малярии, близкой к трехдневной. Три первых вида широко распространены в тропических и субтропических климатических поясах, последний - только в тропической Африке. Все виды сходны морфологически и жизненными циклами, отличаясь друг от друга деталями строения и некоторыми особенностями цикла развития, проявляющимися в основном продолжительностью его отдельных периодов.
Происхождение плазмодиев представляется загадочным. Дело в том, что нуклеотидные последовательности геномов этих паразитов на 10% состоят из генетического материала растений. Они синтезируют более 500 различных растительных белков. Их кодирует генетический материал уникальных органелл, называемых апикопластами, которые по строению сходны с хлоропластами растений. Однако их функции - не фотосинтез, а синтез жирных кислот, необходимых для проникновения в клетки хозяина, а также ряда ферментов, использующихся в энергетическом обмене.
Вероятно, плазмодии возникли сотни миллионов лет назад за счет симбиоза примитивных эукариотических организмов с формами, близкими к древним предкам сине-зеленых водорослей. Косвенно это доказывают эксперименты на лабораторных животных, зараженных плазмодиями. Лечение их препаратами на основе гербицидов (специфических органических соединений, вызывающих гибель растений и применяющихся для борьбы с сорняками в сельском хозяйстве) оказалось
успешным. В настоящее время создается ряд медицинских препаратов на основе гербицида фосмидомицина для лечения малярии у человека.
Интересно, что жизнедеятельность малярийного плазмодия подавляет также ряд антибиотиков, не действующих на другие эукариотические клетки и использующихся исключительно для лечения заболеваний бактериальной природы. Это также подтверждает, что апикопласты плазмодиев, как и хлоропласты растений, - результат эволюции древних симбиотических прокариот, интегрировавшихся в клетки эукарио-тической природы.
6% ДНК плазмодия представляет собой блок из 150 вариантов гена, ответственного за специфику антигенного состава клеточной оболочки, белки которой периодически меняются, обеспечивая паразиту избегание действия иммунной системы хозяина так же, как это происходит у трипаносом (см. выше).
Жизненный цикл малярийных плазмодиев типичен для споровиков, включая стадии бесполого размножения в виде шизогонии, полового процесса и спорогонии. Окончательный хозяин паразитов - комар p. Anopheles (см. п. 21.22). В его организме происходит половой процесс и спорогония - многократное клеточное деление с образованием споро-зоитов - форм, инвазионных для человека. Промежуточный хозяин - человек. В его организме происходит размножение паразита. Комар - одновременно и переносчик болезни, поэтому малярия - типичное ан-тропонозное трансмиссивное заболевание.
Со слюной зараженного комара при укусе плазмодии попадают в кровь человека (рис. 19.10). Развитие паразитов в организме человека происходит синхронно. С током крови они разносятся по организму и поселяются в клетках печени. Здесь они растут и размножаются шизогонией таким образом, что один паразит делится на тысячи дочерних особей. Клетки печени при этом разрушаются, и паразиты, называющиеся на этой стадии мерозоитами, поступают в кровь и внедряются в эритроциты. P. vivax использует для проникновения в эритроциты в качестве рецептора мембранный белок CD234. С этого момента начинается эритроцитарная часть цикла развития плазмодия. Паразит питается гемоглобином, растет и размножается шизогонией. При этом каждый плазмодий делится на 8-24 мерозоита. После разрушения эритроцита мерозоиты попадают в плазму крови и оттуда в новые эритроциты, после чего весь цикл эритроцитарной шизогонии повторяется.
Выход большого числа мерозоитов из разрушенных эритроцитов сопровождается выбросом в плазму крови значительного количества ток-
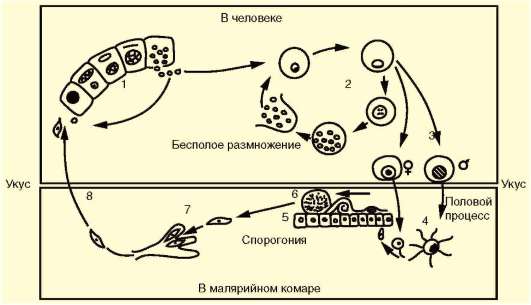
Рис. 19.10. Жизненный цикл малярийного плазмодия: 1 - преэритроцитарная шизогония в клетках печени; 2 - эритроцитарная шизогония; 3 - образование гаметоцитов; 4 - оплодотворение; 5 - спорогония в стенке желудка комара; 6 - ооциста со спорозоитами; 7 - проникновение спорозоита в слюнные железы комара; 8 - заражение человека
сических продуктов жизнедеятельности. Их воздействие на организм приводит к резкому повышению температуры тела, ознобу, слабости и головным болям. Такое состояние возникает внезапно и длится в среднем 1,5-2 ч. Вслед за этим наступают чувство жара, сухость во рту, жажда. Температура тела достигает 40-41 °С. Резко усиливается потоотделение, нарастает слабость, возможна потеря сознания. Перечисленные симптомы облегчают комарам, ориентирующимся с помощью обонятельных и терморецепторов, поиск хозяев-прокормителей и обеспечивает плазмодиям возможность дальнейшего расселения. Через несколько часов все перечисленные симптомы исчезают, и больные обычно засыпают. Весь приступ может продолжаться от 6 до 12 ч. При трехдневной и овале-малярии промежутки между приступами составляют 48 ч, число таких приступов может достигать 10-15, после чего они прекращаются за счет повышения уровня специфического иммунитета, но паразиты в крови еще могут обнаруживаться. В таком случае человек становится парази-тоносителем и продолжает представлять опасность для окружающих как возможный источник заражения.
Обычно поврежденные эритроциты транспортируются в селезенку и там разрушаются.
P. falciparum, находящийся в эритроците, приводит к изменению его метаболизма и свойств оболочки: на ее поверхности образуется белок, имеющий сродство к мембранному рецептору CD36, располагающемуся на поверхности клеток эндотелия сосудов. При этом пораженные эритроциты прикрепляются к внутренней поверхности стенки кровеносных сосудов и перестают циркулировать в крови. Задержка таких эритроцитов надолго в фиксированном состоянии позволяет паразиту проходить эритроцитарную стадию развития без риска быть уничтоженным в селезенке. Плазмодий подавляет иммунную систему хозяина, повреждая Г-лимфоциты и приводя к ослаблению экспрессии генов CD3/TCR-комплекса хозяина.
Из части мерозоитов в эритроцитах образуются незрелые половые клетки - мужские и женские гаметоциты. Они являются инвазионной стадией для комара. Дальнейшее их развитие возможно только в его пищеварительной системе. При укусе больного человека комаром гаме-тоциты попадают в желудок последнего, где из них образуются зрелые гаметы. В результате оплодотворения в желудке комара образуется подвижная зигота, которая перемещается на наружную поверхность стенки желудка и покрывается оболочкой, формируя ооцисту. С этого момента начинается период спорогонии, когда содержимое ооцисты многократно делится, образуя около 10 тыс. спорозоитов - тонких серповидных клеток, которые после разрыва оболочки поступают в слюнные железы комара. Нахождение огромного числа спорозоитов плазмодия в слюнных железах и передней кишке комара приводит к тому, что комар может одномоментно всосать лишь небольшое количество крови. Это вынуждает его несколько раз менять хозяев-прокормителей, что повышает вероятность заражения малярией большего числа людей.
При кровососании спорозоиты поступают в кровяное русло человека.
Естественный отбор приводит к возникновению новых антигенных вариантов возбудителя, которые обеспечивают возможность наступления рецидивов заболевания. Рецидивы могут повторяться несколько раз, но постепенно популяция эритроцитарных паразитов полностью погибает. Однако в течение 3-5 лет инвазия может вновь активизироваться за счет находящихся в латентном состоянии в печени экзоэри-троцитарных шизонтов, которые могут выходить из печеночных клеток и внедряться в эритроциты. Таким образом, весь процесс болезни может начаться снова.
При малярии, вызываемой P. malariae, приступы повторяются через 72 ч. Часто встречается и бессимптомное носительство. Экзоэритроци-тарной стадии в цикле развития этого паразита нет, поэтому поздние рецидивы невозможны, хотя инвазия характеризуется упорным течением и длится до 40 лет.
При тропической малярии вначале приступы развиваются через разные промежутки времени, а позже - через 24 ч. От осложнений со стороны центральной нервной системы или почек возможна смерть больного. Шизонты в клетках печени не сохраняются, а заболевание может продолжаться до 18 мес.
Все виды малярийных плазмодиев могут инвазировать человека и при гемотрансфузии (переливание крови). В этом случае ни у одного из паразитов не формируется экзоэритроцитарной стадии. Поэтому поздних рецидивов в этом случае не бывает. Гемотрансфузионный способ заражения чаще всего встречается при четырехдневной малярии в связи с тем, что при этой форме болезни шизонты в эритроцитах находятся в очень малом количестве и могут не обнаруживаться при исследовании крови доноров.
Заражение малярией может происходить и трансплацентарно, когда от больной матери заражается плод. Не исключается и возможность заражения при использовании нестерилизованных хирургических инструментов и шприцов.
Иногда человек может быть инвазирован одновременно двумя или тремя видами плазмодиев. В таком случае малярийные приступы не имеют четкой периодичности и клинический диагноз затруднен.
Лабораторный диагноз малярии можно поставить только в период, соответствующий стадии эритроцитарной шизогонии, когда в крови удается обнаружить паразитов.
Плазмодий, недавно проникший в эритроцит, имеет кольцевидную форму. Его цитоплазма выглядит как ободок, окружающий крупную вакуоль с продуктами диссимиляции. Ядро паразита смещено к краю клетки. Следующая стадия называется амебовидным шизонтом. У паразита появляются ложноножки, а вакуоль увеличивается. Наконец плазмодий занимает почти весь эритроцит. Следующая стадия развития паразита - фрагментация шизонта. На фоне деформированного эритроцита обнаруживаются множественные мерозоиты, в каждом из которых лежит ядро. Кроме бесполых клеток в эритроцитах можно увидеть и гаметоциты. Они отличаются крупными размерами, не имеют псевдоподий и вакуолей (рис. 19.11).
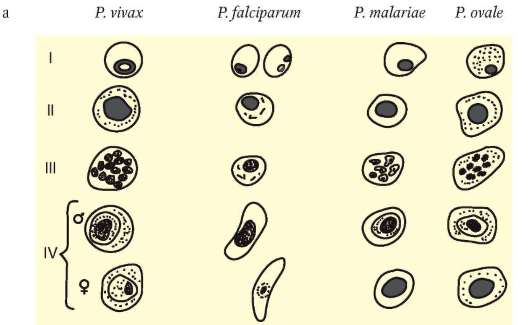
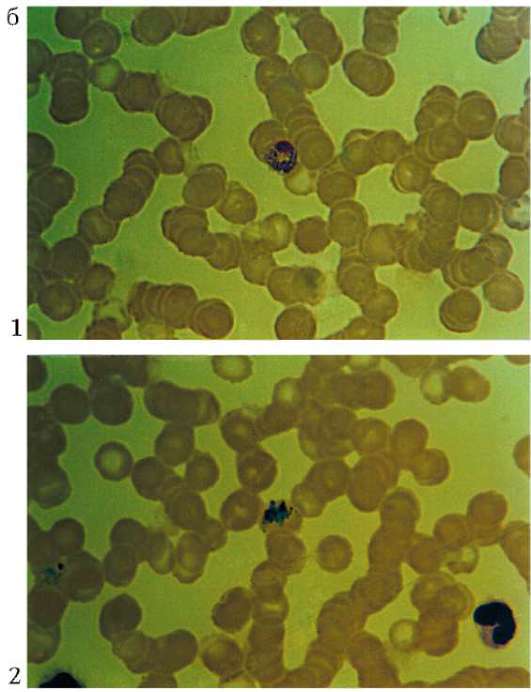
Рис. 19.11. а - малярийные плазмодии (схема). Стадии развития в эритроцитах: I - стадия кольца; II - стадия амебовидного шизонта; III - стадия фрагментации; IV- гаметоциты; б - малярийные плазмодии в мазках крови: 1 - Plasmodium vivax, гамето-цит; 2 - P. vivax, стадия фрагментации
Профилактика малярии - раннее выявление и лечение больных, профилактическое лечение в зонах широкого распространения малярии. Как и при любых трансмиссивных заболеваниях, необходима прицельная борьба с переносчиками.
Малярия в разных ее формах - крайне тяжелое заболевание. Она является фактором естественного отбора в человеческих популяциях, обитающих в пределах ареала расселения плазмодиев. Выживание человека в этих зонах сопровождалось закреплением и повышением популяци-онной частоты аллелей, снижающих вероятность попадания паразитов в эритроциты или не допускающих возможности их размножения в организме хозяина. Именно поэтому в зонах расселения этих паразитов наиболее часто встречаются различные заболевания из группы гемогло-бинопатий (см. также п. 12.2.5, рис. 12.9).
Малярией в настоящее время на Земле страдают около 270 млн человек.
19.4. ПРОСТЕЙШИЕ - ФАКУЛЬТАТИВНЫЕ ПАРАЗИТЫ ЧЕЛОВЕКА
В 1965 г. в Австралии впервые были выявлены случаи заболеваний, вызываемых свободноживущими почвенными амебами, и с тех пор они регистрируются во многих странах. В большинстве случаев эти заболевания диагностируются только после смерти больных на основе гистологического исследования тканей, в которых обнаруживаются эти простейшие.
Крайняя тяжесть заболеваний, вызываемых этими амебами, объясняется тем, что паразитический образ жизни для них не обязателен. Поэтому как у амеб, так и у человека на протяжении эволюции не возникло взаимных адаптации, в связи с чем система «паразит-хозяин» неустойчива.
Среди амеб этой группы наиболее известны представители родов Naegleria и Acanthamoeba (рис. 19.12).
Амебы p. Naegleria в организм человека попадают при купании в загрязненной воде через носовую полость и проникают в мозговые оболочки. Здесь амебы размножаются и вызывают острый менингоэн-цефалит, который почти всегда заканчивается смертью. Наиболее часто поражаются дети.
Амебы p. Acanthamoeba образуют устойчивые цисты, которые попадают в организм человека не только через носоглотку и пищеварительную систему, но и при вдыхании, а также через травмированную кожу и
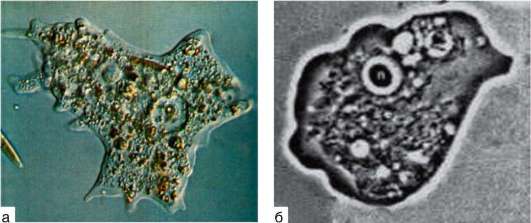
Рис. 19.12. Факультативные паразиты человека: а - Acanthamoeba sp.; б - Naegleria sp.
роговицу. Заболевание проявляется по-разному в зависимости от путей попадания возбудителя в организм. Характерно образование гранулем, содержащих амеб. У ослабленных больных и детей заболевание часто заканчивается менингоэнцефалитом и летальным исходом.
Вопросы для самоконтроля
1. Характеристика и классификация типа Простейшие.
2. Особенности паразитирования простейших в зависимости от их локализации в организме хозяина.
3. Простейшие, обитающие в полых органах. Пути заражения, меры профилактики.
4. Простейшие, обитающие в тканях. Пути заражения, меры профилактики.
5. Особенности географического распространения паразитических простейших и соответствующих паразитарных заболеваний.