Клиническая генетика : учебник / Н. П. Бочков, В. П. Пузырев, С. А. Смирнихина ; под ред. Н. П. Бочкова. - 4-е изд., доп. и перераб. - 2011. - 592 с. : ил.
|
|
|
|
Глава 8. ФАРМАКОГЕНЕТИКА
ОБЩИЕ ВОПРОСЫ
Фармакогенетика изучает индивидуальные различия в ответах на лекарства, обусловленные аллельными вариациями в генах, определяющих метаболизм лекарства, эффективность и токсичность. Это направление как раздел экологической медицинской генетики и клинической фармакологии зародилось в результате практической потребности разобраться в осложнениях лекарственного лечения. Клиническая фармакология накапливала наблюдения патологических реакций на лекарства, а медицинская генетика расшифровывала механизмы их возникновения.
Врач сталкивается с повышенной чувствительностью индивида к лекарству, похожей на передозировку, хотя больному назначена доза, соответствующая его возрасту и полу; с частичной или полной толерантностью больного к лекарству, даже несмотря на увеличение дозы; с парадоксальными реакциями на лекарство, включающими совсем другие осложнения, чем те, которые могли бы быть обусловлены механизмами действия лекарства.
Основные положения фармакогенетики были сформулированы в 1950-1970 гг. Термин «фармакогенетика» был введен в 1958 г. немецким ученым Ф. Фогелем. Развитие фармакогенетики основывалось на регистрации нежелательных лекарственных реакций с их анализом сначала клинико-генеалогическим и близнецовым методами, а в последующем - молекулярно-генетическим. При этом изучался не только конечный патологический фенотип, но и биохимические ступени метаболизма лекарства, что давало возможность понять сущность нежелательных лекарственных реакций и их ключевые точки.
Генетическое разнообразие человека - основа индивидуальных различий биотрансформации ксенобиотиков, к которым и относятся лекарства (см. гл. 7). Следовательно, теоретической базой фармакогенетики является функциональная геномика человека, а именно сведения о полиморфизме генов, вовлеченных в биотрансформацию лекарств и в генетический контроль их взаимодействия. Таким обра-
зом, основная задача фармакогенетики - изучение аллельных вариантов генов, определяющих индивидуальные особенности фармакокинетических и фармакодинамических характеристик организма.
Расшифровка генома человека и прогресс фармакологии выдвинули фармакогенетику на одно из первых мест в персонализированной медицине (индивидуализированное лечение).
Индивидуальные вариации в ответе на лекарства осуществляются двумя путями. Во-первых, за счет фармакокинетических процессов (всасывания, транспортировки, метаболизма и выведения лекарства или метаболитов). Во-вторых, за счет фармакодинамики лекарства. Вследствие аллельных вариаций наблюдаются различия в мишенях (рецепторах, энзимах) или метаболических путях. Таким образом, говоря обобщенно, фармакогенетика изучает любые генетически детерминированные вариации в ответе на лекарства в отношении эффективности и токсичности.
Для понимания фармакогенетических закономерностей необходимо усвоить принципы биотрансформации (детоксикации) ксенобиотиков, изложенные в главе 7.
Все ступени биотрансформации лекарственных средств осуществляются соответствующими ферментами и белками. Список основных из них представлен в табл. 8.1.
Таблица 8.1. Ферменты и белки биотрансформации лекарственных средств
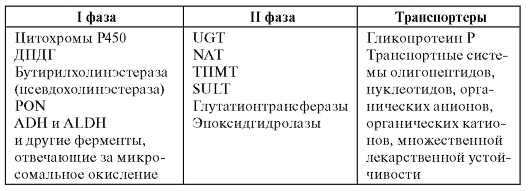
Примечание. ДПДГ - дигидропиримидиндегидрогеназа. SULT - сульфотрансфераза.
Генетический полиморфизм определяет три главных фенотипа метаболизаторов (лиц, принимающих лекарства): экстенсивные, медленные и быстрые.
Экстенсивные метаболизаторы - индивиды с нормальной скоростью метаболизма рассматриваемых лекарственных средств. К этой группе принадлежит большинство населения. Они являются чаще всего гомозиготами по «дикому» аллелю соответствующего фермента.
Медленные метаболизаторы (иногда нулевые) характеризуются сниженной скоростью метаболизма рассматриваемого лекарственного средства. С генетической точки зрения они являются гомозиготами (при аутосомно-рецессивном типе наследования) или гетерозиготами (при аутосомно-доминантном типе наследования) по мутантному («медленному») аллелю соответствующего фермента. У таких лиц синтез фермента отсутствует или синтезируется неактивный («дефектный») фермент, в результате чего лекарственное средство накапливается в высоких концентрациях, что и приводит к появлению нежелательных побочных реакций. Отсюда ясно, что для медленных метаболизаторов доза лекарства должна быть меньшей или назначают другое лекарство.
Быстрые (или сверхактивные) метаболизаторы характеризуются повышенной скоростью метаболизма определенных лекарств. В основном это гомозиготы (при аутосомно-рецессивном типе наследования) или гетерозиготы (при аутосомно-доминантном типе наследования) по «быстрому» аллелю соответствующего фермента. Достаточно часто встречаются индивиды с копиями функциональных аллелей, что также приводит к повышенному метаболизму лекарства. Быстрый метаболизм лекарства не позволяет при стандартных дозах достичь его терапевтической концентрации в крови, поэтому доза лекарства для быстрых метаболизаторов должна быть выше, чем для нормальных метаболизаторов.
ФАРМАКОГЕНЕТИЧЕСКИЕ ЗАКОНОМЕРНОСТИ
I ФАЗЫ БИОТРАНСФОРМАЦИИ
Наибольшее значение в вариациях фармакокинетических реакций имеет цитохром Р450, обеспечивающий I фазу метаболизма лекарств. Цитохром Р450 - большое семейство из 56 дифференциально функциональных ферментов, каждый из которых кодируется отдельным геном CYP. С фармакогенетической точки зрения особенно важны шесть генов - CYP1A1, CYP1A2, CYP2C9, CYP2C19, CYP2D6 и CYP3A4. Они ответственны за I фазу биотрансформации 90% широко распро-
страненных лекарств. Например, CYP3A4 вовлечен в метаболизм более 40% всех лекарств, используемых в клинической медицине, а CYP2D6 метаболизирует более 70 различных лекарств. Вполне понятно, что все вариации в метаболизме обусловлены аллелями с различной функциональной значимостью. Есть аллели, повышающие метаболизм, другие понижают его, а третьи вообще не участвуют в биотрансформации. В таблице 8.2 приведены избранные примеры полиморфных генов цитохрома Р450, участвующих в метаболизме лекарств.
Таблица 8.2. Примеры генов цитохрома Р450, вовлеченных в метаболизм лекарств
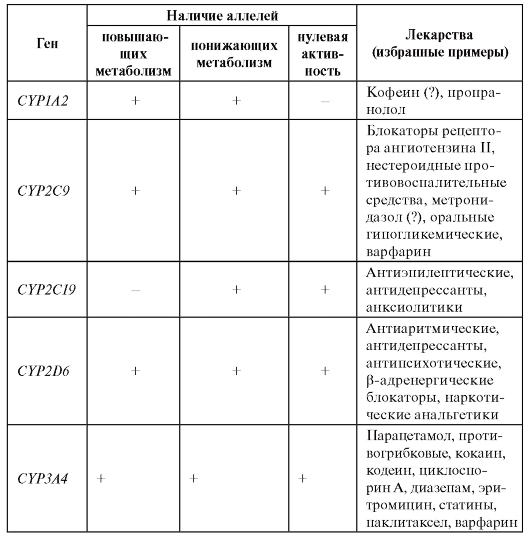
Более подробные сведения о семействе цитохрома Р450 и биотрансформации лекарств представлены в книге В.Г. Кукеса, Н.П. Бочкова «Клиническая фармакогенетика», гл. 2.
Генетические вариации в I фазе биотрансформации отмечены по следующим ферментам - ДПДГ, PON, псевдохолинэстеразе (бутирилхолинэстеразе), ADH, ALDH.
ДПДГ отвечает за восстановление урацила и тимидина, а также метаболизирует фторурацил, применяемый в составе комбинированной химиотерапии злокачественных новообразований многих органов. Низкая активность ДПДГ - причина осложнений лечения фторурацилом. Эта особенность наследуется по аутосомно-рецессивному типу. Молекулярно-генетическими исследованиями выявлены мутации в гене, кодирующем синтез ДПДГ, наличие которых приводит к сниженной активности фермента и, следовательно, к повышенной чувствительности к фторурацилу. Распространенность мутантных гомозигот определена только в Японии. Она составляет 1:10 000 населения. Гетерозиготы, по-видимому, также имеют сниженный уровень ферментов. Современные представления о генетическом полиморфизме ДПДГ позволяют рекомендовать внедрение фено- и генотипирования этого фермента в генетическую практику.
PON - фермент из группы арилэстераз - метаболизирует фосфорорганические антихолинэстеразные соединения (параоксон, метифосфакол, дихлорвос, зарин, табун и др.), эфиры уксусной кислоты (фенилацетат, тиофенилацетат, венилацетат и др.), органофосфорные соединения (EPN-оксон, этилнитрофенилэтилфосфонат), карбаматы (севин, N-диметилкарбамилфлуорид). Генетический полиморфизм PON не вызывает сомнений. Из известных 3 изоформ PON наиболее важным с фармакогенетической точки зрения является PON1. Мутация в этом гене (Gln192Arg) ведет к повышенной чувствительности к фосфорорганическим соединениям. Распространенность этой мутации достаточно высокая: среди испанского населения - 16%, североевропейского - 9%, японского - 41,4%. Именно высокой частотой мутации у японского населения объясняется большое число жертв после применения зарина при террористическом акте в токийском метро в 1995 г.
Псевдохолинэстераза (бутирилхолинэстераза) катализирует реакцию гидролиза ацетилхолина. В фармакогенетике этот фермент давно уже известен в связи с его участием в гидролизе деполяризующего миорелаксанта суксаметония, широко применяющегося в
анестезиологии. В гене бутирилхолинэстеразы (аномальной псевдохолинэстеразы) обнаружено несколько мутаций, которые ведут к синтезу фермента со сниженной активностью, а это приводит к продолжительной остановке дыхания (апноэ) при применении суксаметония (вместо 2-3 мин - 2 ч и более). Наследуется эта аномальная реакция по аутосомно-рецессивному типу. Повышенная чувствительность к суксаметонию наблюдается у гомозигот. Разные мутации этого гена ведут к апноэ разной длительности, и гомозиготы встречаются с разной частотой (от 1 : 3000 до 1 : 150 000). Частота гомозигот по всем мутантным аллелям, определяющим сниженную активность бутирилхолинэстеразы, согласно литературным данным, следующая: у европейцев - 1 : 2500, у чехов и словаков - 1 : 400, у жителей Ирана и Ирака - 1 : 400. Распространенность гетерозигот следующая: у европейцев 2-4 : 100, у чехов и словаков - 7 : 100, у жителей Ирана и Ирака - 10 : 100.
Профилактика осложнений, вызываемых мутантными формами псевдохолинэстеразы, может осуществляться путем фенотипирования с помощью так называемого дибукаинового теста или путем генотипирования, поскольку структура гена и мутаций хорошо изучена. Генетическая и биохимическая расшифровка данного фармакогенетического варианта позволяет точно выявить лиц с повышенной чувствительностью к суксаметонию и обеспечить безопасность его применения.
ADH экспрессируется в печени и является ключевым ферментом в окислении этанола и других спиртов до альдегидов. Ген этого фермента хорошо изучен, особенно его полиморфный вариант G141A. Следовательно, возможна и его ПЦР-диагностика. Аллель А обусловливает повышенную активность фермента, что ведет к накоплению альдегидов (весь алкоголь «перерабатывается»), которые обладают выраженным токсическим эффектом. Такие индивиды имеют резко повышенную чувствительность к этиловому спирту и поэтому менее подвержены алкоголизму. Даже небольшие дозы алкоголя ведут к сильнейшему отравлению.
ALDH экспрессируется в печени в двух формах: ALDH-1 (цитозольная) и ALDH-2 (митохондриальная). С генетической точки зрения лучше изучен ген ALDH-2, мутации в котором ведут к алкогольной интоксикации. Фермент ALDH-2 вовлечен в патогенез различных злокачественных новообразований, связанных со злоупотреблением алкоголем. Распространенность мутантных форм ALDH-2 очень высо-
кая среди населения монголоидной расы (до 50%). Молекулярногенетическая диагностика гетеро- и гомозигот по патологическим мутациям возможна.
ФАРМАКОГЕНЕТИЧЕСКИЕ ЗАКОНОМЕРНОСТИ II ФАЗЫ БИОТРАНСФОРМАЦИИ
Во II фазе биотрансформации лекарственных средств осуществляется конъюгация их или их метаболитов с эндогенными веществами с образованием гидрофильных конъюгатов.
Глюкуронирование является наиболее важной реакцией II фазы метаболизма лекарств. К лекарственному средству присоединяется УДФ за счет катализа с помощью ферментов [УДФ- глюкуронилтрансферазы (UGT)], включающих два семейства и более 20 изоферментов. Они катализируют большое число лекарств (морфин, хлорамфеникол, парацетамол и др.), их метаболитов, гормонов, пестицидов, канцерогенов. Физиологической функцией UGT является глюкуронирование эндогенных соединений (например, билирубина). Глюкуронированию подвергаются лекарственные средства из следующих групп:
• фенолы (пропофол, парацетамол);
• спирты (хлорамфеникол, кодеин, оксазепам);
• алифатические амины (ламотриджин, амитриптилин);
• карбоновые кислоты (фенилбутазон и др.);
• карбоксильные кислоты (напроксен, кетопрофен).
Наследственное нарушение глюкуронирования билирубина наблюдается при синдромах Жильбера и Криглера-Найяра. Мутации в гене UGT1 приводят к синтезу UGT с активностью на 25-30% меньшей по сравнению с нормой, поэтому у больных с синдромом Жильбера наблюдается снижение клиренса толбутамида, парацетамола, рифампицина. Другие генетические полиморфизмы (мутации) генов, кодирующих разные изоформы UGT, влияют на фармакокинетику и фармакодинамику лоразепама, морфина, карведилола и других лекарств. Исследование полиморфизма гена UGT1A1 разрешено в США для коррекции терапии иринотеканом (высокоэффективным цитостатиком) с целью профилактики развития гипербилирубинемии.
Ацетилирование. Эта реакция осуществляется двумя NAT (NAT1 и NAT2). NAT1 не обладает генетическим полиморфизмом, а для NAT2,
напротив, важная роль в фармакогенетике хорошо доказана. Ген локализован в хромосоме 8р23, известно более 20 мутантных аллелей. В зависимости от активности фермента NAT2 все люди разделяются на «быстрых», «промежуточных» и «медленных» ацетиляторов. Впервые фармакогенетические закономерности NAT2 были установлены в 1960-е годы на примере лечения изониазидом больных туберкулезом. У «медленных» ацетиляторов обнаруживается повышенная чувствительность не только к изониазиду, но и к сульфаниламидам, ариламинам, гидразинам, к некоторым антиаритмическим и другим препаратам. Механизм токсического действия препаратов связан с медленным выведением лекарств из-за сниженной скорости ацетилирования, а следовательно, и выведения препарата. Происходит накопление препарата (рис. 8.1).
Распространенность «медленных» ацетиляторов составляет 10-15% у монголоидного населения и почти 50% у населения европеоидной расы. Помимо ассоциации полиморфизма гена NAT2 с неблагоприятными побочными эффектами лекарств, обнаружена также связь с различными многофакторными заболеваниями. Частота рака мочевого пузыря в 2-3 раза выше у «медленных» ацетиляторов, чем у «быстрых», а среди последних почти в 2 раза чаще встречается колоректальный рак.
S-метилирование. Реакцию S-метилирования катализирует фермент ТПМТ. Это основной путь метаболизма эффективных цито-
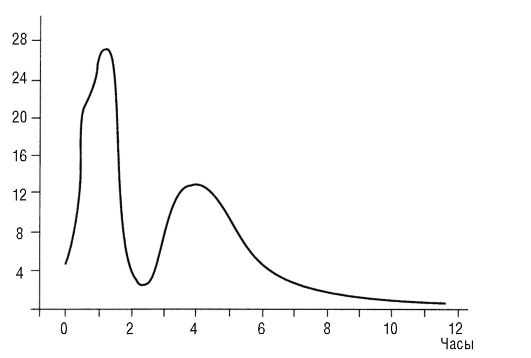
Рис. 8.1. Распределение индивидов по скорости ацетилирования изониазида: по оси абсцисс - время после введения, часы; по оси ординат - число лиц
статиков (меркаптопурина, азатиоприна и тиогуанина). Ген TPMT хорошо изучен (локализован в хромосоме 6q22.3). Хотя низкая эффективность ТПМТ наследуется по аутосомно-рецессивному типу, повышенная чувствительность к тиопуринам отмечается не только у гомозигот, но и у гетерозигот. Известно уже 8 различных аллелей, кодирующих фермент с низкой активностью, что ведет к нарушению метаболизма меркаптопурина. При наличии таких аллелей требуется снижение стандартной дозы цитостатика в 2-4 раза.
Распространенность гомозигот по всем аллельным вариантам гена TPMT среди европейского и афроамериканского населения составляет 4-5%. Безопасные дозы меркаптопурина для пациентовгомозигот по мутантным аллелям в 10-15 раз ниже среднетерапевтических, для гетерозигот - в 2-4 раза. Для обеспечения безопасности химиотерапии меркаптопурином (острый лимфобластный лейкоз, лимфомы) необходимо проводить фенотипирование (активность TPMT в эритроцитах) или генотипирование на мутантные варианты гена TPMT. В клиниках Европы и США одна из этих процедур типирования является обязательной перед началом лечения.
Сульфатирование. В организме человека сульфатированию подвергаются фенолы (экзогенные), гормоны щитовидной железы, катехоламины, некоторые стероидные гормоны. Идентифицировано 40 изоферментов SULT, которые кодируются 10 генами. С фармакогенетической точки зрения наибольший интерес представляют две формы изофермента. SULT1A1 метаболизирует парацетамол, морфин, продукты распада лидокаина, эстрадиол и другие лекарственные препараты фенольной структуры. Субстратами SULT1A3 являются допамин, серотонин, норэпинефрин и некоторые другие соединения. Хотя обнаружен широкий генетический полиморфизм SULT, данных об ассоциации полиморфизмов генов этих ферментов с дозами соответствующих лекарственных препаратов пока не выявлено.
Водная конъюгация. Эту реакцию, важнейшую в детоксикации большого количества ксенобиотиков, катализирует фермент эпоксидгидроксилаза (EPAX). Известны две его изоформы и их гены. Большая часть водной конъюгации токсических метаболитов лекарственных препаратов (например, фенитоина) осуществляется с помощью EPAX1. Обнаружен генетический полиморфизм EPAX1. Точечная мутация является причиной снижения активности фермента (меньше 30% от нормы), что ведет к повышенному риску врожденных пороков развития, если женщина во время беременности принимает фенитоин. Медленный аллель mEPHX1
встречается примерно у 6% европейского населения. У носителей мутаций нарушен процесс окисления ксенобиотиков. Выявлена ассоциация этого аллеля с заболеваниями органов дыхания, особенно у курильщиков (рак, эмфизема, обструктивные пневмонии), а также с нарушениями в репродуктивной системе (спонтанные аборты, рак яичников).
Конъюгация с глутатионом. Среди лекарственных препаратов конъюгации с глутатионом подвергаются этакриновая кислота и гепатотоксический метаболит парацетамола - N-ацетилбензохинонимин, превращающиеся в нетоксические соединения. Конъюгацию с глутатионом катализируют ферменты глутатион-S-SН-трансферазы (GST). Выделено пять изоферментов GST, ген GSTM1 принимает важнейшее участие в инактивации канцерогенов. Распространенность носителей нулевого аллеля, у которых отсутствует экспрессия GSTM1, составляет 40-45% у европейского населения и 60% - у негроидного.
Ассоциации между аллельными вариантами генов и изменениями фармакологического ответа представлены в табл. 8.3.
Таблица 8.3. Ассоциации между аллельными вариантами генов глутатион-S- SH-трансфераз и изменениями фармакологического ответа (по Кукесу В.Г. и Бочкову Н.П., 2007)
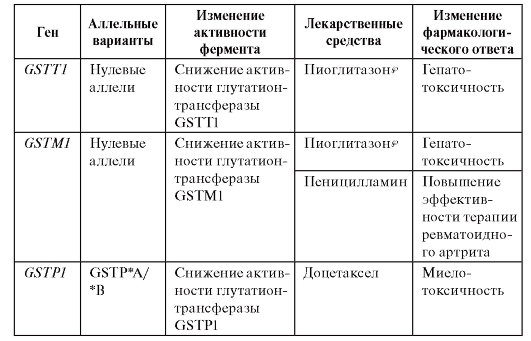
Глутатионопосредованная детоксикация имеет важнейшее значение в сохранении резистентности клеток к перекисному окислению липидов, алкилированию белков, освобождению от свободных радикалов, а также она предотвращает поломки ДНК. Таким образом, глутатион-D-SН-трансферазы прежде всего представляют интерес с экотоксикологической точки зрения (см. гл. 7). Их значение в фармакогенетике требует дальнейшего изучения.
ФАРМАКОГЕНЕТИЧЕСКИЕ ЗАКОНОМЕРНОСТИ
ТРАНСПОРТА ЛЕКАРСТВЕННЫХ СРЕДСТВ (III ФАЗА БИОТРАНСФОРМАЦИИ)
Ферменты, обеспечивающие фармакокинетические функции всасывания, распределения и выведения из организма лекарственных средств, называют «транспортерами лекарств». К ним относятся гликопротеин Р, транспортеры органических анионов и катионов и др. Характеристика основных транспортеров лекарственных средств (название, локализация, функция, лекарственные средства и их метаболиты-субстраты, ингибиторы, индукторы) представлена в книге В.Г. Кукеса и Н.П. Бочкова (с. 218-226).
Наибольший интерес с фармакогенетической точки зрения представляет полиморфизм гена MDR1, кодирующий гликопротеин Р (локус 7q21.1). Этот фермент контролирует выброс различных ксенобиотиков из клетки, препятствует всасыванию лекарственных средств из кишечника. Субстратами гликопротеина Р являются сердечные гликозиды, блокаторы медленных кальциевых каналов, статины, макролиды, цитостатики, противовирусные препараты. Полный перечень субстратов, индукторов и ингибиторов гликопротеина Р представлен в книге В.Г. Кукеса и Н.П. Бочкова (с. 214-217).
Четыре ОНП гена MDR1 изучены детально (табл. 8.4).
Таблица 8.4. Полиморфные маркеры гена, кодирующего гликопротеин Р

Окончание таблицы 8.4

Наиболее значимой мутацией гена MDR1 является С3435Т. Замена цитозина на тимин в 26-м экзоне ведет к серьезному нарушению функции гликопротеина Р, что может быть причиной тяжелой интоксикации в случае применения многих лекарств. Частота аллелей и генотипов по полиморфному аллелю С3435Т значительно варьирует в разных этнических группах, в том числе на территории РФ.
Хотя многое из фармакогенетики гликопротеина Р еще требует клинической проверки, но на основании уже проведенных исследований обнаружены ассоциации полиморфных маркеров с изменением фармакологического ответа на многие лекарства. Эти результаты представлены в табл. 8.5 (по В.Г. Кукесу и Н.П. Бочкову).
Таблица 8.5. Ассоциации между носительством генотипов по полиморфным вариантам гена MDR1, кодирующим гликопротеин Р, и изменением фармакологического ответа
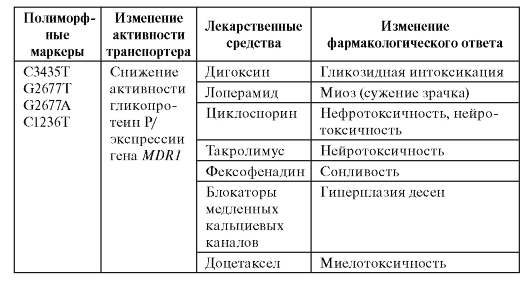
Окончание таблицы 8.5
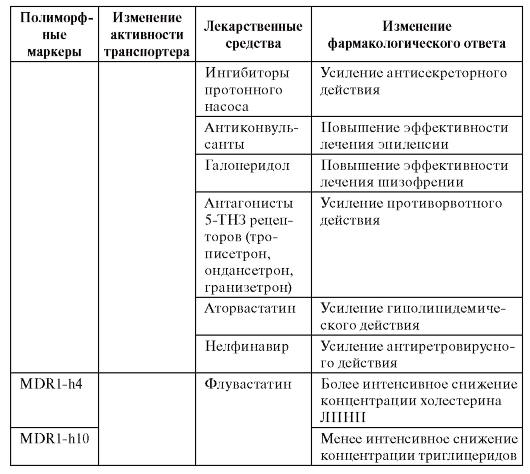
Отсюда следуют приведенные ниже практические рекомендации фармакологов клиницистам при обнаружении у пациента полиморфного маркера (Сычев Д.А. и др., 2007):
• следует снижать дозу лекарств-субстратов гликопротеина Р с узкой терапевтической широтой (дигоксин, циклоспорин);
• не следует применять лекарства-субстраты гликопротеина Р, нежелательные лекарственные реакции которых связаны с их проникновением через гистогематические барьеры (фексофенадин, лоперамид);
• назначать препараты с низкой биодоступностью, так как они могут оказаться у лиц с мутациями наиболее эффективными (статины, ингибиторы ВИЧ-протеиназы);
• назначать препараты, мишени которых расположены в ЦНС, а проникновение через гематоэнцефалический барьер затруднено, так как у этой категории они могут оказаться наиболее эффективными (противосудорожные, галоперидол).
Исходя из вышеизложенных сведений о генетическом полиморфизме гликопротеина Р, необходимость их использования для индивидуализации лечения не вызывает сомнений.
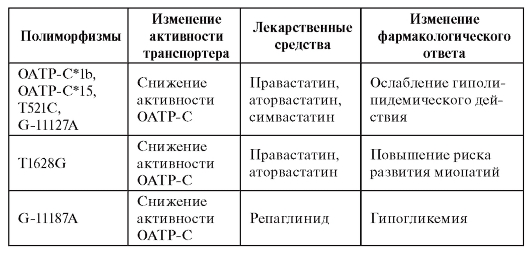
К транспортерам лекарственных средств также относятся трансмембранные белки - транспортеры органических анионов и катионов. К субстратам этих транспортеров относятся широко применяемые лекарства (антибиотики, диуретики, противовирусные, противоопухолевые средства, статины). Ассоциации между носительством аллельных вариантов гена OATP-C (органический анионтранспортирующий полипептид С) и неблагоприятным фармакологическим ответом представлены в табл. 8.6 (по Кукесу В.Г. и Бочкову Н.П., 2007).
Таблица 8.6. Ассоциации носительства генотипов гена OATP-C с изменением фармакологического ответа
В фармакокинетике (всасывание, распределение, выведение) лекарственных средств принимают участие и другие транспортеры (олигопептидов, нуклеозидов, множественной лекарственной устойчивости), генетический полиморфизм которых в настоящее время интенсивно изучается.
Более подробную информацию о фармакогенетике препаратов для лечения сердечно-сосудистых заболеваний и антитромботиче-
ских препаратов можно посмотреть в статьях В.В. Ляхович с соавт. «Основы фармакогенетики в клинике сердечно-сосудистых заболеваний» и О.В. Сироткиной с соавт. «Фармакогенетика антитромботических препаратов» на компакт-диске.
ФАРМАКОДИНАМИКА И ГЕНЕТИЧЕСКИЙ
ПОЛИМОРФИЗМ
Мутации в генах, кодирующих белки-мишени для лекарственных средств (рецепторы, ферменты, ионные каналы), ведут к изменениям фармакологического ответа. Эти генетические полиморфизмы активно изучаются и сведения о них уже применяются в клинической практике. Перечислим некоторые из наиболее изученных полиморфизмов (табл. 8.7).
Таблица 8.7. Примеры аномальных ответов у носителей мутаций в фармакодинамических реакциях
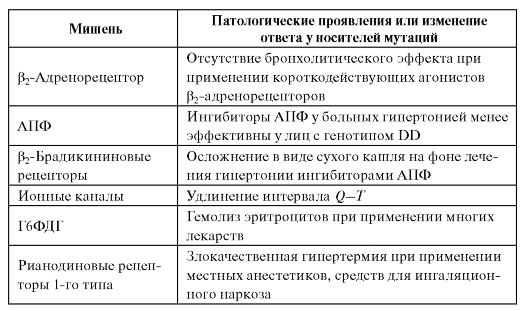
Примечание. АПФ - ангиотензинпревращающий фермент.
Таким образом, генетический полиморфизм играет существенную роль в вариациях фармакодинамических процессов.
ЗАКЛЮЧЕНИЕ
Как известно, судьба лекарств в организме определяется всасыванием, распределением (по органам, клеткам, органеллам), взаимодействием с клеточными элементами, метаболизмом и выведением. Все ступени кинетики лекарства и динамики его действия осуществляются с помощью специфических и неспецифических ферментов и белков. Учитывая широкий биохимический полиморфизм человеческих популяций, можно предполагать, что судьба каждого лекарства на каком-то фармакокинетическом или фармакодинамическом этапе связана с полиморфной системой фермента, белка, рецептора и других клеточных мишеней. Это и обусловливает весьма разнородные реакции индивидов на лекарства.
С фармакологической точки зрения вариации ответов на лекарства могут быть обусловлены изменением либо метаболизма лекарств в организме, либо динамики их действия (нарушение клеточных мишеней лекарств).
По поводу аномалий метаболизма лекарств (первая группа) можно сказать, что генетическая детерминация ферментов, обеспечивающих метаболизм или фармакокинетику лекарств, не вызывает сомнений. Возникновение мутаций в таких генах приводит к отсутствию синтеза фермента или потере его ферментативной активности. Как правило, эти мутации наследуются по аутосомно-рецессивному типу, поэтому дефект фермента проявляется только у гомозигот, следовательно, не очень часто, хотя в некоторых популяциях частота мутантного аллеля и соответственно частота лиц с патологической реакцией на лекарства могут быть высокими.
Вторая группа неадекватных реакций на лекарства - это фармакологические эффекты через взаимодействие с белками-мишенями, такими, как рецепторы, ферменты, белки сигнальной трансдукции, контроля клеточного цикла и других событий. Молекулярно-генетическими исследованиями показано, что многие гены, кодирующие такие лекарственные мишени, полиморфны. Их мутантные формы приводят соответственно к нарушению специфических взаимодействий лекарства и мишени, а отсюда и к аномальной реакции на уровне организма.
Во многих работах показано, что судьба большинства лекарств определяется функционированием нескольких взаимодействующих генов, поэтому кривые распределения индивидов в зависимости от концентрации лекарств в крови при введении стандартной дозы соответствуют кривым полигенного наследования (рис. 8.2).
В этих случаях фармакогенетический подход мало применим для индивидуализации лекарственной терапии.
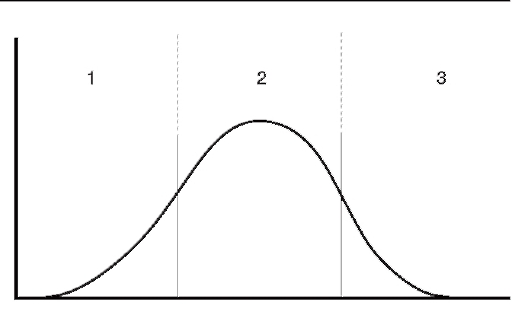
Рис. 8.2. Распределение индивидов по концентрации лекарства в плазме крови после введения стандартной дозы при полигенной детерминации: по оси абсцисс - условная концентрация вещества в плазме; по оси ординат - условное число лиц; 1 - отсутствие эффекта от лекарства; 2 - оптимальный эффект; 3 - токсический эффект
Как было показано в данной главе, число генов, мутации в которых ведут к фармакогенетическим последствиям, достаточно большое, и перечень их постоянно пополняется. Патологические реакции на лекарства касаются разных функций и систем организма при разных заболеваниях. Следовательно, ознакомление с фармакогенетикой необходимо врачу любой специальности. Знание фармакогенетических особенностей обеспечит лучшую
эффективность и большую безопасность назначаемой лекарственной терапии. Однако для этих целей необходима разработка недорогих, быстрых, адаптированных к клинической практике методов тестирования аллельных вариантов соответствующих генов (генотипирование) или концентрации лекарств (фенотипирование).
Что касается методов генотипирования, то в их основе лежит ПЦР-реакция, а современные разработки по созданию биочипов делают реальным и доступным обследование пациента на фармакогенетические варианты в еще более широком масштабе. В онкологической практике во многих странах используются биочипы для тестирования пациентов с повышенным риском токсичности цитостатических препаратов на основе меркаптопурина. В США применяется несколько фармакогенетических тестов для индивидуализации выбора лекарственных средств и их доз (антидепрессантов, нейролептиков, меркаптопурина, варфарина и других лекарств).
Безусловно, в некоторых случаях практичнее ориентироваться на методы фенотипирования ферментов и продуктов биотрансформации (изониазидовый тест, антипириновый тест, дибукаиновый тест).
В заключение следует подчеркнуть, что фармакогенетика решает не все проблемы персонализации лекарственной терапии. Анализ ситуации на сегодня показывает, что предсказательным гено- и феноти-
пированием может быть обеспечено примерно 15-20% случаев индивидуального подбора лекарств или их доз, что позволяет избежать нежелательных лекарственных реакций. Для 15-40% случаев анализ генетического полиморфизма имеет меньшее значение из-за полигенного влияния на исход лекарственного лечения, а для 50% пациентов фармакогенетический подход никак не будет влиять на подбор лекарств, потому что другие физиологические и средовые факторы влияют сильнее, чем наследственные.
КЛЮЧЕВЫЕ СЛОВА И ПОНЯТИЯ
Ацетилирование Белки-мишени Водная конъюгация
Генетические основы фармакодинамики Генетические основы фармакокинетики Глюкуронирование Конъюгация с глутатионом S-метилирование
Патологические реакции на лекарства
Персонализированная медицина
Субстрат
Сульфатирование
Типы метаболизаторов
Фазы биотрансформации
Фармакогенетика
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Генетический паспорт - основа индивидуальной предиктивной медицины / под ред. В.С. Баранова. - СПб.: Изд-во Н-Л, 2009. - 527 с.
Середенин С.Б. Лекции по фармакогенетике. - М.: МИА, 2004. -
303 с.
Сычев Д.А., Раменская Г.В., Игнатьев И.В., Кукес В.Г. Клиническая фармакогенетика // под ред. В.Г. Кукеса, Н.П. Бочкова: учеб. пос. -
М.: ГЭОТАР-Медиа, 2007. - 245 с.
Сычев Д.А., Савельева М.И., Кукес В.Г. Проблема внедрения фармакогенетики в реальную клиническую практику: Медицинская гентика. - 2008. - № 1. - С. 21-27.