Клиническая генетика : учебник / Н. П. Бочков, В. П. Пузырев, С. А. Смирнихина ; под ред. Н. П. Бочкова. - 4-е изд., доп. и перераб. - 2011. - 592 с. : ил.
|
|
|
|
Глава 11. ПРОФИЛАКТИКА НАСЛЕДСТВЕННОЙ ПАТОЛОГИИ
ГРУЗ НАСЛЕДСТВЕННОЙ ПАТОЛОГИИ В МЕДИЦИНСКОМ И СОЦИАЛЬНОМ АСПЕКТАХ
Каждая семья мечтает иметь здоровых детей. Это становится особенно актуальным после рождения больного ребенка. Уменьшение числа детей в семьях в развитых странах делает чрезвычайно важным оптимальный исход каждой беременности. В этом смысле профилактика наследственных болезней должна занимать ведущее место как в работе врача, так и в системе здравоохранения.
Известно, что вся наследственная патология определяется грузом мутаций, вновь возникающих и унаследованных из предыдущих поколений. Эффекты мутационного процесса для популяций человека выражаются в эволюционно-генетическом, медицинском и социальном аспектах. Эволюционно-генетические последствия мутационного процесса (балансированный полиморфизм, летальность) рассмотрены в гл. 1.
Медицинские последствия мутационного груза - повышенная потребность в медицинской помощи и сниженная продолжительность жизни больных.
Медицинскую помощь лицам с наследственными болезнями в поликлинических условиях оказывают в 5-6 раз чаще, чем людям без такой патологии. В детских больницах общего профиля от 10 до 20% пациентов составляют дети с наследственной патологией, что в 5-10 раз выше частоты таких больных в популяции. Более частое обращение к врачу людей с наследственной патологией вполне понятно, так же как и более длительная их госпитализация. Во-первых, сама болезнь требует большого объема медицинской помощи, а иногда и постоянного лечения. Во-вторых, наследственная болезнь не исключает ожог, травму, инфекционные заболевания. Напротив, они
* Исправлено и дополнено при участии канд. мед. наук Т.И. Субботиной.
возникают чаще, протекают тяжелее и длительнее в связи с меньшими возможностями поддержания биохимического, иммунного и гормонального гомеостаза у больных с наследственной патологией.
В обобщенной форме медицинские последствия врожденных пороков развития и наследственных болезней представлены в табл. 11.1.
Таблица 11.1. Последствия врожденных аномалий различных типов в развитых странах (по материалам Всемирной организации здравоохранения)
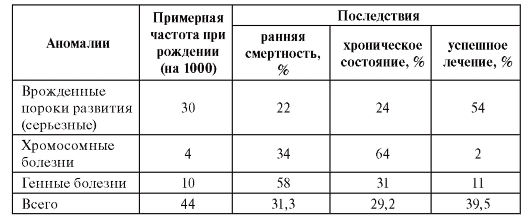
Продолжительность жизни больных с наследственной патологией зависит не только от самой болезни, но и от уровня медицинской помощи. Хотя точные расчеты еще не сделаны, для стран с хорошо развитой системой здравоохранения можно с большой уверенностью полагать, что не менее 50% всех пациентов с наследственными болезнями умирают в детском возрасте. В Канаде проведена комплексная оценка ожидаемой продолжительности жизни для всех больных с наследственной патологией (с разным возрастом начала болезней и разной их тяжестью). Она оказалась на 20 лет меньше средней по стране (50 лет вместо 70).
О социальной и медицинской значимости профилактики наследственных болезней говорят высокий уровень инвалидности больных и экономические затраты на их содержание. В течение многих лет такие больные остаются инвалидами, которые не могут себя обслуживать. В домах-интернатах для детей-инвалидов средние расходы на 1 ребенка в месяц равны среднемесячной зарплате по стране. Такие дети в интернатах живут в среднем до 10 лет. Из 1 млн новорожденных примерно 5000 - кандидаты на многолетнюю тяжелую инвалидность с детства.
Наряду с медицинской и социальной значимостью профилактики наследственных болезней не менее важны психологические аспекты в семье с больным ребенком. Тяжесть и прогредиентность течения болезни создают, как показывают наблюдения, психологическую напряженность даже в очень дружных семьях. Супруги или родственники выясняют (или подозревают), кто виноват в рождении больного ребенка. Члены семьи имеют разное мнение о передаче ребенка в интернат (отказе от ребенка), особенно если он жил с родителями. Постоянный уход за больным ребенком требует больших материальных затрат, моральных и физических сил, что так или иначе ведет к конфликтам. К тревоге за больного ребенка присоединяется страх за возможную болезнь у других детей.
Хотя наследственные болезни, с обывательской точки зрения, встречаются редко, жизнь конкретной семьи концентрируется на больном ребенке.
Наконец, необходимость профилактики наследственных болезней диктуется и популяционными закономерностями их распространения. При улучшении медицинской помощи больные будут не только дольше жить, что автоматически повышает число больных с наследственной патологией в популяции, но и передавать мутации следующим поколениям. Например, за последние 100 лет в Англии повысилась частота мутантного гена, обусловливающего врожденный стеноз привратника. Операция по рассечению мышцы привратника превратила эту аномалию из смертного приговора в рубец на брюшной стенке. Носители мутантного гена (после операции они уже не являются больными в строгом смысле) оставляют потомство, часть которого также имеет мутантный ген, а в популяции дополнительно возникают новые случаи заболевания в результате мутационного процесса.
В связи с планируемым размером семьи (как правило, 1-3 ребенка) разница в числе детей у здоровых и наследственно отягощенных супругов во многом нивелируется (репродуктивная компенсация). Естественный отбор перестает регулировать численность потомства. В наследственно отягощенных семьях бывает больше беременностей (понятно, что часть беременностей заканчивается гибелью потомства на любой стадии внутриутробного развития), но число живых детей такое же, как и в неотягощенных семьях. Часть таких детей гетерозиготны, в результате искусственно поддерживается повышенный уровень репродукции мутантных аллелей.
ГЕНЕТИЧЕСКИЕ ОСНОВЫ ПРОФИЛАКТИКИ НАСЛЕДСТВЕННОЙ ПАТОЛОГИИ
Общие положения
С профилактической точки зрения всю наследственную патологию целесообразно подразделить на 3 категории:
• вновь возникающие мутации (в первую очередь это анеуплоидии и тяжелые формы доминантных мутаций);
• унаследованные от предыдущих поколений (как генные, так и хромосомные);
• болезни с наследственной предрасположенностью. Различают 3 вида профилактики наследственной патологии.
Первичная профилактика
Под первичной профилактикой понимают действия, которые должны предупредить зачатие больного ребенка; это планирование деторождения и улучшение среды обитания человека.
Планирование деторождения включает 3 основные позиции:
• оптимальный репродуктивный возраст, который для женщин составляет 21-35 лет (более ранние или поздние беременности увеличивают вероятность рождения ребенка с врожденной патологией и хромосомными болезнями) (см. рис. 5.29);
• отказ от деторождения в случаях высокого риска наследственной и врожденной патологии (при отсутствии надежных методов дородовой диагностики, лечения, адаптации и реабилитации больных);
• отказ от деторождения в браках с кровными родственниками и между двумя гетерозиготными носителями патологического гена.
Улучшение среды обитания человека должно быть направлено главным образом на предупреждение вновь возникающих мутаций путем жесткого контроля содержания мутагенов и тератогенов в окружающей среде. Это особенно важно для профилактики всей группы соматических генетических болезней (врожденные пороки развития, злокачественные новообразования, иммунодефицитные состояния и т.п.).
Вторичная профилактика
Вторичная профилактика предполагает прерывание беременности при высокой вероятности заболевания плода или пренатально
диагностированной болезни. Прервать беременность можно только в установленные сроки и с согласия женщины. Основанием для элиминации эмбриона или плода является наследственная болезнь.
Прерывание беременности - не самое лучшее решение, но пока это единственный метод для вторичной профилактики большинства тяжелых и смертельных генетических дефектов.
Третичная профилактика
Под третичной профилактикой наследственной патологии понимают коррекцию проявления патологических генотипов. Это можно назвать и нормокопированием, поскольку при патологическом генотипе стремятся получить нормальный фенотип.
Третичная профилактика проводится как при наследственных болезнях, так и (особенно часто) при болезнях с наследственной предрасположенностью. С ее помощью можно добиться полной нормализации функций или снижения выраженности патологического процесса. Для некоторых форм наследственной патологии она может совпадать с лечебными мероприятиями в общемедицинском смысле.
Предотвратить развитие наследственного заболевания (нормокопирование) можно внутриутробно или после рождения.
Для некоторых наследственных заболеваний возможно внутриутробное лечение (например, при резус-несовместимости, некоторых ацидуриях, галактоземии).
Развитие заболевания в настоящее время можно предотвратить путем коррекции (лечения) после рождения больного. Типичными примерами болезней, для которых эффективна третичная профилактика, могут быть галактоземия, фенилкетонурия, гипотиреоз (см. ниже) и др. Например, целиакия проявляется с началом прикорма ребенка. В основе болезни лежит непереносимость глютена. Исключение этого белка из пищи полностью гарантирует избавление от тяжелейшей патологии ЖКТ.
Профилактика наследственных болезней и болезней с наследственной предрасположенностью должна включать несколько этапов и проводиться на популяционном уровне. Современные представления о наследственной патологии и методические возможности позволяют осуществлять профилактику на разных уровнях онтогенеза. Их характеристики и целевые установки представлены в табл. 11.2.
Таблица 11.2. Характеристика основных типов популяционно-генетических профилактических программ
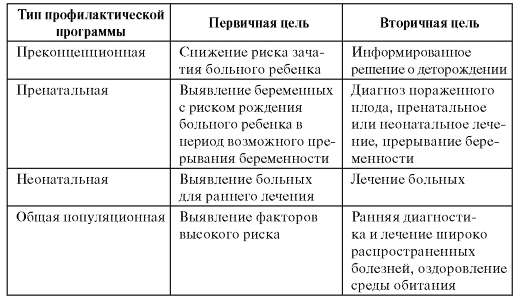
Как видно из табл. 11.2, мероприятия по профилактике можно проводить до зачатия и заканчивать общепопуляционным обследованием. При этом желательно использовать одновременно два принципиально разных подхода: семейный и популяционный. Каждый из этих подходов имеет свои разрешающие способности и ограничения.
Современная основа профилактики наследственной патологии - теоретические разработки в области молекулярной природы наследственных болезней, механизмов и процессов их развития в пре- и постнатальном периодах, закономерностей сохранения мутаций (а иногда и распространения) в семьях и популяциях, а также изучение процессов возникновения и становления мутаций в зародышевых и соматических клетках.
В генетическом плане можно выделить 5 подходов к профилактике наследственной патологии, которые рассмотрены ниже.
Управление экспрессией генов
В середине 20-х годов XX в. в экспериментах были обнаружены явления пенетрантности и экспрессивности, которые вскоре стали предметом изучения медицинской генетики. Выше отмечалось, что
Н.К. Кольцов сформулировал понятие «евфеника», под которым он понимал формирование хороших качеств или исправление болезненных проявлений наследственности у человека путем создания соответствующих условий (лекарства, диета, воспитание и др.). Эти идеи стали реализовываться только в 60-х годах XX в., когда накопились сведения о первичных продуктах патологического гена и молекулярных механизмах патогенеза наследственных болезней. Зная механизмы действия патологических генов, можно разрабатывать методы их фенотипической коррекции, другими словами, управлять пенетрантностью и экспрессивностью.
По мере прогресса науки накапливаются сведения о методах профилактики наследственной патологии на разных стадиях онтогенеза - о лечебных или диетических воздействиях. Клиническим примером управления экспрессией генов, уже прошедшим длительную проверку практикой, является предупреждение последствий фенилкетонурии, галактоземии и врожденного гипотиреоза. Клиническая картина этих болезней формируется в раннем постнатальном периоде, в связи с чем принцип третичной профилактики сравнительно простой. Болезнь должна быть диагностирована в течение нескольких дней после рождения, чтобы сразу применить профилактическое лечение, предупреждающее развитие патологического фенотипа (клинической картины). Нормокопирование может достигаться диетическими (при фенилкетонурии, галактоземии) или лекарственными (при гипотиреозе) методами.
Коррекция проявления патологических генов может начинаться с эмбриональной стадии развития. Закладываются основы так называемой преконцепционной и перинатальной профилактики наследственных болезней (в течение нескольких месяцев до зачатия и до родов). Так, например, гипофенилаланиновая диета для матери во время беременности уменьшает проявления фенилкетонурии в постнатальном периоде у ребенка. Отмечено, что врожденные аномалии нервной трубки (полигенный характер наследования) реже встречаются у детей женщин, получающих достаточное количество витаминов. Дальнейшая проверка показала, что если провести лечение женщин в течение 3-6 мес до зачатия и на протяжении первых месяцев беременности гипервитаминной (витамины С, Е, фолиевая кислота) диетой, то вероятность развития у ребенка аномалий нервной трубки существенно уменьшается. Это важно для семей, в которых уже есть больные дети, а также для популяций с высокой частотой патологи-
ческих генов (например, по врожденным аномалиям нервной трубки среди населения Ирландии). Подробнее о проблемах преконцепционной профилактики репродуктивного здоровья см. в статье Л.Ф. Курило на компакт-диске.
В перспективе могут быть разработаны новые методы внутриутробной коррекции патологического проявления генов, что особенно важно для семей, в которых по религиозным соображениям неприемлемо прерывание беременности.
В таблице 11.3 приведены примеры врожденных аномалий, для которых уже разработаны методы внутриутробного лечения.
Таблица 11.3. Примеры внутриутробного лечения врожденных болезней
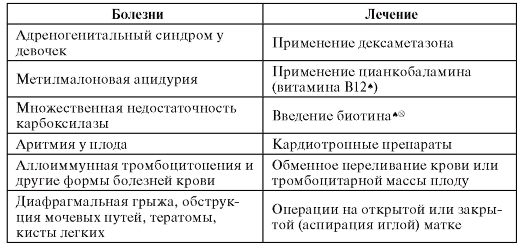
Опыт пренатальной терапии плодов женского пола с дефицитом 21-гидроксилазы может служить отправной точкой для разработки методов лечения других наследственных болезней. Лечение проводится по следующему плану.
Беременным, имеющим риск рождения ребенка с врожденной гиперплазией коры надпочечников, до 10-й недели беременности назначают дексаметазон (20 мкг/кг) независимо от состояния и пола плода. Дексаметазон подавляет секрецию андрогенов эмбриональными надпочечниками. Одновременно необходимо провести пренатальную диагностику пола плода и ДНК-диагностику мутаций в гене (путем либо биопсии хориона, либо амниоцентеза). Если обнаруживается, что плод мужского пола или плод женского пола не поражен, то пренатальную терапию прекращают, а если у плода
женского пола находят мутации в гомозиготном состоянии, то лечение продолжают до родов.
Пренатальное лечение низкими дозами дексаметазона вряд ли дает побочные эффекты. При наблюдении за детьми до 10-летнего возраста не обнаружено никаких отклонений. У женщин, получающих дексаметазон, наблюдаются небольшие побочные эффекты (колебания настроения, прибавка массы тела, повышение артериального давления, общий дискомфорт), но они согласны переносить эти неудобства ради здоровья дочерей. Положительные результаты лечения плодов женского пола с дефицитом 21-гидроксилазы (адреногенитальный синдром) существенно перевешивают отрицательные моменты.
Третичная профилактика на основе управления экспрессией генов особенно важна и эффективна для предупреждения болезней с наследственной предрасположенностью. Исключение из среды факторов, способствующих развитию патологического фенотипа, а иногда и обусловливающих его, - прямой путь к профилактике таких болезней.
Профилактике поддаются все моногенные формы наследственной предрасположенности путем исключения из среды обитания проявляющих факторов, в первую очередь фармакологических средств у носителей недостаточности Г6ФДГ, аномальной псевдохолинэстеразы, мутантной ацетилтрансферазы. В этих случаях речь идет о первичной (врожденной) непереносимости лекарств, а не о приобретенной лекарственной болезни (см. гл. 8).
Для работы в производственных условиях, провоцирующих болезненные состояния у лиц с мутантными аллелями (например, контакты со свинцом, пестицидами, окислителями), необходимо проводить отбор рабочих в соответствии с установленными принципами (см. гл. 7).
Хотя профилактика многофакторных состояний более сложная, поскольку они вызываются взаимодействием нескольких факторов среды и полигенных комплексов, все же при правильном семейном анамнезе и молекулярно-генетическом анализе полиморфных маркеров генов предрасположенности к заболеваниям можно выявить «слабые» звенья в здоровье индивида и создать благоприятные условия для замедления или приостановки развития многофакторного заболевания (предупредительная медицина). На этом принципе основана профилактика гипертонической болезни, атеросклероза, рака легких.
Элиминация эмбрионов и плодов с наследственной патологией
Механизмы элиминации нежизнеспособных эмбрионов и плодов отрабатывались эволюционно. У человека это спонтанные аборты и преждевременные роды. Конечно, не все они происходят по причине неполноценности эмбриона или плода; часть из них связана с условиями вынашивания, т.е. с состоянием женского организма. Однако определенно не менее чем в 50% случаев прерванных беременностей у плодов имеются либо врожденные пороки развития, либо наследственные болезни.
Таким образом, элиминация эмбрионов и плодов с наследственной патологией заменяет спонтанный аборт как природное явление. Методы пренатальной диагностики быстро развиваются, поэтому этот профилактический подход получает все большее значение. Установление диагноза наследственного заболевания у плода служит показанием для прерывания беременности.
Процедура пренатальной диагностики и особенно прерывание беременности должны проводиться с согласия женщины. Как указывалось выше, в некоторых семьях по религиозным соображениям беременность не может быть прервана.
Естественный отбор у человека в течение внутриутробного периода позволил американскому эмбриологу Дж. Уоркани в 1978 г. сформулировать концепцию тератаназии. Под термином «тератаназия» понимается естественный процесс просеивания (или отсеивания) плодов с врожденной патологией. Тератаназия может осуществляться путем создания «непереносимых» условий для плода с патологией, хотя такие условия вполне приемлемы для нормального плода. Эти факторы как бы выявляют патологическое состояние и одновременно вызывают гибель плода. Некоторые экспериментальные доказательства в пользу такой точки зрения уже имеются. Научные разработки могут быть направлены на поиск методов индуцированной селективной гибели плода с патологическим генотипом. Методы должны быть физиологичными для матери и абсолютно безопасными для нормального плода.
Генная инженерия на уровне зародышевых клеток
Профилактика наследственных болезней может быть наиболее полной и эффективной, если в зиготу будет встроен ген, по функции заменяющий мутантный. Устранение причины наследственной болезни (а именно это и есть наиболее фундаментальный аспект
профилактики) означает достаточно серьезное манипулирование генетической информацией в зиготе. Это могут быть: введение нормального аллеля в геном путем трансфекции, обратная мутация патологического аллеля, включение нормального гена в работу, если он блокирован, выключение мутантного гена. Сложности этих задач очевидны, но интенсивные экспериментальные разработки в области генной инженерии свидетельствуют о принципиальной возможности их решения. Генно-инженерная профилактика наследственных болезней стала уже не утопией, а перспективой, хотя и неблизкой.
Предпосылки для коррекции генов человека в зародышевых клетках уже созданы. Их можно обобщить в виде следующих положений.
- Расшифровка генома человека завершена, особенно на уровне секвенирования нормальных и патологических аллелей. Интенсивно развивается функциональная геномика, благодаря которой будут известны межгенные взаимодействия.
- Любые гены человека нетрудно получать в чистом виде на основе химического или биологического синтеза. Интересно, что ген глобина человека был одним из первых искусственно полученных генов.
- Разработаны методы включения генов в геном человека с разными векторами или в чистом виде путем трансфекции.
- Методы направленного химического мутагенеза позволяют индуцировать специфические мутации в строго определенном локусе (получение обратных мутаций - от патологического аллеля к нормальному).
- В экспериментах на разных животных получены доказательства трансфекции отдельных генов на стадии зигот (дрозофила, мышь, коза, свинья и др.). Введенные гены функционируют в организме-реципиенте и передаются по наследству, хотя и не всегда по законам Менделя. Например, ген гормона роста крыс, введенный в геном зигот мышей, функционирует у родившихся мышей. Такие трансгенные мыши значительно больше по размерам и массе тела, чем обычные.
Генно-инженерная профилактика наследственных болезней на уровне зигот разработана пока слабо, хотя выбор способов синтеза генов и способов их доставки в клетки уже достаточно широк. Решение вопросов трансгеноза у человека сегодня упирается не только в генно-инженерные трудности, но и в этические проблемы. Ведь речь идет о композиции новых геномов, которые создаются не эво-
люцией, а человеком. Эти геномы вольются в генофонд человечества. Какова будет их судьба с генетической и социальной точек зрения, будут ли они функционировать как нормальные геномы, готово ли общество принять на себя последствия неудачных исходов? Сегодня ответить на эти вопросы трудно, а без ответа на них нельзя начинать клинические испытания, поскольку произойдет безвозвратное вмешательство в геном человека. Без объективной оценки эволюционных последствий генной инженерии нельзя применять эти методы у человека (даже с медицинскими целями на стадии зигот). Генетика человека еще далека от полного понимания всех особенностей функционирования генома. Неясно, как геном будет работать после введения в него дополнительной генетической информации, как он будет вести себя после мейоза, редукции числа хромосом, в сочетании с новой зародышевой клеткой и т.п.
Все сказанное выше дало основание специалистам в области биомедицинской этики на международном уровне [ВОЗ (Всемирная организация здравоохранения), ЮНЕСКО (Организация Объединенных Наций по вопросам образования, науки и культуры), Совет Европы] рекомендовать временно воздержаться от проведения экспериментов, а тем более от клинических испытаний с трансгенозом зародышевых клеток.
Планирование семьи
При высоком (более 20%) риске рождения больного ребенка и отсутствии возможностей пренатальной диагностики рекомендуется отказ от деторождения. Понятно, что такая рекомендация должна быть дана после квалифицированной медико-генетической консультации, когда нет методов пренатальной диагностики или для семьи по различным соображениям неприемлемо прерывание беременности.
Как известно, кровнородственные браки повышают вероятность рождения ребенка с наследственной болезнью. Отказ от кровнородственных браков или ограничение деторождения в них может рассматриваться как метод профилактики наследственной патологии. Об этом говорят следующие факты.
Кровнородственные браки на уровне двоюродных сибсов предпочитает не менее 20% населения всего мира. По меньшей мере, 8,4% детей рождаются от родителей-родственников. Этот обычай распространен в Восточном Средиземноморье и Южной Индии, а также среди многих популяций, ведущих племенной образ жизни на протяжении тысячелетий.
В США, Канаде, России, большинстве европейских стран, в Австралии, Новой Зеландии частота кровнородственных браков менее 1%, в среднеазиатских республиках, Японии, Северной Индии, южноамериканских странах - 1-10%, в странах Северной Африки, Среднего Востока, Южной Индии - от 10 до 50%.
Обычай кровнородственных браков в прошлом поддерживал женщину и семью. Однако это отражается на частоте рождения детей с рецессивными болезнями. Для родителей-неродственников общий риск мертворождений, младенческой и детской смертности или серьезных врожденных пороков развития равен примерно 2,5%, риск умственного недоразвития составляет еще 3%. Суммарно эти риски примерно удваиваются для детей супружеских пар - двоюродных сибсов. Если младенческая смертность в регионе высокая, то этот эффект мало заметен, а если она низкая, то эффект кровного родства в виде врожденных пороков развития и хронических инвалидизирующих заболеваний становится явным.
В популяциях с высокой частотой какой-либо болезни, в которых проводится диагностика носительства, возможен отказ от браков гетерозиготных носителей.
Для женщин после 35 лет существенно повышается вероятность рождения ребенка с хромосомными болезнями (см. гл. 5), для мужчин - с генными (табл. 11.4).
Таблица 11.4. Средний возраст отцов к моменту рождения детей с аутосомнодоминантными заболеваниями (спорадические случаи)
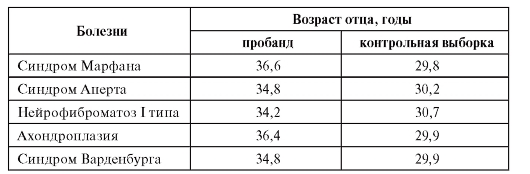
Разница в возрасте отцов пробандов и отцов в контрольной выборке составляет в среднем 5 лет. Причины этого явления неясны, но для профилактики наследственных болезней его надо принимать во внимание.
Таким образом, окончание деторождения до 35 лет и даже ранее является одним из факторов профилактики наследственных болезней. При планировании рождения 2-3 детей такого периода вполне достаточно для большинства семей.
Охрана окружающей среды
Наследственная изменчивость человека постоянно пополняется новыми мутациями. Вновь возникающие спонтанные мутации определяют в целом до 20% всей наследственной патологии. Для некоторых тяжелых доминантных форм новые мутации являются причиной 90% наследственных болезней и более. Наследственные болезни, обусловленные вновь возникшими мутациями, фактически нельзя предсказать. Это случайные события, редкие для каждого гена.
Пока нет предпосылок вмешиваться в процесс спонтанного мутагенеза у человека, хотя интенсивные исследования антимутагенеза и антитератогенеза могут привести к созданию новых методов профилактики наследственных болезней и врожденных пороков развития.
Наряду со спонтанным мутагенезом у человека возможен индуцированный мутагенез (радиационный, химический, биологический). Универсальный характер индуцированного мутагенеза на всех уровнях организации наследственности для всех живых существ не вызывает сомнений. Естественно, что индуцированный мутагенез может служить дополнительным источником наследственных болезней. С точки зрения профилактики наследственных болезней он должен быть полностью исключен.
Необходимо подчеркнуть, что индуцированный мутационный процесс опасен в плане не столько индивидуального прогноза, сколько популяционного. Отсюда вытекает, что исключение мутагенных факторов из среды обитания человека является методом популяционной профилактики наследственных болезней.
Методы проверки внешних факторов на мутагенность разработаны, их можно ввести в гигиенические регламентации по охране окружающей среды. Этот вопрос очень важен, потому что мутагенные эффекты факторов окружающей среды проявляются не в экспонированной популяции, а в потомстве в нескольких поколениях.
К охране среды обитания человека относится также исключение из нее факторов, вызывающих экогенетические патологические реак-
ции. Например, для лиц с пигментной ксеродермой (гомозигот) надо исключить контакт с ультрафиолетовыми лучами, для лиц с недостаточностью ингибитора протеаз - с пылью, для носителей мутации порфиринового гена - с барбитуратами и т.д.
МЕДИКО-ГЕНЕТИЧЕСКОЕ КОНСУЛЬТИРОВАНИЕ
Общие положения
Медико-генетическое консультирование - специализированный вид медицинской помощи - является наиболее распространенным методом профилактики наследственных болезней.
Его суть заключается в определении прогноза рождения ребенка с наследственной патологией на основе уточненного диагноза, объяснении вероятности этого события консультирующимся и помощи семье в принятии решения о дальнейшем деторождении.
Еще в конце 20-х годах ХХ в. С.Н. Давиденков впервые в мире организовал медико-генетическую консультацию при Институте нервно-психиатрической профилактики. Он четко сформулировал задачи и методы медико-генетического консультирования. Однако развитие данной области профилактики и генетики человека в целом затормозилось в 30-х годах практически во всех развитых странах. Это было связано с тем, что в нацистской Германии для обоснования геноцида использовали генетические концепции и ввели насильственную стерилизацию как метод «оздоровления расы». Евгеническая стерилизация широко проводилась в США, Дании, Швеции и других странах. Во многом в связи с евгеникой, а также по политическим соображениям в Москве был закрыт Медикогенетический институт (1936).
Хотя в США медико-генетические консультации (кабинеты) начали организовываться уже в 40-х годах, действительно интенсивное развитие такой помощи в разных странах (в том числе в России и Германии) началось в 60-70-х годах. К этому времени произошел большой прорыв в изучении хромосомной патологии и наследственных болезней обмена веществ.
Термин «медико-генетическая консультация» определяет два понятия: врачебное заключение врача-генетика и специализированное учреждение здравоохранения (как самостоятельное, так и в составе объединения).
Показания для медико-генетического консультирования:
• наличие установленного или предполагаемого наследственного заболевания в семье;
• рождение ребенка с врожденным пороком развития;
• задержка умственного или физического развития ребенка;
• повторные спонтанные аборты, выкидыши, мертворождения;
• высокий риск патологии плода по результатам биохимического скрининга маркерных сывороточных белков беременной;
• наличие УЗИ-маркеров наследственного заболевания у плода;
• возраст беременной 35 лет и старше;
• близкородственные браки;
• воздействие тератогенов в первые 3 мес беременности.
В принципе каждой супружеской паре желательно пройти медикогенетическое консультирование до планирования деторождения (проспективно) и, безусловно, необходимо после рождения больного ребенка (ретроспективно).
Функции врача-генетика
Врач-генетик выполняет две основные функции. Во-первых, он с помощью других «узких» специалистов устанавливает диагноз, используя при дифференциальной диагностике специальные генетические методы; во-вторых, он определяет прогноз здоровья будущего (или уже родившегося) потомства. Перед врачом всегда возникают врачебные, генетические и деонтологические проблемы; на разных этапах консультирования преобладают то одни, то другие.
Медико-генетическая консультация включает 4 этапа: диагностику, прогнозирование, заключение, совет. Общение врача-генетика с семьей больного должно быть доверительным и доброжелательным.
Диагностика
Консультирование всегда начинается с уточнения диагноза наследственной болезни, поскольку точный диагноз остается необходимой предпосылкой любой консультации. Прежде чем направить пациента в медико-генетическую консультацию, лечащий врач должен с помощью доступных ему методов максимально уточнить диагноз и определить цель консультации. Если необходимо дополнительно применять генеалогический, цитогенетический, биохимические и другие специальные генетические методы (например, определить сцепление генов или использовать молекулярно-генетические методы и т.п.), то пациента направляют на медико-генетическую консультацию,
и врач-генетик помогает лечащему врачу в установлении диагноза. При этом может возникнуть необходимость направления пациента или его родственников на дополнительное обследование. Со своей стороны врач-генетик может поставить перед другими специалистами (невропатологом, эндокринологом, ортопедом, офтальмологом и др.) конкретную задачу - распознать симптомы предполагаемой наследственной болезни у пациента или его родственников. Сам врач-генетик не может иметь столь универсальных знаний, чтобы в полном объеме обеспечить клиническую диагностику нескольких тысяч наследственных болезней.
На первом этапе консультирования перед врачом-генетиком возникает много сугубо генетических задач (генетическая гетерогенность болезни, унаследованная или вновь возникшая мутация, средовая или генетическая обусловленность данного врожденного заболевания и т.д.).
Диагноз уточняют в медико-генетической консультации с помощью генетического анализа. С этой целью врач-генетик пользуется клинико-генеалогическим, цитогенетическим и молекулярно-генетическими методами, а также анализом сцепления генов, методами генетики соматических клеток. Из негенетических методов широко используются биохимические, иммунологические и другие параклинические методы, которые помогают установить точный диагноз.
Клинико-генеалогический метод при условии тщательного сбора родословной дает определенную информацию для установления диагноза наследственной болезни. Клинико-генеалогический метод позволяет описать впервые встретившуюся, новую форму заболевания. Если в родословной четко прослеживается тип наследования, то консультирование возможно даже при неустановленном диагнозе (особенности использования клинико-генеалогического метода и его разрешающие возможности рассмотрены выше). В медикогенетической консультации указанный метод применяется во всех случаях без исключения.
Цитогенетическое исследование, как свидетельствует опыт работы многих консультаций, применяется не менее чем в 10% случаев. Это обусловлено необходимостью прогноза для потомства при установленном диагнозе хромосомной болезни и потребностью в уточнении диагноза в неясных случаях при врожденных пороках развития. С такими проблемами часто встречаются в практике консультирования. Обследуют, как правило, не только пробандов, но и родителей.
Биохимические, иммунологические и другие параклинические методы не являются специфичными для генетической консультации, но применяются так же широко, как и при диагностике ненаследственных болезней. При наследственных болезнях часто применяют одни и те же тесты не только у пациента, но и у других членов семьи (составление биохимической или иммунологической «родословной»).
В процессе генетического консультирования часто возникает потребность в дополнительном параклиническом обследовании. В таких случаях больного или его родственников направляют в соответствующие специализированные учреждения.
В конечном счете в медико-генетической консультации диагноз уточняется путем генетического анализа всех полученных сведений, в том числе (если это необходимо) данных о сцеплении генов или результатов исследования культивированных клеток. Врач-генетик должен быть высококвалифицированным специалистом в разных областях медицинской генетики.
Прогноз для потомства
После уточнения диагноза определяют прогноз для потомства. Врач-генетик формулирует генетическую задачу, решение которой основывается либо на теоретических расчетах с использованием методов генетического анализа и вариационной статистики, либо на эмпирических данных (таблицы эмпирического риска). Ясно, что обычная подготовка врача общей практики не позволяет квалифицированно сделать такой прогноз. Ошибка врача при неправильном прогнозе для семьи может быть роковой: повторно родится тяжелобольной ребенок либо семья неправомерно откажется от деторождения.
Если применяется пренатальная диагностика, не требуется решение генетической задачи. В таких случаях не прогнозируется рождение ребенка с болезнью, а диагностируется заболевание у плода.
Заключение медико-генетического консультирования и советы родителям
Заключение медико-генетического консультирования и советы родителям можно объединить. Заключение врача-генетика обязательно должно быть письменным, потому что члены семьи могут возвратиться к обдумыванию ситуации. Наряду с этим необходимо устно в доступной форме объяснить смысл генетического риска и помочь семье принять решение.
Заключительные этапы консультирования требуют самого пристального внимания. Как бы ни совершенствовались методы расчета риска (эмпирического или теоретического), как бы полно ни внедрялись достижения медицинской генетики в работу консультаций, консультирование будет неэффективным, если пациенты неправильно поймут объяснение врача-генетика. Помогает и контакт с семейным врачом, которому супруги доверяют, поэтому очень важна согласованность действий семейного (лечащего) врача и врача-генетика. Например, даже при установленном в пренатальном периоде диагнозе у плода не все женщины принимают решение о прерывании беременности. При тяжелых хромосомных болезнях (трисомии 13, 18, 21) прерывают беременность 83% женщин, при пороках нервной трубки - 76%, при синдроме Тернера - 70%, при других формах хромосомных аномалий - 30%.
Для достижения цели консультирования при беседе с пациентами следует учитывать уровень их образования, социально-экономическое положение семьи, структуру личности и взаимоотношения супругов. Многие пациенты не подготовлены к восприятию информации о наследственных болезнях и генетических закономерностях. Одни склонны чувствовать вину за случившееся несчастье и страдают от комплекса неполноценности, другие вполне серьезно доверяют рассказам знакомых, третьи приходят в консультацию с нереальными запросами или ожиданиями, в связи с тем, что были неправильно осведомлены о возможностях генетической консультации (в том числе иногда лечащими врачами). Необходимо иметь в виду, что почти все консультирующиеся супруги хотят иметь ребенка (иначе бы они не обратились за консультацией). Это значительно повышает профессиональную ответственность и лечащего врача, и врачагенетика. Каждое неточное слово может быть интерпретировано в том направлении, в котором настроены супруги. Если супруги сильно опасаются иметь больного ребенка и хотят родить здорового, то каждая неосторожная фраза врача об опасности усиливает страх, хотя на самом деле риск может быть небольшим. Наоборот, желание иметь ребенка бывает настолько сильным, что даже при большом риске супруги принимают решение о деторождении, потому что врач сказал о некоторой вероятности рождения здорового ребенка.
Изложение сведений о риске должно быть индивидуально приспособлено к каждому случаю. В одних случаях следует говорить о 25% вероятности иметь больного ребенка, в других - о 75% вероятности рождения здорового ребенка. Однако всегда нужно убедить паци-
ентов в случайном распределении наследственных факторов, чтобы устранить чувство вины за рождение больного ребенка. Иногда это чувство бывает очень сильным.
На медико-генетическую консультацию целесообразно направлять супругов не раньше чем через 3-6 мес после установления диагноза наследственной болезни, так как в этот период происходит адаптация к ситуации в семье, а раньше какая-либо информация о будущих детях воспринимается плохо.
Тактика врача-генетика в помощи пациентам в принятии решения окончательно не определена. Безусловно, она зависит от конкретной ситуации. Хотя решение принимают сами пациенты, в принятии решения семьей роль врача может быть активной или сводиться только к объяснению смысла риска. По нашему мнению, врач-генетик и лечащий врач (особенно семейный) должны помогать советом в принятии решения, так как при существующем уровне знаний в области генетики у населения консультирующимся трудно самостоятельно принять адекватное решение.
Медицинские задачи консультирования решаются легче, чем социально-этические проблемы. Например, при одной и той же болезни, при одной и той же вероятности рождения больного ребенка разная обстановка в семье (обеспеченность, взаимоотношения супругов и др.) требует различных подходов к объяснению риска. В любом случае принятие решения о деторождении остается за семьей.
Организационные вопросы
При организации медико-генетических консультаций как структурных подразделений нужно опираться на сложившуюся в стране систему здравоохранения и учитывать степень развития медицины в целом, в том числе уровень знаний генетики у врачей. Консультации функционируют как звено существующей системы медицинской помощи населению.
В большинстве зарубежных стран с развитым здравоохранением система консультирования является 3-х ступенчатой: в простых случаях прогноз для потомства определяется семейным врачом; более сложные случаи попадают к врачу-генетику, работающему в крупном медицинском центре; консультирование в сложных генетических ситуациях осуществляется в специальных генетических консультациях. Для реализации этой в целом эффективной системы необходимо, чтобы каждый семейный или лечащий врач хорошо понимал
клиническую генетику, а организация медицинской помощи населению должна быть адекватной.
Медико-генетические консультации как структурные подразделения лечебно-профилактических учреждений могут быть как общепрофильными, так и специализированными.
Пробанды, обращающиеся в консультацию общего профиля по нозологическому принципу, имеют самую различную патологию. Поскольку работа по уточнению диагноза в консультации занимает большое место, разнообразный профиль заболеваний пробандов заставляет обследовать и пробандов, и родственников. В связи с этим генетические консультации целесообразно создавать на базе крупных многопрофильных лечебно-профилактических учреждений республиканского или областного подчинения. Больной и его родственники в этом случае могут получить консультацию у специалистов и при необходимости быть госпитализированы. Кроме того, консультация должна иметь возможность направлять на специализированное (томография, исследование гормонального профиля и др.) обследование в другие учреждения, если больница, на базе которой функционирует консультация, не располагает такими возможностями. Тесный контакт с другими отделениями и их правильная соподчиненность - важный принцип работы медикогенетической консультации общего профиля.
Специализированные медико-генетические консультации могут быть организованы при крупных специализированных больницах, в которых врач-генетик приобретает опыт консультирования по наследственным болезням одного профиля. В трудных случаях консультации общего профиля могут направлять больных в специализированную консультацию.
Две консультации - общего профиля и специализированные - могут функционировать параллельно, но независимо.
В штат консультации общего профиля должны входить врачигенетики, цитогенетики и биохимики-генетики. Врач-генетик, ведущий прием населения, должен иметь всестороннюю генетическую подготовку, так как ему приходится решать самые разнообразные генетические задачи. Объектом исследования врача-генетика является семья, а пробанд - лишь отправное лицо в этом исследовании. Любая консультация требует сбора сведений о родственниках, а иногда и их обследования. Заключение врача-генетика о повторном риске заболевания предназначается непосредственно семье, обратившейся за помощью, поэтому смысл заключения надо разъяснять в доступной форме
(нередко нескольким членам семьи). Все это занимает гораздо больше времени, чем прием больного любым другим специалистом. На первичный осмотр пробанда и его родителей, а также на сбор семейного анамнеза требуется от 1 до 1,5 ч. Повторная консультация (письменное заключение, объяснение в доступной форме, помощь в принятии решения) занимает в среднем 30 мин. Таким образом, один врач-генетик в течение рабочего дня может принять не более 5 семей.
Из всех специальных исследований наибольшая потребность возникает в цитогенетических анализах (в среднем 1 исследование на 1 семью). Большая потребность в применении цитогенетического метода обусловлена направлением на медико-генетическую консультацию прежде всего пациентов с хромосомной патологией, врожденными пороками развития и акушерской патологией. При этом, как правило, обследуются не 1 человек, а 2 или 3.
Биохимические исследования необходимы примерно 10% пациентов, обратившихся в консультацию. Это довольно высокая цифра. Однако при большом разнообразии наследственных болезней обмена веществ повторное применение одних и тех же биохимических методов в консультации бывает очень редко. В крупных городах целесообразно создавать специализированные биохимические лаборатории с широкими методическими возможностями для обследования больных с разнообразными нарушениями обмена веществ.
Таким образом, генетическая консультация как структурное подразделение представляет собой звено поликлинической службы, состоящее из кабинета врача-генетика, процедурной (взятие крови) и лаборатории для проведения цитогенетических и просеивающих биохимических исследований. Клинические, параклинические, молекулярно-генетические, биохимические, иммунологические и другие исследования проводят в специализированных лабораториях и лечебно-профилактических учреждениях, к которым прикреплена консультация. Такие консультации в больницах не исключают организации высокоспециализированных медико-генетических центров со всеми необходимыми подразделениями.
Анализ обращаемости в медико-генетическую консультацию
До сих пор только незначительное число семей (вряд ли более 10%), которым требуется совет врача-генетика, обращается за такой специализированной помощью. При этом более 50% направлен-
ных на консультацию лиц имеют неправильные показания для ее проведения. Это несоответствие связано с недостаточным уровнем медико-генетических знаний у врачей и населения и с недостаточным пониманием организаторами здравоохранения значения медикогенетического консультирования как метода профилактики наследственных болезней.
Поскольку основным проводником идеи медико-генетического консультирования является врач общей практики, от его знаний и понимания задач консультаций зависит направление на такую консультацию. Осведомленность населения по вопросам наследственных болезней также влияет на обращаемость в медико-генетическую консультацию. Однако обоснованность обращений целиком зависит от компетентности врача.
Соотношение пациентов, направленных врачами и самостоятельно обратившихся в консультацию, сильно колеблется. В разных консультациях доля самостоятельно обратившихся составляет от 10 до 80%. Это зависит от того, на кого (на врачей или на население) была направлена пропаганда, которая в значительной мере определяет и обоснованность обращений, т.е. точный диагноз и правильные показания для проведения консультации.
Распределение обратившихся в консультацию по группам заболеваний должно соответствовать относительной частоте таких болезней в популяциях человека. Однако анализ обращаемости по нозологическому принципу в консультациях разных стран показывает отклонения от теоретически ожидаемого распределения.
Чаще всего в консультации обращаются семьи, имеющие детей с хромосомными болезнями, врожденными пороками развития и нервно-психическими заболеваниями.
Социальная характеристика пациентов в разных консультациях однотипна. Большинство пациентов имеют высшее образование и хорошо обеспечены. Мотивами для обращения в консультацию являются желание иметь здорового ребенка (около 90% опрошенных) и желание вылечить больного ребенка (около 10% случаев). В 50% семей отмечаются конфликтные взаимоотношения супругов.
Эффективность медико-генетических консультаций
Целью генетического консультирования в общепопуляционном смысле является снижение груза патологической наследственности, а цель отдельной консультации - это помощь семье в принятии
правильного решения по вопросам планирования семьи, лечения и прогноза здоровья больного. Следовательно, критерием эффективности медико-генетического консультирования в широком смысле служит изменение частоты патологических генов, а результатом работы отдельной консультации - изменение поведения супругов, обращающихся в консультацию по вопросам деторождения.
При широком внедрении медико-генетического консультирования можно достигнуть некоторого уменьшения частоты наследственных болезней, а также снижения смертности (особенно детской). Расчеты показывают, что из каждых 100 проконсультированных семей в 3-5 не рождаются больные дети (без консультации они бы родились), несмотря на то, что 25-30% проконсультированных не следуют совету врача-генетика. Если бы лечащие (или семейные) врачи помогли супругам следовать таким рекомендациям, то эффективность медико-генетического консультирования была бы еще выше.
Популяционные эффекты медико-генетического консультирования выражаются в изменении частоты патологических аллелей. Этот показатель изменится мало, потому что основной вклад в частоту генов в популяциях вносят гетерозиготные носители, а их частота в результате консультирования практически не изменится. Если консультируемые будут следовать советам врача-генетика, то уменьшится только число гомозиготных носителей. Снижение частоты тяжелых доминантных болезней в популяциях в результате медикогенетического консультирования не будет существенным, потому что 80-90% из них являются результатом новых мутаций.
Кабинеты медико-генетического консультирования должны быть организованы во всех областных и крупных городских больницах. Объем медико-генетического консультирования, безусловно, зависит от уровня медицинской помощи в стране.
При развитом здравоохранении реальные потребности в медикогенетическом консультировании достаточно большие. Например, всем семьям, где родились дети с врожденной и наследственной патологией (их около 5%), требуется медико-генетическая помощь. Следовательно, в России при расчетном числе 1 500 000 родов в год таких семей будет 75 000. В медико-генетическом консультировании нуждаются женщины старше 35 лет, решившие родить ребенка. В год в России рожает более 70 000 женщин старше 35 лет. Другие расчеты консультаций по поводу ранних форм сердечно-сосудистых заболева-
ний, рака, нервных, психических и других болезней показывают, что каждая 5-10-я семья нуждается в общем или специализированном медико-генетическом консультировании.
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА
Общие вопросы
Под термином «пренатальная диагностика» понимается совокупность всех методов обследования состояния эмбриона или плода, направленных на выявление врожденных пороков развития, наследственных болезней и любых других форм (инфекционных, травматических) заболеваний, развивающихся внутриутробно. Цель такой диагностики - предупреждение рождения детей с врожденными и наследственными заболеваниями. Пренатальная диагностика как научно-практическое направление возникло в 70-х годах прошлого века и быстро прогрессировало, опираясь на успехи генетики и клинических дисциплин. Число пренатальных диагностических процедур в настоящее время исчисляется десятками миллионов в год.
Пренатальная диагностика наследственных болезней - комплексная быстро развивающаяся область медицины, использующая и УЗИ, и оперативную технику (хорионбиопсия, амнио- и кордоцентез, биопсия мышц и кожи плода), и лабораторные методы (цитогенетические, биохимические, молекулярно-генетические).
Забота семьи о здоровье будущего ребенка (а иногда и необоснованная обеспокоенность) требует не только оценки генетических и средовых факторов риска исхода беременности (медико-генетическая консультация), но и использования методов пренатальной диагностики.
При организации и развитии системы пренатальной диагностики должны выполняться следующие условия.
- Врачи, определяя показания к исследованиям, должны знать вероятность ложноположительных и ложноотрицательных диагнозов, или, другими словами, ограничения метода.
- Пренатальная диагностика должна включать два этапа:
• первый этап - выявление и отбор женщин (точнее, семей) с повышенным риском неблагополучного в генетическом плане исхода беременности при медико-генетическом консультиро-
вании или первичном обследовании беременных, в том числе с использованием методов просеивающей диагностики; • второй этап - уточняющая пренатальная диагностика. Любые методы уточняющей диагностики (инвазивные или неинвазивные, лабораторные, дорогостоящие, трудоемкие) применяют только у женщин с факторами риска.
- Специалисты по пренатальной диагностике (акушер-гинеколог, врач-генетик, врач лаборант-генетик) должны знать диагностические ограничения метода не вообще, а конкретно в их лаборатории (ультразвуковая техника, возможность взятия образцов тканей и клеток плода и др.). Нужно учитывать, что соответствующая лабораторная диагностика может быть недоступной или ограниченной.
- Специалисты должны строго соблюдать стандарты определения показаний и выполнения процедур и лабораторных анализов, осуществлять текущий контроль качества работы, а также иметь статистику исходов беременностей и расхождений диагнозов (контроль после абортов или после рождения).
Важность соблюдения всех перечисленных условий связана не только с медицинскими, но и с деонтологическими соображениями: все эти вопросы обостряются в семье в ожидании ребенка.
Методы пренатальной диагностики подразделяют на непрямые и прямые.
Непрямые методы - акушерско-гинекологическое, серологическое исследование, а также анализ эмбриоспецифических маркеров [PAPP-А (ассоциированный с беременностью плазменный белок А - Pregnancy Associated Plasma Protein A), АФП (α-фетопротеин), ХГЧ (хорионический гонадотропин человека), несвязанный эстриол]. Перечисленные маркеры составляют суть так называемых просеивающих лабораторных методов.
Прямые методы - неинвазивное или инвазивное исследование плода. Неинвазивное исследование практически ограничено УЗИ, хотя в редких случаях применяют рентгенографию и др. К инвазивным методам относятся хорион- и плацентобиопсия, амнио- и кордоцентез, биопсия тканей плода.
Для каждого метода есть показания и противопоказания, разрешающие возможности и осложнения. Выбор метода и вся тактика пренатальной диагностики должны быть строго индивидуализированы в соответствии с конкретной ситуацией в семье и с состоянием беременной.
Скрининг беременных на основе определения биохимических маркеров (просеивающие методы)
Такие методы позволяют выделить женщин, имеющих повышенный риск рождения ребенка с наследственной или врожденной болезнью. Методы должны быть доступными для широкого применения и недорогими.
Безусловно, медико-генетическое консультирование семей просеивает их на предмет пренатальной диагностики. Оптимальным вариантом просеивания с целью профилактики наследственной патологии путем пренатальной диагностики было бы медико-генетическое консультирование с проведением генеалогического анализа всех семей, планирующих деторождение. В этом случае, по-видимому, около 10% женщин нуждались бы в более глубоком обследовании. При медико-генетическом консультировании на пренатальную диагностику направляют женщин по следующим показаниям:
• возраст 35 лет и старше (мужчин 45 лет и старше);
• наличие в семье или в популяции пренатально выявляемой наследственной болезни;
• неблагоприятный акушерский анамнез (повторные спонтанные прерывания беременности или рождение ребенка с врожденными пороками развития);
• сахарный диабет;
• эпилепсия;
• инфекции у беременной;
• лекарственная терапия;
• контакты с тератогенными факторами.
К просеивающим методам, определяющим необходимость инвазивной пренатальной диагностики, относятся УЗИ плода и определение в сыворотке крови беременной веществ, получивших название сывороточных маркеров матери:
• концентрации АФП;
• уровня ХГЧ;
• уровня несвязанного эстриола;
• PAPP-А.
α-фетопротеин вырабатывает желточный мешок и печень плода. Этот белок экскретируется с мочой в амниотическую жидкость, откуда проникает в кровь беременной через плодные оболочки и плаценту. Его содержание меняется в течение беременности. В каждой лаборатории должны быть установлены нормы в медианном выражении содержания
белка для каждой недели беременности, потому что концентрации АФП колеблются у представительниц разных рас и в различных географических зонах, причем распределение концентраций не подчиняется закону нормального распределения. Отклонение от среднего (нормального) уровня показателя (обозначается в единицах МОМ - multiples of median) оценивается по отношению величины содержания АФП в крови конкретной женщины к усредненной величине (медиане) содержания данного белка у многих женщин при том же сроке нормальной беременности. Этот метод позволяет заподозрить врожденные дефекты нервной трубки и брюшной стенки. При такой патологии концентрация АФП в сыворотке крови беременной во II триместре существенно выше, чем в норме (рис. 11.1). Повышение уровня АФП регистрируется также при гастрошизисе, омфалоцеле, аномалиях почек.
Поскольку в некоторых популяциях аномалии развития нервной трубки встречаются в несколько раз чаще, чем в среднем, в таких популяциях необходимо определять концентрацию АФП у всех беременных. Показанием к данному исследованию является также отягощенная родословная, т.е. наличие в ней больного с аномалией нервной трубки в пределах III степени родства по обеим линиям супругов.
Концентрация АФП снижена с 15 по 18-ю неделю беременности в крови женщин, вынашивающих плод с болезнью Дауна (рис. 11.2) или другими хромосомными болезнями.
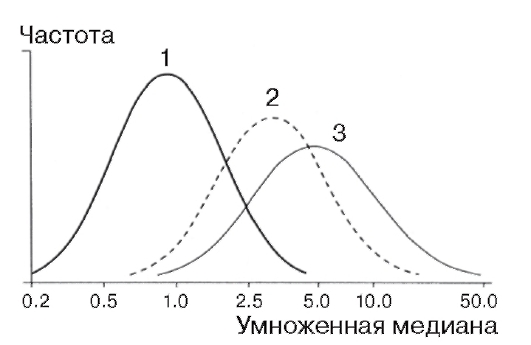
Рис. 11.1 Концентрация (по оси абсцисс) α-фетопротеина (АФП) в сыворотке крови беременной при вынашивании нормального плода и плода с врожденным дефектом нервной трубки: 1 - непораженные; 2 - открытая spina bifida; 3 - анэнцефалия
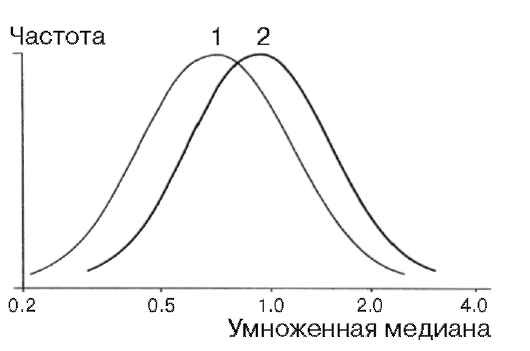
Рис. 11.2. Концентрация (по оси абсцисс) α-фетопротеина (АФП) в сыворотке крови беременной при вынашивании плода с синдромом Дауна: 1 - синдром Дауна; 2 - непораженные
Механизм этой ассоциации неясен, но ее существование не вызывает сомнений. Такое обследование беременных позволяет выявить до 20% случаев болезни Дауна.
Медицинских противопоказаний для определения концентрации АФП нет. Женщину с измененным уровнем АФП направляют на дополнительное обследование. Если концентрация белка повышена, то для уточнения диагноза аномалии нервной трубки проводят УЗИ и определяют концентрацию АФП в амниотической жидкости. Если концентрация белка понижена, то назначают цитогенетическое исследование клеток (амниоцитов или лимфоцитов) плода.
Повысить эффективность просеивающей диагностики болезни Дауна путем анализа АФП позволяет определение уровня ХГЧ в сыворотке крови будущей матери. В норме содержание ХГЧ уменьшается до низких значений после I триместра беременности. У 68% женщин, вынашивающих плод с хромосомной болезнью, этот показатель остается повышенным до родов. Медиана концентрации ХГЧ при синдроме Дауна повышена в 2 раза и более (рис. 11.3). Ложноположительные результаты получают редко.
Введение в просеивающую программу определения содержания неконъюгированного эстриола в сыворотке крови беременной еще более расширяет диагностические возможности метода, правда, при этом существенно увеличивается относительное число ложноположительных ответов. Концентрация этого гормона значительно ниже
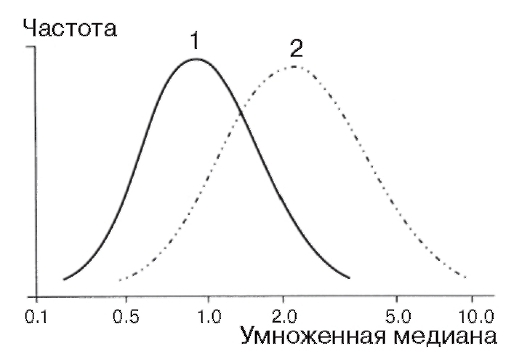
Рис. 11.3. Концентрация (по оси абсцисс) хорионического гонадотропина человека (ХГЧ) в сыворотке крови беременной при вынашивании плода с синдромом Дауна: 1 - непораженные; 2 - синдром Дауна
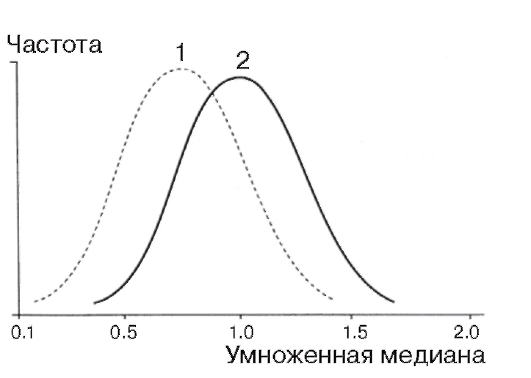
Рис. 11.4. Концентрация (по оси абсцисс) неконъюгированного эстриола в сыворотке крови беременной при вынашивании плода с синдромом Дауна: 1 - синдром Дауна; 2 - непораженные
при вынашивании плода с болезнью Дауна (рис. 11.4).
Наибольшие диагностические возможности предоставляет комбинация трех описанных указанных тестов (рис. 11.5).
В последние годы активно обсуждается возможность использования и некоторых других сывороточных маркеров матери (например, PAPP-А), изменение которых также тесно коррелирует с трисомиями у плода уже в I триместре.
Компьютерные программы позволяют сопоставлять результаты и использовать полученные показатели с достаточной степенью достоверности. С путями повышения эффективности биохимического скрининга можно ознакомиться в одноименной статье Т.К. Кащеевой на компакт-диске.
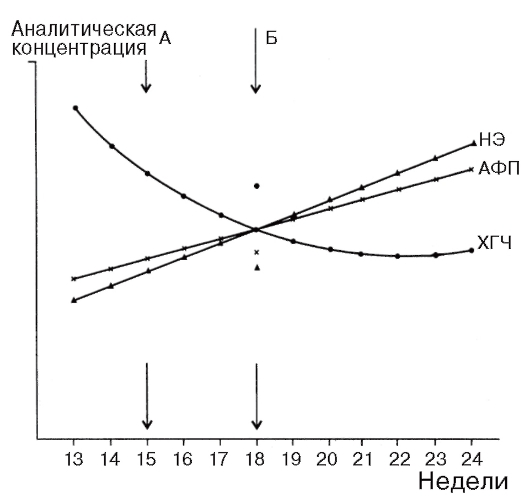
Рис. 11.5. Комбинация результатов просеивающей биохимической диагностики врожденных аномалий нервной трубки и синдрома Дауна: по оси абсцисс - срок беременности; по оси ординат - аналитическая концентрация; А - низкий риск; Б - высокий риск; НЭ - неконъюгированный эстриол
Хотя возможность достоверного неинвазивного пренатального определения патологии или пола плода по периферической крови посредством предварительного обогащения клеток или ДНК сомнению не подвергается, по причине дороговизны применение этих методов остается в пределах научных исследований см. статью А.В. Лаврова «Фетальные клетки и свободная плодная ДНК в крови матери в неинвазивной перенатальной диагностике» на компакт-диске.
К неинвазивным методам относится УЗИ. Радиоили рентгенография применялась 20-30 лет назад (да и то не очень широко) на начальных этапах пренатальной диагностики. В последние годы постепенно становится возможным применение с целью визуализации плода МРТ. Несмотря на высокую разрешающую способность, ценность метода значительно снижается из-за небольшой скорости формирования изображения (секунды и десятки секунд), что вследствие подвижности плода может приводить к неверным результатам.
УЗИ позволяет выявить как врожденные пороки развития, так и функциональное состояние плода, плаценты, пуповины, оболочек. Сроки проведения УЗИ в России определены приказом Министерства здравоохранения. Это 10-13-я, 20-22-я и 30-32-я недели беременности. УЗИ можно также использовать для выявления задержки роста эмбриона или плода, начиная с 6-8-й недели беременности.
УЗИ можно применять и как просеивающий, и как уточняющий метод. В некоторых странах УЗИ проводят всем беременным. Это позволяет предупредить рождение 2-3 детей с серьезными врожденными пороками развития на 1000 новорожденных, что составляет примерно 30% всех детей с такой патологией. Для проведения детального повторного УЗИ как уточняющей диагностической процедуры можно выделить следующие показания:
• выявление отклонений (маркеров патологии) или пороков развития плода в ходе просеивающего УЗИ;
• несоответствие размеров плода сроку беременности;
• рождение предыдущего ребенка с врожденными пороками развития;
• болезни у женщины (сахарный диабет, эпилепсия, алкоголизм и др.), повышающие риск рождения ребенка с врожденными пороками развития;
• воздействие тератогенного фактора (радиация, химические вещества, инфекции) в первые 10 нед беременности;
• врожденные пороки развития у кого-либо из супругов (или у родственников I-III степени родства по линиям обоих супругов).
Краткий перечень врожденных пороков развития, диагностируемых с помощью УЗИ приблизительно в 80-90% случаев, представлен в табл. 11.5. Диапазон пороков, распознаваемых с помощью этого метода, достаточно широк. Этими сведениями должен владеть каждый врач. О возможностях пренатальной диагностики врожденных пороков сердца можно узнать в одноименной статье И.М. Волкова с соавт. на компакт диске.
Таблица 11.5. Врожденные пороки развития, диагностируемые с помощью ультразвукового исследования

Окончание таблицы 11.5

Инвазивные методы
Первоначально к инвазивным методам относилась только фетоскопия. Теперь инвазивными методами получают клетки и ткани эмбриона, плода и провизорных органов в любом периоде гестации. Разработка методов взятия материала стимулировалась появлением более совершенных методов лабораторной диагностики наследственных болезней. Инвазивные методы совершенствуются в нескольких направлениях: более раннее получение образцов для исследования, более широкий спектр образцов, более безопасные для беременной и плода методы взятия образцов.
К настоящему времени в мировой практике имеется достаточный опыт (миллионы обследованных) по применению хорион- и плацентобиопсии, получению амниотической жидкости (амниоцентез), биопсии тканей плода, взятию крови плода (кордоцентез).
Хорион- и плацентобиопсия применяются для получения небольшого количества ворсин хориона или кусочков плаценты в период с 7-й по 16-ю неделю беременности. Процедура осуществляется трансабдоминально или трансцервикально под контролем УЗИ (рис. 11.6, 11.7). Принципиальной разницы между показаниями для применения этих двух способов биопсии нет. Результативность процедуры зависит от того, каким методом специалист владеет лучше. Хотя хорионбиопсия технически проста, необходимы достаточный опыт и постоянное техническое совершенствование. Хорошие результаты получают акушеры, делающие не менее 200- 400 хорионбиопсий в год, неудачи составляют 1%. На основе большого материала (несколько миллионов случаев) сделаны выводы об осложнениях после хорионбиопсии. После трансцервикальной хорионбиопсии примерно у 10-30% женщин возникает небольшое
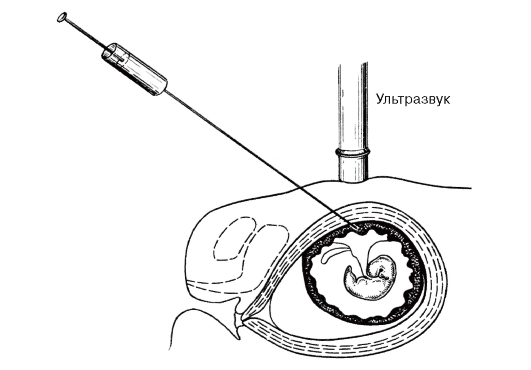
Рис. 11.6. Трансабдоминальная хорионили плацентобиопсия
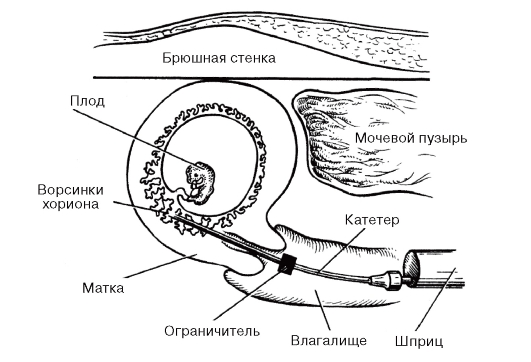
Рис. 11.7. Трансцервикальная хорионили плацентобиопсия
кровотечение, очень редко - маточная инфекция, после трансабдоминального способа у 2,5% женщин возможна угроза прерывания беременности.
Одним из осложнений хорионбиопсии является спонтанный аборт (выкидыш). Общие потери плода после хорионбиопсии составляют в среднем 2,5-3%, в эти цифры входит и частота спонтанных выкидышей. Собственно хорионбиопсия индуцирует, очевидно, не более 2% случаев прерывания беременности.
Каких-либо нарушений плаценты, роста плода, появления врожденных пороков развития и увеличения перинатальной смертности после хорионбиопсии не наблюдается. В некоторых центрах отмечено, что ранняя хорионбиопсия (в срок до 8 нед беременности) может индуцировать поперечные врожденные ампутации конечностей, так называемые редукционные пороки. В связи с этим (с 1992 г.) хорионбиопсию рекомендуется проводить после 8-й недели беременности, а после 11-й недели делают плацентобиопсию.
Образцы хориона (ворсины) подлежат цитогенетическому, молекулярно-генетическому, биохимическому исследованию с целью выявления наследственной патологии. При аспирации ворсин хориона в материал могут попадать клетки децидуальной оболочки матки, что может приводить к диагностическим ошибкам. Считается, что в 4% случаев лабораторная диагностика биоптатов хориона дает ложноположительные результаты (например, в 1,5% анализов отмечается хромосомный мозаицизм, который является мозаицизмом хориона, а не эмбриона), а иногда (хотя и крайне редко) - ложноотрицательные результаты. Точность анализов во многом зависит от квалификации врача лаборанта-генетика.
Амниоцентез - пункция плодного пузыря с целью получения околоплодной жидкости с находящимися в ней амниоцитами. Используется для пренатальной диагностики с начала 1970-х годов. Накоплен огромный опыт проведения этой процедуры. Диагностическая значимость метода не вызывает сомнений. Обычно процедура осуществляется на 15-18-й неделе беременности, ранний амниоцентез проводят на 12-15-й неделе беременности. Риск осложнений беременности при амниоцентезе меньше, чем при хорионбиопсии, по данным некоторых авторов, всего 0,2%. По этой причине во многих центрах пренатальной диагностики предпочитают делать амниоцентез, а не хорионбиопсию. В случае неудавшегося анализа хорионбиоптатов пренатальную диагностику повторяют с помощью амниоцентеза.
Амниоцентез проводят через переднюю брюшную стенку (трансабдоминально) женщины под контролем УЗИ (рис. 11.8). Чрезцервикальный амниоцентез возможен, но применяется редко. Из амниотической полости извлекают 3-30 мл жидкости.
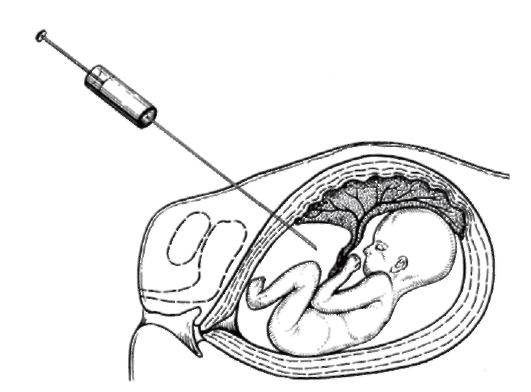
Рис. 11.8. Амниоцентез
Предлагавшиеся ранее биохимическое и вирусологическое исследования амниотической жидкости малоинформативны для пренатальной диагностики.
Из биохимических показателей жидкости только концентрация АФП диагностически значима. Уровень АФП существенно повышается при аномалиях нервной трубки и дефектах передней брюшной стенки.
Основным диагностическим материалом при амниоцентезе являются клетки. Их обязательно надо культивировать (на это затрачивается 2-4 нед) и для цитогенетических, и для биохимических исследований. Только молекулярно-генетические варианты диагностики с помощью ПЦР не требуют культивирования клеток.
Кордоцентез - внутриматочная пункция сосудов пуповины для получения крови плода (рис. 11.9). Сроки кордоцентеза - 18-22-я неделя беременности. Образцы крови используют для цитогенетической (культивируются лимфоциты), молекулярно-генетической и биохимической диагностики наследственных болезней.
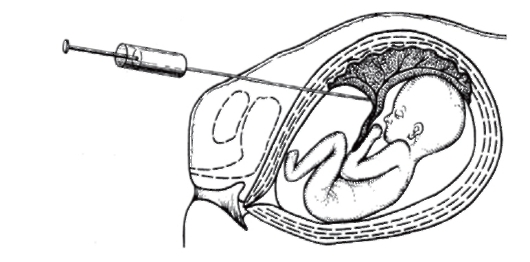
Рис. 11.9. Кордоцентез
Кордоцентез применяют для диагностики хромосомных болезней, наследственных болезней крови (гемоглобинопатии, коагу-
лопатии, тромбоцитопении), иммунодефицитов, гематологического статуса при резуссенсибилизации, внутриутробных инфекций.
По данным мультицентрового исследования, частота осложнений при кордоцентезе суммарно по 16 российским центрам пренатальной диагностики не пре-
вышает 2%. Первая попытка получить материал успешна в 80-97% случаев. Преимущество кордоцентеза по сравнению с амниоцентезом заключается в том, что кровь удобнее для исследования, чем клетки амниотической жидкости. Лимфоциты культивируются быстрее (2-3 дня) и надежнее, чем амниоциты. Молекулярные методы быстрого кариотипирования в пренатальной диагностике см. на компакт-диске в одноименной статье В.А. Тимошевского и И.Н. Лебедева.
Биопсия тканей плода как диагностическая процедура осуществляется во II триместре гестации под контролем УЗИ.
Для диагностики тяжелых наследственных болезней кожи (ихтиоз, эпидермолиз) делают биопсию кожи плода с патоморфологическим (а иногда и с электронно-микроскопическим) исследованием материала. Морфологические критерии наследственных болезней кожи позволяют установить точный диагноз или уверенно отвергнуть его.
Для диагностики мышечной дистрофии Дюшенна на внутриутробной стадии разработан иммунофлюоресцентный метод. Для этого производят биопсию мышц плода. Биоптат обрабатывают моноклональными мечеными антителами к белку дистрофину, который у больных не синтезируется. Соответствующая флюоресцентная обработка высвечивает белок. При унаследовании патологического гена свечение отсутствует. Этот прием является примером диагностики наследственной болезни на уровне первичного продукта гена. В случае миопатии Дюшенна такой метод дает более точные результаты, чем молекулярно-генетическая диагностика.
Заключение
Врачу общей практики необходимо иметь представление о методах пренатальной диагностики, их возможностях и ограничениях, о показаниях для направления на исследования. Конкретные сроки ее проведения и выбор метода (а иногда методов) определяет группа (команда) пренатальной диагностики (врач-генетик, акушер-гинеколог и врач лаборант-генетик), основываясь на состоянии здоровья беременной, течении беременности, психологической готовности женщины к процедуре. Объем и возможности вторичной профилактики наследственных болезней путем элиминации эмбрионов и плодов после пренатальной диагностики представлены в суммированном виде в табл. 11.6-11.8.
Таблица 11.6. Методы пренатальной диагностики
Таблица 11.7. Сравнительная характеристика методов пренатальной диагностики с использованием трансабдоминальной техники взятия образцов (по материалам Всемирной организации здравоохранения)

Окончание таблицы 11.7
Таблица 11.8. Показания для применения разных методов инвазивной пренатальной диагностики
ПРЕДЫМПЛАНТАЦИОННАЯ ДИАГНОСТИКА
Благодаря развитию методов вспомогательных репродуктивных технологий [экстракорпоральное оплодотворение, интрацитоплазматическая инъекция сперматозоида в ооцит (ICSI)], с одной стороны, и усовершенствованию методов лабораторной диагностики наследственных болезней, с другой, в конце 90-х годов прошлого века зародилась предымплантационная диагностика. Материалом для
предымплантационной диагностики являются полярные тельца или отдельные бластомеры, полученные с помощью микроманипулятора из бластоцист.
Такая диагностика относится к методам первичной профилактики наследственных болезней. Ее преимущество заключается в том, что она помогает избежать повторных абортов после обычной пренатальной диагностики в семьях с высоким риском наследственной патологии.
Предымплантационная диагностика успешна при следующих условиях:
• получение зародыша на предымплантационной стадии развития (до 5-7-го дня после оплодотворения);
• наличие диагностических (аналитических) микрометодов на уровне одной или нескольких клеток;
• микрохирургическая техника (микробиопсия) для взятия минимального числа клеток без повреждения зародышевого пузырька;
• точные медицинские показания со стороны семьи для диагностики.
Получение предымплантационных эмбрионов возможно нехирургическим маточным лаважем и оплодотворением в пробирке.
С помощью маточного лаважа можно получить еще не имплантировавшийся зародыш в течение 90-130 ч после оплодотворения. К этому времени зародыш спускается из маточной трубы в матку. Эта процедура безболезненная и безопасная. Соответствующие приспособления (улавливатель, проводник и катетер) уже прошли испытание. Процедура не влияет на последующие овариальные циклы и не препятствует будущим беременностям.
После подсадки зародыша в матку нормальная беременность наступает в 50% случаев.
Экстракорпоральное оплодотворение и интрацитоплазматическая инъекция сперматозоида в ооцит (ICSI) хорошо зарекомендовали себя в акушерской практике. Эти методы применяют для преодоления различных видов бесплодия.
Микрохирургическая процедура выделения клетки для лабораторной диагностики осуществляется с помощью микроманипулятора (рис. 11.10). От зародыша на стадии 8-16 клеток можно отделить 1-2 клетки. Иногда исследование ограничивается вторичным полярным тельцем (оно несет геном яйцеклетки). Зародыш сохраняют
в условиях глубокой заморозки (или зародыш продолжает развиваться в искусственных условиях), пока проводится анализ клетки.
Подсадка после заморозки возможна во время любого другого овариального цикла.
Диагностика на уровне одной или нескольких клеток в настоящее время реальна при многих болезнях. Ее проводят с использованием ПЦР, моноклональных антител, ультрамикроаналитических методов. Уже появились сообщения об успешной диагностике на предымплантационной стадии синдрома Марфана, миотонической дистрофии, хореи Гентингтона, семейного полипозного рака толстой кишки, муковисцидоза,
ОМ2-ганглиозидоза (болезнь Тея-Сакса), синдрома Леша-Найхана, талассемии, спинальной мышечной атрофии, мышечной дистрофии Дюшенна, умственной отсталости с ломкой Х-хромосомой, фенилкетонурии.
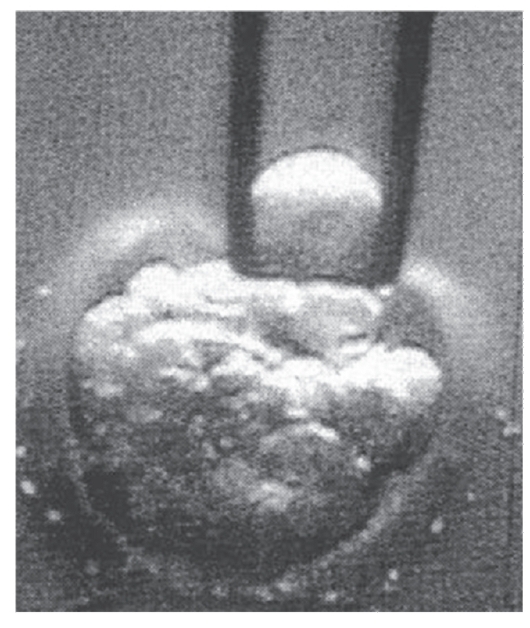
Рис. 11.10. С помощью микроманипулятора удаляется одна клетка (с ядром) из человеческого эмбриона на стадии 12 клеток. Фото с видеозаписи
На сегодняшний день предымплантационная диагностика доступна примерно для 50 нозологических форм моногенной и хромосомной природы.
Можно надеяться, что в ближайшие годы методические возможности предымплантационной диагностики расширятся как в области получения диагностического материала, так и аналитических методов (культивирование предымплантационных эмбрионов и их бластомеров, микроманипуляции, криопрезервация).
Предымплантационная диагностика - крайне важное направление в системе новых репродуктивных технологий, потому что по непонятным пока причинам частота анеуплоидий у эмбрионов человека, согласно данным отечественных исследователей, очень
высокая: 30-50% аномальных зародышей при оценке анеуплоидий по хромосомам 13, 16, 18, 21, 22, Х и Y. Подробнее о предымплантационной диагностике можно узнать из статьи А.В. Светлакова с соавт. «Задачи и перспективы предимплантационной генетической диагностики» на компакт-диске.
ДОКЛИНИЧЕСКАЯ ДИАГНОСТИКА,
ПРОСЕИВАЮЩИЕ ПРОГРАММЫ И ПРОФИЛАКТИЧЕСКОЕ ЛЕЧЕНИЕ
Идея просеивания (скрининга) родилась в США в начале ХХ в. (осмотр школьников, профилактические осмотры на выявление туберкулеза, регулярные обследования рабочих и др.). Перечисленные приемы уверенно вошли в практику мирового здравоохранения. Скрининг предполагает массовое и безотборное обследование, профилактическую направленность и двухэтапность (по меньшей мере) диагностики.
Просеивание (скрининг) можно определить как идентификацию нераспознанных болезней с помощью быстро осуществляемых тестов. Это обеспечивает отбор лиц с вероятным заболеванием. Их повторно обследуют с применением уточняющих диагностических методов, позволяющих либо отвергнуть предполагавшийся на первом этапе диагноз, либо подтвердить его.
Идея массового обследования новорожденных на наследственную болезнь стала проверяться в 60-х годах ХХ в. К настоящему времени уже окончательно сложились основные положения массовой диагностики наследственных болезней на доклинической стадии (критерии отбора наследственных болезней для скрининга и диагностические методы).
Массовое просеивание новорожденных на наследственные болезни проводится, если они:
• без своевременного профилактического лечения существенно снижают жизнеспособность, приводят к инвалидности и к необходимости специальной помощи больному;
• поддаются точной биохимической или молекулярно-генетической диагностике на доклинической стадии;
• поддаются эффективному профилактическому лечению;
• имеют частоту 1 : 10 000 и выше. Лишь в некоторых странах при наличии исследовательской группы просеивание новорожден-
ных осуществляется для болезней, встречающихся с частотой 1 : 20 000-1 : 40 000. Диагностические методы массового просеивания новорожденных должны отвечать следующим критериям.
- Экономичность. Методы должны быть технически простыми и дешевыми в массовых исследованиях.
- Диагностическая значимость. Ложноотрицательных результатов практически не должно быть, а соотношение истинно положительных и ложноположительных должно быть не менее 1:5. Это можно назвать чувствительностью и специфичностью метода.
- Надежность или воспроизводимость. Результаты обследования должны одинаково воспроизводиться в работе разных исследователей.
- Доступность биологического материала. Метод должен быть приспособлен к анализу биологического материала, легко получаемого в малом количестве, хорошо сохраняемого (хотя бы несколько дней) и приемлемого для пересылки в централизованную лабораторию.
Основная цель программ массового просеивания новорожденных на наследственные болезни - раннее выявление заболевания на доклинической (досимптомной) стадии и организация лечения. Программа обязательно включает следующие этапы:
• взятие биологического материала для исследования у всех новорожденных и доставка материала в диагностическую лабораторию;
• лабораторная просеивающая диагностика;
• уточняющая диагностика всех случаев с положительными результатами при просеивании;
• лечение и диспансеризация больных с контролем хода лечения;
• медико-генетическое консультирование семьи.
Таким образом, программы массового обследования на наследственные болезни, поддающиеся профилактическому лечению, могут учреждаться только в рамках федерального или регионального (в том числе городского) здравоохранения. Для этого нужны организация специального звена в структуре здравоохранения и немалые экономические затраты, которые в общегосударственном масштабе компенсируются уменьшением числа инвалидов с детства. Многочисленные исследования, проведенные в разных странах, показали, что экономическая эффективность просеивающих программ (сохранение здоровья леченых индивидов) дает государству 5-10-кратную экономическую выгоду.
Первая программа скрининга новорожденных на фенилкетонурию была организована в США примерно 25 лет назад. За прошедшее время в разных странах проверялись также программы более чем для 10 наследственных болезней обмена веществ. В результате были отработаны изложенные выше критерии массовой диагностики наследственных болезней. В конечном счете страны с развитым здравоохранением стали проводить массовое просеивание новорожденных лишь для нескольких болезней, характеристики которых представлены в табл. 11.9. Следует отметить, что эти рекомендации справедливы для популяций европеоидной расы. Для других рас, а иногда популяций частоты указанных болезней могут быть ниже, и тогда не будет показаний для их массовой диагностики.
Таблица 11.9. Характеристики болезней, по которым проводится массовое просеивание новорожденных
С 2006 г. в России проводится неонатальный скрининг пяти наследственных заболеваний: адреногенитального синдрома, галактоземии, врожденного гипертиреоза, муковисцидоза, фенилкетонурии - с целью их раннего выявления, своевременного лечения, профилактики инвалидности, развития тяжелых клинических последствий, снижения детской смертности.
Для проведения неонатального скрининга забирают образцы крови из пятки новорожденного на 4-й день жизни (у доношенных) и на 7-й день у недоношенных через 3 ч после кормления. Забор образцов крови осуществляется на специальные фильтровальные тест-бланки, которые выдаются медико-генетической консультацией
учреждениям здравоохранения, оказывающим медицинскую помощь женщинам в период родов. С результатами, проблемами и перспективами неонатального скрининга можно ознакомиться в одноименной статье Л.П. Назаренко с соавт. на компакт-диске.
Фенилкетонурия
В России в последние десятилетия введена федеральная программа скрининга, основанная на флюорометрическом количественном методе определения фенилаланина в крови. В разных странах применяются различные методы. Суть диагностики фенилкетонурии сводится к количественному определению концентрации фенилаланина в крови. Опыт показал, что пропущенные случаи фенилкетонурии являются не ошибками лабораторных методов, а следствием недобросовестности или небрежности при взятии крови в родильных домах.
В случае положительного результата скрининга у детей проводят уточняющую биохимическую диагностику. Это уже более сложная, иногда многоэтапная процедура. Во-первых, необходимо подтвердить гиперфенилаланинемию, во-вторых, следует разобраться в ее причине. Она может быть обусловлена типичной фенилкетонурией (недостаточность фенилаланингидроксилазы), вариантными или атипичными формами этой болезни, наследственной гиперфенилаланинемией (доброкачественной), другими формами нарушения метаболизма.
При подтверждении диагноза фенилкетонурии ребенка переводят на искусственную бесфенилаланиновую диету.
В таблице 11.10 приведены названия питательных смесей для питания детей с фенилкетонурией.
Таблица 11.10. Бесфенилаланиновые питательные смеси
Витамины и минеральные соли дают в виде фармакологических препаратов. Со временем диету расширяют. Дети старше 1 года легче переносят пищевой фенилаланин. Лечение диетой проводится под регулярным биохимическим контролем концентрации фенилаланина в крови: 2 раза в неделю в 1-й месяц (обычно это период госпитализации), еженедельно до 6-месячного возраста, 2 раза в месяц в возрасте 6 мес - 1 год и ежемесячно в дальнейшем. Этот контроль позволяет определять адекватность терапии.
При своевременном начале лечения бесфенилаланиновой диетой в первые месяцы после рождения у детей, гомозиготных по гену недостаточности фенилаланингидроксилазы, не отмечается никаких клинических признаков задержки психического или физического развития. С 9-11 лет у таких пациентов диету можно существенно расширить, но они остаются под наблюдением специалиста-генетика. Это особенно актуально для женщин, больных фенилкетонурией, так как во время беременности повышенный уровень фенилаланина и его дериватов в сыворотке женщины токсичен для генетически здорового плода. Это требует специальных профилактических мероприятий.
Врожденный гипотиреоз
Под названием «врожденный гипотиреоз» понимают сумму наследственной и ненаследственной патологии: агенезию щитовидной железы, эктопию щитовидной железы, дисгормоногенез (наследственные болезни), аутоиммунные процессы. Основные клинические проявления: умственная отсталость, резкое отставание в росте, отечность кожных покровов, а при дисгормоногенезе - и развитие зоба. Для всех форм болезни приемлема одна и та же программа массового просеивания, поскольку биохимическими маркерами являются снижение в плазме крови содержания тироксина и увеличение содержания тиреотропного гормона (ТТГ). Диагностическая значимость просеивания в полной мере проявляется при определении обоих маркеров, но по экономическим соображениям часто останавливаются на определении ТТГ.
Применяют радиоиммунный и иммуноферментный (иммунофлюоресцентный) методы просеивающей диагностики. Их чувствительность и специфичность примерно одинаковы. Иммуноферментный метод предпочтительнее по техническим соображениям. Тироксин и ТТГ определяют в образцах крови
новорожденных, высушенных на специальной фильтровальной бумаге (см. выше).
При положительном результате диагноз должен быть подтвержден эндокринологом в клинических условиях и результатом лабораторного анализа сыворотки крови на тироксин, ТТГ и другие гормоны.
Заместительную терапию левотироксином натрия (L-тироксин) нужно начинать у детей с положительным просеивающим тестом еще до окончательного подтверждения диагноза. Эффективность терапии достаточно высока, но лечение, начатое после 2-го месяца жизни, неэффективно, хотя к этому возрасту заболевание клинически проявляется только у 4% больных. Это делает особенно важной раннюю диагностику.
Врожденная гиперплазия надпочечников
Эта к линическая форма объединяет 9 наследственных нарушений ферментных процессов в трех взаимосвязанных метаболических путях стероидогенеза. Наиболее часто встречается недостаточность 21-гидроксилазы, на основе чего разработаны методы просеивающей диагностики у новорожденных. Эти методы выявляют биохимический маркер болезни - увеличение содержания 17-α-оксипрогестерона в крови. Разработаны радиоиммунный и иммуноферментный методы, позволяющие четко улавливать повышенный уровень 17-α-оксипрогестерона. Чувствительность обоих методов достаточно высокая, но по техническим соображениям предпочтительнее иммуноферментный метод.
При установлении диагноза по клинической картине необходимо лабораторное подтверждение.
Лечение - заместительная гормональная терапия, обычно успешное.
Галактоземия
В России, начиная с 2006 г., проводится скрининг на галактоземию. Это заболевание - следствие мутаций ферментов, участвующих в метаболизме галактозы. Из-за недостаточности этих ферментов в организме накапливаются токсические метаболиты (галактоза и галактозо-1-фосфат), которые негативно действуют на внутренние органы (печень, мозг, почки, кишечник). Помимо этого для галактоземии характерно угнетение активности лейкоцитов, что чаще всего приводит к сепсису. Заболевание манифестирует на 1-2-й неделе жизни. Дети без лечения живут не дольше полугода.
Скрининг новорожденных проводят на 4-5-й день у доношенных детей и на 7-й день - у недоношенных. Важно, чтобы ребенок находился на естественном вскармливании или на питании с помощью галактозосодержащих смесей.
Существует несколько подходов выявления галактоземии. В нашей стране оценивают уровень метаболитов и галактозы в сыворотке новорожденных с помощью тандемной масс-спектрометрии. При уровне галактозы >7 мг% в сыворотке новорожденного тест повторяют, при уровне >10 мг% - считают положительным. Одновременно с этим проводят и ферментный анализ флюорометрическим методом. Основное преимущество ферментного анализа - возможность выявить недостаточность вне зависимости от характера питания. Однако этот метод позволяет выявить лишь гомозигот по мутации галактозо- 1-фосфатуридилтрансферазы (в гене GALT), тогда как гетерозиготы и гомозиготы по мутациям других ферментов (галактокиназы и УДФ- галактозо-4-эпимеразы) могут быть пропущены.
Основным недостатком биохимического скрининга новорожденных на галактоземию является достаточно большое количество ложноположительных результатов. Связано это с тем, что условия получения, транспортировки и хранения материала (температура, влажность) могут привести к снижению активности фермента.
Подтверждают диагноз молекулярно-генетическими методами. Найдено уже более 180 различных мутаций в гене GALT, но наиболее часто встречаются Q188R и K285N. В совокупности они составляют около 70% случаев заболевания классической формой галактоземии. Описана также мутация N314D в этом же гене, приводящая к галактоземии Дуарте. Этот вид галактоземии отличается относительно мягким течением, уровень фермента снижается незначительно, что приводит к стертой клинике. Галактоземию Дуарте чаще всего можно выявить только путем скрининга.
До сих пор внедрение скрининга новорожденных на галактоземию считается спорным вопросом, так как данное заболевание не отвечает всем критериям ВОЗ для массового скрининга: заболевание является редким, оно может манифестировать еще до получения результатов скрининга, лечение не всегда полностью купирует все симптомы. Поэтому в последнее время все чаще говорят о селективном скрининге галактоземии, включающем проведение метаболических исследований совместно с молекулярно-генетическими в группах риска. Именно таким образом можно исключить ложноположительные
результаты скрининга и определить вид галактоземии, что существенно повысит эффективность лечения.
Лечение галактоземии предполагает исключение из пищевого рациона галактозы. Это позволяет уменьшить и предупредить развитие осложнений со стороны внутренних органов. Однако раннее начало лечения не влияет на возникновение отдаленных последствий. У больных галактоземией часто отмечается задержка умственного и речевого развития, развиваются эндокринологические и неврологические нарушения, отклонения со стороны половых органов. Узнать подробнее о галактоземии можно в статье Е.Ю. Захаровой с соавт. «Гальктоземия тип I: клинические проявления, диагностика и лечение» на компакт-диске.
Муковисцидоз
Неонатальный скрининг на муковисцидоз основан на значительном повышении концентрации иммунореактивного трипсина в крови новорожденных, страдающих этим заболеванием. Протокол скрининга на муковисцидоз включает 4 этапа.
- Первичный тест на иммунореактивный трипсин. Если уровень иммунореактивного трипсина больше или равен 70 нг/мл, то проводят 2-й этап.
- Ретест на иммунореактивный трипсин проводят на 21-28-й день. Если уровень иммунореактивного трипсина больше или равен 40 нг/мл, то переходят к 3-му этапу.
- Потовая проба - определение хлоридов в поте биохимическим методом. Если содержание хлоридов 60-80 ммоль/л (пограничный результат), то проводят 4-й этап. Если больше 80 ммоль/л, то считают скрининг на муковисцидоз положительным.
- ДНК-диагностика (молекулярно-генетическое обследование проводится в том случае, если потовая проба имеет сомнительные результаты или по желанию родителей).
Молекулярно-генетическое подтверждение доступно лишь в некоторых регионах России, поэтому ключевым этапом скрининга является потовая проба, которую обычно делают дважды.
Ранние лечебно-реабилитационные мероприятия, включающие заместительную ферментную терапию, приводят к улучшению нутритивного статуса, что ведет к улучшению состояния и замедлению необратимых процессов в бронхолегочной системе, а следовательно, определяет и более высокую продолжительность жизни. Раннее
выявление больных муковисцидозом способствует профилактике данного заболевания путем проведения пренатальной диагностики.
Итак, предотвратить клинические проявления наследственной патологии можно путем профилактического лечения болезни на предсимптоматической стадии. Прогресс молекулярной и клинической медицины позволяет идти дальше по пути нормокопирования патологических генетических состояний. Уже разрабатываются методы пренатального лечения (см. табл. 11.3), и имеется опыт лечения метилмалоновой ацидурии на внутриутробной стадии большими дозами витамина В12. Недостаточность карбоксилазы лечат пренатально введением биотина. Лечение дексаметазоном врожденной недостаточности 21-гидроксилазы можно начинать с 9-й недели беременности, если проведена пренатальная диагностика. Женщинам, больным фенилкетонурией и гетерозиготным по гену фенилкетонурии, во время беременности рекомендуется диета с низким содержанием фенилаланина.
В последнее время развивается гипотеза преконцепционной профилактики. Период такой профилактики включает несколько месяцев до зачатия и ранние сроки развития зародыша. Предполагается, что подготовка организма женщины (полноценная витаминизированная диета, антиоксидантная терапия, коррекция иммунитета, отсутствие стрессов) до зачатия и на ранних стадиях развития зародыша (до 10-й недели) способствует уменьшению частоты врожденных пороков развития многофакторной природы. Особенно четко это показано для аномалий нервной трубки (различные варианты спинномозговых грыж) и врожденных пороков сердца. Частота повторного рождения ребенка с таким пороком в среднем равна 4,6%, а у женщин, которые принимали фолиевую кислоту и витамин С, - 0,7%.
КЛЮЧЕВЫЕ СЛОВА И ПОНЯТИЯ
Генная инженерия и первичная профилактика
Груз наследственной патологии (медицинские последствия)
Лабораторная пренатальная диагностика
Медико-генетическое консультирование
Методы пренатальной диагностики
Методы просеивающей пренатальной диагностики
Первичная, вторичная и третичная профилактика наследственных болезней
Преконцепционная профилактика Показания для пренатальной диагностики Предымплантационная диагностика Пренатальное лечение Прогноз здоровья потомства
Просеивающие программы диагностики болезней обмена для новорожденных
Профилактическое лечение Тератаназия
Ультразвуковая диагностика врожденных пороков развития Фенотипическая коррекция Функции врача-генетика
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Лавров А.В. Фетальные клетки и свободная плодная ДНК в крови матери в неинвазивной пренатальной диагностике // Медицинская генетика. - 2009. - Т. 8. - № 7. - С. 3-8.
Пренатальная диагностика наследственных и врожденных болезней / под ред. Э.К. Айламазяна, В.С. Баранова. - М.: МЕДпрессинформ, 2006. - 416 с.