Клиническая генетика : учебник / Н. П. Бочков, В. П. Пузырев, С. А. Смирнихина ; под ред. Н. П. Бочкова. - 4-е изд., доп. и перераб. - 2011. - 592 с. : ил.
|
|
|
|
Глава 1. ВВЕДЕНИЕ В КЛИНИЧЕСКУЮ ГЕНЕТИКУ
ОСНОВНЫЕ ПОНЯТИЯ
Генетика наряду с морфологией, физиологией и биохимией служит теоретическим фундаментом современной медицины. Наследственность лежит в основе всех жизненных проявлений. Без наследственности и изменчивости была бы невозможна эволюция жизни на Земле. Поскольку человек - продукт длительной эволюции живой природы, все общебиологические закономерности отражены в его формировании как биологического вида Человек разумный (Homo sapiens).
Генетика человека изучает явления наследственности и изменчивости на всех уровнях его организации и существования: молекулярном, клеточном, организменном, популяционном, биохорологическом, биогеохимическом. С периода зарождения (начало XX в.) и особенно в период интенсивного подъема (50-е годы XX в.) генетика человека развивалась не только как теоретическая, но и как клиническая дисциплина, постоянно подпитываясь как общебиологическими концепциями (эволюционное учение, онтогенез), так и генетическими открытиями [законы наследования признаков, хромосомная теория наследственности, информационная роль ДНК (дезоксирибонуклеиновой кислоты)]. В то же время на процесс становления генетики человека как науки постоянно и существенно влияли достижения теоретической и клинической медицины. Человек как биологический объект изучен детальнее, чем любой другой высокоорганизованный организм (дрозофила, мышь и др.). Изучение патологических вариаций (предмет врачебной профессии) стало основой для познания наследственности человека. В свою очередь, развитие генетики человека ускоряло развитие теоретических дисциплин (например, молекулярной биологии) и клинической медицины (например, новой области в медицине - учения о хромосомных болезнях).
Медицинская генетика изучает роль наследственности в патологии человека, закономерности передачи от поколения к поколению
* Исправлено и дополнено при участии д-ра биол. наук И.Н. Лебедева.
наследственных болезней, разрабатывает методы диагностики, лечения и профилактики наследственной патологии, включая болезни с наследственной предрасположенностью. Результатом исследований в этом направлении становятся медицинские и генетические открытия и достижения, направленные на борьбу с болезнями и улучшение здоровья людей.
Медицинская генетика, составляя важнейшую часть теоретической медицины, рассматривает в связи с патологией следующие вопросы:
• какие наследственные механизмы поддерживают гомеостаз организма и определяют здоровье индивида;
• каково значение наследственных факторов (мутации или сочетание определенных аллелей) в этиологии болезней;
• каково соотношение наследственных и средовых факторов в патогенезе болезней;
• какова роль наследственных факторов в определении клинической картины болезней (и наследственных, и ненаследственных);
• влияет ли (и если влияет, то как) наследственная конституция на процесс выздоровления человека и исход болезни;
• как наследственность определяет специфику фармакологического и других видов лечения.
Как теоретическая и клиническая дисциплина медицинская генетика продолжает интенсивно расширяться в разных направлениях: геномика, цитогенетика, молекулярная и биохимическая генетика, иммуногенетика, генетика развития, популяционная генетика, клиническая генетика, фармакогенетика, экологическая генетика, нутригенетика, токсикогенетика.
Образование по медицинской генетике включает изучение основ общей генетики (менделизм, учение о хромосомах, химические основы наследственности), основных положений генетики человека (человек как объект генетического исследования) и клинической генетики.
Клиническая генетика - прикладной раздел медицинской генетики. Ее достижения применяются для решения клинических проблем пациентов или их семей. Она дает ответ на вопросы: какая болезнь у пациента (диагноз), как ему помочь (лечение), как предупредить рождение больного потомства (прогноз и профилактика), как диагностировать и уменьшить вероятность развития болезни с наследственным предрасположением. В настоящее время в клинической генетике используются, с одной стороны, генетические методы (генетический анализ, молекулярно-биологические, цитогенетические, биохими-
ческие, иммуногенетические) и, с другой стороны, все современные методы клинического обследования [ультразвуковое исследование (УЗИ), магнитно-резонансная томография (МРТ), компьютерная томография (КТ), позитронно-эмиссионная томография (ПЭТ)].
КРАТКАЯ ИСТОРИЯ МЕДИЦИНСКОЙ ГЕНЕТИКИ
Доменделевский период
Учение о наследственности человека зарождалось в медицине из эмпирических наблюдений семейных и врожденных болезней. Уже в трудах Гиппократа отмечалась роль наследственности в происхождении болезней: «...эпилепсия, как и другие болезни, развиваются на почве наследственности; и действительно, если от флегматика проис-
ходит флегматик, от желчного - желчный, от чахоточного - чахоточный, от страдающего болезнью селезенки - страдающий болезнью селезенки, то что может помешать, чтобы болезнь, которою страдают отец и мать, поразила бы также одного из их детей». Однако в дальнейшем интерес к роли наследственности в происхождении болезней был утрачен, и на первое место в теориях медицины выдвигались внешние этиологические факторы. Лишь в XVIII-XIX вв. появились отдельные работы о значении наследственности в происхождении болезней (полидактилия, гемофилия, альбинизм).

Рис. 1.1. В.М. Флоринский (1834- 1899). Акушер-гинеколог и педиатр. Автор книги «Усовершенствование и вырождение человеческого рода» (1865). Основатель первого в Сибири учебного заведения - Сибирского университета в Томске (1880-1888)
Понятие о патологической наследственности у человека утвердилось во второй половине XIX в. и было принято многими врачебными школами. С пониманием патологической наслед-
ственности зародилась концепция о вырождении человеческого рода и необходимости его улучшения, причем одновременно (1865 г.) и независимо друг от друга ее высказывали В.М. Флоринский в России и Ф. Гальтон в Англии (рис. 1.1, 1.2).

Рис. 1.2. Френсис Гальтон (1822- 1911). Один из основоположников генетики человека и евгеники. Основные труды в этой области: «Наследственный талант и характер» (1865); «Наследственный гений: исследование его законов и следствий» (1869); «Очерки по евгенике» (1909)
Предпосылки развития учения о наследственности человека в XIX в. вытекали из биологических открытий, революционизировавших развитие медицины: клеточной теории (Т. Шванн) и доказательства клеточной преемственности (Р. Вирхов); понимания идеи онто- и филогенеза; объяснения эволюции на основе естественного отбора и борьбы за существование (Ч. Дарвин).
Не меньшее влияние, чем биологические открытия, на развитие учения о наследственных болезнях оказали общемедицинские предпосылки. В XIX в. изучение причин заболеваний стало главным направлением в
медицине. Начался период выделения отдельных болезней как нозологических единиц, в том числе наследственных. Например, были описаны болезнь Дауна, нейрофиброматоз, врожденная дисплазия соединительной ткани и др. Изучение патологических симптомов сменилось изучением нозологических форм болезненных процессов, которые можно было прослеживать в родословных как дискретные формы.
Несмотря на то, что в XIX в. учение о наследственных болезнях и закономерностях наследственности человека существенно продвинулось, в целом еще было много противоречий. В большинстве работ этого периода были перемешаны факты и ошибочные представления. Критериев правильной интерпретации наследования болезней еще не
существовало. Генетика человека находилась на «донаучной» стадии развития. Этот период можно назвать доменделевским.
Открытие законов Менделя
Только с переоткрытием законов Менделя в 1900 г. появились уникальные возможности «инвентаризации» наследственных болезней. На примере то одной, то другой болезни законы Менделя подтверждались либо врачами, либо биологами. Наследственность как этиологическая категория прочно вошла в медицину. Природа многих болезней стала понятной.
Так, в самом начале XX в. английский врач А. Гаррод объяснил наследственный характер необычного метаболического состояния - аутосомно-рецессивной алкаптонурии - в соответствии с закономерностями наследования признаков, открытых Менделем. Более того, он объяснил своей идеей и другие биохимические аномалии, опубликовав в 1909 г. книгу «Врожденные ошибки метаболизма», благодаря которой он был признан отцом биохимической генетики.
В первых двух десятилетиях ХХ в. в результате эйфории от менделевской интерпретации многих болезней была существенно преувеличена роль наследственности в формировании поведения человека и наследственной отягощенности населения. Концепция обреченности и вырождения семей с наследственной патологией стала ведущей для объяснения отягощенности общества потомством таких больных. Диагноз наследственной болезни считался приговором больному и даже его семье. На этом фоне стала набирать силу евгеника - ранее сформулированное Ф. Гальтоном направление (или даже наука) об улучшении породы (или природы) человека (позитивная евгеника - преимущественное размножение лиц с положительными качествами).
Под негативной евгеникой понимали ту ее часть, которая ставила своей целью освобождение человечества от индивидуумов с наследственной патологией. Евгеника в конечном счете «обосновывала» насильственное ограничение репродуктивной свободы. Евгенику правильнее считать не наукой, а социальным или общественным движением. Подробная информация о евгенике представлена на компакт-диске (см. «Евгенику»).
Евгеника - один из примеров широкого необоснованного внедрения непроверенных результатов в практику (головокружение от успехов). В целом она сыграла отрицательную роль в развитии и генетики,
и медико-биологической науки. Подробно и объективно история евгеники в России изложена в книгах Е.А. Пчелова и В.В. Бабкова (см. рекомендуемую литературу).
20-е годы ХХ века
Генетика человека продолжает развиваться. На основе использования менделизма и хромосомной теории наследственности (формальная генетика) приходило понимание общих закономерностей
наследственной патологии, причин клинического полиморфизма, генетической гетерогенности, признание роли внешней среды в развитии болезней с наследственной предрасположенностью.
В нашей стране медицинская генетика в 20-30-х годах успешно развивалась. В первую очередь следует упомянуть основоположника клинической генетики С.Н. Давиденкова, одновременно и генетика, и невропатолога (рис. 1.3), который наряду с огромным вкладом в изучение генетики нервных болезней на несколько десятилетий определил разработку общегенетических проблем. Он первым в мире поставил вопрос о составлении каталога генов человека, сформулировал понятие о генетической гетерогенности наследственных болезней, организовал медикогенетическую консультацию.

Рис. 1.3. С.Н. Давиденков (1880- 1961). Генетик, невропатолог. Основатель клинической генетики в СССР. Впервые поставил вопрос о создании каталога генов (1925). Организовал первую в мире медикогенетическую консультацию (1929). По генетике наследственных болезней нервной системы опубликовал несколько книг: «Наследственные болезни нервной системы» (1-е изд. в 1925 г., 2-е изд. в 1932 г.); «Проблема полиморфизма наследственных болезней нервной системы» (1934); «Эволюционно-генетические проблемы в невропатологии» (1947)
Поддержал развитие медицинской генетики И.П. Павлов. В 20-х годах ХХ в. он приступил к изучению генетики высшей нервной деятельности. О его роли в становлении медицинской гене-
тики см. в статье Н.П. Бочкова на компакт-диске (см. «Статью об И.П.Павлове».)
30-40-е годы ХХ века
С 1930 по 1937 г. медицинская генетика развивалась в Медико-биологическом институте, переименованном в 1935 г. в Медико-генетический. Это был передовой институт, в котором проводились первоклассные близнецовые и цитогенетические исследования. Институт, к сожалению, был закрыт, а его директор проф. С.Г. Левит репрессирован (рис. 1.4).

Рис. 1.4. С.Г. Левит (1894-1937). Директор Медико-биологического института, преобразованного в 1935 г. в Медико-генетический институт. Руководил работами в разных областях генетики человека (цитогенетика, близнецовые исследования, клиническая генетика, формальная генетика)
В 30-х годах ХХ в. генетика твердо и широко вошла в медицинскую науку и практику. Наиболее точно значение генетики для медицины того периода выразил И.П. Павлов (1935): «Жизнь требует всемерного использования открытых Менделем законов наследственности. Генетические истины достаточно изучены для того, чтобы интенсивно начать применять их. Наши врачи должны как
азбуку знать законы наследственности. Воплощение в жизнь научной истины о законах наследственности поможет избавить человечество от многих скорбей и горя».
50-е годы - конец ХХ века
Наиболее эффективный период развития генетики человека начался с 50-х годов ХХ в. В 1959 г. была открыта хромосомная природа болезней, и цитогенетика на несколько лет стала веду-
щим направлением в медицине. В этот период сформировалась клиническая генетика как результат слияния трех ветвей генетики человека - цитогенетики, формальной (менделевской) генетики и биохимической генетики. Человек был главным объектом общегенетических исследований. Взаимовлияние генетики и медицины дало колоссальный рывок в исследовании наследственности человека и реализации достижений в практике.
Именно в 1960-е годы в нашей стране возобновилось развитие медицинской генетики. Старшее поколение генетиков и ученых смежных дисциплин (В.Д. Тимаков, С.Н. Давиденков, В.П. Эфроимсон, А.Д. Прокофьева-Бельговская, Е.Ф. Давиденкова, С.А. Нейфах, А.А. Малиновский, Е.Е. Погосянц, Н.Н. Медведев, Ю.Я. Керкис) приняло активное участие в ее возрождении. В 1969 г. в Москве был создан Институт медицинской генетики АМН СССР, преобразованный в 1989 г. во Всесоюзный научный центр медицинской генетики АМН СССР (ныне Учреждение Российской академии медицинских наук Медико-генетический научный центр РАМН). Информация об ученых-генетиках старшего поколения представлена на компакт-диске.
На рубеже ХХ и XXI вв. медицинская генетика заняла лидирующее место в медико-биологической науке, аккумулировав передовые методы и концепции разных медицинских и биологических дисциплин.
Интенсивному развитию медицинской генетики во второй половине ХХ в. способствовало несколько обстоятельств. Благодаря снижению уровня инфекционных и алиментарных заболеваний после Второй мировой войны больше внимания стали уделять болезням эндогенной природы, в том числе наследственным. Прогресс лабораторной и инструментальной медицины, широкий обмен информацией обеспечили более точную нозологизацию синдромов и болезней. Прогресс общей генетики и биологии принципиально изменил методологию генетического изучения человека (молекулярная биология, цитогенетика, генетика соматических клеток).
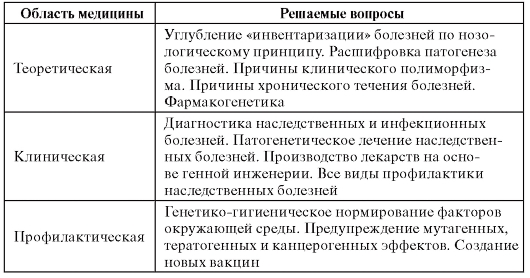
Главным итогом медицинской генетики к концу ХХ в. стало создание генетических технологий, которые позволяют ускоренно решать трудные вопросы в медицине и здравоохранении (табл. 1.1).
Таблица 1.1. Генетические технологии в медицине и здравоохранении
Современные успехи генетики человека заставляют врача по-новому их осваивать. «Как наша современная медицинская практика опирается на уточненные знания в области анатомии человека, физиологии и биохимии, так в будущем изучение генетических болезней потребует детального понимания молекулярной патологии, физиологии и биохимии генома человека. Нам потребуются врачи, настолько осведомленные в молекулярной анатомии и физиологии хромосом и генов, насколько кардиохирург знает работу сердца и структуру сосудистого дерева». Это высказывание лауреата Нобелевской премии П. Берга, относящееся к 1981 г., особенно актуально в настоящее время, когда в результате международной программы секвенирован и во многом расшифрован геном человека, а молекулярная медицина стала основой клинической и профилактической медицины.
АКСИОМЫ МЕДИЦИНСКОЙ ГЕНЕТИКИ
- Наследственные болезни - часть общей наследственной изменчивости человека. Нет резкой границы между наследственной изменчивостью, ведущей к вариациям нормальных признаков, и изменчивостью, результатом которой являются наследственные болезни. В одних и тех же генах могут возникать и нейтральные, и положительные, и патологические мутации.
- В развитии наследственных признаков или болезней принимают участие наследственная конституция (генотип) и внешняя среда. Во всех жизненных проявлениях действие любых генов осуществляется в тесном взаимодействии с факторами среды. Хотя в развитии одних признаков или болезней определяющую роль играет наследственность (генотип), а в развитии других существенное значение имеет внешняя среда, нет таких признаков, которые бы зависели только от наследственности или только от среды. При различных условиях среды экспрессия гена может изменяться и, следовательно, возможна разная выраженность фенотипа.
- Человечество отягощено огромным грузом разнообразных мутаций, которые накапливались в процессе длительной эволюции. Постоянный мутационный процесс поставляет новые мутации в генофонд человечества, а естественный отбор либо сохраняет и умножает их число, либо приводит к исчезновению.
- Наследственная отягощенность современного человечества состоит из двух компонентов. Один - это накопленные в процессе эволюции и истории человечества патологические мутации, другой - вновь возникающие наследственные изменения в половых клетках. Количество вновь возникающих мутаций может увеличиваться под влиянием мутагенных факторов среды (ионизирующей радиации, химических веществ и других факторов).
- Среда обитания человека в широком смысле слова, границы браков, планирование семьи принципиально изменились и продолжают изменяться. Человек постоянно сталкивается с новыми факторами среды, ранее никогда не встречавшимися на протяжении всей его эволюции, а также испытывает большие социальные и экологические нагрузки. Это приводит к появлению новых видов наследственной патологии - экогенетическим болезням. Расширился круг потенциальных брачных партнеров, больших масштабов достигла миграция населения, увеличивается мутагенная нагрузка; все это меняет генетическую структуру популяций человека. В то же время популяционные генетические процессы обладают большой инерцией, поэтому не следует ожидать, что всеобъемлющее расширение границ браков на всей планете, мутационный процесс и экогенетические реакции могут в короткий срок (1-2 поколения)
вызвать опасный взрыв наследственности человека или резкий подъем частоты наследственных болезней. - Прогресс медицины и общества приводит к увеличению продолжительности жизни больных с наследственными болезнями, восстановлению у них репродуктивной функции и, следовательно, к увеличению их числа в популяциях. Больной или носитель патологического гена является полноправным членом общества и имеет равные права со здоровыми людьми. Такие концепции, как евгеника, вырождение семей с наследственной патологией, неизлечимость наследственных болезней, запрещение браков или стерилизация по генетическим показаниям, ушли в прошлое.
ГЕНОМИКА И КЛИНИЧЕСКАЯ МЕДИЦИНА
Геномом называют полный состав ДНК клетки, т.е. совокупность всех генов и межгенных участков.
Общие принципы построения геномов и их структурнофункциональную организацию изучает геномика. Методы геномики направлены на расшифровку новых закономерностей биологических систем и процессов и включают секвенирование, картирование и идентификацию функций генов и внегенных элементов. Геномика человека - основа молекулярной медицины и имеет важнейшее значение для разработки методов диагностики, лечения и профилактики наследственных и ненаследственных болезней. Для медицины также большое значение имеют исследования в области геномики патогенных микроорганизмов, поскольку они проливают свет на природу инфекционного процесса и создание лекарств, направленных на специфические мишени бактерий.
Геномика подразделяется на несколько почти самостоятельных направлений: структурную, функциональную, сравнительную, эволюционную и медицинскую геномику.
Структурная геномика изучает последовательность нуклеотидов в геномах, определяет локализацию (картирование) и строение генов, распределение генетических элементов в пространстве всего генома. Этот раздел в геномике медицины иногда называют «анатомией генома человека», подчеркивая, что расположение генов на наших хромосомах является важнейшей особенностью нашей анатомии, как
все, что было описано в XVI в. А. Везалием в трактате «О строении человеческого тела в семи книгах». Неовезалианская метафора часто используется генетиками в характеристике генома человека.
Функциональная геномика направлена на идентификацию функций каждого гена и любых элементов генома, изучение их взаимодействия и регуляции на всех уровнях организации - от молекулярного, клеточного, органного и тканевого до организменного. В связи с этим функциональная геномика оперирует следующими понятиями.
- Транскриптом - полный набор транскриптов, производимых клеткой. Основные компоненты транскриптов - первичный РНК-транскрипт (РНК - рибонуклеиновая кислота) и молекулы матричной РНК (мРНК).
- Протеом - полный комплект белков, вырабатываемых данной клеткой; это белковый комплемент генома клетки.
- Метаболом - совокупность продуктов метаболизма клетки. Различают метаболомику и метабономику. Первая изучает продукты метаболизма клеток. Вторая - изменения метаболизма биологических систем под действием различных факторов.
- Интерактом - интегративная система всех межбелковых взаимодействий как основа любых биологических процессов.
- Феном, по аналогии с понятием «геном», определяется как полный набор фенотипических характеристик клетки.
Сравнительная геномика изучает сходства и различия в организации геномов разных организмов с целью выяснения общих закономерностей их строения и функционирования.
Эволюционная геномика объясняет пути эволюции геномов, причины происхождения генетического полиморфизма и биоразнообразия, роль горизонтального переноса генов. Эволюционный подход к изучению генома человека позволяет проследить за длительностью формирования комплексов генов, отдельных хромосом, стабильностью его частей, недавно обнаруженными элементами непостоянства генома, процессом расообразования, эволюцией наследственной патологии.
Медицинская геномика - самостоятельное направление, решающее прикладные вопросы клинической и профилактической медицины на основе знаний генома человека и геномов возбудителей инфекций. В этом направлении есть место анатомической метафоре, и некоторые специальные разделы называют «патологической анатомией
генома человека». В этом случае генетики в концентрированном виде представляют клиницистам информацию о тех мутациях или полиморфизмах генов, которые являются причиной болезней или вовлечены в их патогенез. Пример такой информационной базы в отношении наследственных болезней человека - каталог В. Маккьюсика «Менделевская наследственность человека» (Mendelian Inheritance in Man - MIM) и его электронная online-версия - OMIM.
Все шаги эволюции живой природы, несомненно, должны были закрепляться в информационной системе ДНК (для некоторых существ - в РНК), а также в ее организации в клетке для выполнения функции сохранения наследственности и противоположной функции - поддержания изменчивости. Это наиболее обоснованное представление о формировании генома каждого вида, поэтому применительно к геному человека можно сказать, что эволюция человека - это эволюция его генома. Такое положение подтверждается многочисленными молекулярно-генетическими исследованиями, поскольку стало возможным сопоставление геномов разных видов млекопитающих, в том числе человекообразных обезьян, а в пределах вида Homo sapiens - геномов разных рас, этносов, популяций и отдельных индивидов.
Организация генома каждого эукариотического вида представляет собой последовательную иерархию элементов: нуклеотидов, кодонов, доменов, генов с межгенными участками, сложных генов, хромосом, гаплоидного набора вместе с внехромосомной и внеядерной ДНК. В эволюционном преобразовании генома каждый из этих иерархических уровней мог вести себя совершенно различно (изменяясь, комбинируясь с другими и т.д.).
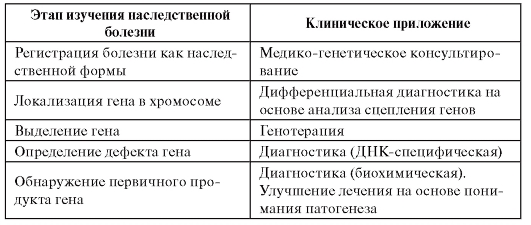
Учение о геноме человека - обширная область генетики человека, включающая следующие разделы: «инвентаризация» генов, группы сцепления, картирование генов (локализация), секвенирование всей ДНК (генов, их мутаций и хромосом в целом), мейотические преобразования, функционирование отдельных генов и их взаимодействие, интеграция структуры и функции генома в целом. На решении всех этих вопросов была сосредоточена обширная многолетняя Международная программа «Геном человека» (с 1990 по 2003 г.). Главным направлением работ было последовательное секвенирование участков генома. Успешные разработки в этой области сразу придали программе и клинико-генетическую значимость (табл. 1.2).
Таблица 1.2. Клинические приложения сведений о геноме человека
Систематическое изучение генома человека фактически началось с применения менделевского анализа наследственных признаков человека (начало XX в.). Генеалогический метод вошел тогда в широкую практику, и шаг за шагом стал накапливаться материал по «инвентаризации» дискретных наследственных признаков человека. Однако этот процесс постепенно замедлялся (за 50 лет было открыто не более 400 менделирующих признаков и 4 группы сцепления). Возможности клинико-генеалогического метода в чистом виде для этих целей были исчерпаны.
Бурный прогресс цитогенетики человека, биохимической генетики и особенно генетики соматических клеток в 60-х гг. ХХ в. в комплексе с генеалогическим подходом поставил изучение генома человека на новые теоретические основы и высокий методический уровень. Обнаружение новых менделирующих признаков человека, особенно биохимических и иммунологических, стало быстро продвигаться, появились возможности изучения сцепления и локализации генов.
Особый импульс изучению генома человека дали молекулярногенетические методы, или технология генной инженерии (70-е годы XX в.). Процесс познания генома углубился до выделения гена в чистом виде и его секвенирования.
В отличие от классической генетики, в современной генетике изменился подход к анализу генов. В классической генетике последовательность изучения наследственности была следующей: идентификация менделирующего признака - локализация гена в хромосоме
(или группе сцепления) первичный продукт гена ген. В современной генетике стал возможным и обратный подход: выделение гена - секвенирование - первичный продукт.
ХАРАКТЕРИСТИКА ГЕНОМА ЧЕЛОВЕКА
ДНК-уровень
Общее количество ДНК в соматической клетке составляет 6,2х109 пар оснований, следовательно, гаплоидный набор состоит из 3,1х109 пар нуклеотидов. Основное количество ДНК локализовано в хромосомах (99,5%). Внехромосомная часть генома человека - это ДНК митохондрий (0,5%). Совсем небольшое количество составляют отдельные кольцевые молекулы ДНК в ядре и цитоплазме. Структурные классы ДНК человека представлены на рис. 1.5.
В ядерной или хромосомной ДНК только 25-35% составляют гены и их регуляторные участки (это уникальные последовательности). Лишь 10% относящейся к генам ДНК является кодирующей.
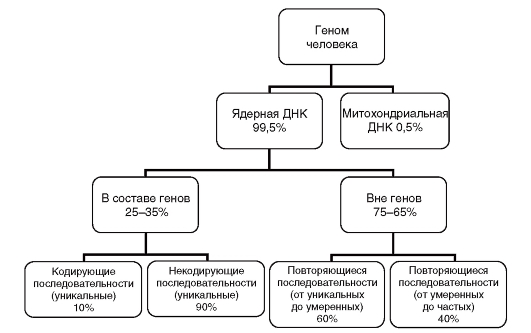
Рис. 1.5. Структурные классы ДНК человека
Следовательно, 2,5-3,5% всей ядерной ДНК имеют отношение к синтезу белков. Что делает остальная часть генома, пока неизвестно. Однако вряд ли она не имеет функций.
Повторы
В составе геномной ДНК выделяют несколько классов повторяющихся последовательностей. Участки ДНК различаются по длине каждого повтора и числу повторяющихся единиц (их называют тандемными). Различают умеренно повторяющиеся последовательности (до 1000 повторов в одном локусе) и высокоповторяющиеся (свыше 1000 повторов). Они могут быть локализованы в одном локусе или во многих локусах одной или разных хромосом. Одна и та же последовательность может повторяться в разных локусах разное число раз. Такие повторы называют гипервариабельными тандемными повторами.
Если повтор состоит из 2-6 пар нуклеотидов, то такие повторы называют микросателлитами. Число повторяющихся копий микросателлитов варьирует от 5 до 50, а суммарная протяженность может достигать несколько сотен нуклеотидов. Другая группа повторов - мини-сателлиты, представлена повторяющимися элементами размером от 10 до 100 пар нуклеотидов. Этот умеренно повторяющийся класс повторов формирует тракты протяженностью 102-105 нуклеотидов. Значительная часть мини-сателлитов равномерно рассеяна по геному. Некоторые гипервариабельные повторы этого класса кластеризуются в субтеломерных областях хромосом.
Мини- и микросателлитные тандемные повторы разбросаны по всему геному и представляют собой уникальную для каждого человека комбинацию по числу тандемных повторов в разных локусах и по числу таких локусов. Их выявление характеризует генетический полиморфизм каждого человека, оценка которого используется в медико-генетических и судебно-медицинских целях (см. гл. 9).
Высокоповторяющиеся последовательности размером от 100 пар нуклеотидов и более, формирующие тракты протяженностью до 103- 107 нуклеотидов, составляют фракцию сателлитной ДНК. Данный класс повторов локализован преимущественно в областях конститутивного гетерохроматина и в прицентромерных регионах хромосом.
Особый класс низкокопийных повторов составляют крупные блоки рассеянных по геному дупликаций. Многие из них имеют достаточно протяженные размеры (до 100 тыс. пар нуклеотидов) и обнаруживают высокую степень идентичности нуклеотидных последовательностей
(>95%). Существует две категории сегментных дупликаций - внутрихромосомные и межхромосомные. Часто они кластеризуются в прицентромерных и субтеломерных районах хромосом. В геноме человека блоки сегментных дупликаций локализованы в хромосомах 7, 15, 17, 22, X (рис. 1.6). Высокая степень гомологии нуклеотидных
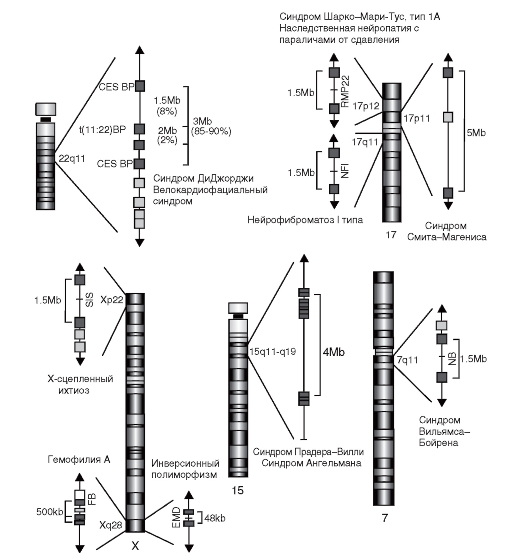
Рис. 1.6. Сегментные дупликации в геноме человека
последовательностей в пределах сегментных дупликаций определяет возможность прохождения между ними неравного кроссинговера, что приводит к возникновению микроделеций и микродупликаций в хромосомных сегментах. Многие из этих нарушений проявляются хромосомными или генными заболеваниями (в зависимости от размера затрагиваемого участка).
Наконец, недавно в геноме человека было идентифицировано 255 областей с крупными, размером от 100 тыс. пар нуклеотидов до 2,2 млн пар нуклеотидов, блоками повторов (CNV - Copy Number Variation). В настоящее время ведутся исследования, направленные на установление структуры и функции данного класса повторов. Получены первые данные, указывающие на ассоциацию числа крупных блоков повторов с системной красной волчанкой, псориазом, риском инфицирования вирусом иммунодефицита человека (ВИЧ) I типа.
Внехромосомные и кольцевые молекулы ДНК
Обнаруживают в цитоплазме и ядре. У человека они изучены еще недостаточно. В строгом смысле они являются не составными элементами генома, а его продуктом. Их размер колеблется от 150 пар нуклеотидов до 20 тыс. пар нуклеотидов. Являются ли эти молекулы продуктом фрагментации хромосомной ДНК в клетке или они образуются в результате других генетических процессов (гомологичной рекомбинации, обратной транскрипции), пока не ясно. Исследованные к настоящему времени у млекопитающих большие кольцевые ДНК размером от 150 до 900 тыс. пар нуклеотидов, локализованные только в ядрах, представляют собой амплифицированные участки онкогенов или генов устойчивости к ядам и антиметаболитам. С этими молекулами предположительно связывают устойчивость клеток к лекарствам и способность клеток к неограниченному росту. Их происхождение объясняют делециями соответствующих областей хромосом.
Полиморфизм
Изменения в структуре ДНК (в хромосомах или митохондриях) ведут к генетическому полиморфизму. Под полиморфизмом понимают такие варианты последовательностей ДНК, которые распространены в общей популяции с частотой не менее 1%. Эти изменения могут быть качественными, когда они обусловлены заменой или потерей нуклеотидов, или количественными, когда в определенном локусе
варьирует число нуклеотидных повторов различной протяженности. И те, и другие варианты генетического полиморфизма встречаются как в смысловых (внутриэкзонных), так и в несмысловых (внегенных или интронных) последовательностях молекулы ДНК. Существует несколько типов полиморфизма ДНК:
• полиморфизм по числу и распределению мобильных генетических элементов;
• полиморфизм по числу копий тандемных повторов ДНК (VNTR - variable number of tandem repeats);
• однонуклеотидные замены в последовательности ДНК (однонуклеотидные полиморфизмы - ОНП).
ОНП - одна из наиболее частых форм генетического полиморфизма. Под этим термином понимают варианты последовательностей

Рис. 1.7. Примеры однонуклеотидного полиморфизма (ОНП) у двух индивидов (объяснение в тексте)
ДНК у разных людей с вовлечением одной пары оснований (рис. 1.7). На рисунке представлены 3 фрагмента последовательностей от двух индивидов. В прямоугольниках выделены однонуклеотидные различия в геномных последовательностях. ОНП - наиболее характерный источник вариаций между людьми. Эти вариации встречаются на протяжении всей ДНК (в экзонах, интронах, межгенных промежутках, повторах) и отражают ранее возникшие мутации.
Секвенированием геномов или их частей у разных людей установлено, что однонуклеотидные различия обнаруживаются в среднем с частотой 1 замена на 600-1200 нуклеотидов. Число картированных в рамках проекта HapMap ОНП составляет более 4,5 млн. Расчеты показывают, что 2 человека на 99,9% идентичны по нуклеотидным последовательностям, т.е. только 0,1% различий по одному нуклеотиду создает огромные индивидуальные фенотипические вариации.
Предполагают, что различия по одному основанию между определенными отрезками геномов лежат в основе не только генных болезней, но и чувствительности к возбудителям или защиты от них, в основе приспособительных реакций и наследственной предрасположенности к многофакторным болезням.
Число ОНП на один ген у человека колеблется от нуля до нескольких десятков, причем в кодирующих последовательностях гена содержится в среднем по 4 полиморфных сайта. В генах человека около 50% некодирующих ОНП, 25% синонимичных кодирующих (не изменяющих аминокислоту в кодируемом белке) и 25% несинонимичных кодирующих ОНП. Типичный индивидуум гетерозиготен примерно по 24 000-40 000 несинонимичных замен. Хотя информация об ОНП еще неполная (основные сведения получены в последние несколько лет), уже известно, что все гены содержат ОНП.
С помощью карт ОНП выясняют вклад индивидуальных генов в болезни комплексной (многофакторной) и полигенной природы. Сравнение частот определенных типов ОНП у пациентов и в контрольных группах позволяет идентифицировать ОНП, с которыми ассоциируется заболевание. Несмотря на большие перспективы, которые открываются для объяснения заболеваний человека на основе понимания природы и размаха полиморфизма ОНП, необходимо остерегаться «геномомании». Гены и геномы действуют не в вакууме.
Среда не менее важна для биологии человека, чем гены. При правильном подходе с помощью карт ОНП можно лучше понять роль природы (генотипа) и среды в развитии человека в целом и патологии в частности.
Выше представлены характеристики основной хромосомной части генома человека, но во всех клетках активно функционирует еще и другая его часть, локализованная в митохондриях. Организация генома митохондрий по сравнению с хромосомным имеет некоторые отличия.
Митохондриальный геном
Митохондрии содержат кольцевую двухцепочечную ДНК, которую иногда называют 25-й хромосомой человека (мтДНК - митохондриальная ДНК). В каждой соматической клетке в среднем содержится около 1000 митохондрий. Суммарно ДНК митохондрий составляет не более 0,5% общего количества ДНК в организме. ДНК митохондрий реплицируется полуавтономно от ядерной ДНК.
Геном митохондрий человека был полностью секвенирован еще в 1981 г. Он содержит 16 569 пар оснований и кодирует 2 рибосомные РНК (рРНК) [12S и 16S], 22 транспортные РНК (тРНК) и 13 полипептидов. Полипептиды являются субъединицами ферментативных комплексов окислительного фосфорилирования. Другие 66 субъединиц дыхательной цепи кодируются в ядре.
Митохондриальный геном как целое отличается от ядерного генома несколькими признаками:
• мтДНК наследуется по материнскому типу. В зиготе содержится от 1 до 4 отцовских митохондрий, а материнских - 25 000. К тому же не исключается, что после оплодотворения репликация отцовских митохондрий вообще блокируется.
• Комбинативная изменчивость мтДНК (мейоз) отсутствует. Нуклеотидная последовательность меняется в поколениях только в результате мутаций.
• Митохондриальный геном непрерывен, т.е. не содержит интронов. В нем имеется всего лишь несколько межгенных пар оснований (или их вообще нет). Известно только одно исключение - около 1000 пар нуклеотидов является интроном в области промоторов (Д-петля). В мтДНК нет защитных гистонов и системы репарации ДНК. Такая организация определяет примерно в 10 раз большую скорость мутирования по сравнению с ядерной ДНК.
• Большинство генов мтДНК чередуются с генами тРНК, которые служат разделяющими сигналами для дальнейшего процессинга первичных транскриптов.
• Внутри одной клетки могут функционировать митохондрии с разными типами мтДНК. Это состояние называют гетероплазмией. Присутствие в клетках митохондрий с одним типом мтДНК - гомоплазмия.
• В мтДНК транскрибируются или транслируются обе цепи. Код мтДНК лишь частично отличается от универсального (UGA кодирует триптофан, AUA кодирует метионин, AGA и AGG являются стоп-кодонами).
Мутации генов мтДНК лежат в основе митохондриальных болезней, отличающихся от моногенных болезней не только особенностями передачи из поколения в поколение по материнской линии, но и своеобразными чертами клинической картины.
Патологические мутации мтДНК открыты в каждом типе митохондриальных генов.
Генный уровень
Основное внимание в генетике всегда уделялось гену. Благодаря комплексному подходу к изучению генов (от фенотипа на уровне организма до расшифровки нуклеотидной последовательности) накопилась обширная информация о строении и функции генов. Ген - последовательность нуклеотидов в ДНК, кодирующих определенную мРНК и соответствующий белок, либо РНК, несущие структурные или регуляторные функции. Большинство генов являются участками ДНК, которые несут информацию о последовательности аминокислотных остатков в белке, однако некоторые гены кодируют только РНК. Со всеми генами связаны регуляторные последовательности ДНК, т.е. участки, к которым присоединяются белки, определяющие, будет ли ген экспрессирован в данное время и в данном месте.
На основе данных по секвенированию определено, что в геноме человека около 30 000 генов, а не 70 000-100 000, как считали ранее. По уточненным данным Национального центра биотехнологической информации США на март 2008 г. в геноме человека насчитывается 31 809 генов, включая псевдогены, гены, кодирующие микроРНК. В базу OMIM (Gene Map) включены только гены, влияющие на различ-
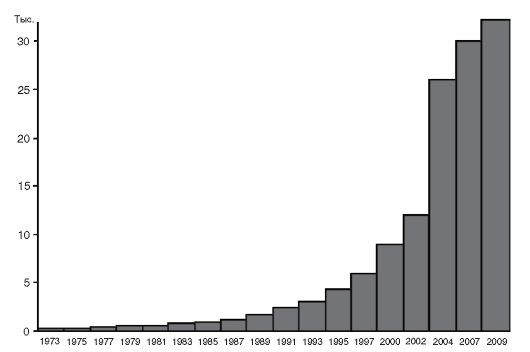
Рис. 1.8. Динамика картирования генов человека
ные заболевания. На май 2009 г. зарегистрировано 10 752 таких генов. Динамика картирования генов представлена на рис. 1.8. Сотни генов, вероятно, получены человеком в результате горизонтальной передачи, начиная от бактерий. Более 6500 генов человека (примерно 1/6 часть генома) охарактеризованы экспериментально (по функции продукта, наличию мутаций, тканеспецифичности, размеру транскрипта).
Гены человека более сложные, чем у других изученных организмов (например, у дрозофилы). Благодаря альтернативному сплайсингу, число синтезируемых белковых продуктов, очевидно, в 1,5-2 раза больше, чем число генов. Явление альтернативного сплайсинга заключается в следующем. Из одного и того же первичного РНК-транскрипта в процессинге РНК в разных тканях образуется не один, а несколько разных по длине мРНК-транскриптов. Соответственно синтезированные полипептиды также будут различными. Таким образом, одна и та же ДНК-последовательность может кодировать не один, а несколько разных белковых продуктов. Предполагается, что 40-60% генов человека подвергается альтернативному сплайсингу. Это существенным образом увеличивает разнообразие кодируемых геном продуктов.
Размер генов человека, число экзонов и интронов в них варьируют в широких пределах (табл. 1.3).
Таблица 1.3. Классификация генов человека по размеру (примеры)
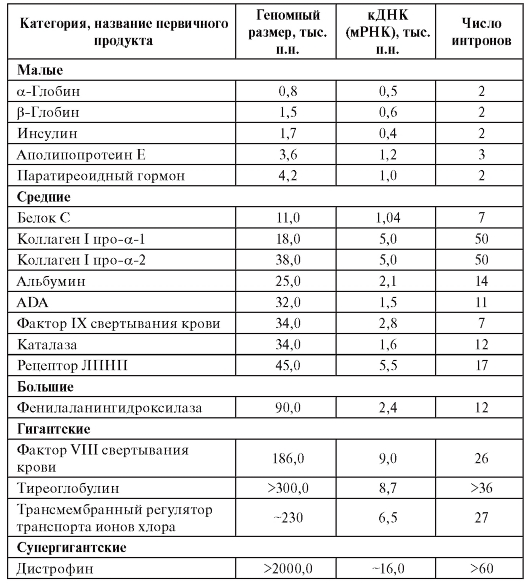
Примечание. ADA - аденозиндезаминаза. ЛПНП - липопротеиды низкой плотности, п.н. - пар нуклеотидов.
Большинство генов имеет размеры до 50 000 пар нуклеотидов (табл. 1.4). Средняя длина участка хромосомы, приходящегося на ген, составляет 27 000 пар нуклеотидов. Однако есть гены, размер которых в 100 раз меньше или в 100 раз больше этой средней величины.
Таблица 1.4. Распределение генов человека по размеру
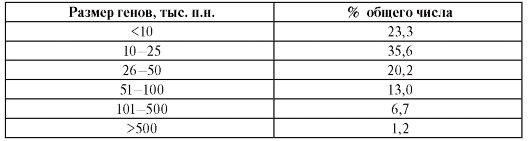
Примечание. п.н. - пар нуклеотидов.
Как известно из менделевской генетики, различные аллели могут проявляться в доминантном, рецессивном и кодоминантном вариантах. В геноме человека это правило в отдельных случаях нарушается.
В таблице 1.5 приведены примеры доминантного или рецессивного проявления одних и тех же фенотипов, обусловленных различными мутациями в одном и том же гене.
Таблица 1.5. Доминантные и рецессивные формы одних и тех же патологических состояний, обусловленные различными мутациями в одном и том же гене
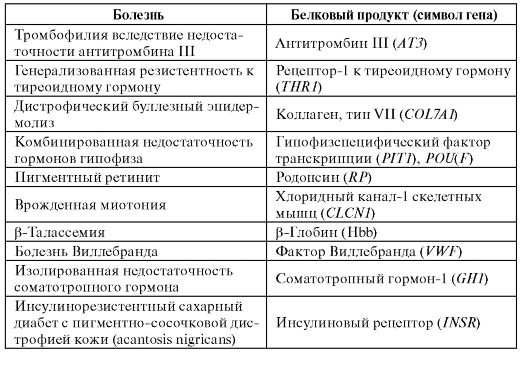
Эти данные необходимо принимать во внимание при медикогенетическом консультировании, когда родословная может не укладываться в рамки привычных типов наследования.
Функции генов
Накопленные сведения о генах человека позволяют выделить их группы по функциям первичного продукта: ферменты; модуляторы белковой функции; рецепторы; транскрипционные факторы; белки внутриклеточного матрикса; белки внеклеточного матрикса; трансмембранные переносчики; структуры ионных каналов; молекулы клеточных сигналов; гормоны; экстраклеточные переносчики; иммуноглобулины.
Кроме того, необходимо отметить наличие генов, продуктом которых являются различные классы РНК (тРНК, рРНК, малые ядерные РНК). В настоящее время идет активное изучение новых видов РНК. К моменту написания данного учебника открыто более 20 видов РНК, которые участвуют в синтезе белка, посттранскрипционной регуляции, репликации ДНК. Например, микроРНК в эукариотических клетках и малые интерферирующие РНК могут блокировать трансляцию мРНК или усиливать ее распад, что приводит к подавлению экспрессии гена. Этот феномен назван РНК-интерференцией и по эффекту напоминает эпигенетическую регуляцию экспрессии генов путем их метилирования. Малая ядерная РНК участвует в сплайсинге путем удаления интронов из мРНК. Очевидно, что основная роль большинства видов РНК - регуляция экспрессии генов и их продуктов. Полагают, что 30-50% регуляции транскрипционной активности выполняется упомянутыми выше видами РНК.
Безусловно, есть еще и гены с неизвестным пока действием.
Наибольшую функциональную категорию (31,2% общего числа идентифицированных генов) составляют гены, кодирующие ферменты. В 2 раза меньше генов-модуляторов белковой структуры и функции (13,6%). Они стабилизируют, свертывают полипептидные цепи или влияют на функции белка. Каждая из остальных категорий генов составляет менее 10% общего числа.
Сроки развития наследственных болезней во многом зависят от функции вовлеченного в патологию гена. Болезни, ассоциированные с генами, кодирующими белки во всех функциональных категориях, могут проявляться в любом периоде жизни. Гены, кодирующие транскрипционные факторы, чаще представлены среди генов, вызывающих болезни с началом во внутриутробном периоде. Это
говорит о том, что транскрипционные факторы, вероятно, играют важную роль в «оркестровке» развития на ранних стадиях онтогенеза. Неудивительно, что гены, кодирующие транскрипционные факторы, составляют более 30% генов, ассоциируемых с фенотипами врожденных пороков развития.
Особенно высока доля болезней с началом на 1-м году жизни, вызванных мутациями в генах, кодирующих ферменты (47%). Развивающийся плод имеет доступ к материнской метаболической системе гомеостаза через плаценту. Таким образом, дети с врожденными нарушениями, вызванными недостаточностью ферментов, обычно нормальны при рождении, но симптомы нарушения гомеостаза развиваются после рождения, когда у ребенка включается собственная дефектная система метаболизма.
Болезни, вызванные дефектами генов, кодирующих ферменты, наследуются по аутосомно-рецессивному типу, а связанные с генами, кодирующими модуляторы белковой функции или рецепторы, - по аутосомно-рецессивному или аутосомно-доминантному. Болезни, вызванные генами транскрипционных факторов, обычно относятся к группе аутосомно-доминантных.
Таким образом, временные закономерности формирования наследственных болезней строго соответствуют роли и месту первичных продуктов в онтогенезе. Болезни транскрипционных факторов развиваются внутриутробно, патология ферментов - в течение 1-го года жизни, рецепторов - в возрасте от 1 года до пубертатного периода, модуляторов белковой функции - у взрослых до 50 лет.
Клетка живет и работает благодаря строго скоординированным действиям генов. Количественное распределение функций генов, участвующих в основных процессах типичной клетки человека, следующее: синтез РНК и белков - 22%; клеточное деление - 12%; клеточные сигналы - 12%; защита клетки - 12%; обмен (метаболизм) - 17%; клеточные структуры - 8%; неизвестная функция - 17%.
Немаловажная роль в регуляции активности генов отводится эпигенетическим механизмам, которые обеспечивают наследуемые, но потенциально обратимые изменения экспрессии генов, не связанные с нарушениями их нуклеотидной последовательности. Молекулярную основу эпигенетической регуляции составляют ковалентные модификации ДНК (метилирование цитозина) и гистоновых белков (ацетилирование, метилирование, фосфорилирование и ряд других) в составе хроматина, обеспечивающие формирование уникальной для
каждой клетки функциональной организации ее генома, так называемого эпигенотипа. Совершенно очевидно, что клетки организма, обладающие одинаковым генотипом, могут иметь бесконечное множество эпигенотипов, при этом реализация генотипа в фенотип осуществляется сквозь призму эпигенотипа.
Следует признать вполне закономерным, что с прогрессом в области эпигенетики начали формироваться представления и о новом классе патологии человека - эпигенетических болезнях, связанных именно с нарушениями эпигенотипа - стабильными и наследуемыми изменениями генной экспрессии, приводящими к возникновению заболевания при отсутствии структурных мутаций в кодирующих генах. Примерами таких заболеваний являются хроматиновые болезни, болезни геномного импринтинга. Весом вклад эпигенетических нарушений в развитие опухолевых процессов. Обсуждается роль эпигенетических модификаций генома и в этиологии многофакторных заболеваний человека.
Одним из основных правил наследования признаков традиционно считалось правило эквивалентности реципрокных скрещиваний, т.е. равнозначной функции аллеля, полученного от отца или от матери. Однако, как показали подробные исследования, это правило может не соблюдаться. Функции генов взаимосвязаны и могут изменяться вплоть до дифференциального выключения одного из аллелей на протяжении всего онтогенеза. Случаи наследования с выключением одного из аллелей (материнского или отцовского) объясняют генетическим импринтингом.
Генетический импринтинг - это эпигенетический процесс, дифференциально помечающий локусы хромосом одного из родителей, что приводит к выключению экспрессии генов, в них расположенных. Следовательно, в участках генома, подверженных импринтингу, обнаруживается моноаллельная (а не биаллельная) экспрессия генов, т.е. если импринтирован материнский аллель, то экспрессируется только отцовский, и наоборот. Неэквивалентный вклад родителей в геном потомства обусловливает отклонение от строгих менделевских законов, согласно которым вклад каждого из родителей в наследственность потомков равнозначен. Таким образом, фенотипические проявления конкретного гена могут меняться из-за трех причин: не только из-за его делеции или мутации в нем, но и за счет эпигенетического выключения экспрессии. Речь идет о стойких функциональных различиях экспрессии гомологичных генов у потомства. Механизмом
импринтинга в большинстве случаев является дифференциальное полоспецифическое метилирование цитозиновых оснований ДНК, устанавливаемое при созревании половых клеток, которое и выключает в конечном итоге транскрипцию гена у потомства.
Известные импринтируемые регионы всего генома человека представлены на рис. 1.9.
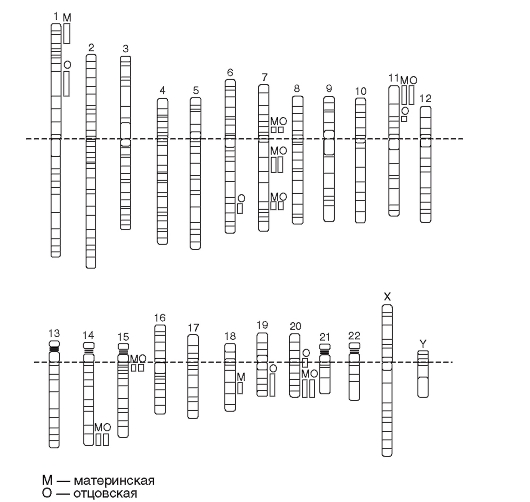
Рис. 1.9. Карта импринтированных генов генома человека. Хромосомные регионы, содержащие один ген или более, экспрессируемые только с материнской копии, отмечены белым; регионы, содержащие один или более генов, экспрессируемых только с отцовской копии, отмечены серым. Некоторые регионы содержат кластеры импринтированных генов: материнский импринтинг (т.е. экспрессируется только отцовский аллель) и отцовский импринтинг (т.е. экспрессируется только материнский аллель)
В настоящее время в геноме человека известно около 70 генов, подверженных импринтингу. Большинство из них сгруппировано в кластеры. Такая организация импринтированных генов возникла и поддерживается в ходе эволюции геномов млекопитающих, обеспечивая тесную координацию установления и поддержания моноаллельной экспрессии генов в пределах кластеров. В геноме человека кластеры импринтированных генов локализованы в регионах 7q32, 11p15, 15q11-13. Микроделеции или микродупликации в этих регионах, мутации в самих импринтированных генах или нарушения характера их дифференциального метилирования, а также ошибочное наследование одной пары гомологичных хромосом от одного из родителей при отсутствии гомолога другого родительского происхождения (однородительская дисомия хромосом) приводят к изменению дозы импринтированных локусов. Эти изменения обусловливают феномен «потери импринтинга» - появление биаллельной экспрессии импринтированного гена, либо, напротив, полное исчезновение продукта гена в клетке. Нарушения функций импринтированных генов имеют прямое отношение к наследственной патологии человека, обусловливая формирование особого класса заболеваний - болезней геномного импринтинга (синдромы Рассела-Сильвера, Видемана-Беквита, Прадера-Вилли, Ангельмана, транзиторный неонатальный сахарный диабет и ряд других).
Генетический импринтинг может проявляться не только на уровне гена или кластера генов. Он может затрагивать целую хромосому (однородительские дисомии) и даже геномы. Эффекты геномного импринтинга у человека изучены на примере пузырного заноса (табл. 1.6).
Из представленных в табл. 1.6 данных можно сделать вывод, что развитие плаценты в большей степени обеспечивается геномом отца, а раннее развитие эмбриональных структур обеспечивается геномом матери.
Таблица 1.6. Последствия разных вариантов импринтинга целого генома у человека

Окончание таблицы 1.6
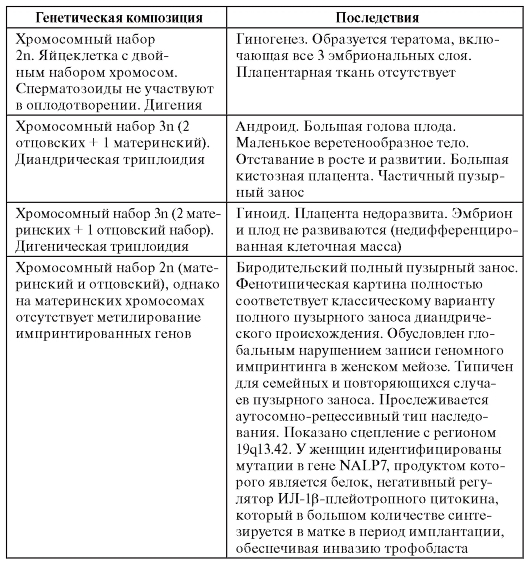
Примечание. ИЛ - интерлейкин.
Генетические карты хромосом
Геном человека наряду с секвенированием нуклеотидной последовательности охарактеризован к настоящему времени и по генетическим картам хромосом. Карты - это схемы, отражающие порядок расположения генов и других генетических элементов на хромосоме с указанием расстояния между ними. Генетическое расстояние измеря-
ется по частоте рекомбинаций между гомологичными хромосомами и выражается в сантиморганидах (сМ, названа в честь Т.Х. Моргана). Одна сМ соответствует частоте рекомбинаций, равной 1%. Длина всего генома человека равна примерно 3000-3500 сМ.
Изучение групп сцепления и составление карт хромосом первоначально основывались на анализе расщепления фенотипов в потомстве формально-генетическими методами. Результат генетического картирования зависит от трех основных условий: точности клинического диагноза; обширности родословных; использования информативных генетических маркеров. Соблюдение этих условий и международный обмен информацией обеспечили фундамент для составления карт.
Применение молекулярно-генетических методов значительно ускорило картирование генов, а секвенирование генома позволяет составить полные генетические карты для всех хромосом, как это сделано впервые для хромосом 21 и 22.
На рис. 1.10 представлена в качестве примера карта хромосомы 3 по генам, патологические мутации в которых ведут к наследственным
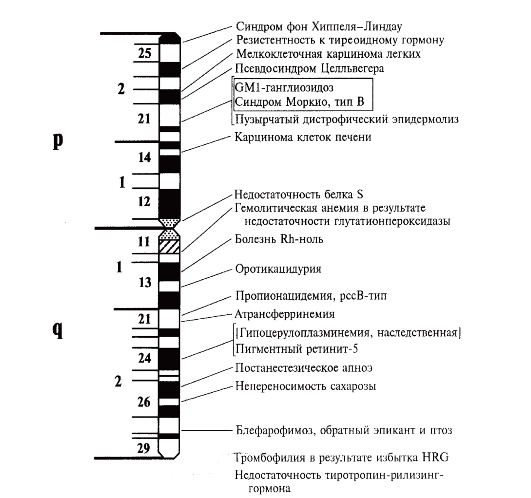
Рис. 1.10. Патологическая анатомия хромосомы 3
болезням. Такие карты называют патологической анатомией генома человека. Это далеко не полная карта, которая постоянно пополняется, как и по другим хромосомам.
Примером полной генетической карты может быть геном митохондрий (рис. 1.11), наиболее точно расшифрованный и секвенированный. На рисунке видно, что каждый ген митохондрий занимает свое положение. Известны все особенности генома митохондрий (см. выше).
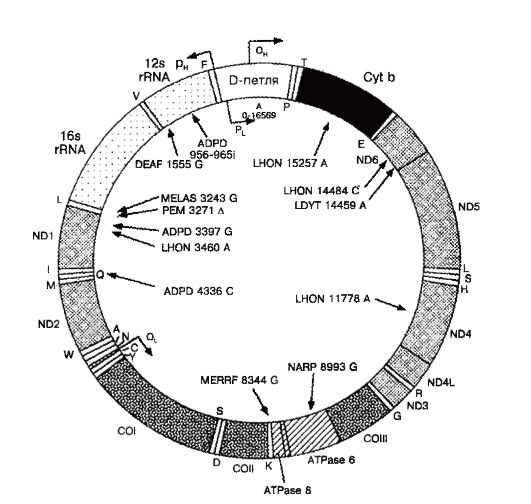
Рис. 1.11. Структура митохондриального генома и примеры митохондриальных болезней. ADPD - Болезнь Альцгеймера/болезнь Паркинсона; DEAF - нейросенсорная потеря слуха; LHON - наследственная нейроофтальмопатия Лебера; LDYT - LHON и дистония MELAS (митохондриальная миопатия, энцефалопатия, молочнокислый ацидоз и приступы судорог); MERRF - миоклональная эпилепсия в сочетании с необычно красными мышечными волокнами; NARP - нейропатия, атаксия и пигментный ретинит; PEM - летальная прогрессирующая энцефаломиопатия
Знание генетических карт необходимо в разных разделах медицинской генетики - для диагностики болезней методом сцепления, оценки патологических эффектов хромосомных транслокаций, решения вопросов эволюционной и популяционной генетики.
ЗНАЧЕНИЕ ГЕНЕТИКИ ДЛЯ МЕДИЦИНЫ
Прогресс в развитии медицины и общества приводит к относительному возрастанию доли генетически обусловленной патологии в заболеваемости, смертности, социальной дезадаптации (инвалидизации).
Половина спонтанных абортов обусловлена генетическими причинами.
Известно уже около 5000 наследственных болезней. Примерно 5-5,5% детей рождаются с наследственными или врожденными болезнями.
Не менее 30% перинатальной и неонатальной смертности обусловлено врожденными пороками развития и наследственными болезнями с другими проявлениями. Анализ причин детской смертности в целом (табл. 1.7) также показывает существенное значение генетических факторов.
Таблица 1.7. Вклад наследственных и врожденных болезней в младенческую и детскую смертность в развитых странах по сравнению с другими причинами
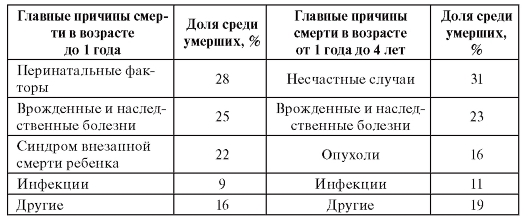
С возрастом меняется профиль наследственной патологии, но груз патологии не уменьшается. Хотя частота тяжелых форм наследственных болезней снижается в результате достаточно высокой летально-
сти в детском возрасте, в пубертатном возрасте и позже проявляются новые болезни. После 20-30 лет начинают проявляться болезни с наследственной предрасположенностью.
Не менее 25% всех больничных коек занято пациентами, страдающими болезнями с наследственной предрасположенностью.
Как известно, большая доля социальных расходов в развитых странах идет на обеспечение инвалидов с детского возраста. Огромна роль генетических факторов в этиологии и патогенезе инвалидизирующих состояний в детском возрасте (табл. 1.8).
Таблица 1.8. Вклад генетического компонента в хронические инвалидизирующие врожденные состояния в развитых странах (по материалам Всемирной организации здравоохранения)
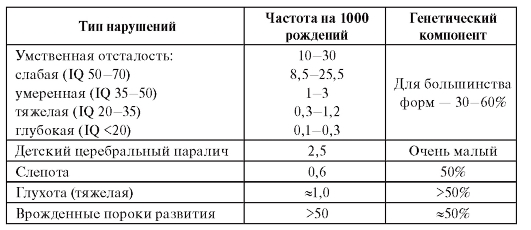
Примечание. IQ - коэффициент умственного развития, интеллекта (Intelligence Quotient).
Доказана существенная роль наследственной предрасположенности в возникновении широко распространенных болезней (ишемической болезни сердца, эссенциальной гипертонии, язвенной болезни желудка и двенадцатиперстной кишки, псориаза, бронхиальной астмы и др.). Следовательно, для лечения и профилактики этой группы болезней, встречающихся в практике врачей всех специальностей, необходимо знать механизмы взаимодействия средовых и наследственных факторов.
Медицинская генетика помогает понять взаимодействие биологических и средовых факторов (включая специфические) в патологии человека.
В развитых странах улучшается медицинское обслуживание, повышается уровень жизни, что меняет направленность и интенсивность отбора. Новая среда, большие социальные и экологические нагрузки (избыток информации, стрессы, загрязнение атмосферы и др.) могут усилить мутационный процесс или изменить проявляемость генов; и то и другое приведет к дополнительному появлению наследственной патологии.
Недавно была предложена концепция медицины 4-х «П» (Hood, 2008), в которой отражены направления приложений геномных и генетических знаний к практической медицине.
- Предсказательная (предикативная) медицина рекомендует и развивает проекты по диагностике вероятных (возможных) болезней на основе анализа ДНК и оценок профилей экспрессии патологических генов у конкретного человека. Термину «предсказательная медицина» ближе всего понятие, предложенное ранее А. Боде (1998), - «геномная медицина», определяемая как стандартное генотипирование ради улучшения качества медицинской помощи.
- Профилактическая (превентивная)медицина организует лечебнопрофилактические мероприятия для лиц с высокой вероятностью развития той или иной болезни с наследственным предрасположением.
- Персонализированная медицина проводит лечебно-профилактические мероприятия в отношении конкретных пациентов на основе их индивидуальных геномных особенностей (фармакогенетика, профессиональные вредности, образ жизни, диета и т.п.).
- Партнерская медицина означает информированное и активное участие самого пациента в сотрудничестве с врачами при выборе вариантов лечения и образа жизни.
Знание основ медицинской генетики позволяет врачу понимать механизмы индивидуального течения болезни и выбирать соответствующие методы лечения. Медико-генетические знания лежат в основе диагностики наследственных болезней. Они помогают направить пациента и членов его семьи на медико-генетическое консультирование для первичной и вторичной профилактики наследственной патологии.
Медико-генетические знания способствуют формированию у врача четких ориентиров в восприятии новых медико-биологических
открытий, поскольку прогресс науки быстро и глубоко изменяет клиническую практику.
Наследственные болезни долго не поддавались лечению, а единственным методом профилактики была рекомендация воздержаться от деторождения. Эти времена прошли.
Современная медицинская генетика вооружила клиницистов методами ранней досимптомной (доклинической) и даже пренатальной диагностики наследственных болезней. Интенсивно развиваются и в некоторых центрах уже применяются методы предымплантационной (до имплантации зародыша) диагностики. Понимание молекулярных механизмов патогенеза наследственных болезней и высокие медицинские технологии обеспечили успешное лечение многих форм патологии.
Сложилась стройная система помощи больным с наследственными болезнями: медико-генетическое консультирование, пренатальная диагностика, массовая диагностика у новорожденных наследственных болезней обмена, поддающихся диетической и лекарственной коррекции, диспансеризация больных с наследственными заболеваниями и членов их семей. Внедрение этой системы в практику здравоохранения обеспечивает снижение частоты рождения детей с врожденными пороками развития и наследственными болезнями на 60-70%. Врачи и организаторы здравоохранения обязаны активно участвовать во внедрении достижений медицинской генетики в практику ради счастливой семьи со здоровым потомством.
ЗАКЛЮЧЕНИЕ
Интенсивное развитие геномики человека обеспечили новый этап в развитии медицины и переход ее на молекулярный уровень. Геномика человека является основой молекулярной медицины. Понятие «молекулярная медицина» и «молекулярные болезни» введено Л. Полингом в 50-х годах XX в. Это понятие шире, чем «геномная медицина». По мнению Л. Полинга, основная роль в биологических системах и проявлениях жизнедеятельности должна быть отведена разнообразию типов связей, обусловливающих межмолекулярные воздействия. Молекулярная медицина выявляет связи между свойствами и функциями молекул в общих проявлениях жизнедеятельности.
Резкое увеличение геномной информации стало началом переосмысления процессов развития человека и его болезней. Развитие
патологии прослеживается на молекулярном уровне от первичного продукта гена до исхода заболевания.
Полные данные по нуклеотидной последовательности генома ускоряют генетический анализ человека. В связи с этим изменяются направления биомедицинских исследований.
- В предыдущие годы основное внимание в изучении наследственности человека было сосредоточено на структурной геномике (секвенировании генома). Теперь исследования направлены на функциональную геномику (межгенные сети, протеомику).
- С середины 80-х годов XX в. обнаружение генов (их идентификация вплоть до нуклеотидной последовательности) осуществлялось главным образом через картирование генов (метод позиционного клонирования). Сведения по геному человека позволяют идентифицировать новые гены на уровне нуклеотидных последовательностей быстрее и точнее.
- До последнего времени акцент в изучении наследственной патологии был на моногенных болезнях и на анализе одного гена. Теперь он сдвигается в сторону многофакторных болезней, анализа множественных генов и мониторинга предрасположенности.
- Изучение действия гена (первичных продуктов) всегда считалось «высшим пилотажем» в генетике, но теперь исследования должны больше концентрироваться на механизмах регуляции действия гена.
- С точки зрения общей патологии достижения геномики направляют мысль от изучения этиологии наследственных болезней (специфических мутаций) к их патогенезу (механизмам формирования патологического фенотипа).
При обсуждении значимости секвенирования генома человека для медицины и здравоохранения нередко звучат необоснованные обещания. В науке (например, в онкологии) не раз вполне объективно прогнозируемые результаты разработок не сбывались, потому что проблема (явление, болезнь) оказывалась сложнее, и прямое планирование успехов прогресса не оправдывалось. Знание генома человека, несомненно, приведет к прогрессу во многих (если не во всех) разделах медицины, но маловероятно, что это будет единственным направлением развития медицины.
Исходя из уже применяемых в практическом здравоохранении достижений генетики, можно предполагать следующие перспективы использования результатов геномных исследований:
• широкое применение генодиагностики наследственных болезней, в том числе пренатальной;
• техническую доступность предымплантационной диагностики в основных медико-генетических центрах;
• генетическое тестирование на болезни с наследственной предрасположенностью и принятие профилактических мер;
• разработку новых подходов и методов лечения, в том числе генной терапии отдельных заболеваний;
• создание новых типов лекарств на основе геномной информации (фармакогеномике).
Накопление генетической информации будет аккумулироваться медициной в широком плане и использоваться здравоохранением для разных контингентов населения. Уже есть предпосылки для выявления детей с высоким риском раннего атеросклероза, чтобы начать их лечение на ранних этапах и предупредить изменения в сосудах во взрослом состоянии. Супруги могут получить сведения о своем генетическом статусе в отношении наследственной болезни у ребенка до планирования деторождения. Население среднего и более старшего возраста может быть обследовано по риску многих болезней, которые удастся предупредить (или облегчить) путем диетических рекомендаций или лекарственного лечения. Проверку индивидуальной чувствительности к лекарствам можно проводить молекулярно-генетическими методами, и это должно стать стандартной процедурой перед началом лечения.
КЛЮЧЕВЫЕ СЛОВА И ПОНЯТИЯ
Аксиомы медицинской генетики Генетика человека
Генетические технологии в медицине Генетический импринтинг Геномика Евгеника Карты хромосом Клиническая генетика Медицинская генетика Менделизм в генетике человека Молекулярная медицина Митохондриальный геном
Однонуклеотидный полиморфизм Причины детской смертности Протеомика
Частота наследственной патологии Эпигенетика
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Бабков В.В. Заря генетики человека. Русское евгеническое движение и начало генетики человека. - М.: Прогресс-Традиция, 2008. -
800 с.
Генетика: учебник / под ред. акад. РАМН В.И. Иванова. - М.: Академкнига, 2006. - 638 с.
Генетический паспорт - основа индивидуальной предиктивной медицины / под ред. В.С. Баранова. - СПб.: Изд-во Н-Л, 2009. -
527 с.
Геномика - медицине: науч. изд. / под ред. В.И. Иванова, Л.Л. Киселева. - М.: Академкнига, 2005. - 392 с.
Гинтер Е.К. Медицинская генетика: учебник. - М.: Медицина,
2003. - 448 с.
Гиэд Д. Будущая эволюция человека / Евгеника двадцать первого века. - М.: Захаров, 2005. - 176 с.
МакКонки Э. Геном человека / Пер. с англ. - М.: Техносфера,
2008. - 288 с.
Марахонов А.В., Баранова А.В., Скоблов М.Ю. РНК-интерференция: фундаментальные и прикладные аспекты // Медицинская генетика. - 2008. - № 10. - С. 44-55.
Пчелов Е.А. Родословная гениальности: из истории отечественной науки 1920-х годов - М.: Старая Басманная, 2008. - 350 с.
Рогаев Е.И., Боринская С.А., Исламгулов Д.В., Григоренко А.П. МикроРНК человека в норме и патологии. Молекулярная биология. - 2008. -
Т. 42. - № 5. - С. 751-764.
Nakamura Y. DNA variations in human and medical genetics: 25 years of my experience // Journal of Human Genetics. - 2009. - V. 54. - N 1. - P. 1-8.
Свердлов Е.Д. Взгляд на жизнь через окно генома. Т. 1. Очерки структурной молекулярной генетики. - М.: Наука, 2009. - 525 с.