Иммунология : практикум : учеб. пособие / [Ковальчук Л. В. и др.] - 2010. - 176 с. : ил.
|
|
|
|
ГЛАВА 7 МЕТОДЫ ОЦЕНКИ СИСТЕМЫ ЦИТОКИНОВ
В настоящей главе будет рассмотрен комплексный подход в оценке системы цитокинов с использованием описанных ранее современных методов исследования.
Вначале мы изложим основные представления о системе цитокинов.
Цитокины в настоящее время рассматривают как белковопептидные молекулы, продуцируемые различными клетками организма и осуществляющие межклеточные и межсистемные взаимодействия. Цитокины - универсальные регуляторы жизненного цикла клеток, они контролируют процессы дифференцировки, пролиферации, функциональной активации и апоптоза последних.
Цитокины, продуцируемые клетками иммунной системы, называют иммуноцитокинами; они представляют собой класс растворимых пептидных медиаторов иммунной системы, необходимых для ее развития, функционирования и взаимодействия с другими системами организма (Ковальчук Л.В. и соавт., 1999).
Являясь регуляторными молекулами, цитокины играют важную роль в осуществлении реакций врожденного и адаптивного иммунитета, обеспечивают их взаимосвязь, контролируют гемопоэз, воспаление, заживление ран, образование новых кровеносных сосудов (ангиогенез) и многие другие жизненно важные процессы.
В настоящее время существует несколько различных классификаций цитокинов, учитывающих их строение, функциональную активность, происхождение, тип цитокиновых рецепторов. Традиционно, в соответствии с биологическими эффектами, принято выделять следующие группы цитокинов.
1. Интерлейкины (ИЛ-1-ИЛ-33) - секреторные регуляторные белки иммунной системы, обеспечивающие медиаторные взаимодействия в иммунной системе и связь ее с другими системами организма. Интерлейкины разделяют по функциональной активности на про- и противовоспалительные цитокины, ростовые факторы лимфоцитов, регуляторные цитокины и др.
 3. Факторы некроза опухоли (ФНО) - цитокины с цитотоксическим и регуляторным действиями: ФНОа и лимфотоксины (ЛТ).
3. Факторы некроза опухоли (ФНО) - цитокины с цитотоксическим и регуляторным действиями: ФНОа и лимфотоксины (ЛТ).
4. Факторы роста гемопоэтических клеток - фактор роста стволовых клеток (Kit - ligand), ИЛ-3, ИЛ-7, ИЛ-11, эритропоэтин, тробопоэтин, гранулоцитарно-макрофагальный колониестимулирующий фактор - ГМ-КСФ, гранулоцитарный КСФ - Г-КСФ, макрофагаль-
ный КСФ - М-КСФ).
5. Хемокины - С, СС, СХС (ИЛ-8), СХ3С - регуляторы хемотаксиса различных типов клеток.
6. Факторы роста нелимфоидных клеток - регуляторы роста, дифференцировки и функциональной активности клеток различной тканевой принадлежности (фактор роста фибробластов - ФРФ, фактор роста эндотелиальных клеток, эпидермальный фактор роста - ЭФР эпидермиса) и трансформирующие факторы роста (ТФРβ, ТФРα).
Среди прочих в последние годы активно изучается фактор, ингибирующий миграцию макрофагов (миграцию ингибирующий фактор - МИФ), который рассматривается как нейрогормон с цитокиновой и ферментной активностью (Суслов А.П., 2003; Ковальчук Л.В. и соавт.,
2004).
Цитокины различаются по строению, биологической активности и другим свойствам. Однако наряду с различиями цитокины обладают общими свойствами, характерными для данного класса биорегуляторных молекул.
1. Цитокины - это, как правило, гликозилированные полипептиды средней молекулярной массы (менее 30 кD).
2. Цитокины вырабатываются клетками иммунной системы и другими клетками (например, эндотелием, фибробластами и др.) в ответ на активирующий стимул (патогенассоциированные молекулярные структуры, антигены, цитокины и др.) и участвуют в реакциях врожденного и адаптивного иммунитета, регулируя их силу и продолжительность. Некоторые цитокины синтезируются конститутивно.
3. Секреция цитокинов - короткий по времени процесс. Цитокины не сохраняются как преформированные молекулы, а их
синтез начинается всегда с транскрипции генов. Клетки вырабатывают цитокины в низкой концентрации (пикограммы на миллилитр).
4. В большинстве случаев цитокины продуцируются и действуют на клетки-мишени, находящиеся в непосредственной близости (короткодистантное действие). Основное место действия цитокинов - межклеточный синапс.
5. Избыточность системы цитокинов проявляется в том, что каждый тип клеток способен продуцировать несколько цитокинов, а каждый цитокин может секретироваться различными клетками.
6. Для всех цитокинов характерна плейотропность, или полифункциональность действия. Так, проявление признаков воспаления обусловлено влиянием ИЛ-1, ФНОα, ИЛ-6, ИЛ-8. Дублирование функций обеспечивает надежность работы системы цитокинов.
7. Действие цитокинов на клетки-мишени опосредуется высокоспецифичными высокоаффинными мембранными рецепторами, представляющими собой трансмембранные гликопротеины, состоящие, как правило, более чем из одной субъединицы. Внеклеточная часть рецепторов ответственна за связывание цитокина. Существуют рецепторы, устраняющие избыток цитокинов в патологическом очаге. Это так называемые рецепторы-ловушки. Растворимые рецепторы представляют собой внеклеточный домен мембранного рецептора, отделенный с помощью фермента. Растворимые рецепторы способны нейтрализовывать цитокины, участвовать в транспорте их в очаг воспаления и в выведении из организма.
8. Цитокины работают по принципу сети. Они могут действовать согласованно. Многие функции, приписываемые первоначально одному цитокину, как оказалось, обусловлены согласованным действием нескольких цитокинов (синергизм действия). Примерами синергического взаимодействия цитокинов являются стимуляция воспалительных реакций (ИЛ-1, ИЛ-6 и ФНОа), а также синтеза IgE
(ИЛ-4, ИЛ-5 и ИЛ-13).
Одни цитокины индуцируют синтез других цитокинов (каскад). Каскадность действия цитокинов необходима для развития воспалительных и иммунных реакций. Способность одних цитокинов усиливать или ослаблять продукцию других обусловливает важные позитивные и негативные регуляторные механизмы.
Известно антагонистическое действие цитокинов, например продукция ИЛ-6 в ответ на увеличение концентрации ФНОа может быть
негативным регуляторным механизмом контроля выработки этого медиатора при воспалении.
Цитокиновая регуляция функций клеток-мишеней осуществляется с помощью аутокринного, паракринного или эндокринного механизмов. Некоторые цитокины (ИЛ-1, ИЛ-6, ФНОα и др.) способны участвовать в реализации всех перечисленных механизмов.
Ответ клетки на влияние цитокина зависит от нескольких факторов:
• от типа клеток и их исходной функциональной активности;
• от локальной концентрации цитокина;
• от присутствия других медиаторных молекул.
Таким образом, клетки-продуценты, цитокины и специфические для них рецепторы на клетках мишенях формируют единую медиаторную сеть. Именно набор регуляторных пептидов, а не индивидуальные цитокины, определяют окончательный ответ клетки. В настоящее время система цитокинов рассматривается как универсальная система регуляции на уровне целостного организма, обеспечивающая развитие защитных реакций (например, при инфекции).
В последние годы сложилось представление о системе цитокинов, объединяющей:
1) клетки-продуценты;
2) растворимые цитокины и их антагонисты;
3) клетки-мишени и их рецепторы (рис. 7.1).
Нарушения различных компонентов системы цитокинов приводят к развитию многочисленных патологических процессов, а потому выявление дефектов в этой регуляторной системе имеет важное значение для правильной постановки диагноза и назначения адекватной терапии.
Вначале рассмотрим основные компоненты системы цитокинов.
Клетки-продуценты цитокинов
I. Основную группу клеток-продуцентов цитокинов в адаптивном иммунном ответе представляют лимфоциты. Покоящиеся клетки не секретируют цитокины. При распознавании антигена и при участии рецепторных взаимодействий (CD28-CD80/86 для Т-лимфоцитов и СD40-CD40L для В-лимфоцитов) происходит активация клеток, приводящая к транскрипции генов цитокинов, трансляции и секреции гликозилированных пептидов в межклеточное пространство.
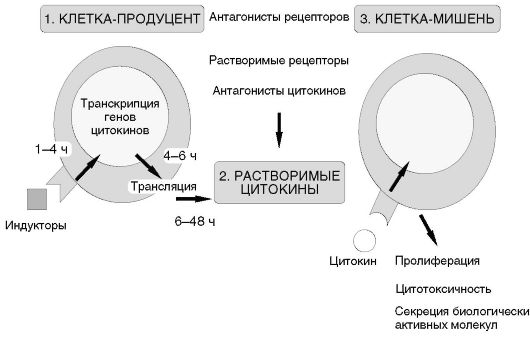 Рис. 7.1. Система цитокинов
Рис. 7.1. Система цитокинов
CD4 Т-хелперы представлены субпопуляциями: Тh0, Тh1, Тh2, Тh17, Tfh, которые различаются между собой спектром секретируемых цитокинов в ответ на различные антигены.
Тh0 вырабатывают широкий спектр цитокинов в очень низких концентрациях.
Направление дифференцировки Th0 определяет развитие двух форм иммунного ответа с преобладанием гуморальных или клеточных механизмов.
Природа антигена, его концентрация, локализация в клетке, тип антигенпрезентирующих клеток и определенный набор цитокинов регулируют направление дифференцировки Тh0.
Дендритные клетки после захвата и процессинга антигена представляют антигенные пептиды Th0 клеткам и вырабатывают цитокины, регулирующие направление их дифференцировки в эффекторные клетки. Роль индивидуальных цитокинов в данном процессе отражена на рис. 7.2. ИЛ-12 индуцирует синтез ИФНγ Т-лимфоцитами и ]ЧГК. ИФНу обеспечивает дифференцировку ТЫ1, которые начинают секретировать цитокины (ИЛ-2, ИФНу, ИЛ-3, ФНОа, лимфотоксины), регулирующие развитие реакций на внутриклеточные патогены
(гиперчувствительности замедленного типа (ГЗТ) и различные типы клеточной цитотоксичности).
ИЛ-4 обеспечивает дифференцировку Тh0 в Тh2. Активированные Тh2 вырабатывают цитокины (ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-13 и др.), определяющие пролиферацию В-лимфоцитов, их дальнейшую дифференцировку в плазматические клетки,и развитие реакций антителогенеза, преимущественно на внеклеточные патогены.
ИФНу негативно регулирует функцию Тh2-клеток и, наоборот, ИЛ-4, ИЛ-10, секретируемые Тh2, угнетают функцию Тh1 (рис. 7.3). Молекулярный механизм этой регуляции связан с транскрипционными факторами. Экспрессия Т-bet и STAT4, детерминированная ИФНу, направляет дифференцировку Т-клеток по пути Тh1 и супрессирует развитие Тh2. ИЛ-4 индуцирует экспрессию GATA-3 и STAT6, что соответственно обеспечивает превращение наивных ТЫ0 в Тh2-клетки (рис. 7.2).
В последние годы описана особая субпопуляция Т-клеток хелперов (Тh17), продуцирующих ИЛ-17. Члены семейства ИЛ-17 могут экспрессироваться активированными клетками памяти (CD4CD45RO), у5Т-клетками, NKT клетками, нейтрофилами, моноцитами под влиянием ИЛ-23, ИЛ-6, ТФРβ, вырабатываемых макрофагами и дендритными клетками. Основным дифференцировочным фактором у человека является ROR-C, у мышей - ROR-γl Показана кардинальная роль ИЛ-17 в развитии хронического воспаления и аутоиммунной патологии (см. рис. 7.2).
Кроме того, Т-лимфоциты в тимусе могут дифференцироваться в естественные клетки-регуляторы (Treg), экспрессирующие поверхностные маркеры CD4+ CD25+ и транскрипционный фактор FOXP3. Эти клетки способны подавлять иммунный ответ, опосредуемый Тh1 и Тh2-клетками, путем прямого межклеточного контакта и синтеза ТФРβ и ИЛ-10.
Схемы дифференцировки клонов Тh0 и секретируемых ими цитокинов представлены на рис. 7.2 и 7.3 (см. также цв. вклейку).
Т-цитотоксические клетки (CD8+), естественные киллеры - слабые продуценты цитокинов, таких, как интерфероны, ФНОа и лимфотоксины.
Избыточная активация одной из субпопуляций Тh может определить развитие одного из вариантов иммунного ответа. Хроническая несбалансированность активации Тh способна привести к формированию иммунопатологических состояний, связанных с проявления-
ми аллергии, аутоиммунной патологии, хронических воспалительных процессов и др.
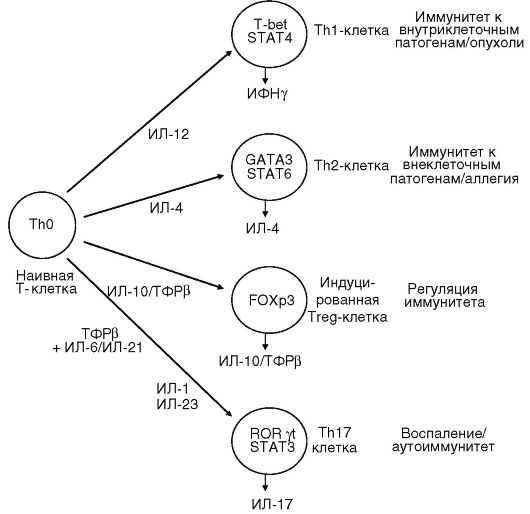 Рис. 7.2. Различные субпопуляции Т-лимфоцитов, продуцирующие цитокины
Рис. 7.2. Различные субпопуляции Т-лимфоцитов, продуцирующие цитокины
II. В системе врожденного иммунитета основными продуцентами цитокинов являются клетки миелоидного ряда. С помощью Toll-по- добных рецепторов (TLRs) они распознают сходные молекулярные структуры различных патогенов, так называемые патогенассоциированные молекулярные патерны (РАМП), например липополисахарид (ЛПС) грамотрицательных бактерий, липотейхоевые кислоты, пептидогликаны грамположительных микроорганизмов, флагеллин, ДНК, богатую неметилированными СрG повторами, и др. В результате
такого взаимодействия с TLR запускается внутриклеточный каскад передачи сигнала, приводящий к экспрессии генов двух основных групп цитокинов: провоспалительных и ИФН типа 1 (рис. 7.4, см. также цв. вклейку). Главным образом эти цитокины (ИЛ-1, -6, -8, -12, ФНОа, ГМ-КСФ, ИФН, хемокины и др.) индуцируют развитие воспаления и участвуют в защите организма от бактериальных и вирусных инфекций.
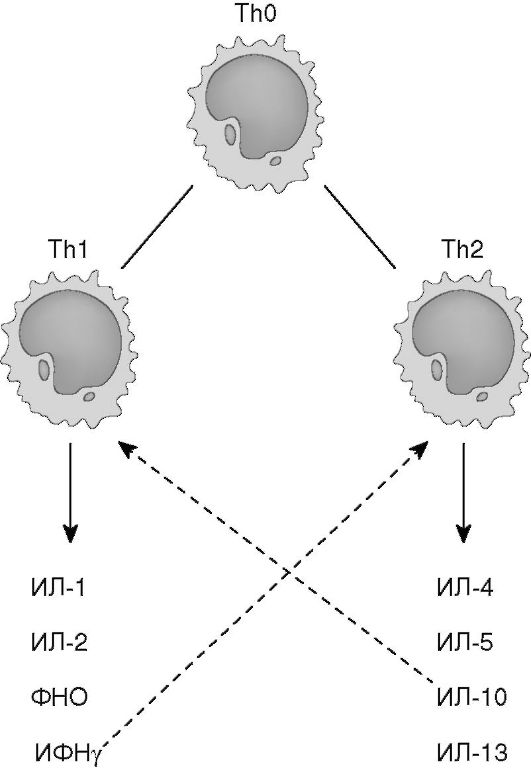 Рис. 7.3. Спектр цитокинов, секретируемых ТЫ1- и ТЫ2-клетками
Рис. 7.3. Спектр цитокинов, секретируемых ТЫ1- и ТЫ2-клетками
III. Клетки, не относящиеся к иммунной системе (клетки соединительной ткани, эпителия, эндотелия), конститутивно секретируют аутокринные факторы роста (ФРФ, ЕФР, ТФРр и др.). и цитокины, поддерживающие пролиферацию гемопоэтических клеток.
Цитокины и их антагонисты подробно описаны в ряде монографий (Ковальчук Л.В. и соавт., 2000; Кетлинский С.А., Симбирцев А.С.,
2008).
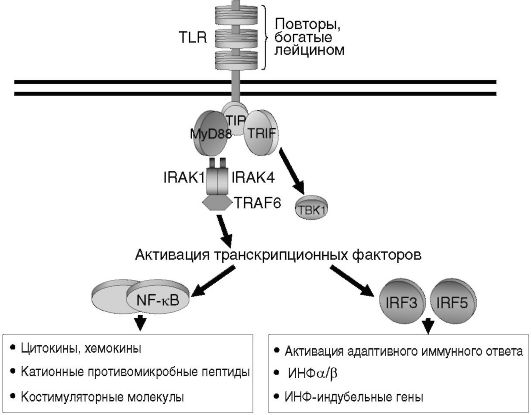 Рис. 7.4. TLR-опосредованная индукция выработки цитокинов клетками врожденного иммунитета
Рис. 7.4. TLR-опосредованная индукция выработки цитокинов клетками врожденного иммунитета
Избыточная экспрессия цитокинов небезопасна для организма и может привести к развитию чрезмерной воспалительной реакции, острофазового ответа. В регуляции выработки провоспалительных цитокинов принимают участие различные ингибиторы. Так, описан ряд веществ, которые неспецифически связывают цитокин ИЛ-1 и препятствуют проявлению его биологического действия (а2-макроглобулин, С3-компонент комплемента, уромодулин). Специфическими ингибиторами ИЛ-1 могут быть растворимые рецепторы-ловушки, антитела и рецепторный антагонист ИЛ-1 (ИЛ-1RA). При развитии воспаления происходит усиление экспрессии гена ИЛ-1RA. Но и в норме этот антагонист присутствует в крови в высокой концентрации (до 1 нг/мл и более), блокируя действие эндогенного ИЛ-1.
Клетки-мишени
Действие цитокинов на клетки-мишени опосредуются через специфические рецепторы, связывающие цитокины с очень высокой аффинностью, причем отдельные цитокины могут использовать
общие субъединицы рецепторов. Каждый цитокин связывается со своим специфическим рецептором.
Рецепторы цитокинов представляют собой трансмембранные белки и делятся на 5 основных типов. Наиболее распространен так называемый гемопоэтиновый тип рецепторов, имеющих два экстраклеточных домена, один из которых содержит общую последовательность аминокислотных остатков двух повторов триптофана и серина, разделенных любой аминокислотой (WSXWS-мотив). Второй тип рецепторов может иметь два внеклеточных домена с большим количеством консервативных цистеинов. Это рецепторы семейства ИЛ-10 и ИФН. Tретий тип представлен рецепторами цитокинов, относящихся к группе ФНО. Четвертый тип рецепторов цитокинов принадлежит к суперсемейству иммуноглобулиновых рецепторов, имеющих внеклеточные домены, напоминающие по строению домены молекул иммуноглобулинов. Пятый тип рецепторов, связывающих молекулы семейства хемокинов, представлен трансмембранными белками, пересекающими клеточную мембрану в 7 местах. Рецепторы цитокинов могут существовать в растворимой форме, сохраняя способность связывать лиганды (Кетлинский С.А. и др., 2008).
Цитокины способны влиять на пролиферацию, дифференцировку, функциональную активность и апоптоз клеток-мишеней (см. рис. 7.1). Проявление биологической активности цитокинов в клетках-мишенях зависит от участия различных внутриклеточных систем в передаче сигнала от рецептора, что связано с особенностями клеток-мишеней. Сигнал к апоптозу проводится в том числе с помощью специфического участка семейства рецепторов ФНО, так называемого домена «смерти» (рис. 7.5, см. цв. вклейку). Дифференцировочный и активирующий сигналы передаются посредством внутриклеточных белков Jak-STAT - сигнальных трансдукторов и активаторов транскрипции (рис. 7.6, см. цв. вклейку). G-белки участвуют в передаче сигнала от хемокинов, что приводит к усилению миграции и адгезии клеток.
В комплексный анализ системы цитокинов входит следующее.
I. Оценка клеток-продуцентов.
1. Определение экспрессии:
• рецепторов, распознающих патоген или антиген TКР, TLR) на уровне генов и молекулы белка (ПЦР, метод проточной цитофлуориметрии);
• адаптерных молекул, проводящих сигнал, запускающий транскрипцию цитокиновых генов (ПЦР и др.);
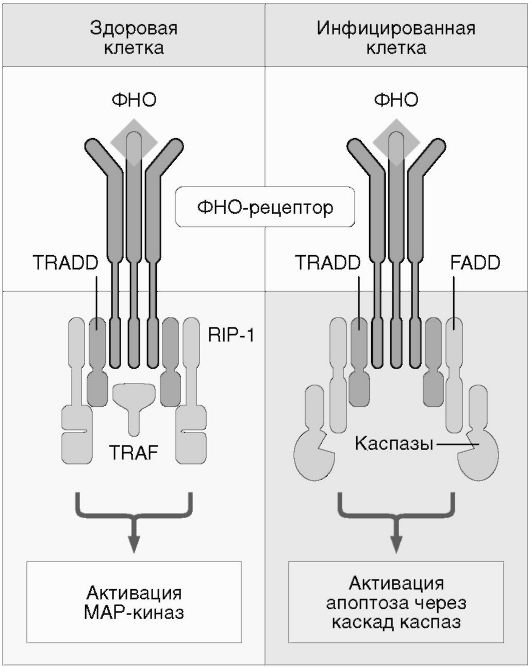 Рис. 7.5. Передача сигнала с ФНО-рецептора
Рис. 7.5. Передача сигнала с ФНО-рецептора
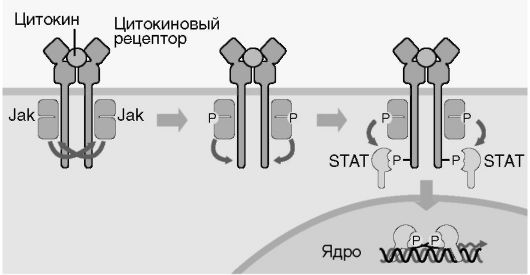 Рис. 7.6. Jak-STAT - сигнальный путь с цитокиновых рецепторов типа 1
Рис. 7.6. Jak-STAT - сигнальный путь с цитокиновых рецепторов типа 1
• генов цитокинов (ПЦР); белковых молекул цитокинов (оценка цитокинсинтезирующей функции мононуклеарных клеток человека).
2. Количественное определение субпопуляций клеток, содержащих те или иные цитокины: Th1, Th2 Th17 (метод внутриклеточного окрашивания цитокинов); определение количества клеток, секретирующих определенные цитокины (метод ELISPOT, см. гл. 4).
II. Оценка цитокинов и их антагонистов в биологических средах организма.
1. Tестирование биологической активности цитокинов.
2. Количественное определение цитокинов с помощью ИФА.
3. Иммуногистохимическое окрашивание цитокинов в тканях.
4. Определение соотношения оппозитных цитокинов (про- и противовоспалительных), цитокинов и антагонистов рецепторов цитокинов.
III. Оценка клеток-мишеней.
1. Определение экспрессии рецепторов цитокинов на уровне генов и белковой молекулы (ПЦР, метод проточной цитофлуориметрии).
2. Определение сигнальных молекул во внутриклеточном содержимом.
3. Определение функциональной активности клеток-мишеней.
В настоящее время разработаны многочисленные методы оценки системы цитокинов, которые дают разноплановую информацию. Среди них различают:
1) молекулярно-биологические методы;
2) методы количественного определения цитокинов с помощью иммуноанализа;
3) тестирование биологической активности цитокинов;
4) внутриклеточное окрашивание цитокинов;
5) метод ELISPOT, позволяющий выявить цитокины вокруг единичной цитокинпродуцирующей клетки;
6) иммунофлюоресценцию.
Приводим краткую характеристику этих методов.
С помощью молекулярно-биологических методов можно исследовать экспрессию генов цитокинов, их рецепторов, сигнальных молекул, изучать полиморфизм указанных генов. В последние годы выполнено большое число работ, выявивших ассоциации между вариантами аллелей генов молекул системы цитокинов и предрасположенностью
к ряду заболеваний. Изучение аллельных вариантов генов цитокинов может дать информацию о генетически запрограммированной продукции того или иного цитокина. Наиболее чувствительной считается полимеразная цепная реакция в реальном времени - ПЦР-РВ (см. гл. 6). Метод гибридизации in situ позволяет уточнить тканевую и клеточную локализацию экспрессиии цитокиновых генов.
Количественное определение цитокинов в биологических жидкостях и в культурах мононуклеарных клеток периферической крови методом ИФА можно охарактеризовать следующим образом. Поскольку цитокины являются локальными медиаторами, более целесообразно измерять их уровни в соответствующих тканях после экстракции тканевых протеинов или в естественных жидкостях, например в слезе, смывах из полостей, моче, амниотической жидкости, спинномозговой жидкости и т.д. Уровни цитокинов в сыворотке или других биологических жидкостях отражают текущее состояние иммунной системы, т.е. синтез цитокинов клетками организма in vivo.
Определение уровней продукции цитокинов мононуклеарами периферической крови (МНК) показывает функциональное состояние клеток. Спонтанная продукция цитокинов МНК в культуре свидетельствует, что клетки уже активированы in vivo. Индуцированный (различными стимуляторами, митогенами) синтез цитокинов отражает потенциальную, резервную способность клеток отвечать на антигенный стимул (в частности, на действие лекарственных препаратов). Сниженная индуцированная продукция цитокинов может служить одним из признаков иммунодефицитного состояния. Цитокины не специфичны в отношении конкретного антигена. Поэтому специфическая диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью определения уровня тех или иных цитокинов невозможна. В то же время оценка уровней цитокинов позволяет получить данные о тяжести воспалительного процесса, его переходе на системный уровень и прогнозе, функциональной активности клеток иммунной системы, о соотношении Th1- и Th2-клеток, что очень важно при дифференциальной диагностике ряда инфекционных и иммунопатологических процессов.
В биологических средах можно определить цитокины количественно с помощью целого ряда методов иммуноанализа, используя поликлональные и моноклональные антитела (см. гл. 4). ИФА позволяет узнать, каковы точные концентрации цитокинов в био-
логических жидкостях организма. Иммуноферментное выявление цитокинов имеет ряд преимуществ перед другими методами (высокая чувствительность, специфичность, независимость от присутствия антагонистов, возможность точного автоматизированного учета, стандартизации учета). Однако и этот метод имеет свои ограничения: ИФА не характеризует биологическую активность цитокинов, может давать ложные результаты за счет перекрестно-реагирующих эпитопов.
Биологическое тестирование проводят на основе знания основных свойств цитокинов, их действия на клетки-мишени. Изучение биологических эффектов цитокинов позволило разработать четыре разновидности тестирования цитокинов:
1) по индукции пролиферации клеток-мишеней;
2) по цитотоксическому эффекту;
3) по индукции дифференцировки костно-мозговых предшественников;
4) по противовирусному действию.
ИЛ-1 определяют по стимулирующему действию на пролиферацию мышиных тимоцитов, активированных митогеном in vitro; ИЛ-2 - по способности стимулировать пролиферативную активность лимфобластов; по цитотоксическому действию на мышиные фибробласты (L929) тестируют ФНОа и лимфотоксины. Колониестимулирующие факторы оценивают по их способности поддерживать рост костномозговых предшественников в виде колоний в агаре. Противовирусную активность ИФН выявляют по угнетению цитопатического действия вирусов в культуре диплоидных фибробластов человека и опухолевой линии фибробластов мышей L-929.
Созданы клеточные линии, рост которых зависит от присутствия определенных цитокинов. В табл. 7.1 представлен список клеточных линий, используемых для тестирования цитокинов. По способности индуцировать пролиферацию чувствительных клеток-мишеней проводят биотестирование ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-7, ИЛ-15 и др. Однако эти методы тестирования отличаются недостаточной чувствительностью и информативностью. Молекулы ингибиторов и антагонистов могут маскировать биологическую активность цитокинов. Некоторые цитокины проявляют общую биологическую активность. Тем не менее эти методы идеальны для тестирования специфической активности рекомбинантных цитокинов.
Таблица 7.1. Клеточные линии, используемые для тестирования биологической активности цитокинов
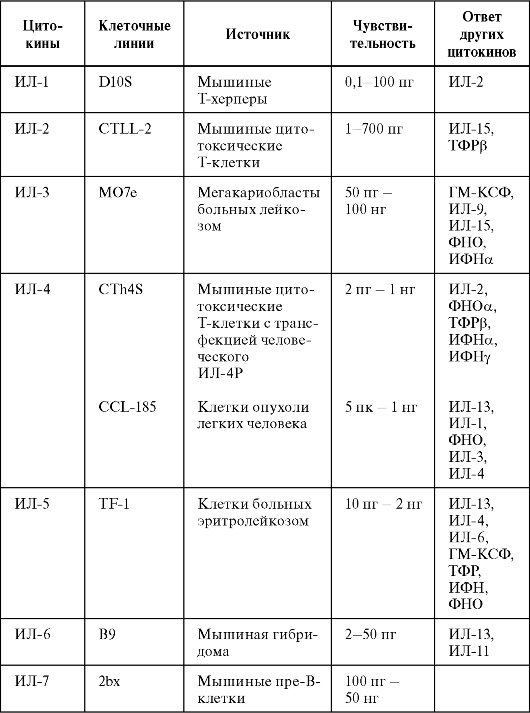 Окончание табл. 7.1
Окончание табл. 7.1
 Лабораторная работа 7-1
Лабораторная работа 7-1
Определение биологической активности ИЛ-1 по комитогенному действию на пролиферацию тимоцитов мышей
В основе метода биологического тестирования ИЛ-1 лежит способность цитокина стимулировать пролиферацию мышиных тимоцитов.
ИЛ-1 может быть определен в культуре моноцитов, стимулированных ЛПС, а также в любой биологической жидкости организма. Необходимо обратить внимание на ряд деталей.
1. Для тестирования применяют тимоциты мышей линии С3Н/ HeJ, стимулированные к пролиферации митогенами (конканавалин А - КонА и фитогемагглютинин - ФГА). Тимоциты С3Н/HeJ выбраны не случайно: мыши этой инбредной линии не отвечают на ЛПС, который может находиться в составе тестируемого материала и вызывать продукцию ИЛ-1.
2. Тимоциты отвечают на ИЛ-2 и митогены, поэтому в препаратах, тестируемых на ИЛ-1, следует определять также присутствие ИЛ-2 и митогенов.
Порядок работы
1. Получают суспензию тимоцитов в концентрации 12×106/мл среды RРМI 1640, содержащей 10% сыворотки эмбрионов коров и 2-меркаптоэтанол (5×10-5 М).
2. Готовят ряд последовательных двукратных разведений опытных (биологические жидкости организма) и контрольных образцов. В качестве контрольных используют биологические жидкости, содержащие ИЛ-1 или образцы, полученные при инкубации мононуклеарных клеток без ЛПС, и лабораторный стандартный ИЛ-1-содержащий препарат. В 96-луночные круглодонные планшеты из каждого разведения переносят по 50 мкл в 6 лунок.
3. В три лунки каждого разведения добавляют по 50 мкл растворенного в полной среде очищенного ФГА (Wellcome) в концентрации 3 мкг/мл, а в другие 3 лунки - по 50 мкл среды.
4. В каждую лунку добавляют по 50 мкл суспензии тимоцитов и инкубируют в течение 48 ч при 37 °С.
6. Перед завершением культивирования в лунки вносят по 50 мкл раствора (1 мкКи/мл) ['3Н]-тимидина и инкубируют еще 20 ч.
7. Для определения уровня радиоактивности клетки культуры переносят на фильтровальную бумагу с помощью автоматического сборщика клеток, фильтры высушивают и определяют включение метки жидкостным сцинтилляционным счетчиком.
8. Результаты выражают в виде коэффициента стимуляции.
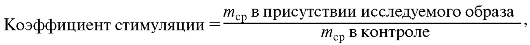 где mcp - среднее число импульсов в 3 лунках.
где mcp - среднее число импульсов в 3 лунках.
Если тимоциты отвечают на стимуляцию стандартным ИЛ-1, то индекс стимуляции исследуемого образца, превышающий 3, достоверно свидетельствует об ИЛ-1-активности.
Биоанализ является единственным методом для оценки функционирования цитокина, но данный метод должен быть дополнен разными видами соответствующего контроля на специфичность с использованием моноклональных антител. Добавление определенных моноклональных антител к цитокину в культуру блокирует биологическую активность цитокина, что доказывает: сигналом к пролиферации клеточной линии служит определяемый цитокин.
Использование биоанализа для выявления интерферона. Принцип оценки биологической активности ИФН основан на его противовирусном действии, которое определяется по степени ингибиции размножения тест-вируса в культуре клеток.
В работе могут быть использованы клетки, чувствительные к действию ИФН: первично трипсинизированные клетки-фибробласты эмбрионов кур и человека, перевиваемые клетки диплоидных фибробластов человека и культура мышиных клеток (L929).
При оценке противовирусного действия ИФН целесообразно использовать вирусы с коротким циклом размножения, высокой чувствительностью к действию ИФН: вирус энцефаломиелита мышей, везикулярного стоматита мыши и др.
Лабораторная работа 7-2
Определение активности интерферона
1. Взвесь диплоидных фибробластов плода человека на среде с 10% сывороткой эмбрионов коров (концентрация клеток - 15-20×106/мл) разливают в стерильные 96-луночные плоскодонные планшеты по 100 мкл в лунку и помещают в СО2-инкубатор при температуре 37 °С.
2. После формирования полного монослоя из лунок удаляют ростовую среду и в каждую лунку добавляют по 100 мкл поддерживающей среды.
3. Титрование активности ИФН в исследуемых образцах проводят методом двукратных разведений на монослое фибробластов.
Одновременно с образцами в лунки вносят вирус энцефаломиелита мышей (ВЭМ) в дозе, вызывающей 100% поражение клеток через 48 ч после заражения.
4. Для контроля используют лунки с интактными (необработанными) клетками, зараженными вирусом.
В каждом исследовании в качестве референс-препаратов используют пробы референс-ИФН с известной активностью.
5. Планшеты с разведениями образца инкубируют 24 ч при температуре 37 °С в атмосфере с 5% содержанием СО2.
6. Уровень активности ИФН определяют величиной, обратной значению максимального разведения тестируемого образца, задерживающего цитопатическое действие вируса на 50%, и выражают ее в единицах активности на 1 мл.
7. Для определения типа ИФН в систему добавляют антисыворотку против ИФНα, ИФНβ или ИФНγ. Антисыворотка отменяет действие соответствующего цитокина, что позволяет идентифицировать тип ИФН.
Определение биологической активности миграции ингибирующего фактора. В настоящее время сформировались совершенно новые представления о природе и свойствах МИФ, открытого в 60-х годах прошлого столетия в качестве медиатора клеточного иммунитета и много лет остававшегося без должного внимания (Bloom B.R., Bennet В., 1966; David J.R., 1966). Лишь в последние 10-15 лет стало ясно: МИФ представляет собой один из важнейших биологических медиаторов в организме с широким спектром биологических функций цитокина, гормона, фермента. Действие МИФ на клетки-мишени реализуется через СD74--рецептор или через неклассический путь эндоцитоза.
МИФ рассматривают как важный медиатор воспаления, активирующий функцию макрофагов (выработку цитокинов, фагоцитоз, цитотоксичность и др.), а также как эндогенный иммунорегуляторный гормон, модулирующий глюкокортикоидную активность.
Накапливается все больше сведений о роли МИФ в патогенезе многих воспалительных заболеваний, включая сепсис, ревматоидный артрит (РА), гломерулонефрит и др. При РА значительно увеличена концентрация МИФ в жидкости пораженных суставов, коррелирующая с тяжестью заболевания. Под влиянием МИФ возрастает выработка провоспалительных цитокинов как макрофагами, так и синовиальными клетками.
Известны различные методы тестирования активности МИФ, когда мигрирующие клетки (клетки-мишени для МИФ) помещают в стеклянный капилляр (капиллярный тест), в каплю агарозы или в агарозный колодец.
Мы приводим сравнительно простой скрининговый метод, основанный на формировании на дне лунок 96-луночного плоскодонного планшета клеточных микрокультур (лейкоцитов или макрофагов), стандартных по площади и числу клеток, с последующим их культивированием в питательной среде и определением изменения площади этих микрокультур при действии МИФ (Суслов А.П., 1989).
Лабораторная работа 7-3
Определение МИФ-активности
Определение биологической активности МИФ проводят с помощью устройства для формирования клеточных микрокультур (рис. 7.7) - МИГРОСКРИН (НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН).
1. В лунки 96-луночного планшета (Flow, Великобритания или аналогичные) добавляют по 100 мкл разведенной на культуральной среде пробы, в которой определяют МИФ-активность (каждое разведение в 4 параллелях, опытные пробы). Культуральная среда включает RPMI 1640, 2 mM L-глутамина, 5% сыворотки эмбриона коровы, 40 мкг/мл гентамицина.
2. В контрольные лунки добавляют культуральную среду (в 4 параллелях) по 100 мкл.
3. Готовят клеточную суспензию перитонеальных макрофагов, для чего 2 мышам-гибридам (СВАхС57В1/6)F1 внутрибрюшинно вводят по 10 мл раствора Хенкса с гепарином (10 ЕД/мл), осторожно массируют брюшко в течение 2-3 мин. Затем животное забивают декапитацией, осторожно прокалывают брюшную стенку в области паха и через иглу шприцем отсасывают экссудат. Клетки перитонеального экссудата дважды отмывают раствором Хенкса, центрифугируя их 10-15 мин при 200 g. Затем готовят суспензию клеток с концентрацией 10±1 млн/мл среды RPMI 1640. Подсчет проводят в камере Горяева.
4. Собирают систему МИГРОСКРИН, представляющую собой штатив для направленной и стандартной фиксации наконечников с клеточными культурами в строго вертикальном положении на заданной высоте над центром лунки 96-луночного культурального планшета, а также включающую 92 наконечника для автоматической пипетки фирмы «Costar», USA (рис. 7.7).
Вставляют ножки штатива в угловые лунки планшета. Клеточную суспензию набирают автоматической пипеткой в наконечники - по 5 мкл в каждый, ополаскивают от избытка клеток однократным опусканием в среду и вставляют вертикально в гнезда штатива системы. Заполненный штатив с наконечниками выдерживают при комнатной температуре в течение 1 ч на строго горизонтальной поверхности. За это время происходит оседание клеток суспензии на дно лунок, где формируются стандартные клеточные микрокультуры.
5. Штатив с наконечниками осторожно снимают с планшета. Планшет с микрокультурой клеток помещают в строго горизонтальном положении в СО2-инкубатор, где культивируют в течение 20 ч. В ходе культивирования клетки мигрируют по дну лунки.
6. Количественный учет результатов после инкубации проводят на бинокулярной лупе, визуально оценивая размер колонии по шкале внутри окуляра. Микрокультуры имеют форму круга. Затем исследователи определяют среднее значение диаметра колоний по результатам измерения колоний в 4 опытных или контрольных лунках. Погрешность измерения равна ±1 мм.
Индекс миграции (ИМ) рассчитывают по формуле:
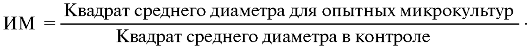 Проба обладает МИФ-активностью, если значения ИМ равны
Проба обладает МИФ-активностью, если значения ИМ равны
0,6±0,2.
За условную единицу (ЕД) МИФ-активности принимают обратную величину, равную значению наибольшего разведения пробы (образца), при котором индекс миграции равен 0,6±0,2.
Биологическую активность ФЕOα оценивают по цитотоксическому его действию на линию трансформированных фибробластов L-929. В качестве положительного контроля используют рекомбинантный ФНОа, а в качестве отрицательного контроля - клетки в культуральной среде.
Вычисляют цитотоксический индекс (ЦИ):
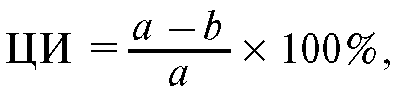 где a - количество живых клеток в контроле; b - количество живых клеток в опыте.
где a - количество живых клеток в контроле; b - количество живых клеток в опыте.
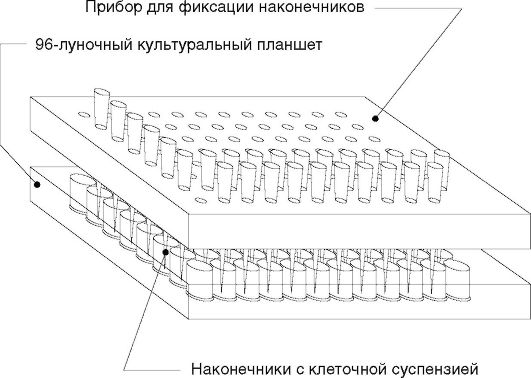 Рис. 7.7. Схема МИГРОСКРИН - устройства для количественной оценки миграции клеточных культур
Рис. 7.7. Схема МИГРОСКРИН - устройства для количественной оценки миграции клеточных культур
Клетки окрашивают красителем (метиленовым синим), который включается только в погибшие клетки.
За условную единицу активности ФНО принимают значение обратного разведения образца, необходимого для получения 50% клеточной цитотоксичности. Удельная активность образца - отношение активности в условных единицах на 1 мл к концентрации белка, содержащегося в образце.
Внутриклеточное окрашивание цитокинов. Изменение соотношения клеток, продуцирующих различные цитокины, может отражать патогенез заболевания и служить критерием прогноза заболевания и оценки проводимой терапии.
Методом внутриклеточного окрашивания определяют экспрессию цитокина на уровне одной клетки. Проточная цитофлуориметрия позволяет подсчитать количество клеток, экспрессирующих тот или иной цитокин.
Перечислим основные этапы определения внутриклеточных цитокинов.
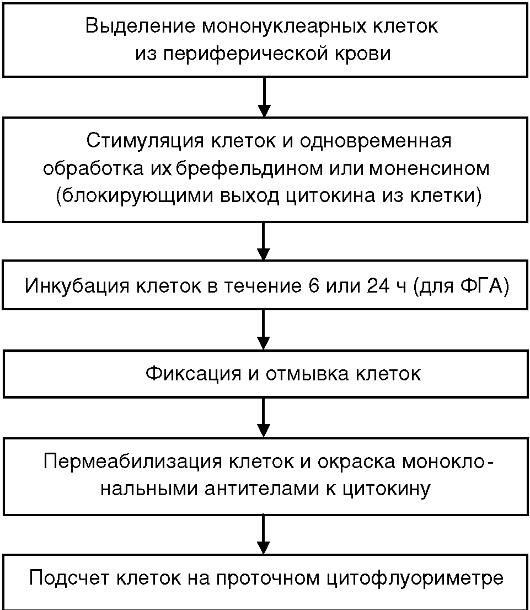 Нестимулированные
клетки продуцируют небольшие количества цитокинов, которые, как
правило, не депонируются, поэтому важным этапом оценки внутриклеточных
цитокинов являются стимуляция лимфоцитов и блокада выхода этих продуктов
из клеток.
Нестимулированные
клетки продуцируют небольшие количества цитокинов, которые, как
правило, не депонируются, поэтому важным этапом оценки внутриклеточных
цитокинов являются стимуляция лимфоцитов и блокада выхода этих продуктов
из клеток.
В качестве индуктора цитокинов чаще всего используют активатор протеинкиназы С форбол-12-миристат-13-ацетат (ФМА) в комбинации с ионофором кальция иономицином (ИН). Применение такого сочетания вызывает синтез широкого спектра цитокинов: ИФНу, ИЛ-4, ИЛ-2, ФНОα. Недостаток использования ФМА-ИН - проблемы выявления CD4-молекул на поверхности лимфоцитов после такой активации. Также продукцию цитокинов Т-лимфоцитами индуцируют с помощью митогенов (ФГА). В-клетки и моноциты стимулируют
ЛПС.
Мононуклеарные клетки инкубируют в присутствии индукторов продукции цитокинов и блокатора их внутриклеточного транспорта брефельдина А или моненсина в течение 2-6 ч.
Затем клетки ресуспендируют в буферном растворе. Для фиксации добавляют 2% формальдегид, инкубируют 10-15 мин при комнатной температуре.
Потом клетки обрабатывают сапонином, который повышает проницаемость клеточной мембраны, и окрашивают моноклональными антителами, специфичными к определяемым цитокинам. Предварительное окрашивание поверхностных маркеров (CD4, CD8) увеличивает количество получаемой информации о клетке и позволяет более точно определить ее популяционную принадлежность.
Имеются некоторые ограничения в применении описанных выше методов. Так, с их помощью невозможно анализировать синтез цитокинов единичной клеткой, невозможно определить количество цитокинпродуцирующих клеток в субпопуляции, невозможно определить, экспрессируют ли цитокинпродуцирующие клетки уникальные маркеры, синтезируются ли различные цитокины разными клетками или одними и теми же. Ответ на эти вопросы получают, используя другие методы исследования. Для определения частоты цитокин-продуцирующих клеток в популяции применяют метод лимитирующих разведений и вариант иммуноферментного анализа ELISPOT (см. гл. 4).
Метод гибридизации in situ. Метод включает:
1) замораживание органа и приготовление криостатных срезов;
2) фиксацию параформальдегидом;
3) выявление мРНК с помощью меченой кДНК. В некоторых случаях цитокиновую мРНК определяют на срезах с помощью радиоизотопной ПЦР.
Иммунофлюоресценция. Метод включает:
1) замораживание органа и приготовление криостатных срезов;
2) фиксацию;
3) обработку срезов меченными флюоресцеином антицитокиновыми антителами;
4) изуальное наблюдение флюоресценции.
Эти методики (гибридизация in situ и иммунофлюоресценция) быстры и не зависят от пороговых концентраций секретируемого продукта. Однако они не определяют количество секретированного цитокина и могут быть сложны технически. Необходим разнообразный тщательный контроль на неспецифические реакции.
С помощью представленных методов оценки цитокинов были выявлены патологические процессы, связанные с нарушениями в системе цитокинов на различных уровнях.
Таким образом, оценка системы цитокинов чрезвычайно важна для характеристики состояния иммунной системы организма. Изучение различных уровней системы цитокинов позволяет получить информацию о функциональной активности разных типов иммунокомпетентных клеток, о тяжести воспалительного процесса, о его переходе на системный уровень и о прогнозе заболевания.
Вопросы и задания
1. Перечислите общие свойства цитокинов.
2. Приведите классификацию цитокинов.
3. Перечислите основные компоненты системы цитокинов.
4. Перечислите клетки-продуценты цитокинов.
5. Охарактеризуйте семейства рецепторов цитокинов.
6. Каковы механизмы функционирования сети цитокинов?
7. Расскажите о выработке цитокинов в системе врожденного иммунитета.
8. Каковы основные подходы к комплексной оценке системы цитокинов?
9. Каковы методы тестирования цитокинов в биологических жидкостях организма?
10. Каковы дефекты в системе цитокинов при различных патологиях?
11. Каковы основные методы биологического тестирования ИЛ-1, ИФН, МИФ, ФНОа в биологических жидкостях?
12. Опишите процесс определения внутриклеточного содержания цитокинов.
13. Опишите процесс определения цитокинов, секретируемых единичной клеткой.
14. Опишите последовательность применяемых методов выявления дефекта на уровне рецептора цитокина.
15. Опишите последовательность методов, применяемых для выявления дефекта на уровне клеток-продуцентов цитокинов.
16. Какую информацию можно получить, исследуя выработку цитокинов в культуре мононуклеарных клеток, в сыворотке крови?