Клиническая иммунология : учебник / под ред. А.М. Земскова. - 2008. - 432 с.
|
|
|
|
ГЛАВА 15. ИММУННЫЕ РАССТРОЙСТВА И ИХ КОРРЕКЦИЯ ПРИ ДРУГИХ ЗАБОЛЕВАНИЯХ
15.1. ПСИХОНЕВРОЛОГИЧЕСКИЕ ЗАБОЛЕВАНИЯ
При приступообразно-прогредиентной шизофрении у больных наблюдается лимфопения, снижение количества CD3+-лимфоцитов, их основных субпопуляций с супрессорными свойствами, в том числе и регуляторов аутоиммунных реакций. Функциональная активность CD3+-лимфоцитов, оцененная интенсивностью РБТЛФГА, подавлена. Уровень CD19+-лимфоцитов повышен или не изменен, продукция IgG заторможена. Общая концентрация иммунных глобулинов в сыворотке крови увеличена. При данной патологии происходит образование антимозговых АТ, причем их уровень увеличивается пропорционально тяжести и продолжительности процесса. Фагоцитарная реакция угнетена. Определение формулы иммунных расстройств, т.е. ведущих иммунных параметров, выделяет в качестве информационно-значимых снижение содержания CD3+-лимфоцитов и их регуляторных субпопуляций.
В качестве иммунокорригирующих средств, повышающих эффективность традиционного лечения шизофрении, апробированы нуклеинат натрия, тимусные производные, гемодез, немедикаментозные воздействия - плазмаферез, ультрафиолетовое облучение аутокрови, квантовая терапия.
У пациентов с грыжами поясничных межпозвонковых дисков отмечалось снижение количества CD3+-клеток, CD4+-лимфоцитов с одновременным увеличением числа носителей CD8+, концентрации иммунных глобулинов основных классов, а также ЦИК и МСМ. Это свидетельствует о дисбалансе иммунной системы с супрессией Т- зависимых иммунных реакций и стимуляцией супрессорного звена. Естественно, такие изменения будут усугублять недостаточность иммунной системы на фоне активации гуморальных реакций с ростом концентрации ЦИК и МСМ. Подобная картина иммунопатологии свидетельствует о развитии у пациентов достаточно выраженных аутоиммунных реакций. Частотный анализ установил у пациентов формирование второй степени расстройств.
Проведение после дискэктомии базовой консервативной терапии с использованием витаминов группы В, стекловидного тела, метилурацила, пентоксила, некоторых других препаратов, наделенных
иммунотропным действием, обусловило определенное устранение иммунных расстройств.
У больных с ишемическим инсультом в первые дни госпитализации отмечалась тенденция к снижению уровня CD3+-лимфоцитов, нулевых лимфоцитов, CD4+-лимфоцитов с дисиммуноглобулинемией и уменьшением концентрации IgG, возрастанием IgM.
Учитывая характер иммунных расстройств, в качестве дополнительных методов воздействия на больного рекомендованы: нуклеинат натрия - мягкий иммуномодулятор со способностью усиливать репаративные процессы, в том числе и в нервной ткани, тимоптин - модулятор Т-зависимых иммунных реакций, регулятор липидного обмена и миелопид - модулятор антителообразования.
При легких травмах мозга отмечается стимуляция гуморальных иммунных реакций, что ограничивает применение в лечении больных иммуностимулирующих средств. Показаны препараты с иммуномодулирующим потенциалом: нуклеинат натрия, бимитил, пирацетам. Однако в ряде случаев у пациентов возможно развитие избыточной нейросенсибилизации, что подразумевает применение десенсибилизирующей терапии.
При ушибах мозга средней и тяжелой выраженности формируется пограничная дисфункция, иногда иммунный паралич. В этих случаях показано удаление продуктов избыточного протеолиза методом гемосорбции с одновременным назначением тимусных препаратов, ориентированных в основном на клеточные реакции иммунитета. Продолжительность введения последних доз должна составлять 5-7-10 дней. Также достаточно эффективным является эпиталамин, увеличивающий уровень CD4+, CD3+, CD22+ лимфоцитов, IgG и снижающий завышенную концентрацию IgA, способствующий ликвидации хронического ДВС-синдрома.
Иногда после ушибов головного мозга формируются внутричерепные инфекционные осложнения. Критериями их индукции является низкий уровень IgG в крови (ниже 8 г/л), низкая концентрация IgG (менее 0,05 г/л), IgA (меньше 0,005 г/л) в ЦСЖ. В этих случаях показана ликвор-активация Т-звена иммунитета, введение интраглобина в субарахноидальное пространство по 10 мл (500 мг) в сут в течение 3 дней с эквивалентным выведением ликвора. Показана определенная активность ронколейкина.
В настоящее время установлено активное участие аутоиммунных реакций в патогенезе рассеянного склероза. Причина их индукции
обсуждается достаточно долго. Пока нет объективных данных об индукторе иммунопатологии, возможно - это вирус. Существует определенная генетическая предрасположенность, агрессивные факторы внешней среды. Учитывая современный уровень развития клинической иммунологии, которая в основном оперирует неспецифическими воздействиями на иммунную систему, это не имеет принципиального значения. Поэтому в разряд препаратов, применяющихся при данной патологии, внесены кортикостероиды, цитостатики, иммуностимуляторы типа тимусных производных, нуклеината натрия, методы афферентной терапии.
У больных в стадии стабилизации рассеянного склероза обнаружено увеличение абсолютного и относительного количества общих Т-клеток (CD3+), процента натуральных киллеров (CD16+), клеток носителей CD11b+ и носителей маркера HLA-DR. Всего из 13 показателей 5 было повышено.
Математически значимая динамика составляющих гуморального звена иммунитета выразилась в росте процента и абсолютного числа В-лимфоцитов (CD19+), концентрации IgA, ЦИК и увеличении индексных показателей IgA/B, IgM/В, IgA, IgM, IgG/В-клетки.
Была отмечена также стимуляция поглотительной способности лейкоцитов (фагоцитарное число) на фоне снижения уровня моноцитов циркулирующей крови.
С помощью коэффициента диагностической ценности был проведен анализ типовых изменений иммунного статуса у больных рассеянным склерозом в зависимости от течения заболевания. Были получены следующие результаты. При стаже болезни 1-5 лет ФРИС имела вид: Лейк1- CD82+ Лимф1-;то же 6-10 лет - Лейк1-CD8з+Лимф1-; то же с легкой формой - CD42-Лимфl-CD31-; то же со средне-тяжелой - CD42-Лейк1-CD82+; то же с тяжелой - IgM1CD42-CD81+; то же с непрерывно-рецидивирующем течением - CD83+Лейк1-CD42-; то же с ремиттирующим течением - CD42-CD81+Лейк1-.
15.2. РЕВМАТОИДНЫЕ ЗАБОЛЕВАНИЯ
На развитие ревматизма (острой ревматической лихорадки) влияют следующие три фактора:
1) врожденные особенности иммунных реакций;
2) перенесенные или латентно протекающие вирусные инфекции;
3) воздействие острой или хронической стрептококковой инфекции. Формирование данной патологии характеризуется уменьшением
количества лейкоцитов, лимфоцитов, СD3+-клеток, СD4+-лимфоцитов, СD8-лимфоцитов при одновременном повышении уровня нулевых клеток. Падение содержания CD3+-лимфоцитов сопровождается параллельным угнетением их функциональной активности (замедление РБТЛФГА). Отмечается интенсификация РБТЛ на стрептококковой Аг и Аг сердечной мышцы. Содержание CD19+-клеток уменьшается или увеличивается, концентрация IgG падает.
Ослабление супрессорных механизмов иммунных реакций (снижение количества и функции CD8+-лимфоцитов) способствует увеличению антителообразования. При ревматизме (острой ревматической лихорадке) отмечается значительное повышение гуморального иммунного ответа на воздействие стрептококков и их токсинов - повышение титра антистрептолизина-О (АСЛ-О), антигиалуронидазы, антистрептокиназы, АТ против М-протеина, А-полисахарида. Наряду с этим, при данной патологии значительную роль играют аутоантитела против многих Аг, находящихся в миокарде. У 76-83% больных ревматизмом (острой ревматической лихорадкой) с первичным кардитом и у 63-69% с возвратным кардитом обнаруживаются ЦИК, коррелирующие с увеличением содержания иммунных глобулинов, повышенными титрами АСЛ-О, тяжестью болезни. Эти комплексы содержат АТ против стрептолизина-О и обладают способностью фиксировать комплемент. Одновременно увеличивается выраженность кожных проб на стрептококковый аллерген. Динамика указанных показателей документирует участие в патологическом процессе аутоиммунных и аутоаллергических механизмов. К этому надо добавить снижение активности α-ГФДГ и повышение проницаемости лизосомальных мембран в лимфоцитах больных, изменения нуклеинового обмена. Таким образом, ревматизм сопровождается вторичным иммунодефицитом по CD3-лимфоцитам и их основным субпопуляциям. В лимфоидных клетках подавлена активность цикла Кребса, снижена стабилизация лизосомальных мембран, что способствует высвобождению биогенных аминов, обусловливающих аллергические реакции.
Лечение ревматизма (острой ревматической лихорадки) включает противострептококковую терапию (бензилпенициллин, полусинтетические пенициллины, антибиотики - макролиды), нестероидные противовоспалительные средства, иммуномодулирующие препараты, среди которых следует упомянуть глюкокортикостероиды, иммунодепрессоры - хингамин, гидроксихлорин, иммунокорректоры (нуклеинат натрия, левамизол, гемодез), немедикаментозные воздействия
(плазмаферез, ультрафиолетовое облучение крови, квантовую терапию).
Была изучена сравнительная эффективность дифференцированной иммунокоррекции нуклеинатом натрия, γ-глобулином (Гг) и комбинацией НН+Гг, которые применяли в комплексе с традиционными лекарственными препаратами, получаемыми больными ревматизмом.
Мишенью действия нуклеината натрия являются в основном ориентированные на уровень иммунных глобулинов класса G, CD3+- клетки и общие лимфоциты, т.е. в спектре мишеней препарата находятся показатели разных звеньев иммунитета, γ-глобулин обусловливает стимуляцию уровня CD3+-лимфоцитов, CD4+ и IgA.
У пациентов, подвергнутых одновременному воздействию НН и Гг, ФМИ имеет следующий вид - IgA+2CD4+3CD3+3, отражая предельную стимуляцию двух параметров Т- и одного - В-звеньев иммунитета.
В принципе патогенез ревматизма (острой ревматической лихорадки) и ревматоидного артрита достаточно близок, однако при детальном анализе обнаружены определенные его отличия.
Установлено, что в остром периоде заболевания у пациентов происходило снижение содержания CD3+-клеток и двух их основных регуляторных субпопуляций с гиперпродукцией и IgG, АТ к ДНК, ЦИК.
Типовые изменения иммунной системы при ревматоидном артрите позволяют рекомендовать для терапии: нуклеинат натрия, тимусные производные, тимомиметик - левамизол, гемодез, некоторые методы афферентной терапии, в тяжелых случаях - кортикостероиды.
Общие изменения при СКВ характеризуются дисбалансом в клеточном и гуморальном звеньях иммунитета: снижение уровня лейкоцитов, общих лимфоцитов, CD3+-, CD4+-, CD8+-клеток. Количество CD19+-клеток повышено, концентрация - IgA, IgG, IgM, ЦИК снижена, фагоцитарная активность подавлена. Это требует назначение больным иммунокорректоров и немедикаментозных воздействий. В их числе прошли более или менее успешную апробацию спленоперфузия, низкоинтенсивное лазерное излучение, введение γ-глобулинов, интерферонов и интерфероногенов, левамизола и др.. Учитывая общий характер иммунопатологии при данном заболевании, представляется адекватным использование тимусных препаратов и нуклеината натрия, цитостатиков (циклофосфамид, азатиоприн), антикоагулянтов, гипотензивных, антиагрегантных средств.
Базовая терапия в этом плане «инертна». Значимая динамика зарегистрирована лишь по общим лейкоцитам и нулевым клеткам. Вариации остальных параметров несущественны.
Иммунологическими мишенями традиционного лечения являются: IgA, СD19+-клетки и ЦИК, т.е. действие терапии замыкается на показателях гуморального звена иммунитета.
При использовании тактивина отмечается увеличение уровня лимфоцитов, СDЗ-клеток, СD4+-клеток, СD19+-лимфоцитов. Нормализуется содержание СБ8-клеток. Ключевыми мишенями оказываются СDЗ-клетки, СD8+-стимуляция и IgA-супрессия.
Эффективность нуклеината натрия в качестве компонента общепринятого лечения оказалась несколько выше. Отмечается достоверная стимуляция абсолютного количества лимфоцитов, СDЗ-клеток, их регуляторных субпопуляций, СD19+-лимфоцитов. Следует отметить, что уровень СD8+-клеток достигает нормальных величин. Также значительно уменьшается концентрация IgG и ЦИК. Повышается фагоцитарная активность нейтрофилов.
Наиболее существенно под влиянием препарата РНК изменяется содержание СD8+-клеток, а также IgA, IgG и ЦИК. Спектр действия нуклеината натрия значительно шире, чем у тимусного производного.
Традиционная терапия способствует клиническому улучшению у 78,8% больных.
Тактивин повышает клинический эффект до 96,6%.
Комплексная терапия с включением нуклеината натрия оказывает положительный лечебный эффект в 92,2%.
Действие тактивина превосходит эффект нуклеината натрия по проявлениям кожного, суставного, лихорадочного синдромов. Нуклеиновый препарат более сильно влияет на пациентов с люпуснефритом и гепатолиенальным синдромом.
15.3. ЗАБОЛЕВАНИЯ С АУТОИММУННЫМ КОМПОНЕНТОМ
Аутоиммунный тиреоидит является вариантом аутоиммунного поражения щитовидной железы. При данной патологии в большом количестве образуются антитиреоидные АТ, направленные против различных компонентов органа, сенсибилизированные против Аг железы цитотоксичные Т-лимфоциты. Одновременно в периферической крови регистрируется дефицит общих СDЗ-клеток, СD8- клеток, IgM, нормальное, повышенное или сниженное количество СD19+-лимфоцитов, избыточное накопление в плазме IgA, ЦИК. Что
касается оценки состояния факторов неспецифической антиинфекционной резистентности, то они существенно подавлены, особенно при тяжелом течении заболевания щитовидной железы.
При тиреотоксикозе также формируются аутоиммунные реакции, направленные против щитовидной железы, однако их выраженность значительно ниже (по некоторым данным в 3 раза), чем при аутоиммунном тиреоидите. Характер иммунных расстройств: недостаточность Т-звена иммунитета, особенно супрессорных механизмов, активизация гуморальных иммунных реакций.
Гипотиреоз характеризуется атрофией железистого эпителия в щитовидной железе, круглоклеточной инфильтрацией. Предположительно, что первичный гипотиреоз является исходом аутоиммунного тиреоидита. И действительно, при гипотиреозе отмечается значительное снижение количества СDЗ+- и СD19+-лимфоцитов, IgM, повышение содержания IgA, накопление в значительных титрах противотиреоидных АТ у 50-95% больных.
В комплекс традиционных лекарственных средств, применяемых при терапии этого заболевания щитовидной железы, допустимо включение стимуляторов Т-звена иммунитета - тимусных производных (тималина, тактивина, тимоптина), нуклеината натрия, левамизола. Как показывает практика, назначение указанных медикаментов должно быть длительным, до нескольких месяцев. Необходимо подчеркнуть, что гормоны щитовидной железы (левотироксин, лиотиронин), широко использующиеся в терапии заболевания Хашимото и первичного гипотиреоза, также наделены иммуностимулирующими свойствами. Однако при длительном применении они способны вызвать иммуносупрессию. Показана также успешность использования в лечении больных кортикостероидов, эпсилон-аминокапроновой кислоты, как правило, в небольших дозах, иногда (при тиреотоксикозе) в сочетании с иммунодепрессорными средствами (пуринетол, хлорамбуцил, азатиоприн). В последние годы выявлена высокая эффективность плазмафереза с ультрафиолетовым облучением аутокрови, квантовой терапии. Не потеряло актуальности применение малых иммунокорректоров - стекловидного тела, плазмола, тканевых препаратов, витаминов.
Апробированы пять вариантов дифференцированного лечения хронического аутоиммунного тиреоидита: моноозонотерапия, сочетание последней с тиреоидными препаратами, озонотерапия, осуществляемая сразу после резекции щитовидной железы, одни тиреотропные средства. Определение конкретных мишеней дифференцированного
лечения (ФМИ) показывает, что монотерапия озоном ориентирована на Т- и В- зависимые реакции со стимуляцией первых и супрессией вторых. Комбинация озонированного раствора с тиреоидными препаратами обеспечивает однозначную стимуляцию Т-клеточных параметров - увеличение уровня СDЗ-клеток, СD4+-лимфоцитов и снижение количества СD8-клеток. Эффект L-тироксина оказался более широким, в начальный срок отмечается стимуляция содержания тиреодных гормонов (ТЗ, Т4), СD4-лимфоцитов, СD8+-лимфоцитов с уменьшением общих СDЗ-лимфоцитов, через месяц значительно стимулируются СDЗ-лимфоциты и их регуляторные субпопуляции, а также поглотительная функция фагоцитов, что в принципе сохраняется З месяца. Эффект комбинированных воздействий (L-тироксин + озон и резекция + озон) Т-зависим.
Характерными изменениями в иммунном статусе у больных сахарным диабетом являются: снижение уровня СDЗ+-, иногда СD19+- лимфоцитов; подавление функциональной активности СDЗ-лим- фоцитов, СD8+-клеток (у больных сахарным диабетом 1-го типа); увеличение содержания IgA и IgM, ЦИК, особенно при развитии сосудистых поражений (диабетической ретинопатии); угнетение фагоцитарной функции лейкоцитов, снижение содержания комплемента, лизоцима, интерферона, бактерицидной активности сыворотки крови и кожи. Нарушаются все фазы фагоцитоза; хемотаксис, прилипание, поглотительная и бактерицидная функции.
Расстройства иммунной реактивности у больных сахарным диабетом вызывают снижение антиинфекционной резистентности, что проявляется различными гнойничковыми поражениями кожи (фурункулез, пиодермия), воспалительными процессами в мочевых путях, желчном пузыре, гнойными абсцессами, респираторными инфекциями, пневмониями и др.
К основным видам лечения больных сахарным диабетом - диете, физическим нагрузкам, фитотерапии, лечением сахароснижающими препаратамии (инсулин, сульфаниламиды, бигуаниды, глитазоны, ингибиторы глюкозидаз, прандиальные регуляторы гликемии, инкретиномиметики, комбинированные препараты) желательно добавление иммунотропных средств. При введении инсулина свиней, отличающегося от человеческого по одной аминокислоте, и особенно бычьего - по трем, возможно образование антител и лимфоцитов, обусловливающих разрушение лекарственного средства. В настоящее время вышеперечисленные инсулины практически не применяются.
Современным стандартом инсулинотерапии является применение генноинженерных человеческих инсулинов либо их аналогов. В случае формирования инсулинрезистентных форм диабета в лечении применяются глюкокортикостероиды, а также иммунодепрессанты (азатиоприн). Показаны тимусные производные, нуклеинат натрия, левамизол, а также тканевые препараты - ФИБС, его сочетание с взвесью плаценты, алоэ.
При комбинации заболеваний с аутоиммунным компонентом - хроническим аутоиммунным тиреоидитом (ХАИТ) и сахарным диабетом типа 1 (СД1) (абсолютный дефицит инсулина) - ХАИТ + СД1 динамика иммунных показателей меняется в качественном и количественном плане. Так, отмечается устойчивое снижение во всех трех случаях уровня СD3+-лимфоцитов, СD8+-клеток; избыток IgG, который был «навязан» комбинации ХАИТ, излишняя концентрация ЦИК с супрессией фагоцитарного показателя, обнаруженная у больных с ХАИТ+СД1, не регистрируется при монозаболеваниях.
Примерно такая же картина наблюдалась у пациентов, страдающих ХАИТ+БА (бронхиальная астма). В остром периоде заболевания наблюдалась супрессия Т-звена иммунитета по общим СD3+-клеткам и основным регуляторным субпопуляциям, дисбаланс фагоцитоза с угнетением поглотительной функции и стимуляцией метаболизма нейтрофилов. Гуморальные реакции оказались интактными.
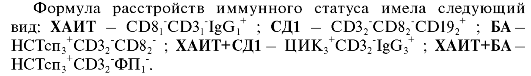 15.4. ЗАБОЛЕВАНИЯ КОЖИ
15.4. ЗАБОЛЕВАНИЯ КОЖИ
Кожа постоянно подвергается воздействию различных внешних агентов и участвует в координации реакций организма на эти воздействия. Она рассматривается как орган, в котором развиваются локальные иммунные реакции и генерируются сигналы, направленные на вовлечение в ответ всей иммунной системы организма.
В отличие от периферических органов иммунной системы (селезенки и лимфатических узлов), от слизистых оболочек дыхательных и пищеварительных путей, имеющих значительные участки оформленной лимфоидной ткани, кожа не содержит больших структурных скоплений лимфоцитов. Здесь они осуществляют свои функции как пул клеток, постоянно циркулирующих с достаточно большой скоростью.
В реализации локальных кожных иммунных реакций участвуют СDЗ-лимфоциты, кератиноциты, дендритные клетки Лангерганса, ретикулярные клетки Гренстейна, эпидермиса и дермы. Взаимодействие СDЗ-лимфоцитов с кератиноцитами в зависимости от условий определяет тип иммунной реакции кожи на антигенный раздражитель - поликлональную Т-клеточную активацию, антигенспецифическую Т-клеточную пролиферацию или анергию, цитотоксичекие реакции. В реализации этих иммунных процессов участвуют выделяющиеся эпидермальными клетками цитокины - ИЛ-1, ИЛ-6, ФНО, ИЛ-7, ИЛ-8, гемопоэтические факторы роста, факторы роста эпидермальных клеток и фибробластов. Эпидермальные клетки продуцируют также неспецифические факторы, участвующие в развитии иммунных реакций - простагландины, лейкотриены, гидроперекиси жирных кислот, активаторы и ингибиторы плазминогена.
Клетки Лангерганса воспринимают антигенную информацию и предоставляют ее лимфоцитам, оказывают влияние на пролиферацию и дифференцировку Т-лимфоцитов дермы. После связывания Аг клетки Лангерганса мигрируют из эпидермиса в дренирующие лимфатические узлы, где они формируют кластеры с Т-лимфоцитами и индуцируют развитие различных форм иммунного ответа. Принципиально важно, что нанесенный на кожу Аг в норме индуцирует хелперный Т-клеточный ответ, а в отсутствие функционально активных клеток Лангерганса он вызывает развитие супрессорного эффекта. Среди Аг-представляющих ретикулярных клеток есть устойчивые к ультрафиолетовому облучению и другим воздействиям клетки Гренстейна, обладающие свойством взаимодействовать с СD8+-лимфоцитами.
В остром периоде грибовидного микоза развиваются типовые реакции иммунной системы - избыточное содержание СD8+-лимфоци- тов, ЦИК, дефицит содержания СD4+-лимфоцитов.
Реализация базового лечения - 4-6 курсов комбинированной полихимиотерапии (проспидин+преднизолон, фотрин+кортикостероиды) обусловливает общую супрессию клеточных параметров от фоновых значений - СD82-СDЗ1-(Лейк1-Лимф1-). Через три недели в числе диагностически значимых мишеней оказываются ЦИК1-СDЗ1-Лейк1-, после З-6 курсов - СD8+З-СDЗ2-Лимф1- с минимальным эффектом нормализации.
В случае дополнительного назначения больным тимусных препаратов наблюдается достоверное снижение исходно повышенной
концентрации ЦИК, стимуляция СD3+-клеток и СD4+-лимфоцитов. В более поздние сроки отмечается нормализация содержания общих лимфоцитов, СD3+- и СD19+-клеток, СD4+-лимфоцитов, СD8+-кле- ток.
Максимальная эффективность иммунокоррекции достигается уже после первого курса лечения. Далее, после 3-6 циклов она несколько снижается, но превышает значимость одного базового лечения.
У пациентов с саркомой Капоши регистрируется снижение уровня основных популяций лимфоцитов на фоне избытка ЦИК: СD31- СD191-ЦИК2+.
Один курс проспидия хлорида в числе прочих изменений обусловливает снижение количества клеток с супрессорными свойствами и увеличение содержания общих лейкоцитов и лимфоцитов.
Мишени комбинации проспидина с тимусным препаратом после первого курса и через 21 день существенно отличаются от традиционной терапии: СD82-Лейк1+Лимф1+ и СD82-ЦИК1-СD41+. Через 3-6 курсов мишени двух вариантов воздействия стали идентичными - СD82-ЦИК1-Лейк1+. Таким образом, в ранние сроки исследования использование иммуномодулятора принципиально меняет характер изменений иммунной реактивности, т.е. подавленный эффект тимактида, выраженный после первого курса, также снижается по мере увеличения срока и курсовой дозы препарата. Интегральная оценка эффективности иммунокоррекции показала ее наибольшую выраженность сразу после первого курса лечения и одинаково меньшую выраженность через 21 день и 3-6 циклов терапии.
Псориаз, или чешуйчатый лишай является одним из распространенных заболеваний кожи, которым страдают более 1-3% населения. В патогенезе его лежат иммунопатологические процессы, в том числе аутоиммунные реакции.
Традиционное лечение включает гипосенсибилизирующие средства, 30% тиосульфат натрия, 10% глюконат кальция, антигистаминные препараты, препараты, повышающие сопротивляемость организма (пирогенал, биостимуляторы), витамины (В6, В12, А).
Иммуномодуляторы назначались по следующей схеме - ликопид в течение 10 дней по 10 мг два раза в день, 1,5% раствор дерината по 5 мл внутримышечно, пять инъекций через 24 ч.
У больных с простым псориазом (ПП) в остром периоде регистрируется снижение содержания СD3+-клеток, СD4+-, СD19+-лимфоци- тов, повышение ЦИК, IgG, фагоцитарного числа и НСТ.
У больных с осложненным псориазом (ОП) все изменения оказались более выраженными: уменьшилось содержание СDЗ+-клеток, СDБ4+-, СD8+-, СD19+-лимфоцитов ЦИК, IgA, фагоцитарного числа,
НСТ.
Традиционное лечение при ПП не вызывает существенных изменений в содержании СDЗ+-, СD4+-, СD8+-лимфоцитов (исходное снижение) и сохраняет начальное увеличение СБ8+-лимфоцитов и фагоцитарной активности.
Дополнительное использование при ПП ликопида устраняет все нарушения, за исключением изменений содержания СD8+-лимфо- цитов и фагоцитарной активности. При ОП тот же препарат, хотя и обусловил некоторое изменение уровня СDЗ-лимфоцитов, ЦИК, IgA, фагоцитарного числа, но не до нормативных значений здоровых людей.
Деринат при неосложненном псориазе обеспечивает практически полную нормализацию иммунопатологии, но также не корригирует соответствующие изменения иммунного статуса при осложненном псориазе, хотя и в большей степени, чем ликопид. Комбинации двух воздействий оказались бесперспективными.
Показаны определенные изменения цитокинового статуса у больных. Так, в остром периоде болезни увеличена концентрация α-ФНО, ИЛ-1р и сывороточного ИЛ-6.
Традиционное лечение у больных ПП вызывает снижение уровня всех цитокинов, не доводя его, однако, до нормальных значений. Ликопид дополнительно уменьшает уровень α-ФНО, не влияя на другие цитокины. Деринат не действует на α-ФНО, но уменьшает ИЛ-1р и ИЛ-6 с достижением уровня нормы. Комбинация обоих воздействий устраняет все расстройства цитокинового статуса.
При традиционной терапии ОП без иммуномодуляторов происходило снижение содержание α-ФНО, ИЛ-1β, тогда как ликопид повышал содержание фактора некроза. Деринат или его комбинация с ликопидом снижали исходно повышенный уровень этих цитокинов, не доводя его до нормы и увеличивали содержание ИЛ-6.
Учитывая динамику составляющих иммунного, лабораторного и клинического статусов, наиболее эффективными для простой формы псориаза оказались ликопид или деринат, для осложненного течения - комплекс дерината с ликопидом и средствами базисной терапии.
В остром периоде заболевания у пациентов с микробной экзе-
мой обнаружено увеличение абсолютного количества лейкоцитов, сегментоядерных клеток, моноцитов, общих СDЗ-клеток, их регуляторных субпопуляций с хелперными и супрессорными свойствами. Изменения параметров В-звена были достаточно монотонными, отражая увеличенную продукцию IgM и IgG. Они сочетались с подавлением поглотительной способности фагоцитов (фагоцитарный показатель и число), угнетением метаболической активности нейтрофилов (спонтанный и активированный НСТ-тест).
В остром периоде глубоких пиодермий у больных регистрируется снижение уровня гемоглобина, эритроцитов, лимфоцитов, рост числа сегментоядерных клеток, дефицит СDЗ-лимфоцитов с подавлением функциональной активности (РБТЛФГА), недостаточность количества СD4+-, СD8+-клеток, IgA. Одновременно у страдающих пиодермией документировано увеличение концентрации IgM и IgG, ЦИК, что сочеталось с угнетением поглотительной способности фагоцитов и активацией метаболизма нейтрофилов. В целом данная патология привела к супрессии Т-зависимых иммунных реакций, дисиммуноглобулинемии, дисбалансу фагоцитоза.
Также при данном заболевании отмечалась повышенная сенсибилизация к аллергенам гемолитического стафилококка и к Аг эпидермиса и ткани почек, что свидетельствует о наличии достаточно выраженных аутоиммунных процессов.
Базовая терапия недостаточно эффективна в плане устранения иммунных расстройств, т.к. у пациентов отмечена лишь тенденция к стимуляции уровня СD4+-лимфоцитов, общих СDЗ-лимфоцитов, фагоцитарного показателя и снижение концентрации ЦИК.
Поэтому рекомендовано дополнительно назначать больным иммунотропные воздействия - тимусные препараты, аутогемотерапию, энтеральные сорбенты, ридостин.
Наиболее активен в этом плане ридостин, затем тимусные препараты и аутогемотерапия, далее энтеральные сорбенты.
Аллергические васкулиты кожи являются тяжело протекающими, часто рецидивирующими, резистентными к проводимой терапии заболеваниями, в патогенезе которых имеются иммунопатологические процессы.
При поверхностных и глубоких васкулитах в остром периоде заболевания обнаруживается увеличение (от уровня нормы) количества общих СDЗ-лимфоцитов, активных Т-лимфоцитов, СD4+-лимфо- цитов; содержание СD8+-лимфоцитов снижается, уровень СD19+-
лимфоцитов, иммунных комплексов в сыворотке крови достоверно увеличивается (примерно одинаково) при обеих нозоформах.
При анализе фагоцитарного звена обнаруживаются определенные различия. Так, при поверхностном васкулите поглотительная способность нейтрофилов повышается, а метаболическая активность этих клеток подавляется. При глубоком васкулите стимулируются оба механизма неспецифической защиты.
Формула расстройства иммунной системы при повреждении мелких сосудов кожи имеет вид CD11вз+IgMз+Тз+, при вовлечении в патологический процесс глубоких сосудов она несколько меняется - CD193+IgM3+CD11в3+.
15.5. ОНКОЛОГИЧЕСКИЕ ЗАБОЛЕВАНИЯ
По современным представлениям, роль иммунной системы состоит в элиминации любых клеток с измененными или чужеродными Аг. Возникновение в организме опухолеродных клеток - это не нарушение нормальной программы клеточного роста, а включение особых генетически детерминированных механизмов, которые в норме находятся в репрессированном состоянии.
На существование специфической противоопухолевой иммунной защиты указывают случаи спонтанной ремиссии человеческих опухолей, а также тот факт, что некоторые опухоли относительно долго могут оказываться локализованными.
От рождения до смерти в организме возникает до 1 млн мутантных клеток в сут. Среди них всегда есть раковые клетки. Механизмы, направленные на их уничтожение, обусловливают функцию иммунного надзора, который реализуют иммунные и неиммунные реакции.
Первый уровень представлен феноменами естественной (врожденной) резистентности, обусловленной натуральными (естественными) киллерами, цитотоксическими моноцитами и макрофагами, гранулоцитами и тучными клетками. Этот уровень действует немедленно даже в отношении минимально измененных клеток, единичных раковых клеток. Кроме перечисленных, в реализации защиты участвуют и другие факторы.
Компетенцией второго уровня является индукция специфического противоопухолевого иммунитета. Главными его участниками являются специфические цитотоксические лимфоциты, макрофаги, антителозависимые киллеры, цитотоксические АТ, интерферон.
Следует заметить, что развитие злокачественных опухолей у людей сопровождается индукцией иммунной недостаточности, в основе которой лежат различные механизмы.
Опухолевые клетки индуцируют образование и накопление поликлональных Аг, которые истощают иммунную систему, заставляя ее продуцировать неспецифические факторы, не несущие защитного потенциала.
Частота мутаций в быстрометастазирующих опухолях в 5-7 раз выше, чем в неметастазирующих, что затрудняет формирование адекватных механизмов элиминации неоплазм.
Мембрана злокачественных клеток за счет синтезированных белков становится в ряде случаев непроницаемой для цитотоксических веществ. «Привыкание» этих клеток к противоопухолевым препаратам происходит значительно быстрее, чем организма в целом. Причем количество резистентных клеток к этим лекарственным средствам может каскадно увеличиваться.
Клетки злокачественных опухолей синтезируют ряд веществ, успешно подавляющих реакции отторжения. К ним относят растворимый супрессорный фактор и другие соединения, достаточно активны блокирующие распознающие рецепторы натуральных киллеров, Т-киллеров, приводя их к «дезориентации».
К этому следует добавить тот факт, что у больных имеется недостаточное количество активатора иммунных реакций ИЛ-2. В ряде случаев у пациентов образуется хорионический гонадотропин - естественный иммуносупрессорный гормон беременности, который также подавляет иммунную реактивность.
При раке интенсивно стимулируются ингибиторные механизмы, затрагивающие Т- и В-супрессоры, макрофаги-супрессоры, что приводит к дисбалансу иммунных реакций.
Злокачественные клетки синтезируют простагландины, в частности, Е2, активно подавляющие иммунитет.
У больных зарегистрировано обеднение сыворотки крови низкомолекулярными нуклеиновыми кислотами, что обусловливает общее подавление уровня метаболизма в организме.
Складывается впечатление, что существуют генетически запрограммированные ситуации, способствующие развитию злокачественных новообразований. Известен так называемый «феномен проскальзывания», когда защитные механизмы срабатывают при попадании или возникновении в организме среднего количества злокачествен-
ных клеток от 10 до 1000. Меньшие и большие их количества распознаются с трудом. Иногда против раковых клеток вырабатываются цитотоксические АТ, которые в отсутствии комплемента злокачественную клетку не убивают, но экранируют от действия других эффективных факторов защиты (феномен блокирования).
В практике наблюдают стимуляцию роста опухоли за счет действия CD3+-лимфоцитов, если одновременно блокируется функция CD19+-клеток.
Описаны ситуации, когда при возникновении опухолей молочных желез наблюдается формирование паритета между количеством злокачественных клеток и Т-киллеров, ее уничтожающих. При уменьшении массы опухоли соответственно падает и число киллерных клеток.
Лечение злокачественных опухолей включает два вида воздействий: подавление размножения клеток и стимуляцию иммунных защитных механизмов.
К стимулирующим воздействиям относят пассивную и активную иммунотерапию.
При пассивной иммунотерапии применяют сыворотки, направленные против Аг опухолей. Этот метод лечения еще не получил широкого распространения в связи с трудностями производства высокоспецифических сывороток или γ-глобулинов.
При активной иммунотерапии пациентам вводят стерилизованные злокачественные клетки или их Аг, индуцирующие формирование специфических иммунных реакций. К этому виду лечения относят и инъекции больным иммунной РНК или трансфер-фактора от иммунизированных Аг данной опухоли животных.
Значительно чаще применяют неспецифическую стимуляцию иммунной реактивности. Необходимость включения в комплексную терапию иммунокорригирующих средств определяется тем, что все основные виды лечения злокачественных новообразований (хирургический, лучевой, лекарственный) оказывают депрессивное действие на иммунную систему.
Наиболее сильным иммунодепрессантом является лучевая терапия.
В качестве неспецифических модуляторов используют вакцину БЦЖ, левамизол, продигиозан, пирогенал, зимозан, экстракты тимуса, спленин, препараты нуклеиновых кислот естественные и синтетические, фитогемагглютинин, митоген лаконоса, различные препараты интерферона, интерфероногены, взвесь плаценты, токоферол, витамин А и т.д.
Также в терапии больных применяют следующие методы лечения:
- использование моноклональных АТ против различных Аг злокачественных клеток или против индуцируемых ими белков, ферментов и других биологически активных веществ;
- применение моноклональных АТ, меченных радионуклидами. Таким образом, реализуется метод доставки радионуклидов непосредственно в клетку-мишень;
- применяются иммунотоксины, представляющие собой моноклональные АТ, конъюгированные с токсинами против злокачественных клеток. В качестве таковых используют эндотоксин псевдомонас, дифтерийный токсин, рицин, сапонин и т.д.;
- осуществляется конъюгация моноклональных АТ и противораковых препаратов, метотрексата, адриамицина, хлорамбуцила, митомицина С;
- реализуется санация костного мозга. У больных до тотального облучения отбирают клетки костного мозга, накапливают их и возвращают пациенту после процедуры. Для уничтожения возможных злокачественных клеток в аутотрансплантате его предварительно обрабатывают специфическими моноклональными АТ к этим клеткам;
- генотерапия опухолей осуществляется внесением в них тем или иным путем генов, вредящих самой раковой опухоли. В качестве векторов используют чаще вирусы - адено-, герпес-, невирусные агенты - липосомы, поликатионы, плазмиды, высокомолекулярную ДНК.
15.6. ПОСЛЕ ОПЕРАЦИЙ, ЗЛОУПОТРЕБЛЕНИЯ ТАБАКА,
АЛКОГОЛЯ
Хирургическое вмешательство обычно вызывает индукцию иммунодефицитных состояний в организме, сопровождающихся формированием гнойных осложнений. Причина состоит в том, что, во-первых, операция проводится по поводу гнойной патологии, и потому имеется риск ее распространения; во-вторых, операция - это психический и физический стресс, обусловливающий иммунодепрессию; в-третьих, операционные вмешательства при тяжелых соматических заболеваниях, затрагивающих жизненно важные органы, сопровождаются применением больным множества лекарственных средств с супрессорными свойствами (сахарный диабет, хронический гепатит, уремия).
Описанные ситуации усугубляются подавляющим действием на иммунную систему наркоза, препаратов анестезии.
После операционного вмешательства отмечается снижение содержания в периферической крови CD3+-лимфоцитов, подавление их функции, изменение выраженности синтеза ИЛ-4, ИЛ-10, ТФР, ПГЕ; тормозится функция естественных киллеров и снижается количество CD4+-клеток. Причем существенно, что при этом происходит активация второй субпопуляции CD4+-лимфоцитов при параллельном снижении активности первой субпопуляции CD4+-лимфоцитов.
Удаление периферических органов иммунной системы вызывает существенные расстройства этой системы. Так, при тонзиллэктомии наблюдается атрофия вилочковой железы, троекратное увеличение частоты хронических заболеваний носа, восьмикратное - наружных придаточных пазух, десятикратное - ОРЗ, двенадцатикратное - фарингитов. Резко снижается ревакцинирующий эффект на вирусные вакцины, на стафилококковый анатоксин. Тормозится продукция IgG и IgA, интерферона, фагоцитарная активность лейкоцитов в ротовой полости, существенно уменьшается образование лизоцима, противовирусных и противополиомиелитных АТ. У здоровых людей с удаленными миндалинами не обнаруживаются какие-либо изменения иммунного статуса, напротив, наблюдается некоторая его стимуляция.
Однако при формировании патологических процессов выраженность иммунных расстройств у таких больных оказывается существенно большей, чем у пациентов с сохраненным периферическим лимфоидным органом.
Аппендэктомия обусловливает некоторое повышение заболеваемости и увеличение тяжести течения кишечных инфекций, падение выраженности защитных факторов в кишечной трубке, нарушение колониерезистентности в толстом кишечнике, увеличение риска формирования дисбактериозов.
После спленэктомии у пациентов в крови снижается уровень IgM, нарушается механизм активации комплемента, уменьшается содержание других классов иммунных глобулинов, способность к синтезу АТ разных классов, активность естественных киллеров и реакции лимфоцитов на митогены. Страдает функция комплемента и других компонентов сыворотки, обладающих опсонизирующими свойствами. Следует, однако, отметить, что у части больных после операции по поводу удаления селезенки в брюшной полости происходит регенерация селезеночной ткани.
Не только операционные, но и любые другие травматические
повреждения оказывают депрессивное воздействие на иммунную систему, в первую очередь, вероятно, из-за стрессового влияния и связанных с ним гормональных сдвигов. Как правило, при тяжелых травмах происходит подавление Т- и В-звеньев иммунитета, функции нейтрофилов.
Учитывая это, для предоперационной подготовки и сразу после проведения операционного вмешательства рекомендуется использование иммунокорригирующих средств: тимусных препаратов, диуцифона, дапсона, нуклеината натрия, полисахаридных препаратов, миелопида, малых иммунокорректоров.
Риском развития иммунных нарушений после операций являются: - наличие тяжелых сопутствующих заболеваний: НВЗЛ, особенно астмы, ишемической болезни сердца, кардиосклероза, ревмокардита, эндокринных (сахарный диабет, ХАИТ), болезней мочевыводящей системы, ревматизма (острая ревматическая лихорадка), язвенной болезни, панкреатита, гастрита, поражения печени, колита, опухоли;
- любые хронические заболевания с длительным приемом медикаментов, особенно антибиотиков, кортикостероидов, цитостатиков, психотропных средств;
- наличие у больных А(II) или АВ(IV) групп крови с увеличением риска иммунодефицитов соответственно в 3 и 2 раза;
- наличие в анамнезе частых инфекционных (в том числе «дремлющих») заболеваний;
- наличие в анамнезе операционных вмешательств, особенно по поводу аппендицита, гинекологических поражений, гнойных инфекций мягких тканей, желчнокаменной болезни.
Возраст: благоприятный 17-40 лет; увеличение на 12% у пациентов 41-60 лет, на 29-40% - старше 60 лет.
Срочность/экстренность проведения операции увеличивает риск ИД в 2,3-3 раза.
Длительность госпитализации провоцирует риск иммунодефицита, оптимально желательно находиться в стационаре 3-5 дней.
У курящих пациентов зарегистрировано (в сравнении с людьми не употребляющими табак) увеличение абсолютного и относительного содержания Т-лимфоцитов, особенно γ-лимфоцитов, являющихся, как известно, популяцией с супрессорными свойствами.
Поглотительная активность фагоцитов была стимулирована только у пожилых людей (50-64 лет) с длительным стажем наличия вредной привычки. Клеточно-опосредованная реактивность (в тестах
РТМЛ и РППЛ) изменялась меньше, но при сильном воздействии вредного фактора понижалась.
При длительном употреблении алкоголя достоверно возрастает содержание общего количества лейкоцитов, CD3+-лимфоцитов, особенно у мужчин, CD8+-клеток, наделенных супрессорными свойствами.
РБТЛ значимо не меняется, при больших дозировках принимаемого алкоголя подавляется поглотительная способность фагоцитов. Концентрация IgG возрастает.
В целом следует признать, что изменения составляющих иммунной реактивности под действием указанных факторов у женщин выражены меньше. По-видимому, это связано с меньшей частотой курения и приема алкоголя.
Общая стимуляция Т-звена иммунитета обусловлена преимущественной активацией Т-супрессорного звена иммунитета, что расценивается как эндогенный фактор онкологического риска и других заболеваний.
В настоящее время сложилось представление, что в патогенезе хронического алкоголизма существенную роль играют нарушения, возникающие в организме в результате включения экзогенного алкоголя и продуктов его метаболизма в обменные процессы. Эти нарушения имеют место в различных физиологических системах организма, в том числе и иммунной. Общим считается признание, что при хроническом алкоголизме формируется вторичный иммунодефицит по Т-зависимому типу, в основе которого лежит индуцированное алкоголем повреждение печени (алкогольный гепатит и алкогольный цирроз). Однако эта точка зрения является односторонней, не учитывает особенности изменений других звеньев иммунитета и характер злоупотребления алкоголем.
По данному разделу можно сделать общее заключение:
- хронический алкоголизм, протекающий без лабораторно-клинических признаков патологии печени, характеризуется увеличением уровня CD19+-лимфоцитов и падением концентрации CD3+-клеток;
- рост количества CD19+-лимфоцитов в крови наиболее выражен у больных со сравнительно небольшой длительностью заболевания и с несистематическим характером потребления алкоголя;
- снижение количества CD3+-лимфоцитов в крови отмечается у пациентов в периоде ремиссии. Алкогольный абстинентный
синдром сопровождается увеличением содержания CD3+-лимфоцитов в сравнении с показателями в постабстинентном периоде и в ремиссии. Это отражает степень сохранности адаптационных возможностей организма при хроническом алкоголизме;
- более высокие показатели CD3+-клеток соответствуют клиническим проявлениям высокой толерантности к алкоголю, что необходимо учитывать при оценке иммунного статуса больных;
- в популяции лимфоцитов периферической крови больных алкоголизмом в большей степени, чем в норме, представлены CD3+-клетки, обладающие аномальными свойствами, их способность к спонтанному розеткообразованию (тест на функциональную активность мембранных рецепторов) слабо ингибируется трипсином, не изменяется под влиянием гистамина;
- длительная интоксикация этанолом угнетает первичный иммунный ответ на тимусзависимые Аг;
- установлена связь (в условиях острой и хронической алкогольной интоксикации) между количеством Т- и В-лимфоцитов и уровнем активности алкогольдегидрогеназы и λ-сукцинатдегидрогеназы печени. Увеличение количества CD3+- и CD19+- лимфоцитов отмечается при повышенной активности алкогольдегидрогеназы и λ-сукцинатдегидрогеназы;
- уменьшение содержания основных популяций лимфоидных клеток - при падении активности этих ферментов. Предполагается прямое действие этанола на рецепторы лимфоцитов;
- нарушения происходят и в фагоцитарном звене иммунитета. По мере увеличения продолжительности алкоголизации у пациентов происходило уменьшения уровня моноцитов, подавление их функциональной активности, что совпадало с падением содержания в сыворотке крови лизоцима и комплемента;
- в основе типовых изменений иммунной системы при хроническом алкоголизме - угнетение Т- и «раздражение» В-зависимых иммунных реакций - лежит нарушение регулирующей функции CD8+-клеток, повреждение рецепторного аппарата макрофагов и эпителия желудочно-кишечного тракта, что сопровождается усиленным проникновением во внутреннюю среду организма кишечных токсинов, пищевых аллергенов и других факторов, «раздражающих» В-звено иммунитета. В итоге гуморальный иммунитет становится неуправляемым, что прояв-
ляется в избытке образования иммунных глобулинов разных классов. К этому следует добавить, что при снижении детоксицирующей функции печени разрушение иммунных белков замедляется. Это также способствует их накоплению в сыворотке крови, развивается прямое токсическое действие этанола на метаболизм различных клеток. В ряде случаев эффект спирта опосредуется через нейромедиаторы дофаминергических структур, нейрогормоны и циклические нуклеотиды. Представленная информация обосновывает назначение лицам, страдающим хроническим алкоголизмом, модуляторов (стимуляторов) Т-звена иммунитета, а также использование анаболических гормонов, аминокислот (ретаболила, L-аспарагиновой и глютаминовой кислот).
15.7. ПОСЛЕ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ПАТОЛОГИИ МОЧЕПОЛОВОЙ СФЕРЫ *
У больных доброкачественной гиперплазией предстательной железы в сочетании с хроническим простатитом уже через сутки после трансуретральной электрорезекции или открытой простатэктомии имеет место угнетение клеточного (снижение содержания в крови CD4+, CD16+, CD25+-лимфоцитов) и гуморального звеньев иммунитета (снижение концентрации в плазме крови IgM и IgG), функции фагоцитов. Это происходит при повышении концентрации провоспалительных цитокинов (ФНО-α и ИЛ-1β) и активации процессов перекисного окисления липидов, что свидетельствует о дальнейшем углублении формирования вторичного иммунодефицитного состояния и является причиной гнойно-воспалительных осложнений, включая развитие пиелонефрита.
У женщин с обострением хронического сальпингоофорита (ХСО) до оперативного вмешательства имеет место повышение концентрации в плазме крови и вагинально-цервикальном секрете цитокинов как провоспалительной (ФНО-α, ИЛ-1β, ИЛ-6, гранулоцитарный колониестимулирующий фактор), так и противовоспалительной активности (ИЛ-4 и ИЛ-10), активация системы комплемента, угнетение фагоцитарной и повышение кислородзависимой активности фагоцитов. Помимо операционной травмы в патогенезе иммунологических расстройств, наблюдаемых после оперативных вмешательств, важную роль играет анестезиологическое пособие, причем большинство применяемых анестетиков в той или иной мере изменяют
А.И. Конопля, А.А. Конопля, В.П. Гаврилюк
гомеостаз и оказывают иммунодепрессивное воздействие на организм больного, проявляющееся уже спустя 15 мин после индукции в наркоз и сохраняющееся приблизительно 7 сут. Наибольшее негативное влияние на иммунный статус пациентов оказывают опиоиды-агонисты, фторотан и другие галогенизированные эфиры, кетамин и барбитураты ультракороткого действия.
У большинства больных с патологией мочеполовой сферы, прооперированных в стадии ремиссии, уже через 1 ч после начала общей анестезии в крови наблюдается повышение индексов интоксикации, содержания сегментоядерных нейтрофилов, моноцитоз, эозинопения, снижение показателей клеточного звена иммунитета, количества В-лимфоцитов, повышение уровня естественных киллеров, показателей фагоцитарной и кислородзависимой активности нейтрофилов периферической крови.
При этом к прямому действию патогенного агента на иммунокомпетентные клетки присоединяется иммуносупрессорное влияние метаболитов с соответствующей направленностью действия. Эта ситуация диктует целесообразность в интра- и послеоперационном периоде дополнительных способов и средств иммунокоррекции.
Патогенетическая коррекция иммунологических расстройств при оперативных вмешательствах при патологии мочеполовой сферы может быть достигнута использованием фармакологических, нефармакологических методов коррекции, чаще их сочетанием. К первому способу можно отнести использование иммуномодуляторов преимущественно прямого действия на иммунокомпетентные клетки (полиоксидоний, деринат, имунофан и др.) и препаратов, корригирующих метаболические процессы в клетках и препятствующих накоплению в крови иммуносупрессирующих соединений. К последним относятся антиоксиданты (коэнзим Q10, кудесан, гипоксен, β-картин, витамины Е и А, мексикор и др.), препараты, регулирующие энергетический обмен (тиамин, рибоксин, милдронат, элькар, берлитион, мексидол и др.) и восстанавливающие поврежденный фосфолипидный каркас клеток (эссенциале, липостабил и др.). Ко второму способу (нефармакологические методы, применяющиеся в доили послеоперационном периоде) относятся физиотерапевтические методы воздействия, такие как лазерное облучение, ультразвуковое, ультрафиолетовое и магнитно-инфракрасно-лазерное воздействие (МИЛ), обладающие как способностью к коррекции внутриклеточного метаболизма, так и иммуномодулирующими свойствами.
Включение комбинированной методики магнито-инфракрасно-лазерной терапии в традиционное лечение больных ДГПЖ с хроническим про-
статитом приводит к коррекции некоторых показателей иммунного и антиоксидантного статусов, а использование, помимо МИЛ-терапии, комплекса водорастворимых витаминов (эспалипона, тиамина хлорид, рибофлавина моноаденозинфосфат, никотинамида) в послеоперационном периоде нормализует большинство нарушенных параметров различных звеньев иммунного статуса и процессов перекисного окисления липидов.
Добавление к хирургической лапароскопической коррекции у больных хроническим сальпингоофоритом по типу сальпингита с перифокальным спаечным процессом в стадии ремиссии ридостина с эспалипоном или дерината с токоферолом приводит к коррекции, а у больных ХСО с мелкокистозной дегенерацией яичников - к нормализации в крови содержания цитокинов, иммунофенотипированных лимфоцитов, фагоцитарной и кислородзависимой активности нейтрофилов.
Применение вобэнзима и мексикора у больных хроническим сальпингоофоритом в стадии обострения после традиционной фармакотерапии и комплексного миниинвазивного хирургического лечения позволяет нормализовать в крови и в вагинально-цервикальном секрете концентрацию продуктов перекисного окисления липидов, концентрацию в крови ИЛ-10, ИЛ-4 и корригировать активность каталазы, тогда как инъекции глутоксима или имунофана в сочетании с мексикором нормализуют Т-клеточное звено иммунитета, корригируют и приводят к норме концентрацию как про-, так и противовоспалительных цитокинов и на системном, и на местном уровнях, корригируют функционально-метаболическую активность нейтрофилов и концентрацию продуктов перекисного окисления в вагинально-цервикальном секрете.
Использование полиоксидония и цигапана у больных осложненными формами ХСО нормализует в послеоперационном периоде представительность субпопуляций лимфоцитов, концентрацию в плазме крови провоспалительных цитокинов (ИЛ-1β, ИЛ-6, ИЛ-8) и С4-компонента системы комплемента. Инфузии рефортана дополнительно к традиционной терапии у больных ХСО, осложненного пиосальпинксом, пельвиоперитонитом, после открытого оперативного лечения нормализуют количество CD4+-, CD16+- лимфоцитов, клеток-маркеров ранней активации и клеток-индукторов фактора апоптоза, повышают количество цитотоксических лимфоцитов, снижает почти до уровня нормы концентрацию провоспалительных цитокинов (ФНО-α, ΙΜ-1β, ИЛ-6 и ИЛ-8) и компонентов системы комплемента.