Клиническая иммунология : учебник / под ред. А.М. Земскова. - 2008. - 432 с.
|
|
|
|
ГЛАВА 10. ИНФЕКЦИОННАЯ ИММУНОЛОГИЯ
10.1. ИНТЕГРАЛЬНОСТЬ ИММУННЫХ РЕАКЦИЙ
Одной из основных функций иммунной системы является распознавание и уничтожение тел и веществ, несущих признаки чужеродной генетической информации, включая возбудителей инфекционных болезней (Р.В. Петров, 1987). При формировании антиинфекционной резистентности в организме развиваются специфические и неспецифические механизмы. Их взаимодействие подвержено определенной временной последовательности и характеризуется синергизмом взаимного усиления.
Неспецифические механизмы
Первым барьером на пути проникновения возбудителя болезни в организм хозяина является кожа и слизистая. Слущивание ороговевшего эпителия, присутствие на коже жирных кислот, выделения сальных желез, функция мерцательного эпителия слизистых, наличие лизоцима, ингибиторов размножения бактерий и вирусов в секретах обусловливают уничтожение возбудителей. Однако главным механизмом защиты является фагоцитоз. При этом не все захваченные клетки погибают, например микобактерии, бруцеллы, сальмонеллы, листерии могут только сохраняться в фагоцитах, но и в ряде случаев размножаются. Некоторые бактерии (капсульные формы пневмококков) вообще почти не фагоцитируются.
Клеточные механизмы невосприимчивости сочетаются с гуморальными факторами. Это - лизоцим, интерферон, альтернативный путь активации комплемента. Последняя реакция обусловлена бактериями, вирусами, грибами, эндотоксинами, она развивается непосредственно при внедрении инфекционного агента.
Специфические механизмы
Поскольку микроорганизмы обладают разнообразными антигенными детерминантами, то в организме, спустя определенный период времени, развивается поликлональный иммунный ответ. При этом входные ворота инфекции и особенности возбудителя определяют, какая форма иммунной реактивности - клеточная или гуморальная - будет реализована.
Продолжительность иммунной защиты может быть пожизненной (корь, коклюш) или ограниченной (грипп). В обоих случаях
ответственными за это являются долгоживущие клетки иммунологической памяти.
Внедрение в организм возбудителей, размножающихся внеклеточно, как правило, индуцирует гуморальный иммунитет. Инфекции, вызванные патогенами, способными размножаться внутриклеточно, - клеточный.
Большинство возбудителей бактериальных инфекций, размножающиеся внеклеточно, обусловливают образование специфических антител, которые связываются с поверхностью бактерий и в присутствии комплемента вызывают цитотоксические реакции (бактериолиз). Кроме того, нагруженные АТ или комплементом бактерии легко подвержены фагоцитозу (опсонизация).
В тех случаях, когда патогномоничные возбудители образуют экзотоксины (столбняк, дифтерия), антитоксины легко нейтрализуют токсические вещества, однако при первичной инфекции они могут синтезироваться слишком поздно и не в состоянии защитить организм.
Клеточный иммунитет имеет особое значение в тех случаях, когда реакции фагоцитоза оказываются несостоятельными, вследствие чего возникает персистенция патогенных бактерий, формируется скопление лимфоидных клеток и макрофагов (гранулема). Иногда это приводит к неспецифической стимуляции макрофагов, что обусловливает повышение резистентности к другим инфекциям. Например, при высоком уровне клеточного иммунитета против туберкулеза повышается устойчивость к грибам, простейшим, бруцеллам, листериям.
Вирусные инфекции, распространяющиеся гематогенно (полиомиелит, корь, эпидемический паротит, ветряная оспа), могут элиминироваться гуморальными механизмами, причем данное заболевание, как правило, характеризуется длительным инкубационным периодом.
В то же время возбудители, размножающиеся прямо в месте внесения (грипп), имеют короткий инкубационный период, что может быть опасно из-за определенной инерционности развития иммунных реакций, тяжелым течением заболевания. Поскольку вирусы являются внутриклеточными паразитами, основную функцию защиты от них выполняют клеточные реакции. Доказательством этого является частое образование у пациентов ГЗТ.
При грибковых, протозойных инфекциях и глистной инвазии формируется преимущественно клеточный иммунитет, что тести-
рует ся положительной внутрикожной пробой с соответствующим Аг. Для возбудителей протозойных инфекций характерно чрезвычайное разнообразие антигенного состава. К тому же большинство этих возбудителей имеют довольно сложный механизм жизненного цикла, что еще более затрудняет иммунную защиту. К этому следует добавить то обстоятельство, что сами возбудители наделены иммуносупрессорным действием, а также то, что при данных патологических процессах реализуется выраженный поликлональный митогенный эффект, истощающий защитные возможности иммунной системы, не формируя резистентности.
Глистные инвазии (аскаридоз, трихинеллез) способствуют стимуляции синтеза IgE. На месте внедрения возбудителя образуется инфильтрат, состоящий из эозинофилов, базофилов и тучных клеток. В некоторых случаях паразитическим червям удается избежать распознавания благодаря слою перекрестно-реагирующих Аг с организмом хозяина.
Индукция специфических иммунных реакций при инфекциях может быть причиной формирования иммунопатологических состояний (аллергические, аутоиммунные реакции и иммунологическая недостаточность).
Так, при внезапном высвобождении больших количеств Аг в результате гибели микроорганизмов в сенсибилизированном органиме образуются иммунные комплексы, вызывающие аутоиммунные гломерулонефриты. Это осложняет течение стрептококковых, пневмококковых и стафилококковых инфекций. Токсические иммунные комплексы могут образовываться и при персистирующих вирусных инфекциях. Особенно четко это проявляется при остром вирусном гепатите А, когда гибель гепатоцитов проявляется типичными клиническими симптомами, совпадающими с началом иммунного ответа. Появление АТ в избытке Аг приводит к образованию токсических иммунных комплексов, а возникновение иммунных комплексов в избытке АТ при разрушении инфицированных клеток приводит к элиминации возбудителя.
Большинство глистных инвазий сопровождается аллергическими реакциями, чаще иммунокомплексными (III тип) или клеточными (IV тип). Встречаются такие атопические реакции (I тип) при аскаридозе, крапивнице и бронхиальной астме.
Аутоиммунные реакции часто сопровождают инфекционные заболевания. Классическим примером их являются поражения суставов и
эндокарда при острой ревматической лихорадке, вызываемой, как известно, β-гемолитическим стрептококком. В их реализации принимают участие несколько механизмов: модификация собственных Аг возбудителями или их токсинами, наличие перекрестно-реагирующих Аг между хозяином и микроорганизмом, интеграция вирусной нуклеиновой кислоты в геном хозяина, модификация Iа белков клетки-мишени белковыми структурами вирусов, внедрившихся в нее, и т.д.
Иммунологическая недостаточность, особенно по Т-звену, практически всегда сопровождает бактериальные, вирусные, грибковые и паразитарные заболевания. Эти состояния могут быть преходящими или вызывать серьезную патологию, проявляться немедленно или отсроченно, когда инфекция давно перенесена, сопровождаться пестрой клинической картиной (частые ОРЗ, грипп) или протекать бессимптомно, выражаясь в хронизации инфекционных патологических процессов. При острых, особенно вирусных, инфекциях возможно катастрофическое ослабление иммунной реактивности, при хронических (малярия) происходит более замедленное функциональное истощение иммунной системы.
10.2. ОСОБЕННОСТИ ТЕЧЕНИЯ ИНФЕКЦИЙ НА СОВРЕМЕННОМ ЭТАПЕ
В конце XX века значительно снизилась частота острозаразных заболеваний, уносящих в прошлом сотни тысяч жизней, - оспа, чума. Сейчас на первое место выходят вирусные, в том числе медленные инфекции, а также патологические процессы, индуцированные внутриклеточными паразитами, - хламидиями, лестереллами, микоплазмами и др.
Многие соматические заболевания, как оказалось, имеют в своей основе инфекционный компонент.
Рак шейки матки - вирус герпеса, папиловирус; лимфома Беркитта, назофарингеальная карцинома - вирус Эпштейна-Барр, первичный рак печени - вирусный гепатит В, С; клеточная лимфосаркома - лимфотропные вирусы ВVI и ВII, язвенная болезнь желудка, язвенная болезнь 12-перстной кишки - хеликобактер; болезнь Крона - иерсинии энтероколитика, ревмокардит - вирусы Коксаки А13, А18, В1, В2, ВЗ, стрептококк; ишемическая болезнь сердца - возможно, хламидии.
Механизмы указанного феномена реализуются на уровне микро- и макроорганизмов.
На уровне микроорганизмов:
- наличие L-форм;
- преобладание условно- и низкопатогенной флоры;
- микст-инфицирование;
- антибиотикорезистентность;
- мутабельность;
- наличие системных и локальных дисбиозов;
- изменение ферментного спектра возбудителей. Указанные причины затрудняют диагностику инфекций. На уровне макроорганизма:
- аутоинфицирование;
- стертость клинической картины;
- хронизация, рецидивы, вторичные осложнения;
- бессимптомное носительство;
- персистирующее течение;
- иммунологические расстройства - иммунодефицитные состояния, аллергия, аутоиммунные осложнения.
Данные механизмы отягощают течение и усложняют лечение заболеваний. Причины:
1. Эволюционная неподготовленность человека к НТР (создание новых экологических факторов - радиоактивный фон, химическое загрязнение, накопление СО2 и др.).
2. Снижение качества жизни населения (низкая рождаемость, неполноценное потомство, хронические заболевания, наркомания, алкоголизм и пр.).
3. Неполноценное питание (генно-инженерные продукты, снижение санитарно-гигиенических норм, голодающие, авитаминозы).
4. Постарение населения (двукратное увеличение числа пожилых лиц с необходимостью частого лечения, диагностикой, злокачественными новообразованиями, возрастными изменениями иммунной системы).
5. Скученность больных. В Российской Федерации З млн З00 тысяч коек размещено на суммарной площади - 15-16 км2, где в течение 1,2 млрд дней находится 64 млн больных и 6 млн медработников (см. гл. 1.1.1).
6. Усиление миграционных процессов (беженцы, сокстуризм - быстрое распространение возбудителей из эндемических очагов).
7. Диагностическая, лечебная агрессия. Имеется более З000 видов
различных вмешательств (катетеризация, бронхо-, гастроскопия, АИК, наркозные аппараты и пр.), которые приводят к нарушению механических барьеров, изменяют биоценоз кожи и слизистых, контаминируют антибиотикорези-стентными штаммами. Например, внутренний контур наркозных аппаратов практически не дезинфицируется. Одним из возможных решений проблемы является использование для профилактики и лечения биологически активных препаратов.
10.3. МЕТОДЫ АКТИВНОЙ И ПАССИВНОЙ ИММУНОПРОФИЛАКТИКИ
Классификация биологических активных препаратов (БАП).
1. Вакцины, анатоксины, бактериофаги, эубиотики микробного происхождения.
2. Препараты на основе АТ - иммунные глобулины, сыворотки, моноклональные антитела, абзиты-стимуляторы биохимических процессов, иммунотоксины - АТ к рецепторам, фрагментам клеток.
3. Иммуномодуляторы.
4. Адаптогены.
5. Диагностические препараты.
Вакцины - средства для индукции активного иммунитета, см.
рис. 18, 19.
Виды вакцин:
- аттенуированные (ослабленные живые);
- из близкородственных штаммов (вирус коровьей оспы);
- рекомбинантные (векторные);
- убитые корпускулярные/молекулярные;
- комбинированные;
- молекулярно-генноинженерные (вакцина противооспенная и ВИЧ);
- генноинженерные мономолекулярные полиантигенные из химерных молекул белка с несколькими антигенными группировками;
- непарантеральные, неинъекционные, вводимые через желудочно-кишечный тракт, дыхательную систему, конъюнктивально;
- идиотип-антиидиотип вакцины;
- анатоксины - нейтрализованные формалином экзотоксины бактерий.
Иммунитет после вакцинации формируется через 14-45 сут. Многие препараты требуют повторного введения или ревакцинации.
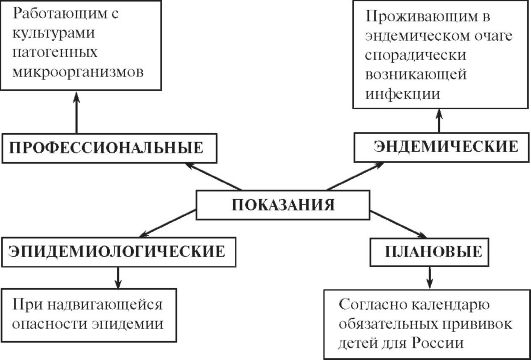 Рис. 18. Показания к использованию вакцин с профилактической целью
Рис. 18. Показания к использованию вакцин с профилактической целью
Эффективность иммунизации составляет от 45-50% (холера) до 80% (дифтерия), 100% (туляремия, оспа) и продолжается от нескольких недель до нескольких месяцев и лет. Введение вакцин/анатоксинов сопровождается развитием поствакцинальных реакций и осложнений. Существуют синдромы общих и местных реакций, аллергизация, аутоиммунные поражения.
Сывороточные препараты используются для специфического лечения, экстренной, пассивной иммунопрофилактики, устранения некоторых форм иммунодефицитов.
Классификация.
1. Антитоксические сыворотки получают после иммунизации крупных животных (противодифтерийная, противостолбнячная, противогангренозная, поливалентные противоботулинические и
др.).
2. Антибактериальные и антивирусные сыворотки получают гипериммуниза-цией животных убитыми бактериями или Аг (противосибиреязвенная, антирабическая и т.д.). При концентрации и очистке получаются гамма-глобулины.
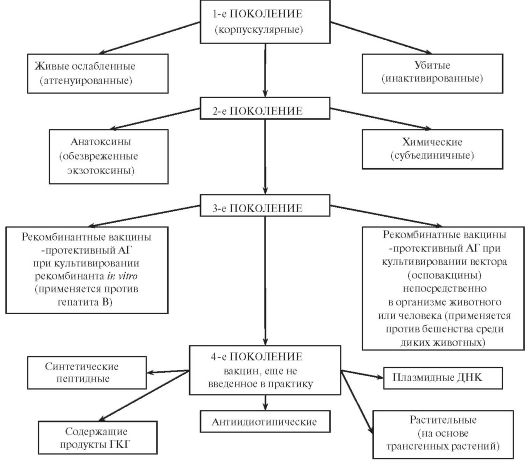 Рис. 19. Различные поколения вакцин
Рис. 19. Различные поколения вакцин
3. Гомологичные глобулины получают из крови людей. Существуют препараты направленного действия из крови добровольцев, привитых различными препаратами (против столбняка, стафилококковых инфекций и пр.).
4. К сывороточным препаратам относится также плазма. Реализация эффекта достигается при внутривенном введении
через несколько минут, внутримышечно - через несколько часов. Продолжительность действия для гомологичных препаратов составляет 21-22 дня, гетерологичных - 10-12 сут.
При использовании сывороточных препаратов возможны следующие осложнения.
1. Полностью не исключен перенос «шприцевых» инфекций (малярия, гепатит В, С).
2. Возможна индукция аллергических реакций вплоть до анафилактического шока, сывороточной болезни.
3. Описано формирование эндокринных нарушений при введении больших доз плацентарного гамма-глобулина мальчикам в возрасте до трех лет.
4. Установлен феномен невынашивания у женщин, получивших в младенчестве, до трех лет, большие дозы сывороточных препаратов.
5. Реальна ситуация торможения антителообразования и снижения напряженности вакцинального иммунитета при иммунизациях на фоне введения сывороточных препаратов.
6. Запрещается вливание гамма-глобулинов соответствующих классов людям с полным отсутствием продукции каких-либо классов иммунных глобулинов.
7. Традиционно применяемая схема пассивной иммунотерапии - дробно с интервалом 1-5 дней нежелательна, поскольку возможна индукция антителообразования против препарата с нейтрализацией его эффекта. Предпочтительно вливание больших доз препаратов, но ограниченное число раз.
8. Следует учитывать, что в любом гамма-глобулине находится до 180-250 различных видов АТ, против множества Аг. Поэтому при развитии конкретной инфекции при отсутствии профильного гаммаглобулина можно вливать любой, имеющийся в наличии сывороточный препарат (М.В. Земсков, 1968).
9. Более рациональным представляется инъекция гамма-глобулинов в остром периоде инфекционного заболевания, а не в стадии ремиссии или выздоровления.
10.4. ПРИНЦИПЫ ИММУНОТЕРАПИИ
Иммунотерапия инфекций подразумевает использование в лечении хронических, плохо поддающихся традиционной терапии заболеваний, вакцин, анатоксинов и γ-глобулинов - т.е. этиотропных средств и патогенетического лечения введением крови, кровезаменителей, плазмы, неспецифических стимуляторов иммунитета.
Ряд препаратов одновременно обладает антимикробным и иммуностимулирующим действием (специфические γ-глобулины, экстракты растений). В настоящее время в связи с изменением характера течения инфекционных заболеваний, широким применением в
клинике средств, подавляющих иммунные реакции (кортикостероиды, антибиотики широкого спектра действия), увеличением аллергизации необходимо предельно быстрое освобождение организма от инфекционного агента и восстановление его нарушенного гомеостаза.
По происхождению иммунотерапевтические средства разделяют на 4 группы:
- получаемые из крови и различных органов человека и животных (плазма, γ-глобулины, тимусные препараты, миелопептиды, интерфероны, спленин, экстракт плаценты, антилимфоцитарная сыворотка и др.);
- получаемые из растений (настойки элеутерококка, китайского лимонника, имании и др.);
- стимуляторы микробного происхождения (пирогенал, продигиозан, зимозан, нуклеинат натрия, бификол, бактериофаги и др.);
- синтетические препараты (левамизол, пентоксил, метилурацил, гемодез, диуцифон и др.).
По характеру иммунотерапевтического действия иммунопрепараты разделяют на средства со специфическим (направленным) действием - вакцины, анатоксины, иммунные сыворотки, γ-глобулины, и неспецифические стимуляторы резистентности организма (кровь, плазма, бификол и др.). Показаниями для назначения иммуностимуляторов являются: вялое течение инфекционного процесса; резкое продолжительное угнетение данных неспецифической антиинфекционной резистентности больного, характера и выраженности патологических изменений, опасность развития вторичной инфекции, применение с лечебной целью препаратов с иммуносупрессорными свойствами.
Иммунотерапию назначают в комплексе с другими лекарственными средствами (антибиотики: сульфаниламиды, кортикостероиды). Ее эффективность зависит от правильной оценки исходного состояния иммунореактивности больного, характера и выраженности патологических изменений, выбора оптимального препарата и схемы его применения. Необходимо также иметь представление о механизмах действия назначаемых средств, их побочных эффектах, совместимости с другими методами лечения инфекций, аллергизирующих свойствах и т.д.
Иногда вакцинотерапия, назначаемая при иммунологической толерантности к данному Аг, может не дать положительного кли-
нич е с кого эффекта и даже усугубить состояние иммунодепрессии, возможен риск развития анафилактического шока, индукция аутоиммунных заболеваний. Известны случаи тяжелых осложнений после введения с лечебной целью, когда происходил массовый распад микробных клеток и формировался токсический шок.
Переливание крови и плазмы является хорошим средством стимуляции реактивности больного. Однако данный метод лечения ограничен стойкими показаниями и должен проводиться под контролем его влияния на течение заболевания, показатели иммунитета и аллергий.
Препараты этиотропного (иммунные сыворотки, γ-глобулины, бактериофаги, интерферон) и дезинтоксикационного (кровь, плазма, кровезаменители) действия следует назначать как можно раньше от начала заболевания. Ряд неспецифических стимуляторов применяют в разгаре заболевания и в периоде реконвалесценции (пентоксил, витамины, метилурацил) или для лечения осложнений (феррокаль, фитин, левамизол). Вакцины с лечебной целью вводят больным с затяжными и хроническими формами заболеваний. Применение полисахаридных препаратов противо-показано при лихорадочных состояниях. Эубиотики не назначают одновременно с антибиотиками и другими препаратами этого рода.
10.5. ПРИНЦИПЫ ИММУНОДИАГНОСТИКИ
Многие инфекционные заболевания сегодня претерпели изменения, что выражается в увеличении удельного веса легких, стертых, бессимптомных форм (дизентерия, скарлатина, коклюш, дифтерия, холера), аллергического компонента, высокой частоте микст-инфекций. Все это затрудняет традиционную диагностику заболеваний, поэтому значимость иммунодиагностики возрастает. Она базируется на выявлении Аг возбудителя или специфических иммунных (аллергических) сдвигов в организме больного.
Методы, основанные на обнаружении Аг в сыворотке крови, секретах, выделениях или пораженных органах
(указанными методами пользуются для ранней диагностики инфекционных заболеваний).
Реакция иммунофлюоресценции (РИФ) основана на соединения Аг бактерий, риккетсий или вирусов со специфическими АТ, меченными соответствующими красителями (изотиоцианатом флуоресцеина). Метод используется для экспрессной диагностики гриппа,
других респираторных заболеваний, микоплазменной инфекции, дизентерии, брюшного тифа, сальмонеллеза, бруцеллеза, малярии, чумы, геморрагического нефрозо-нефрита, туляремии, сифилиса, токсоплазмоза, бешенства.
Реакция непрямой гемагглютинации (РНГА) используется для раннего обнаружения Аг в организме больного и объектах внешней среды при дизентерии, брюшном тифе, сальмонеллезах, колиэнтеритах, холере, чуме, сибирской язве, ботулизме.
Реакция гемагглютинации (РГА) и реакция торможения гемагглютинации (РТГА) применяются для экспрессной идентификации вирусных инфекций (гриппа, парагриппа, эпидемического паротита, полиомиелита, аденовирусов, вирусных энцефалитов и др.).
Реакция нейтрализации Аг (РНА) используется для обнаружения бактериальных экзотоксинов (клостридий, коринебактерий, стафилококков и др.), а также вирусов. Она применяется для диагностики кори, паротита, краснухи, вирусных энцефалитов, денге, омской и геморрагической лихорадок. Позитивные результаты данная реакция дает через несколько сут - 2-3 нед от начала заболевания.
Реакция преципитации (РП) может осуществляться в жидкой фазе, агаровом геле (простая одномерная диффузия) и в виде двумерной диффузии, радиальной диффузии, электрофореза и т.д. Является точным методом диагностики менингококковой инфекции, трипаносомоза, полиомиелита, сибирской язвы, малярии, вирусного гепатита В. Ее также можно применять для идентификации возбудителей брюшного тифа, дизентерии, клостридиозов, бруцеллеза, стрептококкозов и токсинов бацилл столбняка, газовой гангрены.
Радиоиммунный - является одним из наиболее чувствительных методов иммунодиагностики. Его применяют для выявления Аг гепатита В у больных. Для этого к исследуемой сыворотке добавляют референс-сыворотку, содержащую АТ к вирусу гепатита В. Смесь инкубируют 1-2 дня, затем добавляют к ней референс-антиген, меченный I125+ и продолжают инкубацию еще 24 ч. К образовавшемуся растворимому комплексу Аг - АТ добавляют преципитирующие антииммуноглобулины против референс-сыворотки, что приводит к образованию преципитата. Результат реакции учитывают по наличию и числу импульсов в преципитате, зарегистрированных счетчиком.
При наличии в исследуемой сыворотке антигена, связывающегося со специфическими АТ, последние не поступают в связь с меченым
Аг, и поэтому он не обнаруживается в преципитате. Радиоиммунный метод позволяет выявить Аг вируса гепатита В и других возбудителей в ранний срок заболевания у 60-80% больных.
Иммуноферментный анализ достаточно чувствителен и прост. Реакцию обычно ставят в пластиковых планшетах, к стенкам лунок которых фиксируют АТ к искомому Аг. Далее в лунку вносится исследуемый объект, содержащий искомый Аг. Последний соединяется с АТ, образуя комплекс Аг - АТ. Исследуемый субстрат удаляют и вместо него вносят АТ, меченные каким-либо ферментом, например, пероксидазой хрена. Указанные АТ присоединяются к комплексу Аг - АТ и также фиксируются к стенке лунки. Далее в систему вносят вещество, дающее цветную реакцию в присутствии пероксидазы хрена. По интенсивности окрашивания оценивается реакция. Данный метод применяется для диагностики различных инфекций, например СПИДа.
Методы, основанные на обнаружении антител
Обнаружение АТ представляет собой метод более позднего его образования обычно в периоде реконвалесценции или в отдаленный период после перенесенного заболевания. Известно, что у больных могут содержаться в крови АТ, приобретенные в результате перенесенного ранее заболевания или вакцинации. Они могут «маскировать» иммунный ответ на конкретную инфекцию, а иногда существенно влиять на его активность и напряженность. Известно, что малое количество АТ стимулирует синтез гомологичных иммуноглобулинов в инфицированном или вакцинированном организме, а большое - угнетает этот синтез.
Значит диагностическое значение имеет не столько факт обнаружения АТ, сколько определенная величина их титра, характерная для той или иной инфекции.
Еще более показательно четырехкратное увеличение титра АТ в динамике заболевания. Однако для этого необходимо повторное исследование с интервалом в 7-14 дней, что несколько задерживает постановку диагноза, а при острых инфекциях с непродолжительным течением (грипп, корь, дизентерия) исключает возможность его подтверждения в разгаре заболевания.
Необходимо также учитывать, что серологические реакции отличаются неабсолютной специфичностью ввиду наличия общих Аг или отдельных детерминант специфичности возбудителей, относящихся к одному или даже разным видам.
В ряде случаев это может привести к заблуждению, например, при постановке РСК или РТГА с гриппозными Аг сероконверсии иногда более выражена к вирусу, с которым организм сталкивался ранее, чем к вирусу, вызвавшему заболевание в данный момент.
Диагностическую ценность серологических исследований может повысить дифференцированное определение АТ, относящихся к разным классам иммунных глобулинов (IgM и IgG). IgM образуются в более ранние периоды заболевания, поэтому могут служить показателем недавнего инфицирования. В последующем они сменяются АТ, принадлежащими к IgG. IgM свойственна термостабильность (они разрушаются при температуре 62°С), способность расщепляться под действием меркаптоэтанола, что позволяет дифференцировать их от IgG.
Понятно, что специфичность серологических тестов зависит также от качества применяемых диагностикумов: правильности получения, обработки и хранения исследуемых сывороток, техники выполнения реакций. Например, при постановке реакции связывания комплемента (РСК) непригодны гемолизированные сыворотки.
При постановке РНГА с сенсибилизированными эритроцитами барана необходимо освободить исследуемые сыворотки от агглютининов к этим эритроцитам.
Непригодны для исследования сыворотки, имеющие признаки бактериального загрязнения, с посторонними примесями, многократно замороженные и оттаиваемые, хранящиеся при комнатной температуре.
АТ в сыворотке крови больного выявляются с помощью тех же серологических реакций, которые применяются для обнаружения Аг. Различия заключаются в том, что для определения АТ используют стандартные антиген-диагностики, которыми могут служить живые или инактивированные возбудители, растворимые Аг или эритроцитарные антигенные препараты.
Реакция связывания комплемента имеет наибольшее применение для иммунодиагностики, основанной на обнаружении АТ при стрептококковых, менингококковых инфекциях, коклюше, микоплазменной пневмонии, гриппе, паротите, кори, краснухе, цитомегалии, сыпном тифе, риккетсиозах, трипаносомозе, вирусных энцефалитах, чуме, гонорее, сифилисе, сапе, токсоплазмозе, бруцеллезе, листериозах. Это объясняется высокой чувствительностью и специфичностью метода, возможностью использования его для текущей и отдаленной
рет р оспективной диагностики. Недостаток РСК - ее громоздкость, необходимость постоянного наличия эритроцитов, комплемента, антигена-диагностикума, продолжительность постановки, относительно позднее выявление АТ в диагностических титрах (10-14-й день заболевания).
В последние годы все шире применяется реакция непрямой гемагглютинации с использованием эритроцитов, сенсибилизированных растворимыми Аг возбудителя коклюша, туберкулеза, микоплазменной инфекции, кори, цитомегалии, сыпного тифа, малярии, риккетсиозов, чумы, туляремии, токсоплазмоза, эшерихиозов, дизентерии, брюшного тифа, бруцеллеза, листериоза. При наличии качественных эритроцитарных диагностикумов РНГА по специфичности и чувствительности не уступает РСК.
РТГА со стандартными вирусными диагностикумами используется для обнаружения АТ к вирусам гриппа, паротита, кори, клещевого и японского энцефалитов, желтой лихорадки, паппатачи, полиомиелита. Диагностические титры АТ в сыворотке крови больных, выявляемые с помощью РТГА, нарастают медленно (к 10-20-му дню заболевания), обычно не достигают высокого уровня (1:20-1:320). РТГА менее чувствительна и специфична, чем РНГА. Ее используют в качестве вспомогательного средства текущей и ближайшей ретроспективной диагностики.
Реакция нейтрализации АТ (РНА) - очень чувствительный и специфичный метод обнаружения АТ при стафилококковых инфекциях, паротите, кори, ветряной оспе, вирусных энцефалитах, денге, омской геморрагической лихорадке, паховом лимфогранулематозе, столбняке, ящуре, бешенстве. Однако он требует постоянного наличия опытных лабораторных животных, куриных эмбрионов или культур ткани, а также проведения длительных наблюдений (от нескольких дней до нескольких недель), что снижает возможности использования метода в клинике инфекционных болезней.
Реакция преципитации в описанных выше вариантах применяется для выявления АТ к возбудителям полиомиелита, менингококковой инфекции, трипаносомоза и некоторых других заболеваний. В клинической практике для обнаружения АТ у больных РП имеет ограниченное значение в связи с трудностью получения концентрированных растворимых Аг для ее постановки.
ПЦР - полимерная цепная реакция - специфическая амплификация ДНК, инициируемая синтетическими олигонуклеотидными праймерами. Реакция осуществляется in vitro с использованием ДНК-
полимеразы и олигонуклеотидных праймеров (затравок), комплементарных участкам, ограничивающим амплифицируемый дуплексный сегмент. В ходе ПЦР определяется на 100000-1000000 клеток.
Кожные аллергические реакции
Кожные пробы используются для диагностики стрептококковой инфекции, туберкулеза, Ку-лихорадки, туляремии, токсоплазмоза, актиномикоза, лепры, сапа, сибирской язвы, пахового лимогранулематоза, трахомы, листериоза, бруцеллеза.
При сибирской язве, туляремии, Ку-лихорадке кожные пробы со специфическими Аг становятся положительными на 3-5 день заболевания, и поэтому они служат методом ранней диагностики. При вялотекущих хронических инфекциях (паховом лимфогранулематозе, лепре, сифилисе, токсоплазмозе и др.) специфическая кожная аллергия выявляется закономерно через 3-4 нед после начала заболевания и является вспомогательным методом диагностики, применяющимся в разгаре заболевания, а также методом проверки эффективности лечения в период реконвалесценции.
Для постановки аллергических кожных проб (чаще внутрикожных, иногда накожных) используются растворимые Аг возбудителей или извлеченные из микробных клеток аллергенные субстанции (антраксин, малеин, тулярин, лепромаин). Кожные пробы отличаются специфичностью, технической простотой постановки, возможностью получения ответа через 28-72 ч.
При некоторых инфекциях (туляремии, бруцеллезе, токсоплазмозе) положительные кожные пробы сохраняются много лет и служат методом ретроспективного диагноза, выявления восприимчивых лиц, нуждающихся в вакцинации (при туляремии и туберкулезе). Введение Аг (туберкулиновые пробы) в сенсибилизированный организм иногда сопровождается тяжелыми побочными явлениями, осложняющими инфекционный процесс. Например, выраженные кожные пробы могут сопровождаться активацией очагов в легких, кожные пробы с токсоплазмином иногда обусловливают обострение токсоплазмоза глаз, введение бруцеллина - усиление боли в суставах, по ходу нервов, обострение воспалительных очагов, увеличение печени и селезенки. В редких случаях после постановки внутрикожных проб развиваются тяжелые анафилактические реакции. В последние годы рекомендуется ограничить постановку этих проб больным инфекционными заболеваниями и заменять их более безвредными для организма методами определения сенсибилизированных клеток.
Методы выявления сенсибилизированных клеток
Они включают определенные изменения активности, динамики альтерационных изменений ядра и показателя нейтрофилов (ППН), лизиса лейкоцитов (иммунолейкоцитолиз), исчезновение зернистости (дегрануляция) лейкоцитов-базофилов, лейкергии (агломерации) лейкоцитов, реакции бластной трансформации лимфоцитов, реакция торможении миграции лейкоцитов (РТМЛ), исследование образования специфических розеток с эритроцитами барана в присутствии каких-либо агентов, изучение других феноменов, возникающих при контакте сенсибилизированных клеток с аллергеном. Перечисленные тесты отличаются определенной информативностью и специфичностью. Ограничивает использование указанных методических подходов громоздкость постановки, необходимость наличия специально подготовленных стандартных аллергенов, сложных питательных сред при осуществлении реакции бластной трансформации лимфоцитов и других компонентов.
Имеются сведения об успешном применении ППН в реакции иммунолейкоцитолиза для постановки диагноза и клинического прогноза при дизентерии, туберкулезе, вирусном гепатите, стрептококковых инфекциях, токсоплазмозе, бруцеллезе. Преимущество этих тестов - простота постановки, непродолжительное время исследования, абсолютная безвредность для организма больного, возможность проведения анализа со многими аллергенами и в небольшом объеме крови.