Клиническая генетика : учебник / Н. П. Бочков, В. П. Пузырев, С. А. Смирнихина ; под ред. Н. П. Бочкова. - 4-е изд., доп. и перераб. - 2011. - 592 с. : ил.
|
|
|
|
Глава 7. ЭКОЛОГИЧЕСКАЯ ГЕНЕТИКА
ОБЩИЕ ВОПРОСЫ
Экологическая генетика человека изучает влияние факторов среды обитания на наследственность. Основы экологической генетики человека лежат в общебиологических закономерностях эволюции. Одна из парадигм медицинской генетики состоит в том, что во всех жизненных проявлениях действие любых генов осуществляется в тесном взаимодействии с факторами среды.
На протяжении сотен тысяч лет окружающая человека среда постоянно менялась. К ее изменениям человек приспосабливался как биологический вид с широкой нормой реакции. Человек как мыслящее существо активно изменял элементы среды своего обитания. Одновременно на групповом и популяционном уровнях происходил отбор генотипов. Окружающая среда обеспечивала отбор, выживание, процветание популяций или групп людей в зависимости от их наследственных характеристик. Эволюция человека шла через эволюцию его генотипа. Формировалась его биологическая природа. Человек приспосабливался к окружающей среде от первобытной пещеры до современного коттеджа как социальное и биологическое существо.
От собирательства и охоты человек перешел к более эффективной добыче пищи (разведение полезных растений и животных). Это делало его менее зависимым от борьбы за существование, а, следовательно, естественный отбор приобретал характерные для человека формы.
При воздействии неблагоприятных факторов окружающей среды на человека могут наблюдаться нежелательные эффекты в виде:
• изменения наследственных структур (индуцированный мутационный процесс);
• патологических проявлений экспрессии генов в ответ на специфические факторы среды;
• изменений генофонда популяций в результате нарушения генетического равновесия между основными популяционными процессами (мутационным процессом, отбором, миграции, дрейфом генов).
Эффекты 1-го типа - это мутационный процесс, индуцированный мутагенными факторами окружающей среды (в широком смысле слова), ведущий к повышению темпов наследственной изменчивости человека на индивидуальном и популяционном уровнях.
Эффекты 2-го типа у человека проявляются на индивидуальном уровне в виде патологических реакций (болезней), а на популяционном уровне - в виде большей или меньшей приспособленности (адаптации, акклиматизации).
Эффекты 3-го типа - изменения генофонда популяций являются долговременными и реализуются через десятки и даже сотни поколений. Биологически стабильному виду свойственно постоянное равновесие основных генетических процессов (мутационного процесса, отбора, миграции, дрейфа генов). Современный период характеризуется большей скоростью и объемом изменений среды обитания. Наследственность человека на популяционном уровне так быстро меняться не может. Следствием высоких темпов и большого объема изменений среды обитания человека (измененные экологические условия) могут стать изменения в генофонде конкретных популяций или человечества в целом.
ИНДУЦИРОВАННЫЙ
МУТАЦИОННЫЙ ПРОЦЕСС
Источником наследственной изменчивости как основы эволюции служат мутации. Мутационный процесс - одна из существенных характеристик человека как биологического вида. Хорошо установлено, что определенный, оптимальный для человека уровень мутационного процесса может изменяться под влиянием многих физических, химических и биологических факторов. Универсальность и всеобщность явления индуцированного мутагенеза в современных условиях не вызывают сомнений, и, следовательно, все его закономерности распространяются на человека (табл. 7.1).
Таблица 7.1. Последствия индуцированного мутагенеза

Если мутации возникают в зародышевых клетках, то повышается частота наследственной патологии.
Мутации в клетках эмбриона и плода ведут к снижению нормы реакции, или приспособленности будущего ребенка, к сохранению гомеостаза при повышенных нагрузках среды, повышению частоты врожденных пороков развития, гибели эмбриона или плода, внутриутробной задержке роста.
Мутационный процесс в соматических клетках в постнатальном периоде повышает частоту возникновения злокачественных новообразований, нарушает иммунитет, обусловливает преждевременное старение.
Характеристика мутационного процесса у человека на современном уровне знаний представлена в статье «Современный взгляд на мутационный процесс у человека» на компакт-диске.
В целом биологическую и медицинскую значимость последствий мутационного процесса у человека на современном этапе надо рассматривать по показателям мутагенеза, канцерогенеза и тератогенеза.
В 50-х годах ХХ в. в связи с расширенными испытаниями атомного оружия на нашей планете стал повышаться радиационный фон. Широкое применение ионизирующих излучений в медицине, техногенные катастрофы с ядерным материалом (атомные предприятия, подводные лодки, атомные электростанции) приводят к увеличению накапливаемой дозы облучения у каждого индивида и повышению частоты мутаций у сотен тысяч людей, что хорошо известно по последствиям Челябинских и Чернобыльской аварий.
В 50-60-х годах ХХ в. во всех странах стали резко увеличиваться производство и применение химических веществ, в том числе активно влияющих на хромосомы. Химические вещества (до 60 000 наименований) в среде обитания человека входят в состав пищевых продуктов или являются отходами производства. В мире производятся уже десятки миллиардов тонн химических веществ в год. Многие естественные и синтезированные химические вещества в воздухе, воде, пище, на рабочем месте, в коммунальной среде, в лекарствах являются потенциальными мутагенами, канцерогенами, тератогенами.
Принимая во внимание наводнение среды обитания человека химическими веществами и увеличение контактов человека с ионизирующими излучениями, можно сделать вывод о возможности реального повышения частоты мутирования в зародышевых и соматических клетках.
В ХХ в. были выяснены основные закономерности индуцированного мутагенеза, свидетельствующие о неотложности мер по оздоровлению окружающей среды. Среди главных характеристик индуцированного мутагенеза можно указать на:
• отсутствие порога действия;
• зависимость эффекта от дозы;
• стабильность мутаций;
• аддитивность эффектов от действия разных мутагенов;
• отсроченность действия.
Главный результат фундаментальных генетических исследований по проблемам мутагенеза - разработка методов выявления мутагенной опасности. Их широкое применение позволит экологам сделать среду обитания человека более безопасной с генетической точки зрения, поскольку:
• загрязненность окружающей среды, в том числе мутагенными факторами, увеличивается в целом; к тому же быстро изменяется спектр факторов;
• комплексное воздействие многочисленных химических и радиационных загрязнителей дает суммарный эффект, превышающий допустимые уровни токсичности;
• в среде обитания человека все чаще появляются факторы с длительной устойчивостью (диоксины, радионуклиды), постоянно пополняющие мутации;
• современное жилище с его полимерной и пластмассовой «начинкой» может быть источником мутагенных, тератогенных и канцерогенных влияний;
• стресс и широчайшее распространение психоактивных веществ (курение, наркотики) усиливают мутационный процесс.
ПАТОЛОГИЧЕСКИЕ ПРОЯВЛЕНИЯ
ЭКСПРЕССИИ ГЕНОВ
На протяжении эволюции в человеческих популяциях в связи с постоянно текущими мутационными и генетико-автоматическими (дрейф генов) процессами, а также под влиянием отбора сформировался широкий наследственный сбалансированный полиморфизм. Какой-либо ген считается полиморфным, если он присутствует в популяции в виде двух аллелей и более, причем частота редкого аллеля составляет не менее 1%. Распространенность полиморфизмов генов в современных популяциях человека громадная. Не менее 25%, т.е. около 8000 генов, детерминирующих антигенную, ферментативную, рецепторную системы и другие элементы молекулярно-биохимической конституции человека, представлены в виде полиморфных систем - 2 аллеля и более, следовательно, число индивидуальных вариаций генотипов может быть 28000. Чтобы представить себе реальную величину такого многообразия, укажем, что вариации всего лишь по 25 полиморфным системам (225) дают число индивидуальных генотипов, приближающееся к численности населения нашей планеты. С другой стороны, около 99% всех полиморфизмов являются молчащими, и только 1% проявляется под действием того или иного фактора окружающей среды. Кроме того, следует отметить, что значимость каждого полиморфизма определяется занимаемым им положением в геноме. Генетические полиморфизмы, так же, как и мутации, могут приводить к синтезу аномального белка, снижению или повышению его количества, что не может не отразиться на его функции.
Многочисленные вариации в ферментных системах, транспортных белках, антигенах и рецепторах клетки обусловливают индивидуальные особенности метаболизма химических веществ, реакций на биологические агенты или физические факторы.
Концепция экогенетики человека к настоящему времени уже сформировалась. Ее основы начали закладываться в середине 50-х годов прошлого столетия, когда впервые были обнаружены генетически
детерминированные патологические реакции на лекарства, обусловленные недостаточностью ферментов. Для описания таких состояний был предложен термин «фармакогенетика» (см. гл. 8), который вскоре был расширен до понятия «экогенетика».
В связи с большой практической важностью знаний фармакогенетических реакций для клиницистов фармакогенетика подробно изложена в следующей главе, хотя, безусловно, она является частью экогенетики человека. Накопление экспериментальных данных, примеров высокой чувствительности и толерантности к ксенобиотикам (чужеродным веществам) у отдельных индивидов, а также молекулярная расшифровка механизмов наследственных различий биотрансформации ксенобиотиков поставили вопрос о наследственных различиях реакций на разнообразные внешние факторы химической, физической и биологической природы.
Разработка проблем экогенетики человека ускорилась в связи с тем, что среда обитания человека пополнялась новыми факторами (лекарствами, пестицидами, пищевыми добавками, профессиональными вредностями и др.), на которые появлялись патологические реакции. В процессе эволюции человек не соприкасался с такими веществами (или факторами), поэтому на действие этих веществ не было никакого отбора. Какой-то аллель мог ранее распространиться в популяции из-за своих селективных преимуществ или дрейфа, но в других условиях окружающей среды он будет проявлять патологические эффекты. Речь идет о таких, как бы «молчащих», аллелях, которые начинают функционировать в новых условиях среды. Этот
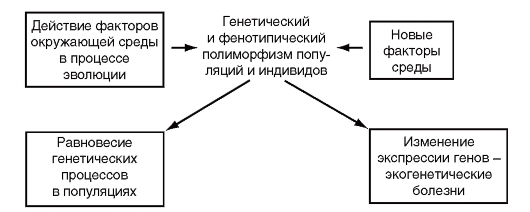
Рис. 7.1. Популяционно-генетическая основа возникновения экогенетических болезней
феномен называется экогенетическим действием факторов (рис. 7.1), а патологические проявления мутантных аллелей под влиянием факторов окружающей среды - экогенетическими реакциями или болезнями.
Понятие о «молчащих» (или нейтральных) генах весьма условно. Биологический или патологический эффект какого-либо аллеля зависит от воздействия специфического фактора среды.
К настоящему времени не только сформулировано понятие об экогенетике, но и определены основные направления исследований в этой области. Оказалось, что наследственные различия могут проявляться в реакциях не только на лекарства, но и на физические факторы, на пищу и особенно на пищевые добавки, на загрязнения атмосферы, профессиональные вредности. Согласно концепции экогенетики, необходимо изучение действия внешних факторов (особенно новых) с целью выявления наследственно обусловленных патологических реакций. Это будет основой создания адаптивной среды для каждого человека: подбор индивидуальной диеты и климата, исключение приема лекарств с патологическими реакциями, обоснование профессионального отбора и т.д. Такой подход приближает нас к персонализированной медицине (см. гл. 6).
Все болезни многофакторной природы можно рассматривать как примеры экогенетики человека, потому что их развитие становится результатом взаимодействия генов предрасположенности и факторов внешней среды.
Генетические различия в реакциях на действие факторов внешней среды можно установить с помощью генеалогического (семейного) анализа, близнецового или популяционно-статистического метода. Каждый из этих методов имеет свои разрешающие возможности и ограничения в экогенетике. В выявлении новых экогенетических вариаций генотипов все методы дополняют друг друга. Кроме того, наряду с применением генетических методов нужно проводить биохимические исследования молекулярных механизмов патологических реакций (вариантов ферментов, рецепторов, транспортных белков, ионных каналов). Одновременно с генетическим анализом нужно применять токсикологические и фармакологические методы для определения концентрации различных веществ в организме и путей их метаболизма.
ГЕНЕТИЧЕСКИЕ ОСНОВЫ БИОТРАНСФОРМАЦИИ ЧУЖЕРОДНЫХ ВЕЩЕСТВ (КСЕНОБИОТИКОВ)
Некоторые специфические мутации являются основой высокой чувствительности или толерантности их носителей к определенным факторам внешней среды. Потенциально токсические факторы окружающей среды поражают не все население в одинаковой мере. Только часть населения, генетически предрасположенная, т.е. имеющая определенные мутации, высоко чувствительна, для которой потенциальная токсичность переходит в реальную. Доказано, что у человека существует генетический контроль метаболизма поступающих в организм химических соединений (биотрансформации). Полиморфизм по этим генам и создает экогенетические вариации.
Современные данные позволяют говорить о трех фазах детоксикации или элиминации чужеродных веществ (ксенобиотиков), из которых первые две осуществляются с помощью генетически детерминируемых ферментов.
На основе многочисленных сведений о природе экогенетических вариаций можно сделать вывод, что они обусловлены сбалансированным полиморфизмом в генах ферментов, участвующих в первых двух фазах детоксикации. Полиморфизм генов детоксикации выражен достаточно сильно. По каждому гену уже известны десятки или даже сотни аллелей различной природы. «Инвентаризация» их еще не завершена.
Первую фазу биотрансформации ксенобиотиков называют фазой активации (функционализации или модификации). В этой фазе осуществляются биохимические реакции, в процессе которых ксенобиотики освобождаются от активных функциональных групп (-ОН, -NH2, -SH) и превращаются из липофильных соединений в более гидрофильные. Первую фазу детоксикации обеспечивают следующие ферменты: семейство изоферментов цитохрома Р450, параоксоназа (PON), алкогольдегидрогеназа (ADH) и альдегиддегидрогеназа (ALDH), бутирилхолинэстераза, эпоксидгидролаза и др. При наличии мутаций в перечисленных выше генах теряется ферментативная активность, активация не будет происходить, и, следовательно, ксенобиотики будут вызывать повреждающий эффект сначала на клеточном, а потом и на организменном уровне.
Вторая фаза - фаза нейтрализации (дезактивации, детоксикации). Суть процессов в этой фазе сводится к синтетическим реакциям. К активированным в первой фазе продуктам присоединяются ацетильные, метильные, суфгидрильные группы, глутатион, что приводит к образованию гидрофильных конъюгатов. Это водорастворимые нетоксичные компоненты, которые и выводятся из организма. Вторую фазу биотрансформации обеспечивают следующие ферменты: глутатион-D-трансферазы и N-ацетилтрансферазы (NAT), тиопуринметилтрансфераза (ТПМТ), сульфонтрансферазы, эпоксидгидролазы, УДФ-глюкуронилтрансферазы (UGT, УДФ - уридиндифосфоглюкуроновая кислота). Если вторая фаза биотрансформации не состоится по причине мутантной формы фермента, то продукты первой фазы детоксикации (промежуточные электрофильные метаболиты), накапливаясь, будут вызывать, как и неактивированные ксенобиотики, окислительный стресс, токсические эффекты, мутации, злокачественные новообразования и другие нежелательные последствия.
Третья фаза детоксикации обеспечивается работой физиологических систем выделения (кожа, почки, кишечник, легкие).
Активная секреция метаболитов (а иногда и просто ксенобиотиков) в мочу, желчь, пот осуществляется гликопротеином Р, а также транспортерами органических анионов и катионов. За препятствие всасываниию ксенобиотиков в кишечнике отвечает гликопротеин Р. Более подробные сведения о третьей фазе детоксикации («транспортеры» метаболитов) можно найти в следующей главе и в статье В.С.Баранова и др. «Научные основы предиктивной медицины» на компакт-диске.
НАСЛЕДСТВЕННО ОБУСЛОВЛЕННЫЕ
ПАТОЛОГИЧЕСКИЕ РЕАКЦИИ НА ДЕЙСТВИЕ ВНЕШНИХ ФАКТОРОВ
Экогенетика человека имеет дело с вариациями ответов организма различных людей на воздействие факторов среды. На основе этих фактов генетики пытаются объяснить, почему поражается только некоторая часть подвергающегося вредному воздействию населения и как индивиды различаются по адаптации к среде.
Экогенетические реакции могут быть обусловлены редкими мутантными аллелями, которые вызывают патологический ответ или
идиосинкразию. Однако существуют и полиморфные системы, обусловливающие количественные вариации ответа. Экогенетические ответы могут контролироваться одним или несколькими генами. Характер сегрегации признака в потомстве в этих случаях будет соответствовать моноили полигенным системам с учетом воздействия соответствующего фактора внешней среды.
Факторы среды обитания человека, которые могут влиять на проявление патологических эффектов мутантных аллелей, необычайно разнообразны (в атмосфере, пище, среди антропогенных факторов, профессиональных вредностей и т.д.).
В широком плане изучение токсических наследственно обусловленных реакций на факторы среды выделено в отдельное направление, названное токсикогенетикой, а в еще более широком смысле - токсикогеномикой. Базы данных по геному человека и современные мощные информационные технологии позволяют прогнозировать токсические проявления отдельных факторов среды у лиц с определенными генотипами.
Загрязнение атмосферы выхлопными газами автотранспорта, газообразными продуктами многочисленных фабрик и заводов представляет серьезную гигиеническую проблему глобального масштаба. В некоторых городах в атмосферу выбрасывается до 1000 кг плотных осадков на человека в год. Химические соединения и пылевые частицы попадают в организм через легкие, кожу и слизистые оболочки, вызывая патологические реакции. Все это в широком понимании входит в среду обитания человека. С одними факторами человек соприкасается постоянно, с другими - изредка. Проявления наследственных вариаций возможны в ответ на воздействие любых факторов. Часть таких факторов уже известна генетикам и врачам.
Для людей, занятых на некоторых производствах, доза (или концентрация) этих веществ намного больше допустимых, но они переносят это без профессиональной болезни. У некоторых индивидов даже меньшая доза ведет к профессиональному заболеванию (силикозу, антракозу, хронической пневмонии).
Наиболее изученная мутация, приводящая к недостаточности белка а1-антитрипсина, обусловливает патологическую реакцию на загрязнение атмосферы. Этот белок сыворотки крови называют также ингибитором протеиназ. В норме его концентрация повышается при различных состояниях (беременность, воспаление, введение эстрогенов). Генетические варианты белка обнаружены во многих популяциях. Его
формы различаются по антитрипсиновой активности и электрофоретической подвижности (аллели М, S, Z). Неактивность белка обусловлена аллелем Z (рецессивный признак). Частота гомозигот ZZ у европейцев составляет 0,05%, гетерозигот - 4,5%. Лица с наследственной недостаточностью ингибитора протеиназ, если они гомозиготны по данному признаку (генотип ZZ), чрезвычайно склонны к развитию хронических воспалительных заболеваний и эмфиземы легких. Эмфизема легких у таких людей развивается в 30 раз чаще, чем в популяции у лиц старше 30-40 лет, и протекает очень тяжело. Основа этой предрасположенности к эмфиземе лежит в том, что антитрипсиновая система играет важную роль в ограничении воспалительного процесса. При любых, даже незначительных повреждениях легочной ткани (воспалении, нарушении микроциркуляции) протеолитические ферменты вскоре начинают разрушать измененные участки. В норме включается синтез ингибитора протеиназ, который нейтрализует действие протеолитических ферментов и приостанавливает разрушение. При недостаточной продукции ингибитора протеиназ (мутантный генотип) протеолитические ферменты разрушают поврежденные участки, что и приводит к эмфиземе легких. Курение и запыленность воздуха существенно ускоряют развитие эмфиземы. Некоторые авторы описывают и более тяжелые случаи проявления недостаточности ингибитора протеиназ у детей - поражение печени. Даже у лиц, гетерозиготных по гену недостаточности ингибитора протеиназ (генотип MZ), частота которых в отдельных популяциях превышает 10%, выражены патологические реакции на повышенную запыленность и курение, т.е. повышен риск эмфиземы легких. Следовательно, необходимо исключить влияние производственной пыли на этих людей, чтобы предотвратить развитие у них этого заболевания. Методы определения недостаточности α1-антитрипсина разработаны, их можно применять при профессиональных осмотрах и отборе для работы на соответствующих производствах.
В среде обитания человека содержится много углеводородов, в том числе полициклических, которые после гидроксилирования арилгидрокарбонгидроксилазой образуют в организме активные эпоксиды. Эта ферментная система у человека хорошо изучена; индукция синтеза этого фермента очень вариабельна. Существуют гомозиготы с большим количеством фермента, гетерозиготы и гомозиготы - с малым. Необходимость этих сведений для понимания химического канцерогенеза очевидна, потому что эпоксиды являются активными канцерогенными формами полициклических углеводородов. Их
канцерогенная активность зависит от относительной активности эпоксидобразующих ферментов, с одной стороны, и систем, разлагающих эпоксиды, - с другой. Таким образом, эти соединения являются потенциальными мутагенами и канцерогенами. Например, до 30% больных раком легких имеют высокий уровень фермента, а в общей популяции этот признак встречается очень редко. Люди с высокой индукцией арилгидрокарбонгидроксилазы должны отказаться от курения и исключить профессиональный контакт с углеводородами.
На развитие легочных заболеваний влияет полиморфизм гена митохондриальной эпогидроксилазы. Данный фермент присоединяет воду к эпоксидам, превращая их в трансгидродиолы и далее в конъюгаты с глюкуроновой кислотой и глутатионом. Так же как и в случае других полиморфизмов, данный ген имеет «быстрый» и «медленный» аллели. Выявлена положительная корреляция «медленного» аллеля с заболеваниями органов дыхания. В сочетании с курением у таких лиц чаще, чем в среднем в популяции, развиваются респираторные заболевания, а также эмфизема и обструктивная пневмония.
Профессиональные вредности
В производственных условиях рабочие контактируют с бензпиреном, ароматическими соединениями, лакокрасочными материалами, продуктами изготовления резиновых изделий, солями тяжелых металлов и другими многочисленными факторами. В последнее время обнаружена взаимосвязь заболеваемости с производственными факторами у лиц с мутациями в группе генов глутатион-S-трансфераз и гена NAT2 (NAT2).
Глутатионопосредованная детоксикация играет ключевую роль в обезвреживании продуктов перекисного окисления липидов и пероксидов ДНК, восстанавливает органические гидроперекиси в спирты и изомеризует некоторые стероиды и простагландины.
Центральное место в семействе генов глутатион-S-трансфераз занимают гены GSTT1, GSTM1 и GSTP1, функционально ослабленные аллели которых ассоциированы с развитием злокачественных новообразований, хронического бронхита, эмфиземы легких. Ген GSTP1 обеспечивает выведение из организма ароматических соединений и бензпирена. Полиморфизм Ile105Val повышает активность фермента к ароматическим соединениям в 7 раз и снижает его детоксикационные свойства по отношению к бензпирену в 3 раза.
Ген NAT2 участвует в детоксикации ксенобиотиков, содержащих ароматические амины или гидразиновые группы, путем их ацетилирования. Выделяют 4 полиморфных варианта: 3 «медленных» и 1 «быстрый». Доказана связь между «медленным» ацетилятором и развитием рака мочевого пузыря. Риск особенно повышается при воздействии соответствующих факторов среды (курение, производство резиновых изделий, красок).
В ряде сообщений описывается различная чувствительность к солям тяжелых металлов (свинца, ртути, кадмия и др.). Например, отравление органическими соединениями ртути вызывает у разных людей нервно-психические расстройства различной выраженности. Гетерозиготные носители генов цистиноза и анемии Фанкони могут быть предрасположены к токсическому действию металлов или других почечных ядов. Повышенный, хотя и не токсический уровень свинца может быть «спусковым крючком» гиперактивного поведения у детей с наследственной предрасположенностью.
Пищевые вещества и пищевые добавки
Развитие таких постгеномных направлений, как протеомика, метаболомика и новые генетические методики, заложили основы изучения генетического контроля в нутрициологии. Нутригеномика изучает влияние основных пищевых ингредиентов на геном, описывает влияние пищевых молекул на метаболические пути и контроль гомеостаза. Сегодня уже доказано, что некоторые нутриенты могут оказывать влияние на ДНК, эпигенетические (например, метилирование), транскрипционные (влияние на мРНК) и посттрансляционные процессы (фосфорилирование, гликозилирование белков). Нутригенетика оценивает, как индивидуальные особенности генотипа определяют ответ на пищу, т.е. как генетические вариации организмов влияют на усвоение пищи.
Основные постулаты нутригеномики следующие.
- Большинство нутриентов прямо или косвенно воздействуют на геном, изменяя экспрессию генов или их структуру.
- При определенных условиях у некоторых индивидов питание может быть серьезным фактором риска развития многих заболеваний.
- Некоторые регулируемые пищевыми факторами гены, возможно, играют роль в возникновении, течении и тяжести хронических заболеваний.
- Степень влияния питания на баланс между здоровьем и заболеванием может зависеть от индивидуального генотипа.
- Коррекция диеты основывается на знании пищевой потребности, состояния питания и генотипа индивида (персонализированное питание).
Классическими примерами нутригенетических заболеваний являются фенилкетонурия (см. гл. 4), галактоземия, непереносимость лактозы, глютеновая энтеропатия, семейная гиперхолестеринемия.
Галактоземия - заболевание, связанное с дефицитом галактозо- 1-фосфатуридилтрансферазы или галактокиназы, в результате чего в организме накапливается галактоза и галактозо-1-фосфат, приводя к катаракте, циррозу печени, задержке психического развития и сепсису. Исключение галактозы из пищевого рациона способствует купированию практически всех симптомов заболевания.
Еще одним из наглядных примеров нутригенетических состояний является непереносимость лактозы, приводящая к дискомфорту в кишечнике и диспепсическим явлениям после употребления молока. В кишечнике не вырабатывается лактаза, в результате чего лактоза не расщепляется и служит хорошим субстратом для размножения гнилостной микрофлоры. Мутантные аллели гена лактазы широко распространены у восточных народов (до 95-100%), среди американских индейцев и афроамериканцев (70-75%). У европейцев частота гомозигот по этим мутациям невелика (5-10%).
Один из вариантов синдрома нарушенного всасывания у детей связан с непереносимостью глютена (белок пшеницы и других злаков). Это заболевание называется целиакией. Дети тяжело заболевают, как только начинают получать прикорм пищей, содержащей злаки. При исключении злаковых продуктов (хлеба, манной каши) такие дети развиваются нормально. Близнецовым и генеалогическим методами показано значение наследственности в этих реакциях. Предрасположенность к целиакии определяется взаимодействием двух генов главного комплекса гистосовместимости II класса (α-1 и β-1). Интересно, что некоторые сорта пшеницы не вызывают патологических реакций. Они отличаются от других сортов заменой одной или нескольких аминокислотных остатков в молекуле глютена.
Конские бобы вызывают гемолиз у лиц с наследственной недостаточностью Г6ФДГ. Если своевременно не приняты меры, за гемолизом следует поражение почек. Носители соответствующего гена часто
(10% и выше) встречаются в районах, где была распространена малярия, потому что гетерозиготы не болеют малярией. Недостаточность Г6ФДГ наследуется как сцепленный с Х-хромосомой рецессивный признак.
Гетерозиготные женщины встречаются чаще, чем гемизиготные мужчины. Все эритроциты мутантного происхождения у гомозигот XX и у гемизигот XY чувствительны к провоцирующим факторам - конским бобам, лекарствам, промышленным окислителям. Гемолиз у таких лиц вызывают и многие лекарства. В полном соответствии с гипотезой М. Лайон у гетерозиготных женщин может быть разное соотношение нормальных и мутантных эритроцитов (от 1:99 до 99 : 1). Примерно у 30% гетерозиготных женщин после воздействия провоцирующих факторов наблюдается гемолиз эритроцитов с выраженными клиническими симптомами.
Структурные мутации гена приводят к синтезу аномальной молекулы Г6ФДГ. Нарушения в этой молекуле изменяют ее каталитическую активность, кинетические свойства, стабильность и электрофоретическую подвижность. Известно более 200 вариантов Г6ФДГ, но развитие патологических реакций обусловливают лишь немногие из них. При наличии аномальной молекулы Г6ФДГ в эритроцитах снижаются связывание кислорода, скорость восстановления метгемоглобина и устойчивость к воздействию различных потенциальных окислителей. При аномальном варианте Г6ФДГ нарушается основная функция фермента - поддержание стабильности мембран эритроцитов.
Катехоламины, содержащиеся в сыре, у некоторых людей могут вызывать мигрень. Это связано с пониженной конъюгацией тирамина. Иногда мигрень провоцирует шоколад, что объясняется низкой активностью моноаминоксидазы.
Известны специфические реакции людей на алкоголь. У большинства представителей монголоидных популяций после употребления малых количеств алкоголя немедленно краснеет лицо, возникают тахикардия, жжение в желудке, мышечная слабость и другие признаки отравления. Это врожденное свойство сохраняется на всю жизнь и не зависит от привыкания к алкоголю. Такая реакция на алкоголь объясняется наследственными вариациями в молекулах двух ферментов, расщепляющих этанол.
Гены ADH печени представлены тремя полиморфными локусами (ADH-1, ADH-2, ADH-3), ALDH - двумя (ALDH-1 и ALDH-2).
Указанная выше токсическая реакция на малые количества алкоголя свойственна людям, у которых отсутствует изоформа ALDH-1.
Что же касается многофакторных заболеваний, то здесь на первый план выступают полиморфизмы генов, участвующих в расщеплении, активации, детоксикации и выведении нутриентов, попадающих в организм с пищей. Считается, что пищевые факторы ответственны примерно за 30% всех злокачественных новообразований. Велика также их роль в развитии сахарного диабета 1-го и 2-го типа, ишемической болезни сердца, ожирения, гипертонической болезни, некоторых пороков развития и другой не менее часто встречаемой патологии.
Наиболее изученным заболеванием с этой точки зрения является сахарный диабет (1-го и 2-го типа). Генетическая предрасположенность к сахарному диабету 1-го типа, по мнению авторитетных эндокринологов, хорошо нивелируется «правильной» диетой. Заболевание можно отсрочить и даже вылечить с помощью создания «персонализированной диеты» на основании сведений о значимых полиморфизмах для этой патологии. Так, показано, что частота сахарного диабета 1-го типа находится в прямой зависимости от энергетической ценности потребляемой пищи и в обратной - от доли растительной пищи в ежедневном рационе человека. Отмечен также выраженный протективный эффект грудного вскармливания. А неблагоприятные аллели генов DQA1 и DQB1 повышают риск заболевания при употреблении животных белков (например, мяса).
Очевидно, что в этиологии сахарного диабета 2-го типа большую роль играет воздействие окружающей среды, в частности питание. Данное заболевание относительно легко корректируется диетой. Однако не у всех пациентов изменение диеты бывает эффективным. На основании этого был сделан вывод об индивидуальных различиях в реакции пациентов на диету. Полиморфизмы затрагивают не только гены, включенные в метаболизм глюкозы, но и обмен инсулина, липидов, водно-солевой гомеостаз тканей, артериальное давление, иммунные реакции и др. Сведения обо всех значимых полиморфизмах помогут составить персонализированную диету для каждого пациента, страдающего сахарным диабетом 2-го типа.
Целый ряд заболеваний и нарушений связан с дефицитом фолиевой кислоты, которая участвует в синтезе нуклеотидов и в реакции превращения гомоцистеина в метионин. Очевидно, что дефицит фолиевой кислоты может вести к различным генетическим нару-
шениям (например, врожденным порокам развития) и к накоплению гомоцистеина, оказывающего токсическое влияние на ткани. Гомоцистеинемия может приводить к развитию ишемической болезни сердца, некоторым формам злокачественных новообразований, патологии беременности, врожденным порокам развития плода, аутоиммунным реакциям. Основными генами, продукты которых участвуют в метаболизме фолиевой кислоты, являются гены: метилентетрагидрофолатредуктазы (MTHFR), метионинсинтетазредуктазы (MTRR), метионинредуктазы (MTR) и транскобаламинсинтетазы (ТС). Все «медленные» аллели данных ферментов способствуют увеличению концентрации гомоцистеина в крови и тканях и снижению фолатов. Наиболее изучен ген MTHFR, для которого доказано, что полиморфизм С677Т является «медленным» аллелем и носители этого аллеля подвержены риску невынашивания беременности в 14 раз большему, чем носители «дикого» аллеля. Частота носителей медленных аллелей в Европе составляет около 10%. Таким лицам показаны повышенные дозы фолиевой кислоты, особенно женщинам во время беременности.
Выше были описаны наиболее изученные процессы, связанные с индивидуальным ответом организма на нутриенты. Однако есть и обратное явление - влияние нутриентов на геном. Жирные кислоты, холестерин, глюкоза, жирорастворимые витамины действуют на геном через факторы транскрипции, чувствительные к ним. Это так называемые регуляторные рецепторные белки, связывающие стеролы (SREBs) и углеводы (ChREBP), а также ядерные рецепторы. Дефицит холина, метионина, фолатов, витаминов В6 и В12 оказывает влияние на ДНК-метилтрансферазы, которые участвуют в процессе метилирования/деметилирования ДНК. Такое влияние может изменять экспрессию ряда генов, приводя к увеличению риска врожденных дефектов заращения нервной трубки, сердечно-сосудистым заболеваниям и злокачественным опухолям.
Как видно из этого раздела, полиморфизмы генов, связанных с метаболизмом нутриентов, играют существенную роль в возникновении, развитии, течении и исходах многих заболеваний. Зная заранее профиль полиморфизмов пациента, врач может составить индивидуальную, персонализированную диету, которая поможет если и не предотвратить эти заболевания, то, как минимум, отсрочить их манифестацию, облегчить симптомы.
Рассмотрение влияния факторов окружающей среды на геном было бы неполной без упоминания эпигенетики. Как известно, под эпигенетикой понимают способ регуляции экспрессии генов без изменения их первичной структуры. Основными механизмами такой регуляции являются метилирование ДНК и модификация гистонов (ацетилирование, метилирование, фосфорилирование). Оба эти механизма тесно связаны и взаимодополняют друг друга, в результате чего хроматин уплотняется и практически полностью выключается экспрессия гена. Природная пластичность эпигенома позволяет также репрограммировать пищевые, химические и физические факторы. Импринтированные гены и метастабильные эпиаллели являются двумя классами генов, которые особенно чувствительны к средовым факторам, потому что их регуляция особенно тесно связана с эпигенетическими механизмами. Разъяснение взаимодействия среды с эпигеномом способствовало бы развитию новой эпигенетически обоснованной стратегии диагностики, профилактики и лечения болезней человека. Потенциально эпигенетической модификации подвергаются CpG-островки транспозонов, промоторных регионов генов «домашнего хозяйства» и регуляторные элементы импринтированных генов. Во время эмбрионального развития данный механизм регуляции позволяет экспрессироваться определенным «нужным» генам в конкретные периоды развития, определяя тем самым правильное развитие зародыша. Не так давно в литературе стали появляться данные о том, что факторы окружающей среды, такие, как питание, химические и физические факторы, могут влиять на метилирование CpG-островков, изменяя тем самым экспрессию, в том числе и во время внутриутробного развития. Так, богатое фолиевой кислотой или бетаином питание матери во время беременности приводит к увеличению метилирования ДНК. К такому же эффекту приводит и чрезмерное употребление генистеина (компонент сои). И, наоборот, такие компоненты, как бисфенол А, подавляют метилирование. Данное явление может никак не отражаться на внутриутробном или постнатальном периодах жизни. Однако, если метилирование ДНК происходит в значимых или импринтированных генах, это потенциально может приводить к нарушению развития плода и к развитию социальнозначимых многофакторных болезней уже во взрослом состоянии (сердечно-сосудистых заболеваний, сахарного диабета 2-го типа, ожирения и др.).
Физические факторы
Несмотря на то что хорошо известна индивидуальная чувствительность к теплу, холоду и солнечному свету, роль наследственных факторов в этой чувствительности стала изучаться лишь недавно.
Четкие расовые различия обнаружены для реакции на холодовой фактор. Например, представители негроидной расы более чувствительны к холоду, чем представители европеоидной расы. Это объясняется разным уровнем теплопродукции и расширения сосудов.
Твердо установлены индивидуальные и расовые различия реакции на ультрафиолетовое облучение. Крайний пример генетической чувствительности - редкая аутосомно-рецессивная болезнь пигментная ксеродерма: под воздействием солнечного света возникают ожоги, затем язвенные поражения кожи и, наконец, злокачественные новообразования. Молекулярно-генетический механизм этого явления хорошо изучен. При пигментной ксеродерме поражается репарирующая система, восстанавливающая нормальное строение ДНК после повреждения ультрафиолетовыми лучами. Речь идет о мутациях в нескольких локусах, обусловливающих процессы репарации ДНК (экзо- и эндонуклеазы, полимеразы, лигазы). Эти гены клонированы и хорошо изучены. Возможна преклиническая и пренатальная диагностика указанной болезни.
Предполагается, что наследственно обусловленное различие в репарирующих системах может иметь определенное значение в чувствительности к ионизирующим излучениям, но достаточных доказательств этому еще нет.
Чувствительность к биологическим агентам
Генетические основы детерминации иммунитета не вызывают сомнений. Неодинаковая выраженность иммунитета у разных индивидов - общебиологическая закономерность. Хорошо известна различная чувствительность людей к вакцинам при введении одних и тех же доз. У некоторых людей появляются клинические признаки инфекции, у других реакция на иммунизацию совершенно отсутствует. Это является следствием генетического полиморфизма реакций на действие внешних биологических факторов.
Первичные иммунодефицитные состояния - наследственные дефекты клеточного и гуморального иммунитета. Они предраспола-
гают к бактериальным и грибковым заражениям, причем для разных форм характерны соответствующие типы инфекций (вирусные, бактериальные, грибковые).
Классическим примером наследственной устойчивости к биологическим агентам служат гемоглобинопатии (серповидно-клеточная анемия, талассемия) и энзимопатии (недостаточность Г6ФДГ), при которых малярийный плазмодий не может размножаться в эритроцитах мутантных гомозигот и гетерозигот. В связи с тем, что лица с гемоглобинопатиями и недостаточностью Г6ФДГ устойчивы к малярийному плазмодию, патологические мутации в соответствующих локусах широко распространились в местностях с высокой заболеваемостью малярией (Африке, Греции, Италии, Филиппинах, Азербайджане, Узбекистане).
ИЗМЕНЕНИЕ ГЕНОФОНДА ПОПУЛЯЦИЙ КАК РЕЗУЛЬТАТ НАРУШЕНИЯ ГЕНЕТИЧЕСКОГО
РАВНОВЕСИЯ
На основании приведенных выше примеров можно сделать однозначный на первый взгляд вывод: необходимо углубленное изучение полиморфизмов генов, отвечающих за метаболизм ксенобиотиков, чтобы в дальнейшем индивидуально подходить к назначению лекарственной терапии, составлению диеты и подбору профессии. Однако не следует забывать, что наличие того или иного полиморфизма не определяет на 100% развитие какого-то заболевания или какой-либо патологической реакции на экзогенное вещество. Речь идет лишь о предрасположенности, о статистически доказанном повышенном риске, но не о 100% предсказании. Ввиду этого сразу встает вопрос о целесообразности ДНК-диагностики огромного количества генетических полиморфизмов. Помимо экономической составляющей, данный вопрос затрагивает и этическую сторону: как осуществлять сбор материала, его анализ, хранение и использование. В любом случае сейчас научный мир разделен на 2 лагеря: выступающие за внедрение диагностики полиморфизмов и противники этого. И у каждой стороны есть веские аргументы в свою пользу.
Ускоренный научно-технический прогресс без учета экологических проблем может приблизить человечество к нарушению биологической гармонии со средой. При чрезвычайном загрязнении
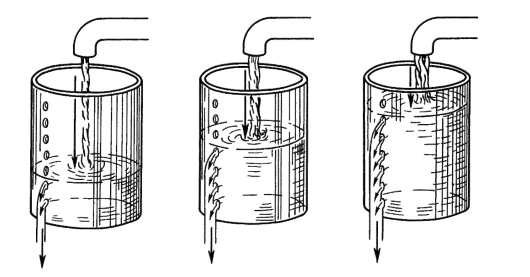
Рис. 7.2. Сохранение наследственной изменчивости в популяциях посредством равновесия между «поступающими» мутациями («втекающая вода») и отбором («вытекающая вода»)
окружающей среды может нарушиться равновесие генетических процессов в популяциях (рис. 7.2).
Среда обитания человека изменилась и продолжает меняться. Человек постоянно сталкивается с новыми факторами среды, а также испытывает большие социальные и экологические нагрузки. Увеличилась мутагенная нагрузка, расширился круг потенциальных брачных партнеров, увеличилась миграция населения, планирование семьи сократило естественное воспроизводство. Все это может менять генетическую структуру популяций. Однако популяционные генетические процессы обладают большой инерцией, поэтому не следует ожидать, что мутационный процесс и экогенетические реакции в течение одного-двух поколений вызовут опасные изменения наследственности человека или резкое увеличение частоты наследственных болезней. Утверждения об ухудшении генофонда человечества надо относить скорее к политическому пиару, чем к научно обоснованным выводам.
ЗАКЛЮЧЕНИЕ
Данные о потенциальном воздействии средовых загрязнений на наследственность человека и их способность повреждать наследственные структуры, репродуктивные функции, внутриутробное развитие справедливо вызывают озабоченность мировой обществен-
ности. Необходимы глубокие разработки в области экологической генетики человека и мероприятия по охране среды его обитания. Современные научные методологии существенно улучшили оценку вредных влияний факторов окружающей среды на наследственность человека. Оценка риска должна постоянно подвергаться коррекции, поскольку становятся доступными новые генетические технологии, а также происходит развитие клеточной биологии и информационных технологий.
Нередко высказываются предложения приблизить среду обитания человека к естественной экологии. Это невозможно, так как практически вся среда обитания современного человека в широком смысле слова выстроена самим человеком. Необходимо стремиться не к возврату в прошлое, а к оценке тех изменений, в том числе и в наследственности, которые возникают при создании новых технологий, и заранее предупреждать их.
Важность проблем, изучаемых экологической генетикой человека, со временем будет возрастать и относительно, и абсолютно. Во-первых, относительная значимость экогенетической патологии будет увеличиваться по мере улучшения медицинской помощи и успешной борьбы с распространенными болезнями. Обычные медицинские меры профилактики не снизят частоту экогенетических болезней. Во-вторых, со временем можно ожидать увеличения экогенетической патологии в абсолютном выражении, поскольку вследствие научно-технического прогресса будут появляться все новые факторы, повысится специфичность новых производственных условий и т.д.
Выявление экогенетической патологии и идентификация ее форм представляют трудную задачу, поскольку надо найти и суть биохимического полиморфизма в популяциях человека, и конкретные факторы среды, обусловливающие патологическое действие «молчащего» гена. В этом процессе познания трудно переоценить роль врача, заметившего «непонятный случай». Это особенно касается вопросов профессиональной патологии и лекарственной терапии: именно здесь можно чаще обнаружить проявление еще не описанных форм экогенетической патологии.
В профилактической медицине концепции экологической генетики человека крайне важны, поскольку они направляют усилия на создание оптимальной среды (пища, лекарства, работа) для каждого индивида с целью предупреждения патологического проявления экогенетического биохимического полиморфизма.
КЛЮЧЕВЫЕ СЛОВА И ПОНЯТИЯ
Генетика чувствительности к алкоголю Изменение генофонда популяций Индуцированный мутационный процесс Локусы биотрансформации ксенобиотиков Методы выявления экогенетических реакций «Молчащие» гены Непереносимость молочного сахара Нутригенетика Нутригеномика
Объем наследственного полиморфизма Примеры реакций на загрязнение атмосферы Токсикогенетика
Фазы биотрансформации ксенобиотиков Целиакия
Эволюция генотипа Экогенетика человека
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Бочков Н.П., Рослова Т.А., Якушина И.И. Медико-генетическое консультирование по поводу мутагенных и тератогенных воздействий. - Медицинская генетика. - 2009. - № 1. - С. 3-8.
Бочков Н.П., Чеботарев А.Н. Наследственность человека и мутагены внешней среды. - М.: Медицина, 1989. - 272 с.
Генетический паспорт - основа индивидуальной предиктивной медицины / под ред. В.С. Баранова. - СПб.: Изд-во Н-Л, 2009. - 527 с.
Спицын В.А. Экологическая генетика человека: эволюционная адаптация. Профессиональная деятельность. Спортивная геномика. Популяционная фармакогенетика. Мультифакториальные болезни. - М.: Наука, 2008. - 503 с.
Dolinoy D.C., Jirtle R. Environmental Epigenomics in Human Health and Disease. - Environmental and Molecular Mutagenesis. - 2008. - V. 49. -
P. 4-8.