Клиническая генетика: Учебник. - 3-е изд., испр. и доп. -Н.П. Бочков, 2004. - 480 с.: ил.
|
|
|
|
ГЛАВА 9. ПРИНЦИПЫ ЛЕЧЕНИЯ НАСЛЕДСТВЕННЫХ БОЛЕЗНЕЙ
Общие вопросы
Эмпирические попытки лечить больных с наследственной патологией, предпринимавшиеся в течение 200 лет вплоть до 30-х годов XX века, не дали положительных результатов. Диагноз наследственной болезни оставался приговором больному и его семье, такие семьи считали вырождающимися. Эта позиция в медицине в первые десятилетия XX века опиралась, по-видимому, также на генетическую концепцию об очень строгой детерминации менделирующих наследственных признаков. В связи с этим в начале XX века возникла негативная евгеника, призывавшая насильственно ограничить деторождение у лиц с наследственной патологией. К счастью, практическая реализация негативной евгеники была недолгой из-за общественного давления.
Переломным периодом в отношении лечения наследственных болезней можно считать 20-30-е годы. Так, в середине 20-х годов в экспериментах на дрозофиле были получены факты, показывающие разную степень проявления действия генов в зависимости от влияния генотипической или внешней среды. На основе этих фактов были сформированы понятия о пенетрантности, экспрессивности и специфичности действия генов. Стала возможной логическая экстраполяция: если среда влияет на экспрессивность генов, то, следовательно, можно уменьшить или исключить патологическое действие генов при наследственных болезнях. На основе этих положений выдающийся русский биолог Н.К. Кольцов предложил и обосновал новое направление в медицинской генетике - евфенику - учение о хорошем проявлении наследственных задатков. По его мнению, евфеника должна изучать все условия среды, стимулирующие проявления положительных и непроявления отрицательных (наследственные болезни) наследственных свойств.
Впервые в мире невропатолог и генетик С.Н. Давиденков, основываясь на собственном клиническом опыте и достижениях экспериментальной генетики, в начале 30-х годов указал на ошибочность мнения о неизлечимости наследственных болез-
ней и вырождении семей с такими болезнями. Он, как и Н.К. Кольцов, исходил из признания роли факторов внешней и внутренней среды в проявлении наследственных болезней. С.Н. Давиденков настаивал на принципиальных возможностях вмешательства в функционирование патологических аллелей и сам много сделал для разработки методов лечения наследственных болезней нервной системы. Такая исходная позиция позволяла разрабатывать различные подходы и методы лечения лиц с наследственными болезнями на основе достижений генетики, теоретической и клинической медицины. Однако отсутствие сведений о патогенетических механизмах наследственных болезней в тот период ограничивало возможности разработки методов. Все подобные попытки, несмотря на правильные теоретические установки, оставались эмпирическими.
В настоящее время благодаря успехам генетики в целом и существенному прогрессу теоретической и клинической медицины можно утверждать, что уже многие наследственные болезни успешно лечатся. Такая установка должна быть у врача.
Общие подходы к лечению наследственных болезней сходны с подходами к лечению болезней любой другой этиологии. При наследственных болезнях полностью сохраняется принцип индивидуализированного лечения, ведь врач и при наследственной патологии лечит не просто болезнь, а болезнь у конкретного человека. Возможно, что при наследственной патологии принцип индивидуализированного лечения должен соблюдаться еще строже, потому что гетерогенность наследственных болезней далеко не расшифрована, а, следовательно, одну и ту же клиническую картину могут вызвать разные наследственные болезни с различным патогенезом. В зависимости от условий пре- и постнатального онтогенеза, а также от всего генотипа человека фенотипические проявления мутаций у конкретного человека могут модифицироваться в ту или другую сторону. Следовательно, необходима разная коррекция наследственной болезни у разных пациентов.
Как и при лечении других хорошо изученных болезней (например, инфекционных), можно выделить 3 подхода к лечению наследственных болезней и болезней с наследственной предрасположенностью: симптоматический, патогенетический, этиотропный. Применительно к наследственным болезням в отдельную группу можно выделить хирургические методы, поскольку иногда они выполняют функции симптоматической терапии, иногда - патогенетической, иногда - и той и другой.
При симптоматическом и патогенетическом подходах используются все виды современного лечения (лекарственное, диетическое, рентгенорадиологическое, физиотерапевтическое, климатическое и т.д.). Генетический диагноз, клинические данные о состоянии больного и вся динамика болезни определяют поведение врача на протяжении всего периода лечения с постоянным и строгим соблюдением гиппократовского принципа «не навреди». При лечении наследственных болезней надо быть особенно внимательным в соблюдении этических и деонтологических норм: часто эти больные имеют тяжелую хроническую патологию с детского возраста. Изложим общие принципы лечения наследственной патологии и разработки новых методов.
Симптоматическое лечение
Хотя неспецифическое лечение не является главным, оно фактически используется всегда, в том числе при лечении пациентов с наследственными болезнями. Симптоматическое лечение применяется при всех наследственных болезнях, даже если врач располагает методами патогенетической терапии. Для многих форм наследственной патологии симптоматическое лечение является единственным.
Лекарственная симптоматическая терапия разнообразна и зависит от формы наследственных болезней. Одним из древних примеров симптоматической терапии, сохранившейся до наших дней, является применение колхицина при острых приступах подагрического артрита. Такое лечение использовали еще греки в античном периоде. Другими примерами симптоматического лечения могут быть применение анальгетиков при наследственных формах мигрени, специфических транквилизаторов при психических проявлениях наследственных болезней, противосудорожных препаратов при судорожных симптомах и т.д. Успехи этого раздела терапии связаны с прогрессом фармакологии, обеспечивающим все более широкий выбор лекарств. Вместе с тем расшифровка патогенеза каждой болезни позволяет понять причину возникновения симптома, а на этой основе становится возможной более тонкая лекарственная коррекция симптомов, если первичная патогенетическая терапия еще невозможна. В качестве примера можно привести общую схему многокомпонентного симптоматического ле-
чения муковисцидоза. Первичное звено патогенеза (нарушение транспорта ионов натрия и хлора) скорригировать при этом заболевании еще не удается.
1. В связи с тем, что у больных выделяется много хлорида натрия с потом, детям с муковисцидозом в жарком сухом климате рекомендуется дополнительно добавлять поваренную соль в пищу. В противном случае иногда может наступить коллапс с тепловым ударом.
2. Недостаточность функции поджелудочной железы у больных (рано или поздно это наступает) восполняется препаратами сухих экстрактов поджелудочной железы животных или ферментов в капсулах (панкреатин, панзинорм, фестал) и желчегонных средств. При клинических признаках нарушения функции печени проводится курс соответствующей терапии (эссенциале, метионин, холин и др.).
3. Наиболее серьезными и трудными для лечения являются нарушения дыхательных путей. Закупорка просветов малых бронхов густой слизью обусловливает развитие инфекции в легочной ткани. На закупорку бронхов и инфекцию направлена симптоматическая (почти патогенетическая) терапия. Для уменьшения обструкции применяют бронхоспазмолитические и отхаркивающие смеси (изопреналин, эуфиллин, атропин, эфедрин и др.), препараты муколитического действия (в основном тиолы - мукосольвин, местабон). Способ введения препарата (в ингаляциях, внутрь, внутримышечно) зависит от выраженности клинической картины. Применяют лекарства, уменьшающие внутриклеточную продукцию слизи, например мукодин (карбоксиметилцистеин).
4. Лечение воспалительных осложнений в легких при муковисцидозе представляет трудную задачу, поскольку эти осложнения обусловлены несколькими видами бактерий, а иногда и грибов. С этой целью проводят интенсивную микробиологически контролируемую антибиотикотерапию (уреидоденициллин, цефалоспорины третьего поколения и др.), а также лечение фторхинолонами для борьбы с синегнойной инфекцией. Антибиотики выбирают в зависимости от чувствительности микрофлоры. Наибольший эффект дает введение антибиотиков в ингаляциях и парентерально.
Как видно на примере лекарственного лечения муковисцидоза, многосимптомные болезни требуют применения нескольких фармакокинетически совместимых лекарств.
Симптоматическое лечение бывает не только лекарственным. Многие виды физических методов лечения (климатотерапия, бальнеолечение, разные виды электротерапии, теплолечение) применяются при наследственных болезнях нервной системы, наследственных болезнях обмена веществ, заболеваниях скелета. После таких курсов лечения больные чувствуют себя намного лучше, продолжительность их жизни увеличивается.
Практически нет таких наследственных болезней, при которых не было бы показано физиотерапевтическое лечение. Например, лекарственное лечение муковисцидоза постоянно подкрепляется многообразными физиотерапевтическими процедурами (ингаляции, массаж и др.).
К симптоматическому можно отнести рентгенорадиологическое лечение при наследственно обусловленных опухолях до и после хирургического вмешательства.
Возможности симптоматического лечения при многих болезнях еще далеко не исчерпаны, особенно это касается лекарственной и диетической терапии.
Следует подчеркнуть, что симптоматическое лечение будет использоваться в большом объеме и в будущем наряду с самым совершенным патогенетическим или даже этиотропным лечением наследственных болезней.
Патогенетическое лечение
Лечение любых болезней путем вмешательства в патогенез всегда эффективнее, чем симптоматическое лечение. При наследственных болезнях патогенетические методы также наиболее обоснованны, хотя и не противопоставляются симптоматическому лечению. По мере изучения патогенеза каждой болезни появляются различные возможности вмешательства в этот процесс, в течение болезни или в выздоровление. Клиническая медицина развивалась на основе теоретических представлений о патологических процессах. Таким же путем идет клиническая генетика в разработке методов лечения.
Для патогенетического лечения наследственных болезней в последние годы применяют принципиально новые подходы, основанные на достижениях молекулярной и биохимической генетики. При описании генных болезней (см. главу 4) приводились примеры
расшифрованных нарушенных звеньев обмена, всех биохимических механизмов, по которым развивается наследственно обусловленный патологический процесс, - от аномального генного продукта до клинической картины болезни. Естественно, что на этой основе можно целенаправленно вмешиваться в патогенез болезни, а такое лечение фактически равнозначно этиотропному. Первопричина, т.е. мутантный ген, хотя и не устраняется, но цепь патологического процесса прерывается и патологический фенотип (болезнь) не развивается, т.е. происходит нормокопирование.
Патогенетическое лечение должно расширяться по мере прогресса генетики развития. Пока ее вклад в разработку методов лечения наследственной патологии незначителен, хотя успехи последних лет не вызывают сомнений. В настоящее время лечение основано на коррекции отдельных нарушенных звеньев, но более эффективно было бы вмешиваться в патологический процесс на уровне системных реакций.
При патогенетических подходах к лечению наследственных болезней исходят из того, что у больных либо образуется аномальный белок (фермент), либо нормального белка вырабатывается недостаточно (до полного отсутствия). За этими событиями следуют изменения цепи превращения субстрата или его продукта. Знание этих принципов и конкретных путей реализации действия гена помогает правильно разрабатывать схемы лечения и даже терапевтическую стратегию. Это особенно четко можно проследить на примере наследственных болезней обмена веществ.
В обобщенном (может быть, немного упрощенном) виде возможные подходы к лечению наследственных болезней обмена веществ представлены на рис. 9.1. Видно, что для различных болезней могут быть разные пути коррекции. Для одной и той же болезни можно использовать вмешательства в разных звеньях и на различных этапах развития патологического процесса.
В целом патогенетические подходы к лечению наследственных болезней в зависимости от уровня биохимического дефекта можно представить следующим образом. Лечение схематично сводится к возмещению или выведению чего-либо. Если ген не работает, то необходимо возместить его продукт; если ген производит не то, что нужно, и образуются токсичные продукты, то необходимы удаление таких продуктов и возмещение основной функции; если ген производит слишком много продукта, то его избыток удаляют.
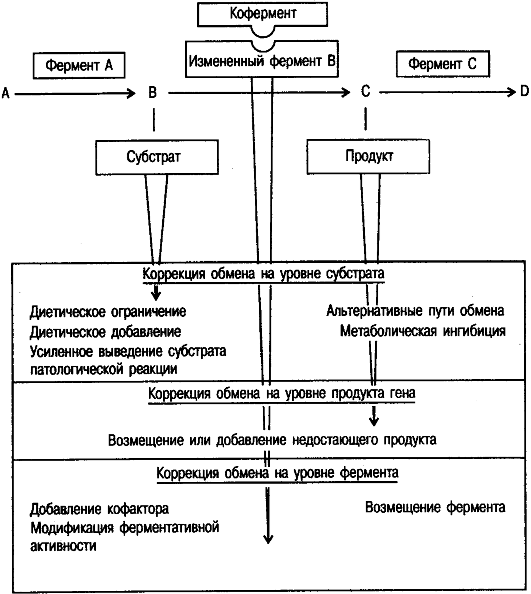 Рис. 9.1. Возможные подходы к лечению наследственных болезней.
Рис. 9.1. Возможные подходы к лечению наследственных болезней.
Коррекция обмена на уровне субстрата
Такое вмешательство - одна из наиболее частых форм лечения наследственных болезней. Коррекцию можно обеспечить разными путями, примеры которых приведены ниже. Субстратом в данном случае (см. рис. 9.1) называется тот компонент пищи, который подвергается метаболизму с помощью генетически детерминируемого фермента (например, фенилаланин, галактоза), а при наследственной болезни он является участником патологической реакции.
Ограничение определенных веществ в пище (диетическое ограничение) было первой успешной мерой в лечении наследственных болезней обмена, при которых отсутствуют соответствующие ферменты для нормального превращения субстратов в продуктах питания. Накопление некоторых токсичных соединений или продуктов их обмена приводит к постепенному развитию болезни. При фенилкетонурии назначают диету с низким содержанием фенилаланина. Несмотря на отсутствие фенилаланингидроксилазы печени, тем самым прерывается патогенетическое звено развития болезни. Ребенок, находившийся несколько лет на искусственной диете, уже не будет страдать тяжелой формой болезни. Спустя несколько лет чувствительность нервной системы к фенилаланину и продуктам его превращения резко снижается и диетическое ограничение может быть уменьшено. Ограничение диеты не обязательно означает составление специального пищевого рациона. Например, новый метод ограничения поступления фенилаланина с пищей при фенилкетонурии основан на приеме внутрь желатиновых капсул, содержащих растительный фермент, который освобождает пищевые продукты от фенилаланина. При таком лечении концентрация фенилаланина в крови уменьшается на 25%. Этот метод особенно целесообразно применять у более взрослых пациентов с фенилкетонурией и беременных, не нуждающихся в строгом соблюдении диеты.
Диетическое ограничение применяется при лечении многих наследственных болезней обмена углеводов и аминокислот (галактоземия, наследственная непереносимость фруктозы и лактозы, аргининемия, цитруллинемия, цистинурия, гистидинемия, метилмалоновая ацидемия, тирозинемия, пропионовая ацидемия) и других болезней с известным первичным дефектом. Применяются диеты, специфичные для каждого заболевания.
Ограничением определенных веществ в диете можно также лечить болезни, для которых еще не расшифрован дефект первичного продукта гена. Эмпирически установлено, например, что при целиакии (см. главу 8) постоянные диспепсические явления провоцирует глютен. Для лечения этой болезни достаточно исключить из пищи продукты, содержащие клейковину.
Хотя селективное ограничение определенных веществ в пище широко используется для повышения эффективности лечения ряда наследственных болезней обмена веществ, остается еще много нерешенных вопросов. Например, несмотря на 35-летний опыт
лечения фенилкетонурии, еще не полностью определены оптимальные границы диеты, продолжительность курса лечения для детей, необходимость ограничения при менее тяжелых формах ферментативной недостаточности, принципы индивидуализации диеты. Диетическое ограничение должно проводиться под строгим биохимическим контролем обмена веществ.
Диетическое добавление применяется реже, чем ограничение, но этот прием также эффективен при патогенетическом лечении и вошел в практику лечения двух болезней обмена.
При синдроме Хартнапа в результате дефекта транспортной функции клеток слизистой оболочки кишечника возникает мальабсорбция триптофана. Биохимическим следствием этого являются отсутствие триптофана в крови, гипераминоацидоз, эндогенный дефицит никотиновой кислоты. У пациентов наблюдаются дерматологические, неврологические и психические проявления пеллагры. Симптомы болезни уменьшаются или даже исчезают при введении в рацион ребенка продуктов с высоким содержанием белка (4 г/кг в день) и добавлении никотинамида или никотиновой кислоты (по 40-200 мг 4 раза в день).
Особенно убедительный аргумент в пользу лечения наследственных болезней с помощью диетического добавления дает лечение гликогеноза III типа (амило-1,6-глюкозидазная недостаточность). Это заболевание сопровождается гепатоспленомегалией, гипогликемией натощак, прогрессирующей миопатией, мышечной атрофией, кардиомиопатией в результате нарушения аланиноглюкозного цикла (низкая концентрация аланина). Это приводит к распаду аминокислот в мышцах при глюконеогенезе. У большинства больных детей наступает улучшение, если белки обеспечивают 20-25% энергетической ценности пищи, а углеводы - не более 40-50%.
Усиленное выведение субстрата патологической реакции может осуществляться разными путями (лекарственным, инструментальным), которые должны снижать концентрацию токсичного субстрата. Полного освобождения от патологических продуктов обмена добиться трудно. Примером усиленного выведения субстрата является влияние хелатов при гепатолентикулярной дегенерации. Например, D-пеницилламин связывает, мобилизует и ускоряет выведение внутриклеточно накопленных ионов меди. Если это средство неэффективно для некоторых пациентов, то применяют тритилена тетраминдигидрохлорид.
При гемоглобинопатиях необходимо усиленное выведение железа, чтобы не развивался гемосидероз паренхиматозных органов.
Применяемый для этих целей десферал (десфероксамин) накапливает ферритины и освобождает организм от излишнего железа.
Можно эффективно применять и непрямые метаболические пути для выведения субстрата. Например, нормальный уровень мочевой кислоты в крови можно обеспечить выведением остаточного азота в форме не только мочевины, но и ее метаболитов. Такой прием применяется для лечения наследственных болезней, обусловленных многими энзимопатиями цикла мочевины. Подобные примеры известны и для других форм наследственных болезней обмена веществ.
Выше были приведены примеры усиленной элиминации субстратов с помощью лекарств. Этих же целей можно добиться с помощью физико-химических методов освобождения от накопленного в крови субстрата (плазмаферез и гемосорбция).
С помощью плазмафереза удаляется большой объем плазмы, содержащей токсичное вещество. Плазмаферез можно применять для освобождения крови от излишка липидов, жирных кислот, фитановой кислоты. Этот метод эффективно используется при лечении болезни Рефсума. Сделаны первые успешные попытки лечения плазмаферезом двух лизосомных болезней накопления - болезней Фабри и Гоше.
Гемосорбция помогает селективно удалять вещества или классы веществ путем их связывания с родственными лигандами. Этот метод уже применяется для лечения семейной гиперхолестеринемии. В качестве лиганда для экстракорпорального связывания ЛПНП используют гепарин-агарозу, правда, получается кратковременный эффект. Уровень холестерина возвращается к исходному через 3-7 дней после лечения.
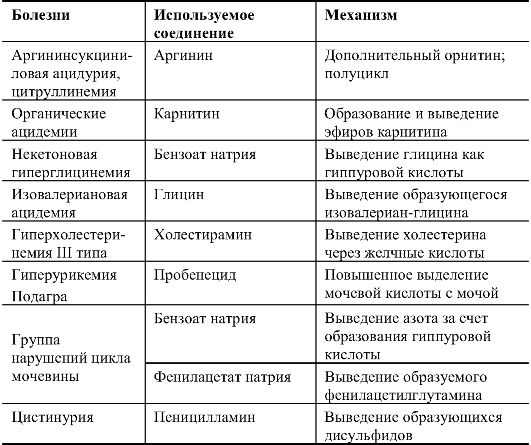
Альтернативные пути обмена при лечении наследственных болезней приведены в табл. 9.1.
Указанный способ лечения во многом сходен с методами усиленного выведения субстрата. Разница заключается только в способах достижения цели: в одном случае усиленно выводится непосредственно субстрат, а в другом субстрат сначала превращается в какое-то соединение, а затем это соединение удаляется.
Метаболическая ингибиция используется тогда, когда надо затормозить синтез накапливаемого при наследственной болезни субстрата или его предшественника. В качестве ингибиторов применяют разные физиологически активные соединения. Например, при синдроме Леша-Нихена и подагре используют аллопуринол, который ингибирует ксантиноксидазу, благодаря чему
Таблица 9.1. Альтернативные пути обмена при лечении наследственных болезней
 уменьшается
концентрация мочевой кислоты в крови. Клофибрат ингибирует синтез
глицеридов и поэтому эффективно снижает концентрацию липидов у пациентов
с гиперхолестеринемией (тип III). Стрихнин конкурирует в связывании
глицина с рецепторами в ЦНС, что улучшает дыхательную и моторную
функции, угнетение которых вызвано высоким содержанием глицина в
спинномозговой жидкости при тяжелой некетоновой гиперглицинемии.
уменьшается
концентрация мочевой кислоты в крови. Клофибрат ингибирует синтез
глицеридов и поэтому эффективно снижает концентрацию липидов у пациентов
с гиперхолестеринемией (тип III). Стрихнин конкурирует в связывании
глицина с рецепторами в ЦНС, что улучшает дыхательную и моторную
функции, угнетение которых вызвано высоким содержанием глицина в
спинномозговой жидкости при тяжелой некетоновой гиперглицинемии.
Коррекция обмена на уровне продукта гена
Этот подход применяется уже давно, поскольку во многих случаях в клинической медицине для некоторых болезней была уста-
новлена патогенетически ключевая роль отсутствия некоторых веществ (инсулин, гормоны роста, антигемофильный глобулин и др.).
Возмещение продукта (или добавление) с целью коррекции обмена применяется при таких нарушениях, патогенез которых обусловлен аномальным ферментом, не обеспечивающим выработку продукта, или другим биологически активным соединением.
Примеров эффективных подходов к «исправлению» наследственных нарушений обмена путем возмещения продукта уже много: введение необходимых стероидов при врожденной гиперплазии надпочечников, тироксина при гипотиреоидизме, гормона роста при гипофизарной карликовости, уридина при оротовой ацидурии. К сожалению, пока еще нет примеров возмещения внутриклеточных белков, хотя попытки в этом направлении предпринимались (например, при лечении лизосомных болезней).
Подобные примеры известны не только для нарушений обмена, но и для других наследственных болезней. Так, введение антигемофильного глобулина предупреждает кровоточивость при гемофилии, γ-глобулин помогает при агаммаглобулинемии, инсулин - при диабете.
При энтеропатическом акродерматите, при котором развивается недостаточность цинка из-за дефекта цинксвязывающего фактора в кишечнике, одинаково улучшают состояние больных и введение грудного молока, содержащего цинксвязывающий фактор, и прием препаратов цинка внутрь. Как только концентрация цинка в крови достигает нормального уровня, состояние больных сразу улучшается.
Для лечения по принципу возмещения продукта надо знать тонкие механизмы патогенеза и вмешиваться в эти механизмы (возмещать продукт) осторожно и внимательно. Так, предварительные попытки лечения болезни Менкеса путем возмещения меди не привели к успеху, хотя концентрация меди и церулоплазмина в крови больных достигала нормального уровня. Оказалось, что дефект при данной болезни обусловлен нарушением регуляции синтеза медьсвязывающего белка, обеспечивающего внутриклеточное содержание меди. По этой причине препараты меди не улучшали состояние больных.
Необходимость знания тонких механизмов обмена для лечения можно показать на примере сцепленной с Х-хромосомой гипофосфатемии. При этом заболевании первичный почечный дефект всасывания фосфата ведет к нарушению (снижению) минерализации костей (рахит) и гипокальциемии. Прием внутрь фосфата и 1,25-дигидроксихолекальциферола улучшает минерализацию ко-
стей и уменьшает гипокальциемию, но не изменяет первичного дефекта потери фосфата с мочой. В связи с этим имеется большая опасность возникновения гиперкальциемии, а, значит, в процессе лечения надо контролировать содержание кальция в крови.
В целом можно ожидать дальнейших сдвигов в патогенетическом лечении путем возмещения продуктов (белков, гормонов) в связи с успехами физико-химической биологии, генной инженерии и биотехнологии: уже получают специфические белки и гормоны человека, необходимые для восполнения нарушенного звена обмена при лечении наследственных болезней (инсулин, соматотропин, интерферон и др.).
Хорошо известны успехи в получении и разведении трансгенных лабораторных животных. Хотя технически создание трансгенных сельскохозяйственных животных много труднее, чем лабораторных, однако это решаемая задача. От крупных животных можно получить большое количество белка. Трансгенных животных, чьи клетки производят нужные белки, можно называть биореакторами. От них можно получать потомство, т.е. возможно воспроизводство из поколения в поколение.
Создание трансгенных животных начинается со сшивки двух генов, каждый из которых клонирован отдельно. Один ген кодирует нужный белок, другой взят из железы или другого органа, который будет производить этот белок. Например, если белок продуцируется с молоком, то специфическими органными генами будут гены из молочной железы.
Гибридная ДНК инъецируется в оплодотворенную яйцеклетку или в эмбрион. Примерно в 5-10% случаев ДНК встраивается в геном. Все яйцеклетки подсаживают в матку самок, а родившихся животных проверяют на присутствие гибридного гена. От животного-основателя получают потомство и таким образом создают стадо.
Одним из примеров живых биореакторов является свинья, продуцирующая человеческий гемоглобин (рис. 9.2). Она «сконструирована» в 1991 г. Около 15% эритроцитов свиньи содержат человеческий гемоглобин. Его можно отделить от свиного с помощью препаративных методов. Такой гемоглобин не содержит вирусы человека, хотя в отдельных случаях не исключаются аллергические реакции.
Другим трансгенным животным стала корова, которая производит человеческий лактоферрин, выделяемый с молоком. В результате подсадки трансгенной яйцеклетки родился бык (рис. 9.3), ставший отцом многих трансгенных телок, в последующем производящих лактоферрин с молоком.
 Рис. 9.2. Трансгенная свинья, которая продуцирует гемоглобин человека.
Рис. 9.2. Трансгенная свинья, которая продуцирует гемоглобин человека.
 Рис. 9.3. Трансгенный бык с геном человеческого лактоферрина. От него получены телята с таким же геном.
Рис. 9.3. Трансгенный бык с геном человеческого лактоферрина. От него получены телята с таким же геном.
 Рис. 9.4. Трансгенная коза, в молоке которой содержится плазминогенный активатор (тромболитический фермент).
Рис. 9.4. Трансгенная коза, в молоке которой содержится плазминогенный активатор (тромболитический фермент).
Получены и другие трансгенные животные. Коза (рис. 9.4) выделяет с молоком активатор плазминогена, который растворяет тромбы, трансгенные кролики - фермент α-глюкозидазу для лечения болезни Помпе, трансгенные куры несут яйца с человеческими антителами.
Коррекция обмена на уровне ферментов
Многоступенчатый путь превращения субстрата в процессе обмена осуществляется с помощью соответствующих ферментов. Большая группа наследственных болезней обусловлена мутациями в генах, детерминирующих синтез ферментов (энзимопатии). Вмешательство в развитие болезни (коррекция) на уровне фермента является примером патогенетического лечения первичных этапов, т.е. приближающегося к этиотропному лечению. Этот вид лечения применяется для коррекции наследственных болезней обмена веществ, при которых известен функционально аномальный
фермент. Для такого лечения можно вводить кофактор или индуцировать (угнетать) синтез фермента с помощью лекарств либо возмещать недостаток фермента.
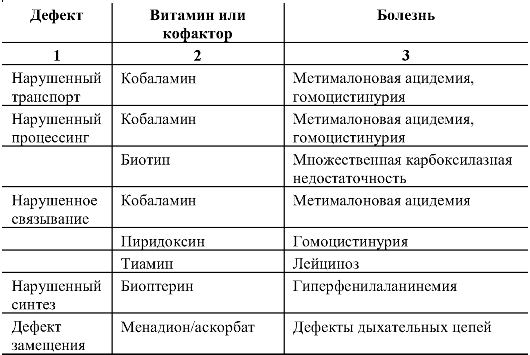
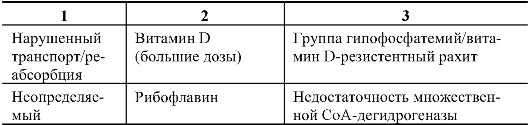
Введение кофактора используется при многих наследственных болезнях. Как известно, некоторые врожденные аномалии обмена связаны с нарушением синтеза или транспортировки специфических кофакторов, что изменяет нормальную каталитическую активность фермента. В этих случаях добавление соответствующего кофактора повышает активность фермента и в значительной мере исправляет метаболический дефект. Показано, что при витаминзависимых состояниях повышение остаточной активности мутантных ферментных комплексов обеспечивает не только биохимическое, но и клиническое улучшение состояния. Известны многочисленные примеры лечения наследственных болезней путем добавления кофакторов, далеко не исчерпывающая классификация которых представлена в табл. 9.2.
Из табл. 9.2 видно, что при лечении наследственных болезней один и тот же кофактор может выполнять разные функции. По-видимому, будет перспективным введение кофактора для внутриутробного лечения плода (как в случае В-зависимой метилмалоновой ацидемии).
Таблица 9.2. Классификация нарушений обмена, при лечении которых добавляют кофактор
 Окончание таблицы 9.2.
Окончание таблицы 9.2.
 Модификация ферментативной активности
Модификация ферментативной активности
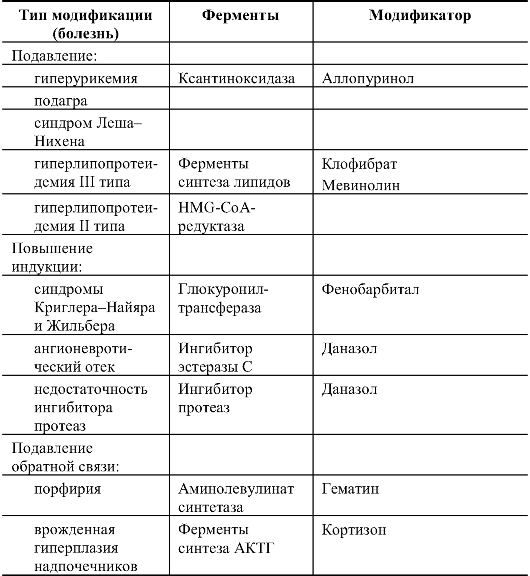
Это уже сложившийся подход при лечении наследственных болезней обмена. Стратегия такого лечения отражена в табл. 9.3, в которой приведены отдельные примеры.
Индукцию синтеза фермента можно использовать для повышения остаточной ферментативной активности путем введения лекарств. Например, фенобарбитал и родственные ему препараты стимулируют функцию эндоплазматического ретикулума и синтез специфичных для него ферментов. В связи с этим фенобарбитал применяют для лечения синдромов Жильбера и Криглера-Найяра. При этом снижается уровень билирубина в плазме крови. Такой подход имеет определенное значение при болезнях, обусловленных недостаточной продукцией ферментов, вырабатываемых в эндоплазматическом ретикулуме.
Индукция синтеза ферментов с помощью даназола (дериват этинилтестостерона) применена для лечения недостаточности α1- антитрипсина и ангионевротического отека. При недостаточности α1-антитрипсина применение даназола в течение 30 дней существенно повышает уровень этого белка в сыворотке. Таким образом, данный метод можно использовать для предупреждения легочных осложнений.
Ангионевротический отек сопровождается снижением количества функционально активного сывороточного ингибитора эстеразы С на 50%. Применение андрогенов повышает в 3-5 раз уровень ингибитора эстеразы. Профилактический прием внутрь даназола снижает или предупреждает острый ангионевротический
Таблица 9.3. Лечение наследственных болезней путем модификации ферментативной активности
 отек, оказывает минимальную вирилизацию и связан с наименьшей токсичностью для печени.
отек, оказывает минимальную вирилизацию и связан с наименьшей токсичностью для печени.
Подавление синтеза фермента используют для лечения острых порфирий, биохимическая основа которых заключается в повышенной выработке аминолевулинатсинтетазы. Гематин подавляет синтез этого фермента и быстро снимает острые приступы порфирии.
Возмещение фермента
Успехи современной энзимологии позволяют выделить этот раздел в патогенетическом лечении наследственных болезней. Это вмешательство на уровне первичного белкового продукта гена, поскольку замена гена еще невозможна. Современные методы: позволяют получить такое количество активного фермента для экспериментальных и клинических целей, которое необходимо для его восполнения при определенных наследственных болезнях. Выше разбирались случаи возмещающей терапии: гормоны при эндокринопатиях, антигемофильный глобулин при гемофилии, γ-глобулин при агаммаглобулинемии. По такому же принципу точного соответствия недостающего продукта строится стратегия ферментотерапии.
Главный вопрос современных разработок в области ферментотерапии - это методы доставки фермента в клетки-мишени и субклеточные образования, вовлеченные в патологию обмена.
Рабочая гипотеза экзогенного введения фермента основывалась на том, что лизосомы часто являются местом патологического процесса и в то же время играют основную роль в клеточном метаболизме. Возможность доставки ферментов в лизосомы, сохранение их активности в клетке и взаимодействие с субстратом были проверены в опытах с культурами фибробластов, полученных от лиц с различными лизосомными болезнями накопления. Ферменты, введенные в культуральную среду, улучшали обмен соответствующего соединения. Такая коррекция продемонстрирована при различных гликосфинголипидозах, мукополисахаридозах, гликогенозах и гликопротеинозах. Опыты показали, что возможно возмещение фермента, который проникает внутрь клетки, достигает лизосом и нормализует превращение субстрата. Однако внутримышечное, внутривенное и внутритрахеальное введение ферментов, полученных из грибов или органов крупного рогатого скота, ослабленным больным с гликогенозом, мукополисахаридозами, метахроматической лейкодистрофией и болезнью Фабри не дало серьезных положительных результатов. Следовательно, в стратегии ферментотерапии надо было определить основные направления, которые в суммарном виде представлены ниже.
1. Возможность получения достаточного количества стабильных, неиммуногенных и стерильных ферментов с высокой специфической активностью.
2. Защита введенной активности от биотрансформации и иммунного надзора, а также доставка фермента в ткань-мишень и субклеточные образования, вовлеченные в патологический процесс.
3. Модельная проверка на млекопитающих для оценки и выбора наилучшей стратегии ферментотерапии.
4. Соответствующим образом запланированные и разрешенные биохимические и клинические испытания на больных.
В 70-х годах XX века была показана возможность получения ферментов из тканей человека и разработаны системы наблюдений за судьбой ферментов в организме млекопитающих. Первые клинические испытания были проведены при различных лизосомных нарушениях. Это были GМ2-ганглиозидоз (β-гексозаминидаза А из мочи), гликогеноз II типа (плацентарная α-галактозидаза), болезнь Фабри (плацентарная α-галактозидаза), болезнь Гоше (плацентарная β-глюкозидаза). Перед клиническим испытанием было установлено, что высокоочищенные ферменты человека гидролизуют естественный субстрат. Проверка показала, что ферменты при внутривенном или подкожном введении обнаруживаются в печеночной ткани. При этом концентрация ферментов в крови уменьшается, а в печени повышается. Однако они не проникают в мозг из-за барьерных функций мозговых оболочек. Отсюда следует вывод о специфической доставке ферментов в клетки-мишени при каждой болезни. Их доставка в разные клеточные структуры может потребовать специфической очистки или какой-либо химической модификации фермента.
В разработке методов лечения наследственных болезней ферментами в первую очередь надо ориентироваться на патогенетические механизмы болезней: в каких клетках, каким путем и в какой форме откладывается субстрат реакции, с одной стороны, и каким путем фермент в норме достигает субстрата, каковы промежуточные стадии обмена - с другой. Именно вмешательство в патофизиологический механизм, ответственный за синтез субстрата, распределение и накопление его можно использовать с терапевтической целью: в одних случаях надо увеличить время циркуляции фермента в крови, в других - способствовать доставке фермента в строго определенные клетки.
Из анализа первичной клеточной патологии при различных лизосомных болезнях накопления видно, что даже близкие по сути заболевания отличаются друг от друга.
Первичный дефект локализуется в нейронах (сфинголипидозы, гликопротеинозы), в клетках ретикулоэндотелиальной системы (болезнь Нимана-Пика, болезнь Гоше), эндотелии, шванновских клетках, поперечно-полосатой мускулатуре.
Экспериментальные разработки в области ферментотерапии наследственных болезней позволили объективно оценивать захват молекул фермента рецепторами, гепатоцитами, клетками ретикулоэндотелиальной системы, фибробластами, клетками эндотелия сосудов и т.д. Это увеличило возможности направленных разработок лечения наследственных болезней, в первую очередь с использованием новых методов доставки ферментов к клеткам-мишеням в синтетических пузырьках-носителях или микрокапсулах-липосомах либо в естественных элементах - аутологичных эритроцитах. Такие методы доставки разрабатываются для лечения не только наследственных болезней, но и другой патологии. Направленная доставка лекарственных веществ в органы, ткани и клетки является актуальной проблемой для медицины в целом.
Современные успехи физико-химической биологии позволяют создавать новые формы микроинкапсулированных ферментных препаратов (опосредованная доставка) или обеспечить более полный захват циркулирующего в крови фермента рецепторами клеток-мишеней (опосредованная рецепция).
Липосомы представляют собой многослойный пузырек с чередующимися водными и липидными слоями. При формировании липосом можно изменять заряд стенки, их величину, число слоев. К мембране липосом можно пришить антитела к клеткам-мишеням, что обеспечит более точную доставку липосом. Липосомы, нагруженные ферментами, при различных путях введения хорошо захватываются клетками. Их липидная оболочка разрушается эндогенной липазой, а освободившийся фермент взаимодействует с субстратом.
Наряду с созданием искусственных носителей липосом разрабатывают методы нагрузки эритроцитов ферментами. При этом можно использовать гомологичные или даже аутологичные эритроциты. Нагрузка ферментами может осуществляться путем либо гипотонизации, или диализа, или с помощью хлорпромазининдуцированного эндоцитоза.
Перспективы лечения наследственных болезней возмещением ферментов зависят от успехов энзимологии, клеточной инженерии, физико-химической биологии. Новые подходы должны обеспечить выделение высокоочищенных ферментов из специфических тканей человека, введение их в активной форме в клетку путем опосредованной рецепции или опосредованной доставки, предупреждение биоинактивации, исключение иммунных реакций. Уже имеются подходы к решению каждой из этих задач, поэтому
можно надеяться на еще более успешное развитие ферментотерапии наследственных болезней.
Хирургическое лечение
Хирургическое лечение наследственных болезней занимает существенное место в системе медицинской помощи больным. Это связано с тем, что, во-первых, многие формы наследственной патологии сопровождаются морфогенетическими отклонениями, включая пороки развития. Во-вторых, расширение возможностей хирургической техники сделало доступными многие трудные операции. В-третьих, реанимация и интенсивная терапия сохраняют жизнь новорожденным с наследственными болезнями, а такие пациенты нуждаются в последующей хирургической помощи.
Хирургическая помощь больным с наследственной патологией в общем виде включает удаление, коррекцию, трансплантацию. Операции часто направлены на устранение симптомов болезни. Однако в некоторых случаях хирургическая помощь выходит за рамки симптоматического лечения, приближаясь по эффекту к патогенетическому лечению. Например, для изменения пути патологического превращения субстратов патологических реакций можно использовать хирургическое шунтирование. При гликогенозах I и III типов делают анастомоз между воротной и нижней полой венами. Это позволяет части глюкозы после всасывания в кишечнике обходить печень и не откладываться в ней в виде гликогена. Аналогичный обходной путь предложен при семейной гиперхолестеринемии (тип IIа) - анастомоз между тощей и подвздошной кишками. Это приводит к снижению всасывания холестерина.
Примерами общехирургических видов лечения могут быть операция по поводу наследственного полипоза толстой кишки (ее удаление), спленэктомия при гемоглобинопатиях, удаление глаза при ретинобластоме, почки при опухоли Вильмса и др. В ряде случаев хирургическое лечение является частью комплексной терапии. Например, при муковисцидозе возможен меконеальный илеус у новорожденных, в процессе развития болезни встречается пневмоторакс. И то и другое устраняется хирургическим путем.
Большое место в лечении наследственных болезней занимает реконструктивная хирургия: при незаращении верхней губы, врож-
денных пороках сердца, атрезии отделов ЖКТ, гипоспадии, для коррекции костно-мышечной системы и т.д.
Трансплантация органов и тканей как метод лечения наследственных болезней все больше входит в практику. Аллотрансплантация может рассматриваться как передача нормальной генетической информации пациенту с нарушением обмена веществ. Такой подход предполагает пересадку клеток, тканей и органов, содержащих нормальную ДНК, для продукции активных ферментов или других продуктов гена у реципиента. Он особенно эффективен тогда, когда патологический процесс ограничен одним органом или тканью, которые и пересаживают. Некоторые авторы развивают даже концепцию ферментной трансплантации клеток, ткани или органа. На самом деле эффект трансплантации сложнее и вряд ли ограничивается только синтезом недостающего фермента.
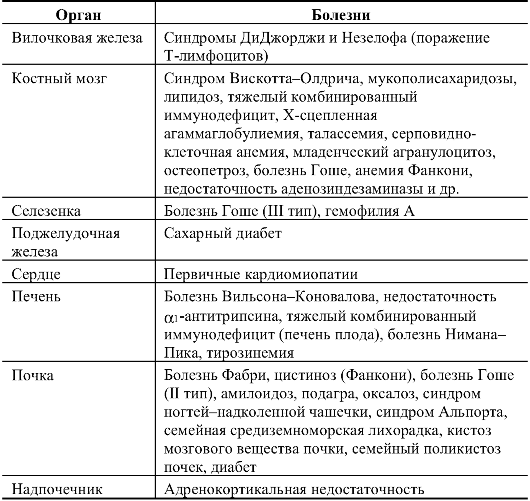
Аллотрансплантация уже выполняется при разных наследственных болезнях и позволяет непрерывно восполнять недостаток фермента, гормона, иммунных функций или эффективно предохранять орган от функциональных нарушений, обусловленных мутацией структурного гена. В табл. 9.4 перечислены наследственные болезни, при которых применяется аллотрансплантация.
Современная трансплантология обладает большими возможностями, и ее успехи можно использовать в лечении наследственных болезней. Имеются многочисленные сообщения об успешных пересадках органов (костного мозга, вилочковой железы, печени плода, донорской печени, поджелудочной железы, селезенки и особенно почки) при упомянутых в табл. 9.4 состояниях. Трансплантация исправляет патологические механизмы наследственных нарушений.
Помимо пересадки органов разрабатываются методы пересадки клеток, функция которых занимает ключевое место в патогенезе наследственных нарушений обмена.
При мукополисахаридозах производят подкожную подсадку культивированных фибробластов от нормальных людей. Эти клетки секретируют ферменты и исправляют нарушенный обмен гликозаминогликанов (мукополисахаридов). Как долго пересаженные клетки будут сохранять такую активность и какое их количество требуется для хорошего лечебного эффекта, предстоит еще выяснить. Можно проводить соответствующие эксперименты на животных, поскольку мукополисахаридозы обнаружены у кошек.
Таблица 9.4. Применение аллотрансплантации для патогенетического лечения наследственных болезней
 В
заключение следует обратить внимание на огромные возможности
хирургического лечения наследственных болезней, используемые еще не в
полной мере. В этом плане весьма перспективны микрохирургия и
эндоскопическая хирургия.
В
заключение следует обратить внимание на огромные возможности
хирургического лечения наследственных болезней, используемые еще не в
полной мере. В этом плане весьма перспективны микрохирургия и
эндоскопическая хирургия.
Этиотропное лечение
Этиотропное лечение любых болезней оптимально, поскольку оно устраняет первопричину заболевания и в результате полностью его излечивает. Несмотря на успехи симптоматической и па-
тогенетической терапии наследственных болезней, вопрос об их этиотропном лечении не снимается. Чем глубже будут знания в области теоретической биологии, тем чаще будет подниматься вопрос о радикальном лечении наследственных болезней.
Однако устранение причины наследственной болезни означает такое серьезное маневрирование с генетической информацией у человека, как доставка нормального гена в клетку, выключение мутантного гена, обратная мутация патологического аллеля. Эти задачи достаточно трудны даже при вмешательствах у простейших организмов. К тому же, чтобы провести этиотропное лечение какой-либо наследственной болезни, надо изменить структуру ДНК не в одной клетке, а во многих функционирующих клетках (и только в функционирующих!). Прежде всего для этого нужно знать, какое изменение произошло в гене в результате мутации, т.е. наследственная болезнь должна быть описана в химических формулах.
Сложности этиотропного лечения наследственных болезней очевидны, хотя уже имеются многочисленные возможности для их преодоления, создаваемые успешной разработкой проекта «Геном человека» и новым направлением в теоретической и клинической медицине - генной терапией. Под этим термином понимается доставка нового генетического материала в клетки индивида, обеспечивающая терапевтический эффект.
Несколько принципиальных открытий в генетике и молекулярной биологии создали предпосылки для разработки и клинической проверки методов этиотропного лечения наследственных болезней (генная терапия).
В экспериментах с РНК- и ДНК-содержащими вирусами опухолей (начало 70-х годов) выявлена способность вирусов переносить гены в трансформированные клетки и сформулирована концепция использования вирусов как переносчиков генов, другими словами, концепция создания векторной системы (рекомбинантная ДНК). Успех, достигнутый в экспериментах с рекомбинантной ДНК, уже к середине 70-х годов обеспечил почти неограниченные возможности в изоляции генов эукариот (в том числе и человека) и манипуляции с ними. В начале 80-х годов была доказана высокая эффективность переноса генов на основе векторных систем в клетки млекопитающих in vitro и in vivo.
Принципиальные вопросы генной терапии у человека решены. Во-первых, гены можно изолировать вместе с фланкирующими (пограничными) областями, содержащими в себе по меньшей мере важные регуляторные последовательности. Во-вторых, изолиро-
ванные гены нетрудно встроить в чужеродные клетки. «Хирургия» трансплантации генов многообразна.
Условия генной терапии разрабатывались удивительно быстро. Первый протокол генной терапии у человека был составлен в 1987 г., был проверен в 1989 г., а с 1990 г. уже началась генная терапия больных. Общие представления об этих этапах и направлениях генной терапии наследственных болезней представлены на рис. 9.5. Безусловно, это общая схема, составляющие которой могут меняться. Осуществление генной терапии возможно двумя путями: через трансгеноз изолированных из организма соматических клеток in vitro или через прямой трансгеноз клеток в организме.
Трансгеноз (перенос генетического материала) in vitro направлен на соматические клетки-мишени, заранее выделенные из организма (например, резекция печени, культура лимфоцитов, пункция костного мозга, культура фибробластов, опухолевые клетки). Для введения ДНК в клетки млекопитающих уже опробованы многие подходы: химические (микропреципитаты фосфата кальция, DEAE-декстран, диметилсульфоксид); слияние клеток (микроклеток, протопластов); физические (микроинъекции, электропорация, лазерная микроинъекция); вирусные (ретровирусы, аденовирусы, аденоассоциированные виру-
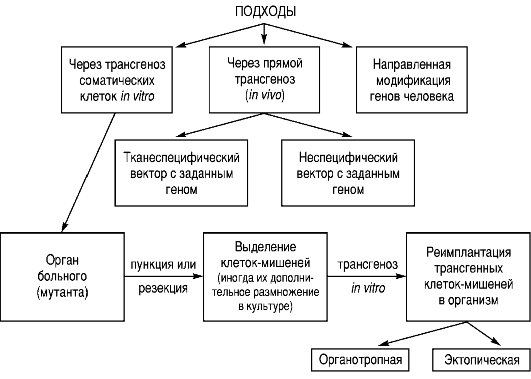 Рис. 9.5. Генно-инженерные подходы к лечению наследственной патологии.
Рис. 9.5. Генно-инженерные подходы к лечению наследственной патологии.
сы). Многие невирусные методы малоэффективны (за исключением электропорации и лазерной микроинъекции). Наиболее эффективными переносчиками ДНК в клетки являются «природные шприцы» - вирусы. Однако совершенствование невирусных методов нужно продолжать, чтобы в случае необходимости полностью исключить введение ненужного генетического материала.
Процедура трансгеноза клеток должна заканчиваться проверкой ее успешности. Трансгеноз можно считать успешным, если не менее 5% всех обработанных клеток будут иметь введенный генетический материал.
Конечная процедура генной терапии через трансгеноз соматических клеток in vitro - это реимплантация трансгенных клетокмишеней. Она может быть органотропной (печеночные клетки вводят через воротную вену) или эктопической (клетки костного мозга вводят через периферическую вену).
Прямой трансгеноз (in vivo) осуществляется следующим образом. Создают рекомбинантный генетический вектор с заданным геном, необходимым для лечения. Вектор может быть тканеспецифическим (органотропным) или неспецифическим. Его вводят в достаточном количестве. В клетках-мишенях или в любых клетках происходит трансгеноз с помощью рекомбинантного вектора.
Изложенные выше принципы проверены в экспериментах на культурах клеток и животных. Совершенствование этих принципов продолжается. Разрабатываются также другие подходы к генной терапии: методы направленной модификации генов и супрессии конкретных мутаций.
Генная терапия была принята в клинической практике быстрее, чем ожидали. Варианты профилактического применения генной терапии можно показать на примере трех болезней.
Недостаточность аденозиндезаминазы. Девочка 4 лет (США) страдала редкой наследственной болезнью - первичным иммунодефицитом (тяжелая комбинированная форма), обусловленным мутацией в гене аденозиндезаминазы (ADA). Все 4 года девочка жила в стерильном боксе. (Пациенты с этим заболеванием не переносят никаких контактов с любой инфекцией из-за тотального отсутствия иммунитета.)
Лимфоциты больной заранее были отделены от остальных элементов крови, Т-лимфоциты стимулированы к росту. Затем in vitro в них был введен ген ADA с помощью ретровирусного вектора. Приготовленные таким образом «генно-инженерные» лимфоциты были возвращены в кровоток.
Указанное событие произошло 14 сентября 1990 г., и эта дата считается днем рождения реальной генной терапии. С этого года стал выходить журнал «Генная терапия».
Из протокола клинического испытания стало ясно, что, во-первых, лимфоциты пациентов с тяжелым иммунодефицитом могут быть изолированы, выращены в лабораторных условиях, в них можно ввести ген, а затем возвратить в кровоток больного. Вовторых, лечение больной было эффективно. Общее количество лимфоцитов возросло до нормального уровня, а количество ADA- белка в Т-клетках увеличилось до 25% нормы. В-третьих, в течение 6 мес перед очередным курсом лечения число «генно-инженерных» лимфоцитов и ADA-фермента в клетках оставалось постоянным. Из стерильного бокса девочку перевезли домой (рис. 9.6).
Выбор болезни для начала использования генотерапии был хорошо продуман. Ген ADA к этому времени был клонирован, имел средние размеры, хорошо встраивался в ретровирусные векторы. Ранее при трансплантации костного мозга при ADA-недо- статочности было показано, что ключевую роль в болезни играют Т-лимфоциты. Следовательно, на эти клетки-мишени должна быть направлена генотерапия. Важным моментом стало то, что функционирование иммунной системы возможно при уровне ADA- белка 5-10% контрольного. Наконец, ADA-«генно-инженерные» Т-лимфоциты имели селективное преимущество перед их исходными дефектными клетками,
Семейная гиперхолестеринемия. Рецепторы ЛПНП, играющих ключевую роль в обмене холестерина, синтезируются в клетках печени. Соответственно на гепатоциты (клетки-мишени) должна быть направлена генотерапия. Одна попытка такого лечения сделана в США у женщины 29 лет с резко выраженным атеросклерозом венечных
 Рис. 9.6. Первые
две девочки, леченные методом генной терапии по поводу тяжелого
комбинированного первичного иммунодефицита, обусловленного
недостаточностью аденозиндезаминазы (примерно через 2,5 года после
начала лечения).
Рис. 9.6. Первые
две девочки, леченные методом генной терапии по поводу тяжелого
комбинированного первичного иммунодефицита, обусловленного
недостаточностью аденозиндезаминазы (примерно через 2,5 года после
начала лечения).
артерий. Эффект предыдущего хирургического шунтирования уже сошел на нет. Брат больной умер от такой же болезни, не дожив до 30 лет. Генотерапия больной была проведена в несколько этапов.
Больной была сделана частичная (около 15%) гепатэктомия. Удаленную долю печени промыли раствором коллагеназы для разделения гепатоцитов. Получили около 6 млн гепатоцитов. Затем эти клетки выращивали в 800 культуральных чашках на питательной среде. Во время роста в культуре для включения нормального гена ЛПНП использовали ретровирусный вектор как передающий агент. Трансгенные гепатоциты были собраны и введены пациентке через катетер в воротную вену (чтобы клетки достигли печени). Через несколько месяцев при биопсии печени обнаружили, что в некоторых клетках функционирует новый ген. Содержание ЛПНП в крови упало на 15-30%. Улучшение состояния больной позволило проводить лечение только лекарствами, снижающими уровень холестерина.
Рак. Необычайно быстрый прогресс в изучении генома человека и методов генной инженерии позволяет развивать генную терапию не только для моногенно наследуемых болезней, но и для таких мультифакториальных болезней, как рак. Генная терапия злокачественных новообразований уже начата, хотя на ее пути много трудностей, обусловленных необходимостью обеспечения селективности, специфичности, чувствительности и безопасности переноса генов. В настоящее время применяется следующая стратегия генотерапии рака: повышение иммуногенности опухоли путем вставки цитокиновых генов, генов, кодирующих главный комплекс гистосовместимости, лимфоцитарных лигандов; направленная доставка (векторирование) опухолевидных цитокинов в клетки, которые в пределах опухоли локально могут реализовать токсические эффекты (например, в лимфоциты, инфильтрующие опухоли); использование опухолеспецифических пролекарственных активаторов, т.е. вставка ферментативно пролекарственно-активирующих генов, сливающихся с промоторными системами, которые реализуются через дифференциально контролируемую (идеально опухолеспецифическую) транскрипцию; введение маркирующих генов, которые могут обеспечивать выявление минимально оставленных после операции или разрастающихся опухолей; искусственная репрессия функций генов путем вставки генов, кодирующих комплементарную (антисмысловую) мРНК репрессируемого гена (онкогены, гены лекарственной резистентности).
Небольшое число попыток генотерапии злокачественных опухолей связано с введением в клетки резецированной опухоли генов
интерлейкина-2 или фактора некроза опухоли. Затем эти клетки вводят подкожно в область бедра. Через 3 нед удаляют регионарный лимфатический узел (для места введения смеси трансгенных опухолевых клеток). Культивируют Т-лимфоциты, выделенные из этого узла. Кроме того, размножают лимфоциты из опухоли (опухольинфильтрирующие). Пациенту вводят общую массу лимфоцитов, что обеспечивает иммунную реакцию на опухолевые клетки. Так лечили больных злокачественной меланомой, раком почки, запущенным раком разных органов.
Как видно из приведенных выше примеров, эра генотерапии человека уже началась. Определены принципы и методические подходы генотерапии, отобраны болезни, потенциально подлежащие этому лечению. Работа продолжается одновременно в разных странах и в различных направлениях. Уже очевидно, что генотерапия будет применяться для лечения не только наследственных болезней, но и злокачественных опухолей и хронических вирусных инфекций.
Вместе с тем необходимо отметить, что применять эти методы надо крайне осторожно (это относится именно к применению, а не к разработке!). Это особенно важно при лечении наследственных болезней (особенно расширенном), даже если будут еще более решительные прорывы в способах доставки генов в клеткимишени. Необходимо внимательно наблюдать за отдельными результатами лечения и строго соблюдать этические и деонтологические принципы.
Генетика человека еще не располагает достаточными сведениями о многообразных особенностях функционирования генетического аппарата. Еще неизвестно, как он будет работать при введении дополнительной генетической информации даже в небольшом количестве.
Итак, лечение наследственных болезней - необычайно трудная задача, не всегда эффективно решаемая. Несмотря на это, оно должно быть постоянным и настойчивым. Нестойкость, а часто и недостаточная выраженность эффектов терапии не означают отказа от ее постоянного проведения не только с клинической точки зрения, но и по деонтологическим соображениям.
В США и Канаде проведена оценка комплексного лечения 65 наследственных болезней обмена. Методы лечения были разные: предупреждение накопления субстрата (33% болезней), возмещение продукта (25%), возмещение фермента и кофермента (15%), трансплантация органов и тканей (22%).
Таблица 9.5. Результаты (в % общего числа) лечения наследственных болезней обмена
 Из
табл. 9.5 видно, что за 10 лет не изменился процент болезней, лечение
которых оказалось успешным. В эту группу входят такие болезни обмена,
как дисахаридазная непереносимость фруктозы, гликогеноз VII типа,
гипербилирубинемия, недостаточность трипсиногена и др. Увеличилось число
болезней с умеренно положительным результатом лечения. В эту группу
входят галактоземия, гликогенозы (I и IV типы), цистиноз,
гепатолентикулярная дегенерация, гомоцистинурия, адреногенитальный
синдром, наследственные формы гипотиреоза и т.д. Некоторые болезни не
ответили на лечение, но за 10 лет их число уменьшилось. К этой группе
относятся альбинизм, алкаптонурия, ганглиозидозы, липидоз, болезнь
Нимана-Пика и др.
Из
табл. 9.5 видно, что за 10 лет не изменился процент болезней, лечение
которых оказалось успешным. В эту группу входят такие болезни обмена,
как дисахаридазная непереносимость фруктозы, гликогеноз VII типа,
гипербилирубинемия, недостаточность трипсиногена и др. Увеличилось число
болезней с умеренно положительным результатом лечения. В эту группу
входят галактоземия, гликогенозы (I и IV типы), цистиноз,
гепатолентикулярная дегенерация, гомоцистинурия, адреногенитальный
синдром, наследственные формы гипотиреоза и т.д. Некоторые болезни не
ответили на лечение, но за 10 лет их число уменьшилось. К этой группе
относятся альбинизм, алкаптонурия, ганглиозидозы, липидоз, болезнь
Нимана-Пика и др.
В целом улучшение после лечения коснулось продолжительности жизни, репродуктивной способности, соматического развития, развития познавательных способностей, обучения в школе, трудоустройства, устранения эстетических недостатков.
Таким образом, отмечается определенный прогресс в лечении наследственных болезней обмена, но это, безусловно, только частичный прогресс. Должны развиваться методы генной терапии, пересадки органов и тканей, фармакотерапии, методы улучшения поддерживающих систем для восстановления нормального гомеостаза.
Ключевые слова и понятия
Виды симптоматического лечения
Генная терапия (общая схема)
Генная терапия злокачественных новообразований
Генная терапия моногенных болезней (примеры)
Евфеника
Концепция вырождающихся семей Коррекция обмена на уровне продукта Коррекция обмена на уровне субстрата
Негативная евгеника
Примеры лекарственного симптоматического лечения
Принципы патогенетического лечения
Трансгеноз
Ферментотерапия наследственных болезней Хирургические методы лечения
Контрольные вопросы
1. В настоящее время наиболее часто применяется терапия наследственных болезней:
а) симптоматическая;
б) патогенетическая;
в) этиотропная.
2. Поддаются коррекции специальными диетами:
а) нейрофиброматоз;
б) фенилкетонурия;
в) муковисцидоз;
г) галактоземия;
д) умственная отсталость с ломкой Х-хромосомой.
3. Метаболическая ингибиция как один из видов коррекции обмена включает:
а) ограничение поступления вещества с пищей;
б) выведение из организма субстрата патологической реакции;
в) снижение интенсивности синтеза патологического субстрата;
г) защиту органов от поступления избыточных количеств продуктов ка-
таболизма.
4. Разработка генной терапии наследственного заболевания возможна при:
а) условии, что мутантный ген должен быть идентифицирован и секвенирован;
б) отсутствии другого эффективного лечения;
в) аутосомно-рецессивном типе наследования болезни;
г) возрасте манифестации болезни не ранее 5 лет;
д) знании патогенеза болезни для определения мишени генной терапии.
5. Верно утверждение:
а) при трансгенозе соматических клеток происходит замена аномального гена нормальным, при трансгенозе зародышевых клеток добавляется нормальный ген;
б) трансгеноз соматических клеток, в отличие от трансгеноза зародышевых, не отражается на генотипе потомства больного;
в) трансгеноз соматических клеток осуществляется постнатально, зародышевых - пренатально;
г) после трансгеноза соматических клеток, в отличие от трансгеноза за-
родышевых, требуется пожизненная иммуносупрессивная терапия;
д) трансгеноз соматических клеток может применяться только при моногенных заболеваниях, зародышевых клеток - еще и при хромосомных и мультифакториальных болезнях.
6. Относительно трансплантации органов и тканей как метода лечения наслед-
ственных заболеваний верны утверждения:
а) помимо пересадки органов, можно пересаживать отдельные клетки, участвующие в патогенезе болезней обмена;
б) трансплантацию костного мозга от здорового индивидуума его сибсу с наследственным заболеванием можно расценивать как трансгеноз зародышевых клеток;
в) при наследственных болезнях отторжение пересаженного органа про-
исходит редко, так как аномальный генотип препятствует реакции трансплантат против хозяина;
г) пересаженный донорский орган через некоторое время также может
поражаться наследственным заболеванием.
7. К какому подходу в лечении наследственных заболеваний можно отнести примеры:
- назначение соматотропного гормона ребенку с наследственной формой карликовости вследствие сниженной функции гипофиза;
- назначение фенобарбитала для профилактики судорог у ребенка с гипераммониемией вследствие недостаточности орнитинтранскарбамилазы;
- назначение больших доз витаминов ребенку с умственной отсталостью вследствие хромосомной аномалии;
- назначение D-пеницилламина для связывания внутриклеточных ионов меди при синдроме Вильсона-Коновалова;
- пересадка печени больному семейной гиперхолестеринемией;
- назначение карнитина ребенку с органической ацидемией для образования эфиров карнитина и их выведения;
- назначение диеты без молочных и кисломолочных продуктов при галактоземии;
а) диетическое ограничение;
б) альтернативные пути обмена;
в) усиленное выведение субстрата;
г) возмещение продукта;
д) ничего из перечисленного.