Клиническая фармакология: избранные лекции / С.В. Оковитый, В.В. Гайворонская, А.Н. Куликов, С.Н. Шуленин. - 2009. - 608 с.
|
|
|
|
ЛЕКЦИЯ 4 КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ АНТИАРИТМИЧЕСКИХ СРЕДСТВ
Аритмии сердца объединяют большое число разнообразных нарушений возникновения и распространения электрического возбуждения в сердце. Классификация аритмий достаточно обширна и сложна, но с клинической точки зрения особенно важны те нарушения ритма, которые могут привести либо к критическому замедлению ритма вплоть до остановки сердечной деятельности (брадиаритмии), либо к угрожающему жизни ускорению ритма сердца (тахиаритмии).
Классификация аритмий сердца
1. Нарушения автоматизма:
1.1. Изменения автоматизма синусного узла:
• Синусовая тахикардия.
• Синусовая брадикардия.
• Синусовая аритмия.
1.2. Активность латентных водителей ритма (наджелудочковых, желудочковых):
• Медленные выскальзывающие комплексы и ритмы.
• Ускоренные выскальзывающие комплексы и ритмы.
• Миграция суправентрикулярного водителя ритма.
• Атриовентрикулярная диссоциация (полная, неполная).
2. Экстрасистолии:
2.1. Наджелудочковые экстрасистолы (предсердные, из АВ-соединения).
2.2. Желудочковые экстрасистолы.
3. Тахиаритмии:
3.1. Наджелудочковые тахиаритмии (пароксизмальные и хронические):
3.1.1. Предсердные тахикардии:
• Синусовая реципрокная пароксизмальная тахикардия.
• Предсердная реципрокная тахикардия.
• Предсердная очаговая (фокусная) тахикардия.
• Многоочаговая («хаотическая») предсердная тахикардия.
• Предсердная тахикардия с АВ-блокадой II степени.
3.1.2. Тахикардии из АВ-соединения:
• АВ-узловая реципрокная тахикардия.
• Очаговая (фокусная) тахикардия из АВ-соединения.
3.1.3. Предсердно-желудочковые (АВ) реципрокные тахикардии (наличие дополнительных путей проведения):
• АВ-реципрокные тахикардии с узкими комплексами QRS (в том числе ортодромная АВ-реципрокная тахикардия при синдроме WPW):
• АВ-реципрокная тахикардия с широкими комплексами QRS (в том числе антидромная АВ-реципрокная тахикардия при синдроме WPW).
3.1.4. Фибрилляция и трепетание предсердий. 3.2. Желудочковые тахиаритмии:
3.2.1. Желудочковая тахикардия (мономорфная, полиморфная).
3.2.2. Фибрилляция и трепетаниежелудочков.
4. Блокады, остановка синусного узла:
4.1. Остановка (отказ) синусного узла.
4.2. Синоатриальная блокада.
4.3. Межпредсердные блокады и синовентрикулярное проведение.
4.4. Атриовентрикулярные блокады.
4.5. Внутрижелудочковые блокады.
5. Синдромыпредвозбуждения желудочков:
5.1. Феномен WPW.
5.2. Предвозбуждение по волокнам Махейма.
6. Парасистолии.
Для лечения и профилактики тахиаритмий используют антиаритмические средства (ААС), хотя коренные изменения в этой области внесли нефармакологические (электрические и хирургические) методы лечения. Лечение тяжелых брадиаритмий осуществляется преимущественно методами электрической кардиостимуляции.
4.1. КРАТКИЕ ОСНОВЫ ЭЛЕКТРОФИЗИОЛОГИИ СЕРДЦА
Образование и упорядоченное проведение электрического импульса к миокарду обеспечивают структуры специализированной проводящей системы, клетки которой, в отличие от обычных кардиомиоцитов, обладают в норме не только возбудимостью и проводимостью, но и способностью к спонтанной генерации ритмических импульсов - автоматизмом.
Источником автоматизма, вызывающим последовательное возбуждение всех отделов сердца, является синусовый (синоатриальный) узел - первичный водитель ритма. Импульс из синусового узла вызывает возбуждение (деполяризацию) миокарда предсердий, распространяясь по трактам Бахмана, Венкебаха и Тореля; проходит к желудочкам через атриовентрикулярный узел (АВУ), в котором движение волны возбуждения существенно замедляется. Далее возбуждение распространяется по стволу предсердно-желудочкового пучка (пучка Гиса), его левой и правой ножкам и, наконец, по мельчайшим волокнам Пуркинье, разветвляющимся в миокарде желудочков. Деполяризация миокарда благодаря специализированной проводящей системе происходит быстро, в строгой последовательности, и идет в направлении от эндокарда к эпикарду желудочков. Реполяризация - возвращение клеток в исходное невозбужденное состояние - протекает медленнее и движется в направлении от эпикарда к эндокарду.
На обычной ЭКГ возбуждение структур проводящей системы не отражается; деполяризация предсердий проявляется зубцом Р, реполяризация предсердий обычно не видна; деполяризация желудочков проявляется комплексом QRS; а реполяризация желудочков - зубцом Т; интервал PQ отражает время, необходимое для проведения возбуждения от САУ к миокарду желудочков - АВ-проведение (через предсердия, АВУ и систему Гиса-Пуркинье); интервал QT охватывает деполяризацию и реполяризацию желудочков, поэтому называется электрической систолой; интервалы РР и RR в норме отражают автоматизм синусного узла (рис. 4.1).
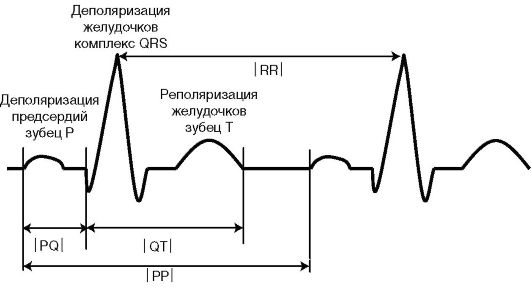
Рис. 4.1. Происхождение зубцов и интервалов ЭКГ
Электрические свойства клеток возбудимой ткани сердца определяются характером их трансмембранного потенциала действия (ПД). ПД возникает тогда, когда деполяризация клеточной мембраны достигнет определенного порога, по принципу «все или ничего». Сам ПД - результат активных трансмембранных ионных потоков через специфические каналы.
ПД кардиомиоцита состоит из следующих фаз (рис. 4.2):
0 - фаза деполяризации (быстрый вход ионов Na+ внутрь клетки);
1 - фаза начальной реполяризации (начало выхода ионов К+ из клетки);
2 - фаза медленной реполяризации или «плато»: (вход ионов Са2+ внутрь клетки, уравновешивающий выход ионов К+);
3 - фаза быстрой реполяризации (выход ионов К+, восстанавливающий исходный потенциал клетки);
4 - фаза полной реполяризации (восстановление баланса ионов: обмен К+ на Na+ и Na+ на Са2+).
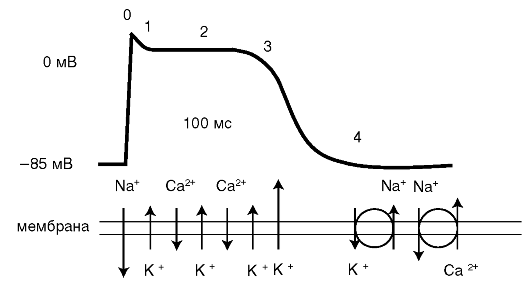
Рис. 4.2. Потенциал действия кардиомиоцита и трансмембранные ионные потоки (упрощенная схема) (Катцунг Б. Г., 1998)
Особенности ПД в клетках, обладающих автоматизмом (Р-клетки САУ и АВУ), заключаются в том, что в 4-ю фазу происходит постепенное уменьшение отрицательного потенциала - спонтанная диа- столическая деполяризация, вызывающая при достижении порога спайк-фазу О ПД, скорость которой существенно ниже, чем в мышечных клетках («пологая деполяризация). Затем деполяризация плавно
переходит в реполяризацию так, что отдельные фазы ПД трудно разграничить (рис. 4.3). В отличие от кардиомиоцитов, деполяризация автоматических клеток создается не быстрыми натриевыми каналами, а медленными входящими токами ионов натрия и калия (If), а также - кальция (1Са).
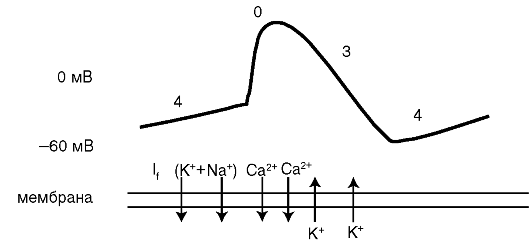
Рис. 4.3. Потенциалдействия клетки синусового узла. Здесь и далее: 0-4 - фазы потенциала действия
Большинство ААС блокируют те или иные ионные каналы, вызывая соответствующие изменения ПД и, следовательно - изменения электрических свойств миокарда и проводящей системы.
Каким же образом ПД определяет электрические свойства ткани? От скорости изменения потенциала в фазу деполяризации (фаза 0) зависит скорость дальнейшей передачи возбуждения - скорость проведения. От длительности и характера реполяризации (фазы 1-3) зависит рефрактерный период - интервал времени, в течение которого клетка полностью или частично утрачивает способность к возбуждению в ответ на электрический стимул. Скорость спонтанной диастолической деполяризации в фазу 4 для клеток САУ и АВУ определяет их автоматизм - частоту ритмической генерации импульсов.
На ЭКГ уменьшение скорости деполяризации - это замедление проведения, которое на уровне предсердий может проявляться рас- ширением зубца Р, на уровне АВУ и системы Гиса-Пуркинье - удлинением интервала PQ, на уровне желудочков - расширением и, нередко, деформацией комплекса QRS - развитием блокады проведения (рис. 4.4). Замедление реполяризации (удлинение рефрактерного периода желудочков) проявляется удлинением QT за счет конечной части желудочкового комплекса - сегмента ST, зубца Τ и часто волны U (см. рис. 4.4).
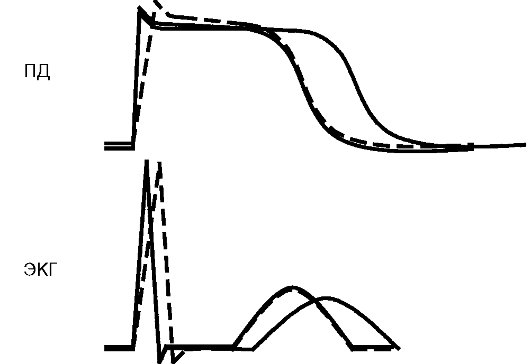
Рис. 4.4. Корреляции между трансмембранным ПД и ЭКГ: сплошная линия - норма, фаза 0 соответствует QRS на ЭКГ, фазы 1-3 определяют длительность QT - электрической систолы сердца; прерывистая линия - замедление фазы 0 приводит к замедлению внутрижелудочкового проведения - расширению QRS; пунктирная линия - замедление фаз 1-3 приво- диткудлинению QT
4.2. ОСНОВНЫЕ МЕХАНИЗМЫ ФОРМИРОВАНИЯ АРИТМИЙ
М. С. Кушаковский (2004) объединяет всевозможные причины аритмий в три класса:
I. Сдвиги регуляции электрических процессов в специализированных и сократительных клетках миокарда нейрогенной или эндокринной (гуморальной) природы.
II. Органические изменения миокарда: болезни миокарда, его аномалии, врожденные или наследственные дефекты с повреждением электрогенных мембран или разрушением клеточных структур.
III. Сочетанные регуляторные и органические причины. Электрофизиологические механизмы возникновения аритмий в
общем виде представлены нарушениями образования импульса, нарушениями проведения импульса, комбинированными нарушениями образования и проведения импульса.
Механизмы возникновения аритмий (по Waldo A. L., WitA. L., 1993):
Нормальное и патологическое образование импульсов
Автоматизм: Нормальный автоматизм:
• Спонтанные аритмии из синусового узла.
• Эктопические спонтанные ритмы. Патологический автоматизм.
Триггерныеритмы:
• Ранние постдеполяризации.
• Поздние постдеполяризации
Патологическое проведение импульсов
• Блокада проведения.
• Однонаправленная блокада и re-entry.
• Рефлексия (отражение).
Одновременное нарушение образования и проведения импульсов
• Парасистолия.
• Блокада 4-й фазыдеполяризации.
Среди многочисленных и постоянно дополняемых механизмов тахиаритмий наибольшее значение в клинической практике имеют сле- дующие: изменения автоматизма, триггерные ритмы и re-entry.
Ускорение ритма вследствие повышения автоматизма синусового узла, предсердий, АВ-соединения или желудочков вызывает так называемые автоматические тахикардии. Частота их встречаемости составляет менее 10%, основной причиной выступают нарушения обмена и нейроэндокринной регуляции (ишемия миокарда, гипоксемия, электролитные расстройства - гипокалиемия, гипомагниемия, нарушения кислотно-основного баланса, гиперсимпатикотония, гиперкатехоламинения). Типичные примеры таких нарушений - многоочаговая предсердная тахикардия при обострении хронических заболеваний легких (гипоксемия), желудочковые аритмии в первые часы инфаркта миокарда (ишемия, гиперкатехоламинемия). Как правило, автоматические аритмии возникают при острых состояниях и разрешаются по мере их купирования вследствие ликвидации этиологического фактора. Обычно специфической антиаритмической терапии не требуют.
Триггерные ритмы. Если аномальный автоматизм - следствие частичной деполяризации мембраны, то триггерные ритмы - результат
неполной реполяризации. Триггерная (наведенная) активность это подпороговые деполяризации мембраны во 2-3-ю фазы ПД (ранние постдеполяризации) или в самом начале 4-й фазы ПД (поздние постде- поляризации). Если вторичная деполяризация достигает порога, возникает внеочередной ПД или их серия, проявляющаяся тахикардией. Ранние постдеполяризации провоцируются замедлением реполяризации (удлинением ПД - удлинением QT) и брадикардией, поэтому их часто называют зависимыми от паузы. Есть данные в пользу того, что именно ранние постдеполяризации - вероятный электрофизиологический механизм двунаправленной веретенообразной полиморфной желудочковой тахикардии типа пируэт (torsades de pointes). Такое осложнение нередко возникает при лечении ААС, удлиняющими QT (препараты IA и III классов).
Поздние деполяризации провоцируются учащением ритма, поэтому их называют катехолзависимыми, амплитуду поздних депо- ляризаций увеличивает высокая концентрация кальция в клетках. Считают, что наджелудочковые и желудочковые аритмии при интоксикации сердечными гликозидами, а также предсердные тахикардии на фоне гиперкатехоламинемии обусловлены этим триггерным механизмом.
Лечение триггерных аритмий чаще всего заключается в ликвидации провоцирующих факторов (устранение пауз, отмена антиаритмических препаратов IA, 1С и III классов для брадизависимых; отмена сердечных гликозидов и назначение β-адероблокаторов для тахизависимых).
Re-entry, или повторный вход импульса с последующим его круговым движением, - механизм большинства клинически значимых тахиаритмий. Условие возникновения - электрическая неоднородность миокарда, при которой два условно параллельных проводящих пути (соединенные проксимально и дистально через проводящую ткань) имеют различные рефрактерные периоды и скорости проведения. Если внеочередной импульс (экстрасистола) возникнет тогда, когда путь с более коротким рефрактерным периодом уже восстановился после очередной деполяризации, возбуждение станет медленно распространяться по нему антероградно до тех пор, пока волокно с более длинным рефрактерным периодом не восстановит способности воспринять импульс, который будет проведен в обратном направлении. Таким образом, возбуждение вернется к исходной точке, где круг замкнется, так как волокно с коротким рефрактерным периодом уже восстановит способность к повторному антероградному проведению
импульса. Формируется источник частой импульсации, которая, распространяясь на окружающий миокард, может захватить контроль над ритмом сердца. Выделяют макрориентри, имеющие, как правило, фиксированный анатомический субстрат в виде препятствия, вокруг которого движется импульс, и микрориентри - «случайные» функциональные круги циркуляции возбуждения, часто множественные. Тахиаритмии, в основе которых лежит re-entry, называют реципрокными, это механизм как наджелудочковых, так и большинства желудочковых аритмий, включая фибрилляцию и трепетание предсердий и желудочков.
ААС могут эффективно подавлять реципрокные аритмии путем выравнивания рефрактерных периодов либо скоростей проведения антеро- и ретроградного путей петли, поскольку ее существование возможно только при определенном соотношении этих параметров. Не менее эффективны электрические воздействия на re-entry (кардиоверсия, дефибрилляция) или хирургическая деструкция, прерывающая круг циркуляции импульса.
4.3. АНТИАРИТМИЧЕСКИЕ СРЕДСТВА
Классификация антиаритмических средств
В настоящее время существуют две классификации ААС: традиционная по Е. Vaughan-Williams (1969) и так называемый сицилианский гамбит (1994). Первая классификация, несмотря на очевидные ограничения, сохраняет свою актуальность и сейчас благодаря компактности, принципу построения (влияние ААС на ионные каналы и рецепторы мембран) и традиции. Сицилианский гамбит предложен с целью устранения недостатков предыдущей системы, таких как: наличие препаратов, не вошедших в нее, не- возможность четкой классификации отдельных ААС, отсутствие характеристики важных дополнительных эффектов и свойств ААС. Между тем, создание большой таблицы, учитывающей все известные особенности действия ААС, не является классификацией в строгом смысле слова, так как не имеет единого принципа построения. Это скорее справочник, позволяющий индивидуализировать лечение пациента.
Таким образом, аналитические достоинства сицилианского гамбита не вполне компенсируют его громоздкость и невозможность
практических обобщений, касающихся ААС. Поэтому при несомненной ценности, эта классификация еще редко используется в клинической практике.
Классификация антиаритмических средств (Vaughan-Williams Ε., 1969, с изменениями и дополнениями)
I класс - средства, блокирующие натриевые каналы - замедляющие деполяризацию:
ΙΑ - умеренное замедление деполяризации и реполяризации:
• Хинидин, прокаинамид, дизопирамид, аймалин.
IB - минимальное замедление деполяризации, укорочение реполяризации:
• Лидокаин, тримекаин, мексилетин, токаинид, дифенилгидантоин, карбамазепин.
IС - выраженное замедление деполяризации, минимальное - реполяризации:
• Флекаинид, энкаинид, лоркаинид, пропафенон, этмозин, этацизин, аллапинин.
Пкласс - блокаторы β-адренергических рецепторов:
• Пропранолол, метопролол, атенолол, эсмолол, надолол, L-co- талол* и др.
III класс - средства, блокирующие калиевые каналы - замедляющие реполяризацию:
• Амиодарон, D-соталол*, ибутилид, дофетилид, бретилий, тедисамил, азимилид, дронедарон, нибентан.
IV класс - блокаторы кальциевых каналов - замедление автоматизма иАВ-проведения:
• Верапамил, дилтиазем, бепридил, галлопамил, тиапамил.
Лекарственные средства, обладающие антиаритмическими свойствами, не вошедшие в классификацию Е. Vaughan-Williams
I. Препараты с первичным антиаритмическим действием:
• Аденозин и аденозина трифосфат (АТФ) - активаторы калиевых каналов.
• Алиндин - блокатор хлорного тока.
• Ивабрадин - ингибитор If-каналов (медленного тока натрия и калия).
• Сердечные гликозиды (дигоксин, строфантин).
* В составе препарата соталол (смесь L-соталола и D-соталола).
• Электролиты (препараты калия, магния).
II. Препараты со вторичным антиаритмическим действием:
• Ингибиторы ангиотензинпревращающего фермента (каптоприл, эналаприл и пр.).
• Статины (симвастатин, аторвастатин и пр.).
• Полиненасыщенныежирные кислоты (омакор).
Лекарственные средства для лечения брадиаритмий (не предназначены для лечения органических дисфункций САУ и АВУ)
• М-холиноблокаторы:
- атропин, препараты красавки.
• Дигидропиридиновые блокаторы кальциевых каналов:
- нифедипин, амлодипин, фелодипин.
• Ингибиторы фосфодиэстеразы:
- теофиллин.
Нефармакологические методы лечения аритмий
Электрическое воздействие:
• Кардиоверсия/Дефибрилляция (наружная, чреспищеводная, внутрисердечная).
• Имплантация кардиовертера-дефибриллятора.
• Электрокардиостимуляция (временная и постоянная). Физическое воздействие (радиочастотная аблация, криоили лазерная деструкция, иссечение очага аритмии):
• Деструкция аритмогенных зон (ДПП, каналов петли re-entry, очагов аритмии).
• Изоляция аритмогенного очага (аблация АВУ, изоляция предсердия и пр.).
• Иссечение аритмогенного участка миокарда (пластика аневризмы и т. д.).
Характеристики отдельных антиаритмических средств
Антиаритмические средства I класса
Объединяющее свойство этого класса - блокада быстрых натриевых каналов, что проявляется уменьшением скорости деполяризации (фазы О ПД) и, следовательно, уменьшением скорости проведения в предсердиях и желудочках, угнетением анормального автоматизма кардиомиоцитов (торможение натрий-опосредованной спонтанной диастолической реполяризации), снижением порога возбудимости миокарда. На ЭКГ это действие может проявляться расширением зуб-
ца Ρ и комплекса QRS. Причина разделения AAC I класса на три подкласса - характер влияния на реполяризацию - длительность ПД. Препараты ΙΑ класса умеренно удлиняют ПД, средства IB класса - укорачивают ПД, средства IС класса - не влияют не него.
Препараты I класса могут приводить к увеличению смертности у лиц с аритмиями, вызванными болезнями сердца, поэтому их не используют для лечения нарушений ритма при тяжелых органических поражениях миокарда и высоком риске внезапной смерти. Между тем, AAC I класса остаются средствами второго ряда при купировании опасных аритмий, а также при лечении и профилактике аритмий у лиц без тяжелой органической патологии сердца.
Антиаритмические средства IA класса
Общие свойства
• Блокада натриевых и калиевых каналов (умеренная).
• Замедление деполяризации (фаза 0) и реполяризации (фазы 1-3) - удлинение ПД (рис. 4.5).
• Удлинение (расширение) комплекса QRS и интервала QT.
• Замедление проведения (умеренное) и увеличение рефрактерности миокарда (умеренное).
• Угнетение анормального автоматизма (слабое).
• Неоднозначное влияние на функцию САУ и АВУ: обычно - увеличение автоматизма САУ и скорости проведения в АВУ (ваголитический эффект), при исходной дисфункции САУ или АВУ - прямое угнетение их функции.
• Типичные проаритмии - ЖТ по типу пируэт (следствие удлинения QT) и реципрокные ЖТ (следствие нарушения проведения).
• Эффективность при наджелудочковых и желудочковых тахиаритмиях, умеренная.
Хинидин [сульфат и бисульфат (Кинидин дурулес, Кинилентин), глюконат (Хинаглют), полигалактуронат (Кардиохин)] замедляет проведение по предсердиям, желудочкам, системе Гиса-Пуркинье и в ДПП, понижает их возбудимость, подавляет очаги ненормального автоматизма. Вызывает расширение зубца Р, интервала PQ, комплекса QRS и интервала QТ на ЭКГ. Препарат оказывает ваголитическое дейс-
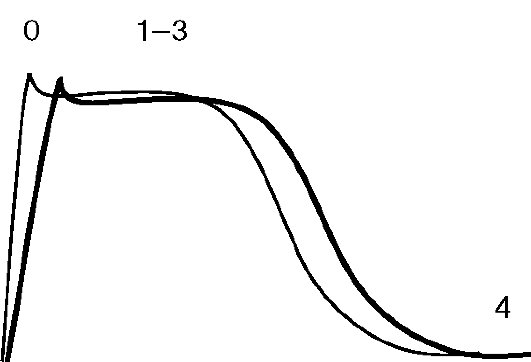
Рис. 4.5. Влияние препаратов IA класса на ПД кардиомиоцита: тонкая линия - ПД в норме; жирная линия - изменения ПД под влиянием AAC IA класса
твие по отношению к САУ и АВУ, что может проявляться учащением синусового ритма (средние дозы хинидина), ускоренным проведением через АВУ с увеличением частоты желудочковых сокращений при мерцательной аритмии или ТП. α-адренолитический эффект (гипотензия, рефлекторная тахикардия) и слабая кардиодепрессия наблюдаются при внутривенном введении (используется редко из-за плохого контроля гемодинамики).
Применяют хинидин для купирования и профилактики фибрилляции предсердий (ФП) и трепетания предсердий (ТП), купирования наджелудочковых тахикардий (НЖТ) и желудочковых тахикардий (ЖТ) (табл. 4.1). При купировании ФП и ТП хинидин обычно комбинируют с верапамилом для исключения резкого учащения желудочкового ритма (хинидина сульфат 200 мг 3-4 раза в сутки или хинидина бисульфат 250 мг 2-3 в сутки + верапамил 40-80 мг 3-4 раза в сутки). При первом применении хинидина для исключения идиосинкразии дается пробная доза (1 таблетка внутрь) и проводится наблюдение в течение нескольких часов.
Фармакокинетика антиаритмических средств представлена в табл. 4.2.
Кардиальные и некардиальные побочные эффекты и осложнения при использовании хинидина могут развиваться в 50% случаев (табл. 4.3). Токсическое действие препарата наиболее вероятно при его концентрации в плазме > 5 мкг/мл, а его предвестниками являются расширение комплекса QRS ≥ 30% от исходного и удлинение QT> 25% от исходного.
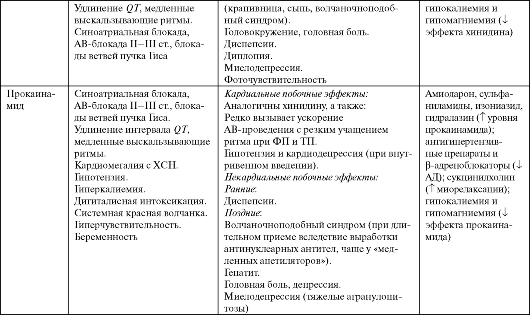
Прокаинамид (Новокаинамид, Пронестил) оказывает ваголитическое действие по отношению к САУ и АВУ, которое выражено слабее, чем у хинидина. α-Адренолитический эффект (вазодилатация с гипотензией) и кардиодепрессия наблюдаются только при внутривенном введении. Прокаинамид реже, чем хинидин вызывает внезапную смерть. Повышает порог фибрилляции желудочков (ФЖ).
Применяют препарат по тем же показаниям, что и хинидин (см. табл. 4.1). В качестве средства второго ряда прокаинамид используют при купировании ЖТ, резистентных к другим ААС, при постоянных ЖТ.
Дизопирамид (Ритмилен, Ритмодан, Норпейс) обладает выраженным системным ваголитическим эффектом, в том числе по отношению к САУ и АВУ (превосходит хинидин), и значительно угнетает сократимость миокарда. У больных с инфарктом миокарда препарат не увеличивает смертность, но повышает частоту развития ХСН. Применяют дизопирамид для лечения и профилактики желудочковых аритмий у пациентов без тяжелых органических поражений миокарда (см. табл. 4.1).
Таблица 4.1. Рекомендуемые дозы, кратность назначения и отдельные фармакокинетические параметры антиаритми- ческих средств IA класса
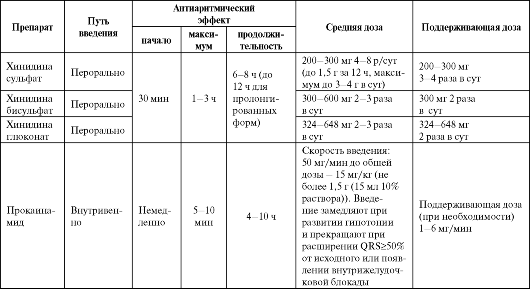
Окончание таблицы 4.1

Таблица 4.2. Фармакокинетика некоторых антиаритмических средств
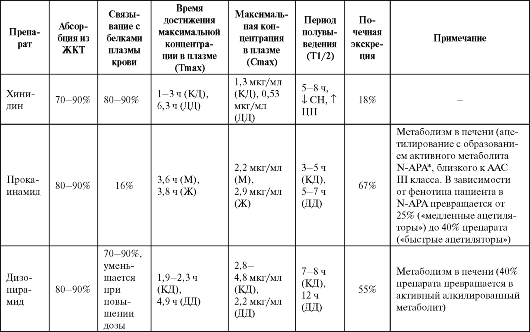
Продолжение таблицы 4.2
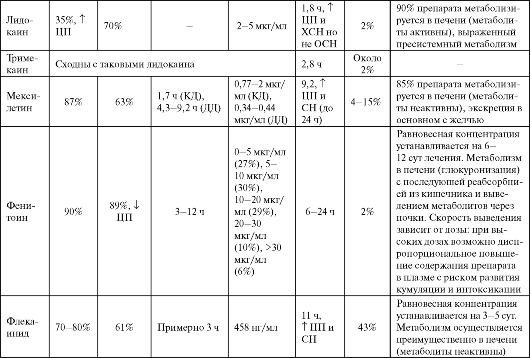
Продолжение табл. 4.2
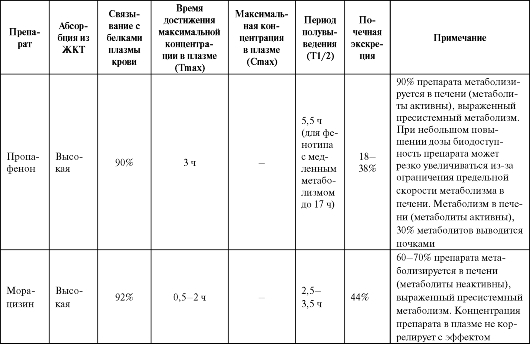
Продолжение таблицы 4.2
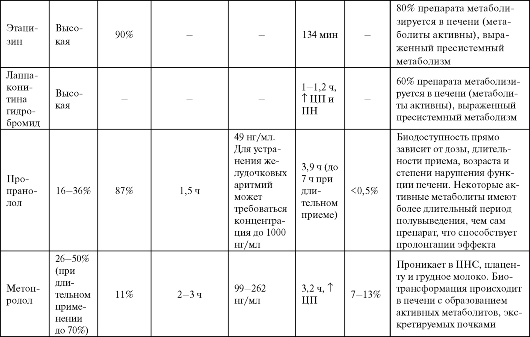
Продолжение табл. 4.2
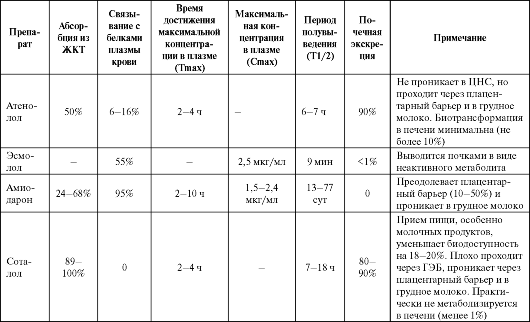
Продолжение таблицы 4.2
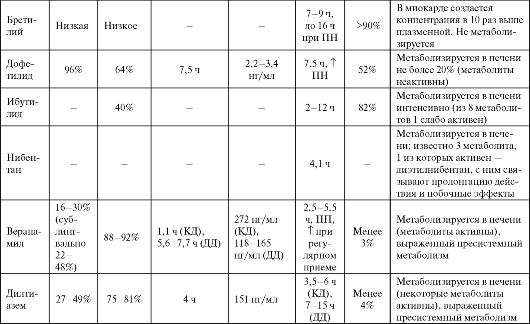
Окончание табл. 4.2

Примечание: * - Ν-ΑΡΑ - N-ацетилпрокаинамид; СН - сердечная недостаточность; ЦП - цирроз печени; ПН - почечная недостаточность; КД - лекарственная форма короткого действия; ДД - лекарственная форма длительного действия; Μ - мужчины; Ж - женщины.
Таблица 4.3. Побочные эффекты, противопоказания к применению и лекарственные взаимодействия некоторых антиаритмических средств

Продолжение таблицы 4.3
Продолжение табл. 4.3
Продолжение таблицы 4.3
Продолжение табл. 4.3
Продолжение таблицы 4.3
Продолжение табл. 4.3
Продолжение таблицы 4.3

Продолжение табл. 4.3
Продолжение таблицы 4.3
Окончание табл. 4.3
Окончание таблицы 4.3
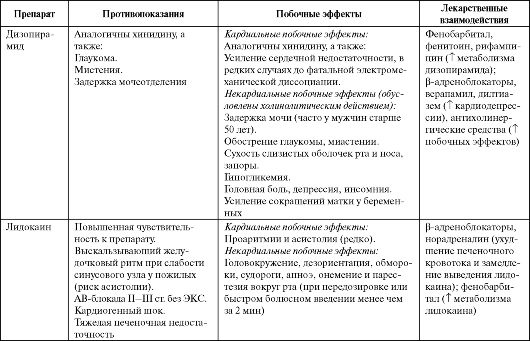
Побочные эффекты, противопоказания к применению и лекарственные взаимодействия ААС IA класса представлены в табл. 4.3.
Антиаритмические средства IB класса
Общие свойства
• Блокада натриевых каналов (инактивированных) слабая, но выражена в поврежденной или ишемизированной аритмогенной ткани, при учащении ритма.
• Замедление деполяризации, преимущественно в очаге аритмии.
• Укорочение реполяризации (фазы 1-3) - укорочение ПД (рис. 4.6).
• Отсутствие значимых изменений Р, PQ, QRS; QT укорачивается или не изменяется.
• Замедление проведения в аритмогенной зоне при желудочковых аритмиях (значительное).
• Отсутствие влияния на САУ, АВУ и миокард предсердий из-за более короткого ПД в предсердиях.
• Подавление нормального и анормального автоматизма в желудочках (умеренное).
• Уменьшение рефрактерности миокарда желудочков (слабое).
• Подавление поздних постдеполяризаций (слабое).
• Угнетение триггерных ритмов в волокнах Пуркинье за счет укорочения ПД (умеренное).
• Высокая эффективность при реципрокных желудочковых тахикардиях.
• Низкая эффективность при наджелудочковых тахиаритмиях (за исключением аритмий при гликозидной интоксикации).
• Низкая вероятность возникновения проаритмии и отсутствие кардиодепрессии.
Лидокаин (Ксилокаин, Ксикаин). Является амидным местным анестетиком. Не вызывает замедления деполяризации и соответственно - скорости проведения в нормальной ткани, но при ишемии, гипокалиемии, частом ритме замедляет проведение и укорачивает рефрактерный период, преимущественно в желудочках (следствие блокады инактивированных натриевых каналов), подавляет автоматизм в желудочках (что может вызвать асистолию при выскальзываю-
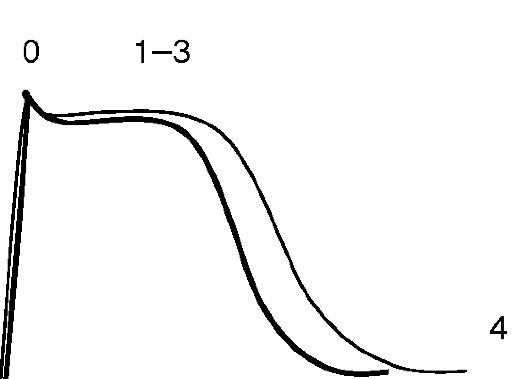
Рис. 4.6. Влияние препаратов IB класса на ПД кардиомиоцита: тонкая линия - ПД в норме; жирная линия - изменения ПД под влиянием ААС IB класса
щем желудочковом ритме). Подавляет не только поздние, но и ранние постдеполяризации. При этом он гемодинамически нейтрален, не вызывает кардиодепрессии.
Применяют лидокаин для купирования желудочковых аритмий у больных с инфарктом миокарда, при операциях на сердце (табл. 4.4). Препарат предотвращает рецидивы ЖТ/ФЖ при инфаркте миокарда, но не снижает летальность при профилактическом введении.
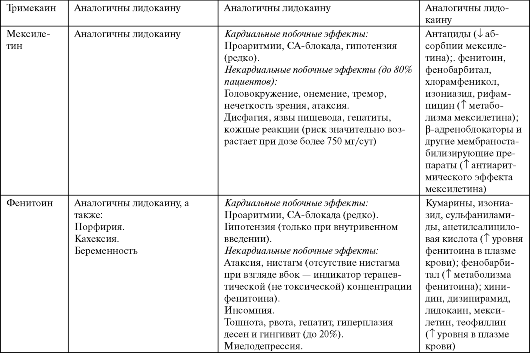
Близким по фармакокинетике и фармакодинамике к лидокаину является тримекаин (Мезокаин), однако при лечении желудочковых аритмий он уступает лидокаину.
Мексилетин (Мекситил, Риталмекс) представляет собой производное лидокаина для приема внутрь. По эффективности приближается к ААС IA класса при лечении желудочковых аритмий у больных после инфаркта миокарда, но не влияет на летальность после ИМ (возможно, увеличивает ее).
Применяют мексилетин для профилактики и лечения желудочковых аритмий, главным образом - лечение симптомных желудочковой экстрасистолии и неустойчивой ЖТ (см. табл. 4.4).
Фенитоин (Дифенин, Дифенилгидантоин) применяется в основном как противосудорожный препарат. Его антиаритмические свойства напоминают лидокаин, однако есть особенность - опосредованный центральный антиадренергический эффект. Показан при желудоч- ковых аритмиях у больных эпилепсией, желудочковых аритмиях при операциях по поводу врожденных пороков сердца (см. табл. 4.4).
Побочные эффекты, противопоказания к применению и лекарственные взаимодействия ААС IB класса представлены в табл. 4.3.
Антиаритмические средства IС класса
Общие свойства
• Блокада натриевых каналов выраженная.
• Замедление деполяризации (фаза 0), реполяризация не изменяется (фазы 1-3) (рис. 4.7).
• На ЭКГ возможны: расширение зубца Р, удлинение интервала PQ, расширение комплекса QRS; интервал QT не изменяется или несколько удлиняется (за счет расширения комплекса QRS).
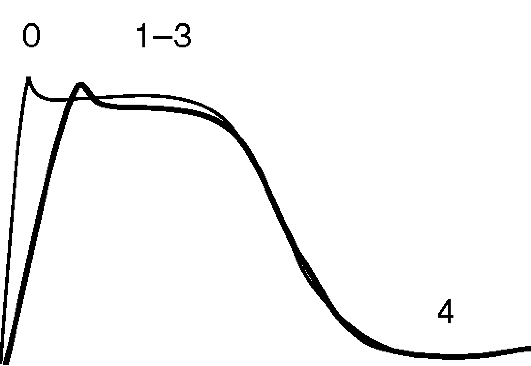
Рис. 4.7. Влияние препаратов IС класса на ПД кардиомиоцита: тон- кая линия - ПД в норме; жирная линия - изменения ПД под влиянием ААС IС класса
Таблица 4.4. Рекомендуемые дозы, кратность назначения и отдельные фармакокинетические параметры антиаритмических средств IB класса
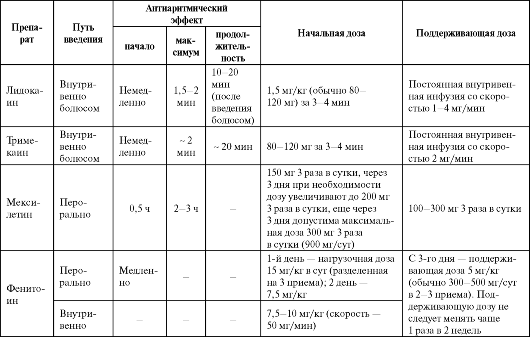
• Замедление проведения в миокарде предсердий, желудочков и проводящей системе (значительное).
• Высокая эффективность при наджелудочковых и желудочковых тахиаритмиях.
• Угнетение сократимости миокарда - кардиодепрессия.
• Высокий аритмогенный потенциал - провокация реципрокных ЖТ.
• Увеличивают смертность при лечении аритмий у больных с постинфарктным кардиосклерозом, значительной дилатацией камер сердца, внутрижелудочковыми блокадами.
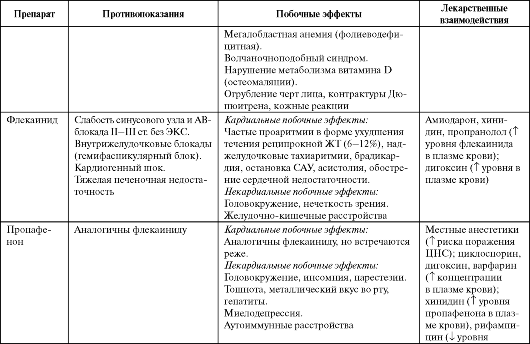
Флекаинид (Тамбокор) замедляет проведение в миокарде предсердий, желудочков и клетках проводящей системы (при любой частоте сердечных сокращений) с дозозависимым удлинением PQ и QRS. Мало влияет на автоматизм синусового узла, но замедляет время восстановления его функции. Селективно снижает ретроградное проведение по дополнительным путям проведения (ДПП) и АВУ
Препарат применяют для купирования и профилактики ФП и ТП у больных без тяжелых заболеваний сердца, купирования опасных желудочковых аритмий, резистентных к лечению другими средствами (табл. 4.5). В то же время следует избегать назначения флекаинида у больных, перенесших инфаркт миокарда, с выраженным снижением сократимости миокарда, дилатацией камер сердца, тяжелой ХСН. Это обусловлено способностью флекаинида, подобно другим препаратам IС группы, снижать сократимость миокарда, а при продолжительном применении переводить эпизоды ишемии миокарда в эпизоды фиб- рилляции желудочков, повышая риск внезапной смерти у больных, перенесших инфаркт миокарда.
Пропафенон (Пропанорм, Ритмонорм), как и все средства IС класса, замедляет проведение в миокарде предсердий, желудочков и клетках проводящей системы, удлиняя PQ и QRS. Степень блокады нарастает с увеличением ЧСС. Однако пропафенон удлиняет эффективный рефрактерный период предсердий, АВ-узла, в ДПП и в желудочках (в меньшей мере). Кроме того, он обладает слабыми свойствами β-адреноблокатора и блокатора кальциевых каналов. Снижает сократимость миокарда в меньшей степени, чем флекаинид и дизопирамид. Считается относительно более безопасным, чем флекаинид.
Пропафенон применяют по тем же показаниям, что и флекаинид (см. табл. 4.5), часто используют для купирования АВ-реципрокных (синдром WPW) и АВ-узловых реципрокных тахикардий.
Таблица 4.5. Рекомендуемые дозы, кратность назначения и отдельные фармакокинетические параметры антиаритми- ческих средств IС класса
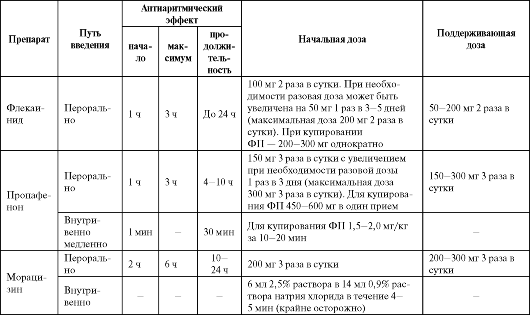
Окончание таблицы 4.5
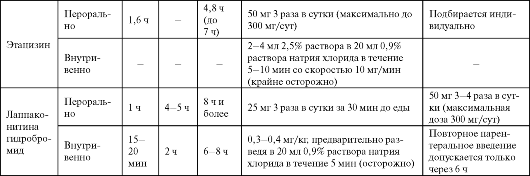
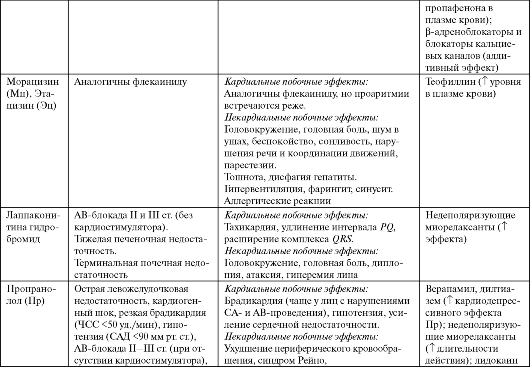
Морацизин (Этмозин) является производным фенотиазитна и, как и все средства IС класса, замедляет проведение в миокарде предсердий, желудочков и клетках проводящей системы, однако по активности уступает флекаиниду и пропафенону. Кроме того, морацизин укорачивает ПД, а следовательно - рефрактерные периоды в миокарде желудочков. Поэтому препарат часто относят к смешанному классу IB-IС (укорачивает реполярзацию, меньше угнетает деполяризацию). Обнаруживает слабый кардиодепресивный эффект (меньше, чем у флекаинида).
Применяют по тем же показаниям, что и флекаинид (см. табл. 4.5). При лечении ЖТ превосходит препараты IB группы, но уступает IС. Ограничения в применении морацизина те же, что и для других пред- ставителей IС класса (см. табл. 4.3), хотя в целом препарат переносится хорошо.
Этацизин сходен по структуре с морацизином, а по свойствам бли- зок к препаратам IС класса. Основное антиаритмическое действие этацизина обусловлено блокадой быстрых натриевых каналов, а также замедлением их восстановления. Способен умеренно блокировать медленные кальциевые каналы. Вызывает типичные для IС класса изменения ЭКГ. Эффективность и безопасность этацизина изучены недостаточно.
Лаппаконитина гидробромид (Аллапинин) выделен из растения Aconitum leucostomum. Электрофизиологическое действие препарата сходно с другими представителями IС класса: замедляет проводимость в предсердиях и желудочках, при этом не влияет на антеградное проведение в АВУ и длительность QT. Не оказывает значимого влияния на ЧСС, АД, сократимость миокарда (в отсутствие ХСН). Имеет умеренное холинолитическое, спазмолитическое, коронаролитическое и седативное действие.
Побочные эффекты, противопоказания к применению и лекарственные взаимодействия ААС IС класса представлены в табл. 4.3.
Антиаритмические средства II класса (β-адреноблокаторы)
Антиаритмическое действие β-адреноблокаторов обусловлено блокадой аритмогенных эффектов катехоламинов. При умеренной способности к подавлению аритмий БАБ оказались очень эффективными в предупреждении жизнеопасных нарушений ритма и профилактике внезапной смерти у широкого круга пациентов. Это единственный класс ААС, безоговорочно доказавший свою способность улучшать прогноз при желудочковых аритмиях у больных с тяжелыми пораже-
ниями миокарда и без таковых. В отличие от других классов ААС, все представители БАБ имеют одинаковый механизм антиаритмического действия.
Электрофизиологические эффекты БАБ выражены там, где в наибольшей степени представлены адренергические рецепторы. Это САУ и АВУ, в которых подавление 4-й фазы ПД (спонтанная диастолическая деполяризация) приводит к замедлению автоматизма, проведения и удлинению рефрактерных периодов, что проявляется на ЭКГ урежением ритма и замедлением АВ-проводимос- ти (удлинение PQ). В нормальном сердце проведение в САУ мало подвержено действию БАБ, но при патологии эти средства могут вызывать СА-блокаду. БАБ мало влияют на скорость проведения и рефрактерность миокарда предсердий и желудочков, но проявляют выраженные эффекты в ишемизированном или поврежденном миокарде. Так, уменьшение ишемии под действием БАБ снижает риск последующих аритмий; кроме того, БАБ повышают порог ФЖ и препятствуют образованию re-entry путем сглаживания регионарных различий автономной иннервации миокарда. Некоторые БАБ обладают мембраностабилизирующими свойствами, но они проявляются за пределами терапевтических доз и не актуальны в клинической практике. БАБ особенно эффективны при аритмиях, провоцируемых ишемией, физической нагрузкой, стрессом и гиперкатехоламинемией (введение адреномиметиков, тиреотоксикоз).
Общие показания к назначению β-адреноблокаторов при аритмиях
• Наджелудочковые тахиаритмии:
- лечение и профилактика синусовой тахикардии, пароксизмов синусовой реципрокной, АВ-реципрокной и АВ-узловой реципрокной тахикардий;
- контроль ЧСС при хронических очаговых тахикардиях, ФП и ТП;
- профилактика ФТ и ТП, провоцируемых повышенным симпатотонусом.
• Желудочковые аритмии:
- профилактика желудочковой экстрасистолии и ЖТ, вызванных физической нагрузкой;
- профилактика внезапной смерти (ЖТ и ФЖ) во время и после инфаркта миокарда;
- профилактика внезапной смерти у больных с гипертрофической кардиомиопатией;
- профилактика внезапной смерти у лиц с врожденным длинным интервалом QT;
- лечение наджелудочковых и желудочковых нарушений ритма при интоксикации дигиталисом.
БАБ повышают выживаемость пациентов с желудочковыми аритмиями.
Многочисленные эффекты БАБ не ограничиваются антиаритмическим действием. Эта группа лекарств занимает одно из центральных мест в лечении любых форм ИБС, артериальной гипертензии (АГ) и хронической сердечной недостаточности (ХСН). БАБ убедительно доказали свою способность положительно влиять на прогноз при этих состояниях. Кроме того, БАБ назначают пациентам с гипертрофической кардиомиопатией, при треморе, для профилактики головной боли при мигрени и пр.
Общие свойства ААС II класса - β-адреноблокаторов
• Блокада β-адренорецепторов.
• Замедление спонтанной диастолической деполяризации (фаза 4) и увеличение рефрактерного периода в САУ и АВУ (рис. 4.8).
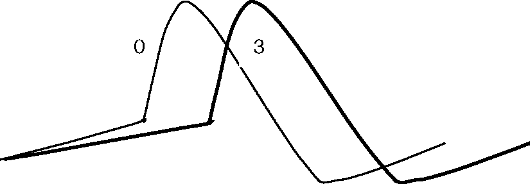
Рис. 4.8. Влияние препаратов II класса на ПД САУ и АВУ:
тонкая линия - исходный ПД; жирная линия - изменения ПД под влиянием β-адреноблокаторов
• На ЭКГ - удлинение интервала PQ.
• Угнетение автоматизма САУ и АВУ
• Угнетение проведения в АВУ (САУ).
• Увеличение эффективных рефрактерных периодов САУ и АВУ
• Отсутствие желудочковых проаритмий (возможны брадиаритмии).
• Эффективность при наджелудочковых и желудочковых тахиаритмиях.
• Способность предупреждать желудочковые тахиаритмии и внезапную смерть, в том числе у больных с органическими поражениями миокарда (ИБС, ХСН и пр.).
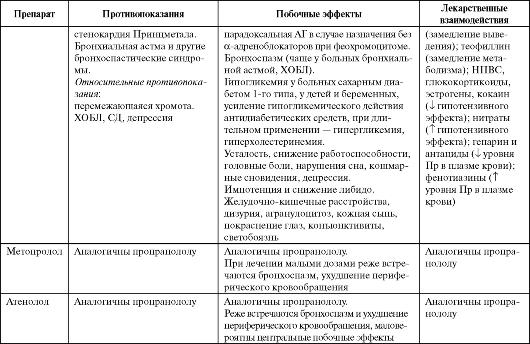
Пропранолол (Анаприлин, Индерал, Обзидан) является по сути эталонным β-адреноблокатором. Препарат представляет собой рацемическую смесь, при этом L-изомер в 100 раз активнее D-изоме- ра, в то время как клиренс L-изомера на 18% меньше, чем D-изомера. Пропранолол обладает мембраностабилизирующим эффектом.
Метопролол представлен как формами короткого действия в виде метопролола тартрата (Вазокардин, Эгилок), так и пролонгированными формами метопролола тартрата (беталок дурулес, эгилок ретард) или метопролола сукцината (Беталок ЗОК, Топрал XL). Это липофильный β1-селективный адреноблокатор с мембраностабилизирующим эффектом, по селективности метопролол несколько уступает атенололу. Так же, как и пропранолол, является рацематом, в котором L-изомер более активен.
Атенолол (Бетакард, Тенормин) является гидрофильным β1-селективным адреноблокатором. Не обладает мембраностабилизирующей активностью.
Эсмолол (Бревиблок) - гидрофильный β1-селективный адреноблокатор ультракороткого действия для внутривенного введения. Не обладает мембраностабилизирующей активностью. Удобен для создания контролируемой β-адренергической блокады (если высока вероятность побочных явлений). Сильнее, чем пропранолол снижает систолическое АД. Дозы эсмолола 50-200 мг эквивалентны 3-6 мг пропранолола при внутривенном введении.
Эсмолол применяют при различных аритмиях (в том числе для контроля частоты ритма при ФП и ТП), упорной синусовой тахикар- дии, артериальной гипертензии у пациентов отделений интенсивной терапии, а также в пред- и послеоперационный периоды; персистирующей ишемии при высоком риске осложнений терапии БАБ.
Рекомендуемые дозы, кратность назначения и отдельные фармакокинетические параметры ААС II класса представлены в табл. 4.6.
Побочные эффекты, противопоказания к применению и лекарственные взаимодействия ААС II класса представлены в табл. 4.3.
Антиаритмические средства III класса
Объединяющее свойство этого класса - блокада калиевых каналов, что проявляется замедлением реполяризации (фазы 1-3 ПД), следовательно, увеличением эффективных рефрактерных периодов
Таблица 4.6. Рекомендуемые дозы, кратность назначения и отдельные фармакокинетические параметры антиаритмических средств II класса
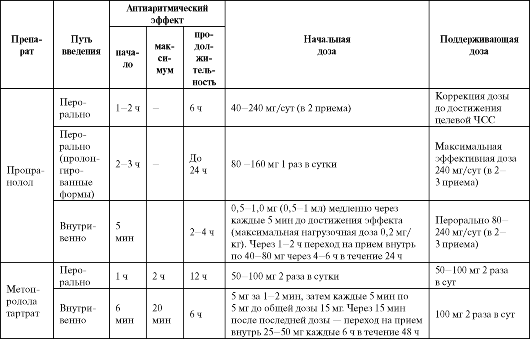
Окончание таблицы 4.6
в миокарде и проводящей системе. На ЭКГ это действие проявляется удлинением QT. Эффект AAC III класса характеризуется «обратной частотной зависимостью» - действие усиливается при более редком ритме и ослабевает при более частом ритме. Между тем большинство препаратов III класса не являются таковыми в чистом виде, они существенно различаются между собой по дополнительным свойствам, степени обратной частотной зависимости, спектру действия и безопасности. В силу особенностей действия (удлинение QT и обратная частотная зависимость) этот класс ААС может провоцировать приступы ЖТ типа пируэт. Единственный представитель III класса ААС, доказавший свою безопасность у больных с тяжелыми заболеваниями сердца (при отсутствии влияния на общую смертность) - амиодарон. Он стал средством первого ряда при купировании и профилактике желудочковых аритмий у этой категории пациентов.
Общие свойстваААСШкласса
• Блокада калиевых каналов выраженная.
• Замедление реполяризации (фаза 1-3 ПД) - увеличение длительности ПД (рис. 4.9).
• На ЭКГ - удлинение интервала QT.
• Увеличение эффективных рефрактерных периодов в проводящей системе, предсердиях и желудочках (умеренное).
• Угнетение автоматизма (от слабого до умеренного).
• Обратная частотная зависимость.
• Проаритмии: ЖТ по типу пируэт - torsades de pointes (следствие удлинения QT).
• Эффективность при наджелудочковых и желудочковых тахиаритмиях (зависит от используемого препарата).
Амиодарон (Кордарон, Амиокордин) обладает эффектами всех четырех классов ААС. Основное действие - блокада калиевых каналов, следовательно, увеличение рефрактерности миокарда и проводящей системы, включая ДПП (проявляется удлинением QT). Кроме того, препарат вызывает незначительную блокаду быстрых натриевых кана-
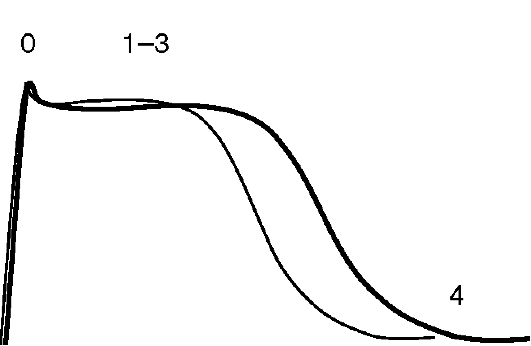
Рис. 4.9. Влияние препаратов III класса на ПД кардиомиоцита: тонкая линия - ПД в норме; жирная линия - изменения ПД под влиянием ААС III класса
лов (свойство I класса ААС), неселективную неконкурентную блокаду β-адренорецепторов (свойство II класса ААС) и блокаду кальциевых каналов (свойство IV класса ААС). Результатом двух последних эффектов являются: угнетение автоматизма САУ (брадикардия) и замедление АВ-проведения (удлинение PQ). Расширение резистивных артерий - снижение периферического сопротивления и постнагрузки, а также коронародилатация - следствие блокады кальциевых каналов.
Основное действие амиодарона развивается медленно, по мере кумуляции препарата, поэтому внутривенное введение препарата с этой точки зрения не имеет существенных преимуществ перед быстрой пероральной нагрузкой. Между тем при внутривенном введении быстрее проявляется β-адреноблокирующее действие амиодарона - угнетение проведения в АВ-узле и гипотензия, что полезно при аритмиях, индуцированных катехоламинами, но может быть нежелательным у пациентов с гиповолемией.
Среди других особенностей действия амиодарона следует отметить минимальную обратную частотную зависимость и низкую ве- роятность развития желудочковых проаритмий, а также отсутствие значимой кардиодепрессии. Эти свойства, а также выраженное антифибрилляторное действие позволяют безопасно применять препарат у больных с органическими изменениями миокарда и тяжелой ХСН.
Амиодарон - наиболее мощный и универсальный антиаритмический препарат. Он эффективен как при желудочковых, так и при наджелудочковых тахиаритмиях. Возможно, он уменьшает частоту внезапной сердечной смерти у больных с дисфункцией ЛЖ после инфаркта миокарда и у больных с дилатационной кардиомиопатией, однако, вероятно, мало влияет на общую смертность у больных с ХСН, уступая в этом имплантриуемым кардиовертерам-дефибрилляторам (ИКД).
Всасывание, распределение, превращения и выведение йодсодержащего амиодарона достаточно сложны, плохо предсказуемы и не до конца ясны. Распределение препарата описывают 3-компартментной моделью. Первый компартмент - центральный - внутрисосудистое пространство, которое можно «заполнить» в течение суток при агрессивном режиме дозирования. Второй компартмент - периферический - большинство органов тела, для его начального заполнения требуется 5-7 дней при обычном режиме нагрузки амиодароном (не- обходимо для поддержания антиаритмического действия). Третий компартмент - глубокий - жировая ткань, его необходимо насытить для создания стабильного эффекта амиодарона (устойчивого равновесия между концентрацией препарата в плазме и принимаемой внутрь
дозой), на что уходят недели и месяцы. Из-за высокой липофильности амиодарон имеет большой объем распределения, зависящий от содержания жировой ткани. Препарат накапливается в органах, содержащих жировую ткань (печень, легкие). Метаболизм амиодарона происходит в печени (метаболит активен), экскреция очень медленная, в основном с желчью, поэтому препарат можно назначать больным с почечной недостаточностью. Период полувыведения колеблется от 3 недель до 3 месяцев. При прекращении приема препарата его содержание в плазме крови снижается наполовину в течение 3-10 дней, после чего длительно (недели, месяцы) поддерживается на этом уровне за счет поступления препарата из жировых депо.
Начало действия амиодарона при пероральном приеме через 2- 3 дня (иногда - через 2-3 месяца), длительность действия от 2 недель до нескольких месяцев. При внутривенном введении блокада β-адре- нергических рецепторов развивается быстро, но основное действие - с той же скоростью, что и при быстрой пероральной нагрузке.
Применяют препарат для купирования и профилактики угрожающих жизни тахиаритмий: контроль частоты ритма, кардиоверсия и профилактика рецидивов аритмии у больных с ФП и ТП, в том числе при наличии ДПП; купирование и профилактика желудочковых тахиаритмий (табл. 4.7).
Побочные эффекты амиодарона многочисленны и имеют дозозависимый характер (см. табл. 4.3), встречаемость их существенно реже при использовании малых поддерживающихдоз препарата (<200 мг/сут).
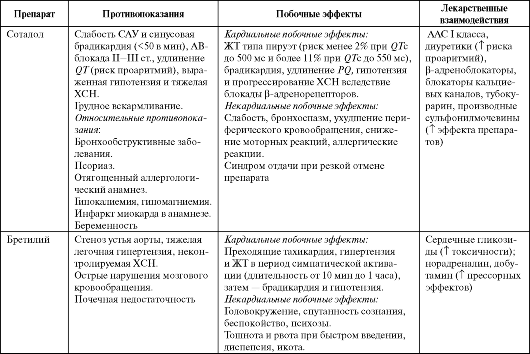
Соталол (Сотагексал, Соталекс) как фармакологический препарат представляет собой рацемическую смесь двух изомеров: D-соталола (ААС III класса) и L-соталола (со свойствами неселективного β-адреноблокатора). Препарат удлиняет ПД в предсердиях, желудочках и в проводящей системе путем блокады калиевых каналов, что проявля- ется удлинением эффективного рефрактерного периода и дозозоависимым удлинением QТ на ЭКГ. Дополнительный β-адреноблокирующий эффект соталола составляет примерно1/3 от эффекта пропранолола. Препарат оказывает отрицательное инотропное действие и обладает значительно выраженной обратной частотной зависимостью.
По антиаритмическому эффекту соталол несколько уступает амиодарону, но превосходит его по частоте проаритмий (тахикардия типа пируэт). Имеется прямая зависимость эффективности (степени удлинения QT) и одновременно частоты проаритмий от дозы. Соталол не снижает смертность при профилактическом применении у больных после перенесенного инфаркта миокарда.
Таблица 4.7. Рекомендуемые дозы, кратность назначения и отдельные фармакокинетические параметры антиаритмических средств III класса
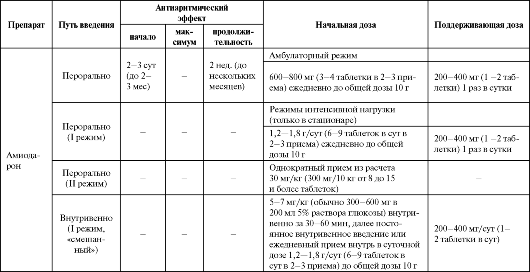
Продолжение табл. 4.7
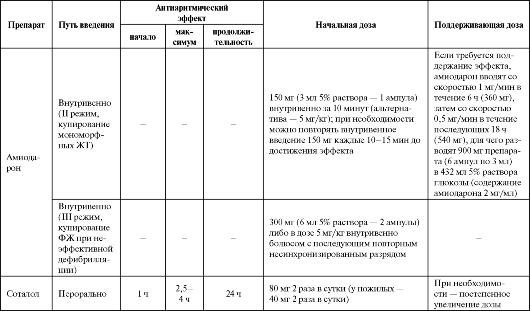
Окончание таблицы 4.7
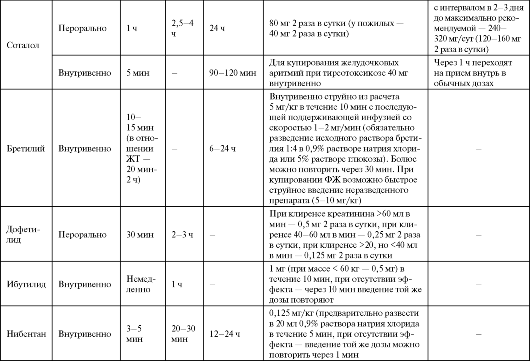
Применение соталола показано для купирования и профилактики желудочковых тахиаритмий, реципрокных АВ и АВ-узловых парок- сизмальных тахикардий, предупреждения рецидивов аритмии у больных ФП и ТП, в том числе при наличии ДПП; купирования наджелудочковых и желудочковых тахиаритмий у больных тиреотоксикозом (см. табл. 4.7).
При лечении соталолом необходим строгий контроль длительности QT. Корригированный QT (QTc) не должен превышать 500 мс (желательно оценивать на синусовом ритме из-за обратной час- тотной зависимости эффекта препарата). Необходимо избегать гипокалиемии (удлиняет QT).
Бретилий (Бретилия тосилат, Бретилол, Орнид) оказывает двойное действие: прямое на мембраны (как препарат III класса удлиняет ПД в волокнах Пуркинье и миокарде) и непрямое симпатолитическое (блокирует обратный захват норадреналина).
Особенность симпатолитического действия препарата состоит в том, что в начальной фазе он стимулирует выброс норадреналина из синапсов, вызывая преходящее усиление адренергического действия, выраженность которого неодинакова у разных пациентов. В начальной фазе действия бретилия (5-10 мин) могут наблюдаться умеренное повышение АД, увеличение ЧСС и укорочение рефрактерных периодов в желудочках, сменяющиеся в течение последующего часа постуральной гипотензией, брадикардией и удлинением рефрактерного периода. Препарат имеет выраженные антифибрилляторные свойства, природа которых до конца не ясна; кроме того, он снижает порог дефибрилляции. Не вызывает ЖТ типа пируэт.
Применяют бретилий при ФЖ, резистентной к электрической дефибрилляции (купирование и профилактика), ЖТ, резистентной к другим ААС, в экстренной ситуации (см. табл. 4.7).
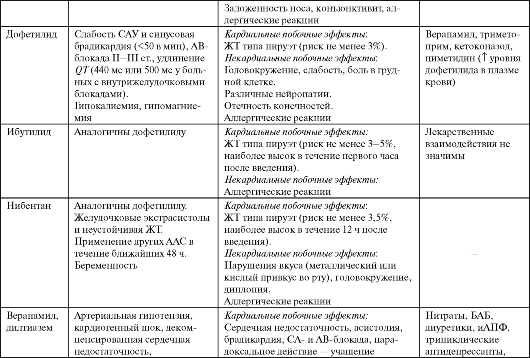
Дофетилид (Тикозин) - классический антиаритмический препарат III класса - удлиняет ПД в предсердиях, желудочках и в проводящей системе с дозозоависимым удлинением QT нa ЭКГ. Риск развития ЖТ по типу пируэт высокий, поэтому препарат не используют для лечения желудочковых аритмий. Применяют дофетилид преимущественно для купирования пароксизмов ФП и ТП (эффективность близка к электрической кардиоверсии) и их профилактики.
Назначают дофетилид перорально, только в стационаре (см. табл. 4.7). Начальная доза препарата зависит от клиренса креатинина, при клиренсе <20 мл/мин дофетилид противопоказан. Перед назначением дофетилида и в процессе лечения обязателен контроль длительности QT.
Больным с QTc >440 мс (500 мс у больных с внутрижелудочковыми блокадами) препарат противопоказан. Через 2-3 ч после первой дозы препарата оценивают QT повторно: при удлинении на 15% и более или QT(U)c ≥500 мс (550 мс при внутрижелудочковой блокаде) дозу уменьшают и повторно контролируют QT через 24 ч. Если QT нe снизится до требуемых величин, дофетилид отменяют. Во время подбора дозы пациент должен находиться в стационаре (палата интенсивной терапии) под непрерывным мониторным контролем, в наличии должны быть средства для оказания неотложной помощи в случае проаритмий. Выписка возможна не ранее 12 ч после восстановления ритма, и не ранее 3 суток с момента начала лечения при продолжении терапии дофетилидом.
Ибутилид (Корверт) - «чистый» антиаритмический препарат III клас- са (см. дофетилид). Применяют ибутилид для купирования пароксизмов ФП/ТП только внутривенно, в стационаре (блок интенсивной терапии) под мониторным ЭКГ-наблюдением, которое продолжают не менее 4 часов после последнего введения препарата (см. табл. 4.7).
Нибентан - препарат III класса, предназначенный для купирования пароксизмов ФП и ТП (эффективность близка к электрической кар- диоверсии). На ЭКГ действие нибентана проявляется удлинением QT (с уменьшением амплитуды Т и появлением высоких волн U).
Используют нибентан для купирования ФП и ТП (см. табл. 4.7). Перед применением препарата целесообразно внутривенно медлен- но ввести 8 мл 25% раствора магния сульфата. Лечение проводят в стационаре (блок интенсивной терапии) под мониторным ЭКГ-наблюдением, которое продолжают не менее 24 ч после последнего введения препарата. Введение нибентана прекращают при удлинении QT(U)c ≥500 мс.
Побочные эффекты, противопоказания к применению и лекарственные взаимодействия ААС III класса представлены в табл. 4.3.
Антиаритмические средства IV класса - блокаторы кальциевых каналов
Блокаторы кальциевых каналов блокируют медленные кальциевые каналы, ответственные за деполяризацию САУ и АВУ. Таким образом, угнетаются автоматизм и проведение в САУ и АВУ, что сопровождается умеренным замедлением ритма и удлинением интервала PQ. БКК мало влияют на электрофизиологические свойства миокарда предсердий, желудочков и ДПП, но при патологии способны влиять на гипополяризованные волокна Пуркинье. Кроме того, БКК подавляют в миокарде триггерную активность, опосредованную медлен-
ными кальциевыми каналами, уменьшают сократимость миокарда и гладких мышц сосудов, вызывая кардиодепрессию и вазодилатацию. Именно расширением сосудов обусловлены снижение АД, характер- ная гиперемия кожи и усиление диуреза (вследствие расширения почечных артерий) у больных при лечении БКК.
БКК эффективны при наджелудочковых аритмиях, так как влияют на проводимость в АВУ, что позволяет эффективно контролировать частоту проводимых предсердных импульсов, разрывать петли re-entry, захватывающие АВУ (реципрокные тахикардии при синдроме WPW и продольной диссоциации АВУ на быстрый и медленный каналы).
Общие показания к назначению БКК при аритмиях
• Купирование пароксизмов АВ-реципрокной и АВ-узловой реципрокной тахикардий.
• Контроль частоты сердечных сокращений при ФП и ТП, предсердных тахикардиях.
• Купирование многоочаговой предсердной тахикардии (у отдельных пациентов).
• Отдельные редкие формы ЖТ (ЖТ, чувствительная к верапамилу). Для лечения аритмий используют недигидропиридиновые БКК -
верапамил и дилтиазем. Верапамил замедляет АВ-проведение больше, чем дилтиазем, но меньше снижает частоту ритма из-за рефлекторной симпатической активации СА-узла в ответ на резкую вазодилатацию. Выраженное расширение артерий является причиной побочных эффектов БКК: это синдром обкрадывания - парадоксальное обострение ишемии из-за перераспределения кровотока в пользу неишемизированной ткани; пастозность голеней и лодыжек из-за перераспределения крови в нижние конечности. Некоторые пациенты, особенно пожилые мужчины с гиперплазией простаты, тяжело переносят увеличение диуреза и учащение мочеиспускания. Среди несосудистых эффектов БКК можно отметить снижение тонуса нижнего отдела пищевода и кардиального жома, гладких мышц кишечника - запоры. Значимого влияния на бронхиальную проходимость, метаболизм липидов и углеводов, свертывание крови БК не оказывают.
БК не следует применять при ФП у пациентов с синдромом WPW из-за риска ускорения проведения по ДПП (учащение ритма, переход в ФЖ), а также при лечении аритмий у больных с тяжелой ХСН или дисфункцией ЛЖ из-за возможного негативного влияния на прогноз.
Общие свойства антиаритмических средств Г7класса
• Блокада кальциевых каналов в САУ и АВУ
• Замедление деполяризации клеток САУ и АВУ (рис. 4.10).
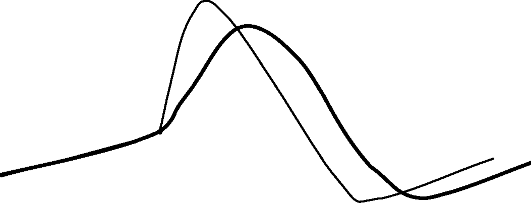
Рис. 4.10. Влияние препаратов IV класса на ПД кардиомиоцита: тонкая линия - ПД исходно; жирная линия - изменения ПД под влиянием блокаторов кальциевых каналов
• Подавление автоматизма, нарушение проведения в САУ и АВУ
• На ЭКГ - замедление ритма, удлинение интервала PQ.
• Угнетение сократимости миокарда (опасны при тяжелой дисфункции ЛЖ).
• Проаритмии не характерны, но возможны брадиаритмии и ускорение проведения импульсов к желудочкам при наличии ДПП.
• Эффективность при наджелудочковых реципрокных и очаговых тахиаритмиях (триггерных и автоматических).
Верапамил (Изоптин, Финоптин) - фенилалкиламиновый БКК, представляющий собой рацемат. При этом L-изомер активнее D-изо- мера, однако биодоступность последнего в 2,5 раза выше.
Верапамил уменьшает ЧСС, удлиняет АВ-проведение, уменьшает сократимость миокарда, снижает или не изменяет сердечный выброс, понижает АД, часто вызывает рефлекторное повышение симпатиче- ской активности, маскирующееся основным действием препарата. При внутривенном введении верапамил может вызывать парадоксальное ускорение проведения по дополнительным проводящим путям (укорочение рефрактерности ДПП из-за повышения симпатотонуса и ограничение скрытого ретроградного проведения в ДПП), резко увеличивая ЧСЖ. Сходное антиаритмическое действие оказывает дилтиазем (дилзем, алтиазем).
Рекомендуемые дозы, кратность назначения и отдельные фармакокинетические параметры ААС IV класса представлены в табл. 4.8.
Побочные эффекты, противопоказания к применению и лекарственные взаимодействия ААС IV класса представлены в табл. 4.3.
Таблица 4.8. Рекомендуемые дозы, кратность назначения и отдельные фармакокинетические параметры антиаритмических средств IV класса
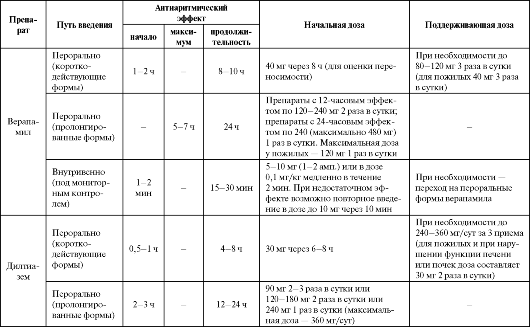
Окончание таблицы 4.8

Таблица 4.9. Рекомендуемые дозы, кратность назначения и отдельные фармакокинетические параметры неклассифицируемых антиаритмических средств
Окончание табл. 4.9
Неклассифицированные антиаритмические средства
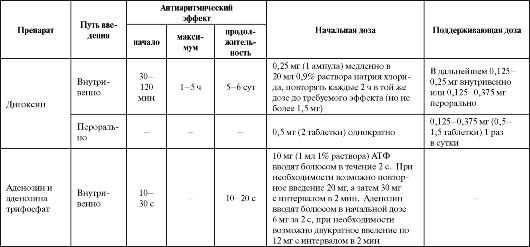
Дигоксин - типичный представитель сердечных гликозидов - блокатор Na+/К+-АТФ-азы. Увеличивает внутриклеточное содержание кальция при мышечном сокращении (усиление сократимости) и повышает тонус блуждающего нерва - угнетение автоматизма САУ, угнетение проведения и удлинение эффективного рефрактерного периода в АВУ, а также укорочение рефрактерного периода и умеренное угнетение проводимости в миокарде предсердий. В токсических дозах дигоксин повышает автоматизм, повышает возбудимость миокарда за счет усиления триггерной активности из-за перегрузки кальцием (поздние постпотенциалы) и уменьшения диастолического потенциала. Вызывает замедление ритма, расширение интервала PQ, укорочение интервала QТ и характерную корытообразную депрессию сегмента ST на ЭКГ.
В качестве антиаритмического средства дигоксин используют для контроля частоты сердечных сокращений при ФП и ТП у больных с ХСН, купирования НЖТ и ЖТ (табл. 4.9).
Аденозин и аденозина трифосфат (АТФ), метаболизирующийся при введении в организм до аденозина, обладают сходным механизмом действия, заключающимся в активации аденозиновых A1 (пуриновых P1) рецепторов. В результате происходит открытие ацетилхолинозависимых калиевых каналов в кардиомиоцитах предсердий, САУ, АВУ, что приводит к укорочению потенциала действия, гиперполяризации и снижению частоты разрядов клеток - водителей ритма.
В высоких концентрациях аденозин вызывает угнетение функции САУ и АВУ (замедление автоматизма и проводимости) и вазодила- тацию. Действие препарата выраженное, но кратковременное из-за очень короткого периода полувыведения (около 10 с). Эффект характеризуется выраженной АВ-блокадой и брадикардией.
Эффективен аденозин при реципрокных наджелудочковых тахикардиях, если петля re-entry проходит через САУ или АВУ, у больных с ДПП (см. табл. 4.9). Выраженная вазодилатация и коронародилатация могут приводить к феномену «обкрадывания», провоцируя коронарную недостаточность у больных ИБС.
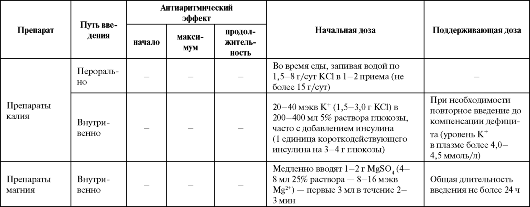
Препараты калия выпускаются во множестве лекарственных форм - калия хлорид в виде таблеток: по 1000 мг (Калий-нормин), таблеток по 750 мг (10 мэкв) с замедленным высвобождением (Калипоз пролонгатум); в виде 4% раствора в ампулах; в сочетании с солями магния (Аспаркам, Панангин) по 140 мг калия аспарагината и 158 мг магния аспарагината.
Соли калия используют для компенсации его дефицита. При гиперкалиемии (уровень калия >8 ммоль/л) подавляются возбудимость и проведение в миокарде и проводящей системе (брадикардия, сино- вентрикулярное проведение, АВ-блокады, асистолия).
Применяют препараты калия при гипокалиемии, интоксикации сердечными гликозидами (см. табл. 4.9).
Препараты магния также представлены многими лекарственными формами (таблетки Магне В6 содержат 500 мг магния лактата (48 мг магния); таблетки Магнерот содержат 500 мг магния оротата (38,2 мг магния); входят в состав препаратов «Аспаркам» и «Панангин»). Ионы Mg2+ активируют Na+/K+-ATФ-a3y, увеличивая содержание внутриклеточного калия - антагонизм с эффектом дигоксина. Магний угнетает проведение по АВУ и подавляет ранние постдеполяризации (их считают причиной возникновения тахикардии типа пируэт), что может быть причиной эффективности при купировании ЖТ типа пируэт (torsades de pointes) даже при нормальном содержании магния в организме. Соли магния также компенсируют его дефицит (дефицит в пище, нарушение всасывания в кишечнике, потеря через почки при острой почечной недостаточности, гиперальдостеронизме, гиперкальциемии, гипертиреозе, приеме диуретиков, аминогликозидов, циклоспорина и метатрексата, алкоголизм, лечение дигиталисом). Дефицит магния проявляется тахикардией, удлинением QT, уплощением Τ с появлением высокой волны U, наконец, аритмиями.
Применяют препараты магния для лечения ЖТ по типу пируэт, при интоксикации сердечными гликозидами, гипокалиемии, гипо- магниемии (см. табл. 4.9). При этом следует учитывать, что препараты магния для приема внутрь не оказывают антиаритмическое действие в острой ситуации из-за непредсказуемого всасывания.
Новые антиаритмические средства
Атриоселективные средства (NIP-142, RSD1235, AVE0118) разрабатываются как препараты, лишенные негативных побочных эффектов, связанных с желудочковыми аритмиями. Воздействуют на ультрабыстрый задержанный выпрямляющий калиевый ток (IКur), который представлен только в предсердиях. Удлиняют рефрактерный период в предсердиях, больше в левом, чем в правом, не влияют на электрофизиологические свойства желудочков. Таким образом, могут использоваться исключительно при наджелудочковых тахиаритмиях (ФП, ТП). AVE0118 - комбинированный ингибитор 1Кш and Ito который увеличивает рефрактерный период в ремоделированных предсердиях и спо-
собен восстановить ритм при персистирующей ФП без формирования гетрогенности проведения в предсердиях или удлинения QT.
Неселективные блокаторы ионных каналов (азимилид и дронедарон). Блокируют калиевые, натриевые и кальциевые каналы, вызывая удлинение потенциала действия без формирования обратной частотной зависимости эффекта. Азимилид имеет большой период полувыведения - 114 ч, что позволяет принимать его однократно в сутки в дозе 100-125 мг, он предупреждает рецидивы ФП и ТП, способен купировать пароксизмы ФП и ослаблять клинические проявления при рецидивах. Не улучшает прогноз у больных ФП и постинфарктным кардиосклерозом или ХСН.
Дронедарон - нейодированное производное амиодарона, в дозе 800 мг/сут предупреждает пароксизмы ФП и обеспечивает эффективный контроль ЧСС при минимальных побочных эффектах (в основном гастроэнтерологические).
Тедисамил - антиангинальный препарат, блокирует ряд калиевых каналов, вызывая удлинение потенциала действия (QТ на ЭКГ) с обратной частотной зависимостью. В дозе 0,4-0,6 мг/кг эффективно и за короткое время купирует пароксизмы ФП и ТП. Побочные действия и осложнения типичны для ААС III класса - пароксизмы ЖТ типа пируэт.
Сравнительная характеристика антиаритмических средств
Сопоставляя свойства различных ААС, можно прийти к выводу о том, что ААС I и III классов обладают способностью купировать и предупреждать как наджелудочковые, так и желудочковые тахиаритмии при отсутствии позитивного влияния или даже негативном влиянии на прогноз у таких пациентов. ААС II и IV классов могут купировать или контролировать в основном наджелудочковые тахиаритмии, при этом ААС II класса - БАБ - обладают свойством предупреждать желудочковые тахиаритмии при парадоксально слабой способности к их подавлению. БАБ - единственный класс ААС, позитивно влияющий на прогноз пациентов с желудочковыми аритмиями.
Общая эффективность наиболее высока у некоторыхААС III класса (амиодарон, дофетилид, ибутилид) иуААС IС класса.
Проаритмическое действие ААС определяется механизмом их действия. ААС I и III классов могут вызывать осложнения, связан- ные нарушениями электрических процессов в проводящей системе и в миокарде на уровне как предсердий, так и желудочков (дисфункции САУ, АВУ, предсердные и желудочковые тахиаритмии и брадиарит-
мии). ААС II и IV классов вызывают преимущественно суправентрикулярные проаритмии: дисфункции САУ, АВУ, ускорение проведения по ДПП (табл. 4.10). Наиболее частыми проаритмиями при назначении ААС IС и IA классов, замедляющих деполяризацию (замедление фазы 0 ПД, расширение QRS нa ЭКГ), являются реципрокные желудочковые тахикардии. Типичное осложнение лечения ААС III и IA классов, удлиняющих ПД (удлинение QT на ЭКГ) - полиморфная желудочковая тахикардия типа пируэт. Универсальный метод контроля при лечении ААС IС и IA классов - мониторинг ширины комплекса QRS (не более 50% от исходной), при лечении ААС III класса (кроме амиодарона) - мониторинг корригированного интервала QT(QTc <520 мс).
Таблица 4.10. Сравнительная характеристика основных классов противоаритмических средств (Фогорос Р. Н., 2002, с изменениями)
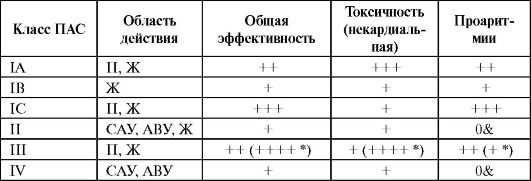
Примечание: Π - предсердия; Ж - желудочки; САУ - синоаурикулярный узел; АВУ - атриовентрикулярный узел; * - для амиодарона; & - за исключением брадиаритмий.
Разновидности проаритмий, встречающиеся при лечении противоаритмическими препаратами (Fuster V. et al., 2006, с изменениями)
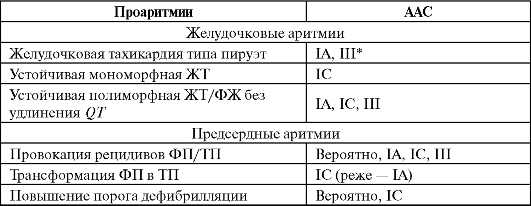
Окончание таблицы

Примечание: * - кроме амиодарона; ** - данные по БАБ противоречивы, но при наличии ДПП их применение требует осторожности.
Принципиальным фактором, определяющим выбор класса ААС для профилактики аритмий, является наличие или отсутствие у па- циента тяжелых заболеваний сердца: ХСН, снижения глобальной сократимости ЛЖ (ФВ <35-40%), ишемии миокарда, крупноочагового постинфарктного кардиосклероза, кардиомиопатии, выраженной гипертрофии миокарда, врожденного или приобретенного гемодинамически значимого порока сердца, а также врожденных синдромов: Бругада и длинного QT (табл. 4.11). В случае заболеваний сердца противопоказаны ААС IA, IС классов, препаратами выбора являются препараты II класса и отдельные представители III класса (амиодарон, у некоторых категорий больных - соталол и дофетилид). При необходимости купирования опасных аритмий у больных с тяжелыми поражениями сердца допустимо использование препаратов IB и IA классов, как препаратов резерва (в случае неэффективности ААС выбора и электрической кардиоверсии/дефибрилляции). У пациентов без тяжелых поражений сердца выбор ААС широк, однако предпочтение следует отдавать средствам, сочетающим хорошую переносимость и высокую эффективность (при ФП/ТП - класс IС, класс III - соталол, дофетилид, ибутилид, класс IA; при желудочковых аритмиях - класс II, IB, IС, ΙΑ), амиодарон выступает в качестве препарата резерва из-за большого числа побочных эффектов.
Таблица 4.11. Препараты выбора при наджелудочковых и желудочковых аритми- ях* (Фогорос Р. Н, 2002, с изменениямиидополнениями)
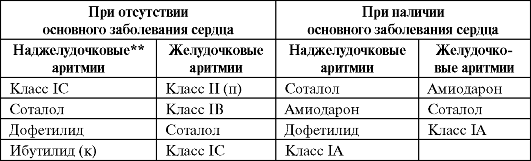
Окончаниетабл. 4.11
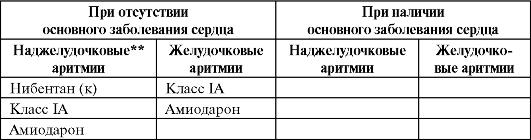
Примечание: * - препараты расположены в порядке снижения предпочтительности выбора; ** - предсердные тахикардии и ФП/ТП; (п) - эффективен только для профилактики ФП/ТП; (к) - используют только для купирования ФП/ТП.
Таким образом, выбор конкретного ААС определяется: потенциальным влиянием на прогноз (при заболеваниях сердца), активностью при данном виде аритмий, профилем безопасности при длительном и остром применении, наконец - опытом применения, как у врача, так и у пациента.
4.4. ОБЩИЕ ПРИНЦИПЫ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ
Наилучший способ лечения аритмии - устранение ее причины (уменьшение гипоксемии при многоочаговой предсердной тахикардии, ликвидация ишемии миокарда при желудочковых аритмиях на фоне коронарной недостаточности, лечение тиреотоксикоза, восполнение потерь электролитов различной природы, абляция дополнительных проводящих путей у лиц с WPW-синдромом и т. д.).
Следует «избегать назначения антиаритмических препаратов всегда, когда это возможно» (Фогорос Р. Н., 2002). Лечению подлежат только те нарушения ритма, которые создают риск для жизни пациента либо сопровождаются выраженными симптомами. Например, нет необходимости в лечении частой малосимптомной желудочковой экстрасистолии у пациента без структурной патологии сердца. Агрессивность антиаритмической терапии должна соответствовать потенциальной опасности аритмии для жизни и здоровья больного.
Специфическое лечение аритмий предусматривает не только назначение ААС, но также отмену препаратов с проаритмическим действием и использование нефармакологических методов лечения: электроимпульсной терапии (ЭИТ), имплантации кардиовертеров-
дефибрилляторов (ИКД) и электрокардиостимуляторов (ЭКС); катетерной абляции и кардиохирургии.
При выборе между фармакологическими и нефармакологическими методами лечения аритмии необходимо сопоставить их эффективность, характер влияния на прогноз, а также безопасность и доступ- ность для конкретного пациента. Нередко для достижения результата требуется комбинация обоих методов воздействия.
Перед назначением антиаритмического препарата следует взвесить потенциальную пользу и риск его применения, а при лечении - свести к минимуму вероятность развития побочных явлений и осложнений терапии. Наиболее опасное осложнение - желудочковые проаритмии: ЖТ типа пируэт (следствие удлинения QT при лечении ААС IA и III классов); мономорфная ЖТ (следствие расширения QRS - ААС IС класса) и устойчивая полиморфная ЖТ (препараты I и III классов). Риск проаритмий особенно высок у больных с тяжелыми поражениями миокарда, исходным нарушением проводимости или реполяризации (блокады, длинный QT), электролитными расстройствами, хронической сердечной, почечной или печеночной недостаточностью.
Лечение нарушений ритма состоит из двух этапов: купирования остро возникшей аритмии и профилактики повторных нарушений ритма или коррекции существующих подострых аритмий. Нередко на каждом из этапов используют разные способы лечения и разные ААС.
Для длительного лечения (профилактики) аритмий можно рекомендовать лишь те средства, которые доказали свою безопасность или способность улучшать прогноз у конкретной категории больных. Так, ААС I класса противопоказаны больным с тяжелыми органическими поражениями миокарда и ХСН, в то время как ААС II класса (БАБ) и отдельные ААС III класса (амиодарон и дофетилид) могут с успехом использоваться именно у этих пациентов.
4.5. ЛЕЧЕНИЕОТДЕЛЬНЫХТАХИАРИТМИЙ
Пароксизмальные наджелудочковые тахикардии
По источнику возникновения выделяют синусовую (реципрокную) тахикардию, предсердные тахикардии, тахикардии из АВ-соеди- нения, предсердно-желудочковые (АВ) тахикардии.
По механизму образования ПНЖТ делят на очаговые (фокусные), в основе которых лежат триггерные механизмы или повышенный автоматизм, и реципрокные, возникающие по механизму re-entry - пов-
торного входа волны возбуждения с круговой циркуляцией импульса в определенной зоне сердца (подавляющее большинство ПНЖТ).
Лечение фокусной предсердной тахикардии
Купирование симпатикотонических пароксизмальных форм фокусной ПТ.
БАБ (пропранолол 1 мг внутривенно в течение 1 мин, при необходимости - повторить введение той же дозы через 5 мин).
При неэффективности или противопоказаниях - БКК (верапамил 5-10 мг внутривенно за 2-3 мин, при необходимости повторить введение через 5 мин - общая доза до 15 мг).
При неэффективности (у больных без грубой патологии миокарда): пропафенон 450-600 мг в 2-3 приема или флекаинид по 100 мг 2 раза в сутки и другие ААС IA и ШС классов.
Профилактика пароксизмов фокусной ПТ и лечение хронической фокусной ПТ:
Хирургические методы лечения (катетерная радиочастотная абляция).
При недоступности (неэффективности) хирургического лечения: БАБ (пропранолол 120-240 мг/сут в 3 приема, метопролол - 50-150 мг/сут); БКК (верапамил 120-240 мг/сут, дилтиазем 120-180 мг/сут перорально).
Лечение предсердной тахикардии с АВ-блокадой II степени
Часто данная аритмия - признак интоксикации дигиталисом, поэтому необходимы:
- отмена сердечных гликозидов;
- внутривенное введение препаратов калия хлорида (0,8-1 г КС1 на одно введение - 20 мл 4-5% раствора в 200-400 мл 5% раствора глюкозы).
Противопоказана электроимпульсная терапия из-за риска ФЖ при дигиталисной интоксикации (!)
Лечение многоочаговой (хаотической) предсердной тахикардии
На ЭКГ эта ПНЖТ характеризуется: неправильным ритмом предсердных зубцов Ρ различной формы и амплитуды (как минимум три разных зубца Р), частотой 100-150 в мин, АВ проведением 1:1 и узкими комплексами QRS. Часто требует дифференциального диагноза с ФП. Развитие этой аритмии связывают с гипоксемией (болезни легких, лихорадочные состояния у пожилых). Лечение заключается в ликвидации гипоксемии, лечении основного заболевания. При устойчивых формах используют БК (верапамил, дилтиазем).
Лечение реципрокных ПНЖТ
Наиболее актуальны АВ-реципрокные тахикардии, связанные с наличием ДПП (например, синдром WPW) и АВ-узловые реципрокные тахикардии, обусловленные продольной диссоциацией АВ-узла на быстрый и медленный каналы. При синдроме WPW развитие тахикардии обусловлено циркуляцией возбуждения между предсердиями и желудочками (антероградно импульс проводится через АВУ, ретроградно - через ДПП - ортодромная реципрокная АВ-тахикардия, либо антероградно - через ДПП, ретроградно - через АВузел - антидромная реципрокная АВ-тахикардия). При диссоциации АВУ импульс совершает круговое движение антеградно - по медленному пути, ретроградно - по быстрому. Общим для описанных вариантов ПНЖТ является участие АВУ в реализации механизма re-entry. Следовательно, при купировании этих НЖТ можно использовать общие подходы, связанные с замедлением проведения в АВУ с целью прекращения re-entry.
Купирование:
- вагусные приемы (проба Вальсальвы, провокация кашля, рвоты, погружение лица в ледяную воду, синокаротидная проба, интенсивное надавливание на живот в области брюшной аорты, надавливание на глазные яблоки);
- при неэффективности аденозина трифосфат в дозе 10 мг (1 мл 1% раствора) внутривенно болюсом, при необходимости - еще 20 мг, а затем 30 мг последовательно с интервалом в 2 мин;
- при неэффективности через 2 мин - верапамил внутривенно медленно 5-10 мг за 2-3 мин (повторить при необходимости через 5 мин - общая доза до 15 мг);
- при неэффективности через 30 мин - прокаинамид внутривенно медленно со скоростью 50 мг/мин (15 мг/кг);
- при антидромной АВ-реципрокной ПТ (редкая форма) - амиодарон внутривенно в дозе 5 мг/кг в течение 10 мин (угнетает антеградное проведение по ДПП);
- при гемодинамической нестабильности, коллапсе или неэффектиности предыдущих мероприятий - ЭИТ (электрическая кардиоверсия синхронизированным разрядом 50-100 Дж).
Профилактика:
- хирургическое лечение: чрессосудистая катетерная радиочастотная абляция (деструкция) ДПП или медленного АВ-канала (эффективность >90%);
- при недоступности (неэффективности) хирургического лечения: БКК (верапамил), амиодарон перорально.
Лечение фибрилляции и трепетания предсердий
ФП - самая частая причина обращения за медицинской помощью по поводу нарушений сердечного ритма. В соответствии с международными и российскими рекомендациями по диагностике и лечению ФП выделяют следующие ее формы:
- пароксизмальная ФП - склонность к спонтанному восстановлению ритма в течение 7 суток с момента возникновения аритмии (обычно в течение первых суток);
- персистирующая ФП - отсутствие склонности к спонтанному восстановлению ритма, длительность нарушений ритма 7 суток и более;
- постоянная ФП - длительно существующая ФП (более 1 года), если кардиоверсия не проводилась или была неэффективной.
Выделяют также впервые выявленный эпизод ФП, и рецидивирующую ФП (2 приступа и более). Клинически ФП может протекать в следующих вариантах: вагусная форма (чаще у женщин среднего возраста (40-50 лет), приступы в ночные часы, после еды, алкоголя, с предшествующей прогрессирующей брадикардией, ФП с относительно невысокой частотой сокращений желудочков, редко переходит в хроническую); адренергическая форма (не имеет половых различий, встречается реже, обычно возникает днем, провоцируется физической нагрузкой, стрессом, часто сопровождается полиурией).
Гемодинамические последствия ФП - отсутствие вклада предсердий в наполнение желудочков и тахисистолия, приводящие при отсутствии лечения к возникновению сердечной недостаточности и формированию у некоторых пациентов аритмогенной кардиомиопатии. Наиболее опасным осложнением ФП являются тромбоэмболии (инсульт, инфаркты миокарда, почек, кишечника, селезенки и пр.). Поэтому основными задачами лечения ФП являются:
- контроль аритмии;
- профилактика тромбоэмболий.
Контроль аритмии
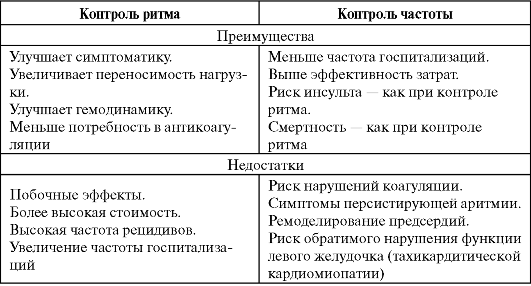
Существуют два альтернативных пути лечения ФП:
- купирование приступа ФП и поддержание синусового ритма;
- контроль частоты желудочковых сокращений при сохранении ФП.
Каждый из путей имеет свои преимущества и недостатки (см. ниже), хотя не исключено, что дальнейшие исследования сделают тактику ведения пациентов более определенной. Полагают, что восстановление и поддержание синусового ритма целесообразно при пароксизмальной форме ФП, у молодых пациентов, у лиц, плохо переносящих пароксизмы ФП, а также у больных с ригидным, как правило, гипертрофированным миокардом ЛЖ, поскольку отсутствие систолы предсердий сильно скажется на наполнении желудочков и гемодинамике. Очевидно также, что купирование ФП необходимо, если она сопровождается неконтролируемой ишемией, гипотензией или острой сердечной недостаточностью. Тактика контроля ЧСС более оправдана у пожилых людей с малосимптомным течением ФП, слабой перспективой поддержания синусового ритма (дилатация предсердий, часто рецидивирующее течение персистирующей ФП), а также при пароксизмальной форме ФП и стабильной гемодинамике.
Характеристика различных подходов к ведению пациентов с мерцательной аритмией (no Iqbal et al.,2005)
Купирование пароксизма ФП и поддержание синусового ритма
Восстановление ритма (кардиоверсия) у больных с ФП или ТП всегда сопряжено с риском эмболий. Он значительно повышается при длительности пароксизма более 48 ч и при отсутствии предварительного лечения антикоагулянтами.
Кардиоверсия без предварительной подготовки антикоагулянтами может быть выполнена при длительности ФП/ТП менее 48 часов:
- пациентам с низким риском эмболии;
- пациентам с гемодинамической нестабильностью (ишемия, инфаркт миокарда, кардиогенный шок, отек легких).
Кардиоверсию с предварительной подготовкой антикоагулянтами (прием непрямых антикоагулянтов - варфарина или фенилина в те- чение минимум 3 недель до кардиоверсии и 4 недель после нее в дозах, необходимых для поддержания MHO на уровне 2,0-3,0) следует выполнить:
- при длительности ФП/ТП >48 ч (или неизвестной давности) у гемодинамически стабильных пациентов;
- при длительности ФП/ТП <48 ч пациентам с высоким риском эмболии (эмболии в анамнезе - инсульт, транзиторные нарушения мозгового кровообращения и пр.; митральный стеноз; протезы клапанов сердца) или с сочетанием двух и более умеренных факторов риска эмболии (возраст >75 лет; сопутствующая ХСН или ФВ <35%; артериальная гипертензия; сахарный диабет);
- при наличии тромба в левом предсердии или ушке левого предсердия.
Кардиоверсию с одновременным началом антикоагулянтной терапии (гепарин болюсом 5000 ЕД внутривенно перед кардиоверсией с последующей постоянной внутривенной инфузией гепарина в до- зах, обеспечивающих удлинение АЧТВ в 1,5-2,0 раза (либо подкожным назначением низкомолекулярных гепаринов в лечебных дозах) до момента, когда прием непрямых коагулянтов обеспечит уровень MHO >2,0 с последующим приемом непрямых антикоагулянтов в течение 4 недель) можно выполнить:
- при длительности ФП/ТП >48 ч пациентам с гемодинамической нестабильностью (ишемия, инфаркт миокарда, кардиогенный шок, отеклегких);
- как альтернативу предварительной подготовке непрямыми антикоагулянтами в случае отсутствия тромба в левом предсердии или в ушке левого предсердия при чреспищеводной эхокардиографии (!)
Чреспищеводная эхокардиография позволяет с высокой вероятностью исключить тромбоз левого предсердия и, таким образом, ускорить выполнение кардиоверсии.
ФП можно прекратить с помощью лекарственных средств (фармакологическая кардиоверсия) или электрическим разрядом (электри- ческая кардиоверсия).
Электрическая кардиоверсия в целом эффективнее фармакологической, особенно при длительности ФП более 7 суток, но требует особых условий - премедикации и подготовки больного. Обычно используют чрескожный синхронизированный разряд 200 Дж (для монофазного импульса), при необходимости - повторные разряды 300 Дж и 360 Дж с интервалом не менее 1-2 мин. ТП можно купировать, начиная с меньшей мощности разряда (50 Дж).
Электрическая кардиоверсия показана:
- больным с нестабильной гемодинамикой (ишемия, инфаркт миокарда, гипотензия, сердечная недостаточность) при неэф- фективности фармакологического контроля высокой частоты сокращений желудочков;
- больным с ФП на фоне предвозбуждения желудочков (например, WPW-синдром) с очень высокой частотой сокращений желудочков или гемодинамической нестабильностью - немедленная кардиоверсия;
- больным со стабильной гемодинамикой, когда субъективные симптомы ФП неприемлемы для больного;
- при восстановлении ритма в случае длительно существующей ФП;
- при наличии предпочтения у пациента (если кардиоверсия требуется нечасто).
Эффективность электрической кардиоверсии повышает предварительное назначение амиодарона, флекаинида, ибутилида, пропа- фенона или соталола, что особенно важно тогда, когда наблюдаются ранние рецидивы ФП после успешного ранее купирования аритмии. Другие ААС неоднозначно влияют на порог кардиоверсии, а сердечные гликозиды повышают риск ФЖ (их следует отменить как минимум за сутки до планируемого восстановления ритма).
Фармакологическая кардиоверсия реализуется проще, но ее результативность ниже (особенно при длительности ФП более 7 суток), а проаритмогенные осложнения развиваются чаще, чем при электро- импульсном воздействии. Доказанной высокой эффективностью при купировании ФП/ТП обладают препараты IС и III классов: дофетилид, флекаинид, ибутилид, пропафенон, амиодарон; эффективность препаратов IA класса хинидина и прокаинамида считают недостаточно установленной, а дигоксин и соталол не рекомендуют для этих целей (табл. 4.12). Следует отметить, что нет сведений о безопасности использования для кардиоверсии препаратов IA, IС и III классов у больных с органическими поражениями сердца и ХСН (исключение - амиодарон), поэтому у данных пациентов препаратом выбора остается амиодарон.
Таблица 4.12. Рекомендуемые дозы антиаритмических средств, применяемых для восстановления синусового ритма при пароксизмах мерцательной аритмии (FusterV. etal.,2006)
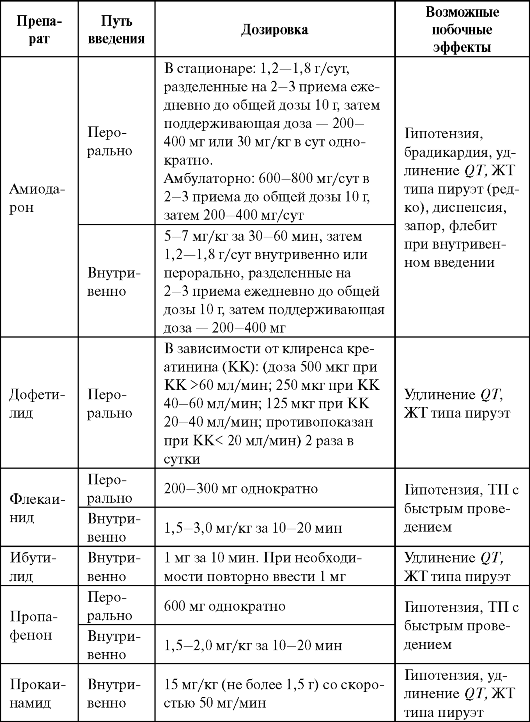
Окончаниетабл. 4.12

Флекаинид и пропафенон могут использоваться для купирования ФП в амбулаторных условиях после первичной апробации в стационаре (исключение - больные с нарушениями СА, АВ и внутрижелудочковой проводимости, синдромами длинного QТ и Бругада, а также органическими поражениями сердца). При купировании ТП перед назначением флекаинида или пропафенона рекомендован прием БАБ или БКК для предупреждения быстрого проведения к желудочкам (проведение 1:1). Амиодарон также можно использовать амбулаторно у широкого круга пациентов, если нет необходимости в скорейшем восстановлении ритма.
Если длительность ФП превышает 7 суток, эффективность фармакологической кардиоверсии снижается в следующем порядке: дофетилид, амиодарон, ибутилид (доказанное действие), дизопирамид, флекаинид, прокаинамид, пропафенон, хинидин (меньшая результативность или изученность).
Учитывая тот факт, что в нашей стране из перечисленных средств широко доступны только амиодарон, пропафенон, хинидин и прокаинамид, препаратами выбора для фармакологической кардиоверсии ФП становятся амиодарон (при персистирующей ФП и пароксизмальной ФП у лиц с органическими поражениями миокарда) и пропафенон (при пароксизмальной ФП у лиц без органической патологии сердца). Хинидин и прокаинамид выступают препаратами второй линии в случае недостаточной эффективности или непереносимости первых.
Препараты, применяемые для поддержания синусового ритма после кардиоверсии, представлены в табл. 4.13.
Таблица 4.13. Обычные дозы препаратов, применяемых для поддержания синусового ритма у больных с ФП (FusterV. et al., 2006)

Окончаниетабл. 4.13
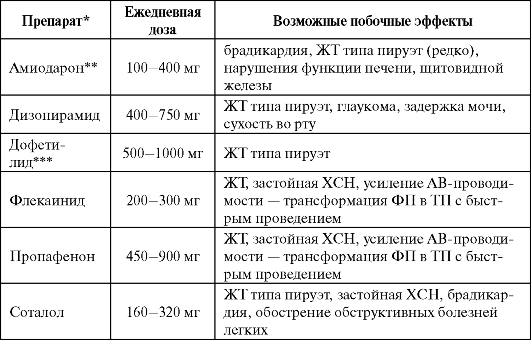
Примечание: * - препараты перечислены в алфавитном порядке; ** - нагрузочную дозу 600 мг/сут дают в течение 1 месяца, 1000 мг/сут - в течение 1 недели; *** - дозу корригируют с учетом функции почек и величины интервала QT на этапе начального лечения в стационаре.
В национальных рекомендациях для профилактики ФП, помимо приведенных в таблице ААС рекомендуют использовать: новокаинамид (1-4 г/сут); хинидин (600-1500 мг/сут), аллапинин (25-75 мг/сут) и этацизин (25-50 мг/сут). Следует иметь в виду, что из перечисленных средств лишь амиодарон и соталол можно относительно безопасно назначать больным с тяжелыми поражениями сердца.
Наряду с медикаментозными методами активно развиваются хирургические способы лечения ФП (изоляция устьев легочных вен методом катетерной абляции и пр., а также имплантация предсердного кардиовертера) и ТП (катетерная абляция зоны медленного проведения волны трепетания - каво-трикуспидального перешейка). Если место хирургических способов в лечении ФП еще окончательно не определено, то разрушение важного участка петли reentry при типичной форме ТП - эффективный способ ее лечения (эффективность до 88%).
Контроль частоты сокращений желудочков при ФП
Адекватное снижение ЧСС при ФП позволяет удлинить время наполнения желудочков, предупредить тахизависимые нарушения внутрижелудочковой проводимости и ишемию миокарда. Важно добиться требуемой частоты сокращений желудочков не только в покое, но и при физической нагрузке. Между тем, не существует единых критериев адекватного контроля ЧСС, основанных на оценке качества жизни и частоты развития аритмогенной кардиомиопатии. Предложены следующие ориентиры: ЧСЖ 60-80 в мин в покое и 90-115 в мин при умеренной физической нагрузке (вариант: максимальная ЧСС при тесте с 6-минутной ходьбой - до 11О в мин); средняя ЧСС при холтеровском мониторировании до 100 в мин при пиковых колебаниях, не превышающих 100% от расчетной максимальной ЧСС для данного возраста.
Фармакологические средства для контроля ЧСС при ФП/ТП представлены в табл. 4.14. БАБ - наиболее эффективные ААС для огра- ничения ЧСС, как в покое, так и при физической нагрузке. В числе их недостатков - избыточное урежение ритма и снижение физической работоспособности, необходимость постепенного наращивания доз БАБ при ХСН. Среди БАБ наиболее предпочтительны атенолол и надолол, такое же действие оказывает соталол (ААС III класса).
БКК (верапамил и дилтиазем) несколько уступают β-адреноблокаторам по эффективности, но обеспечивают лучшие качество жизни и толерантность к физическим нагрузкам, а поэтому показаны при плохой переносимости БАБ. В то же время они могут ухудшить течение ХСН.
Сердечные гликозиды контролируют ЧСЖ только в покое, поэтому их назначают лицам с малоподвижным образом жизни. Для ограни- чения ритма при физической нагрузке дигиталис необходимо комбинировать с БАБ (реже с БКК). Дигоксин показан при персистирующей ФП у больных с обострением ХСН или дисфункцией ЛЖ, но малоэффективен при пароксизмальной форме ФП.
Амиодарон используют тогда, когда адекватного контроля частоты желудочковых сокращений не удалось добиться всеми предыдущими средствами. Сильно ограничивает применение препарата большое число побочных эффектов при длительном лечении.
В острой ситуации для снижения ЧСС при ФП внутривенно вводят БАБ (пропранолол, метопролол, эсмолол) и БКК (верапамил, дилтиазем), а также сердечные гликозиды (при выраженной ХСН и гипотензии). Между тем, эти ААС противопоказаны больным с синдромом WPW (наряду с аденозином и лидокаином), так как могут вызвать ус-
Таблица 4.14. Средства контроля частоты сердечных сокращений у больных с ФП (Fuster V. et al., 2006, с изменениями)
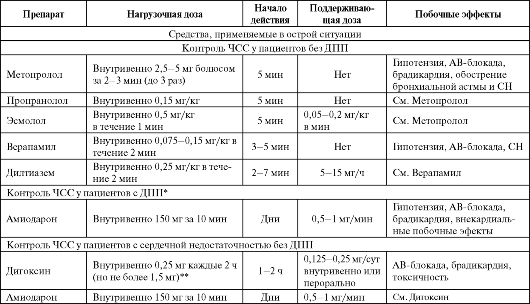
Окончание таблицы 4.14
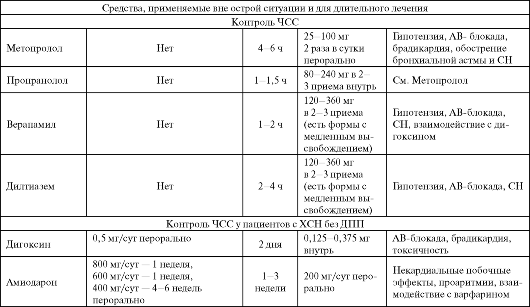
Примечание: * - у пациентов с ДПП предпочтительно выполнение кардиоверсии с последующей катетерной абляцией ДПП; ** - в России принято медленное насыщение дигоксином в виде регулярной инфузии поддерживающих доз (это обусловлено отсутствием возможности для исследования концентрации дигоксина в крови).
корение антеградного проведения по ДПП, резкое увеличение частоты желудочковых ответов, гипотензию и ФЖ. Поэтому для экстренного контроля ЧСС у больных с синдромом WPW используют внутривенное введение ААС IA и III классов (прокаинамид, дизопирамид, амиодарон, ибутилид). Важно отметить, что пероральный прием БАБ и БКК не провоцирует опасных аритмий у пациентов с ДПП.
Хирургические методы контроля ЧСС при ФП включают регуляцию АВ-проведения путем стимуляции (за счет создания ретроградной АВ-блокады) и абляцию АВУ с имплантацией ЭКС. Последний метод более эффективен, но предполагает перманентный прием антикоагулянтов, нарушение синхронизма желудочков и пожизненную зависимость от кардиостимулятора. Следовательно, к абляции АВУ прибегают лишь тогда, когда возможности фармакологической коррекции ЧСС исчерпаны.
Профилактика тромбоэмболии
Антитромботическая терапия показана всем пациентам с ФП (независимо от ее формы: пароксизмальной, персистирующей или хронической), за исключением пациентов с изолированной ФП и больных, имеющих противопоказания. У пациентов с низким риском тромбоэмболий используют аспирин, у пациентов с повышенным риском - непрямые антикоагулянты. Профилактику тромбоэмболий у больных с ТП проводят по тем же принципам, что и у больных с ФП.
Таблица 4.15. Подход к антитромботической терапии у больных ФП на основании оценки риска (FusterV. et al., 2006)

Окончаниетабл. 4.15
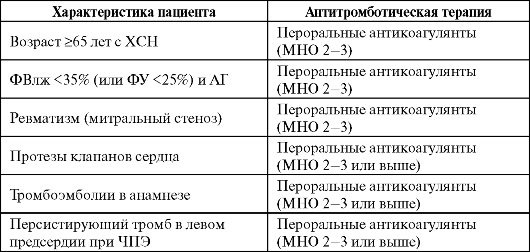
Примечание: * - факторы риска: сердечная недостаточность (ХСН), фракция выброса ЛЖ (ФВлж) <35%, артериальная гипертензия (АГ) в анамнезе; СД - сахарный диабет; ИБС - ишемическая болезнь сердца; ФУ - фракция укороче- ния ЛЖ; ЧПЭ - чреспищеводная эхокардиография.
Тактика лечения больных с ФП/ТП
Впервые выявленная пароксизмальная ФП при стабильной гемодинамике активного лечения не требует: назначают антикоагулян- тную терапию и при необходимости контролируют ЧСС. При впервые выявленной персистирующей ФП может быть избрана тактика контроля ЧСС с одновременным назначением антикоагулянтов либо выполнена кардиоверсия (ей обычно предшествует фармакологический контроль ЧСС и предварительное назначение антикоагулянтов). Антиаритмические препараты на длительный срок не назначают.
При рецидивирующей пароксизмальной ФП в случае отсутствия или минимальной выраженности симптоматики медикаментозная профилактика пароксизмов не требуется. При выраженных симптомах необходим длительный прием ААС. Антикоагулянты и препараты для контроля ЧСС, как правило, необходимы в обеих ситуациях. В случае неэффективности ААС можно рассмотреть вопрос об абляции аритмогенных зон.
Рецидивирующая персистирующая ФП при отсутствии или минимальной симптоматике требует лишь адекватной антикоагулянтной терапии и, по необходимости, контроля ЧСС. В случае выраженной симптоматики больному выполняют электрическую кардиоверсию (при условии адекватного контроля ЧСС, антикоагулянтной подгото-
вительной терапии и предварительного назначения ААС для профилактики ранних рецидивов). Затем назначают ААС для поддержания синусового ритма и продолжают антикоагулянтную терапию. При ре- цидиве ФП с выраженными симптомами на фоне терапии одним или несколькими ААС и препаратом для контроля ЧСС рассматривают вопрос об абляции. Постоянная форма ФП означает лечение антикоагулянтами и, при необходимости, контроль ЧСС.
Прежде чем начинать медикаментозную терапию, направленную на профилактику приступов ФП, следует устранить обратимые при- чины возникновения аритмии (злоупотребление алкоголем, инфаркт миокарда, перикардит, миокардит, тромбоэмболия легочной артерии, гипертиреоз и другие нарушения метаболизма).
Выбор того или иного ААС для профилактики приступов ФП определяется двумя факторами: клиническим вариантом течения ФП и, главным образом, безопасностью данного ААС, которая во многом определяется характером и тяжестью имеющегося заболевания сердца.
Если ФП возникает в основном при физической нагрузке (адренергическая форма), целесообразно первоначальное назначение БАБ, хотя практика показывает, что рецидивы аритмии редко определяются единственным специфическим механизмом, препаратами резерва в этом случае будут соталол, а затем - амиодарон. У больных с вагусным вариантом ФП препаратом выбора может стать дизопирамид, а средствами второй и третьей линии - соответственно флекаинид (а в России также аллапинин) и амиодарон. При недостаточной эффективности профилактики ФП возможна комбинация ААС, например:
- БАБ или ААС III класса (соталол или амиодарон) в сочетании с ААС IС класса (флекаинид, аллапинин, пропафенон);
- БКК (верапамил, дилтиазем) в сочетании с ААС IС класса. Выбор ААС для поддержания синусового ритма определяется не
только клиническим вариантом ФП, но и профилем безопасности, зависящим от характера и степени поражения сердечно-сосудистой системы у пациента. Так, больным с отсутствием заболевания сердца или минимально выраженными изменениями миокарда показаны БАБ, а при их неэффективности - флекаинид, пропафенон, соталол, при неэффективности последних - препараты резерва: амиодарон и дофетилид (в РФ - только амиодарон). В случае безуспешности такого лечения выполняют катетерную абляцию ФП. У больных с артериальной гипертензией без выраженной гипертрофии миокарда ЛЖ алгоритм назначения ААС тот же, что и у пациентов без структурной
патологии сердца. При гипертензии и выраженной гипертрофии левого желудочка (толщина стенок ≥
Показателем эффективности медикаментозной антиаритмической терапии служат нечастые, хорошо переносимые рецидивы ФП. Во время постоянного приема ААС необходимо следить за интервалом QRS - для ААС IС класса (увеличение не более чем на 50%), за интервалом QT - для ААС IA и III класса (QTc <520 мс), контролировать уровни калия и магния и креатинина плазмы; кроме того, больные должны быть предупреждены об опасности одновременного использования некардиотропных лекарств, удлиняющих реполяризацию желудочков (интервал QT).
Лечение желудочковых тахиаритмии
Желудочковые
аритмии (ЖА) создают непосредственную угрозу для жизни, так как могут
вызвать резкое снижение сердечного выброса, фактически - остановку
сердечной деятельности, которая приведет к смерти, если аритмия не
будет купирована. Не случайно вышедшие в
Классификация желудочковых аритмий (Zipes D. Р., 2006)
• Неустойчивая ЖТ (длительность пароксизма <30 с):
- мономорфная;
- полиморфная.
• Устойчивая ЖТ (длительность пароксизма ≥ 30 с):
- мономорфная;
- полиморфная.
• ЖТ с петлей re-entry по ножкам пучка Гиса.
• Двунаправленная ЖТ.
• ЖТ типа пируэт (torsades de pointes).
• Трепетание желудочков.
• Фибрилляция желудочков.
По клиническим проявлениям желудочковые аритмии делят на гемодинамически стабильные (бессимптомные и малосимптомные) и гемодинамически нестабильные (проявляются пресинкопами, синкопами, внезапной сердечной смертью или внезапной остановкой сердца - в случае успешной реанимации). ЖТ/ФЖ могут возникать как при явной кардиальной патологии (ИБС, кардиомиопатии, врожденные пороки сердца, сердечная недостаточность), так и у людей с нормальной структурой сердца.
Общий подход к лечению желудочковых аритмий
ААС, которыми располагает современная медицина, оказались неэффективными при первичном лечении жизнеопасных желудочковых нарушений ритма и в профилактике внезапной сердечной смерти (по данным рандомизированных исследований). Исключение составляют только БАБ (II класс ААС), однако они далеко не всегда устраняют ЖА, в то время как более активные амиодарон и соталол не могут достоверно улучшить выживаемость, а прочие ААС способны даже ее ухудшить. Сегодня огромную роль в лечении ЖА играют немедикаментозные методы: имплантация кардиовертера-дефибриллятора (ИКД), катетерная абляция, наконец, хирургические операции различного рода (иссече- ние аневризмы, реваскуляризация и пр.).
Таким образом, ААС (за исключением БАБ) не следует назначать для первичного лечения ЖА и профилактики внезапной сердечной смерти. Применение ААС у больных с желудочковыми аритмиями ограничено следующими ситуациями:
• Неотложное лечение (купирование) ЖТ и ФЖ.
• Лечение пациентов с ЖА, которым не показан ИКД, в случае неэффективности полныхдоз БАБ (показаны амиодарон, соталол).
• Лечение пациентов с ИКД и феноменом «шторма желудочковой тахикардии» - частых разрядов дефибриллятора из-за непрерывного или частого рецидивирования ЖА (соталол, а у больных с ХСН и дисфункцией ЛЖ - комбинация БАБ с амиодароном).
• Лечение пациентов с ИКД и пароксизмальной или постоянной ФП с частыми ответами желудочков, стимулирующих ложные срабатывания прибора (БАБ, БКК или их комбинация, при неэффективности - амиодарон).
• Дополнительное лечение пациентов с ЖА в отдельных ситуациях. Следует также отметить, что некоторые препараты, обладающие
вторичными антиаритмическими свойствами, способны снизить вероятность внезапной сердечной смерти при различных заболеваниях
сердца, влияя на первичные причины развития ЖА: это электролиты (соли калия и магния); ингибиторы АПФ, блокаторы рецепторов ангиотензина II, антагонисты альдостерона и статины (возможно, также ω-3 полиненасыщенные жирные кислоты).
Купирование различных желудочковых аритмий
Остановка сердца
Остановка сердца в 74% случаев сопряжена с ЖА (ФЖ, ЖТ с отсутствием пульса). Если причиной остановки сердца стала ФЖ и полиморфная ЖТ, то выполняют немедленную дефибрилляцию (оптимально в течение 1-2-й мин после развития остановки сердца) несинхронизированным разрядом 360 Дж (для монофазного тока), если мономорфная ЖТ - синхронизированным разрядом 360 Дж. В случае, когда для подготовки к дефибрилляции требуется больше 2 мин, начинают мероприятия по сердечно-легочной реанимации для улучшения оксигенации.
После первого разряда внутривенно вводят 1 мг адреналина (1 мл 0,1% раствора) с последующим повторным разрядом 360 Дж (если ФЖ не купирована), адреналин при необходимости вводят в той же дозе с интервалами в 3-5 минут, сопровождая повторными разрядами между введениями до эффекта. Если ФЖ/ЖТ рецидивирует после успешной дефибрилляции максимальным разрядом, для поддержания стабильного ритма после дефибрилляции внутривенно вводят амиодарон в дозе 300 мг болюсом (при необходимости возможно однократное пов- торное введение 150 мг препарата) с последующим разрядом 360 Дж. При резистентности к амиодарону могут использоваться:
- лидокаин (1,0-1,5 мг/кг внутривенно болюсом, повторно в дозе 0,5-0,75 мг/кг до общей дозы не более 3 мг/кг);
- магния сульфат внутривенно в дозе 1-2 г (4-8 мл 25% MgS04) в течение 1-2 мин;
- БАБ (пропранолол внутривенно 1 мг повторными болюсами до общей дозы 15-20 мг, метопролол 5 мг внутривенно болюсами до общей дозы 20 мг);
- прокаинамид (17 мг/кг со скоростью 30 мг/мин) допускается, но не рекомендуется.
При резистентных или упорно рецидивирующих ЖА необходима оценка кислотно-основного баланса и электролитного обмена. Метаболический ацидоз компенсируют адекватной вентиляцией легких, однако при предшествующих чувствительных к бикарбонату
причинах ацидоза, при передозировке некоторых препаратов (прокаинамид) и длительной реанимации полезны небольшие дозы натрия бикарбоната внутривенно. При наличии гиперкалиемии, гипокальциемии, интоксикации БКК внутривенно вводят 10% раствор кальция глюконата (5-20 мл со скоростью 2-4 мл/мин).
Если после успешной реанимации у больных ИБС с острым коронарным синдромом возникают рецидивирующие желудочковые нару- шения ритма с нестабильностью гемодинамики, то для их купирования применяют:
• При мономорфных ЖТ у больных с низкой сократительной функцией ЛЖ:
- амиодарон внутривенновдозе 150 мг за 10 мин, или
- лидокаин внутривенно 0,5-0,75 мг/кг болюсом.
• При мономорфных ЖТ у больных с сохранной сократительной функцией ЛЖ:
- прокаинамид, или соталол, или лидокаин, или амиодарон.
• При полиморфных ЖТ и нормальном исходном QT npи низкой сократимости ЛЖ:
- амиодарон или лидокаин.
• При полиморфных ЖТ и нормальном исходном QT npи сохранной сократимости ЛЖ:
- БАБ и коррекция электролитов в комбинации с лидокаином или амиодароном или прокаинамидом или соталолом.
• При полиморфных ЖТ и длинном исходном QT.
- коррекция содержания электролитов;
- магния сульфат;
- стимуляция желудочков, изопротеренол;
- фенитоин или лидокаин.
Устойчивая мономорфная желудочковая тахикардия
Любая тахикардия с широкими комплексами QRS должна рассматриваться как ЖТ, если не доказано обратное. Если мономорф- ная ЖТ сопровождается нестабильностью гемодинамики, абсолютно показана экстренная кардиоверсия (исходный разряд от 100 Дж для монофазного тока). Препарат выбора при мономорфной ЖТ и стабильной гемодинамике: прокаинамид (внутривенно 50 мг/мин в дозе 15 мг/кг), возможная альтернатива у больных с ишемией миокарда или инфарктом миокарда - лидокаин (1-1,5 мг/кг внутривенно болюсом). В случае устойчивой мономорфной ЖТ с нестабильной гемодинамикой, резистентной к кардиоверсии, или рецидивирую-
щих ЖТ после введения новокаинамида или лидокаина - применяют амиодарон (внутривенно 150 мг болюсом, при необходимости с введением поддерживающих доз).
Постоянно-возвратная мономорфная желудочковая тахикардия
Эта форма чаще отмечается в покое, наблюдается длительное время, редко сопровождается гемодинамической нестабильностью и требует экстренных мер. По происхождению это идиопатическая тахикардия из выносящего тракта правого желудочка, редко - у больных с постинфарктным кардиосклерозм. Купирование достигается внутривенным введением амиодарона, БАБ или прокаинамида. Наилучший способ лечения - абляция зоны ЖТ в выносящем тракте правого желудочка.
Полиморфная желудочковая тахикардия
Полиморфная ЖТ может быть устойчивой или самокупирующейся (при этом на ЭКГ между пароксизмами ЖТ будут участки сину- сового ритма). Основная ее причина - ишемия миокарда, хотя эта аритмия наблюдается и при кардиомиопатиях, ХСН, врожденных дефектах (катехоламинергическая ЖТ) и идиопатических состояниях. Полиморфную ЖТ с нормальным QT по морфологии желудочковых комплексов не всегда легко отличить от полиморфной ЖТ с длинным QT (пируэт). Это легче выполнить, анализируя QT на исходной ЭКГ или на участках синусового ритма между нестойкими пароксизмами.
Если полиморфная ЖТ сопровождается нестабильностью гемодинамики, абсолютно показана экстренная кардиоверсия (после предварительной седации), которая может выполняться повторно в любой фазе лечебных мероприятий. При рецидивах полиморфной ЖТ полезно внутривенное введение БАБ, особенно, если имеет место или предполагается ишемия миокарда. При недостаточной эффективности БАБ внутривенно вводят амиодарон, но только в случае, если ЖТ не связана с врожденным или приобретенным удлинением QT(!). Если последнее исключить нельзя, допустимо использование лидокаина внутривенно, особенно у пациентов с ишемией миокарда. При упорной полиморфной ЖТ и подозрении на ишемию миокарда выполняют коронарографию с целью последующей реваскуляризации.
ЖТ типа пируэт (torsades de pointes)
Эта разновидность полиморфной ЖТ обусловлена тремя главными причинами: врожденным удлинением QT («синдром длинного QT»), медикаментозно индуцированным удлинением QT, тяжелыми нару-
шениями внутрижелудочковой проводимости с развитием дистальной полной АВ-блокады. Алгоритм лечения включает:
1) отмену препаратов, удлиняющих QT;
2) коррекцию баланса электролитов (фактор провокации аритмии);
3) временную, а затем постоянную электрокардиостимуляцию пациентам, у которых ЖТ вызвана АВ-блокадой и симптомной брадикардией, или имеет пауза-зависимый характер;
4) назначение БАБ лицам с ЖТ и синусовой брадикардией в комбинации с кардиостимуляцией;
5) внутривенное введение магния сульфата (1-2 г) лицам с удлинением QT;
6) введение изопротеренола при пауза-зависимой ЖТ, но не лицам с врожденным удлинением QT(!).
Мало изучены эффективность внутривенного введения калия (для достижения уровня в плазме крови 4,5-5 ммоль/л), а также польза внутривенного введения лидокаина или перорального приема мексилетина лицам с Х£773-вариантом синдрома врожденного удлинения QT.
Некупируемая желудочковая тахикардия
Это понятие предполагает два варианта ЖТ: устойчивую мономорфную или полиморфную ЖТ со стабильной гемодинамикой, длящу- юся часы; частые рецидивы ЖТ, требующие частых разрядов ИКД (обычно 2 и более раз в сутки) - «шторм желудочковой тахикардии» (как полиморфной, так и мономорфной). Основными причинами этих состояний являются тяжелые заболевания сердца, в том числе ишемия миокарда, однако иногда этот феномен наблюдается у пациентов без грубых структурных изменений в сердце (синдром Бругада, синдром длинного QT, катехоламинергическая ЖТ, лекарственные проаритмии).
Если этиологическим фактором некупируемой или часто рецидивирующей полиморфной ЖТ выступает ишемия - абсолютно показано внутривенное введение БАБ с последующей реваскуляризацией; при недостаточной активности БАБ используют прокаинамид или амиодарон. При стойкой мономорфной ЖТ применяют внутривенно амиодарон или прокаинамид, а также катетерную абляцию ЖТ. При «шторме желудочковой тахикардии» могут оказаться полезными внутривенное введение амиодарона, БАБ или их комбинации, учащающая стимуляция желудочков, модуляция спинного мозга.
Применение ААС для лечения и профилактики желудочковых аритмий у отдельных категорий больных
У пациентов с дисфункцией ЛЖ после перенесенного инфаркта миокарда ведущую роль в профилактике внезапной смерти играют агрессивное лечение ХСН, коронарная реваскуляризация, имплантация ИКД и лечение БАБ. Между тем, если симптомы, связанные с ЖТ, не удается устранить или предупредить БАБ, рекомендуют применение амиодарона (в монотерапии или в комбинации с БАБ), а также соталола. Даже при имплантации ИКД амиодарон или соталол следует использовать в качестве дополнительных средств при частых рецидивах ЖТ/ФЖ. Кроме того, амиодарон (наряду с БАБ) назначают пациентам с дисфункцией ЛЖ после инфаркта миокарда для профилактики ЖТ и облегчения симптоматики при рецидивах гемодинамически стабильных ЖТ у лиц, которым ИКД показан, но не имплантирован из-за отсутствия возможности или отказа самого пациента. Важно отметить, что профилактическое применение ААС у больных с бессимптомными неустойчивыми ЖА после перенесенного инфаркта миокарда не приводит к снижению смертности, а ААС IС класса таким больным вообще не следует назначать.
ЖА - одна из основных причин смертности у больных с ХСН, между тем имплантация ИКД не гарантирует адекватный контроль частоты рецидивов ЖА. Поэтому амиодарон, соталол и или БАБ назначают больным ХСН в дополнение к ИКД для подавления устойчивых и неустойчивых симптомных ЖА. Кроме того, амиодарон показан для купирования желудочковых и наджелудочковых аритмий, сопровождающихся нестабильностью гемодинамики, в случае, если кардиоверсия или устранение обратимых причин не привели к купированию аритмии или предупреждению ее раннего рецидива. В целом амиода- рон, соталол и БАБ могут рассматриваться как альтернатива ИКД при подавлении устойчивых и неустойчивых симптомных ЖА у больных с ХСН, у которых имплантацию ИКД выполнить невозможно.
У больных миокардитом в острой фазе процесса при возникновении устойчивых ЖТ и неустойчивых симптомных ЖТ средствами вы- бора являются только ААС (в частности, амиодарон), поскольку в эту фазу заболевания имплантация ЭКС не показана.
Риск ЖА и внезапной смерти у больных дилатационной кардиомиопатией весьма высок, основной способ профилактики - ИКД, однако амиодарон может быть применен в случае устойчивых ЖТ или ФЖ, если кардиомиопатия имеет неишемический генез. Кроме того, амиодарон применяют у больных гипертрофической кардиомиопатией для
профилактики ЖА при указаниях на эпизоды ЖТ или ФЖ в анамнезе, а также для первичной профилактики внезапной смерти у лиц с одним и более фактором риска, если имплантация ИКД невыполнима. В той же ситуации у больных с аритмогенной дисплазией правого желудочка для лечения ЖА рекомендованы амиодарон и соталол, нередко в сочетании с абляцией аритмогенных зон.
БАБ показаны всем больным с синдромом врожденного удлинения QT, а также лицам с генными маркерами этого синдрома при нормальном интервале QT в связи с повышенным риском внезапной смерти. ИКД (при одновременном назначении БАБ) имплантируют лицам, выжившим после остановки сердца и, возможно, лицам с наиболее неблагоприятными LQT2 и LQT3 подтипами синдрома, а также в случае, если прием БАБ не предупреждает рецидив ЖА или синкопы.
Синдром Бругада, как и синдром длинного QT, характеризуется аномалиями ЭКГ и высоким риском внезапной сердечной смерти от желудочковых аритмий у больных нормальной структурой сердца. Типичный ЭКГ-паттерн - косонисходящая элевация сегмента ST oт высоко расположенной точки / в правых (V- V3) грудных отведениях. Единственный способ профилактики внезапной смерти - ИКД (у пациентов с ЖА, синкопами или остановкой сердца в анамнезе). ААС могут быть полезны только в случае возникновения «электрического шторма», причем для этой цели могут использоваться изопротеренол и, возможно, хинидин.
Особенностью катехоламинергической полиморфной ЖТ - еще одного генетического синдрома является возникновение приступов двунаправленной ЖТ во время физической нагрузки или острого стресса при отсутствии специфических изменений исходной ЭКГ. Основной метод профилактики - назначение БАБ, а также комбинация БАБ и ИКД у пациентов, перенесших остановку сердца, а также у больных, у которых БАБ не предупреждали рецидивы синкоп или ЖА.
К идиопатическим ЖТ относят тахикардии из выносящего тракта правого или левого желудочков (по механизму триггерные, обусловлены поздними постдеполяризациями), а также левожелудочковые фасцикулярные тахикардии (по механизму реципрокные). ЖТ из выносящего тракта правого желудочка эффективно подавляются БАБ, БКК или их комбинацией, а также ААС IС класса. Наилучший способ лечения ЖТ из выносящего тракта правого или левого желудочков - катетерная абляция, она показана в тех случаях, когда больной отказывается принимать ААС, когда ААС неэффективны или плохо
переносятся. При безуспешности лекарственного лечения и абляции целесообразна имплантация ИКД.
Нарушения обмена электролитов могут провоцировать опасные ЖА у пациентов с различными болезнями сердца, а также у лиц с нормальным по структуре сердцем. Так, резкая гиперкалиемия, ги- покалиемия (<3,5 ммоль/л) и гипомагниемия могут вызывать ЖА и внезапную смерть в острый период инфаркта миокарда и у лиц без патологии сердечно-сосудистой системы. ЖТ по типу пируэт - типичное проявление гипомагниемии, которая часто сочетается с гипокалиемией. Последняя может стать причиной ЖА у больных с артериальной гипертензией и ХСН (гипокалиемию провоцирует прием тиазидных и петлевых диуретиков), при остром голодании, алкогольной интоксикации или абстиненции, интоксикации дигиталисом или ААС I класса. Таким образом, введение солей калия и магния полезно при купировании ЖА, вызванных их дефицитом на фоне приема диуретиков, у пациентов с нормальным по структуре сердцем. При этом следует поддерживать уровень калия плазмы выше 4,0 ммоль/л у пациентов без структурных аномалий сердца, этот же уровень калия необходимо поддерживать в острую фазу инфаркта миокарда (4,5-5,0 ммоль/л при удлинении QT, вызванном лекарствами). Соли магния эффективны при лечении ЖА, вызванных интоксикацией сердечными гликозидами.
ЛИТЕРАТУРА
АрдашевВ.Н. Лечение нарушений сердечного ритма / В.Н.Ардашев, В. И. Стеклов. - Μ.: ГВКГ им. акад. Η. Н. Бурденко, 1998. - 165 с.
БелоусовЮ. Б. Клиническая фармакология и фармакотерапия. - 2-е изд., стереотип. / Ю. Б. Белоусов, В. С. Моисеев, В. К. Лепахин. - М.: Универсум паблишинг, 2000. - 539 с.
Бобров Л. Л. Клиническая фармакология и фармакотерапия внутренних болезней / Л. Л. Бобров, В. В. Гайворонская, А. Н. Куликов и др.; под ред. Л. Л. Боброва.-СПб.,2000.- 368с.
Диагностика и лечение фибрилляции предсердий: Российские рекомендации // Приложение к журналу «Кардиоваскулярная терапия и профилактика».-М.,2005.-28с.
Желудочковая экстрасистолия (клиническая значимость, диагностика, лечение): методические рекомендации (МЗ РФ; НИИ кардиологии; Ленинградский обл. кардиол. диспансер) / Л. В. Чирейкин, Ю. В. Шубик, Л. А. Кофаль, Б. А. Татарский, Μ. М. Медведев; под ред. Л. В. Чирейкина. - СПб., 1993.- 21 с.
Канорский С. Т. Новые международные рекомендации по лечению фибрил- ляции предсердий и желудочковых аритмий / С. Г. Канорский // Клиническая фармакология и терапия. - 2007. - Τ 16, ? 4. - С. 46-49.
Катцунг Б. Г.Базисная и клиническая фармакология: в 2 т. - Τ 1: пер. с англ. / Б. Г. Катцунг - М. - СПб.: Бином - НевскийДиалект, 1998. - 612 с.
Корзун А. И. Лечение нарушений ритма сердца / А. И. Корзун, А. М. Подлесов. - www.cardiosite.ru/clinical-lectures/article.asp7id = 846.
Кушаковский М. С. Аритмии сердца: руководство для врачей. - 3-е изд., испр. и доп. / М. С. Кушаковский. - СПб.: ООО «Издательство Фолиант», 2004. - 672 с.
Мазур Н. А. Внезапная смерть (стратификация риска и профилактика) / Н. А. Мазур // Сердце: журнал для практикующих врачей. - 2006. - Т. 5, ? 1 (25). - С. 24-32.
Мазур Н.А. Основы клинической фармакологии и фармакотерапии в кардиологии / Н. А. Мазур. - М.: Медицина, 1988. - 302 с.
Метелица В. /^Справочник по клинической фармакологии сердечно-сосудистых лекарственных средств. - 3-е изд. / В. И. Метелица. - М.: Медицинское информационное агентство, 2005. - 1528 с.
Основы клинической фармакологии и рациональной фармакотерапии: руководство для практикующих врачей. - М.: Бионика, 2002. - 368 с.
Пароксизмальные наджелудочковые реципрокные тахикардии: патогенез, клиника, диагностика, лечение : методические рекомендации (МЗ РФ; НИИ кардиологии) / Л. В. Чирейкин, Ю. В. Шубик, Μ. М. Медведев, Б. А. Татарский; под. ред. Л. В. Чирейкина. - СПб., 1993. - 37 с.
Перепеч Н. Б. Бета-адреноблокаторы в терапии ИБС / Н. Б. Перепеч // Сердце: журналдля практикующихврачей. - 2006. - Т. 5, ? 2 (26). - С. 70-72.
Подлесов А. М. Мерцательная аритмия / А. М. Подлесов, С. А. Бойцов, Д. Ф. Егоров и др.; под ред. С. А. Бойцова. - СПб.: ЭЛБИ-СПб, 2001. - 335 с.
Фогорос Р. М. Антиаритмические средства. - 2-е изд., испр.: пер с англ. / Р. М. Фогорос. - М. - СПб.: Издательство «БИНОМ - Невский Диалект», 2002. - 190 с.
Antman Ε. МАСС/AHA Guidelines for the Management of Patients With >ST-Elevation Myocardial Infarction - Executive Summary A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 1999 Guidelines for the Management of Patients With Acute Myocardial Infarction) / Ε. M. Antman et al. // JACC. - 2004. - Vol. 44, ? 3. - P. 671-719.
Castro A. New antiarrhythmic drugs for the treatment of atrial fibrillation / A. Castro, L. Bianconi, M. Santini // Pacing Clin. Electrophysiol. - 2002. - Vol. 25, ? 2. - P. 249-259.
Connoly S. Meta-analysis of the implantable cardioverter defibrillator secondary prevention trials / S. Connoly et al. // Eur. Heart J. - 2000. - Vol. 21, ? 24. - P. 2071-2078.
Farre J. Amiodarone and 'primary' hrevention of sudden death: critical review of a decade of clinical trials / J. Farre et al. //Am. J. Cardiol. - 1999. - Vol. 83, ?5B.- Ρ 55D-63D.
Fuster V. ACC/AHA/ESC 2006 Guidelines for the management of patients with atrial fibrillation /V. Fuster et al. // J. Am. Coll. Cardiol. - 2006. - Vol. 48, ? 4. - P. el49-e246.
Kowey P. Intravenous antiarrhythmic therapy in the acute control of in-hospital destabilizing ventricular tachycardia and fibrillation / P. Kowey et al. // Am. J. Cardiol. - 1999. - Vol. 84, ? 9A. - P. 46R-51R.
LopezrSendon J. Expert consensus document onb-adrenergic receptor blockers: the task Force on Beta-Blockers of the European Society of Cardiology / J. Lopez-Sendon et al. // Eur. Heart J. - 2004. - Vol. 25. - P. 1341-1362.
Naccarelli G. V. Old and new antiarrhythmic drugs for converting and maintaining sinus rhythm in atrial fibrillation: comparative efficacy and results of trials / G. V. Naccarelli et al. //Am. J. Cardiol. - 2003. - Vol. 91, ? 6A. - P. 15D-26D.
SinghB. N. Amiodarone versus sotalol for atrial fibrillation/B. N. Singh, S. N. Singh, D. J. Reda et al. // N. Engl. J. Med. - 2005. - Vol. 352, ?18. - P. 1861-1872.
The Sicilian Gambit. A new approach to the classification of antiarrhythmic drugs based on their actions on arrhythmogenic mechanisms // Circulation. - 1991. - Vol. 84, ? 4. - P. 1831-1851
Vaughan-Williams Ε. M. A classification of antiarrhythmic actions reassessed after a decade of new drugs / Ε. Μ Vaughan-Williams // J. Clin. Pharmacol. - 1984. - Vol. 24, ? 4. - P. 129-147.
Waldo A. L. Mechanisms of cardiac arrhythmias / A. L. Waldo, A. L. Wit // Lancet. - 1993,-Vol. 341, ? 8854. - P. 1189-1193.
Wyse D. G. A comparison of rate control and rhythm control in patients with atrial fibrillation / D. G. Wyse, A. L. Waldo, J. P. DiMarco et al. // N. Engl. J. Med. - 2002. - Vol. 347, ? 23. - P. 1825-1833.
Zipes D. P. ACC/AHA/ESC 2006 Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death / D. P. Zipes et al. // J. Am. Coll. Cardiol. - 2006. - Vol. 48, ?5- P. e247-e346.