Клиническая фармакология: избранные лекции / С.В. Оковитый, В.В. Гайворонская, А.Н. Куликов, С.Н. Шуленин. - 2009. - 608 с.
|
|
|
|
ЛЕКЦИЯ 9 КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ АНТИОКСИДАНТОВ
Патологические сдвиги гипоксического и свободнорадикального генеза очень часто встречаются совместно, так как все виды гипоксии обязательно сопровождаются активацией свободнорадикальных процессов. Однако избыточное усиление перекисного окисления белков и липидов может представлять и первичное звено патологии без предшествующей гипоксии, например, в начальной стадии лучевого поражения, при некоторых интоксикациях и др. Расстройства гипоксического и свободнорадикального происхождения по мере их нарастания могут привести к деструкции клеток и, следовательно, часто определяют судьбу органа, ткани и в конечном счете - всего организма. Отсюда вытекает актуальность разработки высокоэффективных антигипоксантов и антиоксидантов и их рационального применения.
Избыточная активация реакций свободнорадикального окисления представляет типовой патологический процесс, встречающийся при самых различных заболеваниях и повреждающих воздействиях на организм. Свободные радикалы - молекулы с неспаренными электронами, находящимися на внешней оболочке атома или молекулы, обладающие очень высокой реакционной способностью и, как следствие, выраженным повреждающим действием на клеточные структуры. В понятие свободного радикала не включаются ионы металлов пе- ременной валентности, неспаренные электроны которых находятся на внутренних оболочках.
Доказано участие свободных радикалов в патогенезе очень многих заболеваний (шок различного генеза; атеросклероз; нарушения мозгового, коронарного и периферического кровообращения; сахарный диабет и диабетическая ангиопатия; ревматоидные, воспалительные и дегенеративные заболевания опорно-двигательной системы; поражения глаз; легочные заболевания; онкологическая патология; термические поражения; различные интоксикации; реперфузионные поражения) и преждевременного старения. Кроме того, к повышенному образованию свободных радикалов в организме приводят прием препаратов с прооксидантными свойствами, проведение ряда лечебных процедур (кислородотерапия, гипербарическая оксигенация, ультра-
фиолетовое облучение, лазерная коррекция зрения, лучевая терапия), а также различные экологически неблагоприятные факторы окружающей среды.
Начальным этапом развития окислительного стресса является избыточное образование высокоактивных свободнорадикальных форм кислорода. Причинами этого могут быть во-первых, нарушение функций митохондрий с прекращением образования молекул воды (конечного продукта кислородного метаболизма) и накоплением промежуточных свободнорадикальных форм кислорода, во-вторых, подавление эндогенных антиоксидантных систем, нейтрализующих свободные радикалы. Образовавшиеся свободнорадикальные формы кислорода подвергают перекисной модификации фосфолипиды, а точнее, ненасыщенные жирные кислоты, входящие в их состав и высвобождающиеся при распаде фосфолипидов. В ходе этого окисления образуются свободнорадикальные формы указанных кислот с повреждающими свойствами и токсичные продукты окисления. В результате происходит деструкция клеточных структур вплоть до гибели клеток. Последовательность реакций свободнорадикального окисления представлена на схеме 9.1.
Процессы перекисного окисления липидов (ПОЛ) постоянно происходят в организме и имеют важное значение для обновления состава и поддержании функциональных свойств биомембран, энергетических процессов, клеточного деления, синтеза биологически активных веществ, внутриклеточной сигнализации. Через стадию перекисных производных ненасыщенных жирных кислот осуществляется биосинтез простагландинов и лейкотриенов, а тромбоксаны, оказывающие мощное влияние на адгезивно-агрегационные свойства форменных элементов крови и микроциркуляцию, сами являются гидроперекисями. Образование гидроперекисей холестерина - одно из звеньев в синтезе некоторых стероидных гормонов, в частности, прогестерона.
Избыточная активация процессов цепного свободнорадикального окисления липидов может привести к накоплению в тканях таких продуктов, как липоперекиси, радикалы жирных кислот, кетоны, альдегиды, кетокислоты, что, в свою очередь, повреждает и увеличивает проницаемость клеточных мембран, модифицирует структурные белки, ферменты, биологически активные вещества. Происходит активация процессов апоптоза - либо за счет прямого повреждения клеточных белков, либо за счет изменения характера транскрипции определенных генов. Наконец, свободные радикалы
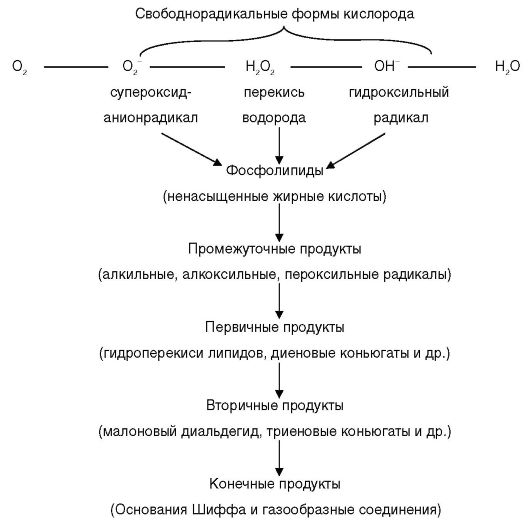
Схема 9.1. Последовательность реакций свободнорадикального окисления
могут играть роль сигнальных молекул, напрямую стимулирующих выход кальция из депо. Некоторые высокоактивные формы и соединения кислорода, азота и хлора, образующиеся в организме, представлены на схеме 9.2.
В реакциях одноэлектронного восстановления кислорода (в дыхательной цепи митохондрий, при аутоокислении избытка катехоламинов и др.) обычно участвует, наряду с молекулой, из которой радикал образуется, ион металла переменной валентности, выполняющий функцию донора или акцептора одного электрона. В результате образуется супероксидный анион-радикал, способный свободно мигриро-
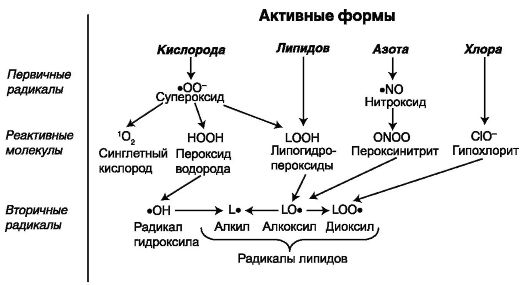
Схема 9.2. Активные формы кислорода, азота и хлора (Владимиров Ю. А., 1998)
вать от места своего образования через мембраны по анионным каналам, что обеспечивает его широкую распространенность в клеточных структурах.
Типичный пример реакции, в которой образуется радикал, - это реакция Фентона - взаимодействие пероксида водорода с ионом двухвалентного железа:
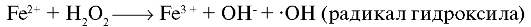
При высоких температурах или под действием ультрафиолетового излучения радикалы могут образовываться также в результате разрыва химической связи (гомолитическое расщепление), однако в обычных условиях такие реакции в нормальных живых клетках практически не имеют места.
Присоединение к супероксидному анион-радикалу еще одного электрона (двухэлектронное восстановление кислорода) приводит к образованию перекиси водорода. Это происходит либо в результате спонтанной дисмутации:

При взаимодействии перекиси водорода и молекулы супероксиданион-радикала, являющегося донором третьего электрона, в присутствии металлов с переменной валентностью образуется гидроксильный радикал, наиболее значимый для процессов пероксидации как самая агрессивная окисляющая форма восстановленного кислорода.
Одним из основных субстратов свободнорадикальных реакций являются насыщенные жирные кислоты, широко представленные в составе липидов мембран. В ходе первой, инициирующей ПОЛ, реакции образуется перекись водорода и радикал жирной кислоты:

Регулятором уровня ПОЛ в организме является антиоксидантная система, в составе которой достаточно условно можно выделить эндогенные антиоксиданты, металлсвязывающие белки и пищевые антиоксиданты.
Некоторые компоненты антиоксидантной системы (Percival M., 1998)
Эндогенные антиоксиданты
Неферментные:
• Билирубин.
• Тиолы (глутатион, α-липоевая кислота, N-ацетилцистеин).
• Тиоредоксин.
• НАДФ и НАДН.
• Убихинон (кофермент Q10).
• Мочевая кислота. Ферментные:
• Медь/цинк- и магнийзависимая супероксиддисмутаза.
• Железозависимая каталаза.
• Селензависимая глутатионпероксидаза.
• Селензависимая тиоредоксинредуктаза.
• Тиоредоксинпероксидаза.
Металлсвязывающие белки
• Альбумин (медь).
• Церулоплазмин (медь).
• Металлотионеин (медь).
• Ферритин (железо).
• Миоглобин (железо).
• Трансферрин (железо).
Пищевые антиоксиданты
• Аскорбиновая кислота (витамин С).
• α-токоферол (витамин Е).
• β-каротин и другие каротиноиды и оксикаротиноиды, в том числе ликопин и лютеин.
• Полифенолы, в том числе флавоноиды, флавоны, флавонолы и проантоцианидины.
К одним из основных ферментов, оказывающих антиоксидантное действие, относятся супероксиддисмутаза, каталаза, ферменты системы глутатиона. Супероксиддисмутаза и каталаза являются высокоспецифичными ферментами и нейтрализуют такие активные формы кислорода, как супероксидный анион-радикал и перекись водорода:
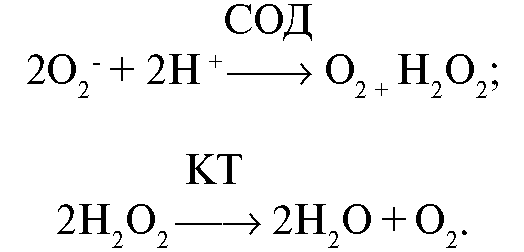
Помимо этих ферментов в разрушении активных форм и соединений кислорода принимают участие тиоредоксинпероксидаза (перок- сиредоксин), тиоредоксин и тиоредоксинредуктаза.
Важной составляющей антиоксидантной защиты является система глутатиона, нейтрализующая перекиси липидов и поддерживающая в восстановленном состоянии SH-группы белков, что обеспечивает их функциональную активность.
Глутатионпероксидаза (ГП, GSH-пероксидаза) - фермент, восстанавливающий перекись водорода и липоперекиси с одновременным окислением глутатиона (GSH):
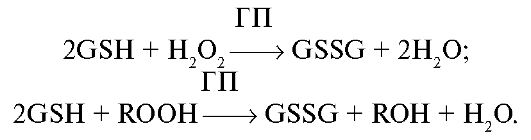
ГП обладает в 1000 раз бóльшим сродством к перекиси водорода по сравнению с каталазой, поэтому ГП рассматривают в качестве антиоксидантного фермента, имеющего первоочередное значение в защите клетки от постоянно образуемой перекиси водорода. Активность ГП прогрессивно возрастает в зависимости от количества возникающих липопероксидов. При этом накапливается окисленный глутатион, смешанные дисульфиды глутатиона и белков, снижается уровень NADPH, а затем и восстановленного глутатиона (GSH).
Глутатионредуктаза (ГР, GSH-редуктаза) катализирует восстановление окисленного глутатиона (GSSG), используя в качестве восстановительного эквивалента NADPH:
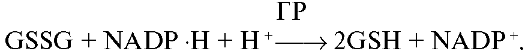
Окисление глутатиона в глутатионпероксидазной реакции, сопряженное с его восстановлением глутатионредуктазой, является определяющим фактором, поддерживающим восстановительный потенциал глутатиона.
Антиоксидантная активность восстановленного глутатиона (GSH) тесно связана с работой защитных ферментов системы глутатиона. В условиях активации перекисного окисления GSH снижается, а окисленного глутатиона - возрастает. На рисунке представлена нейтрализация свободных радикалов и перекисей системой глутатиона (схема 9.3).
Глутатион-S-трансферазы (ГST) - семейство мультифункциональных белков, использующих GSH для конъюгации с гидрофобными веществами, их восстановления или изомеризации. Биологическая роль ГST в организме заключается:
а) в биотрансформации ксенобиотиков:

Роль некоторых эндогенных антиоксидантных ферментов представлена на схеме 9.4.
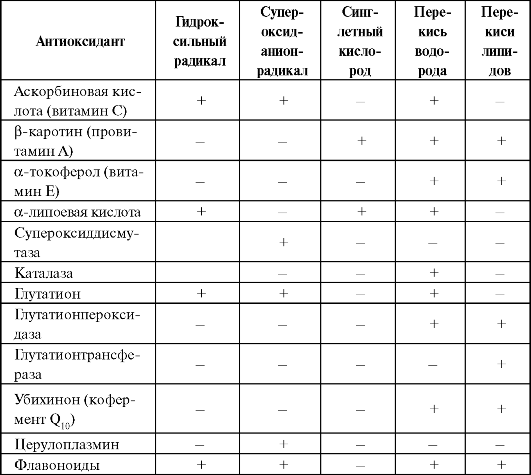
В наиболее общем виде спектр биологической активности некоторых естественных антиоксидантов представлен в табл. 9.1.
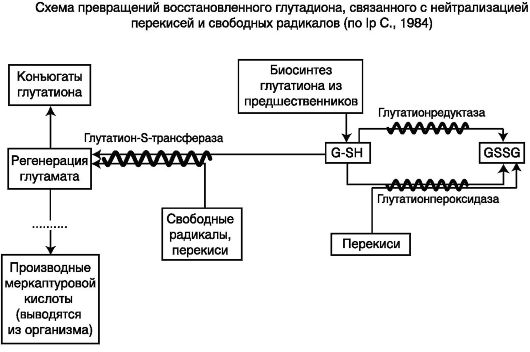
Схема 9.3. Нейтрализация свободных радикалов и перекисей системой глутатиона
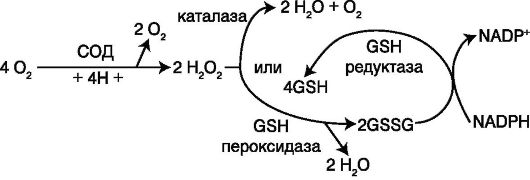
Схема 9.4. Участие некоторых эндогенных антиоксидантных ферментов в антиоксидантной защите (Proctor P. H., Reynolds E. S., 1984)
Таблица 9.1. Некоторые высокоактивные формы и соединения кислорода и нейтрализующие их естественные антиоксиданты (Percival M., 1998, с изменениями и дополнениями)
Препаратами, ограничивающими активность процессов свободнорадикального окисления, являются антиоксиданты.
Классификация антиоксидантов
1. Антирадикальные средства.
1.1. Эндогенные соединения.
1.2. Синтетические препараты.
2. Антиоксидантные ферменты и их активаторы.
2.1. Препараты супероксиддисмутазы.
2.2. Препараты ферроксидазы (церулоплазмина).
2.3. Активаторы антиоксидантных ферментов.
3. Блокаторы образования свободных радикалов.
9.1. АНТИРАДИКАЛЬНЫЕ СРЕДСТВА
Эндогенные соединения
• α-токоферол (витамин Е).
• β-каротин (провитамин А).
• Карнозин.
• Кислота аскорбиновая (витамин С).
• Глутатион восстановленный (Татионил).
• Кислота α-липоевая (Тиоктацид).
• Убихинон (Убинон).
• Ретинол (витамин А).
Механизм действия антирадикальных средств («скэвенджеров») заключается в непосредственном взаимодействии данных препаратов со свободными радикалами с их нейтрализацией.
Наиболее изученное антирадикальное средство - α-токоферол (витамин Е). Строго говоря, термин «витамин Е» является собирательным названием для группы токоферолов - α, β и γ, которые обладают сходной биологической активностью. Наибольшая витаминная и антиоксидантная активность присуща α-токоферолу, в связи с чем именно он нашел применение в медицине.
Витамин Е является природным антиоксидантом, содержащим фенольное кольцо с системой сопряженных двойных связей, защищающим различные вещества от окислительных изменений, участвующим в биосинтезе гема и белков, пролиферации клеток, тканевом дыхании и других важнейших процессах клеточного метаболизма. Он может выполнять структурную функцию, взаимодействуя с фосфолипидами биологических мембран, одновременно тормозя ПОЛ и пре- дупреждая их повреждение.
Поток протонов от фонда NADPH и NADH к α-токоферолу осуществляется цепью антирадикальных эндогенных соединений (глутатион, эрготионин-аскорбат) при участии соответствующих редуктаз и дегидрогеназ. Механизм антиоксидантного действия препарата заключается в переносе водорода фенильной группы на перекисный радикал:
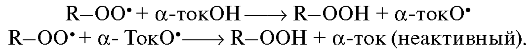
Феноксил - радикал, который образуется при этом, сам по себе достаточно стабилен и в продолжении цепи не участвует.
Синергичный эффект оказывает аскорбиновая кислота, восстанавливающая продукт окисления α-токоферола - α-токофероксид в α-токоферол. Как и другие жирорастворимые витамины, витамин Е хорошо всасывается в верхних отделах тонкой кишки и поступает в кровяное русло через лимфатическую систему. В крови связывается с β-липопротеидами. Около 80% введенного в организм α-токоферола через неделю экскретируется желчью, а небольшая часть выводится в виде метаболитов с мочой.
Суммарный антиоксидантный эффект α-токоферола не слишком выражен, так как в процессе нейтрализации свободных радикалов данным веществом образуются соединения с остаточной радикальной активностью. Другой недостаток α-токоферола заключается в его липофильности, что затрудняет создание лекарственных форм для парентерального введения, необходимых при оказании неотложной помощи. Выход здесь может быть в создании липосомальных форм α- токоферола, более эффективных и потенциально пригодных для парентерального введения. Главное достоинство α-токоферола - очень малая токсичность, как у эндогенного соединения.
Эмпирически витамин Е применяют при самых разнообразных заболеваниях, однако большинство сообщений об эффективности α-токоферола базируется на единичных клинических наблюдениях и экспериментальных данных. Контролируемые исследования практически не проводились. В настоящее время нет четких данных о роли витамина Е в предупреждении опухолевых заболеваний, хотя показана способность препарата снижать образование нитрозаминов (потенциально канцерогенные вещества, образующиеся в желудке), уменьшать образование свободных радикалов и оказывать антитоксическое действие при применении химиотерапевтических средств.
Наиболее крупное исследование, посвященное изучению профилактического антиканцерогенного эффекта α-токоферола у мужчин-
курильщиков - АТВС (The Alpha-Tocopherol Beta-Carotene Cancer Prevention,
Данные Кембриджского исследования CHAOS по применению антиоксидантов в кардиологии, опубликованные в
В то же время в исследовании HOPE (Heart Outcomes Prevention Evaluation, 1993-1999 гг.), в котором изучалось наряду с рамиприлом действие витамина Е (400 МЕ/сут) у бессимптомных больных старше 54-летнего возраста с низкой фракцией выброса левого желудочка и высоким риском сердечно-сосудистых осложнений, установлено, что применение этого антиоксиданта в течение примерно 4,5 лет не оказывало никакого влияния на первичную (инфаркт миокарда, инсульты и смерти от сердечно-сосудистых заболеваний, рак и смерти от рака) точку исследования. При исследовании вторичных точек (случаи развития сердечной недостаточности (СН), нестабильной стенокардии и операции реваскуляризации сердца) оказалось, что прием витамина Е сопровождался даже некоторым повышением риска развития СН и госпитализаций по поводу СН.
Исследование HOPE-TOO (HOPE-The Ongoing Outcomes) явилось продолжением исследования HOPE (за 738 пациентами из вклю- ченных в исследование HOPE проводилось пассивное наблюдение). Исследование подтвердило эффективность длительного применения ингибитора ангиотензинпревращающего фермента рамиприла для вторичной профилактики сердечно-сосудистых заболеваний; среди больных, получавших витамин Е, различий в первичных или вторичных точках не было получено.
Таким образом, достаточно убедительно показано, что применение витамина Е у больных с высоким риском сердечно-сосудистых осложнений не предотвращает их развитие, так же как и возникновение случаев рака. Более того, учитывая возрастание риска развития сердечной недостаточности при длительном приеме витамина Е, необходимо более тщательное клиническое изучение так называемых натуральных продуктов (витаминов, пищевых добавок), широко используемых в профилактических целях.
В другом крупном исследовании по первичной профилактике атеросклеротических заболеваний у людей, по крайней мере с одним фактором риска (гипертензия, гиперхолестеринемия, ожирение, преждевременный ИМ у ближайшего родственника или преклонный возраст), витамин Е (300 МЕ/сут) применялся на протяжении 3,6 лет и не оказал никакого действия ни на одну из конечных точек (частота случаев сердечно-сосудистой смерти и всех сердечно-сосудистых событий).
Не подтвердилась эффективность витамина Е и в большинстве других случаев (гиперхолестеринемия, тренированность спортсменов, сексуальная потенция, замедление процессов старения и многие другие).
В то же время получены достаточно убедительные данные, что при неонатальном гемохроматозе (тяжелое, часто фатальное нарушение метаболизма железа у новорожденных, приводящее к развитию острой печеночной недостаточности) раннее лечение антиоксидантами (витамин E, деферроксамин, селен и N-ацетилцистеин) и трансплантация печени, в дополнение к оптимальному медицинскому обслуживанию, могут привести к благоприятным результатам (подробнее см. далее).
α-токоферол в дозе 294-441 МЕ (450-600 мг) в сутки оказывает терапевтический эффект у больных с синдромом перемежающейся хромоты, что, возможно, связано с улучшением реологических свойств крови. Терапевтические дозы витамина Е могут защищать генетически дефектные эритроциты при талассемии, недостаточности глутатионсинтетазы и глюкозо-6-фосфатдегидрогеназы.
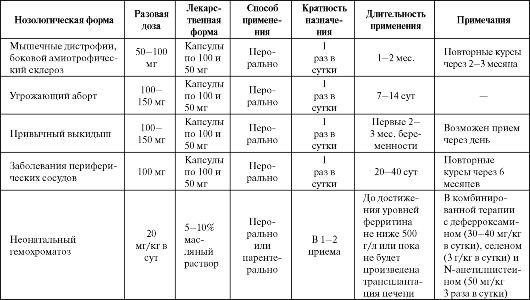
В табл. 9.2 представлены основные показания к применению препарата при заболеваниях, в патогенезе которых предполагается повышенная липопероксидация. Как правило, препарат назначается перорально, а инъекции обычно производят в случаях нарушения всасывания и обмена витамина Е в организме. Дозы такие же, как при приеме внутрь.
Таблица 9.2. Основные показания к применению и схемы назначения α-токоферола
Длительный прием витамина Е в дозах от 100 до 800 мг не вызывает побочных реакций. Возможные проявления токсического действия α-токоферола появляются при парентеральном введении больших доз (табл. 9.3). Следует отметить, что α-токоферол является индуктором изоферментов цитохрома Р-450 3А4.
Совместно с витамином Е в организме действует и аскорбиновая кислота (витамин С), способная образовывать окислительно-восста- новительную пару аскорбиновая кислота/дегидроаскорбиновая кислота. Вероятно, на границе раздела липиды/водная фаза аскорбиновая кислота обеспечивает защиту α-токоферола или восстанавливает его окисленную форму после действия свободных радикалов. Кроме того, предполагается, что витамин С может предотвращать или делать обратимым процесс окисления восстановленного глутатиона (GSH) до его функционально неактивной формы (GSSG). Весьма важным обстоятельством является то, что аскорбиновая кислота проявляет выраженный антиоксидантный эффект только в отсутствие металлов переменной валентности (ионов железа и меди); в присутствии же активной формы железа (Fe3+) она может восстанавливать его до двухвалентного железа (Fe2+), которое способно высвобождать гидроксильный радикал по реакции Фентона, проявляя свойства прооксиданта. Фактически достаточно 10 мг витамина С в день, чтобы избежать его дефицита в организме, но для того чтобы аскорбиновая кислота могла активно функционировать как антиоксидант, дозы должны составлять 80-150 мг/сут.
В одном из первых хорошо спланированных исследований по влиянию длительного регулярного приема аскорбиновой кислоты на кардиоваскулярную летальность (NHANES-I (First National Health and Nutrition Examination Survey)) было установлено, что под влиянием витамина С происходит уменьшение смертности от сердечно-сосудистых причин на 48% и от всех причин на 26%. Однако в других исследованиях не удалось повторить этот успех. Также неудачей окончилась попытка добиться снижения уровня холестерина в крови или выраженности коронарного стеноза путем длительного назначения аскорбиновой кислоты в дозах >250 мг/сут. Не получено до настоящего времени и убедительных данных по снижению онкологической или кардиоваскулярной заболеваемости под влиянием монотерапии аскорбиновой кислотой в относительно высоких дозах (400-1000 мг/ сут). В крупном исследовании VITAL (VITamins And Lifestyle) не подтверждена способность витамина С при длительном приеме умень- шать риск развития рака легких.
Таблица 9.3. Побочные эффекты и противопоказания к применению некоторых антиоксидантов
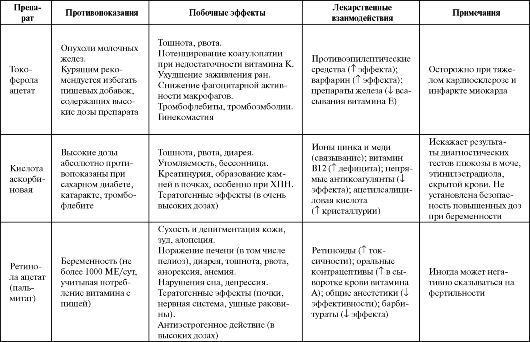
Продолжение табл. 9.3
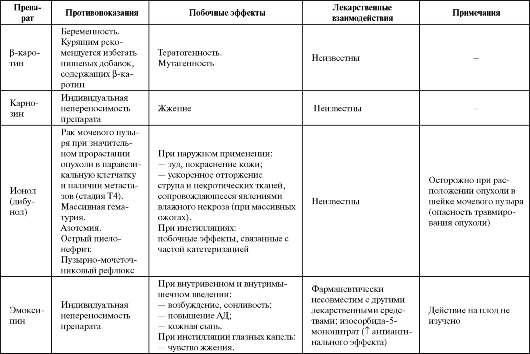
Продолжение таблицы 9.3
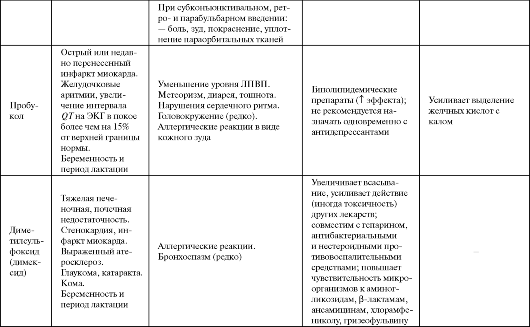
Продолжение табл. 9.3
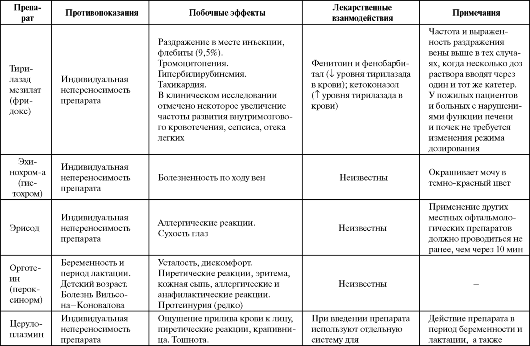
Продолжение таблицы 9.3
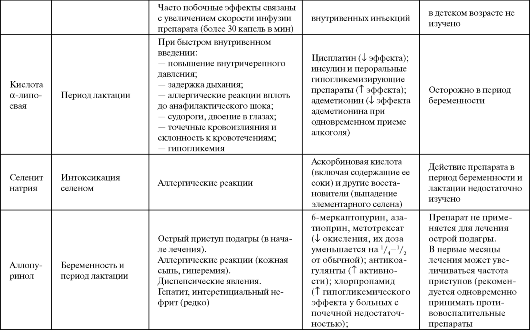
Окончание табл. 9.3

Остается открытым вопрос о безопасности использования больших доз аскорбиновой кислоты. Это связано с несколькими причинами. Во-первых, увеличенные дозы витамина С приводят к увеличению потерь организмом витаминов В12, В6 и В2. Во-вторых, применение высоких доз препарата запрещено у больных катарактой и глаукомой (в силу снижения проницаемости капилляров и нарушения обмена жидкости в передней камере глаза), у больных диабетом и тромбофлебитом. В-третьих, высокие дозы аскорбиновой кислоты также небезопасны при беременности (вследствие повышения уровня эстрогенов).
Помимо этого следует учитывать, что аскорбиновая кислота в процессе метаболизма образует две окисленные формы - дегидроаскорбиновую и дикетогулоновую кислоты, обладающие собственной прооксидантной активностью. Возможные побочные реакции, развивающиеся при приеме препарата, представлены в табл. 9.3.
Ретинол (витамин А) и β-каротин (провитамин А) являются составной частью естественной антиоксидантной системы клетки и оказывают определенное антиоксидантное действие, однако оно под- тверждено преимущественно в экспериментальных исследованиях на животных. Согласно мембранной теории действия витамина А, ретинол способен проникать в гидрофобную зону биомембран и взаимодействовать с лецитино-холестериновыми монослоями на границе раздела фаз, вызывая перестройку мембран клетки, лизосом и митохондрий.
Несмотря на достаточно убедительные теоретические и экспериментальные данные об антиоксидантной активности ретинола, в настоящее время отсутствуют подтвержденные в рандомизированных клинических исследованиях (РКИ) данные по влиянию монотерапии ретинолом на развитие онкологических заболеваний или снижение кардиоваскулярной заболеваемости.
β-каротин, а также каротиноиды, не способные к образованию витамина А, выполняют антиоксидантные функции за счет наличия изопреноидных участков в своей формуле. Они являются достаточно эффективными ловушками для синглетного кислорода, в особенности при низком парциальном давлении кислорода. Кроме того, в этом случае они могут действовать и по другому механизму, выступая в качестве антиоксидантных соединений, обрывающих цепи ПОЛ. В то же время при высоком содержании кислорода β-каротин может проявлять прооксидантную активность. Рекомендуемая доза для мужчин составляет 1000 мкг ретинола или 6 мг β-каротина, тогда как для женщин эта доза меньше и составляет 800 мкг ретинола или 4,8 мг β-каротина.
В 5 РКИ было показано, что прием β-каротина (в дозах 20-30 мг/сут или 50 мг через день) не снижает заболеваемость раком легкого, предстательной и поджелудочной железы, толстой кишки и немеланомного рака кожи. В 4 исследованиях не удалось обнаружить у β-каротина способности снижать кардиоваскулярную летальность. Кроме того, имеются определенные ограничения в применении лекарственных средств, содержащих витамин А и каротиноиды, связанные с их возможной тератогенной активностью. Есть сообщения об увеличении частоты развития рака легких у курильщиков на 18-28% при использовании β -каротина. Известный риск несет применение этих препаратов у беременных, поэтому норма при беременности и лактации уста- новлена соответственно 200 мкг и 400 мкг ретинола.
Особый интерес представляет комбинированное применение эндогенных антирадикальных антиоксидантов. В РКИ CARET изучали применение комбинации β-каротина (30 мг/сут) и ретинола (25 000 МЕ/сут) среди людей группы высокого риска (курильщики, рабочие, контактирующие с асбестом). Через 4 года было выявлено статистически значимое увеличение заболеваемости раком легкого, смертности от этого заболевания и общей смертности. Исследование АТВС также не выявило пользы от комбинированного приема в течение 5-8 лет β-каротина (20 мг/сут) и α-токоферола (50 мг/сут) в плане снижения заболеваемости раком легкого, толстой кишки, желудка, поджелудочной и предстательной железы.
В исследовании HPS (Heart Protection Study) наряду с изучением эффективности симвастатина исследовалось и профилактическое действие антиоксидантов. Применение комплекса витаминов (600 мг витамина Е, 250 мг витамина С и 20 мг β-каротина в сутки) продолжалось в среднем 5,5 лет и не показало каких-либо отличий в групах плацебо и у принимавших витамины. Более того, если и имелась какая-то тенденция, то в сторону превышения числа сосудистых событий в группе антиоксидантного вмешательства.
Наконец, в исследовании HATS (HDL Atherosclerosis Treatment Study) - лечение атеросклероза в зависимости от уровня холестерина липопротеидов высокой плотности (ХС ЛПВП), у 160 больных с коронарной болезнью сердца с подтвержденными стенозами коронарных артерий и низким ХС ЛПВП была использована более высокая, чем в HOPE и HPS, доза витамина Е (800 МЕ/сут). В комбинацию были также включены 1000 мг витамина С, 25 мг β-каротина и 100 мг селена. Действие антиоксидантов сравнивалось с эффектом комбинированного применения симвастатина и никотиновой кислоты (ниацин).
Кроме того, одна из групп получала симвастатин + ниацин и антиоксиданты. Исследование продолжалось 3 года и выявило, что антиоксиданты никак не влияли на уровень ХС ЛПВП, а в комбинации с гипохолестеринемическими препаратами уменьшали эффект последних на ХС ЛПНП и особенно ХС ЛПВП. Также неутешительными, в плане применения антиоксидантов, оказались ангиографические и клинические данные этого исследования.
В двух исследованиях изучали возможность применения аскорбиновой кислоты в комбинации с α-токоферолом для профилактики опухолей толстой кишки. Через 2 или 4 года относительный риск рецидива аденоматозных полипов толстой кишки среди получавших комбинацию витамина С (400 или 1000 мг/сут) и витамина Е (400 мг/ сут), по сравнению с плацебо, не снизился. В то же время в одном небольшом исследовании через 3 года одновременного применения витаминов С (1000 мг/сут), Е (30000 МЕ/сут) и А (70 мг/сут) было отмечено уменьшение частоты рецидивов полипов толстой кишки.
Таким образом, в настоящее время нет достаточного количества убедительных данных о выраженной антирадикальной активности эндогенных препаратов при различной патологии у человека.
Другие эндогенные антиоксиданты с антирадикальным действием, которые уже рассматривались и в качестве антигипоксантов, - это идебенон и убихинон (см. лекцию «Клиническая фармакология антигипоксанатов»). Важнейшая биологическая роль убихинона (ко- фермента Q) определяется участием в митохондриальной цепи электронного транспорта в качестве кофермента. В настоящее время можно считать доказанным, что убихинон, кроме переноса электронов и протонов в митохондриях, выполняет еще одну важную функцию, образуя окислительно-восстановительную систему убихинол-убихинон, а его восстановленная форма является хорошим антиоксидан- том. Кофермент Q является единственным жирорастворимым антиоксидантом, который синтезируется в клетках, а также постоянно регенерируется из окисленной формы с помощью ферментных систем организма. Антиоксидантная активность убихинона проявляется в следующем:
- в фазе инициации цепи ПОЛ восстановленная форма кофермента Q (убихинон) вступает в конкурирующую реакцию с активным соединением и препятствует образованию алкильных радикалов;
- может реагировать с пероксильным радикалом и не дает образоваться новым алкильным радикалам, что ведет к обрыву цепи ПОЛ;
- в клеточных мембранах восстановленный кофермент Q обеспечивает эффективную защиту мембранных липидов, белков и ДНК от разрушительного действия активных форм кислорода;
- кофермент Q восстанавливает витамин Е, взаимодействуя с его токофероксильным радикалом.
Главным образом антиоксидантное действие кофемента Q заключается в предотвращении образования и устранении свободных липидных радикалов, а при концентрациях убихинона, существующих в митохонд- риях, он способен быть ловушкой супероксидного анион-радикала:
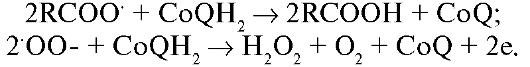
В целом в качестве антиоксиданта убихинон пока менее изучен, чем α-токоферол. Но главное его достоинство в качестве антиоксидантов - относительно небольшая токсичность.
Новым направлением в антиоксидантной терапии стало использование препаратов восстановленного глутатиона, являющегося важным компонентом антиоксидантной системы организма, нейтрализующим высокоактивные перекиси липидов и поддерживающим в восстановленном состоянии сульфгидрильные группы белков, обеспечивая их функциональную активность. Истощение пула восстановленного глутатиона в организме происходит при старении, заболеваниях, в патогенезе которых большую роль играют гипоксия и ишемия. В частности, пилотное исследование по применению препарата восстановленного глутатиона (татионила) в офтальмологии при идеопатической сенильной катаракте дало первые обнадеживающие результаты (табл. 9.4). Получен неплохой эффект при использовании татионила у больных, находящихся на гемодиализе (для предупреждения гемолитической анемии), в спортивной медицине. Однако для широкого внедрения препарата в клиническую практику потребуется еще большое число экспериментальных и клинических исследований.
Таблица 9.4. Применение восстановленного глутатиона (татионила) в офтальмологии
Другим потенциально перспективным для клинического использования эндогенным антиоксидантом является карнозин (дипептид β-аланил-гистидин). В организме карнозин образуется из β-аланина и гистидина под действием карнозинсинтетазы, а в дальнейшем под влиянием N-метилтрансферазы и в присутствии S-аденозилметиони- на он может превращаться в анзерин.
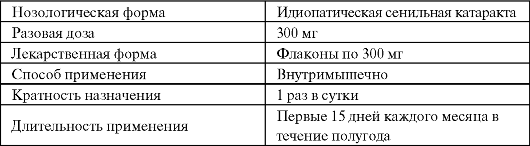
Карнозин и анзерин участвуют в формировании буферной системы организма, способны нейтрализовать активные формы кисло- рода и сахаров, являются буфером протонов и металлов переменной валентности. Карнозин способен защищать белки от неэнзиматического гликозилирования (гликирования), поскольку представляет более удобную мишень для атаки альдегидами. Высокие концентрации карнозина могут эффективно защищать белки от альдосахаров. Более того, карнозин способен связываться с карбонильными группами окисленных белков, а образующееся при этом карнозилированное производное белка быстрее подвергается протеолизу и выключатся из клеточного метаболизма. Клиническое применение карнозина в качестве лекарственного средства пока ограничивается офтальмологией, однако широкий спектр действия позволяет рассматривать его в качестве одного из перспективных биоантиоксидантов и регуляторов клеточного метаболизма (табл. 9.5).
Таблица 9.5. Применение карнозина в офтальмологии
В соответствии с современным уровнем знаний, α-липоевую кислоту классифицируют как витаминоид. Ее биосинтез может осуществляться не только в бактериях и растениях, но и в высших организмах. α-липоевая кислота играет достаточно важную роль в утилизации сахаров и осуществлении нормального энергетического обмена. Через ε-аминогруппу лизинового остатка она связывается с центральным компонентом ацилтрансферазы и действует как кофермент в ряде многоферментных комплексов митохондрий.
α-липоевая кислота и, особенно, дигидролипоат (ее восстановленная форма), являются важными антиоксидантами, работающими как в клетке, так и вне ее. α-липоевая кислота способна нейтрализовать гидроксильный радикал, синглетный кислород, пероксинитрит, гипохлорит и перекись водорода. Кроме того, она хелатирует металлы с переменой валентностью, участвует в восстановлении пула антиоксидантов (например, аскорбиновой кислоты и α-токоферола), повышает внутриклеточный уровень глутатиона, модулирует активность некоторых транскрипционных факторов (например, NFkB). Дигидролипоевая кислота (но не α-липоевая) дополнительно способна нейтрализовать супероксиданион-радикал и пероксильный радикал. Величина окислительно-восстановительного потенциала для дигидролипоевой кислоты/липоевой кислоты, измеренная при рН 7,0, составляет - 0,29 В, что хорошо согласуется со значением потенциала для глутатионовой системы защиты в мембране клетки (-0,23 В).
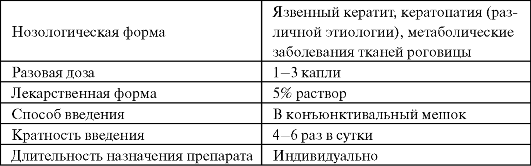
Антиоксидантное действие α-липоевой кислоты нашло применение как один из патогенетических подходов к лечению диабетической полинейропатии и ангиопатии, развитие которых сопровождается усилением перекисной модификации белков и липидов (табл. 9.6).
Таблица 9.6. Некоторые особенности применения α-липоевой кислоты в качестве антиоксиданта
Побочные эффекты α-липоевой кислоты представлены в табл. 9.3.
Синтетические препараты
• Ионол (Дибунол).
• Пробукол (Фенбутол).
• Ацетилцистеин (АЦЦ).
• Тирилазад мезилат (Фридокс).
• Диметилсульфоксид (Димексид).
• Эмоксипин.
• Олифен (Гипоксен).
• Эхинохром-а (Гистохром).
• Церовив (NXY-059).
Из синтетических скэвенджеров одним из первых в эксперименте и клинической практике был исследован ионол (Дибунол) - липофильное соединение, представляющее собой бутилокситолуол. Антиоксидантные свойства препарата сопряжены с его способностью связывать активные формы и соединения кислорода с образованием стабильного феноксильного радикала, не принимающего участия в цепи окислительных превращений и прерывающего цепи окисления в субстрате.
Ионол обладает выраженной антиоксидантной активностью и первоначально был предложен для местного применения (рак и папилломатоз мочевого пузыря, ожоги, отморожения, язвы) (табл. 9.7).
Имеются данные о фармакокинетике 5% линимента препарата при его наружном применении. Он хорошо всасывается с поверхности кожи, накапливается в богатых липидами тканях и определяется в очаге поражения в концентрациях, достаточных для проявления терапевтического эффекта - 32-86 мг/кг. При этом Cmax в крови не превышает 0,64 мг/л и в последующем (через 4 ч после нанесения препарата на кожу) снижается до 0,24 мг/л. При многократном применении ионола имеется прямая зависимость между концентрацией препарата в пораженных тканях и кратностью нанесения на кожу. Учитывая это, препарат можно применять местно 2-3 раза в сутки под окклюзионную повязку длительностью до 2-3 недель.
Системное введение препарата может быть использовано в комплексной терапии острого инфаркта миокарда, так как он предупреждает активируемую стрессом избыточную продукцию NO, NO-обусловленное снижение тонуса коронарных сосудов и развитие постстрессорной гипотензии, снижает риск развития левожелудочковой сердечной недостаточности и нарушений сердечного ритма. Однократный прием ионола в острой фазе процесса улучшает функциональные показатели работы сердца; длительный курсовой прием - стимулирует работу, но без достоверного улучшения сократительной способности миокарда. Стимуляция работы сердца наиболее отчетливо проявляется на 2-3 сутки приема (эффект дозозависимый), что может потребовать дополнительного назначения β-адреноблокаторов. Помимо этого, ионол нормализует концентрацию
Таблица 9.7. Основные показания к применению и схемы назначения ионола
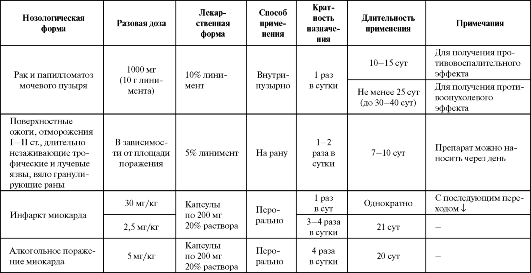
фибриногена в крови, восстанавливает фибринолитическую активность и уменьшает агрегацию форменных элементов крови.
При длительном курсовом назначении препарата, особенно в дозах, приближающихся и превышающих 30 мг/кг в сутки, при отмене препарата или резком снижении дозы возможно развитие феномена отдачи, поэтому дозу препарата надо снижать постепенно, в течение не менее 3 суток.
Курсовое применение ионола (особенно в высоких дозах) иногда могут сопровождать парадоксальные эффекты, когда его антиоксидантное действие трансформируется в противоположное - прооксидан- тное, с подавлением ферментной антиоксидантной системы митохондрий, увеличением образования кислородных радикалов, снижением функционирования цепи переноса электронов в микросомах. Такие нарушения могут быть связаны с действием продуктов окислительной модификации ионола в организме и/или взаимодействием препарата с эндогенными антиоксидантными системами с повреждением их защитных функций. Эти нарушения, как правило, носят кратковременный характер и нормализуются через 3 суток после введения препарата (см. табл. 9.3).
К синтетическим антирадикальным средствам относятся также эмоксипин и пробукол. Эмоксипин - препарат класса 3-оксипириди- на, обладающий широким спектром биологического действия. Он ингибирует свободнорадикальное окисление, активно взаимодействует с перекисными радикалами липидов, гидроксильными радикалами пептидов, стабилизирует клеточные мембраны. Кроме того, препарат снижает агрегацию тромбоцитов и нейтрофилов, уменьшает полимеризацию фибрина, тормозит переход фибрина-мономера в фибринполимер, ингибирует фосфодиэстеразу циклических нуклеотидов, увеличивает содержание цАМФ и цГМФ в клетках.
Первоначально эмоксипин был предложен для применения в офтальмологической практике, однако впоследствии с успехом стал применяться в лечении других заболеваний, сопровождающихся усилением перекисного окисления липидов и гипоксией (инфаркт миокарда, реперфузионный синдром, нестабильная стенокардия, ишемические и геморрагические нарушения мозгового кровообращения различного генеза). В остром периоде инфаркта миокарда препарат ограничивает величину очага некроза, улучшает сократи- тельную способность сердца и функцию его проводящей системы. В этом случае его можно комбинировать с изосорбида-5-монони- ратом, что позволяет достичь большего антиангинального и про-
тивоаритмического эффектов, предотвратить развитие сердечной недостаточности и разрыва миокарда.
При острых ишемических нарушениях мозгового кровообращения эмоксипин уменьшает тяжесть общемозговой и локальной неврологической симптоматики, повышает устойчивость ткани к гипоксии и ишемии. При повышенном АД оказывает гипотензивный эффект. Обладает ретинопротекторными свойствами, защищает сетчатку от повреждающего действия света высокой интенсивности, способствует рассасыванию внутриглазных кровоизлияний, уменьшает проницаемость капилляров.
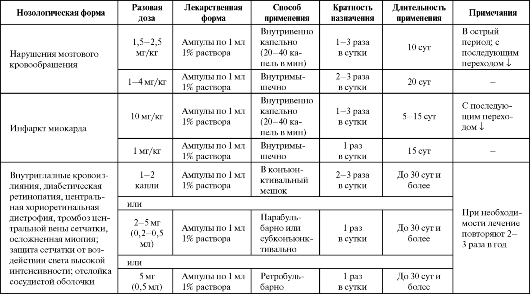
Препарат используется также для профилактики осложнений при коронарной ангиографии (за день до манипуляции и в день процедуры внутривенно капельно 10 мл 1% раствор эмоксипина в 100 мл изото- нического раствора натрия хлорида со скоростью 20-30 капель в мин) (табл. 9.8). Эмоксипин эффективен в комплексной терапии наджелудочковой тахикардии и тахи-бради формы синдрома слабости синусного узла у детей (при данной патологии он превосходит мексидол).
Побочные эффекты эмоксипина представлены в табл. 9.3.
Пробукол (фенбутол) относится к производным бутилфенолов и является гиполипидемическим средством. Он вызывает подавление синтеза холестерина на ранних стадиях, в определенной мере снижает его абсор- бцию из кишечника, увеличивает обратный транспорт холестерина из периферических тканей в печень. Мало влияет на концентрацию в крови триглицеридов и липопротеидов очень низкой плотности, практически не влияет на рассасывание уже существующих бляшек.
Препарат медленно всасывается при приеме внутрь, хорошо растворяется в жировой ткани, постепенно выделяясь в кровь, поэтому его действие сохраняется в течение длительного времени (до шести ме- сяцев после прекращения терапии). Выделяется в основном с желчью и калом, в малой степени с мочой. Особенность действия пробукола состоит в том, что он, связывая активные формы кислорода, предотвращает свободнорадикальное окисление ЛПНП в плазме крови, тем самым уменьшает их захват макрофагами и превращение последних под эндотелием сосудов в «пенистые» клетки, образующие основу атеросклеротической бляшки. Под влиянием препарата увеличивается активность антиоксидантных ферментов.
В исследовании MVP при использовании пробукола отмечено восстановление функции эндотелия у больных ИБС, уменьшение случаев рестеноза после коронарной ангиопластики (при применении не менее чем за 4 недели до процедуры и последующем лечении в течение 6 месяцев). Другие антиоксиданты (α-токоферол в высоких дозах (700 мг/сут), β-каротин и ви-
Таблица 9.8. Основные показания к применению и схемы назначения эмоксипина
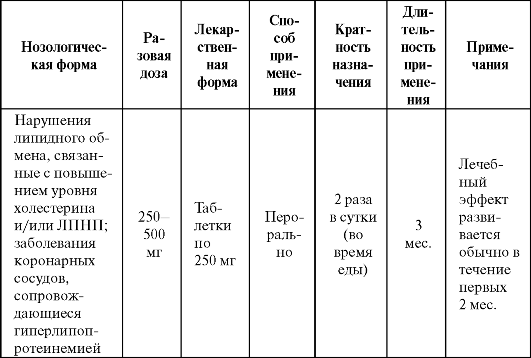
тамин С) оказались в этом случае неэффективны. В некоторых работах показано, что пробукол способствует уменьшению зоны некроза при ишемии миокарда. Показания к применению препарата представлены в табл. 9.9.
Таблица 9.9. Основные показания к применению и схемы назначения пробукола
Антирадикальная активность имеется также у синтетических препаратов, обладающих и другими фармакологическими свойствами. Например, диметилсульфоксид (димексид) широко используется в фармации в качестве растворителя лекарственных веществ, нерастворимых в воде. Кроме того, он облегчает проникновение лекарственных средств через биологические барьеры (кожу, слизистые оболочки и т. п.), т. е. обладает свойствами «пенетранта», оказывает местноанестезирующее, анальгетическое и противомикробное действие, обладает умеренной фибринолитической активностью. В качестве антиоксиданта диметилсульфоксид является очень эффективной «ловушкой» для гидроксильного радикала, обладающего наиболее выраженным повреждающим действием.
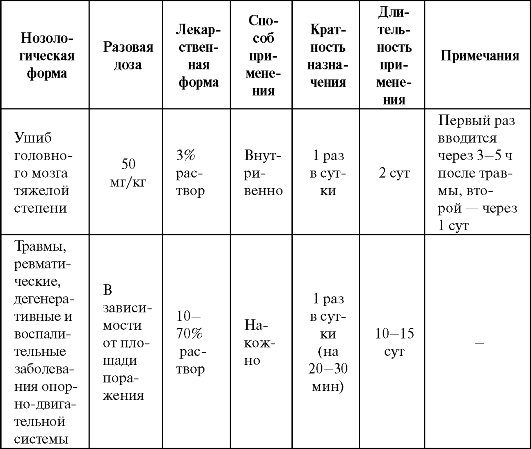
Используется как наружное средство при воспалительных и некоторых других заболеваниях опорно-двигательного аппарата (табл. 9.10). Весьма высокий и устойчивый антиоксидантный эффект препарата обнаружен при тяжелых черепно-мозговых травмах. При данной патологии димексид, повышая антиоксидантный статус организма и
препятствуя развитию вторичного повреждения головного мозга, определяет нейропротекторный эффект.
Побочные эффекты препарата представлены в табл. 9.3.
Таблица 9.10. Основные показания к применению и схемы назначения диметилсульфоксида в качестве антиоксиданта
Тирилазад мезилат (фридокс) представляет собой 21-аминостероид (лазароид), сходный по строению с глюкокортикоидами, но лишенный их гормональных свойств. Данный препарат был создан после того, как было установлено, что нейропротективный эффект глюкокортикоидов (в частности, метилпреднизолон) реализуется, в том числе, за счет антиоксидантного действия. Тирилазад по антиоксидантной активности более чем в 100 раз превосходит глюкокортикоиды. Препарат обладает прямым антирадикальным эффектом (особенно в отношении гидроксильных радикалов), угнетая реакции ПОЛ, а также способствует сохранению в мембранах клеток α-токоферола, являющегося природным антиоксидантом. Стабилизирует клеточную мембрану, снижая ее текучесть.
Фармакокинетика тирилазада имеет значимые половые различия - общие уровни активных метаболитов в крови у женщин сред- него возраста составляют менее 50% от аналогичных показателей у мужчин среднего возраста. Препарат обладает заметной тропностью к нервной ткани, в силу чего он был предложен к применению при субарахноидальных кровоизлияниях у мужчин с целью повышения выживаемости и улучшения функционального исхода, в том случае, если причиной субарахноидального кровоизлияния является разрыв аневризмы сосуда мозга (табл. 9.11).
Таблица 9.11. Основные показания к применению и схемы назначения тирилазада мезилата
Хотя тирилазад показал высокую эффективность в эксперименте, его клиническое изучение в 6 клинических плацебоконтролируемых исследованиях не принесло ожидаемых результатов - он не снижал летальность пациентов с острым нарушением мозгового кровообращения, а у некоторых категорий больных увеличивал комбинированную конечную точку (смертность + инвалидность) почти на 20%. Кроме того, препарат имеет крайне высокую стоимость. Вследствие этого перспективы применения тирилазада представляются весьма сомнительными.
Эхинохром-а (гистохром) - хиноидный пигмент морских беспозвоночных, получаемый в настоящее время синтетически. Он обладает антирадикальными свойствами и нейтрализует основные инициаторы
неферментного ПОЛ, накапливающиеся в зоне ишемического повреждения ткани. Помимо этого препарат стабилизирует клеточные мембраны и выступает как хелатор металлов переменной валентности (в первую очередь железа, играющего важную роль в инициации свободнорадикальных процессов). По антиоксидантной активности эхинохром-а значительно превосходит ионол. Основными областями применения препарата являются кардиология и офтальмология (табл. 9.12).
Эхинохром-а оказывает кардиопротективное действие; при его применении у пациентов с успешной тромболитической терапией инфаркта миокарда (ИМ), снижая частоту реперфузионных аритмий, в том числе угрожающих жизни пароксизмальных желудочковых и наджелудочковых тахикардий, не оказывая существенного влияния на атриовентрикулярную и внутрижелудочковую проводимость.
Препарат замедляет формирование очага и ограничивает зону некроза в течение первых 2-3 суток после ИМ. При этом улучшается сократительная способность левого желудочка и уменьшается частота развития острой сердечной недостаточности (ОСН) на протяжении первых суток заболевания. Эхинохром-а подавляет агрегацию эритроцитов и тромбоцитов.
В офтальмологии эхинохром-а является средством для лечения воспалительных заболеваний роговицы, сосудистой оболочки и сетчатки глаза; патологии, связанной с нарушением трофики тканей глаза и для резорбции крови в стекловидном теле и сетчатке. Побочные эффекты препарата представлены в табл. 9.3.
NXY-059 (Церовив) стал новой попыткой использования антиоксидантов в терапии ишемического инсульта. Препарат представляет собой дисульфонильное производное фенилбутилнитрона, обладает выраженной антирадикальной активностью и вводится пациентам с ишемичесим инсультом в виде непрерывной инфузии на протяжении 72 ч. В отличие от исследовавшихся ранее препаратов, время, в течение которого церовив является эффективным, составляет не 3, а 6 ч после развития инсульта.
Полученные к настоящему времени в исследованиях SAINT и SAINT I клинические данные свидетельствуют, что применение NXY- 059 в течение 6 ч после начала острого ишемического инсульта хотя и не снижает смертность, но статистически значимо улучшает восстанов- ление больных в срок 90 суток и снижает уровень их инвалидности. Так, больные, получавшие препарат, восстанавливались после инсульта без каких-либо видимых последствий на 4,4% чаще, чем больные, получавшие плацебо, а число пациентов, способных самостоятельно ходить и обслуживать себя без посторонней помощи, оказалось пос-
Таблица 9.12. Основные показания к применению и схемы назначения эхинохрома-а
ле лечения NXY-059 на 3,7% выше, чем в контрольной группе. Кроме того, у пациентов, получавших исследуемый препарат, наблюдался меньший риск развития внутричерепного кровоизлияния - 6,4% случаев; в группе контроля этот показатель составил 20,9%.
Дополнительным важным преимуществом препарата является и отсутствие видимых побочных эффектов. Разница между числом побочных явлений (запоров, гипертермии) в исследованиях не имела статистичес- кой значимости, кроме гиперкалиемии, которая отмечалась у 6,4% пациентов из группы лечения NXY-059 и в 4,4% случаев в группе плацебо.
В то же время возможность улучшения нейрофункциональных исходов, оцененных по шкале инсульта Национальных институтов здоровья (National Institutes of Health Stroke Scale (NIHSS), не подтвердилась. К сожалению, такая возможность не подтвердилась и в исследовании SAINT II, что привело к приостановке дальнейшей разработки этого препарата.
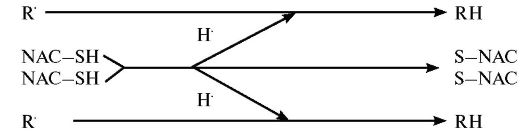
Ацетилцистеин (NAC, АЦЦ) является тиолсодержащим соединением, в основном применяющимся в качестве муколитика. Препарат обладает заметной антиоксидантной активностью, наиболее активно взаимодействуя с гидроксильным радикалом и перекисью водорода:
Экспериментальные работы на животных выявили его высокий антиоксидантный потенциал, однако клинические перспективы при- менения ацетилцистеина в качестве антиоксиданта пока до конца не определены. К сожалению, препарат не проникает через гематоэнцефалический барьер, что делает невозможным его применение при ишемических поражениях ЦНС.
Прямая антиоксидантная активность ацетилцистеина, а также его способность участвовать в синтезе глутатиона, имеет важное значение в реализации его антиоксидантного и муколитического эффекта, например, при хронической обструктивной болезни легких (ХОБЛ). Он доказанно снижает уровень легочных оксидантов (в частности, уровня перекиси водорода) в конденсате выдыхаемого воздуха у больных с ХОБЛ. На фоне длительной терапии АЦЦ снижение числа обострений ХОБЛ показано как минимум в 12 рандомизированных клинических
исследованиях (включавших более 2000 больных), результаты которых были проанализированы в трех независимых метаанализах.
Так, по данным крупного исследования BRONCHUS, которое длилось около 3 лет, АЦЦ, назначаемый ежедневно в дозе 600 мг/сут, приводил к уменьшению частоты развития обострений у больных ХОБЛ, не получающих ингаляционные глюкокортикоиды, на 22%. Одновременно АЦЦ оказывал положительное влияние на выраженность легочной гиперинфляции: терапия препаратом позволяла снизить функциональную остаточную емкость легких на 374 мл, в то время как на фоне плацебо данный параметр увеличивался на 8 мл.
При этом следует отметить, что достоверный положительный эффект наблюдается только у больных, получающих АЦЦ в дозах более 400 мг/сут в течение длительного периода (до 3-х лет) и увеличивается с повышением дозы АЦЦ.
Установлена профилактическая эффективность АЦЦ для предупреждения развития контраст-индуцированной нефропатии (КИН) у пациентов с острым инфарктом миокарда (с подъемом сегмента ST), которым выполняется первичное чрескожное коронарное вмешательство (ЧКВ).
Участники исследования были рандомизированы в соотношении 1:1:1 на получение стандартной дозы АЦЦ (внутривенный болюс 600 мг перед ЧКВ и по 600 мг внутрь дважды в сутки в течение 48 ч - общая доза 3000 мг), высокой дозы АЦЦ (1200 мг внутривенным болюсом с последующим пероральным приемом по 1200 мг дважды в сутки в те же сроки - общая доза 6000 мг) или плацебо. После ЧКВ всем участникам проводилась гидратация изотоническим раствором на- трия хлорида из расчета 1 мл/кг массы тела в час или 0,5 мл/кг в час при наличии явной сердечной недостаточности в течение 12 ч. Первичной конечной точкой испытания считалось развитие КИН, определенной как повышение уровня креатинина сыворотки крови на 25% от исходного уровня и более в течение 72 ч после ЧКВ.
Применение АЦЦ у больных инфарктом миокарда, подвергаемых первичному ЧКВ, значительно снижает риск развития КИН (в контрольной группе КИН отмечена у 33% участников, в группе стандартной дозы - у 15% и в группе высокой дозы - у 8% больных (р < 0,001); при определении КИН как повышения уровня креатинина на ≥ 44 мкмоль/л, она встретилась у 18, 6 и 3% пациентов соответственно (р < 0,001)). Эта профилактическая эффективность препарата выглядит дозозависимой и сопровождается лучшими госпитальными исходами. При этом АЦЦ предупреждал развитие КИН не только у лиц с исходной почечной дисфункцией, но также и без нее. Кроме того, отмечена меньшая частота КИН среди пациентов с умеренным или выраженным снижением систолической функции левого
желудочка. При рассмотрении комбинированной конечной точки (смерть, острая почечная недостаточность, требующая гемодиализа, искусственная вентиляция легких) неблагоприятные события также отмечены чаще в контроле (18%), чем в группе стандартной (7%) и высокой (5%) дозы АЦЦ (р = 0,002).
Показана эффективность АЦЦ в комбинации с витамином Е, деферроксамином и селеном при неонатальном гемохроматозе (см. выше).
Антирадикальной активностью обладают ряд антигипоксантов, в частности, флавоноидсодержащие соединения, некоторые природ- ные и синтетические адаптогены.
Следует отметить, что в целом синтетические антиоксиданты характеризуются более частыми нежелательными эффектами по сравнению с эндогенными соединениями. Для определения показаний и противопоказаний к назначению синтетических антиоксидантов, безусловно, требуются дальнейшие исследования.
9.2. АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ И ИХ АКТИВАТОРЫ
Препараты супероксиддисмутазы
• Эрисод.
• Орготеин (Пероксинорм).
К настоящему времени создано несколько препаратов на основе антиоксидантного фермента супероксиддисмутазы (СОД) - эрисод и орготеин. Действие супероксиддисмутазы заключается в превращении супероксиданион-радикала в перекись водорода, а далее каталаза способствует распаду перекиси водорода до молекул воды. Основные показания к применению эрисода представлены в табл. 9.13.
Орготеин (пероксинорм) является препаратом СОД животного про - исхождения. В отличие от эрисода, может вводиться внутримышечно и подкожно, нейтрализуя активные кислородные радикалы в меж- клеточном пространстве, которые образуются при воспалительных процессах или реакциях под действием ионизирующего облучения. Период полувыведения препарата зависит от пути введения и может варьировать от 0,5 до 6 ч.
Показано, что при введении орготеина в пораженные артритическим процессом суставы в периартикулярных тканях и синовиальной жидкости происходит значительное снижение уровня супероксидных радикалов, продуцируемых фагоцитирующими клетками. Это приводит к уменьше-
Таблица 9.13. Основные показания к применению и схемы назначения эрисода
нию деполимеризации гиалуроновой кислоты и коллагена, снижению деградации протеогликанов и предотвращению повышения уровня простагландинов. Последний эффект также может быть связан с уменьшением орготеином активации фосфолипазы А2. В результате происходит уменьшение боли, восстановление функции у больных с дегенеративными заболеваниями суставов (остеоартрит, ревматоидный артрит, артрозы). При этом показано, что эффекты при внутрисуставном введении препарата сопоставимы с таковыми при применении глюкокортикоидов (бетаметазона, метилпреднизолона). Впрочем, при лечении ревматоидного артрита клиническая эффективность орготеина уступает препаратам золота (эффективность соответственно 86% против 52%), однако количество побочных эффектов при применении орготеина значительно меньше.
У пациентов с раком мочевого пузыря орготеин предотвращает или уменьшает побочные эффекты, вызванные облучением. Снижаются боли, дизурия, явления цистита, эпизоды диареи, при этом применение препарата не препятствует реализации противоопухолевого эффекта лучевой терапии.
При болезни Пейрони (хроническое уплотнение соединительной ткани в области полового члена) введение орготеина может умень- шить симптомы болезни. Однако возможные побочные эффекты (болезненность инъекции, гематомы, анафилактические реакции) ограничивают использование препарата при данной патологии. Основные показания к применению препарата представлены в табл. 9.14.
Достоинством препаратов СОД является их малая токсичность как эндогенных соединений. К недостаткам относится возможность развития аллергических реакций из-за белковой природы препаратов (требуется введение пробных доз) (см. табл. 9.3), небольшой период полужизни в плазме при внутривенном введении (около 5 мин), а также их довольно высокая стоимость. Кроме того, не всегда отмечается выраженная эффективность данных средств вследствие их недостаточной биодоступности, обусловленной большим размером молекулы фермента. Для увеличения биодоступности и эффективности делаются попытки создать липосомальную лекарственную форму СОД (так называемые СОД-наночастицы). Другим путем повышения эффективности препаратов СОД является пролонгирование длительности их действия с помощью конъюгации с полиэтиленгликолем - так называемая ПЭГ-СОД. Первое клиническое исследование по применению такой формы препарата (в дозе от 5000 до 10 000 ЕД/кг) у паци- ентов с черепно-мозговой травмой дало обнадеживающие результаты.
Теоретически наиболее оправданным представляется сочетанное применение как супероксиддисмутазы, так и каталазы, поскольку они
Таблица 9.14. Основные показания к применению и схемы назначения орготеина
катализируют последовательно протекающие реакции нейтрализации активных форм кислорода.
Препараты ферроксидазы (церулоплазмина)
• Церулоплазмин.
Церулоплазмин - медьсодержащий гликопротеид, относящийся к α2-глобулиновой фракции плазмы крови. В состав молекулы ЦП входит по различным данным 6-7 ионов меди. Благодаря способности ЦП окислять Fe2+ до Fe3+ белок получил также систематическое название - ферроксидаза.

В то же время в присутствии гомоцистеина ЦП способен ускорять окисление липопротеидов низкой плотности за счет восстановления ионов Cu2+ в ЦП до Си+. Альдегидная группа глюкозы также способна усилить действие ЦП в процессе окисления ЛПНП. Окисление ЛПНП зависит также от интактности молекулы ЦП и количества ионов меди, связанных с ЦП.
Таблица 9.15. Основные показания к применению и схемы назначения церулоплазмина
Установлено, что у больных, перенесших тяжелый гипоксический эпизод, активность ЦП в крови снижена до 15-20% от нормального уровня. Резкое снижение активности ЦП в раннем послеоперационном периоде - один из признаков развития полиорганной недостаточности. В качестве лекарственного препарата ЦП используется как антиоксидант и стимулятор гемопоэза, уменьшающий интоксикацию и иммунодепрессию (табл. 9.15).
Включение ЦП в комплекс предоперационной подготовки и в раннем послеоперационном периоде позволяет снизить степень тканевой гипоксии и эндогенной интоксикации, улучшить внутриклеточные окислительно-восстановительные процессы, состояние системы гемостаза, функции дыхания и кровообращения. У онкологических больных препарат дает возможность расширить показания к оперативным вмешательствам по поводу рака легкого, кардиального отдела желудка и пищевода с низкими функциональными резервами дыхания и одновременно снизить число послеоперационных осложнений и летальность.
После внутривенного введения изменение концентрации ЦП в сыворотке крови происходит в несколько фаз. В первые часы его содержание резко повышается, затем вследствие распределения между сосудистым и внесосудистым руслом снижается и далее стабилизируется. Через 144 ч после введения препарат не обнаруживается в сыворотке. Период полужизни ЦП 72 ч. Побочные эффекты ЦП достаточно редки и в значительной мере определяются скоростью введения препарата (см табл. 9.3).
Активаторы антиоксидантных ферментов
• Натрия селенит (Селеназа).
К модуляторам активности антиоксидантных ферментов может быть отнесен селенит натрия, действие которого связывают с активацией глутатионпероксидазы, в состав которой входит атом селена и недостаток которого может привести к снижению активности данного фермента. Кроме того, селензависимыми ферментами являются тиоредоксинредуктаза и 5-дейодиназа. Помимо этого селен входит в состав селенопротеинов Р и W, содержащихся в плазме.
Под влиянием селена и селенсодержащих ферментов происходит ингибирование активности протеинкиназы С, 5-липоксигеназы, циклооксигеназы и НАДФ-оксидазы, а также обнаружено синергич- ное действие с а-токоферолом.
В виде монопрепарата селенит натрия широкого применения не получил, однако в клинических исследованиях он показал неплохой результат у пациентов с острым нарушением мозгового кровообраще-
ния (табл. 9.16), значимо уменьшая размеры очага инфаркта мозга, но не влияя на явления вазоспазма.
Таблица 9.16. Схема назначения селена при остром нарушении мозгового кровообращения (по данным клинических исследований)
Нозологическая форма | Острое нарушение мозгового кровообращения |
Разовая доза | 150 мг |
Лекарственная форма | Таблетки по 150 мг |
Способ применения | Перорально |
Кратность назначения | 2 раза в день |
Длительность применения | 2 недели |
Эффект был более выражен при возможно более раннем начале терапии или если препарат назначался парентерально (внутривенно). Однако окончательного ответа на вопрос о безопасности и эффективности применения высоких доз селена пока не получено.
Показана эффективность селена в комбинации с АЦЦ, витамином Е и деферроксамином при неонатальном гемохроматозе (НГ) - тяже- лом, часто фатальном нарушении метаболизма железа у новорожденных, приводящем к развитию острой печеночной недостаточности. Кроме печени органами-мишенями при данной патологии являются поджелудочная железа, сердце и эндокринные железы.
Антиоксидантная и комплексная терапия при данном заболевании включает специфически связывающий ионы железа деферрок- самин (30-40 мг/кг в сут), а также антиоксиданты - селен (3 г/кг в сут), а-токоферол (20 мг/кг в сут) и N-ацетилцистеин (50 мг/кг 3 раза в сутки). Лечение продолжается до достижения уровней ферритина не ниже 500 г/л или пока не выполняют трансплантацию печени. При НГ раннее лечение антиоксидантами и трансплантация печени в дополнение к оптимальному медицинскому обслуживанию позволяют достичь достаточно благоприятного результата (частота выживания пациентов с НГ после 1-го года может составлять 75%, после 2 лет - 70%).
Показана эффективность дополнительного назначения селена при состояниях, характеризующихся выраженной активацией процессов свободнорадикального окисления и сопровождающихся развитием дефицита по этому микроэлементу (табл. 9.17).
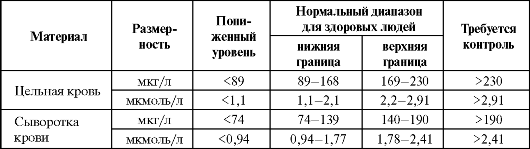
При этом следует ориентироваться на референтные диапазоны уровня селена в крови (табл. 9.18).
Таблица 9.17. Рекомендации по применению селена при патологических состояниях, сопровождающихся развитием его дефицита
Таблица 9.18. Референтные значения уровня селена в крови (Neve J., 1991; Winnefeld K. et al., 1995; Clark L. C. et al., 1996; Thomas L., 2000)
Вопрос о дополнительном использовании селена в качестве средства профилактики гастроинтестинальных опухолевых заболеваний окончательно не решен, но, по-видимому, в этом нет необходимости, поскольку селен и так в достаточном количестве содержится в продуктах питания, а многочисленные клинические исследования не подтвердили его антираковых свойств.
Более того, появились данные о существовании рисков, связанных с избыточным приемом селена (повышение более чем в полтора раза частоты развития сахарного диабета второго типа при регулярном на- значении препарата ежедневно по 200 мкг в течение 8 лет). Эти сведения требуют проведения дополнительных исследований, тем более, что ранее в экспериментах на животных были получены данные о благотворном влиянии селена на метаболизм глюкозы.
Достаточно широкое применение селен нашел как компонент ряда поливитаминных препаратов, содержащих различные витамины с ан- тиоксидантным действием (табл. 9.19).
Таблица 9.19. Состав некоторых селенсодержащих поливитаминных препаратов
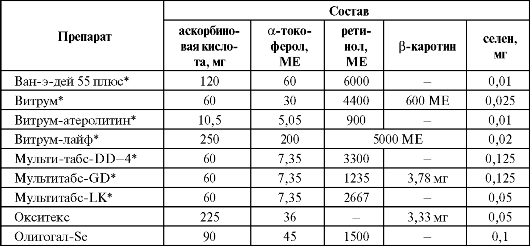
Окончание табл. 9.19
Примечание: * - препараты содержат другие витамины и/или микроэлементы, помимо указанных в таблице.
Изучению эффективности витаминных комбинаций было посвящено несколько исследований. Так, дополнительное введение в рацион плохо питающегося китайского населения β-каротина, α-токоферола и селена уменьшало частоту развития рака желудка, летальность от него и общую онкологическую летальность от 13 до 21%. В небольшом французском исследовании дополнительное назначение комбинации витамина C, витамина Е, β-каротина, селена и цинка уменьшало частоту развития онкологической патологии у мужчин на 31% (у женщин аналогичного эффекта получено не было).
В то же время поливитаминные и минеральные добавки не оказывали никакого существенного эффекта на сердечно-сосудистую забо- леваемость или риск развития катаракты.
Таким образом, на сегодняшний день получено недостаточно данных, доказывающих наличие или отсутствие пользы от использования поливитаминных и минеральных препаратов с антиоксидантным действием для предотвращения онкологических и других хронических заболеваний. Выраженность и клиническая значимость антиоксидантного действ\ия компонентов в данных комбинациях не ясна и требует убедительных доказательств.
9.3. БЛОКАТОРЫ ОБРАЗОВАНИЯ СВОБОДНЫХ РАДИКАЛОВ
• Аллопуринол (Милурит).
• Оксипуринол.
• Антигипоксанты (см. лекцию «Клиническая фармакология антигипоксантов»).
Вторичная антиоксидантная активность характерна для всех антигипоксантов, поскольку эти препараты при гипоксии предотвращают или уменьшают образование свободных радикалов благодаря нормали- зации функций митохондрий (уменьшается накопление высокоактивных форм кислорода) и энергостабилизирующему действию (предотвращается распад и усиливается ресинтез антиоксидантных ферментов, уменьшается разрушение фосфолипидов как источников субстратов для перекисного окисления). Во многих ситуациях использование антиоксидантной активности антигипоксантов является более рациональным, чем применение антиоксидантов, поскольку профилактика заболевания (в данном случае предотвращение образования свободных радикалов антигипоксантами) обычно эффективнее его лечения (нейтрализации образовавшихся радикалов антиоксидантами).
Способность предотвращать возникновение свободных радикалов свойственна противоподагрическому препарату аллопуринолу (милурит). Этот эффект обусловлен ингибированием препаратом ксан- тиноксидазной реакции (схема 9.5), активно протекающей в ишемизированных тканях. В ходе этой реакции происходит превращение гипоксантина в ксантин, а затем в мочевую кислоту и активно образуется супероксиданион-радикал. При этом аллопуринол окисляется ксантиноксидазой до оксипуринола, который и блокирует активный центр фермента.
Это сопровождается снижением концентрации мочевой кислоты и ее солей в жидких средах организма и моче, что способствует растворению имеющихся уратных отложений и предотвращает их образование в тканях и почках, уменьшает оксидативное повреждение тканей. Есть данные об эффективности препарата в комплексном лечении острого панкреатита, как средства ограничения оксидативного стресса при радио- и химиотерапии опухолей.
В экспериментах продемонстрировано, что супероксид анион, образующийся под действием миокардиальной ксантиноксидазы, играет важную роль в развитии дисбаланса между необходимой сократительной активностью левого желудочка и потреблением миокардом кислорода, который возникает при прогрессировании сердечной недостаточности (СН). В доклинических исследованиях у животных с сердечной недостаточностью эти препараты увеличивали сократительную активность миокарда, не влияя на потребность в кислороде. Этот эффект достигался путем увеличения чувствительности миофибрилл
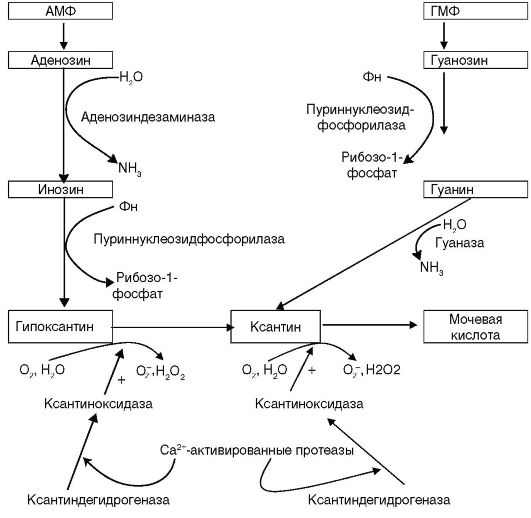
Схема 9.5. Образование высокоактивных форм кислорода ксантиноксидазой
к кальцию. Результаты первых клинических исследований показали, что у больных с СН аллопуринол и оксипуринол на 40% увеличивают сократимость миокарда. При этом они обладают лучшим профилем безопасности, чем амринон и милринон, и могут использоваться как внутривенно, так и внутрь для лечения острой и хронической сердечной недостаточности.
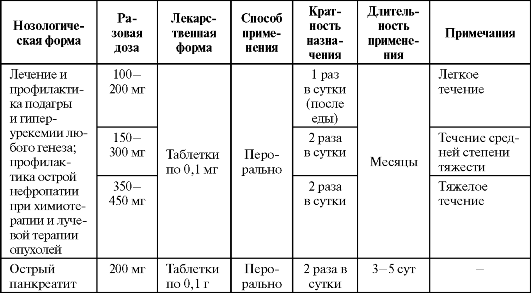
Основные показания к назначению аллопуринола как антиоксиданта представлены в табл. 9.20. Детям до 15 лет назначают внутрь по 10-20 мг/кг массы тела или 100-400 мг/сут. У пациентов с нарушением функции почек доза препарата не должна превышать 100 мг.
Таблица 9.20. Основные показания к применению и схемы назначения аллопуринола в качестве антиоксиданта
Побочные эффекты аллопуринола представлены в табл. 9.3.
Таким образом, основными показаниями к применению антиоксидантов являются избыточно активированные процессы свободнорадикального окисления, сопровождающие различную патологию. Выбор конкретных препаратов, точные показания и противопоказания к их применению пока недостаточно разработаны и требуют дальнейших экспериментальных и клинических исследований.
ЛИТЕРАТУРА
Анацкий А. Н. Интенсивная терапия синдрома полиорганной недостаточности / А. Н. Анацкий, Ю. Б. Семкин, А. П. Григоренко и др. // Научные ведомости БелГУ. - 2000. - Серия «Медицина». - ? 4 (13). - С. 7-10.
Андрианов В. П. Применение антигипоксантов олифена и амтизола для ле- чения больных с хронической недостаточностью кровообращения 11б стадии / В. П. Андрианов, С. А. Бойцов, А. В. Смирнов и др. // Терапевтический архив. - 1996. - ? 5. - С. 74-78.
Афанасьев С. А. Сравнительная эффективность эмоксипина и оксибутирата натрия при экспериментальной ишемии миокарда / С. А. Афанасьев, Е. Д. Алек- сеева // Эксперим. и клин. фармакол. - 1994. - Т. 57, ? 4. - С. 24-26.
Биленко М. В. Ишемические и реперфузионные поражения органов / М. В. Биленко. - М.: Медицина, 1989. - 368 с.
Болдырев А. А. Карнозин и защита тканей от окислительного стресса / А. А. Болдырев. - М.: Изд-во Диалог-МГУ, 1999. - 364 с.
Витамины и профилактика злокачественных новообразований. Обобщенные данные рандомизированных испытаний // Стандарты мировой медицины. - 2006. - ? 3. - С. 11-19.
Владимиров Ю. А. Свободные радикалы и антиоксиданты / Ю. А. Владимиров // Вестн. РАМН. - 1998. - ? 7. - С. 43-51.
Гейвандова Н. И. Случай пелиоза печени в результате длительного приема препарата «Аевит» / Н. И. Гейвандова, И. В. Касторная, А. В. Ягода и др. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - 2006. - Т. 16, ? 3. - С. 89-92.
Грацианский Н. А Уроки церивастатина и результаты исследования «Защита сердца» / Н. А. Грацианский // Consilium Medicum. - 2002. - Т. 4, ? 3. - С. 139-143.
Девис М. Витамин С: химия и биохимия / М. Девис, Дж. Остин, Д. Патридж; пер. с англ. - М.: Мир, 1999. - 176 с.
Журавлев А. И. Антиоксиданты. Свободнорадикальная патология / А. И. Журавлев, С. М. Зубкова. - М.: МИКО-ПРИНТ, 2008. - 269 с.
Закирова А. Н. Корреляционные связи перекисного окисления липидов, антиоксидантной защиты и микрореологических нарушений в развитии ИБС / А. Н. Закирова // Терапевтический архив. - 1996. - ? 9. - С. 37-40.
Закирова А. Н. Антиоксидант гистохром: влияние на перекисное окисление липидов и реологические свойства крови у больных нестабильной стенокардией / А. И. Закирова, А. В. Лебедев, В. В. Кухарчук и др. // Терапевтический архив. - 1996. - ? 8. - С. 12-14.
Зиновьев Е. В. Применение препарата эритроцитарной супероксиддисмутазы в комплексной терапии ожогового шока (экспериментально-клиническое исследование) : автореф. дисс. ... канд. мед. наук / Е. В. Зиновьев. - СПб., 2000. - 16 с.
Коровина Н. А. Применение антиоксидантов в педиатрической практике / Н. А. Коровина, И. Н. Захарова, Е. Г. Обыночная // Consilium-Medicum. - 2003. - Т. 5, ? 9. - http://www. consilium-medicum. com/media/consilium/ 03_09c/47. shtml.
Кудрин А. Н. Свободнорадикальное окисление липидов в патогенезе инфаркта миокарда и лечебно-профилактическая роль антиоксидантов - селенита натрия и его комбинации с витамином Е / А. Н. Кудрин, А. Х. Коган, В. В. Королев и др. // Кардиология. - 1978. - Т. 18, ? 2. - С. 115-118.
Лапшин В. Н.Применение препарата «Эрисод» в комплексной терапии пострадавших с механической шокогенной травмой в остром периоде травма- тической болезни / В. Н. Лапшин, И. В. Страхов, А. Ф. Котлярский // Фарма- котерапия гипоксии и ее последствий при критических состояниях: материалы Всероссийской научной конференции. - СПб., 2004. - С. 140-141.
Лукк М. В. Влияние антигипоксантов на перекисное окисление липидов и антиоксидантную систему при острой гипоксической гипоксии: автореф. дисс. ... канд. мед. наук / М. В. Лукк. СПб., 1999. - 24 с.
Магомедов Н. М. Перекисное окисление липидов в структурно-функцио- нальных нарушениях различных мембран при гипоксии и ишемии: автореф. дисс. ... д-ра биол. наук / Н. М. Магомедов. - М., 1993. - 38 с.
Маньковская И. Н. Влияние ионола на ферментативные процессы окисли- тельного метаболизма в миокарде при гипоксической гипоксии / И. Н. Мань- ковская, О. О. Юрченко // Кислородное голодание и способы коррекции гипоксии: сб. науч. трудов. - Киев: Наукова думка, 1990. - С. 89-96.
Миронова О. П. Антигипоксические и антиоксидантные эффекты амтизола и триметазидина при гипоксии, ишемии и реперфузии головного мозга: автореф. дисс. ... канд. биол. наук / О. П. Миронова. - СПб., 1999. - 22 с.
Неверов И. В. Место антиоксидантов в комплексной терапии пожилых больных ИБС / И. В. Неверов // Русский медицинский журнал. - 2001. - Т. 9, ? 18. - http://speclit. med-lib. rii/card/104. shtml.
Оковитый С. В. Клиническая фармакология антиоксидантов / С. В. Окови- тый // ФАРМиндекс: ПРАКТИК. - 2003. - Вып. 5. - С. 85-111.
Педаченко Е. Г. Антиоксидантный эффект диметилсульфоксида при тяжелой закрытой черепно-мозговой травме / Е. Г. Педаченко, Д. А. Сутковой, О. Б. Ма- лышев и др. - http://www.intermag.kiev.ua/uan/bulet/num5/28-7.html.
Перепеч Н. Б. Олифен в терапии ишемической болезни сердца - первые результаты и перспективы клинического применения / Н. Б. Перепеч, И. Е. Михайлова, А. О. Недошивин и др. // Международные медицинские обзоры. - 1993. - Т. 1, ? 4. - С. 328-333.
Семиголовский Н. Ю. Материалы к изучению отечественного препарата супероксиддисмутазы / Н. Ю. Семиголовский, Б. А. Азанов, Е. В. Иванова, К. Е. Сулай // Фармакотерапия гипоксии и ее последствий при критических состояниях: материалы Всероссийской научной конференции. - СПб., 2004. -
С. 112-115.
Смирнов А. В. Антиоксидантные эффекты амтизола и триметазидина / А. В. Смирнов, Б. И. Криворучко, И. В. Зарубина, О. П. Миронова // Эксперим. и клинич. фармакол. - 1999. - Т 62, ? 5. - С. 59-62.
Трубников Г. А. Антиоксиданты в комплексной терапии больных хрониче- ским бронхитом / Г. А. Трубников, Ю. И. Журавлев // Российский медицинский журнал. - 1998. - ? 2. - С. 38-41.
Филиппович Ю. Б. Основы биохимии / Ю. Б. Филиппович. - М.: Высшая школа, 1993. - 495 с.
Церулоплазмин. - http://iemrams. spb.ru:8100/russian/molgenru/complex/sci- ence/cpl.htm.
Шилина Н. М. Роль пищевых веществ в функционировании системы антиоксидантной защиты организма / Н. М. Шилина, И. Я. Конь // Вопросы детской диетологии. - 2003. - Т. 1, ? 4. - С. 53-57.
Яковлев Г. М. Диметилсульфоксид в экспериментальной и клинической медицине / Г. М. Яковлев, А. С. Свистов, М. И. Миронова // Эксперим. и клинич. фармакол. - 1992. - ? 4. - С. 74-76.
Abrescia P. Free radicals and antioxidants in cardiovascular diseases / P. Abrescia, P. Golino // Expert. Rev. Cardiovasc. Ther. - 2005. - Vol. 3, ? 1. - Р. 159-171.
Albanes D. Alpha-Tocopherol and beta-carotene supplements and lung cancer incidence in the alpha-tocopherol, beta-carotene cancer prevention study: effects of baseline characteristics and study compliance / D. Albanes, О. Р. Heinonen, P. R. Taylor et al. // J. Natl Cancer Inst. - 1996. - Vol. 88, ? 21. - P. 1513-1515.
Andrews P. J. Randomised trial of glutamine and selenium supplemented parenteral nutrition for critically ill patients. Protocol Version 9, 19 February 2007 Known as SIGNET (Scottish Intensive care Glutamine or seleNium Evaluative Trial) / Р. J. Andrews, А. Avenell, D. W. Noble et al. // Trials. - 2007. - Vol. 8, ? 1. - P. 25.
Artigou J. Y. Antioxidative treatment in myocardial reperfusion ischemia / J. Y. Artigou, J. C. Charniot, D. Bonnefont-Rousselot et al. // Arch. Mal. Coeur. Vaiss. - 1993. -
Vol. 86, Spec. ? 4. - P. 105-109.
Atkins D. Routine vitamin supplementation to prevent cancer. Update of the Evidence from randomized controlled trials, 1999-2002 / D. Atkins, P. Shetty. - http:// www.ahrq.gov/clinic/3rduspstf/vitamins/vitupdate. htm.
Barclay L. Antioxidant vitamins improve surgical outcomes / L. Barclay // Ann.
Surg. - 2002. - Vol. 236, ? 6. - P. 814-822.
Berger M. M. Antioxidant supplementation in sepsis and systemic inflammatory response syndrome / М. М. Berger, R. L. Chiolro // Crit Care Med. - 2007. - Vol. 35, ? 9 Suppl. - P. S584-S590.
Bjelakovic G. Antioxidant supplements for prevention of gastrointestinal cancers: a systematic review and meta-analysis / G. Bjelakovic, D. Nikolova, R. G. Simonetti, C. Gluud // Lancet. - 2004. - Vol. 364, ? 9441. - Р. 1219-1228.
Bland J. S. Oxidants and antioxidants in clinical medicine / J. S. Bland // J. Nutr. Environ. Med. - 1995. - Vol. 5. - P. 255-280.
Burton G. W. Antioxidant action of carotenoids / G. W. Burton // J. Nutr. - 1989. - Vol. 119. - P. 109-111.
Cappola T. P. Allopurinol improves myocardial efficiency in patients with idiopathic dilated cardiomyopathy / T P. Cappola, D. A. Kass, G. S. Nelson et al. // Circulation. - 2001. - Vol. 104. - P. 2407-2411.
Carrabba M. The intra-articular treatment of osteoarthritis of the knee. A comparative study between hyaluronic acid (Hyalgan(R)) and orgotein / M. Carrabba, E. Paresce, M. Angelini [et al.] // Europ. J. Rheumatol. Inflamm. - 1992. - Vol. 12,
? 3. - Р. 47-57.
Collaborative Group of the Primary Prevention Project. Low-dose aspirin and vitamin E in people at cardiovascular risk: a randomized trial in general practice // Lancet. - 2001. - Vol. 357. - P. 89-95.
Costagliola C. Effect of reduced glutathione parenteral administration on the progression of cataract in elderly subject: six-months follow-up / C. Costagliola, V. Russo, G. Scibelli, G. Iuliano // InterNet J. Ophthalmol. - 1996. - Vol. 1. - P. 1-6.
De Benedetto F. Long-term oral n-acetylcysteine reduces exhaled hydrogen peroxide in stable COPD / F. De Benedetto, A. Aceto, B. Dragani et al. // Pulm. Pharmacol. Ther. - 2005. - Vol. 18, ? 1. - P. 45-47.
Ekelund U. E. G. Intravenous allopurinol decreases myocardial oxygen consumption and increases mechanical efficiency in dogs with pacing-Induced heart failure / U. E. G. Ekelund, R. W. Harrison, O. Shokek et al. // Circ. Res. - 1999. -
Vol. 5. - P. 437-445.
Enstrom J. E. Vitamin C intake and mortality among a sample of the United States population / J. E. Enstrom, L. E. Kanim, M. A. Klein // Epidemiology. - 1992. - Vol. 3, ? 3. - P 194-202.
Escribano A. Aerosol orgotein (Ontosein) for the prevention of radiotherapy-Induced adverse effects in head and neck cancer patients: a feasibility study / A. Escribano, A. Garcia-Grande, P. Montanes et al. // Neoplasma. - 2002. - Vol. 49, ? 3. -
P. 201-208.
Famaey J. P. Free radicals and activated oxygen / J. P. Famaey // Europ. J. Rheumatol. Inflamm. - 1982. - Vol. 5, ? 4. - Р. 350-359.
Floyd R. A. Antioxidants, oxidative stress and degenerative neurological disorders / R. A. Floyd // Proc. Soc. Exp. Biol. Med. - 1999. - Vol. 222. - P. 236-245.
Grabhorn E. Neonatal hemochromatosis: long-term experience with favorable outcome / E. Grabhorn, A. Richter, M. Burdelski, X. Rogiers, R. Ganschow // Pediatrics. - 2006. - Vol. 118, ? 5. - P. 2060-2065.
Green A. R. Nitrones as neuroprotective agents in cerebral ischemia, with particular reference to NXY-059 / A. R. Green, T. Ashwood, T. Odergren, D. M. Jackson // Pharmacology & Therapeutics. - 2003. - Vol. 100, ? 3. - P. 195-214.
Geromel V. Coenzyme Q and idebenone in the therapy of respiratory chain disease: rationale and comparative benefits / V. Geromel, D. Chretien, P. Benit et al. // Mol. Genet. Metab. - 2002. - Vol. 77, ? 1-2. - P. 21-30.
Goldstein I. M. Ceruloplasmin a scavenger of superoxide anion radicals / I. M. Goldstein, H. B. Kaplan, H. S. Edelson, G. Weissmann // J. Biol. Chem. - 1979. - Vol. 254. - Р. 4040-4045.
Grabhorn E. Neonatal hemochromatosis: long-term eperience with favorable outcome / Е. Grabhorn, А. Richter, М. Burdelski, Х. Rogiers, R. Ganschow // Pediatrics. - 2006. - Vol. 118, ? 5. - Р. 2060-2065.
Greenberg E. R. A clinical trial of antioxidant vitamins to prevent colorectal adenoma. Polyp Prevention Study Group / E. R. Greenberg, J. A. Baron, T. D. Tosteson et al. // N. Engl. J. Med. - 1994. - Vol. 331, ? 3. - P. 141-147.
Greenwald P. Clinical trials of vitamin and mineral supplements for cancer prevention / Р. Greenwald, D. Anderson, S. A. Nelson, P. R. Taylor // Am. J. Clin. Nutr. - 2007. - Vol. 85, ? 1. - P. 314S-331S.
Heitzer T. Клинические эффекты препаратов, нейтрализующих свободные радикалы / T. Heitzer // Сердце и метаболизм. - 2005. - ? 14. - С. 9-14.
Hoffman R. M. Antyoxidants and the prevention of coronary heart disease / R. M. Hoffman, H. S. Gaweral // Arch. Intern. Med. - 1995. - Vol. 155. - Р. 241-246.
Huang H. Y. The efficacy and safety of multivitamin and mineral supplement use to prevent cancer and chronic disease in adults: a systematic review for a National Institutes of Health state-of-the-science conference / H. Y. Huang, В. Caballero, S. Chang et al. // Ann Intern Med. - 2006. - Vol. 145, ? 5. - P. 372-385.
Jeroudi M. Effect of superoxide dismutase and catalase, given separately, on myocardial «stunning» / M. Jeroudi // Am. J. Physiol. - 1990. - Vol. 259. -
Р. H889-H901.
Jones K. Coenzyme Q: efficacy, safety and use / К. Jones, К. Hughes, L. Mischley,
D. J. McKenna // Altern. Ther. Health Med. - 2002. - Vol. 8, ? 3. - P. 42-55.
Kushi L. H. Dietary antioxidant vitamins and death from coronary heart disease in postmenopausal women / L. H. Kushi, M. J. Stampfer, R. J. Prineas et al. // N. Engl. J. Med. - 1996. - Vol. 334. - P. 1156-1162.
Lees K. R. NXY-059 for acute ischemic stroke / K. R. Lees, J. A. Zivin, T. Ashwood et al. // New Eng. J. Med. - 2006. - Vol. 354, ? 6. - P. 588-600.
Malila N. Effects of alpha-tocopherol and beta-carotene supplementation on gastric cancer incidence in male smokers (ATBC Study, Finland) / N. Malila, P. R. Taylor, M. J. Virtanen et al. // Cancer Causes Control. - 2002. - Vol. 13, ? 7. - Р. 617-623.
Marenzi G. N. Acetylcysteine and contrast-Induced nephropathy in primary angioplasty / G. Marenzi, E. Assanelli, I. Marana et al. // N. Eng. J. Med. - 2006. -
Vol. 354. - P. 2773-2782.
Mazieres B. A French controlled multicenter study of intraarticular orgotein versus intraarticular corticosteroids in the treatment of knee osteoarthritis: A one-year followup / B. Mazieres, A. M. Masquelier, М. Н. Capron // J. Rheumatol. - 1991. - Vol. 18
(Suppl. 27). - Р. 134-137.
Morris C. D. Routine vitamin supplementation to prevent cardiovascular disease / C. D. Morris, S. Carson // Ann. Intern. Med. - 2003. - Vol. 139, ? 1. - P. 56-70.
MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial // Lancet. - 2002. - Vol.
360, ? 9326. - Р. 7-22.
Muizelaar J. P. Improving the outcome severe head injury with the oxygen radical scavenger polyethyleneglycol-conjugated superoxide dismutase: a phase II trial / J. P. Muizelaar, А. Marmarou, H. F. Young et al. // J. Neurosurgery. - 1993. - Vol.
78. - P. 375-382.
Neve J. Methods in determination of selenium states / J. Neve // J. Trace Elem. Electrolytes Health Dis. - 1991. - Vol. 5, ? 1. - P. 1-17.
NXY-059 does not meet efficacy endpoints in Phase III Trial for Acute Ischemic Stroke. - http://www.drugnewswire. com/7949/.
Omenn G. S. Chemoprevention of lung cancers: lessons from CARET, the betacarotene and retinol efficacy trial, and prospects for the future / G. S. Omenn // Eur. J. Cancer Prev. - 2007. - Vol. 16, ? 3. - P. 184-191.
Pape D. Effect of ascorbic acid during acute iterative anoxia, hypothesis of an antioxidizing mechanism of action in comparison with the effect of hydroquinone / D. Pape, P. Linee, P. Lacroix et al. // C. R. Seances Soc. Biol. Fil. - 1980. - Vol. 174, ? 1. -
P. 45-51.
Percival M. Antioxidants / M. Percival // Clinical Nutrition Insights. - 1998. - Vol. 10. - В Интернете: http://www. acudoc. com/Antioxidants. PDF.
Ponz de Leon M. Chemoprevention of colorectal tumors: role of lactulose and of other agents / М. Ponz de Leon, L. Roncucci // Scand. J. Gastroenterol. - 1997. -
Vol. 222, Suppl. - P. 72-75.
Proctor P. H. Free radicals and disease in man / P. H. Proctor, E. S. Reynolds // Physiological Chemistry and Physics Medical NMR. - 1984. - Vol. 16. - P. 175-195.
Pacher P. Therapeutic еffects of хanthine оxidase inhibitors: renaissance half a century after the discovery of allopurinol / P. Pacher, А. Nivorozhkin, С. Szab // Pharmacol. Rev. - 2006. - Vol. 58. - P. 87-114.
RahaS. Метаболическое действие свободных радикалов / S. Raha, B. H. Robinson // Сердце и метаболизм. - 2005. - ? 14. - C. 3-8.
Rosenfeldt F. Systematic review of effect of coenzyme Q10 in phtysical exercise, hypertension and heart failure / F. Rosenfeldt, D. Hilton, S. Pepe, H. Krum // Biofactors. - 2003. - Vol. 18, ? 1-4. - P. 91-100.
Routine vitamin supplementation to prevent cancer and cardiovascular disease: recommendations and rationale // Ann. Intern. Med. - 2003. - Vol. 139, ? 1. -
P. 56-70.
Sabbah H. H. Partial fatty acid oxidation inhibitors: a potentially new class of drugs
for heart failure / H. H. Sabbah, W. C. Stanley // Europ. J. Heart. Fail. - 2002. -
Vol. 4, ? 1. - Р. 3-6.
Sadowska A. M. Antioxidant and anti-Inflammatory efficacy of NAC in the treatment of COPD: discordant in vitro and in vivo dose-effects: a review / A. M. Sadowska, B. Manuel-Y-Keenoy, W. A. De Backer // Pulm. Pharmacol. Ther. - 2007. - Vol. 20, ? 1. - P. 9-22.
Scorolli L. Photodynamic therapy for age related macular degeneration with and without antioxidants / L. Scorolli, S. Z. Scalinci, P. G. Limoli et al. // Can. J.
Ophthalmol. - 2002. - Vol. 37, ? 7. - P. 399-404.
Sharma Y. R. Topical glutathione therapy in senile cataracts. Cataract III /
Y. R. Sharma, R. B. Vaipaye, R. Bhatnagar et al. // Indian J. Ophthalmol. - 1989. - Vol. 37, ? 3. - Р. 121-126.
Slatore C. G. Long-term use of supplemental multivitamins, vitamin C, vitamin E, and folate does not reduce the risk of lung cancer / C. G. Slatore, A. J. Lit-
tman, D. H. Au et al. // Am. J. Respir. Crit. Care Med. - 2008. - Vol. 77, ? 5. - Р. 524-530.
Spinnato J. A. Prevention of preeclampsia with antioxidants: evidence from randomized trials / J. A. Spinnato, J. C. Livingston // Clin. Obstet. Gynecol. - 2005. -
Vol. 48, ? 2. - Р. 416-429.
Sreedhar R.. Pharmacological neuroprotection / R. Sreedhar, S. V. Gadhinglajkar // Indian J. Anaesth. - 2003. - Vol. 47, ? 1. - P. 8-22.
Stranges S. Effects of long-term selenium supplementation on the incidence of type 2 diabetes: a randomized trial / S. Stranges, J. R. Marshall, R. Natarajan et al.] // Ann. Intern. Med. - 2007. - (Epub ahead of print).
The Heart Outcomes Prevention Evaluation Study Investigators. Vitamin E supplementation and cardiovascular events in high-risk patients // New Engl. J. Med. -
2000. - Vol. 342. - P. 154-160.
The HOPE and HOPE-TOO Trial Investigators. Effects of Long-term Vitamin E Supplementation on Cardiovascular Events and Cancer. A Randomized Controlled
Trial // JAMA. - 2005. - Vol. 293. - Р. 1338-1347.
The RANTTAS Investigators. A randomized trial of tirilazad mesylate in patients with acute stroke (RANTTAS) // Stroke. - 1996. - Vol. 27. - P. 1453-1458.
Tirilazad for acute ischaemic stroke // The Cochrane Database of Systematic Reviews. - 2007. - Issue 1.
Valencia J. The efficacy of orgotein in the treatment of acute toxicity due to radiotherapy on head and neck tumors / J. Valencia, C. Velilla, A. Urpegui et al. // Tu-
mori. - 2002. - Vol. 88, ? 5. - P. 385-389.
Villa R. F. Pharmacology of lazaroids and brain energy metabolism: a review / R. F. Villa, A. Gorini // Pharmacol. Rev. - 1997. - Vol. 49, ? 1. - Р. 99-136.
Voirin J. Selenium and vitamin E in patients with progressive muscular dystrophy / J. Voirin, G. Deschrevel, J. Y. Guincestre et al. // Ann. Pediatr. - 1990. - Vol. 37, ? 6. - P. 377-379.
Warner D. S. Oxidants, antioxidants and the ischemic brain / D. S. Warner, H. Sheng, I. Batini-Haberle // J. of Experimental Biology. - 2004. - Vol. 207. - Р. 3221-3231.
Winnefeld K. Selenium in serum and whole blood in patients with surgical interventions / К. Winnefeld, Н. Dawczynski, W. Schirrmeister et al. // Biol. Trace Elem. Res. - 1995. - Vol. 50, ? 2. - P.149-155.
Ziegler D. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a meta-analysis / D. Ziegler, Н. Nowak, Р. Kempler, Р. Vargha, Р. А. Low // Diabet. Med. - 2004. - Vol. 21. - P. 114-121.
Zimmermann C. Antioxidant status in acute stroke patients and patients at stroke risk / С. Zimmermann, К. Winnefeld, S. Streck et al. // Eur. Neurol. - 2004. - Vol. 51, ? 3. - P.157-161.