Биологическая химия с упражнениями и задачами : учебник / под ред. чл.-корр. РАМН С.Е. Северина. - 2011. - 624 с.: ил.
|
|
|
|
МОДУЛЬ 6 ОБМЕН УГЛЕВОДОВ
Структура модуля | Темы |
Модульная единица 1 | 6.1. Основные углеводы пищи. Строение, переваривание и всасывание 6.2. Трансмембранный перенос глюкозы и других моносахаридов из кишечника в кровь и из крови в клетки тканей. Пути превращения глюкозы в клетках 6.3. Синтез гликогена (гликогеногенез), мобилизация гликогена (гликогенолиз). Регуляция процессов 6.4. Нарушения переваривания и всасывания углеводов, синтеза и распада гликогена |
Модульная единица 2 | 6.5. Катаболизм глюкозы: аэробный и анаэробный гликолиз. Аэробный распад глюкозы до СО2 и Н2О 6.6. Биологическое значение катаболизма глюкозы. Регуляция процесса 6.7. Пентозофосфатный путь превращения глюкозы |
Модульная единица 3 | 6.8. Синтез глюкозы (глюконеогенез) 6.9. Регуляция гликолиза и глюконеогенеза в печени 6.10. Регуляция содержания глюкозы в крови, гиперглюкоземия |
Модульная единица 1 СТРОЕНИЕ, ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ УГЛЕВОДОВ. СИНТЕЗ И МОБИЛИЗАЦИЯ ГЛИКОГЕНА, РЕГУЛЯЦИЯ ПРОЦЕССОВ. НАРУШЕНИЯ ПЕРЕВАРИВАНИЯ УГЛЕВОДОВ, СИНТЕЗА И МОБИЛИЗАЦИИ ГЛИКОГЕНА
Цели изучения Уметь:
1. Объяснять роль углеводов в метаболизме человека.
2. Объяснять клинические проявления нарушений переваривания и всасывания углеводов для понимания патогенеза ряда заболеваний желудочно-кишечного тракта.
3. Оценивать значение синтеза и распада гликогена для поддержания гомеостаза глюкозы.
4. Объяснять молекулярные механизмы нарушений обмена гликогена.
Знать:
1. Строение основных углеводов пищи. Суточную норму углеводов в питании.
2. Причины и клинические проявления нарушений переваривания лактозы и других дисахаридов.
3. Этапы синтеза гликогена. Особенности мобилизации гликогена в печени и мышцах.
4. Механизмы влияния инсулина, глюкагона и адреналина на обмен гликогена в печени и мышцах.
5. Причины и клинические проявления гликогеновых болезней.
ТЕМА 6.1. ОСНОВНЫЕ УГЛЕВОДЫ ПИЩИ. СТРОЕНИЕ,
ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ
1. Основным источником углеводов организма являются углеводы пищи, к которым относится крахмал. Кроме того, в пище содержатся глюкоза, фруктоза, сахароза и лактоза.
Крахмал представляет собой разветвленный полисахарид, мономером которого является глюкоза. Мономеры линейных участков соединены α1.4-гликозидными связями, а в местах разветвления α1,6-связью. Цепи между участками ветвления содержат примерно 24 мономера. Крахмал поступает в организм в составе растительной пищи.
Лактоза содержится в молоке и является основным углеводом в питании грудных детей. Лактоза состоит из остатков D-галактазы и D-глюкозы, связанных β1,4-гликозидной связью.
Сахароза - дисахарид растений, особенно ее много в сахарной свекле и сахарном тростнике. В сахарозе остатки D-глюкозы и D-фруктозы соединены α,β1,2-гликозидной связью.
Мальтоза поступает с продуктами, в которых крахмал частично гидролизован (солод, пиво). Мальтоза состоит из двух остатков D-глюкозы, соединенных α1,4-гликозидной связью. Глюкоза и фруктоза являются моносахаридами и содержатся в меде и фруктах.
Норма углеводов в питании составляет 400-500 г в сутки. Углеводы обеспечивают более 50% калорий, необходимых человеку в сутки.
Пищевые углеводы - полимеры и димеры - подвергаются перевариванию в пищеварительном тракте под действием ферментов, которые гидролизуют гликозидные связи и образуют мономеры, способные всасываться, поступать в кровь, а затем в ткани (рис. 6.1).
2. Переваривание углеводов. Амилаза слюны расщепляет α1,4-гликозидные связи в крахмале. В ротовой полости происходит лишь частичное переваривание крахмала, так как действие фермента на крахмал кратковременно. Основными продуктами переваривания крахмала в ротовой области являются декстрины.
Желудочный сок не содержит ферментов, расщепляющих пищевые углеводы. Амилаза слюны инактивируется в желудке, так как оптимальное
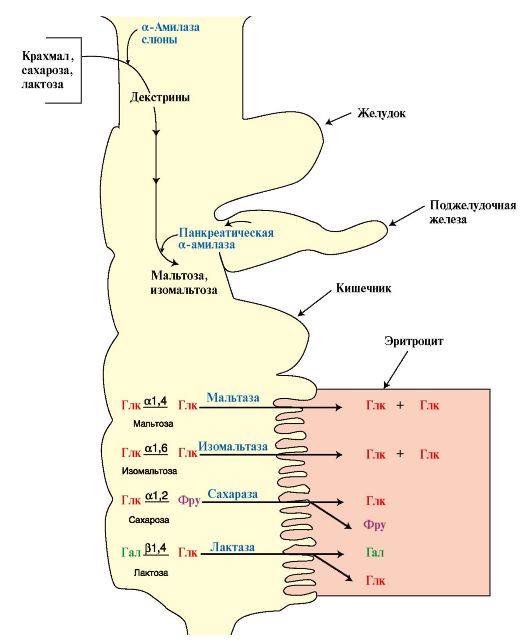 Рис. 6.1. Переваривание углеводов.
Рис. 6.1. Переваривание углеводов.
Ферменты тонкого кишечника, гидролизующие дисахариды, образуют фементативные комплексы, локализованные на поверхности энтероцитов: сахаразо-изомальтазный (включает сахаразу, мальтазу и изомальтазу), гликоамилазный (включает ферменты, расщепляющие олигосахариды и мальтозу), β-гликозидазный (проявляет активность лактазы)
Глк-глюкоза, Фру-фруктоза, Гал-галактоза
значение рН для ее активности составляет 6,7, а рН желудочного сока равно ~ 2. Лишь внутри пищевого комка этот фермент некоторое время продолжает действовать.
Последующее переваривание нерасщепленного или частично расщепленного крахмала происходит в кишечнике. В двенадцатиперстной кишке pH желудочного содержимого нейтрализуется бикарбонатами, содержащимися в секрете поджелудочной железы, и создается оптимальное значение pH 7,5-8 для действия панкреатической α-амилазы.
α-Амилаза поджелудочной железы гидролизует в верхнем отделе тонкого кишечника декстрины и оставшиеся нерасщепленными молекулы крахмала, расщепляя α1,4-гликозидные связи. Гидролиз происходит путем последовательного отщепления дисахаридных остатков. Так как панкреатическая амилаза не гидролизует α1,6-гликозидные связи, то продуктами реакции являются мальтоза и изомальтоза, в последней два остатка D-глюкозы связаны α1,6-гликозидной связью.
Мальтоза и изомальтоза вместе с другими пищевыми дисахаридами - сахарозой и лактозой - гидролизуются специфическими гликозидазами на поверхности клеток тонкого кишечника (возможно и внутри клеток) до соответствующих мономеров.
Гликозидазы тонкого кишечника синтезируются в клетках, но не секретируются в просвет кишечника, а образуют на поверхности клеток крупные ферментативные комплексы с различной субстратной специфичностью: сахаразо-изомальтазный (гидролизует связи в сахарозе, изомальтозе, мальтозе), гликоамилазный (проявляет экзоамилазную активность, катализует гидролиз олигосахаридов, а также расщепляет связи в мальтозе), β-гликозидазный (расщепляет лактозу).
3. Целлюлоза - полисахарид растительной пищи - не расщепляется в желудочно-кишечном тракте, так как фермент, способный гидролизовать β1.4-связи между остатками глюкозы, не вырабатывается у человека, хотя образуется бактериями в толстом кишечнике. Однако непереваренная целлюлоза способствует нормальной перистальтике кишечника.
ТЕМА 6.2. ТРАНСМЕМБРАННЫЙ ПЕРЕНОС ГЛЮКОЗЫ И ДРУГИХ МОНОСАХАРИДОВ ИЗ КИШЕЧНИКА В КРОВЬ И ИЗ КРОВИ В КЛЕТКИ ТКАНЕЙ. ПУТИ ПРЕВРАЩЕНИЯ
ГЛЮКОЗЫ В КЛЕТКАХ
1. Транспорт моносахаридов из просвета кишечника в клетки слизистой осуществляется путем облегченной диффузии и активного транспорта (рис. 6.2). В случае активного транспорта глюкоза и Na+ проходят с люминальной стороны, связываясь с разными участками белка-переносчика. При этом Na+ поступает в клетку по градиенту и «тащит» глюкозу за собой (вторичноактивный транспорт). Градиент концентрации Na+ создается работой Na+, К+-АТФазы (первично-активный транспорт, см. модуль 4).
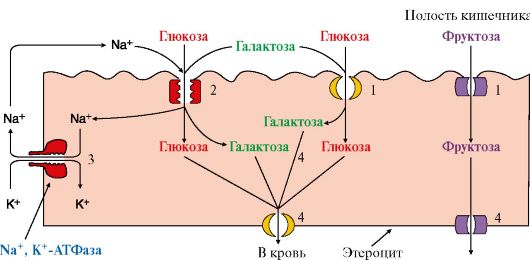 Рис. 6.2. Всасывание углеводов в кишечник:
Рис. 6.2. Всасывание углеводов в кишечник:
1 - всасывание глюкозы, галактозы и фруктозы из кишечника путем облегченной диффузии с помощью специальных белков-переносчиков; 2 - транспорт глюкозы и галактозы в энтероцит путем Na-зависимого вторично-активного транспорта. Белки-переносчики участвуют во всасывании глюкозы из просвета кишечника в энтероцит против градиента концентрации. Энергию, необходимую для транспорта, обеспечивает Na+, К+-АТФаза (3), которая работает, как насос, откачивая из клетки Na+ в обмен на К+ и обеспечивает градиент концентрации Na+; 4 - транспорт моносахаридов из энтероцитов в кровь путем облегченной диффузии
Глюкоза из энтероцитов перемещается во внеклеточную жидкость и далее в кровь с помощью облегченной диффузии. Поступающая из кишечника глюкоза кровью воротной вены транспортируется в печень, где часть ее задерживается, а часть через общий кровоток поступает в клетки других органов и тканей.
2. Поступление глюкозы в клетки из кровотока происходит путем облегченной диффузии при участии специальных белков-переносчиков - ГЛЮТ (глюкозные транспортеры). ГЛЮТ обнаружены во всех тканях. Существует несколько изоформ ГЛЮТ, которые различаются по локализации и сродству к глюкозе. ГЛЮТ пронумерованы в порядке их обнаружения (табл. 6.1).
Таблица 6.1. Распределение белков - транспортеров глюкозы (ГЛЮТ)
Тип ГЛЮТ | Локализация в органах |
ГЛЮТ-1 | Преимущественно в плаценте, мозге, почках, толстой кишке, меньше в жировой ткани, мышцах |
ГЛЮТ-2 | Преимущественно в печени, β-клетках островков Лангерганса, энтероцитах |
ГЛЮТ-3 | Во многих тканях, включая мозг, плаценту, почки |
ГЛЮТ-4 инсулинозависимый | В мышцах (скелетных, сердечной), жировой ткани (находятся почти полностью в цитоплазме) |
ГЛЮТ-5 | В тонкой кишке, в меньшей мере в почках, скелетных мышцах, жировой ткани, мозге. Переносчик фруктозы |
Все типы ГЛЮТ могут находиться как в плазматической мембране, так и в цитозольных везикулах. В клетках мышц и жировой ткани ГЛЮТ-4 (инсулинозависимые) почти полностью локализуются в цитоплазме. Влияние инсулина на такие клетки приводит к перемещению везикул, содержащих ГЛЮТ-4, к плазматической мембране и их слиянию с ней. После этого возможен облегченный транспорт глюкозы в клетки. При снижении концентрации инсулина в крови белки транспортеры глюкозы снова перемещаются в цитозоль и поступление глюкозы в эти ткани прекращается.
3. В метаболические пути глюкоза и другие моносахариды включаются только в виде фосфорных эфиров. Фосфорилирование свободных моносахаридов - обязательная реакция на пути их использования в клетках, она приводит к образованию более реакционноспособных соединений и поэтому может рассматриваться как реакция активации.
Глюкоза, поступающая в клетки органов и тканей, фосфорилируется с использованием АТФ, превращаясь в глюкозо-6-фосфат. Эту реакцию во многих тканях катализирует фермент гексокиназа, а в печени и поджелудочной железе - глюкокиназа. Фосфорилирование глюкозы - практически необратимая реакция. Образование глюкозо-6-фосфата в клетке - это своеобразная «ловушка» для глюкозы, так как мембрана клетки непроницаема для фосфорилированной глюкозы:
 Глюкокиназа имеет высокое значение Кт
= 10 ммоль/л и катализирует фосфорилирование глюкозы в гепатоцитах в
период пищеварения (абсорбтивный период). В этот период концентрация
глюкозы в воротной вене больше, чем в других отделах кровяного русла, и
может превышать 10 ммоль/л. В этих условиях максимальная активность
глюкокиназы обеспечивает поступление глюкозы в клетки печени и ее
фосфорилирование. Глюкокиназа, в отличие от гексокиназы, не ингибируется
продуктом реакции - глюкозо-6-фосфатом.
Глюкокиназа имеет высокое значение Кт
= 10 ммоль/л и катализирует фосфорилирование глюкозы в гепатоцитах в
период пищеварения (абсорбтивный период). В этот период концентрация
глюкозы в воротной вене больше, чем в других отделах кровяного русла, и
может превышать 10 ммоль/л. В этих условиях максимальная активность
глюкокиназы обеспечивает поступление глюкозы в клетки печени и ее
фосфорилирование. Глюкокиназа, в отличие от гексокиназы, не ингибируется
продуктом реакции - глюкозо-6-фосфатом.
Гексокиназа отличается от глюкокиназы высоким сродством к глюкозе и низким значением Кт <0,1ммоль/л. Следовательно, этот фермент, в отличие от глюкокиназы, активен при концентрации глюкозы в крови, соответствующей физиологической норме, и обеспечивает потребление глюкозы мозгом, эритроцитами и другими тканями между приемами пищи (постабсорбтивный период).
4. В клетках глюкозо-6-фосфат может использоваться в различных процессах, основными из которых является: 1-синтез гликогена (форма депонирования глюкозы), 2-синтез некоторых аминокислот, гетерополисахаридов, пентоз, липидов, 3-катаболизм глюкозы до лактата или до СО2 и Н2О, который служит основным источником энергии для организма (рис. 6.3)
5. Дефосфорилирование глюкозо-6-фосфата возможно в печени, почках и клетках эпителия кишечника. В клетках этих органов имеется фермент глюкозо-6-фосфатаза, катализирующий отщепление фосфатной группы гидролитическим путем:
Глюкозо-6-фосфат + Н2О → Глюкоза + Н3РО4. Свободная глюкоза способна поступать из этих органов в кровь.
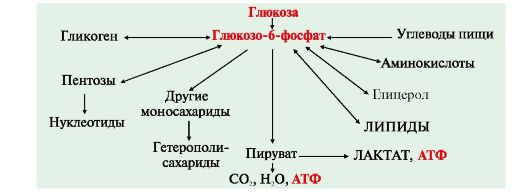 Рис. 6.3. Метаболизм глюкозы в клетках
Рис. 6.3. Метаболизм глюкозы в клетках
ТЕМА 6.3. СИНТЕЗ ГЛИКОГЕНА (ГЛИКОГЕНОГЕНЕЗ), МОБИЛИЗАЦИЯ ГЛИКОГЕНА (ГЛИКОГЕНОЛИЗ). РЕГУЛЯЦИЯ ПРОЦЕССОВ
1. Гликоген - основной резервный полисахарид в клетках животных. Гликоген представляет собой разветвленный гомополисахарид, мономером которого является глюкоза. Остатки глюкозы соединены в линейных участках а1,4-гликозидными связями, а в местах разветвления - связями α1,6. Молекула гликогена более разветвлена, чем молекула крахмала, точки ветвления встречаются через каждые 8-10 остатков глюкозы. Разветвленная структура гликогена обеспечивает большое количество концевых мономеров, что способствует работе ферментов, отщепляющих или присоединяющих мономеры, так как эти ферменты могут одновременно работать на многих ветвях молекулы гликогена.
Гликоген депонируется главным образом в печени и скелетных мышцах и хранится в цитозоле клеток в форме гранул. Гранулы гликогена плохо растворимы в воде и не влияют на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза. С гранулами связаны и некоторые ферменты, участвующие в обмене гликогена, что облегчает взаимодействие ферментов с субстратами.
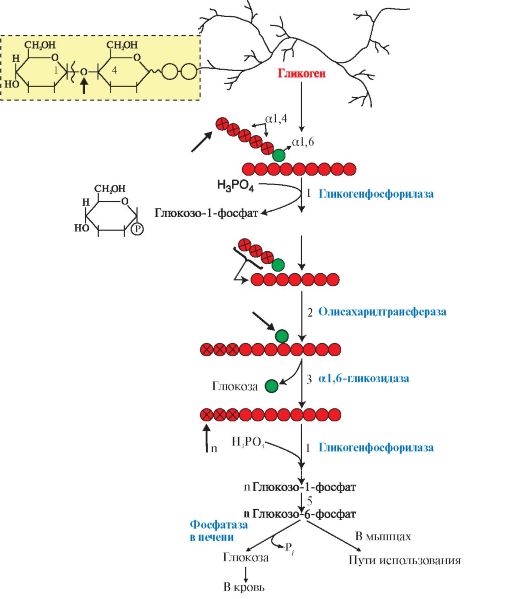
2. Синтез гликогена. Гликоген синтезируется в период пищеварения (абсорбтивный период: 1-2 часа после приема углеводной пищи) в основном в печени и в мышцах. Этот процесс требует затрат энергии, так включение одного мономера в полисахаридную цепь сопряжено с расходованием АТФ и УТФ (рис. 6.4, реакции 1 и 3). Образованная УДФ-глюкоза (реакция 3) является субстратом для гликогенсинтазы, которая переносит остаток глюкозы (реакция 4) на праймер (олигосахарид из 4-8 остатков глюкозы) и соединяет его а1,4-глюкозной связью. Когда длина синтезируемой цепи увеличивается на 11-12 остатков глюкозы, фермент ветвления - глюкозил- 1,4-1,6-трансфераза (реакция 5) образует боковую цепь путем переноса фрагмента из 5-6 остатков глюкозы на внутренний остаток глюкозы, соединяя
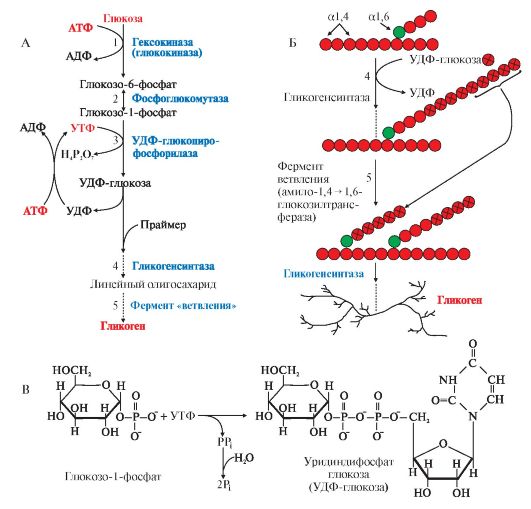
 его
а1,6-гликозидной связью. Затем удлинение цепей и ветвление их
повторяется много раз. В итоге образуется сильно разветвленная молекула,
содержащая до 1млн глюкозных остатков.
его
а1,6-гликозидной связью. Затем удлинение цепей и ветвление их
повторяется много раз. В итоге образуется сильно разветвленная молекула,
содержащая до 1млн глюкозных остатков.
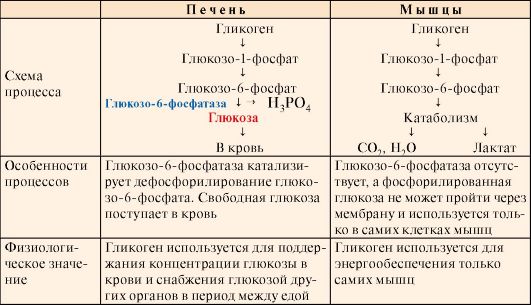
3. Мобилизация (распад) гликогена происходит в интервалах между приемами пищи (постабсорбтивный период) и ускоряется во время физической работы. Этот процесс осуществляется путем последовательного отщепления остатков глюкозы, в виде глюкозо-1-фосфата (рис. 6.5, реакция 1) с помощью гликогенфосфорилазы, расщепляющей а1,4-гликозидные связи. Этот фермент не расщепляет а1,6-гликозидные связи в местах разветвлений, поэтому необходимы еще два фермента, после действия которых остаток глюкозы в точке ветвления освобождается в форме свободной глюкозы (рис. 6.5, реакции 2 и 3). Гликоген распадается до глюкозо-6-фосфата и свободной глюкозы без затрат АТФ.
Мобилизация гликогена в печени отличается от таковой в мышцах одной реакцией (реакция 5), обусловленной наличием в печени фермента глюкозо- 6-фосфатазы.
Присутствие в печени глюкозо-6-фосфатазы обеспечивает главную функцию гликогена печени - высвобождение глюкозы в кровь в интервалах между едой для использования ее другими органами. Таким образом, мобилизация гликогена печени обеспечивает поддержание глюкозы в крови на постоянном уровне 3,3-5,5 ммоль в постабсорбтивном периоде. Это обстоятельство является обязательным условием для работы других органов и особенно мозга. Через 10-18 часов после приема пищи запасы гликогена в печени значительно истощаются, а голодание в течение 24 часов приводит к полному его исчерпанию.
Функция мышечного гликогена заключается в обеспечении клеток глю- козо-6-фосфатом, используемым в самой мышце для окисления и получения энергии или других целей (табл. 6.2).
Таблица 6.2. Особенности мобилизации гликогена в печени и в мышцах
 4. Переключение процессов синтеза и мобилизации гликогена в печени и мышцах происходит
при переходе из абсорбтивного состояния в постабсорбтивное и из
состояния покоя в режим физической работы. В переключении этих
метаболических путей в печени участвуют инсулин, глюкагон и адреналин, а в мышцах - инсулин и адреналин.
4. Переключение процессов синтеза и мобилизации гликогена в печени и мышцах происходит
при переходе из абсорбтивного состояния в постабсорбтивное и из
состояния покоя в режим физической работы. В переключении этих
метаболических путей в печени участвуют инсулин, глюкагон и адреналин, а в мышцах - инсулин и адреналин.
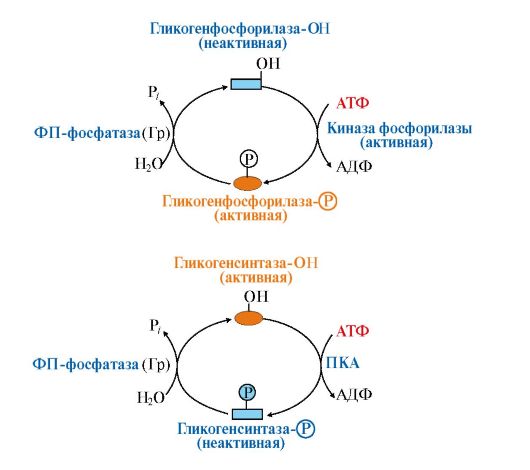
Влияние этих гормонов на синтез и распад гликогена осуществляется путем изменения в противоположном направлении активности двух ключевых ферментов: гликогенсинтазы и гликогенфосфорилазы с помощью их фосфорилирования и дефосфорилирования (рис. 6.6).
 Первичным сигналом для синтеза инсулина и глюкагона является изменение концентрации глюкозы в крови. Инсулин
и глюкагон постоянно присутствуют в крови, но при переходе из
абсорбтивного периода в постабсорбтивный изменяется их относительная
концентрация. Отношение концентраций инсулина и глюкагона в крови
называют инсулин-глюкагоновым индексом, в зависимости от которого изменяется направление метаболизма гликогена в печени.
Первичным сигналом для синтеза инсулина и глюкагона является изменение концентрации глюкозы в крови. Инсулин
и глюкагон постоянно присутствуют в крови, но при переходе из
абсорбтивного периода в постабсорбтивный изменяется их относительная
концентрация. Отношение концентраций инсулина и глюкагона в крови
называют инсулин-глюкагоновым индексом, в зависимости от которого изменяется направление метаболизма гликогена в печени.
5. Регуляция метаболизма гликогена в печени.
В период пищеварения концентрация глюкозы в крови повышается до 10-12 ммоль/л, и это является сигналом для синтеза и секреции инсулина. Концентрация инсулина увеличивается, и его влияние является преобладающим. Инсулин-глюкагоновый индекс в этом случае повышается. Под влиянием инсулина происходит:
• ускорение транспорта глюкозы в клетки инсулинзависимых мышечной и жировой тканей (см. модуль 4);
• изменение активности ферментов путем фосфорилирования и дефосфорилирования. Так, например, инсулин активирует фосфодиэстеразу и снижает концентрацию цАМФ в клетке. Кроме этого, инсулин активирует фосфопротеинфосфатазу гранул гликогена, которая дефосфорилирует гликогенсинтазу и переводит ее в активное состояние. Дефосфорилирование гликогенфосфорилазы под влиянием фосфопротеинфосфатазы, напротив, приводит к ее инактивации (рис. 6.7);
• изменение количества некоторых ферментов путем индукции и репрессии их синтеза. В печени инсулин индуцирует синтез глюкокиназы, ускоряя тем самым фосфорилирование глюкозы.
Все эти свойства инсулина приводят к повышению скорости синтеза гликогена.
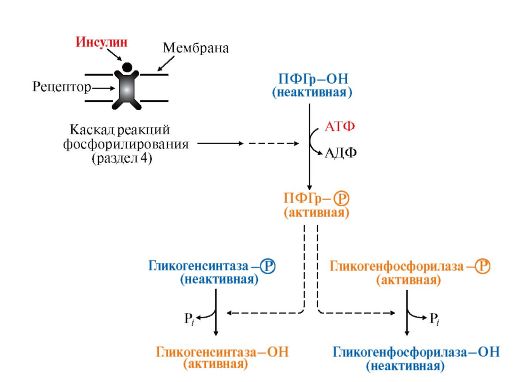 Рис. 6.7. Влияние инсулина на активность гликогенсинтазы и гликогенфосфорилазы:
Рис. 6.7. Влияние инсулина на активность гликогенсинтазы и гликогенфосфорилазы:
ФП-фосфатаза (Гр) - фосфопротеинфосфатаза гранул гликогена
В постабсорбтивном периоде инсулин-глюкагоновый индекс снижается и решающим является влияние глюкагона, который синтезируется в ответ на снижение концентрации глюкозы в крови и стимулирует распад гликогена в печени. Механизм действия глюкагона заключается в том, что он «запускает» аденилатциклазный каскад реакций, приводящий к активации гликогенфосфорилазы и ингибированию гликогенсинтазы (рис. 6.8).
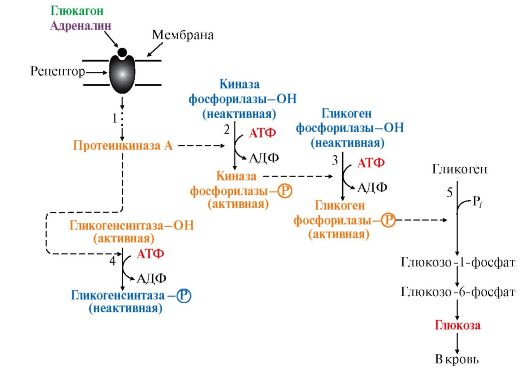 Рис. 6.8. Регуляция синтеза и распада гликогена в печени глюкагоном и адреналином:
Рис. 6.8. Регуляция синтеза и распада гликогена в печени глюкагоном и адреналином:
1 - глюкагон и адреналин взаимодействуют со специфическими мембранным! рецепторами. Комплекс гормон-рецептор передает сигнал через аденилатциклазную систему на протеинкиназу А, переводя ее в активное состояние;
2 - протеинкиназа А фосфорилирует и активирует киназу фосфорилазы;
3 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя ее ι активную форму;
4. - протеинкиназа А фосфорилирует также гликогенсинтазу, переводя ее в неак тивное состояние;
5 - в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы ускоряется распад гликогена
Адреналин имеет сходный с глюкагоном механизм действия на клетки печени (см. рис. 6.8). Но возможно включение и другой эффекторной системы передачи сигнала в клетку печени. Какая система передачи сигнала в клетку будет использована, зависит от типа рецепторов, с которыми взаимодействует адреналин. Так, присоединение адреналина к β2-рецепторам клеток печени приводит в действие аденилатциклазную
систему. Взаимодействие же адреналина с αj-рецепторами «включает» инозитолфосфатный механизм трансмембранной передачи гормонального сигнала (рис. 6.9). Результатом действия обеих систем является фосфорилирование ключевых ферментов, изменение их активности и переключение синтеза гликогена на его распад.
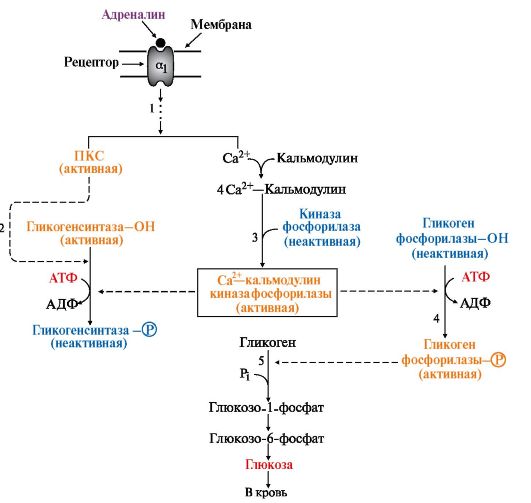 Рис. 6.9. Инозитолфосфатный механизм регуляции синтеза и распада гликогена в печени адреналином и Са2+:
Рис. 6.9. Инозитолфосфатный механизм регуляции синтеза и распада гликогена в печени адреналином и Са2+:
1 - взаимодействие адреналина с α1-рецептором передает сигнал через инозитолфосфатную систему. Это сопровождается активацией фосфолипазы С, мобилизацией Сa2+ из ЭР и активацией протеинкиназы С (ПКС).
2 - протеинкиназа С фосфорилирует гликогенсинтазу и переводит ее в неактивное состояние.
3 - комплекс 4Са2+-кальмодулин активирует киназу фосфорилазы и кальмодулинзависимые протеинкиназы.
4 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу и тем самым ее активирует.
5 - гликогенфосфорилаза катализирует первую реакцию распада гликогена
6. Регуляция метаболизма гликогена в мышцах. Активация адреналином мышечной гликогенфосфорилазы происходит несколько иначе, так как распад гликогена в скелетных мышцах стимулируется мышечными сокращениями (рис. 6.10).
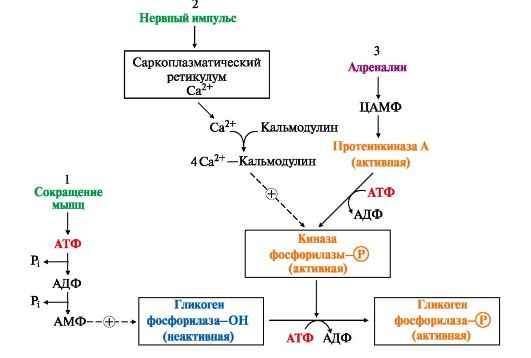 Рис. 6.10. Способы активации гликогенфосфорилазы мышц:
Рис. 6.10. Способы активации гликогенфосфорилазы мышц:
1 - аллостерическая активация гликогенфосфорилазы. В процессе мышечного сокращения происходит превращение АТФ в АМФ, который является аллостерическим активатором дефосфорилированной и малоактивной формы гликогенфосфорилазы;
2 - нервный импульс инициирует высвобождение из саркоплазматического ретикулума ионы Са2+, образующие комплекс с кальмодулином, способный активировать киназу фосфорилазы, которая в свою очередь фосфорилирует и активирует гликогенфосфорилазу;
3 - активация гликогенфосфорилазы адреналином посредством аденилатциклазной системы
При интенсивной мышечной работе киназа фосфорилазы (Са2+-зависимая) активируется под влиянием нервного импульса, так как в саркоплазме в этом случае возрастает концентрация ионов кальция. Результатом действия адреналина в мышцах также является активация цАМФ зависимой протеинкиназы (ПКА) и активация гликогенфосфорилазы путем ее фосфорилирования (рис. 6.10, пути 2 и 3).
При умеренной физической нагрузке и в состоянии покоя, когда уровень цАМФ в клетке низкий и гликогенфосфорилаза находится в дефосфорилированном состоянии, в мышцах действует другой механизм активации гликогенфосфорилазы - аллостерический. Активатором фермента служит АМФ, образующаяся при распаде АТФ (рис. 6.10, путь 1).
7. Значение регуляции обмена гликогена. При передаче гормонального сигнала через внутриклеточные посредники происходит значительное его усиление, поэтому активация фосфорилазы гликогена при участии любой системы передачи сигнала в клетку печени позволяет быстро получить большое количество глюкозы из гликогена. Усиление гормонального сигнала в мышцах имеет большое значение для обеспечения энергетическим материалом интенсивной работы в условиях стресса, например при бегстве от опасности.
При смене постабсорбтивного состояния на абсорбтивное или по окончании мышечной работы вся система возвращается в исходное состояние. Аденилатциклаза и фосфолипаза С инактивируются, цАМФ разрушается фосфодиэстеразой, а фосфопротеинфосфатаза вызывает переход всех внутриклеточных ферментов «каскада» в дефосфорилированную форму.
Итак, регуляция скоростей синтеза и распада гликогена в печени поддерживает постоянство концентрации глюкозы в крови (3,3-5,5 ммоль/л). Регуляция обмена гликогена в мышцах обеспечивает энергетическим материалом как интенсивную работу мышц, так и энергозатраты в состоянии покоя.
ТЕМА 6.4. НАРУШЕНИЯ ПЕРЕВАРИВАНИЯ И ВСАСЫВАНИЯ УГЛЕВОДОВ, СИНТЕЗА И РАСПАДА ГЛИКОГЕНА
1. Причинами нарушений переваривания углеводов могут быть:
• наследственные или приобретенные дефекты ферментов (табл. 6.3), участвующих в гидролизе углеводов в кишечнике;
• нарушение системы транспорта моносахаридов через мембраны клеток кишечника.
И в том и в другом случае возникает осмотическая диарея. Кроме того, нерасщепленные углеводы подвергаются действию ферментов микроорганизмов кишечника с образованием газов, что сопровождается спазмами и болями в кишечнике.
Для диагностики нарушений переваривания используют пробы с нагрузкой определенными углеводами (2 г углевода на 1 кг массы). После нагрузки в норме уровень глюкозы в крови увеличивается примерно на 50 мг в 1 дл по сравнению с исходным. При патологии подъем гликемической кривой незначителен.
Если тест при нагрузке моносахаридом сопровождается адекватным повышением его концентрации в крови, а нагрузка дисахаридом не дает нормальной реакции, то это указывает на недостаточность кишечной дисахаридазы, а не системы транспорта моносахаридов.
Таблица 6.3. Нарушения переваривания дисахаридов
Причина заболевания | Клинические проявления и лабораторные данные |
Наследственный дефицит β-гликозидазного комплекса - фермента лактазы | Встречается относительно редко. После приема молока наблюдаются рвота, диарея, спазмы и боли в животе, метеоризм. Симптомы развиваются сразу после рождения |
Недостаточность лактазы вследствие снижения экспрессии гена фермента в онтогенезе | Характерна для взрослых и детей старшего возраста. Является следствием возрастного снижения количества лактазы. Симптомы непереносимости молока аналогичны таковым при наследственной форме дефицита лактазы |
Недостаточность лактазы вторичного характера | Временная, приобретенная форма. Непереносимость молока может быть следствием кишечных заболеваний, например колитов, гастритов или операций на желудочно-кишечном тракте |
Наследственная недостаточность сахаразо-изомальтазного комплекса | Проявляется при добавлении в рацион детей сахарозы и крахмала. После нагрузки сахарозой отмечается незначительная гипергликемия. Другие сахара (глюкоза, фруктоза, лактоза) переносятся лучше |
Приобретенная недостаточность сахаразо-изомальтазного комплекса | Может возникать вследствие кишечных заболеваний и проявляется диспепсией, провоцируемой крупами, крахмалом, а также пивом и другими напитками на основе солода |
2. Гликогеновые болезни - это группа наследственных заболеваний, причинами которых являются дефекты ферментов, участвующих в синтезе или распаде гликогена, а также в регуляции этих процессов (табл. 6.4).
• Гликогенозы (болезни накопления гликогена) обусловлены дефектом ферментов, участвующих в распаде гликогена. Гликогеноз проявляется избыточным накоплением гликогена в печени, сердечной и скелетных мышцах, почках, легких и других органах. Накапливаемый гликоген может иметь как нормальную структуру, так и измененную. Результатом нарушения распада гликогена является гипоглюкоземия (снижение содержания глюкозы в крови). Гликогенозы различаются характером и локализацией дефектного фермента.
• Агликогенозы являются следствием нарушения синтеза гликогена и сопровождаются снижением его содержания в тканях. Результатом также является гипоглюкоземия.
Таблица 6.4. Гликогеновые болезни и их причины
Фермент | Локализация дефектного фермента | Основные проявления болезней | Название болезни |
1. Глюкозо-6-фос- фатаза | Печень, почки | Накопление гликогена нормальной структуры. Гипоглюкоземия, гиперурикемия, ацидоз (накопление лактата) | Болезнь Гирке |
2. Амило-1,6-глю- козидаза (расщепляет связи в местах ветвления) | Мышцы, печень | Накопление гликогена с короткими внешними ветвями | Болезнь Кори |
3. Амило-1,6-глю- козилтрансфераза | Печень, селезенка | Накопление гликогена с длинными наружными ветвями и редкими точками ветвления | Болезнь Андерсена |
4. Гликогенфосфорилаза | Мышцы | Накопление в мышцах гликогена нормальной структуры | Болезнь Мак-Ардля |
5. Гликогенфосфорилаза | Печень | Накопление в мышцах гликогена нормальной структуры | Болезнь Херса |
6. цАМф-зависимая протеинкиназа | Печень | Аналогичны болезни Херса | - |
7. Киназа гликогенфосфорилазы | Печень | Аналогичны болезни Херса | - |
8. Гликогенсинтаза | Печень | Низкое содержание гликогена в печени, гипоглюкоземия | - |
Количественные характеристики обмена углеводов, изучаемые в данной модульной единице:
концентрация глюкозы в крови: 3,3-5,5 мМоль/л,
80-100 мг/дп
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Заполните табл. 6.5, используя данные рис. 6.1.
Таблица 6.5. Переваривание углеводов
Название фермента, место его синтеза | Место действия фермента (отдел желудочнокишечного тракта) | Химическая реакция, катализируемая ферментом | Гидролизуемая связь |
2. Ответьте письменно на вопросы:
а) почему углеводы не перевариваются в желудке?
б) почему в результате действия α-амилазы на крахмал образуются два разных дисахарида?
в) какой моносахарид образуется в наибольших количествах при переваривании пищевых углеводов?
3. Укажите значение в норме:
• pH слюны,
• pH сока поджелудочной железы,
• концентрацию глюкозы в крови при полноценном рационе питания.
4. Впишите в табл. 6.6 способ транспорта глюкозы по разным маршрутам.
Таблица 6.6. Пути транспорта глюкозы
Маршрут глюкозы | Способ транспорта |
Просвет кишечника - клетки слизистой Клетки кишечника - кровь Кровь - клетки тканей |
5. Напишите ответы на вопросы:
а) почему в организме человека и животных резервную функцию выполняет гликоген, а не крахмал и клетчатка, также построенные из глюкозных остатков?
б) почему анализ крови на определение содержания глюкозы у пациентов берут натощак, а не после приема пищи?
в) в течение какого времени истощается запас гликогена в печени при полном голодании в состоянии покоя?
6. Впишите в табл. 6.7 лиганды (эффекторы), взаимодействие с которыми изменяет активность ферментов, участвующих в трансмембранной передаче гормонального сигнала в клетки печени.
Таблица 6.7. Изменение активности ферментов в результате взаимодействия с лигандами (эффекторами)

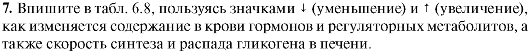 Таблица 6.8. Регуляция обмена гликогена в печени
Таблица 6.8. Регуляция обмена гликогена в печени
 8. Выберите правильный ответ.
8. Выберите правильный ответ.
В постабсорбтивном периоде повышается:
A. Инсулин-глюкагоновый индекс в крови
Б. Перемещение белков-транспортеров из цитозоля в плазматическую мембрану в мышцах
B. Фосфорилирование гликогенсинтазы и гликогенфосфорилазы в печени и мышцах
Г. Разрушение цАМФ фосфодиэстеразой Д. Содержание гликогена в печени
9. Выберите правильные ответы.
В абсорбтивном периоде в состоянии покоя снижается:
A. Инсулин-глюкагоновый индекс в крови
Б. Концентрация цАМФ в клетках печени и мышц
B. Активность ПКС в печени
Г. Фосфорилирование гликогенсинтазы в мышцах и печени
Д. Мобилизация Са2+ из эндоплазматического ретикулума в мышцах
10. Впишите в табл. 6.9 названия ферментов, дефект в которых ведет к накоплению гликогена.
Таблица 6.9. Накопление гликогена и изменения его структуры при дефекте некоторых ферментов
 ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Установите соответствие.
Субстрат:
A. Лактоза в ротовой полости Б. Мальтоза в кишечнике
B. Сахароза в желудке
Г. Крахмал и декстрины в кишечнике Д. Лактоза в кишечнике Фермент:
1. Панкреатическая α-амилаза
2. Сахаразо-изомальтазный комплекс
3. β-гликозидазный комплекс
2. Выполните «цепное» задание. Человек съел во время обеда 200 г хлеба:
а) в результате действия панкреатической α-амилазы образуется дисахарид:
A. Глюкоза (α1,2) Глюкоза Б. Глюкоза (α1,4) Глюкоза
B. Галактоза (β1,4) Глюкоза Г. Глюкоза (β1,4) Глюкоза Д. Глюкоза (α1,2) Фруктоза
б) полученное вещество в тонком кишечнике подвергается действию:
A. Глюкокиназы
Б. Фосфоглюкоизомеразы
B. β-Гликозидазного комплекса Г. Гексокиназы
Д. Сахаразо-изомальтазного комплекса
в) продуктом реакции, которую катализирует выбранный фермент, является:
A. D-глюкоза Б. L-фруктоза
B. L-глюкоза Г. D-манноза Д. D-галактоза
г) этот вещество всасывается в клетки слизистой оболочки кишечника путем:
A. Простотой диффузии Б. Пассивного симпорта
B. Транспорта, зависимого от инсулина Г. Первично-активного транспорта
Д. Облегченной диффузии
3. Выполните цепное задание:
а) потребление глюкозы клетками тканей из кровотока происходит путем:
А. Простой диффузии
Б. Облегченной диффузии
В. Симпорта
Г. Первично-активного транспорта Д. Вторично-активного транспорта
б) этот тип транспорта глюкозы в клетки жировой ткани регулирует гормон:
A. Инсулин Б. Адреналин
B. Вазопрессин Г. Норадреналин Д. Глюкагон
в) механизм действия этого гормона включает:
A. Взаимодействие с цитоплазматическим рецептором Б. Превращение АТФ в цАМФ
B. Активацию протеинкиназы А
Г. Проявление тирозинкиназной активности рецептора Д. Взаимодействие с кальмодулином
г) результатом этого действия является транслокация из цитозоля в плазматическую мембрану белка-переносчика:
A. ГЛЮТ-2 Б. ГЛЮТ-3
B. ГЛЮТ-5 Г. ГЛЮТ-4 Д. ГЛЮТ-1
д) этот белок-переносчик локализован в жировой ткани, а также в клетках:
A. Мозга
Б. Поджелудочной железы
B. Мышц Г. Печени
Д. Кишечника 4. Выполните «цепное» задание:
а) у здорового человека в покое через 1 час после еды, содержащей углеводы, в крови повышается концентрация:
A. Глюкозо-6-фосфата Б. Глюкозы
B. Сахарозы Г. Лактозы Д. Мальтозы
б) это вещество в клетках печени вступает в реакцию:
A. Фосфорилирования Б. Дегидрирования
B. Декарбоксилирования Г. Изомеризации
Д. Взаимодействия с ГЛЮТ-4
в) эту реакцию в печени катализирует фермент:
А. УДФ-глюкопирофосфорилаза Б. Глюкозилтрансфераза
В. Глюкокиназа
Г. Фосфоглюкомутаза
Д. Гликогенсинтаза
г) активность этого фермента в печени увеличивается под влиянием гормона:
A. Адреналина Б. Инсулина
B. Глюкагона Г. Кортизола Д. Тироксина
д) действие этого гормона на фермент заключается в:
A. Аллостерической активации
Б. Фосфорилировании и активировании
B. Индукции синтеза
Г. Активации путем отщепления белка-ингибитора Д. Дефосфорилировании
5. Выполните «цепное» задание:
а) у здорового человека через 4-5 часов в покое после еды увеличивается скорость:
A. Всасывания глюкозы в клетки кишечника
Б. Перемещение ГЛЮТ-4 в мембрану клеток печени
B. Транспорт глюкозы в клетки печени Г. Распад гликогена в печени
Д. Синтез гликогена в печени и мышцах
б) в ходе этого процесса в печени происходит реакция:
A. Фруктозо-1-фосфат - Фруктозо-6-фосфат Б. Гликоген - Глюкозо-1-фосфат
B. Глюкозо-6-фосфат - УДФ-глюкоза Г. Глюкоза - Глюкозо-6-фосфат
Д. Глюкозо-6-фосфат - Глюкозо-1-фосфат
в) эту реакцию катализирует фермент:
A. Гексокиназа
Б. Глюкозо-6-фосфатаза
B. Фосфоглюкомутаза
Г. Гликогенфосфорилаза Д. Олигосахаридтрансфераза
г) этот фермент активируется под влиянием гормона:
A. Инсулина
Б. Альдостерона
B. Глюкагона Г. Кортизола Д. Тироксина
д) механизм действия этого гормона включает (выберите все правильные ответы):
А. Взаимодействие с мембранным рецептором
Б. Внутриклеточный каскад реакций, усиливающий действие гормона
В. Снижение концентрации цАМФ в клетке
Г. Дефосфорилирование регуляторных ферментов
Д. Фосфорилирование регуляторных ферментов
6. Установите соответствие. Характеристика фермента:
A. Активен в фосфорилированной форме Б. Катализирует реакцию с участием АТФ
B. Активен в дефосфорилированной форме Г. Локализован в митохондриях
Д. Катализирует образование свободной глюкозы
Фермент:
1. Глюкокиназа
2. Гликогенсинтаза
3. Гликогенфосфорилаза
7. Выберите правильные ответы.
Распад гликогена в мышцах:
A. Поддерживает постоянную концентрацию глюкозы в крови между приемами пищи
Б. Происходит с использованием энергии АТФ
B. Стимулируется при интенсивной физической работе адреналином
и Са2+
Г. Ускоряется при умеренной физической работе в состоянии покоя
аллостерически с помощью АМФ Д. Нарушается при дефекте глюкозо-6-фосфатазы
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. 1-Г, 2-Б, 3-Д
2. а) Б, б) Д, в) А, г) Д
3. а) Б, б) А, в) Г, г) Г, д) В
4. а) Б, б) А, в) В, г) Б, д) В
5. а) Г, б) Б, в) Г, г) В, д) А, Б, Д
6. 1-Б, 2-В, 3-А
7. В, Г
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Основные углеводы пищи:
• моносахариды (глюкоза, фруктоза, галактоза)
• дисахариды (сахароза, лактоза, мальтоза)
• гомополисахариды (крахмал, гликоген, целлюлоза)
2. Ферменты переваривания углеводов:
• амилаза
• ферментативные комплексы (гликоамилазный, сахаразо-изомальтазный, β-гликозидазный)
3. ГЛЮТ (глюкозные транспортеры) - белки переносчики глюкозы
4. Инсулин-глюкагоновый индекс
5. Абсорбтивный период
6. Постабсорбтивный период
7. Глюкогеногенез - синтез гликогена
8. Гликогенолиз - мобилизация (распад) гликогена
9. Гликогеновые болезни:
• гликогенозы
• агликогенозы
10. Осмотическая диарея
11. Гипоглюкоземия
12. Гиперглюкоземия
13. Концентрация глюкозы в крови в норме: 80-100 мг/дл (3,3-5,5 ммоль/л)
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. В клинику поступил ребенок с диареей, наблюдающейся после кормления молоком. Для установления диагноза провели тест на толерантность к лактозе. Больному натощак дали 50 г лактозы, растворенной в воде. Через 30, 60 и 90 минут в крови определяли концентрацию глюкозы. Результаты показали, что концентрация глюкозы в крови не увеличивалась. Приведите возможные причины полученных результатов, аргументируйте их. Для этого:
а) напишите схему реакций переваривания лактозы в кишечнике, укажите фермент;
б) объясните, почему концентрация глюкозы в крови не увеличивается;
в) укажите, будет ли наблюдаться у данного пациента непереносимость кисломолочных продуктов. Ответ обоснуйте.
2. У годовалого ребенка с нормальным развитием и массой при переводе на смешанное питание появились стойкая диарея, рвота, боли в животе после приема пищи. Исключение из рациона молока не дало положительного результата. При обследовании обнаружили, что после нагрузки сахарозой уровень глюкозы в крови повышался незначительно. Какие дополнительные анализы необходимы для постановки диагноза? Для решения задачи предварительно составьте план ее решения с использованием схем и реакций.
3. У двух пациентов в биохимической лаборатории определяли концентрацию глюкозы в крови. Один пациент сдал кровь на анализ строго натощак, другой - спустя 1 час после приема углеводной пищи. У какого из пациентов получены результаты, которые можно использовать для постановки диагноза? Для ответа на вопрос:
а) укажите концентрацию глюкозы в крови в норме;
б) напишите схемы реакций, протекающие в ЖКТ при переваривании основных углеводов пищи;
в) приведите график изменения содержания глюкозы в крови через 30, 60
и 90 минут после приема углеводной пищи.
4. Сахарный диабет - заболевание, характеризующееся хронической гиперглюкоземией (повышением содержания глюкозы в крови до 250-300 мг/дл после приема углеводной пищи), являющейся следствием недостаточного синтеза или действия инсулина. Одним из подходов к снижению гиперглюкоземии является применение препарата «Глюкобай». Его активное вещество - акарбоза имеет строение тетрасахарида и является ингибитором активности α-гликозидаз - ферментов тонкого кишечника, участвующих в переваривании углеводов. Объясните, как изменится образование глюкозы в кишечнике и ее содержание в крови при лечении препаратом, содержащим акарбозу. Для этого:
а) приведите схему переваривания углеводов в кишечнике;
б) перечислите ферменты, которые ингибируются этим препаратом;
в) назовите тип ингибирования активности этих ферментов акарбозой.
5. У больной обнаружен наследственный дефект глюкозо-6-фосфатазы в печени. Как изменится метаболизм гликогена у этой пациентки? Будет ли происходить в данном случае: синтез гликогена в печени после еды, мобилизация гликогена и выход глюкозы в кровь в постабсорбтивном периоде?
Для ответа на вопросы:
а) напишите схему мобилизации гликогена, укажите ферменты, отметьте дефектный фермент;
б) укажите, чем отличается этот процесс в печени от процесса в мышцах.
6. Во время экзамена у студента содержание глюкозы в крови оказалось равным 7 ммоль/л.
Объясните причину наблюдаемого изменения содержания глюкозы в крови, если студент позавтракал за 4 часа до экзамена. Для ответа:
а) укажите концентрацию глюкозы в крови в норме;
б) назовите гормон, концентрация которого повышается в крови студента в данной ситуации;
в) напишите схему процесса, который активируется в печени этим гормоном и укажите регуляторный фермент;
г) опишите механизм действия гормона на регуляторный фермент и систему трансмембранной передачи гормонального сигнала.
7. Человек совершает срочную физическую работу (например, убегает от опасности) через 30 минут после обеда, состоящего преимущественно из углеводов. Объясните, почему в этой ситуации в скелетных мышцах останавливается синтез гликогена и стимулируется его распад? Для ответа на вопрос задачи:
а) напишите схему синтеза гликогена. Укажите реакции, связанные с затратой энергии при включении одной молекулы глюкозы в гранулу гликогена;
б) напишите схему мобилизации гликогена и укажите количество АТФ, которое может синтезироваться при дальнейшем окислении в мышцах глюкозо-1-фосфата до СО2 и Н2О;
в) укажите, содержание какого гормона повышается в крови в ситуации стресса и как этот гормон влияет на активность регуляторных ферментов синтеза и распада гликогена.
8. Алкалоид кофеин, содержащийся в кофе, вызывает гиперглюкоземию и оказывает возбуждающее действие, хотя не влияет на адреналиновые рецепторы. Известно, что кофеин угнетает действие фермента фосфодиэстеразы. Объясните, почему кофеин вызывает гиперглюкоземию? Для решения задачи предварительно составьте план ее решения. Ответ обоснуйте соответствующими схемами.
Модульная единица 2 КАТАБОЛИЗМ ГЛЮКОЗЫ. ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ПРЕВРАЩЕНИЯ ГЛЮКОЗЫ
Цели изучения Уметь:
1. Оценивать значение аэробного и анаэробного катаболизма глюкозы в разных физиологических состояниях организма.
2. Объяснять особенности катаболизма глюкозы в разных тканях, причины и последствия нарушения этого процесса.
3. Оценивать значение пентозофосфатного пути превращения глюкозы. Объяснять причины и последствия нарушений этого процесса для быстропролиферирующих тканей, эритроцитов, тканей с активно протекающими восстановительными реакциями.
Знать:
1. Основные этапы и последовательность реакций аэробного и анаэробного катаболизма глюкозы.
2. Энергетический эффект аэробного и анаэробного катаболизма глюкозы, способы синтеза АТФ, механизмы регуляции процесса.
3. Окислительный и неокислительный этапы пентозофосфатного пути превращения глюкозы.
ТЕМА 6.5. КАТАБОЛИЗМ ГЛЮКОЗЫ: АЭРОБНЫЙ И АНАЭРОБНЫЙ ГЛИКОЛИЗ. АЭРОБНЫЙ РАСПАД ГЛЮКОЗЫ ДО СО2 И Н2О
1. Гликолиз - специфический путь катаболизма глюкозы, в результате которого происходит расщепление глюкозы с образованием двух молекул пирувата - аэробный гликолиз (рис. 6.11, реакции 1-10,) или две молекулы лактата - анаэробный гликолиз (рис. 6.11, реакции 1-11).
Аэробный и анаэробный гликолиз начинается с реакции фосфорилирования глюкозы (рис. 6.11, реакция 1) и образования глюкозо-6-фосфата, который является своеобразной ловушкой для глюкозы, так как мембрана клетки непроницаема для фосфорилированной глюкозы (нет соответствующих транспортных белков). Все промежуточные соединения гликолиза также находятся в фосфорилированной форме; источником фосфатных групп в реакциях фосфорилирования являются АТФ и Н3РО4.
Все этапы гликолитического пути окисления глюкозы происходят в цитозоле. Большинство реакций гликолиза, за исключением трех (реакции 1, 3, 10), обратимы.
2. В аэробном и анаэробном гликолизе можно выделить два этапа.
А. Превращение глюкозы в две молекулы глицеральдегид-3-фосфата (рис. 6.11, реакции 1-5). Эта серия реакции протекает с потреблением АТФ.
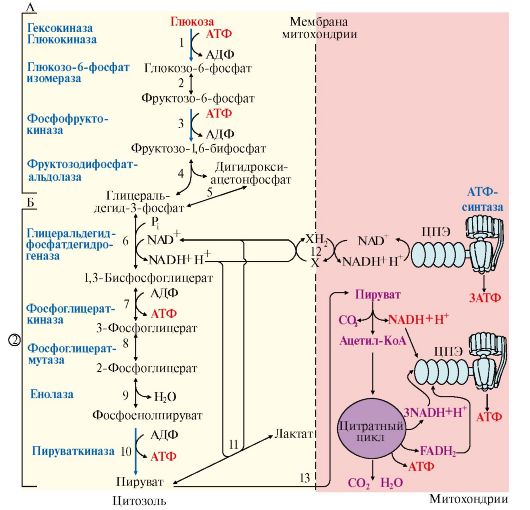 Рис. 6.11. Аэробный и анаэробный распад глюкозы:
Рис. 6.11. Аэробный и анаэробный распад глюкозы:
1-10 - реакции аэробного гликолиза; 1-11 - реакции анаэробного гликолиза; 12 - челночный механизм транспорта водорода в митохондрии (малат-аспартатный или глицерофосфатный) Х, ХН2 - переносчики водорода из цитозоля в митохондрии;(2) стехиометрический коэффициент. Этап А (реакции 1-5) - молекула глюкозы превращается в две молекулы триозы: глицеральдегид-3-фосфат и дигидроксиацетонфосфат, который изомеризуется в глицеральдегид-3-фосфат. В результате образуется две молекулы глицеральдегид-3-фосфата и дальнейший процесс удваивается. На этом этапе происходят две реакции фосфорилирования с затратой двух молекул АТФ (реакции 1 и 3). Этап Б (реакции 6-10) обеспечивает синтез АТФ. Реакция 6 - дегидрирование двух молекул глицеральдегид-3-фосфата, катализируемая NAD-зависимой дегидрогеназой. Регенерация NAD+ из образующейся NADH + H+ происходит в аэробном гликолизе c участием ЦПЭ и челночных механизмов транспорта водорода из цитозоля в митохондрии (реакция 12). В этой реакции синтезируется АТФ путем окислительного фосфорилирования АДФ. Реакции 7 и 10 - субстратное фосфорилирование АДФ; протекают как в аэробном, так и в анаэробном гликолизе. Реакция 11 - регенерация NАD в анаэробном гликолизе. Акцептором водорода является пируват, который превращается в лактат. Реакция 13 - перенос пирувата в митохондрии и окисление его до конечных продуктов в общем пути катаболизма
Б. Превращение глицеральдегидфосфата в пируват или лактат (рис. 6.11, реакции 6-10 и 6-11). Эти реакции связаны с образованием АТФ. На этом этапе происходит реакция дегидрирования глицеральдегид-3- фосфата (см. реакция 6) и образование NADH+H+.
3. Регенерация NAD+, необходимого для окисления новых молекул глицеральдегид-3-фосфата, происходит:
• при аэробном гликолизе посредством его окисления в ЦПЭ (реакция 12). При этом перенос водорода в митохондрии происходит с помощью специальных систем, называемых челночными, с помощью которых водород транспортируется через мембрану при участии пар субстратов, один из которых окисляется в цитозоле, а другой - в митохондриях, т.е. с обеих сторон митохондриальной мембраны находится специфическая дегидрогеназа. Известны две челночные системы: глицерофосфатная и малат-аспартатная (рис. 6.12, 6.13), которые отличаются друг от друга акцепторами водорода для ЦПЭ и, следовательно, количеством синтезированного АТФ. В глицерофосфатной системе водород передается на FAD-зависимую дегидрогеназу, поэтому Р/О = 2. Вторая система энергетически более эффективна, так как водород поступает в ЦПЭ через митохондриальный NAD+ и отношение Р/О составляет 3;
• при анаэробном гликолизе независимо от ЦПЭ. В этом случае окисление NADH осуществляется в результате восстановления пирувата в лактат (рис. 6.11, реакция 11).
4. Образование АТФ при аэробном гликолизе может идти двумя путями: путем субстратного фосфорилирования, когда для синтеза АТФ из АДФ и Н3РО4 используется энергия макроэргической связи субстрата (рис. 6.11, реакции 6, 10) и путем окислительного фосфорилирования за счет энергии переноса электронов и протонов по ЦПЭ (реакции 6, 12).
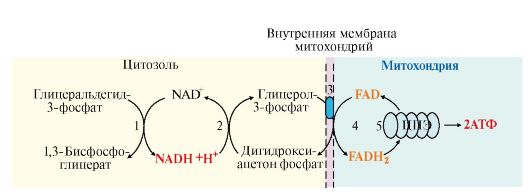 Рис. 6.12. Глицерофосфатная челночная систем:
Рис. 6.12. Глицерофосфатная челночная систем:
1 - глицеральдегид-3-фосфатдегидрогеназа; 2 - глицерол-3-фосфатдегидрогеназа (цитозольный фермент); 3 - транслоказа, обеспечивающая транспорт глицерол- 3-фосфата из цитозоля во внутреннюю мембрану митохондрии; 4 - глицерол-3- фосфатдегидрогеназа (митохондриальный фермент); 5 - окисление FADH2 в ЦПЭ
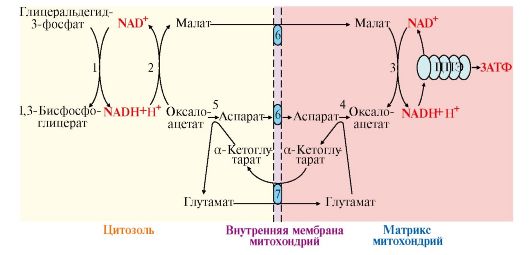 Рис. 6.13. Малат-аспартатная челночная система:
Рис. 6.13. Малат-аспартатная челночная система:
1 - глицеральдегид-3-фосфатдегидрогеназа; 2, 3 - окислительно-восстановительная реакция, протекающая в цитозоле и митохондриях в противоположных направлениях; 2 - малатдегидрогеназа (цитозольный фермент); 3 - малатдегидрогеназа (митохондриальный фермент); 4, 5 - реакция трансаминирования, протекающая в цитозоле и митохондриях в противоположных направлениях; 6, 7 - транслоказы, обеспечивающие транспорт малата, аспартата, глутамата и α-кетоглутарата через мембрану митохондрий
5. Анаэробный гликолиз, или анаэробный распад глюкозы, (эти термины - синонимы) включает в себя реакции специфического пути распада глюкозы до пирувата и восстановление пирувата в лактат (рис. 6.11, реакции 1-11). АТФ при анаэробном гликолизе образуется только путем субстратного фосфорилирования (рис. 6.11, реакции 7, 10).
6. Аэробный распад глюкозы до конечных продуктов (СО2 и Н2О) включает в себя реакции аэробного гликолиза (рис. 6.11, реакции 1-10) и последующее окисление пирувата в общем пути катаболизма (реакция 13). Таким образом, аэробный распад глюкозы - это процесс полного ее окисления до СО2 и Н2О, а аэробный гликолиз - часть аэробного распада глюкозы.
Тема 6.6. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ КАТАБОЛИЗМА ГЛЮКОЗЫ. РЕГУЛЯЦИЯ ПРОЦЕССА
Основное биологическое назначение катаболизма глюкозы заключается в использовании энергии, освобождающейся в этом процессе для синтеза АТФ.
1. Аэробный катаболизм глюкозы до СО2 и Н2О происходит во многих органах и тканях и служит основным, хотя и не единственным, источником энергии для жизнедеятельности. Некоторые ткани находятся в наибольшей
зависимости от катаболизма глюкозы как источника энергии. Например, клетки мозга расходуют до 100 г глюкозы в сутки, окисляя ее аэробным путем. Поэтому недостаточное снабжение мозга глюкозой или гипоксия проявляются симптомами, свидетельствующими о нарушении функций мозга (головокружения, судороги, потеря сознания). Во время продолжительной физической активности синтез АТФ в мышцах происходит в основном за счет аэробного распада глюкозы. Интенсивность этого процесса в мышцах ограничивается количеством кислорода, поступающего в митохондрии и активностью митохондриальных ферментов, обеспечивающих полное окисление глюкозы (активность этих ферментов достигает предела, например, во время бега хорошо тренированного стайера со скоростью 6 м/с). В эритроцитах возможен только анаэробный катаболизм глюкозы, так как клетки не имеют митохондрий.
Итак, соотношение доли аэробного и анаэробного катаболизма глюкозы в производстве энергии зависит от наличия митохондрий в клетках, их количеств, а также от доступности кислорода.
Баланс АТФ при аэробном гликолизе
Реакции, связанные с синтезом АТФ в аэробном гликолизе, происходят после распада глюкозы на две фосфотриозы, т.е. на втором этапе гликолиза. На этом этапе происходят две реакции субстратного фосфорилирования и синтезируется две молекулы АТФ (рис. 6.14, реакции 7 и 10). Кроме того, одна молекула глицеральдегид-3-фосфата дегидрируется (рис. 6.14, реакция 6), а NADН передает водород в митохондриальную ЦПЭ, где синтезируется три или две молекулы АТФ (в зависимости от челночного механизма, который работает в клетке) путем окислительного фосфорилирования. Следовательно, окисление до пирувата одной молекулы глицеральдегид- 3-фосфата сопряжено с синтезом пяти молекул АТФ (если участвует малатаспартатный челнок). Учитывая, что из глюкозы образуется две фосфотриозы, полученную величину нужно удвоить и затем вычесть две молекулы АТР, затраченные на первом этапе. Таким образом, суммарный эффект аэробного гликолиза составляет ((5 ? 2) - 2 = 8 АТФ.
Баланс АТФ при аэробном катаболизме глюкозы до СО2 и Н2О
Энергетическая эффективность аэробного катаболизма глюкозы до конечных продуктов определяется количеством АТФ, синтезируемого в аэробном гликолизе и окислении пирувата в общем пути катаболизма.
В результате аэробного гликолиза образуются две молекулы пирувата. Энергетическая эффективность окисления пирувата в ОПК составляет 15 моль АТФ, а двух молекул пирувата - соответственно 30 моль АТФ (см. модуль 5).
Таким образом, выход АТФ при окислении 1 моль глюкозы до СО2 и Н2О равна сумме: 8 моль АТФ (энергетический эффект аэробного гликолиза) + 30 моль АТФ (эффект окисления 2 моль пирувата в ОПК) и составляет 38 моль АТФ.
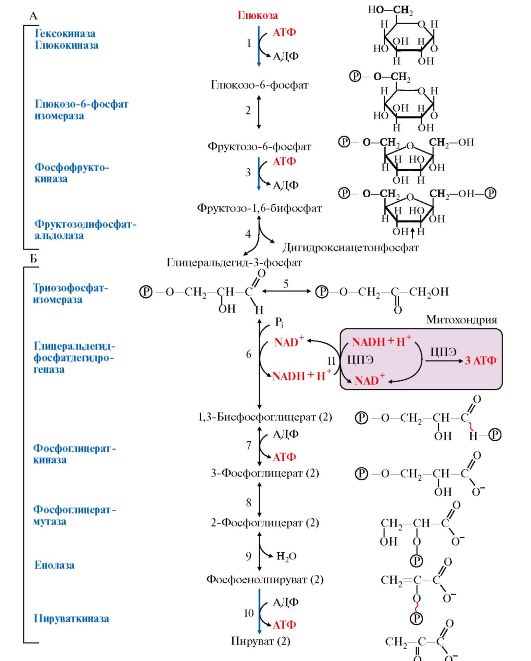 Рис. 6.14. Последовательность реакций в аэробном гликолизе:
Рис. 6.14. Последовательность реакций в аэробном гликолизе:
А - подготовительный этап (реакции 1-5), сопряженный с использованием АТФ (реакции 1, 3); Б - этап, сопряженный с синтезом АТФ (реакции 6-10); Х - малатаспартатная челночная система переноса водорода из цитозоля в митохондрии; (2) - стехиометрический коэффициент; (Р) - фосфатный остаток. ~ - макроэргическая связь с фосфатным остатком в 1,3-бисфосфоглицерате и фосфоенолпирувате; 11 - транспорт водорода в митохондрии на ЦПЭ (глицерофосфатный или малатаспертатный челнок)
В процессе аэробного распада глюкозы происходят шесть реакций дегидрирования. Одна из них протекает на стадии гликолиза и пять - в общем пути катаболизма. Субстратами для специфических дегидрогеназ являются: глицеральдегид-3-фосфат, пируват, изоцитрат, α-кетоглутарат, сукцинат, малат. Кроме того, в процессе аэробного распада глюкозы протекают три реакции, сопряженные с субстратным фосфорилированием АДФ (две реакции в гликолизе и одна в цитратном цикле).
2. Анаэробный распад глюкозы происходит в мышцах, в первые минуты мышечной работы, в эритроцитах (нет митохондрий), а также в разных органах в условиях ограниченного снабжения их кислородом, в том числе в клетках опухолей. Для метаболизма клеток опухолей характерно ускорение как аэробного, так и анаэробного гликолиза. Но преимущественный анаэробный гликолиз и ускорение синтеза лактата свидетельствуют о недостаточной обеспеченности быстроделящихся опухолевых клеток системой кровеносных сосудов. Баланс АТФ при анаэробном гликолизе
Анаэробный гликолиз по сравнению с аэробным менее эффективен. В этом процессе катаболизм 1 моль глюкозы без участия митохондриальной дыхательной цепи сопровождается синтезом 2 моль АТФ и 2 моль лактата. АТФ образуется за счет двух реакций субстратного фосфорилирования (рис. 6.11, реакции 7 и 10). Поскольку глюкоза распадается на две фосфотриозы, то с учетом стехиометрического коэффициента, равного двум, количество моль синтезированного АТФ равно 4. Учитывая 2 моль АТФ, использованные на первом этапе гликолиза, получаем конечный энергетический эффект процесса, равный 2 моль АТФ. Таким образом, 10 цитозольных ферментов, катализирующих превращение глюкозы в пируват вместе с лактатдегидрогеназой, катализирующей восстановление пирувата в лактат (рис. 6.11, реакция 11), обеспечивают в анаэробном гликолизе синтез 2 моль АТФ (на 1 моль глюкозы) без участия кислорода.
Лактат - конечный продукт анаэробного гликолиза транспортируется в другие ткани, например в печень, сердечную мышцу, где превращается в пируват, который затем может окисляться в ОПК до СО2 и Н2О с образованием АТФ.
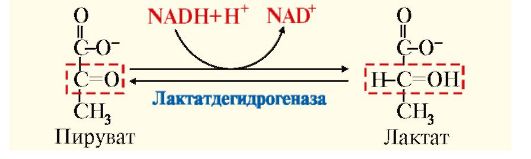 Рис. 6.15. Восстановление пирувата в лактат
Рис. 6.15. Восстановление пирувата в лактат
Окисление молочной кислоты в мышце сердца не только ведет к образованию энергии, но и способствует поддержанию постоянства рН крови. Концентрация лактата в крови зависит от интенсивности и длительности работы. В условиях покоя концентрация лактата равна 1 ммоль/л, при тяжелой работе она может превышать 15 ммоль/л, что приводит к понижению рН крови - лактоацидозу.
Лактоацитоз может возникать при ряде патологических состояний, когда нарушается снабжение тканей кислородом. В этих случаях (инфаркт миокарда, легочная эмболия, кровотечение и др.) энергетические потребности клеток удовлетворяются на счет анаэробного гликолиза, что приводит к повышению уровня лактата и падению рН ниже оптимального уровня, необходимого для активной работы ферментных систем. Результатом этого могут быть резкие нарушения в клеточном метаболизме. Уровень лактата в крови зависит от интенсивности его использования в двух процессах: 1) окисления до СО2 и Н2О и 2) в качестве субстрата для синтеза глюкозы (процесс рассматривается позже). Следовательно, недостаточная активность ферментов пируватдегидрогеназного комплекса, катализирующего превращение пирувата в ацетил-КоА, а также ферментов цитратного цикла и ферментов синтеза глюкозы из лактата может приводить к образованию избытка лактата и соответственно к уменьшению значения рН плазмы крови.
3. Анаболическое значение катаболизма глюкозы.
Процесс катаболизма глюкозы, кроме энергетического значения, имеет также и анаболическое значение. Метаболиты гликолиза используются для синтеза ряда соединений. Так, фруктозо-6-фосфат и глицеральдегид-3-фосфат участвуют в образовании рибозо-5-фосфата - структурного компонента нуклеотидов; 3-фосфоглицерат может включаться в синтез аминокислот, таких как серин, глицин, цистеин. В печени и жировой ткани ацетил-КоА, образующийся из пирувата, используется как субстрат при синтезе жирных кислот, холестерола, а дигидроксиацетонфосфат как субстрат для синтеза глицерол-3-фосфата, необходимого для синтеза триацилглицеролов (ТАГ).
В гликолитическом пути может протекать дополнительная реакция, катализируемая бисфосфоглицератмутазой, превращающая 1,3-бисфосфо- глицерат в 2,3-бисфосфоглицерат (2,3-БФГ), который может при участии 2,3-бисфосфоглицератфосфатазы возвращаться в гликолиз в виде 3-фосфоглицерата (рис. 6.16).
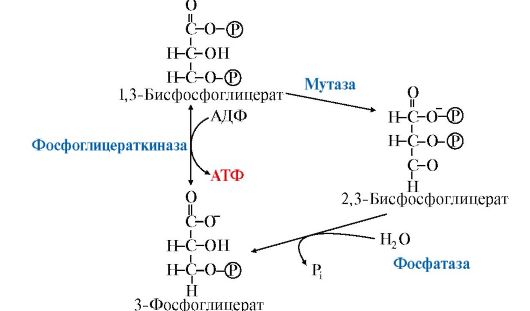 Рис. 6.16. Образование и катаболизм 2,3-бисфосфоглицерата
Рис. 6.16. Образование и катаболизм 2,3-бисфосфоглицерата
В большинстве тканей 2,3-БФГ образуется в небольших количествах. В эритроцитах его содержание значительно, так как он выполняет роль аллостерического регулятора функции гемоглобина. 2,3-БФГ, связываясь с гемоглобином, понижает его сродство к кислороду, способствует его диссоциации и переходу в ткани (см. модуль 1).
4. Регуляция катаболизма глюкозы в скелетных мышцах. Основное значение гликолиза - синтез АТФ, поэтому его скорость должна коррелировать с затратами энергии в организме.
Большинство реакций гликолиза обратимы за исключением трех, катализируемых гексокиназой, фосфофруктокиназой и пируваткиназой. Регуляторные факторы, изменяющие скорость гликолиза, а значит, и образование АТФ, направлены на необратимые реакции. Показателем потребления АТФ является накопление АДФ и АМФ - продуктов распада АТФ.
Даже небольшой расход АТФ ведет к заметному увеличению АДФ и АМФ. Отношение уровня АТФ к АДФ и АМФ характеризует энергетический статус клетки, а его составляющие служат аллостерическими регуляторами скорости как общего пути катаболизма, так и гликолиза (рис. 6.17).
Существенное значение для регуляции гликолиза имеет изменение активности фосфофруктокиназы, поскольку этот фермент катализирует наиболее медленную реакцию процесса. Фосфофруктокиназа активируется АМФ, но ингибируется АТФ. АМФ, связываясь с аллостерическим центром фосфофруктокиназы, увеличивает сродство фермента к фруктозо-6-фосфату и повышает скорость его фосфорилирования.
Повышение уровня АТФ относительно АДФ снижает скорость этой реакции, поскольку АТФ в этих условиях действует как ингибитор: связывается с аллостерическим центром фермента, вызывает конформационные изменения и уменьшает его сродство к субстрату - фруктозо-6-фосфату.
Снижение активности фосфофруктокиназы при высоком уровне АТФ ведет к накоплению как фруктозо-6-фосфата, так и глюкозо-6-фосфата, а последний ингибирует гексокиназу. Гексокиназа во многих тканях (за исключением печени и β-клеток поджелудочной железы) ингибируется глюкозо-6-фосфатом.
При высоком уровне АТФ снижается скорость цикла лимонной кислоты и дыхательной цепи. В этих условиях процесс гликолиза также замедляется. Следует напомнить, что регуляция ферментов ОПК и дыхательной цепи связана с изменением концентрации таких ключевых продуктов, как NADH, АТФ и некоторых метаболитов. Так, увеличение концентрации NADH, в том случае, если снижается скорость его окисления в дыхательной цепи, ингибирует некоторые аллостерические ферменты цитратного цикла (см. модуль 5).
5. Физиологическая роль гликолиза в печени и жировой ткани несколько иная, чем в других тканях. В печени и жировой ткани гликолиз в период пищеварения функционирует в основном как источник субстратов для синтеза жиров. Регуляция гликолиза в печени имеет свои особенности и будет рассмотрена позже.
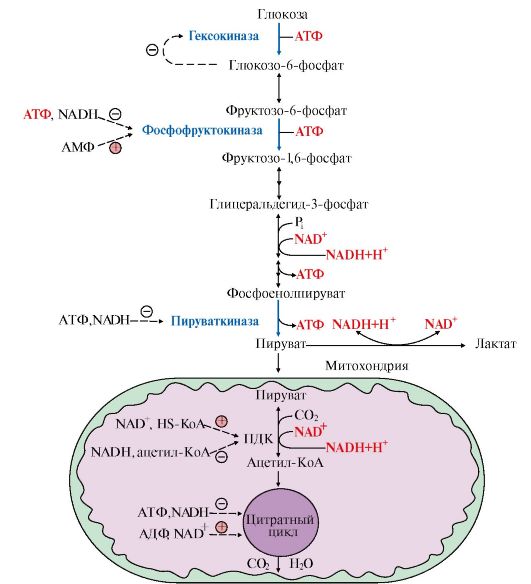 Рис. 6.17. Регуляция катаболизма глюкозы в скелетных мышцах
Рис. 6.17. Регуляция катаболизма глюкозы в скелетных мышцах
ТЕМА 6.7. ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ПРЕВРАЩЕНИЯ
ГЛЮКОЗЫ
1. Пентозофосфатный путь является альтернативным путем окисления глюкозы. К синтезу АТФ этот путь не приводит. Этот процесс поставляет клеткам кофермент NADPH (использующийся как донор водорода в реакциях восстановления и гидроксилирования) и обеспечивает клетки рибозо-5- фосфатом (который участвует в синтезе нуклеотидов и нуклеиновых кислот). Все ферменты пентозофосфатного пути локализованы в цитозоле. В пентозофосфатном пути превращения глюкозы можно выделить окислительный и неокислительный этапы образования пентоз.
• Окислительный этап поставляет клеткам два основных продукта
NADPH+Н+ и пентозы. Образования пентоз включает две реакции дегидрирования. Коферментом дегидрогеназ является NADP+, который восстанавливается до NADPH+H+. Пентозы образуются в результате реакции окислительного декарбоксилирования (рис. 6.18, А).
• Неокислительный этап не связан с образованием NADPH, он служит для синтеза пентоз. Этот этап включает обратимые реакции переноса двух и трех углеродных фрагментов с одной молекулы на другую. В этих превращениях принимают участие ферменты пентозофосфатизомеразы, транскетолаза и трансальдолаза. Транскетолаза в качестве кофермента использует тиаминдифосфат (ТДФ) - дифосфорный эфир витамина В1. Неокислительный этап образования пентоз обратим, следовательно, он может служить для образования гексоз из пентоз. С помощью этого пути избыток пентоз, превышающий потребности клетки, может быть возвращен в фонд гексоз.
Пентозофосфатный путь превращения глюкозы, как окислительный этап, так и неокислительный, может функционировать в печени, жировой ткани, молочной железе, коре надпочечников, эритроцитах, т.е. в органах, где активно протекают реакции гидроксилирования и восстановления, например при синтезе жирных кислот, холестерола, обезвреживания ксенобиотиков в печени и активных форм кислорода в эритроцитах и других тканях.
2. Пентозофосфатный цикл. Окислительный этап синтеза пентоз и этап возвращения пентоз в гексозы (неокислительный этап в обратном направлении) вместе составляют циклический процесс (пентозофосфатный цикл) - за один оборот цикла полностью распадается одна молекула глюкозы. Пентозофосфатный цикл функционирует в основном только в жировой ткани и печени (рис. 6.18, В). Суммарное уравнение пентозофосфатного цикла
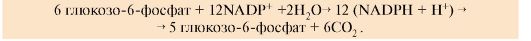 3. Промежуточные
продукты пентозофосфатного пути превращения глюкозы (фруктозо-6-фосфат,
глицеральдегид-3-фосфат) могут включаться в пути аэробного и
анаэробного окисления и служить источником энергии для синтеза АТР.
3. Промежуточные
продукты пентозофосфатного пути превращения глюкозы (фруктозо-6-фосфат,
глицеральдегид-3-фосфат) могут включаться в пути аэробного и
анаэробного окисления и служить источником энергии для синтеза АТР.
У растений реакции пентозофосфатного пути составляют часть процесса образования гексоз из СО2 при фотосинтезе.
4. Пентозофосфатный путь превращения глюкозы в эритроцитах. В эритроцитах NADPН + Н+ используется для защиты этих клеток от активных форм кислорода. В эритроцитах присутствует антиоксидант - тиолсодержащий трипептид - глутатион (Г), восстановленная форма которого содержит SH-группы, участвующие в превращении пероксида водорода в молекулу воды. В этой реакции восстановленная форма глутатиона (Г-SH) переходит в окисленное состояние (Г-S-S-Г. Реакция SH-групп глутатиона
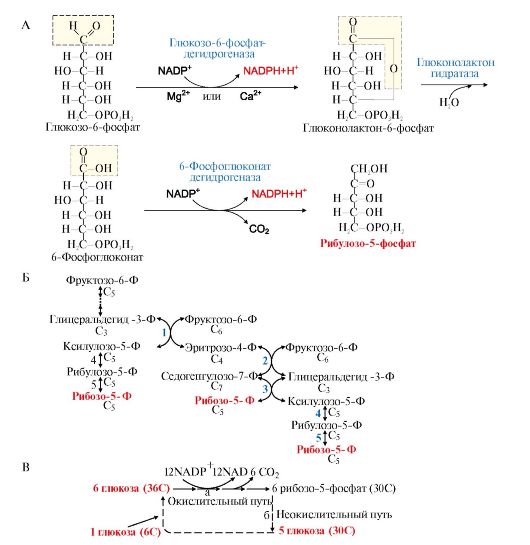 Рис. 6.18. Пентозофосфатный путь превращения глюкозы: А - окислительный этап пентозофосфатного пути.
Рис. 6.18. Пентозофосфатный путь превращения глюкозы: А - окислительный этап пентозофосфатного пути.
Этап включает две реакции дегидрирования. Во второй из этих реакций одновременно происходит декарбоксилирование, углеродная часть укорачивается, образуя пентозы. Коферментом дегидрогеназ является NADP+, который восстанавливается до NADPН + Н+;
Б - неокислительный этап пентозофосфатного пути:
Ф - остаток фосфорной кислоты, С3-С6 - число углеродных атомов. Ферменты: 1 - транскетолаза, кофермент ТДФ; 2 - трансальдолаза; 3 - транскетолаза, кофермент ТДФ; 4, 5 - Пентозофосфатизомеразы; В - Пентозофосфатный цикл:
а - окислительный этап; б - неокслительный этап в обратном направлении
с H2O2 предохраняет цистеиновые остатки в протомерах гемоглобина от окисления активными формами кислорода, а значит, обеспечивает сохранение его конформации и функции.
Для регенерации окисленного глутатиона в восстановленную форму используется в качестве донора водорода NADPH + H+, который образуется в реакциях окислительного пентозофосфатного этапа превращения глюкозы, одна из которых катализируется глюкозо-6-фосфатдегидрогеназой (рис. 6.19).
 Рис. 6.19. Восстановление глутатиона с участием NADPH+H+:
Рис. 6.19. Восстановление глутатиона с участием NADPH+H+:
А - Строение глутатиона:
Г-SH - восстановленная форма; Г-S-S-Г - окисленная форма;
Б - Участие глутатиона в обезвреживании пероксида водорода и его регенерация:
1 - взаимодействие глутатиона с Н2О2 с образованием воды и окисленной формы глутатиона; 2 - регенерация глутатиона с использованием в качестве донора водорода NADPH + H+, образуемой на окислительном этапе пентозофосфатного пути превращения глюкозы
Дефект глюкозо-6-фосфатдегидрогеназы в эритроцитах приводит к дефициту NADPH + H+, снижению концентрации восстановленной формы глутатиона и окислению SH-групп молекул гемоглобина с образованием дисульфидных связей. Этот процесс сопровождается агрегацией протомеров гемоглобина и формированием телец Хайнца. Эритроциты теряют пластичность, необходимую для прохождения через капилляры, нарушается целостность мембраны, что может привести к гемолизу.
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ, ИЗУЧАЕМЫЕ В МОДУЛЬНОЙ ЕДИНИЦЕ:
1. Концентрация лактата в крови в состоянии покоя - 1 ммоль/л
2. Концентрация глюкозы в крови в норме 80-100 мг/дл (3.3 -5.5 ммоль/л)
3. Энергетический эффект аэробного распада 1 моль глюкозы до СО2
и Н2О - 38 (36) моль АТФ
4. Энергетический эффект анаэробного распада 1 моль глюкозы - 2 моль АТФ
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Напишите реакцию дегидрирования, протекающую в специфическом пути катаболизма глюкозы. Укажите сопряжение этой реакции с ЦПЭ, написав схему ЦПЭ.
2. Впишите в табл. 6.10 количество использованных (-АТФ) или синтезированных (+АТФ) молекул АТФ на отдельных этапах аэробного катаболизма глюкозы. Подсчитайте суммарный энергетический эффект окисления одной молекулы глюкозы до СО2 и Н2О. Укажите способ фосфорилирования АДФ.
Таблица 6.10. Синтез и использование АТФ в аэробном распаде глюкозы
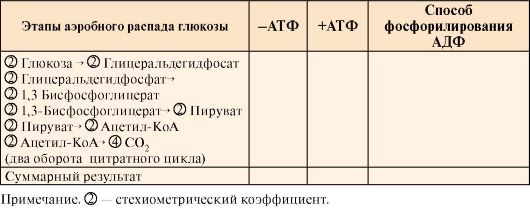 3. Впишите в табл. 6.11 регуляторные ферменты аэробного распада глюкозы до СО2 и Н2О и аллостерические регуляторы активности этих ферментов.
3. Впишите в табл. 6.11 регуляторные ферменты аэробного распада глюкозы до СО2 и Н2О и аллостерические регуляторы активности этих ферментов.
Таблица 6.11. Регуляция аэробного распада глюкозы до СО2 и Н2О
 4. Ознакомьтесь с табл. 6.12.
4. Ознакомьтесь с табл. 6.12.
Таблица 6.12. Энергетические показатели организма при различных физиологических состояниях
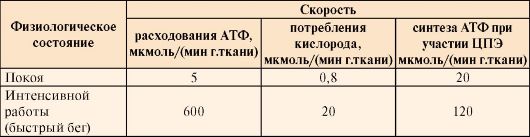 Проанализируйте
данные таблицы и объясните, почему при переходе из состояния покоя в
состояние интенсивной физической работы изменяется скорость расходования
АТФ, потребления кислорода, синтеза АТФ. Укажите, с помощью каких
регуляторных механизмов изменяется скорость синтеза АТФ.
Проанализируйте
данные таблицы и объясните, почему при переходе из состояния покоя в
состояние интенсивной физической работы изменяется скорость расходования
АТФ, потребления кислорода, синтеза АТФ. Укажите, с помощью каких
регуляторных механизмов изменяется скорость синтеза АТФ.
5. Используя информацию, приведенную на рис. 6.18 и 6.19, ответьте на тестовые вопросы.
1. Выберите правильные ответы.
Окислительный этап синтеза пентоз включает реакции:
A. Дегидрирования и декарбоксилирования Б. Превращения пентоз в гексозы
B. Образования доноров водорода для реакций восстановления и гидроксилирования
Г. Сопряженные с ЦПЭ
Д. С участием ферментов транскетолаз
2. Установите соответствие.
A. NADH + H+ Б. NADPH + H+
B. FADH2
Г. Восстановленная форма глутатиона (Г-SH) Д. Окисленная форма глутатиона (Г-S-S-Г)
1. Участвует в реакции обезвреживания ксенобиотиков в печени
2. Окисляется NADH-дегидрогеназой в ЦПЭ
3. Образуется в реакциях защиты гемоглобина от окисления активными формами кислорода
3. Выберите правильные ответы. Пентозофосфатный цикл включает реакции:
A. Совместного протекания окислительного пути синтеза пентоз и пути возврата пентоз в гексозы
Б. Протекающие с участием витамина В1
B. Протекающие с участием витамина РР Г. Необратимые
Д. Образования NADPH + H+.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильные ответы. Катаболизм глюкозы:
A. Может протекать как в аэробных, так и в анаэробных условиях Б. Локализован только в митохондриях клеток
B. Промежуточные продукты используются в анаболических процессах Г. Обеспечивает (максимально) синтез 38 моль АТФ при катаболизме
одной молекулы глюкозы Д. Регулируется аллостерически в зависимости от энергетических потребностей клетки
2. Выберите правильные ответы.
Аэробный катаболизм глюкозы до СО2 и Н2О:
A. Включает общий путь катаболизма
Б. Обеспечивает синтез 6 моль АТФ путем субстратного фосфорилирования
B. Сопряжен с ЦПЭ
Г. Угнетается при гиповитаминозах РР, В2, В1 Д. Происходит только в цитозоле клетки
3. Выберите правильные ответы.
Специфический путь аэробного катаболизма глюкозы до СО2 и Н2О включает:
A. Две необратимые реакции
Б. Три реакции, требующие затраты АТФ
B. Одну окислительно-восстановительную реакцию Г. Две реакции субстратного фосфорилирования Д. Одну реакцию, сопряженную с ЦПЭ
4. Установите соответствие.
Этапы катаболизма глюкозы:
A. Цитрат - α-Кетоглутарат
Б. Глюкоза - Фруктозо-1,6-бисфосфат
B. Фосфоенолпируват - Лактат
Г. Глицеральдегид-3-фосфат - Пируват Д. Глюкозо-6-фосфат - 3-фосфоглицерат Реакции, протекающие на данном этапе:
1. Восстановление с участием водорода NADH + H+
2. Две реакции субстратного фосфорилирования
3. Окисление и декарбоксилирование
5. Установите соответствие.
Процессы:
A. Окисление глюкозы в анаэробном гликолизе Б. Окисление глюкозы в аэробном гликолизе
B. Окисление пирувата в общем пути катаболизма до СО2 и Н2О Г. Аэробный распад глюкозы до СО2 и Н2О
Д. Окислительное декарбоксилирование пирувата
Энергетический эффект процесса (в расчете на окисление 1 моль исходного субстрата):
1. 15 моль АТФ
2. 8 моль АТФ
3. 3 моль АТФ
6. Выполните «цепное» задание:
а) в ходе гликолиза в эритроцитах протекает реакция:
A. Глюкозо-6-фосфат - Глюкоза Б. Пируват - Фосфоенопируват
B. Глюкозо-6-фосфат - Глюкозо-1-фосфат
Г. Глицеральдегид-3-фосфат - 1,3-бисфосфоглицерат Д. Оксалоацетат - Малат
б) эту реакцию катализирует фермент:
A. Пируваткиназа
Б. Глицеральдегид-3-фосфатдегидрогеназа
B. Енолаза
Г. Триозофосфатизомераза Д. Фосфоглицераткиназа
в) одним из продуктов реакции, катализируемой этим ферментом является:
A. FAD ? Н2 Б. Пируват
B. NADH + H+
Г. Лактат
Д. Фосфоенолпируват
г) это вещество далее участвует в реакции:
A. Восстановления пирувата в цитозоле Б. Окисления в ЦПЭ
B. Окисления пирувата в митохондриях Г. Превращения фумарата в малат. Д. Субстратного фосфорилирования АДФ
д) эту реакцию катализирует фермент:
A. NADH-дегидрогеназа Б. Малатдегидрогеназа
B. Пируватдегидрогеназа Г. Лактатдегидрогеназа Д. Глицеролдегидрогеназа
е) этот фермент (выберите все правильные ответы):
A. Обеспечивает регенерацию цитозольного NAD+ Б. Катализирует необратимую реакцию
B. Имеет органоспецифические изоформы Г. Катализирует регуляторную реакцию Д. Используется в энзимодиагностике
7. Выберите правильные ответы.
Ингибирование ферментов ЦПЭ может привести к лактоацидозу, поскольку в этой ситуации:
A. Увеличивается соотношение NADH-NAD+ Б. Уменьшается активность пируватдегидрогеназного комплекса
B. Лактатдегидрогеназа катализирует реакцию восстановления Г. Повышается скорость реакций цитратного цикла Д. Уменьшается рН крови
8. Выберите правильный ответ. Скорость анаэробного распада глюкозы в скелетных мышцах зависит от:
A. Активности малат-аспартатного челнока Б. Соотношения АТФ-АДФ в клетке
B. Интенсивности транспорта СО2 в митохондрии клетки Г. Соотношения NADPH-NADP+ Д. Участия витамина В6
9. Выберите правильные ответы.
Метаболиты пентозофосфатного пути превращения глюкозы могут быть использованы для синтеза:
A. NAD+
Б. Пиридоксальфосфата
B. FАD
Г. Тиаминдифосфата
Д. АТФ
10. Выполните «цепное» задание:
а) к классу трансфераз относится фермент:
A. Енолаза
Б. Лактатдегидрогеназа
B. Фруктозо-1,6 -дифосфатальдолаза Г. Протеинкиназа А
Д. Аденилатциклаза
б) этот фермент активируется при взаимодействии с:
A. Са2+
Б. Диацилглицеролом
B. цАМФ
Г. α-Протомером G-белка
Д. АДФ
в) выбранный активатор образуется в результате реакции, субстратом для которой является:
A. АМФ Б. АТФ
B. ГТФ Г. ГДФ
Д. ц-ГМФ
г) это вещество может образоваться в результате реакции:
A. Глюкоза - Глюкозо-6-фосфат
Б. Глюкозо-6-фосфат - Глюкозо-1-фосфат
B. 3-Фосфоглицерат - 2-Фосфоглицерат Г. Фосфоенолпируват - Пируват
Д. 1.3-Бисфосфоглицерат - 2,3-Бисфосфоглицерат
д) выбранная реакция является одним из этапов:
A. Распада гликогена Б. Синтеза гликогена
B. Цикла трикарбоновых кислот Г. Катаболизма глюкозы
Д. Пентозофосфатного пути превращения глюкозы
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. А, В, Г, Д
2. А, Б, В, Г
3. В, Г, Д
4. 1-В, 2-Г, 3-А
5. 1-В, 2-Б, 3-Д
6. а) Г, б) Б, в) В, г) А, д) Г, е) А, В, Д
7. А, Б;,В, Д
8. Б
9. А, В, Д
10. а) Г, б) В, в) Б, г) Г, д) Г
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Аэробный гликолиз - специфический путь катаболизма глюкозы
2. Анаэробный гликолиз - катаболизм глюкозы без участия кислорода
3. Аэробный распад глюкозы до СО2 и Н2О
4. Регенерация NAD+
5. Челночные системы транспорта водорода в аэробном гликолизе:
• малат-аспартатный челнок;
• глицерофосфатный челнок;
6. Гипоксия - снижение снабжения тканей кислородом
7. Энергетический статус клетки - отношение АТФ/АДФ
8. Лактоацидоз - снижение РН крови при накоплении лактата
9. Анаболические функции катаболизма глюкозы
10. Пентозофосфатный путь превращения глюкозы. Этапы:
• окислительный этап синтеза пентоз;
• неокислительный этап синтеза пентоз
11. Пентозофосфатный цикл
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. Формой депонирования глюкозы является гликоген, который синтезируется в абсорбтивном периоде с затратой энергии. Учитывая, что основным источником АТФ для синтеза гликогена является аэробный распад глюкозы, определите: во что обходится организму хранение глюкозы в виде гликогена.
Рассчитайте: сколько моль глюкозы необходимо окислить, чтобы обеспечить энергией синтез 35 г гликогена (35 г гликогена соответствует примерно 200 моль глюкозных остатков). Энергию УТФ считать эквивалентной АТФ. Расчет обоснуйте. Для этого:
а) напишите схему синтеза гликогена;
б) укажите количество АТФ, необходимое для присоединения одного мономера к молекуле гликогена. Рассчитайте количество АТФ, используемое для синтеза цепи из 200 мономерных остатков;
в) укажите энергетический эффект аэробного распада 1 моль глюкозы до
СО2 и Н2О;
г) укажите, каким способом идет синтез АТФ в этом процессе, напишите схему одной из реакций, сопряженную с синтезом ЦПЭ, и схему ЦПЭ;
д) сопоставьте количество АТФ, затраченное при синтезе гликогена, с количеством АТФ, образовавшимся при окислении глюкозы, и ответьте на вопрос задачи.
2. Хрусталик глаза является светопреломляющей средой глаза, и митохондрии в нем отсутствуют. В качестве источника энергии в хрусталике используется глюкоза. Какой путь катаболизма глюкозы обеспечивает энергией АТФ хрусталик глаза? Для ответа на вопрос:
а) напишите схему метаболического пути, обеспечивающего хрусталик глаза энергией. Укажите ферменты, коферменты реакций;
б) на схеме отметьте реакции, сопряженные с использованием и синтезом АТФ, рассчитайте максимальный выход АТФ в ходе этого процесса;
в) назовите способ синтеза АТФ в этом процессе;
г) перечислите ткани и клетки, в которых синтез АТФ происходит так же, как в хрусталике, укажите причину только такого способа фосфорилирования АДФ в этих клетках;
д) напишите, используя формулы, реакцию дегидрирования, протекающую в этом процессе, и реакцию образования конечного продукта;
е) укажите, каким дальнейшим превращениям может подвергаться конечный продукт этого процесса и последствия, возникающие при его накоплении.
3. Превращение пируватавлактат-обратимая реакция, которая катализируется лактатдегидрогеназой (ЛДГ), являющейся олигомером. Лактатдегидрогеназа представляет собой тетрамер, состоящий из М- и Н-субъединиц, которые, комбинируясь между собой, образуют пять различных тетрамеров (М4, М3Н1, М2Н2, М1Н3, Н4). Эти изоферменты отличаются друг от друга первичной структурой и обладают различными физико-химическими свойствами, а следовательно, разным сродством к субстрату. Кроме того, они имеют различную органную локализацию. Для мышцы сердца характерен изомер Н4, для скелетных мышц - М4. В мышце сердца ЛДГ (Н4) преимущественно катализирует реакцию превращения лактата в пируват.
Объясните роль этого изофермента в метаболизме сердечной мышцы. Для ответа на вопрос:
а) напишите реакцию, катализируемую данным ферментом в мышце
сердца;
б) напишите схему процесса, обеспечивающего включение продукта этой реакции в дальнейший путь окисления до СО2 и Н2О в мышце сердца и рассчитайте энергетический эффект процесса;
в) укажите, какие органы и клетки поставляют продукт реакции, катализируемой ЛДГ, в кровь:
• в состоянии покоя;
• в начальный период интенсивной работы.
4. В опыте к гомогенату мышц добавили глюкозу. Сколько молей АТФ может синтезироваться за счет энергии окисления 1 моль глюкозы в специфическом пути катаболизма, если в опыте использовали гомогенат ткани с нативными митохондриями, но в присутствии барбитуратов? Для ответа на вопрос напишите:
а) схему метаболического пути, в котором синтезируется АТФ в этих условиях;
б) схему процесса, который нарушают барбитураты в выбранном метаболическом пути, и укажите механизм их действия.
5. Катаболизм глюкозы с образованием пирувата может происходить как в аэробных, так и в анаэробных условиях. Сколько моль АТФ будет синтезироваться при распаде глюкозы до двух молекул пирувата в аэробных и анаэробных условиях? Для ответа на вопрос:
а) представьте схему гликолиза и отметьте реакции, сопряженные с использованием и синтезом АТФ;
б) напишите, используя формулы, окислительную реакцию гликолиза и опишите пути использования NADH в аэробных и анаэробных условиях.
6. Спринтер и стайер соревнуются на двух дистанциях - 100 м и 10 км. Спринтер завершает стометровку, стайер бежит десятый километр. Укажите различия в энергетическом обеспечении работы мышц у этих бегунов. Для решения задачи:
а) приведите схему катаболизма глюкозы, который является источником энергии для работы мышц у стайера;
б) укажите энергетический эффект специфического и общего пути катаболизма, способы синтеза АТФ;
в) выпишите субстраты, вступающие в реакции дегидрирования, укажите путь водорода от одного из субстратов к кислороду в ЦПЭ;
г) укажите различия в ходе процесса, в составе конечных продуктов и энергетическом эффекте специфического пути катаболизма глюкозы у спринтера и стайера.
7. У пациентов с заболеваниями легких, при которых развивается общая гипоксия тканей (снижение снабжения кислородом), в гликолитическом пути в эритроцитах может протекать дополнительная реакция, катализируемая 1,3-бисфосфоглицератмутазой в обход стадии, катализируемой 1,3-бисфосфоглицераткиназой. Объясните, почему при этом поступление кислорода в ткани возрастает, а энергетический эффект гликолиза снижается. Для ответа:
а) напишите реакцию, катализируемую 1,3-бисфосфоглицератмутазой, назовите субстрат и продукт. Укажите, способен ли продукт реакции возвращаться в гликолиз? Ответ обоснуйте, написав реакцию;
б) подсчитайте энергетический эффект гликолиза в эритроцитах с участием бисфосфоглицератмутазы и без нее;
в) укажите, какую роль выполняет продукт реакции, катализируемой бисфосфоглицератмутазой.
8. Во время обследования у пациента выявлены анемия и наличие в эритроцитах телец Хайнца - результат агрегации протомеров гемоглобина вследствие окисления SH-групп цистеиновых остатков гемоглобина активными формами кислорода и образования дисульфидных связей. Какие нарушения в метаболизме эритроцитов могут быть причиной данной клинической ситуации. Для решения задачи:
а) укажите, с помощью каких реакций цистеиновые остатки гемоглобина поддерживаются в восстановленном состоянии;
б) назовите кофермент, который участвует в этом процессе;
в) напишите схему процесса, в котором образуется восстановленная форма этого кофермента;
г) укажите дефект работы какого фермента может привести к дефициту необходимого кофермента и быть причиной описанной клинической ситуации.
Модульная единица 3 ГЛЮКОНЕОГЕНЕЗ И ЕГО РЕГУЛЯЦИЯ
Цели изучения Уметь:
1. Интерпретировать связь переключения процессов синтеза и распада глюкозы с ритмом питания и физической нагрузкой.
2. Пояснять причины и последствия лактоацидоза.
3. Объяснять причину гипоглюкоземии при остром алкогольном отравлении.
4. Объяснять причины гиперглюкоземии и гипоглюкоземии. Знать:
1. Основные этапы (схему и реакции) глюконеогенеза.
2. Пути включения в глюконеогенез лактата, аминокислот и глицерола в зависимости от физиологического состояния организма.
3. Регуляцию гликолиза и глюконеогенеза в печени.
ТЕМА 6.8. СИНТЕЗ ГЛЮКОЗЫ (ГЛЮКОНЕОГЕНЕЗ)
1. Глюконеогенез - это процесс синтеза глюкозы из веществ неуглеводной природы. Субстратами глюконеогенеза являются пируват, лактат, глицерол, аминокислоты. Важнейшей функцией глюконеогенеза является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Постоянное поступление глюкозы в качестве источника энергии особенно необходимо для нервной ткани и эритроцитов.
Процесс протекает главным образом в печени и менее интенсивно - в корковом веществе почек, а также в слизистой оболочке кишечника. Включение различных субстратов в глюконеогенез зависит от физиологического состояния организма:
- лактат является продуктом анаэробного гликолиза в эритроцитах, работающих мышцах и других тканях с низким содержанием О2;
- глицерол высвобождается при гидролизе жиров в жировой ткани в постабсорбтивный период или при физической нагрузке;
- аминокислоты образуются в результате распада белков мышц и соединительной ткани и включаются в глюконеогенез при длительном голодании или продолжительной мышечной нагрузке.
2. Большинство реакций гликолиза и глюконеогенеза являются обратимыми и катализируются одними и теми же ферментами (рис. 6.20). Четыре реакции глюконеогенеза необратимы.
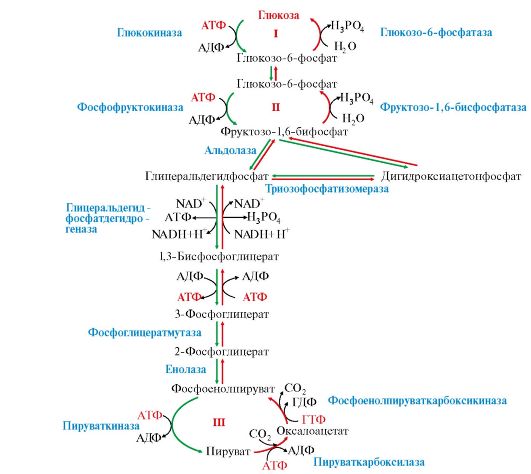 Рис. 6.20. Схема гликолиза и глюконеогенеза.
Рис. 6.20. Схема гликолиза и глюконеогенеза.
Представлена схема метаболических путей: гликолиза (слева) и глюконеогенеза (справа). Ферменты указаны синим цветом. - субстратные циклы, образованные в ходе необратимых реакций гликолиза и глюконеогенеза
Катализатором превращения пирувата в оксалоацетат является биотинсодержащий митохондриальный фермент - пируваткарбоксилаза (рис. 6.21). В митохондриях под действием ферментов малатдегидрогеназы и аминотрансферазы образуется малат и аспартат из оксалоацетата, которые пассивным антипортом удаляются из митохондрии. В цитозоле малат и аспартат в результате соответствующих реакций превращаются в оксалоацетат, который декарбоксилируется и фосфорилируется под действием фосфоенолпируваткарбоксикиназы (ФЕПКК). Все остальные реакции глюконеогенеза протекают в цитозоле. В ходе этого процесса на синтез 1 моль глюкозы из 2 моль пирувата расходуется 4 моль АТФ и 2 моль ГТФ.
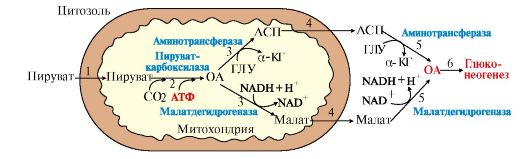 Рис.6.21. Превращение пирувата в оксалоацетат:
Рис.6.21. Превращение пирувата в оксалоацетат:
1 - транспорт пирувата из цитозоля в митохондрию; 2 - превращение пирувата в оксалоацетат (ОА); 3 - превращение оксалоацетата в малат или аспартат (АСП); 4 - транспорт аспартата и малата из митохондрии в цитозоль; 5 - превращение аспартата и малата в оксалоацетат в цитоплазме; 6 - поступление оксалоацетата в глюконеогенез
 3. Использование
лактата в качестве субстрата в глюконеогенезе связано с транспортом его
в печень и превращением в пируват (рис. 6.22). В период мышечного
сокращения в мышце пируват превращается в лактат, так как направление
лактатдегидрогеназной реакции в работающих мышцах и печени обусловлено
преобладанием восстановленной формы - NADH над окисленной формой NAD+
из-за недостатка кислорода. Лактат из мышцы транспортируется в печень,
где он превращается в пируват (благодаря хорошему снабжению кислородом О2
и высокому содержанию NAD+, а затем в глюкозу (в процессе
глюконеогенеза), которая поступит с током крови в мышечную ткань и
эритроциты. Эту последовательность событий называют глюкозолактатным циклом или циклом Кори.
3. Использование
лактата в качестве субстрата в глюконеогенезе связано с транспортом его
в печень и превращением в пируват (рис. 6.22). В период мышечного
сокращения в мышце пируват превращается в лактат, так как направление
лактатдегидрогеназной реакции в работающих мышцах и печени обусловлено
преобладанием восстановленной формы - NADH над окисленной формой NAD+
из-за недостатка кислорода. Лактат из мышцы транспортируется в печень,
где он превращается в пируват (благодаря хорошему снабжению кислородом О2
и высокому содержанию NAD+, а затем в глюкозу (в процессе
глюконеогенеза), которая поступит с током крови в мышечную ткань и
эритроциты. Эту последовательность событий называют глюкозолактатным циклом или циклом Кори.
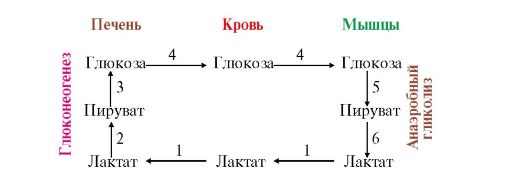 Рис. 6.22. Цикл Кори:
Рис. 6.22. Цикл Кори:
1 - поступление лактата из сокращающейся мышцы и эритроцитов с током крови в печень; 2, 3 - синтез глюкозы из лактата в печени; 4 - поступление глюкозы из печени с током крови в работающую мышцу и в эритроциты; 5, 6 - использование глюкозы как энергетического субстрата сокращающейся мышцей и эритроцитами с образованием лактата
Часть пирувата, образовавшегося из лактата, окисляется в печени до СО2 и Н2О. Энергия, выделяющаяся при окислении, используется для синтеза АТФ, необходимого в процессе глюконеогенеза. Помимо печени, потребителями лактата являются почки и сердечная мышца, где он также окисляется до СО2 и Н2О с образованием АТФ. В мышцах в покое отношение NAD+-NADH повышается и лактат может превращаться в пируват, который будет окисляться до СО2 и Н2О с образованием АТФ.
Снижение использования лактата в качестве субстрата в синтезе глюкозы, вызванное дефектом ферментов глюконеогенеза, может приводить к повышению концентрации молочной кислоты в крови, понижению рН и, следовательно, к лактоацидозу. Кратковременный лактоацидоз встречается довольно часто даже у здоровых людей при интенсивной мышечной работе, который компенсируется путем гипервентиляции легких и ускоренным выведением CO2. При этом Н+ вступает в реакцию с HCO- с образованием угольной кислоты Н2СО3 с последующим превращением в СО2 и Н2О. При некомпенсированном лактоацидозе содержание лактата в крови увеличивается до 5 ммоль/л (в норме - до 2 ммоль/л), значение рН крови может составлять 7,25 и менее (в норме 7,36-7,44).
Причиной повышения содержания лактата в крови может быть нарушение метаболизма пирувата вследствие:
- тканевой гипоксии различного происхождения, вызывающей активацию анаэробного гликолиза;
- поражений печени (токсические дистрофии, цирроз и др.), которые приводят к снижению утилизации лактата;
- наследственных дефектов ферментов глюконеогенеза (в частности, при недостаточности глюкозо-6-фосфатазы), приводящих к нарушению использования лактата;
- дефектов ферментов, нарушающих работу пируватдегидрогеназного комплекса (ПДК);
- гиповитаминозов В1, В2, РР (нарушается коферментная функция).
4. Существенное влияние на глюконеогенез оказывает этанол. Метаболизм этанола на 90% происходит в печени.
Превращение этанола включает две реакции дегидрирования с образованием ацетил-КоА и его последующее окисление в цитратном цикле (рис. 6.23). Алкогольдегидрогеназа содержится в основном в печени (95%), а также в других органах (мозге, почках, легких, кишечнике). Для окисления суточной нормы углеводов (500 г) требуется такое же количество NAD+, как и для окисления 125 г этанола. Частично окисление этанола протекает под действием микросомальных ферментов окисления (см. модуль 12).
В результате катаболизма этанола увеличивается количество NADH, что приводит к смещению лактатдегидрогеназной реакции в сторону образования лактата, снижению образования пирувата и замедлению глюконеогенеза.
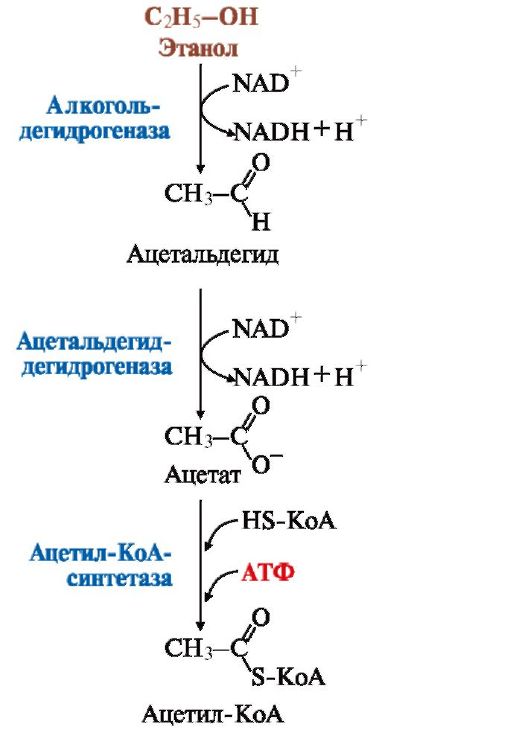 Рис. 6.23. Окисление этанола в печени (ферменты указаны слева синим цветом)
Рис. 6.23. Окисление этанола в печени (ферменты указаны слева синим цветом)
ТЕМА 6.9. РЕГУЛЯЦИЯ ГЛИКОЛИЗА И ГЛЮКОНЕОГЕНЕЗА
В ПЕЧЕНИ
1. Переключение метаболизма печени с гликолиза на глюконеогенез и наоборот происходит при помощи:
- аллостерических механизмов регуляции активности ключевых ферментов;
- ковалентной модификации ферментов путем фосфорилирования (дефосфорилирования) с участием инсулина и глюкагона;
- индукции (репрессии) синтеза ключевых ферментов, катализирующих реакции субстратных циклов.
Регуляция гликолиза и глюконеогенеза в печени направлена на необратимые стадии гликолиза и глюконеогенеза, которые формируют три субстратных цикла (на рис. 6.20 обозначены I, II, III). Название «субстратный цикл» означает объединение реакций синтеза и распада субстрата.
2. Направление реакций первого субстратного цикла регулируется главным образом концентрацией глюкозы. При пищеварении (абсорбтивный период) концентрация глюкозы в крови повышается (до 120-140 мг/дл, или 7-8 ммоль/л). Активность глюкокиназы в этих условиях максимальна. Вследствие этого ускоряется реакция Глюкоза - Глюкозо-6-фосфат. Поскольку глюкокиназа печени не ингибируется глюкозо-6-фосфатом (в отличие от гексокиназы мышц), то основная часть глюкозо-6-фосфата направляется в гликолиз и на синтез гликогена.
3. Направление реакций второго субстратного цикла зависит от активности фосфофруктокиназы и фосфатазы фруктозо-1,6-бисфосфата. В этом цикле действует фруктозо-2,6-бисфосфат, который одновременно выполняет функцию аллостерического активатора фосфофруктокиназы (регуляторный фермент гликолиза) и аллостерического ингибитора фосфатазы фруктозо- 1,6-бисфосфата (регуляторный фермент глюконеогенеза).
Фруктозо-2,6-бисфосфат образуется в абсорбтивный период путем фосфорилирования фруктозо-6-фосфата при участии бифункционального фермента (БИФ), который в дефосфорилированной форме (БИФ-ОН) проявляет киназную активность (рис. 6.24). Дефосфорилирование БИФ происходит с помощью фермента фосфопротеинфосфатазы, который активируется при высоком инсулин-глюкагоновом индексе за счет инсулинового рецептора.
При низком инсулин-глюкагоновом индексе, характерном для периода голодания, происходит фосфорилирование БИФ (БИФ-ОРО3Н2) с помощью протеинкиназы А, которая активируется вследствие активации аденилатциклазной системы в результате взаимодействия гормона глюкагона с рецепторами. При этом БИФ проявляет фосфатазную активность. В результате
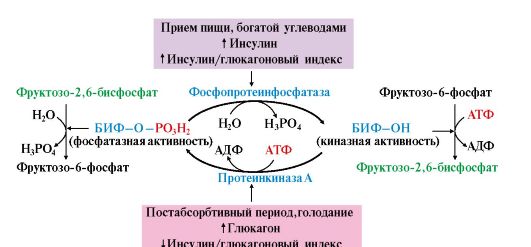 Рис. 6.24. Реакции, катализируемые бифункциональным ферментом (БИФ) в печени.
Рис. 6.24. Реакции, катализируемые бифункциональным ферментом (БИФ) в печени.
БИФ катализирует реакции обратимого превращения фруктозо-6-фосфата в фруктозо-2,6-бисфосфат. БИФ может находиться в двух формах: дефосфорилированной (БИФ-ОН) и фосфорилированной (БИФ-ОРО3Н2). БИФ-ОН обладает киназной активностью и способствует образованию фруктозо-2,6-бисфосфата. БИФ-ОРО3Н2 обладает фосфатазной активностью и способствует уменьшению концентрации фруктозо-2,6-бисфосфата и образованию фруктозо-6-фосфата. Фосфорилирование и дефосфорилирование БИФ связано с ритмом питания и регулируется гормонами. Инсулин (абсорбтивный период) активирует фермент фосфопротеинфосфатазу, что приводит к появлению формы БИФ-ОН, а глюкагон (постабсорбтивный период) активирует аденилатциклазную систему, что вызывает активацию протеинкиназы А и появление формы БИФ-ОРО3Н2
уменьшается количество фруктозо-2,6-бисфосфата, что приводит к замедлению гликолиза и переключению метаболизма на глюконеогенез. Наличие двух активностей (киназной и фосфатазной) у БИФ определило название фермента - «бифункциональный».
БИФ присутствует только в гепатоцитах. Киназную и фосфатазную реакции катализируют разные активные центры БИФ, которые функционируют по очереди в зависимости от состояния фермента фосфорилированного или дефосфорилированного. Превращение фруктозо-2,6-бисфосфата в фрукто- зо-6-фосфат не является обратимым процессом. Образование фруктозо-2,6- бисфосфата требует затрат АТФ, а при образовании фруктозо-6-фосфата из фруктозо-2,6-бисфосфата высвобождается неорганический фосфат.
4. В регуляции третьего субстратного цикла основная роль принадлежит пируваткиназе, фосфорилированная форма которой неактивна, а дефосфорилированная активна (рис. 6.25). Дефосфорилирование пируваткиназы происходит в период пищеварения, когда инсулин активирует фосфопротеинфосфатазу, которая дефосфорилирует пируваткиназу, переводя ее в активное состояние. Следовательно, реакция превращения фосфоенолпируват в пируват ускоряется при пищеварении (абсорбтивный период). В постабсорбтивном состоянии пируваткиназа при действии глюкагона на печень переходит в фосфорилированное неактивное состояние.
Реакция глюконеогенеза превращения пирувата - оксалоацетат катализитуется биотин-зависимым ферментом - пируваткарбоксилазой с участием АТФ в качестве источника энергии. Регуляция этой реакции осуществляется с помощью аллостерической активации ацетил-КоА. Биологическое значение этого эффекта объясняется тем, что при голодании организм начинает использовать жирные кислоты как источник энергии.
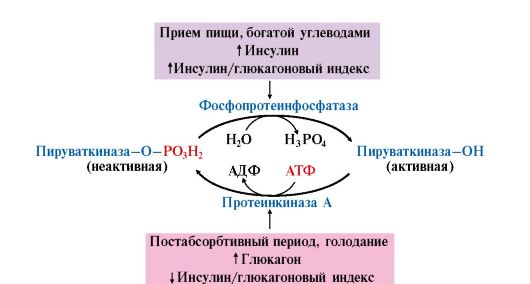 Рис. 6.25. Регуляция пируваткиназы в печени.
Рис. 6.25. Регуляция пируваткиназы в печени.
Регуляция активности пируваткиназы в печени осуществляется путем фосфорилирования (дефосфорилирования) в зависимости от ритма питания
Ацетил-КоА - продукт окисления жирных кислот, активируя пируваткарбоксилазу, направляет пируват по пути глюконеогенеза.
5. Координация в регулировании субстратных циклов II и III достигается с помощью фруктозо-1,6-бисфосфата - продукта субстратного цикла II (гликолитическое направление), который является аллостерическим активатором пируваткиназы. В период пищеварения вследствие ускорения начальных стадий гликолиза концентрация фруктозо-1,6-бисфосфата повышается, что приводит к дополнительной активации пируваткиназы.
Общая схема регуляции гликолиза и глюконеогенеза в печени в зависимости от ритма питания представлена на рис. 6.26.
6. Регуляция энергетического статуса гепатоцитов осуществляется путем изменения скорости аэробного распада глюкозы. АТФ, AДФ, АМФ, а также NADH, NAD+ служат аллостерическими эффекторами ключевых ферментов гликолиза и глюконеогенеза (рис. 6.27).
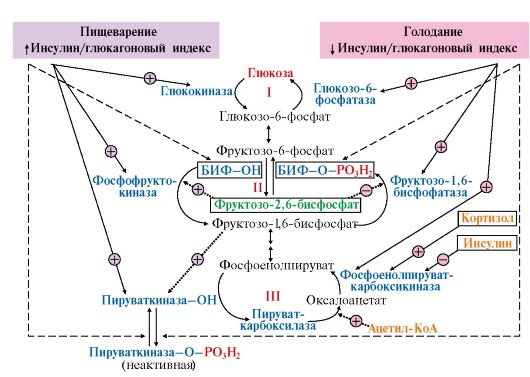

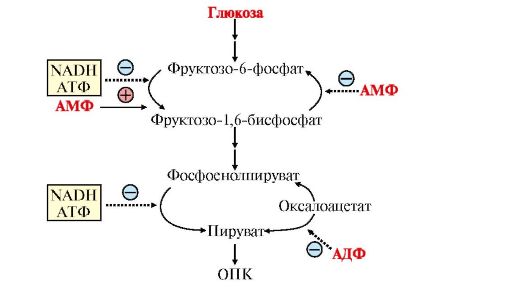
 При высокой концентрации энергетических молекул АТФ и NADH, характерных
для высокоэнергетического статуса клетки, происходит ингибирование
ключевых ферментов гликолиза - фосфофруктокиназы и пируваткиназы, что
вызывает торможение гликолиза. Высокая концентрация AMФ вызывает
активацию фосфофруктокиназы (фермент гликолиза) и ингибирование
фосфатазы фруктозо-1,6-бисфосфата (фермент глюконеогенеза), а AДФ ингибирует
пируваткарбоксилазу, замедляя глюконеогенез. Таким образом, в случае
низкого энергетического статуса клетки наблюдается активация гликолиза и
ингибирование глюконеогенеза.
При высокой концентрации энергетических молекул АТФ и NADH, характерных
для высокоэнергетического статуса клетки, происходит ингибирование
ключевых ферментов гликолиза - фосфофруктокиназы и пируваткиназы, что
вызывает торможение гликолиза. Высокая концентрация AMФ вызывает
активацию фосфофруктокиназы (фермент гликолиза) и ингибирование
фосфатазы фруктозо-1,6-бисфосфата (фермент глюконеогенеза), а AДФ ингибирует
пируваткарбоксилазу, замедляя глюконеогенез. Таким образом, в случае
низкого энергетического статуса клетки наблюдается активация гликолиза и
ингибирование глюконеогенеза.
7. Индукция (репрессия) синтеза ключевых ферментов регулируется с помощью гормонов. Стероидные гормоны осуществляют регуляцию экспрессии генов, изменяя (увеличивая или уменьшая) синтез ключевых ферментов (см. модуль 3). Глюкагон и инсулин также влияют на синтез ключевых ферментов, однако в отличие от стероидных гормонов они, используя системы трансмембранной передачи сигналов, вызывают изменение активности факторов транскрипции, что также приводит к ослаблению или повышению синтеза регуляторных ферментов гликолиза и глюконеогенеза.
В период пищеварения инсулин индуцирует синтез глюкокиназы, фосфофруктокиназы и пируваткиназы, что приводит к активации гликолиза и вызывает репрессию фосфоенолпируваткарбоксикиназы и замедляет глюконеогенез.
В постабсорбтивный период глюкагон повышает транскрипцию генов и синтез ключевых ферментов глюконеогенеза - фосфоенолпируваткарбоксикиназы, фруктозо-1,6-бисфосфатазы и глюкозо-6-фосфатазы, в результате чего активируется глюконеогенез. В период длительного голодания особое значение в стимуляции глюконеогенеза имеет стероидный гормон кортизол, который вызывает индукцию фермента глюконеогенеза - фосфоенолпируваткарбоксикиназы.
ТЕМА 6.10. РЕГУЛЯЦИЯ СОДЕРЖАНИЯ ГЛЮКОЗЫ В КРОВИ, ГИПЕРГЛЮКОЗЕМИЯ
1. Концентрация глюкозы в артериальной крови в течение суток поддерживается на постоянном уровне 80-100 мг/дл (3,3-5,5 ммоль/л). После приема углеводной пищи уровень глюкозы в крови возрастает в течение 0,5-1 ч до 120-140 мг/дл (7-8 ммоль/л) - алиментарная гиперглюкоземия, затем (приблизительно через 2 часа) возвращается к нормальному уровню (рис. 6.28).
 Рис. 6.28. Динамика изменений концентрации глюкозы в течение суток:
Рис. 6.28. Динамика изменений концентрации глюкозы в течение суток:
А-Б-В - период пищеварения (абсорбтивный период); В-Г - постабсорбтивный период.
Стрелка указывает время приема пищи; пунктирная линия - среднее значение концентрации глюкозы, соответствующее физиологической норме
В регуляции метаболизма глюкозы, связанной с режимом питания, участвуют гормоны инсулин и глюкагон.
2. После приема богатой углеводами пищи концентрация глюкозы в воротной вене повышается до 180-360 мг/дл (10-20 ммоль/л), возрастает инсулин/глю- кагоновый индекс и поэтому возрастает скорость глюкокиназной реакции. Инсулин вызывает активацию фосфопротеинфосфатаз, дефосфорилируюих гликогенсинтазу, которая становится активной, и гликогенфосфорилазу, переходящую в неактивное состояние (ингибирующую). В результате в печени глюкозо-6-фосфат включается в гликолиз, удовлетворяя потребности клеток в энергии, и участвует в синтезе гликогена (гликогенез).
Повышение уровня инсулина увеличивает поступление глюкозы в мышцы и жировую ткань за счет ускорения транспорта глюкозы через клеточные мембраны путем перемещения белков - переносчиков ГЛЮТ-4 в плазматическую мембрану. Кроме того, инсулин стимулирует синтез гликогена в мышцах. Таким образом, поглощение глюкозы печенью, мышцами и жировой тканью приводит к восстановлению нормальной концентрации глюкозы в крови приблизительно через 2 часа после приема пищи.
3. В постабсорбтивный период концентрация глюкозы в крови понижается по сравнению с абсорбтивным периодом, значение инсулин/глюкагонового индекса падает. Концентрация глюкозы в крови в этих условиях поддерживается за счет процессов распада гликогена печени (гликогенолиз) и глюконеогенеза.
В течение 12-часового голодания гликоген печени является основным поставщиком глюкозы: глюкагон вызывает активацию гликогенфосфорилазы и мобилизацию гликогена.
Через сутки после последнего приема пищи гликоген печени полностью исчерпан и глюконеогенез - единственный источник, поддерживающий концентрацию глюкозы в крови в пределах нормы.
4. Повышение содержания глюкозы в крови выше 5,5 ммоль/л в постабсорбтивный период называется гипергликемией или гиперглюкоземией и является патологическим состоянием, связанным с гормональным нарушением регуляции содержания глюкозы в крови. Снижение содержания глюкозы в крови ниже 3,3 ммоль/л получило название гипогликемии или гипоглюкоземии. Гипоглюкоземия значительно более опасна для человека, нежели гиперглюкоземия, так как снижение содержания глюкозы в крови приводит к нарушению энергообеспечения клеток головного мозга, в результате чего возможны потеря сознания (гипогликемическая кома), судороги, что может привести к летальному исходу. У здорового человека гипогликемические состояния возникают редко и носят временный характер. Устойчивая гипогликемия развивается при инсуломе - опухоли из β-клеток поджелудочной железы, сопровождающейся гиперпродукцией инсулина, или у больных сахарным диабетом при передозировке инсулина.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Напишите схему процесса, обеспечивающего поддержание концентрации глюкозы в крови при голодании в пределах нормы. Для ответа:
- запишите формулами метаболический путь;
- укажите ферменты и коферменты процесса;
- отметьте реакции, протекающие с затратой макроэргических соединений.
2. В период пищеварения в гепатоцитах возрастает содержание фруктозо- 2,6-бисфосфата. Объясните причину данного явления и роль этого вещества в регуляции углеводного обмена. Для ответа:
а) напишите схему образования и распада фруктозо-2,6-бисфосфата; укажите ферменты, катализирующие эти реакции;
б) составьте схему регуляции активности этих ферментов;
в) напишите схему процессов, в регуляции которых принимает участие фруктозо-2,6-бисфосфат; укажите аллостерические ферменты и их регуляторные лиганды.
3. Перенесите табл. 6.13 в тетрадь и заполните графы.
Таблица 6.13. Регуляторные ферменты гликолиза и глюконеогенеза в печени
Регуляторные ферменты | Аллостерическая регуляция | Фосфорилирование (дефосфорилирование) | Индукция (репрессия) | |||
Активаторы | Ингибиторы | Активная форма фермента | Гормон, участвующий в регуляции | Гормон, участвующий в регуляции | Индукция или репрессия | |
Гликолиз 1. | ||||||
2. | ||||||
3. | ||||||
Глюконео- генез 1. | ||||||
2. | ||||||
3. | ||||||
4. | ||||||
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильные ответы. Глюконеогенез протекает в органах:
A. Слизистая тонкого кишечника Б. Мышцы
B. Печень Г. Почки
Д. Эритроциты
2. Выберите правильный ответ.
На синтез 1 моль глюкозы из пирувата необходимо затратить:
A. 4 моль АТФ Б. 2 моль ГТФ
B. 4 моль АТФ и 2 моль ГТФ
Г. 38 моль АТФ Д. 8 моль АТФ
3. Выполните «цепное» задание:
а) при остром алкогольном отравлении отношение NADH-NAD+ в клетках печени:
A. Увеличится Б. Уменьшится
B. Не изменится
б) в результате этого концентрация лактата в клетках печени:
A. Уменьшится Б. Увеличится
B. Не изменится
в) поэтому наблюдается:
A. Концентрация глюкозы в норме Б. Гиперглюкоземия
B. Гипоглюкоземия
г) это обусловлено:
A. Снижением скорости глюконеогенеза Б. Активацией глюконеогенеза
B. Уменьшением скорости гликолиза
4. Выберите правильный ответ.
В состоянии покоя спустя 6 часов после последнего приема пищи:
A. Основным источником глюкозы в крови является глюконеогенез Б. Аденилатциклаза печени неактивна
B. Запас гликогена в печени полностью исчерпан
Г. Уровень глюкозы в крови поддерживается распадом гликогена мышц
Д. Уровень глюкозы в крови поддерживается распадом гликогена печени
5. Установите порядок событий.
При снижении инсулин/глюкагонового индекса в гепатоцитах происходит:
A. Активация аденилатциклазной системы
Б. Фосфорилирование БИФ и проявление его фосфатазной активности
B. Понижение концентрации фруктозо-2,6-бисфосфата Г. Активация глюконеогенеза
Д. Взаимодействие глюкагона с рецептором
6. Установите соответствие. Биохимические показатели обмена углеводов:
A. Концентрация глюкозы в артериальной крови 140 мг/дл Б. Усилен синтез глюкозы из лактата
B. Концентрация глюкозы в артериальной крови 30 мг/дл
Г. Возрастает скорость глюконеогенеза из аминокислот и глицерола
в печени Д. Преобладает распад гликогена
Время после приема пищи:
1. Абсорбтивный период
2. Постабсорбтивный период
3. Период длительного голодания
7. Выберите правильные ответы.
Накопление молочной кислоты и развитие лактоацидоза может быть вызвано:
A. Поражением клеток печени (цирроз, токсические гепатиты)
Б. Нарушением работы ПДК вследствие дефектов в ферментом или гиповитаминозов
B. Активацией анаэробного гликолиза вследствие тканевой дистрофии
Г. Ускоренным превращением лактата в глюкозу путем глюконеогенеза
Д. Нарушением использования лактата из-за наследственных дефектов ферментов глюконеогенеза
8. Установите соответствие. Особенность катализа:
A. Биотин-зависимый фермент Б. NAD-зависимый фермент
B. FAD-зависимый фермент
Г. Для проявления ферментативной активности требуется ГТФ Д. Катализирует реакцию субстратного фосфорилирования Фермент:
1. Пируваткиназа
2. Пируваткарбоксилаза
3. Фосфоенолпируваткарбоксикиназа
9. Дополните предложение недостающими словами.
В интенсивно работающих мышцах при анаэробном гликолизе образу- ется_________, который поступает в кровь, а затем в печень. В печени
отношение NADH/NAD+___________, чем в сокращающейся мышце,
поэтому лактатдегидрогеназная реакция протекает в сторону образования
пирувата из___________. Продукт реакции включается в__________,
а образовавшаяся глюкоза поступает в кровь и используется скелетными мышцами. Эту последовательность событий называют____________.
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. А, В, Г
2. В
3. А, Б, В, А
4. Д
5. Д, А,Б, В, Г
6. 1-А, 2-Д, 3-Г
7. А, Б, В, Д
8. 1-Д, 2-А, 3-Г
9. лактат; ниже; лактата; глюконеогенез; глюкозолактатный цикл (цикл Кори)
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Глюконеогенез
2. Субстраты глюконеогенеза
3. Регуляция глюконеогенеза
4. Глюкозолактатный цикл (цикл Кори)
5. Гиперглюкоземия (гипергликемия)
6. Гипоглюкоземия (гипогликемия)
7. Абсорбтивный период
8. Постабсорбтивный период
9. Инсулин/глюкагоновый индекс
10. Лактоацидоз
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ, ИЗУЧАЕМЫЕ В МОДУЛЬНОЙ ЕДИНИЦЕ
1. Концентрация глюкозы в крови в норме - 80-100 мг/дл (3,3-5,5 ммоль/л)
2. Алиментарная гиперглюкоземия: 120-140 мг/дл (7-8 ммоль/л)
3. Концентрация лактата в крови в состоянии покоя - 1 ммоль/л
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. Два студента пришли сдавать кровь «на сахар» в поликлинику. Когда результаты анализов были готовы, выяснилось, что у первого студента концентрация глюкозы составляет 90 мг/дл, а у второго - 130 мг/дл. При обсуждении полученных показателей выяснилось, что второй студент утром выпил сладкий чай. Сделайте заключение о результатах анализов и ответьте на следующие вопросы:
а) чем обусловлена рекомендация, что количественное определение глюкозы в биохимических лабораториях проводят строго натощак?
б) какова концентрация глюкозы в крови в норме и в абсорбтивный период?
в) есть ли разница в содержании глюкозы в крови, взятой из вены или из капилляров пальца больного?
2. Бригада скорой помощи привезла в больницу человека с острой алкогольной интоксикацией. Для оказания помощи ему ввели раствор глюкозы и сукцината. Аргументируйте целесообразность проведения этих мероприятий. Для ответа:
а) напишите схему утилизации этанола в печени;
б) объясните, как чрезмерное употребление этанола повлияет на соотношение NADH-NAD+ в гепатоцитах и как это изменение повлияет на направление ЛДГ-реакции в печени;
в) объясните, как сдвиг ЛДГ-реакции повлияет на энергетический обмен. Какую роль при этом будут играть введенные препараты глюкозы и сукцината?
3. В больницу доставлен человек без сознания с признаками алкогольного отравления. При лабораторном исследовании крови получены следующие данные:
• алкоголь - 320 мг/дл (норма - 5 мг/дл);
• глюкоза - 50 мг/дл;
• лактат - 2 ммоль/л (норма - 1 ммоль/л).
Назовите причины изменения концентрации глюкозы и лактата в крови при остром алкогольном отравлении. Приведите соответствующую реакцию и схему процесса, скорость которого снижена у этого человека.
4. Одним из субстратов глюконеогенеза при интенсивной физической нагрузке и голодании является глицерин, образующийся при распаде жиров в жировой ткани. Подсчитайте сколько моль глицерина и АТФ необходимо для синтеза 1 моль глюкозы.
Для ответа:
а) дополните схему синтеза глюкозы из глицерина необходимыми метаболитами и напишите первые две реакции формулами с указанием ферментов и коферментов:
 б) на схеме укажите реакции, требующие затраты АТФ.
б) на схеме укажите реакции, требующие затраты АТФ.
5. При длительном голодании основным субстратом глюконеогенеза являются аминокислоты. Подсчитайте, сколько молей глутамата необходимо для синтеза 1 моль глюкозы. Для этого:
а) предложенную схему превращения глутамата в α-кетоглутарат запишите формулами, назовите фермент, укажите энергетический выход:
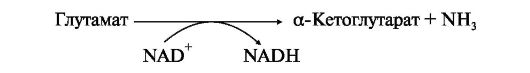 б) напишите
реакции образования оксалоацетата из α-кетоглутарата, рассчитайте
энергетический выход, укажите судьбу оксалоацетата;
б) напишите
реакции образования оксалоацетата из α-кетоглутарата, рассчитайте
энергетический выход, укажите судьбу оксалоацетата;
в) представьте схему глюконеогенеза, укажите ферменты всех необратимых реакций, а также ферменты, катализирующие реакции с потреблением энергии;
г) рассчитайте энергетический баланс использования глутамата в этом процессе (учтите, что на синтез 1 моль глюкозы требуется 2 моль субстрата).
6. При обследованни у ребенка обнаружены такие симптомы, как дерматит, замедленный рост, наблюдаются алопеция (от греч. alopex - лиса: выпадение волос, как у линяющей лисы), расстройство мышечной деятельности. Ребенок часто болел, что связано с ослаблением функции иммунной системы. Анализ мочи показал высокое содержание лактата. При биохимическом обследовании обнаружен дефицит фермента синтетазы холокарбоксилазы, который катализирует присоединение биотина к специфическому остатку лизина в активном центре ферментов. Почему при данном нарушении в моче обнаруживается лактат? Для ответа:
а) укажите, конечным продуктом какого метаболического пути является лактат; напишите реакцию его образования, назовите фермент и кофермент;
б) опишите пути использования лактата в тканях; на схемах укажите реакцию, скорость которой будет снижена вследствие дефицита фермента синтетазы холокарбоксилазы; напишите эту реакцию, назовите фермент и кофермент;
в) напишите схему процесса, который нарушен в клетках тканей больного ребенка; объясните роль этого процесса.
7. При опухоли β-клеток островков Лангерганса поджелудочной железы у больной наблюдается сверхутилизация глюкозы клетками тканей, что сопровождается развитием гипогликемического состояния. Какие процессы в печени активирует этот гормон? Для ответа:
а) укажите, гиперсекреция какого гормона стала причиной развития гипогликемического состояния, объясните механизм его действия на клетки-мишени;
б) напишите схемы процессов, скорость которых регулирует этот гормон в печени;
в) приведите схемы регуляции этих процессов.
Модуль 7
БИОХИМИЯ МЕЖКЛЕТОЧНОГО
МАТРИКСА
Темы модуля_
7.1. Коллаген
7.2. Эластин
7.3. Гетерополисахариды межклеточного матрикса
7.4. Неколлагеновые структурные белки межклеточного матрикса
7.5. Структурная организация межклеточного матрикса (суставной хрящ, базальные мембраны, субэпителиальные слои)
Цели изучения Уметь:
1. Интерпретировать роль важнейших макромолекул (белков и полисахаридов) в структурной организации межклеточного матрикса.
2. Давать объяснение клиническим проявлениям недостаточности витамина С.
3. Анализировать результаты лабораторных исследований на содержание оксипролина и пиридинолинов в физиологических жидкостях, используемых для диагностики онкологических заболеваний и коллагенозов.
4. Объяснять молекулярные механизмы, лежащие в основе нарушений структуры и функций межклеточного матрикса, которые приводят к возникновению ряда заболеваний соединительной ткани.
Знать:
1. Основные белки межклеточного матрикса (коллаген и эластин): особенности аминокислотного состава, первичной и пространственной структуры.
2. Строение и функции гликозаминогликанов и протеогликанов, их роль в организации межклеточного матрикса.
3. Адгезивные белки межклеточного матрикса, их роль в межклеточных взаимодействиях и развитии опухолей.
 Межклеточный
матрикс - это структурированный и упорядоченный комплекс макромолекул,
который окружает клетки соединительной ткани и влияет на их развитие,
организацию, пролиферацию и метаболизм. Он выполняет ряд важных функций:
образует соединительную основу органов и тканей, связывает клетки друг с
другом, обеспечивает механическую прочность и тургор тканей, образует
высокоспециализированные структуры - базальные мембраны, кости, хрящи,
сухожилия и др. Основными компонентами матрикса являются: структурные
белки коллаген и эластин, гликозаминогликаны, протеогликаны, а также
неколлагеновые белки фибронектин, ламинин, тенасцин, остеонектин и др.
Межклеточный
матрикс - это структурированный и упорядоченный комплекс макромолекул,
который окружает клетки соединительной ткани и влияет на их развитие,
организацию, пролиферацию и метаболизм. Он выполняет ряд важных функций:
образует соединительную основу органов и тканей, связывает клетки друг с
другом, обеспечивает механическую прочность и тургор тканей, образует
высокоспециализированные структуры - базальные мембраны, кости, хрящи,
сухожилия и др. Основными компонентами матрикса являются: структурные
белки коллаген и эластин, гликозаминогликаны, протеогликаны, а также
неколлагеновые белки фибронектин, ламинин, тенасцин, остеонектин и др.
ТЕМА 7.1. КОЛЛАГЕН
1. Коллаген - основной структурный белок межклеточного матрикса. Он синтезируется клетками соединительной ткани (остеобластами, хондробластами, фибробластами и др.). Это фибриллярный белок, отличающийся от других белков рядом особенностей состава и структуры:
• пептидная цепь коллагена содержит около 1000 аминокислотных остатков, из которых каждая третья аминокислота - глицин, 20% составляют пролин и гидроксипролин, 10% - аланин, оставшиеся 40% - другие аминокислоты; в коллагене отсутствуют цистеин и триптофан и содержится очень мало гистидина, метионина и тирозина;
• первичную структуру коллагена можно записать в виде [Гли-Х-У ]333, где Х - часто пролин, а У - гидроксипролин; особенности первичной структуры обеспечивают уникальную конформацию коллагена;
• полипептидная цепь коллагена укладывается в левозакрученную α-спираль, которая отличается от α-спирали глобулярных белков; она более развернута, и на один виток приходится три аминокислотных остатка, поэтому в цепи глицин всегда находится над глицином - это обстоятельство имеет важнейшее значение для последующей укладки коллагена и выполнения его функций; стабилизация этой цепи происходит преимущественно силами стерического отталкивания пирролидоновых колец пролина, так как водородных связей пролин и гидроксипролин не образуют;
• следующий уровень структурной организации коллагена - образование правозакрученной суперспирали из трех α-цепей, при формировании которой остатки глицина оказываются по ее центральной оси, что способствует образованию линейной молекулы тропоколлагена и включению ее в волокно.
2. Синтез и созревание коллагена - сложный многоэтапный процесс, который начинается в клетке, а завершается во внеклеточном пространстве (рис. 7.1). Он включает в себя целый ряд посттрансляционных изменений: гидроксилирование пролина и лизина, гликозилирование гидроксилизина, образование тройной спирали, отщепление N- и С-концевых пептидов.
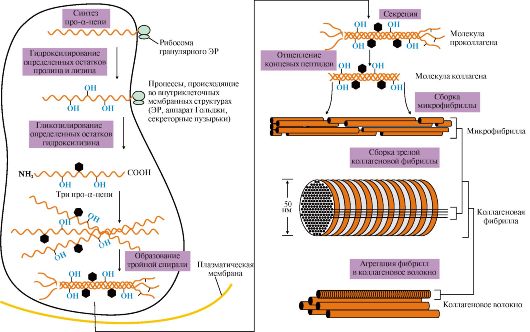 Рис. 7.1. Синтез и созревание коллагена
Рис. 7.1. Синтез и созревание коллагена
Полипептидные цепи коллагена синтезируются на полирибосомах, связанных с мембраной ЭР, в виде предшественников, имеющих на N-конце «сигнальный» пептид. Основная функция этого пептида - ориентация синтеза пептидных цепей в полость ЭР, после выполнения которой этот пептид сразу же отщепляется. Гидроксилирование пролина и лизина начинается в период трансляции полипептидной цепи вплоть до ее отделения от рибосом. Эти реакции катализируют соответствующие гидроксилазы, которые содержат в активном центре железо в виде Fe2+. В реакции участвуют О2 и α-кетоглутарат, для поддержания железа в восстановленной форме необходимо присутствие витамина С. Введение ОН-группы в радикалы пролина и лизина способствует стабилизации цепей в молекуле тропоколлагена за счет образования водородных связей между ними (рис. 7.2). При недостатке витамина С этот процесс замедляется, снижается прочность и стабильность коллагеновых волокон, что приводит к возникновению цинги, симптомами которой являются кровоизлияния под кожу и слизистые, кровоточивость десен, анемия и др. Причина этого - повышенная ломкость и хрупкость кровеносных сосудов, которая приводит к повреждениям сосудистой стенки.
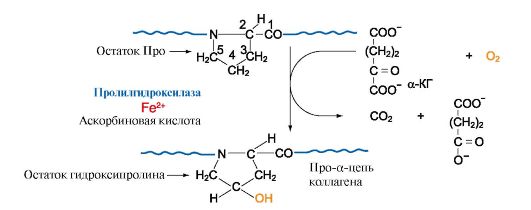 Рис. 7.2. Гидроксилирование пролина в коллагене
Рис. 7.2. Гидроксилирование пролина в коллагене
Гликозилирование лизина под действием гликозилтрансфераз прекращается по мере формирования трехспиральной структуры.
N- и С-концевые пептиды проколлагена содержат остатки Цис, которые формируют внутри- и межцепочечные (только С-концевые пептиды) дисульфидные связи; эти пептиды необходимы для образования тройной спирали коллагена - при их отсутствии спирализация трехцепочечной структуры коллагена нарушается.
Определенную роль в синтезе очень больших цепей пре-проколлагена играют белки-шапероны, которые обеспечивают «контроль их качества»: они способствуют правильному синтезу молекул коллагена и их транспорту по секреторным путям, а также «отслеживают» неправильно собранные молекулы коллагена, которые затем разрушаются.
Внеклеточная стадия синтеза коллагена начинается с протеолиза N- и С-концевых неспирализованных участков, которые содержат соответственно 100 и 250 аминокислотных остатков, и образования тропоколлагена.
3. Коллаген - это полиморфный белок. Известно 19 типов коллагена, которые отличаются друг от друга первичной структурой пептидных цепей, функциями и локализацией в организме. Разные типы коллагена в разных тканях могут образовывать такие структуры, как фибриллы, микрофибриллы, «заякоренные» фибриллы, сети и др.
Фибриллообразующие коллагены (типы I, II, III, V и XI). Основа фибрилл - ступенчато расположенные параллельные ряды молекул тропоколлагена, которые сдвинуты на 1/4 друг относительно друга (рис. 7.3).
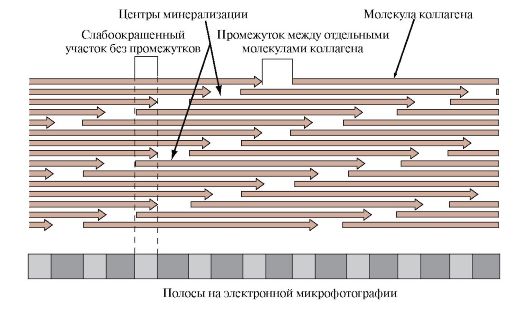 Рис. 7.3. Схема ступенчатого расположения молекул коллагена в коллагеновой фибрилле
Рис. 7.3. Схема ступенчатого расположения молекул коллагена в коллагеновой фибрилле
Преимущественное распределение этих типов коллагена по тканям следующее: I тип - кости, дентин, роговица, сухожилия; II тип - хрящи, межпозвоночные диски, стекловидное тело; III тип - почки, печень, сосуды, лимфатические узлы. Коллагены этих трех типов называют также интерстициальными, они образуют очень прочные фибриллы, которые выдерживают большие механические нагрузки. Стабилизация фибрилл обеспечивается поперечными связями между остатками лизина и аллизина - продукта окисления лизина в молекулах тропоколлагена. Эти типы связей встречаются не только в коллагене, но и в эластине. Модификацию радикалов лизина катализирует медьсодержащий фермент лизилоксидаза, который находится в межклеточном матриксе. Для этих реакций окислительного дезаминирования лизина и гидроксилизина необходимы также витамины РР и В6. Образовавшиеся реактивные альдегиды спонтанно формируют ковалент-
ные связи между собой, а также с другими остатками лизина или гидроксилизина соседних молекул, и в результате возникают поперечные Лиз-Лиз- сшивки (рис. 7.4).
Кроме этих сшивок, между молекулами коллагена могут возникать перекрестные пиридиновые связи, в результате которых образуются пиридинолины (кости и хрящи) и дезоксипиридинолины (кости и дентин), что также способствует повышению прочности этих тканей. Эти структуры имеют важное значение в диагностике: при метастазах рака легких, простаты и молочной железы в кости они определяются в моче.
Коллаген IV типа - структурный компонент базальных мембран - относится к сетеобразующим коллагенам. Особенностью этого коллагена является то, что повторяющиеся спирализованные участки с последовательностями [Гли-Х-У] часто прерываются короткими неспиральными сегментами,
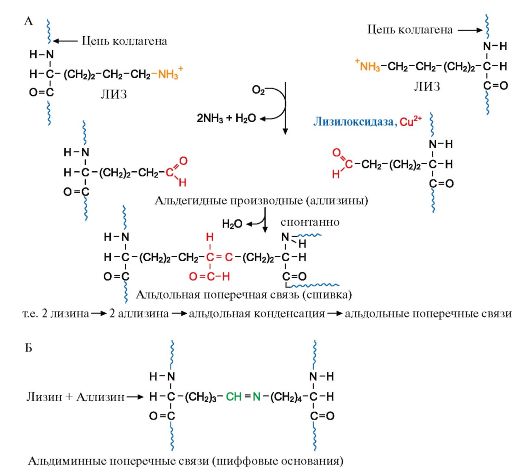 Рис. 7.4. Образование поперечных связей в коллагене:
Рис. 7.4. Образование поперечных связей в коллагене:
А - образование альдольной поперечной сшивки из двух боковых цепей лизина; Б - образование шиффовых оснований из боковых цепей лизина и аллизина
что, по-видимому, увеличивает гибкость коллагена IV типа и способствует формированию на его основе сетчатых структур. У коллагена IV типа N- и С-концевые пептиды не отщепляются. Именно эти фрагменты участвуют в образовании олигомерных форм коллагена, стабилизированных дисульфидными мостиками и поперечными лизиновыми связями. В базальной мембране из этих компонентов формируется сетчатая структура (рис. 7.5).
 Рис. 7.5. Организация коллагена IV типа:
Рис. 7.5. Организация коллагена IV типа:
А - тройная спираль мономера; 7S - N-конец; НК1 - С-конец; Б - полимеризация коллагена IV типа: 1 - мономер; 2 - димеры, образованные соединением мономеров в области НК1-доменов; 3 - тетрамеры, образованнные соединением мономеров в области 7S-сегментов в параллельном и антипараллельном направленииях; 4 - образование сетчатой структуры из олигомерных форм коллагена IV типа
Коллаген VII типа - основной структурный компонент «заякоренных» фибрилл, которые находятся преимущественно в субэпителиальных слоях. Фибриллы образуются димерами этого коллагена, которые соединяются между собой «бок-в-бок» (рис. 7.6). Пучки таких фибрилл участвуют в присоединении эпидермиса к дерме.
4. Катаболизм коллагена. Нативный коллаген гидролизуется ферментом коллагеназой, матриксной металлопротеиназой (ММР-1), которая расщепляет молекулу на два фрагмента (1/4 и 3/4 от общей длины молекулы) (рис. 7.7).
После этого трехцепочечные фрагменты подвергаются протеолизу лизосомальными протеазами. Коллагеназа относится к группе Zп2+-зависимых протеолитических ферментов межклеточного матрикса, которые секретируются разными типами клеток и участвуют в деградации не только коллагена, но и ламинина, фибронектина и других структурных белков матрикса. Ион
 Рис. 7.6. Организация коллагена VII типа:
Рис. 7.6. Организация коллагена VII типа:
1 - мономер коллагена VII типа (НК1 и НК2 - неколлагеновые домены у N- и С-конца); 2 - димер коллагена VII типа, молекулы собраны антипараллельно с перекрытиями на N-конце; 3 - димеры коллагена VII типа после удаления НК2-доменов; 4 - фибрилла, образованная димерами коллагена VII типа, соединенными бок в бок
 Рис. 7.7. Расщепление тройной спирали коллагена тканевой коллагеназой
Рис. 7.7. Расщепление тройной спирали коллагена тканевой коллагеназой
цинка находится в активном центре этих ферментов. В обычных условиях металлопротеиназы (ММР) содержатся в тканях в незначительных количествах. Они относятся к индуцируемым ферментам, синтез которых контролируется на уровне транскрипции рядом регуляторных молекул: цитокинами, эстрогеном, прогестероном и др.
Небольшое количество ММР присутствует в матриксе в неактивной форме, так как ингибировано специфическим тканевым ингибитором матриксных металлопротеиназ (ТIМР). Это белки небольшого размера, способные формировать комплексы со многими членами семейства матриксных протеиназ. ТIМР может взаимодействовать с активной и неактивной формами ММР.
Частичный протеолиз и активацию большинства ММР осуществляют протеазы: плазмин, урокиназа и др. Некоторые ММР могут активировать друг друга. Ингибиторы ММР могут быть инактивированы (разрушены протеолизом) с помощью ряда протеиназ: трипсина, химотрипсина, стро- мелизина-3 и эластазы нейтрофилов. В норме металлопротеиназы отвечают за важнейшие процессы - от эмбрионального развития до формирования иммунного ответа.
Металлопротеиназы играют ключевую роль в развитии многих патологий. Например, избыточная активность этих ферментов ведет к разрушению гематоэнцефалического барьера, деструкции суставного хряща при ревматоидном артрите и остеоартрите, развитию сердечно-сосудистых
патологий, связанных с уменьшением эластичности сосудов. При недостаточной активности металлопротеиназ развивается фиброз тканей и неадекватный иммунный ответ.
Некоторые виды патогенных бактерий способны вырабатывать коллагеназу, обладающую высокой активностью, что способствует их инвазии в ткани и распространению патологического процесса.
5. Особенности обмена коллагена. Коллаген - медленно обменивающийся белок, о скорости его обмена судят по содержанию гидроксипролина (Hyp) в крови и моче. Обмен коллагена более активен у молодых (до 20 лет), у пожилых и старых людей он заметно снижается, так как с возрастом повышается количество поперечных сшивок в коллагене, которые затрудняют действие коллагеназы.
6. В некоторых ситуациях синтез коллагена заметно увеличивается: например, в заживающую рану мигрируют фибробласты и начинают активно синтезировать основные компоненты межклеточного матрикса: коллаген (I и III типа), гиалуроновую кислоту, хондроитин- и дерматансульфаты. При этом повышается активность пролилгидроксилазы и гликозилтрансфераз. Достаточное поступление О2 и витамина С, необходимых для гидроксилирования пролина, способствует более быстрому заживлению ран.
7. Основная причина ряда заболеваний, связанных с нарушением синтеза коллагена, - мутации в генах коллагена. Гены коллагена находятся в разных хромосомах, они очень большие, имеют много коротких экзонов, между которыми располагаются протяженные интроны. Молекула коллагена имеет самую длинную полипептидную цепь (1000 аминокислот), образованию которой предшествует многоэтапный сплайсинг мРНК; следовательно, ген, кодирующий препро-а-цепь, занимает большой участок ДНК, что увеличивает вероятность мутаций.
Примеры некоторых наследственных болезней, связанных с дефектами разных типов коллагена:
• I тип - несовершенный остеогенез, сопровождающийся повышенной ломкостью костей, аномалиями зубов, гиперподвижностью суставов;
• II тип - а) хондродисплазии (около 40); б) синдром Стиклера и Вагнера - нарушение синтеза коллагена в стекловидном теле, осложняющееся отслойкой сетчатки;
• III тип - а) синдром Элерса-Данлоса с поражением кожи, сосудов, толстого кишечника; б) семейная аневризма аорты; в) прогрессирующая миопия;
• IV тип - синдром Альпорта с нарушением фильтрационной функции почек;
• VII тип - буллезный эпидермолиз, сопровождающийся образованием на коже пузырей, которые легко травмируются и эрозируются;
• IX тип - множественная эпифизальная дисплазия.
ТЕМА 7.2. ЭЛАСТИН
Эластин - это основной структурный компонент волокон, которые содержатся в тканях, обладающих значительной эластичностью (кровеносные сосуды, связки, легкие). Для этих тканей характерна высокая растяжимость при нагрузке и быстрое восстановление исходной формы и размера после ее снятия.
Эластин - гликопротеин с молекулярной массой 70 000 Да, он содержит около 800 аминокислотных остатков; 70% составляют гидрофобные аминокислоты с небольшими радикалами (Гли, Вал, Ала, Лей, Про), гидроксипролина мало, гидроксилизина нет, нет также цистеина, метионина и триптофана. В отличие от большинства белков пептидные цепи эластина не приобретают характерную третичную структуру, а сохраняют гибкую случайную конформацию.
В межклеточном матриксе из молекул эластина формируются волокна, сети, слои, в которых отдельные молекулы связаны множеством сшивок. При этом образуются такие структуры, как лизиннорлейцин и десмозин.
 Образованию
этих структур предшествует посттрансляционная модификация остатков
лизина. Медьсодержащая лизилоксидаза катализирует образование радикалов
аллизина (реактивных альдегидов), которые участвуют в формировании
десмозина (см. рис. 7.4). Образованная структура похожа на пиридиновое
кольцо, очень прочное и не подвергающееся даже кислотному гидролизу.
Структура десмозина связывает между собой две, три или четыре молекулы
эластина.
Образованию
этих структур предшествует посттрансляционная модификация остатков
лизина. Медьсодержащая лизилоксидаза катализирует образование радикалов
аллизина (реактивных альдегидов), которые участвуют в формировании
десмозина (см. рис. 7.4). Образованная структура похожа на пиридиновое
кольцо, очень прочное и не подвергающееся даже кислотному гидролизу.
Структура десмозина связывает между собой две, три или четыре молекулы
эластина.
Наличие гибкой случайной конформации молекул эластина и большого количества поперечных сшивок (десмозина и норлейцина) позволяют эластическим волокнам проявлять свои резиноподобные свойства (рис. 7.8).
 Рис. 7.8. Молекулы эластина связаны ковалентными сшивками в обширную сеть
Рис. 7.8. Молекулы эластина связаны ковалентными сшивками в обширную сеть
Нарушения образования десмозина, вызванные дефектами ферментов или нарушениями всасывания меди, проявляются серьезной патологией со стороны сердца, легких, сосудов (дефекты сердечных клапанов, аневризмы аорты, варикозная болезнь, эмфизема легких).
ТЕМА 7.3. ГЕТЕРОПОЛИСАХАРИДЫ МЕЖКЛЕТОЧНОГО
МАТРИКСА
1. Гликозаминогликаны - это линейные отрицательно заряженные гетерополисахариды, которые содержат в своем составе повторяющиеся дисахаридные единицы: гексуронувую кислоту (глюкуроновую или идуроновую) и производное аминосахара (глюкозили галактозамина). Самый крупный гликозаминогликан межклеточного вещества - гиалуроновая кислота, ее молекулярная масса достигает 105-107 Да. Гиалуроновая кислота построена из глюкуроновой кислоты и N-ацетилглюкозамина. В каждом дисахариде имеется отрицательно заряженная карбоксильная группа, а поскольку таких мономеров в молекуле гиалуроновой кислоты очень много, она является полианионом. Благодаря своим полианионным свойствам, гиалуроновая кислота связывает большие количества воды, и в результате этого межклеточное вещество приобретает характер желеобразного матрикса. Гиалуроновая кислота (как и все гликозаминогликаны) способна связывать ионы Na+
и Ca2+, что определяет участие межклеточного вещества в регуляции водносолевого обмена.
Кроме гиалуроновой кислоты, к гликозаминогликанам относятся хондроитинсульфаты, дерматансульфаты, кератансульфаты, гепарин и гепарансульфаты. Все они содержат сульфатную группу, которая несет отрицательный заряд, и поэтому также являются полианионами.
2. Протеогликаны - это высокомолекулярные соединения, состоящие из белка (5%) и гликозаминогликанов (95%). Белки в разных протеогликанах представлены одной полипептидной цепью с разной молекулярной массой. К белку могут присоединяться гликозаминогликаны (кроме гиалуроновой кислоты). Они связываются с белковой молекулой ковалентными связями по ОН-группе серина, треонина или >Ш2-группе аспарагина (рис. 7.9).
 Рис. 7.9. Гликозаминогликан, связанный с ОН-группой серина корового белка
Рис. 7.9. Гликозаминогликан, связанный с ОН-группой серина корового белка
Структура и физико-химические свойства гликозаминогликанов и протеогликанов позволяют им выполнять в организме разнообразные функции, например:
• взаимодействовать со всеми структурными компонентами межклеточного матрикса;
• связывать молекулы, катионы и способствовать формированию тургора различных тканей;
• играть роль молекулярного сита, препятствовать распространению патогенных микроорганизмов;
• выполнять рессорную функцию в хрящах;
• способствовать созданию фильтрационного барьера в почках и др.
В хрящевом матриксе основной протеогликан - агрекан - присоединяется к гиалуроновой кислоте с помощью корового белка (Мм-220 кДа), имеющего три глобулярных домена: G1, G2, G3 (рис. 7.10). Между доменами G2 и G3 находятся области, в которых к нему присоединяются кератансульфаты (-30 цепей) и хондроитинсульфаты (-100 цепей). В межклеточном матриксе
 Рис. 7.10. Строение агрекана:
Рис. 7.10. Строение агрекана:
1 - хондроитинсульфат; 2 - кератансульфат; 3 - коровый белок; ГК - гиалуроновая кислота
агрекан взаимодействует с гиалуроновой кислотой и небольшим связывающим белком. Конечный агрегат с молекулярной массой более 200?106 Да состоит из одной молекулы гиалуроновой кислоты и -100 молекул агрекана (и такого же количества связывающего белка).
Больше всего протеогликанов содержится в межклеточном веществе хрящей, межпозвоночных дисков, сухожилий, связок, менисков, кожи, т.е. в тех анатомических структурах, которые подвергаются выраженной механической нагрузке и деформации. В хрящах суставных поверхностей протеогликаны выполняют рессорную функцию, т.е. смягчают и гасят резкие перемены нагрузки.
Основными протеогликанами базальных мембран являются гепарансульфатсодержащие протеогликаны (ГСПГ). Это гетерогенные молекулы, представленные в основном двумя разновидностями - с низкой плотностью и высокой плотностью. ГСПГ низкой плотности имеют большое многодоменное белковое ядро и три длинные гепарансульфатные цепи (рис. 7.11, А).
ГСПГ высокой плотности состоят из четырех коротких гепарансульфатных цепей, связанных с небольшим белковым ядром (рис. 7.11, Б).
 Рис. 7.11. Гепарансульфатсодержащие протеогликаны низкой (А) и высокой (Б)плотности
Рис. 7.11. Гепарансульфатсодержащие протеогликаны низкой (А) и высокой (Б)плотности
Одной из функций ГСПГ является создание фильтрационного барьера,
так как эти молекулы - полианионы, они препятствуют прохождению других отрицательно заряженных молекул, что имеет решающее значение при фильтрации плазмы через базальную мембрану клубочков почек.
Катаболизм гликозаминогликанов происходит при участии таких ферментов, как гиалуронидаза, глюкуронидаза, галактозидаза, сульфатаза и др. Некоторые патогенные микроорганизмы, например возбудители гнойных инфекций (стафилококки, стрептококки и др.) и газовой гангрены, выделяют гиалуронидазу, которая способствует распространению инфекционного процесса.
ТЕМА 7.4. НЕКОЛЛАГЕНОВЫЕ СТРУКТУРНЫЕ БЕЛКИ МЕЖКЛЕТОЧНОГО МАТРИКСА
Неколлагеновые структурные белки межклеточного матрикса: фибронектин, ламинин, нидоген.
1. Фибронектин - это неколлагеновый структурный гликопротеин, который синтезируется и выделяется в межклеточное пространство многими клетками. Он построен из двух полипептидных цепей, соединенных дисульфидными мостиками (рис. 7.12).
Каждая цепь фибронектина содержит 7-8 доменов, на которых расположены специфические центры для связывания многих веществ. Фибронектин может связывать коллаген, протеогликаны, гиалуроновую кислоту, углеводы плазматических мембран, фермент трансглутаминазу. Структура фибронектина позволяет ему выполнять интегрирующую роль в организации межклеточного вещества, а также способствовать адгезии клеток. Метастазирование злокачественных клеток возможно, в частности, потому, что на их поверхности снижается количество фибронектина и они менее прочно связаны между собой.
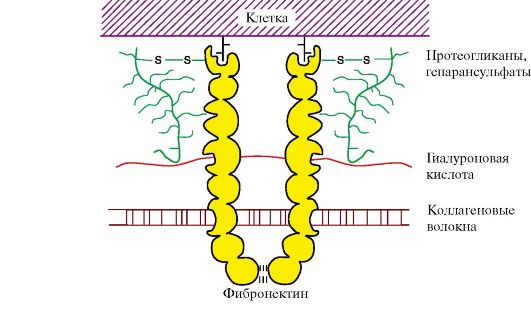 Рис. 7.12. Строение фибронектина
Рис. 7.12. Строение фибронектина
2. Ламинин - наиболее распространенный неколлагеновый гликопротеин базальных мембран. Он состоит из трех полипептидных цепей: А, В1 и В2. Молекула ламинина имеет крестообразную форму с тремя одноцепочечными ветвями и одной трехцепочечной ветвью (рис. 7.13). Каждая цепь ламинина содержит несколько глобулярных и стержневидных доменов, на которых имеются специфические центры, способные связывать различные вещества. Ламинин взаимодействует со всеми структурными компонентами базальных
 Рис. 7.13. Строение комплекса ламинин-нидоген
Рис. 7.13. Строение комплекса ламинин-нидоген
мембран, включая коллаген IV типа, нидоген, ГСПГ, фибронектин. Кроме того, молекула ламинина имеет несколько центров связывания с клетками, т.е. в базальных мембранах он выполняет функцию основного компонента, связывающего клетки с субклеточными структурами.
3. Нидоген - сульфатированный гликопротеин базальных мембран. Этот белок представлен одной полипептидной цепью, содержащей три глобулярных домена (см. рис. 7.13). Один из доменов нидогена имеет центр связывания ламинина, в области другого домена находится центр связывания коллагена IV типа. Таким образом, нидоген может выступать в качестве одного из связывающих мостов между различными компонентами межклеточного матрикса и участвовать в образовании тройных комплексов ламинин- нидоген-коллаген.
ТЕМА 7.5. СТРУКТУРНАЯ ОРГАНИЗАЦИЯ МЕЖКЛЕТОЧНОГО МАТРИКСА (СУСТАВНОЙ ХРЯЩ, БАЗАЛЬНЫЕ МЕМБРАНЫ, СУБЭПИТЕЛИАЛЬНЫЕ СЛОИ)
Межклеточный матрикс образует такие высокоспециализированные структуры, как хрящ, сухожилия, базальные мембраны, кости и зубы. Эти структуры различаются между собой как по молекулярному составу, так и по способам организации основных компонентов (белков и полисахаридов) в различных формах межклеточного матрикса.
1. Организация межклеточного матрикса в суставном хряще. Основные компоненты межклеточного хрящевого матрикса - коллаген II типа, агрекан, гиалуроновая кислота и вода. Кроме них в матриксе находятся малые протеогликаны, коллагены VI, IX, XI типов, связывающий белок, другие неколлагеновые белки (фибронектин, анкорин, хрящевой олигомерный белок, хондроадгерин), разнообразные ростовые факторы. «Эндоскелет» хрящевого матрикса образован фибриллярной сетью, которая состоит из коллагенов II, IX и XI типов и придает хрящу прочность.
Высокомолекулярные агрегаты, состоящие из агрекана и гиалуроновой кислоты и входящие в состав хряща, являются полианионами, так как содержат большое количество кислых групп. Это способствует высокой гидратации хрящевого матрикса и обеспечивает выполнение им рессорных функций. Содержание воды в суставном хряще непостоянно: при нагрузке жидкость вытесняется, пока давление набухания не уравновесит внешнюю нагрузку. Когда нагрузка прекращается, вода вновь возвращается в хрящ (рис. 7.14). Очень наглядно это проявляется в межпозвоночных дисках. Утром, после ночного сна, на долю воды приходится около 75% массы диска. При внешней нагрузке на диски в течение дня содержание воды уменьшается примерно на 20%. Вследствие этого рост человека к вечеру на 1-2 см меньше, чем утром. У космонавтов в условиях невесомости отмечается увеличение роста даже на 5 см.
 Рис. 7.14. Изменения, происходящие в суставном хряще при его сжатии и при снятии нагрузки
Рис. 7.14. Изменения, происходящие в суставном хряще при его сжатии и при снятии нагрузки
2. Базальные мембраны - это специализированная форма межклеточного матрикса. Они синтезируются различными клетками: эндотелиальными, эпителиальными, мышечными, нервными, жировыми. Базальные мембраны представляют собой тонкие слои, которые обычно отделяют клетки и клеточные слои от окружающей соединительной ткани. Например, они окружают отдельные мышечные волокна, жировые и шванновские клетки. А в таких структурах, как почечные клубочки и легочные альвеолы, базальные мембраны расположены между двумя различными слоями клеток и играют роль высокоселективного фильтрационного барьера.
С помощью электронной микроскопии выявлена двухслойная структура базальных мембран: 1) lamina rara, которая находится со стороны клеточной мембраны и 2) lamina densa, которая соединена с подлежащей соединительной тканью (рис. 7.15). Основными компонентами базальных мембран являются коллаген IV типа, ламинин, гепарансульфатсодержащие протеогликаны (ГСПГ).
Нерастворимость и механическую стабильность базальных мембран обеспечивают молекулы коллагена IV типа, которые организуются в специальную опорную сеть. Эта эластичная трехмерная сеть образует структурный остов, к которому прикрепляются другие компоненты базальных мембран: ламинин, нидоген, ГСПГ.
Базальные мембраны выполняют разнообразные и сложные функции. В почечных канальцах базальная мембрана служит полупроницаемым фильтром, препятствующим переходу макромолеул из плазмы в первичную мочу. Большую роль в этом процессе играет высокий отрицательный заряд протеогликанов, который препятствует прохождению через базальную мембрану других отрицательно заряженных молекул (например, белков), а также отрицательно заряженных эритроцитов. Базальные мембраны играют также важную роль в прикреплении и ориентации клеток, в процессах эмбрионального развития и тканевой регенерации.
 Рис. 7.15. Строение типичной базальной мембраны
Рис. 7.15. Строение типичной базальной мембраны
3. Организация межклеточного вещества в субэпителиальных слоях. Основным организующим компонентом является коллаген VII типа. Пучки фибрилл, образованные димерами этого коллагена, своими С-концами могут присоединяться к lamina densa базальной мембраны (как бы «заякориваться» в ней) и образовывать петли в субэпидермисе. Такие «заякоренные» фибриллы могут соединять lamina densa базальной мембраны с «якорными дисками», которые находятся в более глубоких субэпителиальных слоях и по своему составу похожи на базальные мембраны (содержат коллаген IV типа). «Заякоренные» фибриллы также связываются с фибриллами коллагена I и III типов (рис. 7.16) и обеспечивают присоединение эпидермиса к дерме.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Известно, что коллагеновое волокно отличается очень высокой прочностью: волокно диаметром в 1 мм выдерживает нагрузку в 10 кг. Объясните, какие особенности первичной структуры и конформации коллагена обеспечивают такую прочность.
2. Выпишите по порядку этапы посттрансляционных изменений в молекуле коллагена: укажите ферменты, кофермент, объясните их роль в формировании коллагенового волокна.
 Рис. 7.16. Организация «заякоренных» фибрилл в субэпителиальных слоях
Рис. 7.16. Организация «заякоренных» фибрилл в субэпителиальных слоях
3. Напишите схему реакции, катализируемой коллагеназой. Укажите регуляторные факторы, стимулирующие экспрессию гена этого фермента. Объясните, почему в норме коллагеназа малоактивна.
4. Эластин находится в эластических волокнах тканей, которые способны к обратимому растяжению (стенки кровеносных сосудов, легкие, связки, кожа). Объясните, как структура эластина обеспечивает резиноподобные свойства этих тканей.
5. Изобразите строение межцепочечных структур (лизиннорлейцин и десмозин), назовите аминокислотные остатки, принимающие участие в их формировании; укажите фермент, кофактор.
6. Вспомните структурные формулы дисахаридов, из которых построены основные гликозаминогликаны. Заполните следующую таблицу:
Гликозаминогликан | Мономерные звенья | Структурная формула дисахарида | |
Гексуроновая кислота | Гексозамин | ||
1. Гиалуроновая кислота | |||
2. Хондроитинсульфат | |||
3. Кератансульфат | |||
4. Дерматансульфат | |||
5. Гепарансульфат | |||
7. Перенесите в тетрадь рис. 7.10 и выполните задания:
а) Установите соответствие. Структурный элемент межклеточного
матрикса:
1. Гликозаминогликан, построенный из глюкуроновой кислоты и N-ацетилглюкозамина
2. Цепи хондроитинсульфата
3. Белок, взаимодействующий с ГАГ и коровым белком
б) Запишите строение и основные функции протеогликанов, объясните, почему рост человека утром отличается от его роста вечером
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильный ответ. Для полипептидных цепей коллагена
характерны последовательности аминокислот:
A. -Цис-Лей-Три- Б. -Лиз-Арг-Про-
B. -Гли-Оксипро-Про- Г. -Оксипро-Глу-Асп- Д. -Мет-Гис-Про-
2. Выберите правильный ответ.
В образовании десмозина участвует:
A. Оксипролин Б. Метионин
B. Аргинин Г. Лизин
Д. Тирозин
3. Выберите правильный ответ.
В состав протеогликанов базальных мембран входят:
А. Гиалуроновая кислота Б. Хондроитинсульфаты В Кератансульфаты Г. Гепарансульфаты Д. Дерматансульфаты
 4. Выберите правильные ответы. Прочность коллагенового волокна обусловлена:
4. Выберите правильные ответы. Прочность коллагенового волокна обусловлена:
A. Смещением молекул тропоколлагена на 1/4 относительно друг друга
Б. Образованием водородных связей между отдельными полипептидными цепями коллагена
B. Образованием ковалентных связей между цепями коллагена (Лиз-Лиз) Г. Образованием S-S-связей между цепями коллагена
Д. Наличием большого количества «жестких» молекул
5. Выберите правильные ответы. Гиалуроновая кислота:
A. Является протеогликаном
Б. Состоит из повторяющихся дисахаридных единиц
B. Может связывать большие количества воды
Г. Расщепляется под действием гиалуронидазы, которая содержится во
многих патогенных микроорганизмах Д. Имеет суммарный заряд «+»
6. Выберите правильные ответы. Десмозин:
A. Образован аминокислотными остатками четырех полипептидных цепей
Б. Определяет способность эластина к растяжению и сжатию
B. Содержит остатки реактивного альдегида
Г. При недостатке Cu2+, РР нарушается формирование этой структуры Д. В структуру входят остатки гидроксипролина
7. Установите соответствие:
А. Коллаген Б. Эластин
8. Фибронектин Г. Ламинин
Д. Нидоген
1. Не имеет характерной конформации
2. Состоит из двух полипептидных цепей, соединенных дисульфидными связями
3. Основной компонент межклеточного матрикса хрящей, костей, сухожилий
8. Установите соответствие. Фермент:
A. Пролилгидроксилаза Б. Коллагеназа
B. Эластаза
Г. Лизилоксидаза
Д. Гликозилтрансфераза
Кофактор:
1. Fe2+
2. Cu2+
3. Zn2+
9. Установите правильную последовательность событий. В ходе биосинтеза коллагена происходит:
A. Гидроксилирование Про и Лиз Б. Образование проколлагена
B. Гликозилирование
Г. Отщепление концевых пропептидов
Д. Синтез пептидных цепей препроколлагена
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. В
2. Г
3. Г
4. А, Б, В, Д
5. Б; В; Г
6. А, Б, В, Г
7. 1-Б, 2-В, 3-А
8. 1-А, 2-Г, 3-Б
9. Д→А→В→Б→Г
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Межклеточный матрикс
2. Коллаген
3. Эластин
4. Гликозаминогликаны
5. Протеогликаны
6. Витамин С
7. Коллагеназа
8. Фибронектин
9. Ламинин
10. Соединительная ткань
11. Базальные мембраны
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
1. Синдром Элерса-Данлоса тип VIII: малый рост, деформация суставов, искривление позвоночника. Причина заболевания - дефект ферментов проколлагенпептидаз. Нарушение каких этапов синтеза коллагена наблюдается при этом заболевании и приводит к указанным клиническим проявлениям?
Для ответа на вопрос:
а) укажите особенности строения коллагена, назовите основные этапы его синтеза и созревания;
б) укажите что такое проколлаген, изобразите его строение;
в) представьте схему действия проколлагенпептидаз, назовите образующийся продукт и его функции в организме.
2. Клинические проявления цинги - кровоизлияния под кожу и слизистые оболочки, кровоточивость десен, выпадение зубов, анемия. С недостатком какого витамина связано это заболевание и к нарушению какого процесса оно приводит?
Для ответа на вопрос:
а) назовите этот витамин, объясните, почему он хорошо всасывается в верхних отделах кишечника;
б) вспомните, в синтезе какого белка участвует этот витамин, опишите строение этого белка;
в) напишите реакцию, в которой участвует данный витамин, объясните его функцию, назовите фермент; укажите вещества, необходимые для протекания этой реакции.
3. α-Цепь коллагена содержит много остатков глицина. Мутации, в результате которых глицин заменяется на какую-либо другую аминокислоту, приводят к серьезным последствиям: ломкости костей, аномалиям зубов, гиперподвижности суставов и т.д. Почему это происходит? Для ответа на вопрос:
а) укажите аминокислотный состав коллагена; объясните, какое значение это имеет для формирования структуры коллагена;
б) назовите особенности первичной структуры коллагена и его основную посттрансляционную модификацию; напишите реакцию, укажите фермент и кофермент;
в) объясните, какое значение имеют остатки глицина для образования нормальной молекулы тропоколлагена.
4. Системная склеродермия - заболевание, при котором активируется синтез коллагена, развивается фиброз кожи и внутренних органов. Какой метаболит свидетельствует об интенсивности обмена коллагена и как он изменяется при этом заболевании?
Для ответа на вопрос:
а) вспомните особенности катаболизма коллагена, основной продукт, который появляется в крови и моче;
б) назовите ферменты катаболизма коллагена, их основные типы;
в) объясните, почему для лечения этого заболевания применяют стероидные гормоны.
5. Многие патогенные микроорганизмы (возбудители гнойных инфекций, газовой гангрены) содержат фермент гиалуронидазу, которая способствует внедрению этих микроорганизмов в ткани, а также возникновению и распространению патологического процесса. Почему это происходит?
Для ответа на вопрос:
а) назовите субстрат гиалуронидазы, опишите его строение;
б) укажите, к какому классу веществ он относится и какую роль играет в структурной организации и функционировании межклеточного матрикса;
в) объясните, какую роль играет гиалуронидаза в распространении патологического инфекционного процесса.
6. Одним из факторов, обусловливающих метастазирование клеток злокачественных опухолей, является снижение количества одного из структурных белков межклеточного матрикса на поверхности клеток. Почему при недостаточности этого белка между клетками злокачественной ткани резко ослаблена адгезия? Для ответа на вопрос:
а) назовите этот белок, укажите особенности его строения;
б) вспомните структурные компоненты межклеточного матрикса, которые могут присоединяться к этому белку, укажите роль этих компонентов в организации межклеточного матрикса.