Биологическая химия с упражнениями и задачами : учебник / под ред. чл.-корр. РАМН С.Е. Северина. - 2011. - 624 с.: ил.
|
|
|
|
МОДУЛЬ 4 СТРОЕНИЕ И ФУНКЦИИ БИОЛОГИЧЕСКИХ МЕМБРАН
_Темы_
4.1. Общая характеристика мембран. Строение и состав мембран
4.2. Транспорт веществ через мембраны
4.3. Трансмембранная передача сигналов_
Цели изучения Уметь:
1. Интерпретировать роль мембран в регуляции метаболизма, транспорте веществ в клетку и удалении метаболитов.
2. Объяснять молекулярные механизмы действия гормонов и других сигнальных молекул на органы-мишени.
Знать:
1. Строение биологических мембран и их роль в обмене веществ и энергии.
2. Основные способы переноса веществ через мембраны.
3. Главные компоненты и этапы трансмембранной передачи сигналов гормонов, медиаторов, цитокинов, эйкозаноидов.
ТЕМА 4.1. ОБЩАЯ ХАРАКТЕРИСТИКА МЕМБРАН.
СТРОЕНИЕ И СОСТАВ МЕМБРАН
Все клетки и внутриклеточные органеллы окружены мембранами, которые играют важную роль в их структурной организации и функционировании. Основные принципы построения всех мембран одинаковы. Однако плазматическая мембрана, а также мембраны эндоплазматического ретикулума, аппарата Гольджи, митохондрий и ядра имеют существенные структурные особенности, они уникальны по своему составу и по характеру выполняемых функций.
Мембраны:
• отделяют клетки от окружающей среды и делят ее на компартменты (отсеки);
• регулируют транспорт веществ в клетки и органеллы и в обратном направлении;
• обеспечивают специфику межклеточных контактов;
• воспринимают сигналы из внешней среды.
Согласованное функционирование мембранных систем, включающих рецепторы, ферменты, транспортные системы, помогает поддерживать гомеостаз клетки и быстро реагировать на изменения состояния внешней среды путем регуляции метаболизма внутри клеток.
Биологические мембраны построены из липидов и белков, связанных друг с другом с помощью нековалентных взаимодействий. Основу мембраны составляет двойной липидный слой, в состав которого включены белковые молекулы (рис. 4.1). Липидный бислой образован двумя рядами амфифильных молекул, гидрофобные «хвосты» которых спрятаны внутрь, а гидрофильные группы - полярные «головки» обращены наружу и контактируют с водной средой.
1. Липиды мембран. В состав липидов мембран входят как насыщенные, так и ненасыщенные жирные кислоты. Ненасыщенные жирные кислоты встречаются в два раза чаще чем насыщенные, что определяет текучесть мембран и конформационную лабильность мембранных белков.
В мембранах присутствуют липиды трех главных типов - фосфолипиды, гликолипиды и холестерол (рис. 4.2 - 4.4). Чаще всего встречаются глицерофосфолипиды - производные фосфатидной кислоты.
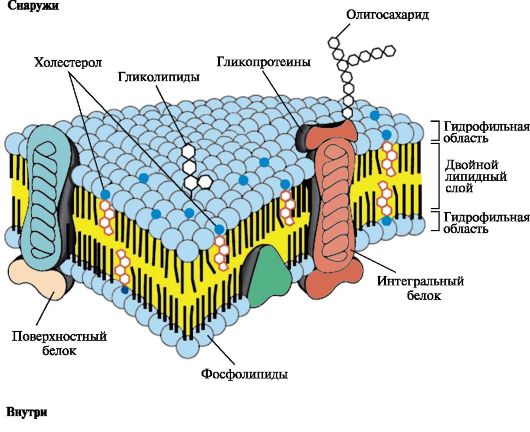 Рис. 4.1. Поперечный разрез плазматической мембраны
Рис. 4.1. Поперечный разрез плазматической мембраны
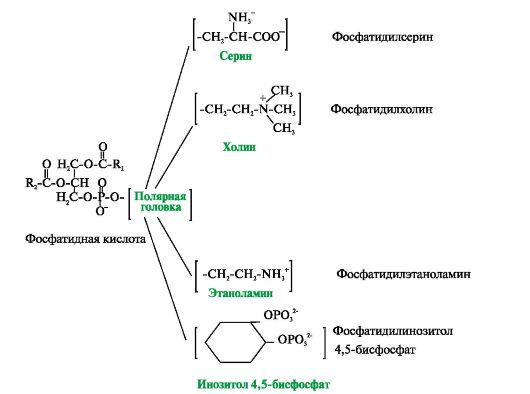 Рис. 4.2. Глицерофосфолипиды.
Рис. 4.2. Глицерофосфолипиды.
Фосфатидная кислота - это диацилглицеролфосфат. R1, R2 - радикалы жирных кислот (гидрофобные «хвосты»). Со вторым углеродным атомом глицерола связан остаток полиненасыщенной жирной кислоты. Полярной «головкой» является остаток фосфорной кислоты и присоединенная к нему гидрофильная группа серина, холина, этаноламина или инозитола
Существуют также липиды - производные аминоспирта сфингозина.
Аминоспирт сфингозин при ацилировании, т.е. присоединении жирной кислоты к NH2-группе, превращается в церамид. Церамиды различаются по остатку жирной кислоты. С ОН-группой церамида могут быть связаны разные полярные группы. В зависимости от строения полярной «головки» эти производные разделены на две группы - фосфолипиды и гликолипиды. Строение полярной группы сфингофосфолипидов (сфингомиелинов) сходно с глицерофосфолипидами. Много сфингомиелинов содержится в составе миелиновых оболочек нервных волокон. Гликолипиды представляют собой углеводные производные церамида. В зависимости от строения углеводной составляющей различают цереброзиды и ганглиозиды.
Холестерол содержится в мембранах всех животных клеток, он придает мембранам жесткость и снижает их жидкостность (текучесть). Молекула холестерола располагается в гидрофобной зоне мембраны параллельно гидрофобным «хвостам» молекул фосфо- и гликолипидов. Гидроксильная группа холестерола, как и гидрофильные «головки» фосфо- и гликолипидов,
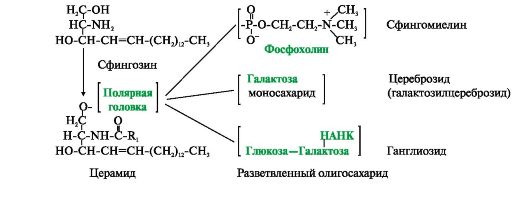 Рис. 4.3. Производные аминоспирта сфингозина.
Рис. 4.3. Производные аминоспирта сфингозина.
Церамид - ацилированный сфингозин (R1 - радикал жирной кислоты). К фосфолипидам относятся сфингомиелины, у которых полярная группа состоит из остатка фосфорной кислоты и холина, этаноламина или серина. Гидрофильной группой (полярной «головкой») гликолипидов является углеводный остаток. Цереброзиды содержат моноили олигосахаридный остаток линейного строения. В состав ганглиозидов входит разветвленный олигосахарид, одним из мономерных звеньев которого является НАНК - N-ацетилнейраминовая кислота
обращена к водной фазе. Молярное соотношение холестерола и других липидов в мембранах равно 0,3-0,9. Самое высокое значение имеет эта величина для цитоплазматической мембраны.
Увеличение содержания холестерола в мембранах уменьшает подвижность цепей жирных кислот, что влияет на конформационную лабильность мембранных белков и снижает возможность их латеральной диффузии. При повышении текучести мембран, вызванном действием на них липофильных веществ или перекисным окислением липидов, доля холестерола в мембранах возрастает.
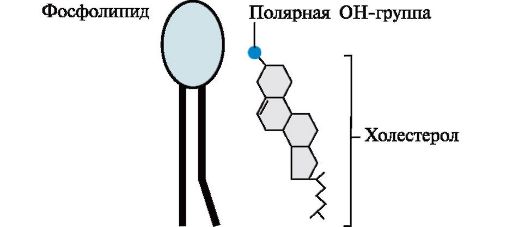 Рис. 4.4. Положение в мембране фосфолипидов и холестерола.
Рис. 4.4. Положение в мембране фосфолипидов и холестерола.
Молекула холестерола состоит из жесткого гидрофобного ядра и гибкой углеводородной цепи. Полярной «головкой» является ОН-группа у 3-го углеродного атома молекулы холестерола. Для сравнения на рисунке представлено схематическое изображение фосфолипида мембран. Полярная головка этих молекул значительно больше и имеет заряд
Липидный состав мембран различен, содержание того или другого липида, по-видимому, определяется разнообразием функций, которые выполняют эти молекулы в мембранах.
Главные функции липидов мембран состоят в том, что они:
• формируют липидный бислой - структурную основу мембран;
• обеспечивают необходимую для функционирования мембранных белков среду;
• участвуют в регуляции активности ферментов;
• служат «якорем» для поверхностных белков;
• участвуют в передаче гормональных сигналов.
Изменение структуры липидного бислоя может привести к нарушению функций мембран.
2. Белки мембран. Белки мембран различаются по своему положению в мембране (рис. 4.5). Мембранные белки, контактирующие с гидрофобной областью липидного бислоя, должны быть амфифильными, т.е. иметь неполярный домен. Амфифильность достигается благодаря тому, что:
• аминокислотные остатки, контактирующие с липидным бислоем, в основном неполярны;
• многие мембранные белки ковалентно связаны с остатками жирных кислот (ацилированы).
Ацильные остатки жирных кислот, присоединенные к белку, обеспечивают его «заякоревание» в мембране и возможность латеральной диффузии. Кроме того, белки мембран подвергаются таким посттрансляционным модификациям, как гликозилирование и фосфорилирование. Гликозилирование наружной поверхности интегральных белков защищает их от повреждения протеазами межклеточного пространства.
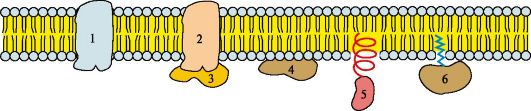 Рис. 4.5. Белки мембран:
Рис. 4.5. Белки мембран:
1, 2 - интегральные (трансмембранные) белки; 3, 4, 5, 6 - поверхностные белки. В интегральных белках часть полипептидной цепи погружена в липидный слой. Те участки белка, которые взаимодействуют с углеводородными цепями жирных кислот, содержат преимущественно неполярные аминокислоты. Участки белка, находящиеся в области полярных «головок», обогащены гидрофильными аминокислотными остатками. Поверхностные белки разными способами прикрепляются к мембране: 3 - связанные с интегральными белками; 4 - присоединенные к полярным «головкам» липидного слоя; 5 - «заякоренные» в мембране с помощью короткого гидрофобного концевого домена; 6 - «заякоренные» в мембране с помощью ковалентно связанного ацильного остатка
Наружный и внутренний слои одной и той же мембраны различаются по составу липидов и белков. Эта особенность в строении мембран называется трансмембранней асимметрией.
Белки мембран могут участвовать в:
• избирательном транспорте веществ в клетку и из клетки;
• передаче гормональных сигналов;
• образовании «окаймленных ямок», участвующих в эндоцитозе и экзоцитозе;
• иммунологических реакциях;
• качестве ферментов в превращениях веществ;
• организации межклеточных контактов, обеспечивающих образование тканей и органов.
ТЕМА 4.2. ТРАНСПОРТ ВЕЩЕСТВ ЧЕРЕЗ МЕМБРАНЫ
Одна из главных функций мембран - регуляция переноса веществ в клетку и из клетки, удержание веществ, которые нужны клетке и выведение ненужных. Транспорт ионов, органических молекул через мембраны может проходить по градиенту концентрации - пассивный транспорт и против градиента концентрации - активный транспорт.
1. Пассивный транспорт может осуществляться следующими способами (рис. 4.6, 4.7):
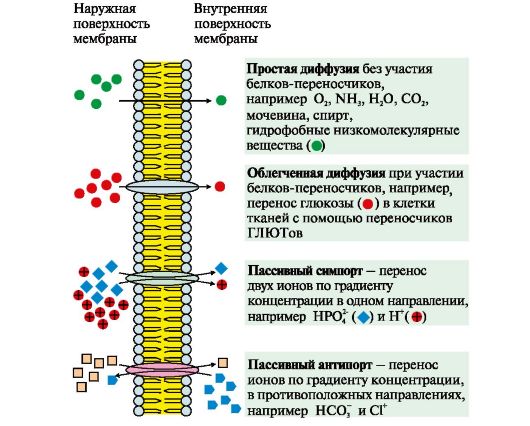 Рис. 4.6. Механизмы переноса веществ через мембраны по градиенту концентрации
Рис. 4.6. Механизмы переноса веществ через мембраны по градиенту концентрации
К пассивному транспорту относится диффузия ионов по белковым каналам, например диффузия Н+, Са2+, N+, К+. Функционирование большинства каналов регулируется специфическими лигандами или изменением трансмембранного потенциала.
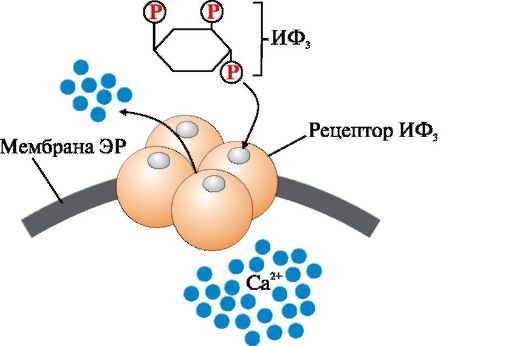 Рис. 4.7. Са2+-канал мембраны эндоплазматического ретикулума, регулируемый инози- тол-1,4,5-трифосфатом (ИФ3).
Рис. 4.7. Са2+-канал мембраны эндоплазматического ретикулума, регулируемый инози- тол-1,4,5-трифосфатом (ИФ3).
ИФ3 (инозитол-1,4,5-трифосфат) образуется при гидролизе мембранного липида ФИФ2 (фосфатидилинозитол-4,5-бисфосфата) под действием фермента фосфолипазы С. ИФ3 связывается специфическими центрами протомеров Са2+- канала мембраны эндоплазматического ретикулума. Изменяется конформация белка и канал открывается - Са2+ поступает в цитозоль клетки по градиенту концентрации
2. Активный транспорт. Первично-активный транспорт происходит против градиента концентрации с затратой энергии АТФ при участии транспортных АТФаз, например Na+, К+-АТФаза, Н+-АТФаза, Са2+-АТФаза (рис. 4.8). Н+-АТФазы функционируют как протонные насосы, с помощью которых создается кислая среда в лизосомах клетки. С помощью Са2+-АТФазы цитоплазматической мембраны и мембраны эндоплазматического ретикулума поддерживается низкая концентрация кальция в цитозоле клетки и создается внутриклеточное депо Са2+ в митохондриях и эндоплазматическом ретикулуме.
Вторично-активный транспорт происходит за счет градиента концентрации одного из переносимых веществ (рис. 4.9), который создается чаще всего Na+, К+-АТФазой, функционирующей с затратой АТФ.
Присоединение в активный центр белка-переносчика вещества, концентрация которого выше, изменяет его конформацию и увеличивает сродство к соединению, которое проходит в клетку против градиента концентрации. Вторично-активный транспорт бывает двух типов: активный симпорт и антипорт.
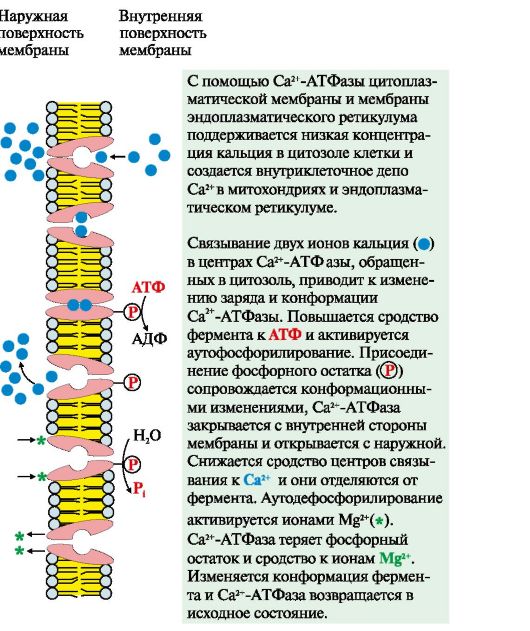 Рис. 4.8. Механизм функционирования Са2+-АТФазы
Рис. 4.8. Механизм функционирования Са2+-АТФазы
 Рис. 4.9. Вторично-активный транспорт
Рис. 4.9. Вторично-активный транспорт
3. Перенос макромолекул и частиц с участием мембран - эндоцитоз и экзоцитоз.
Перенос из внеклеточной среды в клетку макромолекул, например белков, нуклеиновых кислот, полисахаридов или еще более крупных частиц, происходит путем эндоцитоза. Связывание веществ или высокомолекулярных комплексов происходит в определенных участках плазматической мембраны, которые называются окаймленными ямками. Эндоцитоз, происходящий с участием рецепторов, встроенных в окаймленные ямки, позволяет клеткам поглощать специфические вещества и называется рецептор-зависимым эндоцитозом.
Макромолекулы, например пептидные гормоны, пищеварительные ферменты, белки внеклеточного матрикса, липопротеиновые комплексы, секретируются в кровь или межклеточное пространство путем экзоцитоза. Этот способ транспорта позволяет выводить из клетки вещества, которые накапливаются в секреторных гранулах. В большинстве случаев экзоцитоз регулируется путем изменения концентрации ионов кальция в цитоплазме клеток.
ТЕМА 4.3. ТРАНСМЕМБРАННАЯ ПЕРЕДАЧА СИГНАЛОВ
Важное свойство мембран - способность воспринимать и передавать внутрь клетки сигналы из окружающей среды. Восприятие клетками внешних сигналов происходит при их взаимодействии с рецепторами, расположенными в мембране клеток-мишеней. Рецепторы, присоединяя сигнальную молекулу, активируют внутриклеточные пути передачи информации, это приводит к изменению скорости различных метаболических процессов.
1. Сигнальная молекула, специфически взаимодействующая с мембранным рецептором, называется первичным мессенджером. В качестве первичных мессенджеров выступают различные химические соединения - гормоны, нейромедиаторы, эйкозаноиды, ростовые факторы или физические факторы, например квант света. Рецепторы клеточной мембраны, активированные первичными мессенджерами, передают полученную информацию системе белков и ферментов, которые образуют каскад передачи сигнала, обеспечивающий усиление сигнала в несколько сот раз. Время ответа клетки, заключающееся в активации или инактивации метаболических процессов, мышечного сокращения, транспорта веществ из клеток-мишеней, может составлять несколько минут.
Мембранные рецепторы подразделяются на:
• рецепторы, содержащие субъединицу, связывающую первичный мессенджер, и ионный канал;
• рецепторы, способные проявлять каталитическую активность;
• рецепторы, с помощью G-белков активирующие образование вторичных (внутриклеточных) мессенджеров, передающих сигнал специфическим белкам и ферментам цитозоля (рис. 4.10).
Вторичные мессенджеры имеют небольшую молекулярную массу, с высокой скоростью диффундируют в цитозоле клетки, изменяют активность соответствующих белков, а затем быстро расщепляются или удаляются из цитозоля.
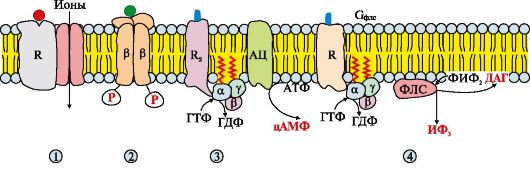 Рис. 4.10. Рецепторы, локализованные в мембране.
Рис. 4.10. Рецепторы, локализованные в мембране.
Мембранные рецепторы можно разделить на три группы. Рецепторы: 1 - содержащие субъединицу, связывающую сигнальную молекулу и ионный канал, например рецептор ацетилхолина на постсинаптической мембране; 2 - проявляющие каталитическую активность после присоединения сигнальной молекулы, например рецептор инсулина; 3, 4 - передающие сигнал на фермент аденилатциклазу (АЦ) или фосфолипазу С (ФЛС) при участии мембранных G-белков, например разные типы рецепторов адреналина, ацетилхолина и других сигнальных молекул
Роль вторичных мессенджеров выполняют молекулы и ионы:
• цАМФ (циклический аденозин-3',5'-монофосфат);
• цГМФ (циклический гуанозин-3',5'-монофосфат);
• ИФ3 (инозитол-1,4,5-трифосфат);
• ДАГ (диацилглицерол);
• Са2+.
Существуют гормоны (стероидные и тиреоидные), которые, проходя липидный бислой, проникают в клетку и взаимодействуют с внутриклеточными рецепторами. Физиологически важным различием между мембранными и внутриклеточными рецепторами является скорость ответа на поступающий сигнал. В первом случае эффект будет быстрым и непродолжительным, во втором - медленным, но длительным.
Рецепторы, сопряженные с G-белками
Взаимодействие гормонов с рецепторами, сопряженными с G-белками, приводит к активации инозитолфосфатной системы трансдукции сигнала или изменению активности аденилатциклазной регуляторной системы.
2. Аденилатциклазная система включает (рис. 4.11):
- интегральные белки цитоплазматической мембраны:
• Rs - рецептор первичного мессенджера - активатора аденилатциклазной системы (АЦС);
• R; - рецептор первичного мессенджера - ингибитора АЦС;
• фермент аденилатциклазу (АЦ).
- «заякоренные» белки:
• Gs - ГТФ-связывающий белок, состоящий из α,,βγ-субъединиц, в котором (α,-субъединица связана с молекулой ГДФ;
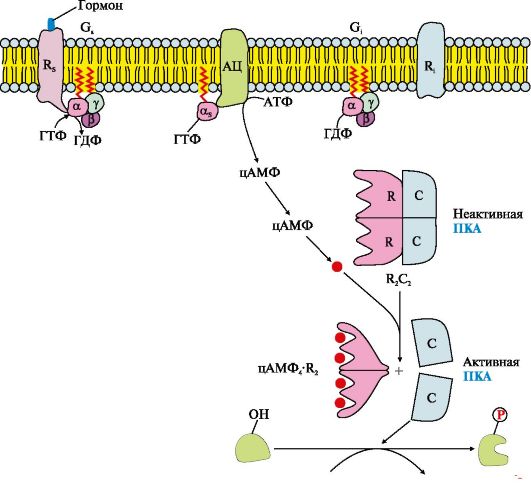
Рис. 4.11. Функционирование аденилатциклазной системы
• G; - ГТФ-связывающий белок, состоящий из αβγ-субъединиц, в котором а;-субъединица связана с молекулой ГДФ; - цитозольный фермент протеинкиназу А (ПКА).
Последовательность событий передачи сигнала первичных мессенджеров с помощью аденилатциклазной системы
Рецептор имеет центры связывания первичного мессенджера на наружной поверхности мембраны и G-белка (α,,βγ-ГДФ) на внутренней поверхности мембраны. Взаимодействие активатора аденилатциклазной системы, например гормона с рецептором (Rs), приводит к изменению конформации рецептора. Увеличивается сродство рецептора к G..-белку. Присоединение комплекса гормон-рецептор к GS-ГДФ снижает сродство α,,-субъединицы G..-белка к ГДФ и увеличивает сродство к ГТФ. В активном центре α,,-субъединицы ГДФ замещается на ГТФ. Это вызывает изменение конформации субъединицы α,, и снижение ее сродства к субъединицам βγ. Отделившаяся субъединица α,,-ГТФ латерально перемещается в липидном слое мембраны к ферменту аденилатциклазе.
Взаимодействие α,,-ГТФ с регуляторным центром аденилатциклазы изменяет конформацию фермента, приводит к его активации и увеличению скорости образования вторичного мессенджера - циклического аденозин- 3',5'-монофосфата (цАМФ) из АТФ. В клетке повышается концентрация цАМФ. Молекулы цАМФ могут обратимо соединяться с регуляторными субъединицами протеинкиназы А (ПКА), которая состоит из двух регуляторных (R) и двух каталитических (С) субъединиц - (R2С2). Комплекс R2С2 ферментативной активностью не обладает. Присоединение цАМФ к регуляторным субъединицам вызывает изменение их конформации и потерю комплементарности к С-субъединицам. Каталитические субъединицы приобретают ферментативную активность.
Активная протеинкиназа А с помощью АТФ фосфорилирует специфические белки по остаткам серина и треонина. Фосфорилирование белков и ферментов повышает или понижает их активность, поэтому изменяется скорость метаболических процессов, в которых они участвуют.
Активация сигнальной молекулой рецептора R стимулирует функционирование Gj-белка, которое протекает по тем же правилам, что и для G..-белка. Но при взаимодействии субъединицы αi-ГТФ с аденилатциклазой активность фермента снижается.
Инактивация аденилатциклазы и протеинкиназы А
α,,-Субъединица в комплексе с ГТФ при взаимодействии с аденилатциклазой начинает проявлять ферментативную (ГТФ-фосфатазную) активность, она гидролизует ГТФ. Образующаяся молекула ГДФ остается в активном центре α,,-субъединицы, изменяет ее конформацию и уменьшает сродство к АЦ. Комплекс АЦ и α,,-ГДФ диссоциирует, α,,-ГДФ включается в G..-белок. Отделение α,,-ГДФ от аденилатциклазы инактивирует фермент и синтез цАМФ прекращается.
Фосфодиэстераза - «заякоренный» фермент цитоплазматической мембраны гидролизует образовавшиеся ранее молекулы цАМФ до АМФ. Снижение концентрации цАМФ в клетке вызывает расщепление комплекса цАМФ4К"2 и повышает сродство R- и С-субъединиц, образуется неактивная форма ПКА.
Фосфорилированные ферменты и белки под действием фосфопротеинфосфатазы переходят в дефосфорилированную форму, изменяется их конформация, активность и скорость процессов, в которых участвуют эти ферменты. В результате система приходит в исходное состояние и готова вновь активироваться при взаимодействии гормона с рецептором. Таким образом, обеспечивается соответствие содержания гормона в крови и интенсивности ответа клеток-мишеней.
3. Участие аденилатциклазной системы в регуляции экспрессии генов. Многие белковые гормоны: глюкагон, вазопрессин, паратгормон и др., передающие свой сигнал посредством аденилатциклазной системы, могут не только вызвать изменение скорости реакций путем фосфорилирования уже имеющихся в клетке ферментов, но и увеличивать или уменьшать их количество, регулируя экспрессию генов (рис. 4.12). Активная протеинкиназа А может проходить в ядро и фосфорилировать фактор транскрипции (СRЕВ). Присоединение фосфорного
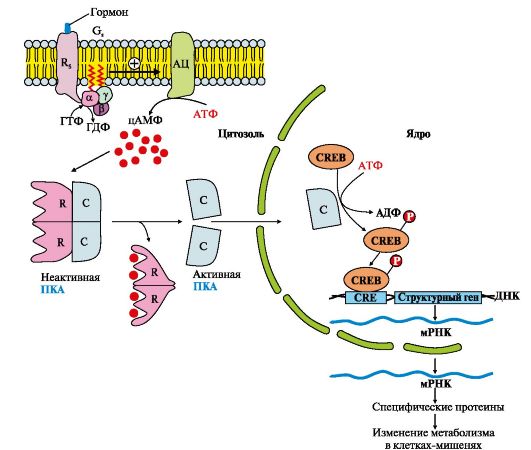 Рис. 4.12. Аденилатциклазный путь, приводящий к экспрессии специфических генов
Рис. 4.12. Аденилатциклазный путь, приводящий к экспрессии специфических генов
остатка повышает сродство фактора транскрипции (СRЕВ-(Р) к специфиче-ской последовательности регуляторной зоны ДНК-СRЕ (цАМФ-response element) и стимулирует экспрессию генов определенных белков.
Синтезированные белки могут быть ферментами, увеличение количества которых повышает скорость реакций метаболических процессов, или мембранными переносчиками, обеспечивающими поступление или выход из клетки определенных ионов, воды или других веществ.

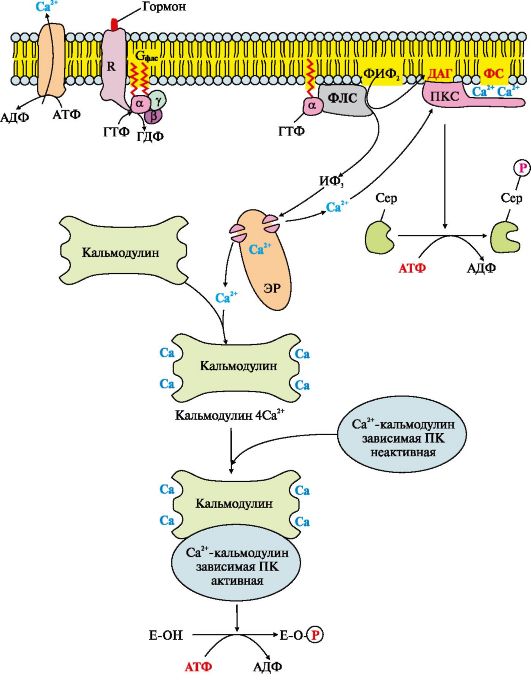 Рис. 4.13. Инозитолфосфатная система
Рис. 4.13. Инозитолфосфатная система
Работу системы обеспечивают белки: кальмодулин, фермент протеинкиназа С, Са2+-кальмодулин-зависимые протеинкиназы, регулируемые Са2+-каналы мембраны эндоплазматического ретикулума, Са2+-АТФазы клеточной и митохондриальной мембран.
Последовательность событий передачи сигнала первичных мессенджеров с помощью инозитолфосфатной системы
Связывание активатора инозитолфосфатной системы с рецептором (R) приводит к изменению его конформации. Повышается сродство рецептора к Gфлс-белку. Присоединение комплекса первичный мессенджер-рецептор к Gфлс-ГДФ снижает сродство афлс-субъединицы к ГДФ и увеличивает сродство к ГТФ. В активном центре афлс-субъединицы ГДФ замещается на ГТФ. Это вызывает изменение конформации субъединицы афлс и снижение сродства к субъединицам βγ, происходит диссоциация Gфлс-белка. Отделившаяся субъединица афлс-ГТФ латерально перемещается по мембране к ферменту фосфолипазе С.
Взаимодействие афлс-ГТФ с центром связывания фосфолипазы С изменяет конформацию и активность фермента, возрастает скорость гидролиза фосфолипида клеточной мембраны - фосфатидилинозитол-4,5-бисфосфа- та (ФИФ2) (рис. 4.14).
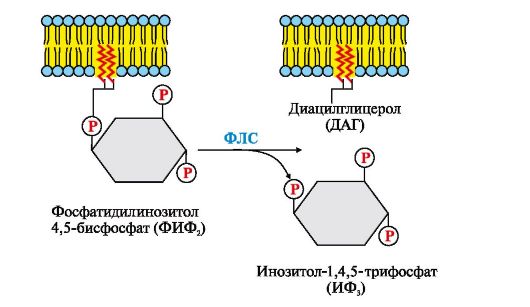 Рис. 4.14. Гидролиз фосфатидилинозитол-4,5-бисфосфата (ФИФ2)
Рис. 4.14. Гидролиз фосфатидилинозитол-4,5-бисфосфата (ФИФ2)
В ходе реакции образуются два продукта - вторичные вестники гормонального сигнала (вторичные мессенджеры): диацилглицерол, который остается в мембране и участвует в активации фермента протеинкиназы С, и инозитол-1,4,5-трифосфат (ИФ3), который, будучи гидрофильным соединением, уходит в цитозоль. Таким образом, сигнал, принятый рецептором клетки, раздваивается. ИФ3 связывается специфическими центрами Са2+- канала мембраны эндоплазматического ретикулума (Э)), что приводит к изменению конформации белка и открытию Са2+-канала. Так как концентрация кальция в ЭР примерно на 3-4 порядка выше, чем в цитозоле, после открытия канала Са2+ по градиенту концентрации поступает в цитозоль. В отсутствие ИФ3 в цитозоле канал закрыт.
В цитозоле всех клеток содержится небольшой белок кальмодулин, имеющий четыре центра связывания Са2+. При повышении концентрации
кальция он активно присоединяется к кальмодулину, образуя комплекс 4Са2+-кальмодулин. Этот комплекс взаимодействует с Са2+-кальмодулинзависимыми протеинкиназами, другими ферментами и повышает их активность. Активированная Са2+-кальмодулин-зависимая протеинкиназа фосфорилирует определенные белки и ферменты, в результате чего изменяется их активность и скорость метаболических процессов, в которых они участвуют.
Повышение концентрации Са2+ в цитозоле клетки увеличивает скорость взаимодействия Са2+ с неактивным цитозольным ферментом протеинкиназой С (ПКС). Связывание ПКС с ионами кальция стимулирует перемещение белка к плазматической мембране и позволяет ферменту вступать во взаимодействие с отрицательно заряженными «головками» молекул фосфатидилсерина (ФС) мембраны. Диацилглицерол, занимая специфические центры в протеинкиназе С, в еще большей степени увеличивает ее сродство к ионам кальция. На внутренней стороне мембраны образуется активная форма ПКС (ПКС ? Са2+ ? ФС ? ДАГ), которая фосфорилирует специфические ферменты.
Включение ИФ-системы непродолжительно, и после ответа клетки на стимул происходит инактивация фосфолипазы С, протеинкиназы С и Са2+-кальмодулин-зависимых ферментов. афлс-Субъединица в комплексе с ГТФ и фосфолипазой С проявляет ферментативную (ГТФ-фосфатазную) активность, она гидролизует ГТФ. Связанная с ГДФ афлс-субъединица теряет сродство к фосфолипазе С и возвращается в исходное неактивное состояние, т.е. включается в комплекс αβγ-ГДФ Gфлс-белок).
Отделение афлс-ГДФ от фосфолипазы С инактивирует фермент и гидролиз ФИФ2 прекращается. Повышение концентрации Са2+ в цитозоле активирует работу Са2+-АТФаз эндоплазматического ретикулума, цитоплазматической мембраны, которые «выкачивают» Са2+ из цитозоля клетки. В этом процессе принимают участие также Na+/Са2+- и Н+/Са2+-переносчики, функционирующие по принципу активного антипорта. Снижение концентрации Са2+ приводит к диссоциации и инактивации Са2+-кальмодулинзависимых ферментов, а также потере сродства протеинкиназы С к липидам мембраны и снижению ее активности.
ИФ3 и ДАГ, образовавшиеся в результате активации системы, могут снова взаимодействовать друг с другом и превращаться в фосфатидилинозитол- 4,5-бисфосфат.
Фосфорилированные ферменты и белки под действием фосфопротеинфосфатазы переходят в дефосфорилированную форму, изменяется их конформация и активность.
5. Каталитические рецепторы. Каталитические рецепторы являются ферментами. Активаторами этих ферментов могут быть гормоны, ростовые факторы, цитокины. В активной форме - рецепторы-ферменты фосфорилируют специфические белки по -ОН-группам тирозина, поэтому их называют тирозиновыми протеинкиназами (рис. 4.15). При участии специальных механизмов сигнал, полученный каталитическим рецептором, может быть передан в ядро, где он стимулирует или подавляет экспрессию определенных генов.
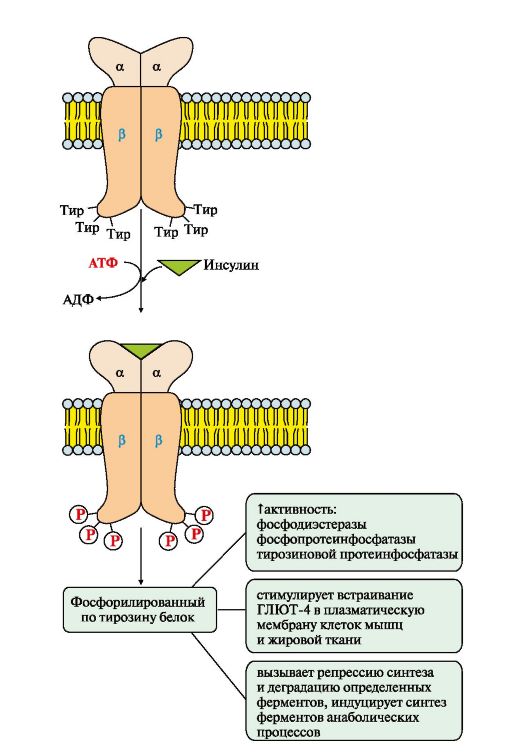 Рис. 4.15. Активация рецептора инсулина.
Рис. 4.15. Активация рецептора инсулина.
Фосфопротеинфосфатаза дефосфорилирует специфические фосфопротеины.
Фосфодиэстераза превращает цАМФ в АМФ и цГМФ в ГМФ.
ГЛЮТ 4 - переносчики глюкозы в инсулинзависимых тканях.
Тирозиновая протеинфосфатаза дефосфорилирует β-субъединицы рецептора
инсулина
Примером каталитического рецептора может служить рецептор инсулина, в состав которого входят две а- и две β-субъединицы. а-Субъединицы расположены на наружной поверхности клеточной мембраны, β-субъединицы пронизывают мембранный бислой. Центр связывания инсулина образован N-концевыми доменами а-субъединиц. Каталитический центр рецептора находится на внутриклеточных доменах β-субъединиц. Цитозольная часть рецептора имеет несколько остатков тирозина, которые могут фосфорилироваться и дефосфорилироваться.
Присоединение инсулина в центр связывания, образованный а-субъединицами, вызывает кооперативные конформационные изменения рецептора. β-Субъединицы проявляют тирозинкиназную активность и катализируют трансаутофосфорилирование (первая β-субъединица фосфорилирует вторую β-субъединицу, и наоборот) по нескольким остаткам тирозина. Фосфорилирование приводит к изменению заряда, конформации и субстратной специфичности фермента (Тир-ПК). Тирозиновая-ПК фосфорилирует определенные клеточные белки, которые получили название субстратов рецептора инсулина. В свою очередь эти белки участвуют в активации каскада реакций фосфорилирования:
• фосфопротеинфосфатазы (ФПФ), которая дефосфорилирует специфические фосфопротеины;
• фосфодиэстеразы, которая превращает цАМФ в АМФ и цГМФ в ГМФ;
• ГЛЮТ 4 - переносчиков глюкозы в инсулинзависимых тканях, поэтому повышается поступление глюкозы в клетки мышц и жировой ткани;
• тирозиновой протеинфосфатазы, которая дефосфорилирует β-субъединицы рецептора инсулина;
• регуляторных белков ядра, факторов транскрипции, повышающих или снижающих экспрессию генов определенных ферментов.
Реализация эффекта ростовых факторов может осуществляться с помощью каталитических рецепторов, которые состоят из одной полипептидной цепи, но при связывании первичного мессенджера образуют димеры. Все рецепторы этого типа имеют внеклеточный гликозилированный домен, трансмембранный (а-спираль) и цитоплазматический домен, способный при активации проявлять протеинкиназную активность.
Димеризация способствует активации их каталитических внутриклеточных доменов, которые осуществляют трансаутофосфорилирование по аминокислотным остаткам серина, треонина или тирозина. Присоединение фосфорных остатков приводит к формированию у рецептора центров связывания для специфических цитозольных белков и активации протеинкиназного каскада передачи сигнала (рис. 4.16).
Последовательность событий передачи сигнала первичных мессенджеров (ростовых факторов) при участии Ras- и Raf-белков.
Связывание рецептора (R) с фактором роста (ФР) приводит к его димеризации и трансаутофосфорилированию. Фосфорилированный рецептор приобретает сродство к Grb2-белку. Образованный комплекс ФР*R*Grb2 взаимодействует с цитозольным белком SOS. Изменение конформации SOS
обеспечивает его взаимодействие с заякоренным белком мембраны Ras-ГДФ. Образование комплекса ФР?R?Gгb2?SOS?Ras-ГДФ снижает сродство Ras- белка к ГДФ и увеличивает сродство к ГТФ.
Замена ГДФ на ГТФ изменяет конформацию Ras-белка, который отделяется от комплекса и взаимодействует с Raf-белком в примембранной области. Комплекс Ras-ГТФ?Raf проявляет протеинкиназную активность и фосфорилирует фермент МЕК-киназу. Активированная МЕК-киназа в свою очередь фосфорилирует МАП-киназу по треонину и тирозину.
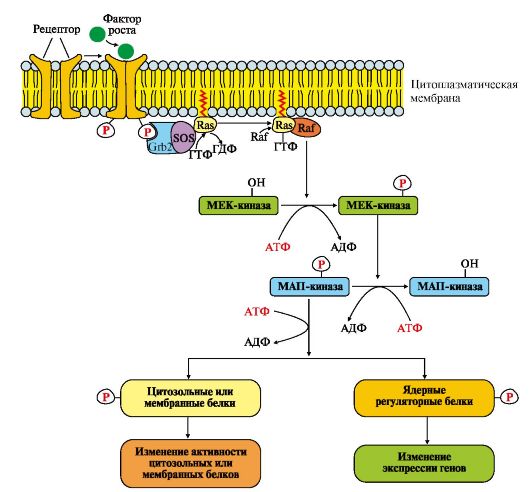 Рис.4.16. МАП-киназный каскад.
Рис.4.16. МАП-киназный каскад.
Рецепторы такого типа имеют эпидермальный фактор роста (ЭФР), фактор роста нервов (ФРН) и другие ростовые факторы.
Grb2 - протеин, взаимодействующий с рецептором ростового фактора ( growth receptor binding protein); SOS (GEF) - ГДФ-ГТФ обменный фактор (guanine nucleotide exchange factor); Ras - G-белок (гуанидинтрифосфатаза); Raf-киназа - в активной форме - фосфорилирующая МЕК-киназу; МЕК-киназа - киназа МАП-киназы; МАП-киназа - митогенактивированная протеинкиназа (mitogen-aktivated protein kinase)
Присоединение группы -РО32- к аминокислотным радикалам МАП-киназы изменяет ее заряд, конформацию и активность. Фермент фосфорилирует по серину и треонину специфические белки мембран, цитозоля и ядра.
Изменение активности этих белков оказывает влияние на скорость метаболических процессов, функционирование мембранных транслоказ, митотическую активность клеток-мишеней.
Рецепторы с гуанилатциклазной активностью также относятся к каталитическим рецепторам. Гуанилатциклаза катализирует образование из ГТФ цГМФ, который является одним из важных мессенджеров (посредников) внутриклеточной передачи сигнала (рис. 4.17).
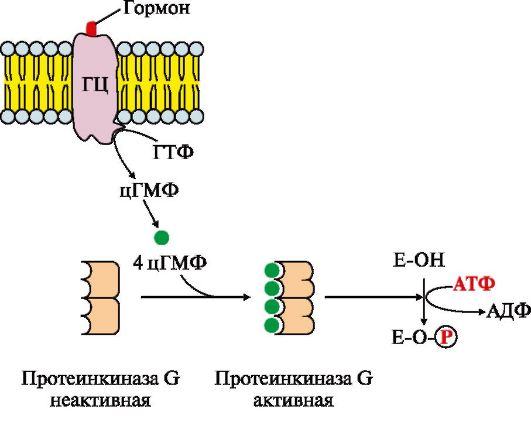 Рис. 4.17. Регуляция активности мембранной гуанилатциклазы.
Рис. 4.17. Регуляция активности мембранной гуанилатциклазы.
Мембранно-связанная гуанилатциклаза (ГЦ) - трансмембранный гликопротеин. Центр связывания сигнальной молекулы находится на внеклеточном домене, внутриклеточный домен гуанилатциклазы в результате активации проявляет каталитическую активность
Присоединение первичного мессенджера к рецептору активирует гуанилатциклазу, которая катализирует превращение ГТФ в циклический гуанозин-3',5'-монофосфат (цГМФ) - вторичный мессенджер. В клетке повышается концентрация цГМФ. Молекулы цГМФ могут обратимо присоединяться к регуляторным центрам протеинкиназы G (ПКЧ5), которая состоит из двух субъединиц. Четыре молекулы цГМФ изменяют конформацию и активность фермента. Активная протеинкиназа G катализирует фосфорилирование определенных белков и ферментов цитозоля клетки. Одним из первичных мессенджеров протеинкиназы G является предсердный натриуретический фактор (ПНФ), регулирующий гомеостаз жидкости в организме.
6. Передача сигнала с помощью внутриклеточных рецепторов. Гидрофобные по химической природе гормоны (стероидные гормоны и тироксин) могут диффундировать через мембраны, поэтому их рецепторы находятся в цитозоле или ядре клетки.
Цитозольные рецепторы связаны с белком-шапероном, который предотвращает преждевременную активацию рецептора. Ядерные и цитозольные рецепторы стероидных и тиреоидных гормонов содержат ДНКсвязывающий домен, обеспечивающий в ядре взаимодействие комплекса гормон-рецептор с регуляторными участками ДНК и изменение скорости транскрипции.
Последовательность событий, приводящих к изменению скорости транскрипции
Гормон проходит через двойной липидный слой клеточной мембраны. В цитозоле или ядре гормон взаимодействует с рецептором. Комплекс гормон-рецептор проходит в ядро и присоединяется к регуляторной нуклеотидной последовательности ДНК - энхансеру (рис. 4.18) или сайленсеру. Доступность промотора для РНК-полимеразы увеличивается при взаимодействии с энхансером или уменьшается при взаимодействии с сайленсером. Соответственно увеличивается или уменьшается скорость транскрипции определенных структурных генов. Зрелые мРНК выходят из ядра. Увеличивается или уменьшается скорость трансляции определенных белков. Изменяется количество белков, которые влияют на метаболизм и функциональное состояние клетки.
В каждой клетке существуют рецепторы, включенные в состав разных сигнал-трансдукторных систем, преобразующих все внешние сигналы во внутриклеточные. Число рецепторов для конкретного первичного мессенджера может варьировать в пределах от 500 до более 100 000 на клетку. Они располагаются на мембране отдаленно друг от друга либо сосредоточены в определенных ее участках.
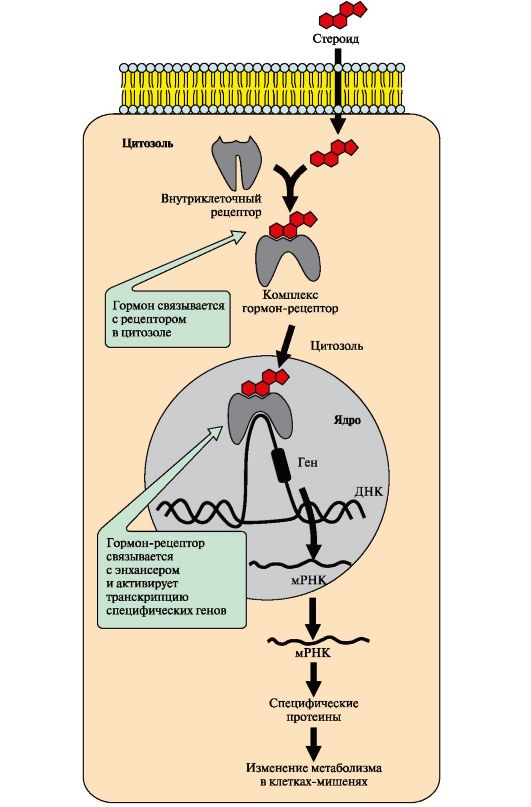 Рис. 4.18. Передача сигнала на внутриклеточные рецепторы
Рис. 4.18. Передача сигнала на внутриклеточные рецепторы
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. а) перенесите таблицу 4.1 в тетрадь, к названиям липидов допишите формулы. Для работы по темам модуля необходимо знать формулы фосфатидилхолина, фосфатидилсерина, фосфатидилинозитол-4,5-бисфосфата.
Таблица 4.1. Фосфолипиды мембран
Название фосфолипида | Формула |
A. Фосфатидилэтаноламин Б. Фосфатидилхолин B. Фосфатидилсерин Г. Фосфатидилинозитол-4,5-бисфосфат Д. Сфингомиелин |
б) из таблицы выберите липиды, участвующие в:
1. Активации протеинкиназы С
2. Реакции образования ДАГ под действием фосфолипазы С
3. Формировании миелиновых оболочек нервных волокон
в) напишите реакцию гидролиза липида, выбранного вами в п. 2;
г) укажите, какой из продуктов гидролиза участвует в регуляции Са2+-канала эндоплазматического ретикулума.
2. Выберите правильные ответы.
На конформационную лабильность белков-переносчиков может влиять:
A. Содержание холестерола в бислое мембран
Б. Изменение электрического потенциала на мембране
B. Присоединение специфических молекул Г. Жирнокислотный состав липидов бислоя Д. Количество переносимого вещества
3. Установите соответствие:
A. Кальциевый канал ЭР Б. Са2+-АТФаза
B. ГЛЮТ-4
Г. Ка+-зависимый переносчик Са2+ Д. N+, К+-АТФаза
1. Переносит Na+ по градиенту концентрации
2. Функционирует по механизму облегченной диффузии
3. Переносит Na+ против градиента концентрации
4. Перенесите табл. 4.2. в тетрадь и заполните ее.
Таблица 4.2. Аденилатциклазная и инозитолфосфатная системы
Строение и этапы функционирования | Аденилатциклазная система | Инозитолфосфатная система |
Пример первичного мессенджера системы | ||
Интегральный белок клеточной мембраны, взаимодействующий комплементарно с первичным мессенджером | ||
Белок, активирующий фермент сигнальной системы | ||
Фермент системы, образующий вторичный (е) мессенджер (ы) | ||
Вторичный (ые) мессенджер (-ы) системы | ||
Цитозольный (е) фермент (ы) системы, взаимодействующий (е) с вторичным мессенджером | ||
Механизм регуляции (в данной системе) активности ферментов метаболических путей | ||
Механизмы снижения концентрации вторичных мессенджеров в клетке-мишени | ||
Причина снижения активности мембранного фермента сигнальной системы |
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Установите соответствие:
A. Пассивный симпорт Б. Пассивный антипорт
B. Эндоцитоз Г. Экзоцитоз
Д. Первично-активный транспорт
1. Транспорт вещества в клетку происходит вместе с частью плазматической мембраны
2. Одновременно в клетку по градиенту концентрации проходят два разных вещества
3. Перенос веществ идет против градиента концентрации
2. Выберите правильный ответ.
ag-Субъединица G-белка, связанная с ГТФ, активирует:
A. Рецептор
Б. Протеинкиназу А
B. Фосфодиэстеразу Г. Аденилатциклазу Д. Протеинкиназу С
3. Установите соответствие.
Функция:
A. Регулирует активность каталитического рецептора Б. Активирует фосфолипазу С
B. Переводит в активную форму протеинкиназу А
Г. Повышает концентрацию Са2+ в цитозоле клетки Д. Активирует протеинкиназу С
Вторичный мессенджер:
1. цАМФ
2. Са2+
3. ИФ3
4. Установите соответствие.
Функционирование:
A. Способен к латеральной диффузии в бислое мембраны
Б. В комплексе с первичным мессенджером присоединяется к энхансеру
B. Проявляет ферментативную активность при взаимодействии с первичным мессенджером
Г. Может взаимодействовать с G-белком
Д. В процессе передачи сигнала взаимодействует с фосфолипазой С Рецептор:
1. Инсулина
2. Адреналина
3. Стероидного гормона
5. Выполните «цепное» задание:
а) пептидные гормоны взаимодействуют с рецепторами:
A. В цитозоле клетки
Б. Интегральными белками мембран клеток-мишеней
B. В ядре клетки
Г. Ковалентно связанными с ФИФ2
б) взаимодействие такого рецептора с гормоном вызывает повышение концентрации в клетке:
A. Гормона
Б. Промежуточных метаболитов
B. Вторичных мессенджеров Г. Ядерных белков
в) этими молекулами могут быть:
A. ТАГ Б. ГТФ
B. ФИФ2 Г. цАМФ
г) они активируют:
A. Аденилатциклазу
Б. Са2+-зависимый кальмодулин
B. Протеинкиназу А Г. Фосфолипазу С
д) этот фермент изменяет скорость метаболических процессов в клетке путем:
A. Повышения концентрации Са2+ в цитозоле Б. Фосфорилирования регуляторных ферментов
B. Активации протенфосфатазы
Г. Изменения экспрессии генов регуляторных белков
6. Выполните «цепное» задание:
а) присоединение фактора роста (ФР) к рецептору (R) приводит к:
A. Изменению локализации комплекса ФР-R
Б. Димеризации и трансаутофосфорилированию рецептора
B. Изменению конформации рецептора и присоединению к Gs-белку Г. Перемещению комплекса ФР-R
б) такие изменения в структуре рецептора увеличивают его сродство к поверхностному белку мембраны:
А. Gs B. Ras
Б. Raf Г. Grb2
в) это взаимодействие повышает вероятность присоединения к комплексу цитозольного белка:
А. Кальмодулина B. Ras
Б. ПКС Г. SOS
г) который увеличивает комплементарность комплекса к «заякоренному» белку:
А. Ras B. Gs
д) изменение конформации «заякоренного» белка снижает его сродство к:
А. цАМФ B. ГТФ
Б. ГДФ Г. АТФ
е) это вещество заменяется на:
А. ГДФ B. АМФ
Б. цГМФ Г. ГТФ
ж) присоединение нуклеотида способствует взаимодействию «заякоренного» белка с:
А. ПКА B. Кальмодулином
Б. SOS Г. Raf
з) этот белок входит в состав комплекса, который фосфорилирует:
А. МЕК-киназу В. Протеинкиназу С
Б. Протеинкиназу А Г. МАП-киназу
и) этот фермент в свою очередь активирует:
А. МЕК-киназу В. Протеинкиназу G
Б. Raf-белок Г. МАП-киназу
к) фосфорилирование белка повышает его сродство к:
А. Белкам SOS и Raf В. Регуляторным белкам ядра Б. Кальмодулину Г. Ядерным рецепторам
л) активация этих белков приводит к:
A. Дефосфорилированию ГТФ в активном центре белка Ras Б. Снижению сродства рецептора к фактору роста
B. Повышению скорости матричных биосинтезов Г. Диссоциации комплекса SOS-Grb2
м) вследствие этого:
A. Белок SOS отделяется от рецептора
Б. Происходит диссоциация протомеров рецептора (R)
B. Ras-белок отделяется от Raf-белка
Г. Возрастает пролиферативная активность клетки-мишени.
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. 1-В, 2-А, 3-Д
2. Г
3. 1-В, 2-Д, 3-Г
4. 1-В, 2-Г, 3-Б
5. а) Б, б) В, в) Г, г) В, д) Б
6. а) Б, б) Г, в) Г, г) А, д) Б, е) Г, ж) Г, з) А, и) Г, к) В, л) В, м) Г
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Структура и функции мембран
2. Транспорт веществ через мембраны
3. Особенности строения белков мембран
4. Трансмембранные системы передачи сигналов (аденилатциклазная, инозитолфосфатная, гуанилатциклазная, каталитические и внутриклеточные рецепторы)
5. Первичные мессенджеры
6. Вторичные мессенджеры (посредники)
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
1. Ознакомьтесь с рис. 4.19 и выполните следующие задания:
а) назовите вид транспорта;
б) установите порядок событий:
A. Cl- по градиенту концентрации выходит из клетки
Б. Протеинкиназа А фосфорилирует R-субъединицу канала
B. Изменяется конформация R-субъединицы
Г. Происходят кооперативные конформационные изменения мембранного белка
Д. Активируется аденилатциклазная система
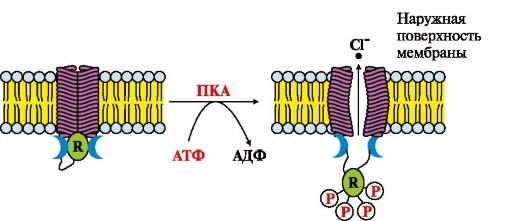 Рис. 4.19. Функционирование С1--канала эндотелия кишечника.
Рис. 4.19. Функционирование С1--канала эндотелия кишечника.
R - регуляторный белок, который переходит в фосфорилированную форму под действием протеинкиназы А (ПКА)
в) сравните функционирование Са2+-канала мембраны эндоплазматического ретикулума и Cl--канала клетки эндотелия кишечника, заполнив табл. 4.3.
Таблица 4.3. Способы регуляции функционирования каналов
Этап функционирования | Са2+-канал ЭР | С1--канал энтероцитов |
Система активации | ||
Причина изменения конформации канала | ||
Механизм транспорта ионов |
Решите задачи
1. Сокращение сердечной мышцы активирует Са2+, содержание которого в цитозоле клетки повышается за счет функционирования цАМФ-зависимых переносчиков цитоплазматической мембраны. В свою очередь, концентрация цАМФ в клетках регулируется двумя сигнальными молекулами - адреналином и ацетилхолином. Причем известно, что адреналин, взаимодействуя с β2-адренорецепторами, повышает концентрацию цАМФ в клетках миокарда и стимулирует сердечный выброс, а ацетилхолин, взаимодействуя с М2-холинорецепторами, снижает уровень цАМФ и сократимость миокарда. Объясните, почему два первичных мессенджера, используя одну и ту же систему трансдукции сигнала, вызывают различный клеточный ответ. Для этого:
а) представьте схему передачи сигнала для адреналина и ацетилхолина;
б) укажите различие в каскадах передачи сигналов этих мессенджеров.
2. Ацетилхолин, взаимодействуя с М3-холинорецепторами слюнных желез, стимулирует выход Са2+ из ЭР. Повышение концентрации Са2+ в цитозоле обеспечивает экзоцитоз секреторных гранул и высвобождение в слюнной проток электролитов и небольшого количества белков. Объясните, как регулируется работа Са2+-каналов ЭР. Для этого:
а) назовите вторичный мессенджер, обеспечивающий открытие Са2+-каналов ЭР;
б) напишите реакцию образования вторичного мессенджера;
в) представьте схему трансмембранной передачи сигнала ацетилхолина, в ходе активации которой образуется регуляторный лиганд Са2+-кана-
лов ЭР.
3. Исследователи рецептора инсулина установили значительное изменение в гене белка - одного из субстратов инсулинового рецептора. Как нарушение в структуре этого белка скажется на функционировании системы передачи сигнала инсулина? Для ответа на вопрос:
а) приведите схему трансмембранной передачи сигнала инсулина;
б) назовите белки и ферменты, которые активирует инсулин в клеткахмишенях, укажите их функцию.
4. Белок Ras является «заякоренным» белком цитоплазматической мембраны. Функцию «якоря» выполняет 15-углеродный остаток фарнезила Н3С-(СН3)С=СН-СН2-[СН2-(СН3)С=СН-СН2]2-, который присоединяется к белку ферментом фарнезилтрансферазой в ходе посттрансляционной модификации. В настоящее время ингибиторы этого фермента проходят клинические испытания.
Почему использование этих препаратов приводит к нарушению трансдукции сигнала ростовых факторов ? Для ответа:
а) представьте схему передачи сигнала с участием Ras-белков;
б) объясните функцию Ras-белков и последствия нарушения их ацилирования;
в) предположите, для лечения каких заболеваний были разработаны эти препараты.
5. Стероидный гормон кальцитриол активирует всасывание пищевого кальция, увеличивая количество белков-переносчиков Са2+ в клетках кишечника. Объясните механизм действия кальцитриола. Для этого:
а) приведите общую схему передачи сигнала стероидных гормонов и опишите ее функционирование;
б) назовите процесс, который активирует гормон в ядре клетки-мишени;
в) укажите, в каком матричном биосинтезе будут участвовать молекулы, синтезированные в ядре, и где он протекает.