Биологическая химия с упражнениями и задачами : учебник / под ред. чл.-корр. РАМН С.Е. Северина. - 2011. - 624 с.: ил.
|
|
|
|
МОДУЛЬ 8 ОБМЕН ЛИПИДОВ
Структура модуля | Темы модуля |
Модульная единица 1 | 8.1. Строение и функции основных липидов организма человека 8.2. Переваривание и всасывание жиров. Ресинтез жиров в клетках слизистой оболочки кишечника 8.3. Хиломикроны - транспортная форма экзогенных жиров |
Модульная единица 2 | 8.4. Биосинтез высших жирных кислот и его регуляция 8.5. Биосинтез жиров в печени и жировой ткани. Регуляция синтеза жиров 8.6. Ожирение |
Модульная единица 3 | 8.7. Мобилизация жира. Гормональная регуляция мобилизации жиров 8.8. β-Окисление жирных кислот - источник энергии для синтеза АТФ. Регуляция β-окисления 8.9. Кетоновые тела: синтез и катаболизм. Кетоацидоз 8.10. Производные полиеновых кислот - эйкозаноиды: строение, биосинтез и биологическое действие |
Модульная единица 4 | 8.11. Холестерол: биологические функции. Поступление с пищей и транспорт кровью экзогенного холестерола 8.12. Биосинтез холестерола и его регуляция 8.13. Биосинтез желчных кислот и их роль в поддержании гомеостаза холестерола в организме. Биохимия желчнокаменной болезни 8.14. Роль липопротеинов в транспорте холестерола 8.15. Типы дислипопротеинемий. Биохимические основы патогенеза и лечения атеросклероза |
Модульная единица 1 СТРОЕНИЕ И ФУНКЦИИ ОСНОВНЫХ ЛИПИДОВ ОРГАНИЗМА ЧЕЛОВЕКА. ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ ЛИПИДОВ. ТРАНСПОРТ ЖИРОВ ХИЛОМИКРОНАМИ
Цели изучения Уметь:
1. Использовать знания о переваривании и всасывании липидов для понимания этих процессов в норме и для объяснения симптомов, возникающих при их нарушении.
2. Интерпретировать результаты исследования активности панкреатической липазы.
3. Интерпретировать результаты биохимических исследований крови при гиперхиломикронемии.
Знать:
1. Строение и функции липидов организма человека.
2. Процессы переваривания и ассимиляции жиров, последствия их нарушений.
3. Строение и функции липопротеинов, диагностическое значение определения липопротеинов крови при некоторых патологиях липидного обмена.
4. Причины и клинические проявления гиперхиломикронемии.
ТЕМА 8.1. СТРОЕНИЕ И ФУНКЦИИ ОСНОВНЫХ ЛИПИДОВ ОРГАНИЗМА ЧЕЛОВЕКА
1. Липиды - это разнообразная по строению группа органических молекул, имеющих общие свойства - гидрофобность или амфифильность. Благодаря этим свойствам липиды образуют структуры, не смешиваемые с водой, например капли жира в адипоцитах или бислойные структуры мембран. Липиды подразделяются на ряд классов (табл. 8.1).
Жирные кислоты входят в состав большинства липидов организма человека (табл.8.1). Они могут быть связаны как с глицеролом (ТАГ и глицерофосфолипиды), так и с аминоспиртом сфингозином, образуя группу сфинголипидов. Жирные кислоты, наряду с глюкозой, являются важнейшим источником энергии («топливные молекулы»). Жирные кислоты в организме человека содержат четное число С-атомов (табл. 8.2), что определяется способом их синтеза.
Жиры - триацилглицеролы - самая компактная и энергоемкая форма хранения энергии. Жиры запасаются в жировых клетках - адипоцитах, которые входят в состав жировой ткани. В норме содержание жиров в организме человека составляет 6-10 кг. Этого количества жиров достаточно для обеспечения энергией организма в течение 40-50 дней при полном голодании. Жировая ткань выполняет также теплоизолирующую и механическую защитные функции.
Фосфолипиды - молекулы, обладающие амфифильными свойствами, так как они имеют гидрофобную часть, образованную чаще всего радикалами жирных кислот, и гидрофильную часть - остаток фосфорной кислоты, аминоспирта или аминокислоты. Фосфолипиды могут вследствие своих амфифильных свойств образовывать бислойные структуры мембран или гидрофильный монослой на поверхности липопротеинов - частиц, обеспечивающих транспорт гидрофобных липидов кровью. Фосфолипиды разделяют на глицерофосфолипиды, основой строения которых является глицерол, и сфинголипиды, имеющие в своей структуре аминоспирт сфингозин (табл. 8.1). Сфинголипиды содержатся в мембранах многих клеток; в наружных мембранах они являются составной частью антигенов
Таблица 8.1. Строение и функции основных классов липидов человека
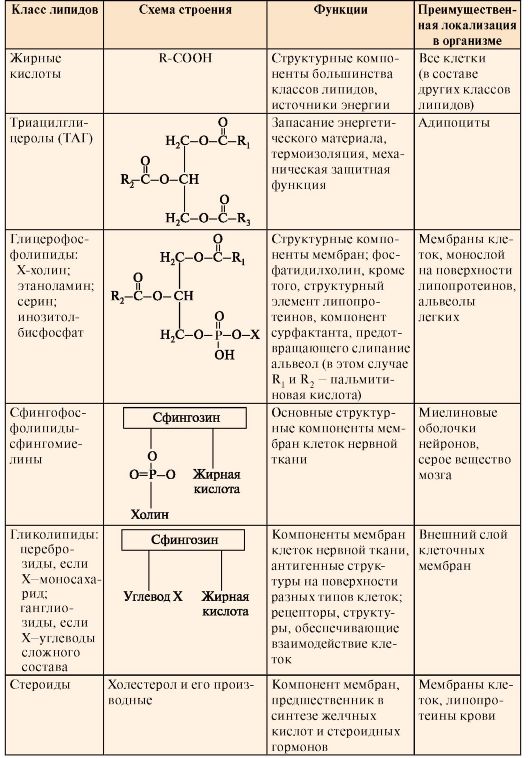 Таблица 8.2. Состав и строение жирных кислот организма человека
Таблица 8.2. Состав и строение жирных кислот организма человека
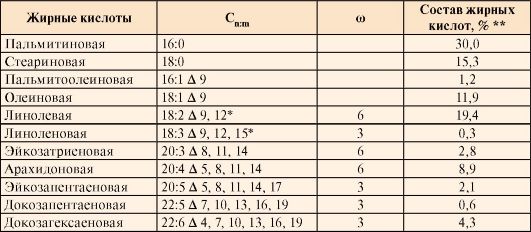 Примечание. Сп
- число атомов углерода в данной жирной кислоте; m - число двойных
связей в радикале жирной кислоты; Δ9, 12 - положение двойных связей в
радикале жирной кислоты, считая от первого, карбоксильного углерода;
ω-3, ω-6 - положение первой двойной связи, считая от метильного углерода
радикала жирной кислоты; знаком * отмечены полиеновые эссенциальные
жирные кислоты, которые должны поступать с пищей. Остальные полиеновые
кислоты могут синтезироваться из них, например, арахидоновая кислота
может синтезироваться из линолевой (18:2 ω-6). В колонке ** представлен
суммарный состав жирных кислот у человека, находящегося на обычном
пищевом рационе. В зависимости от типа ткани, жирных кислот пищи и ряда
других условий состав жирных кислот липидов может несколько отличаться
от указанного
Примечание. Сп
- число атомов углерода в данной жирной кислоте; m - число двойных
связей в радикале жирной кислоты; Δ9, 12 - положение двойных связей в
радикале жирной кислоты, считая от первого, карбоксильного углерода;
ω-3, ω-6 - положение первой двойной связи, считая от метильного углерода
радикала жирной кислоты; знаком * отмечены полиеновые эссенциальные
жирные кислоты, которые должны поступать с пищей. Остальные полиеновые
кислоты могут синтезироваться из них, например, арахидоновая кислота
может синтезироваться из линолевой (18:2 ω-6). В колонке ** представлен
суммарный состав жирных кислот у человека, находящегося на обычном
пищевом рационе. В зависимости от типа ткани, жирных кислот пищи и ряда
других условий состав жирных кислот липидов может несколько отличаться
от указанного
и рецепторов. Особенно много сфинголипидов в нервной ткани, где они формируют миелиновые оболочки нейронов.
Холестерол - основной стероид и предшественник всех остальных стероидов в организме человека. Холестерол входит в состав мембран всех клеток, влияя на свойства их гидрофобного слоя, и является предшественником в синтезе желчных кислот, стероидных гормонов.
2. Эссенциальные факторы питания липидной природы. Некоторые липиды не синтезируются в организме человека и поэтому являются незаменимыми факторами питания. К ним относятся жирные кислоты с двумя и большим числом двойных связей (полиеновые) - эссенциальные жирные кислоты. Некоторые из этих кислот являются субстратами для синтеза гормонов местного действия - эйкозаноидов (тема 8.10).
Жирорастворимые витамины выполняют разнообразные функции: витамин А участвует в процессе зрения, а также роста и дифференцировки клеток; доказана его способность угнетать рост некоторых видов опухолей; витамин К участвует в свертывании крови; витамин D участвует в регуляции обмена кальция; витамин Е - антиоксидант, ингибирует образование свободных радикалов и таким образом противодействует повреждению клеток в результате перекисного окисления липидов.
ТЕМА 8. 2. ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ ЖИРОВ. РЕСИНТЕЗ ЖИРОВ В КЛЕТКАХ СЛИЗИСТОЙ ОБОЛОЧКИ
КИШЕЧНИКА
1. Основные липиды, поступающие с пищей, являются жирами (до 90%). Переваривание жиров - это процесс их гидролиза под действием фермента панкреатическая липаза. Для действия этого фермента необходимы следующие условия (рис. 8.1): рН-7,8; желчные кислоты, эмульгирующие жиры; белок колипаза, синтезируемый в поджелудочной железе и секретируемый вместе с панкреатической липазой.
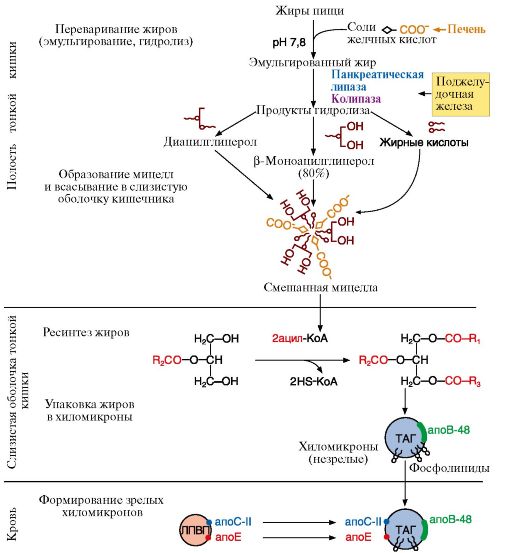 Рис. 8.1. Этапы переваривания и всасывания жиров
Рис. 8.1. Этапы переваривания и всасывания жиров
2. Оптимальное значение рН в кишечнике для действия панкреатической липазы создается в результате нейтрализации кислого содержимого, поступающего из желудка, бикарбонатом, секретируемым поджелудочной железой:
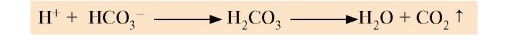 3. Эмульгирование жиров (смешивание
жиров с водой) происходит под действием поверхностно-активных веществ -
солей желчных кислот. В процессе эмульгирования увеличивается площадь
поверхности контакта жиров - субстратов панкреатической липазы и
фермента, растворенного в водной среде. Желчные кислоты синтезируются в
печени из холестерола и секретируются в желчный пузырь. В желчном пузыре
образуется желчь, мицеллы которой имеют следующий состав: желчные кислоты, фосфолипиды, холестерол. Желчные
кислоты и фосфолипиды удерживают холестерол в растворенном состоянии.
При нарушении соотношения компонентов мицелл могут образовываться
желчные камни, содержащие холестерол, так как он нерастворим в воде и
при снижении количества эмульгирующих веществ в желчи легко выпадает в
осадок.
3. Эмульгирование жиров (смешивание
жиров с водой) происходит под действием поверхностно-активных веществ -
солей желчных кислот. В процессе эмульгирования увеличивается площадь
поверхности контакта жиров - субстратов панкреатической липазы и
фермента, растворенного в водной среде. Желчные кислоты синтезируются в
печени из холестерола и секретируются в желчный пузырь. В желчном пузыре
образуется желчь, мицеллы которой имеют следующий состав: желчные кислоты, фосфолипиды, холестерол. Желчные
кислоты и фосфолипиды удерживают холестерол в растворенном состоянии.
При нарушении соотношения компонентов мицелл могут образовываться
желчные камни, содержащие холестерол, так как он нерастворим в воде и
при снижении количества эмульгирующих веществ в желчи легко выпадает в
осадок.
4. Действие панкреатической липазы. Белок - колипаза, секретируемый поджелудочной железой в неактивной форме, активируется путем частичного протеолиза и после этого облегчает связывание панкреатической липазы с мицеллами и таким образом ускоряет процесс гидролиза. Панкреатическая липаза с большей скоростью расщепляет в жирах сложноэфирные связи в 1- и 3-положениях, поэтому основными продуктами переваривания жиров являются 2-моноацилглицеролы и жирные кислоты (рис. 8.2).
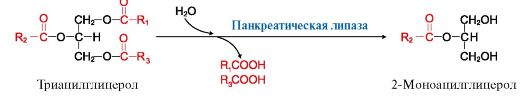 Рис. 8.2. Гидролиз жиров под действием панкреатической липазы
Рис. 8.2. Гидролиз жиров под действием панкреатической липазы
Фосфолипиды, поступающие с пищей, гидролизуются фосфолипазой А2, которая в неактивной форме секретируется в кишечник, где активируется трипсином по механизму частичного протеолиза. Продукты гидролиза жиров и фосфолипидов становятся амфифильными соединениями и в таком виде могут всасываться в составе смешанных мицелл.
5. Образование смешанных мицелл. Продукты гидролиза жиров (жирные кислоты, моноацилглицеролы), а также желчные кислоты, холестерол, жирорастворимые витамины образуют смешанные мицеллы и в такой форме проникают в клетки слизистой оболочки тонкой кишки, где мицеллы распадаются на составные компоненты, а продукты гидролиза жиров подвергаются ресинтезу.
6. Ресинтез жиров в энтероцитах. Ресинтезу жиров предшествует активация жирной кислоты, т.е. присоединение ее к коферменту А:
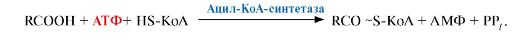 Ресинтез
молекул ТАГ из 2-моноацилглицерола и активных форм жирных кислот (рис.
8.1) происходит под действием ацилтрансфераз. В ходе ресинтеза
образуются ТАГ, отличающиеся по составу от тех, которые входили в состав
пищи, так как в ресинтезе участвуют и жирные кислоты, синтезируемые в
организме человека.
Ресинтез
молекул ТАГ из 2-моноацилглицерола и активных форм жирных кислот (рис.
8.1) происходит под действием ацилтрансфераз. В ходе ресинтеза
образуются ТАГ, отличающиеся по составу от тех, которые входили в состав
пищи, так как в ресинтезе участвуют и жирные кислоты, синтезируемые в
организме человека.
7. Нарушения переваривания жиров. Снижение секреции, или активности, панкреатической липазы, которое наблюдается при воспалении поджелудочной железы (панкреатите), или нарушение эмульгирования жиров вследствие недостаточного поступления желчи в просвет кишечника (например, при желчнокаменной болезни) приводит к снижению скорости переваривания и всасывания жиров и появлению в кале непереваренных жиров - стеаторее. При длительном нарушении переваривания и всасывания жиров снижается всасывание незаменимых факторов питания липидной природы - жирорастворимых витаминов и полиеновых жирных кислот. В результате развиваются гиповитаминозы с соответствующими клиническими симптомами; например, недостаток витамина K приводит к снижению скорости свертывания крови, к кровотечениям, недостаток витамина А - к снижению остроты зрения, особенно в темноте («куриная слепота»).
ТЕМА 8.3. ХИЛОМИКРОНЫ - ТРАНСПОРТНАЯ ФОРМА ЭКЗОГЕННЫХ ЖИРОВ
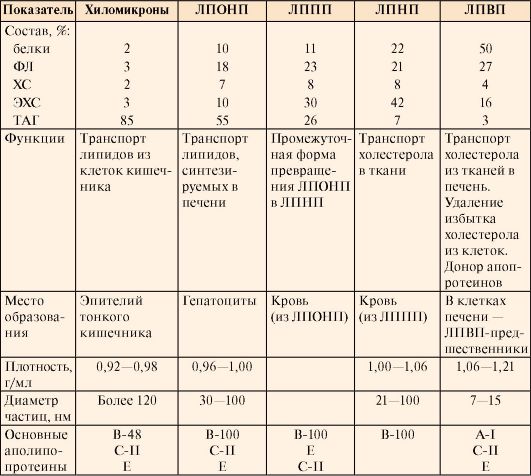
1. Липиды, в частности жиры, холестерол и его эфиры не растворяются в водных фазах организма, поэтому транспорт их кровью и лимфой осуществляется в виде комплексов с белками и фосфолипидами, которые называются липопротеинами.
2. Все липопротеины имеют сходное строение: ядро состоит из гидрофобных молекул: ТАГ, эфиров холестерола, а на поверхности находится монослой фосфолипидов, полярные группы которых обращены к воде, а гидрофобные погружены в гидрофобное ядро липопротеина (рис. 8.3). Кроме фосфолипидов, на поверхности находятся белки - аполипопротеины (табл. 8.3). Аполипопротеины выполняют различные функции. Интегральные аполипопротеины являются структурными компонентами. Периферические аполипопротеины в плазме крови могут передаваться от одного типа липопротеинов к другим, определяя их дальнейшие превращения.
Таблица 8.3. Характеристика липопротеинов
 Основной
структурный аполипопротеин хиломикронов - белок В-48, который
синтезируется в клетках слизистой оболочки тонкой кишки, необходим для
формирования структуры хиломикронов. Образовавшиеся в энтероцитах
липопротеины представляют собой незрелые хиломикроны, в которые
включаются ресинтезированные жиры и всосавшиеся гидрофобные вещества:
холестерол, жирорастворимые витамины. Незрелые хиломикроны сначала
попадают в лимфу, затем - в кровоток. В крови незрелые хиломикроны
получают от ЛПВП, образующихся в печени, апопротеины - С-II, Е
Основной
структурный аполипопротеин хиломикронов - белок В-48, который
синтезируется в клетках слизистой оболочки тонкой кишки, необходим для
формирования структуры хиломикронов. Образовавшиеся в энтероцитах
липопротеины представляют собой незрелые хиломикроны, в которые
включаются ресинтезированные жиры и всосавшиеся гидрофобные вещества:
холестерол, жирорастворимые витамины. Незрелые хиломикроны сначала
попадают в лимфу, затем - в кровоток. В крови незрелые хиломикроны
получают от ЛПВП, образующихся в печени, апопротеины - С-II, Е
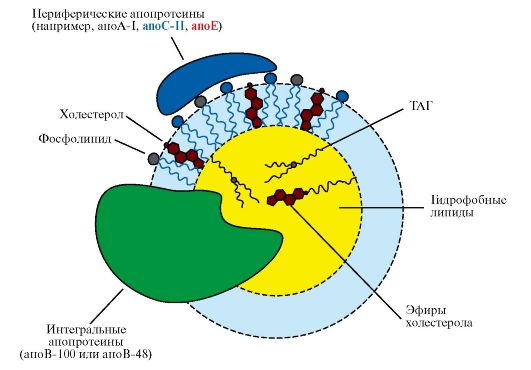 Рис. 8.3. Строение липопротеинов плазмы крови
Рис. 8.3. Строение липопротеинов плазмы крови
(рис. 8.1, 8.2, табл. 8.3) и превращаются в зрелые хиломикроны. Появление в крови в абсорбтивный период хиломикронов (довольно крупных частиц) делает сыворотку крови опалесцирующей.
3. В крови зрелые хиломикроны подвергаются действию фермента липопротеинлипазы, который локализуется на поверхности эндотелия сосудов, в основном в жировой и мышечной тканях. Этот фермент «узнает» хиломикроны, взаимодействуя с апоС-II, который активирует этот фермент. Липопротеинлипаза гидролизует жиры в составе хиломикронов до глицерола и свободных жирных кислот (рис. 8.4). Глицерол переносится в печень, а жирные кислоты могут или окисляться в тканях, являясь источником энергии, или депонироваться в виде ТАГ жировой ткани. Структуры, которые образуются из хиломикронов после удаления основной части ТАГ, называются остаточными хиломикронами (ХМ ост.) и захватываются печенью через рецепторы, связывающие апоЕ. АпоС-II после удаления ТАГ из ХМ переносятся обратно на ЛПВП. В составе остаточных хиломикронов содержатся холестерол и его эфиры, жирорастворимые витамины, апопротеины. Остаточные хиломикроны в клетках печени подвергаются гидролитическому действию ферментов лизосом. В результате освобождаются холестерол, жирные кислоты,
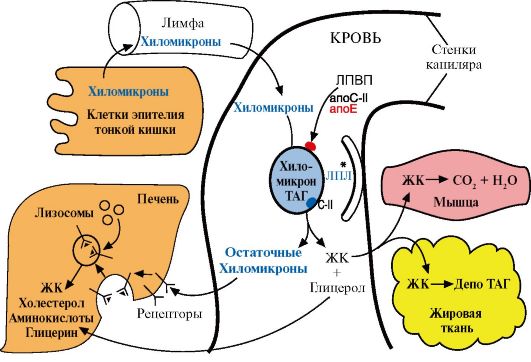 Рис. 8.4. Путь экзогенных жиров и хиломикронов ЛПЛ - липопротеинлипаза; ЖК - жирные кислоты
Рис. 8.4. Путь экзогенных жиров и хиломикронов ЛПЛ - липопротеинлипаза; ЖК - жирные кислоты
аминокислоты. Таким образом, функцию хиломикронов можно охарактеризовать как транспорт экзогенных пищевых липидов, в основном жиров, из кишечника в ткани. В течение 1-3 часов хиломикроны исчезают из крови и сыворотка человека в постабсорбтивный период становится более прозрачной.
4. В крови содержатся и другие типы липопротеинов (табл. 8.3). Если исследовать липопротеины крови методом ультрацентрифугирования или электрофореза, то можно получить результаты, представленные на рис. 8.5.
5. При генетическом дефекте липопротеинлипазы содержание в крови хиломикронов и ЛПОНП будет повышенным по сравнению с нормой даже в постабсорбтивный период. На поверхности такой сыворотки при стоянии на холоде всплывают белые жирные хлопья, образованные хиломикронами, что является проявлением гипертриацилглицеролемии и, соответственно, гиперхиломикронемии.
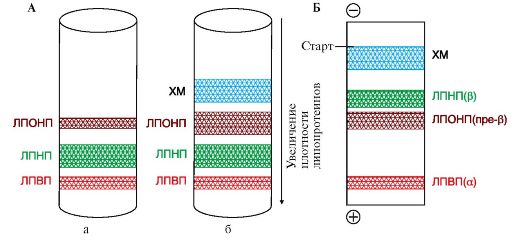 Рис. 8.5. Липидограммы сыворотки крови человека.
Рис. 8.5. Липидограммы сыворотки крови человека.
А - получены методом ультрацентрифугирования: а - через 12 часов после еды; б - через 1 час после еды;
Б - получены методом электрофореза (абсорбтивный период). В медицинской литературе ЛПВП часто называют ά-липопротеинами, а ЛПОНП и ЛПНП - пре-β- и β-липопротеинами соответственно
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
 2. Используя
данные табл. 8.2, объясните различие в строении жирных кислот ω-3 и ω-6
семейств. Приведите примеры соответствующих жирных кислот и укажите
возможные пути их использования в организме.
2. Используя
данные табл. 8.2, объясните различие в строении жирных кислот ω-3 и ω-6
семейств. Приведите примеры соответствующих жирных кислот и укажите
возможные пути их использования в организме.
3. Напишите формулу 1-пальмитоил-2-линолеоил-3-стеароилглицерола. Обратите внимание на то, что такой состав жирных кислот характерен для животных жиров. Ненасыщенные кислоты обычно располагаются у второго углеродного атома глицерола. Растительные масла содержат больше полиненасыщенных жирных кислот и являются жидкими. Напишите пример формулы триацилглицерола растительного масла.
4. Напишите формулу дипальмитоилфосфатидилхолина. Этот фосфолипид является основным компонентом сурфактанта - вещества, выстилающего альвеолы легких и предотвращающего слипание альвеол во время выдоха. Объясните, почему фосфолипиды сурфактанта содержат только насыщенные жирные кислоты, учитывая, что эти кислоты постояно контактируют с O2.
5. Используя рис. 8.1, выполните следующие тестовые задания:
а) Выберите правильные ответы.
Для нормального переваривания жиров в тонкой кишке необходимы:
A. Липаза панкреатическая Б. Желчные кислоты
B. HCO3-
Г. Липопротеинлипаза Д. Колипаза
б) Выберите правильные ответы.
С участием желчных кислот происходит:
A. Эмульгирование жиров
Б. Повышение активности панкреатической липазы
B. Всасывание жирных кислот и холестерола Г. Поступление глицерола в энтероциты
Д. Увеличение активности липопротеинлипазы
6. Напишите формулы таурохолевой и гликохолевой кислот (см. модульная единица 4, рис. 8.34) в ионизированной форме и объясните, почему вещества такого типа называются поверхностно-активными. Опишите механизм эмульгирующего действия исходя из их структуры.
7. Напишите реакцию гидролиза ТАГ, используя их общую формулу, под действием панкреатической липазы и реакции, объясняющие дальнейшие превращения продуктов гидролиза жиров, происходящие в клетках слизистой кишечника.
8. Используя данные табл. 8.3, выпишите основные липидные компоненты хиломикронов, ЛПОНП, опишите разницу в их составе и функции.
9. Выполните задания.
Сравните свойства панкреатической и ЛП-липаз. Для этого:
а) Запишите табл. 8.4. в тетрадь и заполните соответствующие колонки.
б) Напишите реакцию, катализируемую ЛП-липазой.
Таблица 8.4. Сравнительные характеристики липаз
Панкреатическая липаза | Липопротеинлипаза | ТАГ-липаза | |
Локализация реакции | |||
Активаторы реакции | |||
Субстраты реакции | |||
Основные продукты реакции | |||
Судьба продуктов реакции |
Примечание. Колонку «ТАГ-липаза» можно заполнить на последующих занятиях. Фермент ТАГ-липаза имеет и другие названия: «гормончувствительная липаза», «тканевая липаза»
10. Зарисуйте схему липидограммы сыворотки крови, полученной методом ультрацентрифугирования в абсорбтивный период, и объясните принцип расположения фракций липопротеинов.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Установите соответствие. Характеристика строения:
A. Моноеновая кислота
Б. Двойные связи в положении Δ6, 9
B. Двойные связи в положении Δ9, 12, 15 Г. Тетраеновая кислота
Д. Двойные связи в положении Δ9, 12 Жирная кислота:
1. Олеиновая кислота
2. Линолевая кислота ω-6
3. Линоленовая кислота
 3. Установите правильную последовательность событий.
3. Установите правильную последовательность событий.
При переваривании и всасывании жиров:
A. Эмульгирование пищевых липидов
Б. Гидролиз жиров под действием панкреатической липазы
B. Секреция холецистокинина при приеме пищи Г. Секреция желчных кислот
Д. Образование смешанных мицелл Е. Всасывание продуктов гидролиза
4. Выберите правильные ответы.
В ресинтезе ТАГ в клетках слизистой оболочки тонкой кишки участвуют вещества:
A. 2-Моноацилглицерол Б. Ацилтрансферазы
B. Ацил-КоА
Г. Глицерол-3-фосфат
Д. Жирные кислоты жиров
5. Выберите правильные ответы.
Гипертриацилглицеролемия может быть результатом:
A. Снижения синтеза апоВ-48
Б. Генетического дефекта ЛП-липазы
B. Изменения структуры апоЕ
Г. Снижения секреции желчных кислот Д. Генетического дефекта апоС-II
6. Установите соответствие.
A. Передают апоВ-48 на ЛПВП Б. Формируются в печени
B. Переходят из энтероцитов в лимфу Г. Содержат апоС-II и апоЕ
Д. Захватываются гепатоцитами
1. ХМ незрелые
2. ХМ зрелые
3. ХМ ост.
7. Выполните «цепное» задание:
а) ассимиляция жиров в тонкой кишке начинается с:
A. Гидролиза Б. Ресинтеза
B. Активации жирной кислоты Г. Эмульгирования
Д. Образования смешанных мицелл
б) это обеспечивает:
A. Формирование ресинтезированных ТАГ Б. Участие жирной кислоты в ресинтезе
B. Всасывание смешанных мицелл
Г. Образование тонкодисперсной эмульсии
Д. Использование продуктов гидролиза жирных кислот и β-МАГ
в) в ходе следующего этапа:
A. Происходит гидролиз ТАГ
Б. Образуются смешанные мицеллы
B. Формируются хиломикроны
Г. Активируются жирные кислоты Д. Протекает ресинтез ТАГ
г) образовавшиеся продукты:
A. Выходят в кровь
Б. Включаются в состав ХМ
B. Всасываются в клетки кишечника Г. Взаимодействуют с альбумином Д. Участвуют в ресинтезе жиров
д) далее следует:
A. Действие ЛП-липазы Б. «Созревание» хиломикронов
B. Ресинтез ТАГ Г. Формирование хиломикронов Д. Транспорт хиломикронов кровью
е) течение этого процесса обеспечивают:
A. Ацетил-КоА карбоксилаза Б. ТАГ-липаза жировой ткани
B. Липаза панкреатического сока Г. Ацилтрансферазы клеток эндотелия кишечника Д. ЛП-липаза
ж) продукты этих реакций:
A. Находятся в составе ХМ остаточных Б. Включаются в состав незрелых ХМ
B. Превращают ХМ в ХМ остаточные Г. Транспортируются непосредственно в кровь Д. Образуют поверхностный слой в ХМ
8. Выберите правильный ответ. Содержание ТАГ в зрелых ХМ составляет:
A. 40% Б. 50%
B. 20% Г. 85% Д. 60%
9. Выберите правильные ответы.
В крови на ХМ незрелые переносятся аполипопротеины:
A. C-II
Б. В-100
B. Е
Г. А-I
Д. В-48
10. Выберите правильные ответы. Результатом нарушения переваривания и всасывания жиров может быть:
A. Выведение пищевых жиров с фекалиями (стеаторея) Б. Гиповитаминоз В1 и В2
B. Ускорение всасывания глюкозы Г. Снижение скорости свертывания крови Д. Снижение зрения в темноте «куриная слепота»
Количественные характеристики обмена липидов, изучаемые в данной модульной единице:
[ТАГ] в сыворотке крови составляет 0,4-1,8 ммоль/л
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. 1-А, 2-Д, 3-В
2. 1-В, 2-Б, 3-Г
3. В, Г, А, Б, Д, Е
4. А, Б, В
5. Б, Д
6. 1-В, 2-Г, 3-Д
7. а) Г, б) Г, в) А, г) В, д) В, е) Г, ж) Б
8. Г
9. А, В
10. А, Г, Д
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Липиды: триацилглицеролы, фосфолипиды, холестерол, гликолипиды, сфинголипиды
2. Эссенциальные жирные кислоты
3. Жирорастворимые витамины: А, D, E, K
4. Желчные кислоты
5. Эмульгирование жиров
6. Переваривание жиров
7. Панкреатическая липаза
8. Ресинтез жиров
9. Липопротеины, аполипопротеины
10. Хиломикроны, хиломикроны остаточные (ремнантные частицы)
11. ЛП - липаза
12. Стеаторея
13. Гиперхиломикронемия
14. Гипертриацилглицеролемия
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. Жиры пищи, полученной человеком, содержали линолевую, линоленовую и олеиновую кислоты. В составе ХМ через 1 час после еды были обнаружены жиры, содержащие в основном пальмитиновую, линолевую, стеариновую и олеиновую кислоты. Объясните эти результаты, выполнив следующие задания:
а) напишите реакцию гидролиза жира, полученного с пищей;
б) представьте схему следующих этапов ассимиляции жиров;
в) напишите реакции, которые объяснили бы разницу в составе жиров пищи и жиров в составе ХМ.
2. После еды, содержащей жиры и углеводы, внешний вид сыворотки крови изменяется, она становится непрозрачной («молочная сыворотка»), а через 2-3 часа вновь выглядит прозрачной. Объясните эти изменения. Для этого:
а) зарисуйте в тетради диаграмму изменения содержания ТАГ в крови после приема жирной пищи (рис. 8.6);
б) объясните, почему состояние крови после приема жирной пищи характеризуют как «алиментарная гиперлипидемия»;
в) укажите, какие из липопротеинов будут преобладать в сыворотке крови через 1 час после приема насыщенной жирами пищи;
г) укажите состав основных компонентов этих липопротеинов.
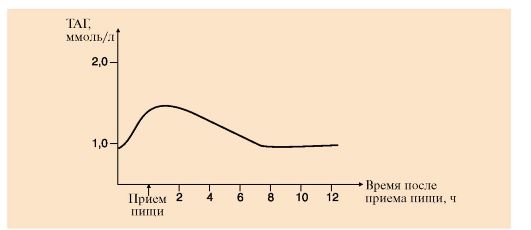 Рис. 8.6. Содержание ТАГ в сыворотке крови после приема пищи, содержащей жир
Рис. 8.6. Содержание ТАГ в сыворотке крови после приема пищи, содержащей жир
3. Значение Кт ЛП-липазы, локализующейся в капиллярах жировой ткани, существенно выше, чем значение Кт ЛП-липазы скелетных мышц. Сделайте вывод о биологическом значении этой разницы. Для этого:
а) вспомните, как значение величины Кт характеризует фермент;
б) опишите, как отличается потребление жирных кислот жировой и мышечной тканями при высокой и низкой концентрации в крови липопротеинов, транспортирующих жиры;
в) напишите названия двух ферментов, участвующих в утилизации глюкозы разными тканями, катализирующих одинаковую реакцию, и также отличающихся значениями Кт;
г) укажите биологическое значение отличия по Кт ферментов, участвующих в использовании тканями «топливных молекул» - глюкозы и жиров.
4. У больного 25 лет утром натощак взята сыворотка крови для анализа. Содержание ТАГ составляло 3 ммоль/л. Содержание холестерола соответствует норме. Сыворотка крови мутная, при хранении в холодильнике на поверхности образуются жирные хлопья. Объясните результаты анализов и возможные причины симптомов, наблюдаемых у больного. Для этого ответьте на вопросы и выполните задания:
а) какими методами можно определить содержание фракций липопротеинов в сыворотке крови?
б) нарисуйте схемы (липидограммы), отражающие состав липопротеинов сыворотки крови голодного человека и человека, имеющего указанные симптомы заболевания;
в) перенесите график, представленный на рис. 8.6, в тетрадь. На графике нанесите линию, отражающую изменения в концентрации ТАГ в крови данного пациента по сравнению со здоровым человеком;
г) укажите, нарушения каких молекулярных механизмов может привести к таким изменениям в обмене липидов;
д) сформулируйте рекомендации по питанию данному пациенту.
5. У женщины 40 лет обнаружены камни в желчном пузыре, которые периодически перекрывали желчный проток и нарушали отток желчи в кишечник.
Укажите все возможные последствия нарушения секреции желчи. Для этого:
а) напишите пример формулы желчной кислоты и объясните роль этих молекул в переваривании жиров;
б) укажите функцию желчных кислот во всасывании продуктов переваривания липидов и нарисуйте соответствующую схему;
в) укажите, дефицит каких веществ может возникнуть у таких больных, и каковы могут быть последствия и симптомы.
6. Экспериментальным животным скармливали смесь аминокислот, содержащих радиоактивную метку. Эти аминокислоты включались в различные белки, в том числе и в апопротеины В-48, Е и С-II. В каких органах и липопротеинах можно обнаружить указанные апопротеины?
При ответе:
а) проследите пути этих белков после включения их в структуру соответствующего липопротеина, написав соответствующие схемы;
б) укажите функции каждого из апопротеинов.
7. Пациенту, страдающему избыточным весом, врач прописал препарат ксеникал, который является ингибитором панкреатической липазы; препарат необходимо применять во время еды. Почему применение ксеникала способствует снижению веса? Ответьте на вопрос, выполнив следующие задания:
а) напишите реакцию, катализируемую панкреатической липазой;
б) объясните, почему длительное применение препарата вызывает снижение веса;
в) укажите возможные негативные последствия длительного применения ксеникала.
Модульная единица 2 БИОСИНТЕЗ ВЫСШИХ ЖИРНЫХ КИСЛОТ И ЖИРОВ
Цели изучения Уметь:
1. Использовать знания о биосинтезе высших жирных кислот и жиров (липогенезе) для понимания значения этих процессов в организме здорового человека.
2. Объяснять молекулярные механизмы, лежащие в основе развития ожирения.
3. Использовать знания о биосинтезе жирных кислот и жиров для понимания основ рационального питания.
4. Оценить собственный индекс массы тела и дать соответствующие рекомендации по питанию.
Знать:
1. Схему биосинтеза высших жирных кислот и его регуляцию.
2. Основные этапы биосинтеза жиров из углеводов; особенности биосинтеза жиров в печени и жировой ткани и регуляции этих процессов.
3. Образование, превращения и функции ЛПОНП.
4. Причины развития ожирения и его возможнные последствия.
ТЕМА 8.4. БИОСИНТЕЗ ВЫСШИХ ЖИРНЫХ КИСЛОТ И ЕГО РЕГУЛЯЦИЯ
1. Образование субстратов для биосинтеза высших жирных кислот.
Субстратами для синтеза жирных кислот являются продукты катаболизма глюкозы, поэтому синтез жирных кислот происходит при высокой концентрации глюкозы в крови в абсорбтивный период, в основном, в печени. С меньшей активностью синтез жирных кислот идет в жировой ткани. В период лактации синтез жирных кислот активно происходит в молочных железах и жирные кислоты включаются в жиры молока. В клетках, где происходит синтез жирных кислот, активируются гликолиз и пентозофосфатный путь катаболизма глюкозы, в результате которых образуются субстраты для синтеза жирных кислот: ацетил-КоА, NADPH, ATФ. Синтезированные жирные кислоты быстро включаются в состав других молекул: жиров и фосфолипидов. Синтез жирных кислот и жиров называется липогенезом.
Образование ацетил-КоА в результате окислительного декарбоксилирования пирувата - конечного продукта гликолиза - происходит в матриксе митохондрий, но ацетил-КоА не проникает через мембрану митохондрий в цитоплазму, где идет синтез жирных кислот. Поэтому ацетил-КоА конденсируется с оксалоацетатом, образуя цитрат, который с помощью транслоказы переносится в цитоплазму (рис. 8.7). В цитоплазме под действием фермента цитратлиазы идет реакция:
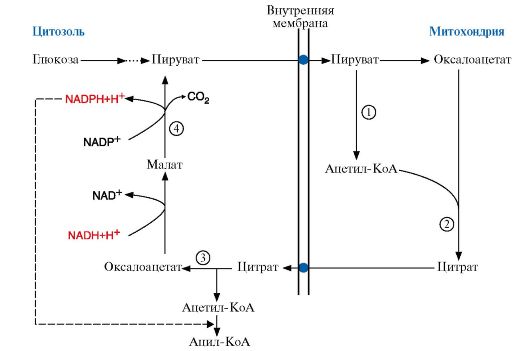 Рис. 8.7. Перенос ацетильных остатков из митохондрий в цитозоль.
Рис. 8.7. Перенос ацетильных остатков из митохондрий в цитозоль.
Ацетил-КоА, образующийся под действием пируватдегидрогеназного комплекса (1), не проникает через мембрану митохондрий в цитоплазму, где происходит синтез жирных кислот. Поэтому ацетил-КоА конденсируется ферментом цитратсинтазой с оксалоацетатом (2), образуя цитрат, который с помощью транслоказы переносится в цитоплазму, где он расщепляется под действием цитратлиазы (3), и ацетил-КоА используется как субстрат для синтеза жирных кислот. Реакция, катализируемая малик-ферментом (4), является одним из источников NADPH для синтеза жирных кислот
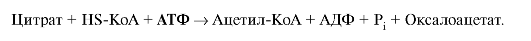 Ацетил-КоА,
перенесенный в цитоплазму, является исходным субстратом для синтеза
жирных кислот, а оксалоацетат подвергается следующим превращениям:
Ацетил-КоА,
перенесенный в цитоплазму, является исходным субстратом для синтеза
жирных кислот, а оксалоацетат подвергается следующим превращениям:
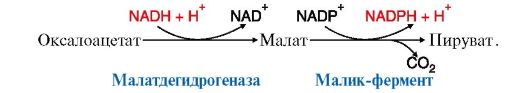 Пируват
возвращается в матрикс митохондрий, a NADPH, восстановленный в
результате действия малик-фермента, используется как донор водорода для
последующих реакций синтеза жирных кислот. Другой источник NADPH -
реакция, катализируемая ферментом пентозофосфатного пути -
глюкозо-6-фосфатдегидрогеназой.
Пируват
возвращается в матрикс митохондрий, a NADPH, восстановленный в
результате действия малик-фермента, используется как донор водорода для
последующих реакций синтеза жирных кислот. Другой источник NADPH -
реакция, катализируемая ферментом пентозофосфатного пути -
глюкозо-6-фосфатдегидрогеназой.
2. Первая реакция синтеза жирных кислот - это превращение ацетил-КоА в малонил-КоА:
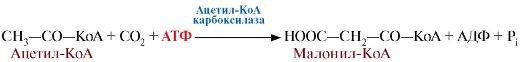 Фермент, катализирующий эту реакцию, ацетил-КоА-карбоксилаза, является регуляторным в биосинтезе жирных кислот. Он относится к классу лигаз и в качестве кофермента использует биотин.
Фермент, катализирующий эту реакцию, ацетил-КоА-карбоксилаза, является регуляторным в биосинтезе жирных кислот. Он относится к классу лигаз и в качестве кофермента использует биотин.
3. Последующие реакции синтеза жирных кислот катализируются ферментным комплексом - синтазой жирных кислот или пальмитатсинтазой. Конечным продуктом синтеза является пальмитиновая кислота.
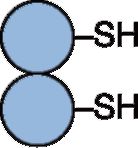
Синтаза жирных кислот - полифункциональный фермент, состоящий из двух идентичных полипептидных цепей, каждая из которых имеет семь активных центров и ацилпереносящий белок, который переносит растущую цепь жирной кислоты из одного активного центра в другой. Каждый из белков имеет два центра связывания, содержащих SH-группы, одна из которых принадлежит цистеину, другая - фосфопантотеину. Схематично этот комплекс изображают таким образом:
 Синтез
жирной кислоты начинается с переноса ацетильного, а затем малонильного
остатков с помощью ферментов ацетилтрансацилазы и малонилтрансацилазы на
активные центры синтазы жирных кислот (рис. 8.8, реакции 1, 2). Далее
карбоксильная группа малонила выделяется в виде СО2 и по освободившейся валентности присоединяется ацетил с образованием ацетоацетил-Е (рис. 8.8, реакция 3). Последующие реакции восстановления, дегидратации, восстановления (реакции 4-6) приводят
к образованию радикала бутирила, связанного с ферментом. Затем
повторяется такой же цикл реакций и образуется радикал жирной кислоты с
шестью углеродными атомами. Циклы повторяются вплоть до образования
радикала пальмитиновой кислоты, который ферментом тиоэстеразой
отщепляется от ферментного комплекса. Так как биосинтез жирных кислот
является процессом, в котором повторяются одни и те же
последовательности реакций, процесс называют циклическим; в каждом цикле
радикал жирной кислоты увеличивается на два атома углерода, источником
которых является малонил-КоА (рис. 8.8, 8.9). В каждом цикле
происходят реакции восстановления с использованием NADPH + H+, одним из
источников которого является пентозофосфатный путь окисления глюкозы,
другим - малик-фермент. Реакции восстановления обеспечивают синтез
насыщенного алифатического радикала жирных кислот.
Синтез
жирной кислоты начинается с переноса ацетильного, а затем малонильного
остатков с помощью ферментов ацетилтрансацилазы и малонилтрансацилазы на
активные центры синтазы жирных кислот (рис. 8.8, реакции 1, 2). Далее
карбоксильная группа малонила выделяется в виде СО2 и по освободившейся валентности присоединяется ацетил с образованием ацетоацетил-Е (рис. 8.8, реакция 3). Последующие реакции восстановления, дегидратации, восстановления (реакции 4-6) приводят
к образованию радикала бутирила, связанного с ферментом. Затем
повторяется такой же цикл реакций и образуется радикал жирной кислоты с
шестью углеродными атомами. Циклы повторяются вплоть до образования
радикала пальмитиновой кислоты, который ферментом тиоэстеразой
отщепляется от ферментного комплекса. Так как биосинтез жирных кислот
является процессом, в котором повторяются одни и те же
последовательности реакций, процесс называют циклическим; в каждом цикле
радикал жирной кислоты увеличивается на два атома углерода, источником
которых является малонил-КоА (рис. 8.8, 8.9). В каждом цикле
происходят реакции восстановления с использованием NADPH + H+, одним из
источников которого является пентозофосфатный путь окисления глюкозы,
другим - малик-фермент. Реакции восстановления обеспечивают синтез
насыщенного алифатического радикала жирных кислот.
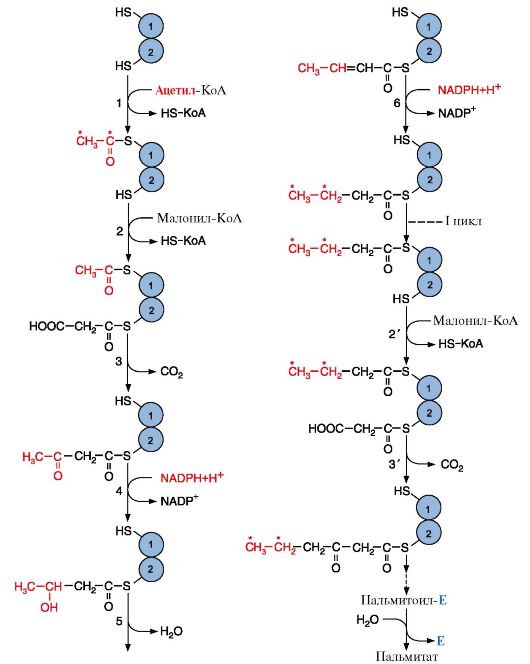 Рис. 8.8. Синтез пальмитиновой кислоты.
Рис. 8.8. Синтез пальмитиновой кислоты.
Пальмитоил-Е - остаток пальмитиновой кислоты, связанный с синтазой жирных кислот. Пальмитиновая кислота отделяется от ферментного комплекса тиоэстеразой. В синтезированной жирной кислоте только два дистальных атома углерода (СН3 и соседний с ним), выделенные красным цветом, происходят из ацетил-КоА, остальные атомы углерода включаются в радикал жирной кислоты из молекул малонил-КоА
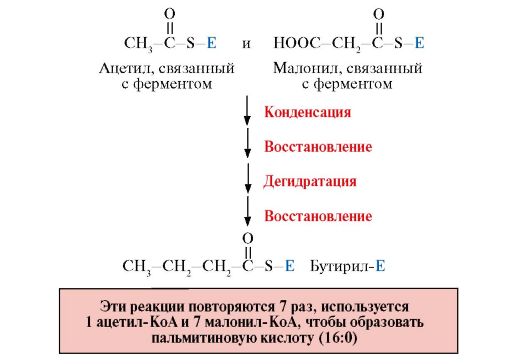 Рис. 8.9. Этапы синтеза пальмитиновой кислоты
Рис. 8.9. Этапы синтеза пальмитиновой кислоты
Реакции восстановления обеспечивают синтез насыщенного алифатического радикала жирных кислот
4. Другие жирные кислоты в организме человека синтезируются из пальмитиновой кислоты. Удлинение углеродного скелета происходит также с использованием малонил-КоА. Таким образом синтезируется, например, стеариновая кислота. В организме человека возможен синтез ненасыщенных кислот, однако двойная связь может быть образована у 9 атома углерода (С161 Δ9) и между карбонильной группой и С9. В организме человека не синтезируются жирные кислоты с двойными связями, расположенными дистальнее С9, поэтому полиеновые жирные кислоты с двойными связями между С9 и метильной группой являются эссенциальными и их необходимо получать с пищей. Для обеспечения потребностей организма в эссенциальных жирных кислотах суточная норма жиров (-80-100 г) должна на треть состоять из жиров растительного происхождения.
Образованные жирные кислоты не остаются в клетках в свободном виде, а используются для синтеза жиров и фосфолипидов. Жиры, синтезированные в жировой ткани, запасаются в ней, а жиры, синтезированные в печени, упаковываются в ЛПОНП, которые секретируются в кровь.
5. Регуляция синтеза жирных кислот.
Скорость синтеза жирных кислот определяется как активностью регуляторного фермента - ацетил-КоА-карбоксилазы, так и зависит от ряда других факторов. Активность ацетил-КоА-карбоксилазы регулируется несколькоми механизмами:
после еды в абсорбтивный период под действием гормона инсулина активируется фермент фосфатаза, который переводит ацетил-КоАкарбоксилазу в дефосфорилированную активную форму (рис. 8.10). Цитрат активирует ассоциацию дефосфорилированных протомеров, и фермент становится активным (рис. 8.11);
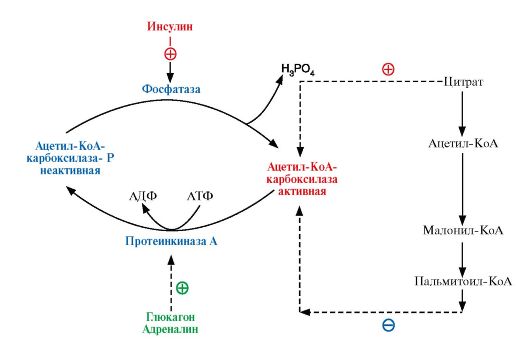 Рис. 8.10. Регуляция ацетил-КоА-карбоксилазы
Рис. 8.10. Регуляция ацетил-КоА-карбоксилазы
В абсорбтивный период инсулин стимулирует дефосфорилирование ацетил-КоАкарбоксилазы, цитрат активирует объединение протомеров и фермент становится активным. При голодании (под действием глюкагона) и при физической работе (под действием адреналина) фермент фосфорилируется и становится неактивным
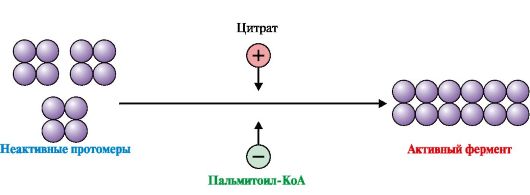 Рис. 8.11. Регуляция ацетил-КоА-карбоксилазы путем ассоциации (диссоциации) протомеров
Рис. 8.11. Регуляция ацетил-КоА-карбоксилазы путем ассоциации (диссоциации) протомеров
• инсулин не только активирует регуляторный фермент ацетил-КоАкарбоксилазу, но и индуцирует его синтез и синтез ряда других ферментов, участвующих в превращении продуктов катаболизма глюкозы в жирные кислоты (рис. 8.12). Поэтому длительное избыточное потребление углеводов активирует синтез жирных кислот и жиров, что ведет к ожирению;
• при голодании или физической работе гормоны глюкагон или адреналин, активируя аденилатциклазную систему, переводят ацетил-КоАкарбоксилазу в фосфорилированную неактивную форму. ПальмитоилКоА - конечный продукт синтеза - стимулирует диссоциацию протомеров, ускоряя инактивацию фермента.
Таким образом, в результате гормональной регуляции синтез жирных кислот активируется в абсорбтивный период (после еды) и ингибируется при голодании и физической работе, причем это происходит не только за счет изменения активности ферментов, но и путем индукции или репрессии ферментов, участвующих в синтезе жирных кислот из углеводов
(рис. 8.12).
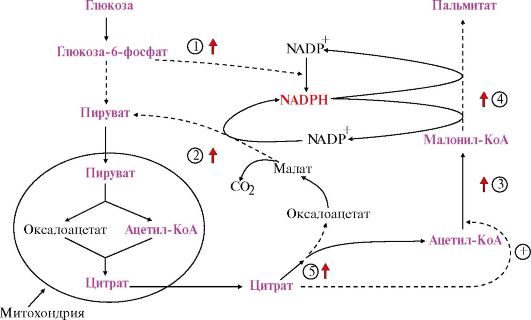 Рис. 8.12. Синтез жирных кислот из продуктов катаболизма глюкозы
Рис. 8.12. Синтез жирных кислот из продуктов катаболизма глюкозы
- индуцируемый фермент) При длительном избыточном потреблении углеводов под действием гормона инсулина происходит индукция синтеза ферментов, участвующих как в образовании субстратов синтеза жирных кислот, так и непосредственно в их синтезе: 1 - глюкозо- 6-фосфат-дегидрогеназа, 2 - малик-фермент, 3 - ацетил-КоА-карбоксилаза, 4 - синтаза жирных кислот, 5 - цитратлиаза
ТЕМА 8.5. БИОСИНТЕЗ ЖИРОВ В ПЕЧЕНИ И ЖИРОВОЙ ТКАНИ. РЕГУЛЯЦИЯ СИНТЕЗА ЖИРОВ
1. Жиры - наиболее компактная форма запасания энергетического материала, поэтому избыточное количество углеводов, получаемых с пищей, перерабатывается в жиры и запасается в адипоцитах. Синтез жиров происходит в абсорбтивный период и стимулируется инсулином. Наиболее активно синтез жиров происходит в печени, жировой ткани и лактирующей молочной железе.
2. Для синтеза жиров необходимы глицерол в виде глицерол-3-фосфата (рис. 8.13) и активные формы жирных кислот - ацил-КоА. Глицерол вначале должен превратиться в глицерол-3-фосфат. В печени глицерол-3-фосфат образуется двумя путями:
а) при восстановлении дигидроксиацетонфосфата (метаболита гликолиза);
б) при фосфорилировании глицеролкиназой свободного глицерола, попадающего в печень из крови.
В жировой ткани фермент глицеролкиназа отсутствует и единственным источником глицерол-3-фосфата является дигидроксиацетонфосфат, образующийся в процессе гликолиза, поэтому одновременно с синтезом жиров в адипоцитах должны проходить реакции гликолиза.
3. В печени жирные кислоты, необходимые для синтеза жиров, синтезируются в основном из продуктов катаболизма глюкозы. Далее синтез жиров идет через образование фосфатидной кислоты (рис. 8.13).
Синтезированные в гепатоцитах жиры упаковываются в незрелые ЛПОНП, главным белковым компонентом которых является апоВ-100. Этот белок кодируется тем же геном, что и белок В-48 в слизистой тонкой кишки, однако в гепатоцитах он соответствует всей кодирующей части гена (100%), а в кишечнике в результате посттранскрипционных изменений считывается только 48% гена, поэтому этот белок называют апоВ-48. В крови ЛПОНП получают апоЕ и С-II от ЛПВП и превращаются в зрелые ЛПОНП, функцией которых является транспорт кровью жиров, синтезированных в печени, в другие органы, главным образом в жировую ткань.
4. В капиллярах жировой и других тканей жиры в составе ЛПОНП и хиломикронов подвергаются гидролизу под действием липопротеинлипазы. Этот фермент «узнает» на поверхности липопротеинов белок апоС-II, активируется им и гидролизует ТАГ, входящие в состав липопротеинов, до глицерола и жирных кислот. В разных тканях находятся изоформы ЛП-липазы, отличающиеся значениями Кш. В капиллярах жировой ткани значение Кm выше - следовательно, этот фермент активно работает при высокой концентрации липопротеинов в крови в абсортивный период; в мышцах Кш ниже - следовательно, мышцы могут утилизировать жирные кислоты, освобождающиеся из липопротеинов, и при более низкой их концентрации в крови. Жирные кислоты, освободившиеся под действием
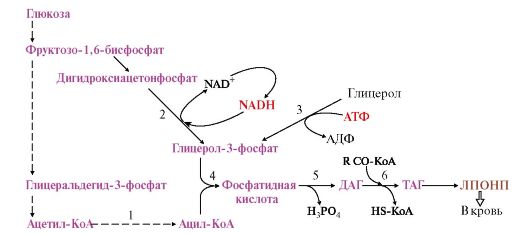 Рис. 8.13. Синтез жиров в печени
Рис. 8.13. Синтез жиров в печени
Синтез жиров в печени происходит в основном из продуктов катаболизма глюкозы. После еды образующийся в результате гликолиза избыток ацетил-КоА активно используется для синтеза жирных кислот (1). Глицерол-3-фосфат образуется двумя путями (2, 3). Синтез ТАГ происходит через образование фосфатидной кислоты (4), при дефосфорилировании которой образуется ДАГ (5). Следующая реакция ацилирования превращает его в ТАГ (6). ТАГ в составе ЛПОНП секретируются в кровь
ЛП-липазы, из крови поступают в клетки и используются по-разному: в адипоцитах - для синтеза жиров и их депонирования (рис. 8.14), а в миокарде и скелетных мышцах они окисляются, образуя АТФ, необходимый для работы этих тканей.
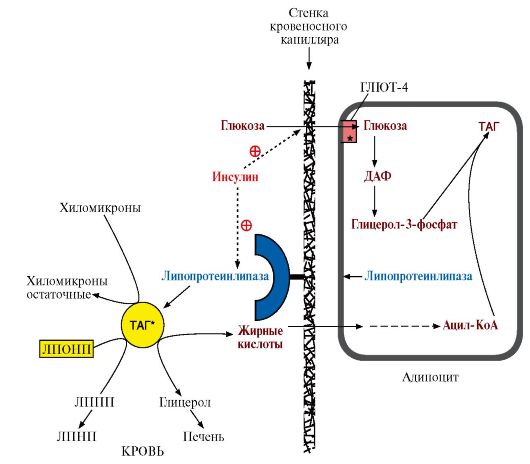
5. Запасание жиров в жировой ткани - так называемое депонирование жиров - происходит в абсорбтивный период, когда увеличивается соотношение инсулин - глюкагон.
Инсулин активирует:
• синтез ЛП-липазы и ее экспонирование на поверхности капилляров в жировой ткани;
• транспорт глюкозы внутрь адипоцитов, стимулируя включение ГЛЮТ-4 в плазматическую мембрану, так как жировая ткань является инсулинзависимой;
• гликолиз, что обеспечивает образование глицерол-3-фосфата и АТФ, необходимых для синтеза жиров;
• пентозофосфатный путь, в ходе которого восстанавливается NADP+, необходимый для синтеза жирных кислот.
6. Сравнение гликогена и жиров как запасаемых энергоносителей. По существу роль гликогена и жиров в организме одинакова - это формы запасания энергии. Однако между ними есть и значительные различия как в количественном, так и в функциональном отношении.
 Жиров в организме содержится в приблизительно в 30 раз больше, чем гликогена (табл. 8.5.)
Жиров в организме содержится в приблизительно в 30 раз больше, чем гликогена (табл. 8.5.)
Таблица 8.5. Гликоген и жиры в организме человека
Параметр, кг | Гликоген | Жиры |
Содержание в организме | 0,3 | 10 |
Суточное потребление | ~0,4 | 0,1 |
Если учесть, что жиры и по калорийности превосходят углеводы, то разница в запасе энергии в этих формах становится еще внушительнее. Запаса гликогена хватает примерно на 1 сутки голодания, в то время как жиров - на много недель.
Суточное потребление углеводов превышает содержание гликогена в организме. Это значит, что полное обновление гликогена в организме может произойти менее чем за 2 суток (например, после суточного голодания и последующих приемов пищи в течение дня). За 1 сутки может обновиться только 1/100 всего запаса жиров.
Запасы гликогена в клетках расходуются на всем протяжении суток, за исключением примерно двухчасовых промежутков после приемов пищи. Жиры, депонированные в жировой ткани, могут и не расходоваться, поскольку при обычном ритме питания в крови постоянно имеются липопротеины, снабжающие органы жирными кислотами. Таким образом, можно считать, что липопротеины выполняют не только транспортную функцию, но и функцию краткосрочного запасания жиров. По роли в энергетическом обмене жиры липопротеинов (хиломикронов и ЛПОНП) в большей мере сходны с гликогеном, чем жиры, депонированные в жировой ткани.
Важной особенностью жиров является то, что при их гидролизе образуется два функционально различных продукта - жирные кислоты и глицерол. Глицерол используется для глюконеогенеза (наряду с аминокислотами) и тем самым участвует в обеспечении глюкозой клеток мозга и других глюкозозависимых клеток при голодании, а окисление жирных кислот является источником АТФ для многих тканей.
ТЕМА 8.6. ОЖИРЕНИЕ
1. Ожирение - это увеличение отложения жира в адипоцитах по сравнению с нормой. В норме у человека с массой тела около 70 кг количество жира в депо составляет около 10-11 кг. Важной характеристикой содержания жира в организме является индекс массы тела (ИМТ), который рассчитывается по
формуле:
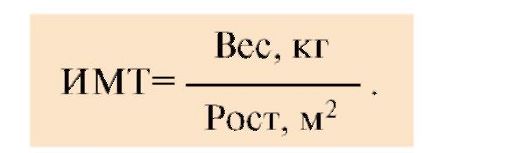 Нормальное значение ИМТ лежит в пределах 20-24,9 кг/м2. При значениях 25-29,9 кг/м2 человек имеет избыточный вес, а значения >30 указывают на ожирение.
Нормальное значение ИМТ лежит в пределах 20-24,9 кг/м2. При значениях 25-29,9 кг/м2 человек имеет избыточный вес, а значения >30 указывают на ожирение.
Ожирение очень распространено: оно наблюдается почти у 50% людей старше 50 лет.
При развитии ожирения сначала увеличивается размер адипоцитов, но при дальнейшем увеличении количества жира, когда существующие адипоциты заполнены, преадипоциты могут дифференцироваться в дополнительные адипоциты. В норме количество адипоцитов после рождения до 22-25 лет
увеличивается в среднем в пять раз. Постоянное переедание, особенно в раннем возрасте, приводит к гиперплазии адипоцитов и к развитию тяжелых форм ожирения. При лечении ожирения наблюдают уменьшение количества жиров в адипоцитах, но количество самих адипоцитов практически не изменяется.
2. Первичное ожирение развивается в результате алиментарного дисбаланса - избыточной калорийности питания по сравнению с расходами энергии.
Количество потребляемой пищи зависит от многих факторов, в том числе и от регуляции чувства голода и насыщения. Чувство голода и насыщения определяются концентрацией в крови глюкозы, а также некоторых аминокислот и гормонов, которые инициируют чувство насыщения - холецистокинина, нейротензина, бомбезина, лептина.
Важным социальным фактором развития первичного ожирения является нерациональное гиперкалорийное питание в семье, потребление продуктов fast food, обладающих избыточной калорийностью и низким содержанием ценных питательных веществ.
3. Генетические факторы в развитии ожирения. Метаболические различия между тучными и худыми людьми до настоящего времени не могут быть определены однозначно. Имеется несколько теорий, объясняющих эти различия:
1) генетически детерминированная разница в функционировании бесполезных циклов. Эти циклы состоят из пары метаболитов, которые превращаются друг в друга с помощью двух ферментов. Одна из этих ферментативных реакций идет с затратой АТФ. Например:
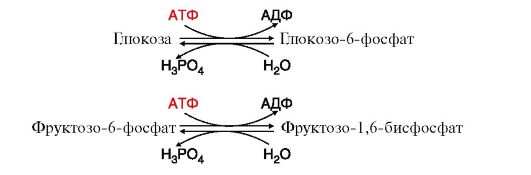 Если
прямая и обратная реакции субстратных циклов протекают одновременно, то
происходит бесполезный расход АТФ и, соответственно, источников
энергии. В этом случае количество продуктов катаболизма глюкозы,
доступное для синтеза жиров, уменьшается и, следовательно, тормозится
синтез жиров;
Если
прямая и обратная реакции субстратных циклов протекают одновременно, то
происходит бесполезный расход АТФ и, соответственно, источников
энергии. В этом случае количество продуктов катаболизма глюкозы,
доступное для синтеза жиров, уменьшается и, следовательно, тормозится
синтез жиров;
2) у людей, склонных к ожирению, вероятно, имеется более прочное сопряжение дыхания и окислительного фосфорилирования, т.е. более эффективный метаболизм;
3) у худых и тучных людей возможно разное соотношение аэробного и анаэробного гликолиза. При анаэробном гликолизе, как менее эффективном, «сжигается» гораздо больше глюкозы, в результате чего снижается ее переработка в жиры.
4. У человека и животных имеется ген ожирения - obese gene. Мутации в этом гене приводят к развитию ожирения. Продуктом экспрессии гена ожирения является белок ob. Тривиальное название этого белка «лептин» (от греч. «тонкий, худой»). Он состоит из 145 аминокислот и секретируется в кровь адипоцитами. Получены доказательства того, что лептин действует как гормон, контролирующий массу жировой ткани. К настоящему времени описаны пять мутаций в гене лептина, которые ассоциируются с фенотипом ожирения. Для этого фенотипа характерны повышенное отложение жиров в жировой ткани, чрезмерное потребление пищи, низкая физическая активность и развитие сахарного диабета II типа. Патогенез ожирения при дефекте гена ob может быть следующим: низкий уровень лептина в крови является сигналом недостаточного количества запаса жиров в организме. Этот сигнал включает механизмы, приводящие к повышению аппетита и, в результате, к увеличению массы тела. Однако ожирение у человека является полигенным заболеванием и может быть вызвано различными причинами. Даже если жировые клетки продуцируют достаточное количество лептина, ожирение может развиваться в результате снижения чувствительности рецепторов к лептину: создается более высокий порог чувствительности к концентрации лептина, прежде чем включаются механизмы, приводящие к снижению массы тела.
5. Вторичное ожирение - это тип ожирения, которое развивается в результате какого-либо основного заболевания, чаще всего эндокринного, например гипотиреоза.
Ожирение является фактором развития многих заболеваний, таких как сахарный диабет II типа, гипертоническая болезнь, атеросклероз. Комплекс заболеваний, причина которых - увеличение массы жировой ткани, объединяется в понятие «метаболический синдром». У людей с ожирением в крови увеличена концентрация жирных кислот, холестерола и жиров.
Адипоциты являются не только тканью, аккумулирующей жиры, но и клетками, выделяющими различные гормоны (кроме лептина) и цитокины. Нарушение баланса этих веществ при ожирении приводит к развитию инсулинрезистентности тканей и к развитию сахарного диабета.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Напишите реакцию, катализируемую регуляторным ферментом метаболического пути биосинтеза жирных кислот. Изобразите формулу кофермента, участвующего в этой реакции, и опишите его функцию в реакции.
2. Используя рис. 8.7 и 8.10, напишите схемы реакций, показывающих роль цитрата в биосинтезе жирных кислот.
3. Напишите суммарное уравнение биосинтеза пальмитиновой кислоты и подсчитайте количество циклов, необходимых для ее синтеза.
4. Рассчитайте, сколько молей АТФ необходимо затратить для синтеза пальмитиновой кислоты. Изобразите реакцию, которая идет с затратой АТФ.
5. Запишите реакции, происходящие с участием NАDРH в первом цикле биосинтеза жирных кислот.
6. Перенесите в тетрадь табл. 8.6 и заполните в ней колонку «Биосинтез», отражающие основные характеристики биосинтеза жирных кислот.
Таблица 8.6. Сравнение процессов биосинтеза и β-окисления жирных кислот
Процесс | Биосинтез | β-Окисление |
Локализация процесса | ||
Исходный субстрат | ||
Переносчик субстрата через митохондриальную мембрану | ||
Коферменты окислительновосстановительных реакций | ||
Источник присоединяемого фрагмента или отщепляемый фрагмент | ||
Регуляторные ферменты | ||
Регуляторные факторы: активаторы ингибиторы | ||
7. Используя рис. 8.12, выпишите названия ферментов, участвующих в превращении продуктов катаболизма глюкозы в жирные кислоты, синтез кото-
рых индуцируется инсулином.
А. Б.
В. Г.
Д.
8. Запишите названия ферментов, выполняющих следующие функции:
а) освобождает исходный субстрат для синтеза жирных кислот в цитоплазме клетки;
б) восстанавливают NADP+;
в) катализирует циклические превращения, приводящие к удлинению углеродной цепи жирных кислот;
г) регуляторный фермент биосинтеза жирных кислот.
9. Перенесите табл. 8.7 в тетрадь и сравните особенности биосинтеза жиров в различных тканях.
Таблица 8.7. Особенности биосинтеза жиров в различных тканях
Ткань | Исходные субстраты синтеза | Тип липопротеина, транспортирующего жир из органа |
Слизистая оболочка тонкой кишки | ||
Печень | ||
Жировая ткань |
10. Опишите изменения в обмене жиров у человека, получившего с пищей 300 г углеводов. Для этого:
а) назовите гормон, определяющий состояние обмена жиров через 2часа после приема пищи;
б) перерисуйте в тетрадь рис. 8.15. Вместо номера в схеме впишите соответствующее вещество из перечисленных ниже:
A. Фосфатидная кислота Б. Ацетил-КоА
B. Малонил-КоА
Г. ТАГ
Д. Дигидроксиацетонфосфат
Е. ДАГ
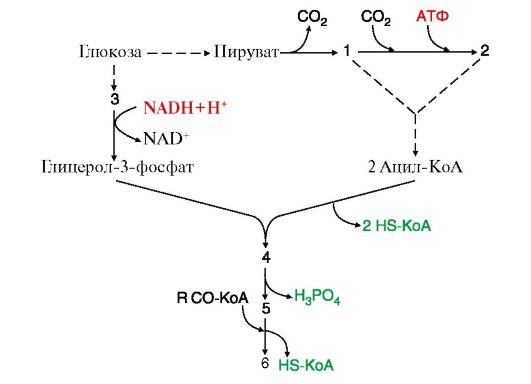 Рис. 8.15 Синтез жиров из углеводов в печени
Рис. 8.15 Синтез жиров из углеводов в печени
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Установите соответствие. Источники кислоты:
A. Образуется в организме из пальмитиновой кислоты
Б. Должна поступать с пищей, так как не синтезируется в организме
B. Может синтезироваться из незаменимой кислоты, поступающей с пищей
Г. Является основной жирной кислотой, синтезируемой в организме Д. Основная жирная кислота в составе молочного жира Жирная кислота
1. 18:2 Δ(9, 12)
2. 18:0
3. 20:4 Δ(5, 8, 11, 14)
2. Выберите правильные ответы.
Синтез жирных кислот будет увеличиваться при:
A. Повышении концентрации глюкозы в крови после еды Б. Снижении секреции инсулина
B. Увеличении секреции глюкагона
Г. Дефосфорилировании ацетил-КоА-карбоксилазы Д. Накоплении цитрата
3. Пищевая потребность взрослого человека при умеренной физической активности составляет:
A. Углеводы 250 г, белки 120 г, жиры 150 г Б. Углеводы 500 г, белки 50 г, жиры 120 г
B. Углеводы 400 г, белки 100 г, жиры 90 г Г. Углеводы 600 г, белки 150 г, жиры 200 г Д. Углеводы 800 г, белки 400 г, жиры 200 г
4. Выполните «цепное» задание:
а) исходный субстрат для синтеза жирных кислот поступает в цитоплазму в составе:
A. Ацетил-КоА Б. Изоцитрата
B. Оксалоацетата Г. Пирувата
Д. Цитрата
б) это вещество подвергается в цитоплазме действию:
A. Цитратсинтазы
Б. Ацетил-КоА-карбоксилазы
B. Синтазы жирных кислот Г. Цитратлиазы
Д. Пируваткарбоксилазы
в) продукт этого фермента непосредственно превращается в:
A. Малонил-КоА Б. Ацил-КоА
B. Бутирил-КоА
Г. Ацетоацил-КоА Д. Еноил-КоА
г) это вещество переносится на синтазу жирных кислот с помощью:
A. Ацетилтрансацилазы
Б. Ацилкарнитинтрансферазы
B. Пируваткиназы
Г. Малонилтрансацилазы Д. Цитратсинтазы
д) продукт этого фермента далее участвует в реакции:
A. Дегидратации Б. Восстановления
B. Гидратации
Г. Дегидрирования Д. Конденсации
е) в ходе этой реакции образуется радикал:
A. Пальмитоил Б. Ацетоацетил
B. β-Гидроксибутирил Г. Еноил
Д. Ацетил
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. 1-Б, 2-А, 3-В
2. А, Г, Д
3. В
4. а) Д, б) Г, в) А, г) Г, д) Д, е) Б
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Субстраты для синтеза высших жирных кислот и жиров
2. Биосинтез высших жирных кислот
3. Регуляция биосинтеза жирных кислот
4. Липогенез
5. Синтез жиров в печени и депонирование в жировой ткани
6. Роль ЛПОНП в транспорте жиров
7. Лептин
8. ИМТ - индекс массы тела
9. Первичное и вторичное ожирение
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
1. В клетках, где идет синтез жирных кислот, одновременно должен осуществляться и пентозофосфатный путь (ПФП) катаболизма глюкозы. Объясните взаимосвязь между этими процессами. Для этого:
1) укажите кофермент, который поставляет ПФП для реакций синтеза жирных кислот, и напишите реакции, протекающие с его участием;
2) напишите реакции ПФП, в которых этот кофермент восстанавливается;
3) напишите другие реакции, поставляющие этот кофермент для биосинтеза жирных кислот;
4) объясните, почему при синтезе жирных кислот используется большое количество этого кофермента.
2. Олеиновая кислота содержится в организме в довольно больших количествах как в составе ТАГ, так и в составе глицерофосфолипидов. Напишите реакции синтеза олеиновой кислоты из пальмитиновой, используя рис. 8.43 (учебник «Биохимия» под ред. Е.С. Северина, 2003)
Решите задачи
1. Пациент А с низкой физической активностью, имеющий избыточный вес, ежедневно в течение двух недель получал пищу, которая содержала 600 г углеводов, 100 г жиров, 120 г белков. Пациент Б того же возраста, имеющий нормальный вес, получал пищу, содержащую 300 г углеводов, 80 г жиров и 100 г белков, и выполнял умеренную физическую работу. Опишите разницу в метаболизме этих пациентов, выполнив задания:
а) объясните, какие отличия в соотношении инсулин - глюкагон в течение суток наблюдаются у этих пациентов;
б) напишите реакцию, катализируемую регуляторным ферментом синтеза жирных кислот;
в) представьте схемы, объясняющие возможные механизмы регуляции этого фермента;
г) напишите краткие схемы метаболических путей, активность которых повышена у пациента А по сравнению с пациентом Б.
2. Экспериментальные животные получали с пищей только глюкозу, содержащую радиоактивные атомы углерода. Через несколько часов исследовали жиры, содержащиеся в адипоцитах, и обнаружили радиоактивный углерод и в составе глицерола и радикалов жирных кислот. Объясните это, написав соответствующие схемы.
3. После еды, содержащей 300 г углеводов, 30 г жиров и 100 г белков, человек находится в состоянии покоя в течение 2 часов. Как изменится обмен веществ в печени и жировой ткани в этих условиях? При ответе:
а) напишите необходимые схемы;
б) укажите состав липопротеинов крови через 2 часа после еды, нарисовав соответствующую липидограмму;
в) изобразите схему транспорта жиров кровью в данной ситуации.
4. При обследовании пациентов, страдающих первичным ожирением, часто наблюдается гипертриацилглицеролемия, у них повышена концентрация ЛПОНП. Как можно объяснить изменения в составе крови у этих пациентов?
При ответе:
а) дайте определение первичного ожирения;
б) укажите причины первичного ожирения;
в) напишите схему, объясняющую увеличение ТАГ и ЛПОНП в сыворотке крови пациентов;
г) укажите возможные последствия ожирения.
5. Рассчитайте свой ИМТ, сравните его с нормой, сделайте заключение о его величине и дайте себе рекомендации по питанию.
Модульная единица 3 ЖИРЫ, ЖИРНЫЕ КИСЛОТЫ И КЕТОНОВЫЕ ТЕЛА КАК ИСТОЧНИКИ ЭНЕРГИИ. ЭЙКОЗАНОИДЫ, СТРОЕНИЕ, СИНТЕЗ И БИОЛОГИЧЕСКИЕ ФУНКЦИИ
Цели изучения Уметь:
1. Использовать знания о мобилизации жиров и β-окислении жирных кислот для понимания механизмов обеспечения энергией организма при голодании, физической работе, переохлаждении.
2. Применять знания о механизмах синтеза и использования кетоновых тел как дополнительного источника энергии при голодании, физической работе, сахарном диабете.
3. Интерпретировать результаты биохимических исследований крови и мочи при кетонемии и кетонурии.
4. Использовать знания о синтезе и биологических эффектах эйкозаноидов для понимания механизмов регуляции тонуса гладкой мускулатуры, свертывания крови, воспаления и для понимания действия лекарственных препаратов, влияющих на эти процессы.
Знать:
1. Механизмы гормональной регуляции мобилизации жиров.
2. Реакции β-окисления жирных кислот, расчет выхода АТФ.
3. Реакции синтеза и окисления кетоновых тел, причины и механизмы развития кетоацидоза.
4. Биологическую роль полиеновых кислот как предшественников эйкозаноидов.
5. Основные этапы синтеза эйкозаноидов, их биологические эффекты, механизмы действия лекарств - ингибиторов синтеза эйкозаноидов.
ТЕМА 8.7. МОБИЛИЗАЦИЯ ЖИРА. ГОРМОНАЛЬНАЯ
РЕГУЛЯЦИЯ МОБИЛИЗАЦИИ ЖИРОВ
1. Жиры, депонированные в адипоцитах в абсорбтивный период, используются как источник энергии в период голодания и при длительной физической работе. Жиры являются самыми высококалорийными веществами в организме, так как жирные кислоты, входящие в их состав, являются наиболее восстановленными молекулами (т.е. содержащими много связей -СН2-), при окислении которых выделяется большое количество энергии. Так, при окислении 1 г жиров выделяется 9,7 ккал, а 1 г углеводов - 4,7 ккал.
2. Мобилизация жира происходит в основном под действием гормонов глюкагона и адреналина и представляет собой гидролиз жира в адипоцитах до жирных кислот и глицерола ферментом - гормончувствительной
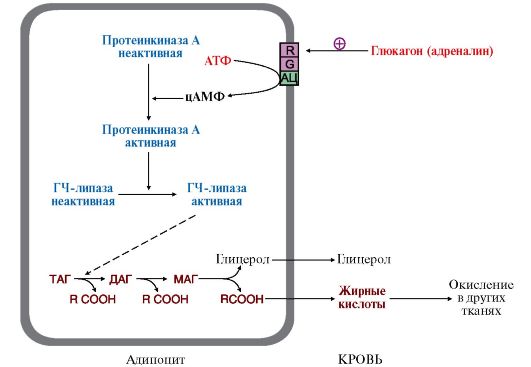 Рис. 8.16. Мобилизация жира из жировых депо
Рис. 8.16. Мобилизация жира из жировых депо
ГЧ-липаза - гормончувствительная липаза (ТАГ-липаза).
После отделения первой жирной кислоты под действием ТАГ-липазы остальные сложноэфирные связи в ДАГ и МАГ гидролизуются другими липазами
липазой (или ТАГ-липазой) (рис. 8.16). Этот фермент находится в адипоцитах и активируется путем фосфорилирования через аденилатциклазную систему. Кроме гормончувствительной липазы, в регуляции мобилизации жиров участвует и белок перилипин, который в дефосфорилированной форме покрывает капли жира в адипоцитах (рис. 8.17), а при фосфорилировании отделяется от них, и молекулы ТАГ становятся доступными действию гормончувствительной липазы.
Мобилизация жиров стимулируется также норадреналином, секретируемым симпатическими нервными окончаниями при физической работе и стрессе и передающим сигнал через аденилатциклазную систему. Действие норадреналина через синапсы более эффективно, чем действие циркулирующего в крови адреналина.
3. В результате мобилизации жиров концентрация жирных кислот в крови увеличивается приблизительно в два раза. Время полужизни жирных кислот очень мало (менее 5 минут); это означает, что существует быстрый поток жирных кислот из жировой ткани к другим органам. Жирные кислоты, как гидрофобные молекулы, транспортируются кровью в периферические ткани в комплексе с белком альбумином, имеющим центры связывания гидрофобных молекул.
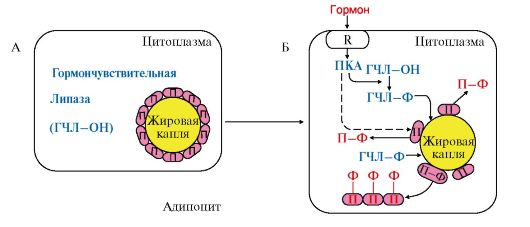 Рис. 8.17. Роль перилипина в регуляции мобилизации жиров из жировой ткани
Рис. 8.17. Роль перилипина в регуляции мобилизации жиров из жировой ткани
А - до действия глюкагона; Б - после действия гормона
Перилипин (П) фосфорилируется протеинкиназой А и отделяется от жировой капли. Фосфорилированная гормончувствительная липаза (ГЧЛ) получает доступ к субстрату - ТАГ и начинает их гидролиз. П-Ф - перилипин фосфорилированный
ТЕМА 8.8. β-ОКИСЛЕНИЕ ВЫСШИХ ЖИРНЫХ КИСЛОТ - ИСТОЧНИК ЭНЕРГИИ ДЛЯ СИНТЕЗА АТФ. РЕГУЛЯЦИЯ I -ОКИСЛЕНИЯ
1. Жирные кислоты, как и глюкоза, являются основными «топливными молекулами». Большинство тканей, кроме нервной ткани, эритроцитов (в которых отсутствуют митохондрии), использует жирные кислоты как источник энергии.
Жирные кислоты, проникающие из крови в клетку, сначала подвергаются реакции активации под действием фермента ацил-КоА-синтетазы:
 Жирные кислоты могут вступать в различные реакции: окисления, синтеза ТАГ или фосфолипидов только в виде КоА-производных.
Жирные кислоты могут вступать в различные реакции: окисления, синтеза ТАГ или фосфолипидов только в виде КоА-производных.
2. β-Окисление жирных кислот - это специфический путь катаболизма
жирных кислот, продуктом которого является ацетил-КоА. Название «β-окисление» эти реакции получили потому, что окисление в радикале жирной кислоты происходит по β-углеродному атому. β-Окисление жирных кислот и последующее за ним окисление ацетил-КоА в ЦТК служат источником энергии для синтеза АТФ.
Процесс β-окисления происходит в матриксе митохондрий и только в аэробных условиях, так как он связан с ЦПЭ через коферменты дегидрогеназ, водород от которых поступает в ЦПЭ. Внутренняя мембрана митохондрий непроницаема для ацил-КоА, поэтому существует система переноса
радикала жирных кислот через мембрану в комплексе с молекулой карнитина (рис. 8.18). Фермент карнитинацилтрансфераза I, осуществляющий перенос ацила на карнитин на внешней мембране митохондрий, является регуляторным в процессе β-окисления, так как определяет скорость переноса жирных кислот внутрь митохондрий.
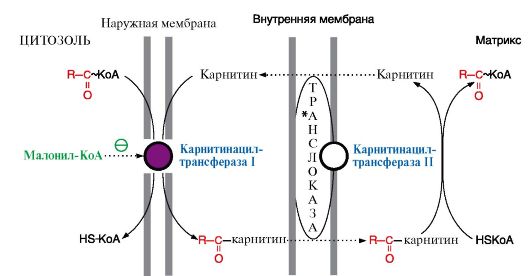 Рис. 8.18. Транспорт высших жирных кислот через мембраны митохондрий
Рис. 8.18. Транспорт высших жирных кислот через мембраны митохондрий
Во внешней мембране митохондрий находится фермент карнитинацилтрансфераза I, который катализирует перенос ацила с КоА на небольшую молекулу - карнитин. Затем ацилкарнитин с помощью транслоказы проходит через внутреннюю мембрану митохондрий, где фермент карнитинацилтрансфераза II переносит ацил на внутримитохондриальный HS-KoA. Фермент карнитинацилтрансфераза I - регуляторный в процессе β-окисления, ингибитором этого фермента является малонил-КоА
3. После того как ацил-КоА попадает в матрикс митохондрий, начинается процесс β-окисления, представляющий собой четыре последовательные реакции, которые заканчиваются укорочением жирной кислоты на два углеродных атома, отделяющиеся в форме ацетил-КоА (рис. 8.19). Эти четыре реакции β-окисления (дегидрирование, гидратация, дегидрирование, отщепление ацетил-КоА) обычно называют «циклом β-окисления», так как имеется в виду, что одни и те же реакции повторяются с радикалом жирной кислоты до тех пор, пока вся кислота не превратится в ацетильные остатки.
Количество молекул АТФ, которые образуются при окислении жирной кислоты, можно рассчитать по формуле:
 2* - энергия двух макроэргических связей АТФ используется на активацию жирной кислоты.
2* - энергия двух макроэргических связей АТФ используется на активацию жирной кислоты.
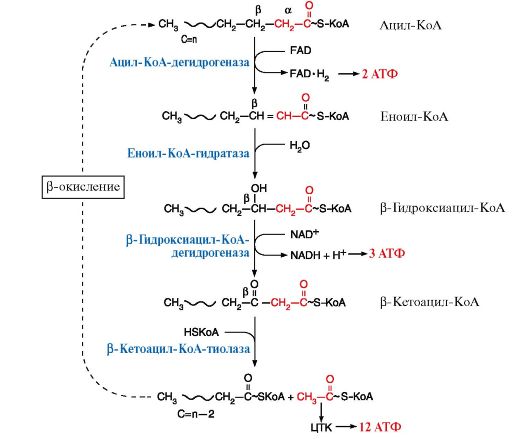 Рис. 8.19. Реакции β-окисления жирных кислот
Рис. 8.19. Реакции β-окисления жирных кислот
 4. Регуляция β-окисления. Скорость процесса β-окисления зависит от ряда факторов:
4. Регуляция β-окисления. Скорость процесса β-окисления зависит от ряда факторов:
• состояния голодания или сытости (т.е. соотношения инсулин - глюкагон);
• активности регуляторного фермента карнитинацилтрансферазы I;
• доступности субстрата - жирных кислот;
• потребности клетки в энергии;
• доступности кислорода.
Под действием инсулина, гормона «сытого состояния» в клетках печени появляется ингибитор регуляторного фермента карнитинацилтрансферазы I - малонил-КоА (рис. 8.18). Это вещество образуется в первой реакции синтеза жирных кислот, катализируемой регуляторным ферментом синтеза жирных кислот - ацетил-КоА-карбоксилазой. Появление в гепатоцитах малонил-КоА немедленно ингибирует β-окисление жирных кислот, таким образом, синтез и окисление жирных кислот не могут происходить одновременно. При голодании или физической работе под действием гормонов глюкагона или адреналина синтез малонил-КоА снижается и скорость β-окисления увеличивается, следовательно, окисление жирных кислот становится важным источником энергии при голодании или длительной физической работе.
В мышцах карнитинацилтрансфераза I также ингибируется малонилКоА. Хотя эта ткань не синтезирует жирные кислоты, в ней имеется изофермент ацетил-КоА-карбоксилазы, синтезирующий малонил-КоА для регуляции β-окисления. Этот изофермент фосфорилируется под действием протеинкиназы А, активируемой в клетках адреналином, и АМФ-зависимой протеинкиназой и таким образом ингибируется; концентрация малонилКоА снижается. Следовательно, при физической работе, когда в клетке появляется АМФ, под действием адреналина активируется β-окисление, однако его скорость зависит еще и от доступности кислорода. Поэтому β-окисление становится источником энергии для мышц только через 10-20 минут после начала физической нагрузки (так называемые аэробные нагрузки), когда приток кислорода к тканям увеличивается.
5. При голодании и физической работе активируется липолиз в жировой ткани и поток жирных кислот в ткани увеличивается. Жирные кислоты становятся важным источником энергии для таких тканей, как скелетные мышцы, миокард, печень. Однако мозг не может использовать жирные кислоты как источник энергии, потому что они не проникают через гематоэнцефалический барьер, являясь гидрофобными молекулами. Поэтому в таких ситуациях, особенно при длительном голодании, печень перерабатывает ~50% поступающих в нее жирных кислот в другие источники энергии - кетоновые тела, которые может утилизировать нервная ткань.
ТЕМА 8.9. КЕТОНОВЫЕ ТЕЛА: СИНТЕЗ И КАТАБОЛИЗМ.
КЕТОАЦИДОЗ
1. К кетоновым телам относят три вещества: β-гидроксибутират, ацетоацетат и ацетон.
Только первые два являются источниками энергии и могут окисляться в тканях. В норме концентрация кетоновых тел в крови невелика и составляет 1-3 мг/дл. Синтез кетоновых тел увеличивается при:
• голодании;
• длительной интенсивной физической нагрузке;
• употреблении пищи, богатой жирами, но с низким содержанием углеводов (диета Аткинса, «кремлевская» диета);
• сахарном диабете.
Кетоновые тела являются водорастворимыми кислотами, поэтому в отличие от жирных кислот, они могут проходить через гематоэнцефалический барьер и служат, наряду с глюкозой, источником энергии для нервной ткани, особенно после 3-5 дней голодания, когда концентрация кетоновых тел в крови существенно увеличивается (рис. 8.20).
Скелетные мышцы и почки используют кетоновые тела даже при их низкой концентрации в крови.
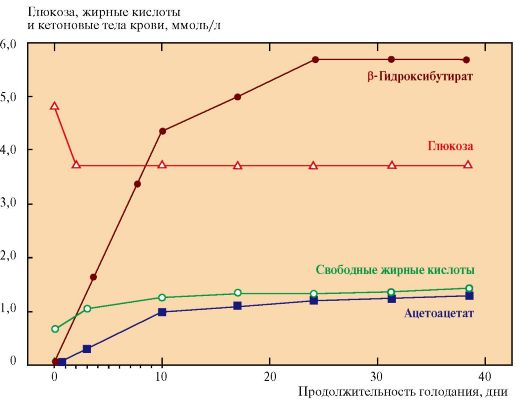 Рис. 8.20. Изменение концентрации глюкозы, жирных кислот и кетоновых тел в плазме крови при голодании
Рис. 8.20. Изменение концентрации глюкозы, жирных кислот и кетоновых тел в плазме крови при голодании
2. Синтез кетоновых тел происходит в митохондриях печени и в небольшом количестве - в корковом слое почек. Исходным субстратом синтеза служит ацетил-КоА, образующийся в результате β-окисления жирных кислот. Ситуация, в которой увеличивается синтез кетоновых тел, развивается следующим образом. При голодании гормон глюкагон (или адреналин при физической работе) через аденилатциклазную систему в жировой ткани активирует распад жира. Жирные кислоты выделяются в кровь и транспортируются в комплексе с альбуминами в печень. В печени увеличивается скорость β-окисления и образуется большое количество ацетил-КоА. Скорость реакций цикла Кребса в этих условиях снижена в результате ингибирования регуляторных ферментов цитратного цикла аллостерическими ингибиторами АТФ и NADH, концентрация которых повышена в результате активного β-окисления. Кроме того, при высокой концентрации NADH оксалоацетат восстанавливается до малата и в такой форме переносится в цитозоль, где реакция идет в обратном направлении. Оксалоацетат становится субстратом для глюконеогенеза и менее доступен для взаимодействия с ацетил-КоА. В результате в митохондриях накапливается ацетил-КоА, который используется для синтеза кетоновых тел (рис. 8.21, 8.22).
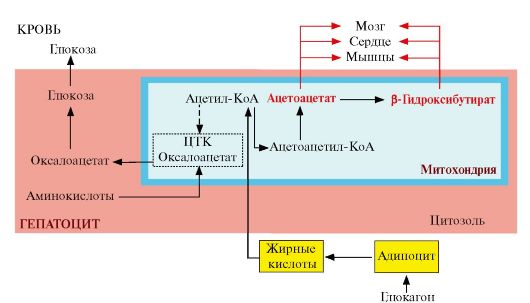 Рис. 8.21. Активация синтеза кетоновых тел при голодании
Рис. 8.21. Активация синтеза кетоновых тел при голодании
Пунктирная линия - скорость метаболических путей снижена, сплошная линия - повышена. При голодании в результате преобладания действия глюкагона активируются липолиз в жировой ткани и β-окисление в печени. Количество оксалоацетата в митохондриях уменьшается, так как его образуется меньше, и, кроме того, он выходит в цитозоль (восстанавливаясь до малата), где используется в глюконеогенезе. В результате скорость использования ацетил-КоА в ЦТК снижается и он используется для синтеза кетоновых тел. Синтез кетоновых тел значительно увеличивается при сахарном диабете
Основным кетоновым телом в крови является β-гидроксибутират (рис. 8.22), так как равновесие в реакции Ацетоацетат β-Гидроксибутират сдвинуто вправо из-за присутствия высоких концентраций NАDН, который восстанавливается в реакциях β-окисления, протекающих, как и синтез кетоновых тел, в матриксе митохондрий. Повышение концентрации кетоновых тел в крови называют кетонемией.
3. Регуляция синтеза кетоновых тел осуществляется через фермент ГМГ-КоА-синтазу (рис. 8.22). Этот фермент ингибируется при высоких концентрациях свободного кофермента HS-КоА. Таким образом скорость синтеза кетоновых тел координируется с количеством жирных кислот, поступающих в печень. В ситуациях голодания, сахарного диабета, тяжелой физической работы под действием гормонов глюкагона и адреналина происходит мобилизация ТАГ из жировой ткани, поток жирных кислот в печень увеличивается и HS-КоА связывается с жирными кислотами в ацилКоА. Концентрация свободного HS-КоА снижается и синтез кетоновых тел увеличивается.
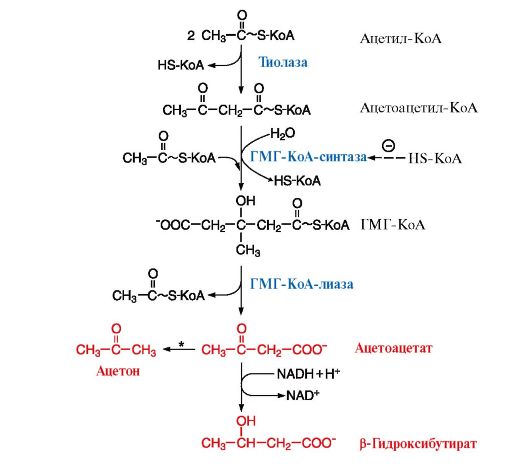 Рис. 8.22. Синтез кетоновых тел в митохондриях гепатоцитов
Рис. 8.22. Синтез кетоновых тел в митохондриях гепатоцитов
* - реакция происходит неферментативно только при высокой концентрации ацетоацетата в крови, например при длительном голодании или сахарном диабете
4. Окисление кетоновых тел как источников энергии происходит во многих тканях (рис. 8.23). В печени отсутствует фермент, необходимый для активации кетоновых тел - сукцинил-КоА-ацетоацетаттрансфераза. Поэтому печень не окисляет кетоновые тела и продуцирует их только на «экспорт». Эритроциты, в которых отсутствуют митохондрии, также не используют кетоновые тела.
5. При длительном голодании и особенно при сахарном диабете в крови существенно возрастает концентрация кетоновых тел и организм не успевает их утилизировать. При накоплении кетоновых тел развивается кетоацидоз, так как ацетоацетат и β-гидроксибутират - это легко диссоцирующие кислоты:
 Кетоацидоз
является опасным осложнением сахарного диабета. При высоких
концентрациях кетоновых тел в крови ацетоацетат неферментативно
декарбоксилируется, превращаясь в третье кетоновое тело - ацетон. Ацетон не утилизируется как источник энергии и выводится из организма.
Кетоацидоз
является опасным осложнением сахарного диабета. При высоких
концентрациях кетоновых тел в крови ацетоацетат неферментативно
декарбоксилируется, превращаясь в третье кетоновое тело - ацетон. Ацетон не утилизируется как источник энергии и выводится из организма.
Выведение кетоновых тел, в том числе и ацетона, с мочой (кетонурия), потом выдыхаемым воздухом является способом выведения избытка кетоновых тел из организма и уменьшения таким образом ацидоза.
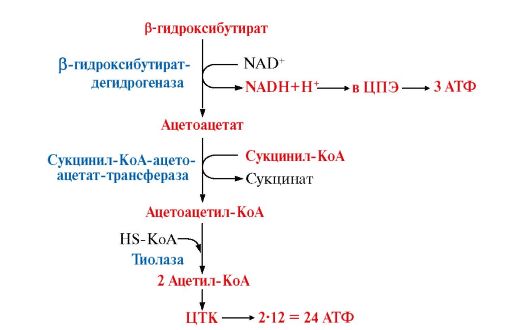 Рис. 8.23. Схема окисления кетоновых тел
Рис. 8.23. Схема окисления кетоновых тел
При окислении кетоновые тела активируются путем превращения ацетоацетата в ацетоацетил-КоА. Донором КоА является сукцинил-КоА. В результате окисления β-гидроксибутирата образуется 2 ацетил~КоА, которые далее окисляются в ЦТК. Таким образом при окислении β-гидроксибутирата образуется 27 молекул АТФ, но для активации ацетоацетата используется энергия одной макроэргической связи сукцинил-КоА, поэтому теоретический выход АТФ составляет 26 молекул АТФ
ТЕМА 8.10. ПРОИЗВОДНЫЕ ПОЛИЕНОВЫХ КИСЛОТ - ЭЙКОЗАНОИДЫ: СТРОЕНИЕ, БИОСИНТЕЗ И БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ
1. Эйкозаноиды - это большая группа веществ, которые могут синтезироваться почти всеми типами клеток, за исключением эритроцитов, и как гормоны местного действия оказывают эффекты по паракринному или аутокринному механизму через специфические рецепторы. Главные биологические эффекты эйкозаноидов:
• участвуют в регуляции сокращений гладкой мускулатуры (разные типы эйкозаноидов вызывают вазоконстрикцию или вазодилатацию, бронхоконстрикцию или бронходилатацию);
• регулируют экскрецию воды и Na+ почками и артериальное давление;
• участвуют в развитии воспаления;
• регулируют свертываемость крови (табл. 8.8).
Таблица 8.8. Биологическое действие основных типов эйкозаноидов
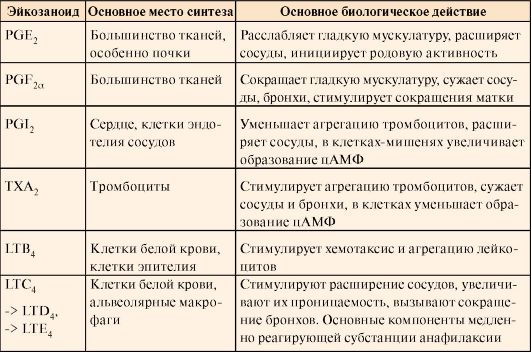 Основные классы эйкозаноидов представлены:
Основные классы эйкозаноидов представлены:
• простагландинами PG (включая простациклины);
• тромбоксанами;
• лейкотриенами.
2. Исходными субстратами для синтеза эйкозаноидов являются полиеновые жирные кислоты с 20 атомами углерода («эйкоза» по-гречески - 20). Главный субстрат для синтеза эйкозаноидов у человека - арахидоновая кислота (20:4 ω-6), также используются 20:5 ω-3 и 20:3 ω-6 жирные кислоты.
Полиеновые кислоты с 20 атомами углерода поступают в организм человека с пищей или образуются по следующим схемам из незаменимых жирных кислот с 18 атомами углерода, также поступающих с пищей:
 3. В разных тканях из арахидоновой кислоты под действием специфического для этой ткани набора ферментов образуются различные эйкозаноиды. Обычно в каждом типе клеток синтезируется преимущественно один тип эйкозаноидов.
3. В разных тканях из арахидоновой кислоты под действием специфического для этой ткани набора ферментов образуются различные эйкозаноиды. Обычно в каждом типе клеток синтезируется преимущественно один тип эйкозаноидов.
Образовавшиеся в клетке эйкозаноиды выходят из нее и взаимодействуют с рецепторами на поверхности этой же клетки (аутокринный механизм) или с рецепторами на соседних клетках (паракринный механизм). Время полураспада простагландинов равно нескольким минутам, однако за это время они вызывают существенные изменения в метаболизме тех тканей, где они образовались. Для каждого эйкозаноида есть несколько типов рецепторов, которые располагаются в мембране клеток рядом с аденилатциклазой, некоторые из простагландинов взаимодействуют с G-белками аденилатциклазной системы. Такие простагландины, взаимодействуя со своими рецепторами, могут модулировать активность аденилатциклазы. Например, PGE1 увеличивает количество цАМФ в некоторых клетках, a PGE2 уменьшает. Ответ клетки на действие эйкозаноидов определяется типом ее рецепторов. Эйкозаноиды по сумме признаков определяют как гормоны местного действия, однако при некоторых патологических состояниях эйкозаноиды могут оказывать и системное действие, если их концентрация в крови увеличивается до соответствующего уровня, при котором они могут влиять на тонус гладкой мускулатуры в целом.
4. Номенклатура эйкозаноидов. Простагландины обозначаются символами, например PGA, где PG обозначает слово «простагландин», а буква, например, А - заместитель в 5-членном кольце в молекуле простагландина (рис. 8.24):
 Рис. 8.24. Строение основных классов эйкозаноидов
Рис. 8.24. Строение основных классов эйкозаноидов
R7 - алифатический радикал из семи атомов углерода, который содержит двойную связь и карбоксильную группу на конце; R8 - алифатический радикал, содержащий двойные связи и -ОН группу в положении 15
Каждая из групп эйкозаноидов отличается, кроме того, по числу двойных связей в боковых цепях. Число двойных связей обозначается нижним цифровым индексом, например PGEr.
Число двойных связей в боковых цепях зависит от предшественника - полиеновой кислоты, из которой образовались простагландины. Две двойные связи жирной кислоты - субстрата - используются при образовании кольца (рис. 8.25), а оставшиеся двойные связи находятся в радикалах, связанных с кольцом, и определяют серию простагландина: серия 1 - если одна двойная связь, серия 2 - если две двойные связи и т.д.
 5. Синтез эйкозаноидов начинается после отделения жирной кислоты от фосфолипидов мембран под действием фермента фосфолипазы A2.
Этот фермент активируется многими сигналами: гормонами, механическим
раздражением, медиаторами. Арахидоновая (или другая полиеновая) кислота
переходит в цитозоль клетки и становится доступной для синтеза
эйкозаноидов. Синтез основной группы эйкозаноидов - простагландинов,
простациклинов и тромбоксанов - начинается с действия на полиеновую
кислоту бифункционального фермента - простагландинсинтазы. Первый
активный центр этого фермента - циклооксигеназа; он формирует 5-членное
кольцо и присоединяет две молекулы кислорода, образуя нестабильный
пероксид - первичный простагландин PGG2.
5. Синтез эйкозаноидов начинается после отделения жирной кислоты от фосфолипидов мембран под действием фермента фосфолипазы A2.
Этот фермент активируется многими сигналами: гормонами, механическим
раздражением, медиаторами. Арахидоновая (или другая полиеновая) кислота
переходит в цитозоль клетки и становится доступной для синтеза
эйкозаноидов. Синтез основной группы эйкозаноидов - простагландинов,
простациклинов и тромбоксанов - начинается с действия на полиеновую
кислоту бифункционального фермента - простагландинсинтазы. Первый
активный центр этого фермента - циклооксигеназа; он формирует 5-членное
кольцо и присоединяет две молекулы кислорода, образуя нестабильный
пероксид - первичный простагландин PGG2.
PGG2 быстро восстанавливается до PGH2 в положении 15 вторым активным центром - пероксидазой, использующей восстановленный глутатион как донор водорода. Последующие превращения PGH2 зависят от типа тканей; например, тромбоксаны синтезируются в основном в тромбоцитах, простациклины - в клетках эндотелия сосудов, PGE2, PGF2a - во многих тканях.
Если арахидоновая кислота подвергается действию другого фермента - липоксигеназы, то образуются молекулы с тремя сопряженными двойными связями (отсюда название «лейкотриены»). Они имеют несколько вариантов структур и в основном участвуют в развитии аллергических реакций. Синтез большинства эйкозаноидов увеличивается при воспалительных процессах. Активность фосфолипазы А2 при этих состояниях повышается и субстраты становятся доступными для синтеза эйкозаноидов.
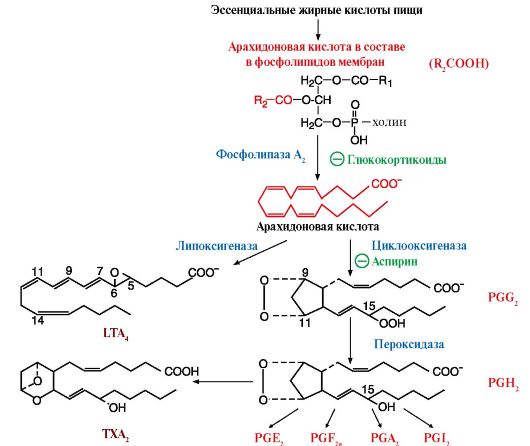 Рис. 8.25. Синтез эйкозаноидов
Рис. 8.25. Синтез эйкозаноидов
Полиеновые жирные кислоты, содержащие 20 углеродных атомов и от 3 до 5 двойных связей, обычно соединены со вторым атомом глицерола фосфолипидов мембран, отделяются под действием фосфолипазы А2 и после этого становятся субстратами для синтеза разных типов эйкозаноидов. Главные пути синтеза эйкозаноидов - циклооксигеназный, приводящий к синтезу простагландинов и тромбоксанов, и липоксигеназный, приводящий к синтезу лейкотриенов
6. Ингибиторами синтеза эйкозаноидов являются:
- глюкокортикоиды, которые индуцируют синтез группы белков - липокортинов, ингибирующих активность фосфолипазы А2, и таким образом подавляют синтез всех типов эйкозаноидов, участвующих в воспалении. Эти препараты обладают сильным противовоспалительным свойством, так как подавляют синтез всех эйкозаноидов.
- аспирин и другие нестероидные противовоспалительные препараты необратимо ингибируют циклооксигеназу (рис. 8.26).
7. Роль эйкозаноидов в регуляции свертывания крови. В норме свертывающая и противосвертывающая системы крови пребывают в состоянии равновесия, при котором кровь находится в жидком состоянии,
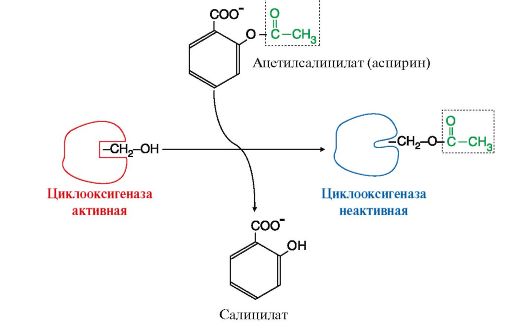 Рис. 8.26. Механизм инактивации циклооксигеназы аспирином
Рис. 8.26. Механизм инактивации циклооксигеназы аспирином
Ацетильный остаток переносится с молекулы аспирина на OH-группу фермента и необратимо ингибирует его
но способна быстро образовывать тромб при возникновении соответствующих условий. При патологии или при действии фармакологических средств это равновесие может смещаться в любую сторону. В норме клетки эндотелия сосудов продуцируют простациклины PGI2, PGE2, PGD2, которые препятствуют агрегации тромбоцитов и сужению сосуда (рис. 8.27); TXA2, стимулирующий агрегацию тромбоцитов, в этих условиях не секретируется. ТХА2 секретируется тромбоцитами только в результате их активации - например, при контакте с поврежденной стенкой кровеносного сосуда (рис. 8.28). При разрушении клеток эндотелия (например, в результате образования атеросклеротической бляшки) синтез PGI, PGE, PGD снижается. Тромбоциты активируются в месте контакта с поврежденной стенкой сосуда и секретируют ТХА2, что стимулирует образование тромба в области повреждения эндотелия сосудов и развитие инфаркта.
При изучении факторов риска развития инфаркта миокарда было замечено, что люди, потребляющие большое количество рыбьего жира, значительно реже болеют инфарктом миокарда, так как у них медленнее образуются тромбы в сосудах сердца. Оказалось, что структура эйкозаноидов, синтезируемых в организме, зависит от состава жирных кислот пищи (табл. 8.2). Если с пищей поступает больше жирных кислот ω-3, которые в большом количестве содержатся в рыбьем жире, то эти кислоты включаются преимущественно в фосфолипиды мембран (вместо арахидоновой) и после действия фосфолипазы А2 являются основными субстратами для синтеза
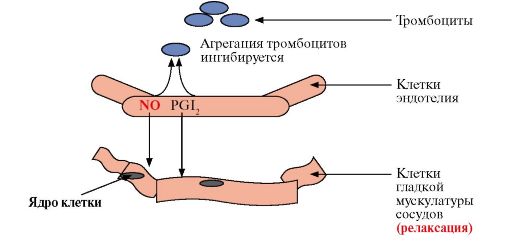 Рис.
8.27. Роль простациклинов и тромбоксанов в регуляции тонуса клеток
гладкой мускулатуры стенок сосудов и агрегации тромбоцитов
Рис.
8.27. Роль простациклинов и тромбоксанов в регуляции тонуса клеток
гладкой мускулатуры стенок сосудов и агрегации тромбоцитов
В норме клетки эндотелия продуцируют PGI2, который вызывает релаксацию гладкой мускулатуры сосудов и ингибирует агрегацию тромбоцитов. Тромбоциты в неактивном состоянии не продуцируют тромбоксаны, кровь находится в жидком состоянии. NO - оксид азота, продуцируемый ферментом NO-синтазой, также обладает вазодилятаторным эффектом
эйкозаноидов. Это оказывает существенное влияние на свертывание крови, что представлено на следующей схеме:
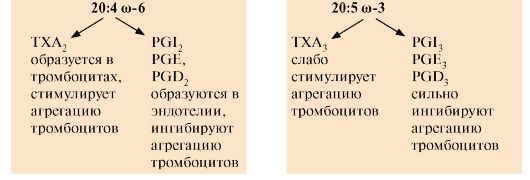 Следовательно, при преобладании в рационе кислоты 20:4 ω-6 образуются ТХА2, действие которых уравновешено PGI2
и другими PG. Если в рационе преобладают ω-3-кислоты, то в клетках
эндотелия образуются более сильные ингибиторы тромбообразования (PGI3, PGE3, PGD3), что снижает риск образования тромба и развития инфаркта миокарда.
Следовательно, при преобладании в рационе кислоты 20:4 ω-6 образуются ТХА2, действие которых уравновешено PGI2
и другими PG. Если в рационе преобладают ω-3-кислоты, то в клетках
эндотелия образуются более сильные ингибиторы тромбообразования (PGI3, PGE3, PGD3), что снижает риск образования тромба и развития инфаркта миокарда.
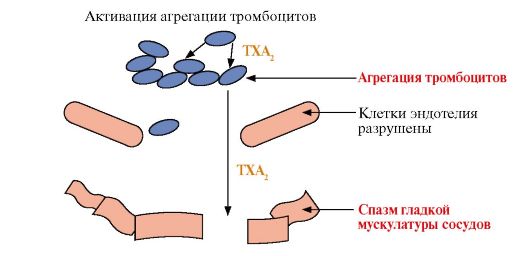 Рис. 8.28. Действие тромбоксана А2
Рис. 8.28. Действие тромбоксана А2
При поражении клеток эндотелия сосуда (например, в результате развития атеросклеротической бляшки) синтез PGI2 в данном участке стенки сосуда не происходит. В это время тромбоциты контактируют с поврежденной сосудистой стенкой, в них активируется фосфолипаза А2, освобождается арахидоновая кислота и из нее синтезируется ТХА2. ТХА2 стимулирует агрегацию тромбоцитов и сокращение стенок сосуда, в результате чего на поврежденном участке сосуда образуется тромб, происходит резкое сужение просвета сосуда, нарушается кровоснабжение ткани и может развиться инфаркт
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Объясните изменения в метаболизме жировой ткани, если после последнего приема пищи прошло 14 часов. При ответе:
а) укажите гормон, действие которого на жировую ткань преобладает в этих условиях;
б) изобразите схему действия этого гормона на жировую клетку.
2. Выберите правильные ответы.
В условиях, когда происходит мобилизация жира:
A. ТАГ-липаза находится в дефосфорилированном состоянии Б. Концентрация глюкозы в крови составляет 60 мг/дл
B. Все жирные кислоты в печени перерабатываются в кетоновые тела Г. Мозг использует жирные кислоты как источник энергии
Д. Протеинкиназа в адипоцитах находится в активной форме
3. Установите порядок событий.
При физической работе происходит:
A. Увеличение секреции адреналина
Б. Диссоциация субъединиц протеинкиназы А
B. Увеличение количества цАМФ в адипоцитах
Г. Фосфорилирование гормончувствительной липазы
Д. Гидролиз ТАГ в адипоцитах
Е. β-Окисление жирных кислот в мыщцах
4. Запишите схему последнего цикла β-окисления жирных кислот и объясните, почему этот метаболический путь возможен только в аэробных условиях.
5. Рассчитайте выход АТФ при полном окислении одной молекулы стеариновой и одной молекулы олеиновой кислоты до СО2 и Н2О и объясните отличие выхода АТФ при окислении олеиновой кислоты по сравнению со стеариновой.
6. Заполните колонку в табл. 8.6 (модульная единица 2), характеризующую процесс β-окисления.
7. В β-окислении жирных кислот участвуют несколько типов ацил-КоАдегидрогеназ: на первом этапе работает фермент, дегидрирующий жирные кислоты с большой длиной углеродной цепи (от С18 до С12); после того как жирные кислоты укорачиваются до С12, начинает работать другая дегидрогеназа, которая дегидрирует жирные кислоты со средней длиной цепи (от С12 до С6). Это необходимо знать, так как одно из наиболее распространенных генетических заболеваний - дефект дегидрогеназы жирных кислот со средней длиной цепи. Частота таких заболеваний составляет 1:15 000 человек. При дефекте этого фермента накапливаются жирные кислоты с короткой алифатической цепью, например Затем они подвергаются ω-окислению и выделяются в виде дикарбоновых кислот с мочой [НООС-(СН2)4-СООН]. Объясните, почему у таких больных в период между приемами пищи развивается гипогликемия и не увеличивается синтез кетоновых тел. Для этого:
а) напишите реакцию, катализируемую ацил-КоА-дегидрогеназой;
б) укажите, как изменится использование жирных кислот и глюкозы в качестве источников энергии в этих условиях;
в) назовите причину приступов гипогликемии через 5-6 часов после приема пищи у таких больных;
г) объясните, почему, несмотря на состояние гипогликемии (ситуация, когда синтез кетоновых тел должен увеличиваться), у этих больных кетоновые тела не синтезируются.
8. Объясните, почему мозг может использовать кетоновые тела как источник энергии, а эритроциты и печень - нет. При ответе напишите схему окисления кетоновых тел и рассчитайте выход АТФ.
9. Используя номенклатуру и схему синтеза эйкозаноидов, изобразите строение РGE2. Укажите исходный субстрат его синтеза и биологические эффекты PGE2.
 Эйкозаноиды:
Эйкозаноиды:
1. PGE1
2. PGF2a
3. TXA3
11. Установите соответствие.
Проявление биологической активности:
A. Инициирует родовую активность
Б. Стимулирует сокращение гладкой мускулатуры кишечника
B. Стимулирует агрегацию тромбоцитов
Г. Вызывает сокращение бронхов и образование в них секрета Д. Вызывает вазодилятацию Эйкозаноид:
1. TXA2
2. LTA4
3. PGI2
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильные ответы.
Опухоль надпочечников - феохромоцитома продуцирует повышенное количество адреналина. У больных с феохромоцитомой:
A. Увеличена концентрация цАМФ в жировой ткани Б. Снижена активность гормончувствительной липазы
B. Увеличена концентрация жирных кислот в крови Г. Повышена концентрация ТАГ в крови
Д. Протеинкиназа А активирована в адипоцитах
2. Выберите правильный ответ.
Один цикл β-окисления включает четыре последовательные реакции:
A. Окисление, дегидратация, окисление, расщепление
Б. Восстановление, дегидрирование, восстановление, расщепление
B. Дегидрирование, гидратация, дегидрирование, расщепление Г. Гидрирование, дегидратация, гидрирование, расщепление Д. Восстановление, гидратация, дегидрирование, расщепление
3. Выберите правильные ответы.
В работающих скелетных мышцах скорость β-окисления возрастает при:
A. Повышении концентрации NАD+ в митохондриях Б. Увеличении концентрации NАDН в митохондриях
B. Активации синтеза малонил-КоА в цитозоле Г. Гипоксии
Д. Уменьшении соотношения АТФ-АДФ в клетке
4. Выберите правильные ответы.
Синтез кетоновых тел активируется, когда:
A. Концентрация инсулина в крови повышена
Б. Концентрация жирных кислот в крови повышена
B. Скорость реакции ЦТК в печени увеличена Г. Синтез ГМГ-КоА в митохондриях увеличен
Д. Скорость β-окисления в митохондриях печени выше нормы
5. Установите соответствие.
Характеристики кетоновых тел:
A. Окисляется, превращаясь в другое кетоновое тело Б. Образуется из продуктов катаболизма глюкозы
B. Накопление в крови вызывает алкалоз Г. Не является источником энергии
Д. Активируется с участием сукцинил~КоА Кетоновые тела:
1. Ацетоацетат
2. Ацетон
3. β-Гидроксибутират
6. Выберите правильные ответы.
При длительном голодании используют кетоновые тела в качестве источника энергии:
A. Мозг
Б. Скелетные мышцы
B. Сердце Г. Печень
Д. Эритроциты
7. Выберите правильный ответ.
При длительном голодании наибольший вклад в развитие ацидоза вносит:
A. Пальмитат
Б. β-Гидроксибутират
B. Ацетат Г. Ацетон
Д. Ацетоацетат
8. Установите порядок событий.
При синтезе простагландинов:
A. Освобождается арахидоновая кислота из фосфолипидов мембран Б. Синтезируется PGE2
B. Под действием циклооксигеназы образуется PGG2 Г. Под действием пероксидазы образуется PGH2
Д. Активируется фосфолипаза А2
9. Выберите правильный ответ.
Нестероидные противовоспалительные препараты ингибируют:
A. Тромбоксансинтазу Б. Циклооксигеназу
B. Липоксигеназу Г. Пероксидазу
Д. Фосфолипазу А2
10. Выберите правильные ответы. Лейкотриены:
A. Синтезируются из арахидоновой кислоты под действием циклооксигеназы
Б. Содержат четыре двойные связи
B. Синтезируются клетками белой крови
Г. При избыточной секреции могут вызывать приступ бронхиальной астмы
Д. Ингибируются аспирином
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. А, В, Д
2. В
3. А, Д
4. Б, Г, Д
5. 1-Д; 2-Г; 3-А
6. А, Б, В
7. Б
8. Б→А→В→Г→Д
9. Б
10. Б, В, Г
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Мобилизация жиров (липолиз)
2. Гормончувствительная липаза (ТАГ-липаза)
3. Гормоны, стимулирующие липолиз
4. β-Окисление жирных кислот, биологические функции
5. Генетические дефекты ацил-КоА-дегидрогеназы
6. Кетоновые тела, биологическая функция
7. Кетонемия, кетонурия, кетоацидоз
8. Эйкозаноиды: простагландины, тромбоксаны, лейкотриены, биологические функции
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. Жиры являются наиболее энергоемкими молекулами. Объясните это, исходя из структуры жиров, и рассчитайте количество молекул АТФ, образующихся при окислении одной молекулы трипальмитоилглицерола. Для этого:
а) напишите реакцию гидролиза этого соединения;
б) рассчитайте число молекул АТФ, образующихся при окислении одной молекулы пальмитата до СО2 и Н2О;
в) напишите реакции катаболизма глицерола (Глицерол → Глицерол-3- фосфат → Диоксиацетонфосфат → Глицеральдегидфосфат) и схему пути дальнейшего окисления глицеральдегидфосфата до СО2 и Н2О;
г) рассчитайте число молекул АТФ, синтезируемых при окислении одной молекулы глицерола до СО2 и Н2О;
д) рассчитайте суммарный выход АТФ при окислении одной молекулы трипальмитоилглицерола.
2. У пациента измерили концентрацию жирных кислот в артериальной крови, поступающей в миокард (0,8 ммоль/л), и венозной, вытекающей из миокарда (0,4 ммоль/л). Общее количество липидов в миокарде не изменилось. Объясните разницу в концентрации жирных кислот. Для этого ответьте на вопросы:
а) как жирные кислоты транспортируются по крови?
б) какой специфический метаболический путь жирных кислот в миокарде определяет эту разницу? Изобразите схему этого пути;
в) какую функцию выполняет этот метаболический путь в миокарде?
г) как изменится скорость этого пути при уменьшении концентрации кислорода в крови, питающей миокард?
д) укажите коферменты, обеспечивающие связь этого метаболического пути с ЦПЭ.
3. При анализе крови у здорового человека концентрация глюкозы в крови после еды составляет ~8 ммоль/л. Как изменится активность регуляторного фермент β-окисления жирных кислот в этих в условиях?
При ответе:
а) объясните, как называется такое состояние у здорового человека;
б) укажите, концентрация какого гормона увеличена в крови;
в) напишите реакцию, катализируемую регуляторным ферментом β-окисления, и укажите его ингибитор;
г) напишите реакцию образования этого ингибитора;
д) оцените, как изменится скорость β-окисления в этих условиях.
4. При одном из наследственных заболеваний в скелетных мышцах больных снижена концентрация карнитина в результате дефекта ферментов,
участвующих в его синтезе. Почему у таких пациентов снижена способность выполнять физическую работу? При ответе:
а) напишите схему, показывающую роль карнитина в метаболизме жирных кислот;
б) укажите, скорость какого метаболического пути снижена у таких больных;
в) объясните, почему в биоптате мышц больных содержатся большие вакуоли жира, видимые под микроскопом.
5. Экспериментальные животные в течение 1 недели получали с пищей избыток глюкозы, содержащий радиоактивный углерод. Затем животные голодали в течение двух дней. В крови обнаружены кетоновые тела, содержащие радиоактивный углерод. Объясните результаты эксперимента, напишите краткие схемы метаболических путей, через которые проходит радиоактивный углерод, поступивший в организм в составе глюкозы.
6. У пациента обнаружена повышенная свертываемость крови. Для уменьшения риска образования тромбов и развития инфаркта миокарда кардиолог назначил ежедневный прием кардиоаспирина в дозе 0,1 г. Какие молекулярные механизмы лежат в основе снижения скорости тромбообразования под действием этого препарата? Для ответа:
а) напишите схему реакции, на которую влияет аспирин;
б) укажите фермент, на который действует аспирин, и укажите механизм его действия;
в) объясните механизм влияния аспирина на свертываемость крови;
г) сравните действие аспирина на тромбоциты и клетки эндотелия;
д) объясните, почему действие аспирина прекращается через несколько часов.
7. Безуглеводная диета доктора Аткинса и ее разновидность - «кремлевская» - одни из самых популярных в наши дни. Суть их в том, что необходимо резко ограничить поступление углеводов с пищей (не более 15 г в день), а жиров и белков можно есть даже больше, чем при нормальном питании. Объясните, почему, несмотря на потребление жиров, человек «сбрасывает вес». Какие негативные последствия возможны при данной диете?
Для ответа:
а) объясните, как повлияет диета на синтез инсулина и почему;
б) изобразите схему синтеза и гидролиза ТАГ в жировой ткани. Покажите на схемах, какие процессы усиливаются и какие подавляются у человека, соблюдающего такую диету (обозначьте процессы, скорость которых увеличивается, красной линией, скорость которых уменьшается - синей);
в) укажите, концентрация каких ЛП повысится в крови, и объясните, почему у людей, длительное время придерживающихся данной диеты, возрастает риск развития атеросклероза?
г) напишите реакции синтеза кетоновых тел в печени и объясните, как изменится скорость этих реакций у человека, соблюдающего данную диету? К каким негативным последствиям это может привести?
8. Рассчитайте выход АТФ при окислении 1 моль β-гидроксибутирата и объясните, почему это кетоновое тело преобладает в крови при длительном голодании.
Модульная единица 4 ОБМЕН ХОЛЕСТЕРОЛА, ЕГО РЕГУЛЯЦИЯ И ТРАНСПОРТ КРОВЬЮ. ДИСЛИПОПРОТЕИНЕМИИ. БИОСИНТЕЗ И ФУНКЦИИ ЖЕЛЧНЫХ КИСЛОТ. ЖЕЛЧНОКАМЕННАЯ БОЛЕЗНЬ
Цели изучения Уметь:
1. Применять знания об обмене холестерола для понимания основ рационального питания, профилактики атеросклероза и его последствий.
2. Использовать знания об обмене холестерола и желчных кислот для понимания молекулярных механизмов развития атеросклероза, желчнокаменной болезни и принципов их лечения.
3. Интерпретировать результаты биохимических анализов содержания холестерола и липопротеинов крови.
Знать:
1. Функции холестерола в организме.
2. Этапы биосинтеза холестерола и молекулярные механизмы его регуляции.
3. Роль липопротеинов в транспорте экзогенного и эндогенного холестерола.
4. Этапы синтеза и конъюгации желчных кислот, их роль в переваривании липидов и обмене холестерола.
5. Причины, вызывающие нарушение обмена холестерола, и их последствия; гиперхолестеролемия, дислипопротеинемии, атеросклероз, желчнокаменная болезнь.
ТЕМА 8.11. ХОЛЕСТЕРОЛ, БИОЛОГИЧЕСКИЕ ФУНКЦИИ. ПОСТУПЛЕНИЕ С ПИЩЕЙ И ТРАНСПОРТ КРОВЬЮ ЭКЗОГЕННОГО ХОЛЕСТЕРОЛА
1. Холестерол - основной стероид организма человека - имеет сложную циклическую структуру, содержащую боковую цепь в положении 17 (рис. 8.29) и гидроксильную группу в положении 3, что позволяет ему образовывать эфиры с жирными кислотами.
Основные функции холестерола в организме (рис. 8.31):
• компонент мембран, влияющий на вязкость гидрофобного слоя;
• компонент монослоя липидов на поверхности липопротеинов (вместе с фосфолипидами);
• предшественник желчных кислот, стероидных гормонов, витамина D3.
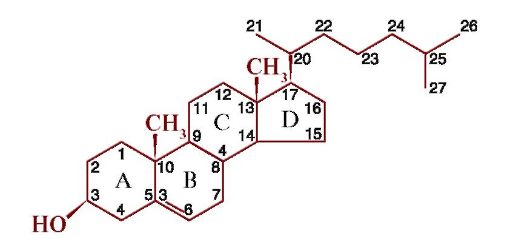 Рис. 8.29. Строение холестерола
Рис. 8.29. Строение холестерола
В организме человека содержится около 140 г холестерола, в основном в клетках нервной, мышечной тканей и печени. В клетках холестерол находится преимущественно в наружном слое плазматических мембран, где соотношение фосфолипидов и холестерола В мембранах клеток и на поверхности липопротеинов содержится свободный неэтерифицированный холестерол, а эфиры холестерола либо представляют собой форму депонирования в клетках, где происходит синтез стероидных гормонов, либо присутствуют во внутреннем гидрофобном ядре липопротеинов.
Холестерол, несмотря на наличие гидроксильной группы, очень плохо растворим в воде - 0,2 мг в 100 мл, однако в крови его концентрация в 300 раз больше, так как он находится в гидрофобном ядре липопротеинов.
Концентрация холестерола в крови у взрослых здоровых людей не должна превышать 200 мг/дл, или 5,2 ммоль/л, у детей первого года жизни ~50±10 мг/дл.
2. В суточном количестве пищи современного человека содержится около 1 г холестерола, однако всасывается в составе смешанных мицелл приблизительно 0,5 г. Холестерол - это стероид животного происхождения, поэтому он поступает с животной пищей, особенно много его в мясе, печени, мозге, яичных желтках, сыре. Стероиды растительного происхождения в кишечнике практически не всасываются и удаляются с калом. Количество синтезированного в организме холестерола колеблется от 0,5 до 1,0 г и зависит от его содержания в пище.
Эфиры холестерола, поступающие в организм с пищей, гидролизуются холестеролэстеразой панкреатического сока.
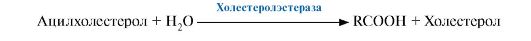 Продукты
гидролиза всасываются эпителием кишечника в составе смешанных мицелл.
Экзогенный или синтезированный клетками кишечника холестерол частично
превращается в эфиры. Этот процесс включает две стадии:
Продукты
гидролиза всасываются эпителием кишечника в составе смешанных мицелл.
Экзогенный или синтезированный клетками кишечника холестерол частично
превращается в эфиры. Этот процесс включает две стадии:
• активацию жирной кислоты под действием ацил-КоА-синтетазы;
• перенос ацильного остатка ацил-КоА на ОН-группу холестерола, который катализирует ацилхолестеролацилтрансфераза (АХАТ).
В клетках слизистой кишечника эфиры холестерола, свободный холестерол, ресинтезированные ТАГ и синтезированные энтероцитами аполипопротеины В-48, А-I и А-II упаковываются в хиломикроны, называемые незрелыми, которые первоначально поступают в лимфу, а затем - в кровь.
В кровотоке незрелые хиломикроны контактируют с ЛПВП и получают от них белки: апоС-II - активатор липопротеинлипазы и апоЕ - лиганд рецепторов липопротеинов на мембране клеток печени (рис. 8.1, 8.30). В результате хиломикроны превращаются в зрелые частицы и подвергаются действию ЛП-липазы. ТАГ, входящие в состав хиломикронов, гидролизуются ЛП-липазой до глицерола и жирных кислот, которые покидают хиломикроны и поступают в ткани. Хиломикроны уменьшаются в размере и превращаются в остаточные (ХМ ост. или ремнантные частицы), в которых находится холестерол, поступивший из кишечника.
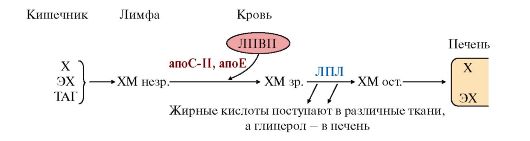 Рис. 8.30. Транспорт экзогенного холестерола
Рис. 8.30. Транспорт экзогенного холестерола
Х, ЭХ - холестерол и его эфиры; ХМ - хиломикроны; ЛПЛ - липопротеинлипаза; ХМ ост. - хиломикроны остаточные; ХМ незр. - ХМ незрелые, ХМ зр. - ХМ зрелые
Остаточные хиломикроны удаляются из кровеносного русла печенью по механизму эндоцитоза с помощью ЛПНП-рецепторов, лигандами которых служат апоВ и апоЕ. Затем компоненты остаточных хиломикронов расщепляются лизосомальными ферментами. Холестерол, освобождающийся из остаточных хиломикронов и других липопротеинов, включается в общий фонд этого стероида в организме.
 Рис. 8.31. Фонд холестерола в организме и пути его использования и выведения
Рис. 8.31. Фонд холестерола в организме и пути его использования и выведения
ТЕМА 8.12. БИОСИНТЕЗ ХОЛЕСТЕРОЛА И ЕГО РЕГУЛЯЦИЯ
1. Синтез холестерола может происходить в большинстве типов клеток, однако основное его количество синтезируется в печени (~ 75 -80%), тонкой кишке (~15%), коже и железах, продуцирующих стероидные гормоны - коре надпочечников и половых железах. Печень является главным органом, поставляющим холестерол в другие ткани.
Исходным субстратом для синтеза холестерола является ацетил-КоА. Синтез холестерола происходит в абсорбтивный период, когда в печени активируется гликолиз, который является главным источником ацетил-КоА для синтеза холестерола. В синтезе холестерола из ацетил-КоА участвует около 30 ферментов, и этот метаболический путь является одним из самых длинных в организме. Реакции синтеза холестерола происходят в цитозоле и эндоплазматическом ретикулуме. Для синтеза необходим ацетил-КоА и NАDPН, образующийся в основном в реакциях пентозофосфатного пути катаболизма глюкозы. Все 27 атомов углерода холестерола (рис. 8.29) происходят из ацетил-КоА.
2. Процесс синтеза холестерола условно разделяют на три этапа. I этап - реакции от ацетил-КоА до мевалоновой кислоты (рис. 8.32).
Так как ацетил-КоА образуется в митохондриях, а синтез холестерола происходит в цитоплазме клеток, то (как и при синтезе жирных кислот) ацетилКоА доставляется в цитоплазму в составе цитрата. Первые реакции процесса сходны с реакциями синтеза кетоновых тел, которые, в отличие от синтеза холестерола, протекают в митохондриях. В результате конденсации двух
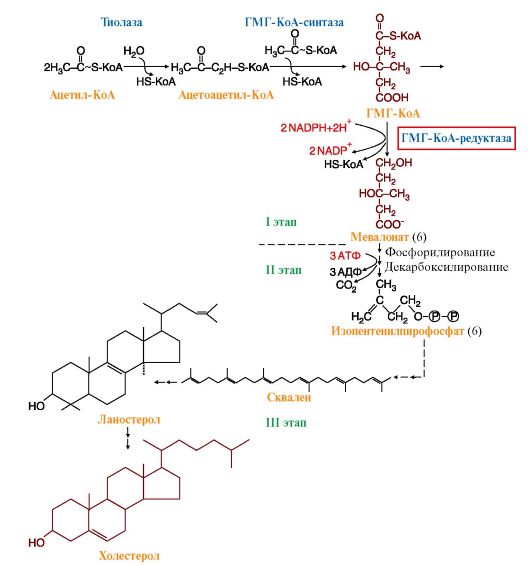 Рис. 8.32. Схема синтеза холестерола
Рис. 8.32. Схема синтеза холестерола
I этап - реакции от ацетил-КоА до мевалоновой кислоты - включает регуляторную реакцию синтеза холестерола, катализируемую ГМГ-КоА редуктазой.
II этап - образование сквалена из шести молекул мевалоната. В ходе этого этапа из молекул мевалоната образуются изопреноидные производные - изопентенилпирофосфаты, конденсация которых приводит к формированию 30-углеродного соединения - сквалена, имеющего линейную структуру.
III этап - сквален превращается в холестерол. Сквален циклизуется с образованием полициклического ядра ланостерола, модификация которого сопровождается потерей трех углеродных атомов и ведет к образованию холестерола
молекул ацетил-КоА образуется ацетоацетил-КоА, затем присоединяется третья молекула ацетил-КоА и образуется β-гидрокси-β-метилглутарил-КоА (ГМГ-КоА). ГМГ-КоА восстанавливается ГМГ-КоА-редуктазой в мевалонат с использованием двух молекул NADPH + H+. Эта реакция является регуляторной и лимитирует скорость данного метаболического пути.
II этап - образование сквалена из шести молекул мевалоната. В ходе этого этапа из молекул мевалоната (с затратой трех молекул АТФ на одну молекулу мевалоната) образуются фосфорилированные 5-углеродные изопреноидные производные - изопентенилпирофосфаты, конденсация которых приводит к формированию 30-углеродного соединения - сквалена, имеющего линейную структуру.
III этап - сквален циклизуется и превращается в холестерол, содержащий гидроксильную группу в 3-положении.
Все промежуточные реакции синтеза холестерола до образования сквалена протекают в цитозоле клеток (II этап). Сквален и последующие метаболиты в водных средах нерастворимы и синтезируются в мембранном слое эндоплазматического ретикулума с участием ферментов микросомального окисления (III этап).
3. Регуляторной реакцией синтеза холестерола является превращение ГМГКоА в мевалонат. Эту реакцию катализирует ГМГ-КоА-редуктаза, активность которой может варьировать в широких пределах (рис. 8.33). Она регулируется многими механизмами:
• изменением количества фермента, которое контролируется на уровне экспрессии гена ГМГ-КоА-редуктазы (транскрипционный контроль). Холестерол, некоторые его оксипроизводные (25-оксихолестерол, 24,25- эпоксихолестерол), кортикостероиды, желчные кислоты являются низкомолекулярными корепрессорами транскрипции гена ГМГ-КоАредуктазы. В промоторной части гена обнаружены участки, к которым присоединяются белки, связанные с холестеролом или его оксипроизводными и блокирующие синтез фермента. Индукторами синтеза ГМГ-КоА-редуктазы являются эстрогены. В течение дня активность ГМГ-КоА-редуктазы и скорость синтеза холестерола варьируют.
• количество ГМГ-КоА редуктазы регулируется и путем ее протеолиза, активируемого избытком холестерола и его производных (рис. 8.33).
• по механизму фосфорилирования-дефосфорилирования (рис. 8.33). В абсорбтивый период в гепатоцитах под действием гормона инсулина ГМГ-КоА-редуктаза переходит в активное дефосфорилированное состояние и синтез холестерола активируется. При голодании и в постабсорбтивном периоде глюкагон вызывает фосфорилирование этого фермента, переводит его в неактивное состояние и синтез холестерола замедляется;
• высокими концентрациями АМФ, так как в условиях недостатка АТФ, увеличивается количество АМФ, который активирует АМФзависимую проинкиназу, что в конечном итоге приводит к фосфорилированию и инактивации ГМГ-КоА-редуктазы.
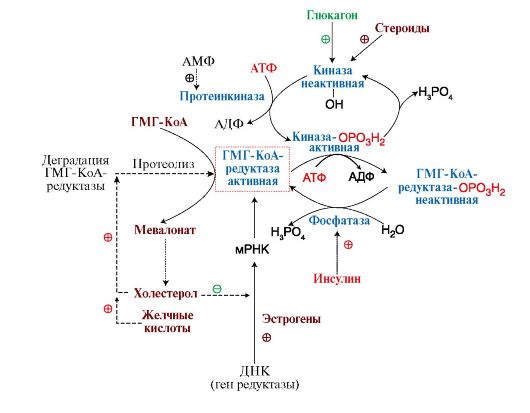 Рис. 8.33. Регуляция активности ГМГ-КоА-редуктазы в печени.
Рис. 8.33. Регуляция активности ГМГ-КоА-редуктазы в печени.
• Регуляторный фермент синтеза холестерола ГМГ-КоА-редуктаза активируется в печени в абсорбтивный период под действием инсулина и при условии высоких концентраций АТФ. В это период он находится в дефосфорилированном состоянии и синтез холестерола происходит.
• Поступление избытка холестерола с пищей, высокое содержание желчных кислот уменьшают синтез холестерола, так как активируют протеолиз ГМГ-КоА редуктазы, кроме того, избыток стероидов увеличивает синтез киназы, которая фосфорилирует и ингибирует ГМГ-КоА-редуктазу.
• При голодании гормон глюкагон стимулирует инактивацию ГМГ-КоА-редуктазы путем ее фосфорилирования и синтез холестерола тормозится.
4. Большая часть молекул холестерола, синтезированных в печени (эндогенного холестерола), превращается в эфиры, которые упаковываются в ЛПОНП незрелые, и в таком виде секретируются в кровь.
ТЕМА 8.13. БИОСИНТЕЗ ЖЕЛЧНЫХ КИСЛОТ И ИХ РОЛЬ
В ПОДДЕРЖАНИИ ГОМЕОСТАЗА ХОЛЕСТЕРОЛА В ОРГАНИЗМЕ. БИОХИМИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ
1. В печени 300-500 мг холестерола ежесуточно окисляется в желчные кислоты. Желчные кислоты выполняют следующие функции:
• участвуют в переваривании и всасывании липидов;
• являются конечными продуктами катаболизма холестерола, в виде которых он экскретируется с калом из организма;
• являются компонентами желчи, удерживающими холестерол в растворенном состоянии.
2. Синтез желчных кислот происходит в мембранах эндоплазматического ретикулума гепатоцитов под действием гидроксилаз (цитохромов, в состав которых входит цитохром Р450), катализирующих включение гидроксильных групп в положение 7α, 12α (рис. 8.34), с последующим укорочением бокового радикала в положении 17, с окислением его до карбоксильной группы, откуда и происходит название - желчные кислоты.
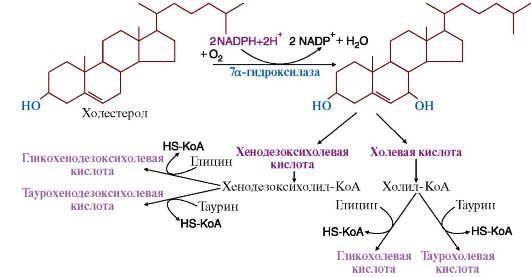 Рис. 8.34. Синтез и конъюгация желчных кислот
Рис. 8.34. Синтез и конъюгация желчных кислот
Регуляторный фермент синтеза желчных кислот 7а-гидроксилаза; его ингибитором являются желчные кислоты. Первичные желчные кислоты - холевая и хенодезоксихолевая - подвергаются реакции конъюгации - связыванию с глицином и таурином, в результате чего увеличиваются их эмульгирующие свойства
3. Образующиеся в печени холевая и хенодезоксихолевая кислоты называются первичными желчными кислотами. Они этерифицируются глицином (рис. 8.35) или таурином, давая парные (или конъюгированные) желчные кислоты, и в такой форме секретируются в желчь. В процесс конъюгации желчные кислоты вступают в активной форме в виде производных
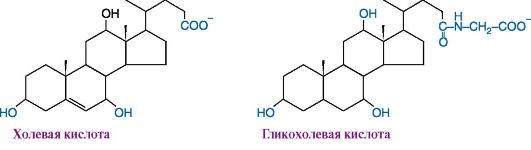 Рис. 8.35. Структура желчных кислот
Рис. 8.35. Структура желчных кислот
ИS-КоA-(холил-КоА). Конъюгация желчных кислот делает их более амфифильными и таким образом увеличивает детергентные свойства. Отношение глициновых конъюгатов к тауриновым приблизительно 3:1.
4. Синтез желчных кислот регулируется ферментом 7a-гидроксилазой. Этому ферменту для протекания реакции требуется кислород и NADPH. Конечный продукт метаболического пути - желчные кислоты уменьшают синтез этого фермента, подавляя транскрипцию гена. Холестерол индуцирует синтез этого фермента, но подавляет экспрессию гена ГМГ-КоА-редуктазы. Таким образом эти эффекты поддерживают необходимый уровень свободного холестерола в печени. Тиреоидные гормоны индуцируют синтез 7а-гидроксилазы, а эстрогены являются корепрессорами и подавляют транскрипцию гена этого фермента.
5. Желчные кислоты, синтезированные в печени, секретируются в желчный пузырь и накапливаются в желчи. При приеме жирной пищи выделяется гормон холецистокинин, который стимулирует сокращение желчного пузыря, желчь изливается в тонкий кишечник, эмульгирует жиры и обеспечивает их переваривание и всасывание. Когда первичные желчные кислоты достигают нижних отделов тонкой кишки, они подвергаются действию ферментов бактерий, которые сначала отщепляют глицин и таурин, а затем удаляют 7а-гидроксильную группу. Так образуются вторичные желчные кислоты: дезоксихолевая и литохолевая кислоты. Около 95% желчных кислот всасывается в подвздошной кишке и возвращается в печень, где они опять конъюгируются с таурином и глицином и выделяются в желчь. В результате в желчи находятся и первичные и вторичные желчные кислоты. Весь этот путь желчных кислот называется энтерогепатическая циркуляция желчных кислот (рис. 8.36).
В норме количество желчных кислот и холестерола, удаляющихся через кишечник, составляет 1,0-1,3 г за сутки, т.е. более 90% от количества холестерола, которое поступает с пищей и синтезируется в тканях. Так поддерживается гомеостаз этого стероида в организме человека.
6. В составе желчи содержатся: холестерол, желчные кислоты, фосфатидилхолин и пигменты, образующиеся при распаде гема. Холестерол наименее полярное вещество и удерживается в растворенном состоянии только
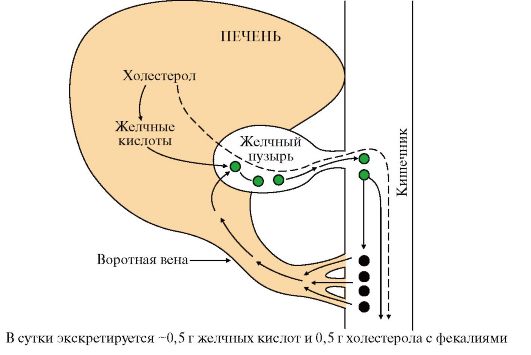
 благодаря
включению в мицеллы, образованные желчными кислотами и
фосфатидилхолином. Если содержание холестерола в желчи увеличивается или
уменьшается количество желчных кислот и фосфатидилхолина, то холестерол
выпадает в осадок, образуя камни в желчном пузыре. Камни, состоящие из
холестерола, - белые, если в них включаются продукты распада гема, то
цвет камней может быть от коричневого до черного.
благодаря
включению в мицеллы, образованные желчными кислотами и
фосфатидилхолином. Если содержание холестерола в желчи увеличивается или
уменьшается количество желчных кислот и фосфатидилхолина, то холестерол
выпадает в осадок, образуя камни в желчном пузыре. Камни, состоящие из
холестерола, - белые, если в них включаются продукты распада гема, то
цвет камней может быть от коричневого до черного.
ТЕМА 8.14. РОЛЬ ЛИПОПРОТЕИНОВ В ТРАНСПОРТЕ
ХОЛЕСТЕРОЛА
1. В транспорте холестерола между различными органами участвуют все типы липопротеинов, однако их функции различны. Так, холестерол, полученный с пищей (экзогенный холестерол), в клетках кишечника включается в состав хиломикронов (рис. 8.3) как в форме свободного холестерола, так и в виде эфиров, синтезированных в слизистой кишечника под действием фермента АХАТ. В крови зрелые хиломикроны подвергаются действию ЛП-липазы, которая гидролизует содержащиеся в них жиры. Образующиеся в результате хиломикроны остаточные (ремнантные частицы), содержащие холестерол, захватываются гепатоцитами.
2. В печени экзогенный холестерол вместе с эндогенным, синтезированным в этом органе, образуют общий «пул». В печени холестерол вместе с ТАГ упаковывается в ЛПОНП незрелые, в которых главным белком является апопротеин В-100 (рис. 8.37). В формировании ЛПОНП (и хиломикронов) участвует также микросомальный белок, транспортирующий ТАГ, синтезированные в печени и кишечнике, внутрь ЛПОНП и хиломикронов. Дефект этого белка приводит к наследственному заболеванию (а^-липопротеинемии). При этом заболевании нарушается формирование хиломикронов в кишечнике и
ЛПОНП в печени.
3. В крови белки - апоЕ и апоС-II переносятся с поверхности ЛПВП на ЛПОНП; ЛПОНП превращаются таким образом в зрелые и на них начинает действовать ЛП-липаза (рис. 8.37). По мере уменьшения содержания ТАГ в составе ЛПОНП они превращаются в ЛППП; ЛП-липаза продолжает действовать на ЛППП, гидролизуя жиры, и ЛППП превращаются в ЛПНП. На ЛППП действует также печеночная липаза, гидролизуя жиры в их составе. АпоС-II по мере уменьшения содержания жиров в ЛППП переносится обратно на ЛПВП. Содержание холестерола и его эфиров в ЛПНП достигает -50%, и ЛПНП захватываются по механизму эндоцитоза различными клетками, в том числе и гепатоцитами, с помощью ЛПНП-рецепторов, взаимодействующих с апоВ-100 и апо Е.
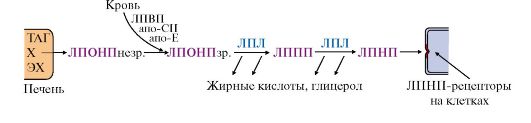 Рис. 8.37. Транспорт эндогенного холестерола из печени в периферические непеченочные ткани
Рис. 8.37. Транспорт эндогенного холестерола из печени в периферические непеченочные ткани
Холестерол и его эфиры из печени выходят в составе ЛПОНП незрелых. После переноса апо С-II и апо Е с ЛПВП на ЛПОНП они превращаются в зрелые и подвергаются действию ЛП-липазы, находящейся на стенках капилляров. В результате ТАГ гидролизуются и удаляются из ЛПОНП, жирные кислоты и глицерол поступают в различные ткани, а ЛПОНП превращаются в ЛПНП, которые захватываются клетками через специфические ЛПНП рецепторы
4. В «обратном» транспорте холестерола, т.е. выведении избытка холестерола из тканей и крови в печень, главную роль играют ЛПВП. Они синтезируются в виде ЛПВП предшественников в печени и, в небольшом количестве, - в тонкой кишке. Эти липопротеины практически не содержат холестерола, но включают значительное количество фосфолипидов и апопротеинов Е, С-II, А-I, А-II. Незрелые ЛПВП внешне похожи на диски, состоящие из бислоя фосфолипидов, с включенными в него апопротеинами (рис. 8.38).
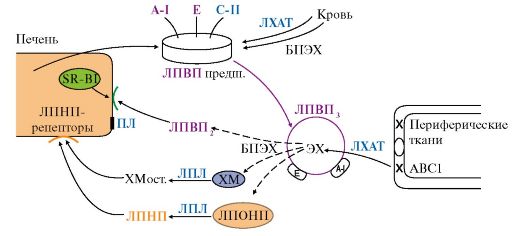 Рис. 8.38. «Обратный транспорт» холестерола в печень:
Рис. 8.38. «Обратный транспорт» холестерола в печень:
Апопротеины: А-I, Е, С-II; ЛХАТ - лецитинхолестеролацилтрансфераза; ЭХ - эфиры холестерола; БПЭХ - белок, переносящий эфиры холестерола; SR-B1 - «скэвенджер» рецепторы; ПЛ - печеночная липаза; ЛПЛ - липопротеинлипаза; АВС1 - АТФсвязывающий кассетный белок 1 (имеет такое название из-за своей структуры). Основные пути поступления избытка эфиров холестерола обратно в печень в составе:
• ремнантных липопротеинов, содержащих апоЕ (хиломикроны остаточные, ЛПНП и ЛППП), которые узнаются ЛПНП-рецепторами;
• из ЛПВП2, подвергающихся действию печеночной липазы на поверхности гепатоцитов, путем переноса эфиров холестерола в гепатоциты через «скэвенджер»-рецепторы
После поступления в кровь ЛПВП сначала выполняют функцию донора апоС-II и апоЕ для липопротеинов, содержащих большое количество ТАГ: ХМ и ЛПОНП. Затем ЛПВП начинают «сбор» избытка холестерола из мембран клеток и других липопротеинов крови.
Для этого к поверхности ЛПВП прикрепляется фермент - ЛХАТ- лецитинхолестеролацилтрансфераза, который активируется белком апоА-I и катализирует реакцию:
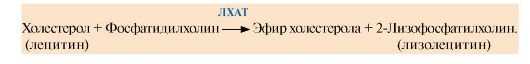 Эта
реакция происходит при контакте ЛПВП с другими липопротеинами.
Образовавшиеся гидрофобные эфиры холестерола погружаются в сердцевину
ЛПВП, и частицы приобретают сферическую форму, увеличиваются в размерах и
превращаются в ЛПВП3. В переносе холестерола из мембран
клеток в ЛПВП участвуют еще несколько белков. ЛПВП могут
взаимодействовать с поверхностью клеток с помощью апоА-I или апоЕ.
Присутствующий в мембранах клеток белок АВС1 (АТФ-связывающией кассетный
белок 1) переносит холестерол с мембраны клетки на ЛПВП, где холестерол
подвергается действию ЛХАТ и в виде эфиров холестерола накапливается
внутри ЛПВП3.
Эта
реакция происходит при контакте ЛПВП с другими липопротеинами.
Образовавшиеся гидрофобные эфиры холестерола погружаются в сердцевину
ЛПВП, и частицы приобретают сферическую форму, увеличиваются в размерах и
превращаются в ЛПВП3. В переносе холестерола из мембран
клеток в ЛПВП участвуют еще несколько белков. ЛПВП могут
взаимодействовать с поверхностью клеток с помощью апоА-I или апоЕ.
Присутствующий в мембранах клеток белок АВС1 (АТФ-связывающией кассетный
белок 1) переносит холестерол с мембраны клетки на ЛПВП, где холестерол
подвергается действию ЛХАТ и в виде эфиров холестерола накапливается
внутри ЛПВП3.
Далее эфиры холестерола транспортируются с ЛПВП3 на ЛПНП или ЛПОНП с помощью «белка, переносящего эфиры холестерола» (БПЭХ) или путем обмена с ТАГ, которые из ЛПОНП переносятся на ЛПВП. Последние увеличиваются в размере и превращаются в ЛПВП2. Эти частицы подвергаются действию печеночной липазы, гидролизующей ТАГ в ЛПВП2, и они превращаются опять в ЛПВП3.
Поступление эфиров холестерола, собранных с помощью ЛПВП, в печень осуществляется в основном через:
• ЛПНП-рецепторы по механизму эндоцитоза (эти рецепторы узнают апоВ-100 и апоЕ, которые имеются на ЛПНП, ремнантных ХМ и ЛПОНП);
• «скэвенджер»-рецепторы (SR-BI), когда эфиры холестерола переносятся непосредственно с ЛПВП в гепатоциты после действия на ЛПВП печеночной липазы;
• в меньшей степени эфиры холестерола поступают путем эндоцитоза ЛПВП при взаимодействии их апоЕ с рецепторами.
Таким образом, ЛПВП выполняют функцию удаления избытка холестерола из крови и тканей с последующей доставкой его в печень, поэтому ЛПВП оказывают антиатерогенное действие на организм. Благодаря этому свойству врачи часто называют холестерол, находящийся в ЛПВП - «хорошим», а холестерол в ЛПНП «плохим», так как повышение содержания ЛПНП в крови является фактором развития атеросклероза.
ЛПНП и ЛПВП, в отличие от хиломикронов (рис. 8.5), постоянно присутствуют в крови.
5. Избыток холестерола, поступивший в печень, частично превращается в желчные кислоты (рис. 8.36) и удаляется из организма с фекалиями, частично выводится с фекалиями в неизмененном виде. Другими путями из организма выводится лишь небольшое количество холестерола
(рис. 8.31).
ТЕМА 8.15. ТИПЫ ДИСЛИПОПРОТЕИНЕМИЙ. БИОХИМИЧЕСКИЕ ОСНОВЫ ПАТОГЕНЕЗА И ЛЕЧЕНИЯ
АТЕРОСКЛЕРОЗА
1. Отклонение содержания липопротеинов в крови от нормы называют дислипопротеинемиями. Снижение содержания каких-либо липопротеинов в крови называется гиполипопротеинемиями и наблюдаются они довольно редко. Пример гиполипопротеинемий - болезнь Танжера, которая является следствием генетического дефекта белка АВС1, переносящего холестерол из мембран клеток на ЛПВП. Проявление заболевания низкое (1-5% нормы) содержание в крови ЛПВП, содержание ЛПНП также снижено. У таких больных холестерол накапливается в печени, селезенке, костном мозге, шванновских клетках, что вызывает гепато- и спленомегалию, нейропатию; концентрация холестерола в крови также снижена.
2. Повышение содержания липопротеинов в плазме крови называют гиперлипопротеинемиями. Существует несколько типов классификаций гиперлипопротеинемий; в табл.8.9 приведена классификация, наиболее распространенная в настоящее время.
Один из примеров таких заболеваний - семейная гиперхиломикронемия (накопление ТАГ и хиломикронов в крови) (гиперлипопротеинемия I типа). Ее причины были рассмотрены в модульной единице 1 (модуль 8).
Таблица 8.9. Гиперлипопротеинемии
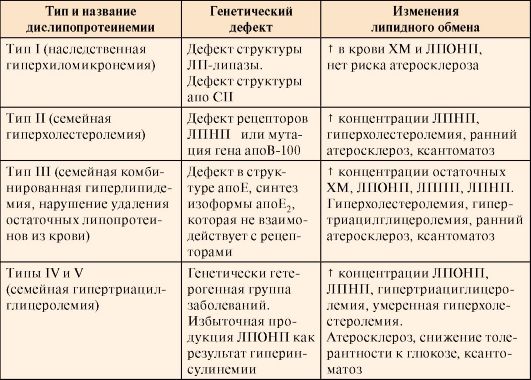 Наиболее
распространенными нарушениями обмена липопротеинов являются
заболевания, связанные с повышением холестерола в крови -
гиперхолестеролемией. Самым частым заболеванием такого типа является семейная гиперхолестеролемия (тип
II), причиной которой являются различные мутации в гене белка -
рецептора ЛПНП. Гетерозиготы с этой патологией встречаются с частотой
1:500 человек.
Наиболее
распространенными нарушениями обмена липопротеинов являются
заболевания, связанные с повышением холестерола в крови -
гиперхолестеролемией. Самым частым заболеванием такого типа является семейная гиперхолестеролемия (тип
II), причиной которой являются различные мутации в гене белка -
рецептора ЛПНП. Гетерозиготы с этой патологией встречаются с частотой
1:500 человек.
Этот ген имеет очень сложную структуру, включает большое количество интронов и экзонов, и для него описано более 300 типов различных мутаций. Они в большей или меньшей степени повреждают структуру рецептора, нарушают его способность к эндоцитозу после взаимодействия с ЛПНП. Это приводит к развитию гиперхолестеролемии и раннему атеросклерозу.
Атеросклероз представляет собой заболевание, при котором поражается внутренний слой артерий за счет отложения холестерола в интиме сосудов.
В таких местах образуется атеросклеротическая бляшка, нарушающая свойства внутренней поверхности артерий, приводящая к нарушению тока крови и являющаяся местом возможного образования тромба. Последствиями этого являются инфаркт миокарда, инсульт и т.д.
3. Для выяснения степени предрасположенности пациентов к развитию атеросклероза рассчитывают коэффициент атерогенности в крови, взятой натощак:
 В норме это соотношение должно быть <3,5. Чем выше его значение, тем выше риск развития атеросклероза.
В норме это соотношение должно быть <3,5. Чем выше его значение, тем выше риск развития атеросклероза.
4. Другим генетическим фактором риска развития атеросклероза является необычная форма ЛПНП, содержащих аполипопротеин (а) - гликопротеин, связанный дисульфидной связью с апоВ-100. Течение этой формы атеросклероза, в отличие от других, не поддается лечению путем изменения питания.
5. Молекулярных причин, приводящих к развитию атеросклероза, очень много, например, различные нарушения структуры или ЛПНП-рецепторов или самих ЛПНП в результате модификаций белкового или липидного компонента, что может происходить при увеличении активности перекисного окисления липидов или в результате гликозилирования белков - ковалентного связывания их с глюкозой. Такие измененные ЛПНП (или множественно модифицированные ЛПНП), становясь «чужеродными» компонентами, захватываются макрофагами, которые в результате этого превращаются в «пенистые клетки». Эти клетки, «нагруженные» холестеролом, проникают через промежутки между клетками эндотелия в интиму сосудов и там разрушаются. Холестерол накапливается в этом участке, что является начальной стадией формирования атеросклеротических бляшек.
6. Биохимические подходы к лечению атеросклероза включают:
Изменение питания:
• снижение потребления холестерола (<300 мг/сутки);
• снижение калорийности питания за счет как жиров, так и углеводов;
• увеличение потребления витаминов-антиоксидантов (С, Е). Изменение образа жизни:
• отказ от курения (курение повышает скорость свободнорадикального окисления липидов, в том числе в ЛПНП);
• увеличение физических нагрузок, что повышает синтез ЛПВП.
Медикаментозное лечение заключается в применении:
• ингибиторов ГМГ-КоА-редуктазы - статинов, которые тормозят синтез эндогенного холестерола, и это усиливает захват холестерола из крови;
• полимеров, например, холестероламина, адсорбирующего желчные кислоты и прерывающего энтерогепатическую циркуляцию. В результате увеличивается захват холестерола печенью и окисление его в желчные кислоты;
• ниацина (никотиновой кислоты и ее производных), который уменьшает образование ЛПОНП и липолиз в жировой ткани;
• фибратов, которые, действуя через рецепторы, увеличивают синтез ЛПлипазы, апоА-I, апоА-II, понижают содержание ТАГ в крови и повышают содержание ЛПВП.
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ РАБОТЫ
1. Напишите реакции гидролиза и ресинтеза эфиров холестерола, которые происходят в кишечнике при поступлении экзогенного холестерола. Укажите соответствующие ферменты.
2. Напишите схему метаболического пути, который поставляет ацетилКоА - исходный субстрат для синтеза холестерола, и рассчитайте, сколько молекул ацетил-КоА и NADPH необходимо для синтеза одной молекулы мевалоната.
3. Используя предыдущий ответ и рис. 8.32, рассчитайте, сколько молекул ацетил-КоА необходимо для синтеза одной молекулы холестерола.
4. Составьте схему, показывающую, как изменяется синтез холестерола в абсорбтивный и постабсорбтивный периоды. Укажите роль соответствующих гормонов.
5. Напишите реакции конъюгации желчных кислот, укажите их значение и, используя полученные формулы, покажите, как изменяются свойства конъюгатов желчных кислот по сравнению с исходными кислотами.
6. Используя рис. 8.30, опишите путь экзогенного холестерола в печень.
7. Составьте схему, показывающую поступление холестерола из ЛПОНП в другие ткани.
8. Перенесите табл. 8.10 в тетрадь. Заполните ее, сравнив свойства холестерола и его эфиров, поставив «+» или «-» в соответствующей графе.
9. Перенесите в тетрадь и заполните табл. 8.11.
Таблица 8.10. Сравнение свойств холестерола и его эфиров
Холестерол | Эфиры холестерола | |
1. Находится в составе мембран клеток | ||
2. Преимущественная форма в составе ЛПНП | ||
3. Образуется в кишечнике под действием холестеролэстеразы | ||
4. Образуется в кишечнике под действием АХАТ | ||
5. Непосредственный субстрат для синтеза желчных кислот | ||
6. Образуется в ЛПВП | ||
7. Переносится с ЛПВП на ЛПОНП | ||
8. Форма депонирования в клетках | ||
9. Корепрессор транскрипции гена ГМГ-КоА-редуктазы | ||
10.В печени упаковывается в ЛПОНП | ||
11. В кишечнике упаковывается в ХМ незр. |
Таблица 8.11. Факторы, обусловливающие развитие гиперхолестеролемии
Генетические факторы | Алиментарные факторы |
1. | 1. |
2. | 2. |
3. | 3. |
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Выберите правильный ответ.
В молекуле холестерола количество атомов углерода, происходящих из ацетил-КоА, составляет:
A. 35 Б. 21
B. 27 Г. 24 Д. 15
2. Установите правильную последовательность событий.
При ассимиляции экзогенного холестерола происходит:
A. Реакция под действием фермента АХАТ Б. Транспорт в составе хиломикронов
B. Всасывание в составе смешанных мицелл Г. Захват ХМ ост. гепатоцитами
Д. Гидролиз эфиров холестерола под действием холестеролэстеразы
3. Выберите правильные ответы.
Фермент ГМГ-КоА-редуктаза активен при:
A. Снижении концентрации глюкозы в крови Б. Действии на него киназы
B. Повышении секреции инсулина
Г. Поступлении избытка холестерола с пищей Д. Действии на него фосфатазы
4. Выберите правильные ответы.
Укажите, кому из пациентов необходимо сделать дополнительные исследования для расчета коэффициента атерогенности, если содержание холестерола в крови у них составляет:
A. 260 мг/дл Б. 150 мг/дл
B. 240 мг/дл
Г. 4,8 мМоль/л Д. 6,8 мМоль/л
5. Установите соответствие.
Характеристика:
A. Образуется в кишечнике
Б. Продукт реакции конъюгации
B. Образуется в поджелудочной железе
Г. Содержит четыре гидроксильные группы Д. Образуется под действием 7α- и 12α-гидроксилаз Желчные кислоты:
1. Таурохенодезоксихолевая
2. Литохолевая
3. Холевая
6. Установите правильную последовательность событий.
При транспорте холестерола из печени в другие ткани происходит:
A. Взаимодействие апоВ-100 с ЛПНП-рецепторами Б. Образование ЛППП
B. Формирование структуры ЛПОНП незр. Г. Действие ЛП-липазы
Д. Перенос апоЕ и С-II с ЛПВП на ЛПОНП Е. Синтез апоВ-100
7. Установите правильную последовательность событий.
В ходе формирования и превращений ЛПВП происходит:
A. Образование ЛПВП3
Б. Перенос апоС-II и апоЕ на хиломикроны и ЛПОНП незр
B. Формирование ЛПВП незр.
Г. Этерификация холестерола под действием ЛХАТ и его перенос с
поверхности клеток внутрь ЛПВП Д. Превращение ЛПВП3 в ЛПВП2
8. Установите соответствие. Характеристика состава липопротеина:
A. Содержит -55% ТАГ
Б. Холестерол и его эфиры составляют -50%
B. Донор апоЕ и С-II
Г. На поверхности расположены ЛХАТ и его активатор А-I Д. Основной белок апоВ-48
Липопротеин:
1. ЛПОНП
2. ЛПНП
3. ЛПВП зрелый
9. Выберите правильные ответы.
Риск развития желчнокаменной болезни увеличивается при:
A. Повышенной активности ГМГ-КоА-редуктазы Б. Повышенной активности 7а-гидроксилазы
B. Употреблении в основном растительной пищи Г. Потреблении избытка углеводов
Д. Избыточном потреблении мясной пищи
10. Выберите правильные ответы.
Риск развития гиперхолестеролемии увеличивается при:
A. Изменении структуры ЛПНП в результате перекисного окисления липидов
Б. Мутациях в гене белка-рецептора ЛПНП
B. Гиперкалорийном питании
Г. Снижении активности ГМГ-КоА-редуктазы
Д. Значении коэффициента атерогенности, равном трем
 ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
ЭТАЛОНЫ ОТВЕТОВ К «ЗАДАНИЯМ ДЛЯ САМОКОНТРОЛЯ»
1. В
2. Д, В, А, Б, Г
3. В, Д
4. А, В, Д
5. 1_Б, 2_А, 3_Д
6. Е, В, Д, Г, Б, А
7. В, Б, Г, А, Д
8. 1_А, 2_Б, 3_Г
9. А, Г, Д
10. А, Б, В
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
1. Транспорт экзогенного холестерола хиломикронами
2. Биосинтез холестерола, пути использования в организме
3. ГМГ-КоА редуктаза _ регуляторный фермент синтеза холестерола
4. Желчные кислоты: первичные, вторичные, биосинтез, конъюгация
5. Желчнокаменная болезнь
6. Энтерогепатическая циркуляция желчных кислот
7. Роль ЛПОНП, ЛПНП и ЛПВП в транспорте холестерола
8. ЛПНП-рецепторы
9. «Обратный» транспорт холестерола
10. Гиперхолестеролемия и атеросклероз
11. Дислипопротеинемии
12. Биохимические основы развития атеросклероза
13. Семейная гиперхолестеролемия
ЗАДАНИЯ ДЛЯ АУДИТОРНОЙ РАБОТЫ
Решите задачи
1. Женщина 50 лет в течение нескольких лет ежедневно получает с пищей около 600 г углеводов, 80 г белков и 80 г жиров в основном растительного происхождения, физическим трудом не занимается. Объясните, как повлияет такой образ жизни на обмен холестерола. Для этого:
а) напишите краткие схемы метаболических путей, поставляющих субстраты для синтеза холестерола;
б) укажите гормон, увеличивающий скорость этих путей;
в) напишите схему синтеза холестерола;
г) укажите, как и через какие механизмы меняется активность синтеза
холестерола при таком образе жизни.
2. Экспериментальные животные получали с пищей жиры, в которых все атомы углерода были радиоактивны. Через некоторое время радиоактивные атомы углерода были обнаружены в крови в составе эфиров холестерола в липопротеинах, транспортирующих экзогенные липиды из кишечника. Укажите возможные пути попадания радиоактивного углерода из жиров пищи в эфиры холестерола липопротеинов (выполняющих у животных те же функции, что и хиломикроны у человека). Решите задачу, написав все соответствующие реакции и схемы.
3. У женщины 40 лет периодически появлялись острые боли в правом подреберье, иногда после таких приступов развивалась желтуха. При УЗ-исследовании были обнаружены камни в желчном пузыре. Объясните молекулярные механизмы развития желчнокаменной болезни. Для этого:
а) напишите схему синтеза первичных желчных кислот и их конъюгации, отметьте регуляторный фермент;
б) представьте схему гормональной регуляции этого фермента;
в) перечислите особенности питания, способствующие развитию желчнокаменной болезни;
г) опишите возможный состав камней в желчном пузыре и причины их формирования;
д) объясните, почему на начальных этапах заболевания таким больным в качестве лекарства прописывают препарат уросан (урсодезоксихолевая кислота, по своим свойствам сходная с желчными кислотами, синтезируемыми в организме человека).
4. При исследовании состава желчи в ней обнаружены не только первичные, но и вторичные желчные кислоты. Объясните причины этого явления, ответив на следующие вопросы и выполнив задания:
а) напишите формулы первичных желчных кислот;
б) составьте схему, показывающую дальнейшие превращения желчных кислот в печени и кишечнике;
в) напишите формулы вторичных желчных кислот, сравните их структуру; укажите, какая из них быстрее выделяется с фекалиями и почему;
г) перечислите состав основных компонентов мицелл желчи.
5. При обследовании у больного 40 лет обнаружена гиперхолестеролемия. При сборе анамнеза выяснилось, что отец больного умер в 45 лет от инфаркта миокарда. Врач назначил строгую диету и лечение ловастатином. На схемах (рис. 8.39) показано изменение у больного количества ЛПНП-рецепторов на поверхности клеток при лечении статинами: А _ до начала лечения; Б _ через 60 дней после начала лечения. Концентрация общего холестерола в крови до начала лечения была 400 мг/дл, после лечения _ 250 мг/дл. Сравните схемы А и Б на рис. 8.39 и объясните механизм снижения концентрации холестерола в крови после лечения ловастатином.
Для этого:
а) укажите возможные причины уменьшения количества рецепторов на поверхности клеток у больного до начала лечения; какое заболевание можно предположить в данном случае?
б) назовите все возможные причины гиперхолестеролемии;
в) напишите реакцию, ингибируемую ловастатином; перерисуйте схемы А и Б в тетрадь и в схеме Б укажите место действия лекарства;
г) опишите механизмы, приводящие к увеличению количества рецепторов на поверхности клеток в результате лечения.
 6. У
двух мужчин 60 лет определяли концентрацию общего холестерола и
холестерола в ЛПВП. У пациента А: холестерол общий - 280 мг/дл,
холестерол ЛПВП - 60 мг/дл; у пациента Б: холестерол общий - 280 мг/дл,
холестерол ЛПВП - 50 мг/дл. Оцените полученные данные. Для этого:
6. У
двух мужчин 60 лет определяли концентрацию общего холестерола и
холестерола в ЛПВП. У пациента А: холестерол общий - 280 мг/дл,
холестерол ЛПВП - 60 мг/дл; у пациента Б: холестерол общий - 280 мг/дл,
холестерол ЛПВП - 50 мг/дл. Оцените полученные данные. Для этого:
а) рассчитайте коэффициент атерогенности и определите, у кого из пациентов выше риск развития атеросклероза и его осложнений;
б) составьте схему, показывающую роль ЛПВП в обмене холестерола;
в) объясните, почему ЛПНП называют «атерогенными» липопротеинами, а ЛПВП - «антиатерогенными».
7. Фармацевтическая компания планирует создание новых препаратов, уменьшающих риск развития атеросклероза и его последствий - инфаркта миокарда и инсульта. Поступили предложения создавать препараты:
а) стимулирующие транскрипцию гена ЛХАТ;
б) стимулирующие транскрипцию белка АВС1;
в) новые ингибиторы простагландинсинтазы.
Докажите обоснованность таких предложений, составив соответствующие схемы, и напишите схемы реакций, в которых участвуют эти белки.