Патологическая анатомия : учебник / А. И. Струков, В. В. Серов. - 5-е изд., стер. - М.: Литтерра, 2010. - 848 с. : ил.
|
|
|
|
БОЛЕЗНИ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
Болезни сердечно-сосудистой системы занимают ведущее место в патологии современного человека. По статистическим данным, такие болезни, как атеросклероз, гипертоническая болезнь, ишемическая болезнь сердца и порока сердца, составляют наибольший процент заболеваний и являются основной причиной смертности человечества.
Среди заболеваний сердечно-сосудистой системы наибольшее значение имеют: эндокардит, миокардит, пороки сердца, кардиосклероз, атеросклероз, гипертоническая болезнь, ишемическая болезнь сердца, цереброваскулярные болезни, васкулиты.
Эндокардит
Эндокардит - воспаление эндокарда, т.е. внутренней оболочки сердца. Он возникает при многих заболеваниях, обычно инфекционной природы (вторичный эндокардит), в ряде случаев является самостоятельной нозологической формой (первичный эндокардит). Среди первичных эндокардитов выделяют бактериальный (септический) эндокардит, фибропластический париетальный эндокардит с эозинофилией.
Бактериальный (септический) эндокардит
Бактериальный (септический) эндокардит является одной из форм сепсиса (см. Сепсис).
Фибропластический париетальный эндокардит с эозинофилией
Фибропластический париетальный эндокардит с эозинофилией (париетальный фибропластический эозинофильный эндокардит Леффлера, системный эозинофильный васкулит с пристеночным эндокардитом) - редкое заболевание, характеризующееся выраженной сердечной недостаточностью, эозинофильным лейкоцитозом в сочетании с поражением кожи и внутренних органов. Течение болезни может быть острым или хроническим.
Этиология и патогенез. Причину болезни связывают с бактериальной или вирусной инфекцией. В патогенезе большое значение придают иммунным нарушениям, о чем свидетельствует обнаружение у больных LE- клеток. Проявление болезни объясняют действием циркулирующих иммунных комплексов.
Патологическая анатомия. Основные изменения находят в париетальном эндокарде желудочков сердца. Он становится резко утолщенным (констриктивный эндокардит) за счет фиброза, которому предшествует некроз эндокарда. Эластические волокна разрушаются и замещаются коллагеновыми, на поверхности эндокарда появляются тромботические массы (тромбоэндокардит), которые подвергаются организации. Фибропластический процесс может переходить на сосочковые мышцы и хордальные нити, что ведет к недостаточности митрального или трикуспидального клапана. В коже, миокарде, печени, почках, легких, головном мозге, скелетных мышцах стенка сосудов и периваскулярная ткань инфильтрированы клетками, среди которых преобладают эозинофилы - эозинофильные васкулиты и эозинофильные инфильтраты. Характерны тромбозы сосудов и тромбоэмболические осложнения в виде инфарктов и кровоизлияний. Селезенка и лимфатические узлы увеличены, гиперплазия лимфоидной ткани сочетается с инфильтрацией ее эозинофилами.
Осложнения. Часто встречаются тромбозы и тромбоэмболии, инфаркты легких, кровоизлияния в головной мозг.
Смерть наступает от острой или хронической сердечной недостаточности или от тромбоэмболических осложнений.
Миокардит
Миокардит - воспаление миокарда, т.е. мышцы сердца. Возникает обычно вторично при вирусных (полиомиелит, корь, мононуклеоз, острые вирусные респираторные инфекции), риккетсиозных (сыпной тиф), бактериальных (дифтерия, скарлатина, туберкулез, сифилис, сепсис) и протозойных (трипаносомоз) инфекционных и инфекционно-аллергических (ревматизм) заболеваниях (вторичный миокардит). Как самостоятельное заболевание представлен идиопатическим миокардитом.
Идиопатический миокардит
Идиопатический миокардит (миокардит Абрамова-Фидлера, идиопатический злокачественный, инфекционно-аллергический миокардит) характеризуется избирательным воспалительным процессом в миокарде (изолированный миокардит) и тяжелым прогрессирующим течением с частым летальным исходом (злокачественный миокардит). Течение болезни острое или хроническое рецидивирующее.
Этиология и патогенез. В настоящее время признана аллергическая природа идиопатического миокардита, обоснованная А.И. Абрикосовым и Я.Л. Рапопортом. Заболевание рассматривается как крайний вариант неспецифического инфекционно-аллергического миокардита, хотя некоторые авторы отождествляют его с застойной (конгестивной) кардиомиопатией (см. Кардиомиопатии). В пользу инфекционно-аллергического
генеза миокардита свидетельствует частое его развитие после вирусной или бактериальной инфекции, введения сывороток и вакцин, неупорядоченного приема лекарств. Прогрессирование болезни связано, вероятно, с аутоиммунизацией.
Патологическая анатомия. Типичным для идиопатического миокардита является распространенное поражение миокарда всех отделов сердца. Оно увеличено в размерах, дряблое, полости растянуты, как правило, с тромботическими наложениями; мышца на разрезе пестрая, клапаны интактны. Выделяют 4 морфологических (гистологических) типа идиопатического миокардита (Рапопорт Я.Л., 1951): дистрофический (деструктивный); воспалительно-инфильтративный; смешанный; сосудистый.
Дистрофический (деструктивный) тип характеризуется преобладанием гидропической дистрофии и лизисом кардиомиоцитов, причем реактивные изменения отсутствуют (ареактивный миолиз). В участках гибели мышечных клеток происходит лишь коллапс ретикулярной стромы.
Воспалительно-инфильтративный тип представлен серозным отеком и инфильтрацией стромы миокарда разнообразными клетками - нейтрофилами, лимфоцитами, макрофагами, плазматическими клетками. Среди них находят также многоядерные гигантские клетки. Дистрофические изменения кардиомиоцитов выражены умеренно.
Смешанный тип отражает сочетание деструктивных и воспалительноинфильтративных изменений.
Сосудистый тип характеризуется преобладанием поражения сосудов - васкулитами; кроме того, находят дистрофические и воспалительноинфильтративные изменения миокарда.
В исходе изменений, типичных для каждого морфологического типа идиопатического миокардита, развивается очаговый или (и) диффузный кардиосклероз, нередко в сочетании с гипертрофией миокарда.
Пестрота морфологических изменений миокарда (миолиз, межуточное воспаление, склероз, гипертрофия) определяет полиморфизм клинических проявлений идиопатического миокардита, его клинические варианты (аритмичный, псевдокоронарный, инфарктоподобный и др.).
Изменения других органов (помимо сердца) и тканей связаны с сердечной недостаточностью и тромботическими наложениями на париетальном эндокарде. Они проявляются застойным полнокровием и дистрофическими изменениями паренхиматозных элементов, тромбоэмболией сосудов, инфарктами и кровоизлияниями в легких, головном мозге, почках, кишечнике, селезенке и т.д.
Осложнения. Наиболее часто встречаются и являются грозными тромбоэмболические осложнения, которые могут быть первыми проявлениями миокардита.
Смерть наступает от сердечной недостаточности или тромбоэмболических осложнений.
Пороки сердца
Пороки сердца (vicia cordis) - стойкие отклонения в строении сердца, нарушающие его функцию.
Различают приобретенные и врожденные пороки сердца.
Приобретенные пороки сердца
Приобретенные пороки сердца характеризуются поражением клапанного аппарата сердца и магистральных сосудов и возникают в результате заболеваний сердца после рождения. Среди этих заболеваний большее значение имеет ревматизм, меньшее - атеросклероз, сифилис, бактериальный эндокардит, бруцеллез, а также травма. Приобретенные пороки сердца - хронические заболевания, в редких случаях, например при разрушении створок клапана вследствие язвенного эндокардита, возникают остро.
Механизм формирования приобретенного порока сердца тесно связан с эволюцией эндокардита, завершающейся организацией тромботических масс, рубцеванием, петрификацией и деформацией клапанов и фиброзных колец. Прогрессированию склеротических изменений способствуют возникающие при формировании порока нарушения гемодинамики.
Патологическая анатомия. Склеротическая деформация клапанного аппарата приводит к недостаточности клапанов, которые не в состоянии плотно смыкаться в период их закрытия, или сужению (стенозу) предсердно-желудочковых отверстий или устий магистральных сосудов. При комбинации недостаточности клапанов и стеноза отверстия говорят о комбинированном пороке сердца. Возможно поражение клапана (изолированный порок) или клапанов сердца (сочетанный порок).
Наиболее часто развивается порок митрального клапана, или митральный порок, возникающий обычно при ревматизме и очень редко при атеросклерозе. Различают недостаточность митрального клапана, стеноз левого предсердно-желудочкового (митрального) отверстия и их комбинацию (митральную болезнь). Чистые формы недостаточности встречаются редко, чистые формы стеноза - несколько чаще. В большинстве случаев отмечается их комбинация с преобладанием той или иной разновидности порока, которая в конечном итоге завершается стенозом отверстия. Прогрессирование склероза, а следовательно, и порока обусловлено чаще всего повторными атаками ревматизма (эндокардита), а также гиперпластическими изменениями клапана, возникающими в связи с непрерывной травматизацией измененного клапана током крови. В результате этого в створках митрального клапана появляются сосуды, затем соединительная ткань створок уплотняется, они превращаются в рубцовые, иногда обызвествленные, сросшиеся образования. Отмечаются склероз и петрификация фиброзного кольца. Хорды также склерозируются, становятся толстыми и укороченными. При преобладании недостаточности митрального клапана вследствие обратного тока крови (регургитация) при диастоле левое сердце переполняется кровью, развивается компенсаторная гепертрофия стенки левого желудочка.
Сужение отверстия митрального клапана чаще развивается на уровне фиброзного кольца, и отверстие имеет вид узкой щели, напоминающей пуговичную петлю, реже отверстие клапана имеет вид «рыбьей пасти» (рис. 140). Сужение митрального отверстия может достигать такой степени, что оно едва пропускает браншу пинцета. При преобладании стеноза возникает затруднение тока крови в малом круге кровообращения, левое предсердие расширяется, стенка его утолщается, эндокард склерозируется, становится белесоватым. В результате гипертонии в малом круге стенки правого желудочка подвергаются резкой гипертрофии (утолщаются до 1-2 см), полость желудочка расширяется.
Порок аортальных клапанов занимает по частоте второе место после митрального и обычно возникает на почве ревматизма, реже - атеросклероза, септического эндокардита, бруцеллеза, сифилиса. При ревматизме склероз полулунных заслонок и порок клапанов развиваются в связи с теми же процессами, которые формируют митральный порок. Заслонки срастаются между собой, утолщаются, в склерозированные заслонки откладывается известь (рис. 141), что приводит в одних случаях к преобладанию недостаточности клапанов, а в других - к стенозу аортального отверстия. При атеросклерозе обызвествление и склероз заслонок сочетаются с липоидозом и липосклерозом, причем изменения больше выражены на поверхности заслонок, обращенной к синусам. При септическом эндокардите и бруцеллезе наблюдаются резкая деструкция (узуры, перфоративные отверстия, аневризмы) заслонок и деформация их в связи с выраженной петрификацией. Сифилитический аортальный порок сочетается обычно с мезаортитом; в связи с расширением аорты в этих случаях преобладает недостаточность клапанов.
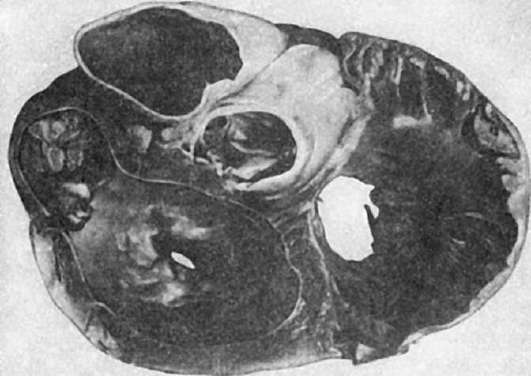 Рис. 140. Митральный порок сердца. Резко выраженный стеноз левого венозного (митрального) отверстия (вид сверху)
Рис. 140. Митральный порок сердца. Резко выраженный стеноз левого венозного (митрального) отверстия (вид сверху)
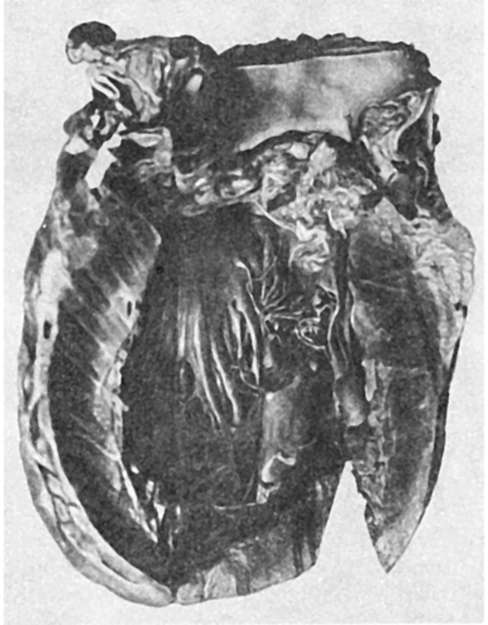 Рис. 141. Аортальный порок сердца. Утолщение, склероз и сращение заслонок; гипертрофия стенки левого желудочка
Рис. 141. Аортальный порок сердца. Утолщение, склероз и сращение заслонок; гипертрофия стенки левого желудочка
Сердце при аортальных пороках подвергается значительной рабочей гипертрофии, главным образом за счет левого желудочка (см. рис. 141). При недостаточности аортальных клапанов масса сердца может достигать 700-900 г - возникает так называемое бычье сердце (cor bovinum). Эндокард левого желудочка утолщен, склерозирован. В результате нарушений гемодинамики ниже клапанного отверстия иногда возникают образования, напоминающие полулунные заслонки («дополнительные клапаны»).
Приобретенные пороки трехстворчатого клапана и клапанов легочной артерии возникают редко на почве ревматизма, сифилиса, сепсиса, атеросклероза. Возможны как недостаточность клапанов, так и стеноз отверстия.
Помимо изолированных, часто наблюдаются сочетанные пороки: митрально-аортальный, митрально-трикуспидальный, митральноаортально-трикуспидальный. Многие сочетанные пороки являются и комбинированными.
Приобретенный порок сердца может быть компенсированным и декомпенсированным.
Компенсированный порок сердца протекает без расстройств кровообращения, нередко длительно и латентно. Компенсация осуществляется за счет гипертрофии тех отделов сердца, на которые падает усиленная нагрузка в связи с пороком. Возникает концентрическая гипертрофия миокарда. Однако гипертрофия имеет свои пределы, и на определенном этапе ее развития в миокарде появляются дистрофические изменения, которые ведут к ослаблению работы сердца. Концентрическая гипертрофия сменяется эксцентрической вследствие наступившей миогенной дилатации полостей сердца.
Декомпенсированный порок сердца характеризуется расстройством сердечной деятельности, ведущей к сердечно-сосудистой недостаточности. Причиной декомпенсации могут быть обострение ревматического процесса, случайная инфекция, чрезмерная физическая нагрузка, психическая травма. Сердце становится дряблым, полости расширяются, в ушках его образуются тромбы. Обнаруживается белковая и жировая дистрофия мышечных волокон, в строме появляются очажки воспалительной ин-
фильтрации. В органах возникает венозный застой, появляются цианоз, отеки, водянка полостей. Сердечно-сосудистая недостаточность становится частой причиной смерти больных, страдающих пороком сердца. Реже смерть наступает внезапно от тромбоэмболии, закупорки суженного митрального отверстия шаровидным тромбом, паралича гипертрофированного сердца, пневмонии.
Врожденные пороки сердца
Врожденные пороки сердца возникают в результате нарушения формирования сердца и отходящих от него сосудов (см. Болезни детского возраста).
Кардиосклероз
Кардиосклероз - разрастание соединительной ткани в сердечной мышце. Как правило, это вторичный процесс.
Патологическая анатомия. Различают очаговый и диффузный кардиосклероз. При очаговом кардиосклерозе в мышце сердца образуются различной величины белесоватые тяжистые участки - рубцы. Такие рубцы обычно образуются при организации инфарктов миокарда. Они пронизывают иногда толщу мышцы сердца и представляют собой обширные поля (крупноочаговый кардиосклероз), на месте которых нередко формируется хроническая аневризма (от греч. aneuryno - расширять) сердца. По периферии таких рубцов миокард утолщен (регенерационная гипертрофия). Довольно часто развивается мелкоочаговый кардиосклероз, представленный белесоватыми периваскулярными очажками и полосками, которые равномерно разбросаны в мышце сердца. Он возникает в результате разрастания соединительной ткани в участках дистрофии, атрофии и гибели отдельных мышечных клеток в связи с гипоксией. Диффузный кардиосклероз, или миофиброз, характеризуется диффузным утолщением и огрублением стромы миокарда за счет новообразования в ней соединительной ткани. Соединительная ткань в таких случаях оплетает, как бы замуровывает атрофирующиеся мышечные волокна.
Морфогенез. Различают 3 вида кардиосклероза: постинфарктный, заместительный и миокардитический. Постинфарктный кардиосклероз обычно бывает крупноочаговым, заместительный - мелкоочаговым, миокардитический - диффузным (миофиброз).
Клиническое значение. С кардиосклерозом связано нарушение сократительной функции миокарда, проявляющееся в сердечной недостаточности и нарушениях ритма сердца. Крупноочаговый постинфарктный кардиосклероз служит основой развития хронической аневризмы сердца.
Атеросклероз
Атеросклероз (от греч. athere - кашица и sklerosis - уплотнение) - хроническое заболевание, возникающее в результате нарушения жирового и
белкового обмена, характеризующееся поражением артерий эластического и мышечно-эластического типа в виде очагового отложения в интиме липидов и белков и реактивного разрастания соединительной ткани.
Атеросклероз широко распространен среди населения экономически развитых стран Европы и Северной Америки. Болеют обычно люди во второй половине жизни. Проявления и осложнения атеросклероза являются наиболее частыми причинами смертности и инвалидности в большинстве стран мира.
Следует отличать атеросклероз от артериосклероза, которым обозначают склероз артерий независимо от причины и механизма его развития. Атеросклероз является лишь разновидностью артериосклероза, отражающей нарушения метаболизма липидов и белков (метаболический артериосклероз). В таком толковании термин «атеросклероз» был введен в 1904 г. Маршаном и обоснован экспериментальными исследованиями Н.Н. Аничкова. Поэтому атеросклероз называют болезнью Маршана- Аничкова.
В зависимости от этиологических, патогенетических и морфологических признаков различают следующие виды артериосклероза: 1) атеросклероз (метаболический артериосклероз); 2) артериосклероз, или гиалиноз (например, при гипертонической болезни); 3) воспалительный артериолосклероз (например, сифилитический, туберкулезный); 4) аллергический артериосклероз (например, при узелковом периартериите); 5) токсический артериосклероз (например, адреналиновый); 6) первичный кальциноз средней оболочки артерий (медиакальциноз Менкеберга); 7) возрастной (старческий) артериосклероз.
Этиология. В развитии атеросклероза наибольшее значение имеют следующие факторы: 1) обменные (экзо- и эндогенные); 2) гормональные; 3) гемодинамический; 4) нервный; 5) сосудистый; 6) наследственные и этнические.
Среди обменных факторов основное значение имеют нарушения жирового и белкового обмена, прежде всего холестерина и липопротеидов.
Гиперхолестеринемии придавалась чуть ли не ведущая роль в этиологии атеросклероза. Это было доказано экспериментальными исследованиями. Скармливание животным холестерина приводит к гиперхолестеринемии, отложению холестерина и его эфиров в стенке аорты и артерий, развитию атеросклеротических изменений. У больных атеросклерозом людей также нередко отмечают гиперхолестеринемию, ожирение. Эти данные позволяли ранее считать, что в развитии атеросклероза исключительное значение имеет алиментарный фактор (алиментарная инфильтрационная теория атеросклероза Н.Н. Аничкова). Однако в дальнейшем было доказано, что избыток экзогенного холестерина у человека во многих случаях не приводит к развитию атеросклероза, корреляция между гиперхолестеринемии и выраженностью морфологических изменений, свойственных атеросклерозу, отсутствует.
В настоящее время в развитии атеросклероза придается значение не столько самой гиперхолестеринемии, сколько нарушению обмена липо-
протеидов, ведущему к преобладанию плазменных липопротеидов очень низкой плотности (ЛПОНП) и низкой плотности (ЛПНП) над липопротеидами высокой плотности (ЛПВП).
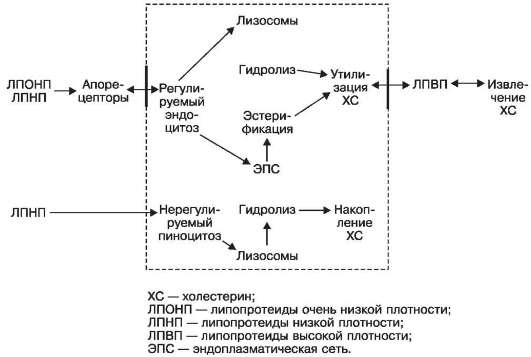
Липопротеиды очень низкой и низкой плотности отличаются от липопротеидов высокой плотности прежде всего тем, что липидный компонент у первых представлен холестерином, а у вторых - фосфолипидами; белковым компонентом у первых и вторых является апопротеин. Из этого следует, что метаболизм холестерина в клетке связан прежде всего с обменом в ней липопротеидов, к которым клетка имеет специфические апорецепторы. При регулируемом (рецепторном) обмене поставщиками холестерина в клетку являются ЛПОНП и ЛПНП (регулируемый эндоцитоз), при этом излишки холестерина после утилизации его клеткой извлекаются ЛПВП. Однако при наследственной утрате апорецепторов клеткой или их поломе при преобладании ЛПОНП и ЛПНП над ЛПВП регулируемый обмен холестерина в клетке сменяется нерегулируемым (нерегулируемый пиноцитоз), что ведет к накоплению холестерина в клетке (схема XVII). Поэтомуто ЛПОНП и ЛПНП называют атерогенными.
Схема XVII. Метаболизм холестерина в клетке
 В основе обменных нарушений при атеросклерозе лежит дислипопарапротеинемия с преобладанием ЛПОНП и ЛПНП, что ведет к нерегулируемому клеточному обмену холестерина (рецепторная теория атеросклероза Гольдштейна и Брауна), появлению так называемых пенистых клеток в интиме артерий, с которыми связано образование атеросклеротических бляшек.
В основе обменных нарушений при атеросклерозе лежит дислипопарапротеинемия с преобладанием ЛПОНП и ЛПНП, что ведет к нерегулируемому клеточному обмену холестерина (рецепторная теория атеросклероза Гольдштейна и Брауна), появлению так называемых пенистых клеток в интиме артерий, с которыми связано образование атеросклеротических бляшек.
Значение гормональных факторов в развитии атеросклероза несомненно. Так, сахарный диабет и гипотиреоз способствуют, а гипертиреоз и эстрогены препятствуют развитию атеросклероза. Имеется прямая связь между ожирением и атеросклерозом. Несомненна и роль гемодинамического фактора (артериальная гипертензия, повышение сосудистой проницаемости) в атерогенезе. Независимо от характера гипертонии при ней отмечается усиление атеросклеротического процесса. При гипертонии атеросклероз развивается даже в венах (в легочных венах - при гипертензии малого круга, в воротной вене - при портальной гипертензии).
Исключительная роль в этиологии атеросклероза отводится нервному фактору - стрессовым и конфликтным ситуациям, с которыми связано психоэмоциональное перенапряжение, ведущее к нарушению нейроэндокринной регуляции жиробелкового обмена и вазомоторным расстройствам (нервно-метаболическая теория атеросклероза А.Л. Мясникова). Поэтому атеросклероз рассматривается как болезнь сапиентации.
Сосудистый фактор, т.е. состояние сосудистой стенки, в значительной мере определяет развитие атеросклероза. Имеют значение заболевания (инфекции, интоксикации, артериальная гипертония), ведущие к поражению стенки артерий (артериит, плазматическое пропитывание, тромбоз, склероз), что «облегчает» возникновение атеросклеротических изменений. Избирательное значение при этом имеют пристеночные и интрамуральные тромбы, на которых «строится» атеросклеротическая бляшка (тромбогенная теория Рокитанского-Дьюгеда). Некоторые исследователи придают основное значение в развитии атеросклероза возрастным изменениям артериальной стенки и рассматривают атеросклероз как «проблему возраста», как «геронтологическую проблему» (Давыдовский И.В., 1966). Эта концепция не разделяется большинством патологов.
Роль наследственных факторов в атеросклерозе доказана (например, атеросклероз у молодых людей при семейной гиперлипопротеидемии, отсутствии апорецепторов). Имеются данные о роли этнических факторов в его развитии.
Таким образом, атеросклероз следует считать полиэтиологическим заболеванием, возникновение и развитие которого связано с влиянием экзогенных и эндогенных факторов.
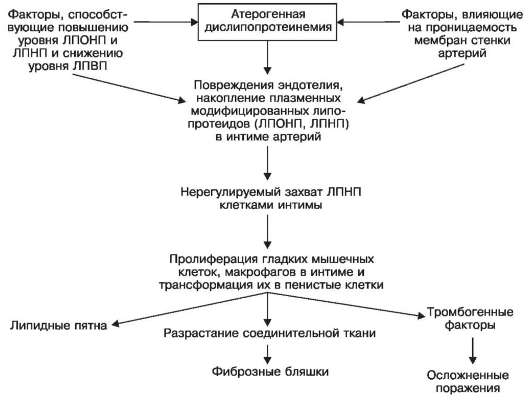
Патогенез атеросклероза учитывает все факторы, способствующие его развитию, но при этом прежде всего те, которые ведут к атерогенной липопротеидемии и повышению проницаемости мембран стенки артерий. С ними связано в дальнейшем повреждение эндотелия артерий, накопление плазменных модифицированных липопротеидов (ЛПОНП, ЛПНП) в интиме, нерегулируемый захват атерогенных липопротеидов клетками интимы, пролиферация в ней гладкомышечных клеток и макрофагов с последующей трансформацией в так называемые пенистые клетки, которые причастны к развитию всех атеросклеротических изменений (схема XVIII).
Схема XVIII. Патогенез атеросклероза
 Патологическая анатомия и морфогенез. Сущность процесса хорошо отражает термин: в интиме артерий появляются кашицеобразный жиробелковый детрит (athere) и очаговое разрастание соединительной ткани (sclerosis), что
приводит к формированию атеросклеротической бляшки, суживающей просвет
сосуда. Обычно поражаются, как уже упоминалось, артерии эластического и
мышечно-эластического типа, т.е. артерии крупного и среднего калибра;
значительно реже в процесс вовлекаются мелкие артерии мышечного типа.
Патологическая анатомия и морфогенез. Сущность процесса хорошо отражает термин: в интиме артерий появляются кашицеобразный жиробелковый детрит (athere) и очаговое разрастание соединительной ткани (sclerosis), что
приводит к формированию атеросклеротической бляшки, суживающей просвет
сосуда. Обычно поражаются, как уже упоминалось, артерии эластического и
мышечно-эластического типа, т.е. артерии крупного и среднего калибра;
значительно реже в процесс вовлекаются мелкие артерии мышечного типа.
Атеросклеротический процесс проходит определенные стадии (фазы), которые имеют макроскопическую и микроскопическую характеристику (морфогенез атеросклероза).
При макроскопическом исследовании различают следующие виды атеросклеротических изменений, отражающие динамику процесса (рис. 142, 143, см. на цв. вкл.): 1) жировые пятна или полоски; 2) фиброзные бляшки; 3) осложненные поражения, представленные фиброзными бляшками с изъязвлением, кровоизлияниями и наложениями тромботических масс; 4) кальциноз, или атерокальциноз.
Жировые пятна или полоски - это участки желтого или желто-серого цвета (пятна), которые иногда сливаются и образуют полоски, но не возвышаются над поверхностью интимы. Они содержат липиды, выявляемые
при тотальной окраске сосуда красителями на жиры, например Суданом. Раньше всего жировые пятна и полоски появляются в аорте на задней стенке и у места отхождения ее ветвей, позже - в крупных артериях.
У 50% детей в возрасте моложе 1 года можно обнаружить в аорте липидные пятна. В юношеском возрасте липидоз усиливается, жировые пятна появляются не только в аорте, но и в венечных артериях сердца. С возрастом изменения, характерные для физиологического раннего липидоза, в подавляющем большинстве случаев исчезают и не являются источником развития дальнейших атеросклеротических изменений.
Фиброзные бляшки - плотные, овальные или круглые, белые или беложелтые образования, содержащие липиды и возвышающиеся над поверхностью интимы. Часто они сливаются между собой, придают внутренней поверхности сосуда бугристый вид и резко суживают его просвет (стенозирующий атеросклероз). Наиболее часто фиброзные бляшки наблюдаются в брюшной аорте, в отходящих от аорты ветвях, в артериях сердца, мозга, почек, нижних конечностей, сонных артериях и др. Чаще поражаются те участки сосудов, которые испытывают гемодинамическое (механическое) воздействие (в областях ветвления и изгибов артерий, на стороне их стенки, которая имеет жесткую подстилку).
Осложненные поражения возникают в тех случаях, когда в толще бляшки преобладает распад жиробелковых комплексов и образуется детрит, напоминающий содержимое ретенционной кисты сальной железы, т.е. атеромы. Поэтому такие изменения называют атероматозными. Прогрессирование атероматозных изменений ведет к деструкции покрышки бляшки, ее изъязвлению (атероматозная язва), кровоизлияниям в толщу бляшки (интрамуральная гематома) и образованию тромботических наложений на месте изъязвления бляшки. С осложненными поражениями связаны: острая закупорка артерии тромбом и развитие инфаркта, эмболия как тромботическими, так и атероматозными массами, образование аневризмы сосуда в месте его изъязвления, а также артериальное кровотечение при разъедании стенки сосуда атероматозной язвой.
Кальциноз, или атерокальциноз, - завершающая фаза атеросклероза, которая характеризуется отложением в фиброзные бляшки солей кальция, т.е. их обызвествлением. Бляшки приобретают каменистую плотность (петрификация бляшек), стенка сосуда в месте петрификации резко деформируется.
Различные виды атеросклеротических изменений нередко сочетаются: в одном и том же сосуде, например в аорте, можно видеть одновременно жировые пятна и полосы, фиброзные бляшки, атероматозные язвы с тромбами и участки атерокальциноза (см. рис. 142, 143), что свидетельствует о волнообразности течения атеросклероза.
Микроскопическое исследование позволяет уточнить и дополнить характер и последовательность развития изменений, свойственных атеросклерозу. На основании его результатов выделены следующие стадии морфогенеза атеросклероза (рис. 144): 1) долипидная; 2) липоидоз; 3) липосклероз; 4) атероматоз; 5) изъязвление; 6) атерокальциноз.
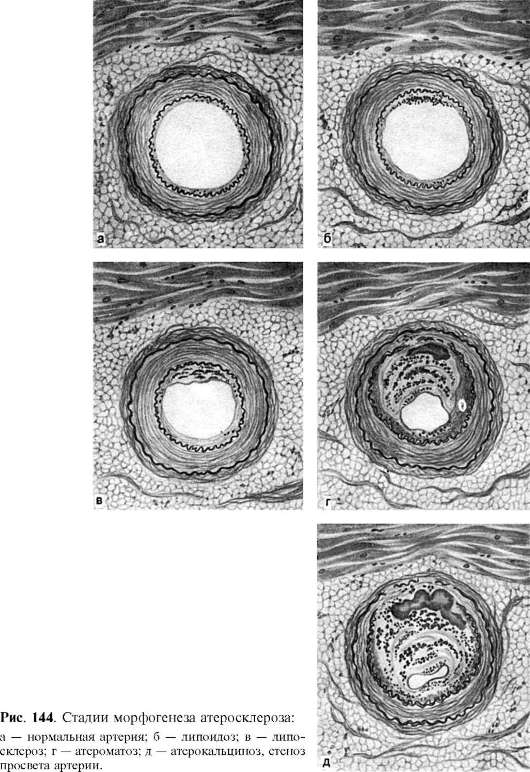 Долипидная стадия характеризуется
изменениями, отражающими общие нарушения метаболизма при атеросклерозе
(гиперхолестеринемия, гиперлипопротеидемия, накопление грубодисперсных
белков и мукоидных веществ в плазме крови, повышение активности
гиалуронидазы и т.д.) и «травму» интимы продуктами нарушенного
метаболизма. К этим изменениям относятся: 1) повышение проницаемости
эндотелия и мембран интимы, что ведет к накоплению во внутренней
оболочке белков плазмы, фибриногена (фибрина) и образованию плоских
пристеночных тромбов; 2) накопление кислых гликозаминогликанов в интиме,
с чем связано появление мукоидного отека внутренней оболочки, а поэтому
благоприятных условий для фиксации в ней липопротеидов очень низкой и
низкой плотности, холестерина, белков (рис. 145); 3) деструкция
эндотелия, базальных мембран интимы, эластических и коллагеновых
волокон, способствующая еще большему повышению проницаемости интимы для
продуктов нарушенного обмена и пролиферации гладкомышечных клеток.
Долипидная стадия характеризуется
изменениями, отражающими общие нарушения метаболизма при атеросклерозе
(гиперхолестеринемия, гиперлипопротеидемия, накопление грубодисперсных
белков и мукоидных веществ в плазме крови, повышение активности
гиалуронидазы и т.д.) и «травму» интимы продуктами нарушенного
метаболизма. К этим изменениям относятся: 1) повышение проницаемости
эндотелия и мембран интимы, что ведет к накоплению во внутренней
оболочке белков плазмы, фибриногена (фибрина) и образованию плоских
пристеночных тромбов; 2) накопление кислых гликозаминогликанов в интиме,
с чем связано появление мукоидного отека внутренней оболочки, а поэтому
благоприятных условий для фиксации в ней липопротеидов очень низкой и
низкой плотности, холестерина, белков (рис. 145); 3) деструкция
эндотелия, базальных мембран интимы, эластических и коллагеновых
волокон, способствующая еще большему повышению проницаемости интимы для
продуктов нарушенного обмена и пролиферации гладкомышечных клеток.
Продолжительность долипидной стадии определяется возможностью липолитических и протеолитических (фибринолитических) ферментов интимы «очищать» ее от «засорения» продуктами нарушенного метаболизма. Как правило, активность этих ферментов интимы в долипидной стадии повышена, истощение их знаменует начало стадии липоидоза.
В стадии липоидоза отмечается очаговая инфильтрация интимы, особенно поверхностных ее отделов, липидами (холестерином), липопротеидами, белками (рис. 146), что ведет к образованию жировых пятен и полос. Липиды диффузно пропитывают интиму и накапливаются в гладко-
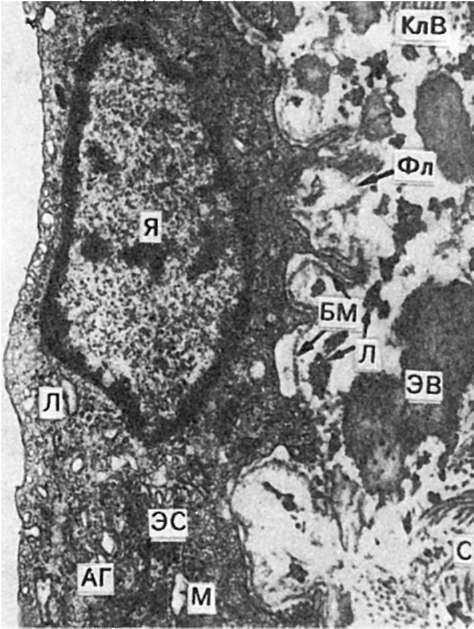 Рис. 145. Долипидные изменения интимы аорты при атеросклерозе: В
эндотелиальной клетке увеличивается зона комлекса Гольджи (АГ), более
выражена эндоплазматическая сеть (ЭС), в которой появляется плотный
материал - липиды (Л); базальная мембрана (БМ) несколько разрыхлена; за
базальной мембраной среди коллагеновых (КлВ) и эластических (ЭВ) волокон
фибриллярные отложения (Фл) белков и липидов (Л). Я - ядро. х23 000 (по
Рис. 145. Долипидные изменения интимы аорты при атеросклерозе: В
эндотелиальной клетке увеличивается зона комлекса Гольджи (АГ), более
выражена эндоплазматическая сеть (ЭС), в которой появляется плотный
материал - липиды (Л); базальная мембрана (БМ) несколько разрыхлена; за
базальной мембраной среди коллагеновых (КлВ) и эластических (ЭВ) волокон
фибриллярные отложения (Фл) белков и липидов (Л). Я - ядро. х23 000 (по
Гиру)
 Рис. 146. Липоидоз. Во внутренних отделах интимы скопления липидов (черного цвета)
Рис. 146. Липоидоз. Во внутренних отделах интимы скопления липидов (черного цвета)
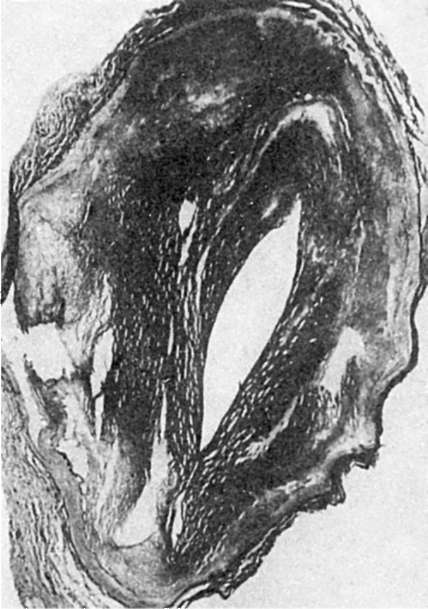 Рис. 147. Липосклероз. Просвет венечной артерии сердца сужен фиброзной бляшкой
Рис. 147. Липосклероз. Просвет венечной артерии сердца сужен фиброзной бляшкой
мышечных клетках и макрофагах, которые получили название пенистых, или ксантомных, клеток (от греч. xanthos - желтый). В эндотелии также появляются липидные включения, что свидетельствует об инфильтрации интимы липидами плазмы крови. Отчетливо выражены набухание и деструкция эластических мембран.
Липосклероз характеризуется разрастанием молодых соединительнотканных элементов интимы в участках отложения и распада липидов и белков, разрушением эластических и аргирофильных мембран. Очаговое разрастание в интиме молодой соединительной ткани и ее последующее созревание ведут к формированию фиброзной бляшки (рис. 147), в которой появляются тонкостенные сосуды, связанные с vasa vasorum. Существует точка зрения, что формирование фиброзной бляшки связано с пролиферацией гладкомышечных клеток, возникающей в ответ на повреждение эндотелия и эластических волокон артерий.
При атероматозе липидные массы, составляющие центральную часть бляшки, а также прилежащие коллагеновые и эластические волокна распадаются (рис. 148). При этом образуется мелкозернистая аморфная масса, в которой обнаруживаются кристаллы холестерина и жирных кислот, обрывки эластических и коллагеновых волокон, капельки нейтральных жиров (атероматозный детрит). В краях у основания бляшки появляются много новообразованных сосудов, врастающих из vasa vasorum, а также ксантомные клетки, лим-
фоциты, плазматические клетки. Атероматозные массы отграничены от просвета сосуда слоем зрелой, иногда гиалинизированной, соединительной ткани (покрышка бляшки). В связи с тем что атероматозному распаду подвергаются гладкие мышечные волокна средней оболочки, бляшка «погружается» довольно глубоко, достигая в некоторых случаях адвентиции. Атероматоз - начало осложненных поражений. При прогрессировании атероматоза в связи с разрушением новообразованных сосудов происходит кровоизлияние в толщу бляшки (интрамуральная гематома), покрышка бляшки разрывается. Наступает стадия изъязвления, характеризующаяся образованием атероматозной язвы. Края ее подрытые, неровные, дно образовано мышечным, а иногда наружным, слоем стенки сосуда. Дефект ин-
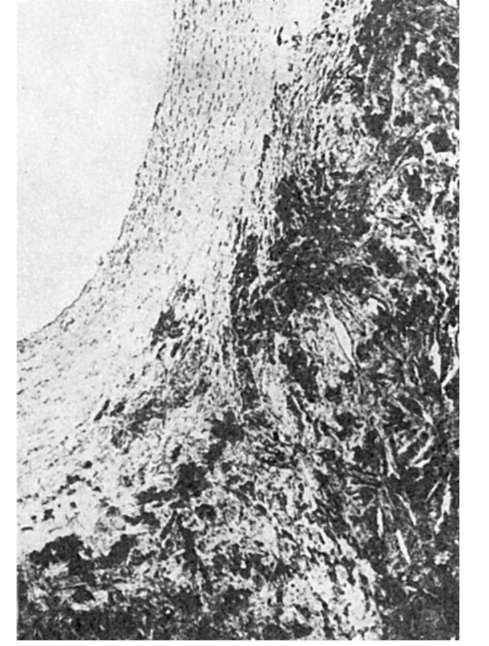 Рис. 148. Атероматоз. В толще бляшки атероматозный детрит, кристаллы холестерина
Рис. 148. Атероматоз. В толще бляшки атероматозный детрит, кристаллы холестерина
тимы очень часто покрывается тромботическими наложениями, причем тромб может быть не только пристеночным, но и обтурирующим.
Атерокальциноз - завершающая стадия морфогенеза атеросклероза, хотя отложение извести начинается уже в стадии атероматоза и даже липосклероза. Известь откладывается в атероматозные массы, в фиброзную ткань, в межуточное вещество между эластическими волокнами. При значительных отложениях извести в покрышке бляшки образуются плотные и ломкие пластинки. Обызвествлению бляшек способствует эластолиз. В связи с деструкцией эластических мембран происходит накопление аспарагиновой и глутаминовой кислот. Ионы кальция связываются со свободными карбоксильными группами этих кислот и осаждаются в виде фосфата кальция.
Морфогенез атеросклероза в значительной мере определяет выделение клинических периодов и стадий болезни.
Морфологическое обоснование получило и волнообразное течение атеросклероза, складывающееся из чередований фаз прогрессирования (активная фаза), стабилизации (неактивная фаза) и регрессирования. Прогрессирование атеросклероза характеризуется морфологией волны липоидоза, которая наслаивается на старые изменения (липосклероз, атероматоз, атерокальциноз) и ведет к развитию осложненных поражений (атероматоз, кровоизлияние в толще бляшки, тромбоз). Следствием раз-
вивающейся острой ишемии органов и тканей становятся инфаркт, гангрена, кровоизлияния. При регрессировании атеросклероза происходят макрофагальная резорбция и вымывание липидов из бляшек, разрастание соединительной ткани увеличивается. Хроническая ишемия органов и тканей усиливается, что ведет к дистрофии и атрофии паренхиматозных элементов, нарастанию склероза интерстиция.
Клинико-морфологические формы
В зависимости от преимущественной локализации атеросклероза в том или ином сосудистом бассейне, осложнений и исходов, к которым он ведет, выделяют следующие клинико-анатомические его формы: 1) атеросклероз аорты; 2) атеросклероз венечных артерий сердца (сердечная форма, ишемическая болезнь сердца); 3) атеросклероз артерий головного мозга (мозговая форма, цереброваскулярные заболевания); 4) атеросклероз артерий почек (почечная форма); 5) атеросклероз артерий кишечника (кишечная форма); 6) атеросклероз артерий нижних конечностей.
При каждой из названных форм могут наблюдаться двоякие изменения. Медленное атеросклеротическое сужение питающей артерии и хроническая недостаточность кровообращения приводят к ишемическим изменениям - дистрофии и атрофии паренхимы, диффузному или мелкоочаговому склерозу стромы. При острой окклюзии питающей артерии и острой недостаточности кровоснабжения возникают изменения другого рода. Эти катастрофически наступающие изменения имеют некротический характер и проявляются инфарктами, гангреной, кровоизлияниями. Они, как уже говорилось, отмечаются обычно при прогрессирующем атеросклерозе.
1. Атеросклероз аорты - наиболее часто встречающаяся форма. Более резко он выражен в брюшном отделе и характеризуется обычно атероматозом, изъязвлениями, атерокальцинозом. В связи с этим атеросклероз аорты часто осложняется тромбозом, тромбоэмболией и эмболией атероматозными массами с развитием инфарктов (например, почек) и гангрены (например, кишечника, нижней конечности). Нередко на почве атеросклероза развивается аневризма аорты (рис. 149), т.е. выбухание стенки в месте ее поражения, чаще изъязвления. Аневризма может иметь различную форму, в связи с чем различают цилиндрическую, мешковидную, грыжевидную аневризмы. Стенку аневризмы в одних случаях образует аорта (истинная аневризма), в других - прилегающие к ней ткани и гематома (ложная аневризма). Если кровь отслаивает среднюю оболочку аорты от интимы или от адвентиция, что ведет к образованию покрытого эндотелием канала, то говорят о расслаивающей аневризме. Образование аневризмы чревато ее разрывом и кровотечением. Длительно существующая аневризма аорты приводит к атрофии окружающих тканей (например, грудины, тел позвонков).
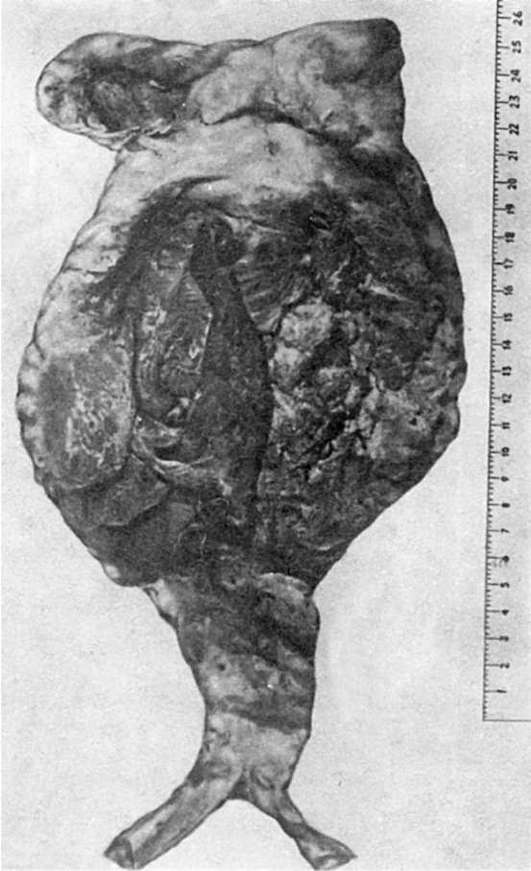 Рис. 149. Атеросклеротическая аневризма брюшной аорты, заполненная тромбами
Рис. 149. Атеросклеротическая аневризма брюшной аорты, заполненная тромбами
Атеросклероз дуги аорты может лежать в основе синдрома дуги аорты, а атеросклероз бифуркации аорты с тромбозом ее - вести к развитию синдрома Лериша, имеющего характерную симптоматику.
2. Атеросклероз венечных артерий сердца лежит в основе ишемической его болезни (см. Ишемическая болезнь сердца).
3. Атеросклероз артерий головного мозга является основой цереброваскулярных заболеваний (см. Цереброваскулярные заболевания). Длительная ишемия головного мозга на почве стенозирующего атеросклероза мозговых артерий приводит к дистрофии и атрофии коры мозга, развитию атеросклеротического слабоумия.
4. При атеросклерозе почечных артерий сужение просвета бляшкой обычно наблюдается у места ответвления основного ствола или деления его на ветви первого и второго порядка. Чаще процесс односторонний, реже - двусторонний. В почках развиваются либо клиновидные участки атрофии паренхимы с коллапсом стромы и замещением этих участков соединительной тканью, либо инфаркты с последующей организацией их
и формированием втянутых рубцов. Возникает крупнобугристая атеросклеротическая сморщенная почка (атеросклеротический нефросклероз; рис. 150), функция которой страдает мало, так как большая часть паренхимы остается сохранной. В результате ишемии почечной ткани при стенозирующем атеросклерозе почечных артерий в ряде случаев развивается симптоматическая (почечная) гипертония.
5. Атеросклероз артерий кишечника, осложненный тромбозом, ведет к гангрене кишки.
6. При атеросклерозе артерий конечностей чаще поражаются бедренные артерии. Процесс длительное время протекает бессимптомно благодаря развитию коллатералей. Однако при нарастающей недостаточности коллатералей развиваются атрофические изменения мышц, похолодание конечности,
появляются характерные боли при ходьбе - перемежающаяся хромота. Если атеросклероз осложняется тромбозом, развивается гангрена конечности - атеросклеротическая гангрена.
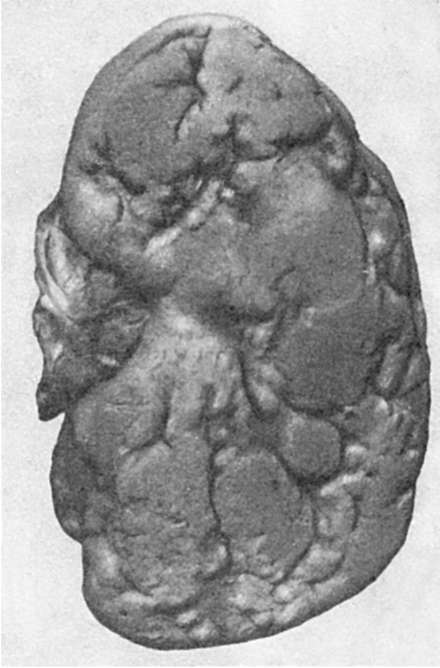 Рис. 150. Атеросклеротический нефросклероз
Рис. 150. Атеросклеротический нефросклероз
Гипертоническая болезнь
Гипертоническая болезнь (синонимы: первичная, или эссенциальная, гипертензия, болезнь высокого артериального давления) - хроническое заболевание, основным клиническим признаком которого является длительное и стойкое повышение артериального давления (гипертензия). Описана как самостоятельное заболевание неврогенной природы, как «болезнь неотреагированных эмоций» отечественным клиницистом Г.Ф. Лангом.
Гипертоническая болезнь, как и атеросклероз, является болезнью урбанизации и сапиентации, широко распространена в экономически развитых странах, испытывающих все возрастающее напряжение психоэмоциональной сферы. Болеют чаще мужчины во второй половине жизни.
Выделение гипертонической болезни позволило отграничить ее от симптоматических гипертензий, или гипертонических состояний, которые появляются вторично при многих заболеваниях нервной и эндокринной систем, патологии почек и сосудов.
К развитию симптоматической гипертензий ведут:
1) заболевания ЦНС: энцефалит, полиомиелит на уровне стволовой части мозга, опухоли и травмы мозга (посткоммоционная гипертензия);
2) заболевания эндокринной системы: опухоли надпочечников (феохромоцитома, альдостерома, кортикостерома), параганглиев (параганглиома) и гипофиза (базофильная аденома); эндокринно-сексуальная гипертензия (климактерический период у женщин и мужчин);
3) заболевания почек и мочевыводящих путей (почечная, или нефрогенная, гипертензия): гломерулонефриты, пиелонефрит, гидронефроз, диабетическая и печеночная нефропатия, амилоидоз почек, врожденные аномалии, поликистоз почек;
4) заболевания сосудов: атеросклероз дуги и коарктация аорты на разных уровнях, сужение крупных артерий (подключичной, сонной), системный васкулит; сужение и аномалии почечных артерий (реноваскулярная гипертензия).
Этиология. В возникновении гипертонической болезни, помимо психоэмоционального перенапряжения, ведущего к нарушениям высшей нервной деятельности типа невроза и расстройству регуляции сосудистого тонуса (Ланг Г.Ф., 1922; Мясников А.Л., 1954), велика роль наследственного фактора и избытка поваренной соли в пище.
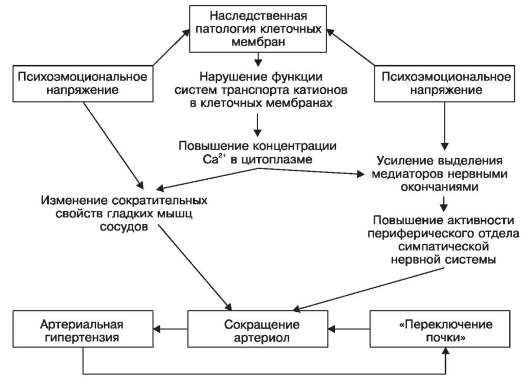
Патогенез. В механизме развития гипертонической болезни участвует ряд факторов: 1) нервный; 2) рефлекторные; 3) гормональные; 4) почечный; 5) наследственные. Считают, что психоэмоциональное перенапряжение (нервный фактор) ведет к истощению центров сосудистой регуляции с вовлечением в патогенетический механизм рефлекторных и гуморальных факторов. Среди рефлекторных факторов следует учитывать возможное выключение депрессорных влияний каротидного синуса и дуги аорты, а также активацию симпатической нервной системы. Среди гормональных факторов имеют значение усиление прессорных влияний гипофизарнодиэнцефальной области (гиперплазия клеток задней и передней долей гипофиза), избыточное выделение катехоламинов (гиперплазия мозгового вещества надпочечников) и активация ренин-гипертензивной системы в результате нарастающей ишемии почек (гиперплазия и гипергранулярность клеток юкстагломерулярного аппарата, атрофия интерстициальных клеток мозгового вещества почек).
Почечному фактору в патогенезе гипертонической болезни придается исключительное значение, так как экскреция почками натрия и воды, секреция ими ренина, кининов и простагландинов - один из основных механизмов регуляции артериального давления.
В системе кровообращения почка выполняет роль своеобразного регулятора, определяющего величину систолического артериального давления и обеспечивающего по механизму обратной связи его долгосрочную стабилизацию на определенном уровне (баростатная функция почки). Обратную связь в этой системе осуществляют нервные и эндокринные механизмы регуляции артериального давления: автономная нервная система с баро- и хеморецепторами и центрами сосудистой регуляции в стволе головного мозга, ренин-ангиотензиновая система, нейроэндокринная система (вазопрессин, окситоцин), кортикостероиды, натрий-
уретический гормон и предсердный натрийуретический фактор. В связи с этим обязательным условием развития хронической артериальной гипертензий становится смещение кривой зависимости выделительной функции почки от величины систолического артериального давления в сторону более высоких ее значений. Этот феномен получил название «переключения почки» (Гайтон А., 1980), которое сопровождается сокращением приносящих артериол, торможением работы противоточно-множительной системы почек, усилением реабсорбции воды в дистальных канальцах.
В зависимости от активности прессорных систем почек говорят о вазоконстрикторной гипертензии при высокой активности ренина в плазме крови (наклонность к спазмам артериол резко выражена) или о гиперволемической гипертензии при низкой активности ренина (увеличение массы циркулирующей крови). Уровень артериального давления определяется активностью не только прессорных, но и депрессорных систем, в том числе кининовой и простагландиновой систем почек, принимающих участие в экскреции натрия и воды.
Роль наследственных факторов в патогенезе гипертонической болезни подтверждена результатами ряда экспериментальных исследований. Показано, например, что экскреторные и инкреторные функции почек, регулирующие уровень артериального давления, могут быть детерминированы генетически. В эксперименте получены линии животных со «спонтанной» артериальной гипертонией, в основе которой лежат дефекты экскреторной и других функций почек. Убедительна в этом отношении и «мембранная теория» первичной гипертензии (Постнов Ю.В., Орлов С.Н., 1987), согласно которой первичным звеном в генезе эссенциальной гипертензии является генетический дефект клеточных мембран в отношении регуляции распределения внутриклеточного кальция, что ведет к изменению сократительных свойств гладких мышц сосудов, усилению выделения медиаторов нервными окончаниями, повышению активности периферического отдела симпатической нервной системы и в финале к сокращению артериол, результатом которого становится артериальная гипертензия и включение почечного фактора («переключение почки»). Естественно, что наследственная патология клеточных мембран не снимает роли стрессовых ситуаций, психоэмоционального напряжения в развитии гипертонической болезни. Мембранная патология клеток может быть лишь фоном, на котором благоприятно действуют другие факторы (схема XIX). Важно подчеркнуть тот факт, что почечный фактор нередко замыкает «порочный круг» патогенеза гипертонической болезни, так как развивающийся артериолосклероз и следующая за ним ишемия почек включают ренин-ангиотензин-альдостероновую систему.
Патологическая анатомия. Морфологические изменения при гипертонической болезни отличаются большим разнообразием, отражающим характер и длительность ее течения.
Характер течения болезни может быть злокачественным (злокачественная гипертензия) и доброкачественным (доброкачественная гипертензия).
Схема XIX. Патогенез гипертонической болезни (по Ю.В. Постнову и С.Н. Орлову в модификации)
 При злокачественной гипертензии доминируют
проявления гипертонического криза, т.е. резкого повышения артериального
давления в связи со спазмом артериол. Морфологические проявления
гипертонического криза достаточно характерны и представлены гофрированностью и деструкцией базальной мембраны эндотелия и своеобразным расположением его в виде частокола, что является выражением спазма артериолы (рис. 151), плазматическим пропитыванием или фибриноидным некрозом ее стенки (рис. 152) и присоединяющимся тромбозом. В
связи с этим развиваются инфаркты, кровоизлияния. В настоящее время
злокачественная гипертония встречается редко, преобладает
доброкачественно и медленно текущая гипертоническая болезнь.
При злокачественной гипертензии доминируют
проявления гипертонического криза, т.е. резкого повышения артериального
давления в связи со спазмом артериол. Морфологические проявления
гипертонического криза достаточно характерны и представлены гофрированностью и деструкцией базальной мембраны эндотелия и своеобразным расположением его в виде частокола, что является выражением спазма артериолы (рис. 151), плазматическим пропитыванием или фибриноидным некрозом ее стенки (рис. 152) и присоединяющимся тромбозом. В
связи с этим развиваются инфаркты, кровоизлияния. В настоящее время
злокачественная гипертония встречается редко, преобладает
доброкачественно и медленно текущая гипертоническая болезнь.
При доброкачественной гипертензии, учитывая длительность развития болезни, различают три стадии, имеющие определенные морфологические различия: 1) доклиническую; 2) распространенных изменений артерий; 3) изменений органов в связи с изменением артерий и нарушением внутриорганного кровообращения. Однако следует учитывать, что в любой стадии доброкачественной гипертензии может возникнуть гипертонический криз с характерными для него морфологическими проявлениями.
1. О доклинической стадии гипертонической болезни говорят в тех случаях, когда появляются эпизоды временного повышения артериаль-
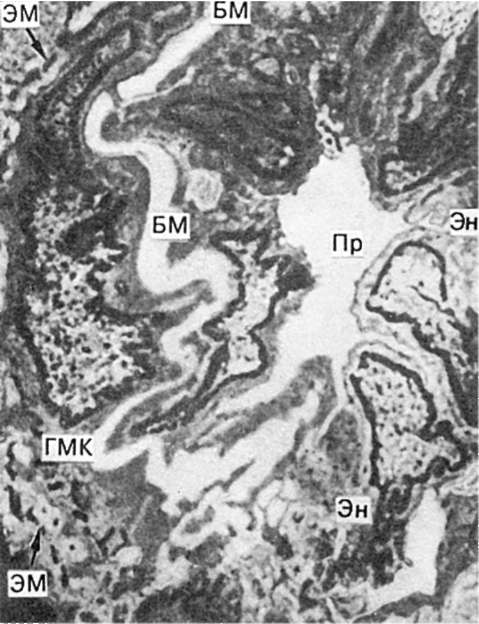 Рис. 151. Спазм артериолы при гипертонической болезни.
Рис. 151. Спазм артериолы при гипертонической болезни.
Просвет сосуда (Пр) сужен, эндотелиальные клетки (Эн) плотно прижаты друг к другу, межэндотелиальные пространства не выявляются; базальная мембрана (БМ) гофрирована и расщеплена, внутренняя эластическая мембрана (ЭМ) фрагментирована. ГМК - гладкомышечная клетка. Электронограмма. х16 000 (по Спиро и др.)
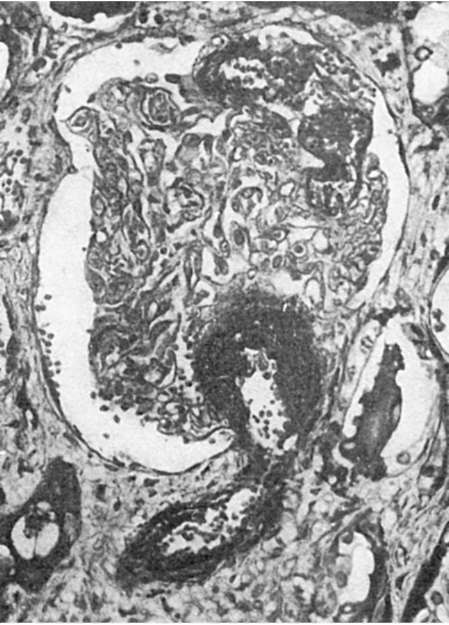 Рис. 152. Фибриноидный некроз стенки приводящей артериолы и капиллярных петель клубочка почки (участки некроза черные)
Рис. 152. Фибриноидный некроз стенки приводящей артериолы и капиллярных петель клубочка почки (участки некроза черные)
ного давления (транзиторная гипертензия). В этой стадии находят гипертрофию мышечного слоя и эластических структур артериол и мелких артерий, морфологические признаки спазма артериол или более глубокие их изменения в случаях гипертонического криза. Отмечается умеренная компенсаторная гипертрофия левого желудочка сердца.
2. Стадия распространенных изменений артерий характеризует период стойкого повышения артериального давления. В артериолах, артериях эластического, мышечно-эластического и мышечного типов, а также в сердце возникают характерные изменения. Изменения артериол - наиболее типичный признак гипертонической болезни - выражаются в плазматическом пропитывании и его исходе - гиалинозе, или артериолосклерозе. Плазматическое пропитывание артериол и мелких артерий развивается в связи с гипоксическим повреждением эндотелия, его мембраны, мышечных клеток и волокнистых структур стенки, к которому ведет спазм сосуда. Элементы деструкции стенки, как и пропитывающие
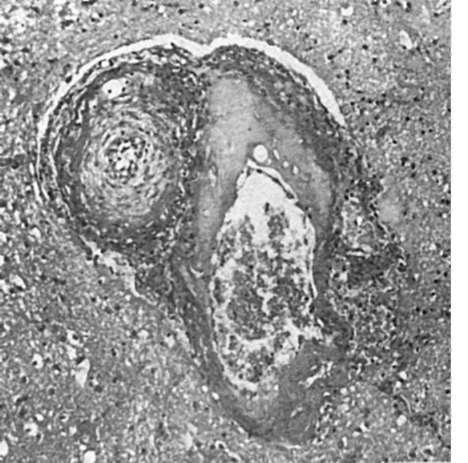 Рис. 153. Гиалиноз артериол головного мозга
Рис. 153. Гиалиноз артериол головного мозга
ее белки и липиды, резорбируются с помощью, макрофагов, однако эта резорбция, как правило, неполная. Развивается гиалиноз артериол, или артериолосклероз (рис. 153). Аналогичные изменения появляются в мелких артериях мышечного типа. Наиболее часто плазматическому пропитыванию и гиалинозу подвергаются артериолы и мелкие артерии почек, головного мозга, поджелудочной железы, кишечника, сетчатки глаза, капсулы надпочечников.
Во время гипертонического криза плазматическое пропитывание артериол, артериолонекроз и геморрагии доминируют в каком-либо одном органе, что определяет клиническую специфику «криза (артериолонекроз почек, ведущий к острой почечной недостаточности, плазматическое пропитывание артериол и диапедезные кровоизлияния в дне IV желудочка, что ведет к внезапной смерти, и т.д.).
Изменения артерий эластического, мышечно-эластического и мышечного типов представлены эластофиброзом и атеросклерозом. Эластофиброз характеризуется гиперплазией и расщеплением внутренней эластической мембраны, развивающимися компенсаторно в ответ на стойкое повышение артериального давления, и разрастанием между расщепившимися мембранами соединительной ткани, т.е. склерозом. При стойкой и длительной артериальной гипертонии развивается выраженный атеросклероз, который отличается некоторым своеобразием: атеросклеротические изменения имеют более распространенный характер, «спускаясь» в артерии мышечного типа, чего не наблюдается при отсутствии гипертонии; при гипертонии фиброзные бляшки располагаются циркулярно, а не сегментарно, что ведет к более резкому сужению просвета сосуда. Эластофиброз и стенозирующий атеросклероз резко выражены в артериях сердца, мозга, почек, поджелудочной железы, в сонных и позвоночных артериях.
В этой стадии степень гипертрофии миокарда нарастает, масса сердца достигает 900-1000 г, а толщина стенки левого желудочка - 2-3 см (рис. 154). В связи со стенозирующим атеросклерозом венечных артерий возникает гипоксия миокарда, которая ведет к развитию дистрофических и некробиотических изменений мышечных волокон и миогенному расширению полостей гипертрофированного сердца (эксцентрическая гипертрофия миокарда), а также к изменениям интрамуральной нервной системы сердца.
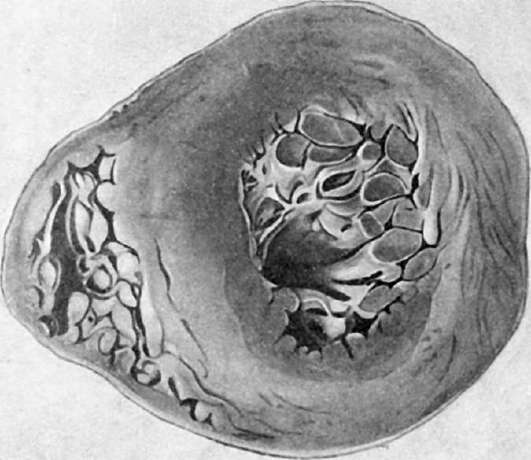 Рис. 154. Гипертрофия миокарда левого желудочка сердца при гипертонической болезни (поперечный разрез)
Рис. 154. Гипертрофия миокарда левого желудочка сердца при гипертонической болезни (поперечный разрез)
В условиях кислородного голодания и усиливающихся нарушений трофики миокарда вследствие патологии интрамуральной нервной системы сердца развивается диффузный мелкоочаговый кардиосклероз (гипертонический кардиосклероз; рис. 155).
3. Последнюю стадию гипертонической болезни характеризуют вторичные изменения органов в связи с изменением артерий и нарушением внутриорганного кровообращения. Эти вторичные изменения могут появляться
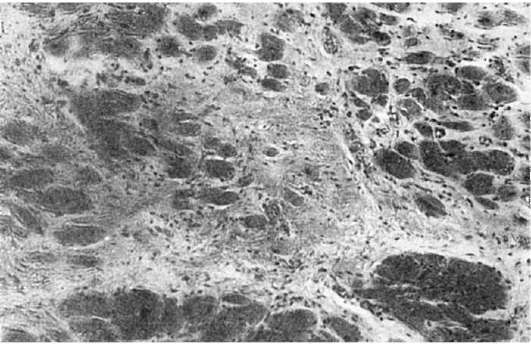 Рис. 155. Кардиосклероз при гипертонической болезни
Рис. 155. Кардиосклероз при гипертонической болезни
катастрофически быстро на почве спазма, тромбоза сосуда, завершающего плазматическое пропитывание или фибриноидный некроз его стенки. Тогда они проявляются кровоизлияниями или инфарктами. Вторичные изменения органов могут развиваться и медленно на почве артериоло- и атеросклеротической окклюзии сосудов, что ведет к атрофии паренхимы и склерозу органов.
Клинико-морфологические формы
На основании преобладания сосудистых, геморрагических, некротических и склеротических изменений в сердце, мозге, почках при гипертонической болезни выделяют сердечную, мозговую и почечную клиникоморфологические ее формы.
Сердечная форма гипертонической болезни, как и сердечная форма атеросклероза, составляет сущность ишемической болезни сердца (см. Ишемическая болезнь сердца).
Мозговая форма гипертонической болезни в настоящее время стала основой цереброваскулярных заболеваний (см. Цереброваскулярные заболевания).
Почечная форма гипертонической болезни характеризуется как острыми, так и хроническими изменениями.
К острым изменениям относятся инфаркты почек и артериолонекроз почек. Инфаркты почек появляются при тромбоэмболии или тромбозе артерий. Иногда они бывают субтотальными или тотальными. Артериолонекроз почек - морфологическое выражение злокачественной гипертонии. Помимо артериол, фибриноидному некрозу подвергаются капиллярные петли клубочков (см. рис. 152), в строме возникают отек и геморрагии, в эпителии канальцев - белковая дистрофия. В ответ на некроз в артериолах, клубочках и строме развиваются клеточная реакция и склероз (злокачественный нефросклероз Фара). Почки выглядят несколько уменьшенными в размерах, пестрыми, поверхность их мелкогранулярная. Артериолонекроз приводит к острой почечной недостаточности и заканчивается обычно летально при отсутствии возможности проведения гемодиализа.
Изменения почек при хроническом доброкачественном течении гипертонической болезни связаны с гиалинозом артериол, артериолосклерозом. Гиалиноз артериол сопровождается коллапсом капиллярных петель и склерозом клубочков - гломерулосклерозом. В результате недостаточного кровоснабжения и гипоксии канальцевая часть большинства нефронов атрофируется и замещается соединительной тканью, которая разрастается также вокруг погибших клубочков. На поверхности почек появляются множественные мелкие очаги западения. Нефроны, соответствующие относительно сохранным клубочкам, гипертрофируются (регенерационная гипертрофия почек) и выступают над почечной поверхностью в виде серо-красных гранул. Почки выглядят маленькими, плотными, поверхность их мелкогранулярная, паренхима атрофична, особенно истончено
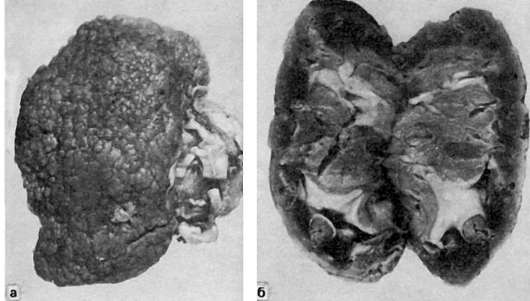 Рис. 156. Первично-сморщенная почка. Вид с поверхности (а) и на разрезе (б)
Рис. 156. Первично-сморщенная почка. Вид с поверхности (а) и на разрезе (б)
корковое вещество. Такие почки, являющиеся исходом их склероза на почве гиалиноза артериол (артериолосклеротический нефросклероз), называют первично-сморщенными (рис. 156). Клиническое выражение артериолосклеротического нефросклероза - хроническая почечная недостаточность, завершающаяся азотемической уремией.
Изменения глаз при гипертонической болезни вторичные, связанные с характерными изменениями сосудов. Они представлены отеком соска зрительного нерва, кровоизлияниями, отслойкой сетчатки, белковым выпотом и отложением в ней белковых масс, некрозом сетчатки и тяжелыми дистрофическими изменениями нервных клеток ганглиозного слоя. Изменения эндокринных желез: в надпочечниках происходит гиперплазия мозгового и коркового слоев с образованием в последнем регенераторных аденом. В дальнейшем эти изменения сменяются атрофическими. В передней доле гипофиза отмечается гиперплазия базофильных клеток, как и клеток задней доли, выделяющих вазопрессорные вещества. В других органах нередко возникают изменения, служащие проявлением гипертонических кризов или следствием хронической гипоксии.
Ишемическая болезнь сердца
Ишемическая болезнь сердца - группа заболеваний, обусловленных абсолютной или относительной недостаточностью коронарного кровообращения. Поэтому ишемическая болезнь - это коронарная болезнь сердца. Она выделена как «самостоятельное заболевание» Всемирной организацией здравоохранения в 1965 г. в связи с большой социальной значимостью. Ишемическая болезнь в настоящее время настолько широко рас-
пространена во всем мире, особенно в экономически развитых странах, что говорят об ее эпидемии. Опасность ишемической болезни сердца заключается в скоропостижной смерти. На долю ее приходится примерно 2/3 случаев смерти от сердечно-сосудистых заболеваний. Болеют чаще мужчины в возрасте 40-65 лет.
Этиология и патогенез. Среди непосредственных причин развития ишемической болезни сердца следует назвать длительный спазм, тромбоз или тромбоэмболию венечных артерий сердца и функциональное перенапряжение миокарда в условиях атеросклеротической окклюзии этих артерий. Однако это - лишь местные причины развития ишемии и некроза сердечной мышцы и его последствий. Ими, естественно, не исчерпывается этиология ишемической болезни сердца, генетически связанной с атеросклерозом и гипертонической болезнью. Этиологические факторы атеросклероза и гипертонической болезни, прежде всего психоэмоциональное перенапряжение, ведущее к ангионевротическим нарушениям, являются этиологическими факторами ишемической болезни сердца. Поэтому-то атеросклероз, гипертоническая болезнь и ишемическая болезнь сердца «идут рядом». Лишь в редких случаях при ишемической болезни сердца отсутствует атеросклероз венечных артерий сердца.
Патогенетические факторы ишемической болезни, атеросклероза и гипертонической болезни также общие. Среди них главные: 1) гиперлипидемия; 2) артериальная гипертензия; 3) избыточная масса тела (ожирение); 4) малоподвижный образ жизни; 5) курение; 6) нарушение толерантности к углеводам, в частности сахарный диабет; 7) мочекислый диатез; 8) генетическая предрасположенность; 9) принадлежность к мужскому полу.
Патогенетические факторы ишемической болезни расцениваются эпидемиологами как факторы риска, т.е. показатели вероятности развития инфаркта миокарда - главного проявления ишемической болезни сердца - в определенный промежуток времени (обычно 10 лет) у определенной группы населения (обычно 1000 мужчин). Так, «предсказательная» ценность гиперлипидемии составляет 21%, а суммы таких факторов, как гиперлипидемия, артериальная гипертензия, курение и избыточная масса тела, - 44%, т.е. почти у половины обследованных лиц с 4 факторами риска в течение 10 лет развивается ишемическая болезнь сердца.
Гиперлипидемия как патогенетический фактор ишемической болезни сердца имеет значение не только для развития коронарного атеросклероза - морфологической основы болезни, но и для образования тромбов, так как тромбозу венечных артерий, как правило, предшествует волна липидоза, связанная с атеросклеротическим кризом. Понятным становится значение при ишемической болезни сердца сахарного диабета, сопровождающегося гиперлипидемией.
Артериальная гипертензия в генезе инфаркта миокарда играет важную и неоднозначную роль. Она утяжеляет течение атеросклероза, в том числе и венечных артерий сердца, ведет к функциональному отягощению
миокарда, способствует развитию плазморрагических, геморрагических и тромбоэмболических изменений.
Избыточная масса тела и малоподвижный образ жизни создают общие и местные предпосылки обменного, а курение - вазомоторного характера, способствующие развитию ишемии миокарда и ее последствий.
Классификация. Следует помнить, что генетически ишемическая болезнь сердца связана с атеросклерозом и гипертонической болезнью. По существу это сердечная форма атеросклероза и гипертонической болезни, проявляющаяся ишемической дистрофией миокарда, инфарктом миокарда, кардиосклерозом.
Ишемическая болезнь сердца течет волнообразно, сопровождаясь коронарными кризами, т.е. эпизодами острой (абсолютной) коронарной недостаточности, возникающими на фоне хронической (относительной недостаточности коронарного кровообращения). В связи с этим различают острую и хроническую формы ишемической болезни сердца. Острая ишемическая болезнь сердца морфологически проявляется ишемической дистрофией миокарда и инфарктом миокарда, хроническая ишемическая болезнь сердца - кардиосклерозом (диффузным мелкоочаговым и постинфарктным крупноочаговым), осложняющимся в ряде случаев хронической аневризмой сердца.
Ишемическая дистрофия миокарда
Ишемическая дистрофия миокарда, или острая очаговая дистрофия миокарда, развивается при относительно кратковременных эпизодах коронарного криза, когда возникают характерные изменения электрокардиограммы, но ферментемия (повышение активности трансаминаз, лактатдегидрогеназы и др.) отсутствует, что является одним их доказательств отсутствия некроза миокарда.
Миокард дряблый и бледный, в участках ишемии иногда пестрый и отечный. В коронарной артерии нередко обнаруживается свежий тромб.
Макроскопическая диагностика очагов ишемической дистрофии возможна с помощью солей тетразолия, теллурита калия. В участках ишемии, где активность окислительно-восстановительных ферментов резко ослаблена, зерна формазана и восстановленный теллур не выпадают, поэтому участки ишемии выглядят светлыми на темном фоне неизмененного миокарда.
Микроскопически находят паретическое расширение капилляров, стаз эритроцитов, отек интерстициальной ткани. Возможно присоединение к этим изменениям кровоизлияний и лейкодиапедеза, скоплений лейкоцитов по периферии зоны ишемии. Мышечные волокна теряют исчерченность, лишены гликогена, они интенсивно окрашиваются эозином, фуксином, пиронином и реактивом Шиффа, что свидетельствует о некробиотических изменениях. Окрашенные акридиновым оранжевым они дают в люминесцентном микроскопе не оранжевое, а зеленое свечение, что позволяет отличить зону ишемии от интактного миокарда.
Ранние электронно-микроскопические и гистохимические изменения сводятся к уменьшению числа гранул гликогена, снижению активности окислительно-восстановительных ферментов (особенно дегидрогеназ и диафораз), набуханию и деструкции митохондрий и саркоплазматической сети (рис. 157). Эти изменения, связанные с нарушением тканевого дыхания, усилением анаэробного гликолиза и разобщением дыхания и окислительного фосфорилирования, появляются уже через несколько минут от начала ишемии. Важная роль в первичных ишемических изменениях ультраструктур миокарда принадлежит освобождению катехоламинов и ионным сдвигам (потеря магния, калия и фосфора, накопление натрия, кальция и воды), которые определяют гидропически-деструктивные изменения ультраструктур в поздние сроки ишемии миокарда.
Осложнением ишемической дистрофии миокарда чаще всего является острая сердечная недостаточность, она же становится и непосредственной причиной смерти. Видимо, поэтому клиницисты обычно обозначают эту форму ишемической болезни сердца как «острая сердечная недостаточность».
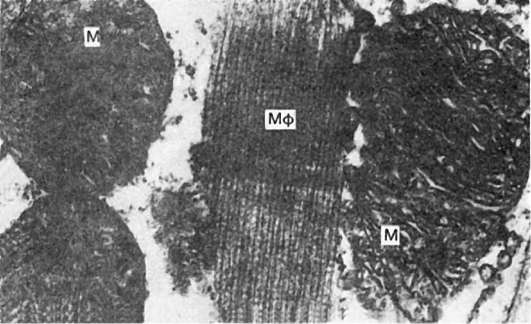 Рис. 157. Ишемическая дистрофия миокарда.
Рис. 157. Ишемическая дистрофия миокарда.
Исчезновение гранул гликогена, набухание и гомогенизация митохондрия (М), фрагментация их крист. Отек саркоплазмы. Мф - миофибриллы. х21 000
Инфаркт миокарда
Инфаркт миокарда - это ишемический некроз сердечной мышцы, поэтому клинически, помимо изменений электрокардиограммы, для него характерна ферментемия. Как правило, это ишемический (белый) инфаркт с геморрагическим венчиком (рис. 158, см. на цветн. вкл.).
Классификация и патологическая анатомия. Инфаркт миокарда принято классифицировать по ряду признаков: 1) по времени его возникнове-
ния; 2) по локализации в различных отделах сердца и сердечной мышцы; 3) по распространенности; 4) по течению.
Инфаркт миокарда - понятие временное. Он занимает примерно 8 нед с момента приступа ишемии миокарда - первичный (острый) инфаркт миокарда.
Если инфаркт миокарда развивается спустя 8 нед после первичного (острого), то его называют повторным инфарктом. Инфаркт, развившийся в течение 8 нед существования первичного (острого), называют рецидивирующим инфарктом миокарда.
Инфаркт миокарда локализуется чаще всего в области верхушки, передней и боковой стенок левого желудочка и передних отделов межжелудочковой перегородки, т.е. в бассейне передней межжелудочковой ветви левой венечной артерии, которая функционально более отягощена и сильнее других ветвей поражается атеросклерозом. Реже инфаркт возникает в области задней стенки левого желудочка и задних отделов межжелудочковой перегородки, т.е. в бассейне огибающей ветви левой венечной артерии. Когда атеросклеротической окклюзии подвергаются основной ствол левой венечной артерии и обе его ветви, развивается обширный инфаркт миокарда. В правом желудочке и особенно в предсердиях инфаркт развивается редко.
Топография и размеры инфаркта определяются не только степенью поражения определенных ветвей венечных артерий, но и типом кровоснабжения сердца (левый, правый и средний типы). Поскольку атеросклеротические изменения обычно интенсивнее выражены в более развитой и функционально отягощенной артерии, инфаркт миокарда чаще наблюдается при крайних типах кровоснабжения - левом или правом. Эти особенности кровоснабжения сердца позволяют понять, дочему, например, при тромбозе нисходящей ветви левой венечной артерии в разных случаях инфаркт имеет различную локализацию (передняя или задняя стенка левого желудочка, передний или задний отдел межжелудочковой перегородки).
Размеры инфаркта определяются степенью стенозирующего атеросклероза венечных артерий (рис. 159), возможностью коллатерального кровообращения и уровнем закрытия (тромбоз, эмболия) артериального ствола; они зависят также от функционального состояния (отягощения) миокарда.
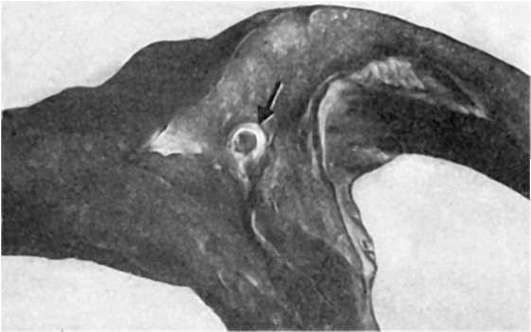 Рис. 159. Стенозирующий атеросклероз венечной артерии (показан стрелкой) при ишемической болезни сердца
Рис. 159. Стенозирующий атеросклероз венечной артерии (показан стрелкой) при ишемической болезни сердца
При гипертонической болезни, сопровождающейся гипертрофией мышцы сердца, инфаркты имеют более распространенный характер. Они выходят далеко за пределы бассейна артерии, которая обтурирована тромбом.
Инфаркт миокарда может захватывать различные отделы сердечной мышцы: субэндокардиальные - субэндокардиальный инфаркт, субэпикардиальные - субэпикардиальный инфаркт, его среднюю часть - интрамуральный инфаркт или всю толщу сердечной мышцы - трансмуральный инфаркт. При вовлечении в некротический процесс эндокарда (субэндокардиальный и трансмуральный инфаркты) в ткани его развивается реактивное воспаление, на эндотелии появляются тромботические наложения. При субэпикардиальном и трансмуральном инфарктах нередко наблюдается реактивное воспаление наружной оболочки сердца - фибринозный перикардит.
Руководствуясь распространенностью некротических изменений в сердечной мышце, различают мелкоочаговый, крупноочаговый и трансмуральный инфаркт миокарда.
В своем течении инфаркт миокарда проходит две стадии - некротическую и стадию рубцевания. В некротической стадии при гистологическом исследовании область инфаркта представляет собой некротизированную ткань, в которой периваскулярно сохраняются «островки» неизмененного миокарда. Область некроза отграничена от сохранившегося миокарда зоной полнокровия и лейкоцитарной инфильтрации (демаркационное воспаление) (рис. 160). Эту стадию характеризуют не только некротические изменения в очаге инфаркта, но и глубокие дисциркуляторные и обменные нарушения вне этого очага. Они характеризуются фокусами неравномерного кровенаполнения, кровоизлияниями, исчезновением из кардиомиоцитов гликогена, появлением в них липидов, деструкцией митохондрий и саркоплазматической сети, некрозом единичных мышечных клеток. Сосудистые нарушения появляются и за пределами сердца, например в головном мозге, где можно обнаружить неравномерное полнокровие, стазы в капиллярах и диапедезные кровоизлияния.
Стадия рубцевания (организации) инфаркта начинается по существу тогда, когда на смену лейкоцитам приходят макрофаги и молодые клетки фибробластиче-
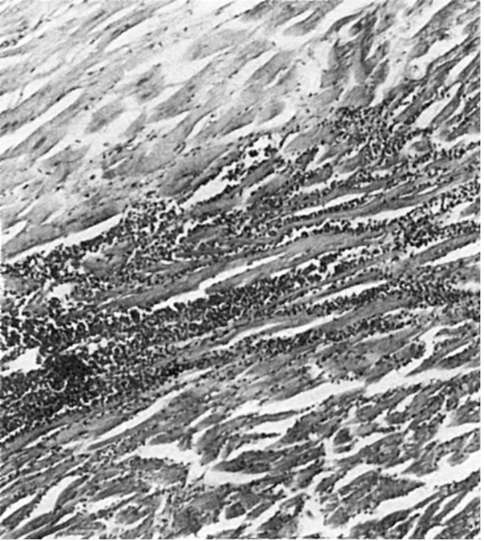 Рис. 160. Инфаркт миокарда. Участок некроза (вверху) отграничен от сохранившегося миокарда (внизу) зоной демаркационного воспаления
Рис. 160. Инфаркт миокарда. Участок некроза (вверху) отграничен от сохранившегося миокарда (внизу) зоной демаркационного воспаления
ского ряда. Макрофаги принимают участие в резорбции некротических масс, в их цитоплазме появляются липиды, продукты тканевого детрита. Фибробласты, обладая высокой ферментативной активностью, участвуют в фибриллогенезе. Организация инфаркта происходит как из зоны демаркации, так и из «островков» сохранившейся ткани в зоне некроза. Этот процесс продолжается 7-8 нед, однако эти сроки подвержены колебаниям в зависимости от размеров инфаркта и реактивности организма больного. Новообразованная соединительная ткань вначале рыхлая, типа грануляционной, затем созревает в грубоволокнистую рубцовую, в которой вокруг сохранившихся сосудов видны островки гипертрофированных мышечных волокон. В полости перикарда в исходе фибринозного перикардита появляются спайки. В них нередко образуются сосуды, анастомозирующие с внесердечными коллатералями, что способствует улучшению кровоснабжения миокарда. Таким образом, при организации инфаркта на его месте образуется плотный рубец. В таких случаях говорят о постинфарктном крупноочаговом кардиосклерозе. Сохранившийся миокард, особенно по периферии рубца, подвергается регенерационной гипертрофии.
Осложнениями инфаркта являются кардиогенный шок, фибрилляция желудочков, асистолия, острая сердечная недостаточность, миомаляция, острая аневризма и разрыв сердца, пристеночный тромбоз, перикардит. Миомаляция, или расплавление некротизированного миокарда, возникает в случаях преобладания процессов аутолиза мертвой ткани. Миомаляция ведет к разрыву сердца (рис. 161) и кровоизлиянию в полость сердечной сорочки (гемоперикард и тампонада его полости) (рис. 162).
Острая аневризма сердца, т.е. выбухание некротизированной стенки его (рис. 158, см. на цветн. вкл.), образуется при обширных инфарктах. Полость аневризмы обычно тромбируется, в ее стенке появляются надрывы эндокарда, кровь проникает в эти надрывы, отслаивает эндокард и разрушает некротизированный миокард. Возникают разрыв сердца и гемоперикард.
Пристеночные тромбы образуются при субэндокардиальном и трансмуральном инфарктах, с ними
связана опасность тромбоэмболи-
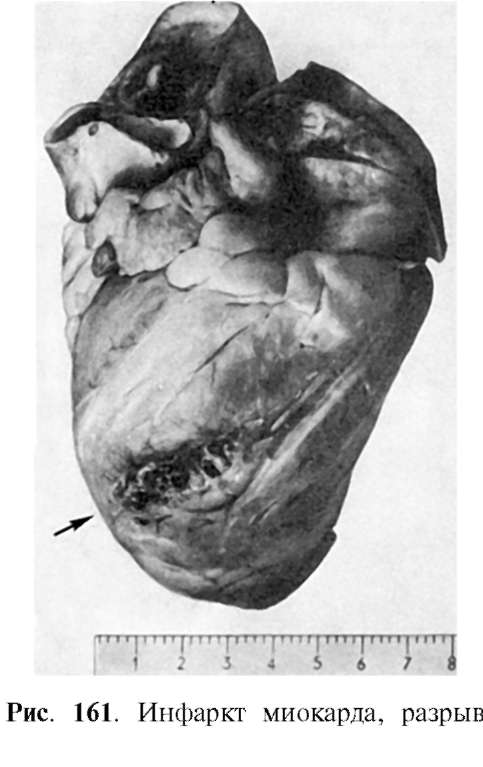
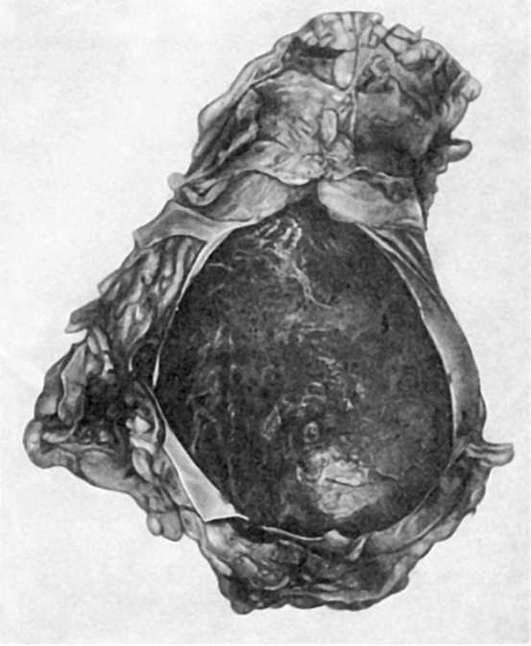 Рис. 162. Тампонада полости перикарда при разрыве сердца на почве инфаркта. Полость сердечной сорочки заполнена кровью
Рис. 162. Тампонада полости перикарда при разрыве сердца на почве инфаркта. Полость сердечной сорочки заполнена кровью
ческих осложнений. Перикардит, обычно фибринозный, нередко находят при субэпикардиальном и трансмуральном инфарктах.
Смерть при инфаркте миокарда может быть связана как с самим инфарктом миокарда, так и с его осложнениями. Непосредственной причиной смерти в ранний период инфаркта становятся фибрилляция желудочков, асистолия, кардиогенный шок, острая сердечная недостаточность. Смертельными осложениями инфаркта миокарда в более поздний период являются разрыв сердца или его острой аневризмы с кровоизлиянием в полость перикарда, а также тромбоэмболии (например, сосудов головного мозга) из полостей сердца, когда источником тромбоэмболии становятся тромбы на эндокарде в области инфаркта, в острой аневризме, в ушках сердца.
Кардиосклероз
Кардиосклероз как проявление хронической ишемической болезни может быть атеросклеротическим диффузным мелкоочаговым либо постинфарктным крупноочаговым, на основе которого образуется хроническая аневризма сердца (постинфарктные изменения).
Хроническая аневризма сердца (рис. 163) образуется обычно в исходе трансмурального обширного инфаркта, когда рубцовая соединительная ткань, заместившая инфаркт, становится стенкой сердца. Она истончается и под давлением крови выбухает - образуется аневризматический мешок, заполненный слоистыми тромботическими массами. С хронической
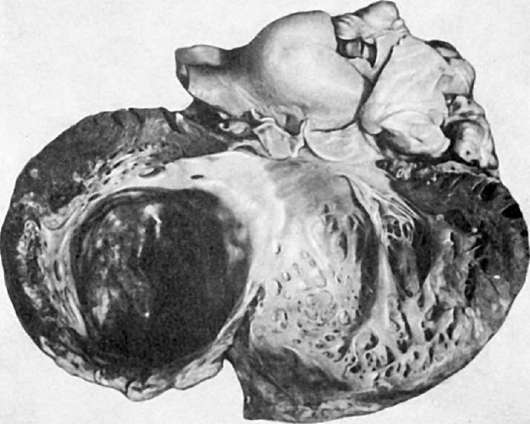 Рис. 163. Хроническая аневризма сердца
Рис. 163. Хроническая аневризма сердца
аневризмой связаны развитие хронической сердечной недостаточности (в сердце постоянно находится «остаточная» кровь), тромбоэмболических осложнений и разрыва стенки аневризмы с тампонадой полости перикарда. Эти осложнения являются и более частыми причинами смерти при хронической ишемической болезни сердца. Следует, однако, помнить, что больному с хронической ишемической болезнью сердца постоянно грозит опасность развития повторного инфаркта со всеми возможными в таких случаях осложнениями.
Цереброваскулярные заболевания
Цереброваскулярные заболевания характеризуются острыми нарушениями мозгового кровообращения, фоном для развития которых являются атеросклероз и гипертоническая болезнь. По своему существу - это церебральные проявления атеросклероза и гипертонической болезни, реже - симптоматических гипертензий.
Как самостоятельная группа болезней цереброваскулярные заболевания выделены, как и ишемическая болезнь сердца, в связи с социальной их значимостью. Эти заболевания в экономически развитых странах по заболеваемости и летальности «догнали» ишемическую болезнь сердца.
Этиология и патогенез. Все, что было сказано об этиологии и патогенезе ишемической болезни сердца, приложимо к цереброваскулярным заболеваниям. Среди непосредственных причин острых нарушений мозгового кровообращения основное место занимают спазм, тромбоз и
тромбоэмболия церебральных и прецеребральных (сонных и позвоночных) артерий. Огромное значение имеет психоэмоциональное перенапряжение, ведущее к ангионевротическим нарушениям.
Классификация. Среди острых нарушений мозгового кровообращения, лежащих в основе цереброваскулярных заболеваний, выделяют транзиторную ишемию головного мозга и инсульт. Инсультом (от лат. in-sultare - скакать) называют остро (внезапно) развивающееся локальное расстройство мозгового кровообращения, сопровождающееся повреждением вещества мозга и нарушениями его функции. Различают: 1) геморрагический инсульт, представленный гематомой или геморрагическим пропитыванием вещества мозга; к нему причисляют и субарахноидальное кровоизлияние; 2) ишемический инсульт, морфологическим выражением которого является инфаркт (ишемический, геморрагический, смешанный).
Патологическая анатомия. Морфология транзиторной ишемии головного мозга представлена сосудистыми расстройствами (спазм артериол, плазматическое пропитывание их стенок, периваскулярный отек и единичные мелкие геморрагии) и очаговыми изменениями мозговой ткани (отек, дистрофические изменения групп клеток). Эти изменения обратимы; на месте бывших мелких геморрагий могут определяться периваскулярные отложения гемосидерина. При образовании гематомы мозга, которая встречается в 85% при геморрагическом инсульте, находят выраженную альтерацию стенок артериол и мелких артерий с образованием микроаневризм и разрывом их стенок. В месте кровоизлияния ткань мозга разрушается, образуется полость, заполненная свертками крови и размягченной тканью мозга (красное размягчение мозга). Кровоизлияние локализуется чаще всего в подкорковых узлах головного мозга (зрительный бугор, внутренняя капсула) и мозжечке. Размеры его бывают разными: иногда оно охватывает всю массу подкорковых узлов, кровь прорывается в боковые, III и IV желудочки мозга, просачивается в область его основания (рис. 164). Инсульты с прорывом в желудочки мозга всегда заканчиваются смертью. Если больной переживает инсульт, то по периферии кровоизлияния в ткани мозга появляется много сидерофагов, зернистых шаров, клеток глии и свертки крови рассасываются. На месте гематомы образуется киста с ржавыми стенками и буроватым содержимым. У больных, длительно страдавших мозговой формой гипертонической болезни и умерших от инсульта, наряду со свежими кровоизлияниями нередко находят кисты как следствие бывших ранее геморрагии.
При геморрагическом пропитывании вещества мозга как разновидности геморрагического инсульта обнаруживают мелкие сливающиеся очаги кровоизлияний. Среди пропитанного кровью мозгового вещества определяются нервные клетки с некробиотическими изменениями. Кровоизлияния типа геморрагического пропитывания встречаются обычно в зрительных буграх и мосту мозга (варолиев мост) и, как правило, не возникают в коре мозга и мозжечке.
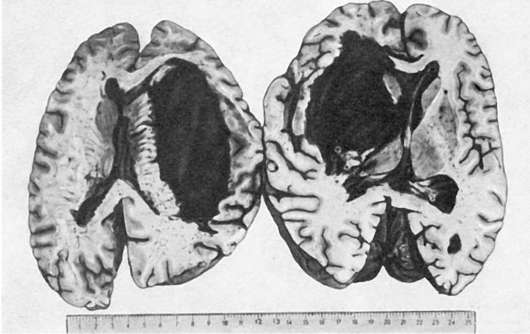 Рис. 164. Кровоизлияние в головной мозг с прорывом в боковые желудочки (геморрагический инсульт)
Рис. 164. Кровоизлияние в головной мозг с прорывом в боковые желудочки (геморрагический инсульт)
Ишемический инфаркт мозга, образующийся при тромбозе атеросклеротически измененных прецеребральных или церебральных артерий, имеет разнообразную локализацию. Это - самое частое (75% случаев) проявление ишемического инсульта. Выглядит ишемический инфаркт как очаг серого размягчения мозга. При микроскопическом исследовании среды некротических масс можно обнаружить погибшие нейроны.
Теморрагический инфаркт мозга внешне напоминает очаг геморрагического пропитывания, но механизм его развития другой: первично развивается ишемия мозговой ткани, вторично - кровоизлияния в ишемизированную ткань. Чаще геморрагический инфаркт встречается в коре мозга, реже - в подкорковых узлах.
При смешанном инфаркте, который всегда возникает в сером веществе мозга, можно найти участки как ишемического, так и геморрагического инфаркта. На месте инфарктов мозга, как и гематомы, образуются кисты, причем стенка кисты на месте геморрагического инфаркта содержит скопление гемосидерина («ржавая киста»).
Осложнения инсультов (кровоизлияний и инфарктов мозга), как и их последствий (кисты мозга), - параличи. Мозговые инсульты - частая причина смерти больных атеросклерозом и гипертонической болезнью.
Кардиомиопатии
Кардиомиопатии (от греч. kardia - сердце, myos - мышца, pathos - болезнь) - группа заболеваний, характеризующихся первичными дис-
трофическими изменениями миокарда. Эта группа включает различные заболевания некоронарного (некоронарогенные кардиомиопатии) и неревматического (неревматогенные кардиомиопатии) происхождения, разные по этиологии и патогенезу, но сходные клинически. Основное клиническое проявление кардиомиопатии - недостаточность сократительной функции миокарда в связи с его дистрофией.
Классификация. Кардиомиопатии делят на первичные (идиопатические) и вторичные.
Среди первичных (идиопатических) кардиомиопатий различают: 1) гипертрофическую (констриктивную); 2) дилатационную (конгестивную); 3) рестриктивную (эндомиокардиальный фиброз). Вторичные кардиомиопатии встречаются при: 1) интоксикациях (алкоголь, этиленгликоль, соли тяжелых металлов, уремия и др.); 2) инфекциях (вирусные инфекции, тифы, трипаносомоз - болезнь Шагаса, трихинеллез и др.); 3) болезнях обмена наследственного (тезаурисмозы - кардиопатический амилоидоз, гликогеноз) и приобретенного (подагра, тиреотоксикоз, гиперпаратиреоз, первичный амилоидоз, авитаминоз, нарушения электролитно-стероидного обмена) характера; 4) болезнях органов пищеварения (синдром нарушенного всасывания, панкреатит, цирроз печени и др.).
Первичные (идиопатические) кардиомиопатии
1. Гипертрофическая (констриктивная) кардиомиопатия имеет наследственный характер. Среди морфогенетических гипотез обсуждаются следующие: 1) повышенная сократимость, возможно обусловленная увеличением чувствительности к катехоламинам, приводит к повреждению кардиомиоцитов, фиброзу и гипертрофии сократительного миокарда; 2) повышенная сократимость миокарда в эмбриональном периоде (пренатальная фаза) ведет к развитию гиперплазии кардиомиоцитов в определенных отделах миокарда, преимущественно в межжелудочковой перегородке. Гиперплазия кардиомиоцитов сменяется в постнатальной фазе прогрессирующей гипертрофией миокарда; 3) первичная патология коллагена с нарушением фиброзного скелета миокарда ведет к дезорганизации миофибрилл.
Гипертрофическая кардиомиопатия может проявляться в виде двух форм: диффузной (идиопатическая гипертрофия миокарда) или локальной (идиопатический гипертрофический субаортальный стеноз). При первой форме отмечается диффузное утолщение миокарда левого желудочка и межжелудочковой перегородки, правые отделы сердца гипертрофируются редко, размер полостей сердца нормальный или уменьшенный. При микроскопическом исследовании находят хаотичное расположение кардиомиоцитов, особенно в межжелудочковой перегородке. При второй, локальной, форме гипертрофия миокарда охватывает в основном верхние отделы левого желудочка, что ведет к субаортальному сужению (субаортальный мышечный стеноз). При диффузной и локальной формах клапанный аппарат сердца и венечные артерии интактны.
2. Дилатационную (конгестивную) кардиомиопатию связывают с вирусным миокардитом (особенно вирусом Коксаки). Высказываются предположения о значении в развитии этого вида кардиомиопатии сочетанного действия вируса и алкоголя.
Для дилатационной кардиомиопатии характерно резкое расширение полостей сердца, мышца которого может быть в той или иной степени гипертрофирована. Сердце приобретает шаровидную форму, масса его увеличивается, особенно за счет левого желудочка. Миокард дряблый, тусклый, пронизан белесоватыми прослойками, характерно чередование гипертрофированных и атрофичных кардиомиоцитов. Клапанный аппарат и венечные артерии сердца не изменены. В полостях сердца нередко возникают тромбы.
3. Рестриктивную кардиомиопатию некоторые авторы рассматривают как исход париетального эндокардита Леффлера (см.), хотя это мнение не имеет достаточных оснований. При этом виде первичной кардиомиопатии находят диффузный или очаговый фиброз эндокарда левого, реже правого желудочка; иногда в процесс вовлекается задняя створка митрального клапана. Часто встречаются пристеночные тромбы с последующей их организацией. Утолщение эндокарда, иногда резко выраженное (до 3-5 см), ведет к уменьшению (облитерации) полости желудочка.
Вторичные кардиомиопатии
Морфологические проявления вторичных кардиомиопатии достаточно полиморфны в связи с разнообразием вызывающих их причин. Но в основе вторичных кардиомиопатии независимо от этиологических факторов лежит дистрофия кардиомиоцитов. Алкогольная кардиомиопатия имеет наибольшее значение среди вторичных кардиомиопатии.
Патогенез алкогольной кардиомиопатии связан в первую очередь с биологическими свойствами этанола - его прямым токсическим действием на кардиомиоциты, а также влиянием метаболита этанола - ацетальдегида. Безусловно значение также сосудистых нарушений и связанной с ними гипоксии, повреждающего действия на миокард катехоламинов.
Морфологические изменения сердца сводятся к умеренной гипертрофии миокарда, расширению полостей сердца с пристеночными тромбами. Миокард дряблый, глинистого вида, иногда с небольшими рубчиками. Коронарные артерии интактны, возможны липидные пятна и полоски в интиме, выраженные атеросклеротические изменения отсутствуют. При микроскопическом исследовании отмечается сочетание дистрофии (гидропической и жировой), атрофии и гипертрофии кардиомиоцитов, встречаются очажки лизиса кардиомиоцитов и склероза. Поврежденные участки миокарда чередуются с неизмененными. При электронномикроскопическом исследовании биоптатов сердца находят кистозное расширение саркоплазматической сети и Т-системы кардиомиоцитов, что считается характерным для алкогольной кардиомиопатии.
Осложнения алкогольной кардиомиопатии - внезапная смерть (фибрилляция желудочков) или хроническая сердечная недостаточность, тромбоэмболический синдром.
Осложнения кардиомиопатии выражаются обычно хронической сердечно-сосудистой недостаточностью или тромбоэмболическим синдромом в связи с наличием тромбов в полостях сердца.
Васкулиты
Васкулиты - заболевания, характеризующиеся воспалением и нередко присоединяющимся некрозом сосудистой стенки. Они могут иметь местньпй или системный характер. Местные васкулиты обычно развиваются в очагах воспаления вследствие перехода процесса на сосудистую стенку с окружающих тканей (например, гнойно-некротический васкулит при флегмоне). Для системных васкулитов, которые могут быть основой самостоятельных болезней (первичные васкулиты) или проявлением какого-либо другого заболевания (вторичные васкулиты), характерно распространенное поражение сосудов.
Системные васкулиты
Среди васкулитов в патологии человека системные васкулиты имеют основное значение. Критериями морфологической оценки их являются: 1) тип воспалительной реакции, определяющий характер васкулита; 2) глубина поражения сосудистой стенки; 3) топография и распространенность изменений в сосудистой системе; 4) характер органной патологии в связи с поражением сосудов.
В зависимости от типа воспалительной реакции, преобладания альтеративно-экссудативных или продуктивных изменений васкулиты делят на некротические (деструктивные), деструктивно-продуктивные, продуктивные, выделяя среди них отдельно гранулематозные. Руководствуясь глубиной поражения сосудистой стенки, т.е. вовлечением в воспалительный процесс внутренней, средней или наружной ее оболочки, различают эндоваскулит, мезоваскулит и периваскулит, а при сочетанном поражении оболочек - эндомезоваскулит и панваскулит. Подавляющее большинство системных васкулитов характеризуется поражением всех оболочек сосудистой стенки с исходом в склероз и кальциноз, что ведет в одних случаях к резкому стенозу просвета, вплоть до облитерации его, в других - к развитию аневризмы.
Топография и распространенность изменений в сосудистой системе при системных васкулитах самые разнообразные - в процесс могут вовлекаться сосуды всех калибров и типов: аорта (аортит), артерии (артериит), артериолы (артериолит), капилляры (капиллярит), вены (флебит), лимфатические сосуды (лимфангит). Однако при разных видах васкулитов поражаются преимущественно сосуды определенного калибра: аорта и ее крупные ветви, крупные, средние и мелкие артерии (эластически-
мышечного и мышечного типа), мелкие артерии и сосуды микроциркуляторного русла, вены.
Изменения в органах и тканях в связи с развитием васкулита носят вторичный характер и представлены инфарктами, постинфарктным крупноочаговым и ишемическим мелкоочаговым склерозом, атрофией паренхиматозных элементов, гангреной, кровоизлияниями. Помимо местных, могут наблюдаться общие изменения, связанные с васкулитом питающего тот или иной орган сосуда. Так, при вовлечении в процесс почечных артерий развивается ренальная гипертензия, сосудов легких - гипертония малого круга и симптом легочно-сердечной недостаточности, сосудов кожи - геморрагический диатез.
Этиология и патогенез. Этиология подавляющего большинства первичных системных васкулитов неизвестна. Патогенез системных васкулитов (как первичных, так и вторичных) связан с иммунными реакциями гиперчувствительности, возникающими на различные антигены. В зависимости от преобладания того или иного механизма гиперчувствительности системные васкулиты делят на три группы: 1) васкулиты гиперчувствительности немедленного типа; 2) васкулиты гиперчувствительности замедленного типа; 3) васкулиты гиперчувствительности смешанного типа. При ведущей роли гиперчувствительности немедленного типа (иммунокомплексное повреждение сосудистой стенки) преобладают альтеративные (фибриноидные изменения, вплоть до некроза) и экссудативные (инфильтрация стенки полиморфно-ядерными лейкоцитами, макрофагами) процессы, развиваются деструктивные (некротические) васкулиты, чаще некротические артерииты (узелковый периартериит, синдром Вегенера, аллергический гранулематоз, васкулиты при ревматических заболеваниях, «ангииты повышенной гиперчувствительности»). При преобладании гиперчувствительности замедленного типа основное значение приобретают клеточные реакции в виде лимфогистиоцитарных инфильтратов и образование гранулем. Возникают продуктивные васкулиты, в том числе гранулематозные артерииты (болезнь Такасу, болезнь Хортона). Васкулиты, обусловленные гиперчувствительностью немедленного типа и характеризующиеся деструктивным характером изменений, обычно протекают остро, а васкулиты, обусловленные гиперчувствительностью замедленного и смешанного типа, имеющие характер продуктивных, гранулематозных, - подостро и хронически.
Классификация системных васкулитов учитывает следующие критерии (Серов В.В., Коган А.Е., 1982): этиологию, патогенез, нозологическую принадлежность, преимущественный характер и распространенность воспалительной реакции, морфологический тип пораженных сосудов, преимущественную локализацию, обусловливающую заинтересованность определенных органов (органная патология), клиническую картину заболевания. При этом следует придерживаться нозологического принципа, на основании которого васкулиты разделены на первичные и вторичные.
Классификация системных васкулитов (по Серову В.В. и Коган Е.А., 1982) А. Первичные васкулиты.
I. С преимущественным поражением аорты и ее крупных ветвей и гигантоклеточной гранулематозной реакцией: неспецифический аортоартериит (болезнь Такаясу), височный артериит (болезнь Хортона).
II. С преимущественным поражением артерий среднего и мелкого калибра и деструктивно-продуктивной реакцией: 1) узелковый периартериит; 2) аллергический гранулематоз; 3) системный некротизирующий васкулит; 4) гранулематоз Вегенера; 5) лимфатический синдром с поражением кожи и слизистых оболочек.
III. С преимущественным поражением артерий мелкого калибра, сосудов микроциркуляторного русла и вен: облитерирующий тромбангит (болезнь Бюргера).
IV. С поражением артерий различных калибров - смешанная (неклассифицируемая) форма.
Б. Вторичные васкулиты.
V. При инфекционных заболеваниях: 1) сифилитические; 2) туберкулезные; 3) риккетсиозные, в том числе сыпнотифозные; 4) септические; 5) прочие.
VI. При системных заболеваниях соединительной ткани: 1) ревматические; 2) ревматоидные; 3) волчаночные.
VII. Васкулиты «гиперчувствительности» при: 1) сывороточной болезни; 2) пурпуре Шенлейна-Геноха; 3) эссенциальной смешанной криоглобулинемии; 4) злокачественных новообразованиях.
Среди первичных системных васкулитов наибольшее значение имеют неспецифический аортоартериит, узелковый периартериит, гранулематоз Вегенера и облитерирующий тромбангит. Вторичные системные васкулиты описаны в главах, посвященных инфекционным и ревматическим заболеваниям.
Неспецифический аортоартериит
В основе неспецифического аортоартериита (болезнь Такаясу) лежит воспаление артерий эластического типа - аорты и проксимальных отделов отходящих от нее ветвей, ствола легочной артерии.
Этиология и патогенез. Этиология не выяснена, однако отмечается связь с различными инфекционными заболеваниями (риккетсиозы, ревматизм). Играют также роль профессиональные вредности (интоксикация пестицидами, соединениями свинца, сварочными аэрозолями). Патогенез связывают с иммунологическими механизмами.
Патологическая анатомия. Наиболее часто поражение локализуется в области дуги аорты и брахиоцефальных артерий (74%), реже - в брюшном (42%) и грудном (18%) отделах аорты, в области бифуркации (18%) и в восходящей части дуги (9%). В процесс могут вовлекаться любые ветви аорты, в том числе венечные артерии сердца. При генерализации процесса воспалительные изменения обнаруживаются и в стенках артерий более
мелкого калибра. Сосуды имеют характерный вид: их стенки утолщены, ригидны, представлены белесоватой тканью. Интима может иметь утолщения, суживающие просвет, в котором обнаруживаются пристеночные или обтурирующие тромбы (рис. 165). В адвентиции и периваскулярной ткани выражены явления склероза, встречаются аневризматические выпячивания стенки. Поражение может быть сегментарным или диффузным. В зависимости от макроскопической картины различают стенозирующий, аневризматический и деформирующий варианты неспецифического аортоартериита.
Микроскопически обнаруживают поражение всех слоев сосудистой стенки - панартериит с гигантоклеточной реакцией. Прослеживается смена фаз воспалительной реакции, завершающейся склерозированием сосудистой стенки, что позволяет говорить о стадиях неспецифического аортоаортита. Ранняя (острая) стадия характеризуется деструкцией внутренней эластической мембраны и инфильтрацией всех слоев стенки лимфоидными и плазматическими клетками, гигантские клетки ред-
 Рис. 165. Неспецифический аортоартериит:
Рис. 165. Неспецифический аортоартериит:
а - аорта; резкое утолщение стенки и окклюзия просвета; б - сужение нисходящей части грудной аорты, стеноз чревной и обеих почечных артерий, окклюзия верхней брыжеечной артерии (аортограмма, препарат А.В. Покровского)
ки. Интима утолщена за счет пролиферации эндотелия и пристеночных тромбов. Наибольшие изменения отмечаются в медии и адвентиции. В поздней (подострой) стадии описанные изменения сменяются продуктивной реакцией с формированием гранулем из макрофагов, эпителиоидных, гигантских и плазматических клеток, лимфоцитов. В финальной (склеротической) стадии развивается склероз стенки сосуда, в которой видны остатки внутренней эластической мембраны. Обнаруживаются организация тромботических масс, васкуляризация средней оболочки и стеноз просвета, вплоть до полной облитерации.
Узелковый периартериит
Узелковый периартериит (синонимы: классический узелковый периартериит, болезнь Куссмауля-Мейера) - ревматическое заболевание, характеризующееся системным поражением соединительной ткани артерий преимущественно среднего и мелкого калибров.
Этиология и патогенез. Этиология заболевания неизвестна. В патогенезе ведущую роль играет иммунокомплексный механизм поражения сосудистой стенки, завершающийся фибриноидным некрозом.
Патологическая анатомия. Среди артерий малого и среднего калибров наиболее часто поражаются почечные (90-100%), венечные артерии сердца (88-90%), брыжеечные (57-60%), печеночные и артерии головного мозга (46%). Реже находят артерииты поперечнополосатой мускулатуры, желудка, поджелудочной железы, надпочечников, периферических нервов. Иногда в процесс вовлекаются артерии крупного калибра (сонные, подключичные, подвздошные, бедренные).
В основе болезни лежит васкулит, причем воспаление в стенке артерии складывается из последовательной смены альтеративных изменений (сегментарный или циркулярный фибриноидный некроз средней оболочки) экссудативной и пролиферативной клеточной реакциями в наружной оболочке. Завершается воспаление склерозом с образованием узелковых утолщений стенки артерий (узелковый периартериит, рис. 166). В зависимости от фазы процесса, которую застает морфолог, при узелковом периартериите различают деструктивный, деструктивно-продуктивный и продуктивный васкулиты.
Течение узелкового периартериита может быть острым, подострым
и хроническим волнообразным,
 что определяет различный характер органных изменений. При остром и подостром течении во внутренних органах появляются фокусы ишемии, инфаркты, кровоизлияния; при хроническом волнообразном течении - склеротические изменения в сочетании с дистрофически-некротическими и геморрагическими, что ведет к функциональной недостаточности тех или иных органов и систем. В почках часто развивается подострый (экстракапиллярный продуктивный) или хронический (мезангиальный) гломерулонефрит, ведущий к нефросклерозу и нарастающей почечной недостаточности.
что определяет различный характер органных изменений. При остром и подостром течении во внутренних органах появляются фокусы ишемии, инфаркты, кровоизлияния; при хроническом волнообразном течении - склеротические изменения в сочетании с дистрофически-некротическими и геморрагическими, что ведет к функциональной недостаточности тех или иных органов и систем. В почках часто развивается подострый (экстракапиллярный продуктивный) или хронический (мезангиальный) гломерулонефрит, ведущий к нефросклерозу и нарастающей почечной недостаточности.
Гранулематоз Вегенера
Гранулематоз Вегенера - системный некротизирующий васкулит с гранулематозом и преимущественным поражением артерий и вен среднего и мелкого калибра, а также сосудов микроциркуляторного русла дыхательных путей, легких и почек.
Этиология и патогенез. Развитие заболевания связывают с гипотетическим антигеном, природа которого пока не установлена. Высказываются предположения о значении микробных и вирусных агентов, а также лекарственных препаратов, обладающих антигенными и гаптенными свойствами. Роль провоцирующих факторов могут играть переохлаждение, инсоляция, вакцинация, часто предшествующие началу заболевания. Патогенез тесно связан с иммунологическими механизмами, причем имеются доказательства в пользу иммунокомплексной природы поражения сосудов.
Патологическая анатомия. Морфологическую основу заболевания составляют:
1) системный некротизирующий васкулит с гранулематозной реакцией;
2) некротизирующий гранулематоз преимущественно верхних дыхательных путей с последующим вовлечением в процесс трахеи, бронхов и ткани легкого;
3) гломерулонефрит.
Сосудистые изменения при гранулематозе Вегенера складываются из трех фаз: альтеративной (некротической), экссудативной и продуктивной с выраженной гранулематозной реакцией. В исходе возникают склероз и гиалиноз сосудов с развитием хронических аневризм или стеноза, вплоть до полной облитерации просвета. В артериях среднего калибра (мышечного типа) чаще обнаруживается эндартериит, а в артериях мелкого калибра - панартериит. С большим постоянством поражаются сосуды микроциркуляторного русла, развиваются деструктивные и деструктивнопродуктивные артериолиты, капилляриты и венулиты. Поражение именно этих сосудов лежит в основе формирования гранулем, которые сливаются, образуя поля гранулематозной ткани, подвергающейся некрозу.
Некротизирующий гранулематоз вначале обнаруживается в области верхних дыхательных путей, что сопровождается картиной назофарингита, седловидной деформацией носа, гайморита, фронтита, этмоидита, ангины, стоматита, ларингита, отита. Патогномоничным является гной-
ное воспаление с образованием язв и кровотечениями. В ряде случаев эти симптомы служат единственным проявлением заболевания - локализованной формы гранулематоза Вегенера. При прогрессировании развивается генерализованная форма, при которой некротизирующий гранулематоз обнаруживается в трахее, бронхах, ткани легкого, где развиваются язвенно-некротические процессы, фокусы бронхопневмонии. Помимо дыхательного тракта, гранулемы могут обнаруживаться также в почках, коже, тканях суставов, печени, селезенке, сердце и других органах. В исходе гранулематозного поражения развиваются склероз и деформация органов.
Гломерулонефрит - характерный признак гранулематоза Вегенера. Чаще он представлен мезангиопролиферативной или мезангиокапиллярной формой с фибриноидным некрозом капиллярных петель и артериол клубочков и экстракапиллярной реакцией (образование характерных «полулуний»).
В подавляющем большинстве случаев наблюдается сочетание поражения верхних дыхательных путей, легких и почек.
Облитерирующий тромбангиит
Облитерирующий тромбангиит (болезнь Винивартера-Бюргера) - системный васкулит, при котором поражение преимущественно мелких артерий и вен нижних конечностей ведет к окклюзии этих сосудов.
Этиология и патогенез. Причины заболевания, как и механизм его развития, не установлены. Однако безусловное значение имеет курение. Болеют чаще мужчины в возрасте до 40 лет.
Патологическая анатомия. Преобладает поражение вен нижних конечностей, развивается преимущественно продуктивный эндо-, мезо- и перифлебит, к которому присоединяется тромбоз с обтурацией просвета сосудов. В артериях нижних конечностей, которые поражаются в меньшей степени по сравнению с венами, развиваются аналогичные изменения - продуктивный эндо-, мезо- и периартериит. Сосуды приобретают вид толстых фиброзных тяжей с сегментарным утолщением стенок.
Различают острую, подострую и хроническую стадии болезни. Для острой стадии характерно развитие альтеративно-экссудативного и альтеративно-продуктивного тромбоваскулита. К альтеративным изменениям присоединяется инфильтрация стенки сосуда и периваскулярной ткани полиморфно-ядерными лейкоцитами, что вызывает разрушение внутренней эластической мембраны, а иногда и образование микроабсцессов. В подострой стадии преобладает продуктивная тканевая реакция. В стенке сосудов обнаруживаются лимфогистиоцитарные инфильтраты, признаки избыточной васкуляризации и ранней организации тромбов. Особенно типично формирование гранулем, которые выявляются обычно в средней оболочке и вокруг некротизированных фрагментов внутренней эластической мембраны, а также в тромботических массах. Гранулемы напоминают либо олеогранулемы, либо туберкулезные гранулемы. В хронической стадии доминируют признаки организации тромбов, что
приводит к полной облитерации просвета сосуда. Организация тромбов может сопровождаться их канализацией и петрификацией.
Возможна генерализация тромбангиита с вовлечением в процесс сосудов сердца и головного мозга, что ведет к развитию инфарктов.
Течение заболевания хроническое и волнообразное, в финале нередко осложняется гангреной конечности.
Системные заболевания соединительной ткани (ревматические болезни)
Системные заболевания соединительной ткани принято называть в настоящее время ревматическими болезнями. До недавнего времени их называли коллагеновыми (Клемперер П., 1942), что не отражало их сущности. При ревматических болезнях поражается вся система соединительной ткани и сосудов в связи с нарушением иммунологического гомеостаза (болезни соединительной ткани с иммунными нарушениями). В группу этих болезней входят ревматизм, ревматоидный артрит, болезнь Бехтерева, системная красная волчанка, системная склеродермия, узелковый периартериит, дерматомиозит.
Поражение соединительной ткани при ревматических болезнях проявляется в виде системной прогрессирующей дезорганизации и складывается из 4 фаз: мукоидного набухания, фибриноидных изменений, воспалительных клеточных реакций и склероза. Однако каждое из заболеваний имеет свои клинико-морфологические особенности в связи с преимущественной локализацией изменений в тех или иных органах и тканях. Течение хроническое и волнообразное.
Этиология ревматических болезней изучена недостаточно. Наибольшее значение придают инфекции (вирус), генетическим факторам, определяющим нарушения иммунологического гомеостаза, влиянию ряда физических факторов (охлаждение, инсоляция) и лекарств (лекарственная непереносимость).
В основе патогенеза ревматических заболеваний лежат иммунопатологические реакции - реакции гиперчувствительности как немедленного, так и замедленного типа.
Ревматизм
Ревматизм (болезнь Сокольского-Буйо) - инфекционно-аллергическое заболевание с преимущественным поражением сердца и сосудов, волнообразным течением, периодами обострения (атаки) и затихания (ремиссии). Чередование атак и ремиссий может продолжаться много месяцев и даже лет; иногда ревматизм принимает скрытое течение.
Этиология. В возникновении и развитии заболевания доказана роль β-гемолитического стрептококка группы А, а также сенсибилизации организма стрептококком (рецидивы ангины). Придается значение возрастным и генетическим факторам (ревматизм - полигенно наследуемое заболевание).
Патогенез. При ревматизме возникает сложный и многообразный иммунный ответ (реакции гиперчувствительности немедленного и замедленного типов) на многочисленные антигены стрептококка. Основное значение придается антителам, перекрестно реагирующим с антигенами стрептококка и антигенами тканей сердца, а также клеточным иммунным реакциям. Некоторые ферменты стрептококка оказывают протеолитическое влияние на соединительную ткань и способствуют расщеплению комплексов гликозаминогликанов с белками в основном веществе соединительной ткани. В результате иммунного ответа на компоненты стрептококка и на продукты распада собственных тканей в крови больных появляется широкий спектр антител и иммунных комплексов, создаются предпосылки для развития аутоиммунных процессов. Ревматизм принимает характер непрерывно-рецидивирующего заболевания с чертами аутоагрессии.
Морфогенез. Структурную основу ревматизма составляют системная прогрессирующая дезорганизация соединительной ткани, поражение сосудов, особенно микроциркуляторного русла, и иммунопатологические процессы. В наибольшей степени все эти процессы выражены в соединительной ткани сердца (основное вещество клапанного и пристеночного эндокарда и в меньшей степени листков сердечной сорочки), где можно проследить все фазы ее дезорганизации: мукоидное набухание, фибриноидные изменения, воспалительные клеточные реакции и склероз.
Мукоидное набухание (рис. 30, см. на цв. вкл.) является поверхностной и обратимой фазой дезорганизации соединительной ткани и характеризуется усилением метахроматической реакции на гликозаминогликаны (преимущественно гиалуроновую кислоту), а также гидратацией основного вещества.
Фибриноидные изменения (набухание и некроз) представляют собой фазу глубокой и необратимой дезорганизации: наслаиваясь на мукоидное набухание, они сопровождаются гомогенизацией коллагеновых волокон и пропитыванием их белками плазмы, в том числе фибрином.
Клеточные воспалительные реакции выражаются образованием прежде всего специфической ревматической гранулемы. Формирование гранулемы начинается с момента фибриноидных изменений и характеризуется вначале накоплением в очаге повреждения соединительной ткани макрофагов, которые трансформируются в крупные клетки с гиперхромными ядрами. Далее эти клетки начинают ориентироваться вокруг масс фибриноида. В цитоплазме клеток происходит увеличение содержания РНК и зерен гликогена. В дальнейшем формируется типичная ревматическая гранулема с характерным палисадообразным или веерообразным расположением клеток вокруг центрально расположенных масс фибриноида (рис. 167). Макрофаги принимают активное участие в рассасывании фибриноида, обладают высокой фагоцитарной способностью. Они могут фиксировать иммуноглобулины. Ревматические гранулемы, состоящие из таких крупных макрофагов, называют «цветущими», или зрелыми (см. рис. 167). В
дальнейшем клетки гранулемы начинают вытягиваться, среди них появляются фибробласты, фибриноидных масс становится меньше - формируется «увядающая» гранулема. В итоге фибробласты вытесняют клетки гранулемы, в ней появляются аргирофильные, а затем коллагеновые волокна, фибриноид полностью рассасывается; гранулема приобретает характер рубцующейся. Цикл развития гранулемы составляет 3-4 мес.
На всех фазах развития ревматические гранулемы окружаются лимфоцитами и единичными плазматическими клетками. Вероятно, лимфокины, выделяемые лимфоцитами, активируют фибробласты, что способствует фиброплазии гра- нулемы. Процесс морфогенеза рев-
матического узелка описан Ашоффом (1904) и позднее более детально В.Т. Талалаевым (1921), поэтому ревматический узелок носит название ашофф-талалаевской гранулемы.
Ревматические гранулемы образуются в соединительной ткани как клапанного, так и пристеночного эндокарда, миокарда, эпикарда, адвентиции сосудов. В редуцированном виде они встречаются в перитонзиллярной, периартикулярной и межмышечной соединительной ткани.
Помимо гранулем, при ревматизме наблюдаются неспецифические клеточные реакции, имеющие диффузный или очаговый характер. Они представлены межуточными лимфогистиоцитарными инфильтратами в органах. К неспецифическим тканевым реакциям относят и васкулиты в системе микроциркуляторного русла. Склероз является заключительной фазой дезорганизации соединительной ткани. Он носит системный храктер, но наиболее выражен в оболочках сердца, стенках сосудов и серозных оболочках. Чаще всего склероз при ревматизме развивается в исходе клеточных пролиферации и гранулем (вторичный склероз), в более редких случаях - в исходе фибриноидного изменения соединительной ткани (гиалиноз, «первичный склероз»).
Патологическая анатомия. Наиболее характерные изменения при ревматизме развиваются в сердце и сосудах.
Выраженные дистрофические и воспалительные изменения в сердце развиваются в соединительной ткани всех его слоев, а также в сократительном миокарде. Ими главным образом и определяется клиникоморфологическая картина заболевания.
 Эндокардит - воспаление эндокарда - одно из ярких проявлений ревматизма. По локализации различают эндокардит клапанный, хордальный и пристеночный. Наиболее
выраженные изменения развиваются в створках митрального или аортального
клапанов. Изолированное поражение клапанов правого сердца наблюдается
очень редко и при наличии эндокардита клапанов левого сердца.
Эндокардит - воспаление эндокарда - одно из ярких проявлений ревматизма. По локализации различают эндокардит клапанный, хордальный и пристеночный. Наиболее
выраженные изменения развиваются в створках митрального или аортального
клапанов. Изолированное поражение клапанов правого сердца наблюдается
очень редко и при наличии эндокардита клапанов левого сердца.
При ревматическом эндокардите отмечаются дистрофические и некробиотические изменения эндотелия, мукоидное, фибриноидное набухание и некроз соединительной основы эндокарда, клеточная пролиферация (гранулематоз) в толще эндокарда и тромбообразование на его поверхности. Сочетание этих процессов может быть различным, что позволяет выделить несколько видов эндокардита. Выделяют 4 вида ревматического клапанного эндокардита (Абрикосов А.И., 1947): 1) диффузный, или вальвулит; 2) острый бородавчатый; 3) фибропластический; 4) возвратнобородавчатый.
Диффузный эндокардит, или вальвулит (по В.Т. Талалаеву), характеризуется диффузным поражением створок клапанов, но без изменений эндотелия и тромботических наложений. Острый бородавчатый эндокардит сопровождается повреждением эндотелия и образованием по замыкающему краю створок (в местах повреждения эндотелия) тромботических наложений в виде бородавок (рис. 168). Фибропластический эндокардит развивается как следствие двух предыдущих форм эндокардита при особой склонности процесса к фиброзу и рубцеванию. Возвратно-бородавчатый эндокардит характеризуется повторной дезорганизацией соединительной ткани клапанов, изменением их эндотелия и тромботическими наложениями на фоне склероза и утолщения створок клапанов (рис. 169). В
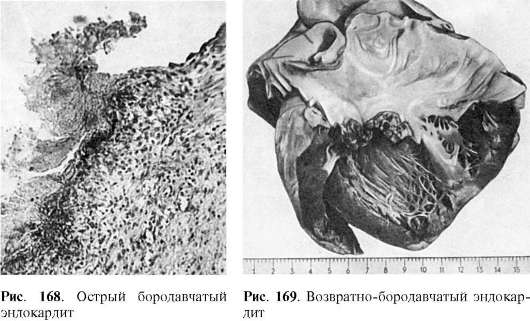 исходе
эндокардита развиваются склероз и гиалиноз эндокарда, что приводит к
его утолщению и деформации створок клапана, т.е. к развитию порока сердца (см. Порок сердца).
исходе
эндокардита развиваются склероз и гиалиноз эндокарда, что приводит к
его утолщению и деформации створок клапана, т.е. к развитию порока сердца (см. Порок сердца).
Миокардит - воспаление миокарда, постоянно наблюдающееся при ревматизме. Выделяют 3 его формы: 1) узелковый продуктивный (гранулематозный); 2) диффузный межуточный экссудативный; 3) очаговый межуточный экссудативный.
Узелковый продуктивный (гранулематозный) миокардит характеризуется образованием в периваскулярной соединительной ткани миокарда ревматических гранулем (специфический ревматический миокардит - см. рис. 167). Гранулемы, распознающиеся только при микроскопическом исследовании, рассеяны по всему миокарду, наибольшее их число встречается в ушке левого предсердия, в межжелудочковой перегородке и задней стенке левого желудочка. Гранулемы находятся в различных фазах развития. «Цветущие («зрелые») гранулемы наблюдаются в период атаки ревматизма, «увядающие» или «рубцующиеся» - в период ремиссии. В исходе узелкового миокардита развивается периваскулярный склероз, который усиливается по мере прогрессирования ревматизма и может приводить к выраженному кардиосклерозу.
Диффузный межуточный экссудативный миокардит, описаннъгй М.А. Скворцовым, характеризуется отеком, полнокровием интерстиция миокарда и значительной инфильтрацией его лимфоцитами, гистиоцитами, нейтрофилами и эозинофилами. Ревматические гранулемы встречаются крайне редко, в связи с чем говорят о неспецифическом диффузном миокардите. Сердце становится очень дряблым, полости его расширяются, сократительная способность миокарда в связи с развивающимися в нем дистрофическими изменениями резко нарушается. Эта форма ревматического миокардита встречается в детском возрасте и довольно быстро может заканчиваться декомпенсацией и гибелью больного. При благоприятном исходе в миокарде развивается диффузный кардиосклероз.
Очаговый межуточный экссудативный миокардит характеризуется незначительной очаговой инфильтрацией миокарда лимфоцитами, гистиоцитами и нейтрофилами. Гранулемы образуются редко. Эта форма миокардита наблюдается при латентном течении ревматизма.
При всех формах миокардита встречаются очаги повреждения и некробиоза мышечных клеток сердца. Такие изменения сократительного миокарда могут быть причиной декомпенсации даже в случаях с минимальной активностью ревматического процесса.
Перикардит имеет характер серозного, серозно-фибринозного или фибринозного и нередко заканчивается образованием спаек. Возможна облитерация полости сердечной сорочки и обызвествление образующейся в ней соединительной ткани (панцирное сердце).
При сочетании эндо- и миокардита говорят о ревматическом кардите, а при сочетании эндо-, мио- и перикардита - о ревматическом панкардите.
Сосуды разного калибра, в особенности микроциркуляторного русла, постоянно вовлекаются в патологический процесс. Возникают ревматические васкулиты - артерииты, артериолиты и капилляриты. В артериях и артериолах возникают фибриноидные изменения стенок, иногда тромбоз. Капилляры окружаются муфтами из пролиферирующих адвентициальных клеток. Наиболее выражена пролиферация эндотелиальных клеток, которые слущиваются. Такая картина ревматического эндотелиоза характерна для активной фазы заболевания. Проницаемость капилляров резко повышается. Васкулиты при ревматизме носят системный характер, т.е. могут наблюдаться во всех органах и тканях (рис. 170). В исходе ревматического васкулита развивается склероз сосудов (артериосклероз, артериолосклероз, капилляросклероз).
Поражение суставов - полиартрит - считается одним из постоянных проявлений ревматизма. В настоящее время оно встречается у 10-15% больных. В полости сустава появляется серозно-фибринозный выпот. Синовиальная оболочка полнокровна, в острой фазе в ней наблюдаются мукоидное набухание, васкулиты, пролиферация синовиоцитов. Суставной хрящ обычно сохраняется. Деформации обычно не развиваются. В околосуставных тканях, по ходу сухожилий соединительная ткань может подвергаться дезорганизации с гранулематозной клеточной реакцией. Возникают крупные узлы, что характерно для нодозной (узловатой) формы ревматизма. Узлы состоят из очага фибриноидного некроза, окруженного валом из крупных клеток макрофагального типа. С течением времени такие узлы рассасываются, и на их месте остаются рубчики.
Поражение нервной системы развивается в связи с ревматическими васкулитами (см. рис. 170) и может выражаться дистрофическими изменениями нервных клеток, очагами деструкции мозговой ткани и кровоизлияниями. Такие изменения могут доминировать в клинической картине, что чаще встречается у детей - церебральная форма ревматизма (малая хорея).
При ревматической атаке наблюдаются воспалительные изменения серозных оболочек (ревматический полисерозит), почек (ревматический очаговый или диффузный гломерулонефрит), легких с поражением сосудов и интерстиция (ревматическая пневмония), скелетных мышц (мышечный
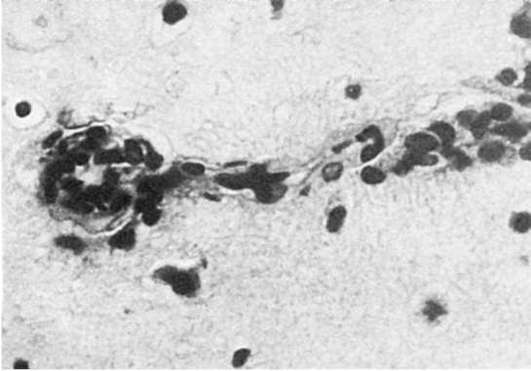 Рис. 170. Капиллярит и артериолит головного мозга при ревматизме
Рис. 170. Капиллярит и артериолит головного мозга при ревматизме
ревматизм), кожи в виде отека, васкулитов, клеточной инфильтрации (нодозная эритема), эндокринных желез, где развиваются дистрофические и атрофические изменения.
В органах иммунной системы находят гиперплазию лимфоидной ткани и плазмоклеточную трансформацию, что отражает состояние напряженного и извращенного (аутоиммунизация) иммунитета при ревматизме.
Клинико-анатомические формы. По преобладанию клинико-морфологических проявлений заболевания выделяются (в известной мере условно) следующие описанные выше формы ревматизма: 1) кардиоваскулярная; 2) полиартритическая; 3) нодозная (узловатая); 4) церебральная.
Осложнения ревматизма чаще связаны с поражением сердца. В исходе эндокардита возникают пороки сердца. Бородавчатый эндокардит может стать источником тромбоэмболии сосудов большого круга кровообращения, в связи с чем возникают инфаркты в почках, селезенке, в сетчатке, очаги размягчения в головном мозге, гангрена конечностей и т.д. Ревматическая дезорганизация соединительной ткани приводит к склерозу, особенно выраженному в сердце. Осложнением ревматизма могут стать спаечные процессы в полостях (облитерация полости плевры, перикарда и т.д.).
Смерть от ревматизма может наступить во время атаки от тромбоэмболических осложнений, но чаще больные умирают от декомпенсированного порока сердца.
Ревматоидный артрит
Ревматоидный артрит (синонимы: инфекционный полиартрит, инфект-артрит) - хроническое ревматическое заболевание, основу которого составляет прогрессирующая дезорганизация соединительной ткани оболочек и хряща суставов, ведущая к их деформации.
Этиология и патогенез. В возникновении заболевания допускается роль бактерий (β-гемолитический стрептококк группы В), вирусов, микоплазмы. Большое значение придается генетическим факторам. Известно, что заболевают ревматоидным артритом преимущественно женщины - носители антигена гистосовместимости HLA/B27 и D/DR4. В генезе тканевых повреждений - как локальных, так и системных - при ревматоидном артрите важная роль принадлежит высокомолекулярным иммунным комплексам. Эти комплексы содержат в качестве антигена IgG, а в качестве антитела - иммуноглобулины различных классов (IgM, IgG, IgA), которые называют ревматоидным фактором.
Ревматоидный фактор продуцируется как в синовиальной оболочке (его находят в синовиальной жидкости, синовиоцитах и в клетках, инфильтрирующих ткани сустава), так и влимфатических узлах (ревматоидный фактор циркулирующих в крови иммунных комплексов). Изменения тканей суставов в значительной мере связаны с синтезируемым местно, в синовиальной оболочке, ревматоидным фактором, относящимся преимущественно к IgG. Он связывается с Fc-фрагментом иммуноглобулинаантигена, что ведет к образованию иммунных комплексов, активирующих
комплемент и хемотаксис нейтрофилов. Эти же комплексы реагируют с моноцитами и макрофагами, активируют синтез простагландинов и интерлейкина I, которые стимулируют выброс клетками синовиальной оболочки коллагеназы, усиливая повреждение тканей.
Иммунные комплексы, содержащие ревматоидный фактор и циркулирующие в крови, осаждаясь на базальных мембранах сосудов, в клетках и тканях, фиксируют активированный комплемент и вызывают воспаление. Оно касается прежде всего сосудов микроциркуляции (васкулит). Помимо гуморальных иммунных реакций, при ревматоидном артрите имеют значение и реакции гиперчувствительности замедленного типа, проявляющиеся наиболее ярко в синовиальной оболочке.
Патологическая анатомия. Изменения возникают в тканях суставов, а также в соединительной ткани других органов.
В суставах процессы дезорганизации соединительной ткани определяются в околосуставной ткани и в капсуле мелких суставов кистей рук и стоп, обычно симметрично захватывая как верхние, так и нижние конечности. Деформация наступает сначала в мелких, а затем в крупнъгх, обычно в коленных, суставах.
В околосуставной соединительной ткани первоначально наблюдаются мукоидное набухание, артериолиты и артерииты. Далее наступает фибриноидный некроз, вокруг очагов фибриноидного некроза появляются клеточные реакции: скопления крупных гистиоцитов, макрофагов, гигантских клеток рассасывания. В итоге на месте дезорганизации соединительной ткани развивается зрелая волокнистая соединительная ткань с толстостенными сосудами. При обострении заболевания те же изменения возникают в очагах склероза. Описанные очаги фибриноидного некроза носят название ревматоидных узлов (рис. 171). Они появляются обычно около крупных суставов в виде плотных образований размером до лесного ореха. Весь цикл их развития от начала возникновения мукоидного набухания до образования рубца занимает 3-5 мес.
В синовиальной оболочке воспаление появляется в самые ранние сроки заболевания. Возникает синовит (рис. 172) - важнейшее морфологическое проявление болезни, в развитии которого выделяют три стадии.
В первой стадии синовита в полости сустава скапливается мутноватая жидкость; синовиальная оболочка набухает, становится полнокровной, тусклой. Суставной хрящ сохранен, хотя в нем могут появляться поля, лишенные клеток, и мелкие трещины. Ворсины отечные, в их строме - участки мукоидного и фибриноидного набухания, вплоть до некроза некоторых ворсин. Такие ворсины отделяются в полость сустава и из них образуются плотные слепки - так называемые рисовые тельца. Сосуды микроциркуляторного русла полнокровны, окружены макрофагами, лимфоцитами, нейтрофилами, плазматическими клетками; местами появляются кровоизлияния. В стенке фибриноидно-измененных артериол обнаруживают иммуноглобулины. В ряде ворсин определяется пролиферация синовиоцитов. В цитоплазме плазматических клеток обнаруживается ревматоидный фактор. В синовиальной жидкости увеличивается содержание
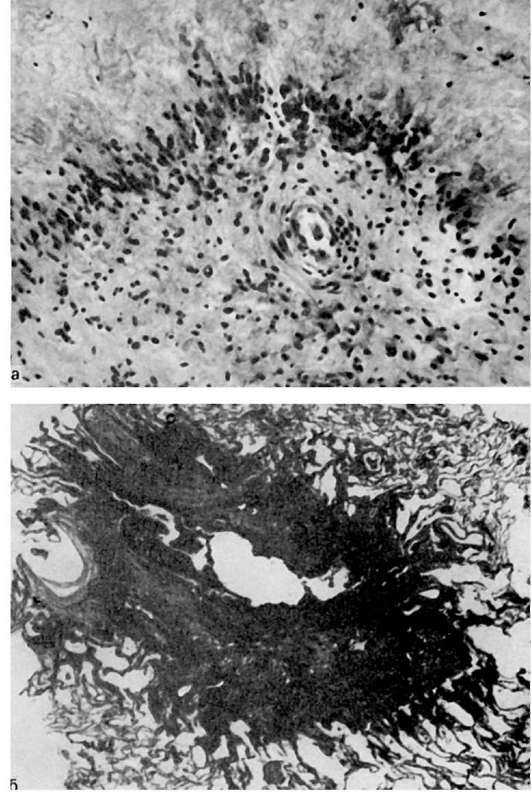 Рис. 171. Ревматоидный узел:
Рис. 171. Ревматоидный узел:
а - фибриноидныи некроз в околосуставной ткани с клеточной реакцией на периферии; б - сформированный ревматоидный узелок в легком с некрозом и распадом в центре
нейтрофилов, причем в цитоплазме некоторых из них также обнаруживается ревматоидный фактор. Такие нейтрофилы названы рагоцитами (от греч. ragos - гроздь винограда). Их образование сопровождается активацией ферментов лизосом, выделяющих медиаторы воспаления и тем самым способствующих его прогрессированию. Первая стадия синовита иногда растягивается на несколько лет.
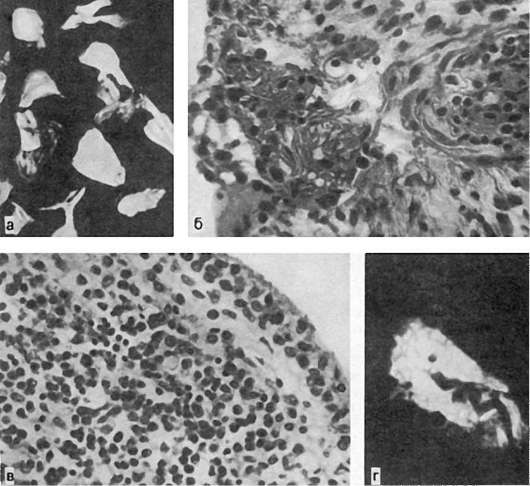 Рис. 172. Синовит при ревматоидном артрите:
Рис. 172. Синовит при ревматоидном артрите:
а - рисовые тельца; б - синовит; в - плазматические клетки инфильтрата; г - фиксация IgG в стенке артериолы
Во второй стадии синовита наблюдается разрастание ворсин и разрушение хряща. По краям суставных концов костей постепенно возникают островки грануляционной ткани, которая в виде пласта - паннуса (от лат. pannus - лоскут) наползает на синовиальную оболочку и на суставной хрящ. Этот процесс особенно ярко выражен в мелких суставах кистей рук и стоп. Межфаланговые и пястно-пальцевые суставы легко подвергаются вывиху или подвывиху с типичным отклонением пальцев в наружную (ульнарную) сторону, что придает кистям вид плавников моржа. Аналогичные изменения наблюдаются в суставах и костях пальцев нижних конечностей. В крупных суставах в этой стадии отмечаются ограничение подвижности, сужение суставной щели и остеопороз эпифизов костей. Наблюдается утолщение капсулы мелких суставов, ее внутренняя поверхность неровная, неравномерно полнокровная, хрящевая поверхность тусклая, в хряще видны узуры, трещины. В крупных суставах отмечается срастание соприкасающихся поверхностей синовиальной оболочки.
При микроскопическом исследовании местами виден фиброз синовиальной оболочки, местами - очаги фибриноида. Часть ворсин сохранена и разрастается, строма их пронизана лимфоцитами и плазматически-
ми клетками. Местами в утолщенных ворсинах формируются очаговые лимфоидные скопления в виде фолликулов с зародышевыми центрами (рис. 173) - синовиальная оболочка становится органом иммуногенеза. В плазматических клетках фолликулов выявляется ревматоидный фактор. Среди ворсин встречаются поля грануляционной ткани, богатой сосудами и состоящей из нейтрофилов, плазматических клеток, лимфоциов и макрофагов. Грануляционная ткань разрушает и замещает ворсинки, нарастает на поверхность хряща и проникает в его толщу через небольшие трещины (рис. 174). Гиалиновый хрящ под влиянием грануляций постепенно истончается, расплавляется; костная поверхность эпифиза обнажается. Стенки сосудов синовиальной оболочки утолщены и гиалинизированы.
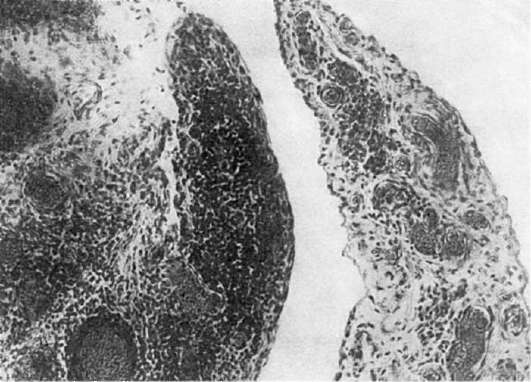 Рис. 173. Синовит при ревматоидном артрите. Образование лимфоидных фолликулов в толще ворсин
Рис. 173. Синовит при ревматоидном артрите. Образование лимфоидных фолликулов в толще ворсин
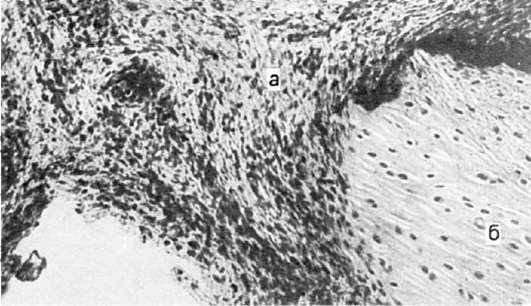 Рис. 174. Ревматоидный артрит. Грануляционная ткань (а) «наползает» на суставной хрящ (б)
Рис. 174. Ревматоидный артрит. Грануляционная ткань (а) «наползает» на суставной хрящ (б)
Третья стадия ревматоидного синовита, которая развивается иногда через 20-30 лет от начала заболевания, характеризуется появлением фиброзно-костного анкилоза. Наличие различных фаз созревания грануляционной ткани в полости сустава (от свежих до Рубцовых) и масс фибриноида свидетельствует о том, что в любой стадии болезни, иногда даже при многолетнем ее течении, процесс сохраняет свою активность и неуклонно прогрессирует, что приводит к тяжелой инвалидизации больного.
Висцеральные проявления ревматоидного артрита обычно выражены незначительно. Они проявляются изменениями соединительной ткани и сосудов микроциркуляторного русла серозных оболочек, сердца, легких, иммунокомпетентной системы и других органов. Довольно часто возникают васкулиты и полисерозит, поражение почек в виде гломерулонефрита, пиелонефрита, амилоидоза. Реже встречаются ревматоидные узлы и участки склероза в миокарде и легких.
Изменения иммунокомпетентной системы характеризуются гиперплазией лимфатических узлов, селезенки, костного мозга; выявляется плазмоклеточная трансформация лимфоидной ткани, причем имеется прямая зависимость между выраженностью гиперплазии плазматических клеток и степенью активности воспалительного процесса.
Осложнения. Осложнениями ревматоидного артрита являются подвывихи и вывихи мелких суставов, ограничение подвижности, фиброзные и костные анкилозы, остеопороз. Самое грозное и частое осложнение - нефропатический амилоидоз.
Смерть больных ревматоидным артритом наступает часто от почечной недостаточности в связи с амилоидозом или от ряда сопутствующих заболеваний - пневмонии, туберкулеза и др.
Болезнь Бехтерева
Болезнь Бехтерева (синонимы: болезнь Штрюмпелля-Бехтерева- Мари, анкилозирующий спондилоартрит, ревматоидный спондилит) - хроническое ревматическое заболевание с поражением преимущественно суставно-связочного аппарата позвоночника, ведущим к его неподвижности; возможно вовлечение в процесс периферических суставов и внутренних органов.
Этиология и патогенез. Определенное значение в развитии болезни придается инфекционно-аллергическому фактору, травме позвоночника и главное - наследственности: болеют чаще мужчины, у которых в 80-100% случаев выявляется антиген гистосовместимости HLA-B27. Предполагают возможность аутоиммунизации, так как антиген гистосовместимости HLA-B27, встречающийся почти постоянно у больных анкилозирующим спондилоартритом, сцеплен с геном слабого иммунного ответа. Этим объясняют возможность неполноценной и извращенной иммунной реакции при воздействии бактериальных и вирусных агентов, что определяет развитие хронического иммунного воспаления в позво-
ночнике с остеопластической трансформацией его тканей. Неполноценным и извращенным иммунным ответом объясняют также развитие хронического воспаления и склероза во внутренних органах.
Патологическая анатомия. При анкилозирующем спондилоартрите возникают деструктивно-воспалительные изменения в тканях мелких суставов позвоночника, которые мало отличаются от изменений при ревматоидном артрите. В результате длительно текущего воспаления разрушаются суставные хрящи, появляются анкилозы мелких суставов. Соединительная ткань, заполняющая полость суставов, подвергается метаплазии в костную, развиваются костные анкилозы суставов, подвижность их ограничивается. Такой же процесс с образованием кости развивается в межпозвоночных дисках, что ведет к полной неподвижности позвоночного столба. Нарушаются функции сердца и легких, иногда развивается легочная гипертензия. Поражаются и внутренние органы: в аорте, сердце, легких наблюдаются хроническое воспаление и очаговый склероз; развивается амилоидоз с преимущественным поражением почек.
Системная красная волчанка
Системная красная волчанка (болезнь Либмана-Сакса) - острое или хроническое системное заболевание соединительной ткани с выраженной аутоиммунизацией и преимущественным поражением кожи, сосудов и почек. Системная красная волчанка (СКВ) - болезнь молодых женщин, составляющих до 90% заболевших. Однако возможно заболевание у детей и пожилых женщин, редко у мужчин.
Этиология. Накопилось достаточно фактов в пользу вирусной этиологии СКВ. В эндотелиальных клетках (рис. 175), лимфоцитах и тромбоцитах крови больных СКВ при электронно-микроскопическом исследо-
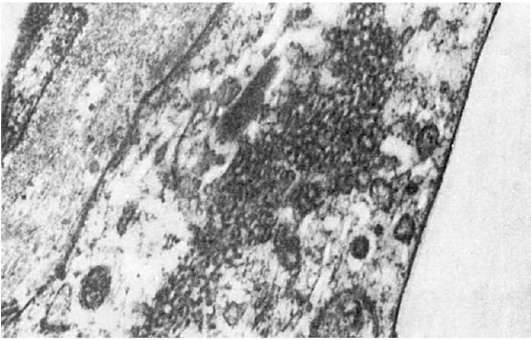 Рис. 175. Системная
красная волчанка. Вирусоподобные включения в эндотелии капилляра
почечного клубочка (электронно-микроскопическое исследование биоптата
почки). х15 000
Рис. 175. Системная
красная волчанка. Вирусоподобные включения в эндотелии капилляра
почечного клубочка (электронно-микроскопическое исследование биоптата
почки). х15 000
вании обнаружены вирусоподобные включения. У больных СКВ и их родственников выявлены лимфоцитотоксические антитела, являющиеся маркерами персистирующей вирусной инфекции, и антитела к двухспиральной (вирусной) РНК. Кроме того, при СКВ находят в высоких титрах циркулирующие антитела к вирусам кори, краснухи, парагриппа и другим РНК-содержащим вирусам из группы парамиксовирусов. Однако не исключают, что вирусная инфекция при СКВ развивается вторично на фоне клеточного иммунодефицита. Большое значение имеет наследственное предрасположение.
Патогенез. Развитие болезни связывают с нарушением регуляции гуморального и клеточного иммунитета, снижением Т-клеточного контроля за счет поражения Т-лимфоцитов вирусом. Клинико-лабораторные и иммуноморфологические исследования показывают, что при СКВ имеет место сенсибилизация организма компонентами клеточных ядер (ДНК). В пусковом механизме иммунных нарушений играют роль не только вирусы, но и инсоляция, наследственные факторы. Гуморальные иммунные реакции связаны с наличием в плазме крови широкого спектра аутоантител к различным компонентам ядра и цитоплазмы (к ДНК, РНК, гистонам, нуклеопротеидам), эритроцитам, лимфоцитам, тромбоцитам, но преимущественно к нативной ДНК. В крови появляется большое количество иммунных комплексов, которые вызывают в тканях воспаление и фибриноидный некроз (проявления гиперчувствительности немедленного типа).
Патогенное действие клеточных иммунных реакций (гиперчувствительности замедленного типа) представлено лимфомакрофагальными инфильтратами, разрушающими тканевые элементы. Под влиянием лечения СКВ принимает более медленное и доброкачественное течение.
Патологическая анатомия. Изменения при СКВ отличаются большим разнообразием. Заболевание носит выраженный генерализованнъгй характер, отсюда необычайный клинический и морфологический его полиморфизм, создающий большие трудности в диагностике. Изменения, которые обнаруживают при вскрытии умершего, не имеют каких-либо характерных признаков. Патолого-анатомический диагноз обычно устанавливается по совокупности морфологических признаков, а также данных клинического обследования. Однако микроскопическая картина позволяет выяснить признаки, характерные для этого заболевания. Наиболее яркие изменения при СКВ развиваются в рыхлой соединительной ткани (подкожной, околосуставной, межмышечной), в стенках сосудов микроциркуляторного русла, в сердце, почках и органах иммунокомпетентной системы.
Разнообразные тканевые и клеточные изменения можно разбить на 5 групп. К первой группе относятся острые некротические и дистрофические изменения соединительной ткани. Наблюдаются все стадии прогрессирующей дезорганизации соединительной ткани, фибриноидные изменения и некроз стенок мелких кровеносных сосудов (рис. 176), осо-
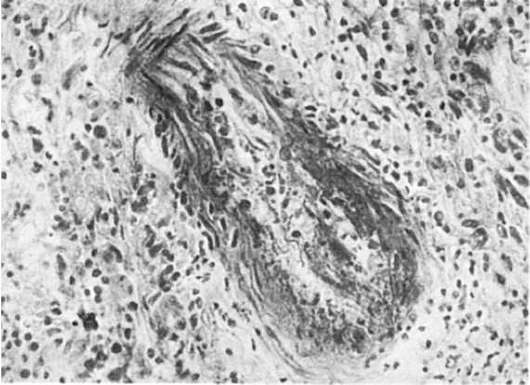 Рис. 176. Фибриноидный некроз мелкой артерии при системной красной волчанке
Рис. 176. Фибриноидный некроз мелкой артерии при системной красной волчанке
бенно микроциркуляторного русла. Фибриноид при СКВ имеет свои особенности: в нем содержится большое количество распавшегося ядерного белка и глыбок хроматина.
Вторая группа тканевых изменений при СКВ представлена подострым межуточным воспалением всех органов, включая нервную систему, с вовлечением в процесс сосудов микроциркуляторного русла (капилляриты, артериолиты, венулиты). Среди клеток воспалительного инфильтрата преобладают лимфоциты, макрофаги, плазматические клетки. Воспалительный процесс разной интенсивности возникает и в серозных оболочках (полисерозит).
Третью группу составляют изменения склеротического характера. Они развиваются в исходе изменений первой и второй групп. Склероз нередко сочетается со свежими проявлениями дезорганизации соединительной ткани и васкулитами, что свидетельствует об обострении заболевания. К характерным признакам СКВ относится периартериальный «луковичный» склероз в селезенке (рис. 177).
Четвертая группа представлена изменениями иммунокомпетентной системы. В костном мозге, лимфатических узлах, селезенке обнаружи-
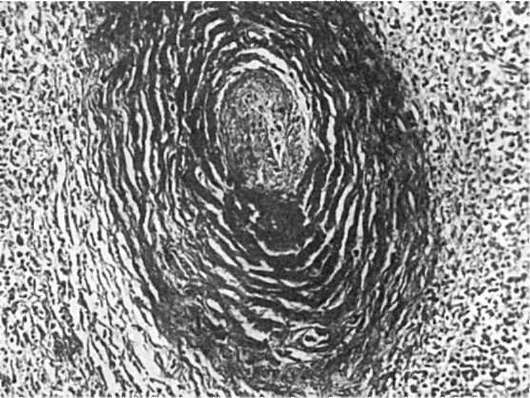 Рис. 177. Периартериальный «луковичный» склероз в селезенке при системной красной волчанке
Рис. 177. Периартериальный «луковичный» склероз в селезенке при системной красной волчанке
ваются очаговые скопления лимфоцитов и плазматических клеток, продуцирующих иммуноглобулины. Встречается гиперплазия вилочковой железы с лимфоидными фолликулами. Отмечается повышенная фагоцитарная активность макрофагов. В селезенке и лимфатических узлах появляются белковые преципитаты, возникающие в результате диспротеиноза.
К пятой группе изменений относится ядерная патология, наблюдаемая в клетках всех органов и тканей, но главным образом в лимфатических узлах. Конфигурация ядер сохраняется, но они постепенно теряют ДНК и при окраске ядерными красителями становятся бледными. При гибели клетки ядро определяется в виде светло окрашенного ядерными красителями тела, в дальнейшем оно распадается на глыбки. Такие ядра называют гематоксилиновыми тельцами, которые считают специфичными для СКВ. В связи с появлением антиядерных антител (волчаночный фактор) наблюдается еще один иммунопатологический феномен, характерный для СКВ. Он состоит в том, что нейтрофилы и макрофаги фагоцитируют клетки с поврежденными ядрами и образуют так называемые волчаночные клетки (рис. 178). Обнаружение их в крови является одним из достоверных признаков СКВ. Эти клетки могут появляться в костном мозге, селезенке, лимфатических узлах, стенке сосудов.
Все пять групп тканевых и клеточных изменений при СКВ обычно обнаруживаются в разных сочетаниях, но выраженность их может быть разной в зависимости от остроты и длительности течения болезни.
Висцеральные проявления системной красной волчанки различны. Сердце при СКВ поражается в 1/3 случаев; изменения могут наблюдаться во всех его слоях - эндокарде, миокарде, перикарде. У части больных развивается абактериальный бородавчатый эндокардит, названный по имени описавших его авторов эндокардитом Либмана и Сакса.
Как уже говорилось, сосуды разного калибра подвергаются значительным изменениям, особенно сосуды микроциркуляторного русла - возникают артериолиты, капилляриты и венулиты. В стенке аорты в связи с поражением ее микрососудов появляются вторичные изменения в виде эластолиза и мелких рубчиков в средней оболочке. В разных органах васкулиты вызывают вторичные изменения - дистрофию паренхиматозных элементов, некроз.
Почки часто поражаются при СКВ. Возникает два варианта гломерулонефрита: один с характерными морфологическими признаками - волчаночный нефрит, другой - без этих признаков, имеющий обычную
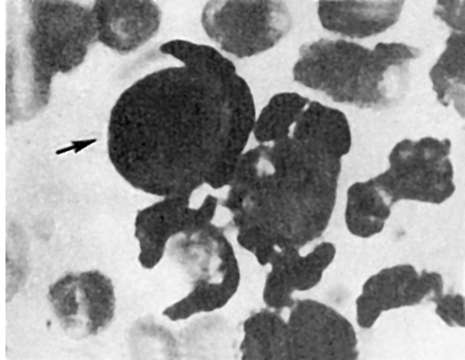 Рис. 178. Волчаночная клетка (показана стрелкой)
Рис. 178. Волчаночная клетка (показана стрелкой)
картину гломерулонефрита (см. Болезни почек). При волчаночном нефрите почки увеличены, пестрые, с участками кровоизлияний (рис. 179). При микроскопическом исследовании волчаночный нефрит характеризуется наличием патологических изменений в ядрах (гематоксилиновые тельца), утолщением капиллярных мембран клубочков, принимающих вид проволочных петель, появлением гиалиновых тромбов и очагов фибриноидного некроза с фиксацией в них иммунных комплексов (рис. 180). В исходе волчаночного нефрита может возникать сморщивание почек с последующим развитием уремии.
Суставы вовлекаются в патологический процесс, однако изменения не достигают большой степени и редко сопровождаются деформацией (в таких случаях заболевание приобретает большое сходство с ревматоидным артритом). Гистологически в синовиальной оболочке выявляется клеточный инфильтрат, состоящий из макрофагов и плазматических клеток, встречаются склерозированные ворсинки, развиваются васкулиты. В околосуставной ткани наблюдаются участки мукоидного и фибриноидного набухания и поля склероза.
На коже боковых поверхностей лица симметрично появляютсякрасные, слегка шелушащиеся участки, соединенные узкой красного цвета полосой на переносице (фигура бабочки). При обострении и прогрессировании болезни появляются высыпания и на других участках тела. С течением времени пятна приобретают коричневатый оттенок. При гистологическом исследовании в собственно коже в острых случаях видны отек и капилляриты, в артериолах наблюдаются фибриноидные изменения, вплоть до некроза. При затихании процесса в стенке сосудов и вокруг них появляются лимфоциты и макрофаги. Развиваются склероз, гиперкератоз, атрофия потовых и сальных желез, что ведет к облысению.
Осложнения. Наиболее опасные для жизни осложнения связаны с поражением почек - развитием их недостаточности на почве волчаночного
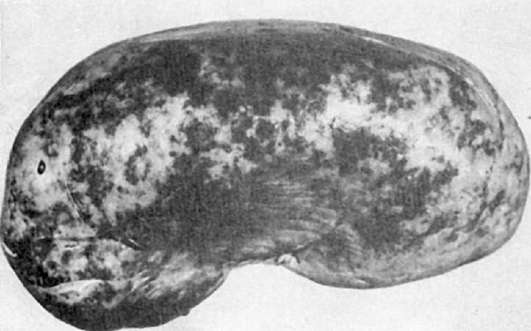 Рис. 179. Почка при волчаночном нефрите
Рис. 179. Почка при волчаночном нефрите
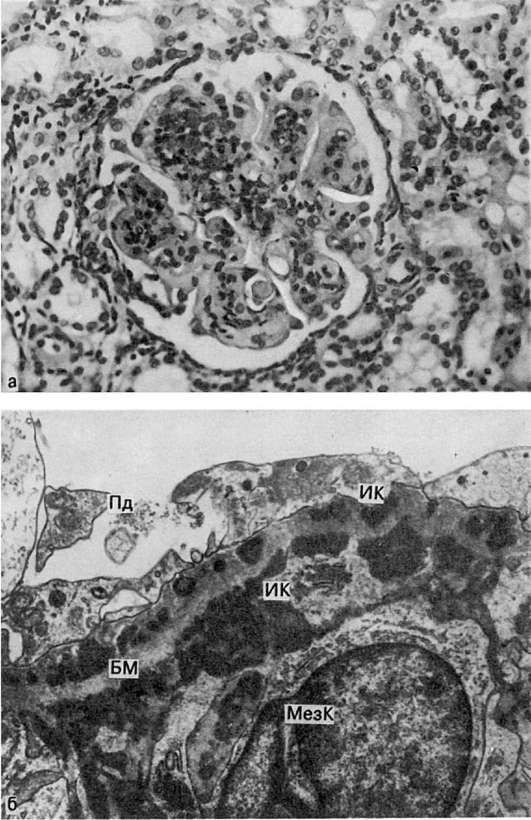 Рис. 180. Волчаночный нефрит:
Рис. 180. Волчаночный нефрит:
а - кариорексис, гиалиновые тромбы (гистологическая картина); б - субэпителиальные и мезангиальные иммунные комплексы (ИК), деструкция подоцита (Пд). БМ - базальная мембрана, МезК - мезангиальная клетка. х10 000
нефрита. Иногда в связи с интенсивным лечением гормональными препаратами развиваются гнойные и септические процессы, «стероидный» туберкулез, а также эндокринные расстройства.
Смерть больных наступает чаще всего от почечной недостаточности или инфекции (сепсис, туберкулез).
Системная склеродермия
Системная склеродермия (системный прогрессирующий склероз) - хроническое заболевание с преимущественным поражением соединительной ткани кожи и висцеральными проявлениями.
Этиология и патогенез. Предполагают, что основное значение в развитии заболевания имеет нарушение синтеза коллагена (аномальный неофибриллогенез), что показано при культивировании кожи больных системной склеродермией. Продукция несовершенного коллагена вызывает усиленный его распад и развитие фиброза. Не исключается роль вирусной инфекции (РНК-содержащий вирус) и генетических факторов. В патогенезе определенную роль могут играть аутоиммунные нарушения.
Патологическая анатомия. В коже и внутренних органах наблюдаются все виды дезорганизации соединительной ткани со слабовыраженной клеточной реакцией, заканчивающиеся грубым склерозом и гиалинозом. Кожа становится плотной и малоподвижной. В суставах отмечаются разной степени васкулиты, иногда с тромбами. Особенно опасно поражение сосудов почек в связи с возможностью развития некроза коркового слоя почек и острой их недостаточности - «истинная склеродермическая почка». Возможно преобладание крупноочагового кардиосклероза с сердечнососудистой недостаточностью - «склеродермическое сердце» (рис. 181) или фиброза базальных отделов легких и субплевральных областей - базальный пневмофиброз.
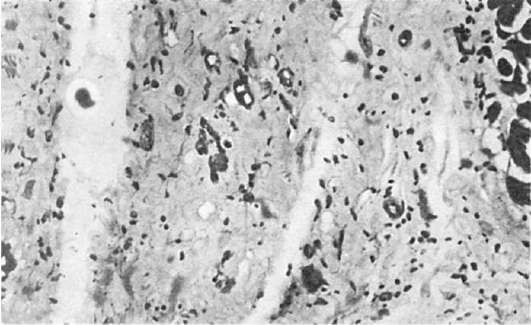 Рис. 181. Рубцовое поле в миокарде при системной склеродермии
Рис. 181. Рубцовое поле в миокарде при системной склеродермии
Осложнением у больных склеродермией наиболее часто является недостаточность тех органов и систем, в которых наиболее выражены склеротические изменения.
Узелковый периартериит
Узелковый периартериит см. Васкулиты.
Дерматомиозит
Дерматомиозит - ревматическое заболевание, главным и ведущим клинико-морфологическим проявлением которого является системное поражение поперечнополосатой, в меньшей степени гладкой, мускулатуры и кожи. Наблюдаются случаи заболевания без поражения кожи, тогда его обозначают как полиомиозит. Дерматомиозит и полиомиозит встречаются в любом возрасте, преимущественно у женщин.
Этиология и патогенез. Предполагается вирусная природа заболевания. Косвенным подтверждением этого служит обнаружение у больных в цитоплазме эндотелио- и миоцитов тубулярных структур, сходных с парамиксовирусами. Показано значение генетической предрасположенности, описаны случаи семейного дерматомиозита. Развитие болезни связано, вероятнее всего, с нарушениями иммунологического гомеостаза и аутоиммунизацией. Пусковым механизмом является, видимо, вирусная инфекция. Очевидна связь дерматомиозита с опухолями, при этом опухолевые антигены могут быть перекрестно реагирующими с антигенами мышц, что усугубляет аутоиммунизацию. Отмечено улучшение состояния больных после удаления опухоли.
Патологическая анатомия. Наиболее часто изменения развиваются в скелетной мускулатуре, в мышцах глотки, гортани, диафрагмы, глазных мышцах. Мышцы становятся бледно-желтыми, отечными. В подкожной клетчатке, мышцах появляются очаги кальциноза. При микроскопическом исследовании постоянно обнаруживаются дистрофические изменения мышечных волокон, в них исчезает поперечная исчерченность, уменьшается содержание гликогена, резко понижается активность ряда ферментов. Многие мышечные волокна некротизированы, и в очагах некроза видно выпадение извести в виде мелких зерен. В соединительнотканной строме мышц, которая вовлекается в процесс вторично, развиваются отек и воспалительная реакция. В инфильтрате преобладают лимфоциты, макрофаги и плазматические клетки (рис. 182). Скопления лимфоцитов и макрофагов особенно выражены по ходу микрососудов, со стороны эндотелия капилляров отмечаются пролиферация и десквамация, вплоть до полного закрытия просвета.
Изменения внутренних органов при дерматомиозите постоянны. Они носят воспалительный, дистрофический или склеротический характер и наиболее часто наблюдаются в сердце, легких, желудочно-кишечном тракте.
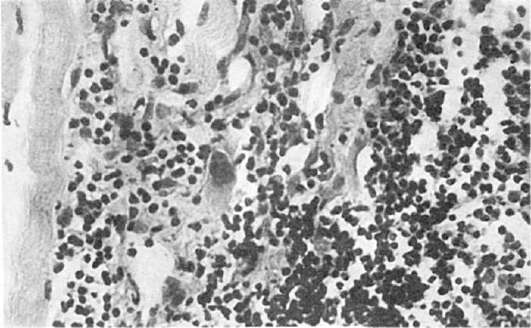 Рис. 182. Дерматомиозит. Дистрофические изменения мышечных волокон, клеточная инфильтрация межуточной ткани
Рис. 182. Дерматомиозит. Дистрофические изменения мышечных волокон, клеточная инфильтрация межуточной ткани
Наиболее опасна пневмония, которая в детском возрасте часто является причиной гибели больного.
Лимфатические узлы и селезенка обычно увеличены, с явлениями гиперплазии лимфоидной ткани и плазмоклеточной трансформацией.
Клинико-морфологические формы. Выделяют первичную (идиопатическую) и вторичную (опухолевую) формы дерматомиозита, морфологические проявления которых идентичны. Каждая из этих форм может иметь острое, подострое, непрерывно-рецидивирующее и хроническое течение.
Первичная форма обычно встречается у детей, вторичная - у взрослых.
Из опухолей, при которых развивается дерматомиозит, наиболее часто отмечается рак (яичников, молочной железы, легкого, желудка, кишечника). Нередко дерматомиозит служит первым проявлением опухоли.