Эндокринология : учебник. И.И. Дедов - 2009. - 432 с.: ил.
|
|
|
|
ГЛАВА 9 ОПУХОЛИ ЭНДОКРИННОЙ ЧАСТИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
9.1. АНАТОМИЯ И ФИЗИОЛОГИЯ ЭНДОКРИННОЙ ЧАСТИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
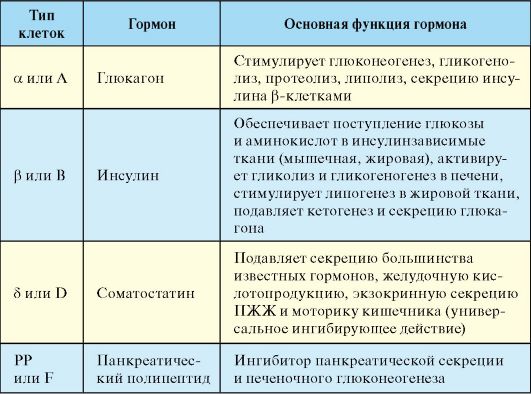
Поджелудочная железа расположена забрюшинно, на уровне L1-L3 позвонков, имеет размеры 10-20 х 5-10 х 3-5 см и массу около 100 г. Эндокринная часть поджелудочной железы (ПЖЖ) представлена панкреатическими островками Лангерганса, которые составляют около 1/100 массы всей железы. Островки (общее число 1-2 млн) рассеяны во всех отделах ПЖЖ, при этом их больше в хвостовой части. Островок имеет диаметр около 100-200 мкм и состоит из 100-200 эндокринных клеток. Эндокринная часть ПЖЖ функционирует в тесной физиологической связи с одиночными гормон-продуцирующими клетками желудочно-кишечного тракта (ЖКТ) и других органов. По суммарной массе эндокрин-продуцирующих клеток эндокринная часть ПЖЖ и кишечные эндокриноциты являются самой крупной «эндокринной железой» человеческого организма. Основными продуктами секреции панкреатических островков Лангерганса являются инсулин, глюкагон, соматостатин и панкреатический полипептид (табл. 9.1). Инсулин является полипептидньм гормоном, продуцирующимся β-клетками островков Лангерганса в виде предшественника проинсулина, который после протеолитического отщепления С-пептида превращается в биологически активный гормон (см. п. 7). Глюкагон - полипептид, состоящий из 29 аминокислотных остатков. Синтезируется глюкагон в виде крупной молекулы-предшественника - проглюкагона. Лишь 30-40 % иммунореактивного глюкагона плазмы приходится на долю панкреатического глюкагона. Остальная часть - это более крупные молекулы, лишенные биологической активности. Физиологически и иммунологически глюкагон аналогичен энтероглюкагону, продуцируемому эндокринными клетками двенадцатиперстной кишки. Соматостатин представляет собой циклический полипептид, секретирующийся D клетками ПЖЖ виде крупного прогормона.
Табл. 9.1. Основные гормоны панкреатических островков
 Окончательный
продукт состоит из 14 аминокислотных остатков. Свое название
соматостатин получил в связи с тем, что вначале был выделен из
гипоталамуса как фактор, ингибирующий секрецию гормона роста.
Окончательный
продукт состоит из 14 аминокислотных остатков. Свое название
соматостатин получил в связи с тем, что вначале был выделен из
гипоталамуса как фактор, ингибирующий секрецию гормона роста.
По современным представлениям физиологическая роль панкреатических и кишечных гормонов состоит в регуляции процессов пищеварения (все желудочно-кишечные гормоны), клеточного метаболизма (инсулин) и эндогенного синтеза его основных субстратов (инсулин, глюкагон). Панкреатические и желудочнокишечные гормоны представляют собой гетерогенную группу гуморальных факторов. Часть из них (секретин, холецистокинин) соответствует классическому понятию «гормон» (гуморальный фактор, оказывающий действие на отдаленные от него структуры). Другие гормоны (вазоактивный интестинальный пептид, соматостатин) действуют паракринно и нейрокринно, т.е. как нейромедиаторы.
9.2. МЕТОДЫ ОБСЛЕДОВАНИЯ ПАЦИЕНТОВ С ГОРМОНАЛЬНО-АКТИВНЫМИ ОПУХОЛЯМИ
ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
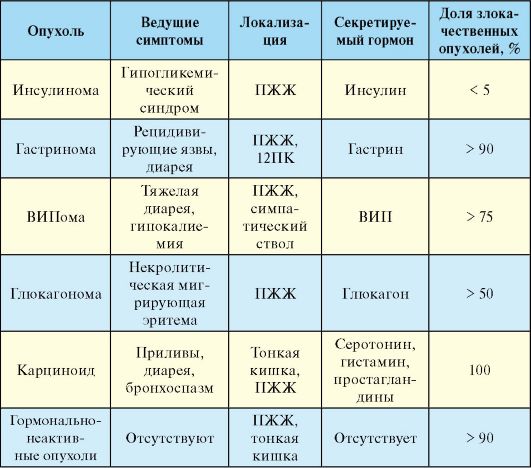
За исключением сахарного диабета все известные на сегодняшний день заболевания эндокринной части ПЖЖ патогенетически связаны с избытком панкреатических гормонов, т.е. речь идет о гормонально активных опухолях (табл. 9.2). Клиническая картина этих заболеваний гетерогенна и определяется симптоматикой, вызванной гиперсекрецией того или иного гормона и, в случае злокачественных опухолей, инвазивным ростом и метастазированием.
Табл. 9.2. Эндокринные опухоли поджелудочной железы и желудочнокишечного тракта (ПЖЖ - поджелудочная железа, 12ПК - двенадцатиперстная кишка; ВИП - вазоактивнй интестинальный пептид).
 При
подозрении на гормонально-активную опухоль ПЖЖ первым этапом является
подтверждение или исключение гиперсекреции того или иного гормона. С
этой целью проводится гормональное исследование, в котором
определяется уровень самого гормона, его предшественника (С-пептид) или
метаболита (5-ГИУК). В ряде случаев проводятся функциональные пробы
(проба с голоданием). Если гиперсекреция гормона доказана, проводится топическая диагностика, принципы
которой для всех гормонально-активных опухолей схожи. С целью
топической диагностики могут быть использованы следующие методы:
При
подозрении на гормонально-активную опухоль ПЖЖ первым этапом является
подтверждение или исключение гиперсекреции того или иного гормона. С
этой целью проводится гормональное исследование, в котором
определяется уровень самого гормона, его предшественника (С-пептид) или
метаболита (5-ГИУК). В ряде случаев проводятся функциональные пробы
(проба с голоданием). Если гиперсекреция гормона доказана, проводится топическая диагностика, принципы
которой для всех гормонально-активных опухолей схожи. С целью
топической диагностики могут быть использованы следующие методы:
1. Ультразвуковое исследование:
- трансабдоминальное (стандартное);
- эндоскопическое (датчик устанавливается на эндоскоп);
- интраоперационное (датчик устанавливается на ПЖЖ).
2. Томография органов брюшной полости:
- компьютерная томография (КТ);
- магнитно-резонансная томография (МРТ).
3. Эндоваскулярные методы:
- ангиография;
- исследование проб портальной венозной крови для определения градиента концентрации гормонов.
4. Сцинтиграфия соматостатиновых рецепторов.
Очень трудны для топической диагностики мелкие опухоли диаметром 1 см и менее. Чаще всего в данном случае речь идет об инсулиномах и гастриномах. Ценность стандартного УЗИ ПЖЖ в диагностике этих опухолей очень низка, что связано с недостаточной интенсивностью внутреннего эхосигнала от опухоли. Несколько больше она для КТ и МРТ. Чувствительность эндоваскулярных методов выше, но их явным недостатком является инвазивность. Ангиографический метод основан на выявлении гиперваскуляризации новообразований и их метастазов. Методика исследования проб портальной венозной крови заключается в катетеризации портальной системы, при этом, если уровень гормона в пробе крови из отдельного региона превысит системный на 50 %, это свидетельствует о соответствующей локализации опухоли (рис. 9.1).
Самыми чувствительными из неинвазивных методов топической диагностики эндокринных опухолей ПЖЖ и ЖКТ на сегодняшний
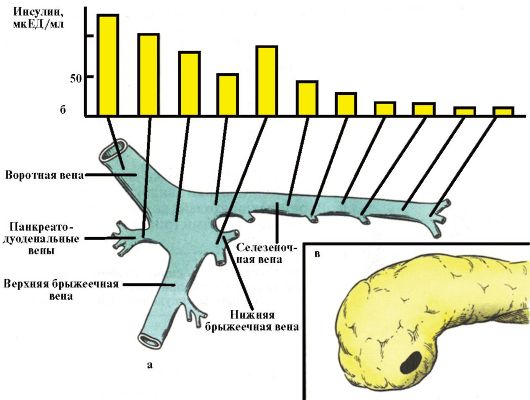 Рис. 9.1. Чрескожная
чреспеченочная портография с селективным забором венозной крови для
определения уровня инсулина в топической диагностике инсулиномы:
Рис. 9.1. Чрескожная
чреспеченочная портография с селективным забором венозной крови для
определения уровня инсулина в топической диагностике инсулиномы:
а - схема портальной системы с указанием точек селективного забора проб крови; б - уровень инсулина в соответствующих точках; в - наиболее вероятная локализация инсулиномы - головка поджелудочной железы в области крючковидного отростка
день являются эндоскопическое УЗИ и сцинтиграфия соматостатиновых рецепторов. При первой методике датчик ультразвукового аппарата помещается на эндоскоп и исследование производится непосредственно через кишечную стенку.
Большинство эндокринных опухолей ПЖЖ и ЖКТ (за исключением инсулиномы) имеет соматостатиновые рецепторы, на чем и базируется метод сцинтиграфии соматостатиновых рецепторов. В данном случае радиоактивная метка (индий-111) вводится в аналог соматостатина длительного действия октреотид. Радиофармпрепарат накапливается в опухолях, содержащих соматостатиновые рецепторы, что позволяет использовать этот метод для топической диагностики первичных опухолей и их метастазов, послеоперационного контроля за
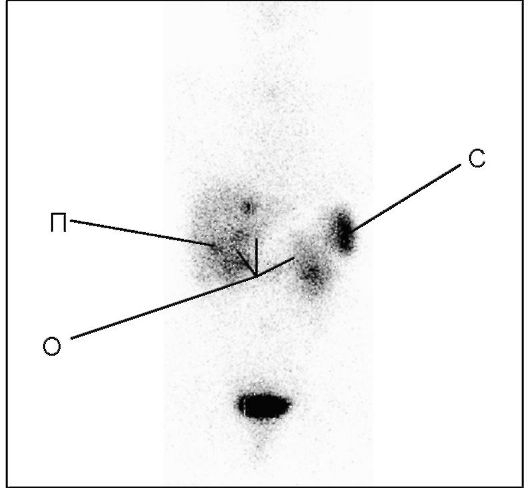 Рис. 9.2. Сцинтиграмма
соматостатиновых рецепторов с помощью октреотида, маркированного
индием-111. На сцинтиграмме (вид спереди) видны рецептор-позитивные
образования, соответствующие локализации первичной опухоли и ее
метастазов (П - печень, С - селезенка, О - предполагаемая локализация
первичной опухоли в панкреатодуоденальном регионе)
Рис. 9.2. Сцинтиграмма
соматостатиновых рецепторов с помощью октреотида, маркированного
индием-111. На сцинтиграмме (вид спереди) видны рецептор-позитивные
образования, соответствующие локализации первичной опухоли и ее
метастазов (П - печень, С - селезенка, О - предполагаемая локализация
первичной опухоли в панкреатодуоденальном регионе)
радикальностью вмешательства, а также для дифференциальной диагностики эндокринных и неэндокринных опухолей, которые были выявлены другими методами (рис. 9.2).
9.3. ИНСУЛИНОМА
Инсулинома - инсулинпродуцирующая опухоль, происходящая из β-клеток островков Лангерганса, обусловливающая развитие тощакового гипогликемического синдрома (табл. 9.3).
Гипогликемический синдром - симптомокомплекс, развивающийся вследствие дисбаланса в системе поддержания уровня глюкозы в крови с развитием гипогликемии. Гипогликемией принято считать снижение концентрации глюкозы в крови ниже 2,2-2,5 ммоль/л, при этом уровень гликемии не всегда коррелирует с выраженностью клинической симптоматики. Наиболее часто гипогликемические расстройства развиваются в процессе лечения сахарного диабета, однако эти состояния к гипогликемическому синдрому не относятся и рассматриваются отдельно (см. п. 7.7.3).
Табл. 9.3. Инсулинома
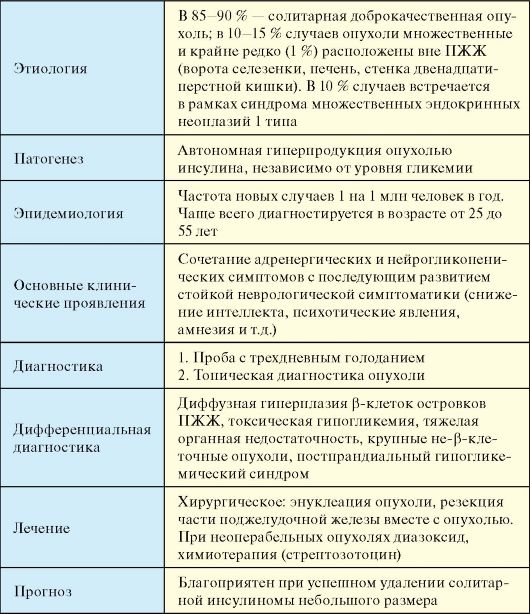 Этиология
Этиология
В 85-90 % случаев солитарная доброкачественная опухоль. В 10-15 % случаев опухоли множественные, и крайне редко (1 %) расположены вне ПЖЖ (ворота селезенки, печень, стенка двенадцатиперстной кишки). Примерно 10 % инсулином встречается в рамках синдрома множественных эндокринных неоплазий 1 типа (см. п. 10.2).
Патогенез
В основе патогенеза гипогликемического синдрома при инсулиноме лежит автономная, т.е. независимая от уровня гликемии гиперпродукция опухолью инсулина. У здорового человека длительное голодание приводит к снижению уровня глюкозы в крови до нижнего диапазона нормы. При этом отмечается значительное снижение уровня инсулина в крови вплоть до следовых концентраций. У больных с инсулиномами гликогенолиз подавлен опухолевым инсулином, и когда прекращается поступление глюкозы из ЖКТ в кровяное русло, создаются условия для развития гипогликемического приступа. В ответ на гипогликемию происходит выброс контринсулярных гормонов (катехоламины, кортизол, гормон роста), который обусловливает адренергическую симптоматику. Явления нейроглюкопении обусловлены снижением в крови уровня основного энергетического субстрата для головного мозга. Хроническая гипогликемия приводит к дистрофическим изменениям в ЦНС.
Эпидемиология
Инсулинома - редкое заболевание, частота новых случаев составляет 1 на 1 млн человек в год. Наиболее часто инсулинома диагностируется в возрасте от 25 до 55 лет. У детей наблюдается лишь 5 % от общего числа инсулином.
Клинические проявления
♦ Адренергические симптомы: дрожь, тахикардия, холодный пот, голод, страх, парестезии.
♦ Нейрогликопенические симптомы: астения, речевые, зрительные, поведенческие нарушения, амнезия, снижение концентрации внимания, головная боль, сомноленция, судороги, параличи, кома.
Набор и выраженность перечисленных симптомов в отдельно взятых случаях значительно варьируют. Это могут быть только адренергические или только нейрогликопенические симптомы, причем четкая зависимость их выраженности и последовательности развития по мере утяжеления гипогликемии отсутствует. Быстрое и значительное падение уровня гликемии сопровождается гипогликемическим шоком, который характеризуется выраженной адренергической симптоматикой и прогрессирующим нарушением сознания. Длительная гипогликемия и ее частые эпизоды приводят к необратимым изменениям в ЦНС, прежде всего в коре больших полушарий, проявления которых значительно варьируют от делириозных и галлюцинаторно-парано-
идных эпизодов до типичных эпилептических припадков, неизбежным исходом которых является стойкое слабоумие.
Чаще всего приступы развиваются в ранние утренние часы, что связано с длительным перерывом в приеме пищи. Обычно больные просыпаются утром с трудом, сознание к ним возвращается медленно, длительное время они остаются дезориентированы, суетливы, действуют «как во сне», односложно или невпопад отвечают на вопросы. Приступ чаще всего заканчивается глубоким расстройством сознания, который купируется внутривенным введением глюкозы. Распространенное представление о повышенном аппетите у больных с инсулиномой не всегда соответствует действительности. Обычно сами больные обнаруживают быстрый и выраженный эффект от приема пищи для предупреждения или купирования едва начавшегося приступа. Поэтому пациенты носят с собой мучное или сласти в качестве «лекарства», хотя особой потребности в пище не ощущают. У большинства пациентов с инсулиномой за время заболевания увеличивается масса тела, и нередко значительно - до 15-40 кг.
Диагностика
1. Проба с трехдневным голоданием, целью которой является провокация патогномоничной для инсулиномы триады Уиппла:
- возникновение приступов гипогликемии натощак;
- падение уровня глюкозы в крови ниже 2,5 ммоль/л во время приступа;
- купирование приступа внутривенным введением глюкозы.
Время начала голодания отмечается как время последнего приема пищи; допускается только питье воды. На протяжении пробы периодически проводится исследование содержания глюкозы в крови, инсулина и С-пептида. Более достоверно определение глюкозы в лабораторных условиях по сравнению с экспресс-методом при помощи глюкометра. В начале пробы крови берутся каждые 6 ч, а при снижении уровня глюкозы ниже 3 ммоль/л этот интервал сокращается. Голодание прекращается в том случае, если уровень глюкозы падает ниже 2,5 ммоль/л и при этом имеются симптомы гипогликемии, которые в дальнейшем купируются внутривенным введением глюкозы. Прекращение теста только при наличии низкого уровня глюкозы в крови при отсутствии гипогликемической симптоматики неправомерно и снижает диагностическую ценность пробы. Если у пациента в течение 72 ч отсутствуют симптомы гипогликемии и снижение
гликемии ниже 2,5 ммоль/л, проба прекращается, и ее результаты расцениваются как отрицательные. В большинстве случаев у больных с инсулиномой триада Уиппла развивается через 12-18 ч от начала теста (рис. 9.3).
2. Топическая диагностика инсулиномы проводится только при положительной пробе с голоданием. Наибольшей ценностью обладают эндоскопическое исследование и интраоперационное УЗИ; при необходимости проводится ангиография с селективным забором крови из вен портальной системы (см. п. 9.2).
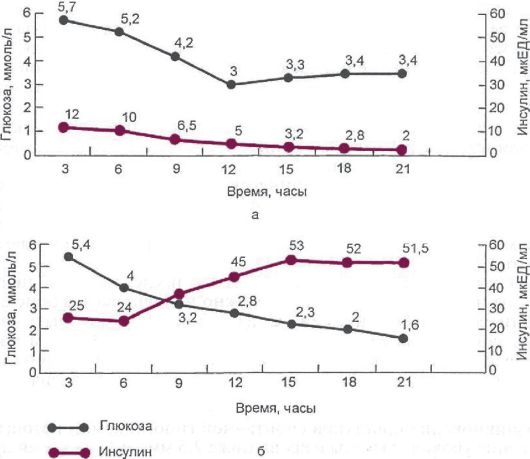 Рис. 9.3. Содержание
глюкозы и инсулина в крови во время пробы с трехдневным голоданием. А -
в норме; Б - у пациента с инсулиномой. В норме после 12 ч голодания
произошло значительное снижение уровня инсулина, а уровень глюкозы
увеличился до 3,4 ммоль/л. При инсулиноме спустя 15-18 ч голодания
гликемия снизилась до 2 ммоль/л, однако уровень инсулина продолжал
нарастать на всем протяжении пробы, несмотря на развитие
гипогликемического состояния
Рис. 9.3. Содержание
глюкозы и инсулина в крови во время пробы с трехдневным голоданием. А -
в норме; Б - у пациента с инсулиномой. В норме после 12 ч голодания
произошло значительное снижение уровня инсулина, а уровень глюкозы
увеличился до 3,4 ммоль/л. При инсулиноме спустя 15-18 ч голодания
гликемия снизилась до 2 ммоль/л, однако уровень инсулина продолжал
нарастать на всем протяжении пробы, несмотря на развитие
гипогликемического состояния
Дифференциальная диагностика
Тощаковая гипогликемия в большинстве случаев обусловлена органической патологией, тогда как постпрандиальная - функциональными расстройствами работы вегетативной нервной системы и ЖКТ.
Тощаковая гипогликемия
1. Диффузная гиперплазия β-клеток островков ПЖЖ (незидиобластоз и микроаденоматоз островков Лангерганса) - диффузная или диссеминированная пролиферация островковых клеток с элементами трансформации протокового эпителия в β-клетки неизвестной этиологии. Встречается казуистически редко. Клинически протекает также как инсулинома. Диагноз устанавливается на этапе топической диагностики. Лечение подразумевает резекцию большей части (90 %)
ПЖЖ.
2. Токсическая гипогликемия (инсулин, препараты сульфонилмочевины, алкоголь, пентамидин, хинин, салицилаты и др.) Для артифициальной гипогликемии, вызванной введением инсулина, характерен низкий уровень С-пептида. Наиболее сложна диагностика артифициального гипогликемического синдрома, вызванного приемом препаратов сульфонилмочевины, поскольку в данном случае будет определяться высокий уровень С-пептида. При этом может помочь определение метаболитов препаратов сульфонилмочевины в моче.
3. Тяжелая органная недостаточность (печеночная, сердечная, почечная, сепсис).
4. Крупные не-β-клеточные опухоли (печени, коры надпочечников, мезенхимомы).
6. Постпрандиальный гипогликемический синдром: состояние после операций на ЖКТ (демпинг-синдром); идиопатическая постпрандиальная гипогликемия развивается без каких-либо видимых причин; наиболее сложна для диагностики и лечения.
Лечение
Хирургическое: энуклеация опухоли, резекция части поджелудочной железы вместе с опухолью. При неоперабельных злокачественных инсулиномах для предотвращения (урежения и снижения выраженности) гипогликемических состояний в ряде случаев эффективен диазоксид. При неоперабельных метастатических инсулиномах применяется химиотерапия стрептозотоцином, который обладает селективной токсичностью по отношению к β-клеткам ПЖЖ.
Прогноз
Наиболее благоприятен в случае успешного удаления солитарной инсулиномы небольшого размера; наихудший - при злокачественных инсулиномах.
9.4. ГАСТРИНОМА
Гастринома - гастрин-продуцирующая опухоль, клинически проявляющаяся триадой, описанной в 1955 г. Р. Золлингером и Е. Эллисоном: выраженная гиперсекреция соляной кислоты париетальными клетками желудка, рецидивирующие пептические язвы, неинсулин-продуцирующая опухоль ПЖЖ (табл. 9.4).
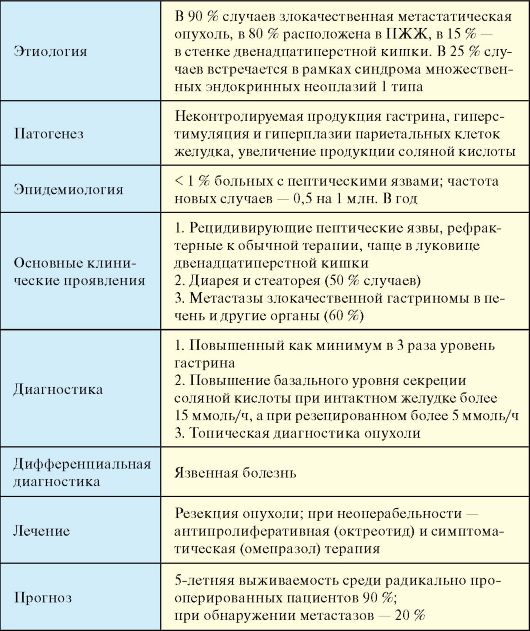
Этиология
Гастринома - в 90 % случаев злокачественная метастатическая опухоль, чаще (80 %) расположена в ПЖЖ, значительно реже - в стенке двенадцатиперстной кишки (15 %) и антральном отделе желудка, крайне редко (5 %) - в других органах (сальник, яичники, билиарная система). В 25 % случаев гастринома встречается в рамках синдрома множественных эндокринных неоплазий 1 типа (см. п. 10.2.1).
Патогенез
В основе патогенеза синдрома Золлингера-Эллисона лежит неконтролируемая продукция гастрина опухолью. Гипергастринемия приводит к гиперстимуляции, гиперплазии париетальных клеток и значительному увеличению продукции соляной кислоты, которая обусловливает формирование пептических язв, инактивацию панкреатических ферментов и повреждение слизистой кишечника вследствие чего развивается диарея.
Эпидемиология
Гастринома - редкое заболевание, встречается не более чем у 1 % больных с пептическими язвами. Частота новых случаев составляет 0,5 на 1 млн в год, чаще (60 %) страдают мужчины.
Клинические проявления
• Рецидивирующая пептическая язва, рефрактерная к обычной терапии.
• Диарея и стеаторея (50 % случаев).
• Метастазы злокачественной гастриномы в печень и другие органы (60 %).
Табл. 9.4. Гастринома
 Диагностика
Диагностика
1. Повышенный как минимум в 3 раза (норма < 60 пг/мл) уровень гастрина, который должен исследоваться в разные дни.
2. Повышение базального уровня секреции соляной кислоты при интактном желудке более 15 ммоль/ч, а при резецированном более 5 ммоль/ч.
3. Топическая диагностика опухоли (см. п. 9.2). Дифференциальная диагностика
Язвенная болезнь желудка и двенадцатиперстной кишки; симптоматические язвы.
Лечение
При солитарной доброкачественной гастриноме показана энуклеация опухоли. При гастриномах, встречающихся спорадически, максимально возможное число радикальных операций составляет около 30 %. При неоперабельных опухолях или невозможности их визуализации вмешательства с целью панкреатодуоденальной резекции или гастрэктомии не производятся - пациенту показана только медикаментозная терапия. Препаратом выбора антипролиферативной терапии при злокачественных гастриномах является октреотид. Для симптоматической терапии при язвах и диарее весьма эффективны блокаторы протонной помпы (омепразол).
Прогноз
Пятилетняя выживаемость среди пациентов с радикально резецированными гастриномами составляет 90 %, среди всех больных с гастриномами она составляет 60-75 %, 10-летняя - 50 %. При обнаружении метастазов 5-летняя выживаемость снижается до 20 %. Причиной смерти в 60 % случаев является опухолевая прогрессия.
9.5. ГЛЮКАГОНОМА
Глюкагонома - редкая островково-клеточная опухоль в избытке продуцирующая глюкагон (табл. 9.5).
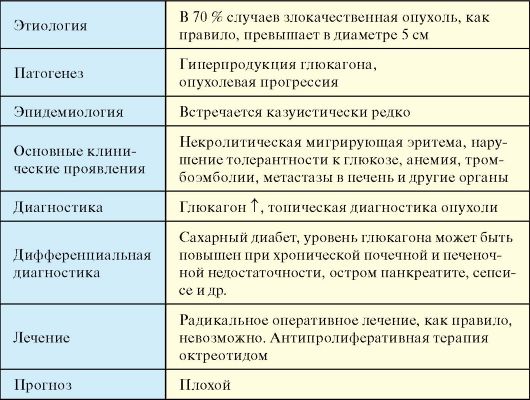
Этиология
Глюкагонома в 70 % случаев злокачественна (в 80 % на момент диагностики определяются метастазы), чаще всего локализуется
в хвосте ПЖЖ и на момент диагностики, как правило, превышает в диаметре 5 см (не представляет проблем с топической диагностикой). Мультицентрические опухоли обнаруживаются в 10-12 % случаев.
Табл. 9.5. Глюкагонома
 Патогенез
Патогенез
В его основе лежит гиперпродукция глюкагона и опухолевая прогрессия. С избытком глюкагона связаны нарушения углеводного обмена (усиление печеночного глюконеогенеза и гликолиза), а с нарушением обмена аминокислот - изменения со стороны кожи. Встречается в рамках синдрома множественных эндокринных неоплазий 1 типа.
Эпидемиология
Встречается казуистически редко.
Клинические проявления
♦ Некролитическая мигрирующая эритема со вторичным буллезным дерматитом (90 %).
♦ Нарушение толерантности к глюкозе или сахарный диабет (90 %).
♦ Анемия, потеря массы тела, анорексия.
♦ Тромбоэмболические осложнения с образованием венозных тромбов (20 %) и легочной эмболией (12 %).
♦ Метастазы в печень и другие органы брюшной полости.
Диагностика
1. Высокий уровень глюкагона крови (у 80 % пациентов превышает норму в 5-10 раз). Уровень глюкагона более 1000 пг/мл (норма < 200 пг/мл) считается патогномоничным для глюкагономы.
2. Гипоаминоацидемия (80 %).
3. Топическая диагностика опухоли и ее метастазов (см. п. 9.2). Дифференциальная диагностика
♦ Сахарный диабет, кожные изменения другой этиологии, метастазы в печень другой опухоли.
♦ Уровень глюкагона в крови может быть повышен (обычно умеренно) при хронической почечной и печеночной недостаточности, остром панкреатите, сепсисе, акромегалии, синдроме Кушинга, длительном голодании.
Лечение
На момент диагностики развернутого глюкагонома-синдрома радикальное оперативное вмешательство, как правило, уже невозможно. Для антипролиферативной терапии и подавления продукции глюкагона наиболее эффективен октреотид (длительно действующий аналог соматостатина).
Прогноз
В большинстве случаев неблагоприятный.
9.6. ВИПОМА
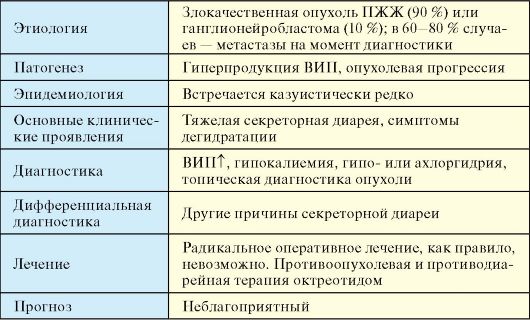
ВИПома, или синдром Вернера-Моррисона (синонимы: WDHH-синдром от англ. watery diarrhea, hypokalemia, hypochlorhydria; синдром панкреатической холеры) обусловлены гиперсекрецией вазоактивного интенстинального пептида (ВИП) (табл. 9.6).
Этиология
Злокачественная опухоль ПЖЖ (90 %) или ганглионейробластома (10 %). ВИПомы, как правило, представляют собой солитарные, крупные
опухоли, чаще располагающиеся в хвосте ПЖЖ. На момент диагностики в 60-80 % случаев они уже имеют метастазы.
Патогенез
Гиперпродукция ВИП, опухолевая прогрессия. ВИП стимулирует интестинальную секрецию электролитов и жидкости, имеет вазодилататорный эффект, ингибирует секрецию соляной кислоты в желудке.
Эпидемиология
Встречается казуистически редко. Табл. 9.6. ВИПома
 Клинические проявления
Клинические проявления
♦ Тяжелая секреторная диарея, которая может иметь угрожающий для жизни характер (панкреатическая холера). Объем стула менее 700 г в день практически исключает диагноз ВИПомы.
♦ Симптомы дегидратации.
Диагностика
1. Высокий уровень ВИП в крови, гипокалиемия, гипоили ахлоргидрия.
2. Топическая диагностика опухоли (см. п. 9.2).
Дифференциальная диагностика
Другие причины секреторной диареи (кишечные инфекции, виллезная аденома, медуллярный рак щитовидной железы, системный мастоцитоз и др.).
Лечение
Радикальное оперативное лечение, как правило, невозможно. Препаратом выбора противоопухолевой терапии, который одновременно эффективно купирует диарею, является октреотид.
Прогноз
В большинстве случаев неблагоприятный.
9.7. КАРЦИНОИДНЫЙ СИНДРОМ
Карциноидный синдром - симптомокомплекс, связанный с ростом и гормонопродукцией опухолей, происходящих из энтерохромаффинных клеток. Под карциноидом понимают опухоль, вызывающую карциноидный синдром (табл. 9.7).
Этиология
По гистологической структуре набору продуцируемых гормонов и степени злокачественности карциноидные опухоли значительно варьируют в зависимости от локализации. Карциноидные опухоли подразделяются на происходящие из переднего, среднего и заднего отделов первичной эмбриональной кишки (табл. 9.8). На карциноид кишечника приходится 90 % случаев всех карциноидных опухолей. Наиболее часто кишечный карциноид локализуется в терминальном отделе подвздошной кишки, червеобразном отростке, прямой кишке.
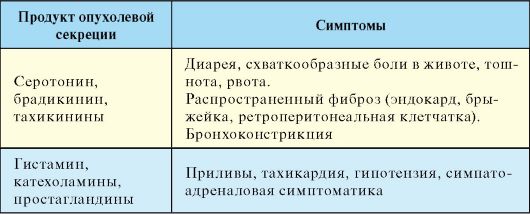
Патогенез
Большая часть симптомов карциноидного синдрома обусловлена гиперсекрецией опухолью таких веществ как серотонин, кинины, гистамин, катехоламины и простагландины. Основным биохимическим маркером карциноидного синдрома является серотонин. Опухоли, происходящие из передней кишки (бронхи, желудок), в основном вырабатывают не серотонин, а 5-гидрокситриптофан. Основным метаболитом биогенных аминов является 5-гидроксииндолуксусная кислота (5-ГИУК). Патогенез отдельных клинических проявлений карциноидного синдрома представлен в табл. 9.9.
Табл. 9.7. Карциноидный синдром
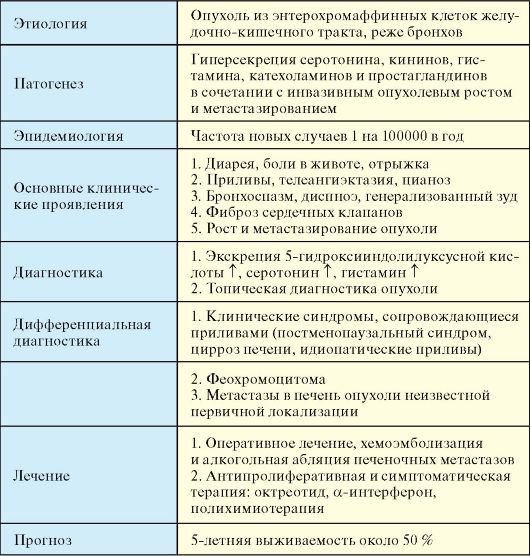 Табл. 9.8. Классификации карциноидных опухолей
Табл. 9.8. Классификации карциноидных опухолей
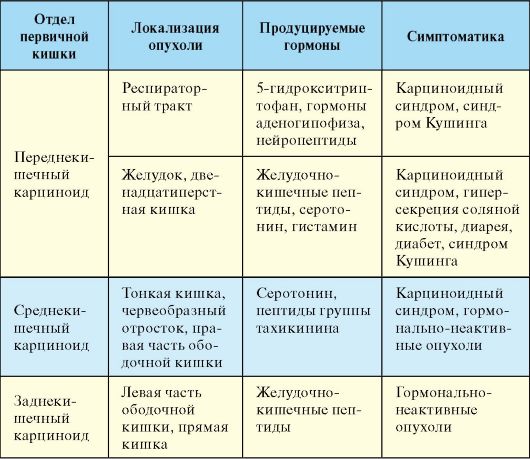 Табл. 9.9. Патогенез отдельных клинических проявлений карциноидного синдрома
Табл. 9.9. Патогенез отдельных клинических проявлений карциноидного синдрома
 Развернутая
симптоматика карциноидного синдрома при кишечном карциноиде
соответствует поздней стадии опухолевого процесса и метастатическому
поражению печени. Первичная опухоль, как правило, имеет небольшие
размеры, и секретируемые ею продукты, попадая в печень, полностью
инактивируются. Когда печень перестает справляться с массивной
опухолевой секрецией, ее продукты начинают поступать в системный
кровоток, и только тогда появляется симптоматика карциноидного синдрома.
Точно так же, механически, объясняется преимущественное поражение при
кишечном карциноиде эндокарда правых отделов сердца, куда кровь из
пораженной печени поступает по нижней полой вене. Отличие внекишечного
карциноида от кишечных форм заключается в том, что продукты опухолевой
секреции попадают непосредственно в системный кровоток, а не в
портальную систему. Таким образом, в этих случаях симптоматика
карциноидного синдрома может развиваться еще на ранних стадиях
опухолевого процесса, когда радикальная операция еще возможна.
Развернутая
симптоматика карциноидного синдрома при кишечном карциноиде
соответствует поздней стадии опухолевого процесса и метастатическому
поражению печени. Первичная опухоль, как правило, имеет небольшие
размеры, и секретируемые ею продукты, попадая в печень, полностью
инактивируются. Когда печень перестает справляться с массивной
опухолевой секрецией, ее продукты начинают поступать в системный
кровоток, и только тогда появляется симптоматика карциноидного синдрома.
Точно так же, механически, объясняется преимущественное поражение при
кишечном карциноиде эндокарда правых отделов сердца, куда кровь из
пораженной печени поступает по нижней полой вене. Отличие внекишечного
карциноида от кишечных форм заключается в том, что продукты опухолевой
секреции попадают непосредственно в системный кровоток, а не в
портальную систему. Таким образом, в этих случаях симптоматика
карциноидного синдрома может развиваться еще на ранних стадиях
опухолевого процесса, когда радикальная операция еще возможна.
Эпидемиология
Частота новых случаев карциноидных опухолей составляет 1 на 100000 в год. Средний возраст манифестации карциноидов тонкой кишки составляет 50-60 лет; встречается с одинаковой частотой у мужчин и женщин.
Клинические проявления
♦ Диарея, боли в животе, отрыжка.
♦ Приливы, телеангиэктазия, цианоз. Приливы могут быть спровоцированы физической нагрузкой, алкоголем или такими продуктами, как сыр, копченость, кофе. Они могут повторяться в течение дня, длятся обычно несколько минут, сопровождаясь сильной потливостью. Пациенты жалуются при этом на чувство жара, сердцебиение и дрожь. У некоторых может быть силь-
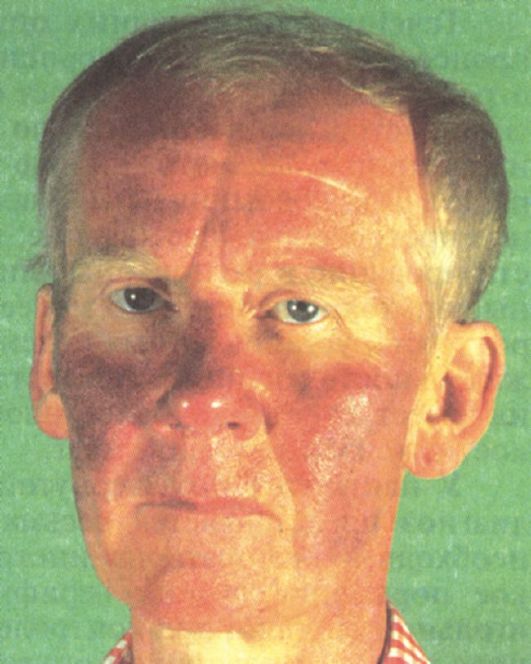 Рис. 9.4. Изменение цвета лица пациента во время приливов при карциноидном синдроме
Рис. 9.4. Изменение цвета лица пациента во время приливов при карциноидном синдроме
ное слезо- и слюнотечение. На этом фоне могут наблюдаться выраженная артериальная гипотензия, затруднение дыхания, диарея. Кожа лица и верхней половины туловища постепенно приобретает стойкий красно-синюшный оттенок, появляются телеангиэктазии (рис. 9.4). При карциноиде желудка и бронхов приливы представляют собой ярко-красные пятна на лице и верхней половине туловища с четкой границей.
♦ Бронхоспазм (10-15 %), диспноэ, генерализованный зуд.
♦ Фиброз сердечных клапанов (2/3 пациентов) с развитием правожелудочковой недостаточности, редко - брыжеечный и ретроперитонеальный фиброз (с явлениями кишечной непроходимости и обструкции мочеточников).
♦ Рост и метастазирование опухоли (кишечная непроходимость, механическая желтуха и пр.).
Диагностика
1. Основным маркером карциноидных опухолей является метаболит серотонина - 5-ГИУК, определяемая в суточной моче. Решающим в диагностике бронхиального и желудочного карциноида является определение в моче серотонина и гистамина.
2. Топическая диагностика опухоли (см. п. 9.2). Высокой информативностью при карциноидных опухолях обладает сцинтиграфия соматостатиновых рецепторов.
Дифференциальная диагностика
1. Клинические синдромы, сопровождающиеся приливами (постменопаузальный синдром, цирроз печени, идиопатические приливы).
2. При наличии в клинической картине выраженного симпатоадреналового компонента необходим дифференциальный диагноз с феохромоцитомой.
3. Метастазы в печень опухоли неизвестной первичной локализации.
Лечение
♦ Оперативное вмешательство может иметь смысл даже в том случае, если выявляются отдаленные, особенно солитарные, медленно растущие метастазы.
♦ Хемоэмболизация и алкогольная абляция печеночных метастазов.
♦ Антипролиферативная и симптоматическая терапия: препарат выбора - октреотид. Кроме того, эффективны препараты α-интерферона, полихимиотерапия (стрептозотоцин, 5-фторурацил и адриамицин).
Прогноз
Злокачественность карциноидных опухолей сильно варьирует - 5-летняя выживаемость составляет около 50 %. Описаны случаи молниеносного течения, но чаще продолжительность жизни пациентов даже с распространенным метастатическим процессом составляет более 5 лет (описаны случаи выживания до 20 лет и много случаев до 10 лет) и может значительно продлиться на фоне современной антипролиферативной терапии. Наиболее благоприятен прогноз при карциноиде червеобразного отростка, наихудший - при бронхиальном карциноиде.