Эндокринология : учебник. И.И. Дедов - 2009. - 432 с.: ил.
|
|
|
|
ГЛАВА 8 ЗАБОЛЕВАНИЯ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
8.1. АНАТОМИЯ И ФИЗИОЛОГИЯ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Паращитовидные (околощитовидные) железы располагаются на задней поверхности щитовидной железы вне ее капсулы около верхнего и нижнего полюсов, имеют округлую форму, диаметр до 5 мм, массу до 0,5 г. Обычно у человека 2 пары паращитовидных желез (верхние и нижние). Число и локализация паращитовидных желез (ПЩЖ) могут существенно варьировать, доходя иногда до 12 пар. Дополнительные ПЩЖ встречаются в ткани щитовидной и вилочковой желез, в переднем и заднем средостении, в перикарде, позади пищевода, в области бифуркации общей сонной артерии. Кровоснабжение ПЩЖ осуществляется в основном ветвями щитовидной артерии, в связи с чем возможны повреждения этих желез при операциях на щитовидной железе.
Паренхима желез состоит из паратироцитов, среди которых выделяют главные, окрашивающиеся основными красителями, и оксифильные клетки. Главные паратироциты - гормонально-активные клетки, которые подразделяются на светлые клетки, преобладающие у детей, и темные клетки, преобладающие у взрослых. Оксифильные паратироциты («покоящиеся» клетки) появляются в возрасте 10 лет, они гормонально-неактивны.
Основным гормоном ПЩЖ является паратгормон, который образуется в околощитовидных железах из предшественников препропаратгормона и пропаратгормона. Биологическая активность человеческого паратгормона связана с фрагментами 1-29, 1-34 и 53-84 его аминокислотной цепи. В крови гормон циркулирует в трех основных формах: интактный паратгормон с молекулярной массой 9500, биологически активный карбоксильный фрагмент с молекулярной массой 7000-7500, биологически активный фрагмент с молекулярной массой 4000. Образование фрагментов происходит в печени и почках. Действие паратгормона опосредовано аденилатциклазной системой клеток-мишеней.
Паратгормон принимает участие в поддержании гомеостаза кальция, при снижении уровня которого секреция гормона стимулируется, а при повышении - тормозится. При повышенной потребности в кальции функция ПЩЖ усиливается (рис. 8.1).
Воздействуя непосредственно на остеокласты, паратгормон способствует высвобождению солей кальция из костной ткани, при этом в крови возрастает уровень кальция и фосфора. Под влиянием паратгормона увеличиваются число и активность остеокластов в результате непосредственного воздействия его на рецепторы остеобластов, продуцирующих местные тканевые факторы, активирующие клеткипредшественники остеокластов. Эффекты кратковременного и длительного воздействия паратгормона на кость различны: короткое прерывистое действие ведет к костеобразованию, длительное непрерывное - к деструкции. При избытке паратгормона возникает отрицательный костный баланс (уменьшение плотности костной ткани), что сопровождается избыточным выделением оксипролина.
Воздействуя на почечные канальцы, паратгормон понижает реабсорбцию фосфатов, вызывая фосфатурию. Кроме того, косвенно влияние паратгормона на фосфорно-кальциевый обмен связано с его активирующим влиянием на lα-гидроксилазу почечных канальцев,
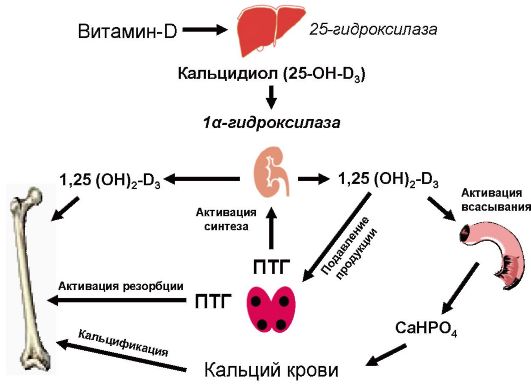 Рис. 8.1. Регуляция обмена кальция
Рис. 8.1. Регуляция обмена кальция
в результате чего 25-оксихолекальциферол превращается в активный 1,25-диоксихолекаль-циферол [1,25-(OH)2-D3, кальцитриол].
Кальцитриол [1,25-(OH)2-D3] действует на резервуары кальция как синергист паратгормона. Его действие в первую очередь направлено на повышение всасывания кальция в кишечнике и усиление его реабсорбции в почечных клубочках. Холекальциферол (витамин D3) образуется в коже (мальпигиев слой эпидермиса) из 7-дегидрохолестерола под действием ультрафиолетовых лучей (рис. 8.2).
Далее холекальциферол связывается с D-связывающим белком и поступает в печень. В печени холекальциферол под действием 25- гидроксилазы превращается в 25-оксихолекальциферол (25-OH-D3) - основную форму, в которой этот витамин циркулирует в кровотоке в связи с тем же D-связывающим белком. В проксимальных извитых почечных канальцах под действием Ια-гидроксилазы 25-окси- холекальциферол гидроксилируется в С1-положении, превращаясь
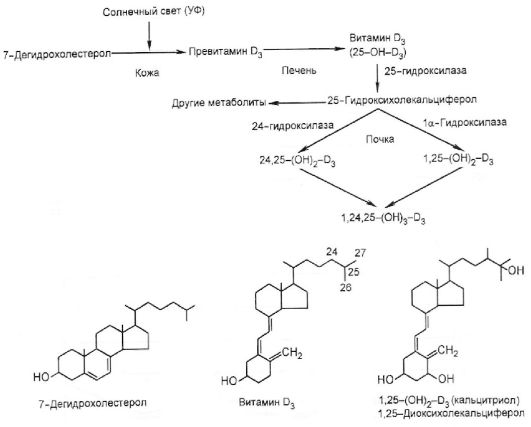 Рис. 8.2. Синтез и метаболизм витамина D3
Рис. 8.2. Синтез и метаболизм витамина D3
в биологически активный 1,25-диоксихолекальциферол [1,25-(OH)2- D3]. Повышение уровня кальцитриола в плазме тормозит активность 1α-гидроксилазы и повышает активность 24-гидроксилазы, что приводит к преимущественному образованию из 25-OH-D3 не 1,25- (OH)2-D3, а побочного продукта - 24,25-(OH)2-D3, который не обладает биологической активностью. Действие 1,25-(OH)2-D3 на клеточном уровне аналогично таковому для других стероидных гормонов.
В регуляции обмена кальция важную роль играет также кальцитонин - гормон, вырабатываемый С-клетками щитовидной железы. Кальцитонин является пептидом, состоящим из 32 аминокислот. Подавляя активность остеокластов, кальцитонин тормозит резорбцию костного матрикса и тем самым вызывает высвобождение кальция и фосфатов. Продукция кальцитонина и паратгормона связана обратной зависимостью. Основным стимулятором секреции кальцитонина является повышение концентрации ионизированного кальция в крови, ингибитором - снижение уровня кальция. Следует заметить, что удаление щитовидной железы (с парафолликулярными клетками) у человека и животных не приводит к гиперкальциемии, а введение кальцитонина здоровым лицам не приводит к снижению уровня кальция в крови.
В норме человек потребляет около 1 грамма кальция в сутки. От 25 до 50 % кальция всасывается при участии 1,25-диоксихолекальцифе- рола. В плазме крови кальций содержится в двух основных формах. Фракция кальция, связанная с альбумином, составляет несколько меньше половины общего количества кальция, определяемого рутинными методами. Биологически активной является фракция свободного (ионизированного) кальция. Гипокальциемия стимулирует синтез паратгормона, который усиливает резорбцию кальция из костной ткани в кровь, экскрецию фосфора с мочой, что позволяет поддерживать нормальное соотношение кальция и фосфора.
Основная масса (99 %) имеющегося в организме кальция находится в костях. Костная ткань представляет собой постоянно обновляющуюся динамическую систему, где в течение всей жизни происходят процессы ремоделирования: разрушение старой кости - костная резорбция и образование новой кости - костеобразование. Костная ткань состоит из клеточных элементов, межклеточного вещества - костного матрикса и минеральных компонентов. В состав костной ткани входят следующие клетки: остеобласты, обладающие способностью к белковому синтезу, остеокласты, рассасывающие костную ткань за
счет лизосомных ферментов; остеоциты - метаболически неактивные клетки, находящиеся в глубоко вмонтированных в кость лакунах; остеоциты происходят из остеобластов, замурованных в собственном костном матриксе.
Процесс ремоделирования кости делится на 5 фаз (рис. 8.3). В здоровом
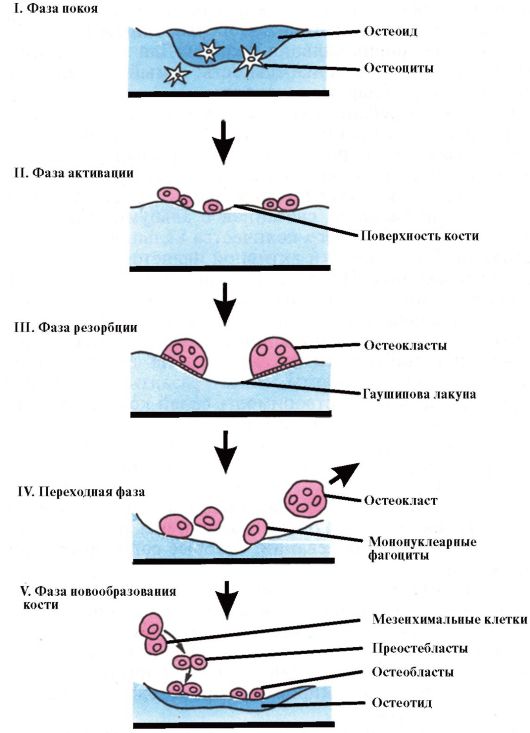 Рис. 8.3. Цикл костного ремоделирования
Рис. 8.3. Цикл костного ремоделирования
взрослом организме в фазе покоя находится до 80 % трабекулярной и 95 % кортикальной костной ткани. Фаза активации, возникающая в каждом участке кости с интервалом 2-3 года, включает в себя пролиферацию и активацию предшественников остеокластов, поступление и прикрепление мультиядерных остеокластов к поверхности резорбируемого участка. Далее следует фаза резорбции, которая продолжается около 1-3 недель. Этот процесс заключается в расплавлении неорганического костного матрикса с последующей деградацией органического, что обеспечивается поступлением в участки резорбции ионов водорода и лизосомных ферментов остеокластов. Переходная фаза длится 1-2 недели, при этом в резорбированной полости появляются остеобласты. Новообразование кости начинается с откладывания остеобластами костного матрикса со скоростью 2-3 мкм в день, который через 5-10 дней минерализуется. Процесс костеобразования длится около 3 месяцев, а полный цикл обновления кости в каждом участке занимает 4-8 мес. Общее обновление кости составляет приблизительно 4-10 % ежегодно.
В среднем пик костной массы формируется к 20 годам, затем наступает период относительного равновесия (плато), а с 35-40 лет начинается возрастная физиологическая потеря массы кости со скоростью 0,3-0,5 % в год. После наступления менопаузы у женщин костные потери ускоряются до 2-5 % в год, продолжаясь в таком темпе до 60-70 лет. Женщины в течение всей жизни в среднем теряют до 35 % кортикальной и около 50 % трабекулярной костной массы. У мужчин потери составляют 15-20% кортикальной кости и 20-30 % трабекулярной.
8.2. МЕТОДЫ ОБСЛЕДОВАНИЯ ПРИ ЗАБОЛЕВАНИЯХ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
8.2.1. Физикальные методы
К ним относят общеклиническое обследование с осмотром костей скелета и пальпацией области шеи, хотя даже крупные паратиромы почти никогда не доступны пальпации. При гипопаратиреозе могут выявлять относительно малоспецифичные симптомы Труссо, Хвостека и Вейса (см. п. 8.5).
8.2.2. Лабораторные методы
Основные методы лабораторной диагностики - определение уровня ионизированного кальция, фосфора и интактного паратгормона в сыворотке. Кроме того, может использоваться определение экскреции
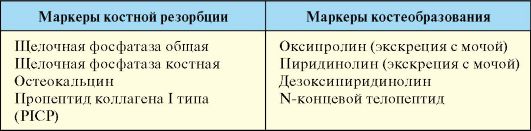
кальция и фосфора с мочой. Определение уровня ионизированного кальция значительно информативнее определения уровня общего кальция, на котором может отразиться уровень альбумина, рН сыворотки и ряд других факторов. С целью оценки состояния костного ремоделирования используют оценку сывороточных маркеров костной резорбции и костеобразования, которые позволяют косвенно оценить состояние костной ткани, риск развития и эффективность терапии остеопороза (табл. 8.1).
Табл. 8.1. Сывороточные маркеры костной резорбции и костеобразования
 8.2.3. Инструментальные методы
8.2.3. Инструментальные методы
УЗИ является наиболее простым методом визуализации ПЩЖ, но они обычно выявляются только при значительном увеличении. С целью топической диагностики паратиром используют сцинтиграфию с технетрилом.
Основным методом изучения костей скелета остается рентгенография, тем не менее, она обладает низкой чувствительностью в плане диагностики остеопороза, т.к. выявляет последний уже на значительно выраженной стадии (при потере до 20-30 % костной ткани). Для ранней диагностики остеопороза используют костную денситометрию, которая позволяет выявить потерю уже 2-5 % массы кости, оценить динамику плотности костной ткани в процессе развития заболевания или лечения. Применяют изотопные методы (моно- и двухфотонная абсорбциометрия), рентгеновские (моно- и двухэнергетическая абсорбциометрия, количественная компьютерная томография) и ультразвуковые методы. С помощью монофотонной, моноэнергетической и ультразвуковой денситометрии исследуют периферические отделы скелета (лучевая, малоберцовая, пяточная кость), что удобно для скрининга или предварительной диагностики. Наиболее универсальной является двухэнергетическая рентгеновская абсорбциометрия (DEXA), позволяющая измерять минеральную плотность кости
в любом участке скелета. Для таких денситометров разработаны стандартные (автоматические) программы для поясничных позвонков, проксимальных отделов бедра, костей предплечья и программа «все тело». Наряду с абсолютными показателями плотности кости при денситометрии автоматически вычисляют Z-критерий (минеральная плотность костной ткани относительно средних значений для данного возраста и пола) и Т-критерий (сравнение плотности кости с пиковыми значениями в возрасте 30 лет). При тяжелых остеопенических процессах неясного происхождения важную роль в дифференциальной диагностике играет биопсия костной ткани, которая позволяет различить остеопороз и остеомаляцию, а также другие виды патологии костной ткани.
8.3. ПЕРВИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
Первичный гиперпаратиреоз (ПГП) - заболевание ПЩЖ, проявляющееся избыточной продукцией паратгормона с развитием синдрома гиперкальциемии (табл. 8.2).
Табл. 8.2. Первичный гиперпаратиреоз
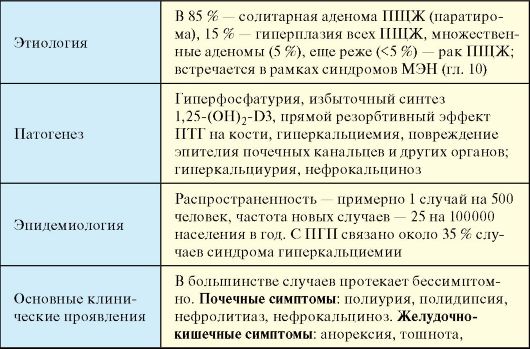 Окончание табл. 8.2
Окончание табл. 8.2
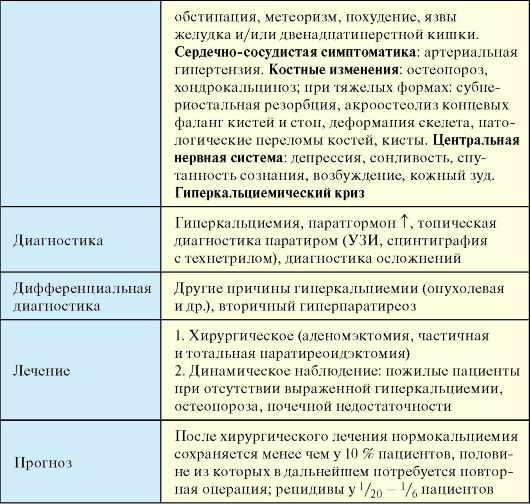 Этиология
Этиология
В 85 % случаев причиной ПГП является солитарная аденома ПЩЖ (паратирома), значительно реже - аденомы множественные (5 %), еще реже (< 5%) - рак ПЩЖ. Гиперплазия всех ПЩЖ встречается примерно у 15 % больных. ПГП встречается при обоих вариантах синдрома множественных эндокринных неоплазий (см. гл. 10).
Патогенез
Гиперпродукция паратгормона приводит к избыточному выведению через почки фосфата. Снижение плазменного уровня последнего стимулирует синтез 1,25-(OH)2-D3, который способствует всасыванию
избытка Са2+ в кишечнике. В далеко зашедших стадиях процесса гиперкальциемия усиливается за счет активации избытком паратгормона остеокластов. Избыток паратгормона приводит к ускорению обмена в костной ткани, ускорению костной резорбции и костеобразования, но образование новой кости отстает от ее рассасывания, что приводит к генерализованному остеопорозу и остеодистрофии, вымыванию кальция из костных депо и гиперкальциемии, а также гиперкальциурии, способствующей повреждению эпителия почечных канальцев и образованию камней в почках. Нефрокальциноз, в свою очередь, ведет к снижению функции почек. В возникновении язвенного поражения желудка и двенадцатиперстной кишки важную роль играют гиперкальциемия с артериолосклерозом и кальцификацией сосудов. Гиперкальциемия наряду с повышением артериального давления создает предпосылки для формирования гипертрофии левого желудочка, функцию которого также ухудшают типичные для гиперпаратиреоза клапанные, коронарные и миокардиальные кальцинаты.
Эпидемиология
Распространенность ПГП составляет примерно 1 случай на 500 человек, частота новых случаев - порядка 25 на 100000 населения в год. С ПГП связано около 35 % случаев синдрома гиперкальциемии (гиперкальциемия регистрируется у взрослых в 0,5-1,1 % случаев, чаще у женщин старше 50 лет; среди госпитализированных лиц - в 5 %). После сахарного диабета и заболеваний щитовидной железы ПГП является третьим по распространенности эндокринным заболеванием. Пик заболеваемости приходится на 40-50 лет, при этом ПГП в 2 раза чаще встречается у женщин, в частности у 3 % женщин в постменопаузе. ПГП выявляется примерно у 2-5 % всех пациентов с мочекаменной болезнью.
Клинические проявления
У большинства пациентов ПГП протекает бессимптомно и диагноз устанавливается при обследовании по поводу гиперкальциемии.
1. Почечные симптомы включают полиурию, полидипсию, нефролитиаз (25 %), часто осложняющийся пиелонефритом; редко - нефрокальциноз с развитием почечной недостаточности.
2. Желудочно-кишечная симптоматика: анорексия, тошнота, обстипация, метеоризм, похудение. В 10 % случаев развиваются язвы желудка и/или двенадцатиперстной кишки, в 10 % - панкреатит, реже пан-
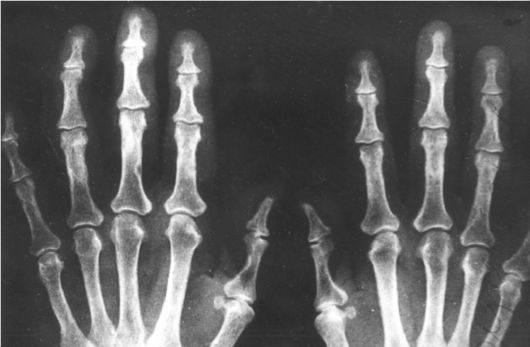 Рис. 8.4. Рентгенограмма кистей при первичной гиперпаратиреозе: признаки субпериостальной резорбции концевых фаланг
Рис. 8.4. Рентгенограмма кистей при первичной гиперпаратиреозе: признаки субпериостальной резорбции концевых фаланг
креакалькулез. В 2 раза чаще, чем в популяции, встречается желчнокаменная болезнь.
3. Сердечно-сосудистая симптоматика: артериальная гипертензия и ее осложнения.
4. Костные изменения: остеопороз, хондрокальциноз; при тяжелом ПГП: субпериостальная резорбция, акроостеолиз концевых фаланг кистей и стоп (рис. 8.4), деформация скелета, патологические переломы костей (рис. 8.5), кисты, гигантоклеточные опухоли и эпулиды (кистозные образования).
5. Центральная нервная система: депрессия, сонливость, спутанность сознания, возбуждение, кожный зуд.
6. Гиперкальциемический криз - весьма редкое тяжелое осложнение ПГП. Характерны сонливость, ступор, кома, психоз, вслед за нарастающей анорексией, рвотой, болью в эпигастрии; быстро развивается резкая слабость, обезвоживание, ану-
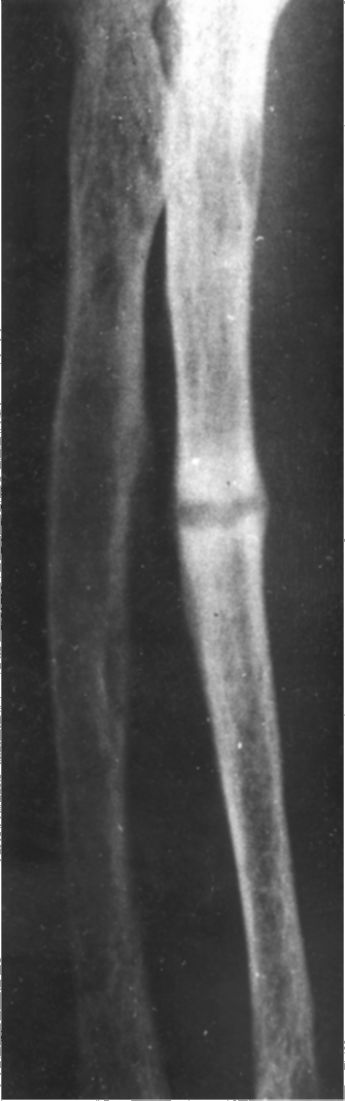 Рис. 8.5. Рентгенограмма костей голени с кистами и псевдопереломами при первичном гиперпаратиреозе
Рис. 8.5. Рентгенограмма костей голени с кистами и псевдопереломами при первичном гиперпаратиреозе
 Рис. 8.6. Сцинтиграфия с технетрилом при солитарной паратироме
Рис. 8.6. Сцинтиграфия с технетрилом при солитарной паратироме
рия, коматозное состояние; тяжелое осложнение - миопатия с вовлечением проксимальных отделов туловища, межреберных мышц и диафрагмы; типична лихорадка до 38-39 °С. Криз развивается при уровне кальция в плазме более 4 ммоль/л и провоцируется длительным постельным режимом, тиазидными диуретиками, препаратами кальция и витамина D.
Диагностика
♦ Гиперкальциемия, как правило, выявляется у лиц без какойлибо симптоматики при рутин-
ном биохимическом анализе крови. Кроме того, характерны гипофосфатемия, гиперкальциурия и гиперфосфатурия, повышение уровня щелочной фосфатазы в плазме и экскреции с мочой гидроксипролина и цАМФ.
♦ Повышенный уровень паратгормона. Исследование показано при двукратно зарегистрированной гиперкальциемии.
♦ Топическая диагностика паратиром: УЗИ, сцинтиграфия с технетрилом, КТ, МРТ (область шеи и средостения).
♦ Диагностика осложнений ПГП: остеопороз, нефрокальциноз и др.
Дифференциальная диагностика
1. Гиперкальциемия другого генеза:
- злокачественные опухоли (множественная миелома, рак молочной железы, костные метастазы); уровень ПТГ, как правило, снижен;
- передозировка витамином D;
- саркоидоз и другие гранулематозные заболевания;
- редкие причины (тиреотоксикоз, прием тиазидных диуретиков, иммобилизация, болезнь Аддисона, передозировка витамином А, почечная недостаточность);
2. Вторичный гиперпаратиреоз (протекает на фоне нормокальциемии).
3. Скрининговое исследование для исключения синдромов множественных эндокринных неоплазий (см. гл. 10).
Лечение
Подходы к лечению определяются выраженностью ПГП, возрастом и физическим состоянием пациента, поскольку единственным радикальным вариантом лечения является хирургическое вмешательство.
1. Хирургическое лечение: при солитарной паратироме - ее удаление, при гиперплазии нескольких ПЖЩ проводится парциальная, либо тотальная паратиреоидэктомия с последующей терапией гипопаратиреоза.
2. Динамическое наблюдение проводится при выявлении легкой выраженности ПГП у лиц пожилого возраста, т.е. В той возрастной группе, где ПГП чаще всего встречается. Оно допустимо в ситуациях отсутствия абсолютных показаний к оперативному лечению (табл. 8.3). Динамическое наблюдение подразумевает определение уровня кальция, функции почек, артериального давления каждые 6-12 месяцев, проведение костной денситометрии и УЗИ почек каждые 2-3 года.
Табл. 8.3. Показания к хирургическому лечению ПГП
 3. Медикаментозное лечение не
разработано. Препаратами выбора для лечения остеопороза являются
бисфосфонаты, которые оказывают транзиторное гипокальциемическое
действие. Их же в сочетании с регидратационной терапией используют при
лечении гиперкальциемического криза.
3. Медикаментозное лечение не
разработано. Препаратами выбора для лечения остеопороза являются
бисфосфонаты, которые оказывают транзиторное гипокальциемическое
действие. Их же в сочетании с регидратационной терапией используют при
лечении гиперкальциемического криза.
Прогноз
После хирургического лечения того или иного объема нормокальциемия сохраняется менее чем у 10 % пациентов, половине из которых
в дальнейшем требуется повторная операция. Рецидивы ПГП развиваются у 1/20 пациентов, прооперированных по поводу солитарной паратиромы и у 1/6 - по поводу гиперплазии ПЩЖ.
8.4. ВТОРИЧНЫЙ ГИПЕРПАРАТИРЕОЗ
Вторичный гиперпаратиреоз (ВГП) представляет собой компенсаторную гиперфункцию и гиперплазию ПЩЖ, развивающуюся при длительной гипокальциемии и гиперфосфатемии различного генеза (табл. 8.4). При третичном гиперпаратиреозе происходит развитие автономной гиперпродукции паратгормона гиперплазированными ПЩЖ или формирование аденомы ПЩЖ при длительно существующем вторичном гиперпаратиреозе.
Этиология
♦ Почечная патология: хроническая почечная недостаточность, тубулопатии, почечный рахит.
♦ Кишечная патология: синдром мальабсорбции.
♦ Костная патология: остеомаляция (сенильная, пуэрперальная, идиопатическая), болезнь Педжета.
♦ Недостаточность витамина D: заболевания почек, заболевания печени, наследственные ферментопатии.
♦ Злокачественные заболевания: миеломная болезнь.
Основными причинами ВГП являются почечная недостаточность и болезни системы пищеварения. В соответствии с этим выделяют почечный и интестинальный ВГП. В связи с широким использованием гемодиализа и увеличением продолжительности жизни больных с ХПН ВГП стал встречаться значительно чаще.
Патогенез
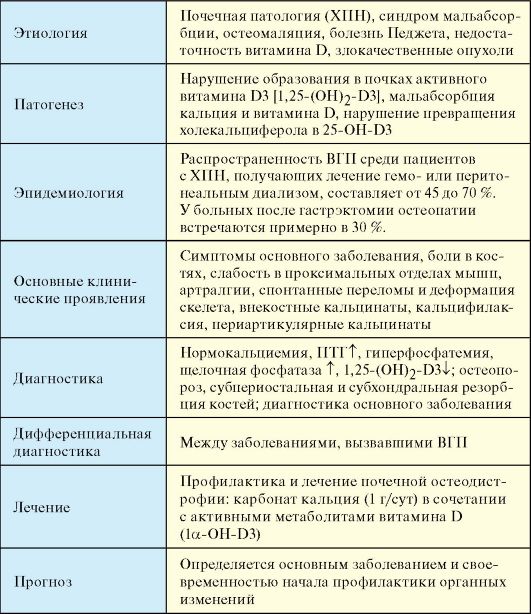
Развитие ВГП при ХПН связано с нарушением образования в почках активного витамина D3 [1,25-(OH)2-D3J. Прогрессирующее увеличение плазменного уровня неорганического фосфора начинается уже при снижении скорости клубочковой фильтрации до 60 мл/мин и менее. Гипокальциемия стимулирует секрецию паратгормона. Почечная остеодистрофия представляет собой комбинацию остеомаляции, развивающейся при дефиците 1,25-(OH)2-D3, и повышенной костной резорбции в результате гиперпродукции паратгормона (рис. 8.7).
Табл. 8.4. Вторичный гиперпаратиреоз
 В основе патогенеза интестинальной формы ВГП лежит мальабсорбция кальция и витамина D, которая приводит к гиперстимуляции ПЩЖ. При заболеваниях печени развитие ВГП связано с нарушением превращения холекальциферола в 25-OH-D3. Наиболее часто это происходит при первичном билиарном циррозе. Патогенез третичного
В основе патогенеза интестинальной формы ВГП лежит мальабсорбция кальция и витамина D, которая приводит к гиперстимуляции ПЩЖ. При заболеваниях печени развитие ВГП связано с нарушением превращения холекальциферола в 25-OH-D3. Наиболее часто это происходит при первичном билиарном циррозе. Патогенез третичного
 Рис. 8.7. Патогенез почечной остеодистрофии
Рис. 8.7. Патогенез почечной остеодистрофии
гиперпаратиреоза связан с постепенным формированием автономии гиперфункционирующих ПЩЖ.
Эпидемиология
К моменту перевода пациентов на гемодиализ гистологические изменения той или иной степени выявляются в костной ткани у 90 % пациентов. Распространенность ВГП среди пациентов с ХПН, получающих лечение гемоили перитонеальным диализом, составляет от 45 до 70 %. У 60 % пациентов с уровнем креатинина от 150 до 400 мкмоль/л уровень интактного паратгормона превышает 200 пг/мл (норма 10-65 пг/мл). У больных после гастрэктомии остеопатия встречаются примерно в 30 % случаев.
Клинические проявления
Доминируют симптомы основного заболевания, чаще всего ХПН. Специфическими симптомами являются боли в костях, слабость в проксимальных отделах мышц, артралгии. Могут возникать спонтанные переломы и деформация скелета. Образование внекостных
кальцинатов имеет различные клинические проявления. При кальцификации артерий могут развиваться ишемические изменения (кальцифилаксия). На руках и ногах могут быть выявлены периартикулярные кальцинаты. Кальцификация конъюнктивы и роговицы в сочетании с рецидивирующим конъюнктивитом обозначается как синдром «красного глаза».
Диагностика
1. Нормокальциемия в сочетании с повышенным уровнем ПТГ. Кроме того, характерна гиперфосфатемия, высокий уровень щелочной фосфатазы, низкий уровень 1,25-(OH)2-D3. Определение уровня ПТГ рекомендуется при нефропатии любого генеза со снижением скорости клубочковой фильтрации менее 60 %.
2. Костные изменения сходны с таковыми при ПГП (остеопороз, субпериостальная и субхондральная резорбция костей кисти и пр.).
3. Диагностика основного заболевания (ХПН, мальабсорбция).
Дифференциальная диагностика
Между заболеваниями, вызвавшими ВГП.
Лечение
При хронической почечной недостаточности профилактика остеопатии показана при повышении уровня неорганического фосфора в плазме более 1,5 ммоль/л. С этой целью назначают активные метаболиты витамина D (1α-ОН-D3: 0,25 - 0,5 мкг/день), при тенденции к гипокальциемии - в сочетании с препаратами кальция (1 г/день). При трехкратном повышении уровня ПТГ и/или повышении уровня кальция крови более 2,6-2,7 ммоль/л показана субтотальная паратиреоидэктомия.
Прогноз
Определяется основным заболеванием и своевременностью начала профилактики органных изменений (препараты витамина D при
ХПН).
8.5. ГИПОПАРАТИРЕОЗ
Гипопаратиреоз - заболевание, связанное с дефицитом паратгормона в результате недостаточности ПЩЖ, проявляющееся синдромом гипокальциемии (табл. 8.5).
Табл. 8.5. Гипопаратиреоз
 Этиология
Этиология
♦ Послеоперационный гипопаратиреоз.
♦ Идиопатический (аутоиммунный) гипопаратиреоз:
- изолированный;
- при аутоиммунном полигландулярном синдроме 1-го типа (см. гл. 10).
♦ Облучение, инфильтративные заболевания.
♦ Аплазия ПЩЖ и тимуса (синдром Di George).
Наиболее частой формой является послеоперационный гипопаратиреоз. При этом он развивается не столько в результате удаления
желез, сколько за счет нарушения их кровоснабжения связи с возникновением фиброза клетчатки в зоне оперативного вмешательства. Идиопатический гипопаратиреоз является очень редким заболеванием. Им обычно манифестирует аутоиммунный полигландулярный синдром 1-го типа (см. гл. 10). Крайне редким заболеванием, при котором встречается гипопаратиреоз, является синдром Ди Джорджи (Di George): сочетание агенезии ПЩЖ с аплазией тимуса и врожденными пороками сердца. Другой редкой причиной гипопаратиреоза является разрушение ПЩЖ опухолевой инфильтрацией в области шеи, а также при гемохроматозе и амилоидозе.
Патогенез
Дефицит паратгормона приводит к повышению уровня фосфора в крови, а также к гипокальциемии, обусловленной снижением всасывания кальция в кишечнике, уменьшением его мобилизации из костей и недостаточной реабсорбцией в почечных канальцах, что отчасти связано с уменьшением синтеза в почках 1,25(OH)2D3, продукция которого контролируется паратгормоном. Гипокальциемия и гиперфосфатемия приводят к универсальному нарушению проницаемости клеточных мембран и к повышению нервно-мышечной возбудимости и судорожной готовности, вегетативной лабильности, а также к отложению солей кальция во внутренних органах и стенках крупных сосудов.
Эпидемиология
Распространенность гипопаратиреоза в общей популяции составляет 0,2-0,3 %. У хирургов, часто оперирующих на щитовидном железе, это осложнение развивается в 2 % случаев, а при повторных операциях - в 5-15 %.
Клинические проявления
1. Тетания (тетанический приступ) проявляется парестезиями и фибриллярными подергиваниями, переходящими в болезненные тонические судороги, протекающие при сохраненном сознании, симметрично вовлекающие сгибатели конечностей («рука акушера», «конская стопа»), лицевые мышцы («рыбий рот»), реже разгибатели спины (опистотонус). Характерны, но неспецифичны для гипопаратиреоза симптомы Хвостека (сокращение мимической мускулатуры при постукивании в месте выхода лицевого нерва), Труссо (появление «руки акушера» через 2-3 мин после сдавления плеча манжеткой тонометра) и Вейса (поколачивание у наружного края глазницы
вызывает сокращение круговой мышцы глаза). Спазмы гладкой мускулатуры проявляются ларинго- и бронхоспазмом, дисфагией, рвотой, поносом, запором. Из вегетативных проявлений для гипопаратиреоза характерны жар, озноб, сердцебиения, боли в области сердца. Эквивалентами тетанических судорог могут быть эпилептические припадки.
2. Трофические нарушения и внекостная кальцификация: нарушение роста волос и ногтей, дефекты зубной эмали, сухость кожи, катаракта, кальцификация базальных ганглиев, которая клинически может проявиться экстрапирамидной симптоматикой с хореоатетозом или паркинсонизмом.
Диагностика
Гипокальциемия, гиперфосфатемия, сниженный уровень ПТГ в крови (для пациентов после оперативных вмешательств на щитовидной железе в анамнезе - необязательное исследование).
Дифференциальная диагностика
♦ Транзиторный (обычно не более 4-х недель) гипопаратиреоз после операций на щитовидной железе в результате обратимого нарушения кровоснабжения ПЩЖ. Если после операции гипокальциемия в сочетании с низким уровнем паратгормона сохраняется более 12 недель, можно говорить о развитии стойкого послеоперационного гипопаратиреоза. На это время пациенту назначаются препараты кальция, при необходимости в комбинации с препаратами витамина D.
♦ Другие заболевания, протекающие с судорожным синдромом: эпилепсия, истерия, гипервентиляционный синдром, спазмофилия, гипогликемия и др.
♦ Другие заболевания, протекающие с гипокальциемией: тяжелая соматическая патология, острый панкреатит, тяжелый дефицит витамина D, почечная недостаточность, прием ряда лекарственных препаратов (цисплатин, кальцитонин, фосфаты), многократные переливания крови (связывание кальция избытком цитрата).
Лечение
1. Гипокальциемический криз. 20 мл 10 % раствора глюконата кальция, разведенного в 100-200 мл физиологического раствора или 5% раствора глюкозы внутривенно, в течение 10 минут. При повторении (сохранении) симптоматики введение глюконата кальция повторяется.
2. Поддерживающая терапия включает назначение 1,0-1,5 г элементарного кальция в день (в виде кальция карбоната). У большинства пациентов монотерапия препаратами кальция не позволяет компенсировать ГПТ (поддерживать нормальный уровень кальция в крови). В связи с этим назначаются препараты витамина D: дигидротахистерол (0,5-2 мг в день; 12-40 капель), холекальциферол (25000-75000 ME); 1α-OH-D3 (2-4 мкг в день), 1,25(ОН)2D3 (1-3 мкг в день).
Прогноз
Как правило, благоприятный.
8.6. ОСТЕОПОРОЗ
Остеопороз - системное заболевание скелета, характеризующееся снижением массы кости в единице объема и нарушением микроархитектоники костной ткани, приводящим к увеличению хрупкости костей и высокому риску их переломов (табл. 8.6). Наряду с термином остеопороз используется термин остеопения, имеющий двоякий смысл. Во-первых, так обозначается любое снижение минеральной плотности кости, во-вторых, ситуация, при которой по данным костной денситометрии критерий «Т» оказывается в пределах от -1 до -2,5.
Табл. 8.6. Остеопороз
 Окончание табл. 8.8
Окончание табл. 8.8
 Этиология
Этиология
По этиологии остеопороз может быть первичным, который подразделяется на постменопаузальный, сенильный, ювенильный, идиопатический, и вторичным, или симптоматическим, т.е. обусловленным каким-то конкретным заболеванием (рис. 8.8). Основные факторы риска остеопороза представлены в табл. 8.7.
Табл. 8.7. Факторы риска развития остеопороза

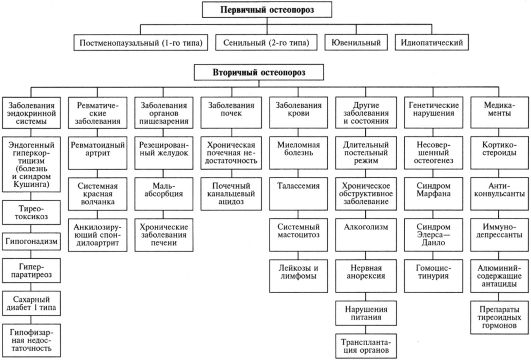 Рис. 8.8. Этиология остеопороза
Рис. 8.8. Этиология остеопороза
Патогенез
При остеопорозе с высоким костным обменом резорбция кости не компенсируется нормальным или повышенным костеобразованием, а при остеопорозе с низким костным обменом скорость резорбции кости нормальна или снижена, а темп костеобразования замедлен. Обе формы могут проявляться как различные стадии остеопоротического процесса у одного больного. В патогенезе постменопаузального остеопороза пусковым фактором является эстрогенная недостаточность, резко ускоряющая потери костной массы. На остеобластах имеются рецепторы эстрогенов, а дефицит последних способствует продукции остеобластами фактора, стимулирующего и дифференцировку, и активность остеокластов, что обусловливает повышенную резорбцию кости. В патогенезе сенильного остеопороза наряду с дефицитом половых стероидов и кальцитонина большое значение придают отрицательному кальциевому балансу, обусловленному дефицитом витамина D и сниженной абсорбции кальция в кишечнике, что в итоге приводит к развитию вторичного гиперпаратиреоза и повышенной резорбции костной ткани. Нарушение обмена витамина D вызывается как уменьшением инсоляции вследствие снижения пребывания на улице, так и нарушением образования его активных форм из-за дефицита половых гормонов. Избыточная или недостаточная секреция большинства гормонов в любом возрасте ведет к остеопорозу (гиперпаратиреоз, тиреотоксикоз, синдром Кушинга и др.). Избыток глюкокортикоидов подавляет костеобразование, при этом снижается всасывание кальция в кишечнике и повышается экскреция его почками, что создает отрицательный кальциевый баланс, приводит к вторичному гиперпаратиреозу и повышенной костной резорбции. Механизм развития остеопороза при гипогонадизме у женщин в репродуктивном периоде сходен с таковым при постменопаузе.
Для постменопаузального, стероидного и гипогонадного остеопороза характерны преимущественные потери трабекулярной костной ткани (переломы тел позвонков, ребер, лучевой кости в типичном месте). Преимущественное поражение кортикальной костной ткани свойственно сенильному остеопорозу, гиперпаратиреозу и тиреотоксикозу (переломы трубчатых костей, шейки бедра).
Эпидемиология
Более половины всех переломов костей среди взрослых может быть связано с остеопорозом. Распространенность переломов костей у женщин примерно в 2 раза выше, чем у мужчин. Каждая третья женщина
после наступления менопаузы и более половины всех лиц в возрасте 75-80 лет имеют остеопороз. В РФ остеопороз выявлен у 30 % женщин и 22% мужчин в возрасте старше 50 лет. Затраты здравоохранения США на лечение остеопоротических переломов составляют 7-10 млрд. долларов в год при населении 250 млн. человек.
Клинические проявления
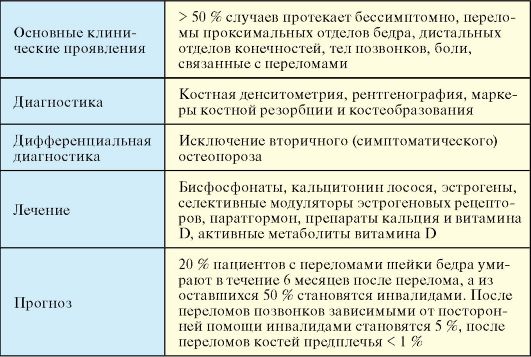
♦ Более чем в 50 % случаев протекает бессимптомно или малосимптомно и выявляется лишь при наличии переломов костей, которые могут иметь любую локализацию.
♦ Переломы проксимальных отделов бедра и дистальных отделов костей предплечья.
♦ Переломы тел позвонков, боли в спине, нарушение функции и деформация позвоночника (уменьшение роста, горб, нарушение походки).
Диагностика
Основным методом диагностики остеопороза и оценки минеральной плотности костной ткани является костная денситометрия, меньшее значение имеет традиционная рентгенография (см. п. 8.2.3). Если критерий «Т» по данным денситометрии оказывается меньше -2,5, устанавливается диагноз остеопороза; в том случае если критерий «Т» меньше -1,0, но больше -2,5 - речь идет об остеопении. Костная денситометрия показана:
- Женщинам в постменопаузе после 65 лет независимо от наличия дополнительных факторов риска.
- Женщинам в постменопаузе моложе 65 лет при наличии дополнительных факторов риска (табл. 8.7).
- Мужчинам в возрасте 70 лет и старше.
- Взрослым с переломами при минимальной травме в анамнезе.
- Взрослым с заболеваниями и состояниями, приводящими к снижению костной массы, особенно женщинам старше 45 лет и мужчинам старше 65 лет.
- Взрослым, принимающим препараты, снижающие костную массу.
- С целью мониторинга эффективности лечения остеопороза.
Для оценки уровня костного метаболизма с целью выбора и оценки эффективности терапии остеопороза могут использоваться маркеры костной резорбции и костеобразования (табл. 8.1).
Дифференциальная диагностика
Ее целью является исключение вторичного остеопороза, при котором помимо симптоматического возможно этиотропное лечение приведщего к нему основного заболевания (рис. 8.8). Большинству пациентов с остеопорозом необходимо проведение исследований: общего и биохимического анализа крови, функции почек и печени, уровня ионизированного кальция и фосфора, ТТГ, тестостерона (только у мужчин). В зависимости от данных клинической картины проводятся другие необходимые исследования.
Лечение
При остеопорозе применяют препараты нескольких групп:
1. Бисфосфонаты (алендронат, ибандроновая кислота) существенно снижают риск переломов позвоночника, бедренной кости и костей запястья. Механизм их действия заключается в подавлении активности остеокластов, уменьшении опосредованной остеокластами резорбции костной ткани.
2. Кальцитонин лосося (миакальцик) помимо антирезорбтивной активности, связанной с воздействием на специфические рецепторы остеокластов, обладает анальгетическим эффектом и способствует уменьшению болей при переломах костей.
3. Заместительная терапия эстрогенами у женщин в постменопаузе может использоваться как для профилактики, так и для лечения остеопороза (см. п. 5.4).
4. Селективные модуляторы эстрогеновых рецепторов (ралоксифен) в одних тканях проявляют себя как агонисты эстрогенов (костная ткань), в других - как антагонисты (эндометрий, молочная железа); используются для лечения остеопороза у женщин в постменопаузе.
5. Терипаратид - N-терминальный фрагмент паратгормона человека, усиливает костеобразование за счет влияния на активность остеобластов.
6. Препараты кальция (преимущественно карбонат), витамина D и активные метаболиты витамина D (α-кальцидиол, кальцитриол) используются в комбинации с перечисленными выше препаратами в комплексной терапии остеопороза.
Прогноз
У женщины в возрасте 55 лет шанс перелома, связанного с остеопорозом, на протяжении последующей жизни составляет 1/3, для мужчины этого возраста - 1/12/ Около 20 % пациентов с переломами шейки
бедра умирает в течение 6 месяцев после перелома, а из оставшихся 50 % становятся инвалидами. После переломов позвонков зависимыми от посторонней помощи инвалидами становятся 5 % пациентов, после переломов костей предплечья - менее 1 %.