Эндокринология : учебник. И.И. Дедов - 2009. - 432 с.: ил.
|
|
|
|
ГЛАВА 4 ЗАБОЛЕВАНИЯ НАДПОЧЕЧНИКОВ
4.1. АНАТОМИЯ И ФИЗИОЛОГИЯ НАДПОЧЕЧНИКОВ
Надпочечник - парная железа внутренней секреции, расположенная в забрюшинном пространстве над верхним полюсом почки. Располагаются надпочечники на уровне XI-XII грудных позвонков (рис. 4.1).
Надпочечники состоят из двух морфофункционально самостоятельных эндокринных желез - мозгового и коркового веществ, имеющих различное эмбриональное происхождение. Корковое вещество диффе-
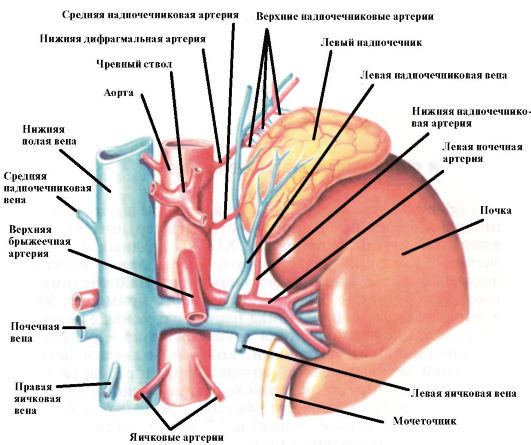 Рис. 4.1. Надпочечники
Рис. 4.1. Надпочечники
ренцируется из интерреналовой ткани, которая представляет собой часть мезодермы, расположенной между двумя первичными почками. Мозговое вещество имеет общее происхождение с нервной системой, развиваясь из симпатобластов, которые, выселяясь из симпатического ствола, внедряются в интерреналовое тело. Аналогичное происхождение имеет экстраадреналовая хромаффинная ткань, к которой относятся параганглии и бифуркационные хромаффинные тельца.
Гистологически в коре надпочечника, на долю которой приходится 80-90 % ткани всего органа, выделяют 3 зоны. Непосредственно под капсулой располагается клубочковая зона, секретирующая альдостерон. К ней прилежит пучковая зона, основными продуктами которой являются глюкокортикоидные гормоны. Самая внутренняя зона - сетчатая, которая в основном секретирует андрогены (рис. 4.2).
Из коры надпочечника выделено около 50 различных стероидов, большинство из которых является промежуточными продуктами синтеза активных гормонов. Стероидные гормоны практически не
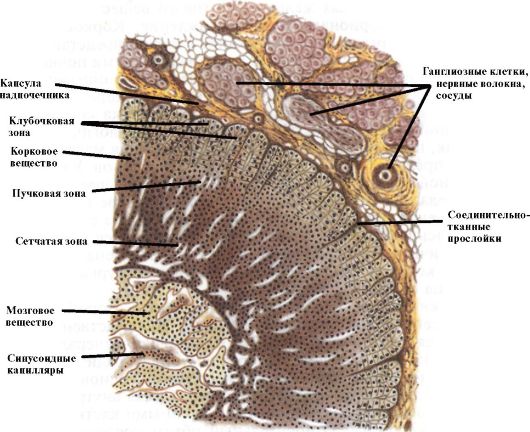 Рис. 4.2. Гистологическое строение надпочечника
Рис. 4.2. Гистологическое строение надпочечника
накапливаются в клетках коры надпочечника, а сразу поступают в кровь по мере синтеза. В соответствии с преобладающим действием на метаболизм гормоны коры надпочечника (кортикостероиды) подразделяют на три основных класса: минералокортикоиды, глюкокортикоиды и андрогены.
Кортикостероиды, как и другие стероидные гормоны, синтезируются из холестерина. Первой реакцией в синтезе стероидных гормонов является конверсия холестерина (С27-стероид) в прегненолон (С21-стероид) путем отщепления 6-й углеродной группы. Ферментный комплекс, катализирующий его, обозначается как P450scc, т.е. фермент отщепления боковой цепи (англ. side chain cleavage enzyme), или 20,22-десмолаза. В дальнейшем происходит последовательное гидроксилирование стероидного ядра с образованием большого числа стероидных гормонов (рис. 4.3).
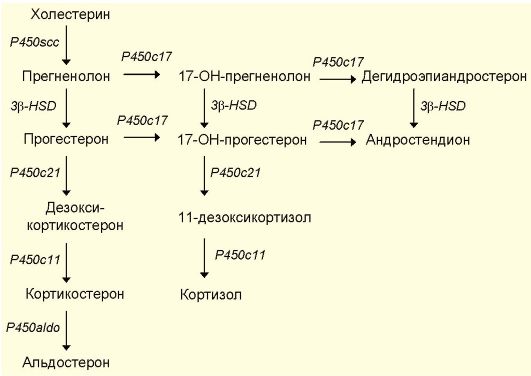 Рис. 4.3. Схема биосинтеза кортикостероидов. Международные названия ферментов:
Рис. 4.3. Схема биосинтеза кортикостероидов. Международные названия ферментов:
P450scc - фермент отщепления боковой цепи (20,22-десмолаза); P450c17 - 17а-гидроксилаза и С20-22-лиаза; 3β-ΗSD - 3β-гидроксистероиддегидрогеназа и Δ5,4-изомераза; P450c21 - 21-гидроксилаза; P450c11 - 11β-гидроксилаза; P450aldo - альдостеронсинтетаза
Аналогичным образом стероидогенез происходит в яичках и яичниках. Специфика направленности стероидогенеза определяется различной экспрессией в этих органах генов гидроксилаз. В клубочковой зоне отсутствует фермент Р450с17 (17а-гидроксилаза/С20-22-лиаза), что делает невозможным синтез в ней кортизола и андрогенов. Фермент Р450с11 присутствует только в клубочковой зоне, что делает невозможным синтез альдостерона в пучковой и сетчатой зонах. Действие кортикостероидов, как и других стероидных гормонов, опосредовано внутриклеточными рецепторными белками, которые представляют собой факторы транскрипции, меняющие экспрессию различных генов.
Кора надпочечника в функциональном плане может быть разделена на 2 части: АКТГ - независимую клубочковую зону и зависимые от АКТГ пучковую и сетчатую зоны. Секреция альдостерона клубочковой зоной коры надпочечников регулируется системой ренин-ангиотензин-альдостерон, автономно от эффектов АКТГ аденогипофиза. АКТГ влияет только на начальные стадии биосинтеза минералокортикоидов. При выпадении секреции АКТГ клубочковая зона, функционирующая автономно (в отличие от пучковой и сетчатой), атрофии не подвергается. Именно с этим связано более мягкое течение вторичной надпочечниковой недостаточности по сравнению с первичной, при которой разрушаются все зоны коры надпочечника.
Для пучковой и сетчатой зон, которые являются частью гипоталамо-гипофизарно-надпочечниковой системы, основным секреторным и трофическим стимулятором является адренокортикотропный гормон (АКТГ), выделение которого регулируется кортикотропинрилизинг-гормоном (КРГ) по принципу отрицательной обратной связи. Суточная динамика плазменной концентрации кортизола определяется циркадным ритмом секреции АКТГ. Максимальных значений уровни обоих гормонов достигают к 6 ч утра, минимальных - в 20-24 ч. Предшественником АКТГ является крупный белок проопиомеланокортин (ПОМК), при расщеплении молекулы которого образуются АКТГ, меланоцитостимулирующий гормон (МСГ) и β-липотропный гормон (β-ЛПГ).
• Кора надпочечника является жизненно важным органом, что преимущественно определяют две основные функции: Задержка в организме натрия и поддержание физиологической
осмолярности внутренней среды обеспечивается альдостероном.
• Адаптация организма к стрессовым факторам внешней среды (весь комплекс воздействий на организм: от инфекционных и травмирующих агентов до эмоциональных стрессов) обеспечивается глюкокортикоидами, основным представителем которых у человека является кортизол (гидрокортизон).
Функцией системы ренин-ангиотензин-альдостерон является регуляция гомеостаза воды, электролитов и поддержание системного артериального давления. Ангиотензин II, который сам по себе является наиболее мощным физиологическим вазоконстриктором, стимулирует синтез альдостерона, главным органом-мишенью которого является почка, где он усиливает реабсорбцию натрия в дистальных извитых канальцах и собирательных трубочках (рис. 4.4).
Глюкокортикоиды оказывают многостороннее действие на обмен веществ. С одной стороны, активируя печеночный глюконеогенез, а с другой, стимулируя высвобождение аминокислот - субстратов глюконеогенеза из периферических тканей (мышечной, лимфоидной) за счет усиления катаболизма белков, глюкокортикоиды способствуют
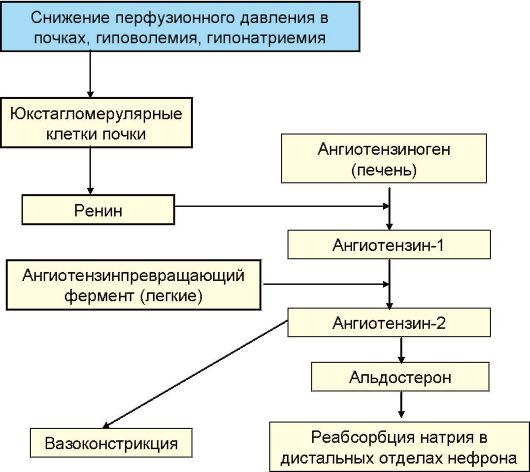 Рис. 4.4. Система ренин-ангиотензин-альдостерон
Рис. 4.4. Система ренин-ангиотензин-альдостерон
развитию гипергликемии, являясь таким образом контринсулярными гормонами. Кроме того, глюкокортикоиды стимулируют гликогеногенез, что приводит к увеличению запасов гликогена в печени. Основное влияние глюкокортикоидов на жировой обмен обусловлено их способностью усиливать липолитическое действие катехоламинов и гормона роста. Избыточное количество глюкокортикоидов стимулирует липолиз в одних частях тела (конечности) и липогенез - в других (лицо, туловище) и приводит к возрастанию уровня свободных жирных кислот в плазме. В целом глюкокортикоиды оказывают анаболическое действие на обмен белков и нуклеиновых кислот в печени и катаболическое - в других органах, включая мышцы, жировую, лимфоидную ткани, кожу и кости. Тормозя рост и деление фибробластов, а также продукцию коллагена, глюкокортикоиды нарушают репаративную фазу воспалительного процесса.
Главными надпочечниковыми андрогенами являются дегидроэпиандростерон (ДЭА) и андростендион. По своей андрогенной активности тестостерон превосходит их соответственно в 20 и 10 раз. Перед секрецией 99 % ДЭА сульфатируется до ДЭА-С (дегидроэпиандростерон-сульфат). В организме женщины 2/3 циркулирующего тестостерона образуется в результате периферического преобразования из ДЭА и андростендиона. Уровни ДЭА и ДЭА-С прогрессивно увеличиваются в период пубертата (в возрасте от 7-8 до 13-15 лет), что соответствует периоду адренархе. Тестостерон, а также эстрогены в норме в значимых количествах надпочечниками не продуцируются.
В мозговомслоенадпочечниковвырабатываетсяадреналин. В отличие от него норадреналин является нейромедиатором и преимущественно (80 %) обнаруживается в органах, иннервируемых симпатическими нервами. Предшественником катехоламинов является аминокислота тирозин. Период полужизни катехоламинов составляет всего 10-30 секунд. Основным метаболитом адреналина является ванилилминдальная кислота (80 %). Небольшая часть гормонов (менее 5 %) выделяется с мочой в неизменной форме, другими их метаболитами (10-15 %) являются метанефрин и норметаиефрин (рис. 4.5).
Гормоны симпатоадреналовой системы в отличие от кортикостероидов не являются жизненно необходимыми. Их основной функцией является адаптация организма к острому стрессу. Адреналин способствует активации липолиза, мобилизация глюкозы и подавляет продукцию инсулина. Катехоламины действуют через два главных класса мембранных адренорецепторов (а и β).
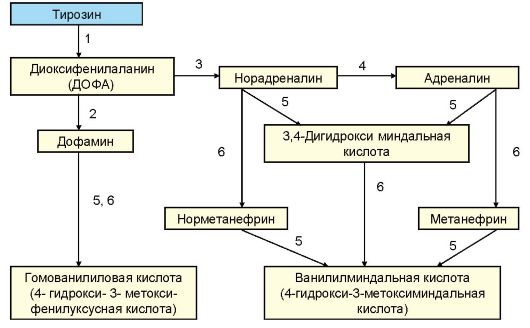 Рис. 4.5. Биосинтез и метаболизм катехоламинов:
Рис. 4.5. Биосинтез и метаболизм катехоламинов:
1 - тирозингидроксилаза; 2 - ДОФА-декарбоксилаза; 3 - дофамингидроксилаза; 4 - фенилэтаноламин-N-метилтрансфераза (ΦΝΜΤ); 5 - МАО (моноаминоксидаза); 6 - КОМТ (катехол-0-метилтрансфераза)
4.2. МЕТОДЫ ОБСЛЕДОВАНИЯ ПАЦИЕНТОВ С ЗАБОЛЕВАНИЯМИ НАДПОЧЕЧНИКОВ
4.2.1. Физикальные методы
Данные анамнеза и физического обследования имеют наибольшее значение в диагностике патологии надпочечников. Большинство заболеваний имеет яркую клиническую картину (болезнь Аддисона, синдром Кушинга), и дальнейшее обследование лишь подтверждает диагноз. Специфические для патологии надпочечников физикальные методы исследования отсутствуют.
4.2.2. Лабораторные методы
Значительная лабильность уровней большинства кортикостероидов, короткий период их полужизни в плазме и наличие сложной многоуровневой системы регуляции их секреции являются причиной того, что для
лабораторной диагностики заболеваний коры надпочечников используется большое число функциональных проб (табл. 4.1). Однократное определение плазменного уровня кортизола вне динамических тестов в большинстве случаев малоинформативно.
Табл. 4.1. Диагностика нарушения продукции гормонов надпочечников
 Если кортикостероиды и катехоламины являются весьма стабильными in vitro соединениями,
то АКТГ и ренин быстро распадаются под влиянием ферментов
гемолизирующихся форменных элементов крови. Для адекватного суждения об
уровне указанных гормонов кровь необходимо забирать в пробирку с
антикоагулянтом, после чего быстро отделять плазму.
Если кортикостероиды и катехоламины являются весьма стабильными in vitro соединениями,
то АКТГ и ренин быстро распадаются под влиянием ферментов
гемолизирующихся форменных элементов крови. Для адекватного суждения об
уровне указанных гормонов кровь необходимо забирать в пробирку с
антикоагулянтом, после чего быстро отделять плазму.
Помимо гормональных исследований важную роль в диагностике играет определение уровня электролитов. Так, для гиперкортизолизма и гиперальдостеронизма характерны гипокалиемия и гипернатриемия, а для гипокортицизма - гиперкалиемия и гипонатриемия. Необходимо помнить, что гемолиз способствует завышению реального уровня калия в крови.
4.2.3. Инструментальные методы
Основными методами визуализации надпочечников являются КТ и МРТ. В диагностике заболеваний надпочечников эти методы имеют примерно одинаковую информативность. Достоинством КТ
является ее меньшая стоимость. Верхний полюс надпочечника появляется на томографическом срезе на уровне XI-XII грудного позвонка, чаще всего в виде небольшой полоски позади нижней полой вены. Слева от него лежит правая ножка диафрагмы и внутридиафрагмальный отдел брюшной части аорты. Справа расположена правая доля печени. Левый надпочечник обычно виден в виде буквы «Y» или треугольного образования, расположенного кпереди и медиальнее верхнего полюса левой почки. Кпереди от левого надпочечника и позади хвоста поджелудочной железы лежит селезеночная артерия. Корковое и мозговое вещества при КТ и МРТ не дифференцируются. Оба метода позволяют определить размеры надпочечников, выявить патологические образования и оценить их размер и форму (рис. 4.6 и 4.7).
В первую очередь визуализация надпочечников показана при заболеваниях, сопровождающихся гиперкортицизмом. При подозрении на злокачественные опухоли надпочечников предпочтение следует отдавать МРТ, которая позволяет охарактеризовать взаимоотношение надпочечника с окружающими структурами. При УЗИ надпочечники визуализируются плохо; исключение могут составить крупные опухоли более 3 см в диаметре. Значительную ценность в топической диагностике феохромоцитомы представляет сцинти-
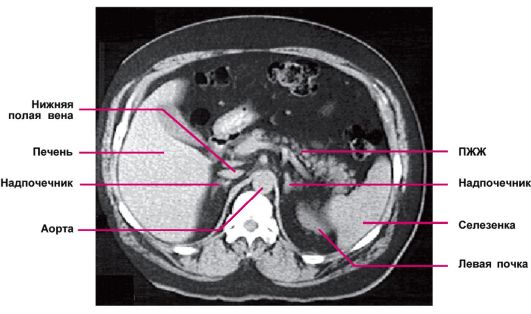 Рис. 4.6. Компьютерная томограмма надпочечников в норме
Рис. 4.6. Компьютерная томограмма надпочечников в норме
графия с 1231-метайодбензилгуанидином (1311-МЙБГ). В диагностике первичного гиперальдостеронизма в ряде случаев используется ангиографическое исследование с селективным забором крови из надпочечниковых вен с целью латерализации поражения.
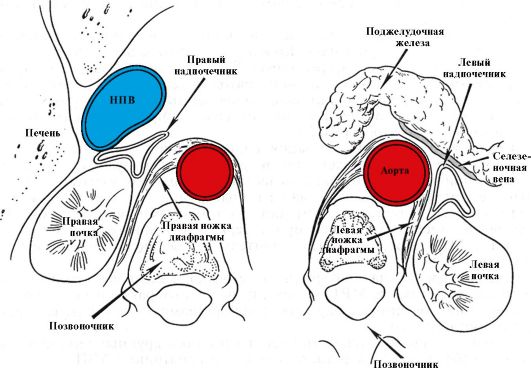 Рис. 4.7. Схематическое изображение компьютерной или магнитно-резонансной томограммы надпочечников
Рис. 4.7. Схематическое изображение компьютерной или магнитно-резонансной томограммы надпочечников
4.3. КЛАССИФИКАЦИЯ ЗАБОЛЕВАНИЙ
НАДПОЧЕЧНИКОВ
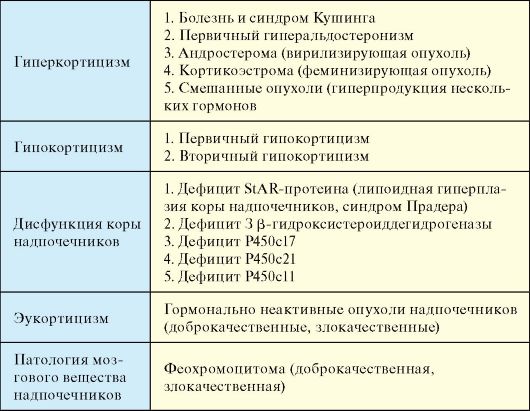
Помимо состояний, сопровождающихся гипер- и гипофункцией, в патологии коры надпочечников в отличие от других желез внутренней секреции выделяется группа заболеваний, характеризующихся дисфункцией органа. При дисфункции коры надпочечников имеют место избыточная продукция одних гормонов и недостаточная других. Заболевания надпочечников подразделяются по функциональному состоянию органа: гиперфункция, гипофункция, дисфункция (табл. 4.2).
Табл. 4.2. Классификация заболеваний надпочечников
 4.4. СИНДРОМ КУШИНГА
4.4. СИНДРОМ КУШИНГА
Синдром Кушинга (гиперкортицизм, СК) - клинический синдром, обусловленный эндогенной гиперпродукцией или длительным экзогенным приемом кортикостероидов (табл. 4.3). Впервые клиническая картина эндогенного гиперкортицизма была описана в 1912 г. Гарвеем Кушингом (1864-1939).
Этиология
Этиологическая классификация СК представлена в табл. 4.4. В соответствии с этиологией СК подразделяется на АКТГ-зависимый и АКТГ-независимый: в первом случае гиперпродукция кортикостероидов связана с избытком АКТГ (крайне редко КРГ), во втором - нет.
Табл. 4.3. Синдром Кушинга
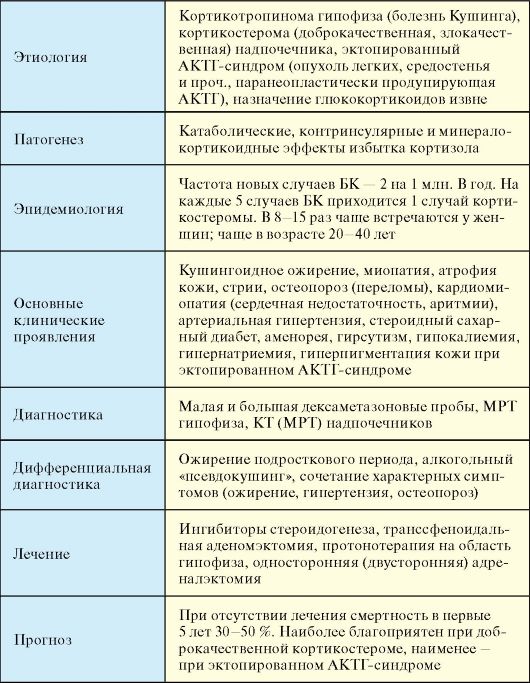 Табл. 4.4. Этиологическая классификация синдрома Кушинга
Табл. 4.4. Этиологическая классификация синдрома Кушинга
 Гипофизарный АКТГ-зависимый синдром Кушинга традиционно обозначается термином болезнь Кушинга (БК). Последняя
представляет собой нейроэндокринное заболевание, патогенетической
основой которого является формирование кортикотропиномы или гиперплазии
кортикотрофов гипофиза, сочетающееся с повышением порога
чувствительности гипоталамо-гипофизарной системы к ингибирующему влиянию
кортизола, что приводит к нарушению суточной динамики секреции АКТГ с
развитием двусторонней гиперплазии коры надпочечников. Таким образом,
несмотря на порой значительную гиперпродукцию кортизола, последний не
подавляет продукцию АКТГ, как это происходит в норме. Таким образом,
имеется нарушение механизма отрицательной обратной связи секреции кортизола. Морфологическим
субстратом БК является аденома гипофиза (в 90 % случаев микроаденома),
которая представляет собой моноклональную опухоль. При БК, в отличие от
эктопированного АКТГ-синдрома, продукция АКТГ аденомой гипофиза не
полностью автономна.
Гипофизарный АКТГ-зависимый синдром Кушинга традиционно обозначается термином болезнь Кушинга (БК). Последняя
представляет собой нейроэндокринное заболевание, патогенетической
основой которого является формирование кортикотропиномы или гиперплазии
кортикотрофов гипофиза, сочетающееся с повышением порога
чувствительности гипоталамо-гипофизарной системы к ингибирующему влиянию
кортизола, что приводит к нарушению суточной динамики секреции АКТГ с
развитием двусторонней гиперплазии коры надпочечников. Таким образом,
несмотря на порой значительную гиперпродукцию кортизола, последний не
подавляет продукцию АКТГ, как это происходит в норме. Таким образом,
имеется нарушение механизма отрицательной обратной связи секреции кортизола. Морфологическим
субстратом БК является аденома гипофиза (в 90 % случаев микроаденома),
которая представляет собой моноклональную опухоль. При БК, в отличие от
эктопированного АКТГ-синдрома, продукция АКТГ аденомой гипофиза не
полностью автономна.
Этиология СК, обусловленного кортизолпродуцирующей опухолью надпочечника (кортикостерома, злокачественная кортикостерома), неизвестна. В данном случае речь идет гиперпродукции кортизола, которая не зависит от АКТГ и абсолютно автономна. Эктопированный
АКТГ-синдром, или синдром эктопической (внегипофизарной) продукции АКТГ (значительно реже КРГ) обусловлен гиперпродукцией АКТГ некоторыми опухолями (мелкоклеточный рак легких, тимома, опухоль поджелудочной железы). Причины, по которым эти опухоли приобретают способность к паранеопластической продукции АТКГ, неизвестны.
Патогенез
В основе патогенеза патологических изменений, которые при СК развиваются со стороны большинства органов и систем, лежит в первую очередь гиперпродукция кортизола. Последний в нефизиологических концентрациях оказывает катаболическое действие на белковые структуры и матрицы большинства тканей и структур (кости, мышцы, в том числе гладкие и миокард, кожа, внутренние органы и т.п.), в которых постепенно развиваются выраженные дистрофические и атрофические изменения. Нарушения углеводного обмена заключаются в стойкой стимуляции глюконеогенеза и гликолиза в мышцах и печени, что приводит к гипергликемии (стероидный диабет). На жировой обмен избыток кортизола оказывает комплексное действие: на одних участках тела происходит избыточное отложение, а на других - атрофия жировой клетчатки, что объясняется разной чувствительностью отдельных жировых компартментов к ГК. Важным компонентом патогенеза СК являются электролитные расстройства (гипокалиемия, гипернатриемия), которые обусловлены влиянием избытка кортизола на почки. Прямым следствием этих электролитных сдвигов является артериальная гипертензия и усугубление миопатии, в первую очередь кардиомиопатии, которая приводит к развитию сердечной недостаточности и аритмиям. Иммуносупрессивное действие ГК обуславливает склонность к инфекциям.
Эпидемиология
Наиболее частым вариантом СК, с которым сталкиваются врачи большинства специальностей, является экзогенный СК, развившийся на фоне терапии ГК; его реальная распространенность неизвестна. Частота новых случаев БК составляет 2 на 1 млн. населения в год. На каждые 5 случаев БК приходится 1 случай кортикостеромы. Как БК, так и кортикостерома в 8-15 раз чаще встречаются у женщин. Болеют в основном лица в возрасте 20-40 лет. Синдром эктопической продукции АКТГ встречается примерно у 12 % больных с эндогенным гиперкортицизмом, наблюдается он в более старшем возрасте (40-60
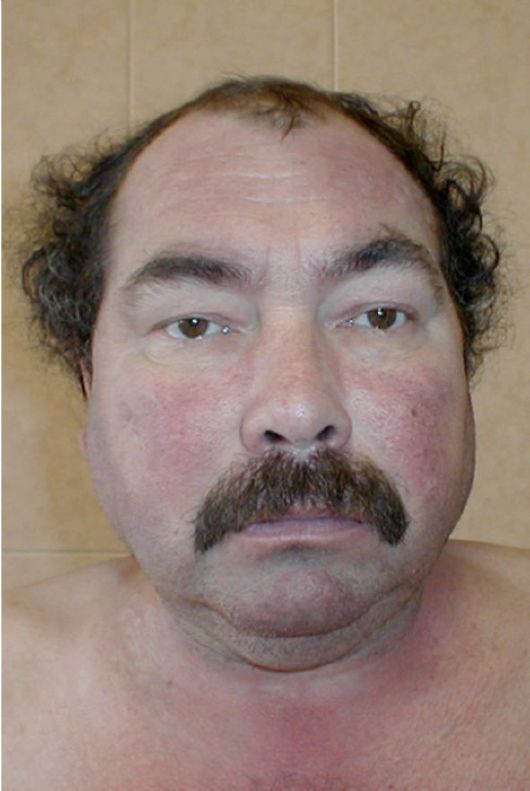 Рис. 4.8. Внешний вид больного с синдромом Кушинга
Рис. 4.8. Внешний вид больного с синдромом Кушинга
лет), чаще у мужчин (соотношение 1:3). Двусторонняя АКТГ-независимая нодулярная гиперплазия надпочечников встречается в основном в детском и юношеском возрасте. Тотальный гиперкортицизм у детей является чрезвычайной редкостью, при этом в отличие от взрослых доминируют опухоли коры надпочечника, а среди них злокачественные кортикостеромы.
Клинические проявления
Данные физикального обследования больного (осмотр) имеют решающее значение в диагностике СК, но практически никогда не позволяют заподозрить конкретную его форму (гипофизарную или надпочечниковую). В ряде случаев, основываясь на данных клинической картины, может быть заподозрен эктопированный АКТГ-синдром.
1. Ожирение наблюдается у 90 % больных. Жир откладывается диспластично (кушингоидный тип ожирения): на животе, груди, шее, лице (лунообразное лицо багрово-красного цвета, иногда с цианотичным оттенком - «матронизм») и спины («климактерический горбик») На тыльной стороне кисти жировая клетчатка и кожа заметно истончаются, при других формах ожирения этого не наблюдается. Даже при отсутствии ожирения у крайне тяжелых больных имеется перераспределение подкожной жировой клетчатки (рис. 4.8).
2. Атрофия мышц особенно выражена и заметна на плечевом поясе и ногах. Типична атрофия ягодичных и бедренных мышц («скошенные ягодицы»). При попытке больного присесть и встать оба эти движения будут значительно затруднены, особенно вставание. Атрофия мышц передней брюшной стенки («лягушачий живот») приводит к появлению грыжевых выпячиваний по белой линии живота. Для эктопированного АКТГ-синдрома характерен особенно выраженный миастенический синдром, связанный с тяжелой гипокалиемией и мышечной дистрофией.
3. Кожа истончена, имеет мраморный вид с подчеркнутым сосудистым рисунком, сухая, с участками региональной потливости,
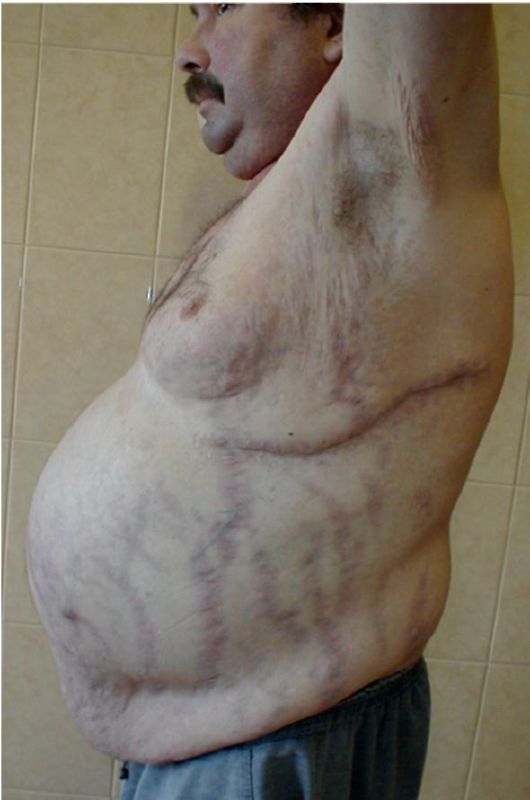 Рис. 4.9. Стрии при синдроме Кушинга
Рис. 4.9. Стрии при синдроме Кушинга
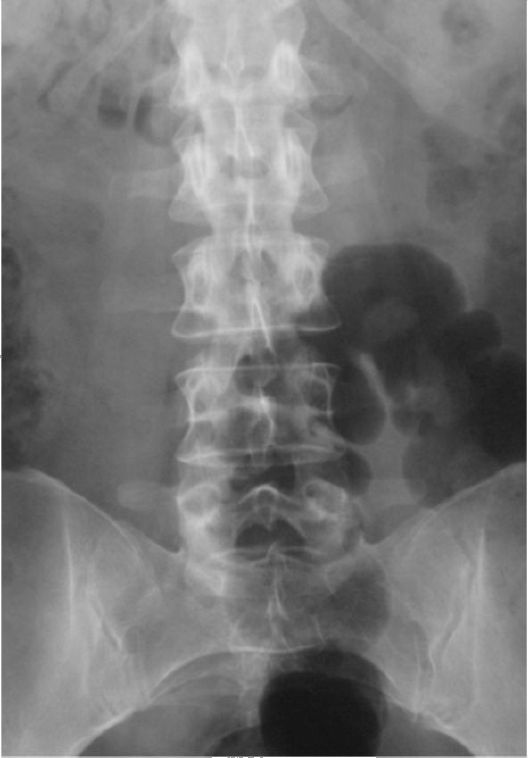 Рис. 4.10. Остеопороз грудного и поясничного отделов позвоночника при синдроме Кушинга
Рис. 4.10. Остеопороз грудного и поясничного отделов позвоночника при синдроме Кушинга
шелушится. Сочетание прогрессирующего ожирения и распада коллагена кожи объясняет появление полос растяжения - стрий. Стрии имеют багрово-красный или фиолетовый цвет, располагаются на коже живота, внутренней поверхности бедер, молочных желез, плеч, и ширина их может достигать нескольких сантиметров (рис. 4.9). На коже нередко определяются высыпания типа акне, многочисленные мелкие подкожные кровоизлияния. Гиперпигментация в отдельных случаях может наблюдаться при БК и закономерно при эктопированном АКТГ-синдроме. В последнем случае меланодермия может быть особенно резко выражена, при этом ожирение весьма умеренно, а в ряде случаев вообще отсутствует, как и характерное перераспределение жира.
4. Остеопороз является тяжелейшим осложнением гиперкортицизма, которое развивается у 90 % пациентов. Наиболее выражены изменения в грудном и поясничном отделах позвоночника, сопровождающиеся снижением высоты тел позвонков и компрессионными переломами (рис. 4.10). На рентгенограмме на фоне выделяющихся концевых пластинок тело позвонка может полностью просвечиваться («стеклянные позвонки»). Переломы очень часто сопровождаются
сильными болями, иногда симптомами сдавления корешков спинного мозга. Сочетаясь с атрофией мышц спины, такие изменения часто приводят к сколиозу и кифосколиозу. Если болезнь начинается в детском возрасте, отмечается значительное отставание ребенка в росте в связи с торможением под влиянием избытка глюкокортикоидов развития эпифизарных хрящей.
5. Кардиомиопатия при СК имеет смешанный генез. Ее развитию способствуют катаболические эффекты стероидов на миокард, электролитные сдвиги и артериальная гипертензия. Клинически она проявляется нарушениями ритма сердца (фибрилляция предсердий, экстрасистолия) и сердечной недостаточностью, которая в большинстве случаев является непосредственной причиной смерти пациентов.
6. Нервная система. Симптоматика варьирует от заторможенности и депрессии до эйфории и стероидных психозов. Часто обнаруживается несоответствие скудных жалоб тяжести состояния.
7. Стероидный сахарный диабет встречается у 10-20 % пациентов; для него характерно легкое течение и компенсация на фоне диетотерапии и назначения таблетированных сахаропонижающих препаратов.
8. Половая система. Избыток секреции надпочечниковых андрогенов обусловливает у женщин развитие гирсутизма (избыточный рост волос по мужскому типу). Нарушение под влиянием избытка андрогенов циклического выделения гонадолиберина вызывает развитие аменореи.
Диагностика
1. Определение базального уровня кортизола и АКТГ имеет низкое диагностическое значение в диагностике СК. В качестве скринингового теста более информативно определение суточной экскреции свободного кортизола с мочой, но это исследование уступает по чувствительности и специфичности малой дексаметазоновой пробе.
2. При наличии у пациента симптомов или проявлений СК в первую очередь необходимо доказать или отвергнуть эндогенную гиперпродукцию кортизола при помощи малой дексаметазоновой пробы. В соответствии с наиболее распространенным протоколом в 1-й день в 8-9 часов утра у пациента определяется уровень кортизола в сыворотке крови. В 24 часа этого же дня (ночью) пациент принимает внутрь 1 мг дексаметазона. В 8-9 часов утра следующего дня у пациента опять определяется уровень кортизола сыворотки. В норме и при состояниях, не сопровождающихся эндогенным гиперкортицизмом, после назначения дексаметазона уровень кортизола снижается более чем в 2 раза. При любом варианте СК продукция кортизола адекватно не подавляется.
3. В том случае, если в малой дексаметазоновой пробе не произошло должного подавления уровня кортизола, необходимо прове-
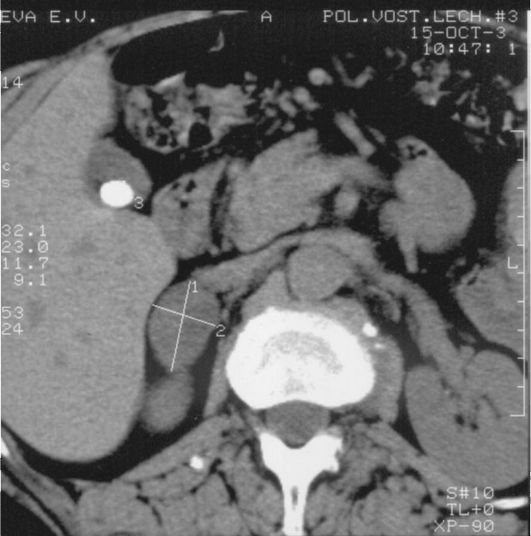 Рис. 4.11. Компьютерная томограмма надпочечников при синдроме Кушинга: кортикостерома правого надпочечника
Рис. 4.11. Компьютерная томограмма надпочечников при синдроме Кушинга: кортикостерома правого надпочечника
дение дифференциальной диагностики между патогенетическими вариантами СК, как правило, между БК и кортикостеромой надпочечника. С этой целью проводят большую дексаметазоновую пробу. Ее протокол отличается от такового при малой дексаметазоновой пробе только дозой препарата: пациенту назначается 8 мг дексаметазона. При БК после приема дексаметазона происходит снижение уровня кортизола более чем на 50 % от исходного; при кортикостероме и эктопированном АКТГ-синдроме указанного снижения уровня кортизола не происходит.
4. Топическая диагностика при БК подразумевает проведение МРТ с целью выявления аденомы гипофиза. Кроме того, проводится КТ или МРТ надпочечников, при которых в случае БК выявляется двусторонняя гиперплазия. Эти же методы используются для визуализации кортикостеромы (рис. 4.11). Визуализация опухоли, обусловливающей эктопированный АКТГ-синдром, в ряде случаев затруднена. Как правило, она локализуется в легких или средостении (значительно реже в ЖКТ) и на момент диагностики имеет обширные метастазы.
5. Диагностика осложнений СК подразумевает проведение рентгенографии позвоночника для выявления компрессионных перело-
мов позвоночника, биохимическое исследование с целью диагностики электролитных нарушений и стероидного сахарного диабета и прочее.
Дифференциальная диагностика
Проводится с заболеваниями и состояниями, клинические проявления которых напоминают таковые при СК. Очень часто имеет место гиподиагностика СК, и пациенты получают специализированную помощь примерно через 3-5 лет от появления даже явных проявлений заболевания.
♦ Ожирение подросткового периода, часто в сочетании с бурным линейным ростом, нередко сопровождается такими симптомами, как транзиторная артериальная гипертензия, появление розовых стрий. От СК это состояние позволяет дифференцировать отсутствие миопатии и других органных и костных изменений, свойственных СК. В проведении дексаметазоновой пробы необходимость возникает очень редко.
♦ Алкогольный «псевдокушинг» развивается у пациентов, хронически злоупотребляющих алкоголем. При этом некоторые клинические симптомы очень сходны с таковыми при СК. Так, развивается ожирение по верхнему типу с отложением жира в области живота и щек, кожа лица приобретает красноватый оттенок, характерна миопатия, особенно мышц ног. Кроме того, алкоголизму часто сопутствует сердечно-сосудистая патология, как правило, артериальная гипертензия.
♦ Отдельные проявления, которые встречаются при СК, такие как артериальная гипертензия, остеопороз, сахарный диабет, гипокалиемия, генерализованная миопатия, особенно в случае их сочетания нередко требуют проведения малой дексаметазоновой пробы.
♦ Малая дексаметазоновая проба или определение суточной экскреции кортизола с мочой входят в алгоритм обследования пациентов с инциденталомой надпочечника (случайно выявленное объемное образование) (см. п. 4.9).
Лечение
1. Ингибиторы стероидогенеза (хлодитан, аминоглютетимид) после постановки диагноза назначают большинству пациентов с эндогенным гиперкортицизмом. Пациенты, которым назначается протонотерапия на область гипофиза, вынуждены получать препараты длительно, до года и более в ожидании развития эффекта протонотерапии.
2. Тренссфеноидальное удаление кортитропиномы гипофиза является методом выбора при БК в ситуации, когда при МРТ удается четко
визуализировать аденому. Ремиссия развивается у 90 % прооперированных пациентов. Прогностически благоприятным после аденомэктомии является развитие транзиторного гипокортицизма, который может сохраняться от нескольких месяцев до года.
3. Протонотерапия на область гипофиза показана пациентам с БК, у которых не визуализируется аденома гипофиза. Развития стойкой ремиссии БК можно ожидать примерно через год после проведения протонотерапии.
4. Адреналэктомия является основным методом лечения кортикостеромы надпочечника. В ряде случаев при тяжелом течении БК, когда пациенту показано проведение протонотерапии, производится односторонняя адреналэктомия, которая позволяет несколько уменьшить выраженность гиперкортицизма. Двусторонняя адреналэктомия для лечения БК последние несколько десятилетий практически не используется. Тем не менее в ряде случаев при крайне тяжелом течении заболевания к ней приходится прибегать. После двусторонней адреналэктомии при БК может происходить значительный рост аденомы гипофиза (синдром Нельсона).
5. При эктопированном АКТГ-синдроме лечение будет зависеть от локализации и распространенности опухолевого процесса. В большинстве случаев радикальное лечение из-за распространенного метастазирования невозможно. В отдельных случаях показано симптоматическое проведение двусторонней адреналэктомии.
6. Симптоматическая терапия при гиперкортицизме включает назначение гипотензивных препаратов, калия, сахароснижающих препаратов, а также препаратов лечения остеопороза.
Прогноз
При отсутствии адекватного лечения смертность при СК в первые 5 лет от начала заболевания достигает 30-50 % пациентов. Прогноз наиболее благоприятен при СК, вызванном доброкачественной кортикостеромой, хотя восстановление функции второго надпочечника происходит не у всех пациентов (80 %). При БК прогноз благоприятен при ранней диагностике и своевременно начатом лечении. После достижения эукортицизма большинство пациентов требует длительного лечения развившихся осложнений, в первую очередь, остеопороза. Наиболее неблагоприятен прогноз при эктопированном АКТГ-синдроме и при распространенном метастазировании злокачественной кортикостеромы. При злокачественной кортикостероме 5-летняя выживаемость составляет до 20-25 %; средняя продолжительность жизни пациента - 14 месяцев.
4.5. ГИПОКОРТИЦИЗМ
Надпочечниковая недостаточность (НН, недостаточность коры надпочечников, гипокортицизм) - клинический синдром, обусловленный недостаточной секрецией гормонов коры надпочечника в результате нарушения функционирования одного или нескольких звеньев гипоталамо-гипофизарно-надпочечниковой системы (табл. 4.5). НН подразделяется на первичную, являющуюся результатом деструкции самой коры надпочечников, и вторичную (гипоталамо-гипофизарную), возникающую вследствие недостаточности секреции АКТГ аденогипофизом. В клинической практике наиболее часто встречается первичная хроническая надпочечниковая недостаточность (95 % случаев) (1-ХНН). Заболевание, обусловленное деструктивным процессом в надпочечниках, впервые было описано в 1855 г. английским врачом Томасом Аддисоном (1793-1860). Первичный гипокортицизм аутоиммунной и туберкулезной этиологии обозначается как болезнь Аддисона.
Табл. 4.5. Гипокортицизм
 Окончание табл. 4.5
Окончание табл. 4.5
 * Симптомы только 1-НН.
* Симптомы только 1-НН.
Этиология
Основными причинами 1-ХНН являются:
♦ Аутоиммунная деструкция коры надпочечников (аутоиммунный адреналит) (98 % случаев). В крови большинства пациентов обнаруживаются антитела к ферменту 21-гидроксилазе (P450c21). Кроме того, у 60-70 % пациентов развиваются другие аутоиммунные заболевания, чаще всего, аутоиммунный тиреоидит. 1-ХНН аутоиммунного генеза является компонентом аутоиммунных полигландулярных синдромов
(см. п. 9.1).
♦ Туберкулез надпочечников (1-2 %) развивается вследствие гематогенного распространения микобактерий. Большинство пациентов страдает туберкулезным поражением легких.
♦ Адренолейкодистрофия (АЛД) (1-2 %) - Х-сцепленное рецессивное заболевание, при котором наследуется дефект ферментных систем, осуществляющих обмен длинноцепочечных жирных кислот, в результате происходит их аккумуляция в белом веществе ЦНС и коре надпочечников, приводящая к дистрофическим изменениям. Фенотипически АЛД варьирует от тяжелых нейродегенеративных форм до состояний, в клинической картине которых доминирует 1-ХНН.
♦ Редкие причины (коагулопатии, дусторонний геморрагический инфаркт надпочечников (синдром Уотерхауса-Фридериксена) метастазы опухолей, двусторонняя адреналэктомия, ВИЧ-ассоциированный комплекс. Основными причинами вторичного гипокортицизма являются различные опухолевые и деструктивные процессы в гипоталамо-гипофизарной области. Острая надпочечниковая недостаточность (аддисонический криз), в подавляющем большинстве случаев, имеет те же причины, что и хроническая и представляет собой ее декомпенсацию.
Патогенез
При первичном гипокортицизме в результате разрушения более 90 % коры обоих надпочечников формируется дефицит альдостеро-
на и кортизола. Дефицит альдостерона приводит к потере натрия, задержке калия (гиперкалиемия) и прогрессирующему обезвоживанию. Следствием водных и электролитных расстройств являются изменения со стороны сердечно-сосудистой и пищеварительной систем. Дефицит кортизола приводит к снижению адаптивных возможностей организма, снижению процессов глюконеогенеза и синтеза гликогена. В связи с этим 1-ХНН манифестирует на фоне различных физиологических стрессов (инфекции, травмы, декомпенсация сопутствующей патологии). Дефицит кортизола по механизму отрицательной обратной связи приводит к повышению продукции АКТГ и его предшественника проопиомеланокортина (ПОМК). В результате протеолиза последнего помимо АКТГ образуется еще и меланоцитстимулирующий гормон (МСГ). Таким образом, при первичном гипокортицизме параллельно избытку АКТГ формируется избыток МСГ, который и обуславливает наиболее яркий симптом 1-ХНН - гиперпигментацию кожи и слизистых.
В связи с тем, что продукция альдостерона корой надпочечников происходит практически независимо от эффектов АКТГ, при вторичном гипокортицизме вследствие недостатка АКТГ развивается дефицит одного только кортизола, а продукция альдостерона сохраняется. Именно это определяет тот факт, что вторичный гипокортицизм имеет относительно более легкое течение по сравнению с первичным.
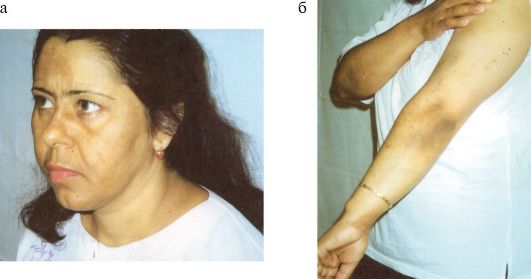 Рис. 4.12. Гиперпигментация кожи при болезни Аддисона (а, б)
Рис. 4.12. Гиперпигментация кожи при болезни Аддисона (а, б)
Эпидемиология
Первичный гипокортицизм встречается с частотой 40-60 новых случаев в год на 1 млн взрослого населения. Распространенность вторичного гипокортицизма неизвестна.
Клинические проявления
Основными клиническими симптомами первичного гипокортицизма (болезни Аддисона) являются:
1. Гиперпигментация кожи и слизистых. Выраженность гиперпигментации соответствует тяжести и давности процесса. Вначале темнеют открытые части тела, наиболее подверженные действию солнца, - лицо, шея, руки, а также места, которые и в норме более сильно пигментированы (соски, мошонка, наружные половые органы) (рис. 4.12). Большую диагностическую ценность имеет гиперпигментация мест трения и видимых слизистых оболочек. Характерны гиперпигментация ладонных линий, которые выделяются на относительно светлом фоне окружающей ткани, потемнение мест трения одеждой, воротником, поясом. Оттенок кожи может варьировать от дымчатого, бронзового (бронзовая болезнь), цвета загара, грязной кожи, вплоть до выраженной диффузной гиперпигментации. Достаточно специфична, но не всегда выражена гиперпигментация слизистых оболочек губ, десен, щек, мягкого и твердого неба. Отсутствие меланодермии является достаточно серьезным доводом против диагноза 1-ХНН, тем не менее встречаются случаи так называемого «белого аддисонизма», когда гиперпигментация почти отсутствует. На фоне гиперпигментации у больных часто обнаруживаются беспигментные пятна (витилиго). Размер их колеблется от мелких, едва заметных, до крупных, с неправильными контурами, ярко выделяющихся на общем темном фоне. Витилиго характерно исключительно для 1-ХНН аутоиммунного генеза.
2. Похудение. Его выраженность колеблется от умеренного (3-6 кг) до значительного (15-25 кг), особенно при исходно избыточной массе тела.
3. Общая слабость, астения, депрессия, снижение либидо. Общая слабость прогрессирует от легкой, до полной потери работоспособности. Пациенты подавлены, вялы, неэмоциональны, раздражительны, у половины из них диагностируются депрессивные расстройства.
4. Артериальная гипотензия вначале может иметь только ортостатический характер; пациенты часто сообщают об обморочных состояниях, которые провоцируются различными стрессами. Обнаружение у пациента артериальной гипертензии - веский довод против диагноза надпочечниковой недостаточности, хотя, если 1-ХНН развилась
на фоне предшествовавшей гипертонической болезни, артериальное давление может быть нормальным.
5. Диспепсические расстройства. Наиболее часто отмечаются плохой аппетит и разлитые боли в эпигастрии, чередование поносов и запоров. При выраженной декомпенсации заболевания появляются тошнота, рвота, анорексия.
6. Пристрастие к соленой пище связано с прогрессирующей потерей натрия. В ряде случаев оно доходит до употребления соли в чистом виде.
7. Гипогликемия в виде типичных приступов практически не встречается, но может выявляться при лабораторном исследовании.
Клиническую картину вторичного гипокортицизма отличает отсутствие гиперпигментации и симптоматики, связанной с дефицитом альдостерона (артериальная гипотония, пристрастие к соленой пище, диспепсия). На первый план выступают такие малоспецифические симптомы, как общая слабость и приступы гипогликемий, которые описываются, как эпизоды плохого самочувствия через несколько часов после еды.
Клиническая картина острой надпочечниковой недостаточности
(аддисонического криза) представлена комплексом симптомов, по преобладанию которых можно выделить три клинические формы:
• Сердечно-сосудистая форма. При этом варианте доминируют явления острой недостаточности кровообращения: бледность лица с акроцианозом, похолодание конечностей, выраженная артериальная гипотония, тахикардия, нитевидный пульс, анурия, коллапс.
• Желудочно-кишечная форма. По симптоматике может напоминать пищевую токсико-инфекцию или даже состояние острого живота. Преобладают боли в животе спастического характера, тошнота, неукротимая рвота, жидкий стул, метеоризм.
• Нервно-психическая форма. Преобладают головная боль, менингеальные симптомы, судороги, очаговая симптоматика, бред, заторможенность, ступор.
Диагностика
Первичный гипокортицизм
1. Лабораторное подтверждение гипокортицизма. Для 1-ХНН характерна гиперкалиемия, гипонатриемия, лейкопения, лимфоцитоз, сниженный уровень кортизола и альдостерона, высокий уровень АКТГ и ренина. Как указывалось, информативность определения базального уровня кортизола ограничена. В основе лабораторной
диагностики 1-ХНН лежит тест с 1-24АКТГ (синактеном). 1-24АКТГ вводится внутривенно в дозе 250 мкг, либо внутримышечно в дозе 500-1000 мкг (синактен-депо). В первом случае уровень кортизола оценивается через 60 минут, во втором - через 8-12 часов. Если уровень кортизола на фоне стимуляции превышает 500 ммоль/л, диагноз 1-ХНН может быть исключен.
2. Этиологическая диагностика. Маркером 1-ХНН аутоиммунного генеза являются антитела к P450c21. Для адренолейкодистрофии характерно повышение в крови уровня длинноцепочечных жирных кислот (С24:0 - С26:0), а также достаточно специфичные изменения, выявляемые при МРТ головного и спинного мозга (симметричная демиелинизация, вовлекающая мозолистое тело и перивентрикулярное периокципитальное белое вещество). При 1-ХНН туберкулезного генеза практически всегда выявляются изменения со стороны легких.
Вторичный гипокортицизм
1. Лабораторное подтверждение гипокортицизма. С этой целью проводится тест с инсулиновой гипогликемией, которая в норме приводит к значительному выбросу АКТГ гипофизом и последующему повышению продукции кортизола. Инсулин короткого действия вводится натощак в дозе 0,1-0,2 Ед/кг; если гипогликемия не достигается, доза инсулина увеличивается. На фоне гипогликемии производится забор крови для определения уровня кортизола; если последний превышает 500 нмоль/л, НН может быть исключена. Проба противопоказана пожилым пациентам с сердечно-сосудистой патологией.
2. Этиологическая диагностика. Причина вторичного гипокортицизма, как правило, очевидна по анамнестическим данным (аденома гипофиза, оперативное вмешательство на гипофизе и т.п.). При необходимости проводится МРТ гипофиза.
Дифференциальная диагностика
Другие причины меланодермии (гемохроматоз, склеродермия, хлоазма, интоксикации (мышьяк, серебро), синдром мальабсорбции, синдром Пейтца-Джегерса, похудения (тиреотоксикоз, опухоли и прочее), гипотонии, диспептических расстройств.
Лечение
Включает пожизненную заместительную терапию препаратами кортикостероидов. После постановки диагноза в большинстве случаев лечение начинается с внутримышечного или внутривенного введения гидрокортизона (100-150 мг/сут на 2-3 инъекции). Выраженный положительный эффект от терапии гидрокортизоном является важным свидетельством правильности установленного диагноза. После
стабилизации состояния пациента с 1-ХНН назначается поддерживающая терапия: комбинация препаратов с глюко- и минералокортикоидной активностью (табл. 4.6).
Табл. 4.6. Заместительная терапия хронической надпочечниковой недостаточности
 С целью имитации циркадианного ритма продукции кортизола 2/3 дозы глюкокортикоидов обычно назначается рано утром, а 1/3
дозы - в обеденное время. Адекватности проводимой терапии соответствует
постепенный регресс гиперпигментации, нормальное самочувствие и
артериальное давление, отсутствие отеков. При любых инфекционных
заболеваниях дозу гидрокортизона необходимо увеличить в 2-3 раза; при
тяжелых лихорадочных заболеваниях может понадобиться переход на инъекции
гидрокортизона. Перед различными инвазивными медицинскими манипуляциями
(экстракция зуба, гастроскопия и прочее) необходимо однократное
введение 50-100 мг гидрокортизона. Особенность заместительной терапии при вторичном гипокортицизме состоит в отсутствии необходимости назначения флудрокортизона, за исключением отдельных случаев выраженной гипотонии.
С целью имитации циркадианного ритма продукции кортизола 2/3 дозы глюкокортикоидов обычно назначается рано утром, а 1/3
дозы - в обеденное время. Адекватности проводимой терапии соответствует
постепенный регресс гиперпигментации, нормальное самочувствие и
артериальное давление, отсутствие отеков. При любых инфекционных
заболеваниях дозу гидрокортизона необходимо увеличить в 2-3 раза; при
тяжелых лихорадочных заболеваниях может понадобиться переход на инъекции
гидрокортизона. Перед различными инвазивными медицинскими манипуляциями
(экстракция зуба, гастроскопия и прочее) необходимо однократное
введение 50-100 мг гидрокортизона. Особенность заместительной терапии при вторичном гипокортицизме состоит в отсутствии необходимости назначения флудрокортизона, за исключением отдельных случаев выраженной гипотонии.
Лечение острой надпочечниковой недостаточности базируется на следующих основных принципах:
• Регидратационная терапия: изотонический раствор в объеме 2-3 литра в первые сутки в сочетании с 10-20 % раствором глюкозы.
• Массированная заместительная терапия гидрокортизоном: 100 мг в/в, затем каждые 3-4 часа по 50-100 мг в/в или в/м. По мере стабилизации состояния пациента доза снижается до поддерживающей. При отсутствии гидрокортизона, например на время доставки пациента в клинику возможно назначение эквивалентных доз преднизолона.
• Симптоматическая терапия сопутствующих заболеваний, вызвавших декомпенсацию ХНН (чаще всего - антибактериальная терапия инфекционных заболеваний).
Прогноз
Продолжительность и качество жизни пациентов, ориентированных в своем заболевании, которые при необходимости могут адекватно изменять дозу глюкокортикоидов при сопутствующих заболеваниях, у которых отсутствуют явления передозировки кортикостероидами, мало отличаются от обычных. Прогноз ухудшается при развитии сопутствующих аутоиммунных заболеваний. Прогноз при адренолейкодистрофии плохой и определяется скоростью демиелинизирующего процесса в ЦНС, а не гипокортицизмом. Летальность от острой надпочечниковой недостаточности может достигать 40-50 %.
4.6. ВРОЖДЕННАЯ ДИСФУНКЦИЯ КОРЫ НАДПОЧЕЧНИКОВ
Врожденная дисфункция коры надпочечников (ВДКН, адреногенитальный синдром) - группа аутосомно-рецессивно наследуемых нарушений синтеза кортикостероидов. Более чем 90 % всех случаев ВДКН обусловлено дефицитом 21-гидроксилазы (Р450с21). Остальные формы ВДКН встречаются казуистически редко.
Табл. 4.7. Врожденная дисфункция коры надпочечников (дефицит Р450с21)
 Окончаниет табл. 4.7
Окончаниет табл. 4.7
 Этиология
Этиология
Ген фермента Р450с21 расположен на коротком плече хромосомы 6. Существует два гена - активный ген CYP21-B, кодирующий Р450с21, и неактивный псевдоген CYP21-A. Эти гены в значительной мере гомологичны. Наличие рядом с кодирующим геном гомологичной ДНК-последовательности зачастую ведет к нарушениям спаривания в мейозе и как следствие этого - к конверсии генов (перемещение фрагмента активного гена на псевдоген), либо к делеции части смыслового гена. В обоих случаях функция активного гена нарушается. На хромосоме 6 рядом с генами CYP21 находятся гены HLA, которые наследуются кодоминантно, в результате чего у всех гомозиготных сибсов будет определяться идентичный HLA-гаплотип.
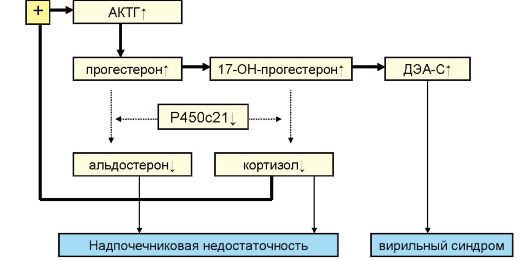 Рис. 4.13. Схема патогенеза врожденной дисфункции коры надпочечников при дефиците P450c21
Рис. 4.13. Схема патогенеза врожденной дисфункции коры надпочечников при дефиците P450c21
Патогенез
Патогенетической сущностью ВДКН является угнетение выработки одних кортикостероидов при одновременном увеличении выработки других вследствие дефицита того или иного фермента, обеспечивающего один из этапов стероидогенеза. В результате дефицита P450c21 нарушается процесс перехода 17-гидроксипрогестерона в 11-дезокси- кортизол и прогестерона в дезоксикортикостерон (рис. 4.13).
Таким образом, в зависимости от выраженности дефицита фермента развивается дефицит кортизола и альдостерона. Дефицит кортизола по механизму отрицательной обратной связи стимулирует продукцию АКТГ, воздействие которого на кору надпочечника приводит к ее гиперплазии и стимуляции синтеза кортикостероидов «выше блока», т.е. стероидогенез смещается в сторону синтеза избытка андрогенов. Развивается гиперандрогения надпочечникового генеза. Клинический фенотип определяется степенью активности мутировавшего гена CYP21-B. При ее полной утрате развивается сольтеряющий вариант синдрома, при котором нарушается синтез как глюкокортикоидов, так и минералокортикоидов. При сохранении умеренной активности фермента минералокортикоидная недостаточность не развивается в связи с тем, что физиологическая потребность в альдостероне примерно в 200 раз ниже, чем в кортизоле. Выделяют 3 варианта дефицита Р450с21:
- дефицит Р450с21 с сольтеряющим синдромом;
- простая вирильная форма (неполный дефицит Р450с21);
- неклассическая форма (постпубертатная).
Эпидемиология
Распространенность ВДКН значительно варьирует среди разных национальностей. Среди представителей европейской расы распространенность классических вариантов (сольтеряющий и простой) дефицита Р450с21 составляет примерно 1 на 14000 новорожденных. Значительно выше этот показатель у евреев (неклассическая
форма дефицита Р450с21 - до 19 % евреев Ашкенази). Среди эскимосов Аляски распространенность классических форм дефицита Р450с21 составляет 1 на 282 новорожденных.
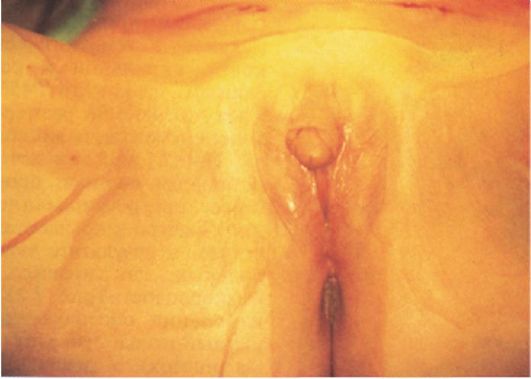 Рис. 4.14. Наружные половые органы у девочки с врожденной дисфункцией коры надпочечников (выраженная гипертрофия клитора)
Рис. 4.14. Наружные половые органы у девочки с врожденной дисфункцией коры надпочечников (выраженная гипертрофия клитора)
Клинические проявления
Сольтеряющая форма дефицита P450c21
1. Избыток андрогенов, начиная с ранних стадий развития плода, у новорожденных девочек обуславливает интерсексуальное строение наружных гениталий (женский псевдогермафродитизм). Выраженность изменений варьирует от простой гипертрофии клитора до полной маскулинизации гениталий: пенисообразный клитор с экстензией отверстия уретры на его головку (рис. 4.14). Строение внутренних гениталий у плодов с женским генотипом при ВДКН всегда нормальное. У мальчиков отмечаются увеличение размеров пениса и гиперпигментация мошонки. При отсутствии лечения в постнатальном периоде происходит быстрое прогрессирование вирилизации. Быстро закрываются зоны роста костей, в результате чего у взрослых больных, как правило, отмечается низкорослость. У девочек при отсутствии лечения определяется первичная аменорея, связанная с подавлением гипофизарно-яичниковой системы избытком андрогенов.
2. Надпочечниковая недостаточность (дефицит альдостерона и кортизола) проявляется такими симптомами, как вялое сосание, рвота, обезвоживание, метаболический ацидоз, нарастающая адинамия. Развиваются
характерные для НН электролитные изменения и дегидратация. Указанные симптомы в большинстве случаев манифестируют между 2-й и 3-й неделей после рождения ребенка. Одним из проявлений дефицита глюкокортикоидов является прогрессирующая гиперпигментация.
Простая вирильная форма дефицита P450c21 развивается вследствие умеренного дефицита фермента, при этом сольтеряющий синдром (надпочечниковая недостаточность) не развивается. Но выраженный избыток андрогенов, начиная с внутриутробного периода, обусловливает описанные выше проявления вирилизации.
Неклассическая (постпубертатная) форма дефицита P450c21
Пренатальная вирилизация наружных гениталий и признаки надпочечниковой недостаточности отсутствуют. Клиническая картина значительно варьирует. Чаще всего эта форма синдрома диагностируется у женщин репродуктивного возраста при целенаправленном обследовании по поводу олигоменореи (50 % пациенток), бесплодия, гирсутизма (82 %), акне (25 %). В ряде случаев какие-либо клинические проявления и снижение фертильности практически отсутствуют.
Диагностика
Основным маркером дефицита Р450с21 является высокий уровень предшественника кортизола - 17-гидроксипрогестерона (17-OHPg). В норме он не превышает 5 нмоль/л. Уровень 17-OHPg более 15 нмоль/л подтверждает дефицит Р450с21. У большинства пациентов с классическими формами ВДКН уровень 17-OHPg превышает 45 нмоль/л. При пограничном уровне 17-OHPg (5-15 нмоль/л) показано проведение теста с 1-24АКТГ (синактен), при этом диагноз постпубертатной формы будет подтвержден только в 20 % случаев. В основном он используется для диагностики неклассической формы дефицита Р450с21. Если после введения 1-24АКТГ уровень 17-OHPg не превышает 30 нмоль/л, диагноз ВДКН вследствие дефицита Р450с21 может быть исключен.
Кроме того, для дефицита Р450с21 характерно повышение уровня ДЭА-С и андростендиона. Для сольтеряющей формы типично повышение уровня ренина плазмы, что отражает дефицит альдостерона и дегидратацию. При классических формах наряду с этим повышен уровень АКТГ.
В ряде стран, включая Российскую Федерацию, осуществляется неонатальный скрининг ВДКН вследствие дефицита Р450с21.
Дифференциальная диагностика
Простой вирильный вариант синдрома необходимо дифференцировать от андрогенпродуцирующих опухолей надпочечников и гонад, идиопатического преждевременного полового созревания у мальчиков. Сольтеряющий синдром при дефиците Р450с21 необходимо дифференцировать от редких вариантов ВДКН, псевдогиперальдостеронизма и ряда других состояний.
Наиболее частой дифференциально-диагностической проблемой является интерпретация погранично повышенного уровня 17-OHPg. Поскольку 17-OHPg частично продуцируется желтым телом, его уровень может быть несколько повышен во второй фазе менструального цикла и почти всегда во время беременности. Наряду с этим во время беременности, как правило, несколько повышен уровень общего тестостерона и других андрогенов, что может приводить к гипердиагностике неклассической формы ВДКН.
Лечение
При классических формах детям назначается таблетированный гидрокортизон в суточной дозе 15-20 мг/м2 поверхности тела или преднизолон 5 мг/м2. Доза разбивается на 2 приема: 1/3 дозы утром, 2/3 дозы на ночь для максимального подавления продукции АКТГ гипофизом. При сольтеряющей форме дополнительно необходимо назначение флудрокортизона (50-200 мкг/сут). При тяжелых сопутствующих заболеваниях и оперативных вмешательствах дозу глюкокортикоидов необходимо увеличить. При поздней постановке диагноза вирильной формы ВДКН у лиц с генетически женским полом могут понадобиться хирургические вмешательства для пластики наружных гениталий.
Постпубертатная (неклассическая) форма ВДКН вследствие дефицита Р450с21 требует терапии только при наличии выраженных косметических проблем (гирсутизм, акне) или при снижении фертильности. Обычно назначается 0,25-0,5 мг дексаметазона или 2,5-5 мг преднизолона на ночь. Гирсутизм и акне могут даже более эффективно корригироваться при помощи антиандрогенов (ципротерон), как правило, с эстрогенами в составе оральных контрацептивов. Мужчинам с неклассической формой дефицита P450c21 лечение не требуется.
Прогноз
При классических формах в полной мере зависит от своевременности постановки диагноза (предотвращает развитие выраженных наруше-
ний строения наружных гениталий у девочек) и качества проводимой заместительной терапии, а также своевременности проведения пластических операций на наружных гениталиях. Сохраняющаяся гиперандрогения или, наоборот, передозировка кортикостероидами способствует тому, что большинство пациентов остаются небольшого роста, что наряду с возможными косметическими дефектами (маскулинизация фигуры у женщин) нарушает психосоциальную адаптацию. При адекватном лечении у женщин с классическими формами ВДКН (в том числе и сольтеряющей) возможно наступление и нормальное вынашивание беременности.
4.7. ГИПЕРАЛЬДОСТЕРОНИЗМ
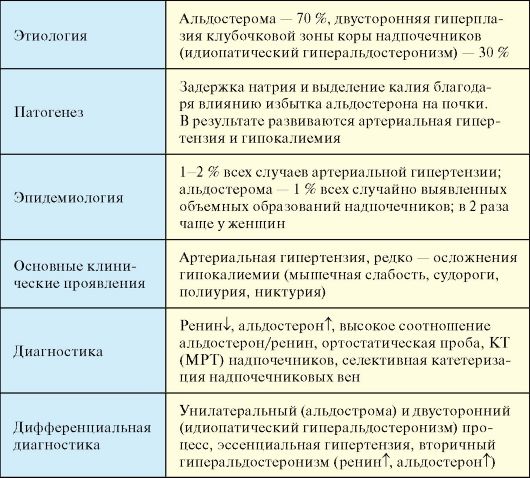
Гиперальдостеронизм представляет собой избыток альдостерона в организме, который может иметь первичный и вторичный генез. Первичный гиперальдостеронизм (ПГА) - клинический синдром, развивающийся в результате избыточной продукции альдостерона, проявляющийся низкорениновой артериальной гипертензией в сочетании с гипокалиемией. Его наиболее частой причиной является альдостеронпродуцирующая опухоль надпочечника (синдром Конна) (табл. 4.15). Впервые артериальная гипертензия (АГ), сопровождающаяся гиперпродукцией альдостерона в сочетании с опухолью коры надпочечников, была описана Джеромом Конном в 1954 г.
Вторичный гиперальдостеронизм (ВГА) представляет собой повышение уровня альдостерона, развивающееся в результате активации ренин-ангиотензин-альдостероновой системы при различных нарушениях водно-электролитного обмена, обусловленное повышением продукции ренина.
Этиология
Наиболее частой причиной ПГА является одиночная альдостеронпродуцирующая аденома (табл. 4.16). Опухоль чаще имеет небольшие размеры - до 3 см в диаметре. Злокачественные альдостеромы встречаются исключительно редко. Идиопатический первичный гиперальдостеронизм характеризуется неопухолевой двусторонней гиперплазией клубочковой зоны коры надпочечников с микроили макронодулярными изменениями или без таковых; его причина также неизвестна.
Патогенез
При ПГА избыток альдостерона воздействует на дистальный отдел нефрона и способствует задержке натрия и потере калия. В результате происходит задержка в организме жидкости, увеличение объема циркулирующей крови (ОЦК) и артериальная гипертензия. Увеличение ОЦК приводит к подавлению продукции ренина почкой. Выраженная и длительная гипокалиемия приводит к дистрофическим изменениям почечных канальцев (калипеническая почка). У пациентов с ПГА помимо риска развития осложнений обусловленных артериальной гипертензией, развивается специфическое для гиперальдостеронизма осложнение - альдостерониндуцированной гипертрофия миокарда.
Табл. 4.15. Первичный гиперальдостеронизм
 Окончаниет табл. 4.15
Окончаниет табл. 4.15
 При ВГА повышение
продукции альдостерона является вторичным и компенсаторным изменением в
ответ на снижение объема почечного кровотока любого генеза. Это
происходит при стенозе почечной артерии, при нарушении кровообращения в
большом круге при сердечной недостаточности (застойная почка), при
снижении ОЦК на фоне терапии мочегонными и при многих других состояниях.
При ВГА повышение
продукции альдостерона является вторичным и компенсаторным изменением в
ответ на снижение объема почечного кровотока любого генеза. Это
происходит при стенозе почечной артерии, при нарушении кровообращения в
большом круге при сердечной недостаточности (застойная почка), при
снижении ОЦК на фоне терапии мочегонными и при многих других состояниях.
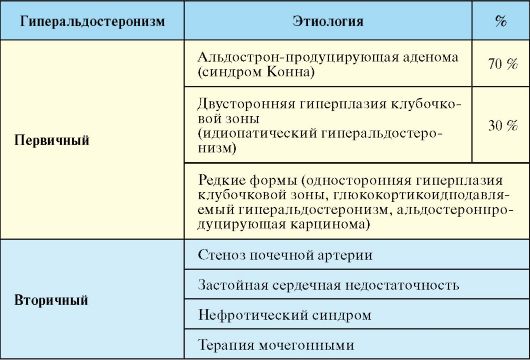
Табл. 4.16. Этиология гиперальдостеронизма
 Эпидемиология
Эпидемиология
ПГА диагностируется у 1-2 % лиц с артериальной гипертензией (АГ). Около 1 % случайно выявленных объемных образований надпочечников является альдостеромами (инциденталомами). Альдостеромы
в 2 раза чаще выявляются у женщин. Распространенность ВГА неизвестна, но она многократно выше, чем ПГА.
Клинические проявления
Первичный гиперальдостеронизм
1. Артериальная гипертензия, как правило, умеренной тяжести, при этом часто резистентная к стандартной гипотензивной терапии.
2. Осложнения гипокалиемии встречаются редко: мышечная слабость, судороги, парестезии; тяжелая гипокалиемия может осложниться дистрофическими изменениями почек, клинически проявляющимися полиурией и никтурией (гипокалиемический нефрогенный несахарный диабет).
Вторичный гиперальдостеронизм не имеет специфических клинических проявлений, поскольку является компенсаторным феноменом при многих заболеваниях и состояниях, при этом характерные для ПГА электролитные изменения при нем никогда не развиваются.
Диагностика
Основным показанием для обследования пациента на предмет ПГА является артериальная гипертензия в сочетании с гипокалиемией. Следует иметь в виду, что в ряде случаев уровень калия при ПГА не опускается ниже 3,5-3,6 ммоль/л. Другими показаниями для обследования являются артериальная гипертензия резистентная к обычной гипотензивной терапии и/или у лиц моложе 40 лет. В основе диагностики ПГА лежит определение уровня альдостерона и ренина и расчет их соотношения. Для ПГА характерны высокий уровень альдостерона, низкий уровень активности ренина плазмы (АРП) и, что наиболее важно, высокое соотношение альдостерон/ренин. В зависимости от того, в каких единицах изменяется уровень гормонов, соотношение альдостерон/ренин при ПГА превышает критическое значение, приведенное ниже:

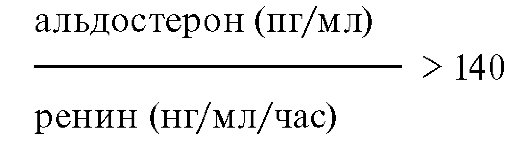 Для
правильного определения уровня АРП необходимо строгое соблюдение правил
забора крови: кровь набирается в пробирку с антикоагулянтом, плазма
отделяется центрифугированием. До проведения анализа пациенту за
несколько недель необходимо отменить ингибиторы АПФ, диуретики,
β-блокаторы и блокаторы кальциевых каналов; верошпирон (спиронолактон)
необходимо отменить минимум за 6 недель.
Для
правильного определения уровня АРП необходимо строгое соблюдение правил
забора крови: кровь набирается в пробирку с антикоагулянтом, плазма
отделяется центрифугированием. До проведения анализа пациенту за
несколько недель необходимо отменить ингибиторы АПФ, диуретики,
β-блокаторы и блокаторы кальциевых каналов; верошпирон (спиронолактон)
необходимо отменить минимум за 6 недель.
Если соотношение альдостерон/АРП превышает указанный пороговый уровень, пациенту показано проведение маршевой (ортостатической) пробы. Она основана на том, что в норме утром после ночного пребывания в горизонтальном положении уровень альдостерона и АРП до перехода в вертикальное положение примерно на 30 % ниже. Первый забор крови для определения уровня альдостерона и АРП проводится в 8 часов утра, в постели до вставания. После этого пациенту предлагается 3-4 часа находиться в вертикальном положении; затем кровь берется повторно. При ПГА, развившемся в результате гиперсекреции альдостерона автономной альдостеронсекретирующей аденомой, уровень АРП снижен исходно, и не повышается после ортостатической нагрузки. Уровень альдостерона при этом исходно повышен и не повышается как в норме, а наоборот снижается. Это объясняется тем, что при утрате зависимости секреции альдостерона от уровня ангиотензина II его продукция начинает подчиняться циркадному ритму секреции АКТГ, для которого характерно снижение секреции к полудню.
Следующим этапом диагностики является визуализация надпочечников при помощи КТ или МРТ. Альдостерома визуализируется как объемное образование одного из надпочечников небольшого размера. При идиопатическом ПГА надпочечники не изменены, либо имеются мелкоузелковые образования. При сложностях с латерализацией поражения, например, при выявлении объемных образований в обоих надпочечниках, показано проведение катетеризация надпочечниковых вен с определением и сравнением уровня альдостерона и кортизола слева и справа.
ВГА не является самостоятельным заболеванием и не требует целенаправленного выявления.
Дифференциальная диагностика
1. Эссенциальная и другие симптоматические артериальные гипертензии.
2. Дифференцировать ПГА и ВГА позволяет определение активности ренина плазмы и ортостатическая проба.
3. Наибольшие сложности возникают с дифференцировкой одностороннего (альдостерома) и двустороннего (идиопатический ПГА) процесса. Даже если в одном из надпочечников при КТ определяется солитарное объемное образование, это еще не значит, что речь идет об альдостероме. Это может оказаться гормонально-неактивное объемное образование в сочетании с идиопатической гиперплазией коры обоих надпочечников, в связи с чем удаление надпочечника с образованием будет неэффективно. Помочь в диагностике может селективная катетеризация надпочечниковых вен.
Лечение
При альдостероме показана адреналэктомия. При идиопатическом ПГА (двусторонняя гиперплазия коры надпочечников) лечение консервативное: назначается верошпирон (200-400 мг в день) в комбинации с другими препаратами: ингибиторами АПФ, антагонистами кальциевых каналов.
Прогноз
После адреналэктомии по поводу альдостеромы артериальное давление и уровень калия нормализуются у 70-80 % пациентов, у которых не успели развиться необратимые изменения в почках.
4.8. ФЕОХРОМОЦИТОМА
Феохромоцитома (от phaios - темный, бурый; chromos - хром) - опухоль мозгового вещества надпочечников или экстраадреналовой хромаффинной ткани, секретирующая катехоламины (адреналин, норадреналин), клинически проявляющаяся злокачественной артериальной гипертензией (АГ) кризового течения (табл. 4.17).
Этиология
Хромаффинные клетки мозгового вещества надпочечников и симпатической нервной системы имеют общее эмбриональное происхождение - они формируются из клеток гребешка нервной трубки. Помимо мозгового вещества надпочечников хромаффинные клетки в больших количествах обнаруживаются в симпатических ганглиях и многочисленных повсеместно расположенных хромаффинных тельцах.
Табл. 4.17. Феохромоцитома
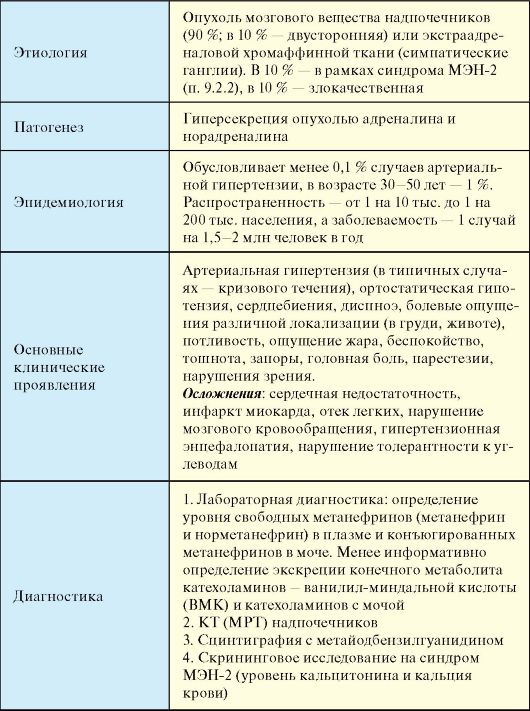 Окончание табл. 4.17
Окончание табл. 4.17
 Крупные
скопления хромаффинных клеток расположены в области бифуркации аорты и
подвздошных вен (орган Цуреккандля). Все эти структуры могут стать
источником вненадпочечниковых феохромоцитом
Крупные
скопления хромаффинных клеток расположены в области бифуркации аорты и
подвздошных вен (орган Цуреккандля). Все эти структуры могут стать
источником вненадпочечниковых феохромоцитом
(рис. 4.15).
Феохромоцитому называют «опухолью 10 %», поскольку 10 % опухолей локализуется вне надпочечника (соответственно, 90% -в одном из надпочечников), 10 % феохромоцитом - злокачественны, 10 % феохромоцитом - двусторонние (опухоли определяются в обоих надпочечниках), 10 % феохромоцитом встречаются в рамках синдрома множественных эндокринных неоплазий 2 типа (МЭН-2) (см. п. 9.2.2). Этиология спорадически встречающихся феохромоцитом неизвестна. При феохромоцитоме в рамках МЭН-2 выявляется мутация RET- протоонкогена на хромосоме 10.
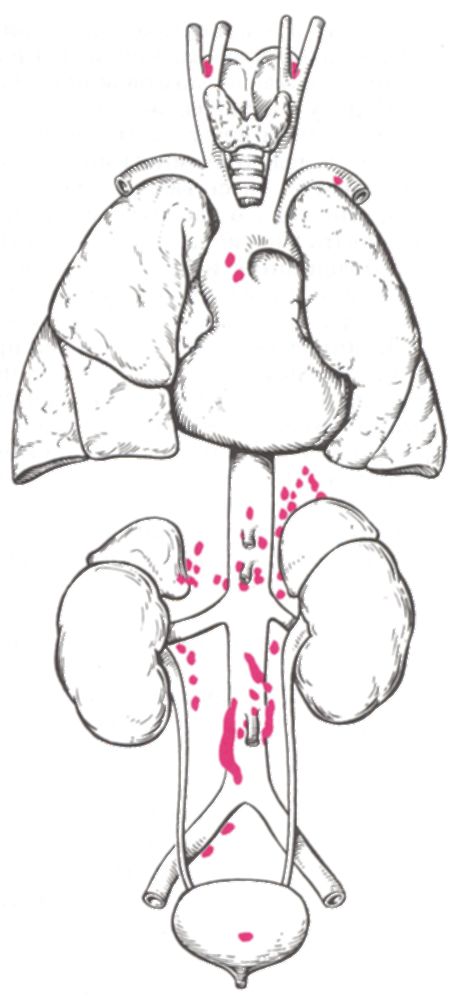 Рис. 4.15. Возможные варианты локализации феохромоцитом
Рис. 4.15. Возможные варианты локализации феохромоцитом
Патогенез
Связан с выраженным избытком в организме катехоламинов (адреналина и/или норадреналина), которые, воздействуя на адренорецепторы, вызывают соответствующую симптоматику и изменения. Продукция катехоламинов опухолью может происходить в постоянном или, наиболее часто, в импульсном режиме, что определяет кризовый характер АГ. Выброс катехоламинов опухолью может провоцироваться различными внешними воздействиями: физическая нагрузка, эмоциональная травма, перемена позы, медицинские манипуляции и прочее. В патогенезе изменений со стороны сердечно-сосудистой системы, которые часто носят фатальный характер, важную роль играет гиперкатехоламинемия (токсическая катехоламиновая кардиомиопатия или катехоламиновые некрозы миокарда).
Эпидемиология
Является редким заболеванием. С феохромоцитомой связано менее 0,1 % случаев артериальной гипертензии, а среди лиц с гипертензией в возрасте 30-50 лет - 1 %. Распространенность составляет по разным данным от 1 на 10 тыс. до 1 на 200 тыс. населения, а заболеваемость - 1 случай на 1,5-2 млн. человек в год. На 100 тыс. аутопсий феохромоцитома выявляется в 20-150 наблюдениях. Заболевание может развиться в любом возрасте, но чаще феохромоцитома выявляется у лиц 30-50 лет, несколько чаще у женщин.
Клинические проявления
1. Артериальная гипертензия может быть постоянной, но чаще носит кризовый характер, при этом АД зачастую достигает очень высокого уровня (систолическое более 250 мм Hg). АГ часто сочетается с ортостатической гипотензией в межприступном периоде. Характерны сердцебиения, диспноэ, болевые ощущения различной локализации (в груди, животе)
2. Общие симптомы: потливость, ощущение жара, беспокойство, тошнота, запоры.
3. Неврологические проявления: головная боль, парестезии, нарушения зрения. Зачастую приступы протекают по типу панических атак с выраженным психомоторным возбуждением (симпато-адреналовый криз).
4. Злокачественные феохромоцитомы помимо гиперпродукции катехоламинов характеризуются инвазивным ростом и метастазированием (лимфатические узлы, кости, печень, средостение).
5. Осложнениями феохромоцитомы являются сердечная недостаточность, инфаркт миокарда, отек легких, нарушение мозгового кровообращения, гипертензионная энцефалопатия, нарушение толерантности к углеводам. При отсутствии своевременного лечения пациенты практически неизбежно погибают во время феохромоцитомного криза при явлениях сердечной недостаточности и неуправляемой гемодинамики (тяжелая гипертензия с последующим падением АД, резистентным к адреномиметикам).
Диагностика
I. Лабораторная диагностика
• Определение уровня катехоламинов в крови для диагностики феохромоцитомы неинформативно.
• Наибольшую диагностическую ценность имеет определение уровня промежуточных продуктов метаболизма катехоламинов: свободных метанефринов (метанефрин и норметанефрин) в плазме и конъюгированных метанефринов в моче.
• Менее информативным, но традиционно широко используемым является определение экскреции конечного метаболита катехоламинов - ванилилминдальной кислоты (ВМК) и свободных катехоламинов с мочой, при этом концентрация ВМК может исследоваться в суточной моче, либо в моче, собранной через несколько часов после гипертонического криза.
II. Топическая диагностика
• КТ (МРТ) надпочечников является весьма информативным исследованием, поскольку 90 % феохромоцитом имеет надпочечниковую локализацию. Наибольшие сложности возникают при диагностике вненадпочечниковых феохромоцитом. При неясной локализации опухоли проводится УЗИ сердца (перикарда), мочевого пузыря, МРТ с исследованием паравертебральных и парааортальных зон, КТ грудной клетки.
• Сцинтиграфия с метайодбензилгуанидином (МЙБГ) - наиболее ценное исследование в топической диагностике вненадпочечниковых феохромоцитом. МЙБГ концентрируется в клетках хромаффинной ткани, при этом нормальная надпочечниковая ткань редко поглощает изотоп, но его поглощают 90 % феохромоцитом.
III. Скрининговое исследование на предмет сопутствующей патологии, в первую очередь медуллярного рака щитовидной железы и гиперпаратиреоза (синдром МЭН-2, см. п. 9.2.2): определение уровня кальцитонина и кальция крови.
Дифференциальная диагностика
Эссенциальная гипертензия кризового течения, тиреотоксикоз, панические атаки (симпатоадреналовые кризы), истерический невроз, нейроциркуляторная дистония, инциденталома надпочечника (с артериальной гипертензией или без нее).
Лечение
Открытая или эндоскопическая адреналэктомия. После постановки диагноза и в рамках предоперационной подготовки пациенты должны получать комбинированную терапию, состоящую из α-адренолокаторов (доксазозин, феноксибензамин, празозин) и β-адреноблокаторов (пропранолол).
Прогноз
Смертность в специализированных хирургических учреждениях составляет 1-4 %. После адреналэктомии по поводу феохромоцитомы 5-летняя выживаемость превышает 95 %. Частота рецидивов не превышает 10 %, при этом речь идет о появлении опухоли в контралатеральном надпочечнике. Пятилетняя выживаемость при злокачественной феохромоцитоме составляет около 40 %.
4.9. ИНЦИДЕНТАЛОМА (СЛУЧАЙНО ВЫЯВЛЕННОЕ ОБЪЕМНОЕ ОБРАЗОВАНИЕ)
Инциденталома (англ. incidental - внезапный, случайный) - случайно выявленное объемное образование надпочечника, не имеющее клинических проявлений (табл. 4.18).
Этиология
Надпочечники локализуются в области, которая очень часто визуализируется при КТ, МРТ и УЗИ, которые выполняются по многочисленным показаниям с целью диагностики заболеваний других органов. При этом объемные образования надпочечников, не имеющие какихлибо проявлений, оказываются случайной находкой.
Табл. 4.18. Инциденталома надпочечника
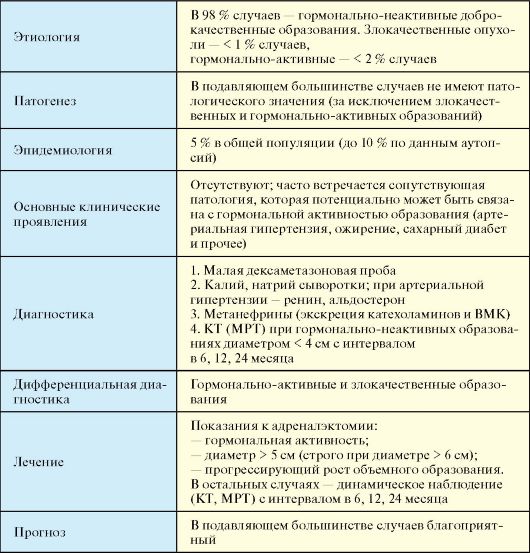 В
98 % случаев речь идет о гормонально-неактивных доброкачественных
образованиях. Злокачественные опухоли встречаются менее чем в 1 %
случаев, гормонально-активные - менее чем в 2 % случаев (табл.
В
98 % случаев речь идет о гормонально-неактивных доброкачественных
образованиях. Злокачественные опухоли встречаются менее чем в 1 %
случаев, гормонально-активные - менее чем в 2 % случаев (табл.
4.19).
Патогенез
Подавляюще большинство инциденталом не имеет патологического значения для организма. Исключение составляют злокачественные и гормонально-активные опухоли.
Табл. 4.19. Морфология инциденталом надпочечника
 Эпидемиология
Эпидемиология
В общей популяции распространенность инциденталом надпочечника составляет около 5 %, а по данным аутопсий достигает 10 %.
Клинические проявления
Отсутствуют, хотя у многих пациентов инциденталомам сопутствует патология, которая потенциально может быть связана с гормональной активностью образования (артериальная гипертензия, ожирение, сахарный диабет и прочее).
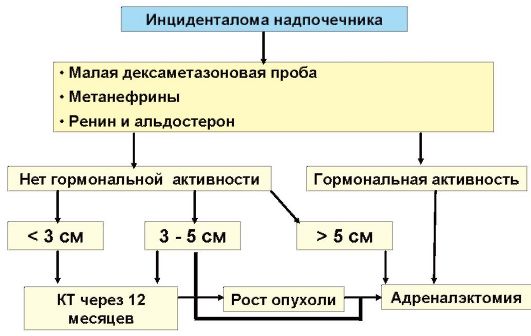 Рис. 4.16. Алгоритм диагностики и лечения при инциденталомах надпочечника
Рис. 4.16. Алгоритм диагностики и лечения при инциденталомах надпочечника
Диагностика
Целью диагностического поиска является исключение гормональной активности и злокачественного характера образования (рис. 4.16). С этой целью проводят:
- малую дексаметазоновую пробу (альтернатива - определение сточной экскреции кортизола с мочой);
- определение уровня калия и натрия сыворотки, а при сопутствующей артериальной гипертензии - уровня ренина и альдостерона;
- определение уровня метанефринов (альтернатива - экскреция катехоламинов и ВМК);
- динамическое наблюдение (КТ или МРТ) при гормональнонеактивных образованиях диаметром менее 5 см с интервалом в 6, затем 12 и далее 24 месяца.
Дифференциальная диагностика
Злокачественные и гормонально-активные опухоли.
Лечение
Оперативное лечение (открытая или эндоскопическая адреналэктомия) показано в следующих ситуациях:
• Гормонально-активное образование.
• Объемное образование более 5 см в диаметре; при образованиях более 6 см показания достаточно строгие из-за повышенного риска злокачественности.
• Прогрессирующий рост объемного образования по данным динамического наблюдения.
В остальных случаях показано динамическое наблюдение с проведением КТ (МРТ) надпочечников с интервалом в 6, 12, а затем 24 месяца.
Прогноз
В подавляющем большинстве случаев благоприятный.