Эндокринология : учебник. И.И. Дедов - 2009. - 432 с.: ил.
|
|
|
|
ГЛАВА 6 РЕПРОДУКТИВНАЯ ЭНДОКРИНОЛОГИЯ МУЖСКОГО ПОЛА
6.1. АНАТОМИЯ И ФИЗИОЛОГИЯ МУЖСКОЙ РЕПРОДУКТИВНОЙ СИСТЕМЫ
Яички - парные органы длиной 3,6-5,5 см, шириной 2,1-3,2 см; масса каждого яичка составляет около 20 г. Из-за расположения в мошонке яички имеют температуру на 2-2,5 °С ниже температуры в брюшной полости, что является необходимым условием для нормального сперматогенеза. Яичко состоит из 250 пирамидальных долек, разделенных фиброзными перегородками. В каждой дольке яичка находятся извитые и прямые семенные канальцы, которые переходят в более крупные выносящие канальцы. Семенные канальцы выстилает эпителиальный сперматогенный слой с клетками Сертоли. Между канальцами имеется интерстициальная ткань с клетками Лейдига (рис. 6.1). Длина семенных канальцев может достигать 70 см.
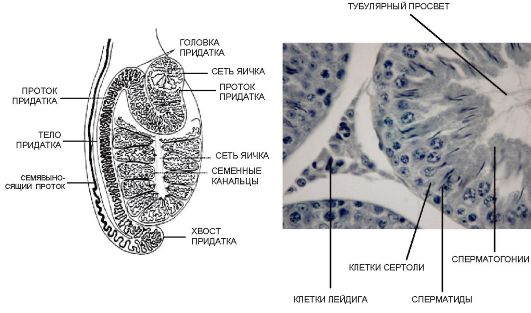 Рис. 6.1. Строение яичка
Рис. 6.1. Строение яичка
Яички одновременно выполняют двойную функцию: репродуктивную и эндокринную. Местом синтеза тестостерона являются клетки Лейдига. Репродуктивная функция яичка заключается в образовании сперматозоидов. Процесс сперматогенеза осуществляется в извитых семенных канальцах паренхимы яичка, которые составляют более 85 % его объема. Эндокринная функция заключается в продукции мужских половых гормонов (андрогенов), среди которых основным является тестостерон, оказывающий биологическое действие практически на все ткани организма. Его основными эффектами являются:
• дифференцировка и стимуляция развития наружных и внутренних половых органов и гипоталамо-гипофизарной системы по мужскому типу;
• стимуляция роста волос на лице, лобке, в подмышечных впадинах;
• стимуляция линейного роста тела, задержка азота и стимуляция развития мускулатуры, индукция увеличения гортани и утолщения голосовых связок;
• стимуляция эритропоэза и андроидного распределения подкожной жировой клетчатки;
• активация сперматогенеза совместно с ФСГ;
• обеспечение формирования мужской психики и сексуальности.
Секреция тестостерона происходит не постоянно, а эпизодически, что является одной из причин значительных колебаний его уровня в крови. Максимальная секреция происходит между 02.00-06.00 ч, а минимальная - около 13.00 ч. Только 2 % тестостерона циркулирует в свободном виде, 30 % его связано с глобулином, связывающим половые гормоны (ГСПГ), 68 % - с альбумином и другими белками.
Тестостерон, являясь стероидным гормоном, проникает в клетки-мишени путем пассивной диффузии. Он является доминирующим внутриядерным андрогеном в головном мозге, гипофизе и почках. В других тканях тестостерон с помощью фермента 5α-редуктазы превращается в более активный дигидротестостерон. В клетках тестостерон и дигидротестостерон связываются с андрогеновыми рецепторами, а образовавшийся рецепторно-стероидный комплекс переносится в ядро, где связывается со специфическими участками хроматина.
Тестостерон метаболизируется в печени в относительно неактивные сульфаты и глюкурониды, которые экскретируются с мочой и желчью.
Деятельность яичек регулируется гипоталамо-гипофизарной системой. Гонадотропин-рилизинг-гормон (ГРГ), вырабатываемый гипоталамусом, оказывает стимулирующее влияние на продукцию гонадотропинов гипофиза. У мужчин функционирует постоянный тонический центр секреции ГРГ в отличие от женщин, у которых его секреция осуществляется циклически. Такая половая дифференцировка гипоталамуса происходит во внутриутробном периоде под влиянием вырабатываемого эмбриональными яичками тестостерона.
ФСГ активно влияет на сперматогенез, стимулирует эпителий канальцев яичка. ЛГ у мужчин инициирует развитие и созревание интерстициальных клеток и влияет на синтез тестостерона клетками Лейдига. Стимуляция ЛГ клеток Лейдига играет важную роль на ранних этапах сперматогенеза, когда необходима высокое содержание тестостерона в яичке. Для созревания сперматозоидов необходим ФСГ. Клетки Сертоли также обладают эндокринной функцией и продуцируют ингибин, который, как и тестостерон, подавляет продукцию ФСГ гипофизом (рис. 6.2).
Полностью процесс сперматогенеза занимает примерно 74 дня, после чего на протяжении 12-21 дня сперма транспортируется через придаток яичка.
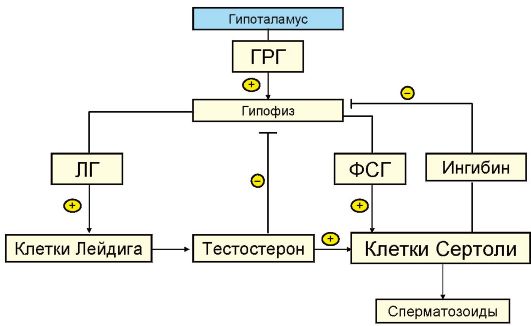 Рис. 6.2. Регуляция сперматогенеза
Рис. 6.2. Регуляция сперматогенеза
6.2. МЕТОДЫ ОБСЛЕДОВАНИЯ В АНДРОЛОГИИ
6.2.1. Физикальные методы
Обследование больных с нарушениями функции яичек состоит из соматического обследования и осмотра половых органов. Соматическое обследование включает в себя выявление характерных признаков развития скелета, мышечной системы, жировой клетчатки. Большое значение имеет характер развития вторичных половых признаков. При осмотре половых органов обращают внимание на строение наружных гениталий, величину полового члена, место выхода уретры (наличие гипоили эписпадии), складчатость и пигментацию мошонки, степень ее отвисания, характер оволосения лобка. Пальпацию яичек следует проводить теплыми руками, чтобы не было ускользания яичка. При этом определяют размер яичек, обращают внимание на их консистенцию (плотность), характер поверхности, состояние придатка.
6.2.2. Лабораторные методы
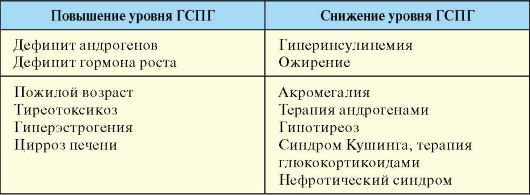
При определении содержания тестостерона в крови необходимо учитывать, что утром его уровень примерно на 30 % выше, чем вечером. Нормальный уровень тестостерона у здорового мужчины в первой половине дня составляет 12-40 нмоль/л. Уровень тестостерона менее 10 нмоль/л наиболее вероятно свидетельствует о дефиците гормона; пограничные данные (между 10 и 12 нмоль/л) требуют уточнения. Поскольку только 2 % тестостерона циркулирует в свободном виде, определение уровня свободного тестостерона в рутинной клинической практике оказывается слишком сложно. В связи с этим при интерпретации определения уровня тестостерона в сомнительных ситуациях следует брать в расчет содержание в сыворотке основного белка, связывающего гормон, а именно ГСПГ. У мужчин его уровень в норме составляет 18-50 нмоль/л и меняется при различных заболеваниях и состояниях (табл. 6.1).
Кроме того, для диагностики вариантов гипогонадизма проводится определение базальных уровней ЛГ и ФСГ. В отдельных случаях с этой целью проводятся стимуляционые пробы. В пробе с хорионическим гонадотропином оценивается стимулированный уровень тестостерона, который в норме примерно в два раза превышает базальный.
Для дифференциальной диагностики вторичного (гипофизарного) и третичного (гипоталамического) гипогонадизма используется проба с гонадотропин-рилизинг-гормоном, после введения которого при третичном гипогонадизме происходит повышение уровня ФСГ и ЛГ.
Табл. 6.1. Факторы, влияющие на уровень ГСПГ
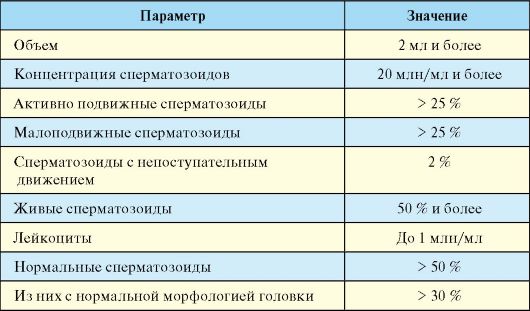
 С целью диагностики мужского бесплодия проводится исследование эякулята, который
получается при помощи мастурбации. Анализ эякулята следует проводить
после не менее 2-х и не более 7-дневного полового воздержания (табл.
6.2).
С целью диагностики мужского бесплодия проводится исследование эякулята, который
получается при помощи мастурбации. Анализ эякулята следует проводить
после не менее 2-х и не более 7-дневного полового воздержания (табл.
6.2).
Табл. 6.2. Нормальные показатели спермограммы
 Возможны следующие основные варианты изменения спермограммы:
Возможны следующие основные варианты изменения спермограммы:
• олигоспермия - снижение объема эякулята менее 2 мл;
• олигозооспермия - уменьшение количества сперматозоидов в эякуляте;
• азооспермия - в эякуляте отсутствуют сперматозоиды;
• астенозооспермия - снижение подвижности сперматозоидов;
• тератозооспермия - в эякуляте более 50 % патологических сперматозоидов;
• некрозооспермия - в эякуляте более 50 % сперматозоидов мертвые. 6.2.3. Инструментальные методы
Основным методом является УЗИ яичек, которое позволяет точно определить их объем. До пубертатного возраста длина яичек равна примерно 2 см, а объем 2 мл. В период полового созревания яички увеличиваются и к 16-летнему возрасту достигают размеров, как у взрослого мужчины: объем яичка в среднем равен 12-25 мл.
6.3. МУЖСКОЙ ГИПОГОНАДИЗМ
Гипогонадизм у мужчин - патологическое состояние, обусловленное уменьшением уровня андрогенов в организме или снижением чувствительности к ним, которое может приводить к недоразвитию половых органов, вторичных половых признаков и бесплодию. Выделяют первичный гипогонадизм, вызванный нарушением функции самих половых желез, и вторичный гипогонадизм, возникший в результате снижения секреции гонадотропинов. Первичный гипогонадизм сопровождается гиперсекрецией гонадотропных гормонов и называется гипергонадотропным гипогонадизмом. При вторичном гипогонадизме имеет место снижение секреции гонадотропных гормонов - гипогонадотропный гипогонадизм (табл. 6.3). Реже встречается нормогонадотропный гипогонадизм, который характеризуется низкой продукцией тестостерона при нормальном уровне гонадотропинов. Кроме того, гипогонадизм может быть врожденным и приобретенным.
Этиология и патогенез
Как первичный (табл. 6.4), так и вторичный (табл. 6.5) гипогонадизм могут развиться в силу многих причин, начиная от генетических синдромов и заканчивая внешними факторами, которые приводят к нарушению продукции тестостерона и/или гонадотропинов.
Табл. 6.3. Мужской гипогонадизм
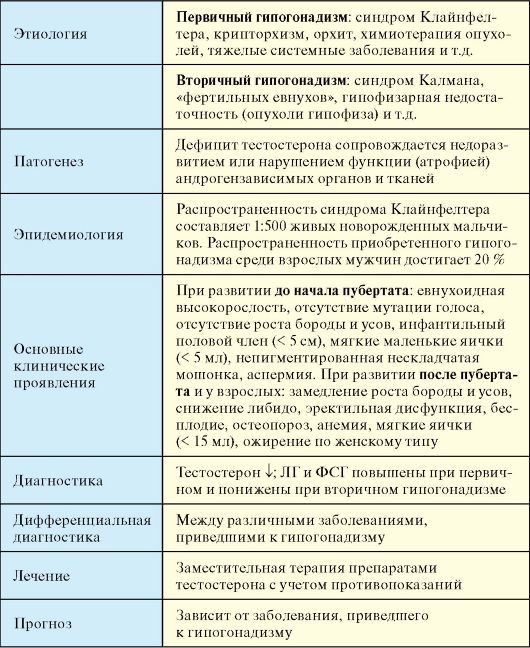 Отдельно рассматривается проблема возрастного снижения продукции тестостерона или синдром LOH (англ. Late Onset Hypogonadism), который недавно обозначался как синдром ADAM (англ. Androgen Deficiency in the Aging Male).
Отдельно рассматривается проблема возрастного снижения продукции тестостерона или синдром LOH (англ. Late Onset Hypogonadism), который недавно обозначался как синдром ADAM (англ. Androgen Deficiency in the Aging Male).
Табл. 6.4. Причины первичного гипогонадизма у мужчин
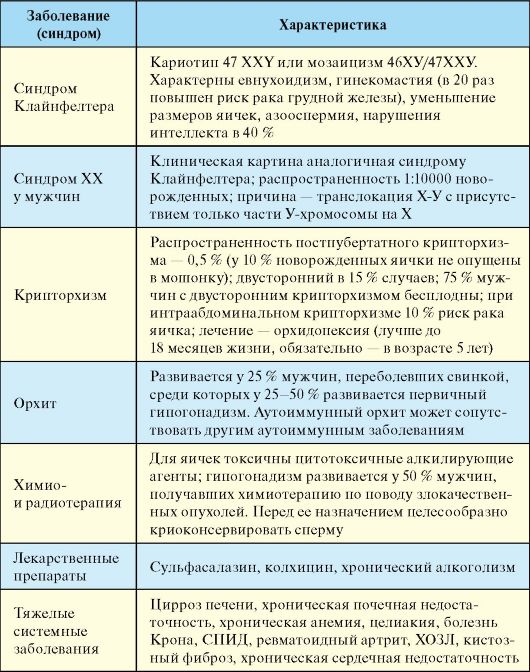 Табл. 6.5. Причины вторичного гипогонадизма у мужчин
Табл. 6.5. Причины вторичного гипогонадизма у мужчин
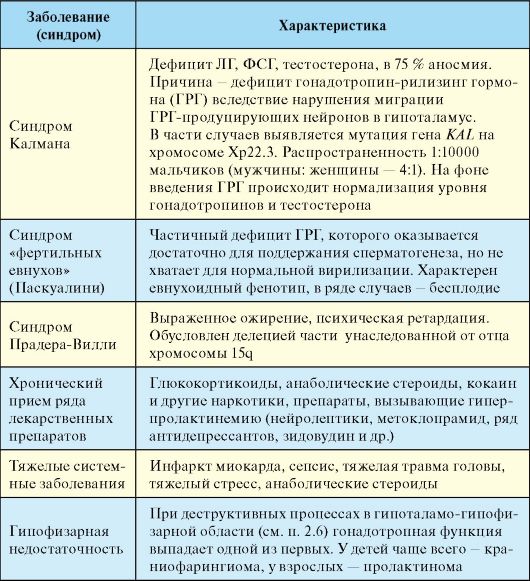 Эпидемиология
Эпидемиология
Наиболее частой причиной врожденного гипогонадизма у мужчин является синдром Клайнфелтера, распространенность которого составляет 1:500 живых новорожденных мальчиков. Значительно чаще встречается приобретенный гипогонадизм, распространенность которого среди мужчин достигает 20 %, но этот показатель в существенной мере зависит от использованных критериев диагностики
Табл. 6.6. Симптоматика гипогонадизма в зависимости от периода его возникновения
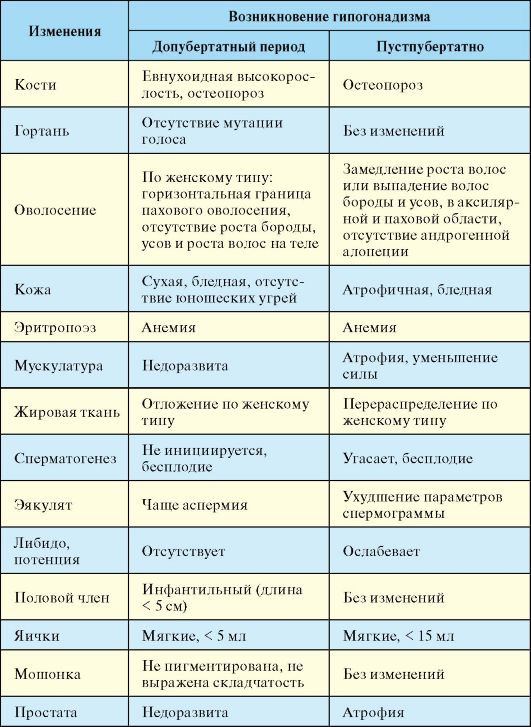 (нижняя граница нормы для уровня тестостерона) и обследованной популяции.
(нижняя граница нормы для уровня тестостерона) и обследованной популяции.
Клинические проявления
В первую очередь зависят от возраста развития гипогонадизма (табл. 6.6).
Диагностика
1. Клиническая картина гипогонадизма (табл. 6.6) в сочетании со специфическими проявлениями заболевания, приведшего к гипогонадизму (наследственные синдромы, соматические заболевания и прочее; табл. 6.4-6.5).
2. Сниженный уровень тестостерона (см. п. 6.2.2).
3. Высокий уровень ЛГ и ФСГ при первичном гипогонадизме, низкий при вторичном.
Дифференциальная диагностика
♦ Между заболеваниями, приведшими к гипогонадизму.
♦ Гипогонадизм, не связанный с патологией яичек и нарушением продукции гонадотропинов: гиперпролактинемия, гиперпродукция эстрадиола (опухоли яичек, надпочечников, печени) и проч.
Лечение
Заместительная терапия препаратами андрогенов. Абсолютными противопоказаниями к ее назначению являются рак простаты и грудной железы, относительными - доброкачественная гиперплазия простаты, полицитемия и синдром апноэ во сне. Перед планированием назначения терапии андрогенами необходимо проведение ректального исследования простаты, пальпация грудных желез, определение простат-специфического антигена, уровня гемоглобина и гематокрита, а также липидного спектра.
Существует достаточно много лекарственных форм тестостерона. Смесь эфиров тестостерона (сустанон, омнадрен) вводится в дозе 250 мг внутримышечно 1 раз в 2-4 недели. В виде таблетированных препаратов может назначаться тестостерона андеканоат (40 мг 3 раза в день). Кроме того, существуют трансдермальные системы, подкожные имплантанты, гели и другие лекарственные формы. Мониторинг заместительной терапии тестостероном подразумевает клиническое исследование, ректальное исследование простаты, определение уровня простат-специфического антигена у лиц старше 45 лет, уровня гемоглобина и гематокрита и липидного спектра. Эти
исследования проводятся через 3 месяца после начала лечения, а затем с интервалом в 6-12 месяцев.
Прогноз
Зависит от конкретного заболевания, приведшего к гипогонадизму.
6.4. ЭРЕКТИЛЬНАЯ ДИСФУНКЦИЯ
Стойкая невозможность достижения и/или поддержания эрекции полового члена, достаточной для осуществления полового акта (табл. 6.7).
Табл. 6.7. Эректильная дисфункция
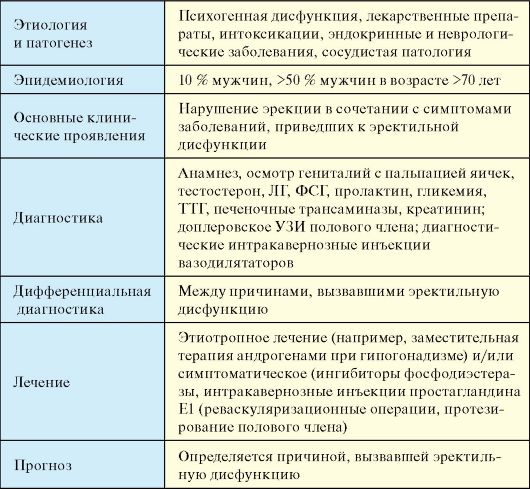 Этиология
Этиология
Органические нарушения являются причиной эректильной дисфункции в 50-70 % случаев. Основные причины эректильной дисфункции приведены в табл. 6.8.
Табл. 6.8. Причины эректильной дисфункции
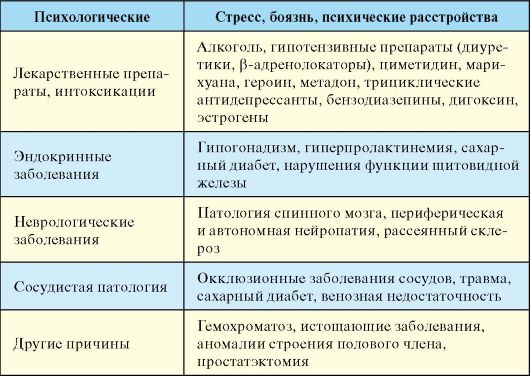 Патогенез
Патогенез
Причины первичных психогенных нарушений эрекции чаще лежат в социальной сфере и воспитании. Вторичные нарушения возникают остро и связаны с конкретной ситуацией, партнершей, страхом и воспоминанием о неудачном опыте. На нарушение кровоснабжения полового члена приходится 50-80 % случаев эректильной дисфункции органического генеза. Они могут быть обусловлены нарушением артериального притока (атеросклероз) или нарушением окклюзии кавернозных тел. Эректильная дисфункция сопровождает многие неврологические заболевания. Эрекция сохраняется у 95 % больных с повреждением верхних отделов спинного мозга и только у 25 % с повреждением крестцового отдела. Эндокринные заболевания обусловливают примерно 5 % от всех случаев эректильной дисфункции,
тем не менее среди мужчин с эндокринной патологией распространенность нарушений эрекции достаточно высока. Так, среди больных сахарным диабетом со стажем заболевания более 6 лет распространенность эректильной дисфункции составляет 50 %.
Эпидемиология
Встречается у 10 % мужчин и более чем у 50 % мужчин в возрасте старше 70 лет. В возрасте 40 лет 5 % мужчин указывают на полную и 15 % на частичную эректильную дисфункцию. Распространенность эректильной дисфункции вдвое превышает частоту ИБС.
Клинические проявления
Нарушение эрекции возможно в сочетании с симптомами гипогонадизма (п. 6.3) или заболеваний, приведших к эректильной дисфункции.
Диагностика
1. Анамнез. Выясняется время начала эректильной дисфункции, ее длительность и прогрессирование (внезапное начало характерно для психогенной дисфункции), наличие ночных и утренних эрекций (их отсутствие свидетельствует в пользу органической природы дисфункции), симптомов гипогонадизма (снижение либидо). Выясняется количество потребляемого алкоголя, других психоактивных средств и лекарственных препаратов.
2. Физикальное обследование: пальпация яичек, исключение аномалий строения полового члена.
3. Лабораторное обследование: уровень тестостерона, ЛГ, ФСГ, пролактина, гликемии натощак, ТТГ, печеночных трансаминаз, креатинина и др.
4. Инструментальное обследование (по показаниям): доплеровское УЗИ полового члена (оценка артериального и венозного кровотока); интракавернозные инъекции вазодилятаторов (папаверин, простагландин Е1) - появление эрекции исключает сосудистый генез дисфункции.
Дифференциальная диагностика
Между причинами, вызвавшими эректильную дисфункцию.
Лечение
1. Этиотропное лечение: заместительная терапия андрогенами при гипогонадизме, дофаминомиметиками при гиперпролактинемии, психотерапия и т.д.
2. Симптоматическое лечение:
- ингибиторы фосфодиэстеразы (силденафил, тадалафил, варденафил);
- интракавернозные инъекции простагландина Е1;
- хирургическое лечение (реваскуляризация, протезирование полового члена).
Прогноз
Определяется причиной, вызвавшей эректильную дисфункцию.
6.5. ГИНЕКОМАСТИЯ
Гинекомастия представляет собой доброкачественное увеличение грудных желез у мужчин диаметром более 2 см. Гинекомастия не является самостоятельным заболеванием, а представляет собой симптом других болезней. Истинную гинекомастию необходимо дифференцировать от ложной гинекомастии, или липомастии, при которой увеличение грудной железы происходит за счет жировой ткани. При истинной гинекомастии грудные железы увеличиваются в результате гиперплазии долевых млечных протоков и гипертрофии соединительной ткани железы, т.е. макроскопически представляет собой увеличение железистой и стромальной ткани. Истинная гинекомастия подразделяется на физиологическую (у новорожденных, пубертатная и старческая) и патологическую (табл. 6.9).
Табл. 6.9. Гинекомастия
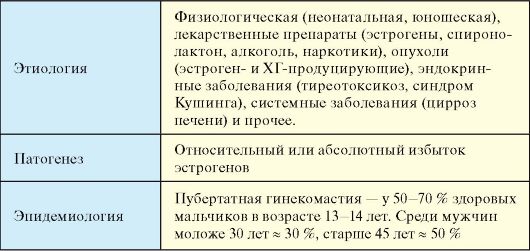 Окончание табл. 6.9
Окончание табл. 6.9
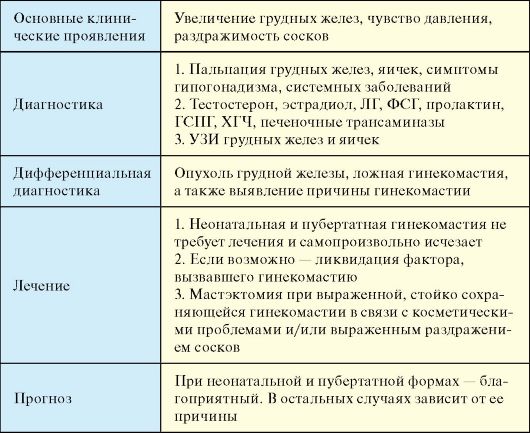 Этиология
Этиология
Причиной гинекомастии могу быть многочисленные факторы окружающей среды и заболевания. Основные из них перечислены в табл. 6.10.
Патогенез
Общим в патогенезе гинекомастии является избыток в организме мужчины эстрогенов - абсолютный или относительный. Гинекомастия новорожденных связана с циркуляцией в крови избытка плацентарных эстрогенов и редко бывает персистирующей. Причиной наиболее часто встречающейся пубертатной или юношеской гинекомастии является избыточная активность ароматазы, которая осуществляет конверсию тестостерона в эстрогены.
Табл. 6.10. Причины гинекомастии
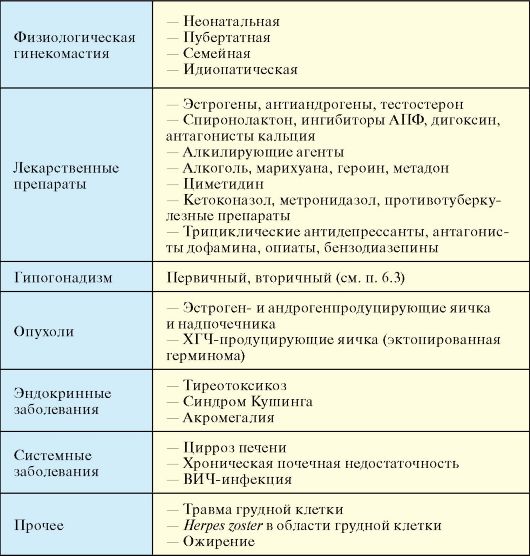 Гинекомастия может развиваться практически при любой из форм гипогонадизма. При
врожденных формах происходит избыточная ароматизация надпочечниковых
андрогенов при отсутствии или дефиците подавляющего эффекта
тестостерона. При вторичном гипогонадизме и гиперпролактинемии
гинекомастия встречается достаточно редко.
Гинекомастия может развиваться практически при любой из форм гипогонадизма. При
врожденных формах происходит избыточная ароматизация надпочечниковых
андрогенов при отсутствии или дефиците подавляющего эффекта
тестостерона. При вторичном гипогонадизме и гиперпролактинемии
гинекомастия встречается достаточно редко.
Гинекомастия часто развивается при хронических системных заболеваниях. При циррозе печени повышенный уровень эстрогенов обусловлен избыточной ароматизацией андростендиона в результате повышения синтеза глобулина, связывающего половые гормоны
(ГСПГ). Возможными причинами развития гинекомастии при тиреотоксикозе является усиление периферической ароматизации андрогенов.
Эстрогенные препараты стимулируют рост грудной железы непосредственно. Спиронолактон метаболизируется в канренон, который является конкурентным антагонистом рецепторов эстрадиола. Циметидин оказывает не только антиандрогенное действие, но и снижает 2-гидроксилирование эстрадиола, что приводит к 20 % повышению уровня последнего. Другие препараты вызывают гипогонадизм, воздействуя как ингибиторы синтеза тестостерона (кетоконазол), повреждая клетки Лейдига (цитостатики), вызывая гиперпролактинемию (нейролептики).
Эпидемиология
Встречается у 50-70 % здоровых мальчиков в возрасте 13-14 лет (пубертатная гинекомастия). В целом распространенность гинекомастии среди мужчин моложе 30 лет составляет около 30 % и достигает 50 % среди мужчин старше 45 лет.
Клинические проявления
При гинекомастии новорожденных определяется небольшое увеличение грудных желез. В ряде случаев при этом могут определяться молозивоподобные выделения, что связано с персистирующей гиперпролактинемией. Как правило, гинекомастия протекает бессимптомно или проявляется чувством давления и повышенной чувствительностью сосков. Типично концентрическое увеличение грудной железы, которое определяется как параареолярное уплотнение, отграниченное от окружающей жировой клетчатки. В 80 % случаев гинекомастия двусторонняя. При одностороннем увеличении грудной железы возрастает вероятность опухолевого процесса. Для эстроген- и ХГпродуцирующих опухолей характерно быстрое внезапное увеличение грудных желез в сочетании с болями, чувством давления.
Диагностика
1. Физикальное обследование: пальпация грудных желез, яичек, оценка развития вторичных половых признаков (симптомы гипогонадизма), поиск клинических признаков системных заболеваний. При опросе обращают внимание на принимаемые лекарственные препараты и пищевые добавки, употребление алкоголя, наркотиков.
2. Лабораторное исследование: тестостерон, эстрадиол, ЛГ, ФСГ, пролактин, ГСПГ, ХГЧ, печеночные трансаминазы.
УЗИ грудных желез позволяет дифференцировать истинную и ложную гинекомастию, выявить опухоль грудной железы. УЗИ яичек необходимо для исключения их опухоли.
Дифференциальная диагностика
Опухоль грудной железы, ложная гинекомастия, а также выявление причины гинекомастии.
Лечение
♦ Неонатальная и пубертатная гинекомастии не требуют лечения и самопроизвольно исчезают.
♦ Патологическая гинекомастия может разрешиться после ликвидации вызвавшего ее фактора (отмена лекарственного препарата, компенсация основного заболевания и т.д.).
♦ Лечение может понадобиться при выраженной, стойко сохраняющейся гинекомастии в связи с косметическими проблемами и/или выраженным раздражением сосков. В этих случаях речь, как правило, идет о мастэктомии, поскольку попытки консервативного лечение (тамоксифен, кломифен, даназол), чаще всего безуспешны. Кроме того, хирургическое лечение гинекомастии в связи с высоким риском развития рака необходимо при синдроме Клайнфелтера.
Прогноз
При неонатальной и пубертатной формах - благоприятный. В последнем случае гинекомастия в течение 2 лет регрессирует у 75 % пациентов, а на протяжении трех лет еще у 15 %. Прогноз патологической гинекомастии зависит от ее причины, которая может быть устранимой (наркомания, прием лекарственного препарата, который можно отменить) и неустранимой (цирроз печени).