Лучевая диагностика и терапия: учебное пособие / С.К. Терновой, В.Е. Синицын. - 2010. - 304 с: ил.
|
|
|
|
ГЛАВА 2 МЕТОДЫ ЛУЧЕВОЙ ДИАГНОСТИКИ
2.1. РЕНТГЕНОДИАГНОСТИКА
(РЕНТГЕНОЛОГИЯ)
Практически во всех медицинских учреждениях широко используются аппараты для рентгенологического исследования. Рентгеновские установки просты, надежны, экономичны. Именно эти системы по-прежнему служат основой для диагностики травм скелета, болезней легких, почек и пищеварительного канала. Кроме того, рентгеновский метод играет важную роль при выполнении различных интервенционных вмешательств (как диагностических, так и лечебных).
2.1.1. Краткая характеристика рентгеновского излучения
Рентгеновское излучение представляет собой электромагнитные волны (поток квантов, фотонов), энергия которых расположе- на на энергетической шкале между ультрафиолетовым излучением и гамма-излучением (рис. 2-1). Фотоны рентгеновского излучения имеют энергию от 100 эВ до 250 кэВ, что соответствует излучению с частотой от 3?1016 Гц до 6?1019 Гц и длиной волны 0,005-10 нм. Электромагнитные спектры рентгеновского излучения и гаммаизлучения в значительной степени перекрываются между собой.
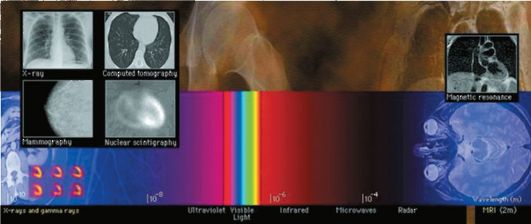
Рис. 2-1. Шкала электромагнитных излучений
Основным отличием этих двух видов излучения является способ их возникновения. Рентгеновские лучи получаются при участии электронов (например, при торможении их потока), а гамма-лучи - при радиоактивном распаде ядер некоторых элементов.
Рентгеновские лучи могут генерироваться при торможении ускоренного потока заряженных частиц (так называемое тормозное излучение) или же при возникновении высокоэнергетичных переходов в электронных оболочках атомов (характеристическое излучение). В медицинских приборах для генерации рентгеновских лучей используются рентгеновские трубки (рис. 2-2). Их основными компонентами являются катод и массивный анод. Электроны, испускаемые вследствие разности электрических потенциалов между анодом и катодом, ускоряются, достигают анода, при столкновении с материалом которого тормозятся. Вследствие этого возникает тормозное рентгеновское излучение. Во время столкновения электронов с анодом происходит и второй процесс - выбиваются электроны из электронных оболочек атомов анода. Их места занимают электроны из других оболочек атома. В ходе этого процесса генерируется второй тип рентгеновского излучения - так называемое характеристическое рентгеновское излучение, спектр которого в значительной мере зависит от материала анода. Аноды чаще всего изготавливают из молибдена или вольфрама. Существуют специальные устройства для фокусировки и фильтрации рентгеновского излучения с целью улучшения получаемых изображений.
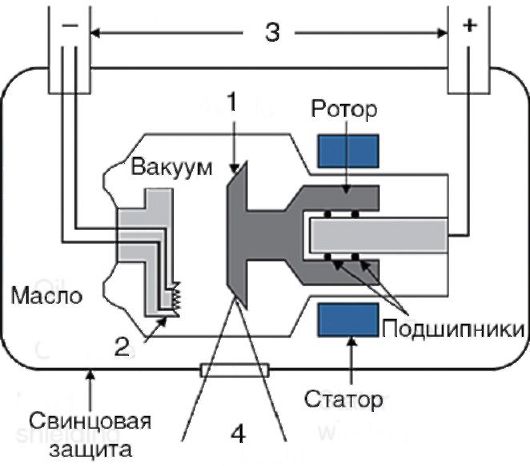
Рис. 2-2. Схема устройства рентгеновской трубки:
1 - анод; 2 - катод; 3 - напряжение, подаваемое на трубку; 4 - рентгеновское излучение
Свойствами рентгеновских лучей, обусловливающими их использование в медицине, являются проникающая способность, флюоресцирующее и фотохимическое действия. Проникающая способность рентгеновских лучей и их поглощение тканями человеческого тела и искусственными материалами являются важнейшими свойствами, которые обусловливают их применение в лучевой диагностике. Чем короче длина волны, тем большей проникающей способностью обладает рентгеновское излучение.
Различают «мягкое» рентгеновское излучение с малой энергией и частотой излучения (соответственно с наибольшей длиной волны) и «жесткое», обладающее высокой энергией фотонов и частотой излучения, имеющее короткую длину волны. Длина волны рентгеновского излучения (соответственно его «жесткость» и проникающая способность) зависит от величины напряжения, приложенного к рентгеновской трубке. Чем выше напряжение на трубке, тем больше скорость и энергия потока электронов и меньше длина волны у рентгеновских лучей.
При взаимодействии проникающего через вещество рентгеновского излучения в нем происходят качественные и количественные изменения. Степень поглощения рентгеновских лучей тканями различна и определяется показателями плотности и атомного веса элементов, составляющих объект. Чем выше плотность и атомный вес вещества, из которого состоит исследуемый объект (орган), тем больше поглощаются рентгеновские лучи. В человеческом теле имеются ткани и органы разной плотности (легкие, кости, мягкие ткани и т.д.), это объясняет различное поглощение рентгеновских лучей. На искусственной или естественной разности в поглощении рентгеновских лучей различными органами и тканями и основана визуализация внутренних органов и структур.
Для регистрации прошедшего через тело излучения используется его способность вызывать флюоресценцию некоторых соединений и оказывать фотохимическое действие на пленку. С этой целью исполь- зуются специальные экраны для рентгеноскопии и фотопленки для рентгенографии. В современных рентгеновских аппаратах для регистрации ослабленного излучения применяют специальные системы цифровых электронных детекторов - цифровые электронные панели. В этом случае рентгеновские методы называют цифровыми.
Из-за биологического действия рентгеновских лучей необходимо прибегать к защите пациентов при исследовании. Это достигается
максимально коротким временем облучения, заменой рентгеноскопии на рентгенографию, строго обоснованным применением ионизирующих методов, защитой с помощью экранирования пациента и персонала от воздействия излучения.
2.1.2. Рентгенография и рентгеноскопия
Рентгеноскопия и рентгенография являются основными методами рентгенологического исследования. Для изучения различных органов и тканей создан целый ряд специальных аппаратов и методов (рис. 2-3). Рентгенография по-прежнему очень широко используется в клинической практике. Рентгеноскопия применяется реже из-за относительно высокой лучевой нагрузки. К рентгеноскопии вынуждены прибегать там, где рентгенография или неионизирующие методы получения информации недостаточны. В связи с развитием КТ роль классической послойной томографии снизилась. Методика послойной томографии применяется при исследовании легких, почек и костей там, где отсутствуют кабинеты КТ.
Рентгеноскопия (греч. scopeo - рассматривать, наблюдать) - исследование, при котором рентгеновское изображение проецируется на флюоресцирующий экран (или систему цифровых детекторов). Метод позволяет проводить статическое, а также динамическое, функциональное изучение органов (например, рентгеноскопия желудка, экскурсия диафрагмы) и контролировать проведение интервенционных процедур (например, ангиографии, стентирования). В настоящее время при использовании цифровых систем изображения получают на экране компьютерных мониторов.
К основным недостаткам рентгеноскопии относятся относительно высокая лучевая нагрузка и трудности в дифференциации «тонких» изменений.
Рентгенография (греч greapho - писать, изображать) - исследование, при котором получают рентгеновское изображение объекта, фиксированное на пленке (прямая рентгенография) или на специальных цифровых устройствах (цифровая рентгенография).
Различные варианты рентгенографии (обзорная рентгенография, прицельная рентгенография, контактная рентгенография, контрастная рентгенография, маммография, урография, фистулография, артрография и пр.) используются с целью улучшения качества и увеличения количества получаемой диагности-
Рис. 2-3. Современный рентгеновский аппарат
ческой информации в каждой конкретной клинической ситуации. Например, контактную рентгенографию используют при снимках зубов, а контрастную - для проведения экскреторной урографии.
Методики рентгенографии и рентгеноскопии могут применяться при вертикальном или горизонтальном положении тела пациента на стационарных или палатных установках.
Традиционная рентгенография с использованием рентгенологической пленки или цифровая рентгенография остается одной из основных и широко применяемых методик исследования. Это связано с высокой экономичностью, простотой и информативностью получаемых диагностических изображений.
При фотографировании объекта с флюоресцирующего экрана на пленку (обычно небольшого размера - фотопленка специального формата) получают рентгеновские изображения, применяющиеся обычно для массовых обследований. Эта методика называется флюорографией. В настоящее время она постепенно выходит из употребления вследствие замены ее цифровой рентгенографией.
Недостатком любого вида рентгенологического исследования является его невысокая разрешающая способность при исследовании малоконтрастных тканей. Применявшаяся для этой цели ранее классическая томография не давала желаемого результата. Именно для преодоления этого недостатка и была создана КТ.
2.2. УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА (СОНОГРАФИЯ, УЗИ)
Ультразвуковая диагностика (сонография, УЗИ) - метод лучевой диагностики, основанный на получении изображения внутренних органов с помощью ультразвуковых волн.
УЗИ широко используется в диагностике. За последние 50 лет метод стал одним из наиболее распространенных и важных, обес- печивающих быструю, точную и безопасную диагностику многих заболеваний.
Ультразвуком называют звуковые волны с частотой свыше 20 000 Гц. Это форма механической энергии, имеющей волновую природу. Ультразвуковые волны распространяются в биологических средах. Скорость распространения ультразвуковой волны в тканях постоянна и составляет 1540 м/сек. Изображение получается при анализе отраженного от границы двух сред сигнала (эхо-сигнала). В медицине наиболее часто используются частоты в диапазоне 2-10 МГц.
Ультразвук генерируется специальным датчиком с пьезоэлектрическим кристаллом. Короткие электрические импульсы создают механические колебания кристалла, в результате чего генерируется ультразвуковое излучение. Частота ультразвука определяется резонансной частотой кристалла. Отраженные сигналы записываются, анализируются и отображаются визуально на экране прибора, создавая изображения исследуемых структур. Таким образом, датчик работает последовательно как излучатель, а затем - как приемник ультразвуковых волн. Принцип работы ультразвуковой системы представлен на рис. 2-4.
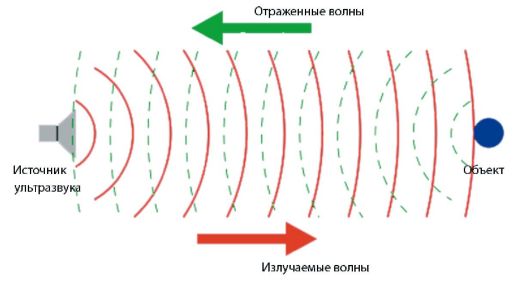
Рис. 2-4. Принцип работы ультразвуковой системы
Чем больше акустическое сопротивление, тем больше отражение ультразвука. Воздух не проводит звуковые волны, поэтому для улучшения проникновения сигнала на границе воздух/кожа на датчик наносят специальный ультразвуковой гель. Это позволяет устранить прослойку воздуха между кожей пациента и датчиком. Сильные артефакты при исследовании могут возникнуть от структур, содержащих воздух или кальций (легочные поля, петли кишки, кости и кальцинаты). Например, при исследовании сердца последнее может быть практически полностью прикрыто тканями, отражающими или не проводящими ультразвук (легкие, кости). В этом случае исследование органа возможно только через небольшие области на
поверхности тела, где исследуемый орган контактирует с мягкими тканями. Такая область называется ультразвуковым «окном». При плохом ультразвуковом «окне» исследование может быть невозможно или малоинформативно.
Современные ультразвуковые аппараты - это сложные цифровые устройства. В них используются датчики, работающие в режиме реального времени. Изображения динамичны, на них можно наблюдать такие быстрые процессы, как дыхание, сокращения сердца, пульсацию сосудов, движение клапанов, перистальтику, движения плода. Положение датчика, подключаемого к ультразвуковому прибору гибким кабелем, может изменяться в любой плоскости и под любым углом. Генерируемый в датчике аналоговый электрический сигнал оцифровывается, и создается цифровое изображение.
Очень важной при ультразвуковом исследовании является методика допплерографии. Допплер описал физический эффект, согласно которому частота звука, генерируемого движущимся объектом, изменяется при ее восприятии неподвижным приемником в зависимости от скорости, направления и характера движения. Метод допплерографии используют для измерения и визуализации скорости, направления и характера движения крови в сосудах и камерах сердца, а также движения любых других жидкостей.
При допплеровском исследовании кровеносных сосудов через исследуемую область проходит непрерывно-волновое или импульсное ультразвуковое излучение. При пересечении ультразвуковым лучом сосуда или камеры сердца ультразвук частично отражается эритроцитами. Так, например, частота отраженного эхо-сигнала от крови, движущейся в направлении датчика, будет выше, чем исходная частота волн, излучаемых датчиком. Наоборот, частота отраженного эхо-сигнала от крови, движущейся от датчика, будет ниже. Разница между частотой принятого эхо-сигнала и частотой генерируемого датчиком ультразвука называется допплеровским сдвигом. Этот частотный сдвиг пропорционален скорости кровотока. Ультразвуковой прибор автоматически преобразует допплеровский сдвиг в относительную скорость кровотока.
Исследования, объединяющие в себе двухмерное ультразвуковое исследование в масштабе реального времени и импульсную доппле- рографию, называют дуплексными. При дуплексном исследовании направление допплеровского луча накладывается на двухмерное изображение в В-режиме.
Современное развитие техники дуплексного исследования привело к появлению методики цветового допплеровского картирования кровотока. В пределах контрольного объема окрашенный кровоток накладывается на двухмерное изображение. При этом кровь отображается цветом, а неподвижные ткани - в серой шкале. При движении крови к датчику используются красно-желтые цвета, при движении от датчика - сине-голубые. Такое цветное изображение не несет дополнительной информации, но дает хорошее визуальное представление о характере движения крови.
В большинстве случаев с целью проведения УЗИ достаточно использовать датчики для чрескожного исследования. Однако в части случаев необходимо приблизить датчик к объекту. Например, у крупных пациентов для исследования сердца применяются датчики, помещенные в пищевод (чреспищеводная эхокардиография), в других случаях для получения высококачественного изображения применяют внутриректальные или внутривагинальные датчики. Во время операции прибегают к использованию операционных датчиков.
В последние годы все шире используется трехмерное УЗИ. Спектр ультразвуковых систем очень широк - есть портативные устройства, аппараты для интраоперационного УЗИ и УЗ-системы экспертного класса (рис. 2-5).
В современной клинической практике метод ультразвукового исследования (сонография) распространен исключительно широко. Это объясняется тем, что при применении метода отсутствует ионизирующее излучение, есть возможность проведения функциональных и нагрузочных тестов, метод информативен и относительно недорог, аппараты компактны и просты в использовании.
Рис. 2-5. Современный ультразвуковой аппарат
Однако метод сонографии имеет свои органичения. К ним относятся высокая частота артефактов на изображении, небольшая глубина проникновения сигнала, малое поле обзора, высокая зависимость интерпретации результатов от оператора.
С развитием ультразвукового оборудования информативность этого метода повышается.
2.3. КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ (КТ)
КТ - метод рентгеновского исследования, основанный на получении послойных изображений в поперечной плоскости и их компьютерной реконструкции.
Создание аппаратов для КТ - следующий революционный шаг в получении диагностических изображений после открытия Х-лучей. Это связано не только с универсальностью и непревзойденной разрешающей способностью метода при исследовании всего тела, но и с новыми алгоритмами построения изображений. В настоящее время во всех приборах, связанных с получением изображений, в той или иной степени используются технические приемы и математические методы, которые были положены в основу КТ.
КТ не имеет абсолютных противопоказаний к своему использованию (кроме ограничений, связанных с ионизирующей радиацией) и может применяться для неотложной диагностики, скрининга, а также как метод уточняющей диагностики.
Основной вклад в создание компьютерной томографии сделал британский ученый Годфри Хаунсфилд в конце 60-х гг. ХХ века.
На первых порах компьютерные томографы подразделялись на поколения в зависимости от того, как была устроена система «рентгеновская трубка - детекторы». Несмотря на множественные отличия в строении, все они назывались «шаговыми» томографами. Это было связано с тем, что после выполнения каждого поперечного среза томограф останавливался, стол с пациентом делал «шаг» на несколько миллиметров, а затем выполнялся следующий срез.
В 1989 г. появилась спиральная компьютерная томография (СКТ). В случае СКТ рентгеновская трубка с детекторами постоянно вращается вокруг непрерывно движущегося стола с пациен-
том. Это позволяет не только сократить время исследования, но и избежать ограничений «шаговой» методики - пропуска участ- ков при исследовании из-за разной глубины задержки дыхания пациентом. Новое программное обеспечение дополнительно позволило изменять ширину среза и алгоритм восстановления изображения после окончания исследования. Это дало возможность получать новую диагностическую информацию без повторного исследования.
С этого момента КТ стала стандартизованной и универсальной. Удалось синхронизировать введение контрастного вещества с нача- лом движения стола при СКТ, что привело к созданию КТ-ангиографии.
В 1998 г. появилась мультиспиральная КТ (МСКТ). Были созданы системы не с одним (как при СКТ), а с 4 рядами цифровых детекторов. С 2002 г. начали применяться томографы с 16 рядами цифровых элементов в детекторе, а с 2003 г. количество рядов элементов достигло 64. В 2007 г. появились МСКТ с 256 и 320 рядами детекторных элементов.
На таких томографах можно получать сотни и тысячи томограмм всего лишь за несколько секунд с толщиной каждого среза 0,5-0,6 мм. Такое техническое усовершенствование позволило выполнять исследование даже больным, подключенным к аппарату искусственного дыхания. Кроме ускорения обследования и улучшения его качества была решена такая сложная проблема, как визуализация коронарных сосудов и полостей сердца с помощью КТ. Появилась возможность при одном 5-20-секундном исследовании изучить коронарные сосуды, объем полостей и функцию сердца, перфузию миокарда.
Принципиальная схема устройства КТ показана на рис. 2-6, а внешний вид - на рис. 2-7.
К основным достоинствам современных КТ относятся: быстрота получения изображений, послойный (томографический) характер изображений, возможность получения срезов любой ориентации, высокое пространственное и временное разрешение.
Недостатками КТ являются относительно высокая (по сравнению с рентгенографией) лучевая нагрузка, возможность появления арте- фактов от плотных структур, движений, относительно невысокое мягкотканое контрастное разрешение.
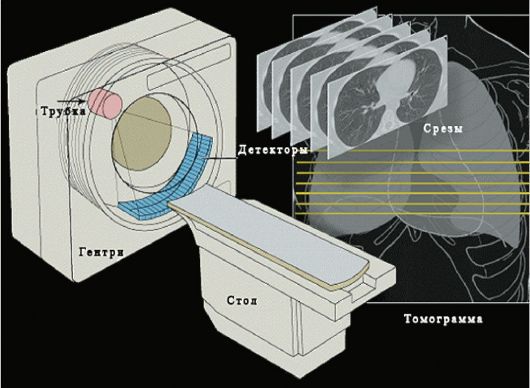
Рис. 2-6. Схема устройства МСКТ
Рис. 2-7. Современный 64-спиральный компьютерный томограф
2.4. МАГНИТНО-РЕЗОНАНСНАЯ
ТОМОГРАФИЯ (МРТ)
Магнитно-резонансная томография (МРТ) - метод лучевой диагностики, основанный на получении послойных и объемных изоб- ражений органов и тканей любой ориентации с помощью явления ядерного магнитного резонанса (ЯМР). Первые работы по получению изображений с помощью ЯМР появились в 70-х гг. прошлого века. К настоящему времени этот метод медицинской визуализации неузнаваемо изменился и продолжает развиваться. Совершенствуются техническое и программное обеспечение, улучшаются методики получения изображений. Раньше область использования МРТ ограничивалась лишь изучением ЦНС. Сейчас метод с успехом применяется и в других областях медицины, включая исследования сосудов и сердца.
После включения ЯМР в число методов лучевой диагностики прилагательное «ядерный» перестали использовать, чтобы не вызывать у пациентов ассоциации с ядерным оружием или ядерной энергетикой. Поэтому в наши дни официально используется термин «магнитнорезонансная томография» (МРТ).
ЯМР - это физическое явление, основанное на свойствах некоторых атомных ядер, помещенных в магнитном поле, поглощать внешнюю энергию в радиочастотном (РЧ) диапазоне и излучать ее после прекращения воздействия радиочастотного импульса. Напряженность постоянного магнитного поля и частота радиочастотного импульса строго соответствуют друг другу.
Важными для использования при магнитно-резонансной томографии являются ядра 1H, 13С, 19F, 23Na и 31Р. Все они обладают магнитными свойствами, что отличает их от немагнитных изотопов. Протоны водорода (1H) наиболее распространены в организме. Поэтому для МРТ используется именно сигнал от ядер водорода (протонов).
Ядра водорода можно представить как маленькие магниты (диполи), имеющие два полюса. Каждый протон вращается вокруг собс- твенной оси и обладает небольшим магнитным моментом (вектором намагниченности). Вращающиеся магнитные моменты ядер называют спинами. Когда такие ядра помещают во внешнее магнитное поле, они могут поглощать электромагнитные волны определенных частот. Этот феномен зависит от типа ядер, напряженности магнитного поля, физического и химического окружения ядер. При этом поведе-
ние ядра можно сравнивать с вращающимся волчком. Под действием магнитного поля вращающееся ядро совершает сложное движение. Ядро вращается вокруг своей оси, а сама ось вращения совершает конусообразные круговые движения (прецессирует), отклоняясь от вертикального направления.
Во внешнем магнитном поле ядра могут находиться либо в стабильном энергетическом состоянии, либо в возбужденном состоянии. Разность энергий этих двух состояний настолько мала, что количество ядер на каждом из этих уровней почти идентично. Поэтому результирующий сигнал ЯМР, зависящий именно от различия населенностей этих двух уровней протонами, будет очень слабым. Чтобы обнаружить эту макроскопическую намагниченность, необходимо отклонить ее вектор от оси постоянного магнитного поля. Это достигается с помощью импульса внешнего радиочастотного (электромагнитного) излучения. При возвращении системы к равновесному состоянию излучается поглощенная энергия (МРсигнал). Этот сигнал регистрируется и используется для построения МР-изображений.
Специальные (градиентные) катушки, расположенные внутри главного магнита, создают небольшие дополнительные магнитные поля таким образом, что сила поля линейно увеличивается в одном направлении. Передавая радиочастотные импульсы с установленным заранее узким диапазоном частот, можно получать МР-сигналы только от выбранного слоя ткани. Ориентация градиентов магнитного поля и соответственно направление срезов могут быть легко заданы в любом направлении. Получаемые от каждого объемного элемента изображения (воксель) сигналы имеют свой, единственный, распознаваемый, код. Этим кодом являются частота и фаза сигнала. На основании этих данных можно строить двухили трехмерные изображения.
Для получения сигнала магнитного резонанса используются комбинации радиочастотных импульсов различной длительности и формы. Сочетая различные импульсы, формируют так называемые импульсные последовательности, которые используются для получения изображений. К специальным импульсным последовательностям относятся МР-гидрография, МР-миелография, МР-холангиография и МР-ангиография.
Ткани с большими суммарными магнитными векторами будут индуцировать сильный сигнал (выглядят яркими), а ткани с малы-
ми магнитными векторами - слабый сигнал (выглядят темными). Анатомические области с малым количеством протонов (например, воздух или компактная кость) индуцируют очень слабый МР-сигнал и, таким образом, всегда представляются на изображении темными. Вода и другие жидкости имеют сильный сигнал и на изображении выглядят яркими, причем различной интенсивности. Изображения мягких тканей также имеют различную интенсивность сигнала. Это обусловлено тем, что, помимо протонной плотности, характер интенсивности сигнала при МРТ определяется и другими параметрами. К ним относятся: время спин-решетчатой (продольной) релаксации (Т1), спин-спиновой (поперечной) релаксации (Т2), движение или диффузия исследуемой среды.
Время релаксации тканей - Т1 и Т2 - является константой. В МРТ используются понятия «Т1-взвешенное изображение», «Т2-взвешенное изображение», «протонно-взвешенное изображение», обозначающие, что различия между изображениями тканей преимущественно обусловлены преимущественным действием одного из этих факторов.
Регулируя параметры импульсных последовательностей, рентгенолаборант или врач могут влиять на контрастность изображений, не прибегая к помощи контрастных средств. Поэтому в МР-томог- рафии существует значительно больше возможностей для изменения контраста на изображениях, чем при рентгенографии, КТ или УЗИ. Однако введение специальных контрастных веществ еще более может изменить контрастность между нормальными и патологическими тканями и улучшить качество визуализации.
Принципиальная схема устройства МР-системы и внешний вид прибора показаны на рис. 2-8
и 2-9.
Обычно МР-томографы классифицируются в зависимости от напряженности магнитного поля. Сила магнитного поля измеряется в теслах (Тл) или гауссах (1Тл = 10 000 гаусс). Сила магнитного поля Земли колеблется от 0,7 гаусса на полюсе до 0,3 гаусса на экваторе. Для кли-

Рис. 2-8. Схема устройства МРТ
Рис. 2-9. Современная система МРТ с полем 1,5 тесла
нической МР-томографии используются магниты с полями от 0,2 до 3 тесла. В настоящее время для диагностики чаще всего используются МР-системы с полем 1,5 и 3 Тл. Такие системы составляют до 70% мирового парка оборудования. Линейной зависимости между силой поля и качеством изображений нет. Однако приборы с такой силой поля дают лучшее по качеству изображение и имеют большее количество программ, применяемых в клинической практике.
Основной областью применения МРТ стал головной, а затем и спинной мозг. Томограммы головного мозга позволяют получить великолепное изображение всех структур мозга, не прибегая к дополнительному введению контраста. Благодаря технической возможности метода получать изображение во всех плоскостях, МР-томография произвела революцию в исследовании спинного мозга и межпозвонковых дисков.
В настоящее время МР-томография все шире используется для исследования суставов, органов малого таза, молочных желез, сердца и сосудов. Для этих целей разработаны дополнительные специальные катушки и математические методы построения изображения.
Специальная техника позволяет записать изображения сердца в разные фазы сердечного цикла. Если исследование проводится при
синхронизации с ЭКГ, то можно получить изображения функционирующего сердца. Такое исследование называется кино-МРТ.
Магнитно-резонансная спектроскопия (МРС) - это неинвазивный метод диагностики, который позволяет качественно и количес- твенно определять химический состав органов и тканей, используя ядерный магнитный резонанс и феномен химического сдвига.
МР-спектроскопия чаще всего проводится с целью получения сигналов от ядер фосфора и водорода (протонов). Однако из-за технических трудностей и длительности проведения она все еще редко применяется в клинической практике. Не следует забывать, что все более широкое применение МРТ требует особого внимания к вопросам безопасности пациентов. При обследовании с помощью МР-спектроскопии пациент не подвергается действию ионизирующего излучения, однако на него действуют электромагнитные и радиочастотные излучения. Находящиеся в теле обследуемого человека металлические предметы (пули, осколки, крупные имплантаты) и все электронно-механические устройства (например, водитель сердечного ритма) могут повредить пациенту из-за смещения или нарушения (прекращения) нормальной работы.
Многие пациенты испытывают боязнь закрытых пространств - клаустрофобию, что приводит к невозможности выполнить исследование. Таким образом, все пациенты должны быть информированы о возмож- ных нежелательных последствиях исследования и о характере процедуры, а лечащие врачи и врачи-рентгенологи перед исследованием обязаны опрашивать пациента на предмет наличия указанных выше предметов, ранений и операций. Перед исследованием пациент должен полностью переодеться в специальный костюм для исключения попадания металлических вещей из карманов одежды внутрь канала магнита.
Важно знать относительные и абсолютные противопоказания к проведению исследования.
К абсолютным противопоказаниям к исследованию относят состо - яния, при которых его проведение создает угрожающую для жизни больного ситуацию. К такой категории относятся и все пациенты с наличием электронно-механических устройств в теле (кардиостимуляторов), и пациенты с наличием металлических клипс на артериях головного мозга. К относительным противопоказаниям к исследованию относятся состояния, которые могут создавать определенные опасности и трудности при проведении МРТ, но оно в большинстве случаев все-таки возможно. Такими противопоказаниями являются
наличие кровоостанавливающих скобок, зажимов и клипс прочей локализации, декомпенсации сердечной недостаточности, первый триместр беременности, клаустрофобия и необходимость в физиологическом мониторинге. В таких случаях решение о возможности проведения МРТ решается в каждом индивидуальном случае исходя из соотношения величины возможного риска и ожидаемой пользы от выполнения исследования.
Большинство небольших металлических объектов (искусственные зубы, хирургический шовный материал, некоторые виды искус- ственных клапанов сердца, стенты) не являются противопоказанием к проведению исследования. Клаустрофобия является препятствием для проведения исследования в 1-4% случаев.
Как и другие методики лучевой диагностики, МРТ не лишена недостатков.
К существенным недостаткам МРТ относятся относительно длительное время исследования, невозможность точного выявления мелких камней и кальцинатов, сложность оборудования и его эксплуатации, специальные требования к установке приборов (защита от помех). С помощью МРТ трудно обследовать пациентов, нуждающихся в оборудовании, которое поддерживает их жизнедеятельность.
2.5. РАДИОНУКЛИДНАЯ ДИАГНОСТИКА
Радионуклидная диагностика или ядерная медицина - метод лучевой диагностики, основанный на регистрации излучения от введенных в организм искусственных радиоактивных веществ.
Для радионуклидной диагностики применяется широкий спектр меченых соединений (радиофармпрепаратов (РФП)) и способов их регистрации специальными сцинтилляционными датчиками. Энергия поглощенного ионизирующего излучения возбуждает в кристалле датчика вспышки видимого света, каждая из которых усиливается с помощью фотоумножителей и преобразуется в импульс тока.
Анализ мощности сигнала позволяет определить интенсивность и положение в пространстве каждой сцинтилляции. Эти данные используются для реконструкции двухмерного изображения распространения РФП. Изображение может быть представлено непосредственно на экране монитора, на фотоили мультиформатной пленке или записано на компьютерный носитель.
Выделяют несколько групп радиодиагностических приборов в зависимости от способа и типа регистрации излучений:
- радиометры - приборы для измерения радиоактивности всего тела;
- радиографы - приборы для регистрации динамики изменения радиоактивности;
- сканеры - системы для регистрации пространственного распределения РФП;
- гамма-камеры - приборы для статической и динамической регистрации объемного распределения радиоактивного индикатора.
В современных клиниках большинство приборов для радионуклидной диагностики составляют гамма-камеры различных типов.
Современные гамма-камеры представляют собой комплекс, состоящий из 1-2 систем детекторов большого диаметра, стола для позиционирования пациента и компьютерной системы для накопления и обработки изображений (рис. 2-10).
Следующим шагом в развитии радионуклидной диагностики стало создание ротационной гамма-камеры. С помощью этих приборов удалось применить методику послойного исследования распределения изотопов в организме - однофотонную эмиссионную компьютерную томографию (ОФЭКТ).

Рис. 2-10. Схема устройства гамма-камеры
Для ОФЭКТ используются ротационные гамма-камеры с одним, двумя или тремя детекторами. Механические системы томографов позволяют вращать детекторы вокруг тела пациента по разным орбитам.
Пространственное разрешение современных ОФЭКТ составляет порядка 5-8 мм. Вторым условием выполнения радиоизотопного исследования, помимо наличия специального оборудования, является использование специальных радиоактивных индикаторов - радиофармпрепаратов (РФП), которые вводятся в организм пациента.
Радиофармпрепарат - радиоактивное химическое соединение с известными фармакологическими и фармакокинетическими харак- теристиками. К РФП, применяемым в медицинской диагностике, предъявляются достаточно строгие требования: тропность к органам и тканям, легкость приготовления, короткий период полураспада, оптимальная энергия гамма-излучения (100-300 кЭв) и низкая радиотоксичность при относительно высоких допустимых дозах. Идеальный радиофармпрепарат должен поступать только в предназначенные для исследования органы или патологические очаги.
Понимание механизмов локализации РФП служит основой адекватной интерпретации радионуклидных исследований.
Использование современных радиоактивных изотопов в медицинской диагностической практике безопасно и безвредно. Количество активного вещества (изотопа) настолько мало, что при введении в организм это не вызывает физиологических эффектов или аллергических реакций. В ядерной медицине используются РФП, испускающие гамма-лучи. Источники альфа- (ядра гелия) и бета-частиц (электроны) в настоящее время не используются в диагностике из-за высокой степени поглощения тканями и высокой лучевой нагрузки.
Наиболее применяемым в клинической практике является изотоп технеций-99т (период полураспада - 6 ч). Этот искусственный радионуклид получают непосредственно перед исследованием из специальных устройств (генераторов).
Радиодиагностическое изображение, независимо от его типа (статика или динамика, планарное или томографическое), всегда отражает специфическую функцию исследуемого органа. По сути, это отображение функционирующей ткани. Именно в функциональном аспекте заключается принципиальная отличительная особенность радионуклидной диагностики от других методов визуализации.
РФП вводят обычно внутривенно. Для исследований вентиляции легких препарат вводится ингаляционно.
Одной из новых томографических радиоизотопных методик в ядерной медицине является позитронная эмиссионная томография (ПЭТ).
Метод ПЭТ основан на свойстве некоторых короткоживущих радионуклидов при распаде испускать позитроны. Позитрон - час- тица, равная по массе электрону, но имеющая положительный заряд. Позитрон, пролетев в веществе 1-3 мм и потеряв в столкновениях с атомами полученную в момент образования кинетическую энергию, аннигилирует с образованием двух гамма-квантов (фотонов) с энергией 511 кэВ. Эти кванты разлетаются в противоположных направлениях. Таким образом, точка распада лежит на прямой - траектории двух аннигилированных фотонов. Два детектора, расположенные друг против друга, регистрируют совмещенные аннигиляционные фотоны (рис. 2-11).
ПЭТ позволяет проводить количественную оценку концентрации радионуклидов и обладает более широкими возможностями для изу- чения метаболических процессов, чем сцинтиграфия, выполняемая с помощью гамма-камер.
Для ПЭТ используются изотопы таких элементов, как углерод, кислород, азот, фтор. Меченные этими элементами РФП являются естественными метаболитами организма и включаются в обмен
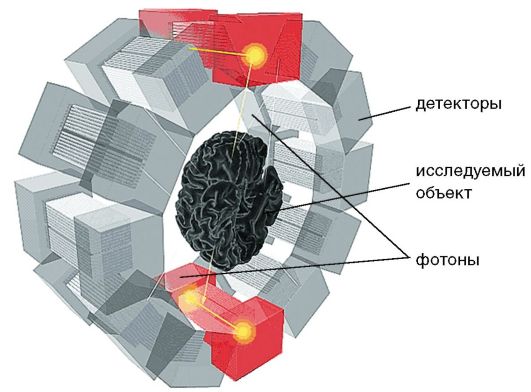
Рис. 2-11. Схема устройства ПЭТ
веществ. В результате можно изучать процессы, происходящие на клеточном уровне. С этой точки зрения ПЭТ является единственной (кроме МР-спектроскопии) методикой для оценки метаболических и биохимических процессов in vivo.
Все позитронные радионуклиды, используемые в медицине, являются сверхкороткоживущими - период их полураспада исчисляется минутами или секундами. Исключение составляют фтор-18 и руби- дий-82. В этой связи наиболее часто используется меченная фтором- 18 деоксиглюкоза (фтордеоксиглюкоза - ФДГ).
Несмотря на то, что первые системы для ПЭТ появились еще в середине ХХ в., их клиническое применение тормозится из-за некоторых ограничений. Это технические сложности, возникающие при устройстве в клиниках ускорителей для производства короткоживущих изотопов, высокая их стоимость, трудность в трактовке результатов. Одно из ограничений - плохое пространственное разрешение - было преодолено совмещением ПЭТ-системы с МСКТ, что, правда, еще больше удорожает систему (рис. 2-12). В этой связи ПЭТ-исследования проводятся по строгим показаниям, когда другие методы оказываются неэффективными.
Основными достоинствами радионуклидного метода являются высокая чувствительность к различным видам патологических процессов, возможность оценки метаболизма и жизнеспособности тканей.
К общим недостаткам радиоизотопных методов относят невысокое пространственное разрешение. Использование радиоактивных препаратов в медицинской практике связано с трудностями их транспортировки, хранения, фасовки и введения пациентам.
Рис. 2-12. Современная система ПЭТ-КТ
Устройство радиоизотопных лабораторий (особенно для ПЭТ) требует специальных помещений, охраны, сигнализации и других мер предосторожности.
2.6. АНГИОГРАФИЯ
Ангиография - метод рентгеновского исследования, связанный с прямым введением контрастного вещества в сосуды с целью их изучения.
Ангиография подразделяется на артериографию, флебографию и лимфографию. Последняя, в связи с развитием методов УЗИ, КТ и МРТ, в настоящее время практически не применяется.
Ангиография проводится в специализированных рентгеновских кабинетах. Эти кабинеты отвечают всем требованиям, предъявля- емым к операционным. Для ангиографии применяются специализированные рентгеновские аппараты (ангиографические установки) (рис. 2-13).
Введение контрастного препарата в сосудистое русло осуществляется путем инъекции шприцем или (чаще) специальным автомати- ческим инжектором после пункции сосудов.
Рис. 2-13. Современная ангиографическая установка
Основным способом катетеризации сосудов является методика катетеризации сосуда по Сельдингеру. Для выполнения ангиографии в сосуд через катетер вводится определенное количество контрастно- го агента и проводится съемка прохождения препарата по сосудам.
Вариантом ангиографии является коронароангиография (КАГ) - методика исследования коронарных сосудов и камер сердца. Это сложная методика исследования, требующая особой подготовки рен- тгенолога и сложного оборудования.
В настоящее время диагностическая ангиография периферических сосудов (например, аортография, ангиопульмонография) применяется все реже. При наличии в клиниках современных УЗ-аппаратов КТ- и МРТ-диагностика патологических процессов в сосудах все чаще осуществляется с помощью малоинвазивных (КТ-ангиография) или неинвазивных (УЗИ и МРТ) методик. В свою очередь, при ангиографии все чаще выполняются малоинвазивные хирургические процедуры (реканализация сосудистого русла, баллонная ангиопластика, стентирование). Таким образом, развитие ангиографии привело к рождению интервенционной радиологии.
2.7 ИНТЕРВЕНЦИОННАЯ РАДИОЛОГИЯ
Интервенционная радиология - область медицины, основанная на применении методов лучевой диагностики и специальных инструментов для выполнения малоинвазивных вмешательств с целью диагностики и лечения заболеваний.
Интервенционные вмешательства нашли широкое распространение во многих областях медицины, так как зачастую могут заменить большие хирургические вмешательства.
Первое чрескожное лечение стеноза периферической артерии было осуществлено американским врачом Чарльзом Доттером в 1964 г. В 1977 г. швейцарский врач Андреас Грюнтциг сконструировал катетер с баллоном и выполнил процедуру дилатации (расширения) стенозированной коронарной артерии. Этот метод стал называться баллонной ангиопластикой.
Баллонная ангиопластика коронарных и периферических артерий в настоящее время является одним из основных методов лечения стенозов и окклюзий артерий. В случае рецидива стенозов такая процедура может повторяться многократно. Для предотвращения повторных стенозов в конце прошлого века стали использовать эндо-
васкулярные протезы - стенты. Стент - это трубчатая металлическая конструкция, которая устанавливается в суженное место после баллонной дилатации. Расправленный стент не дает возникнуть повторному стенозу.
Установка стента проводится после диагностической ангиографии и определения места критического сужения. Стент подбирается по длине и размеру (рис. 2-14). С помощью такой методики можно закрывать дефекты межпредсердной и межжелудочковой перегородок без больших операций или проводить баллонную пластику стенозов аортального, митрального, трехстворчатого клапанов.
Особое значение приобрела методика установки специальных фильтров в нижнюю полую вену (кава-фильтры). Это необходимо для предотвращения попадания эмболов в сосуды легких при тромбозе вен нижних конечностей. Кава-фильтр представляет собой сетчатую структуру, которая, раскрываясь в просвете нижней полой вены, улавливает восходящие тромбы.
Еще одно востребованное в клинической практике эндоваскулярное вмешательство - эмболизация (закупорка) сосудов. Эмболизацию применяют для остановки внутренних кровотечений, лечения пато- логических сосудистых соустий, аневризм или для закрытия сосудов, питающих злокачественную опухоль. В настоящее время для эмболизации используются эффективные искусственные материалы, съемные баллоны и стальные микроскопические спирали. Обычно эмболизацию выполняют селективно, чтобы не вызвать ишемии окружающих тканей.
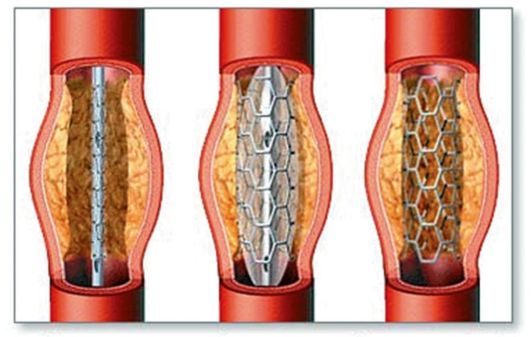
Рис. 2-14. Схема выполнения баллонной ангиопластики и стентирования
К интервенционной радиологии относится также дренирование абсцессов и кист, контрастирование патологических полостей через свищевые ходы, восстановление проходимости мочевыводящих путей при нарушениях мочевыделения, бужирование и баллонная пластика при стриктурах (сужениях) пищевода и желчных протоков, чрескожная термоили криодеструкция злокачественных опухолей и другие вмешательства.
После выявления патологического процесса зачастую приходится прибегать к такому варианту интервенционной радиологии, как пункционная биопсия. Знание морфологического строения образования позволяет выбрать адекватную тактику лечения. Пункционная биопсия выполняется под рентгенологическим, УЗИили КТ-контролем.
В настоящее время интервенционная радиология активно развивается и во многих случаях позволяет избежать больших оператив- ных вмешательств.
2.8 КОНТРАСТНЫЕ СРЕДСТВА ДЛЯ ЛУЧЕВОЙ ДИАГНОСТИКИ
Малая контрастность между соседними объектами или одинаковая плотность соседних тканей (например, плотность крови, сосу- дистой стенки и тромба) затрудняют интерпретацию изображений. В этих случаях в лучевой диагностике часто прибегают к искусственному контрастированию.
Примером усиления контрастности изображений изучаемых органов является применение сульфата бария для исследования органов пищеварительного канала. Впервые такое контрастирование было выполнено в 1909 г.
Труднее было создать контрастные средства для внутрисосудистого введения. Для этой цели после долгих экспериментов с ртутью и свинцом стали использовать растворимые соединения йода. Первые поколения рентгеноконтрастных веществ были несовершенными. Их применение вызывало частые и тяжелые (вплоть до смертельных) осложнения. Но уже в 20-30-х гг. ХХ в. был создан ряд более безопасных водорастворимых йодсодержащих препаратов для внутривенного введения. Широкое применение препаратов этой группы началось с 1953 г., когда был синтезирован препарат, молекула которого состояла из трех атомов йода (диатризоат).
В 1968 г. были разработаны вещества, обладавшие низкой осмолярностью (они не диссоциировали в растворе на анион и катион), - неионные контрастные средства.
Современные рентгеноконтрастные средства представляют собой трийодзамещенные соединения, содержащие три или шесть атомов йода.
Существуют препараты для внутрисосудистого, внутриполостного и субарахноидального введения. Можно также вводить контрастное вещество в полости суставов, в полостные органы и под оболочки спинного мозга. Например, введение контраста через полость тела матки в трубы (гистеросальпингография) позволяет оценить внутреннюю поверхность полости матки и проходимость маточных труб. В неврологической практике при отсутствии МРТ применяют методику миелографии - введение водорастворимого контрастного вещества под оболочки спинного мозга. Это позволяет оценить проходимость субарахноидальных пространств. Из других методик искусственного контрастирования следует упомянуть ангиографию, урографию, фистулографию, герниографию, сиалографию, артрографию.
После быстрого (болюсного) внутривенного введения контрастного средства оно достигает правых отделов сердца, затем болюс проходит сквозь сосудистое русло легких и достигает левых отделов сердца, затем аорты и ее ветвей. Происходит быстрая диффузия контрастного средства из крови в ткани. В течение первой минуты после быстрой инъекции сохраняется высокая концентрация контрастного средства в крови и кровеносных сосудах.
Внутрисосудистое и внутриполостное введение контрастных веществ, содержащих в своей молекуле йод, в редких случаях может оказывать неблагоприятное воздействие на организм. Если такие изменения проявляются клиническими симптомами или изменяют лабораторные показатели пациента, то их называют побочными реакциями. Перед исследованием пациента с применением контрастных веществ необходимо выяснить, есть ли у него аллергические реакции на йод, хроническая почечная недостаточность, бронхиаль- ная астма и другие заболевания. Пациент должен быть предупрежден о возможной реакции и о пользе такого исследования.
В случае появления реакции на введение контрастного вещества персонал кабинета обязан действовать в соответствии со специальной инструкцией по борьбе с анафилактическим шоком для пре- дотвращения тяжелых осложнений.
Контрастные средства используются и при МРТ. Их применение началось в последние десятилетия, после интенсивного внедрения метода в клинику.
Применение контрастных препаратов при МРТ направлено на изменение магнитных свойств тканей. В этом заключается их сущест- венное отличие от йодсодержащих контрастных веществ. Если рентгеновские контрастные средства значительно ослабляют проникающую радиацию, то препараты для МРТ приводят к изменениям характеристик окружающих их тканей. Они не визуализируются на томограммах, как рентгеновские контрасты, но позволяют выявлять скрытые патологические процессы за счет изменения магнитных показателей.
Механизм действия этих средств основан на изменениях времени релаксации участка ткани. Большинство из этих препаратов изготавливается на основе гадолиния. Значительно реже применяются контрастные вещества на основе оксида железа. Эти вещества поразному влияют на интенсивность сигнала.
Позитивные (укорачивающие время релаксации Т1) обычно создаются на основе гадолиния (Gd), а негативные - (укорачивающие время Т2) на основе оксида железа. Контрастные препараты на основе гадолиния считаются более безопасными соединениями, чем йодсодержащие. Имеются лишь единичные сообщения о серьезных анафилактических реакциях на эти вещества. Несмотря на это, необходимы тщательное наблюдение за пациентом после выполнения инъекции и наличие доступного реанимационного оборудования. Парамагнитные контрастные вещества распределяются во внутрисосудистом и внеклеточном пространствах организма и не проходят через гематоэнцефалический барьер (ГЭБ). Поэтому в ЦНС в норме контрастируются только области, лишенные этого барьера, например гипофиз, воронка гипофиза, кавернозные синусы, твердая мозговая оболочка и слизистые оболочки носа и придаточных пазух. Повреждение и разрушение ГЭБ приводят к проникновению парамагнитных контрастных веществ в межклеточное пространство и локальному изменению Т1-релаксации. Это отмечается при целом ряде патологических процессов в ЦНС, таких, как опухоли, метастазы, нарушения мозгового кровообращения, инфекции.
Помимо МР-исследований ЦНС, контрастирование применяется для диагностики заболеваний костно-мышечной системы, сердца, печени, поджелудочной железы, почек, надпочечников, органов малого таза и молочных желез. Эти исследования проводятся значи-
тельно реже, чем при патологии ЦНС. Для выполнения МР-ангиографии и изучения перфузии органов требуется введение контрастного вещества специальным немагнитным инжектором.
В последние годы изучается целесообразность применения контрастных средств для ультразвуковых исследований.
Для повышения эхогенности сосудистого русла или паренхиматозного органа внутривенно вводится ультразвуковое контрастное вещество. Это могут быть взвеси твердых частиц, эмульсии капелек жидкости, а чаще всего - микропузырьки газа, помещенные в различные оболочки. Как и другие контрастные вещества, ультразвуковые контрастные средства должны обладать низкой токсичностью и быстро выводиться из организма. Препараты же первого поколения не проходили через капиллярное русло легких и разрушались в нем.
Используемые сейчас контрастные средства попадают в большой круг кровообращения, что дает возможность применять их для повышения качества изображений внутренних органов, усиления допплеровского сигнала и изучения перфузии. Окончательного мнения о целесообразности использования ультразвуковых контрастных веществ в настоящее время нет.
Побочные реакции при введении контрастных средств встречаются в 1-5% случаев. Подавляющее большинство побочных реакций - легкой степени тяжести и не требует специального лечения.
Следует уделять особое внимание предупреждению и лечению тяжелых осложнений. Частота таких осложнений составляет менее 0,1%. Самую большую опасность представляют развитие анафилак- тических реакций (идиосинкразия) при введении йодсодержащих веществ и острая почечная недостаточность.
Реакции на введение контрастных средств условно можно разделить на легкие, умеренные и тяжелые.
При легких реакциях у пациента фиксируются чувство жара или озноба, небольшая тошнота. Необходимости в проведении лечебных мероприятий нет.
При умеренных реакциях вышеописанные симптомы могут сопровождаться также снижением АД, возникновением тахикардии, рвоты, крапивницы. Необходимо оказание симптоматической лечебной помощи (обычно - введение антигистаминных препаратов, противорвотных средств, симпатомиметиков).
При тяжелых реакциях может возникнуть анафилактический шок. Необходимо срочное проведение реанимационных мероприя-
тий, направленных на поддержание деятельности жизненно важных органов.
К группе повышенного риска относятся следующие категории больных. Это пациенты:
- с тяжелыми нарушениями функции почек и печени;
- с отягощенным аллергологическим анамнезом, особенно имевшие побочные реакции на контрастные вещества ранее;
- с тяжелой сердечной недостаточностью или легочной гипертензией;
- с выраженным нарушением функции щитовидной железы;
- с тяжелым сахарным диабетом, феохромоцитомой, миеломной болезнью.
К группе риска в отношении опасности развития побочных реакций также принято относить маленьких детей и лиц старческого возраста.
Врач, назначающий исследование, должен тщательно оценить отношение риск/польза при выполнении исследований с контрас- тированием и принять необходимые меры предосторожности. Врачрентгенолог, выполняющий исследование у пациента с высоким риском побочных реакций на контрастное вещество, обязан предупредить больного и лечащего врача об опасности применения контрастных средств и при необходимости заменить исследование на другое, не требующее контрастирования.
Рентгеновский кабинет должен быть оборудован всем необходимым для проведения реанимационных мероприятий и борьбы с анафилактическим шоком.
Вопросы и задания
1. Перечислите методы лучевой диагностики, в которых ионизирующее излучение не используется.
2. На основании какого принципа возможна оценка скорости движения крови при ультразвуковом исследовании?
3. Укажите противопоказания к проведению магнитно-резонансной томографии.
4. Какова минимальная толщина среза у современного компьютерного томографа?
5. Какие типы приборов для радионуклидной диагностики наиболее широко применяются в клинической практике?
6. Какой атом содержат контрастные средства, применяемые при ангиографии?