Лучевая диагностика и терапия: учебное пособие / С.К. Терновой, В.Е. Синицын. - 2010. - 304 с: ил.
|
|
|
|
ГЛАВА 13 ЛУЧЕВАЯ ТЕРАПИЯ
Использование
ионизирующей радиации для лечения различных заболеваний началось
практически сразу после великого открытия В.К. Рентгена. С
Первые попытки применения рентгеновского излучения для лечения злокачественных опухолей основывались на первоначальных сведениях о повреждающем действии этого излучения на ткани. Внедрение в клиническую практику источников высоких энергий, искусственных радиоактивных изотопов существенно расширило возможности лучевого лечения и обеспечило заметное повышение его результативности. В современной медицине накоплен богатый клинический опыт использования различных методик лучевой терапии. Благодаря исследованиям в области радиобиологии создана солидная научная база лучевой терапии. Медицина располагает совершенным оборудованием как для определения показаний и планирования лучевой терапии, так и для ее проведения.
Существующие методы лучевого лечения можно разделить на две основные группы - способы наружной (дистанционной) лучевой терапии и внутренней, при которой источники излучения размещаются либо в полости органа, либо внутри опухолевой ткани (соответственно их можно обозначить как внутриполостная или внутритканевая лучевая терапия). Возможно также проведение системной радионуклидной терапии.
Сочетание двух способов облучения или двух видов излучений принято называть сочетанной лучевой терапией.
При сочетании лучевой терапии с хирургическими и/или химиотерапевтическими методами лечения говорят о комбинированной
терапии. В этом случае лучевая терапия может быть пред-, интраили послеоперационной.
Основными системами для проведения дистанционного облучения служат гамма-терапевтические установки различной конструкции (рис. 13-1), использующие нейтронное, протонное излучение, или ускорители электронов, которые генерируют тормозное или фотонное излучение с энергией от 4 до 20 МэВ и электроны разной энергии, подбираемой в зависимости от глубины залегания опухоли. Генераторы нейтронов, ускорители протонов и других ядерных частиц пока находят ограниченное применение. Кроме них все шире исполь-
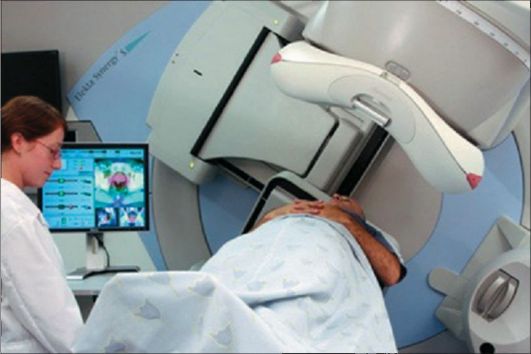
Рис. 13-1. Внешний вид установки для дистанционной лучевой терапии с помощью гамма-излучения
зуются системы для протонной лучевой терапии. Они обеспечивают лучшее распределение дозы по глубине. Максимум дозы сосредоточен в конце пробега (т.е. в облучаемом патологическом очаге - мишени), а нагрузка на поверхности тела и по пути к мишени минимальна. Система для протонной терапии представлена на рис. 13-2.
В настоящее время все большее распространение при дистанционной лучевой терапии получили компьютеризованные стереотак- сические системы с обратной связью проведения для облучения с помощью гамма-лучей («Гамма-нож») либо протонов («Кибер-нож») (рис. 13-3). Такие приборы позволяют с высокой точностью выполнять облучение очагов малых размеров или сложной формы, минимизируя воздействие на здоровые ткани. Если в процессе лечения происходит смещение тела пациента, прибор выполняет автомати- ческую коррекцию расположения зоны облучения.
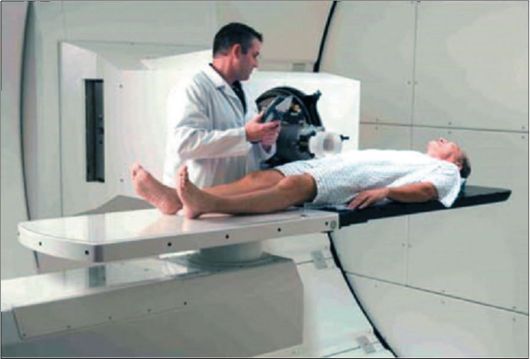
Рис. 13-2. Установка для дистанционной лучевой терапии с помощью протонов
Для контактной лучевой терапии или, как ее все чаще называют, брахитерапии (рис. 13-4) имеется ряд аппаратов и систем, дающих возможность прицельно имплантировать источники гамма-излучения внутрь опухоли или рядом с ней (рис. 13-5).
В основе применения ионизирующих излучений в лучевой терапии злокачественных опухолей лежат глубокие знания биологическо-
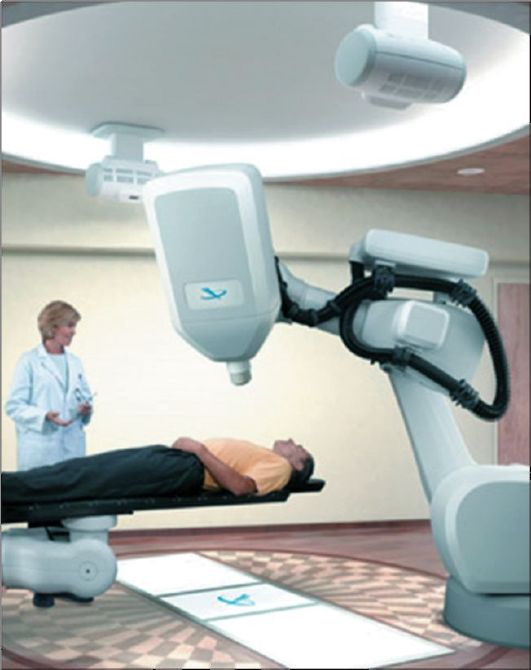
Рис. 13-3. Установка для стереотаксической лучевой терапии («Кибер-нож»)

Рис. 13-4. Прибор для контактной лучевой терапии (брахитерапии) предстательной железы
го действия ионизирующих излучений на различные органы, ткани и опухоли. Это чрезвычайно сложный процесс, сопровождающийся определенными морфологическими и функциональными изме- нениями облучаемой ткани. При этом отчетливо прослеживается
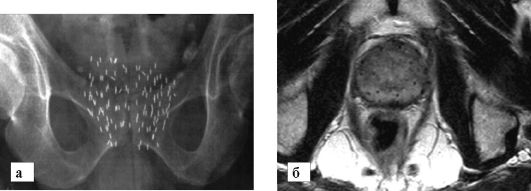
Рис. 13-5. Брахитерапия рака предстательной железы:
а - рентгенограмма таза. Видны тени от введенных капсул; б - МР-томограмма, на которой видно распределение капсул, введенных в железу
сочетание регрессивных явлений с восстановительными процессами, находящимися в тесной зависимости от поглощенной энергии и времени, прошедшего после облучения. Четкие представления об этих процессах послужили основой для успешного применения излучений в лечебных целях как средства, позволяющего уничтожить опухолевую ткань и подавить ее рост и в то же время избежать необратимых постлучевых изменений нормальных органов и тканей, окружающих опухоль.
Для лучевой терапии преимущественно используются приборы, которые генерируют гамма-излучение. Оно характеризуется короткой длиной волны, но высокой проникающей способностью в материалах с низкой молекулярной массой (вода, биологические ткани) и хорошо задерживающимися веществами с высокой молекулярной массой (свинец).
Действие ионизирующего излучения связано с образованием свободных радикалов в среде микроокружения клеток. Свободные радикалы и оксиданты взаимодействуют с молекулами ДНК, вызывая большое количество разнообразных нарушений ее структуры. Это ведет к дефектам восстановительных функций клетки и, в конце концов, к ее гибели. Во всех случаях применения лучевой терапии при опухолях лечебный комплекс направлен на повреждение опухоли, сохранение окружающих здоровых тканей.
Различные опухоли по-разному реагируют на облучение, поскольку имеют разную гистологическую природу, степень дифферен- цировки клеток, содержат разное количество кислорода и активно пролиферирующих клеток, находящихся в разных стадиях митотического цикла. Именно эти параметры в основном и определяют радиочувствительность опухоли, что, несомненно, принимается в расчет при решении вопроса об индивидуальных показаниях к лучевой терапии.
Успех лучевой терапии зависит от того, насколько точно обеспечивается облучение опухоли, поэтому очень важно точно определять местоположение и границы злокачественного образования с помощью методов визуализации. Наличие нормальных, близлежащих к опухоли органов ограничивает величину радиационной дозы вследствие присущей им специфической радиочувствительности. Если радиационная переносимость органов не будет учитываться при планировании лучевой терапии, то нормальные ткани будут испы- тывать постоянное повреждающее воздействие.
Среди основных методов лечения злокачественных опухолей лучевая терапия и в настоящее время занимает важное место. Примерно две трети онкологических больных нуждаются в лучевой терапии. Положительную роль в применении ионизирующих излучений с лечебной целью играют и такие особенности их биологического действия, как неощутимость воздействия и безболезненность сеансов облучения.
Лучевое лечение злокачественных опухолей может быть радикальным, паллиативным и симптоматическим. Радикальное лечение предусматривает полное уничтожение как первичного очага опухоли, так и возможных метастазов. Паллиативное лечение преследует цель задержать рост и развитие опухоли, продлить жизнь больному. Симптоматическое лечение назначается, чтобы снять какие-либо тяжелые проявления опухолевого роста, например сдавливание опухолью прилежащих органов с развитием тяжелых функциональных расстройств.
При лучевой терапии применяют однократное, фракционированное (дробное) и непрерывное облучение.
Разновидность лучевой терапии, при которой путем однократного прицельного воздействия высоких доз излучения стараются достичь полной гибели клеток опухоли, получила название радиохирургии.
При местно-распространенных нерезектабельных опухолях лучевая терапия как самостоятельный метод или в сочетании с другими способами консервативного лечения позволяет расширить показания к специализированной помощи за счет комплекса противоопухолевых воздействий. При генерализованных формах опухоли лучевая терапия в комплексе с другими воздействиями может дать значительный паллиативный или симптоматический эффект, способствуя как увеличению длительности выживания, так и улучшению качества жизни онкологических больных.
Роль и место лучевой терапии в лечении различных злокачественных опухолей определяются целым рядом обстоятельств - прежде всего биологическими особенностями конкретной опухоли, ее локализацией, степенью распространения, радиочувствительностью, возрастом пациента и другими факторами, а также наличием и характером лечебной альтернативы.
Для повышения эффективности лучевой терапии изучается возможность применения модифицирующих агентов, т.е. различных
физических и химических факторов, способных ослаблять радиопоражаемость нормальных тканей или усиливать радиочувствитель- ность опухоли. Кроме того, разрабатываются математические модели оптимального ритма облучения для опухолей с различными биологическими характеристиками.
Лучевая терапия среди возможных вариантов лечения злокачественных опухолей нередко оказывается методом выбора. В сочетании с современной лекарственной терапией она позволяет значительно увеличить число больных, излеченных от злокачественных опухолей.
Методы лучевой диагностики играют важную роль в планировании лучевой терапии. Ранее локализация опухоли и прилежащих к ней чувствительных органов внутри тела пациента проводилась путем рентгенографии в ортогональных проекциях (при необходимости - путем введения контрастных веществ). План проведения лучевой терапии разрабатывается соответственно плоскости поперечного сечения выбранной зоны с применением специального компьютера. Общепринятый метод планирования имеет ограничения, связанные с тем, что рентгенография обычно не может четко визуализировать опухоль, а также с трудностями пересчета данных в поперечном сечении, что необходимо для дозиметрии.
КТ внесла важный вклад в установление локализации первичных опухолей. КТ-изображения идеально подходят для целей планирования лучевой терапии, поскольку они формируются в поперечных сечениях и обеспечивают детальную визуализацию опухоли и прилегающих к ней органов, а также оконтуривают тело пациента, что необходимо для дозиметрии. Само собой разумеется, что КТ-исследования должны проводиться в условиях, тождественных тем, при которых должна проводиться лучевая терапия, что необходимо для точной репродукции последующих лечебных процедур.
С включением КТ в планирование терапии был разработан новый метод планирования лучевой терапии. КТ-данные могут быть непосредственно направлены в компьютер установки для проведения лучевой терапии (КТ-разметка, КТ-симуляция) (рис. 13-6), так как этот метод позволяет более точно выявлять опухоль, анализировать ее размер и структуру, оценивать состояние близлежащих к ней нормальных органов. Еще большую ценность КТ приобретает при лечении опухолей малого размера, т.е. в тех случаях, когда необходимо проводить облучение с более высокой точностью, чтобы уменьшить риск облучения здоровых тканей.
Современная лучевая терапия при правильно выбранных показаниях и оптимальных методиках ее проведения, как правило, не приводит к возникновению тяжелых осложнений или грубых постлучевых изменений со стороны окружающих нормальных тканей и органов.
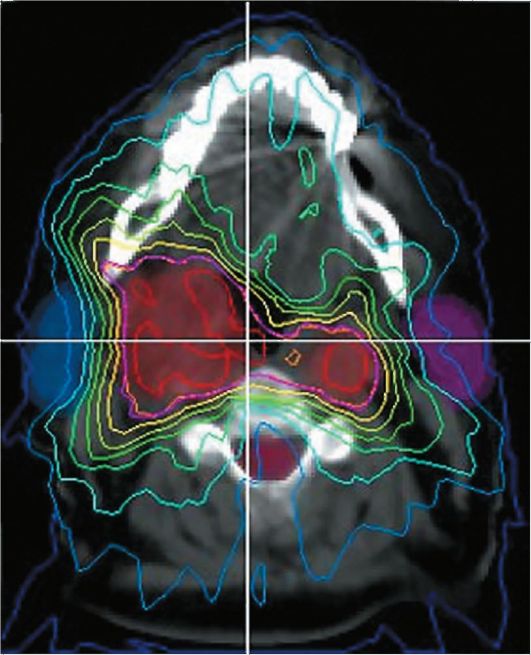
Рис. 13-6. Расчет дозных полей для индивидуального планирования дистанционной лучевой терапии пациента с опухолью шеи. Разметка выполнена с помощью данных КТ