Биохимия тканей и жидкостей полостей рта: учебное пособие / Вавилова Т.П. - 2-е изд., испр. и доп. - 2008. - 208 с. : ил.
|
|
|
|
ГЛАВА 1 БИОХИМИЯ МЕЖКЛЕТОЧНОГО МАТРИКСА
Межклеточный матрикс - комплекс органических и неорганических компонентов, заполняющих пространство между клетками. Для разных тканей характерен свой межклеточный матрикс. Эпителиальные клетки преимущественно связываются с помощью гликопротеинов, кальций-связывающих белков. Особая структура межклеточного матрикса присуща тканям мезенхимного происхождения, которые выполняют механическую, защитную и трофическую функции. Они подразделяются на:
• собственно соединительную ткань - рыхлую неоформленную,
• плотную оформленную и неоформленную; ткани со специальными свойствами - жировую, пигментную,
• ретикулярную и слизистую; скелетные ткани - костную и хрящевую.
Все эти виды соединительной ткани широко представлены во всём организме, и в частности в области головы и шеи.
1.1. ОРГАНИЗАЦИЯ МЕЖКЛЕТОЧНОГО МАТРИКСА
Для соединительной ткани характерно наличие большого количества межклеточного вещества (внеклеточный матрикс), состоя- щего из коллагеновых белков, протеогликанов и гликопротеинов и небольшого числа клеток, расположенных друг от друга на значительном расстоянии. В образовании межклеточного вещества участвуют фибробласты, хондробласты, остеобласты, одонтобласты, цементобласты и другие бластные клетки. Особенностью минерализованных тканей является присутствие в межклеточном веществе неорганических ионов, образующих соли и кристаллы.
Межклеточный матрикс содержит молекулы, способные путём самосборки образовывать комплексы. Благодаря определённому рас- положению центров связывания на молекулах и специфичности их взаимодействий формируется высокоупорядоченная трёхмерная структура межклеточного матрикса, определяющая её функциональные свойства (рис. 1.1).
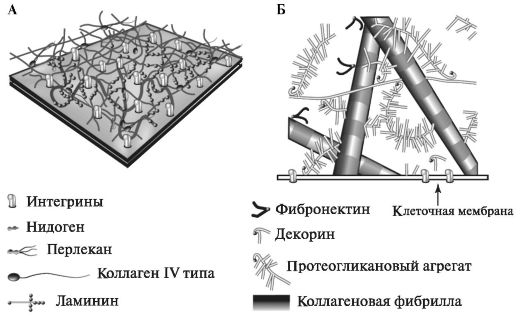
Рис. 1.1. Структурная организация межклеточного матрикса и его связи с
клетками:
А - базальная мембрана; Б - надмолекулярная организация матрикса в
соединительной ткани [по Campbell N. A., Reece J. B., 2002, с изменениями].
Специализированной формой внеклеточного матрикса нормальной ткани является базальная мембрана, образующая дискретную структуру, которая отделяет один клеточный слой от другого. Она отвечает не только за разграничение различных структур и поддержание архитектоники тканей, но и влияет на их дифференцировку, миграцию и фенотипирование клеток. Базальная мембрана служит барьером для макромолекул.
Основными компонентами внеклеточного матрикса являются различные виды коллагена и неколлагеновые белки.
1.2. СТРУКТУРА И СВОЙСТВА КОЛЛАГЕНОВЫХ БЕЛКОВ
Основу межклеточного матрикса составляет семейство коллагеновых белков, относящихся к гликопротеинам и содержащих в большом количестве остатки глицина, пролина и гидроксипролина. Коллагены представлены 20 белками, из которых часть является собственно
коллагенами, а другие содержат только коллагеноподобные домены. Все типы коллагенов в зависимости от структуры делят на несколько групп: фибриллообразующие, ассоциированные с фибриллами кол- лагена, сетевидные, микрофибриллы, заякоренные фибриллы и др. Для обозначения каждого типа коллагена используют определённую формулу, в которой а-цепи записывают арабскими цифрами, а тип коллагена - римскими.
Основная масса коллагенов, присутствующих в тканях полости рта, относится к фибриллообразующим. Локализация основных типов коллагеновых белков в тканях полости рта представлена в табл. 1.1.
Таблица 1.1
Типы коллагеновых белков в тканях полости рта
Ткани полости рта | Типы коллагена |
Дентин зуба | I, III, I V, V, VI |
Пульпа зуба | I, III, V, VI |
Цемент зуба | I, II, III, V, XII, XIV |
Периодонтальные волокна | I, III, V, VI |
Слизистая оболочка | III, I V, V, VI, XII |
Костная ткань | I, III, I V, V, VI |
Хрящевая ткань | II, VI, IX, XII, XIV |
Для тканей полости рта характерно присутствие коллагена I, III, V и VI типов. Следует отметить разнообразие коллагена в цементе зуба, в котором, помимо коллагена I, III и V типов, определяются характерные для хрящевой ткани коллагены II, IX, XII, XIV типов.
Фибриллообразующие коллагены
Все фибриллобразующие коллагены отличаются по аминокислотному составу и содержанию углеводов.
Молекулы коллагенов I, II, III, V, XI типов имеют форму фибрилл и построены из структурных единиц, называемых тропоколлагенами. Молекулы тропоколлагена (Мr 300 кДа) имеют толщину 1,5 нм и длину 300 нм. Они образованы тремя полипептидными цепями, обозначаемые как а-цепи. Каждая цепь содержит около 1000 аминокислотных остатков и представляет собой плотную левозакрученную спираль, содержащую три аминокислотных остатка на виток. Одна треть аминокислотных остатков в коллагене представлена глицином
(30%), одна пятая часть пролином в сумме с 3- и 4- гидроксипролином (21%), поэтому первичную структуру коллагена можно представить в виде схемы гли - х - у-, где х - чаще всего пролин или гидроксипролин, а у - другие аминокислоты (рис. 1.2). Всего в а-цепи встречается около 330 таких повторов.
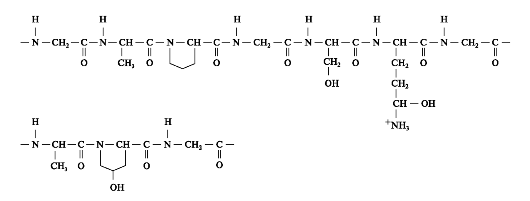
Рис. 1.2. Фрагмент первичной структуры а-цепи коллагена. В области расположения пролина и гидроксипролина происходит «пролиновый излом».
Глицин повторяющейся последовательности гли - х - у- необходим для формирования фибриллярной структуры, так как радикал любой другой аминокислоты не помещается между тремя пептидными цепями в центре тройной спирали. Пролин и гидроксипролин ограничивает вращение полипептидной цепи. Радикалы аминокислот, располагающиеся в положении - х - и -у-, находятся на поверхности тройной спирали. Распределение кластеров радикалов по длине кол- лагеновой молекулы обеспечивает самосборку многомолекулярных коллагеновых структур. Три а-цепи образуют структуру, слегка закрученную в спираль. Формируя фибриллы, молекулы тропоколлагена (тримеры) располагаются ступенчато, смещаясь относительно друг друга на одну четверть длины, что придает фибриллам характерную исчерченность. Депонируясь в тканях, сформированные фибриллы коллагена стабилизируются посредством образования ковалентных поперечных связей (рис. 1.3).
Коллаген I типа [a1(I)]2 а2 содержит 33% глицина, 13% пролина, 1% гидроксилизина и малое количество углеводов. Определяется в составе костей, дентина, пульпы зуба, цемента, периодонтальных волокон. Этот тип коллагеновых волокон участвует в процессах минерализации.
Коллаген II типа [α1(II)]3 присутствует в хрящах и образуется в нехрящевых тканях на ранних стадиях развития. Данный тип коллагена содержит небольшое количество 5 -гидроксилизина (менее 1%) и отличается высоким содержанием углеводов (более 10%).
Коллаген III типа [α1(III)]3 присутствует в стенках кровеносных сосудов. Отличительной особенностью этого коллагена является наличие большого количества гидроксипролина. В составе α-цепей присутствует цистеин, а сама молекула коллагена слабо гликозилирована.
Коллаген V типа [α(V)α2(V)α3(V)] представляет собой гибридную моле- кулу, состоящую из различных цепей, а именно: α1(V), α2(V) и α3(V).
Фибриллярные коллагены также могут иметь в своём составе 2 и более различных типов коллагенов. Так, в некоторых тканях присутствуют гибридные молекулы, содержащие цепи коллагена V и XI типов.
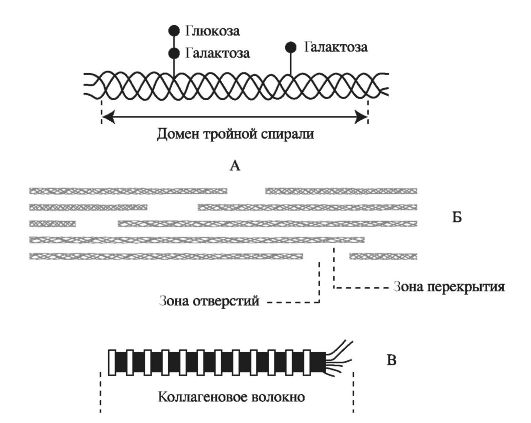
Рис. 1.3. Структура коллагеновых фибрилл: А - тропоколлаген, состоящий из трёх α-цепей; Б - коллагеновые микрофибриллы из 5 рядов тропоколлагена; В - коллагеновые фибриллы включающие 9-12 микрофибрилл тропоколлагена.
Коллагены, ассоциированные с фибриллами
В организации межклеточного матрикса слизистой оболочки, хряща и цемента корня зуба участвуют коллагены IX, XII, XIV типов. Коллагеновые белки этого класса не способны формировать фибриллы, но, связываясь с фибриллярными коллагенами, они ограничивают длину, толщину и ориентацию фибрилл коллагенов I и II типов. Особенностью коллагенов, ассоциированных с фибриллами, является наличие в их структуре как глобулярных, так и фибриллярных доменов.
α-Цепи коллагена IX типа [α(IX)α2(IX)α3(IX)] состоят из 3 фибриллярных и 4 глобулярных доменов. Они связаны поперечными ковалентными связями с фибриллами коллагена II типа. Молекула коллагена IX типа также содержит боковую гликозаминогликановую цепь и большое количество положительно заряженных групп, поэтому к ней могут присоединяться отрицательно заряженные молекулы гиалуроновой кислоты и хондроитинсульфата. В аналогичные взаимодействия с фибриллярными коллагенами I типа вступают коллагены XII типа. Этот тип коллагена локализуется в хряще, цементе, а также в слизистой оболочке полости рта в местах соединения эпителия с субэпителиальными слоями. Коллаген IX типа является трансмембранным белком, с помощью которого lamina densa (тёмная пластинка базальной мембраны, располагающаяся на границе с сосочковым слоем дермы) фиксируется к коллагеновым фибриллам сосочкового слоя дермы.
Нефибриллярные (сетевидные) типы коллагена
К группе нефибриллярных коллагенов относят коллагеновые белки IV, VIII и X типов, которые отличаются по длине и размеру и способны формировать сетевидные структуры. Наиболее распространен, в том числе и в тканях полости рта, коллаген IV типа, являющийся основным структурным белком базальных мембран. Коллаген IV типа содержит 1 α1(IV) и 2 α2(IV) цепи. Пептидные цепи коллагена IV типа после секреции не подвергаются протеолитической модификации и поэтому сохраняют структуру N- и С-концевых глобулярных доменов (NC1, 7S и NC2) (рис. 1.4).

Рис. 1.4. Структура коллагена IV типа - тройная спираль мономера коллагена. В N- и С-концевых областях содержатся глобулярные домены 7S, NC1 и NC2.
В отличие от фибриллярных коллагенов, α-цепи молекулы коллагена IV типа содержат «неколлагеновые» аминокислотные области не только в N- и С-концевых отделах, но и на протяжении всей молекулы. Концевые домены NC1, 7S коллагеновых мономеров в процессе самоагрегации взаимодействуют между собой и образуют связи «конец в конец», что приводит к формированию димеров и тримеров. Суперспирализацию обеспечивают боковые взаимодействия и связи «конец в конец». В результате формируются трёхмерные структуры, подобные сетке с гексагональными ячейками размерами 170 нм.
Коллаген X типа состоит из 3 идентичных цепей с мол. массой 59 кДа.
Коллагены, образующие микрофибриллы
К коллагенам, образующим микрофибриллы, относят коллаген VI типа. Являясь короткоцепочечным белком, он образует микрофибриллы, располагающиеся между фибриллами интерстициальных кол- лагенов. Для этого типа коллагенов характерно присутствие в α-цепях больших глобулярных доменов в N- и С-концевых областях и короткого трёхспирального домена между ними. В процессе синтеза внутри клетки 2 молекулы этого коллагена соединяются антипараллельно с образованием димера, а из димеров образуются тетрамеры, которые секретируются из клетки. Вне клетки тетрамеры связываются «конец в конец» с формированием микрофибрилл. Молекулы этого коллагена содержат многочисленные последовательности арг-гли-асп (RGD), которые обеспечивают клеточную адгезию путём присоединения к мембранным адгезивным белкам - интегринам α1β1 и α2β1. Кроме того, коллаген VI типа способен связываться с фибриллами интерстициальных коллагенов, протеогликанами и гликозаминогликанами.
Синтез коллагена
Коллаген синтезируют и поставляют в межклеточный матрикс почти все клетки (фибробласты, хондробласты, остеобласты, одонтобласты, цементобласты, кератобласты и др.). Синтез и созревание коллагена является сложным многоэтапным процессом, который начинается в клетке и заканчивается в межклеточном матриксе. Нарушения синтеза коллагена, обусловленные мутацией в генах, а также в процессе трансляции и пост- трансляционной модификации сопровождаются появлением дефектных коллагенов. Поскольку около 50% всех коллагеновых белков содержатся в тканях скелета, а остальные 40% в дерме и 10% в строме внутренних органов, то нарушения синтеза коллагена сопровождаются патологией как
костно-суставной системы, так и внутренних органов. Это неизбежно отражается на состоянии тканей челюстно-лицевой области.
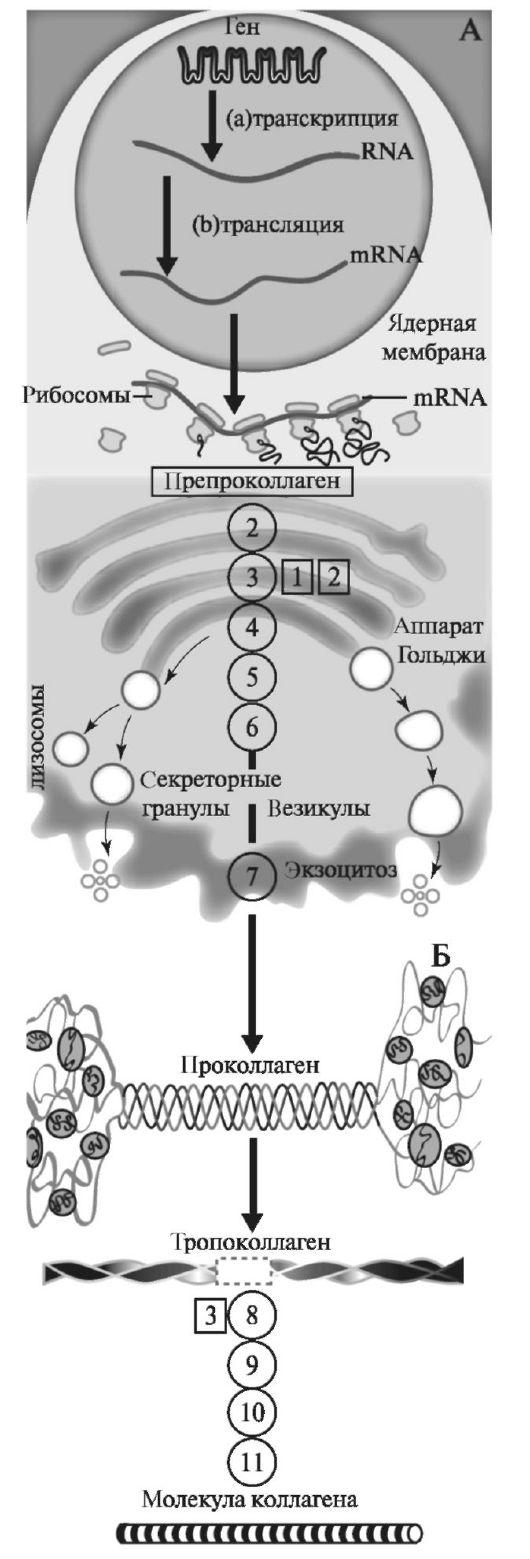
Синтез коллагена включает два этапа. На внутриклеточном этапе происходит трансляция и посттрансляционная модификация полипептидных цепей, и на внеклеточном - модификации белка, завершающаяся образованием коллагеновых волокон (рис. 1.5).
Рис. 1.5. Синтез коллагена. Схема синтеза коллагена: А - внут- риклеточный этап, Б - внеклеточная модификация белка. Цифрами обозначены реакции синтеза. 1а - транскрипция, 1b - трансляция проколлагеновых цепей, 2 - отщепление сигнального пептида, 3 - гид- роксилирование остатков пролина и лизина, 4 - гликозилирование 5-гид- роксилизина и аспарагина, 5 - образование дисульфидных связей в N- и С- концевых пептидах, 6 - формирование тройной спирали проколлагена, 7 - экзоцитоз белковой молекулы, 8 - отщепление N- и -концевых пептидов, 9 - регулируемая сборка фибрилл, 10 - окисление лизина и 5- гидроксилизина до аллизинов, 11 - образование поперечных сшивок с формированием полимерных пептидов [по Кольман Я., Рём К.-Г., 2000, с изменениями]. Ферменты:
1 - проколлагенпролин-4-диокси- геназа;
2 - проколлагенлизин-5-диокси- геназа;
3 - протеин-лизин-6-оксидаза.
Внутриклеточный этап синтеза коллагена. Пептидные α-цепи коллагена синтезируются на полирибосомах, связанных с мембранами эндоплазматической сети. Её синтезированные пептидные цепи в цистернах подвергаются посттрансляционной модификации, которая включает:
• удаление сигнального пептида проколлагеновой цепи при участии специфической протеиназы;
• гидроксилирование остатков пролина и лизина, которое начинается в период трансляции полипептидной цепи вплоть до её отделения от рибосом.
Реакции гидроксилирования катализируют оксигеназы: прокол- лагенпролил-4-диоксигеназа (пролил-4-гидроксилаза), проколлаген- пролил-3-диоксигеназа (пролил-3-гидроксилаза) и проколлагенлизил- 5-диоксигеназа (лизил-5-гидроксилаза). В реакции гидроксилирования используются О2 и 2-оксоглутарат, а в качестве кофактора участвует аскорбиновая кислота. Гидроксилазы пролина и лизина в активном центре содержат Fе2+, а аскорбиновая кислота, которая легко окисляется в дегидроаскорбиновую кислоту, необходима для сохранения атома железа в ферроформе (рис. 1.6).
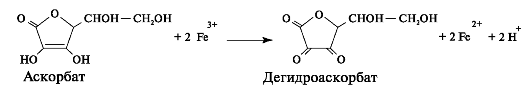
Рис. 1.6. Структурная формула аскорбиновой кислоты.
В реакциях гидроксилирования один атом кислорода присоединяется к четвёртому атому углерода в остатке пролина, а второй атом кислорода включается в янтарную кислоту, которая образуется при декарбоксилировании 2-оксоглутарата (рис. 1.7).
Наряду с гидроксилированием пролина происходит гидроксилирование остатков лизина с образованием 5-гидроксилизина (рис. 1.8).
В дальнейшем гидроксилированные остатки лизина подвергаются гликозилированию.
При участии гликозилтрансфераз образуются ковалентные О-гликозидные связи между 5-ОН группой гидроксилизина и остатком галактозы или дисахаридом галактозилглюкозой. К амидной группе аспарагина присоединяются молекулы N-ацетилглюкозамина или маннозы. Одновременно с гидроксилированием пролина формируется стабильная трёхспиральная структура коллагена (рис. 1.9).
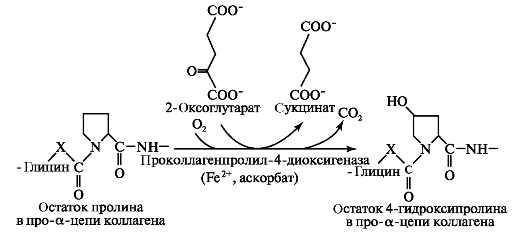
Рис. 1.7. Гидроксилирование остатков пролина в проколлагеновой α-цепи с образованием 4-гидроксипролина.
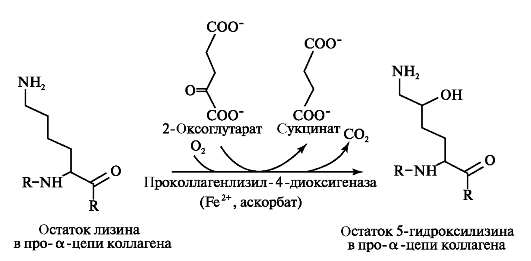
Рис. 1.8. Гидроксилирование остатков лизина в проколлагеновой а-цепи с образованием 5-гидроксилизина.
Гидроксипролин необходим для стабилизации этой тройной спирали коллагена, поскольку его гидроксильные группы участвуют в образовании водородных связей между α-цепями. По окончании гид- роксилирования и гликозилирования все про-α-цепи соединяются между собой водородными связями, а в области С-концевых пропептидов формируются дисульфидные мостики.
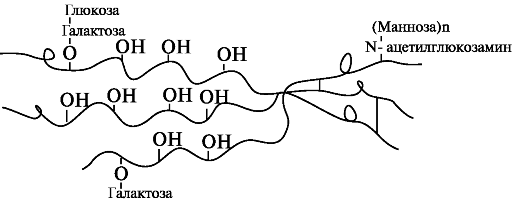
Рис. 1.9. Гликозилированные участки α-цепи молекулы проколлагена.
Из эндоплазматической сети молекулы проколлагена перемещаются в аппарат Гольджи, где они включаются в секреторные пузырьки и в их составе секретируются во внеклеточное пространство.
Внеклеточный этап - модификация молекул проколлагена. В межклеточном пространстве при участии протеолитических ферментов от молекулы проколлагена отщепляются N- и С-концевые пептиды и освобождается тройная спираль коллагена (тропоколлагена). Далее происходит процесс самосборки коллагеновых фибрилл, фиксированных межмолекулярными ковалентными связями (сшивками). В фор- мировании этих связей участвуют остатки лизина и 5-гидроксили- зина и их альдегидные производные, которые образуются вследствие окислительного дезаминирования. Окислительное дезаминирование лизина и 5-гидроксилизина происходит с участием лизилоксидазы. Особенностью этого фермента является присутствие Cu2+ в активном центре. Молекулы лизилоксидазы синтезируются в клетке в виде проферментов и после связывания с ионами Cu2+ упаковываются в везикулы, которые покидают клетку. На клеточной поверхности молекула пролизилоксидазы подвергается ограниченному протеолизу и в сфор- мировавшемся активном центре при участии ионов Cu2+ происходит окисление остатка тирозина до тирозинхинона. Образовавшаяся в активном центре хиноидная структура связывает остатки лизина в молекуле проколлагена с образованием фермент-субстратного комплекса. Дальнейшее дезаминирование лизина происходит в соответствии с реакциями, представленными на рис. 1.10.
На следующем этапе аллизин и 5-гидроксиаллизин конденсируются вместе с лизиловыми и гидроксилизиловыми остатками; формируются внутри- и межмолекулярные поперечные связи. В реакции
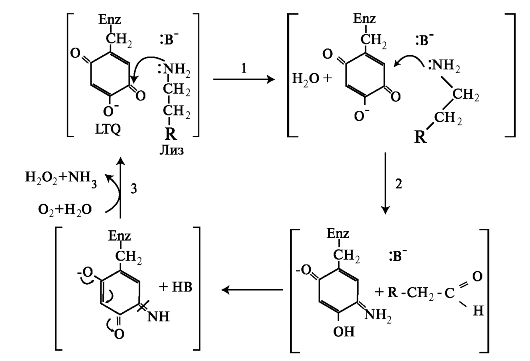
Рис. 1.10. Окисление лизина в структуре коллагена:
1 - формирование фермент-субстратного комплекса; 2 - NH3+ переносится на тирозинхинон (LTQ) и происходит окисление лизина с последующим вытеснением аллизина из активного центра; 3 - в активный центр фермента входят молекулы О2 и Н2О и происходит освобождение NH3 и Н2О2. При этом LTQ возвращается в исходное состояние (Enz - фермент).
конденсации аллизина с остатком лизина другой цепи образуется основание Шиффа. В случае альдольной конденсации двух остатков аллизина образуются альдольные межмолекулярные связи (лизиннорлейцин). Формирование альдольных межмолекулярных связей показано на рис. 1.11.
Альдольная конденсация характерна для коллагена костной ткани и дентина, а основания Шиффа наиболее часто встречаются в коллагенах сухожилий.
Около 25% молекул тропоколлагена распадается, не образуя фибрилл. Получившиеся фрагменты выполняют сигнальные функции и стимулируют коллагеногенез. Пространственная организация фибрилл завершается при участии фибронектина, протеогликанов и коллагенов, ассоциированных с фибриллами.
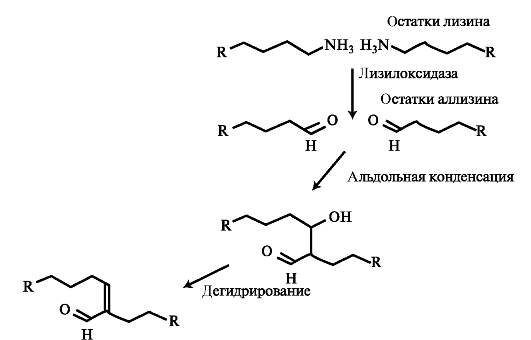
Aльдольные межмолекулярные связи
Рис. 1.11. Окисление лизина и формирование альдольной межмолекулярной связи в реакциях альдольной конденсации двух остатков аллизина.
Нарушение синтеза коллагеновых белков у человека
Любые нарушения в синтезе коллагеновых белков клинически проявляются, в первую очередь, изменением со стороны зубочелюстной системы в виде кровоточивости дёсен, подвижности и выпадения зубов, множественного кариеса. Причины, приводящие к нарушению синтеза коллагеновых белков, различны - недостаток в организме аскорбиновой кислоты, ионов Cu2+, генетические дефекты и аутоиммунные состояния.
Гидроксилирование лизина и пролина очень важный этап для последующего образования ковалентных связей между молекулами коллагена и сборкой коллагеновых фибрилл, зависящий от количества аскорбиновой кислоты. При цинге - заболевании, возникающем вследствие недостатка аскорбиновой кислоты, страдает гидроксилирование остатков пролина и лизина в структуре проколлагена. В результате образуются хрупкие и ломкие сосуды. Нарушение синтеза коллагена в пульпе и дентине приводит к развитию множественно- го кариеса, страдают периодонтальные связки.
Подобные явления встречаются при врождённом дефиците лизилгидроксилазы (синдром Элерса-Данло-Русакова, тип IV). Высокая растворимость молекул коллагена проявляется при врождённом дефекте лизилоксидазы (синдром Элерса-Данло, тип V) или нарушении обмена меди (болезнь Менкеса), что связано с нарушением образования поперечных сшивок между микрофибриллами коллагена. Это приводит к ухудшению механических свойств связок периодонта, состояния тканей пародонта, вялости кожных покровов и возникновении дефектов в развитии скелета у людей, страдающих этим заболеванием.
При сахарном диабете вследствие неспособности клеток захватывать глюкозу из плазмы крови нарушается процесс внутриклеточного гликозилирования проколлагеновых α-цепей. При попадании проколлагена во внутриклеточное пространство углеводы присоединяются неферментативным путём, что также нарушает структуру коллагеновых фибрилл и неколлагеновых белков. Развивается тяжёлая форма пародонтита, плохо поддающаяся лечению. У детей, родившихся от матерей, страдающих инсулинозависимым сахарным диабетом, выявляется системная гипоплазия твёрдых тканей зуба.
Нарушение структуры базальной мембраны возникает при появлении антител к белкам, формирующим архитектонику базальных мембран (синдром Гудпасчера), или мутации гена, кодирующего α-цепи коллагена IV типа (синдром Альпорта). При этих формах патологии наряду с поражением почек и других органов наблюдаются некариозные поражения твёрдых тканей зуба (гипоплазия эмали, уменьшение объёма и нарушение структуры дентина) и дистрофические изменения мягких тканей полости рта.
Для исследования обмена коллагена в моче и плазме крови определяют концентрацию гидроксипролина, пролина, количество продуктов деградации коллагена I типа - N- и С-телопептиды. Характерным показателем распада коллагена является увеличение количества гидроксипролина в плазме крови и моче, а также повышение количества N- и С-телопептидов в плазме крови и содержания кальция, определяемого в моче утром до приёма пищи. О нарушении созревания коллагена свидетельствует рост количества пролина в плазме крови.
Помимо коллагеновых белков в межклеточном матриксе присутствуют и неколлагеновые - эластин, протеогликаны, гликопротеины и др.
1.3. СТРУКТУРА И СВОЙСТВА НЕКОЛЛАГЕНОВЫХ БЕЛКОВ
Эластин
В межклеточном веществе стенок кровеносных сосудов, тканей периодонта, корня языка, в подслизистом слое губ и щёк, лёгких, кожи в больших количествах присутствует эластиновые волокна. Эти ткани обладают очень важными свойствами: они могут растягиваться в несколько раз по сравнению с исходной длиной, сохраняя при этом высокую прочность на разрыв, и возвращаться в первоначальное состояние после снятия нагрузки. Резиноподобные свойства названных тканей обеспечиваются основным белком эластином - гликопротеином с мол. массой 70 кДа.
Эластин содержит около 27% глицина, 19% аланина, 10% валина, 4,7% лейцина. Наличие большого количества гидрофобных радика- лов препятствует созданию стабильной глобулы, в результате полипептидные цепи эластина не формируют регулярные вторичную и третичную структуры, а принимают в межклеточном матриксе разные конформации с примерно равной свободной энергией (рис. 1.12).
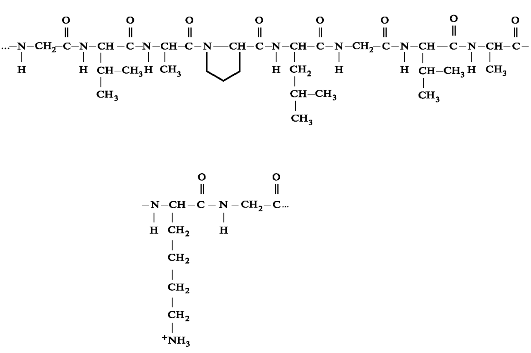
Рис. 1.12. Фрагмент полипептидной цепи эластина.
Нативные волокна эластина построены из относительно небольших, почти сферических молекул, соединённых в волокнистые тяжи с помощью жёстких поперечных сшивок - десмозина и изодесмозина, а также лизиннорлейцина. В образовании поперечных сшивок участвуют 4 остатка лизина, 3 из которых предварительно окисляются до соответствующих альдегидов при участии лизилоксидазы. Десмозин и изодесмозин формируются остатками, принадлежащими, по крайней мере, двум цепям, однако они могут быть образованы также остатками, находящимися в трёх и четырёх цепях. В образовании лизиннорлейцина участвуют 2 остатка лизина (рис. 1.13).
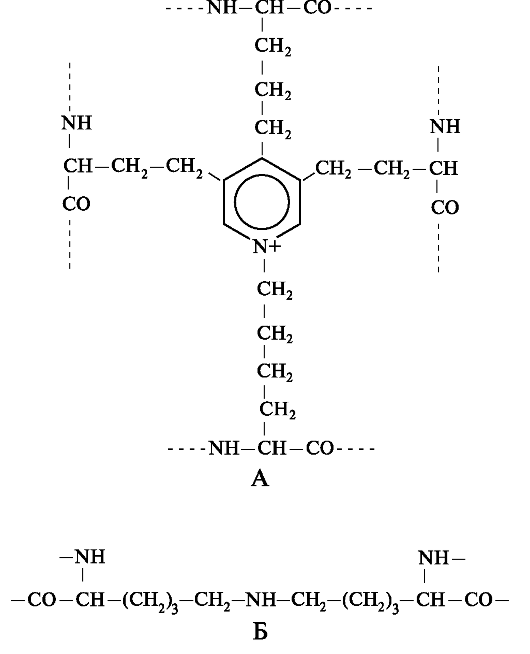
Рис. 1.13. Поперечные сшивки в структуре эластина: А - десмозин, образованый четырьмя остатками лизина; Б - лизиннорлейцин, образованый двумя остатками лизина.
Образование ковалентных сшивок между пептидными цепями эластина с неупорядоченной конформацией позволяет сети волокон эластина растягиваться и сжиматься во всех направлениях, что при- даёт им свойство эластичности (рис. 1.14).
Синтез и распад эластина. Синтез эластина начинается в фибробластах с образования предшественника эластина - белка тропоэластина. Тропоэластин является растворимым мономером, гидрофильные участки которого обогащены остатками лизина. В межклеточном матриксе при участии медьзависимой лизилоксидазы остатки лизина окисляются до аллизина, которые формируют поперечные сшивки, стабилизирующие молекулу эластина. После образования поперечных сшивок эластин приобретает свою конечную внеклеточную форму, для которой характерна нерастворимость, высокая стабильность и низкая скорость метаболизма.
В расщеплении эластина участвует эластаза полиморфноядерных лейкоцитов, которая являясь эндопептидазой, преимущественно рас-
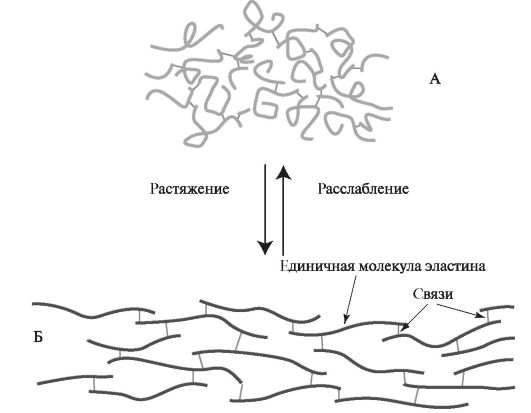
Рис. 1.14. Структурная модель эластина:
А - состояние расслабления; Б - состояние растяжения.
щепляет связи, образованные карбоксильными группами алифатических аминокислот. Она активна в слабощелочной среде (рН 7,5-8,5) и гидролизует во внеклеточном пространстве не только эластин, но и другие белки - протеогликаны, гемоглобин, коллаген, иммуноглобулины. Активность эластазы ингибирует белок α1-антитрипсин (α1-АТ). Наибольшее количество α1-АТ синтезируется печенью и находится в крови. В тканях α1-АТ синтезируется макрофагами.
Изменения структуры эластина при патологических процессах
При нарушении образования десмозинов, изодесмозинов и лизиннорлейцина снижается предел прочности эластических тканей на разрыв, появляются такие нарушения, как истончённость, вялость, растяжимость, то есть утрачиваются их пластичные свойства. Изменения в структуре эластина могут быть обусловлены снижением активности лизилоксидазы при наследственных и приобретённых заболеваниях, дефиците меди. Нарушения структуры эластина могут проявляться сердечно-сосудистыми изменениями в виде аневризм и разрывов аорты, дефектов клапанов сердца, частыми пневмониями и эмфиземой лёгких.
В тканях десны эластаза не активна. При развитии воспаления количество полиморфноядерных лейкоцитов увеличивается и они становятся источником эластазы. Увеличение количества последней происходит на фоне неизменённого или сниженного содержания α1-АТ в тканях десны. Возникающий дисбаланс между ферментом и его ингибитором приводит к декструкции эластических волокон при гингивите и пародонтите.
Протеогликаны и гликозаминогликаны
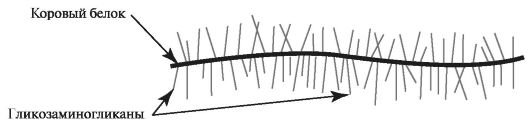
Протеогликаны - класс сложных белков внеклеточного матрикса. Они состоят из различных стержневых (коровых) белков, к которым через N- и О-гликозидные связи присоединены олигосахариды, связанные с цепями гликозамингликанов (рис. 1.15).
Рис. 1.15. Строение протеогликана.
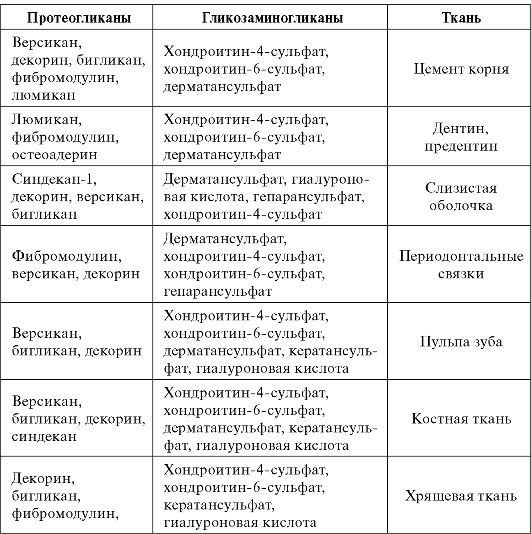
Разные протеогликаны отличаются размерами молекул, относительным содержанием белка и набором гликозаминогликанов. Протеогликаны в больших количествах представлены в дентине, пульпе, цементе, тканях периодонта, слизистых оболочках полости рта (табл. 1.2).
Часть протеогликанов - серглицин, матриксный протеогликан хряща, декорин, версикан и др. находятся в растворимом состоянии и локализуются во внеклеточном матриксе. Другие протеогликаны, например, синдекан, представлены трансмембранными интеграль- Таблица 1.2
Протеогликаны и гликозаминогликаны в тканях полости рта
ными белками. Синдекан имеет внеклеточный трансмембранный и цитоплазматический домены и взаимодействует с актиновым цито- скелетом. Снаружи на клеточной поверхности синдекан связывается с фибронектином и другими компонентами внеклеточного матрикса.
В связывании протеогликанов со специфическими белками участвуют молекулы гликозаминогликанов. Их отрицательно заряженные группы взаимодействуют с положительно заряженными радикалами аминокислот лизина и аргинина, расположенными в определённых областях белковой молекулы. Таким способом связываются высокосульфатированные гликозаминогликаны с фибронектином.
Протеогликаны выполняют функции рецепторов при сборке межклеточного матрикса, облегчают клеточное прикрепление и регулируют процессы роста клеток. Они также могут образовывать комплексы с некоторыми белками, например, факторами роста. В образовавшихся комплексах белки защищены от протеолитических ферментов. Эти комплексы выполняют функцию резервуаров, и только в случае необходимости фактор роста освобождается из них и приобретает способность проявлять свою биологическую активность.
Гликозаминогликаны относятся к гетерополисахаридам. Это линейные структуры, построенные из повторяющихся дисахаридных единиц. Молекула дисахарида состоит из уроновой кислоты и аминосахара, аминогруппа которого обычно ацетилирована. Наличие сульфатных и карбоксильных групп в гликозаминогликанах придает им большой отрицательный заряд и способность связывать воду. Благодаря высокой плотности отрицательного заряда на своей поверхности они связывают катионы Ca2+, Na+, К+ и таким образом принимают участие в минеральном обмене.
Все гликозаминогликаны делят на 2 группы: сульфатированные и несульфатированные. К несульфатированным гликозаминогликанам относится гиалуроновая кислота. Сульфатированные гликозаминогликаны в свободном виде не встречаются; будучи связаны с небольшим количеством белка, они образуют протеогликаны. Структура дисахаридных единиц, входящих в состав гликозаминогликанов, представлена на рис. 1.16.
Гиалуроновая кислота встречается во многих органах и тканях. Она пос- троена из дисахаридных остатков, соединенных β-(1-»4)-гликозидными связями. Дисахаридные фрагменты, в свою очередь, состоят из остатков β-D-глюкуроновой кислоты и N-ацетил-(3-D-глюкозамина, связанных между собой β-(1-3)-гликозидными связями. Гиалуроновая кислота имеет
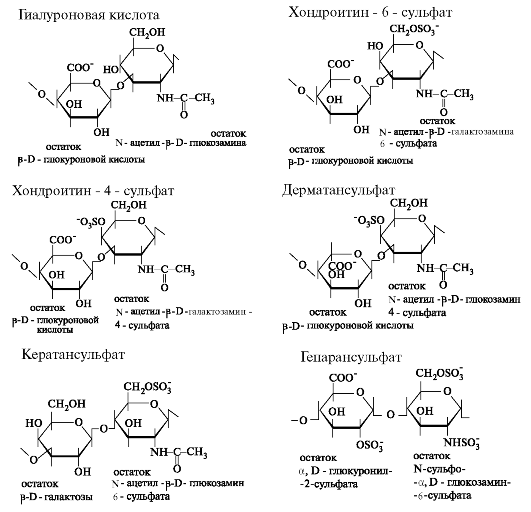
Рис. 1.16. Структура повторяющихся дисахаридных единиц в гликозаминогликанах.
высокую мол. массу (Mr 105-10 7 Да). В ряде органов (стекловидное тело глаза, пупочный канатик, суставная жидкость) она находится в свободном виде, а в хряще формирует протеогликановые агрегаты. В суставной жидкости гиалуроновая кислота играет роль смазочного вещества, уменьшая трение между суставными поверхностями. В процессе развития эмбриона она заполняет межклеточные пространства, облегчая перемещение клеток. В больших количествах гиалуроновая кислота синтезируется во время заживления ран. Связывая воду, она обеспечивает барьерную функцию.
Цепи гиалуроновой кислоты способны свертываться, связывая большое количество воды и формируя домен. В этот домен (опреде-
ленное пространство) имеют доступ небольшие молекулы или ионы, однако крупные молекулы (альбумин, иммуноглобулины) не способны проникать в него. Домены способны контактировать, сжиматься и проникать друг в друга, что и определяет высокую вязкость раствора.
Хондроитинсульфаты содержат повторяющиеся дисахаридные единицы, соединенные β-(1->4)-гликозидными связями. Дисахариды построены из глюкуроновой кислоты и сульфатированного N-ацетилгалак- тозамина, соединённых между собой (3-(1-3)-гликозидными связями. В зависимости от положения сульфатной группы различают хондро- итин-4-сульфат и хондроитин-6-сульфат. Одна полисахаридная цепь хондроитинсульфата содержит около 40 повторяющихся дисахаридных единиц. Мол. масса хондроитинсульфатов колеблется от 10 до 600 кДа. Несмотря на минимальные различия в химической структуре, хон- дроитинсульфаты существенно отличаются по физико-химическим свойствам и распределению в различных видах соединительной ткани. Хондроитин-4-сульфат, преимущественно встречается в составе хрящевой и костной тканей, роговице глаза, а хондроитин-6-сульфат присутствует в сухожилиях, связках, пупочном канатике, а также в костях.
Дерматансульфат - гетерополисахарид, сходный по строению с хондроитинсульфатом. В отличие от последнего дисахаридный фрагмент дерматансульфата содержит вместо D-глюкуроновой кислоты остаток L-идуроновой кислоты. Дерматансульфат присутствует в коже, хрящах, сухожилиях и межпозвонковых дисках, кровеносных сосудах и клапанах сердца. В составе малых протеогликанов (бигликакан и декорин) он содержится в межклеточном веществе костей, хрящей, межпозвоночных дисков и менисков, где участвует в стабилизации коллагеновых волокон.
Кератансульфаты - наиболее гетерогенные гликозаминогликаны; отличаются друг от друга по суммарному содержанию углеводов и распределению в разных тканях. В отличие от всех остальных гликозаминогликанов, кератансульфаты вместо уроновой кислоты содержат остаток D-галактозы. Остатки D-галактозы в дисахаридных фрагментах кератансульфата связаны β-(1->4)-гликозидными связями с остатками N-ацетил-D-глюкозамин-6-сульфата. Между собой дисахаридные фрагменты соединены β-(1->3)-гликозидными связями.
Кератансульфат-1 роговицы глаза содержит, кроме повторяющийся дисахаридной единицы, L-фукозу, D-маннозу и сиаловую кислоту. Кератансульфат-2 обнаружен в хрящевой ткани, костях, межпозвоночных дисках. Кератансульфаты входят в состав большого протеогликана - агрекана и некоторых малых протеогликанов хрящевого матрикса.
Гепарансульфат представляет собой гетерополисахарид, построенный из глюкуроновой кислоты и N-ацетилглюкозамина; содержит большее количество N-ацильных групп и меньше сульфатных. Входит в состав протеогликанов базальных мембран и является постоянным компонентом клеточной поверхности.
Большие протеогликаны
К большим протеогликанам относят белки с большой мол. массой, содержащие свыше 100 цепей гликозаминогликанов. В эту группу входят агрекан, версикан, нейрокан, бревикан и др. Их особенностью является способность связываться с коллагенами, гиалуроновой кислотой и образовывать протеогликановые агрегаты.
В цементе, пульпе зуба, слизистой оболочке, костной ткани и коже присутствует большой хондроитинсульфатсодержащий протеогликан - версикан, мол. масса которого около 1000 кДа. Стержневой белок версикана состоит из аминокислотных последовательностей, содержащих остатки глу-гли-фен. Благодаря большому содержанию сульфата, глута- миновой кислоты и связи с гиалуроновой кислотой версикан в гидратированном состоянии занимает значительное по объёму пространство.
Для матрикса хрящевой ткани характерно присутствие другого большого протеогликана - агрекана (см. хрящевую ткань).
Малые протеогликаны
Малые протеогликаны имеют небольшой коровый белок, к которому присоединены 1 или 2 цепи гликозаминогликанов. Среди малых протеогликанов различают протеогликаны, богатые лейцином, протеогликаны, ассоциированные с клетками, и протеогликаны базальных мембран.
Протеогликаны, богатые лейцином. Особенностью малых протеогликанов этого семейства является наличие 9-12 доменов, богатых лейцином в С-концевой области корового белка. Эти домены обладают свойством связывать коллаген. N-концевая область высоко вариабельна в своей аминокислотной последовательности, которая связана с гликозаминогликанами. Домены N-концевой области участвуют во взаимодействиях белков друг с другом и клетками.
Белки этого семейства представлены декорином, бигликаном, фибромодулином, люмиканом, остеоадерином, остеоглицином, оку- логликаном, оптицином, аспорином.
Малые протеогликаны - фибромодулин, люмикан и остеоадерин в N-концевой области содержат цепи кератансульфата, которые присоединяются к аспарагину, а также сульфатированные остатки тирозина.
Фибромодулин - протеогликан с мол. массой около 40 кДа. Показано, что фибромодулин присоединяется к фибриллам коллагена II типа и ограничивает их диаметр.
Люмикан по своему строению очень сходен с фибромодулином. Присутствует в межклеточном матриксе мышечной и хрящевой тканей, лёгких, тонкой кишки, роговой оболочки глаза. Предполагается его участие в регуляции образования сетчатой коллагеновой структуры.
Остеоадерин - белок с мол. массой 49,1 кДа. Особенностью этого белка является присутствие четырёх сульфатированных остатков тирозина, три из которых располагаются в N-концевой области. В С- концевой области присутствует большое количество отрицательно заряженных аминокислот. Молекула остеоадерина синтезируется зрелыми остеобластами, а также одонтобластами. Он определяется в амелобластическом слое на стадии созревания эмали и участвует в процессах минерализации.
Декорин и бигликан сходны по размерам и структуре, но их синтез находится под контролем различных генов. Мол. масса декорина около 130 кДа, а бигликана - около 270 кДа. Их коровые белки содержат своеобразную 24-аминокислотную последовательность, богатую лейцином, которая тандемно повторяется 10 раз в декорине и 12 раз в бигликане. Бигликан содержит серин в положениях 5 и 11, а декорин в положении 4, что позволяет бигликану присоединять 2 полисахаридные цепи, а декорину - только одну (рис. 1.17). У этих протеогликанов полисахаридные цепи представлены дерматансульфатом. Декорин и бигликан участвуют в межклеточных взаимодействиях, которые могут облегчаться (3-структурой в коровом белке. Показано, что декорин и, вероятно, бигликан взаимодействуют с β-трансформирующим фактором роста (ТФР-(3).
Локализация декорина совпадает с расположением коллагена. Если назначение бигликана неизвестно, то декорин участвует в связывании с коллагенами I и II типов, а также ингибирует фибринолиз. Кроме того, бигликан и декорин обеспечивают взаимодействия между клетками, эластином и адгезивными белками - фибронектином и ламинином.
Протеогликаны, ассоциированные с клетками
В процессе развития клеток появляются малые протеогликаны, получившие название протеогликанов, ассоциированных с клетками. Это семейство белков включает серглицины, синдеканы, бетаглицины, тромбомодулин, фосфатидилинозитол - заякоренные протеогликаны.
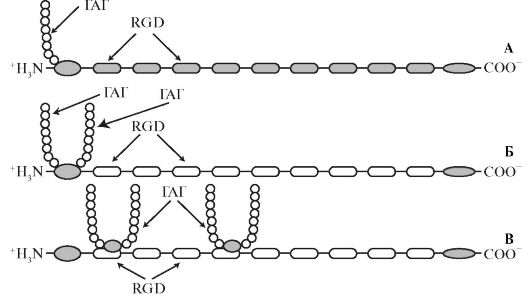
Рис. 1.17. Доменное строение малых протеогликанов: А - декорин; Б - бигликан; В - фибромодулин.
Синдеканы включают 4 типа различных белков. Они являются интегральными протеогликанами и содержат внутриклеточный, трансмембранный и внеклеточный домены. Внеклеточный домен этих белков имеет сходство с доменом протеиназ и способен открывать мембрану клетки, а также содержит и варьирующие цепи гликозаминогликанов, соединённых с синдеканом. Так, синдеканы 1 и 3 содержат гепарансульфат и хондроитинсульфат. Синдекан-1 появляется в эпителиальных клетках в процессе развития, син- декан-2 (фиброгликан) синтезируется фибробластными клетками и гепатоцитами; синдекан-3 (N-синдекан) присутствует в нервной ткани и развивающихся хрящах, а синдекан-4 (риудокан, амфигликан) - в эндотелии, эпителии, гладкомышечных клетках и фибробластах кожи. Синдеканы через внеклеточные домены связывают коллагены, фибронектин, тромбоспондин, тенасцин и фактор роста фибробластов. Внутриклеточные домены синдекана через актин связываются с цитоскелетом.
Серглицины выделены из секреторных везикул. Их состав зависит от типа клеток и клеточной дифференцировки. С коровым белком связаны цепи хондроитин- и гепарансульфата. Особенностью молекул серглицина является высокое содержание сульфатных остатков, что придаёт им устойчивость к протеолизу. Мол. масса серглицинов варьирует в больших пределах (60-750 кДа), а мол. масса корового белка практическ и постоянна (16-18 к Да).
Считают, что серглицины вовлечены в регуляцию ферментативной активности секреторных гранул и дифференцировку гемопоэтических клеток.
Некоторые серглицины синтезируются эндотелиальными клетками, и их синтез повышается под влиянием фактора некроза опухолей и интерлейкина 1α(ИЛ-1α). Серглицин может принимать участие в миграции лейкоцитов при воспалительных процессах. Недавно установлено, что с другими протеогликанами они участвуют в адгезии и активации лимфоидных клеток.
Протеогликаны базальных мембран
В составе базальных мембран выделена целая группа гетерогенных протеогликанов, содержащих гепарансульфат. В структуре корового белка имеются глобулярные домены, разделённые стержневыми фрагментами. Глобулярные домены обеспечивают связь этих протеогликанов с коллагеном IV типа, ламинином и другими гликопротеинами, а также с клетками, расположенными на базальной мембране.
Основным гепарансульфатсодержащим протеогликаном базальных мембран является перлекан. Полипептидная цепь, состоящая из 3500 аминокислотных остатков, связана с тремя гепарансульфатными цепями через гидроксильные группы серина в N-концевой области. Каждая полисахаридная цепь содержит до 200 мономеров. В молекуле перлекана определяется около трёх десятков глобулярных доменов, раз- делённых короткими стержневидными фрагментами, обеспечивающих связь между клетками и компонентами межклеточного матрикса.
Сохранение биомеханических и физиологических особенностей соединительной ткани во многом определяется поддержанием баланса между процессами биосинтеза и деградации коллагенов и протеогликанов. Распад и синтез протеогликанов регулируют: 1) гормоны - соматотропин, тироксин, инсулин; 2) цитокины - ИЛ-1, кахектины; 3) витамины группы А и С; 4) микроэлементы; 5) факторы роста.
Синтез протеогликанов
Синтез протеогликанов начинается с биосинтеза корового белка на полирибосомах. Уже в процессе трансляции белка в шероховатой эндоплазматической сети происходит связывание трисахаридов через амидные группы остатков аспарагина. В качестве донора олигосахаридов выступают долихол-связанные олигосахариды с высоким содержанием маннозы. После присоединения N-сцепленных олигосахаридов стержневой белок подвергается ксилозилированию и фосфорилированию. УДФ-ксилозат-
рансфераза, осуществляющая перенос остатков ксилозы на гидроксильную группу стержневого белка, является одним из ключевых ферментов биосинтеза протеогликанов. Дальнейшие процессы образования цепей гликозаминогликанов происходят в аппарате Гольджи. Полисахаридные цепи гликозаминогликанов синтезируются путём последовательного присоединения моносахаридов, донорами которых обычно являются соответствующие УДФ - сахара. На мембранах аппарата Гольджи локализованы гликозилтрансферазы, при участии которых белковая молекула и подвергается гликозилированию (рис. 1.18).
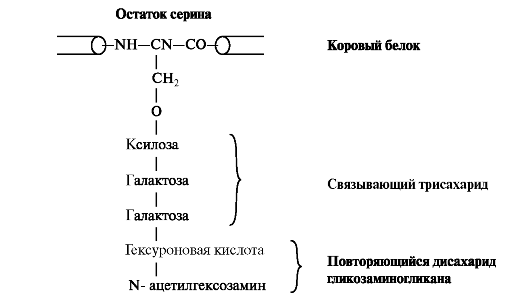
Рис. 1.18. Присоединение гликозаминогликана к коровому белку через связывающий трисахарид. К серину, треонину или аспарагину через О- или N- гликозидную связь присоединяется связующий олигосахарид, состоящий из двух остатков галактозы и одного остатка ксилозы.
УДФ-галактозилтрансфераза I переносит на ксилозу первый остаток галактозы, УДФ-галактозилтрансфераза II - второй остаток галактозы, а завершается формирование связующего трипептида присоединением к нему остатка глюкуроновой кислоты. Эту реакцию катализирует УДФ-глюкуронилтрансфераза I. Дальнейший синтез полисахаридной цепи осуществляется последовательным присоединением N-ацетилгалактозамина (или N-ацетилглюкозамина, галактозы) и глюкуроновой (или идуроновой) кислоты (рис. 1.19).
Модификацией цепей гликозаминогликанов является сульфатирование, то есть присоединение сульфата к С-4 и (или) к С-6 N-ацетилга-

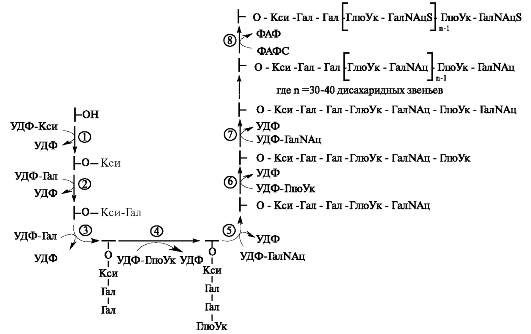
Рис. 1.19. Синтез хондроитинсульфата в составе протеогликана. Ферменты: 1 - УДФ-ксилозилтрансфераза; 2 - УДФ-галактозилтрансфераза I; 3 - УДФгалактозилтрансфераза II; 4 - УДФ-глюкуронилтрансфераза I; 5 - УДФ- N-ацетилгалактозаминтрансфераза I; 6 - УДФ-глюкуронилтрансфераза II; 7 - УДФ-N-ацетилгалактозаминтрансфераза II; 8 - сульфотрансфераза.
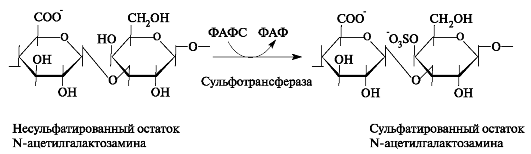
Рис. 1.20. Реакция сульфатирования остатка N-ацетилгалактозамина в процессе синтеза цепи хондроитинсульфата.
лактозамина. Сульфат переносится на молекулу-акцептор с помощью специфических сульфотрансфераз (рис. 1.20). Донором сульфатной группы выступает 3'-фосфоаденозин-5'-фосфосульфат (ФАФС).
Аминосахара и гексуроновые кислоты синтезируются из глюкозы. Непосредственным же предшественником N-ацетилглюкозамина и N-ацетилгалактозамина является фруктозо-6-фосфат. Источником NН2-группы для сахаров выступает глутамин. Образовавшийся ами- носахар далее ацетилируется с помощью ацетил-КоА (рис. 1.21).
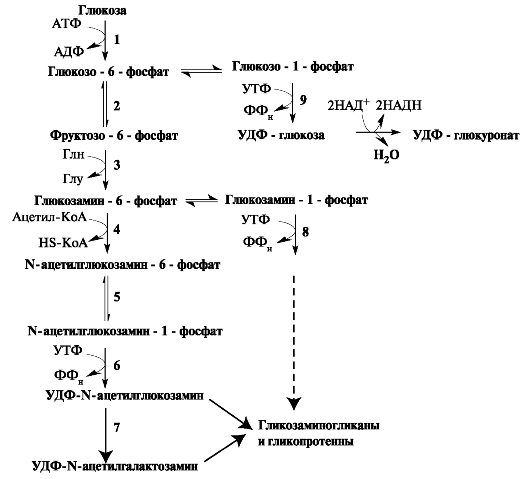
Рис. 1.21. Синтез гликозаминогликанов.
Ферменты: 1 - гексокиназа; 2 - фосфоглюкоизомераза; 3 - аминотрансфераза; 4 - ацетилтрансфераза; 5 - N-ацетилглюкозаминфосфомутаза; 6 - УДФ-N-ацетилглюкозаминпирофосфорилаза; 7 - эпимераза; 8 - УДФ- глюкозаминпирофосфорилаза; 9 - УДФ-глюкопирофосфорилаза; 10 - УДФглюкозо-дегидрогеназа.
В реакциях эпимеризации после включения глюкуроната в углеводную цепь из D-глюкуроновой кислоты образуется L-идуроновая кислота.
На синтез гликозаминогликанов влияют соматотропин и ретиноевая кислота, которые активируют включение сульфата в молекулы. Напротив, синтез гиалуроновой кислоты и сульфатированных глико- заминогликанов тормозят глюкокортикоиды и половые гормоны.
Распад протеогликанов
Распад протеогликанов - физиологический процесс, заключающийся в регулярном обновлении внеклеточных и внутриклеточных макромолекул. В деградации протеогликанов участвуют протеиназы и гликозидазы. Вначале коровый и связующие белки подвергаются воздействию свободных радикалов и в межклеточном матриксе гидролизуются матриксными металлопротеиназами - коллагеназой, желатиназой, стромелизином. Протеиназы расщепляют коровый белок, а гликозидазы гидролизуют цепи гликозаминогликанов и олигосахаридов. Все протеогликаны, содержащие цепи хондроитинсульфата, дерматансульфата, гепарансульфата и кератансульфата, первоначально расщепляются на фрагменты. Затем фрагменты протеогликанов захватываются бластными клетками и подвергаются внутриклеточной деградации. Эти фрагменты могут также с лимфой и кровью перено- ситься в печень. В гепатоцитах происходит их дальнейший гидролиз, в котором участвуют аспартильные, сериновые и другие протеиназы.
Распад гликозаминогликанов
Гликозаминогликаны отличаются высокой скоростью обмена: период полужизни (Т1/2) многих из них составляет от 3 до 10 сут и только для кератансульфата Т1/2 «120 сут. В разрушении полисахаридных цепей участвуют экзо- и эндогликозидазы (гиалуронидаза, (3-глюку- ронидаза, (3-галактозидаза, (3-идуронидаза) и сульфатазы.
Из внеклеточного пространства по механизму эндоцитоза гликозаминогликаны поступают в клетку, где эндоцитозные пузырьки сливаются с лизосомами. Активные лизосомальные ферменты обеспечивают полный постепенный гидролиз гликозаминогликанов до мономеров. Расщепление интактных гликозаминогликанов в клетках начинается с их распада на фрагменты под действием эндогексозаминидаз и эндоглюкуронидазы. Образовавшиеся в реакциях гидролиза олигосахариды подвергаются последовательным действиям экзогликозидаз и сульфатаз, которые отщепляют
мономеры с невосстанавливающегося конца. Так, гидролиз фрагментов хондроитинсульфата, содержащих на невосстанавливающем конце остаток N-ацетилгалактозамина, инициируется сульфатазой, а за ней в процесс включается β-N-ацетилгалактозаминидаза, а затем (3-глюкуронидаза. В итоге образуется неорганический сульфат и моносахариды (рис. 1.22).
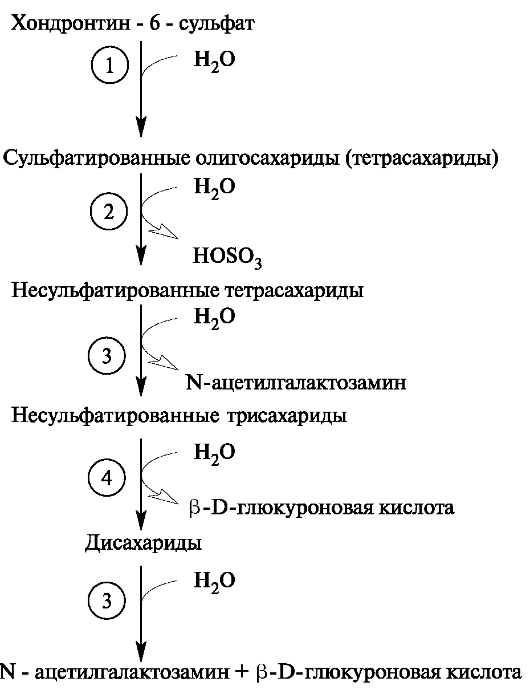
Рис. 1.22. Распад хондроитинсульфата.
Ферменты: 1 - эндогликозидаза; 2 - сульфатаза; 3 - β-N-ацетилгалактоза-
минидаза; 4 - β-глюкуронидаза.
В распаде гиалуроновой кислоты до олигосахаридов участвует гиалуронидаза. Гидролиз образовавшихся олигосахаридов осуществляют β-N-ацетилглюкозаминидаза и β-D-глюкуронидаза.
Внеклеточный распад гликозаминогликанов характерен только для гепарансульфата, который расщепляется гепараназой, синтезиру- емый тромбоцитами или Т-лимфоцитами.
Мукополисахаридозы
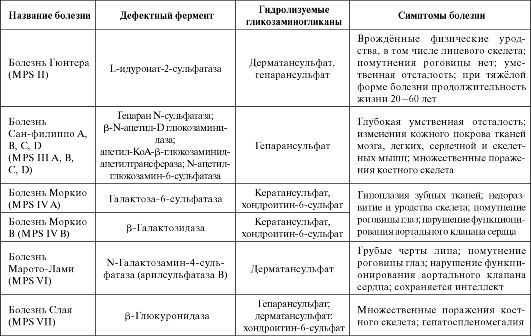
Мукополисахаридозы - тяжёлые наследственные заболевания, обусловленые дефектами гидролаз, участвующих в катаболизме гликозаминогликанов. В лизосомах тканей, для которых характерен синтез наибольшего количества гликозаминогликанов, накапливаются не полностью разрушенные гликозаминогликаны и с мочой выделяются их олигосахаридные фрагменты. Существует несколько типов мукополисахаридозов, вызванных дефектами разных ферментов, участвующих в расщеплении гликозаминогликанов.
Мукополисахаридозы проявляются нарушениями умственного развития у детей, поражениями сердечно-сосудистой системы, дефор- мациями костного скелета, значительно выраженными в челюстнолицевой области, гипоплазией твёрдых тканей зубов, помутнением роговицы глаз, снижением продолжительности жизни (табл. 1.3).
В настоящее время эти болезни не поддаются лечению, поэтому при подозрении на носительство дефектных генов необходимо проводить пренатальную диагностику. В этих случаях определяют активность лизосомальных гидролаз.
1.4. НЕКОЛЛАГЕНОВЫЕ БЕЛКИ СО СПЕЦИАЛЬНЫМИ СВОЙСТВАМИ
Адгезивные и антиадгезивные белки
Белки межклеточного матрикса выполняют самые разные функции. Часть из них обладает способностью склеивать компоненты межклеточного вещества и клеток, и эти белки получили название адгезивных. Другая группа белков, напротив, подавляет адгезию клеток и внеклеточных компонентов, и их называют антиадгезивными. Взаимодействие клеток с внеклеточным матриксом является сложным процессом и проявляется как усилением адгезии, так и её ослаблением. В адгезии мезенхимальных и эпителиальных клеток участвуют белки фибронектин, витронектин, ламинин, нидоген (энтактин) и интегрины. Напротив, антиадгезивные белки - тенасцин, тромбоспондин способны менять форму клеток и частично откреплять их от компонентов внеклеточного матрикса. Вместе с тем такое разделение белков на адгезивные и антиадгезивные является достаточно условным.
Таблица 1.3 Болезни, связанные с нарушением метаболизма гликозаминогликанов
Фибронектин - высокомолекулярный гликопротеин, ключевой белок внеклеточного матрикса, синтезируемый фибробластами. В зависимости от ионной силы и рН внеклеточного матрикса форма молекулы фибронектина может меняться от глобулярной до промежуточной. Молекулы фибронектина представляют собой димеры, состоящие из двух сходных между собой полипептидных цепей, связанных гидрофобными взаимодействиями и двумя дисульфидными связями. Субъединицы подразделяются на ряд различных доменов, способных связываться с клеточными рецепторами через интегрины, а также коллагенами, фибрином и протеогликанами. Связываясь перекрёст- но друг с другом через дисульфидные мостики, молекулы фибронектина образуют фибриллярные структуры (рис. 1.23).
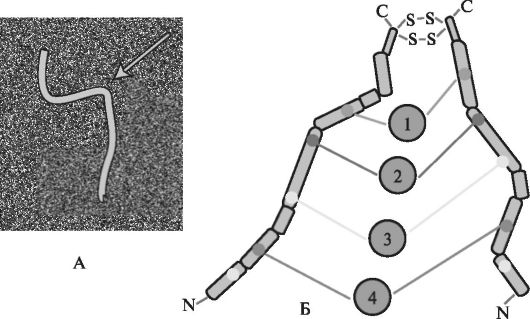
Рис. 1.23. Cтруктура молекулы фибронектина (А ). Модель молекулы фибронектина (Б). Цифрами обозначены домены, связывающие: 1 - гепарин, 2 - клетки, 3 - коллаген, 4 - другие молекулы фибронектина [по Cooper G.M., 2000, с изменениями].
На молекуле фибронектина имеется центр связывания фермента трансглутаминазы. Трансглутаминаза катализирует реакцию соединения остатков глутамина одной полипептидной цепи с остатками лизина другой белковой молекулы. Это позволяет сшивать поперечными ковалентными связями молекулы фибронектина друг с другом, коллагеном и другими протеинами. Фибронектин вовлечён во множественные клеточные процессы, включающие репарацию тканей, эмбриогенез, миграцию и адгезию клеток.
Интегрины представляют собой гетеродимерные белки с мол. массой 100-160 кДа, располагающиеся на плазматической мембране клеток и состоящие из двух нековалентно связанных трансмембранных а- и (3-субъединиц. Для функционирования интегринов необходимо присутствие двухвалентных ионов (Ca2+ или Mg2+), поскольку связывание катиона Ca2+ позволяет N-концевым участкам α- и (3-субъединиц соединяться друг с другом и прикрепляться к внеклеточному матриксу Они способны узнавать в матриксных белках пептид RGD (арг-гли-асп).
Семейство интегринов включает 20 видов рецепторов с разной специфичностью. Такое разнообразие обеспечивается различием в строении α- и (3-цепей. Описано 9 разновидностей α-цепей и 14 (3-субъединиц. Каждая цепь интегрина пересекает мембрану один раз. Обе цепи интегрина имеют большие внеклеточные домены. Эти домены обеспечивают адгезию клеток к клеткам и к компонентам внеклеточного матрикса - коллагену, фибронектину, витронектину, ламинину (рис. 1.24).
Благодаря трансмембранной ориентации интегрины переносят сигналы от внеклеточного матрикса к цитоскелету Большинство интегринов связано с цитоплазматическими С-концевыми участками с актин-связывающими белками клеток. При связывании лиганда β-субъединицы связывающихся интегринов взаимодействуют с так называемыми бел-
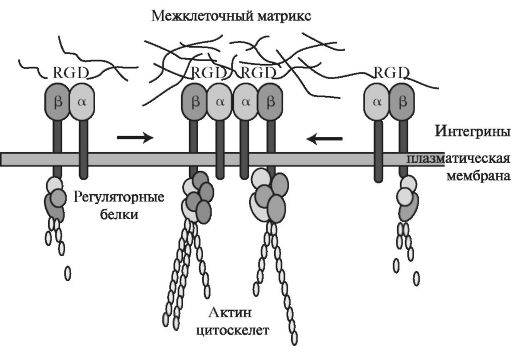
Рис. 1.24. Взаимодействие интегринов с актиновыми белками цитоскелета и межклеточным матриксом [по Campbell N. A., Reece J. B., 2002, с изменениями].
ками прикрепления - талином и α-актинином, которые, в свою очередь, инициируют сборку других соединительных белков. Таким образом происходит связывание интегринов с актиновыми филаментами. Актиновые филаменты через интегрины могут изменять ориентацию секретируемых молекул фибронектина во внеклеточном матриксе. В то же время внеклеточный матрикс может влиять на организацию цитоскелета в клетках-мишенях, что и обеспечивает двустороннюю передачу сигнала. Связывание интегринов с лигандами и сближение клеток необходимы для перестройки базальной мембраны.
Взаимодействие интегринов с белками внеклеточного матрикса в некоторых случаях препятствует апоптозу. Утрата некоторых интегринов (при раке молочной железы, предстательной железы, толстой кишки) или их избыток (при меланоме, плоскоклеточном раке полости рта, носоглотки, гортани) сопряжены с высокой степенью злокачественности опухоли.
Таким образом, информация, которую интегрины передают от внеклеточного матрикса внутрь клетки, в одних случаях стимулирует адге- зию и миграцию опухолевых клеток, в других - приводит к их гибели. Иными словами, интегрины играют роль своеобразного «переключателя», определяющего дальнейшую судьбу опухолевой клетки.
Ламинины - представители семейства адгезивных гликопротеинов c мол. массой 850 кДа. Молекула ламинина представляет собой большой гибкий комплекс, состоящий из длинных α-, β1-, β2-полипептидных цепей, ассоциированных в форме асимметричного креста и удерживаемых вместе при помощи дисульфидных связей. Каждая цепь содержит несколько функциональных доменов, способных связываться с коллагеном IV типа, гепарансульфатом, энтактином (нидогеном) и рецепторами на клеточной поверхности. Ламинины склеивают эпителиальные клетки с базальной мембраной (рис. 1.25).
На ранних этапах морфогенеза базальная мембрана состоит в основном из сети ламинина и не содержит (или содержит мало) коллагена IV типа.
Ламинины в базальной мембране находятся в комплексе с белком нидогеном, который соединяется С-концевым доменом с (32-цепью ламинина. В N-концевой области нидогена располагаются два глобулярных домена, один из которых связывается с коллагеном IV типа и коровым белком протеогликана перлекана. Таким образом, ламинин совместно с нидогеном обеспечивает структурную организацию компонентов базальной мембраны. Кроме того, глобулярные домены
Рис. 1.25. Строение ламинина [по Cooper G.M., 2000, с изменениями].
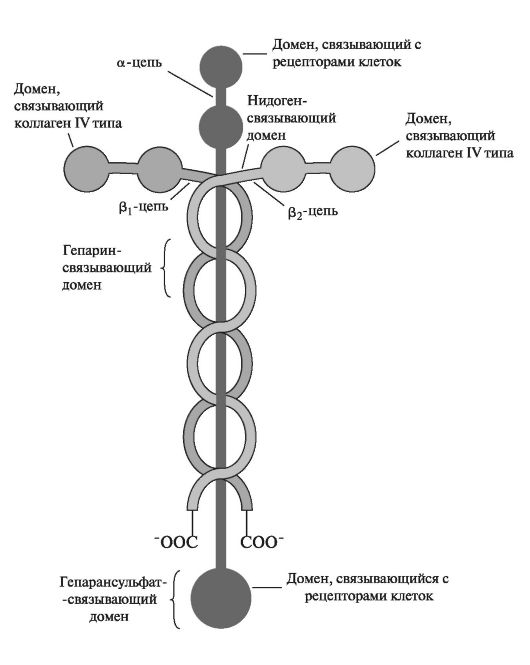
содержат центры связывания других лигандов вне зависимости от нидогена. Так (З1-цепь нидогена содержит домены, сходные со структурой белков цистатинов, обладающих способностью ингибировать цистеиновые трипсиноподобные протеиназы.
Ламинины обеспечивают миграцию эпителиальных клеток и таким образом участвуют в одонтогенезе, связывании тканей периодонта с цементом корня зуба, построении эпителиальной оболочки на поверхности пульпарной ткани при образовании полипа пульпы.
Витронектин - гликопротеин, содержащийся в плазме крови и внеклеточном матриксе. Витронектин вступает во взаимодействие с гликозаминогликанами, коллагеном, плазминогеном, рецептором урокиназы. Стабилизируя ингибирующую конформацию ингибитора активации плазминогена 1 (протеиназы), регулирует деградацию матрикса. Через связывание витронектина с комплементом, гепарином и комплексами тромбин-антитромбин III, он участвует в иммунном ответе и регуляции свертывания крови. В полипептидной цепи витронектина присутствует аминокислотная последовательность RGD, которая обеспечивает его взаимодействие с αVβ3-рецептором интегрина и участие в прикреплении, распластывании и перемещении клеток.
Тенасцин и тромбоспондин - гликопротеины, обладающие как адгезивными, так и антиадгезивными свойствами. Тенасцин и тромбоспондин играют определённую роль в эмбрио- и морфогенезе. Эти белки обеспечивают изменение клеточной формы в условиях in vitro, которое, в свою очередь, приводит к сдвигам в поведении клеток в культуре. Они способствуют реорганизации актинового цитоскелета путём изменения адгезивных контактов с белковыми факторами, обеспечивающими подвижность клеток. Тенасцин и тромбоспондин формируют комплексы с протеогликанами и при связи тенасцина с хондроитинсульфатом изменяются адгезивные свойства протеогликанов.
Тенасцин - олигомерный гликопротеин с мол. массой более 100 кДа. Молекула данного белка имеет мозаичную структуру, а аминокислотная последовательность сходна с эпидермальным фактором роста. В составе тенацина имеются кальций-связывающие домены.
Тромбоспондин - гликопротеин, который проявляет свои антиадгезивные свойства в клетках эндотелия и фибробластов, поскольку с (3-транс- формирующим и тромбоцитарным факторами роста ослабляют связывание матриксных молекул между собой.
Тромбоспондин проявляет и адгезивные свойства при взаимодействии с молекулами интегринов, гликопротеинов, гепарансульфата и
гликолипидов. Глобулярные домены, содержащиеся в N- и C-кон- цевых областях, способствуют связыванию кальция с гепарином, после чего тромбоспондин вступает во взаимодействие с коллагеном, фибронектином, фибриногеном, ламинином и плазминогеном.
Помимо адгезивных белков, участвующих в организации надмолекулярных комплексов межклеточного матрикса, в тканях присутствуют гликопротеины, относящиеся к факторам роста.
Факторы роста
В качестве факторов роста обычно выступают небольшие полипептиды, которые стимулируют или ингибируют пролиферацию опре- делённых типов клеток. Как правило, они секретируются одними клетками и действуют на другие клетки, хотя иногда бывает и так, что они действуют на те же клетки, которые их секретируют. Факторы роста связываются с специфическими для них рецепторами, локализованными на поверхности клеточных мембран своих клеток-мишеней. Большинство факторов роста активируют в клетках тирозиновые протеинкиназы и только ТФР-(3 активирует треониновые протеинкиназы.
Трансформирующий фактор роста (ТФР-(3) - семейство гликопротеинов, включающих 6 разнообразных белков. Они представляют собой димеры, состоящие из двух идентичных субъединиц. Белки ТФР-(3 синтезируются в виде предшественников, секретируются в неактивной форме и активируются путём ограниченного протеолиза.
На клеточной мембране бластных клеток выявлены 3 типа рецепторов к ТФР. Рецепторы третьего типа являются поверхностными протеогликанами и обеспечивают доступ ТФР-(3 к рецепторам первого и второго типов, которые после связывания ТФР-(3 образуют гетеродимер с протеинкиназной активностью. Происходит аутофосфорилирование цитоплазматического домена рецепторов по остаткам серина и треонина. Далее происходит фосфорилирование цитоплазматических белков, участвующих в передаче сигнала в ядро, где происходит активация гена транскрипции. Через такой механизмом активируется синтез белков внеклеточного матрикса, например коллагена I типа и металлопротеиназ.
Кроме того, ТФР-(3 действует как фактор хемотаксиса для моноцитов и фибробластов. Он подавляет пролиферацию и функцию Т- и В-лимфоцитов и эндотелиальных клеток. Среди сложной сети цитокинов, которые влияют на функцию одонтобластов в процессе регенерации дентина, важную роль играют ТФР-(3, который функци-
онирует как мощный иммунодепрессант и индуктор синтеза белков внеклеточного матрикса. ТФР- β поддерживает гомеостаз в комплексе дентин-пульпа при воспалении.
Морфогенетический белок кости (МБК) - кислый гликофосфопротеин, богатый серином и глицином, содержащий три дисульфидные связи. Восстановление дисульфидных связей вызывает инактивацию МБК. В пульпе зуба секретируется в ответ на внешние раздражители одонтобластами для образования заместительного дентина. МБК очень активен в костной ткани и вызывает дифференцировку стволовых клеток в остеогенные.
Фактор роста эндотелия (ФРЭ) - гликопротеин, связывающийся только с клетками эндотелия сосудов и стимулирующий их проли- ферацию.
Кроме того, ФРЭ может активировать специфический белок, включающий киназный комплекс. Образующиеся фосфорилиро- ванные белки вызывают перемещение клеток, поэтому при повреждении пульпы зуба, костной ткани, слизистой оболочки, периодонта и других тканей полости рта под влиянием ФРЭ происходит быстрое перемещение, увеличение и дифференцировка клеток с активацией щелочной фосфатазы.
ФРЭ вызывает расширение кровеносных сосудов, что является важным условием для поддержания кровотока в тканях при воспа- лении. Он также увеличивает синтез ИЛ-1, фактора некроза опухоли (ФНО), которые вносят существенный вклад в расширение сосудов при патологических процессах. Нарушение регуляции процессов факторов роста эндотелия сопровождается увеличением осмотического давления, болью и необратимыми изменениями в ткани.
Инсулиноподобный фактор роста (ИФР) оказывает аутокринное и паракринное действие. Предполагается его участие в быстром росте клеток, их дифференцировке и минерализации твёрдых тканей зуба.
Фактор роста фибробластов (ФРФ) - семейство структурно связанных полипептидов, представленное девятью белками. Мол. масса различных форм ФРФ колеблется от 168 до 250 кДа. До 50% аминокислотной последовательности молекулы фактора роста фибробластов соответствует структуре фактора роста эндотелия. Оба эти пептида также обнаруживают сходное сродство к гепарину и вызывают расширение сосудов. Фактор роста фибробластов участвует в росте и дифференцировке фибробластов при образовании фиброзной капсулы вокруг очага воспаления.
Фактор роста нервов (ФРН) - семейство белков, стимулирующих рост клеток нервной ткани. Практически все клетки человека синтезируют этот фактор. Фактор роста нервов участвует в быстром восстановлении повреждённого участка за счёт роста аксонов из пов- реждённого нервного ствола или от ближележащих неповреждённых нервных волокон. Тем самым ФРН может играть важную роль в ответе нервных клеток на повреждение. Выделение ФРН в полость рта со слюной стимулирует заживление повреждённых участков слизистой оболочки.
Фактор роста гепатоцитов (ФРГ) стимулирует пролиферацию клеток различных тканей. Возможно его участие в агрегации клеток при повреждении тканей, а также в морфогенезе тканей зуба.
Эпидермальный фактор роста (ЭФР) - белок с мол. массой 70 кДа. Различают α- и β-формы ЭФР. Оказывает действие на клетки эктодермы: кератиноциты кожи, эпителиоциты слизистой оболочки полости рта, пищевода, глотки, а также мезодермы: хондроцитов, эндотелия сосудов. Эпидермальный фактор роста стимулирует дифференцировку одон- тобластов и повышает в них синтез ДНК в момент созревания зубных тканей. С возрастом ЭФР угнетает деление одонтобластов, уменьшает синтез коллагена I типа и снижает активность щелочной фосфатазы. На выработку ЭФР влияют стероидные гормоны, тироксин и прогестерон.
Фактор роста тромбоцитов (ФРТ) влияет на многие клетки. Индуцирует синтез щелочной фосфатазы и протеогликанов в одонтобластических клетках зубной пульпы и костной ткани.
1.5. КАТАБОЛИЗМ БЕЛКОВ МЕЖКЛЕТОЧНОГО МАТРИКСА
Ремоделирование тканей связано с дифференцировкой и миграцией клеток. Клетка, вступившая на путь дифференцировки, неизбежно погибает. Нарождающаяся новая клетка начинает синтезировать новые собственные белки, часть из которых поступает в матрикс.
В катаболизме белков клеток и межклеточного матрикса основная роль отводится матриксным металлопротеиназам (ММП, матриксины). В физиологических условиях ММП играют центральную роль в процессах морфогенеза, ремоделирования и резорбции тканей. Своё действие матриксины проявляют в межклеточном матриксе. В активном центре этих ферментов присутствуют кальций или цинк, поэтому они получили название Са2+-зависимых цинковых матриксных металлопротеиназ. Известно более
20 различных металлопротеиназ, отличающихся по субстратной специфичности и другим свойствам. На основании структурной организации и субстратной специфичности выделено четыре основных подсемейства ММП:
• коллагеназы - запускают гидролиз спиральной области коллагенов I, II и III типов;
• желатиназы - гидролизуют коллаген IV типа базальных мембран;
• стромелизины - расщепляют коровые белки протеогликанов и ряд адгезивных белков матрикса;
• металлоэластаза - расщепляет эластин.
В распаде нативного коллагена, период полужизни которого измеряется неделями или месяцами, участвуют коллагеназы, относящиеся к ММП-1 и ММП-13. Коллагеназы рассекают все три пептидные α- цепи молекулы нативного коллагена в спиральной области, примерно на 1/4 расстояния от С-конца, между остатками глицина и лейцина (или изолейцина). Образующиеся фрагменты коллагена становятся растворимыми в воде и денатурируют, после чего их пептидные связи становятся доступными для гидролиза другими пептидазами.
Гидролиз коллагенов базальных мембран происходит при участии желатиназ (ММП-2, ММП-9). В связывании желатинов и коллагенов желатиназами участвуют так называемый фибронектиновый домен, присутствующий в структуре N-концевой области фермента.
Два других фермента - стромелизин -1 (ММП-3) и стромелизин - 2 (ММП-10), расщепляют коровые белки протеогликанов и целый ряд адгезивных белков межклеточного матрикса (табл. 1.4).
Активность матриксных металлопротеиназ повышается при деструкции межклеточного матрикса, которая наблюдается при целом ряде заболеваний - пародонтите, пульпите, хронических язвах, инвазии и метастазировании опухолей и др.
Регуляция активности матриксных металлопротеиназ
Активность матриксных металлопротеиназ находится под постоянным контролем.
Во-первых, они синтезируются в виде препроферментов. Сигнальный пептид обеспечивает направленную секрецию молекулы и после его отщепления образуется профермент. Профермент содержит последовательность аминокислот, в которой остаток цистеина связывает молекулу Zn2+, находящуюся в активном центре. В последующем после отщепления полипептида сформировавшаяся активная форма ММП содержит два основных домена. N-концевой домен содержит цинк-свя-
Таблица 1.4
Семейство матриксных металлопротеиназ
Тип ММП | Фермент | Мол. масса, кДа | Расщепляемые компоненты |
ММП-1 | Инстициальная коллагеназа | 52 | Коллаген I, II, III, VII, VIII, X типов, желатин, протеогликаны |
ММП-2 | Желатиназа А | 72 | Желатин, коллаген IV, V, VII, X, XI типов, фибронектин, эластин, протеогликаны |
ММП-9 | Желатиназа В | 92 | Желатин, коллаген IV, V типов, эластин, протеогликаны |
ММП-3 | Стромелизин-1 | 57 | Эластин, протеогликаны, ламинин, фибронектин, коллаген IV, VII, IX типов, про ММП-1 |
ММП-7 | Матрилизин | 28 | Протеогликаны, ламинин, желатин, фибронектин, коллаген IV типа, проММП-1, -7, -8, -9 |
ММП-12 | Мета л ло эластаза | 55 | Эластин |
ММП-13 | Инстициальная коллагеназа-3 | 52 | Коллаген I, II, III типов, желатин |
ММП-14 | Мембранный тип ММП | 66 | Коллаген I, II, III типов, проММП- 2, -13 (мембранного типа) |
зывающий участок, в котором Zn2+ связывается тремя остатками гистидина и обладает каталитической активностью. В катализе, помимо цинка, принимает участие остаток глутаминовой кислоты. С-концевой домен отвечает за связывание с субстратами и ингибиторами ММП. Между N- и С-концевыми доменами располагается небольшой связывающий домен, который обеспечивает субстратную специфичность (рис. 1.26, А).
В отщеплении сигнального пептида участвуют различные протеиназы. Так, в реакции активации проММП-1 и проММП-3 участву- ет трипсиноподобная протеиназа плазмин, проММП-2 мембранная металлопротеиназа, проММП-9 желатиназа А. Таким образом, активация ферментов происходит в виде каскада и в этот процесс вовлечены одновременно множество проферментов и вновь образующихся активных энзимов (рис. 1.26, Б).
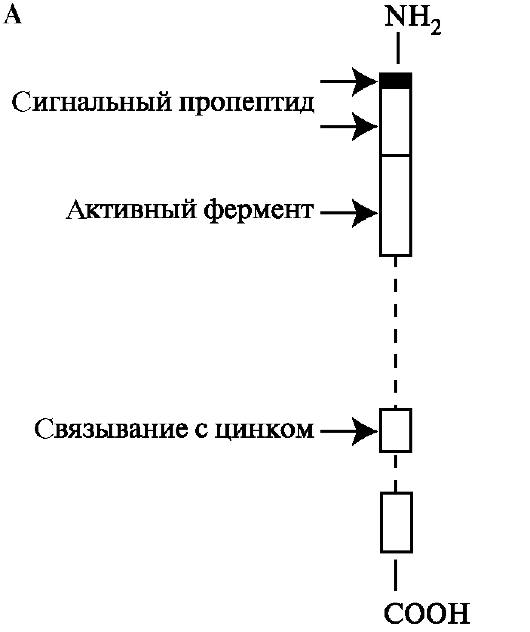
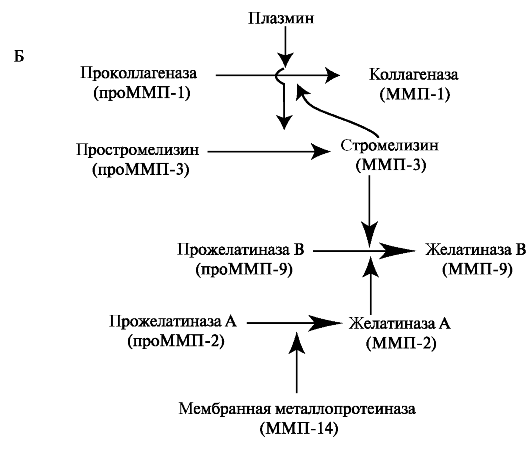
Рис. 1.26. Строение проММП-1: А - активация фермента происходит при отщеплении сигнального пропептида; Б - в ограниченном протеолизе проММП участвуют различные протеиназы.
Во-вторых, активность ферментов зависит от уровня экспрессии их генов. Большинство ММП относится к «индуцируемым» ферментам, синтез которых на уровне транскрипции контролируется рядом
факторов: цитокинами и другими факторами, действующими на поверхность клетки (эстроген, прогестерон и др.). Промоторы ММП содержат общие элементы, отвечающие за механихм регуляции экспрессии генов.
В-третьих, в физиологических условиях в тканях содержится незначительное количество ММП и их активность зависит от присутствия активаторов и ингибиторов в окружающей среде. Активность ММП находится под контролем специфических белков - тканевых ингибиторов металлопротеиназ (ТИМП). В настоящее время хорошо изучены четыре вида ТИМП, выделенных из различных тканей человека: ТИМП-1, ТИМП-2, ТИМП-3, ТИМП-4. ТИМП способны связываться как с активными, так и неактивными формами ММП. Эти белки различаются по их специфическому действию на металлопротеиназы. Так, ТИМП-1 значительно лучше ингибирует ММП-9, в то время как ТИМП-2 подавляет активность ММП-2. ТИМП инактивируются путём гидролиза с участием различных протеиназ - трипсина, химотрипсина, стромелизина-3 и эластазы нейтрофилов.