Биохимия тканей и жидкостей полостей рта: учебное пособие / Вавилова Т.П. - 2-е изд., испр. и доп. - 2008. - 208 с. : ил.
|
|
|
|
ГЛАВА 4 СТРУКТУРА И РАЗВИТИЕ ТКАНЕЙ ПОСТОЯННЫХ ЗУБОВ
Эмаль зуба является уникальным сложносоставным биокерамическим материалом и самой твёрдой тканью человеческого организма. В отличие от других твёрдых тканей организма эмаль не обладает клеточной структурой.
4.1. СТРУКТУРА И СВОЙСТВА ЭМАЛИ
Основная масса неорганических компонентов представлена кристаллами гидроксиапатита (75%), карбонатного апатита (12%), фторапатита (1%) и других форм апатитов, прочно связанных с органической матрицей. Имеются и аморфные участки неорганического матрикса. Тонкие, длинные кристаллы гидроксиапатитов эмали имеют размеры от десятков до сотен нанометров и отличаются от кристаллов других плотных тканей своими размерами.
Основной функцией эмали является защита дентина и пульпы зуба от воздействия внешних раздражителей в окружении большого количества бактерий без катастрофических последствий для организма.
В зрелой эмали определяется до 3,8% воды, из них примерно 3,0-3,3% составляет связанная вода, присутствующая в гидратной оболочке на поверхности кристаллов. В незрелой эмали количество воды достигает 20%; с возрастом её количество уменьшается. Около 0,5% приходится на свободную воду, располагающуюся в микропространствах. Жидкость, присутствующую в эмали и содержащую ионы, называют «эмалевым ликвором», или «эмалевой жидкостью». Кристаллы гидроксиапатита создают в эмали эффект молекулярного сита, через которое в эмалевую жидкость проникают небольшие органические молекулы и минеральные ионы. Эмалевая жидкость распределяется неравномерно. В поверх- ностных участках эмали жидкости немного и её количество увеличивается по направлению к эмалево-дентинной границе. В отличие от воды гидратных оболочек кристаллов, эмалевая жидкость более подвижна и её можно удалить, прогревая зубные ткани при относительно невысоких температурах. Движение жидкости обусловлено капиллярным
механизмом, и по жидкости диффундируют ионы и молекулы. Хотя эмаль не содержит клеток и не способна к регенерации, однако в ней постоянно происходит обмен веществ. В эмаль поступают ионы, пре- имущественно из слюны, а также через дентин из пульпы зуба.
Химический состав эмали
Неорганические вещества зрелой эмали составляют 94-95%, в незрелой формирующейся эмали их намного меньше - всего 5%, а в эмали молочных зубов - 80%. После удаления минеральных компонентов остается тонкая сеть органической матрицы.
Кроме солей фосфата кальция в составе эмали обнаружены свыше 30 разных элементов. В относительно больших количествах при- сутствуют ионы Mg2+, Na+, а также Cl-, K-, Zn2+и Fe2+. Минеральный состав эмали может колебаться в зависимости от характера питания, но процентное соотношение кальция, фосфора и карбоната довольно постоянно. Содержание Sr2+, Pb2+ и некоторых других микроэлементов в эмали колеблется значительно и зависит от их количества в почве данной местности.
Минеральные вещества в эмали распределены неравномерно. Поверхностные более плотные слои содержат меньше воды, карбонатов и больше фтора. Количество неорганических компонентов уменьшается в направлении от поверхности к зоне перехода эмали в дентин (т аб л. 4.1).
Содержание кальция и фосфора в эмали соответственно составляет 33,6-39,4 и 16,1-18,0% по отношению к остальным элементам эмали и в направлении от поверхности зуба к дентину их содержание снижается. Обычно снаружи она для ионов Ca2+ составляет 37,8, а внутри - 34,5% и для фосфатов - 18 и 15%. Однако при этом соотно- Таблица 4.1
Распределение химических элементов в эмали зуба (по Curzon M.E.J., 1983)
Концентрация в пкмоль | Элементы |
> 1000 | Na, Cl, Mg |
100-1000 | K, S, Zn, Si, Sr |
10-100 | Fe, Al, Pb, B, Ba |
1-10 | Cu, Rb, Br, Mo, Cd, I, Ti, Mn, Cr, Sn |
0,1-0,9 | Ni, Li, Ag, Nb, Se, Be, Zr, Co, W, Sb, Hg |
< 0,1 | As, Cs, V, Au, La, Ce, Pr, Nd, Sm, Tb |
шение кальция и фосфатов остаётся постоянным (2,1 и 2,3 - весовое и 1,62-1,78 - молярное соотношение). Такая же закономерность распределения концентрационного градиента в эмали относится и к хлоридам. Напротив, содержание карбонатов, натрия, магния и железа в эмали увеличивается по направлению к дентину. Свинец присутствует в низких концентрациях. Он накапливается в поверхностных слоях эмали, в то время как медь и стронций равномерно распределяются по всей толщине эмали.
Органические вещества эмали
Доля
органических веществ в зрелой эмали составляет 1,2-2,0%. Органический
матрикс представлен небольшим количеством углеводов и липидов, а также
специфическими для данной ткани белками. Они находятся между
кристаллами апатита в виде пучков, пластинок или спирали. Количество
липидов, в основном глицерофосфолипидов, достигает 540-570 мг на
Белки эмали в сформированных постоянных зубах образуют тонкую сетку и представлены энамелинами и амелогенинами в соот- ношении 1:1. Кроме этих белков в эмали определяются отдельные свободные аминокислоты (глицин, валин, пролин, гистидин, лизин и аргинин) и пептиды. Считают, что белковая матрица, окружающая апатиты, предотвращает контакт кислот с ними и тем самым смягчает воздействие этих кислот на кристаллы гидроксиапатита. Органические компоненты эмали влияют на биохимические и физи- ческие процессы, происходящие в эмали зуба. С возрастом увеличивается уровень белка в наружном слое эмали и при этом снижается кариесрезистентность твёрдых тканей зуба.
4.2. АМЕЛОГЕНЕЗ
Образование эмали зуба (амелогенез) связано с дифференцировкой клеток внутреннего эмалевого эпителия. Преэнамелобласты начинают развиваться параллельно с преодонтобластами. Эти клетки содержат большое количество свободных рибосом, митохондрий, комплекс Гольджи и включения гликогена. Дифференцировка клеток эмалевого органа регулируется ТФР-(3, инсулиноподобным-1 и эпидермальным факторами роста.
Отложение первых слоёв дентина индуцирует образование секреторно-активных энамелобластов, которые начинают продуцировать эмаль поверх образующегося слоя дентина. Амелогенез связан с сек- рецией энамелобластами набора специфических белков и состоит из трёх стадий.
• Первая стадия (секреторная) включает: инициацию формирования внеклеточного матрикса; •постепенную деградацию органического матрикса и рост кристаллов; •упорядочное размещение кристаллов;
• контроль за дальнейшим ростом кристаллов в длину и ширину; •формирование призматической структуры кристаллов эмали.
Вторая стадия (созревания) состоит из:
• удаления остатков белковых молекул, при этом состав компонентов приближается к таковым зрелой эмали; •завершения роста кристаллов; •длительного насыщения ионами магния и фтора;
• Третья стадия (зрелая эмаль) заканчивается: формированием эмали; •деградацией клеточного слоя эмалевого органа.
На первой стадии формируется органический матрикс, который лишён минералов и состоит из белков, располагающихся на наружной стороне клеток. Развитие и дальнейшее существование эмали зависит от синтетической активности клеток только на этапе формирования (рис. 4.1).
Преэнамелобласты превращаются в секреторно-активные энамелобласты. В секреторно-активных энамелобластах происходит следующее. В цистернах гранулярной эндоплазматической сети синтезируются белки, преимущественно амелогенины. Они составляют 90% от всех белков, выделяемых энамелобластами, и только 10% протеинов представлены энамелинами, кальций-связывающими и другими белками.
В настоящее время методом двухмерного электрофореза в растворимой клеточной фракции незрелой эмали грызунов было выявлено до 34 различных белков, участвующих в амелогенезе. Эти белки раз- личаются по аминокислотному составу, мол. массе и подвижности
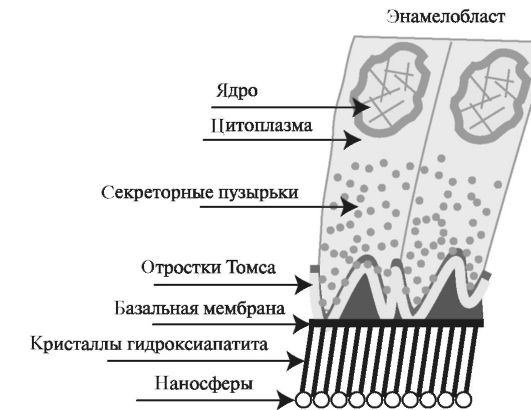
Рис. 4.1. Строение секреторного энамелобласта.
Секреторный энамелобласт содержит большое ядро, для него характерно
образование отростков Томса и формирование секреторных пузырьков.
в электрическом поле. Некоторые из них идентифицированы. Это кальций-связывающие белки: кальбиндин, кальретикулин, аннексин V, кальмодулин и связанные с ним кальцинейтрины А и В, а также белки, участвующие в образовании цитоскелета: тропомиозин, актин, цитокератин (4 изоформы), виментин; ферменты: F^-субъединица АТФ-синтазы, креатинкиназа, эндоплазмин, энолаза, малатдегидрогеназа, фосфоглюкомутаза, энамелизин (ММП-20), калликреин - 4, эмалевая матриксная сериновая протеиназа-1 и белки, участвующие в формировании межклеточного матрикса. Это 6 фракций амелогенинов с мол. массой 28, 27, 25, 23, 21 и 19 кДа, альбумины, энамелины, амелобластины (шеатлины/амелин).
Помимо белков из созревающей эмали выделены пептиды, липиды, моносахариды. В процессе синтеза белки подвергаются посттрансляционной модификации, которая включает фосфорилирование и гликозилирование полипептидных цепей. Фосфат присоединяется к остаткам серила (рис. 4.2).
В комплексе Гольджи синтезированные белки подвергаются гликозилированию, то есть происходит присоединение остатков галактозамина, глюкозамина и сиаловых кислот.
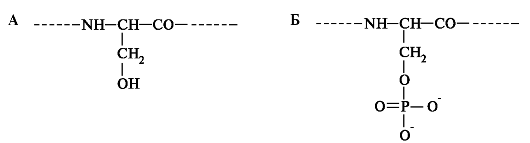
Рис. 4.2. Посттрансляционная модификация белков:
А - серил в составе белка; Б - фосфосерил в составе белка.
Амелогенины содержат большое количество остатков пролина, лейцина, гистидина и глутаминовой кислоты. В их составе отсутствуют гидроксипролин и цистеин, которые характерны для коллагена и кератинов. Это гетерогенная фракция, состоящая из белков с различной мол. массой (19-28 кДа). Белки, выделенные у разных видов животных, имеют подобный аминокислотный состав и не имеют отличий в первых 33 аминокислотных остатках в N-концевой области. По мере созревания происходит расщепление высокомолекулярных амелогенинов и увеличивается доля низкомолекулярных амелогенинов с мол. массой 6 и 13 кДа.
В синтезе амелогенинов на ранней стадии развития зуба участвуют как амелобласты, так и одонтобласты, однако большая часть этих белков синтезируется амелобластами в соотношении 320:1. На стадии созревания эмали это соотношение меняется в сторону уменьшения (20:1).
Энамелины, как и амелогенины, относятся к гликофосфопротеинам. Это кислые белки, богатые аспарагиновой и глутаминовой кислотами, пролином и глицином. Они сильно гликозилированы и содержат до 4% гексозаминов, а также 3,8% нейраминовой кислоты.
Энамелин присутствует в развивающемся зубе в нескольких изоформах. Вначале синтезируется белок-предшественник с мол. массой 130 кДа. На разных стадиях развития эмали появляются его изоформы с меньшей мол. массой. Установлено, что энамелины с разной мол. массой выполняют различные функции. Из энамелина с мол. массой 89 кДа образуется энамелин с мол. массой 32 кДa, который является амелопротеиназой, участвующей в деградации высокомолекулярных белков. Энамелин с мол. массой 67 кДа содержит большое количество аспарагиновой и глутаминовой кислот, аланина, лейцина и лизина. Он по аминокислотному составу близок к сывороточному альбумину.
Помимо энамелинов и амелогенинов энамелобластами синтезируются и другие белки - амелобластин и тафтелин. Тафтелин - кислый фосфорилированный гликопротеин с мол. массой 43,8 кДа. В его составе определяется 1 гликозилированный участок и 5 остатков цистеина. Он формируется на короткое время только в процессе развития эмали.
В стадию секреции энамелобласты и преодонтобласты секретируют белок амелобластин, который также называют амелином, или шеатлином. Вначале синтезируется амелобластин с мол. массой 68 кДа, и в результате его ограниченного протеолиза появляются множество белков с мол. массой 52, 40, 37, 19, 17, 16, 15, 14 и 13 кДа. Белки с мол. массой 16-17 кДа гидрофобны и нерастворимы в воде. В стадию созревания эмали амелобластин уже исчезает.
Белки, синтезируемые энамелобластами, упаковываются в везикулы, и далее происходит перемещение секреторных гранул к апикальной поверхности клеток. Гидрофобные молекулы амелогенина агрегируют между собой и собираются в наносферы (рис. 4.3). Сборка наносфер осуществляется в цитоплазме без участия АТФ.
В момент образования наносфер осуществляется направленная поставка ионов октакальция фосфата для формирования кристаллов.
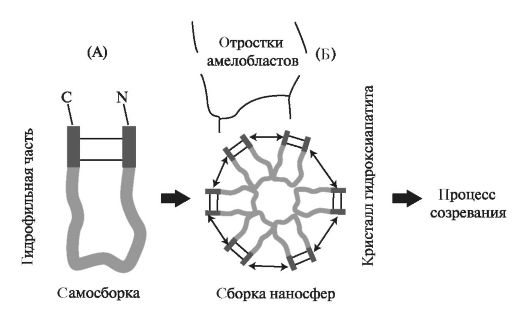
Рис. 4.3. Формирование наносфер в процессе амелогенеза: А - образование связи в амелогенине между аминокислотами N- и С-концевой области; Б - собранные из 6 амелогенинов наносферы выделяются отростками амелобластов и участвуют в процессе созревания эмали.
Неорганические ионы к поверхности эмали поступают из капилляров зубного мешочка. Поступление секреторных гранул во внеклеточное пространство обеспечивают сократительные белки цитоскелета - актин и тропомиозин. Содержимое секреторных гранул освобождается и распределяется поверх новообразованного слоя дентина.
Взаимосвязь между белками внеклеточного матрикса обеспечивает белок с мол. массой 39 кДа, сходный по строению с тафтелином и получивший название тафтелин-интерактивный белок (TIP-39). Он синтезируется как амелобластами, так и одонтобластами. TIP-39, как и тафтелин, способен к образованию доменов, в которых присутствуют надвторичные структуры типа спираль-петля-спираль. В С-концевой области располагается домен, обеспечивающий его связывание с клатрином, который выстилает секреторные гранулы. Предполагают, что TIP-39 участвует в транспорте синтезированных амелобластами белков в межклеточный матрикс эмалевого органа. Этот белок также участвует во внутриклеточном переносе амелогенина. Комплексы тафтелина и TIP-39 обеспечивают связь между дентином и амелобластами в процессе образования дентино-эмалевой границы.
Первичная минерализация эмали
Первичная минерализация эмали представляет двухступенчатый процесс, включающий инициацию и последующий рост кристаллов (эпитаксию). Для роста кристаллов необходимы белки с небольшой мол. массой, а в составе секреторных гранул содержатся высокомолекулярные гликофосфопротеины, поэтому эти белки подвергаются ограниченному расщеплению протеолитическими ферментами - энамелизинами (ММП-20), калликреином и матриксными сериновыми протеиназами. Энамелизин секретируется в начальной стадии созревания эмали как амелобластами, так и одонтобластами, а калликреин- 4 - только амелобластами. Каждая протеиназа обладает субстратной специфичностью и расщепляет пептидные связи, образованные опре- делёнными аминокислотами. Процесс протеолиза носит каскадный характер, что сопровождается образованием белков с разной мол. массой и различными функциями. Так, энамелизин гидролизует амелогенины с мол. массой 25 кДа и образуются белки с мол. массой 20 кДа, которые далее подвергаются гидролизу при участии слабощелочной протеиназы - калликреина-4. В результате протеолиза освобождаются амелогенины с мол. массой 6 и 13 кДа. Образующиеся в процессе гидролиза низкомолекулярные белки способны присоединять Ca2+ и PO43-.
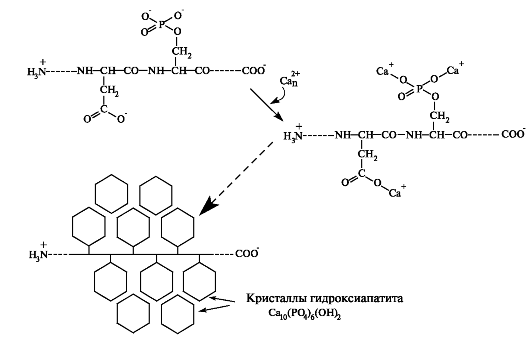
Рис. 4.4. Формирование кристаллитов гидроксиапатита.
К остаткам глутаминовой кислоты, аспарагина и фосфосерила присоединяются ионы кальция и фосфата. В процессе дальнейшей преципитации ионов формируется первичный кристалл гидроксиапатита.
Для образования кристаллов гидроксиапатита необходима высокая концентрация Ca2+. В транспорте Ca2+ участвуют кальций-связывающие белки. Наличие большого количества глутамата и аспартата в эмалевых низкомолекулярных белках и других протеинах минерализованных тканей позволяет присоединять Ca2+ непосредственно к 7- и е-карбоксильным группам этих аминокислот; Ca2+ также связывается с остатками фосфосерила. Присоединение кальция и фосфата к белкам эмали заканчивается формированием кристаллитов гидроксиапатита.
Вначале формируются длинные и тонкие кристаллиты, которые встраиваются в органический матрикс параллельно друг другу. В более позднем периоде кристаллиты утолщаются и превращаются в плоские шестиугольные призмы (рис. 4.4). Упорядоченное построение и форма кристаллов эмали отличается от бесформенных пластинчатых призм кристаллов кости и дентина. Уникальность эмалевых кристаллов обусловлена особенностью их формирования и роста. Рост кристаллов регулируется ионами Ca2+ и PO43 , которые транс-
портируются от амелобластического слоя в эмалевый матрикс. В свою очередь, поток жидкости, изменяющийся в течение развития эмали, регулирует эмалевый матрикс.
В регуляции роста кристалла в длину, ширину и толщину участвуют амелогенины, упакованные в наносферы (рис. 4.5).
Амелогенины подвижны и не связываются с кристаллами. Считают, что присутствие глутаминовой кислоты в составе амелогенинов позволяет связывать молекулы H2O и Ca2+, тем самым способствуя формированию кристаллов. Предполагают, что амелогенины мигрируют по формирующейся эмали и по мере роста кристаллов вытесняются в сторону энамелобластов. Эмалевые белки обнаруживают во всех участках ново- образованной эмали, но наибольшая их концентрация определяется в оболочке эмалевых призм. В формирующейся эмали также обнаружены остатки отростков амелобластов, содержащих небольшое количество глицерофосфолипидов, которое сохраняется в зрелой эмали.
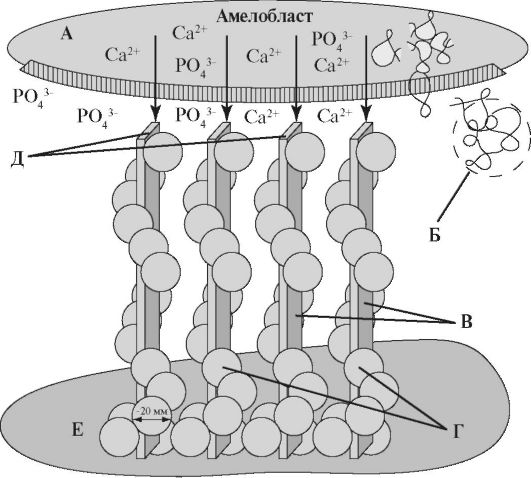
Рис. 4.5. Регуляция роста кристалла [по Ten Cate A.R., 1998]: А - клеточная мембрана амелобласта; Б - собранная наносфера; В - начальные кристаллиты; Г - ансамбли из наносфер, располагающиеся на поверхности первичных кристаллов; Д - кристаллиты присоединяют дополнительные ионы кальция и фосфата; Е - минерализованный матрикс дентина.
Вторичная минерализация эмали
Созревание эмали сопровождается значительным снижением содержания органических компонентов. Почти 100-200-кратное снижение содержания белков при созревании сопровождается значительным изменением их аминокислотного состава. Происходит распад амелогенинов и задерживается деградация энамелинов, при этом энамелины прочно связываются с кристаллами апатита.
Образованная первичная эмаль является незрелой. Она состоит на 30% из органического матрикса и на 70% - из минеральных солей. Во вторичной минерализации участвуют энамелобласты стадии созревания, которые содержат большое количество кальций-связывающих белков. Через энамелобласты к эмали переносятся неорганические ионы и удаляются из созревающей эмали органические вещества и вода. Наружная поверхность эмали содержит меньше белков, чем её внутренняя часть. Белки и пептиды, расположенные снаружи, более растворимы в воде и участвуют в образовании поверхностного слоя эмали. После прорезывания зубов эмаль покрыта тонким слоем клеток (10 мкм), который быстро разрушается и сменяется органической кутикулой, образуемой белками слюны и продуктами эпителия слизистой.
Третичная минерализация эмали
Окончательная минерализация эмали происходит уже после прорезывания зуба, и особенно интенсивно - в течение первого года нахождения коронки зуба в полости рта. Часть неорганических веществ поступает со стороны дентина, но основное их количество поставляет слюна. В связи с этим для полноценной третичной минерализации очень важен минеральный состав и рН слюны.
4.3. СТРУКТУРА ДЕНТИНА
Дентин - основная составная часть зуба. Он содержит до 70% минеральных веществ, 17% органических веществ и 13% воды. Дентин является сложной гетерогенной структурой, которая граничит с эмалью в области коронки зуба и с цементом в корне зуба.
Самый глубокий слой дентина, расположенный на границе с пульпой зуба, называется предентином. Это тонкий слой неминера- лизованной органической матрицы, которая состоит в основном из коллагеновых белков.
Неорганические компоненты дентина
Неорганическая часть дентина представлена кристаллами гидроксиапатитов, фторапатитов, а также аморфным фосфатом кальция. Содержание магния в дентине в три раза превышает таковое в костях. Количество карбонатов в дентине выше, чем в эмали. В области предентина на границе с пульпой зуба определяется самое высокое содержание фтора, которое увеличивается с возрастом. Несмотря на то, что главным минеральным компонентом дентина является гидроксиапатит, суммарный химический состав его не совпадает с формулой идеального гидроксиапатита. Это обусловлено тем, что в дентине присутствует небольшое количество воды и ионов, которые отсутствуют в гидроксиапатите.
Органические компоненты дентина
Поскольку
дентин является разновидностью соединительной ткани, то он содержит
присущий этой ткани органический матрикс, сформированный коллагеновыми
белками I, III, IV, V, VI типов, и протеогликанами, которые постоянно с
разной скоростью синтезируются одонтобластами. Основной коллаген
дентина, как и в костной ткани, относится к коллагену I типа. В дентине
между коллагеновыми фибриллами расположены липидные гранулы
(липосомоподобные структуры), и содержание липидов достигает 330-350 мг
на
Протеогликаны, присутствующие в дентине, содержат хондрои- тин-4-сульфат и хондроитин-6-сульфат. Внутреннюю поверхность дентинных трубочек покрывает гиалуроновая кислота, которая формирует защитную плёнку от проникновения микроорганизмов и регулирует поток воды и ионов.
Особое место среди неколлагеновых белков дентина занимают кислые фосфопротеины, богатые аспарагиновой кислотой и фосфо- серином, что придаёт этим белкам способность связываться с кальцием. По сравнению с костной тканью в дентине значительно меньше белков, содержащих γ-карбоксиглутаминовую кислоту.
К семейству фосфосиалопротеинов, присутствующих в дентине, относятся костный сиалопротеин, матриксный белок дентина-1, остеопонтин, дентинфосфопротеин и дентинсиалопротеин. В процессе синтеза одонтобластами они подвергаются множественным посттрансляци-
онным модификациям: гликозилированию сиаловой кислотой, сульфатированию и фосфорилированию. Это необходимо для связывания углеводных групп с коллагенами, а присутствующие отрицательно заряженные остатки сульфатов и фосфатов выступают в качестве матриц для связывания Ca2+ и формирования кристаллов гидроксиапатита. Считают, что эти белки контролируют участки и скорость минерализации дентина. Часть белков, синтезируемых одонтобластами (костный сиалопротеин, остеопонтин, остеонектин, остеокальцин и др.) определяются как в дентине, так и в костной ткани и пульпе зуба.
Матриксный белок дентина-1 - кислый гликофосфопротеин содержит 2 молекулы N-ацетилнейраминовой кислоты и 1 протеогликановую цепь, связанную с белком через остаток серина. В его составе определяется 8 остатков связанной фосфорной кислоты и 20 молекул сульфата, которые способны связывать Ca2+. В процессе дентиногенеза матриксный белок дентина-1 участвует в формировании и росте кристаллов апатитов дентина. Нарушение синтеза этого белка сопровождается дефектами формирования кристаллической основы дентина.
Дентинсиалопротеин - гликопротеин с мол. массой 95 кДа содержит 30% углеводов и 10% сиаловых кислот и составляет 5-8% от всех белков дентина. По своей структуре сходен с костным сиалопротеином и остеопонтином. Секретируется одонтобластами и преэнамелобластами.
Дентинфосфопротеин (фосфофорин) - главный неколлагеновый белок матрикса дентина. Синтезируется одонтобластами, и на долю этого белка приходится до 50% всех неколлагеновых протеинов дентина. Имеет высокую мол. массу 151-167 кДа. Некоторое несоответствие в значениях молекулярного веса и данных аминокислотного состава в дентинфосфопротеине объясняется способностью этого белка связываться с фрагментами коллагена. В первичной структуре дентинфосфопротеина преобладают остатки аспарагиновой кислоты и фосфосерина, которые составляют 70-80% от общего количества аминокислот. Поскольку этот белок имеет большое сродство к Ca2+, считают, что он действует как нуклеатор в образовании первичных кристаллов гидроксиапатита и влияет на формирование кристаллов в процессе их роста. Связывание Ca2+ дентинфосфопротеином происходит на стадии минерализации дентина.
В процессах минерализации ткани дентина участвуют белки остеоадерин, остеокальцин и остеонектин. В дентине также обнаружен амелогенин, секретируемый одонтобластами. Считают, что амелогенин
выступает в роли фактора, регулирующего дифференцировку клеток и рост кристаллов дентина.
На пролиферацию и дифференцировку одонтобластов, участвующих в формировании и поддержании структуры и формы минерализованного матрикса дентина, влияют различные факторы роста, которые связываются с компонентами внеклеточного матрикса. Это ФРФ, инсулиноподобный фактор роста -1, ТФР-(3, морфогенетический белок кости -2 и -4, ФНО-α, ИЛ-1-(3. При подавлении синтеза ТФР-(3 снижается синтез фосфосиалопротеинов и, как следствие, развивается гипоминерализация дентина.
Разнообразный диапазон белков дентина характеризует возможности этой ткани активно участвовать не только в процессах дентиногенеза, но и реминерализации.
Дентиногенез
Образование дентина и поддержание его состава неразрывно связано с пульпой зуба. Вместе эти ткани формируют дентино-пульпарный комплекс.
Пульпа зуба развивается из зубного сосочка, образованного эктомезенхимой. Эмбриологическое развитие пульпы сопровождается синтезом ряда белков цитоскелета - кератина, виментина, десмина и актина. В процессе эмбрионального развития взаимодействие между эпителиальными клетками внутреннего эмалевого органа и мезенхимальными клетками зубного сосочка приводят к дифференцировке одонтобластов и фибробластов, которые начинают секретировать коллагеновые белки.
Образующиеся секреторно-активные одонтобласты характеризуются присутствием обильной грубой эндоплазматической сети, хорошо развитого аппарата Гольджи, митохондрий и специальных секреторных гранул (рис. 4.6). Такая структура одонтобластов позволяет осуществлять активный синтез и транспорт белков и ионов во внеклеточный матрикс.
Первоначально секреторно-активные одонтобласты синтезируют коллагеновые и неколлагеновые белки. Синтезированные белки, подвергшиеся посттрансляционной модификации, упаковываются в аппарате Гольджи в везикулы, которые освобождаются во внеклеточное пространство путём экзоцитоза в апикальных отделах тела одонтобластов и их отростков. Содержимиое везикул формирует внеклеточный матрикс дентина (предентин), который в последующем подвергается минерализации (рис. 4.7).
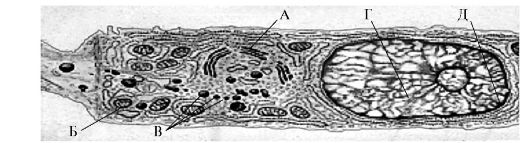
Рис. 4.6. Секреторно-активный одонтобласт [по Ten Cate A.R., 1998]:
А - аппарат Гольджи; Б - митохондрии; В - секреторные гранулы; Г - ядро;
Д - эндоплазматический ретикулум.
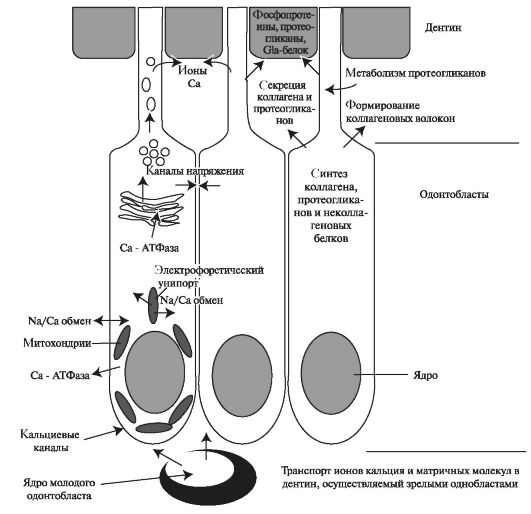
Рис. 4.7. Транспортные системы в одонтобластах дентино-пульпарного комплекса [по Edwards P. A., 2005].
В процессе инициации минерализации, как полагают, участвуют ионы, локализующиеся в телах одонтобластов. Активный транспорт ионов происходит при у частии транспортных ионов Са2+, К+, Nа+-аденозинтрифосфатаз (АТФазы), локализующихся в комплексе Гольджи и кристах митохондрий по дистальному краю тел одонтобластов, за счёт энергии АТФ. Ионы Na+ накапливается в цитоплазме и в матриксных пузырьках одонтобластических клеток, а Са2+ в митохондриях и цитоплазме. Концентрация ионов Са2+ во внеклеточной жидкости больше, чем в самих клетках, поэтому Са2+-АТФаза переносит ионы Са2+ за счёт энергии АТФ против градиента концентрации. При этом активируется пассивный перенос ионов Nа+ и К+ в клетки пульпы и из неё. Транспортные Nа+, К+-АТФазы препятствуют росту осмотического давления в клетках пульпы зубов. Поступление ионов происходит в процессе дентиногенеза и продолжается после прорезывания зуба, поддерживая минеральный состав зрелого дентина.
Нарушение структуры твёрдых тканей зуба в процессе развития
Нарушение развития зубных тканей на ранних стадиях приводит к разнообразным дефектам минерализованных тканей зуба. Эти нарушения носят локальный, системный или наследственный характер. К локальным факторам относятся воспалительные явления местного характера, а также травмы временных зубов в зоне зачатков постоянных зубов. Системные повреждения охватывают целый ряд зубов и возникают при различных инфекционных заболеваниях, метаболических нарушениях как у матери в период беременности, так и у ребёнка в процессе его роста после рождения. Наследственные формы дефектов твёрдых тканей зубов характеризуются их недоразвитием и передаются из поколения в поколение.
Действие повреждающих факторов внешней и внутренней среды на разных этапах морфогенеза зубных тканей приводит к разным формам патологического процесса. Это может выражаться в уменьшении толщины эмалевого слоя, изменении размера и формы кристаллов гидроксиапатита, отсутствии гидроксиапатитов и увеличении массы органического матрикса.
У человека встречается генетически обусловленый несовершенный амелогенез (amelogenesis imperfecta), связанный с дефектом гена АМЕLX в хромосомах энамелобластов. В результате изменяется аминокислотный состав синтезируемых амелогенинов и нарушается рост кристаллов на органическом матриксе.
Введение ингибиторов матричных синтезов также приводит к несовершенному амелогенезу и дентиногенезу. Так при приёме бере- менными женщинами и детьми младшего возраста антибиотиков тетрациклинового ряда у детей возникает множественная гипоплазия эмали (тетрациклиновые зубы). Это обусловлено тем, что тетрациклины связываются с 30S субъединицей рибосомы и блокируют присоединение аминоацил-тРНК в А-центр рибосомы, тем самым нарушая элонгацию полипептидной цепи. Нарушение синтеза белка, в свою очередь, изменяет процессы образования первичных кристаллов гидроксиапатитов в твёрдых тканях зуба.
Поступление избыточного количества фтора в организм беременной женщины и младенца сопровождается развитием другой формы несовершенного амелогенеза - флюороза зубов. Показано, что в больших дозах фтор угнетает пролиферацию амелобластов и соответственно снижает синтез актина и других белков. Он также способен связываться с гидроксильными группами серина полипептидных цепей, что приводит к нарушению образования фосфосерина, участвующего в минерализации зубных тканей. Кроме того, фтор способен связываться с активным центром сериновых протеиназ и таким образом ингибировать ограниченный протеолиз высокомолекулярных белков эмалевого матрикса. Это также не способствует открытию центров инициации минерализации и в дальнейшем образованию кристаллов гидроксиапатитов, поэтому для флюороза характерно более высокое содержание белка в эмали зрелого зуба и уменьшение количества кальция с изменением проницаемости эмали. Для флюороза характерны множественные участки гипоминерализации, которые могут проявляться при лёгкой форме в виде меловидных пятен на поверхности эмали, а при тяжёлой форме в виде изъеденных пигментных пятен. Это объясняется тем, что ионы железа, пищевые пигменты способны связываться с белковой основой и придают эмалевым дефектам жёлто-коричневую окраску.
При метаболических нарушениях, развивающихся при гипоксии плода, не образуется достаточное количество АТФ, что сказывается на фосфорилировании амелогениновых и неамелогениновых белков, а впоследствии на связывании Ca2+ с белковым матриксом эмали.
Важная роль в поражении эмали и дентина отводится характеру питания будущей матери и ребёнка. Пища должна содержать большое количество витаминов и минеральных веществ и мало углеводов. В эксперименте было показано, что при кормлении крысят высокоса-
харозной диетой возникают сдвиги в метаболических процессах клеток дентинно-пульпарного комплекса. Это сопровождается нарушением транспорта ионов Ca2+ и фосфатов и увеличением включения глицина в белки эмали. Высокосахарозная диета способствует накоплению селена в минерализованных тканях. Введение больших доз селена меняет активность ряда ферментов в пульпе зуба, что также ведёт к гипоминерализации твёрдых тканей зуба, а в дальнейшем и развитию кариеса зубов.
4.4. ПУЛЬПА ЗУБА
Пульпа зуба представляет собой рыхлую соединительную ткань, состоящую из межклеточного аморфного вещества, клеточных и волокнистых элементов (коллагеновые и аргирофильные волокна) с включёнными в них кровеносными сосудами и нервными волокнами. Она окружена дентином и повторяет анатомическую форму зуба. В составе пульпы обнаружено около 5% неорганических веществ, 40% органических и около 55% воды.
Пульпа зуба выполняет ряд важнейших функций: трофическую, защитную и пластическую.
Трофическая функция обеспечивается клеточными элементами, которые освобождают клетку от продуктов метаболизма. Твёрдые ткани зуба (дентин, цемент) не имеют кровеносных сосудов, поэтому их питание осуществляется через отростки одонтобластов.
Защитная функция осуществляется клетками ретикулоэндотелиальной системы, в частности гистиоцитами, которые играют роль фагоцитов. Эту роль также выполняют плазматические клетки пульпы, которые вырабатывают антитела. Фибробласты принимают участие в образовании фиброзной капсулы вокруг возникшего в пульпе патологического очага. Образование третичного дентина также следует рассматривать как проявление защитной функции.
Пластическая функция заключается в образовании вторичного дентина благодаря активной деятельности расположенных в пульпе одонтобластов.
Клеточный состав пульпы зуба
В строме пульпы располагается множество различных клеток: одонтобласты, фибробласты, гистиоциты и гранулоциты, тучные и плазматические клетки и др. Все клетки пульпы расположены в межклеточном веществе и образуют трёхмерную сеть.
Одонтобласты представляют собой крупные вытянутые поляризованные клетки, в которых различают тело и отростки (волокна Томса). Они образуют тонкий слой на протяжении всей дентино-пульпарной границы, а отростки пронизывают весь дентин. Тела одонтобластов располагаются близко друг к другу и связаны между собой тремя типами межклеточного соединения: щелевыми, плотными и десмосомами. Благодаря этим контактам слой одонтобластов способен выполнять барьерную функцию. Плотные контакты характерны для рогов пульпы - это точечные (фокальные) соединения между наружными слоями двух соседних плазматических клеток. Щелевые контакты, состоящие из белковых каналов, обеспечивают избирательное прохождение ионов и низкомолекулярных веществ.
Отростки одонтобластов представлены в виде центральной стержневой структуры и отходящих от неё боковых ответвлений. Снаружи отростки одонтобластов ограничены плотной базальной мембраной и содержат цитоскелетные компоненты: микротрубочки, связанные актиновыми нитями. В основном стержне отростка одонтобласта расположены адгезивные белки - виментин и нестин. На поверхности базальной мембраны, покрывающей отростки, располагаются пузырьки, содержащие белок клатрин, который обеспечивает транспорт деградируемых или фрагментированных молекул внутриклеточного матрикса. Через отростки одонтобластов осуществляется доставка питательных компонентов к твёрдым тканям зуба, поэтому благодаря функционированию отростков одонтобластов поддерживается состав межклеточного вещества дентина на протяжении всей жизни зуба.
Зрелые одонтобласты выполняют функцию образования вторичного дентина. В клетках периферического слоя одонтобластов пульпы установлено присутствие в высокой концентрации аминокислот серина, глицина, треонина, аланина, валина, тирозина, фенилаланина, пролина, лейцина, аспартата и глутамата, необходимых для синтеза коллагеновых волокон, протеогликанов, гликопротеинов, гликозаминогликанов, фосфопротеинов и белков, контролирующих скорость минерализации дентина - остеокальцина, остеонектина и кальцийсвязывающих. В центральном слое пульпы концентрируются гликоген и глюкоза. Присутствующие в одонтобластах протеолитические ферменты участвуют в физиологической деградации коллагеновых волокон для последующего их обновления.
Иную функцию выполняют фибробласты. Если одонтобласты участвуют в формировании минерализованного матрикса дентина, то
фибробласты имеют отношение к синтезу гликопротеинов, гликозаминогликанов и коллагеновых волокон самой ткани пульпы.
Недавние исследования выявили наличие в пульпе клеток, обладающих высокой клоногенной и пролиферативной активностью - стволовых клеток пульпы зуба. Данный вид клеток может пролиферировать и дифференцироваться в одонтобластоподобные клетки. Процесс активной пролиферации и дифференцировки происходит при различных физиологических состояниях, а также при кариесе, оперативных вмешательствах и ортодонтическом лечении.
Органические компоненты пульпы зуба
Межклеточное вещество пульпы включает коллагеновые волокна, погружённые в основное вещество, состоящее из различных белков, углеводов, липидов, ферментов, свободных аминокислот, гликопротеинов, протеогликанов, гликозаминогликанов и воды.
В пульпе зуба присутствует коллаген I типа (56%), III типа (41%), V типа (2%), VI типа (0,5%). Коллаген I типа образует широкие фибриллы. Коллаген III типа (ретикулярные волокна) формирует сет- чатую структуру по периферии пульпы зуба. Коллагеновые волокна образуют барьер, который обеспечивает контроль над миграцией ионов и молекул как в пульпу, так и из неё. Эластические волокна имеются только в стенках сосудов. С кровеносными сосудами связаны окситалановые волокна - незрелые эластические волокна, которые находятся преимущественно в периферической части пульпы.
Липиды в пульпе зуба представлены фосфатидилхолином (45%), фосфатидилэтаноламином (24,1%), фосфатидилсерином (17,4%), сфингомиелинами (10,9%), фосфатидилинозитолом (2,4%), а также холестерином и жирными кислотами.
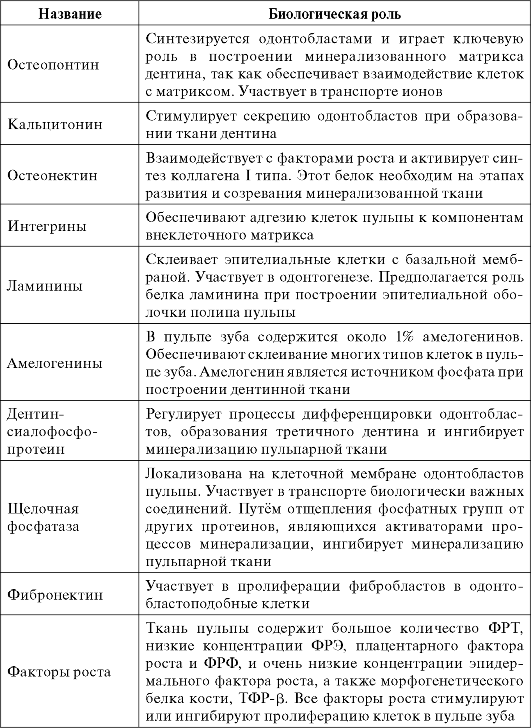
В пульпе зуба помимо коллагенов присутствует большое количество неколлагеновых белков. Методом двухмерного электрофореза в пульпе зуба выявлено около 650 протеинов, из которых идентифицировано более 96. Часть из этих белков характерна только для тканей пульпы, однако большинство из них присутствуют и в других тканях (т аб л. 4.2).
Дентино-пульпарный комплекс
В отличие от эмали постоянство матрикса дентина зрелого зуба поддерживается за счёт функционирования одонтобластов пульпы зуба. Отростки одонтобластов пронизывают дентин до сочленения
Таблица 4.2
Белки пульпы зуба

его с эмалью, формируя дентинные канальцы. Плотность расположения дентинных трубочек различна и составляет от 18 000 до 83 000 на 1 мм2 ткани дентина. Дентинные канальцы становятся проводниками зубного ликвора. Дентинная жидкость по своему белковому составу близка к плазме крови. Кровеносные сосуды пульпы зуба отдают плазму окружающей ткани, заполняя дентинные канальцы жидкостью через отростки одонтобластов. В жидкости содержатся необходимые компоненты для поддержания постоянства минерализованного матрикса дентина, которые поступают путём транскапиллярного обмена через пульпу в дентин. При нарушении транскапиллярного обмена в пульпе обнаруживается вакуолизация отдельных одонтобластов, а в дентине формируются участки пониженой кариесрезистентности. Вот почему взаимодействие пульпы и дентина зуба рассматривают в виде дентино-пульпарного комплекса.
Благодаря жизнедеятельности клеток пульпы образуется вторичный дентин, который за счёт роста и минерализации зоны предентина с возрастом уменьшает размеры пульпарной камеры. Вторичный дентин более минерализован, чем первичный дентин. Образование третичного дентина происходит в ответ на повреждение структуры твёрдых тканей зуба и формируется локально клетками пульпы, непосредственно реагирующими на раздражающее действие. Третичный дентин слабо минерализован и характеризуется неправильным образованием или отсутствием дентинных трубочек.
Таким образом дентино-пульпарный комплекс обеспечивает тесную взаимосвязь между тканями дентина и пульпы зуба как в норме, так и в условиях патологии.
4.5. ЦЕМЕНТ ЗУБА И ПЕРИОДОНТАЛЬНЫЕ ВОЛОКНА
Цемент вместе с периодонтальными волокнами, альвеолой и десной формирует опорно-удерживающий аппарат зуба. Цемент - обызвест- влённая часть зуба, сходная по своей структуре с костной тканью, но в отличие от неё лишена сосудов и не подвержена постоянной перестройке. Цемент прочно соединен с дентином, неравномерно покрывая его в области корня и шейки зуба. Толщина цемента минимальна в области шейки зуба (20-50 мкм) и максимальна у верхушки зуба (100-150 мкм). Самый толстый слой цемента покрывает корни жевательных зубов. Снаружи цемент прочно связан с тканями связочного аппарата зуба.
Вследствие продолжающего в течение всей жизни ритмического отложения слоёв цемента на поверхности корня зуба его объём увели- чивается в несколько раз.
• Цемент выполняет ряд функций: входит в состав поддерживающего (связочного) аппарата зуба,
• обеспечивая прикрепление к зубу волокон периодонта; защищает ткань дентина от повреждения;
• выполняет репаративные функции при образовании так называемых резорбционных лакун при переломе корня зуба.
Строение и состав цемента
Различают клеточный и бесклеточный цемент. Бесклеточный цемент развивается, как и эмаль зуба, из эктодермы. Он располагается на поверхности корня зуба и не содержит клеток. Межклеточное вещество обызвествлено и состоит из плотно расположеных коллагеновых волокон. Клеточный же цемент развивается из мезенхимы и покрывает область бифуркации корня, а также апикальную часть корня. Клеточный цемент состоит из обызвествлённого межклеточного вещества и клеток. Клетки представлены цементоцитами и цементобластами.
Неорганические соединения в цементе составляют 68-70% его массы и представлены разными формами апатитов. На долю органических молекул - коллагена, протеогликанов, углеводов, липидов приходится 17-20%, остальные 10-15% занимает вода.
Органический матрикс цемента состоит главным образом из коллагенов I, II, III, V, XII, XIV типов. Из всех коллагенов цемента основным является коллаген I типа, который составляет 90%. Он выполняет структурную и морфогенетическую функции и образует плато для прикрепления минеральных кристаллов. Коллаген III типа составляет всего 5% и покрывает фибриллы коллагена I типа. В цементе также присутствуют коллагены II, XII, XIV типов, характерные для хрящевой ткани. Эти типы коллагенов оказывают влияние на толщину и ориентацию коллагеновых фибрилл межклеточного матрикса цемента.
В цементе обнаружен специфический цементосвязывающий белок, который синтезируется цементобластами и способствует адгезии и перемещению мезенхимальных клеток.
Основой неколлагенового матрикса цемента являются два больших гликопротеина - костный сиалопротеин и остеопонтин, которые связаны с коллагеновыми белками и клетками через аминокислотные последовательности арг-гли-асп (RGD). Оба белка участвуют в процессах минерализации и играют большую роль в превращении прецементобластов в цементобласты. Костный сиалопротеин и остеопонтин секретируются клетками вдоль корневой поверхности на протяжении всего периода развития зуба. Полагают, что костный сиалопротеин выполняет преимущественно адгезивную функцию для поверхностных клеток зуба и участвует в процессах минерализации. Остеопонтин через взаимодействие с ανβ3-интегрином клеточной мембраны регулирует миграцию клеток в период цементообразующей активности. Остеопонтин также участвует в регуляции активности клеток моноцит-макрофагальной линии, фагоцитоза и образовании NO при воспалительных процессах.
В цементе присутствует фибронектин, который связывает клетки с внеклеточным матриксом. В базальной мембране гертвиговского влагалища в процессе дифференцировки одонтобластов появляется тенасцин. Позднее он участвует в связывании периодонтальных волокон с цементом зуба. Помимо этих белков цементобласты синтезируют остеонектин, остеокальцин, ламинин и ундулин.
Ундулин локализуется между плотно упакованными зрелыми коллагеновыми фибриллами и относится к специфическим неколлагеновым фибриллярным белкам межклеточного матрикса цемента и периодонтальных связок. Различные домены в его структуре обеспечивают связывание этого белка с интерстициальными коллагенами и
коллагеном I типа. Ундулин имеет сходство с тенасцином и фибронектином и вместе с этими белками участвует в развитии и дифференцировке клеток.
Таким образом, все вышеперечисленные белки участвуют в организации внеклеточного матрикса обоих видов цемента, кроме остеонектина, который присущ только для клеточного слоя.
Цементогенез
В процессе образования цемента активно участвуют эктодермальные и мезенхимальные стволовые клетки. Цементобласты образуются из клеток-предшественников - прецементобластов, а те, в свою оче- редь, от прогениторных стромальных клеток. Клетки-предшественники локализуются периваскулярно в периодонтальной связке или в эндостеальных участках альвеолярной кости.
При формировании корня зуба во внутренней поверхности эпителиального (гертвиговское) корневого влагалища откладывается дентин. В ходе дентиногенеза корневое влагалище распадается на отдельные фрагменты, и малодифференцированные соединительнотканные клетки зубного мешочка дифференцируются в цементобласты. Цементпродуцирующие клетки формируют органический матрикс.
Пролиферацию и дифференцировку незрелых цементобластов активируют различные факторы роста, которые представлены морфо- генетическим белком кости (МБК-2, -3, -4), фактором роста фибробластов, ТФР-(3 и инсулиноподобным фактором роста 1. Наряду с этими регуляторными факторами, была обнаружена уникальная молекула, свойственная только для ткани цемента - белок с мол. массой 14 кДа, названный фактором роста цемента. По своему аминокислотному составу он соответствует структуре инсулиноподобного фактора роста 1, но отличается по мол. массе. Дифференцировку клеток и процессы минерализации в цементе также регулирует белок остеопонтин (схема 4.1).
Периодонтальные волокна
Периодонтальные волокна являются разновидностью соединительной ткани со специальными свойствами. Они помогают зубу прочно удерживаться в костной лунке и противостоять большим сжимающим силам в процессе жевания без разрушения смежной кости альвеолы. Периодонтальные волокна также выполняют сенсорную функцию, так как в них имеются чувствительные рецепторы, кото-
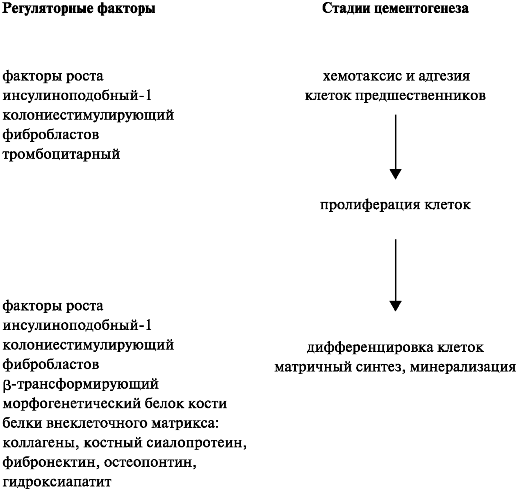
Схема 4.1. Регуляция цементогенеза на разных стадиях развития.
рые помогают регулировать силу жевательного давления на зуб. Это имеет большое значение, поскольку эмаль зуба лишена самостоятельных сенсорных рецепторов. Периодонтальные волокна обеспечивают питание и жизнеспособность цемента.
Клетки периодонта - фибробласты синтезируют белки для поддержания структуры и функции клеток костной ткани, окружающей зуб. В периодонтальных волокнах содержится большое количество коллагеновых белков I, III, V и VI типов, а также различные гликопротеины, факторы роста, адгезивные белки и ферменты. В клетках периодонта активно протекают реакции трансаминирования, глюконеогенеза, синтеза белков. Это обеспечивает тканям периодонта очень высокую регенеративную способность и позволяет обновлять их каждые 10-14 дней.
Формирование периодонтальных волокон
Периодонтальные волокна начинают образовываться в момент формирования корня. Эмалевый орган и гертвиговское влагалище окружены зубным мешочком, который представляют собой уплот- нённые клеточные структуры. Тонкий слой этих клеток соприкасается с эмалевым органом. Эти клетки вначале формируют конструкцию, по своей форме напоминающей стручок. Клетки этого «стручка» начинают делиться и дифференцируются в цементобласты, фибробласты и остеобласты. Фибробласты начинают синтезировать коллагеновые фибриллы, которые и составляют основу периодонтальных связей. Рост волокон периодонта продолжается регулироваться различными факторами роста: β-трансформирующего, инсулиноподоб- ного-1, фибробластов, тромбоцитарного, колониестимулирующего. Сформированные волокна одним концом переплетаются с отростками цементоцитов, а другим концом прочно соединяются с остеобластами кости. По мере продвижения зуба и его прорезывания ориентация этих волокон приобретает определённый характер.
Роль цемента и костной ткани в регенерации периодонта
Исследователями установлено, что у человека периодонтальная связка может быть источником предшественников цементобластов, так как малая часть клеточных клонов, культивированных из периодонтальной связки, формирует цементоподобные минерализованные модули в культуре и образуют специфические для цементов маркёры.
Восстановление разрушенной структуры цемента, возможно, происходит за счёт клеток периодонта, когда собственные клетки не способны к синтезу предшественников. В этом случае цементобласты образуются из стволовых клеток, присутствующих в периодонтальных волокнах, десне или альвеолярной кости. В настоящее время молекулы, отвечающие за дифференцировку, пролиферацию и перемещение цементобластоподобных клеток, не идентифицированы.
Нарушение структуры в периодонте и функции цемента нередко возникают после воспалительных явлений и оперативных вмеша- тельств. Происходит разрушение волокон коллагена, осаждение субстанций бактериальной бляшки и бактериальных эндотоксинов, что приводит к образованию пародонтальных карманов. Деструкция коллагеновых волокон отражается на функционировании поверхностных слоёв цемента, нарушаются процессы адгезии клеток соединительной ткани и они замещаются эпителиальными клетками.
В лечении заболеваний тканей пародонта в дальнейшей перспективе можно использовать культуры клеток, а также цементосвязывающий белок. Для улучшения адгезии клеток соединительной ткани поверхность цемента зуба обрабатывают раствором фибронектина.
При частичном разрыве периодонтальных волокон клетки костной ткани синтезируют коллагеновые волокна, факторы роста и адге- зивные белки, способствующие быстрому восстановлению целости опорно-удерживающего аппарата. Извлечение зуба и трансплантация его обратно в костную лунку приводит либо к частичному восстановлению связок, либо к сращению корня зуба с альвеолой (анкилоз).
Так как ткань цемента более инертна в своей биологической активности, основная роль в возникновении заболеваний периодонта принадлежит костной ткани. При длительной нагрузке на зуб возникает ряд изменений в дифференцировке и пролиферации клеток костной ткани. При напряжении передаётся сигнал к клеткам периодонта, которые начинают активировать синтез циклооксигеназы, провоспалительных цитокинов, протеолитических ферментов, что приводит к деградации коллагеновых фибрилл с последующим разрушением волокон периодонта. Остеобласты, расположенные вдоль приграничной зоны костной ткани с корнем зуба, в ответ на механическое воздействие, переданное периодонтом, подвергаются апоптозу. При этом активируется работа остеокластов, которые резорбируют поверхность корня и формируют лакунарные поверхности. Клетки волокон периодонта синтезируют белок остеопротегерин, который необходим для ингибирования процессов резорбции костной ткани.
Когда сцепление волокон периодонта с костной тканью ослабевает, зуб становится подвижным, нарастают воспалительные изменения в окружающих мягких тканях и формируются периодонтальные щели.
4.6. ЗУБОДЕСНЕВОЕ СОЕДИНЕНИЕ
Десневая борозда -
узкое щелевидное пространство между зубом и десной, располагающееся от
края свободной десны до эпителия прикрепления. Глубина десневой
борозды варьирует в пределах 0,5-
В механизме образования десневой жидкости большое значение принадлежит морфологическим особенностям строения сосудов и эпителия десневой борозды. Концевые сосуды в этой области расположены под эпителием и параллельно ему, что создаёт условия для транссудации содержимого капилляров, включая даже некоторые белки, в ротовую полость.
Благодаря особенностям эпителия прикрепления, а именно широким межклеточным промежуткам и уменьшенному количеству десмо- сом, связывающих эпителиоциты, обеспечивается транспорт веществ через него в обоих направлениях. Многие вещества переносятся из крови в просвет десневой борозды. Таким путём транспортируются электролиты, иммуноглобулины, компоненты комплемента, белки, ферменты, антибактериальные вещества. В этих межклеточных пространствах выявляются многочисленные нейтрофильные гранулоциты, моноциты, которые мигрируют из десны в десневую борозду. В то же время из слюны и с поверхности слизистой оболочки осуществляется массивное поступление антигенов в ткани внутренней среды, что, возможно, необходимо для адекватной стимуляции функции иммунной системы. Таким образом, у людей со здоровым пародонтом десневая жидкость представляет собой транссудат сыворотки крови.
Количество десневой жидкости в норме невелико и зависит от времени суток (утром уменьшается, а вечером увеличивается), мес- тоположения зуба, состояния пародонта. Появление патологических пародонтальных карманов (при воспалении пародонта) сопровождается увеличением количества десневой жидкости и изменением её состава. Не следует упрощенно рассматривать десневую жидкость как среду, через которую вещества выходят только в полость рта. Скорее это водная среда, окружающая зуб, которая определяет его амортиза- ционные свойства в ответ на жевательную нагрузку, поэтому любой сдвиг в количестве и составе десневой жидкости может сказаться в дальнейшем на функции и подвижности зубных рядов.
Состав десневой жидкости
Десневая жидкость в различных соотношениях содержит элементы плазмы крови; межклеточную жидкость тканей десны и периодонта; лейкоциты; микроорганизмы и их метаболиты.
Минеральные вещества. Хотя установлено, что десневая жидкость образуется в основном из плазмы крови всё-таки её ионный состав несколько отличается от плазмы. Так, установлено, что количест-
во ионов Na+ и K+ в десневой жидкости выше, чем в тканях десны и значительно ниже, чем в плазме крови. При воспалении пародонта в десневой жидкости может меняться соотношение ионов Na+ и K+, при этом может увеличиваться как количество Na+, так и K+. В целом же деструкция тканей пародонта чаще сопровождается ростом ионов K+. В десневой жидкости также определяются ионы Ca2+, PO43-, Mg2+, Zn2+, S2+, F-, Cl-. Интересно, что концентрация фтора в десневой жидкости и плазме крови одинакова и предполагается, что десневая жидкость является одним из источников фтора в полости рта. Ионы Ca2+ и Mg2+ в десневой жидкости вызывают адгезию микроорганизмов и осаждение гликопротеинов на поверхности эмали, что играет определённую роль в формировании зубного налёта.
Белки и ферменты десневой жидкости. Установлено, что белковый состав десневой жидкости и сыворотки крови одинаков. Количество общего белка в десневой жидкости составляет 61-68 г/л. Оно не меняется при развитии пародонтита и не зависит от степени тяжести воспаления и гигиены полости рта. В десневую жидкость из плазмы крови поступают альбумин и глобулины. Глобулиновая фракция в норме представлена ферментами, иммуноглобулинами и рядом других белков - компонентов системы комплемента и фибринолиза, лактоферрином и др.
Изменение количества IgG, а также появление IgМ и IgА, возрастание количества полиморфноядерных лейкоцитов с активацией системы комплемента следует рассматривать как часть системы клеточно-гуморального ответа в ответ на агрессивную микрофлору, появляющуюся в полости рта. Присутствующие все 9 компонентов системы комплемента играют важную роль в фагоцитозе, хемотаксисе и освобождении вазоактивных веществ.
Считается, что помимо участия в иммунном ответе, белки десневой жидкости участвуют в соединении эпителия десневого желобка с поверхностью зуба, образуя плёнку натяжения на соприкасающихся поверхностях. В формировании плёнки участвуют белки клеточной адгезии типа фибронектина, а также белок фибрин. Препятствуют образованию плотной фибриновой плёнки белки системы фибринолиза - плазмин, плазминоген и его активаторы.
В норме активность ферментов в десневой жидкости невелика. В десневую жидкость ферменты поступают из плазмы крови, кле- точных элементов десны, волокон периодонта и смешанной слюны. В десневой жидкости определяется активность кислой и щелочной
фосфатаз, гиалуронидазы, β-глюкуронидазы, арилсульфатазы, лизоцима, нитратредуктазы, малатдегидрогеназы, сукцинатдегидрогеназы, трансаминаз, ферментов гликолиза и др.
Изменения десневой жидкости при патологии пародонта
При деструктивно-воспалительных изменениях в тканях пародонта в десневой жидкости повышается активность протеолитических ферментов - матриксных металлопротеиназ и их ингибиторов. Матриксные металлопротеиназы (эластаза, коллагеназа) участвуют в гидролизе коллагена, эластина, иммуноглобулинов и многих других белков межклеточного матрикса (табл. 4.3).
При деструктивном пародонтите под действием протеиназ бактерий происходит разрастание клеток эпителия, завершающееся фор- мированием глубокого пародонтального кармана.
Таблица 4.3
Показатели десневой жидкости при развитии воспаления в пародонте
Показатель | Гингивит | Пародонтит |
Масляная кислота | ++ | + |
Эндотоксины | ++ | + |
Гидроксипролин | - | + |
Гликозаминогликаны | - | + |
Коллагеназа | + | ++ |
Эластаза | - | ++ |
Катепсин D | + | ++ |
Гиалуронидаза | + | ++ |
Арилсульфатаза | + | ++ |
Лактоферрин | + | + |
Интерлейкин 1-β | + | + |
Иммуноглобулины A, G, M | + | + |
Условные обозначения: «-» отсутствие; «+» небольшое количество метаболита или небольшая активность фермента; «++» большое количество метаболита или высокая активность фермента. Гингивит - воспаление десны; пародонтит - воспаление тканей пародонта.